7. SİNTERLEME (PİŞİRME) İŞLEMİNDEKİ REAKSİYONLAR
|
|
|
- Müge Yazar
- 5 yıl önce
- İzleme sayısı:
Transkript
1 7. SİNTERLEME (PİŞİRME) İŞLEMİNDEKİ REAKSİYONLAR Seramik malzemeye mukavemet kazandırmak için yapılan sinterleme (pişirme) işlemi sırasında malzemenin; 1-) Hacmi küçülür 2-) Bulk yoğunluğu artar 3-) Malzemede gözenek miktarı azalır 4-) Malzeme mukavemet ve sertlik kazanır. Pişme işlemindeki reaksiyonlar malzemenin bünyesini oluşturan hammaddelere göre değişir. Reaksiyonlar sonucu genellikle yeni kristal fazlar ve cam fazı oluşur. Kil içeren malzemeler için tipik reaksiyonlar şöyledir: Killi malzeme kurutulmasına rağmen bir miktar fiziksel su içerir. Bu kurutma ile giderilir. Kilin bünyesindeki kristal su ise genellikle kil türüne göre C arasında kayıp olur ve kilin kristal yapısında değişiklikler meydana gelir. Örneğin; Kaolen (Al 2 O 3.2SiO 2.2H 2 O) için; C [ Al Si O ( OH ) ] 3[ 2H O + Al Si O ] 1000 C Al2O3.2SiO2 + 4SiO2 (Metakaolen) (Mullit) (Kristobalit) Daha yüksek sıcaklıklara ısıtıldığında cam fazı oluşur. 8. SERAMİKLERİN FAZ DİYAGRAMLARI 8.1. Giriş Seramik sistemlerde faz diyagramlarının anlaşılması refrakterler, camlar ve diğer yüksek sıcaklıklarda kullanılan malzemelerin üretilmeleri ve kullanımlarında önemli bir yer tutmaktadır. Faz sınırlarının bilinmesi aynı zamanda seramik malzemelerin uzun ve kısa süreli kullanımları sırasında kararlılıklarının anlaşılması açısından da oldukça önemlidir. Faz; bir sistemin homojen, belli bir sıcaklık, basınç ve bileşime sahip, makroskobik olarak tek bir yapı gösteren, bir yüzey ile sistem içindeki diğer kısımlardan mekanik olarak ayrılan bölgesi ya da bölgeleri şeklinde tanımlanabilir. 78
2 Faz diyagramları ise bir bileşen veya birden çok bileşenlerin kombinasyonu ile ilgili bilgi verilerinin grafiksel gösterimidir. Genel olarak bir faz diyagramının bize sağlayacağı bilgileri şu şekilde özetlemek mümkündür. Her saf bileşenin ergime sıcaklığı, İki veya fazla bileşenin karıştırılması sonucu ergime sıcaklığında meydana gelen değişme miktarı, İki bileşenin (örneğin Si0 2 ve Al ) bir üçüncü bileşik (3Al 2 O 3.2SiO 2, müllit) oluşturacak şekilde yaptıkları reaksiyon, Katı eriyik durumunun olup olmaması ve bileşim sınırları, Sıcaklığın katı eriyik sınırına olan etkisi, Bileşenlerin bir kristal yapısından diğerine geçtikleri polimorfik dönüşüm sıcaklığı, Belli bir sıcaklık, bileşim ve basınç değerinde mevcut sıvı ve katı fazların bileşimleri ve yüzde miktarları, Belli sıcaklıklarda karışmayan sıvıların varlığı, Karışımın bileşenlerin miktarlarına bağlı olarak varsa en düşük ergime sıcaklığı (ötektik), soğumayla beraber katılaşmanın başladığı en yüksek sıcaklıklar (likidüs), katılaşmanın tamamlandığı en düşük sıcaklıklar (solidüs), çözünürlük sınırları (solvüs). Seramik oksitlerin denge koşullarının bilinmesi metallerden daha zordur. Bu durum ergimiş seramik karışımın kristalleşmesi sırasında açığa çıkan ısının çok küçük olmasından kaynaklanmaktadır; dolayısıyla bileşim sıcaklık ve durum ilişkisini gösteren faz diyagramlarının elde edilmesi Malzeme Mühendisliğinin temel uğraşlarından birisini oluşturmaktadır Fazlar Kanunu Bir sistem denge halinde olduğu zaman, sıcaklık ve basıncın her noktada aynı değerde ve her bileşenin kimyasal potansiyellerinin veya buhar basınçlarının her faz için aynı olması gerekmektedir. Aksi takdirde sistemin bir bölgesinden diğer bir bölgesine madde ve ısı geçişi meydana gelmesi eğilimi ortaya çıkar. 79
3 Sabit basınç ve sıcaklıkta Gibbs Serbest Enerjisinin termodinamik fonksiyonunun minimum noktası sistemin denge halini gösterir (dg = 0). Bu kuraldan hareket ederek çok fazlı sistemlerde belli sıcaklık ve bileşim değerlerinde dengede olan fazların serbest enerjilerinin en düşük veya negatif oldukları görülecektir. Bileşenlerin kimyasal potansiyellerinin sabit basınç ve sıcaklıkta her fazda eşit olması ilkesi, fazlar kanununun temelini teşkil eder. Gibbs Fazlar Kuralına geçmeden önce bir sistemin serbestlik derecesinin açıklamasını yapalım. Bir fazın sıcaklık, basınç ve bileşimini seçmek suretiyle durumunu (katı, sıvı, gaz) belirleyebiliriz. C sayıda bileşenden oluşan bir fazın bağımsız değişkenlerini (T, P, X 2,X 3...X c ) şeklinde sıralamak mümkündür. İlk kez 19. Yüzyılda J. Willard Gibbs tarafından önerilen bu kural aşağıdaki gibi ifade edilebilir. P+S = C+2 Burada P faz sayısı, S serbestlik derecesi, C ise bileşen sayısıdır. Genellikle çok bileşenli sistemlerde faz diyagramları tespit çalışmaları 1 atm sabit basınç altında yapıldığı için Gibbs faz kuralı; P+S = C+1 olarak ifade edilir. Fazlar kanununu aşağıda görülen bir bileşenli su sistemine uygulayalım: dengede maksimum miktarda bulunabilecek faz sayısı, serbestlik derecesinin 0 olduğu durumda meydana gelir P+0=1+2 =3. Şekil 8.1 de su, buz, buhar fazlarının bir arada bulunduğu halde, sıcaklık ve basınç sabitlenmiş olup bu durumun A noktasında ve yaklaşık 0 C, 0.01 atm basınçta meydana geldiği görülür. A noktasında serbestlik derecesinin 0 olması, o noktanın sabit olduğu yani hiçbir değişkenin değiştirilemeyeceği anlamına gelir. Diyagram üzerindeki sınır çizgileri, dengedeki iki fazın birlikte bulundukları basınç ve sıcaklık koşullarını belirlemektedir. Örneğin sıvı ve buhar fazlarının birlikte bulundukları B noktasında, 2+S=1+2 Serbestlik derecesi S=1 bulunur. Bunun anlamı basınç veya sıcaklık değişkenlerinden birisinin (her ikisi aynı anda değil) değiştirilebileceği, ikinci değişkenin birincisine bağımlı (fonksiyonu) olarak değişmesi sırasında iki fazın bir arada olduğu denge koşullarının sağlanmasıdır. Sadece C noktasında olduğu gibi bir tek fazın mevcut olduğu durumda serbestlik derecesi S=C+2-P=1+2-1=2 bulunur. Bu durumda yeni bir faz 80
4 oluşturmadan tek faz bölgesini çevreleyen sınırlar içinde kalınması koşuluyla basınç ve sıcaklık serbest olarak değiştirilebilir. Şekil 8.1. Su sisteminin sıcaklık-basınç denge diyagramı Teknolojide kullanılan seramikler bir bileşenli, iki bileşenli, üç bileşenli veya daha çok bileşenli olabilir Bir Bileşenli Sistemler Bir bileşenli sistemlerde bir kimyasal bileşik (örneğin H 2 O, Al 2 O 3, Si0 2 vs ) veya bir molekül (H 2 ) sistemin mevcut her fazında homojen olarak dağılmış bulunmaktadır. Su sistemi (Şekil 8.1) basınç ve sıcaklığa bağlı olarak sıvı, gaz veya katı halinde üç ayrı faz şeklinde, sıvı-katı, sıvı-buhar, katı-buhar veya her üç fazın bir arada bulunabildiği denge halinde olabilir; benzer şekilde H 2 molekülü özel koşullarda sıvı ve katı faz durumunda dengede olabilir. Bir bileşenli sistemlerde katı fazlar birden fazla kristal yapıda (allotropi, polimorfizm) bulunabilir: Buna örnek olarak geçen dersimizde bahsettiğimiz SiO 2 verilebilir. Bir bileşenli sistemler için elmas (C), kükürt (S) ve kuvars (Si0 2 ) denge diyagramları da örnek olarak verilebilir (Şekil 8.2 a,b,c). Grafitten sentetik elmas üretimi bir bileşenli faz diyagramlarının önemli bir uygulamasını teşkil eder. Şekil 8.2 a dan görüleceği üzere elmas dönüşümünün gerçekleşmesi için çok yüksek sıcaklıklar ve basınçlar gerekmektedir; bu koşullara ilave olarak reaksiyonun hızlandırılması için nikel gibi sıvı metal katalizöre ihtiyaç duyulmaktadır. Kuvarsın denge durumunda (Şekil 8.2 c) üç farklı katı ve sıvı fazı mevcuttur: Bunlar kuvars, tridimit, kristobalit ve sıvı fazıdır. 81
5 a) b) Şekil 8.2 Bir bileşenli denge diyagramlarından örnekler (a) karbon sistemi, (b) kükürt sistemi ve (c) Si0 2 sistemi c) 8.4. İki Bileşenli Sistemler Bu sistemlerde iki farklı bileşik veya atom birbirlerinin kafes yapısı içerisinde eriyerek tek bir faz veya gözle görülebilen belli sınırlara ayrılmış farklı fazları meydana getirirler. NiO-MgO ve Al Cr alaşımı her oranda birbiri içersinde çözünerek likidüs yüzeyinin altında katı eriyik halinde tek faz olarak bulunurlar (Şekil 8.3). Buna karşılık MgO-CaO ve MgO-Al ikili sisteminde kısmi çözünme vardır (katı eriyik bölgesi) ve çözünmenin gerçekleşmediği sıcaklık-bileşim bölgesinde iki bileşenli katı faz ötektik yapı olarak mevcuttur (Şekil 8.4). 82
6 Şekil 8.3. Birbiri içinde her oranda çözünebilen NiO-MgO ve Al Cr ikili sistemleri Şekil 8.4. Birbiri içinde kısmi olarak çözünebilen MgO-CaO ve MgO - Al ikili sistemleri Tuz-Su sisteminde tuzun (NaCI) suda (H 2 0) çözünmesi sıvı fazda (çözelti) iki bileşenli sistemi oluşturur. Ancak tuz, suda homojen olarak çözünüp dağıldığından tek faz durumu söz konusudur. Buhar fazı için de tek fazlı durum söz konusudur, çünkü farklı bileşenlerin molekülleri veya atomları buhar fazında üniform ve homojen olarak fiziksel bir sınır oluşturmaksızın karışırlar. Denge halinde birden fazla faz oluşturan sistemler için örnekler aşağıdaki şekilde verilebilir: Su ve yağ, birbirleri üzerinde yer alabilen iki tabaka şeklinde veya karıştırma yapıldığında, bir süre boyunca yağ su içinde yuvarlak damlacıklar halinde dağılmış olarak bulunabilir. Her iki durum iki farklı sıvı fazın varlığını göstermektedir, 83
7 Su ve civa, ergimiş durumdaki demir ve kurşun iki sıvı fazdan meydana gelen bir karışım oluşturur, Suda kısmen çözünmüş iki izomorf tuz sistemi, bir sıvı iki katı fazdan oluşan üç fazlı bir sistemdir ve, Ötektik sistemi iki farklı katı bileşiğin, bir sıvı ile denge halinde olduğu üç fazlı bir sistemi teşkil eder. İki sıvı bileşenin birbiri içinde çözündüğü durumlar çoğunlukla metalik sistemlerde görülür. İki bileşenli katı faz sistemlerinde, bazı bileşim değerlerinde bileşenlerin kristal yapılarından farklı yapılar ara faz olarak meydana gelebilir: bu tür ara fazlar tek bir bileşim değerinde stokiyometrik olarak veya bir bileşim aralığında katı eriyik şeklinde bulunabilir. Alümina (Al )-Silika (Si0 2 ) sisteminde müllit ara fazı bu duruma güzel bir örnek teşkil etmektedir (Şekil 8.5). Şekil 8.5. Al Si0 2 sisteminin denge diyagramı İkili faz diyagramlarında serbestlik derecesinin 0 olduğu noktalarda bir takım dönüşüm reaksiyonları vardır. İkili faz diyagramlarına ait bu dönüşüm reaksiyonlarının bir özeti Tablo 8.1 de görülmektedir. 84
8 Tablo 8.1. İki bileşenli sistemlerde görülen başlıca dönüşümler 8.5. Seramik Faz Diyagramları Uygulamaları Oluşan fazların miktarları ve bileşimlerini faz diyagramlarından hesaplamak mümkündür. Bunun için terazi, kaldıraç veya levye kuralı olarak bilinen basit yöntem kullanılır. Bu yöntemde yapılması gereken ilk şey verilen sıcaklık ve bileşimin yerinin tespit edilmesidir. Daha sonra bağ çizgisi çizilir ve aşağıda verilen örnekte olduğu gibi hesaplamalar yapılır. Örnek 1: Aşağıda NiO-MgO ikili denge diyagramı görülmektedir. % 50 MgO içeren bileşimin 2400 C de a) hangi fazlardan meydana geldiğini, b) bu fazların miktarlarını, c) bu fazların her birinin bileşimlerini bulunuz, d) bu bileşimin soğuma eğrisini ve e) mikroyapısını çiziniz. A B C A B C
9 Çözüm : a) İlk önce grafik üzerinde 2400 C den bir yatay ve % 50 MgO dan bir dikey çizerek ikisinin kesiştiği noktadaki fazlar tespit edilir. Görüldüğü gibi bu noktada α ve sıvı olmak üzere iki faz vardır. b) Bu fazların % miktarları bulunurken, tespit edilen noktada bulunan fazların sınırlarını belirleyen bir bağ çizgisi çizilir ve bu bağ çizgisinin sınır uçlarından dikey çizgiler çizilerek o noktadaki bileşim değeri okunur. Her bir fazın karşı değeri kullanılarak (ters kaldıraç prensibi) aşağıdaki gibi hesaplamalar yapılır. (50-38) % α miktarı = x100 = % 54,55 (60-38) (60-50) % sıv ı miktarı = x100 = % 45,45 bulunur. (60-38) c) Her bir fazın kendi tarafındaki noktadan aşağı doğru dik olarak çizilen çizgiden okunan değer, o fazın bileşimini verir. % 60 MgO α fazının bileşimi = % 40 NiO % 38 MgO Sıvı fazın bileşimi = % 62 NiO dir. d) Soğuma eğrileri çizilirken tek faz bölgeleri daha dik, ikili faz bölgelerinin eğimi daha fazla ve S=O ise yatay çizilir. Dolayısıyla yukarıda soruda verilen bileşimin soğuma eğrisi aşağıdaki gibi olacaktır. sıvı faz Sıcaklık ( C) sıvı + α fazı α fazı Zaman e) α sıvı 86
10 Örnek 2: NiO-MgO ikili denge diyagramında a) saf NiO, b) %20 MgO, c) %50 MgO, d) %80 MgO ve e) %100 MgO bileşimlerinin soğuma eğrilerini çiziniz. Çözüm : A B C D E Sıcaklık ( C) Zaman Örnek 3: MgO-CaO sisteminin faz dönüşümleri ile ilgili karakteristik değerleri aşağıda verilmiştir. Ötektik reaksiyon gösteren bu sistemin denge diyagramını çiziniz. Faz bölgelerini isimlendiriniz. Sınır çizgilerinin doğru olduğunu varsayın. MgO in ergime sıcaklığı 2850 C, CaO in ergime sıcaklığı 2620 C, Ötektik bileşim %32 MgO içermektedir, Ötektik sıcaklık 2370 C dir. CaO, MgO içerisinde en fazla %6, oda sıcaklığında %2 oranında erir. MgO, CaO içerisinde ise en fazla %15 ve oda sıcaklığında %3 erir. Çözüm : 87
11 Örnek 4: Aynı diyagram için a) MgO CaO içerisinde erimeseydi, b) MgO CaO içerisinde ve CaO MgO içerisinde erimeseydi diyagram nasıl olurdu? Her iki diyagramda da faz bölgelerini isimlendiriniz. Örnek 5: Normal ergiyen ve anormal ergiyen bileşik nedir? Temsili bir diyagram üzerinde gösteriniz ve faz bölgelerini belirtiniz. Çözüm : Sıvı + A4B A + Sıvı Sıvı + B A + A4B A4B A4B + A2B3 A2B3 A2B3+ B A B Örnek 6: Aşağıdaki BeO-Al 2 O 3 ikili sistemine ait diyagramda faz bölgelerini doldurunuz. 88
12 Çözüm : Örnek 7: Aşağıda görülen MgO-Al 2 O 3 ikili sistemine ait diyagramda a) I, II ve III ile gösterilen bileşimlerin soğuma eğrilerini çiziniz, b) 2200 C de bu bileşimlerin hangi fazları içerdiğini belirtiniz, c) bu fazların miktarlarını bulunuz, d) bu fazların bileşimleri nelerdir, e) II bileşim için 1906, 1904 C ve oda sıcaklığında bulunan fazların miktarlarını bulunuz ve 1904 C den oda sıcaklığına düşünceye kadar hangi fazdan ne kadar bir çökelme olduğunu bulunuz. I II III 89
13 Örnek 8: Silika tuğlası, ateş tuğlası (firebrick), müllit ve alümina refrakterleri maliyet olarak soldan sağa artacak şekilde sıralanmışlardır. Maliyeti ve aşağıdaki faz diyagramını dikkate alarak; a) 1400 C ye kadar kullanılmak üzere, genel amaçlı bir fırın için hangi refrakteri seçersiniz? b) Aynı tip bir fırını 1700 C de çalıştırmak için hangi refrakteri seçersiniz? Neden? NOT : Tuğlalarda bozulma %10-30 sıvı oluştuğunda meydana gelir. Endüstride kullanılan ateş tuğlalarının sınırlı sıcaklığı 1545 C dir. Örnek 9: Elinizde bulunan kaolen numunesini 1500 C, 1700 C ve 1850 C ye ısıttığınız zaman hangi fazların mevcut olacağını bulunuz C deki fazların miktarlarını hesaplayınız ve bu fazların bileşimlerini belirtiniz (Müllit 426, SiO 2 60 g/mol dır). 90
14 Çözüm : Faz diyagramında bileşimi gösterebilmemiz için %? Al 2 O 3 ve %? SiO 2 içerdiğini bulmamız gerekir. Bunun için yapılacak ilk şey müllit ve SiO 2 oranını bulmaktır. Kaolenin genel formülü Al 2 O 3.2SiO 2.2H 2 O dur c ( Al O.2SiO.2H O) 3Al O.2SiO + 4SiO H O Müllit 2 Müllit M A = 426 SiO 2 M A = 4 x 60 =240 Toplam = = 666 Müllit oranı = (426 / 666)x100 = %64 SiO 2 oranı = (240 / 666)x100 = %36 Müllit ve SiO 2 oranını bulduk. Ancak bilmemiz gereken şey % Al 2 O 3 ve % SiO 2 oranıdır ve müllit içerisinde Al 2 O 3 ve SiO 2 vardır. Şimdi müllit içerisindeki bu oranları bulmamız gerekir. Müllit içerisindeki Al 2 O 3 miktarı = (306/426)x100 = % 72 72x0,64 = 46,08 Müllit içerisindeki SiO 2 miktarı = (120/426)x100 = % 28 28x0,64 = 17,92 % SiO 2 = ,92 = 53,92 = 54 [Müllitten gelen + zaten mevcut olan] % Al 2 O 3 = 46,08 = 46 91
15 Artık diyagram üzerinde bu bileşimi işaretleyebiliriz C de bu bileşim için mevcut fazlar Müllit ve kristobalittir C de bu bileşim için mevcut fazlar Müllit ve sıvıdır C de ise tamamen sıvı oluşmaktadır C de bu bileşim için mevcut fazlar Müllit ve sıvıdır 1700 C de bu bileşim için mevcut fazlar Müllit ve sıvı olduğuna göre miktarlarını hesaplayalım. %28 SiO2 Müllit oranı = [(84-54) / (84-28)]x100 = % 54 %72 Al2O3 %84 SiO2 Sıvı oranı = [(54-28) / (84-28)]x100 = % 46 %16 Al2O3 Örnek 10: 85 kg MgCO 3 ve 15 kg SiO 2 ihtiva eden bir karışımın 1600 C de hangi fazlardan oluştuğunu, bunların miktarlarının ve bileşimlerinin ne olduğunu bulunuz (MgO 40.33, MgCO , SiO 2 60 gr/mol). MgCO MgO + ISI 3 CO 2 Bu reaksiyon sonunda sistemde mevcut MgO miktarı = [(40.33 x 85) / ]x100 = 40,5 kg 92
16 Bu yeni durumda 40,5 kg MgO + SiO 2 15 kg = 55,5 kg vardır. Öyleyse yeni durum için MgO ve SiO 2 % hesaplayalım. MgO oranı = (40,5 / 55,5)x100 = % 73 SiO 2 oranı = (15 / 55,5)x100 = % C de MgO ve 2MgO.SiO 2 den oluşmaktadır. % 0 SiO2 MgO oranı = [(42-27) / (42-0)]x100 = % 36 %100 MgO % 42 SiO2 2MgO.SiO 2 oranı = [(27-0) / (42-0)]x100 = % 64 %58 MgO 93
17 8.6. Üç Bileşenli Denge Diyagramları Üç bileşenli sistemler Gibbs üçgeni ile gösterilir. Gibbs üçgeni eşkenar üçgendir ve her bir köşesinde bir element veya bileşik bulunur. İkili bileşimler bu üçgenin kenarları üzerinde gösterilir. Üç bileşenli sistemler, özde iki bileşenli sistemlerden pek farklı değildir; ancak fazlar kuralına göre bu tip sistemlerde dört bağımsız değişken vardır. Bu değişkenler basınç, sıcaklık ve iki bileşenin bileşimleridir. Üçüncü bileşim bağımlı değişkendir. Şekil 8.6 a da kısmi α, β, γ, katı eriyiklerini içeren, bir üçlü ötektik noktaya sahip hipotetik bir denge diyagramı görülmektedir. Görüldüğü gibi A,B,C bileşenleri eşkenar üçgenin köşelerinde, sıcaklık değişkeni ise y ekseninde yer almaktadır. Sistem sabit basınç altında olup E,D, F noktalarında birer ikili ötektik noktası bulunmaktadır. A,D,B,F,C,E,A likidüs yüzeyini kapsayan bölgenin A', B', C' eşkenar üçgenine izdüşümü alındığı takdirde üçlü denge diyagramının iki boyutlu görüntüsü bulunur (Şekil 8.6b). Her bir sıcaklık için çizilecek kesitler üçlü denge diyagramının eşsıcaklık üçgenlerini verirler; ayrıca kesitlerin likidüs yüzeylerini kestiği hatlar izdüşüm üçgeninde izotermler olarak belirmektedir. Üçlü denge diyagramları seramik sistemlerin en önemli kısmını teşkil eder; zira genelde endüstriyel uygulamalarda ikiden fazla bileşenlerin kullanıldığı sistemler karşımıza çıkmaktadır. Şekil 8.6. a) Üçlü ötektik noktaya sahip olan (Sıvı α + β + γ), α, β, γ katı eriyiklerini içeren üç boyutlu üçlü denge diyagramı, b) Üçlü diyagramın likidüs yüzeylerinin izdüşümü 94
18 Üçlü Sistemlerde Bileşim Bulma Aşağıdaki A,B,C üçlü sisteminde bileşim üçgeninin üç köşesi bileşenleri, kenarlar üzerindeki her nokta ikili alaşımları, üçgen içindeki her bir nokta üçlü alaşımları göstermektedir. Kenarlar 100 eşit parçaya bölünmüş olup, her kenar ikili sistemin bileşenlerinin ağırlıkça yüzdelerini vermektedir. Bileşimi bilinen bir üçlü alaşımın diyagramdaki yerini tespit edebilmek için aşağıdaki yöntem takip edilir: Şekil 8.7 a üzerinde, x bileşimi için, x noktasından geçen AC, AB, BC kenarlarına paralel olacak şekilde üç doğru çizilir: B yüzdesi o,p noktaları, A yüzdesi m,n noktaları, C yüzdesi r,s noktalarından tespit edilir. Dikkat edilirse iki bileşenli sistemler için uygulanan kurallar burada da geçerliliğini korumaktadır: x bileşimi hangi köşenin daha yakınında yer alıyorsa, o köşede bulunan bileşence daha zengindir. Şekil 8.7. Bileşim üçgeni Örnek : a) % 50 feldspat, % 30 kaolen, %20 kuvars ve, b) %30 feldspat, % 45 kaolen, %25 kuvars bileşimini diyagram üzerinde gösterelim. Diyagramdan görüldüğü gibi 1. bileşimimiz X1 ve ikinci bileşimimiz ise X2 ile gösterilmiştir. Feldspat % Kaolen X % Feldspat X Kaolen Kuvars % Kuvars 95
19 Çözüm : Diyagramdan görüldüğü gibi 1. bileşimimiz X1 ve ikinci bileşimimiz ise X2 ile gösterilmiştir. İki tane üçlü bileşim karıştırıldığında, elde edilecek yeni bileşim bu iki bileşimin gösterildiği noktalar arasında çizilen doğru üzerinde olacaktır. Örnek : S = %20 Feldspat + %70 Kaolen + %10 Kuvars L = %40 Feldspat + %30 Kaolen + %30 Kuvars gibi iki tane bileşimimiz var. %25 S ile %75 L karıştırıldığında elde edilen yeni bileşimi hesaplayarak Gibbs üçgeninde gösterelim. Çözüm : 0,25 x 20 Feldspat + 0,75 x 40 Feldspat = % 35 Feldspat 0,25 x 70 Kaolen + 0,75 x 30 Kaolen = % 40 Kaolen 0,25 x 10 Kuvars + 0,75 x 30 Kuvars = % 25 Kuvars Görüldüğü gibi yeni bileşimimiz % 35 Feldspat, % 40 Kaolen ve % 25 Kuvars dan oluşmaktadır. Şimdi her üç bileşimimizi de Gibbs üçgeninde gösterelim. Feldspat % Kaolen 30 L S P % Feldspat Kaolen Kuvars % Kuvars Görüldüğü gibi, bu yeni bileşim kendini oluşturan SL doğrusu üzerindedir. Levier kaidesi, bu doğru üzerindeki P noktasına tatbik edilecek olursa; % S = (PL / SL) x 100 ve %L = (SP / SL) x 100 dür. 96
20 Üçlü Denge Diyagramlarında Uygulamalar Aşağıda SiO 2 -CaO-Al 2 O 3 üçlü denge diyagramı görülmektedir. Bu diyagrama bakıldığında CS, C 3 S 2, C 2 S, C 3 S, C 3 A, C 5 A 3, CA, C 3 A 5, A 3 S 2 ikili kimyasal bileşikleri ve CAS 2 (anortit) C 2 AS (gehlenit) üçlü ara kimyasal bileşikleri mevcuttur. Diyagram üzerinde, Alkamade üçgenleri, sınır ve izotermal çizgileri ile karakteristik noktalar gösterilmiştir. İki komşu kristalleşme bölgesini birleştiren doğrulara Alkamade doğrusu denir. Alkameyd teoremine göre bir alkameyd doğrusunun iki komşu faz sınırını kestiği nokta faz sınırında maksimum, alkameyd doğrusu üzerinde minimum bir sıcaklığı göstermektedir. Bir bileşim üçgeni her zaman üç alkameyd doğrusundan oluşmaktadır ve buna alkameyd veya alkamade üçgeni denmektedir. Bir alkameyd üçgeni içerisinde yer alan faz bölgelerinin kavuşma noktaları ötektik (normal ergiyen) ve peritektik (anormal ergiyen) bileşimleri gösterir. Bir noktanın birleştirdiği komşu bölgeler, noktanın içinde bulunduğu Alkameyd üçgenini oluşturan bileşenlerin faz bölgeleri ise söz konusu nokta ötektik, aksi durumda bir peritektik noktası olmaktadır. 97
21 Örneğin, CaO.SiO 2 (CS)-CaO.Al 2 O 3.2SiO 2 (CAS 2 )-SiO 2 Alkameyd üçgeni içerisinde bulunan kavuşma noktasına baktığımızda 1170 C de bir ötektiğin meydana geldiğini görürüz. Bu nokta, bu üçgen içerisindeki üç farklı faz bölgesini birleştirmektedir. Bunu orada bulunan okları takip ederek de anlayabiliriz. Şekil 6.1 b de görüldüğü gibi okların her üçü de bir boktayı işaret ediyorsa ötektik var demektedir. Şimdi de kristalleşme bölgelerine göz atalım. Örneğin CAS 2 yani anortit in kristalleşme bölgesi ile gösterilmiş alandır Verilen bir bileşiğin yeri diyagram üzerinde tespit edildikten sonra oluşan ilk kristale bakılır. Oluşan ilk kristal, o nokta hangi fazın oluşum sınırları içerisindeyse o demektir. Örnek 1 : %80 S + %5 A + %15 C bileşimindeki bir sıvının soğutulmasında; a) Oluşan ilk kristalin nedir? b) İlk kristalin teşekkül ettiği sıcaklık nedir? c) Nihai kristaller nelerdir? d) Katılaşmanın meydana geldiği sıcaklık nedir? e) İkinci oluşacak kristal hangisidir? Çözüm 1 : a) Oluşan ilk kristalin S yani SiO 2 dir. b) Yaklaşık olarak 1600 C dir. c) CaO.SiO 2 (CS)-CaO.Al 2 O 3.2SiO 2 (CAS 2 )-SiO 2 (S) dir. 98
22 d) 1170 C dir ve burada bir ötektik vardır. e) İkinci oluşacak kristal CS dir. Örnek 2 : %60 S + %10 A + %30 C bileşimindeki bir sıvının soğutulmasında; a) Oluşan ilk kristalin nedir? b) İlk kristalin teşekkül ettiği sıcaklık nedir? c) Nihai kristaller nelerdir? d) Katılaşmanın meydana geldiği sıcaklık nedir? e) İkinci oluşacak kristal hangisidir? Çözüm 2 : a) Oluşan ilk kristalin pseudowollostonit dir. b) Yaklaşık olarak 1340 C dir. c) CaO.SiO 2 (CS)-CaO.Al 2 O 3.2SiO 2 (CAS 2 )-SiO 2 (S) dir. d) 1170 C dir ve burada bir ötektik vardır. e) İkinci oluşacak kristal S dir. NOT : Oluşan nihai ürünler verilen bileşimin içinde bulunduğu alkameyd üçgeninin köşeleridir. Oluşacak ikinci kristali bulmak için; verilen bileşim işaretlendikten sonra oluşan ilk kristal tespit edilir. Oluşan ilk kristal köşesinden verilen bileşime bir doğru çizilir ve bu doğru diğer farklı kristal bölgesi sınırına kadar uzatılır. Hangi sınırı kesiyorsa oluşacak ikinci kristal o demektir. Örnek 3 : %40 S + %20 A + %40 C bileşimindeki bir sıvının soğutulmasında; a) Oluşan ilk kristalin nedir? b) İlk kristalin teşekkül ettiği sıcaklık nedir? c) Nihai kristaller nelerdir? d) Katılaşmanın meydana geldiği sıcaklık nedir? e) İkinci oluşacak kristal hangisidir? Çözüm 3 : a) Oluşan ilk kristalin C 2 AS yani gehlenittir. b) Yaklaşık olarak 1350 C dir. c) CaO.SiO 2 (CS)-CaO.Al 2 O 3.2SiO 2 (CAS 2 )- 2CaO.Al 2 O 3.SiO 2 (C 2 AS) dir. d) 1265 C dir ve burada bir ötektik vardır. e) İkinci oluşacak kristal CS dir. 99
23 Örnek 4 : %70 S + %5 A + %25 C bileşimindeki bir sıvının soğutulmasında; a) Oluşan ilk kristalin nedir? b) İlk kristalin teşekkül ettiği sıcaklık nedir? c) Nihai kristaller nelerdir? d) Katılaşmanın meydana geldiği sıcaklık nedir? e) İkinci oluşacak kristal hangisidir? f) İkinci oluşacak kristalin oluşum sıcaklığı nedir? g) 1400 C deki sıvı ve katının % oranı nedir? h) Bu sıvı ve katının bileşimleri nelerdir? Çözüm 4 : a) Oluşan ilk kristalin S yani SiO 2 yani kristobalit dir. b) Yaklaşık olarak 1520 C dir. c) S- CS- CAS 2 dir. d) 1170 C dir ve burada bir ötektik vardır. e) İkinci oluşacak kristal CS dir. f) Yaklaşık olarak 1340 C dir. g) Bu sorunun çözümü için ilk oluşacak kristal köşesinden başlayan, verilen bileşim noktasından geçen doğru, 1400 C izotermine kadar uzatılır. Daha sonra cetvel yardımı ile gerekli uzunluklar ölçülür. Daha sonra Levier kaidesi uygulanır. SiO mm x 36.5 mm 1400 C Verilen bileşim % Sıvı = (30,5 / 36,5) x 100 = % 83.5 % Katı yani SiO2 = (6 / 36,5) x 100 = % 16,5 h) Katının bileşimi %100 SiO 2 dir. Sıvının bileşimi % 65 SiO 2 + %6 Al 2 O 3 + %29 CaO dir. NOT: Sıvının bileşimini bulmak için, 1400 izotermini kestiği nokta sıvı noktası olacağından bu noktadan SiO 2 köşesine, Al 2 O 3 köşesine ve CaO köşesine paralel çizilerek değerleri okunur. 100
şeklinde, katı ( ) fazın ağırlık oranı ise; şeklinde hesaplanır.
 FAZ DİYAGRAMLARI Malzeme özellikleri görmüş oldukları termomekanik işlemlerin sonucunda oluşan içyapılarına bağlıdır. Faz diyagramları mühendislerin içyapı değişikliği için uygulayacakları ısıl işlemin
FAZ DİYAGRAMLARI Malzeme özellikleri görmüş oldukları termomekanik işlemlerin sonucunda oluşan içyapılarına bağlıdır. Faz diyagramları mühendislerin içyapı değişikliği için uygulayacakları ısıl işlemin
Faz ( denge) diyagramları
 Faz ( denge) diyagramları İki elementin birbirleriyle karıştırılması sonucunda, toplam iç enerji mimimum olacak şekilde yeni atom düzenleri meydana gelir. Fazlar, İç enerjinin minimum olmasını sağlayacak
Faz ( denge) diyagramları İki elementin birbirleriyle karıştırılması sonucunda, toplam iç enerji mimimum olacak şekilde yeni atom düzenleri meydana gelir. Fazlar, İç enerjinin minimum olmasını sağlayacak
Faz Dönüşümleri ve Faz (Denge) Diyagramları
 Faz Dönüşümleri ve Faz (Denge) Diyagramları 1. Giriş Bir cisim bağ kuvvetleri etkisi altında en düşük enerjili denge konumunda bulunan atomlar grubundan oluşur. Koşullar değişirse enerji içeriği değişir,
Faz Dönüşümleri ve Faz (Denge) Diyagramları 1. Giriş Bir cisim bağ kuvvetleri etkisi altında en düşük enerjili denge konumunda bulunan atomlar grubundan oluşur. Koşullar değişirse enerji içeriği değişir,
MALZEME BİLGİSİ DERS 7 DR. FATİH AY.
 MALZEME BİLGİSİ DERS 7 DR. FATİH AY www.fatihay.net fatihay@fatihay.net GEÇEN HAFTA KIRILMANIN TEMELLERİ KIRILMA ÇEŞİTLERİ KIRILMA TOKLUĞU YORULMA S-N EĞRİSİ SÜRÜNME GİRİŞ Basınç (atm) Katı Sıvı Buhar
MALZEME BİLGİSİ DERS 7 DR. FATİH AY www.fatihay.net fatihay@fatihay.net GEÇEN HAFTA KIRILMANIN TEMELLERİ KIRILMA ÇEŞİTLERİ KIRILMA TOKLUĞU YORULMA S-N EĞRİSİ SÜRÜNME GİRİŞ Basınç (atm) Katı Sıvı Buhar
FAZ DİYAGRAMLARI ve DÖNÜŞÜMLERİ HOŞGELDİNİZ
 FAZ DİYAGRAMLARI ve DÖNÜŞÜMLERİ Malzeme Malzeme Bilgisi Bilgisi PROF. DR. HÜSEYİN UZUN HOŞGELDİNİZ Prof. Dr. Hüseyin UZUN-Metalurji ve Malzeme Mühendisliği Bölümü 1 /94 İkili Faz Diyagramından Hangi Bilgiler
FAZ DİYAGRAMLARI ve DÖNÜŞÜMLERİ Malzeme Malzeme Bilgisi Bilgisi PROF. DR. HÜSEYİN UZUN HOŞGELDİNİZ Prof. Dr. Hüseyin UZUN-Metalurji ve Malzeme Mühendisliği Bölümü 1 /94 İkili Faz Diyagramından Hangi Bilgiler
ONDOKUZ MAYIS ÜNİVERSİTESİ KİMYA MÜH. BÖLÜMÜ KML I LAB. ÜÇLÜ NOKTA SAPTANMASI DENEY FÖYÜ
 AMAÇ ONDOKUZ MAYIS ÜNİVERSİTESİ KİMYA MÜH. BÖLÜMÜ KML I LAB. ÜÇLÜ NOKTA SAPTANMASI DENEY FÖYÜ Çalışmanın amacı üç bileşenli sistemlerin incelenmesi ve bu sistemler için sıvı-sıvı faz diyagramlarının oluşturulmasıdır.
AMAÇ ONDOKUZ MAYIS ÜNİVERSİTESİ KİMYA MÜH. BÖLÜMÜ KML I LAB. ÜÇLÜ NOKTA SAPTANMASI DENEY FÖYÜ Çalışmanın amacı üç bileşenli sistemlerin incelenmesi ve bu sistemler için sıvı-sıvı faz diyagramlarının oluşturulmasıdır.
Faz kavramı. Kristal yapılı malzemelerin iç yapılarında homojen ve belirli özellikler gösteren bölgelere faz (phase) adı verilir.
 Faz kavramı Kristal yapılı malzemelerin iç yapılarında homojen ve belirli özellikler gösteren bölgelere faz (phase) adı verilir. Fazlar; bu atom düzenlerinden ve toplam iç yapıda bu fazların oluşturdukları
Faz kavramı Kristal yapılı malzemelerin iç yapılarında homojen ve belirli özellikler gösteren bölgelere faz (phase) adı verilir. Fazlar; bu atom düzenlerinden ve toplam iç yapıda bu fazların oluşturdukları
CALLİSTER FAZ DİYAGRAMLARI ve Demir-Karbon Diyagramı
 CALLİSTER FAZ DİYAGRAMLARI ve Demir-Karbon Diyagramı Bileşen deyimi, çoğunlukla alaşımı oluşturan saf metaller ve/veya bileşikler için kullanılır. Örneğin bir bakır-çinko alaşımı olan pirinçte Cu ve Zn,
CALLİSTER FAZ DİYAGRAMLARI ve Demir-Karbon Diyagramı Bileşen deyimi, çoğunlukla alaşımı oluşturan saf metaller ve/veya bileşikler için kullanılır. Örneğin bir bakır-çinko alaşımı olan pirinçte Cu ve Zn,
BMM 205 Malzeme Biliminin Temelleri
 BMM 205 Malzeme Biliminin Temelleri Faz Diyagramları Dr. Ersin Emre Ören Biyomedikal Mühendisliği Bölümü Malzeme Bilimi ve Nanoteknoloji Mühendisliği Bölümü TOBB Ekonomi ve Teknoloji Üniversitesi Ankara
BMM 205 Malzeme Biliminin Temelleri Faz Diyagramları Dr. Ersin Emre Ören Biyomedikal Mühendisliği Bölümü Malzeme Bilimi ve Nanoteknoloji Mühendisliği Bölümü TOBB Ekonomi ve Teknoloji Üniversitesi Ankara
FAZ DİYAGRAMLARI ve DÖNÜŞÜMLERİ HOŞGELDİNİZ
 FAZ DİYAGRAMLARI ve DÖNÜŞÜMLERİ Malzeme Malzeme Bilgisi Bilgisi HOŞGELDİNİZ 1 /94 2 /94 ÇÖZÜNEN ve ÇÖZEN İki maddeyi birbirleri ile karıştırarak bir bileşik veya alaşım yapmak istediğimiz zaman, bileşik
FAZ DİYAGRAMLARI ve DÖNÜŞÜMLERİ Malzeme Malzeme Bilgisi Bilgisi HOŞGELDİNİZ 1 /94 2 /94 ÇÖZÜNEN ve ÇÖZEN İki maddeyi birbirleri ile karıştırarak bir bileşik veya alaşım yapmak istediğimiz zaman, bileşik
ÇÖKELME SERTLEŞTİRMESİ
 ÇÖKELME SERTLEŞTİRMESİ Prof. Dr. Ramazan YILMAZ Sakarya Üniversitesi, Teknoloji Fakültesi, Metalurji ve Malzeme Mühendisliği Bölümü Esentepe Kampüsü, 54187, SAKARYA ÇÖKELME SERTLEŞTİRMESİ (Yaşlandırma
ÇÖKELME SERTLEŞTİRMESİ Prof. Dr. Ramazan YILMAZ Sakarya Üniversitesi, Teknoloji Fakültesi, Metalurji ve Malzeme Mühendisliği Bölümü Esentepe Kampüsü, 54187, SAKARYA ÇÖKELME SERTLEŞTİRMESİ (Yaşlandırma
PROF. DR. HÜSEYİN UZUN HOŞGELDİNİZ
 Sınırsız Katı Eriyebilirlik İkili Faz Diyagramları (İkili İzomorfik Sistemler) Malzeme Malzeme Bilgisi Bilgisi PROF. DR. HÜSEYİN UZUN HOŞGELDİNİZ 1 /94 Sınırsız Katı Eriyebilirlik İkili Faz Diyagramları
Sınırsız Katı Eriyebilirlik İkili Faz Diyagramları (İkili İzomorfik Sistemler) Malzeme Malzeme Bilgisi Bilgisi PROF. DR. HÜSEYİN UZUN HOŞGELDİNİZ 1 /94 Sınırsız Katı Eriyebilirlik İkili Faz Diyagramları
FAZ DİYAGRAMLARI VE DÖNÜŞÜMLERİ
 FAZ DİYAGRAMLARI VE DÖNÜŞÜMLERİ Prof. Dr. Ramazan YILMAZ Sakarya Üniversitesi, Teknoloji Fakültesi, Metalurji ve Malzeme Mühendisliği Bölümü Esentepe Kampüsü, 54187, SAKARYA ÇÖZÜNEN VE ÇÖZEN İki maddeyi
FAZ DİYAGRAMLARI VE DÖNÜŞÜMLERİ Prof. Dr. Ramazan YILMAZ Sakarya Üniversitesi, Teknoloji Fakültesi, Metalurji ve Malzeme Mühendisliği Bölümü Esentepe Kampüsü, 54187, SAKARYA ÇÖZÜNEN VE ÇÖZEN İki maddeyi
FAZ DİYAGRAMLARI ve DÖNÜŞÜMLERİ HOŞGELDİNİZ
 FAZ DİYAGRAMLARI ve DÖNÜŞÜMLERİ Malzeme Malzeme Bilgisi Bilgisi PROF. DR. HÜSEYİN UZUN HOŞGELDİNİZ Prof. Dr. Hüseyin UZUN-Metalurji ve Malzeme Mühendisliği Bölümü 1 /94 Ötektik bileşim Birbirlerini sınırlı
FAZ DİYAGRAMLARI ve DÖNÜŞÜMLERİ Malzeme Malzeme Bilgisi Bilgisi PROF. DR. HÜSEYİN UZUN HOŞGELDİNİZ Prof. Dr. Hüseyin UZUN-Metalurji ve Malzeme Mühendisliği Bölümü 1 /94 Ötektik bileşim Birbirlerini sınırlı
SInIrsIz KatI Erİyebİlİrlİk Faz DİyagramlarI (İkİlİ İzomorfİk Sİstemler)
 SInIrsIz KatI Erİyebİlİrlİk İkİlİ Faz DİyagramlarI (İkİlİ İzomorfİk Sİstemler) Prof. Dr. Ramazan YILMAZ Sakarya Üniversitesi, Teknoloji Fakültesi, Metalurji ve Malzeme Mühendisliği Bölümü Esentepe Kampüsü,
SInIrsIz KatI Erİyebİlİrlİk İkİlİ Faz DİyagramlarI (İkİlİ İzomorfİk Sİstemler) Prof. Dr. Ramazan YILMAZ Sakarya Üniversitesi, Teknoloji Fakültesi, Metalurji ve Malzeme Mühendisliği Bölümü Esentepe Kampüsü,
İKİLİ ÖTEKTİK FAZ DİYAGRAMLARI
 İKİLİ ÖTEKTİK FAZ DİYAGRAMLARI Prof. Dr. Ramazan YILMAZ Sakarya Üniversitesi, Teknoloji Fakültesi, Metalurji ve Malzeme Mühendisliği Bölümü Esentepe Kampüsü, 54187, SAKARYA İKİLİ ÖTEKTİK FAZ DİYAGRAMLARI
İKİLİ ÖTEKTİK FAZ DİYAGRAMLARI Prof. Dr. Ramazan YILMAZ Sakarya Üniversitesi, Teknoloji Fakültesi, Metalurji ve Malzeme Mühendisliği Bölümü Esentepe Kampüsü, 54187, SAKARYA İKİLİ ÖTEKTİK FAZ DİYAGRAMLARI
KTÜ, Metalurji ve Malzeme Mühendisliği Bölümü
 FAZ DİYAGRAMLARI DERS NOTLARI İçerik KTÜ, Metalurji ve Malzeme Mühendisliği Bölümü Peritektik Alaşım Sistemleri Peritektik Dönüşüm: Peritektik dönüşüm; ötektik dönüşüm gösteren alaşım sistemlerine benzer
FAZ DİYAGRAMLARI DERS NOTLARI İçerik KTÜ, Metalurji ve Malzeme Mühendisliği Bölümü Peritektik Alaşım Sistemleri Peritektik Dönüşüm: Peritektik dönüşüm; ötektik dönüşüm gösteren alaşım sistemlerine benzer
MMM291 MALZEME BİLİMİ
 MMM291 MALZEME BİLİMİ Yrd. Doç. Dr. Ayşe KALEMTAŞ Ofis Saatleri: Perşembe 14:00 16:00 ayse.kalemtas@btu.edu.tr, akalemtas@gmail.com Bursa Teknik Üniversitesi, Doğa Bilimleri, Mimarlık ve Mühendislik Fakültesi,
MMM291 MALZEME BİLİMİ Yrd. Doç. Dr. Ayşe KALEMTAŞ Ofis Saatleri: Perşembe 14:00 16:00 ayse.kalemtas@btu.edu.tr, akalemtas@gmail.com Bursa Teknik Üniversitesi, Doğa Bilimleri, Mimarlık ve Mühendislik Fakültesi,
FAZ DİYAGRAMLARI ve DÖNÜŞÜMLERİ HOŞGELDİNİZ
 FAZ DİYAGRAMLARI ve DÖNÜŞÜMLERİ HOŞGELDİNİZ 1 /94 GİRİŞ * Endüstriyel amaçlı kullanılan malzemelerin pek çoğu saf metal değildir. Çünkü saf metaller, servis şartlarında istenilen mekanik özelikleri sağlayamamaktadırlar.
FAZ DİYAGRAMLARI ve DÖNÜŞÜMLERİ HOŞGELDİNİZ 1 /94 GİRİŞ * Endüstriyel amaçlı kullanılan malzemelerin pek çoğu saf metal değildir. Çünkü saf metaller, servis şartlarında istenilen mekanik özelikleri sağlayamamaktadırlar.
Malzemeler yapılarının içerisinde, belli oranlarda farklı atomları çözebilirler. Bu durum katı çözeltiler olarak adlandırılır.
 KATI ÇÖZELTİ Malzemeler yapılarının içerisinde, belli oranlarda farklı atomları çözebilirler. Bu durum katı çözeltiler olarak adlandırılır. Katı çözeltilerin diğer bir ismi katı eriyiktir. Bir çözelti
KATI ÇÖZELTİ Malzemeler yapılarının içerisinde, belli oranlarda farklı atomları çözebilirler. Bu durum katı çözeltiler olarak adlandırılır. Katı çözeltilerin diğer bir ismi katı eriyiktir. Bir çözelti
MMT444 Malzemelerde Simülasyon Termodinamik ve Kinetik
 K O C A E L İ ÜNİVERSİTESİ Metalurji ve Malzeme Mühendisliği Bölümü MMT444 Malzemelerde Simülasyon Termodinamik ve Kinetik 4 Termodinamik modelleme: ThermoCalc Doç. Dr. Ersoy Erişir 2015-2016 Bahar Yarıyılı
K O C A E L İ ÜNİVERSİTESİ Metalurji ve Malzeme Mühendisliği Bölümü MMT444 Malzemelerde Simülasyon Termodinamik ve Kinetik 4 Termodinamik modelleme: ThermoCalc Doç. Dr. Ersoy Erişir 2015-2016 Bahar Yarıyılı
Chapter 9: Faz Diyagramları
 Chapter 9: Faz Diyagramları İki elementi birleştirdiğimizde... ortaya çıkan denklik durumu nedir? genel olarak aşağıdakileri belirlersek... -- kompozisyon (örn., ağ% Cu - ağ% Ni), ve -- sıcaklık (T ) şunlara
Chapter 9: Faz Diyagramları İki elementi birleştirdiğimizde... ortaya çıkan denklik durumu nedir? genel olarak aşağıdakileri belirlersek... -- kompozisyon (örn., ağ% Cu - ağ% Ni), ve -- sıcaklık (T ) şunlara
DOKUZ EYLÜL ÜNİVERSİTESİ MÜHENDİSLİK FAKÜLTESİ DEKANLIĞI DERS/MODÜL/BLOK TANITIM FORMU. Dersin Orjinal Adı: PHASE DIAGRAMS. Dersin Kodu: MME 2006
 Dersi Veren Birim: Metalurji ve Malzeme Mühendisliği Dersin Türkçe Adı: FAZ DİYAGRAMLARI Dersin Orjinal Adı: PHASE DIAGRAMS Dersin Düzeyi:(Ön lisans, Lisans, Yüksek Lisans, Doktora) Lisans Dersin Kodu:
Dersi Veren Birim: Metalurji ve Malzeme Mühendisliği Dersin Türkçe Adı: FAZ DİYAGRAMLARI Dersin Orjinal Adı: PHASE DIAGRAMS Dersin Düzeyi:(Ön lisans, Lisans, Yüksek Lisans, Doktora) Lisans Dersin Kodu:
Gaz. Gaz. Yoğuşma. Gizli Buharlaşma Isısı. Potansiyel Enerji. Sıvı. Sıvı. Kristalleşme. Gizli Ergime Isısı. Katı. Katı. Sıcaklık. Atomlar Arası Mesafe
 İmal Usulleri DÖKÜM Katılaşma Döküm yoluyla üretimde metal malzemelerin kullanım özellikleri, katılaşma aşamasında oluşan iç yap ile belirlenir. Dolaysıyla malzeme özelliklerinin kontrol edilebilmesi
İmal Usulleri DÖKÜM Katılaşma Döküm yoluyla üretimde metal malzemelerin kullanım özellikleri, katılaşma aşamasında oluşan iç yap ile belirlenir. Dolaysıyla malzeme özelliklerinin kontrol edilebilmesi
MALZEME BİLGİSİ. Katı Eriyikler
 MALZEME BİLGİSİ Dr.- Ing. Rahmi ÜNAL Konu: Katı Eriyikler 1 Giriş Endüstriyel metaller çoğunlukla birden fazla tür eleman içerirler, çok azı arı halde kullanılır. Arı metallerin yüksek iletkenlik, korozyona
MALZEME BİLGİSİ Dr.- Ing. Rahmi ÜNAL Konu: Katı Eriyikler 1 Giriş Endüstriyel metaller çoğunlukla birden fazla tür eleman içerirler, çok azı arı halde kullanılır. Arı metallerin yüksek iletkenlik, korozyona
2-C- BAKIR VE ALAŞIMLARININ ISIL İŞLEMLERİ 2-C-3 MARTENSİTİK SU VERME(*)
 2-C- BAKIR VE ALAŞIMLARININ ISIL İŞLEMLERİ 2-C-3 MARTENSİTİK SU VERME(*) Sınai bakırlı alaşımlar arasında sadece soğukta iki veya çok fazlı alüminyumlu bakırlar pratik olarak mantensitik su almaya yatkındırlar.
2-C- BAKIR VE ALAŞIMLARININ ISIL İŞLEMLERİ 2-C-3 MARTENSİTİK SU VERME(*) Sınai bakırlı alaşımlar arasında sadece soğukta iki veya çok fazlı alüminyumlu bakırlar pratik olarak mantensitik su almaya yatkındırlar.
Dislokasyon hareketi sonucu oluşan plastik deformasyon süreci kayma olarak adlandırılır.
 Dislokasyon hareketi sonucu oluşan plastik deformasyon süreci kayma olarak adlandırılır. Bütün metal ve alaşımlarda bulunan dislokasyonlar, katılaşma veya plastik deformasyon sırasında veya hızlı soğutmadan
Dislokasyon hareketi sonucu oluşan plastik deformasyon süreci kayma olarak adlandırılır. Bütün metal ve alaşımlarda bulunan dislokasyonlar, katılaşma veya plastik deformasyon sırasında veya hızlı soğutmadan
Paslanmaz Çelik Gövde. Yalıtım Sargısı. Katalizör Yüzey Tabakası. Egzoz Emisyonları: Su Karbondioksit Azot
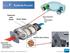 Paslanmaz Çelik Gövde Yalıtım Sargısı Egzoz Emisyonları: Su Karbondioksit Azot Katalizör Yüzey Tabakası Egzoz Gazları: Hidrokarbonlar Karbon Monoksit Azot Oksitleri Bu bölüme kadar, açıkça ifade edilmese
Paslanmaz Çelik Gövde Yalıtım Sargısı Egzoz Emisyonları: Su Karbondioksit Azot Katalizör Yüzey Tabakası Egzoz Gazları: Hidrokarbonlar Karbon Monoksit Azot Oksitleri Bu bölüme kadar, açıkça ifade edilmese
Prof. Dr. İRFAN AY / Öğr. Gör. FAHRETTİN KAPUSUZ 1
 MAKİNE PROGRAMI MALZEME TEKNOLOJİSİ-I- (DERS NOTLARI) Prof.Dr.İrfan AY Öğr. Gör. Fahrettin Kapusuz 2008-20092009 BALIKESİR Prof. Dr. İRFAN AY / Öğr. Gör. FAHRETTİN KAPUSUZ 1 DEMİR-KARBON (Fe-C) DENGE DİYAGRAMI
MAKİNE PROGRAMI MALZEME TEKNOLOJİSİ-I- (DERS NOTLARI) Prof.Dr.İrfan AY Öğr. Gör. Fahrettin Kapusuz 2008-20092009 BALIKESİR Prof. Dr. İRFAN AY / Öğr. Gör. FAHRETTİN KAPUSUZ 1 DEMİR-KARBON (Fe-C) DENGE DİYAGRAMI
Yrd. Doç. Dr. Atilla EVCİN Sol-jel Prosesleri Ders Notları
 Alüminyum Alkoksit ve Alümina Üretimi Alüminyum metalinin alkolle reaksiyonu sonucu alkoksit oluşturulması ve bundan elde edilecek jelinde öğütülüp kalsine edildikten sonra alüminaya dönüşmesi beklenmektedir.
Alüminyum Alkoksit ve Alümina Üretimi Alüminyum metalinin alkolle reaksiyonu sonucu alkoksit oluşturulması ve bundan elde edilecek jelinde öğütülüp kalsine edildikten sonra alüminaya dönüşmesi beklenmektedir.
ELEMENTLER VE BİLEŞİKLER
 ELEMENTLER VE BİLEŞİKLER 1- Elementler ve Elementlerin Özellikleri a) ELEMENTLER Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere
ELEMENTLER VE BİLEŞİKLER 1- Elementler ve Elementlerin Özellikleri a) ELEMENTLER Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere
Malzeme Bilgisi Prof. Dr. Akgün ALSARAN. Temel kavramlar Faz Diyagramları
 Malzeme Bilgisi Prof. Dr. Akgün ALSARAN Temel kavramlar Faz Diyagramları İçerik Giriş Ergime ve katılaşma Faz diyagramları Faz kuralı Faz diyagramlarından sağlanan bilgiler Denge halleri Dğer reksiyon
Malzeme Bilgisi Prof. Dr. Akgün ALSARAN Temel kavramlar Faz Diyagramları İçerik Giriş Ergime ve katılaşma Faz diyagramları Faz kuralı Faz diyagramlarından sağlanan bilgiler Denge halleri Dğer reksiyon
Gazi Üniversitesi Kimya Müh. Böl. 2005-2006 II YY KM-380 KİMYA MÜHENDİSLİĞİ LABORATUVARI I
 Gazi Üniversitesi Kimya Müh. Böl. 2005-2006 II YY KM-380 KİMYA MÜHENDİSLİĞİ LABORATUVARI I SIVI-SIVI FAZ DENGESİ (ÜÇ BİLEŞENLİ SİSTEMLERDE) Deney No : 3a AMAÇ Çalışmanın amacı üç bileşenli sistemlerin
Gazi Üniversitesi Kimya Müh. Böl. 2005-2006 II YY KM-380 KİMYA MÜHENDİSLİĞİ LABORATUVARI I SIVI-SIVI FAZ DENGESİ (ÜÇ BİLEŞENLİ SİSTEMLERDE) Deney No : 3a AMAÇ Çalışmanın amacı üç bileşenli sistemlerin
Fiziksel özellikler nelerdir? Mekanik Elektriksel Termal Manyetik Optik
 DENGE DİYAGRAMLARI Fiziksel özellikler nelerdir? Mekanik Elektriksel Termal Manyetik Optik Malzemeler neden farklı özellikler gösterirler? Özellikler Fiziksel Kimyasal Bahsi gecen yapısal etkenlerden elektron
DENGE DİYAGRAMLARI Fiziksel özellikler nelerdir? Mekanik Elektriksel Termal Manyetik Optik Malzemeler neden farklı özellikler gösterirler? Özellikler Fiziksel Kimyasal Bahsi gecen yapısal etkenlerden elektron
Gelin bugün bu yazıda ilkokul sıralarından beri bize öğretilen bilgilerden yeni bir şey keşfedelim, ya da ne demek istediğini daha iyi anlayalım.
 Kristal Yapılar Gelin bugün bu yazıda ilkokul sıralarından beri bize öğretilen bilgilerden yeni bir şey keşfedelim, ya da ne demek istediğini daha iyi anlayalım. Evrende, kimyasal özellik barındıran maddelerin
Kristal Yapılar Gelin bugün bu yazıda ilkokul sıralarından beri bize öğretilen bilgilerden yeni bir şey keşfedelim, ya da ne demek istediğini daha iyi anlayalım. Evrende, kimyasal özellik barındıran maddelerin
CALLİSTER FAZ DÖNÜŞÜMLERİ
 CALLİSTER FAZ DÖNÜŞÜMLERİ Faz dönüşümlerinin çoğu ani olarak gerçekleşmediğinden, reaksiyon gelişiminin zamana bağlı, yani dönüşüm hızına bağlı olarak gelişen yapısal özelliklerini dikkate almak gerekir.
CALLİSTER FAZ DÖNÜŞÜMLERİ Faz dönüşümlerinin çoğu ani olarak gerçekleşmediğinden, reaksiyon gelişiminin zamana bağlı, yani dönüşüm hızına bağlı olarak gelişen yapısal özelliklerini dikkate almak gerekir.
ELEMENT VE BİLEŞİKLER
 ELEMENT VE BİLEŞİKLER 1- Elementler ve Elementlerin Özellikleri: a) Elementler: Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere
ELEMENT VE BİLEŞİKLER 1- Elementler ve Elementlerin Özellikleri: a) Elementler: Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere
İmal Usulleri. Döküm Tekniği
 İmal Usulleri Döküm Tekniği Örnek Heterojen Çekirdeklenme Alışılmamış laboratuar deneyleri dışında, sıvı metal için homojen çekirdeklenme asla olmaz. Uygulamadaki sıvı metallerin içinde hemen her zaman
İmal Usulleri Döküm Tekniği Örnek Heterojen Çekirdeklenme Alışılmamış laboratuar deneyleri dışında, sıvı metal için homojen çekirdeklenme asla olmaz. Uygulamadaki sıvı metallerin içinde hemen her zaman
Ergime ve katılaşma 2/41
 Faz Diyagramları Ergime ve katılaşma Bir malzemenin eritilmesi ve katılaşması sırasında meydana gelen olayları bilerek bizler amacımıza uygun malzemeler elde edebiliriz. Bunun için erime ve katılaşma sırasında
Faz Diyagramları Ergime ve katılaşma Bir malzemenin eritilmesi ve katılaşması sırasında meydana gelen olayları bilerek bizler amacımıza uygun malzemeler elde edebiliriz. Bunun için erime ve katılaşma sırasında
MMT113 Endüstriyel Malzemeler 7 Seramikler. Yrd. Doç. Dr. Ersoy Erişir 2014-2015 Güz Yarıyılı
 MMT113 Endüstriyel Malzemeler 7 Seramikler Yrd. Doç. Dr. Ersoy Erişir 2014-2015 Güz Yarıyılı Aşınmaya dayanıklı parçalar Kesici takımlar Dekorasyon ve sanat Yalıtkan malzemeler Elektronik http://www.flickr.com
MMT113 Endüstriyel Malzemeler 7 Seramikler Yrd. Doç. Dr. Ersoy Erişir 2014-2015 Güz Yarıyılı Aşınmaya dayanıklı parçalar Kesici takımlar Dekorasyon ve sanat Yalıtkan malzemeler Elektronik http://www.flickr.com
KTÜ, Metalurji ve Malzeme Mühendisliği Bölümü
 FAZ DİYAGRAMLARI DERS NOTLARI İçerik KTÜ, Metalurji ve Malzeme Mühendisliği Bölümü Denge Dışı Reaksiyonlar ve Oluşan Yapılar (Martenzitik ve Beynitik Yapı) Bu güne kadar işlenen konularda denge veya yarı
FAZ DİYAGRAMLARI DERS NOTLARI İçerik KTÜ, Metalurji ve Malzeme Mühendisliği Bölümü Denge Dışı Reaksiyonlar ve Oluşan Yapılar (Martenzitik ve Beynitik Yapı) Bu güne kadar işlenen konularda denge veya yarı
DEMİR KARBON FAZ DİYAGRAMI
 MARMARA ÜNİVERSİTESİ TEKNOLOJİ FAKÜLTESİ MAKİNE MÜHENDİSLİĞİ BÖLÜMÜ MALZEME BİLİMİ Demir, Çelik ve Dökme Demir Yrd. Doç. Dr. Abdullah DEMİR DEMİR KARBON FAZ DİYAGRAMI Saf demire teknolojik özellik kazandıran
MARMARA ÜNİVERSİTESİ TEKNOLOJİ FAKÜLTESİ MAKİNE MÜHENDİSLİĞİ BÖLÜMÜ MALZEME BİLİMİ Demir, Çelik ve Dökme Demir Yrd. Doç. Dr. Abdullah DEMİR DEMİR KARBON FAZ DİYAGRAMI Saf demire teknolojik özellik kazandıran
Faz dönüşümleri: mikroyapı oluşumu, faz dönüşüm kinetiği
 Faz dönüşümleri: mikroyapı oluşumu, faz dönüşüm kinetiği Faz dönüşümleri 1. Basit ve yayınma esaslı dönüşümler: Faz sayısını ve fazların kimyasal bileşimini değiştirmeyen basit ve yayınma esaslı ölçümler.
Faz dönüşümleri: mikroyapı oluşumu, faz dönüşüm kinetiği Faz dönüşümleri 1. Basit ve yayınma esaslı dönüşümler: Faz sayısını ve fazların kimyasal bileşimini değiştirmeyen basit ve yayınma esaslı ölçümler.
Malzeme Bilgisi Prof. Dr. Akgün ALSARAN. Temel kavramlar Demir-Karbon Denge Diyagramı
 Malzeme Bilgisi Prof. Dr. Akgün ALSARAN Temel kavramlar Demir-Karbon Denge Diyagramı İçerik Giriş Demir-sementit diyagramı Demir-grafit diyagramı Dökme demir 2 Giriş Demir, pek çok mühendislik alaşımının
Malzeme Bilgisi Prof. Dr. Akgün ALSARAN Temel kavramlar Demir-Karbon Denge Diyagramı İçerik Giriş Demir-sementit diyagramı Demir-grafit diyagramı Dökme demir 2 Giriş Demir, pek çok mühendislik alaşımının
BÖLÜM 3 DİFÜZYON (YAYINIM)
 BÖLÜM 3 DİFÜZYON (YAYINIM) 1 Mürekkebin suda yayılması veya kolonyanın havada yayılması difüzyona örnektir. En hızlı difüzyon gazlarda görülür. Katılarda atom hareketleri daha yavaş olduğu için katılarda
BÖLÜM 3 DİFÜZYON (YAYINIM) 1 Mürekkebin suda yayılması veya kolonyanın havada yayılması difüzyona örnektir. En hızlı difüzyon gazlarda görülür. Katılarda atom hareketleri daha yavaş olduğu için katılarda
Pik (Ham) Demir Üretimi
 Pik (Ham) Demir Üretimi Çelik üretiminin ilk safhası pik demirin eldesidir. Pik demir için başlıca şu maddeler gereklidir: 1. Cevher: Demir oksit veya karbonatlardan oluşan, bir miktarda topraksal empüriteler
Pik (Ham) Demir Üretimi Çelik üretiminin ilk safhası pik demirin eldesidir. Pik demir için başlıca şu maddeler gereklidir: 1. Cevher: Demir oksit veya karbonatlardan oluşan, bir miktarda topraksal empüriteler
MALZEME BİLGİSİ DERS 5 DR. FATİH AY. www.fatihay.net fatihay@fatihay.net
 MALZEME BİLGİSİ DERS 5 DR. FATİH AY www.fatihay.net fatihay@fatihay.net GEÇEN HAFTA BAĞ KUVVETLERİ VE ENERJİLERİ ATOMLARARASI BİRİNCİL BAĞLAR İKİNCİL VEYA VAN DER WAALS BAĞLARI MOLEKÜLLER BÖLÜM III KATILARDA
MALZEME BİLGİSİ DERS 5 DR. FATİH AY www.fatihay.net fatihay@fatihay.net GEÇEN HAFTA BAĞ KUVVETLERİ VE ENERJİLERİ ATOMLARARASI BİRİNCİL BAĞLAR İKİNCİL VEYA VAN DER WAALS BAĞLARI MOLEKÜLLER BÖLÜM III KATILARDA
FZM 220. Malzeme Bilimine Giriş
 FZM 220 Yapı Karakterizasyon Özellikler İşleme Performans Prof. Dr. İlker DİNÇER Fakültesi, Fizik Mühendisliği Bölümü 1 Ders Hakkında FZM 220 Dersinin Amacı Bu dersin amacı, fizik mühendisliği öğrencilerine,
FZM 220 Yapı Karakterizasyon Özellikler İşleme Performans Prof. Dr. İlker DİNÇER Fakültesi, Fizik Mühendisliği Bölümü 1 Ders Hakkında FZM 220 Dersinin Amacı Bu dersin amacı, fizik mühendisliği öğrencilerine,
GENEL KİMYA. Yrd.Doç.Dr. Tuba YETİM
 GENEL KİMYA MOLEKÜLLER ARASI KUVVETLER Moleküller Arası Kuvvetler Yüksek basınç ve düşük sıcaklıklarda moleküller arası kuvvetler gazları ideallikten saptırır. Moleküller arası kuvvetler molekülde kalıcı
GENEL KİMYA MOLEKÜLLER ARASI KUVVETLER Moleküller Arası Kuvvetler Yüksek basınç ve düşük sıcaklıklarda moleküller arası kuvvetler gazları ideallikten saptırır. Moleküller arası kuvvetler molekülde kalıcı
BAZI ÖRNEKLER Soru 1 - Soru 2 -
 BAZI ÖRNEKLER Soru 1 - ZSD (zaman-sıcaklık-dönüşüm) diyagramlarının nasıl elde edildiğini, gerekli şekilleri çizerek açıklayınız? Cevap: Kritik Çekirdeklenme Çekirdeklenme Hızı Dönüşüm Hızı Soru 2 - Ötektoid
BAZI ÖRNEKLER Soru 1 - ZSD (zaman-sıcaklık-dönüşüm) diyagramlarının nasıl elde edildiğini, gerekli şekilleri çizerek açıklayınız? Cevap: Kritik Çekirdeklenme Çekirdeklenme Hızı Dönüşüm Hızı Soru 2 - Ötektoid
TEKNOLOJİSİ--ITEKNOLOJİSİ. Prof. Dr. İRFAN AY / Öğr. Gör. FAHRETTİN KAPUSUZ
 MAKİNE PROGRAMI MALZEME TEKNOLOJİSİ--ITEKNOLOJİSİ (DERS NOTLARI) Prof.Dr.İrfan AY Öğr. Gör. Fahrettin Kapusuz 2008-2009 2008BALIKESİR 1 DEMİR-KARBON DEMİR(Fe--C) (Fe DENGE DİYAGRAMI 2 DEMİR KARBON DENGE
MAKİNE PROGRAMI MALZEME TEKNOLOJİSİ--ITEKNOLOJİSİ (DERS NOTLARI) Prof.Dr.İrfan AY Öğr. Gör. Fahrettin Kapusuz 2008-2009 2008BALIKESİR 1 DEMİR-KARBON DEMİR(Fe--C) (Fe DENGE DİYAGRAMI 2 DEMİR KARBON DENGE
MMM291 MALZEME BİLİMİ
 MMM291 MALZEME BİLİMİ Ofis Saatleri: Perşembe 14:00 16:00 ayse.kalemtas@btu.edu.tr, akalemtas@gmail.com Bursa Teknik Üniversitesi, Doğa Bilimleri, Mimarlık ve Mühendislik Fakültesi, Metalurji ve Malzeme
MMM291 MALZEME BİLİMİ Ofis Saatleri: Perşembe 14:00 16:00 ayse.kalemtas@btu.edu.tr, akalemtas@gmail.com Bursa Teknik Üniversitesi, Doğa Bilimleri, Mimarlık ve Mühendislik Fakültesi, Metalurji ve Malzeme
MALZEME BİLGİSİ. Katılaşma, Kristal Kusurları
 MALZEME BİLGİSİ Dr.- Ing. Rahmi ÜNAL Konu: Katılaşma, Kristal Kusurları 1 Saf Metallerde Katılaşma Metal ve alaşım malzemelerin kullanım özellikleri büyük ölçüde katılaşma sırasında oluşan iç yapı ile
MALZEME BİLGİSİ Dr.- Ing. Rahmi ÜNAL Konu: Katılaşma, Kristal Kusurları 1 Saf Metallerde Katılaşma Metal ve alaşım malzemelerin kullanım özellikleri büyük ölçüde katılaşma sırasında oluşan iç yapı ile
METALLERDE KATILAŞMA HOŞGELDİNİZ
 METALLERDE KATILAŞMA Malzeme Malzeme Bilgisi Bilgisi PROF. DR. HÜSEYİN UZUN HOŞGELDİNİZ 1 /94 METALLERDE KATILAŞMA Metal ve alaşımlar, belirli bir sıcaklıktan sonra (ergime sıcaklığı) katı halden sıvı
METALLERDE KATILAŞMA Malzeme Malzeme Bilgisi Bilgisi PROF. DR. HÜSEYİN UZUN HOŞGELDİNİZ 1 /94 METALLERDE KATILAŞMA Metal ve alaşımlar, belirli bir sıcaklıktan sonra (ergime sıcaklığı) katı halden sıvı
KAYNAK UYGULAMASI DİFÜZYON KAYNAĞI
 KAYNAK UYGULAMASI DİFÜZYON KAYNAĞI Sertlehimlemenin yakını sayılabilecek bu süreç(*), aynı ölçüde Zr parçalarının birleştirilmelerine uygundur. Bunda herhangi bir sertlehim ilâve metali akmaz; birleştirilecek
KAYNAK UYGULAMASI DİFÜZYON KAYNAĞI Sertlehimlemenin yakını sayılabilecek bu süreç(*), aynı ölçüde Zr parçalarının birleştirilmelerine uygundur. Bunda herhangi bir sertlehim ilâve metali akmaz; birleştirilecek
ÇÖKELME SERTLEŞTİRMESİ HOŞGELDİNİZ
 ÇÖKELME SERTLEŞTİRMESİ Malzeme Malzeme Bilgisi Bilgisi PROF. DR. HÜSEYİN UZUN HOŞGELDİNİZ 1 ÇÖKELME SERTLEŞTİRMESİ (Yaşlandırma Sertleşmesi) Bazı metal alaşımlarının sertlik ve mukavemeti, soğuk deformasyon
ÇÖKELME SERTLEŞTİRMESİ Malzeme Malzeme Bilgisi Bilgisi PROF. DR. HÜSEYİN UZUN HOŞGELDİNİZ 1 ÇÖKELME SERTLEŞTİRMESİ (Yaşlandırma Sertleşmesi) Bazı metal alaşımlarının sertlik ve mukavemeti, soğuk deformasyon
STOKİYOMETRİ: SABİT ORANLAR YASASI
 STOKİYOMETRİ: SABİT ORANLAR YASASI AMAÇ Bu deneyin amacı sabit oranlar yasasını kanıtlamak ve öğrencilere tartma analizlerinde ve hata hesaplamalarında deneyim kazandırmaktır. TEORİ Stokiyometri, bir bileşiğin
STOKİYOMETRİ: SABİT ORANLAR YASASI AMAÇ Bu deneyin amacı sabit oranlar yasasını kanıtlamak ve öğrencilere tartma analizlerinde ve hata hesaplamalarında deneyim kazandırmaktır. TEORİ Stokiyometri, bir bileşiğin
Fiziksel özellikleri her yerde aynı olan (homojen) karışımlara çözelti denir. Bir çözeltiyi oluşturan her bir maddeye çözeltinin bileşenleri denir.
 GENEL KİMYA 1 LABORATUARI ÇALIŞMA NOTLARI DENEY: 8 ÇÖZELTİLER Dr. Bahadır KESKİN, 2011 @ YTÜ Fiziksel özellikleri her yerde aynı olan (homojen) karışımlara çözelti denir. Bir çözeltiyi oluşturan her bir
GENEL KİMYA 1 LABORATUARI ÇALIŞMA NOTLARI DENEY: 8 ÇÖZELTİLER Dr. Bahadır KESKİN, 2011 @ YTÜ Fiziksel özellikleri her yerde aynı olan (homojen) karışımlara çözelti denir. Bir çözeltiyi oluşturan her bir
ELEMETLER VE BİLEŞİKLER ELEMENTLER VE SEMBOLLERİ
 ELEMENTLER VE SEMBOLLERİ Elementler Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere element denir. Elementler çok sayıda
ELEMENTLER VE SEMBOLLERİ Elementler Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere element denir. Elementler çok sayıda
ÖĞRENME ALANI : FİZİKSEL OLAYLAR ÜNİTE 2 : KUVVET VE HAREKET
 ÖĞRENME ALANI : FİZİKSEL OLAYLAR ÜNİTE 2 : KUVVET VE HAREKET A BASINÇ VE BASINÇ BİRİMLERİ (5 SAAT) Madde ve Özellikleri 2 Kütle 3 Eylemsizlik 4 Tanecikli Yapı 5 Hacim 6 Öz Kütle (Yoğunluk) 7 Ağırlık 8
ÖĞRENME ALANI : FİZİKSEL OLAYLAR ÜNİTE 2 : KUVVET VE HAREKET A BASINÇ VE BASINÇ BİRİMLERİ (5 SAAT) Madde ve Özellikleri 2 Kütle 3 Eylemsizlik 4 Tanecikli Yapı 5 Hacim 6 Öz Kütle (Yoğunluk) 7 Ağırlık 8
METALİK MALZEMELERİN GENEL KARAKTERİSTİKLERİ BAHAR 2010
 METALİK MALZEMELERİN GENEL KARAKTERİSTİKLERİ BAHAR 2010 WEBSİTE www2.aku.edu.tr/~hitit Dersler İÇERİK Metalik Malzemelerin Genel Karakteristiklerİ Denge diyagramları Ergitme ve döküm Dökme demir ve çelikler
METALİK MALZEMELERİN GENEL KARAKTERİSTİKLERİ BAHAR 2010 WEBSİTE www2.aku.edu.tr/~hitit Dersler İÇERİK Metalik Malzemelerin Genel Karakteristiklerİ Denge diyagramları Ergitme ve döküm Dökme demir ve çelikler
MARMARA ÜNİVERSİTESİ TEKNOLOJİ FAKÜLTESİ MAKİNE MÜHENDİSLİĞİ BÖLÜMÜ
 MARMARA ÜNİVERSİTESİ TEKNOLOJİ FAKÜLTESİ MAKİNE MÜHENDİSLİĞİ BÖLÜMÜ MALZEME BİLİMİ -Fazlar - Yrd. Doç. Dr. Abdullah DEMİR FAZ KAVRAMI Kristal yapılı malzemelerin iç yapılarında homojen ve belirli özellikler
MARMARA ÜNİVERSİTESİ TEKNOLOJİ FAKÜLTESİ MAKİNE MÜHENDİSLİĞİ BÖLÜMÜ MALZEME BİLİMİ -Fazlar - Yrd. Doç. Dr. Abdullah DEMİR FAZ KAVRAMI Kristal yapılı malzemelerin iç yapılarında homojen ve belirli özellikler
Bölüm 4: Kusurlar. Kusurlar
 Bölüm 4: Kusurlar Malzemelerin bazı özellikleri kusurların varlığıyla önemli derecede etkilenir. Kusurların türleri ve malzeme davranışı üzerindeki etkileri hakkında bilgi sahibi olmak önemlidir. Saf metallerin
Bölüm 4: Kusurlar Malzemelerin bazı özellikleri kusurların varlığıyla önemli derecede etkilenir. Kusurların türleri ve malzeme davranışı üzerindeki etkileri hakkında bilgi sahibi olmak önemlidir. Saf metallerin
Paylaşılan elektron ya da elektronlar, her iki çekirdek etrafında dolanacaklar, iki çekirdek arasındaki bölgede daha uzun süre bulundukları için bu
 4.Kimyasal Bağlar Kimyasal Bağlar Aynı ya da farklı cins atomları bir arada tutan kuvvetlere kimyasal bağlar denir. Pek çok madde farklı element atomlarının birleşmesiyle meydana gelmiştir. İyonik bağ
4.Kimyasal Bağlar Kimyasal Bağlar Aynı ya da farklı cins atomları bir arada tutan kuvvetlere kimyasal bağlar denir. Pek çok madde farklı element atomlarının birleşmesiyle meydana gelmiştir. İyonik bağ
FZM 220. Malzeme Bilimine Giriş
 FZM 220 Yapı Karakterizasyon Özellikler İşleme Performans Prof. Dr. İlker DİNÇER Fakültesi, Fizik Mühendisliği Bölümü 1 Ders Hakkında FZM 220 Dersinin Amacı Bu dersin amacı, fizik mühendisliği öğrencilerine,
FZM 220 Yapı Karakterizasyon Özellikler İşleme Performans Prof. Dr. İlker DİNÇER Fakültesi, Fizik Mühendisliği Bölümü 1 Ders Hakkında FZM 220 Dersinin Amacı Bu dersin amacı, fizik mühendisliği öğrencilerine,
2. Sertleştirme 3. Islah etme 4. Yüzey sertleştirme Karbürleme Nitrürleme Alevle yüzey sertleştirme İndüksiyonla sertleştirme
 Isıl İşlem Isıl İşlem Isıl işlem, metal veya alaşımlarına istenen özellikleri kazandırmak amacıyla katı halde uygulanan kontrollü ısıtma ve soğutma işlemleri olarak tanımlanır. Çeliğe uygulanan temel ısıl
Isıl İşlem Isıl İşlem Isıl işlem, metal veya alaşımlarına istenen özellikleri kazandırmak amacıyla katı halde uygulanan kontrollü ısıtma ve soğutma işlemleri olarak tanımlanır. Çeliğe uygulanan temel ısıl
MALZEMELERİN MUKAVEMETİNİ ARTIRICI İŞLEMLER
 MALZEMELERİN MUKAVEMETİNİ ARTIRICI İŞLEMLER Malzemelerin mekanik özelliği başlıca kimyasal bileşime ve içyapıya bağlıdır. Malzemelerin içyapısı da uygulanan mekanik ve ısıl işlemlere bağlı olduğundan malzemelerin
MALZEMELERİN MUKAVEMETİNİ ARTIRICI İŞLEMLER Malzemelerin mekanik özelliği başlıca kimyasal bileşime ve içyapıya bağlıdır. Malzemelerin içyapısı da uygulanan mekanik ve ısıl işlemlere bağlı olduğundan malzemelerin
DENEYİN ADI: Çeliklerin Isıl İşlemi. AMACI: Çeliklerde ısıl işlem yoluyla mikroyapı ve mekanik özelliklerin değişiminin öğretilmesi.
 DENEYİN ADI: Çeliklerin Isıl İşlemi AMACI: Çeliklerde ısıl işlem yoluyla mikroyapı ve mekanik özelliklerin değişiminin öğretilmesi. TEORİK BİLGİ: Metal ve alaşımlarının, faz diyagramlarına bağlı olarak
DENEYİN ADI: Çeliklerin Isıl İşlemi AMACI: Çeliklerde ısıl işlem yoluyla mikroyapı ve mekanik özelliklerin değişiminin öğretilmesi. TEORİK BİLGİ: Metal ve alaşımlarının, faz diyagramlarına bağlı olarak
Bölüm 3 - Kristal Yapılar
 Bölüm 3 - Kristal Yapılar Katı malzemeler, atomların veya iyonların oluşturdukları düzene göre sınıflandırılır. Kristal malzemede uzun-aralıkta atomsal ölçekte tekrarlayan bir düzen mevcuttur. Katılaşma
Bölüm 3 - Kristal Yapılar Katı malzemeler, atomların veya iyonların oluşturdukları düzene göre sınıflandırılır. Kristal malzemede uzun-aralıkta atomsal ölçekte tekrarlayan bir düzen mevcuttur. Katılaşma
Faz dönüşümünün gelişmesi, çekirdeklenme ve büyüme olarak adlandırılan iki farklı safhada meydana gelir.
 1 Faz dönüşümlerinin çoğu ani olarak gerçekleşmediğinden, reaksiyon gelişiminin zamana bağlı, yani dönüşüm hızına bağlı olarak gelişen yapısal özelliklerini dikkate almak gerekir. Malzemelerin, özellikle
1 Faz dönüşümlerinin çoğu ani olarak gerçekleşmediğinden, reaksiyon gelişiminin zamana bağlı, yani dönüşüm hızına bağlı olarak gelişen yapısal özelliklerini dikkate almak gerekir. Malzemelerin, özellikle
Demir-Karbon Denge Diyagramı
 Demir-Karbon Denge Diyagramı Sıcaklık Demir-Karbon diyagramı Demir, pek çok mühendislik alaşımının temelini oluşturan metaldir. Külçe demir olarak bilinen ve hemen hemen saf durumdaki demir çatı, soba
Demir-Karbon Denge Diyagramı Sıcaklık Demir-Karbon diyagramı Demir, pek çok mühendislik alaşımının temelini oluşturan metaldir. Külçe demir olarak bilinen ve hemen hemen saf durumdaki demir çatı, soba
KOROZYON. Teorik Bilgi
 KOROZYON Korozyon, metalik malzemelerin içinde bulundukları ortamla reaksiyona girmeleri sonucu, dışardan enerji vermeye gerek olmadan, doğal olarak meydan gelen olaydır. Metallerin büyük bir kısmı su
KOROZYON Korozyon, metalik malzemelerin içinde bulundukları ortamla reaksiyona girmeleri sonucu, dışardan enerji vermeye gerek olmadan, doğal olarak meydan gelen olaydır. Metallerin büyük bir kısmı su
Termodinamik Termodinamik Süreçlerde İŞ ve ISI
 Termodinamik Süreçlerde İŞ ve ISI Termodinamik Hareketli bir pistonla bağlantılı bir silindirik kap içindeki gazı inceleyelim (Şekil e bakınız). Denge halinde iken, hacmi V olan gaz, silindir çeperlerine
Termodinamik Süreçlerde İŞ ve ISI Termodinamik Hareketli bir pistonla bağlantılı bir silindirik kap içindeki gazı inceleyelim (Şekil e bakınız). Denge halinde iken, hacmi V olan gaz, silindir çeperlerine
1. Giriş 2. Yayınma Mekanizmaları 3. Kararlı Karasız Yayınma 4. Yayınmayı etkileyen faktörler 5. Yarı iletkenlerde yayınma 6. Diğer yayınma yolları
 1. Giriş 2. Yayınma Mekanizmaları 3. Kararlı Karasız Yayınma 4. Yayınmayı etkileyen faktörler 5. Yarı iletkenlerde yayınma 6. Diğer yayınma yolları Sol üstte yüzey seftleştirme işlemi uygulanmış bir çelik
1. Giriş 2. Yayınma Mekanizmaları 3. Kararlı Karasız Yayınma 4. Yayınmayı etkileyen faktörler 5. Yarı iletkenlerde yayınma 6. Diğer yayınma yolları Sol üstte yüzey seftleştirme işlemi uygulanmış bir çelik
Boya eklenmesi Kısmen karışma Homojenleşme
 DİFÜZYON 1 Katı içerisindeki atomların hareketi yüksek konsantrasyon bölgelerinden düşük konsantrasyon bölgelerine doğrudur. Kayma olayından farklıdır. Kaymada hareketli atom düzlemlerindeki bütün atomlar
DİFÜZYON 1 Katı içerisindeki atomların hareketi yüksek konsantrasyon bölgelerinden düşük konsantrasyon bölgelerine doğrudur. Kayma olayından farklıdır. Kaymada hareketli atom düzlemlerindeki bütün atomlar
ATOM HAREKETLERİ ve ATOMSAL YAYINIM
 ATOM HAREKETLERİ ve ATOMSAL YAYINIM 1. Giriş Malzemelerde üretim ve uygulama sırasında görülen katılaşma, çökelme, yeniden kristalleşme, tane büyümesi gibi olaylar ile kaynak, lehim, sementasyon gibi işlemler
ATOM HAREKETLERİ ve ATOMSAL YAYINIM 1. Giriş Malzemelerde üretim ve uygulama sırasında görülen katılaşma, çökelme, yeniden kristalleşme, tane büyümesi gibi olaylar ile kaynak, lehim, sementasyon gibi işlemler
ELLINGHAM DİYAGRAMLARI
 7 ELLINGHAM DİYAGRAMLARI 7.1. Giriş Ellingham, 1944 yılında oksitli bileşenlerin sıcaklığa karşı oluşum standart serbest enerji değişimlerini gösteren grafiği çizen ilk kişidir. Daha sonraları aynı diyagram
7 ELLINGHAM DİYAGRAMLARI 7.1. Giriş Ellingham, 1944 yılında oksitli bileşenlerin sıcaklığa karşı oluşum standart serbest enerji değişimlerini gösteren grafiği çizen ilk kişidir. Daha sonraları aynı diyagram
Maddelerin Sınıflandırılması. Yrd. Doç. Dr. H. Hasan YOLCU
 Maddelerin Sınıflandırılması Yrd. Doç. Dr. H. Hasan YOLCU Maddelerin Sınıflandırılması Madde Evet Saf Madde Sabit bir bileşimi varmı. Kimyasal formülle belirtilemiliyor mu? Hayır Karışım Element Bileşik
Maddelerin Sınıflandırılması Yrd. Doç. Dr. H. Hasan YOLCU Maddelerin Sınıflandırılması Madde Evet Saf Madde Sabit bir bileşimi varmı. Kimyasal formülle belirtilemiliyor mu? Hayır Karışım Element Bileşik
1. 2. 3. 4. 5. 6. 7. 8. MALZEME BILGISI B9
 1. 2. 3. 4. 5. 6. 7. 8. Aşağıdaki grafik saf suya (H 2 0) ait faz diyagramını göstermektedir. Bu grafikte yer alan değişkenler; dış basınç (düşey eksende ve logaritmik ölçekte) ve sıcaklıktır. Bir bakıma
1. 2. 3. 4. 5. 6. 7. 8. Aşağıdaki grafik saf suya (H 2 0) ait faz diyagramını göstermektedir. Bu grafikte yer alan değişkenler; dış basınç (düşey eksende ve logaritmik ölçekte) ve sıcaklıktır. Bir bakıma
Pratik olarak % 0.2 den az C içeren çeliklere su verilemez.
 1. DENEYİN AMACI: Farklı soğuma hızlarında (havada, suda ve yağda su verme ile) meydana gelebilecek mikroyapıların mekanik özelliklere etkisinin incelenmesi ve su ortamında soğutulan numunenin temperleme
1. DENEYİN AMACI: Farklı soğuma hızlarında (havada, suda ve yağda su verme ile) meydana gelebilecek mikroyapıların mekanik özelliklere etkisinin incelenmesi ve su ortamında soğutulan numunenin temperleme
KONU 11: TAŞIN HAMMADDE OLARAK KULLANIMI: MİNERALLER. Taşın Hammadde Olarak Kullanımı
 KONU 11: TAŞIN HAMMADDE OLARAK KULLANIMI: MİNERALLER Taşın Hammadde Olarak Kullanımı Odun ve kemik gibi, taş da insanın varlığının ilk evrelerinden bu yana elinin altında bulunan ve doğanın ona verdiği
KONU 11: TAŞIN HAMMADDE OLARAK KULLANIMI: MİNERALLER Taşın Hammadde Olarak Kullanımı Odun ve kemik gibi, taş da insanın varlığının ilk evrelerinden bu yana elinin altında bulunan ve doğanın ona verdiği
Gerçekte yükler yayılı olup, tekil yük problemlerin çözümünü kolaylaştıran bir idealleştirmedir.
 STATIK VE MUKAVEMET 4. Ağırlık Merkezi AĞIRLIK MERKEZİ Gerçekte yükler yayılı olup, tekil yük problemlerin çözümünü kolaylaştıran bir idealleştirmedir. Statikte çok küçük bir alana etki eden birbirlerine
STATIK VE MUKAVEMET 4. Ağırlık Merkezi AĞIRLIK MERKEZİ Gerçekte yükler yayılı olup, tekil yük problemlerin çözümünü kolaylaştıran bir idealleştirmedir. Statikte çok küçük bir alana etki eden birbirlerine
KONU 4: DOĞRUSAL PROGRAMLAMA MODELİ İÇİN ÇÖZÜM YÖNTEMLERİ I
 KONU 4: DOĞRUSAL PROGRAMLAMA MODELİ İÇİN ÇÖZÜM YÖNTEMLERİ I 4.1. Dışbükeylik ve Uç Nokta Bir d.p.p. de model kısıtlarını aynı anda sağlayan X X X karar değişkenleri... n vektörüne çözüm denir. Eğer bu
KONU 4: DOĞRUSAL PROGRAMLAMA MODELİ İÇİN ÇÖZÜM YÖNTEMLERİ I 4.1. Dışbükeylik ve Uç Nokta Bir d.p.p. de model kısıtlarını aynı anda sağlayan X X X karar değişkenleri... n vektörüne çözüm denir. Eğer bu
BMM 205 Malzeme Biliminin Temelleri
 BMM 205 Malzeme Biliminin Temelleri Faz Diyagramları Dr. Ersin Emre Ören Biyomedikal Mühendisliği Bölümü Malzeme Bilimi ve Nanoteknoloji Mühendisliği Bölümü TOBB Ekonomi ve Teknoloji Üniversitesi Ankara
BMM 205 Malzeme Biliminin Temelleri Faz Diyagramları Dr. Ersin Emre Ören Biyomedikal Mühendisliği Bölümü Malzeme Bilimi ve Nanoteknoloji Mühendisliği Bölümü TOBB Ekonomi ve Teknoloji Üniversitesi Ankara
Hidrojeokimya, 3/12. Hidrojeokimyasal çalışmalar Yerinde Ölçüm, Örnekleme, Analiz ve Değerlendirme aşamalarından oluşur.
 Hidrojeokimya, 3/12 Hidrojeokimyasal çalışmalar Yerinde Ölçüm, Örnekleme, Analiz ve Değerlendirme aşamalarından oluşur. Analiz sonuçlarının kontrolu Elektro-nötralite (EN, %) Özgül Elektriksel İletkenlik
Hidrojeokimya, 3/12 Hidrojeokimyasal çalışmalar Yerinde Ölçüm, Örnekleme, Analiz ve Değerlendirme aşamalarından oluşur. Analiz sonuçlarının kontrolu Elektro-nötralite (EN, %) Özgül Elektriksel İletkenlik
KATILARDA KRİSTAL YAPI. Hekzagonal a b c 90 o, 120. Tetragonal a b c 90 o. Rombohedral (Trigonal) Ortorombik a b c 90 o. Monoklinik a b c 90 o
 KATILARDA KRİSTAL YAPI Kristal yapı atomun bir üst seviyesinde incelenen ve atomların katı halde oluşturduğu düzeni ifade eden birim hücre (kafes) geometrik parametreleri ve atom dizilimi ile tarif edilen
KATILARDA KRİSTAL YAPI Kristal yapı atomun bir üst seviyesinde incelenen ve atomların katı halde oluşturduğu düzeni ifade eden birim hücre (kafes) geometrik parametreleri ve atom dizilimi ile tarif edilen
Sıcaklık (Temperature):
 Sıcaklık (Temperature): Sıcaklık tanım olarak bir maddenin yapısındaki molekül veya atomların ortalama kinetik enerjilerinin ölçüm değeridir. Sıcaklık t veya T ile gösterilir. Termometre kullanılarak ölçülür.
Sıcaklık (Temperature): Sıcaklık tanım olarak bir maddenin yapısındaki molekül veya atomların ortalama kinetik enerjilerinin ölçüm değeridir. Sıcaklık t veya T ile gösterilir. Termometre kullanılarak ölçülür.
Dik koordinat sisteminde yatay eksen x ekseni (apsis ekseni), düşey eksen ise y ekseni (ordinat ekseni) dir.
 ANALĐTĐK GEOMETRĐ 1. Analitik Düzlem Bir düzlemde dik kesişen iki sayı doğrusunun oluşturduğu sisteme analitik düzlem denir. Analitik düzlem, dik koordinat sistemi veya dik koordinat düzlemi olarak da
ANALĐTĐK GEOMETRĐ 1. Analitik Düzlem Bir düzlemde dik kesişen iki sayı doğrusunun oluşturduğu sisteme analitik düzlem denir. Analitik düzlem, dik koordinat sistemi veya dik koordinat düzlemi olarak da
STOKİYOMETRİ. Kimyasal Tepkimelerde Kütle İlişkisi
 STOKİYOMETRİ Kimyasal Tepkimelerde Kütle İlişkisi Sülfür oksijen içerisinde yanarak kükürt dioksit oluşturur. Modeller elementel sülfürü (S8), oksijeni ve kükürt dioksit moleküllerini göstermektedir. Her
STOKİYOMETRİ Kimyasal Tepkimelerde Kütle İlişkisi Sülfür oksijen içerisinde yanarak kükürt dioksit oluşturur. Modeller elementel sülfürü (S8), oksijeni ve kükürt dioksit moleküllerini göstermektedir. Her
BileĢiklerin formülleri atom sayıları oranını yansıtan en basit formüldür.
 KATILAR KRĠSTAL KATI Sert SıkıĢtırılmayan Tanecikleri belirli geometrik Ģekle sahiptir. ĠYONĠK KRĠSTAL Anyon- katyonlar arasında elektrostatik çekim kuvveti sonucu oluģur (iyonik bağ içerir). Sert-sağlam-
KATILAR KRĠSTAL KATI Sert SıkıĢtırılmayan Tanecikleri belirli geometrik Ģekle sahiptir. ĠYONĠK KRĠSTAL Anyon- katyonlar arasında elektrostatik çekim kuvveti sonucu oluģur (iyonik bağ içerir). Sert-sağlam-
MİNERALLER. Tek mineralden oluşan kayaçlar. Kireçtaşı (Kalsit). Kaya tuzu (Halit). Buzul
 Kayaçlar minerallerden oluşan Yer materyalidir. Çoğu kayaçlar birden fazla mineralden oluşmaktadır. Örnek: Granit Potasyum feldspat. Plajioklas (Feldspat). Kuvars. Hornblende. Biyotit MİNERALLER Tek mineralden
Kayaçlar minerallerden oluşan Yer materyalidir. Çoğu kayaçlar birden fazla mineralden oluşmaktadır. Örnek: Granit Potasyum feldspat. Plajioklas (Feldspat). Kuvars. Hornblende. Biyotit MİNERALLER Tek mineralden
FAZ DİYAGRAMLARI VE DÖNÜŞÜMLERİ
 FAZ DİYAGRAMLARI VE DÖNÜŞÜMLERİ Prof. Dr. Ramazan YILMAZ Sakarya Üniversitesi, Teknoloji Fakültesi, Metalurji ve Malzeme Mühendisliği Bölümü Esentepe Kampüsü, 54187, SAKARYA FAZ DİYAGRAMLARI VE DÖNÜŞÜMLERİ
FAZ DİYAGRAMLARI VE DÖNÜŞÜMLERİ Prof. Dr. Ramazan YILMAZ Sakarya Üniversitesi, Teknoloji Fakültesi, Metalurji ve Malzeme Mühendisliği Bölümü Esentepe Kampüsü, 54187, SAKARYA FAZ DİYAGRAMLARI VE DÖNÜŞÜMLERİ
FZM 220. Malzeme Bilimine Giriş
 FZM 220 Yapı Karakterizasyon Özellikler İşleme Performans Prof. Dr. İlker DİNÇER Fakültesi, Fizik Mühendisliği Bölümü 1 Ders Hakkında FZM 220 Dersinin Amacı Bu dersin amacı, fizik mühendisliği öğrencilerine,
FZM 220 Yapı Karakterizasyon Özellikler İşleme Performans Prof. Dr. İlker DİNÇER Fakültesi, Fizik Mühendisliği Bölümü 1 Ders Hakkında FZM 220 Dersinin Amacı Bu dersin amacı, fizik mühendisliği öğrencilerine,
Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı
 Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani madde yani bileşik
Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani madde yani bileşik
Örneğin; İki hidrojen (H) uyla, bir oksijen (O) u birleşerek hidrojen ve oksijenden tamamen farklı olan su (H 2
 On5yirmi5.com Madde ve özellikleri Kütlesi, hacmi ve eylemsizliği olan herşey maddedir. Yayın Tarihi : 21 Ocak 2014 Salı (oluşturma : 2/9/2016) Kütle hacim ve eylemsizlik maddenin ortak özelliklerindendir.çevremizde
On5yirmi5.com Madde ve özellikleri Kütlesi, hacmi ve eylemsizliği olan herşey maddedir. Yayın Tarihi : 21 Ocak 2014 Salı (oluşturma : 2/9/2016) Kütle hacim ve eylemsizlik maddenin ortak özelliklerindendir.çevremizde
GENEL KİMYA. Yrd.Doç.Dr. Tuba YETİM
 GENEL KİMYA ÇÖZELTİLER Homojen karışımlara çözelti denir. Çözelti bileşiminin ve özelliklerinin çözeltinin her yerinde aynı olması sebebiyle çözelti, «homojen» olarak nitelendirilir. Çözeltinin değişen
GENEL KİMYA ÇÖZELTİLER Homojen karışımlara çözelti denir. Çözelti bileşiminin ve özelliklerinin çözeltinin her yerinde aynı olması sebebiyle çözelti, «homojen» olarak nitelendirilir. Çözeltinin değişen
Doç.Dr.Salim ŞAHİN SÜRÜNME
 Doç.Dr.Salim ŞAHİN SÜRÜNME SÜRÜNME Malzemelerin yüksek sıcaklıkta sabit bir yük altında (hatta kendi ağırlıkları ile bile) zamanla kalıcı plastik şekil değiştirmesine sürünme denir. Sürünme her ne kadar
Doç.Dr.Salim ŞAHİN SÜRÜNME SÜRÜNME Malzemelerin yüksek sıcaklıkta sabit bir yük altında (hatta kendi ağırlıkları ile bile) zamanla kalıcı plastik şekil değiştirmesine sürünme denir. Sürünme her ne kadar
KRİSTALLERİN PLASTİK DEFORMASYONU
 KRİSTALLERİN PLASTİK DEFORMASYONU Turgut Gülmez METALLERDE PLASTİK ŞEKİL DEĞİŞİMİ MEKANİZMALARI :Kayma, ikizlenme, tane sınırı kayması ve yayınma sürünmesi METALLERDE PLASTİK ŞEKİL DEĞİŞİMİ MEKANİZMALARI
KRİSTALLERİN PLASTİK DEFORMASYONU Turgut Gülmez METALLERDE PLASTİK ŞEKİL DEĞİŞİMİ MEKANİZMALARI :Kayma, ikizlenme, tane sınırı kayması ve yayınma sürünmesi METALLERDE PLASTİK ŞEKİL DEĞİŞİMİ MEKANİZMALARI
DOĞAL KURŞUN METALİK KURŞUN PLAKALAR
 KURŞUN ve ALAŞIMLARI DOĞAL KURŞUN METALİK KURŞUN PLAKALAR 1 KURŞUN ve ALAŞIMLARI Romalılar kurşun boruları banyolarda kullanmıştır. 2 KURŞUN ve ALAŞIMLARI Kurşuna oda sıcaklığında bile çok düşük bir gerilim
KURŞUN ve ALAŞIMLARI DOĞAL KURŞUN METALİK KURŞUN PLAKALAR 1 KURŞUN ve ALAŞIMLARI Romalılar kurşun boruları banyolarda kullanmıştır. 2 KURŞUN ve ALAŞIMLARI Kurşuna oda sıcaklığında bile çok düşük bir gerilim
FAZ DİYAGRAMLARI. DERS NOTLARI Genel Kavramlar ve Tek Bileşenli Faz Diyagramları. İçerik
 FAZ DİYAGRAMLARI DERS NOTLARI Genel Kavramlar ve Tek Bileşenli Faz Diyagramları İçerik KTÜ, Metalurji ve Malzeme Mühendisliği Bölümü Ders İçeriği Malzemelerin farklı sıcaklık, basınç ve bileşim değerlerinde
FAZ DİYAGRAMLARI DERS NOTLARI Genel Kavramlar ve Tek Bileşenli Faz Diyagramları İçerik KTÜ, Metalurji ve Malzeme Mühendisliği Bölümü Ders İçeriği Malzemelerin farklı sıcaklık, basınç ve bileşim değerlerinde
