Dokuz Eylül Üniversitesi İnşaat Mühendisliği Bölümü YAPI MALZEMESİ -I
|
|
|
- Ekin Koçer
- 8 yıl önce
- İzleme sayısı:
Transkript
1 Dokuz Eylül Üniversitesi İnşaat Mühendisliği Bölümü YAPI MALZEMESİ -I 2. Katı Cisimlerin İç Yapısı 2.1. Atom Yapısı 2.2. Atom Bağları 2.3. Atomsal Yapı Türleri Metalik (Kristal) Yapı Amorf Yapı Bileşik Yapı Kolloidal Yapı Seramik Yapı 1
2 2. Katı Cisimlerin İç Yapısı Yapı ilk boyutlandırma tasarım yükler altındaki davranış? Yükleme koşulları ve kesin hesaplamalar malzeme mekanik özellikler 2
3 2. Katı Cisimlerin İç Yapısı Mekanik Özellikler iç yapı Atom yapısı Bağlar Moleküler yapı Fazlar Tane yapısı Yapı Mühendisi min.fizik ve kimya bilgisi 3
4 2.1. Atom Yapısı Elektronlar (e) Çekirdek (p+n) Denge durumundaki bir atomda elektronların (-) sayısı protonların (+) sayısına eşittir. Elektronlar, çekirdek kütlesi yanında çok küçüktür (1/1850 oranında) ve bu değer kütle hesabında göz önüne alınmaz. Atomun en önemli özelliği, çeşitli bağ kuvvetlerinin meydana gelmesine yol açan elektron sayısıdır. 4
5 2.1. Atom Yapısı Atom numarası (Z) = proton sayısı = elektron sayısı (dengede) Kütle numarası (A) = Atomdaki proton ve nötronların toplam sayısı Z A 6 C O Fe s 2,2s 2,2p 2 1s 2,2s 2,2p 4 1s 2,2s 2,2p 6,3s 2,3p 6,4s 2,3d 6 5
6 2.1. Atom Yapısı Örneğin, atom numarası 92 olan uranyumun 92 elektronu vardır. r. Buna göre, g uranyum atomunun çekirdeğinde inde 92 proton ve 146 nötron n vardır. r. Böylece uranyumun kütle ağıa ğırlığı 238 olur (elektron kütle k ağıa ğırlığı ihmal). Yoğunluğu: 18.95g/cm 3 1s 2 2s 2 p 6 3s 2 p 6 d 10 4s 2 p 6 d 10 f 14 5s 2 p 6 d 10 f 3 6s 2 p 6 d 1 7s 2 Valans elektronları: 5f 3 6d 1 7s 2 6
7 2.1. Atom Yapısı Nötr bir atom için; elektron sayısı= proton sayısı İyon yükü= proton sayısı elektron sayısı (E.S.) (K.N.) Kütle numarası= proton + (N.S)nötron sayısı (atom ağırlığı) Atom Numarası (A.N.) = Proton Sayısı = Çekirdek Yükü = Elektron Sayısı 7
8 2.1. Atom Yapısı 1 Angstrom = m Atomların çapları çok küçüktür (2-5 Angstrom). Atom numarasına bağlı olarak atom çekirdeğinin yarıçapı mm aralığında, atom yarıçapı ise yaklaşık 10-7 mm civarındadır. Hidrojenin atom yarıçapı 0, mm, toryumun atom yarıçapı 1, mm dir. 8
9 2.1. Atom Yapısı Elektronların çekirdekten belli mesafedeki yörüngelerde hareket ettiği kabul edilir. Her yörüngede 2n 2 (n yörünge sayısı) sayıda elektron bulunur. Yörüngeler K, L, M, N, O, P ve Q olarak adlandırılır. En dış yörüngede bulunan elektronlar: valans elektronları 9
10 2.1. Atom Yapısı Valans elektronları atomlar arası bağı, atomlar arası mesafeyi ve malzemenin birçok özelliğini etkiler. bulunanlardır (Periyodik cetvelin en sağ kolonu: VIIIA En kararlı atomlar en dış kabuğunda 8 elektron grubu). 2 He: 1s 2 10 Ne: 1s 2,2s 2,2p 6 18 Ar:1s 2,2s 2,2p 6,3s 2,3p 6 36 Kr, 54 Xe, 86 Rn 10
11 2.1. Atom Yapısı Elektropozitif elementler Elektronegatif elementler Valans elekton sayısı azalır Kolay elektron verip pozitif yüklü iyon (katyon) oluştururlar. Elektronlarını ortaklaştırarak bağ oluştururlar. Elektron almaya ve negatif iyon (anyon) 11 haline gelmeye eğilimli
12 2.1. Atom Yapısı İZOTOP Elementlerin kimyasal özelliklerini o elementin elektron ve proton sayısı belirler. Bir elementin tüm izotoplarında kimyasal özellikleri aynıdır. İzotoplarda yalnızca fark nötron sayısıdır. İzotoplarda bazı fiziksel özellikler birbirinden farklı olabilir. Örneğin bazı izotoplar radyoaktif olmalarına karşın diğerleri değildir. 12
13 2.1. Atom Yapısı İZOTOP 13
14 2.1. Atom Yapısı İZOTOP Aynı atom numarasına (A.N.=p) sahip ancak kütle numarası (K.N.=p+n) farklı elementlerdir. Aynı atomun protonları sabit kalmakla beraber nötronları değişik olabilir ki bunlara izotop denilir. Örneğin; 26 Atom numarasına sahip demirin izotopları: 54Fe (26 p, 28 n) 55Fe (26 p, 29 n) 56Fe (26 p, 30 n) kararlı 57Fe (26 p, 31 n) kararlı 58Fe (26 p, 32 n) kararlı 59Fe (26 p, 31 n) radyoaktif 60Fe (26 p, 32 n) radyoaktif 14
15 2.1. Atom Yapısı Bir atom gramda; örneğin 55,85 gram demirde 6, (Avagadro sayısı ) kadar atom vardır. Demir atomunun 165 milyar kez büyütülmüş hali (HMK) Brüksel Belçika,
16 2.1. Atom Yapısı İZOTOP 16
17 2.1. Atom Yapısı İZOBAR Atom numaraları birbirlerine yakın elementlerin bazı izotopların kütle sayıları birbirlerine eşit olabilir. Proton adedi farklı, kütle sayıları aynı atomlara izobar denir. 17
18 2.1. Atom Yapısı ATOM MODELLERİ Elektronların hareket etmediği tahmin edilen model Çekirdek etrafında güneş sistemine benzer belirli yörüngelerde dönen elektronlar Son olarak elektronların dalga hareketi yaptığı ve belirli bir bölgede bulunması ihtimali olduğu yörüngeler 18
19 2.2. Atomlar arası bağlar Bağ kuvvetleri: Teorik mukavemetin kaynağı Elektriksel ve ısıl özellikler Atomlar arası bağ kuvvetli ise şekil değiştirme direnci büyük, ergime sıcaklığı yüksek ve ısıl genleşme düşük olur. Atom bağları zayıf (fiziksel) veya kuvvetli (kimyasal) olabilir. Kimyasal bağlar üç şekilde olur. 19
20 2.2. Atomlar arası bağlar En dış yörüngedeki elektron sayısı az ise atom bu elektonları verip yörüngeyi boşaltma eğilimindedir. Bu elementler metaldir ve metal atomları birbiri ile metalik bağ ile bağlanır. En dış yörüngedeki elekton sayısı hemen hemen doluya yakın atomlar ise eksik elektronu tamamlamaya eğilimlidir. Bu elementler ametal olarak adlandırılır. İki ametal arasındaki bağ genelde kovalenttir. Bir metal ile ametal atom arasında ise iyonik bağ meydana gelir. 20
21 2.2. Atomlar arası bağlar BAĞ ÇEŞİTLERİ 1. İyonik Bağ 2. Kovalent Bağ 3. Metalik Bağ 4. Van Der Waals Bağı 21
22 2.2. Atomlar arası bağlar 1. İYONİK K BAĞ Metaller atomlarının son yörüngelerinde genellikle 1, 2 veya 3 elektron bulunur. Ametallerde ise son yörüngede 5, 6 veya 7 elektron bulunur (Bor hariç). 22
23 2.2. Atomlar arası bağlar 1. İYONİK K BAĞ Son yörüngedeki y eksiklikler elektron alış ışverişi i ile sekize tamamlanır. Elektron kaybeder Na + Cl - Na (0) yüksüz Elektron alır Cl (0) yüksüz Na + (+) Katyon Cl - (-) Anyon
24 2.2. Atomlar arası bağlar 1. İYONİK K BAĞ İyonik bağ metaller ile ametaller arasında oluşur. ur. 24
25 2.2. Atomlar arası bağlar 1. İYONİK K BAĞ Sodyum klorür (NaCl) Yoğunluk g/cm 3 Ergime sıcaklığı 801 C Kübik kafes yapısı 25
26 2.2. Atomlar arası bağlar İyonik moleküller suda çözünebilir: Su molekülleri ile iyonlar arasındaki çekim iyonların suda çözülmesini sağlar. İyon yüküne göre su molekülleri yönlenir ve iyonları taşır. 26
27 2.2. Atomlar arası bağlar 1. İYONİK K BAĞ Magnezyum klorür (MgCl 2 ) Yoğunluk 2.32 g/cm 3 Ergime sıcaklığı 714 C Rombohedral kafes yapısı 27
28 2.2. Atomlar arası bağlar 1. İYONİK K BAĞ Kalsiyum oksit (CaO) Kübik kafes yapısı Yoğunluk 3.35 g/cm 3 Ergime sıcaklığı 2572 C 28
29 2.2. Atomlar arası bağlar 1. İYONİK K BAĞ İyonik bağ yönsüzdür. Çünk nkü her iyon mümkm mkün n olduğu kadar zıt z t yönly nlü iyonla çevrilidir. Transfer edilen elektron sayısı arttıkça a bağı koparmak zorlaşı şır r ve malzemenin ergime noktası yükselir. 29
30 2.2. Atomlar arası bağlar 1. İYONİK K BAĞ Genel olarak iyonik bağ içeren katı malzemeler: Serttir. Çünkü atomlar arasında kayma hareketi oluşması güçtür. İyi yalıtkandır. Çünkü serbest elektronları veya serbest iyonları yoktur (bir çözeltide çözülmüş veya eritilmemişse). Kırılgandır, deforme olmak yerine çatlamaya meyillidir. Çünkü bağlar çok kuvvetlidir. Yüksek ergime sıcaklığına sahiptir. 30
31 2.2. Atomlar arası bağlar 2. KOVALENT BAĞ Elektronlar çekirdek etrafında döndd ndükleri gibi kendi eksenleri etrafında da dönerler. d Bu dönme d hareketi neticesinde elektromagnetik kuvvetler oluşur. ur Paylaşı şılan elektron ile pozitif çekirdek arasında çekim 31 kuvveti oluşur. ur.
32 2.2. Atomlar arası bağlar 2. KOVALENT BAĞ Bu bağlar periyodik tablodaki konumları ve elektronegatiflikleri birbirine yakın n olan atomlar arasında oluşur ur (ametal-ametal). ametal). Çok sayıda valans elektronunun yörüngeyi y boşaltacak şekilde verilmesi veya sekize tamamlanması çok enerji gerektirir. Valans elektronlarının ortak kullanımı ile kovalent bağ kurmaya eğilim e vardır. r. 32
33 2.2. Atomlar arası bağlar 2. KOVALENT BAĞ Valans elektronları ortaklaşarak arak oktetler (sekizli elektron sistemi) oluşturur. Kovalent bağ yönlüdür. Her atomun en yakın komşu u sayısı (8-N) kuralı ile belirlenir. (N en dışd kabuktaki elektron sayısıdır.) 33
34 2.2. Atomlar arası bağlar 2. KOVALENT BAĞ F, Cl, Br, I, At N=7 8-N=88 N=8-7=1 Her atomun yalnız z bir komşusu var ise di-atomik moleküller ller oluşur. ur. 17 Cl 1s 2,2s 2,2p 6,3s 2,3p 5 Cl Cl H 2, HCl (gaz) 34
35 2.2. Atomlar arası bağlar 2. KOVALENT BAĞ O, S, Se, Te N=6 8-N=88 N=8-6=2 Her atom iki atomla bağlan lanır r ve uzun zincir oluşturur. Rubber-like strands of plastic sulfur formed by pouring hot molten sulfur into cold water. 16 S 1s 2,2s 2,2p 6,3s 2,3p 4 35
36 2.2. Atomlar arası bağlar 2. KOVALENT BAĞ N, P, Sb N=5 8-N=88 N=8-5=3 Her atomun üç oluşturur. komşusu vardır r ve plaka 7 N 1s 2,2s 2,2p 3 36
37 2.2. Atomlar arası bağlar 2. KOVALENT BAĞ C, Si N=4 8-N=88 N=8-4=4 Her atomun dört d komşusu vardır r ve üç boyutlu yapı oluşturur. 6 C 1s 2,2s 2,2p 2 37
38 2.2. Atomlar arası bağlar 2. KOVALENT BAĞ 3726 C 38
39 2.2. Atomlar arası bağlar 2. KOVALENT BAĞ Elmas hariç kararlı üç boyutlu yapı gösteremedikleri için i in düşük d k mukavemetlidirler. Polimerler genelde kovalent bağlı malzemelerdir. 39
40 2.2. Atomlar arası bağlar 2. KOVALENT BAĞ Atomlar arasındaki kovalent bağlar kuvvetlidir. Ancak moleküller arasındaki bağlar daha zayıftır. Bu nedenle kovalent bağlı malzemeler kırılgandır. Çoğu seramik kovalent bağlıdır. -Sert - İyi yalıtkan - Şeffaf 40
41 2.2. Atomlar arası bağlar 2. KOVALENT BAĞ Buz 0 o C de eriyince hidrojen bağlarının kabaca %15 i kırılır. Sonuç olarak tetrahedral yapı bozulur, her su molekülü komşu 4 molekülden daha fazla moleküle bağlanır. Böylece yoğunluk den 1 e çıkar. 41
42 2.2. Atomlar arası bağlar 3. METALİK K BAĞ çekirdek elektron bulutu Metaller son yörüngelerindeki valans elektronlarını serbest bırakarak iyon haline gelirler. Serbest kalan elektronların metal atomu çekirdeği ile bağları çok zayıftır ve hiçbir atoma bağlı kalmadan metal çekirdekleri etrafında serbestçe dolaşırlar. 42
43 2.2. Atomlar arası bağlar 3. METALİK K BAĞ çekirdek Metal atomları birbirine yaklaştığında son yörüngelerindeki enerji bantları birbirinin içine girer ve serbest elektronlar bu bantlarda hareket edebilirler. elektron bulutu 43
44 2.2. Atomlar arası bağlar 3. METALİK K BAĞ elektron bulutu çekirdek Metallerin valans elektronlarını serbest bırakmaları özelliği, iyi elektrik iletimi sağlamalarına sebep olur. Bu bantlar içinde hareket eden negatif yüklü elektronlar ile pozitif yüklü çekirdek arasındaki çekim metalik bağı oluşturur 44
45 2.2. Atomlar arası bağlar 3. METALİK K BAĞ Metal atomları arasındaki bağ belirli atomlar ve elektronlara bağlı olmadığı için, atomların birbirine göre hareket etmesi ile bu bağ kopmaz. Bu özellik metallerin şekillendirilebilmelerini sağlar. 45
46 2.2. Atomlar arası bağlar 3. METALİK K BAĞ Alüminyum atomlarının en dış yörüngesindeki elektronlar serbest halde bir bulut oluşturur. Bu bulut iyi elektrik iletkenliğinin yanında deformasyon hareketini de kolaylaştırır. Böylece alüminyum cam ve diğer kırılgan malzemelerin tersine yüksek oranda deforme olabilir (düktil). 46
47 2.2. Atomlar arası bağlar 3. METALİK K BAĞ Metalik bağlar yönsüzdür. Aynı atomlar veya kimyasal olarak benzer atomlar arasında oluşur. Yüksek ısı ve elektrik iletkenliği: serbest elektronların kolay hareket etmesi. Serbest elektronlar ışık enerjisini yutmaktadır. Bu nedenle metaller opaktır. 47
48 2.2. Atomlar arası bağlar Kuvvetli bağlar ların n beraberliği Üç kuvvetli bağ ayrı ayrı incelense de birçok malzeme birden fazla şekilde bağlanabilir. Örneğin HCl'de H-Cl bağı sıvı çözeltilerde iyonik, gaz halinde iken kovalent bağlıdır. Hidrojen klorit gazı Hidroklorik asit çözeltisi 48
49 2.2. Atomlar arası bağlar Kuvvetli bağlar ların n beraberliği Bir malzemede birden fazla bağ bulmak mümkündür. Örneğin susuz alçı (anhidrit) CaSO 4 İyonik kovalent Ortorombik kafes 49
50 2.2. Atomlar arası bağlar VAN DER WAALS BAĞLARI Bu bağlar, elektron alış verişini tamamlamış moleküller veya son yörüngesindeki elektron sayısı sekiz olan inert gaz atomları arasında oluşan zayıf bağlardır. 50
51 2.2. Atomlar arası bağlar VAN DER WAALS BAĞLARI MOLEKÜL L KUTUPLAŞMASI Kovalent bağ ile kurulmuş bir molekülde, mesela hidrojen florür molekülünde paylaşılan elektronların çoğu florür atomu etrafında olacağından, molekül içinde bir elektrik yükü dengesizliği vardır. Molekülün + + H H Florür - Dipol + oluşumu H Florür - H + hidrojen tarafı pozitif florür tarafı negatif olur ve bu iki yük farkı moleküller arası çekim kuvvetini oluşturur. 51
52 2.2. Atomlar arası bağlar VAN DER WAALS BAĞLARI Grafit plakları arasındaki ikincil zayıf bağlar. 52
53 2.2. Atomlar arası bağlar VAN DER WAALS BAĞLARI 53
54 2.2. Atomlar arası bağlar Mesafe - bağ enerjisi ilişkisi itme + + çekme + - itme itme - - itme 54
55 2.2. Atomlar arası bağlar Mesafe - bağ enerjisi ilişkisi Metal atomları arasında oluşan itme ve çekme kuvvetlerinin kuvvetin dengelendiği durumdaki atomlar arasındaki uzaklığa atomlar arası mesafe denilir. Bu konumda iç enerji en azdır; yani atomlar en kararlı durumdadırlar. Kuvvet Çekme Net kuvvet İtme Atomlar arası mesafe r R a = R + r a 55
56 2.2. Atomlar arası bağlar Mesafe - bağ enerjisi ilişkisi Net kuvvetin sıfır olduğu nokta, atomlar arası mesafenin en kararlı durumudur. Bu noktada atomlar arası bağ enerjisi değeri 56
57 2.3. Atomsal yapı türleri 1.Kristal (Metalik) Yapı 2. Amorf Yapı 3. Bileşik Yapı 4. Kolloidal Yapı 5. Seramik Yapı 57
58 2.3. Atomsal yapı türleri 1. Kristal (Metalik) Yapı Atomlar 3 boyutta belirli bir düzendedir. Tüm malzeme boyunca sürekliliğini korur. Kristalin karbon Kristalin SiO 2 Kristalin buz 58
59 2.3. Atomsal yapı türleri 1. Kristal (Metalik) Yapı 2. Amorf Yapı Atomların dizilişinde bir düzensizlik vardır. Sıvılar amorf yapılıdır. Amorf karbon Amorf SiO 2 (cam) 59
60 2.3. Atomsal yapı türleri 1. Kristal (Metalik) Yapı 2. Amorf Yapı 3. Bileşik Yapı Çok küçük kristal parçalarının gelişigüzel bir yığını vardır. Yığını tek kitle haline getiren bağlayıcı Ahşap Çelik 60
61 2.3. Atomsal yapı türleri 1. Kristal (Metalik) Yapı 2. Amorf Yapı 3. Bileşik Yapı 4. Kolloidal Yapı duman, sis bitümlü emülsiyonlar 61
62 2.3. Atomsal yapı türleri 1. Kristal (Metalik) Yapı 2. Amorf Yapı 3. Bileşik Yapı 4. Kolloidal Yapı 5. Seramik Yapı Bir metal veya iki metal ile bir ametal atomun belirli steokimetrik oranlarda birleşmesiyle oluşurlar. Seramiklerde metal olmayan atom çoğunlukla oksijendir. Seramiklerde metaller katyon, ametaller ise anyon oluşumuna neden olurlar. Böylece seramiklerde iyonsal bağlar oldukça yaygındır. Ancak seramiklerde kovalan bağlara, kristal yapıya, hatta amorf yapıya da rastlanır. 62
63 Kristal (metalik) yapı kafes sistemleri Metal atomları üç boyutlu olarak düzenli bir diziliş meydana getirirler ki buna uzay kafesi denilir. Üç boyutlu olarak tekrarlanan en küçük yapıya birim hücre (kafes) denilir. 63
64 Kristal (metalik) yapı kafes sistemleri 64
65 Kristal (metalik) yapı kafes sistemleri Kristal sistemi uzunlukları açıları kübik a = b = c = = = 90 65
66 Kristal (metalik) yapı kafes sistemleri Kristal sistemi uzunlukları açıları hekzagonal a = b c = = 90, =
67 Kristal (metalik) yapı kafes sistemleri Kristal sistemi uzunlukları açıları tetragonal a = b c = = = 90 67
68 Kristal (metalik) yapı kafes sistemleri Kristal sistemi uzunlukları açıları rombohedral a = b = c = = 90 68
69 Kristal (metalik) yapı kafes sistemleri Kristal sistemi uzunlukları açıları ortorombik a b c = = = 90 69
70 Kristal (metalik) yapı kafes sistemleri Kristal sistemi uzunlukları açıları monoklinik a b c = = 90, 90 70
71 Kristal (metalik) yapı kafes sistemleri Kristal sistemi uzunlukları açıları triklinik a b c 90 71
72 Kristal (metalik) yapı kafes sistemleri Yapı Malzemesi olarak kullanılan metallerin kristal yapıları daha çok kübik ve hekzagonal sisteme uymaktadır. Hacim Merkezli Kübik (hmk) Yüzey Merkezli Kübik (ymk) Sıkı dizilmiş hekzogonal (sdh) 72
73 Kristal (metalik) yapı kafes sistemleri 73
74 Kristal (metalik) yapı kafes sistemleri Hacim Merkezli Kübik K (hmk) Küpün tam merkezine bir atom ve köşelere de birer atom yerleşmiştir. Küp hacminin içinde kalan atom hacmi: A-A kesiti r 2r 2a r 1 + 8*1/8= 2 adet a ADF= 3a 2 =16r 2 a= ADF= r 3 2*4/3*PI*r 3 a 3 A 74 A
75 Kristal (metalik) yapı kafes sistemleri Yüzey Merkezli Kübik K (ymk): Küpün her köşesine birer atom ve her bir yüzeye de birer atom yerleşmiştir. Küp içinde kalan atom hacmi: B-B kesiti r 2r a r 6*1/2 + 8*1/8= 4 adet a ADF= 2a 2 =16r 2 a= ADF= r 2 2*4/3*PI*r 3 a 3 B B 75
76 Kristal (metalik) yapı kafes sistemleri Sıkı Dizilmiş Hegzagonal (sdh): Atomlar taban düzlemde altıgenin köşelerine ve bir tane de altıgenin tam ortasına yerleşmiştir. İki taban düzlemi arasında taban düzlemindeki üç atoma teğet olacak şekilde üç tane atom yerleşmiştir. ADF=
77 Kristal (metalik) yapı kusurları 1. Nokta Hataları 2. Çizgi Hataları 3. Yüzeysel Y Hatalar 4. Segregasyon 77
78 Kristal (metalik) yapı kusurları 1. Nokta Hataları Boş Yer Boşyer: (Porozite) Katıla laşma sırass rasında büzülme, b yeterli sıvıs olmaması veya içeride gaz hapsolması nedenleri ile oluşur. ur. Boş yer Süreksizlik Kesitte daralma Mukavemet kaybı nedenidir. 78
79 Kristal (metalik) yapı kusurları 1. Nokta Hataları Boşluklar atomların n kristal kafes içerisinde i hareketleri kolaylaştırır r!!! 79
80 Kristal (metalik) yapı kusurları 1. Nokta Hataları Ara yer Yer alan Yabancı atomlar kristal kafes içerisinde i hareketleri zorlaştırır r!!! 80
81 Kristal (metalik) yapı kusurları 1. Nokta Hataları Ara yer alaşımlandırması (çelik) Çelik = demire karbon katılarak alaşımlandırılır. Dayanım ve sertlik artışı Demirin atom yarıçapı: 140 pm Karbonun atom yarıçapı: 70 pm 81
82 Kristal (metalik) yapı kusurları 1. Nokta Hataları Pirinç = bakıra çinko katılarak (%45'e kadar) alaşımlandırılır. Yüksek işlenebilirliğe sahip bir metal Yeralan alaşımlandırması (pirinç) Bakırın atom yarıçapı: 135 pm Çinkonun atom yarıçapı: 135 pm 82
83 Kristal (metalik) yapı kusurları 2. Çizgi Hataları Atomların n hatalı dizilişleri leri bir çizgi boyunca devam ederse çizgi hatası oluşur. ur. Çizgi hataları kenar dislokasyonu ve vida dislokasyonu olarak bilinir. Dislokasyonlar (Bazı iyon sıra ve düzlemlerinin yanlış yerlerde bulunabilmesi) 83
84 Kristal (metalik) yapı kusurları 2. Çizgi Hataları Kenar Dislokasyonu Kenar dislokasyonu, kristal içinde i inde sona eren bir düzlemin kenarıdır. r. İşareti şeklindedir. 84
85 Kristal (metalik) yapı kusurları 2. Çizgi Hataları Vida Dislokasyonu Vida dislokasyonunda ise, çizgi etrafındaki atomların n dizilişi i vidanın n helisi gibidir. İşareti şeklindedir. 85
86 Kristal (metalik) yapı kusurları 2. Çizgi Hataları Kenar ve vida dislokasyonları çoğu zaman beraber bulunurlar ki; buna karışı ışık k dislokasyon denilir. Dislokasyonlar, atomların n denge mesafesini bozduğu u için i in kristalin enerjisini artırır. r. 86
87 Kristal (metalik) yapı kusurları 3. Yüzeysel Y Hatalar Dış Yüzeyler: İç kısımdaki atomlar kendini çevreleyen atomlar ile denge durumunda olduğu u halde, metalin dışd yüzeye açılan a atomlarında denge durumu bozulmuştur. Tane SınırlarS rları: İki boyutlu olan bu sınırlarda s atomlar düzensiz yerleşirler 87
88 Polikristal yapı ve tane sınırları Metalik malzemelerin çoğu küçük kristal kümeciklerinden oluştuğundan polikristal adını alırlar. Bu kristal kümeciklerinin kristal yapısı da kendi içinde düzenlidir. Kristal kümeciklerinin ayrımını, bunların birim hücrelerinin değişik yönlerde dizilişinden anlayabiliriz. 88
89 Polikristal yapı ve tane sınırları Birleşen kristal kümecikleri arasında tane sınırı adı verilen atomik bir boşluk vardır. Bu bölgede belirli bir düzensizlik görülür. İnce yapılı bir metalik cismin kristal kümecikleri daha küçük yapılıdır. Bu nedenle kaba tane yapılı kristale kıyasla daha çok tane sınırı bulunmaktadır. 89
90 Ergime ve kristalleşme ile tane sınırı ilişkisi Her bir maddenin atomları devamlı titreşim im yapar. Bu titreşim im o maddenin sıcakls caklığını belirler. Sıcaklık k yükseldiky kseldikçe e titreşim im artar, düştükçe d e azalır. Mutlak sıfır s r sıcakls caklığında (-273( 273ºC) bütün b n atomların titreşimleri imleri durur. Metallerin sıcakls caklığı arttıkça, a, atomların titreşimleri imleri artar ve bu titreşimler imler atomlar arasındaki bağı zayıflat flatır. Titreşimlerin imlerin meydana getirdiği i enerji, metal atomlarını birbirine bağlayan enerjiyi geçince ergime dediğimiz imiz olay meydana gelir; yani metal sıvıs hale geçer. er. 90
91 Ergime ve kristalleşme ile tane sınırı ilişkisi Ergimiş bir metalin sıvıdan s katıya geçişinde inde meydana gelen kristalleşme iki safhada oluşur: ur: 1. Çekirdek oluşumu umu 2. Kristal büyümesi. b 91
92 Ergime ve kristalleşme ile tane sınırı ilişkisi TANE SINIRLARI Metal sıvıs halden katı hale geçerken erken genellikle çok sayıda kristal tanesi gelişir. ir. Katıla laşma tamamlandığı ığında tanelerin birleşti tiği i yerlerde atom kalınl nlığında düzensiz yerleşme oluşur. ur. Tek kristalli yapılarda tane aynı çekirdekten gelişir ir ve tane sınırlars rları oluşmaz. Tane sınırlars rları yüksek enerjilidir. (Yüzey gerilimi) Tane sınırlars rları kimyasal reaksiyona girebildiği i için i in üzerine dökülen d kimyasallar ile tespit edilir. 92
93 Kristal (metalik) yapı kusurları 4. Segregasyon Katıla laşma sırass rasında belirli fazların, belirli bir yerde toplanması. Makro ya da mikro olabilir. 93
94 Allotropik değişim Isı ve basıncın etkisiyle bazı cisimlerin kristal yapılarında değişimler olabilir. Bu tip kristal yapı değişimine allotropik değişim denir. Örnek: demir Oda sıcaklığında demir atomları hacim merkezli kübik (HMK) şekilde dizilir ki, buna ferrit denir. Sıcaklık 910 C ye yükseltildiğinde HMK yapı yüzey merkezli kübik (YMK) yapıya dönüşür. Buna da ostenit denir. Isıtmaya devam ettiğimiz takdirde ostenit de 1400 C civarında delta demirine dönüşür ki, bu da HMK yapıdadır. Demir, delta hâlinden havada soğutulduğunda tekrar ostenite ve sonra da ferrite dönüşür. 94
95 Allotropik değişim Ergimiş hâldeki demirin ihtiva ettiği karbon % 2 ve altına düşürülerek çelik elde edilir. Çelik % 2 ye kadar karbon ihtiva eden demir-karbon alaşımı Daha yüksek karbon miktarı dökme demirlerde bulunur. Saf demirin ticari kullanımı yoktur. İstenen özellikteki çeliğe göre, karbonun yanında başka alaşım elementleri de olabilir (Nikel, Wolfram, Vanadyum, Titan, Molibden, Krom, Çinko, vs). 95
96 Allotropik değişim Mıknatıs çekmeyen çelik Ostenit, demirin 910 C üzerindeki allotropudur. Oda sıcaklığına inildikçe ferrite dönüşür. Çeliğe belli bir miktarın üzerinde nikel ilâve edilirse, ostenit fazı artık ferrite dönüşmez ve çelik oda sıcaklığında bile ostenit olarak kalır. Ostenit yapının iki özelliği vardır: Birincisi, ostenit fazı manyetik değildir. İkincisi ise, YMK yapılı metaller düşük sıcaklıklarda kırılgan hâle gelmez. Bu sâyede, ostenitik yapılı paslanmaz çelikler -150 ºC nin altındaki (kriyojenik) sıcaklıklarda kullanılabilir. 96
97 Allotropik değişim ALLOTROPİK K DEĞİŞİ ĞİŞİM Karbonun bazı allotropları: a) Elmas b) Grafit c) Altıgen elmas d-f) Fullerenler (C60, C540, C70) g) Amorf karbon h) Karbon nanotüp Karbon allotropları (8) 97
98 Allotropik değişim 98
99 Allotropik değişim 99
100 Allotropik değişim Hafif Karbon Fiberli M3 Cabrio Body pieces are all crafted from carbon fiber reinforced polymer.21 Glass-reinforced plastics are used throughout structural points in the car 100
101 Allotropik değişim nanotüp ve fulleren: yeni sentezlenen karbon formları 2010 Nobel Fizik Ödülü, "iki-boyutlu grafen malzemeler" İngiltere'deki Manchester Üniversitesi'nde çalışan Rus kökenli bilimadamları Andre Geim ve Konstantin Novoselov Görüntü teknolojisinde büyük değişimler 101
102 Allotropik değişim Kalsit: CaCO 3 'ün en kararlı allotropu (300ün üzerinde kalsit kristal formu var) CaCO 3 'ün diğer allotropları: aragonit, mermer, kireçtaşı 102
103 İzotropi - anizotropi (mikro boyutta) Homojenlik, anizotropi ve izotropi boyuta bağlıdır. Tek kristal (monokrsital) yapı anizotropik iken, çoğu kristal yapılı malzeme izotropik ve homojen özellik gösterir. 103
104 İzotropi - anizotropi (makro boyutta) Mekanik, fiziksel, kimyasal özellikleri, dış etkilerin, uygulama doğrultusuna bağlı olarak, farklı değerler alabilir. Özelliklerin yönlere göre farklılık göstermesine anizotropi denir. İzotropik malzemeler (METALLER) δ 1 = δ 2 δ 1 Ξ δ 2 Anizotropik malzemeler (AHŞAP) δ 1 δ 2 δ 1 δ 2 104
105 Metalik Yapı Kontrolü ve Bozuklukları Bir metalik malzemenin yapısı gerekli kesme, parlatma gibi hazırlıklar yapıldıktan sonra mikroskobik olarak incelenebilir. Bu çalışmalar şu açılardan çok yararlıdır: 1) Metalik göçmelerin nedenini açıklayabilirler, 2) Metalin geçmişini öğrenerek uygun fabrikasyon işlemini ortaya çıkarırlar, 3) Isıl işlemlerin yeterlilik derecesini saptarlar, 4) Alaşımların geliştirilmesine yardımcı olabilirler, 5) Metal bileşenleri ve özellikleri kestirilebilir. 105
106 Metalik Yapı Kontrolü ve Bozuklukları Düşük karbon oranlı çelik Yüksek karbon oranlı çelik 106
107 Metalik Yapı Kontrolü ve Bozuklukları ferrit perlit sementit <
Dokuz Eylül Üniversitesi İnşaat Mühendisliği Bölümü YAPI MALZEMESİ -I
 Dokuz Eylül Üniversitesi İnşaat Mühendisliği Bölümü YAPI MALZEMESİ -I 2. Katı Cisimlerin İç Yapısı 2.1. Atom Yapısı 2.2. Atom Bağları 2.3. Atomsal Yapı Türleri 2.3.1. Metalik (Kristal) Yapı 2.3.2. Amorf
Dokuz Eylül Üniversitesi İnşaat Mühendisliği Bölümü YAPI MALZEMESİ -I 2. Katı Cisimlerin İç Yapısı 2.1. Atom Yapısı 2.2. Atom Bağları 2.3. Atomsal Yapı Türleri 2.3.1. Metalik (Kristal) Yapı 2.3.2. Amorf
ATOMLAR ARASI BAĞLAR
 MALZEME 2. HAFTA 1 ATOMSAL BAĞ ATOMLAR ARASI BAĞLAR Atomlar, atomlar arası bağ kuvvetleri ile bir araya gelirler. Malzemenin en küçük yapı taşı olan atomları bağ kuvvetleri bir arada tutar. Atomsal bağların
MALZEME 2. HAFTA 1 ATOMSAL BAĞ ATOMLAR ARASI BAĞLAR Atomlar, atomlar arası bağ kuvvetleri ile bir araya gelirler. Malzemenin en küçük yapı taşı olan atomları bağ kuvvetleri bir arada tutar. Atomsal bağların
ĐÇ YAPISI Doç. Dr. Halit YAZICI
 Dokuz Eylül Üniversitesi Đnşaat Mühendisliği Bölümü YAPI MALZEMESĐ I DERSĐ KATI ÇĐSĐMLERĐN ĐÇ YAPISI Doç. Dr. Halit YAZICI http://kisi.deu.edu.tr/halit.yazici/ Đnşaat Mühendisliğinde, cisimlerin yükler
Dokuz Eylül Üniversitesi Đnşaat Mühendisliği Bölümü YAPI MALZEMESĐ I DERSĐ KATI ÇĐSĐMLERĐN ĐÇ YAPISI Doç. Dr. Halit YAZICI http://kisi.deu.edu.tr/halit.yazici/ Đnşaat Mühendisliğinde, cisimlerin yükler
BÖLÜM 2 ATOMİK YAPI İÇERİK. Atom yapısı. Bağ tipleri. Chapter 2-1
 BÖLÜM 2 ATOMİK YAPI İÇERİK Atom yapısı Bağ tipleri 1 Atomların Yapıları Atomlar başlıca üç temel atom altı parçacıktan oluşur; Protonlar (+ yüklü) Nötronlar (yüksüz) Elektronlar (-yüklü) Basit bir atom
BÖLÜM 2 ATOMİK YAPI İÇERİK Atom yapısı Bağ tipleri 1 Atomların Yapıları Atomlar başlıca üç temel atom altı parçacıktan oluşur; Protonlar (+ yüklü) Nötronlar (yüksüz) Elektronlar (-yüklü) Basit bir atom
ATOMİK YAPI. Elektron Yükü=-1,60x10-19 C Proton Yükü=+1,60x10-19 C Nötron Yükü=0
 ATOMİK YAPI Atom, birkaç türü birleştiğinde çeşitli molekülleri, bir tek türü ise bir kimyasal öğeyi oluşturan parçacıktır. Atom, elementlerin özelliklerini taşıyan en küçük yapı birimi olup çekirdekteki
ATOMİK YAPI Atom, birkaç türü birleştiğinde çeşitli molekülleri, bir tek türü ise bir kimyasal öğeyi oluşturan parçacıktır. Atom, elementlerin özelliklerini taşıyan en küçük yapı birimi olup çekirdekteki
BÖLÜM 2 ATOMİK YAPI İÇERİK. Atom yapısı. Bağ tipleri. Chapter 2-1
 BÖLÜM 2 ATOMİK YAPI İÇERİK Atom yapısı Bağ tipleri 1 Atomların Yapıları Atomlar başlıca üç temel atom altı parçacıktan oluşur; Protonlar (+ yüklü) Nötronlar (yüksüz) Elektronlar (-yüklü) Basit bir atom
BÖLÜM 2 ATOMİK YAPI İÇERİK Atom yapısı Bağ tipleri 1 Atomların Yapıları Atomlar başlıca üç temel atom altı parçacıktan oluşur; Protonlar (+ yüklü) Nötronlar (yüksüz) Elektronlar (-yüklü) Basit bir atom
ATOMİK YAPI. Elektron Yükü=-1,60x10-19 C Proton Yükü=+1,60x10-19 C Nötron Yükü=0
 ATOMİK YAPI Elektron Yükü=-1,60x10-19 C Proton Yükü=+1,60x10-19 C Nötron Yükü=0 Elektron Kütlesi 9,11x10-31 kg Proton Kütlesi Nötron Kütlesi 1,67x10-27 kg Bir kimyasal elementin atom numarası (Z) çekirdeğindeki
ATOMİK YAPI Elektron Yükü=-1,60x10-19 C Proton Yükü=+1,60x10-19 C Nötron Yükü=0 Elektron Kütlesi 9,11x10-31 kg Proton Kütlesi Nötron Kütlesi 1,67x10-27 kg Bir kimyasal elementin atom numarası (Z) çekirdeğindeki
Dokuz Eylül Üniversitesi Đnşaat Mühendisliği Bölümü YAPI MALZEMESĐ I DERSĐ ĐÇ YAPISI YRD.DOÇ.DR. KAMĐLE TOSUN GÜZ YY.
 Dokuz Eylül Üniversitesi Đnşaat Mühendisliği Bölümü YAPI MALZEMESĐ I DERSĐ KATI ÇĐSĐMLERĐN ĐÇ YAPISI YRD.DOÇ.DR. KAMĐLE TOSUN 2010-2011-GÜZ YY. KATI ÇĐSĐMLERĐN ĐÇ YAPISI Đnşaat Mühendisliğinde, cisimlerin
Dokuz Eylül Üniversitesi Đnşaat Mühendisliği Bölümü YAPI MALZEMESĐ I DERSĐ KATI ÇĐSĐMLERĐN ĐÇ YAPISI YRD.DOÇ.DR. KAMĐLE TOSUN 2010-2011-GÜZ YY. KATI ÇĐSĐMLERĐN ĐÇ YAPISI Đnşaat Mühendisliğinde, cisimlerin
ATOMLAR ARASI BAĞLAR Doç. Dr. Ramazan YILMAZ
 ATOMLAR ARASI BAĞLAR Doç. Dr. Ramazan YILMAZ Sakarya Üniversitesi, Teknoloji Fakültesi, Metalurji ve Malzeme Mühendisliği Bölümü Esentepe Kampüsü, 54187, SAKARYA Atomlar Arası Bağlar 1 İyonik Bağ 2 Kovalent
ATOMLAR ARASI BAĞLAR Doç. Dr. Ramazan YILMAZ Sakarya Üniversitesi, Teknoloji Fakültesi, Metalurji ve Malzeme Mühendisliği Bölümü Esentepe Kampüsü, 54187, SAKARYA Atomlar Arası Bağlar 1 İyonik Bağ 2 Kovalent
METALİK MALZEMELERİN GENEL KARAKTERİSTİKLERİ BAHAR 2010
 METALİK MALZEMELERİN GENEL KARAKTERİSTİKLERİ BAHAR 2010 WEBSİTE www2.aku.edu.tr/~hitit Dersler İÇERİK Metalik Malzemelerin Genel Karakteristiklerİ Denge diyagramları Ergitme ve döküm Dökme demir ve çelikler
METALİK MALZEMELERİN GENEL KARAKTERİSTİKLERİ BAHAR 2010 WEBSİTE www2.aku.edu.tr/~hitit Dersler İÇERİK Metalik Malzemelerin Genel Karakteristiklerİ Denge diyagramları Ergitme ve döküm Dökme demir ve çelikler
Atomlar ve Moleküller
 Atomlar ve Moleküller Madde, uzayda yer işgal eden ve kütlesi olan herşeydir. Element, kimyasal tepkimelerle başka bileşiklere parçalanamayan maddedir. -Doğada 92 tane element bulunmaktadır. Bileşik, belli
Atomlar ve Moleküller Madde, uzayda yer işgal eden ve kütlesi olan herşeydir. Element, kimyasal tepkimelerle başka bileşiklere parçalanamayan maddedir. -Doğada 92 tane element bulunmaktadır. Bileşik, belli
Nötr (yüksüz) bir için, çekirdekte kaç proton varsa çekirdeğin etrafındaki yörüngelerde de o kadar elektron dolaşır.
 ATOM ve YAPISI Elementin özelliğini taşıyan en küçük parçasına denir. Atom Numarası Bir elementin unda bulunan proton sayısıdır. Protonlar (+) yüklü olduklarından pozitif yük sayısı ya da çekirdek yükü
ATOM ve YAPISI Elementin özelliğini taşıyan en küçük parçasına denir. Atom Numarası Bir elementin unda bulunan proton sayısıdır. Protonlar (+) yüklü olduklarından pozitif yük sayısı ya da çekirdek yükü
MALZEME BİLGİSİ. Katı Eriyikler
 MALZEME BİLGİSİ Dr.- Ing. Rahmi ÜNAL Konu: Katı Eriyikler 1 Giriş Endüstriyel metaller çoğunlukla birden fazla tür eleman içerirler, çok azı arı halde kullanılır. Arı metallerin yüksek iletkenlik, korozyona
MALZEME BİLGİSİ Dr.- Ing. Rahmi ÜNAL Konu: Katı Eriyikler 1 Giriş Endüstriyel metaller çoğunlukla birden fazla tür eleman içerirler, çok azı arı halde kullanılır. Arı metallerin yüksek iletkenlik, korozyona
FZM 220. Malzeme Bilimine Giriş
 FZM 220 Yapı Karakterizasyon Özellikler İşleme Performans Prof. Dr. İlker DİNÇER Fakültesi, Fizik Mühendisliği Bölümü 1 Atomsal Yapı ve Atomlararası Bağ1 Ders Hakkında FZM 220 Dersinin Amacı Bu dersin
FZM 220 Yapı Karakterizasyon Özellikler İşleme Performans Prof. Dr. İlker DİNÇER Fakültesi, Fizik Mühendisliği Bölümü 1 Atomsal Yapı ve Atomlararası Bağ1 Ders Hakkında FZM 220 Dersinin Amacı Bu dersin
ATOMİK YAPI VE ATOMLAR ARASI BAĞLAR. Aytekin Hitit
 ATOMİK YAPI VE ATOMLAR ARASI BAĞLAR Aytekin Hitit Malzemeler neden farklı özellikler gösterirler? Özellikler Fiziksel Kimyasal Bahsi geçen yapısal etkenlerden elektron düzeni değiştirilemez. Ancak diğer
ATOMİK YAPI VE ATOMLAR ARASI BAĞLAR Aytekin Hitit Malzemeler neden farklı özellikler gösterirler? Özellikler Fiziksel Kimyasal Bahsi geçen yapısal etkenlerden elektron düzeni değiştirilemez. Ancak diğer
BMM 205 Malzeme Biliminin Temelleri
 BMM 205 Malzeme Biliminin Temelleri Atom Yapısı ve Atomlar Arası Bağlar Dr. Ersin Emre Ören Biyomedikal Mühendisliği Bölümü Malzeme Bilimi ve Nanoteknoloji Mühendisliği Bölümü TOBB Ekonomi ve Teknoloji
BMM 205 Malzeme Biliminin Temelleri Atom Yapısı ve Atomlar Arası Bağlar Dr. Ersin Emre Ören Biyomedikal Mühendisliği Bölümü Malzeme Bilimi ve Nanoteknoloji Mühendisliği Bölümü TOBB Ekonomi ve Teknoloji
KATILARIN ATOMİK DÜZENİ KRİSTAL YAPILAR
 KATILARIN ATOMİK DÜZENİ KRİSTAL YAPILAR KRİSTAL YAPILAR Mühendislik açısından önemli olan katı malzemelerin fiziksel özelikleri; katı malzemeleri meydana getiren atom, iyon veya moleküllerin dizilişine
KATILARIN ATOMİK DÜZENİ KRİSTAL YAPILAR KRİSTAL YAPILAR Mühendislik açısından önemli olan katı malzemelerin fiziksel özelikleri; katı malzemeleri meydana getiren atom, iyon veya moleküllerin dizilişine
BİYOLOJİK MOLEKÜLLERDEKİ
 BİYOLOJİK MOLEKÜLLERDEKİ KİMYASALBAĞLAR BAĞLAR KİMYASAL VE HÜCRESEL REAKSİYONLAR Yrd. Doç.Dr. Funda BULMUŞ Atomun Yapısı Maddenin en küçük yapı taşı olan atom elektron, proton ve nötrondan oluşmuştur.
BİYOLOJİK MOLEKÜLLERDEKİ KİMYASALBAĞLAR BAĞLAR KİMYASAL VE HÜCRESEL REAKSİYONLAR Yrd. Doç.Dr. Funda BULMUŞ Atomun Yapısı Maddenin en küçük yapı taşı olan atom elektron, proton ve nötrondan oluşmuştur.
MALZEMENİN İÇ YAPISI: Katılarda Atomsal Bağ
 MALZEMENİN İÇ YAPISI: Katılarda Atomsal Bağ Bölüm İçeriği Bağ Enerjisi ve Kuvveti Atomlar arası mesafe, Kuvvet ve Enerji İlişkisi Atomlar arası Mesafeyi Etkileyen Faktörler. Sıcaklık, Iyonsallik derecesi,
MALZEMENİN İÇ YAPISI: Katılarda Atomsal Bağ Bölüm İçeriği Bağ Enerjisi ve Kuvveti Atomlar arası mesafe, Kuvvet ve Enerji İlişkisi Atomlar arası Mesafeyi Etkileyen Faktörler. Sıcaklık, Iyonsallik derecesi,
MALZEME BİLGİSİ DERS 4 DR. FATİH AY.
 MALZEME BİLGİSİ DERS 4 DR. FATİH AY www.fatihay.net fatihay@fatihay.net GEÇEN HAFTA TEMEL KAVRAMLAR ATOMLARDA ELEKTRONLAR PERİYODİK TABLO BÖLÜM II ATOM YAPISI VE ATOMLARARASı BAĞLAR BAĞ KUVVETLERİ VE ENERJİLERİ
MALZEME BİLGİSİ DERS 4 DR. FATİH AY www.fatihay.net fatihay@fatihay.net GEÇEN HAFTA TEMEL KAVRAMLAR ATOMLARDA ELEKTRONLAR PERİYODİK TABLO BÖLÜM II ATOM YAPISI VE ATOMLARARASı BAĞLAR BAĞ KUVVETLERİ VE ENERJİLERİ
ATOMSAL YAPI TÜRLERİ Metalik malzemelerin çoğu küçük kristal kümeciklerinden oluştuğundan polikristal adını alırlar. Bu kristal kümeciklerinin
 ATOMSAL YAPI TÜRLERİ Metalik malzemelerin çoğu küçük kristal kümeciklerinden oluştuğundan polikristal adını alırlar. Bu kristal kümeciklerinin kristal yapısıda kendi içinde düzenlidir. Kristal kümeciklerinin
ATOMSAL YAPI TÜRLERİ Metalik malzemelerin çoğu küçük kristal kümeciklerinden oluştuğundan polikristal adını alırlar. Bu kristal kümeciklerinin kristal yapısıda kendi içinde düzenlidir. Kristal kümeciklerinin
KRİSTAL KAFES SİSTEMLERİ
 KRİSTAL KAFES SİSTEMLERİ Doç. Dr. Ramazan YILMAZ Sakarya Üniversitesi, Teknoloji Fakültesi, Metalurji ve Malzeme Mühendisliği Bölümü Esentepe Kampüsü, 54187, SAKARYA 1 Giriş 2 Kristal Yapısı ve Birim Hücreler
KRİSTAL KAFES SİSTEMLERİ Doç. Dr. Ramazan YILMAZ Sakarya Üniversitesi, Teknoloji Fakültesi, Metalurji ve Malzeme Mühendisliği Bölümü Esentepe Kampüsü, 54187, SAKARYA 1 Giriş 2 Kristal Yapısı ve Birim Hücreler
Katılar. MÜHENDİSLİK KİMYASI DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN. Yrd. Doç. Dr. Atilla EVCİN Afyonkarahisar Kocatepe Üniversitesi 2006
 Katılar Tüm maddeler, yeteri kadar soğutulduğunda katıları oluştururlar. MÜHENDİSLİK KİMYASI DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN Oluşan katıların doğası atom, iyon veya molekülleri birarada tutan kuvvetlere
Katılar Tüm maddeler, yeteri kadar soğutulduğunda katıları oluştururlar. MÜHENDİSLİK KİMYASI DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN Oluşan katıların doğası atom, iyon veya molekülleri birarada tutan kuvvetlere
GENEL KİMYA. 4. Konu: Kimyasal türler, Kimyasal türler arasındaki etkileşimler, Kimyasal Bağlar
 GENEL KİMYA 4. Konu: Kimyasal türler, Kimyasal türler arasındaki etkileşimler, Kimyasal Bağlar Kimyasal Türler Doğada bulunan bütün maddeler tanecikli yapıdadır. Maddenin özelliğini gösteren küçük yapı
GENEL KİMYA 4. Konu: Kimyasal türler, Kimyasal türler arasındaki etkileşimler, Kimyasal Bağlar Kimyasal Türler Doğada bulunan bütün maddeler tanecikli yapıdadır. Maddenin özelliğini gösteren küçük yapı
Yrd. Doç. Dr. H. Hasan YOLCU. hasanyolcu.wordpress.com
 Yrd. Doç. Dr. H. Hasan YOLCU hasanyolcu.wordpress.com En az iki atomun belli bir düzenlemeyle kimyasal bağ oluşturmak suretiyle bir araya gelmesidir. Aynı atomda olabilir farklı atomlarda olabilir. H 2,
Yrd. Doç. Dr. H. Hasan YOLCU hasanyolcu.wordpress.com En az iki atomun belli bir düzenlemeyle kimyasal bağ oluşturmak suretiyle bir araya gelmesidir. Aynı atomda olabilir farklı atomlarda olabilir. H 2,
CALLİSTER - SERAMİKLER
 CALLİSTER - SERAMİKLER Atomik bağı ağırlıklı olarak iyonik olan seramik malzemeler için, kristal yapılarının atomların yerine elektrikle yüklü iyonlardan oluştuğu düşünülebilir. Metal iyonları veya katyonlar
CALLİSTER - SERAMİKLER Atomik bağı ağırlıklı olarak iyonik olan seramik malzemeler için, kristal yapılarının atomların yerine elektrikle yüklü iyonlardan oluştuğu düşünülebilir. Metal iyonları veya katyonlar
GENEL KİMYA. 4. Konu: Kimyasal türler, Kimyasal türler arasındaki etkileşimler, Kimyasal Bağlar
 GENEL KİMYA 4. Konu: Kimyasal türler, Kimyasal türler arasındaki etkileşimler, Kimyasal Bağlar Kimyasal Türler Doğada bulunan bütün maddeler tanecikli yapıdadır. Maddenin özelliğini gösteren küçük yapı
GENEL KİMYA 4. Konu: Kimyasal türler, Kimyasal türler arasındaki etkileşimler, Kimyasal Bağlar Kimyasal Türler Doğada bulunan bütün maddeler tanecikli yapıdadır. Maddenin özelliğini gösteren küçük yapı
Atomların bir arada tutulmalarını sağlayan kuvvetlerdir Atomlar daha düşük enerjili duruma erişmek (daha kararlı olmak) için bir araya gelirler
 Kimyasal Bağlar; Atomların bir arada tutulmalarını sağlayan kuvvetlerdir Atomlar daha düşük enerjili duruma erişmek (daha kararlı olmak) için bir araya gelirler İki ana gruba ayrılır Kuvvetli (birincil,
Kimyasal Bağlar; Atomların bir arada tutulmalarını sağlayan kuvvetlerdir Atomlar daha düşük enerjili duruma erişmek (daha kararlı olmak) için bir araya gelirler İki ana gruba ayrılır Kuvvetli (birincil,
MADDENİN YAPISI VE ÖZELLİKLERİ ATOM
 MADDENİN YAPISI VE ÖZELLİKLERİ ATOM ATOMUN YAPISI Elementlerin tüm özelliğini gösteren en küçük parçasına atom denir. Atomu oluşturan parçacıklar farklı yüklere sa-hiptir. Atomda bulunan yükler; negatif
MADDENİN YAPISI VE ÖZELLİKLERİ ATOM ATOMUN YAPISI Elementlerin tüm özelliğini gösteren en küçük parçasına atom denir. Atomu oluşturan parçacıklar farklı yüklere sa-hiptir. Atomda bulunan yükler; negatif
Bölüm 3 - Kristal Yapılar
 Bölüm 3 - Kristal Yapılar Katı malzemeler, atomların veya iyonların oluşturdukları düzene göre sınıflandırılır. Kristal malzemede uzun-aralıkta atomsal ölçekte tekrarlayan bir düzen mevcuttur. Katılaşma
Bölüm 3 - Kristal Yapılar Katı malzemeler, atomların veya iyonların oluşturdukları düzene göre sınıflandırılır. Kristal malzemede uzun-aralıkta atomsal ölçekte tekrarlayan bir düzen mevcuttur. Katılaşma
MMM291 MALZEME BİLİMİ
 MMM291 MALZEME BİLİMİ Ofis Saatleri: Perşembe 14:00 16:00 ayse.kalemtas@btu.edu.tr, akalemtas@gmail.com Bursa Teknik Üniversitesi, Doğa Bilimleri, Mimarlık ve Mühendislik Fakültesi, Metalurji ve Malzeme
MMM291 MALZEME BİLİMİ Ofis Saatleri: Perşembe 14:00 16:00 ayse.kalemtas@btu.edu.tr, akalemtas@gmail.com Bursa Teknik Üniversitesi, Doğa Bilimleri, Mimarlık ve Mühendislik Fakültesi, Metalurji ve Malzeme
Bazı atomlarda proton sayısı aynı olduğu halde nötron sayısı değişiktir. Bunlara izotop denir. Şekil II.1. Bir atomun parçaları
 8 II. MİNERALLER II.1. Element ve Atom Elementlerin en ufak parçasına atom denir. Atomlar, proton, nötron ve elektron gibi taneciklerden oluşur (Şekil II.1). Elektron negatif, proton pozitif elektrik yüküne
8 II. MİNERALLER II.1. Element ve Atom Elementlerin en ufak parçasına atom denir. Atomlar, proton, nötron ve elektron gibi taneciklerden oluşur (Şekil II.1). Elektron negatif, proton pozitif elektrik yüküne
Atomlar birleştiği zaman elektron dağılımındaki değişmelerin bir sonucu olarak kimyasal bağlar meydana gelir. Üç çeşit temel bağ vardır:
 Atomlar birleştiği zaman elektron dağılımındaki değişmelerin bir sonucu olarak kimyasal bağlar meydana gelir. Üç çeşit temel bağ vardır: İyonik bağlar, elektronlar bir atomdan diğerine aktarıldığı zaman
Atomlar birleştiği zaman elektron dağılımındaki değişmelerin bir sonucu olarak kimyasal bağlar meydana gelir. Üç çeşit temel bağ vardır: İyonik bağlar, elektronlar bir atomdan diğerine aktarıldığı zaman
INSA 283 MALZEME BİLİMİ. Giriş
 INSA 283 MALZEME BİLİMİ Giriş Malzeme Gereksinimi Bütün mühendislik bilim dallari malzeme ile yakindan iliskilidir. Mühendisler kullanacaklari malzemeyi çok iyi tanıyarak ve genis malzeme tayfi içinde
INSA 283 MALZEME BİLİMİ Giriş Malzeme Gereksinimi Bütün mühendislik bilim dallari malzeme ile yakindan iliskilidir. Mühendisler kullanacaklari malzemeyi çok iyi tanıyarak ve genis malzeme tayfi içinde
Paylaşılan elektron ya da elektronlar, her iki çekirdek etrafında dolanacaklar, iki çekirdek arasındaki bölgede daha uzun süre bulundukları için bu
 4.Kimyasal Bağlar Kimyasal Bağlar Aynı ya da farklı cins atomları bir arada tutan kuvvetlere kimyasal bağlar denir. Pek çok madde farklı element atomlarının birleşmesiyle meydana gelmiştir. İyonik bağ
4.Kimyasal Bağlar Kimyasal Bağlar Aynı ya da farklı cins atomları bir arada tutan kuvvetlere kimyasal bağlar denir. Pek çok madde farklı element atomlarının birleşmesiyle meydana gelmiştir. İyonik bağ
MADDE NEDİR? Çevremize baktığımızda gördüğümüz her şey örneğin, dağlar, denizler, ağaçlar, bitkiler, hayvanlar ve hava birer maddedir.
 MADDE NEDİR? Çevremize baktığımızda gördüğümüz her şey örneğin, dağlar, denizler, ağaçlar, bitkiler, hayvanlar ve hava birer maddedir. Her maddenin bir kütlesi vardır ve bu tartılarak bulunur. Ayrıca her
MADDE NEDİR? Çevremize baktığımızda gördüğümüz her şey örneğin, dağlar, denizler, ağaçlar, bitkiler, hayvanlar ve hava birer maddedir. Her maddenin bir kütlesi vardır ve bu tartılarak bulunur. Ayrıca her
MMT407 Plastik Şekillendirme Yöntemleri
 K O C A E L İ ÜNİVERSİTESİ Metalurji ve Malzeme Mühendisliği Bölümü MMT407 Plastik Şekillendirme Yöntemleri 3 Şekillendirmenin Metalurjik Esasları Yrd. Doç. Dr. Ersoy Erişir 2012-2013 Güz Yarıyılı 3. Şekillendirmenin
K O C A E L İ ÜNİVERSİTESİ Metalurji ve Malzeme Mühendisliği Bölümü MMT407 Plastik Şekillendirme Yöntemleri 3 Şekillendirmenin Metalurjik Esasları Yrd. Doç. Dr. Ersoy Erişir 2012-2013 Güz Yarıyılı 3. Şekillendirmenin
PERİYODİK SİSTEM VE ELEKTRON DİZİLİMLERİ#6
 PERİYODİK SİSTEM VE ELEKTRON DİZİLİMLERİ#6 Periyodik sistemde yatay sıralara Düşey sütunlara.. adı verilir. 1.periyotta element, 2 ve 3. periyotlarda..element, 4 ve 5.periyotlarda.element 6 ve 7. periyotlarda
PERİYODİK SİSTEM VE ELEKTRON DİZİLİMLERİ#6 Periyodik sistemde yatay sıralara Düşey sütunlara.. adı verilir. 1.periyotta element, 2 ve 3. periyotlarda..element, 4 ve 5.periyotlarda.element 6 ve 7. periyotlarda
FZM 220. Malzeme Bilimine Giriş
 FZM 220 Yapı Karakterizasyon Özellikler İşleme Performans Prof. Dr. İlker DİNÇER Fakültesi, Fizik Mühendisliği Bölümü 1 Ders Hakkında FZM 220 Dersinin Amacı Bu dersin amacı, fizik mühendisliği öğrencilerine,
FZM 220 Yapı Karakterizasyon Özellikler İşleme Performans Prof. Dr. İlker DİNÇER Fakültesi, Fizik Mühendisliği Bölümü 1 Ders Hakkında FZM 220 Dersinin Amacı Bu dersin amacı, fizik mühendisliği öğrencilerine,
Malzeme Bilgisi Prof. Dr. Akgün ALSARAN. Temel kavramlar Atomsal yapı
 Malzeme Bilgisi Prof. Dr. Akgün ALSARAN Temel kavramlar Atomsal yapı İçerik Temel kavramlar Atom modeli Elektron düzeni Periyodik sistem 2 Temel kavramlar Bütün maddeler kimyasal elementlerden oluşur.
Malzeme Bilgisi Prof. Dr. Akgün ALSARAN Temel kavramlar Atomsal yapı İçerik Temel kavramlar Atom modeli Elektron düzeni Periyodik sistem 2 Temel kavramlar Bütün maddeler kimyasal elementlerden oluşur.
Katılar & Kristal Yapı
 Katılar & Kristal Yapı Katılar Kristal katılar Amorf katılar Belli bir geometrik şekle sahip olan katılardır, tanecikleri belli bir düzene göre istiflenir. Belli bir geometrik şekli olmayan katılardır,
Katılar & Kristal Yapı Katılar Kristal katılar Amorf katılar Belli bir geometrik şekle sahip olan katılardır, tanecikleri belli bir düzene göre istiflenir. Belli bir geometrik şekli olmayan katılardır,
KATILARDA KRİSTAL YAPI. Hekzagonal a b c 90 o, 120. Tetragonal a b c 90 o. Rombohedral (Trigonal) Ortorombik a b c 90 o. Monoklinik a b c 90 o
 KATILARDA KRİSTAL YAPI Kristal yapı atomun bir üst seviyesinde incelenen ve atomların katı halde oluşturduğu düzeni ifade eden birim hücre (kafes) geometrik parametreleri ve atom dizilimi ile tarif edilen
KATILARDA KRİSTAL YAPI Kristal yapı atomun bir üst seviyesinde incelenen ve atomların katı halde oluşturduğu düzeni ifade eden birim hücre (kafes) geometrik parametreleri ve atom dizilimi ile tarif edilen
ATOM ve YAPISI Maddelerin gözle görülmeyen (bölünmeyen) en parçasına atom denir. Atom kendinden başka hiçbir fiziksel ya da kimyasal metotlarla
 ATOM ve YAPISI Maddelerin gözle görülmeyen (bölünmeyen) en parçasına atom denir. Atom kendinden başka hiçbir fiziksel ya da kimyasal metotlarla kendinden farklı atomlara dönüşemezler. Atomda (+) yüklü
ATOM ve YAPISI Maddelerin gözle görülmeyen (bölünmeyen) en parçasına atom denir. Atom kendinden başka hiçbir fiziksel ya da kimyasal metotlarla kendinden farklı atomlara dönüşemezler. Atomda (+) yüklü
1. Amaç Kristallerin üç boyutlu yapısı incelenecektir. Ön bilgi için İnorganik Kimya, Miessler ve Tarr, Bölüm 7 okunmalıdır.
 14 DENEY KATI HAL 1. Amaç Kristallerin üç boyutlu yapısı incelenecektir. Ön bilgi için İnorganik Kimya, Miessler ve Tarr, Bölüm 7 okunmalıdır. 2. Giriş Atomlar arası (veya moleküller arası) çekim kuvvetleri
14 DENEY KATI HAL 1. Amaç Kristallerin üç boyutlu yapısı incelenecektir. Ön bilgi için İnorganik Kimya, Miessler ve Tarr, Bölüm 7 okunmalıdır. 2. Giriş Atomlar arası (veya moleküller arası) çekim kuvvetleri
Element atomlarının atom ve kütle numaraları element sembolleri üzerinde gösterilebilir. Element atom numarası sembolün sol alt köşesine yazılır.
 Atom üç temel tanecikten oluşur. Bunlar proton, nötron ve elektrondur. Proton atomun çekirdeğinde bulunan pozitif yüklü taneciktir. Nötron atomun çekirdeğin bulunan yüksüz taneciktir. ise çekirdek etrafında
Atom üç temel tanecikten oluşur. Bunlar proton, nötron ve elektrondur. Proton atomun çekirdeğinde bulunan pozitif yüklü taneciktir. Nötron atomun çekirdeğin bulunan yüksüz taneciktir. ise çekirdek etrafında
1. Düzensiz yapı : Atom veya moleküllerin rastgele dizilmesi. Argon gibi asal gazlarda görülür.
 Malzemeler atomların bir araya gelmesi ile oluşur. Bu yapı içerisinde atomları bir arada tutan kuvvete atomlar arası bağ denir. Yapı içerisinde bir arada bulunan atomlar farklı düzenlerde bulunabilir.
Malzemeler atomların bir araya gelmesi ile oluşur. Bu yapı içerisinde atomları bir arada tutan kuvvete atomlar arası bağ denir. Yapı içerisinde bir arada bulunan atomlar farklı düzenlerde bulunabilir.
KİMYASAL BAĞLAR İYONİK BAĞ KOVALANT BAĞ POLAR KOVALENT BAĞ APOLAR KOVALENT BAĞ
 KİMYASAL BAĞLAR İYONİK BAĞ KOVALANT BAĞ POLAR KOVALENT BAĞ APOLAR KOVALENT BAĞ Atomlar bağ yaparken, elektron dizilişlerini soy gazlara benzetmeye çalışırlar. Bir atomun yapabileceği bağ sayısı, sahip
KİMYASAL BAĞLAR İYONİK BAĞ KOVALANT BAĞ POLAR KOVALENT BAĞ APOLAR KOVALENT BAĞ Atomlar bağ yaparken, elektron dizilişlerini soy gazlara benzetmeye çalışırlar. Bir atomun yapabileceği bağ sayısı, sahip
Serüveni 3. ÜNİTE KİMYASAL TÜRLER ARASI ETKİLEŞİM GÜÇLÜ ETKİLEŞİM. o İYONİK BAĞ o KOVALENT BAĞ o METALİK BAĞ
 Serüveni 3. ÜNİTE KİMYASAL TÜRLER ARASI ETKİLEŞİM GÜÇLÜ ETKİLEŞİM o İYONİK BAĞ o KOVALENT BAĞ o METALİK BAĞ KİMYASAL TÜR 1. İYONİK BAĞ - - Ametal.- Kök Kök Kök (+) ve (-) yüklü iyonların çekim kuvvetidir..halde
Serüveni 3. ÜNİTE KİMYASAL TÜRLER ARASI ETKİLEŞİM GÜÇLÜ ETKİLEŞİM o İYONİK BAĞ o KOVALENT BAĞ o METALİK BAĞ KİMYASAL TÜR 1. İYONİK BAĞ - - Ametal.- Kök Kök Kök (+) ve (-) yüklü iyonların çekim kuvvetidir..halde
Periyodik Tablo(sistem)
 Periyodik Tablo(sistem) Geçmişten Günümüze Periyodik Tablo Bilim adamları elementlerin sayısı arttıkça bunları benzer özelliklerine göre sıralamaya çalışmışlardır.(bunu süpermarketlerdeki ürünlerin dizilişlerine
Periyodik Tablo(sistem) Geçmişten Günümüze Periyodik Tablo Bilim adamları elementlerin sayısı arttıkça bunları benzer özelliklerine göre sıralamaya çalışmışlardır.(bunu süpermarketlerdeki ürünlerin dizilişlerine
Gelin bugün bu yazıda ilkokul sıralarından beri bize öğretilen bilgilerden yeni bir şey keşfedelim, ya da ne demek istediğini daha iyi anlayalım.
 Kristal Yapılar Gelin bugün bu yazıda ilkokul sıralarından beri bize öğretilen bilgilerden yeni bir şey keşfedelim, ya da ne demek istediğini daha iyi anlayalım. Evrende, kimyasal özellik barındıran maddelerin
Kristal Yapılar Gelin bugün bu yazıda ilkokul sıralarından beri bize öğretilen bilgilerden yeni bir şey keşfedelim, ya da ne demek istediğini daha iyi anlayalım. Evrende, kimyasal özellik barındıran maddelerin
Bölüm 2: Atomik Yapı & Atomarası Bağlar
 Bölüm 2: Atomik Yapı & Atomarası Bağlar Bağlanmayı ne sağlar? Ne tip bağlar vardır? Bağların sebep olduğu özellikler nelerdir? Chapter 2-1 Atomun yapısı (Birinci sınıf kimyası) atom electronlar 9.11 x
Bölüm 2: Atomik Yapı & Atomarası Bağlar Bağlanmayı ne sağlar? Ne tip bağlar vardır? Bağların sebep olduğu özellikler nelerdir? Chapter 2-1 Atomun yapısı (Birinci sınıf kimyası) atom electronlar 9.11 x
PERİYODİK CETVEL
 BÖLÜM4 W Periyodik cetvel, elementlerin atom numaraları esas alınarak düzenlenmiştir. Bu düzenlemede, kimyasal özellikleri benzer olan (değerlik elektron sayıları aynı) elementler aynı düşey sütunda yer
BÖLÜM4 W Periyodik cetvel, elementlerin atom numaraları esas alınarak düzenlenmiştir. Bu düzenlemede, kimyasal özellikleri benzer olan (değerlik elektron sayıları aynı) elementler aynı düşey sütunda yer
MALZEME BİLGB ATOM YAPISI. Yrd. Doç. Dr. Hayri ÜN. Pamukkale Üniversitesi 2007 - BAHAR
 2 MALZEME BİLGB LGİSİ ATOM YAPISI Yrd. Doç. Dr. Hayri ÜN Pamukkale Üniversitesi 2007 - BAHAR GİRİŞİŞ Herhangi bir yapının projelendirmesi ve inşaatı aşamasında, inşaat mühendisinin görevi ve amacı, aşağıda
2 MALZEME BİLGB LGİSİ ATOM YAPISI Yrd. Doç. Dr. Hayri ÜN Pamukkale Üniversitesi 2007 - BAHAR GİRİŞİŞ Herhangi bir yapının projelendirmesi ve inşaatı aşamasında, inşaat mühendisinin görevi ve amacı, aşağıda
BİLEŞİKLER VE FORMÜLLERİ
 BİLEŞİKLER VE FORMÜLLERİ Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur). Bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere
BİLEŞİKLER VE FORMÜLLERİ Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur). Bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere
KİMYASAL BAĞLAR Kimyasal bağlar, Moleküllerde atomları birarada tutan
 KİMYASAL BAĞLAR Kimyasal bağlar, Moleküllerde atomları birarada tutan kuvvettir. Atomlar birleştiği zaman elektron dağılımındaki değişmelerin bir sonucu olarak kimyasal bağlar meydana gelir. Atomun sembolünün
KİMYASAL BAĞLAR Kimyasal bağlar, Moleküllerde atomları birarada tutan kuvvettir. Atomlar birleştiği zaman elektron dağılımındaki değişmelerin bir sonucu olarak kimyasal bağlar meydana gelir. Atomun sembolünün
Örnek : 3- Bileşiklerin Özellikleri :
 Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani
Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani
Soygazların bileşik oluşturamamasının sebebi bütün orbitallerinin dolu olmasındandır.
 KİMYASAL BAĞLAR Kimyasal bağ, moleküllerde atomları birarada tutan kuvvettir. Bir bağın oluşabilmesi için atomlar tek başına bulundukları zamankinden daha kararlı (az enerjiye sahip) olmalıdırlar. Genelleme
KİMYASAL BAĞLAR Kimyasal bağ, moleküllerde atomları birarada tutan kuvvettir. Bir bağın oluşabilmesi için atomlar tek başına bulundukları zamankinden daha kararlı (az enerjiye sahip) olmalıdırlar. Genelleme
Malzeme Bilgisi Prof. Dr. Akgün ALSARAN. Atom ve moleküller arası Atomsal bağlar
 Malzeme Bilgisi Prof. Dr. Akgün ALSARAN Atom ve moleküller arası Atomsal bağlar İçerik Atomlararası denge mesafesi Elastisite modülü Atomlar niçin bağ yapmak ister? İyonik bağ Kovalent bağ Metalik bağ
Malzeme Bilgisi Prof. Dr. Akgün ALSARAN Atom ve moleküller arası Atomsal bağlar İçerik Atomlararası denge mesafesi Elastisite modülü Atomlar niçin bağ yapmak ister? İyonik bağ Kovalent bağ Metalik bağ
Serüveni PERİYODİK ÖZELLİKLER DEĞİŞİMİ
 Serüveni PERİYODİK ÖZELLİKLER DEĞİŞİMİ PERİYODİK ÖZELLİKLERİN DEĞİŞİMİ ATOM YARIÇAPI Çekirdeğin merkezi ile en dış kabukta bulunan elektronlar arasındaki uzaklık olarak tanımlanır. Periyodik tabloda aynı
Serüveni PERİYODİK ÖZELLİKLER DEĞİŞİMİ PERİYODİK ÖZELLİKLERİN DEĞİŞİMİ ATOM YARIÇAPI Çekirdeğin merkezi ile en dış kabukta bulunan elektronlar arasındaki uzaklık olarak tanımlanır. Periyodik tabloda aynı
 2007-2008 GÜZ YARIYILI MALZEME I Malzeme Bilimi ve Mühendisliğine Giriş Malzemelerin İç Yapısı 01.10.2007 1 ÖĞRETİM ÜYELERİ ve KAYNAKLAR Yrd.Doç.Dr. Şeyda POLAT Yrd.Doç.Dr. Ömer YILDIZ Ders Kitabı : Malzeme
2007-2008 GÜZ YARIYILI MALZEME I Malzeme Bilimi ve Mühendisliğine Giriş Malzemelerin İç Yapısı 01.10.2007 1 ÖĞRETİM ÜYELERİ ve KAYNAKLAR Yrd.Doç.Dr. Şeyda POLAT Yrd.Doç.Dr. Ömer YILDIZ Ders Kitabı : Malzeme
Prof. Dr. İRFAN AY / Öğr. Gör. FAHRETTİN KAPUSUZ 1
 MAKİNE PROGRAMI MALZEME TEKNOLOJİSİ-I- (DERS NOTLARI) Prof.Dr.İrfan AY Öğr. Gör. Fahrettin Kapusuz 2008-20092009 BALIKESİR Prof. Dr. İRFAN AY / Öğr. Gör. FAHRETTİN KAPUSUZ 1 ATOMİK YAPI VE BAĞ KUVVETLERİ
MAKİNE PROGRAMI MALZEME TEKNOLOJİSİ-I- (DERS NOTLARI) Prof.Dr.İrfan AY Öğr. Gör. Fahrettin Kapusuz 2008-20092009 BALIKESİR Prof. Dr. İRFAN AY / Öğr. Gör. FAHRETTİN KAPUSUZ 1 ATOMİK YAPI VE BAĞ KUVVETLERİ
izotop MALZEME BILGISI B2
 1. Giriş 2. Temel Kavramlar 3. Atomlarda Elektronlar 4. Periyodik Tablo 5. Bağ Kuvvetleri ve Enerjileri 6. Atomlararası Birincil Bağlar 7. İkincil bağlar veya Van Der Waals Bağları 8. Moleküller Bu özelliklerinden
1. Giriş 2. Temel Kavramlar 3. Atomlarda Elektronlar 4. Periyodik Tablo 5. Bağ Kuvvetleri ve Enerjileri 6. Atomlararası Birincil Bağlar 7. İkincil bağlar veya Van Der Waals Bağları 8. Moleküller Bu özelliklerinden
ATOM BİLGİSİ I ÖRNEK 1
 ATOM BİLGİSİ I Elementlerin özelliklerini ta ıyan en küçük yapıta ı atomdur. Son çözümlemede, bütün maddelerin atomlar toplulu u oldu unu söyleyebiliriz. Elementler, aynı tür atomlardan, bile ik ve karı
ATOM BİLGİSİ I Elementlerin özelliklerini ta ıyan en küçük yapıta ı atomdur. Son çözümlemede, bütün maddelerin atomlar toplulu u oldu unu söyleyebiliriz. Elementler, aynı tür atomlardan, bile ik ve karı
CANLILARIN KİMYASAL İÇERİĞİ
 CANLILARIN KİMYASAL İÇERİĞİ Prof. Dr. Bektaş TEPE Canlıların Savunma Amaçlı Kimyasal Üretimi 2 Bu ünite ile; Canlılık öğretisinde kullanılan kimyasal kavramlar Hiyerarşi düzeyi Hiyerarşiden sorumlu atom
CANLILARIN KİMYASAL İÇERİĞİ Prof. Dr. Bektaş TEPE Canlıların Savunma Amaçlı Kimyasal Üretimi 2 Bu ünite ile; Canlılık öğretisinde kullanılan kimyasal kavramlar Hiyerarşi düzeyi Hiyerarşiden sorumlu atom
TEKNOLOJİSİ--ITEKNOLOJİSİ. Prof. Dr. İRFAN AY / Öğr. Gör. FAHRETTİN KAPUSUZ
 MAKİNE PROGRAMI MALZEME TEKNOLOJİSİ--ITEKNOLOJİSİ (DERS NOTLARI) Prof.Dr.İrfan AY Öğr. Gör. Fahrettin Kapusuz 2008-2009 2008BALIKESİR 1 ATOMİK YAPI VE BAĞ KUVVETLERİ 2 MALZEMLERİN ATOMİK YAPISI Her element
MAKİNE PROGRAMI MALZEME TEKNOLOJİSİ--ITEKNOLOJİSİ (DERS NOTLARI) Prof.Dr.İrfan AY Öğr. Gör. Fahrettin Kapusuz 2008-2009 2008BALIKESİR 1 ATOMİK YAPI VE BAĞ KUVVETLERİ 2 MALZEMLERİN ATOMİK YAPISI Her element
MALZEME BİLGİSİ DERS 5 DR. FATİH AY. www.fatihay.net fatihay@fatihay.net
 MALZEME BİLGİSİ DERS 5 DR. FATİH AY www.fatihay.net fatihay@fatihay.net GEÇEN HAFTA BAĞ KUVVETLERİ VE ENERJİLERİ ATOMLARARASI BİRİNCİL BAĞLAR İKİNCİL VEYA VAN DER WAALS BAĞLARI MOLEKÜLLER BÖLÜM III KATILARDA
MALZEME BİLGİSİ DERS 5 DR. FATİH AY www.fatihay.net fatihay@fatihay.net GEÇEN HAFTA BAĞ KUVVETLERİ VE ENERJİLERİ ATOMLARARASI BİRİNCİL BAĞLAR İKİNCİL VEYA VAN DER WAALS BAĞLARI MOLEKÜLLER BÖLÜM III KATILARDA
PERİYODİK CETVEL Mendeleev Henry Moseley Glenn Seaborg
 PERİYODİK CETVEL Periyodik cetvel elementleri sınıflandırmak için hazırlanmıştır. İlkperiyodik cetvel Mendeleev tarafından yapılmıştır. Mendeleev elementleri artan kütle numaralarına göre sıralamış ve
PERİYODİK CETVEL Periyodik cetvel elementleri sınıflandırmak için hazırlanmıştır. İlkperiyodik cetvel Mendeleev tarafından yapılmıştır. Mendeleev elementleri artan kütle numaralarına göre sıralamış ve
ATOM NEDİR? -Atom elementin özelliğini taşıyan en küçük parçasına denir. Her canlı-cansız madde atomdan oluşmuştur.
 DERS: KİMYA KONU : ATOM YAPISI ATOM NEDİR? -Atom elementin özelliğini taşıyan en küçük parçasına denir. Her canlı-cansız madde atomdan oluşmuştur. Atom Modelleri Dalton Bütün maddeler atomlardan yapılmıştır.
DERS: KİMYA KONU : ATOM YAPISI ATOM NEDİR? -Atom elementin özelliğini taşıyan en küçük parçasına denir. Her canlı-cansız madde atomdan oluşmuştur. Atom Modelleri Dalton Bütün maddeler atomlardan yapılmıştır.
Bir atomdan diğer bir atoma elektron aktarılmasıyla
 kimyasal bağlar Kimyasal bağ, moleküllerde atomları bir arada tutan kuvvettir. Atomlar daha düşük enerjili duruma erişmek için bir araya gelirler. Bir bağın oluşabilmesi için atomlar tek başına bulundukları
kimyasal bağlar Kimyasal bağ, moleküllerde atomları bir arada tutan kuvvettir. Atomlar daha düşük enerjili duruma erişmek için bir araya gelirler. Bir bağın oluşabilmesi için atomlar tek başına bulundukları
Malzemeler yapılarının içerisinde, belli oranlarda farklı atomları çözebilirler. Bu durum katı çözeltiler olarak adlandırılır.
 KATI ÇÖZELTİ Malzemeler yapılarının içerisinde, belli oranlarda farklı atomları çözebilirler. Bu durum katı çözeltiler olarak adlandırılır. Katı çözeltilerin diğer bir ismi katı eriyiktir. Bir çözelti
KATI ÇÖZELTİ Malzemeler yapılarının içerisinde, belli oranlarda farklı atomları çözebilirler. Bu durum katı çözeltiler olarak adlandırılır. Katı çözeltilerin diğer bir ismi katı eriyiktir. Bir çözelti
KRİSTAL YAPISI VE KRİSTAL SİSTEMLERİ
 KRİSTAL YAPISI VE KRİSTAL SİSTEMLERİ Kristal Yapı: Atomların, üç boyutlu uzayda düzenli (kendini tekrar eden) bir şekilde dizilmesiyle oluşan yapıya kristal yapı denir. Bir kristal yapı birim hücresiyle
KRİSTAL YAPISI VE KRİSTAL SİSTEMLERİ Kristal Yapı: Atomların, üç boyutlu uzayda düzenli (kendini tekrar eden) bir şekilde dizilmesiyle oluşan yapıya kristal yapı denir. Bir kristal yapı birim hücresiyle
Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı
 Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani madde yani bileşik
Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani madde yani bileşik
Elementlerin büyük bir kısmı tabiatta saf hâlde bulunmaz. Çoğunlukla başka elementlerle bileşikler oluşturmuş şekilde bulunurlar.
 Elementlerin büyük bir kısmı tabiatta saf hâlde bulunmaz. Çoğunlukla başka elementlerle bileşikler oluşturmuş şekilde bulunurlar. Elementlerin bileşik oluşturma istekleri onların kararlı yapıya ulaşma
Elementlerin büyük bir kısmı tabiatta saf hâlde bulunmaz. Çoğunlukla başka elementlerle bileşikler oluşturmuş şekilde bulunurlar. Elementlerin bileşik oluşturma istekleri onların kararlı yapıya ulaşma
MALZEME BİLGİSİ. Kristal Yapılar ve Kristal Geometrisi
 MALZEME BİLGİSİ Dr.- Ing. Rahmi ÜNAL Konu: Kristal Yapılar ve Kristal Geometrisi 1 KRİSTAL YAPILAR Malzemelerin iç yapısı atomların diziliş biçimine bağlıdır. Kristal yapı Kristal yapılarda atomlar düzenli
MALZEME BİLGİSİ Dr.- Ing. Rahmi ÜNAL Konu: Kristal Yapılar ve Kristal Geometrisi 1 KRİSTAL YAPILAR Malzemelerin iç yapısı atomların diziliş biçimine bağlıdır. Kristal yapı Kristal yapılarda atomlar düzenli
FZM 220. Malzeme Bilimine Giriş
 FZM 220 Yapı Karakterizasyon Özellikler İşleme Performans Prof. Dr. İlker DİNÇER Fakültesi, Fizik Mühendisliği Bölümü 1 Ders Hakkında FZM 220 Dersinin Amacı Bu dersin amacı, fizik mühendisliği öğrencilerine,
FZM 220 Yapı Karakterizasyon Özellikler İşleme Performans Prof. Dr. İlker DİNÇER Fakültesi, Fizik Mühendisliği Bölümü 1 Ders Hakkında FZM 220 Dersinin Amacı Bu dersin amacı, fizik mühendisliği öğrencilerine,
Bölüm 4: Kusurlar. Kusurlar
 Bölüm 4: Kusurlar Malzemelerin bazı özellikleri kusurların varlığıyla önemli derecede etkilenir. Kusurların türleri ve malzeme davranışı üzerindeki etkileri hakkında bilgi sahibi olmak önemlidir. Saf metallerin
Bölüm 4: Kusurlar Malzemelerin bazı özellikleri kusurların varlığıyla önemli derecede etkilenir. Kusurların türleri ve malzeme davranışı üzerindeki etkileri hakkında bilgi sahibi olmak önemlidir. Saf metallerin
MMM291 MALZEME BİLİMİ
 MMM291 MALZEME BİLİMİ Yrd. Doç. Dr. Ayşe KALEMTAŞ Ofis Saatleri: Perşembe 14:00 16:00 ayse.kalemtas@btu.edu.tr, akalemtas@gmail.com Bursa Teknik Üniversitesi, Doğa Bilimleri, Mimarlık ve Mühendislik Fakültesi,
MMM291 MALZEME BİLİMİ Yrd. Doç. Dr. Ayşe KALEMTAŞ Ofis Saatleri: Perşembe 14:00 16:00 ayse.kalemtas@btu.edu.tr, akalemtas@gmail.com Bursa Teknik Üniversitesi, Doğa Bilimleri, Mimarlık ve Mühendislik Fakültesi,
ATOM BİLGİSİ Atom Modelleri
 1. Atom Modelleri BÖLÜM2 Maddenin atom adı verilen bir takım taneciklerden oluştuğu fikri çok eskiye dayanmaktadır. Ancak, bilimsel bir (deneye dayalı) atom modeli ilk defa Dalton tarafından ileri sürülmüştür.
1. Atom Modelleri BÖLÜM2 Maddenin atom adı verilen bir takım taneciklerden oluştuğu fikri çok eskiye dayanmaktadır. Ancak, bilimsel bir (deneye dayalı) atom modeli ilk defa Dalton tarafından ileri sürülmüştür.
BÖLÜM 2. Kristal Yapılar ve Kusurlar
 BÖLÜM 2 Kristal Yapılar ve Kusurlar 1- ATOMİK VE İYONİK DÜZENLER Kısa Mesafeli Düzenler-Uzun Mesafeli Düzenler Kısa Mesafeli Düzenler (SRO): Kısa mesafede atomların tahmin edilebilir düzenlilikleridir.
BÖLÜM 2 Kristal Yapılar ve Kusurlar 1- ATOMİK VE İYONİK DÜZENLER Kısa Mesafeli Düzenler-Uzun Mesafeli Düzenler Kısa Mesafeli Düzenler (SRO): Kısa mesafede atomların tahmin edilebilir düzenlilikleridir.
2.ÜNİTE:ATOM VE PERİYODİK SİSTEM ATOM ALTI TANECİKLER
 2.ÜNİTE:ATOM VE PERİYODİK SİSTEM ATOM ALTI TANECİKLER ATOM ALTI TANECİKLER: Atom numarası=proton sayısı=çekirdek yükü Kütle numarası (Nükleon sayısı)=proton sayısı+ nötron sayısı Kütle No iyon yükü Atom
2.ÜNİTE:ATOM VE PERİYODİK SİSTEM ATOM ALTI TANECİKLER ATOM ALTI TANECİKLER: Atom numarası=proton sayısı=çekirdek yükü Kütle numarası (Nükleon sayısı)=proton sayısı+ nötron sayısı Kütle No iyon yükü Atom
BÖLÜM 1 1. MALZEMELERİN ATOM YAPISI
 BÖLÜM 1 1. MALZEMELERİN ATOM YAPISI 1 1.2. Atom Yapısı ve Elektron Düzeni Bütün maddeler kimyasal elementlerden oluşur. Elementler ise atomlardan meydana gelir. Bir elementin kimyasal özelliklerini taşıyan
BÖLÜM 1 1. MALZEMELERİN ATOM YAPISI 1 1.2. Atom Yapısı ve Elektron Düzeni Bütün maddeler kimyasal elementlerden oluşur. Elementler ise atomlardan meydana gelir. Bir elementin kimyasal özelliklerini taşıyan
İmal Usulleri 1. Fatih ALİBEYOĞLU -1-
 1 Fatih ALİBEYOĞLU -1- İMALATA GİRİŞ ve GENEL BAKIŞ Öğretim Görevlisi Fatih Alibeyoğlu Dersin İçeriği nin İlkeleri ve Sınıflandırılması Döküm Plastik Şekil Verme Esasları Plastik Şekil Verme Yöntemleri
1 Fatih ALİBEYOĞLU -1- İMALATA GİRİŞ ve GENEL BAKIŞ Öğretim Görevlisi Fatih Alibeyoğlu Dersin İçeriği nin İlkeleri ve Sınıflandırılması Döküm Plastik Şekil Verme Esasları Plastik Şekil Verme Yöntemleri
IVA GRUBU ELEMENTLERİ
 Bölüm 6 IVA GRUBU ELEMENTLERİ Bu slaytlarda anlatılanlar sadece özet olup ayrıntılı bilgiler derste verilecektir. C, Si, Ge, Sn, Pb C: Ametal Si ve Ge: Yarı metal Sn ve Pb: Metal C: +4 ile -4 arası Si
Bölüm 6 IVA GRUBU ELEMENTLERİ Bu slaytlarda anlatılanlar sadece özet olup ayrıntılı bilgiler derste verilecektir. C, Si, Ge, Sn, Pb C: Ametal Si ve Ge: Yarı metal Sn ve Pb: Metal C: +4 ile -4 arası Si
Aşağıda verilen özet bilginin ayrıntısını, ders kitabı. olarak önerilen, Erdik ve Sarıkaya nın Temel. Üniversitesi Kimyası" Kitabı ndan okuyunuz.
 KİMYASAL BAĞLAR Aşağıda verilen özet bilginin ayrıntısını, ders kitabı olarak önerilen, Erdik ve Sarıkaya nın Temel Üniversitesi Kimyası" Kitabı ndan okuyunuz. KİMYASAL BAĞLAR İki atom veya atom grubu
KİMYASAL BAĞLAR Aşağıda verilen özet bilginin ayrıntısını, ders kitabı olarak önerilen, Erdik ve Sarıkaya nın Temel Üniversitesi Kimyası" Kitabı ndan okuyunuz. KİMYASAL BAĞLAR İki atom veya atom grubu
2. HAMLE web:
 2. HAMLE Nötron sayısı İZOTOP ATOM 1-Proton sayıları... nötron ve kütle numaraları.. atomlardır. 2-İzotop atomların fiziksel özellikleri. 3-Nötr izotop atomlar kimyasal özellikleri. 4-İzotop atomlar aynı
2. HAMLE Nötron sayısı İZOTOP ATOM 1-Proton sayıları... nötron ve kütle numaraları.. atomlardır. 2-İzotop atomların fiziksel özellikleri. 3-Nötr izotop atomlar kimyasal özellikleri. 4-İzotop atomlar aynı
Malzemelerin Deformasyonu
 Malzemelerin Deformasyonu Malzemelerin deformasyonu Kristal, etkiyen kuvvete deformasyon ile cevap verir. Bir malzemeye yük uygulandığında malzeme üzerinde çeşitli yönlerde ve çeşitli şekillerde yükler
Malzemelerin Deformasyonu Malzemelerin deformasyonu Kristal, etkiyen kuvvete deformasyon ile cevap verir. Bir malzemeye yük uygulandığında malzeme üzerinde çeşitli yönlerde ve çeşitli şekillerde yükler
KĠMYASAL ÖZELLĠKLER VE KĠMYASAL BAĞ
 Elektronların Dizilimi ve Kimyasal Özellikler Atomların katmanlarında belirli sayılarda elektron bulunmaktadır. Ancak bir atom, tek katmanlıysa ve bu katmanda iki elektronu varsa kararlıdır. Atomun iki
Elektronların Dizilimi ve Kimyasal Özellikler Atomların katmanlarında belirli sayılarda elektron bulunmaktadır. Ancak bir atom, tek katmanlıysa ve bu katmanda iki elektronu varsa kararlıdır. Atomun iki
Yrd.Doç.Dr. Emre YALAMAÇ. Yrd.Doç.Dr. Emre YALAMAÇ İÇERİK
 İÇERİK Elementlere, Bileşiklere ve Karışımlara atomik boyutta bakış Dalton Atom Modeli Atom Fiziğinde Buluşlar - Elektronların Keşfi - Atom Çekirdeği Keşfi Günümüz Atom Modeli Kimyasal Elementler Periyodik
İÇERİK Elementlere, Bileşiklere ve Karışımlara atomik boyutta bakış Dalton Atom Modeli Atom Fiziğinde Buluşlar - Elektronların Keşfi - Atom Çekirdeği Keşfi Günümüz Atom Modeli Kimyasal Elementler Periyodik
Atomdan e koparmak için az ya da çok enerji uygulamak gereklidir. Bu enerji ısıtma, sürtme, gerilim uygulama ve benzeri şekilde verilebilir.
 TEMEL ELEKTRONİK Elektronik: Maddelerde bulunan atomların son yörüngelerinde dolaşan eksi yüklü elektronların hareketleriyle çeşitli işlemleri yapma bilimine elektronik adı verilir. KISA ATOM BİLGİSİ Maddenin
TEMEL ELEKTRONİK Elektronik: Maddelerde bulunan atomların son yörüngelerinde dolaşan eksi yüklü elektronların hareketleriyle çeşitli işlemleri yapma bilimine elektronik adı verilir. KISA ATOM BİLGİSİ Maddenin
Elektronların Dağılımı ve Kimyasal Özellikleri
 Elektronların Dağılımı ve Kimyasal Özellikleri Helyum (2), neon (10), argon (18)in elektron dağılımları incelendiğinde Eğer bu üç elementin birer elektronu daha olsaydı, her birinde yeni bir katman oluşacaktı.
Elektronların Dağılımı ve Kimyasal Özellikleri Helyum (2), neon (10), argon (18)in elektron dağılımları incelendiğinde Eğer bu üç elementin birer elektronu daha olsaydı, her birinde yeni bir katman oluşacaktı.
TOKLUK VE KIRILMA. Doç.Dr.Salim ŞAHĠN
 TOKLUK VE KIRILMA Doç.Dr.Salim ŞAHĠN TOKLUK Tokluk bir malzemenin kırılmadan önce sönümlediği enerjinin bir ölçüsüdür. Bir malzemenin kırılmadan bir darbeye dayanması yeteneği söz konusu olduğunda önem
TOKLUK VE KIRILMA Doç.Dr.Salim ŞAHĠN TOKLUK Tokluk bir malzemenin kırılmadan önce sönümlediği enerjinin bir ölçüsüdür. Bir malzemenin kırılmadan bir darbeye dayanması yeteneği söz konusu olduğunda önem
ATOMUN YAPISI. Özhan ÇALIŞ. Bilgi İletişim ve Teknolojileri
 ATOMUN YAPISI ATOMLAR Atom, elementlerin en küçük kimyasal yapıtaşıdır. Atom çekirdeği: genel olarak nükleon olarak adlandırılan proton ve nötronlardan meydana gelmiştir. Elektronlar: çekirdeğin etrafında
ATOMUN YAPISI ATOMLAR Atom, elementlerin en küçük kimyasal yapıtaşıdır. Atom çekirdeği: genel olarak nükleon olarak adlandırılan proton ve nötronlardan meydana gelmiştir. Elektronlar: çekirdeğin etrafında
A. ATOMUN TEMEL TANECİKLERİ
 ÜNİTE 3 MADDENİN YAPISI VE ÖZELLİKLERİ 1. BÖLÜM MADDENİN TANECİKLİ YAPISI 1- ATOMUN YAPISI Maddenin taneciklerden oluştuğu fikri yani atom kavramı ilk defa demokritus tarafından ortaya atılmıştır. Örneğin;
ÜNİTE 3 MADDENİN YAPISI VE ÖZELLİKLERİ 1. BÖLÜM MADDENİN TANECİKLİ YAPISI 1- ATOMUN YAPISI Maddenin taneciklerden oluştuğu fikri yani atom kavramı ilk defa demokritus tarafından ortaya atılmıştır. Örneğin;
Chemistry, The Central Science, 10th edition Theodore L. Brown; H. Eugene LeMay, Jr.; and Bruce E. Bursten. Kimyasal Bağlar.
 Chemistry, The Central Science, 10th edition Theodore L. Brown; H. Eugene LeMay, Jr.; and Bruce E. Bursten Kimyasal Bağlar Kimyasal Bağlar 3 temel tip bağ vardır: İyonik İyonlar arası elektrostatik etkileşim
Chemistry, The Central Science, 10th edition Theodore L. Brown; H. Eugene LeMay, Jr.; and Bruce E. Bursten Kimyasal Bağlar Kimyasal Bağlar 3 temel tip bağ vardır: İyonik İyonlar arası elektrostatik etkileşim
Dielektrik malzeme DİELEKTRİK ÖZELLİKLER. Elektriksel Kutuplaşma. Dielektrik malzemeler. Kutuplaşma Türleri 15.4.2015. Elektronik kutuplaşma
 Dielektrik malzeme DİELEKTRİK ÖZELLİKLER Dielektrik malzemeler; serbest elektron yoktur, yalıtkan malzemelerdir, uygulanan elektriksel alandan etkilenebilirler. 1 2 Dielektrik malzemeler Elektriksel alan
Dielektrik malzeme DİELEKTRİK ÖZELLİKLER Dielektrik malzemeler; serbest elektron yoktur, yalıtkan malzemelerdir, uygulanan elektriksel alandan etkilenebilirler. 1 2 Dielektrik malzemeler Elektriksel alan
Serüveni 2.ÜNİTE:ATOM VE PERİYODİK SİSTEM ATOMUN BÖLÜNEBİLİRLİĞİ ATOM ALTI TANECİKLER
 Serüveni 2.ÜNİTE:ATOM VE PERİYODİK SİSTEM ATOMUN BÖLÜNEBİLİRLİĞİ ATOM ALTI TANECİKLER ATOMUN BÖLÜNEBİLİRLİĞİ: ATOM ALTI TANECİKLER SÜRTÜNME İLE ELEKTRİKLENME ELEKTROLİZ DENEYİ FARADAY SÜRTÜNME İLE ELEKTRİKLENME:
Serüveni 2.ÜNİTE:ATOM VE PERİYODİK SİSTEM ATOMUN BÖLÜNEBİLİRLİĞİ ATOM ALTI TANECİKLER ATOMUN BÖLÜNEBİLİRLİĞİ: ATOM ALTI TANECİKLER SÜRTÜNME İLE ELEKTRİKLENME ELEKTROLİZ DENEYİ FARADAY SÜRTÜNME İLE ELEKTRİKLENME:
Bir kristal malzemede uzun-aralıkta düzen mevcu4ur.
 Bir kristal malzemede uzun-aralıkta düzen mevcu4ur. Kristal ka8ların bazı özellikleri, malzemelerin kristal yapılarına, yani atomların, iyonların ya da moleküllerin üç boyutlu olarak meydana ge@rdikleri
Bir kristal malzemede uzun-aralıkta düzen mevcu4ur. Kristal ka8ların bazı özellikleri, malzemelerin kristal yapılarına, yani atomların, iyonların ya da moleküllerin üç boyutlu olarak meydana ge@rdikleri
Malzeme Bilimi I Metalurji ve Malzeme Mühendisliği
 I Metalurji ve Malzeme Mühendisliği Doç. Dr. Rıdvan YAMANOĞLU 2017-2018 Metaller katılaşırken kendilerine has, elektron düzenlerinin neden olduğu belli bir kafes sisteminde kristalleşirler. Aluminyum,
I Metalurji ve Malzeme Mühendisliği Doç. Dr. Rıdvan YAMANOĞLU 2017-2018 Metaller katılaşırken kendilerine has, elektron düzenlerinin neden olduğu belli bir kafes sisteminde kristalleşirler. Aluminyum,
Paslanmaz Çelik Gövde. Yalıtım Sargısı. Katalizör Yüzey Tabakası. Egzoz Emisyonları: Su Karbondioksit Azot
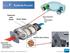 Paslanmaz Çelik Gövde Yalıtım Sargısı Egzoz Emisyonları: Su Karbondioksit Azot Katalizör Yüzey Tabakası Egzoz Gazları: Hidrokarbonlar Karbon Monoksit Azot Oksitleri Bu bölüme kadar, açıkça ifade edilmese
Paslanmaz Çelik Gövde Yalıtım Sargısı Egzoz Emisyonları: Su Karbondioksit Azot Katalizör Yüzey Tabakası Egzoz Gazları: Hidrokarbonlar Karbon Monoksit Azot Oksitleri Bu bölüme kadar, açıkça ifade edilmese
BÖLÜM 3. Katı malzemeler yapılarındaki atom ve iyonların birbirlerine göre düzenlerine bağlı olarak sınıflandırılırlar.
 KRİSTAL YAPISI ve KRİSTAL KUSURLARI Katı malzemeler yapılarındaki atom ve iyonların birbirlerine göre düzenlerine bağlı olarak sınıflandırılırlar. Kristal yapı içinde atomlar büyük atomik mesafeler boyunca
KRİSTAL YAPISI ve KRİSTAL KUSURLARI Katı malzemeler yapılarındaki atom ve iyonların birbirlerine göre düzenlerine bağlı olarak sınıflandırılırlar. Kristal yapı içinde atomlar büyük atomik mesafeler boyunca
