Kuvvetli Asit ve Kuvvetli Baz Titrasyonları
|
|
|
- Ahmet Önal
- 5 yıl önce
- İzleme sayısı:
Transkript
1 Kuvvetli Asit ve Kuvvetli Baz Titrasyonları Prof. Dr. Mustafa DEMİR M.DEMİR(ADU) KUVVETLİ ASİT VE BAZ TİTRASYONLARI 1
2 Sulu çözeltilerde [H 3 O ] kaynağı 1) Asitin su ile tepkimesi 2) Suyun iyonlaşması Kuvvetli asitin derişimi 1.0 x 10-6 M ve daha büyük ise asit derişimi(hcliçin), [ ] [ ] H O C OH C HCl HCl 3 Sodyum hidroksit gibi kuvvetli bazlar için de [ ] [ ] OH C H O C NaOH NaOH alınır. 3 M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 2
3 Bütün titrasyonlarda 1) Eşdeğerlik noktasından önceki 2) Eşdeğerlik noktasındaki 3) Eşdeğerlik noktasından sonraki ph derişimi incelenir. M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 3
4 C C C Eşdeğerlik Noktasından Önce HCl HCl HCl [ H O ] 3 NaOH eklendikten sonraki kalan HCl'in mmolsayısı Çözeltinin toplam hacmi HCl V HCl( ilk) V ilk ilk M M mmolsayısı- eklenen NaOH mmol sayısı Çözeltinin toplam hacmi V HCl HCl( ilk) V V ilk V NaOH V V NaOH ( eklenen) NaOH NaOH ( eklenen) M NaOH NaOH M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 4 M
5 Eşdeğerlik Noktasında Sadece suyun iyonlaşmasından gelen [H ] [ H O ] 3 K su ph log [ ] H ph M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 5
6 Eşdeğerlik Noktasından Sonra C NaOH V M V NaOH NaOH HCl( ilk ) V ilk V NaOH M HCl M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 6
7 Kuvvetli bir Asitin Kuvvetli bir Bazla Titrasyonu için Yük Denkliği Eşitliğinden Titrasyon Eğrisinin Türetilmesi M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 7
8 [ ] [ ] [ ] [ ] H O Na OH Cl 3 [ ] Na V NaOH V NaOH M V NaOH HCl [ ] Cl V V HCl NaOH M V HCl HCl M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 8
9 Eşdeğerlik noktasından önce NaOH eklendiğinde [OH - ] << [Cl - ] olduğundan [ H O ] [ Cl ] [ Na ] [ H O ] 3 3 [ ] H 3 O V V HCl NaOH V M HCl V HCl HCl M V HCl V NaOH V NaOH V NaOH NaOH V M HCl V NaOH M HCl NaOH M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 9
10 Eşdeğerlik noktasında [ ] [ ] Cl Na ve [ ] [ ] H O OH [ ] H O K 3 olduğundan 3 M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 10
11 Eşdeğerlik noktasından sonra [ ] [ ] H 3O << Na [ ] [ Na ] [ Cl ] - OH [ OH ] V V V NaOH NaOH NaOH M V M V NaOH NaOH olduğundan NaOH HCl V V HCl HCl V V HCl NaOH M M HCl V HCl HCl M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 11
12 Kuvvetli bir Bazın Kuvvetli bir Asitle Titrasyonu Örnek: 50 ml 0.05 M NaOH ın 0.1 M HCl ile titrasyonu eğrisi M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 12
13 Başlangıçta [ ] OH 0.05 poh 1.30 ph M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 13
14 Eşdeğerlik noktasından önce [ ] ) 10mlHCl OH poh ph [ ] ) 20ml HCl OH poh ph [ ] ) 24.50ml HCl OH poh 3.17 ph M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 14
15 eşdeğerlik noktasında 25.0ml [ ][ ] [ ] [ ] 14 H OH H OH ph HCl,tamamıtepkimeyegireceğinden sadecesudangelen poh 7 H veoh vardır M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 15
16 eşdeğerlik noktasından sonra 25.50ml HCl ortamdafazladanh [ ] H ph [ ] ) 30ml H H ph 2.20 bulunacakt ır. M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 16
17 HCl ph M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 17
18 ph V HCl M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 18
19 ph 15 12,5 10 7,5 5 2, V HCl M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 19
20 Kuvvetli bir Asitin Kuvvetli bir Bazla Titrasyonu Örnek: 50 ml 0.05 M HCl nin 0.1 M NaOH ile titrasyonu. M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 20
21 [ ] H 0.05 ph ) Başlangıç M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 21
22 eşdeğerlik noktasından önce 2)10ml NaOH 3) 20mlNaOH 4) 24.0ml NaOH, 5) 24.90mlNaOH 6) 24.95mlNaOH 7) 24.99ml NaOH [ H O ] 3 [ H O ] 3 [ H ] [ H ] [ H ] > ph > ph > ph > ph > ph [ ] 5 H > ph M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 22
23 Eşdeğerliknoktasında 8) 25.0ml NaOH [ ] H Sadecesudan gelenh veoh [ ][ ] [ ] [ ] 14 7 H OH H OH ph 7 vardır M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 23
24 M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 24 [ ] [ ] [ ] [ ] [ ] ph OH NaOH 50ml ph OH NaOH 30ml 12) ph OH NaOH ml ) ph OH NaOH ml ) ph OH NaOH fazlalığı vardır. Ortamda NaOH ml sonra noktasından Eşdeğerlik ) ) poh poh poh ph poh ph poh
25 NaOH ph M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 25
26 ph V NaOH PH POH M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 26
27 Örnek 5 : 50 ml 0.1 M HCl üzerine 0.1 M derişimindeki NaOH eklenerek titrasyon yapılmaktadır. NaOH in hacmine karşı ph değişimini inceleyiniz. M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 27
28 Eşdeğerlik noktasından önce [ ] 50 V H ( 0.10) 50 V ilişkisi bulunacaktır. M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 28
29 V 50-V 50V [H] ph x M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 29
30 Eşdeğerlik noktasında: Stokiyometrik miktarda (50 ml) NaOH eklendiğinde; ph7 olacaktır. M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 30
31 Eşdeğerlik noktasından sonra; Ortama daha fazla NaOH eklenmesiyle, ph değişimi [ ] V 50 OH ( 0.10) V 50 eşitliği kullanılarak bulunur. M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 31
32 V V-50 V50 [OH - ] poh ph x x x x x x x M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 32
33 ph V (NaOH) M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 33
34 ÖRNEK: 0.1 M derişimdeki 50 ml lik HCl çözeltisinin 0.1 M NaOH ile titrasyonunu inceleyiniz ve titrasyon eğrisini çiziniz. (Farklı yaklaşım) M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 34
35 Titrasyona başlamadan önce 50 ml HCl çözeltisinde (50/1000)x mol H vardır ve bu çözeltinin ph ı ph log [ ] -1 H - log(1.0x10 ) ph 1 dir. Çözeltiye 10 ml 0.1 M NaOH eklendiğinde (10/1000 )x mol OH - eklenmiştir ve bu da H - OH H 2 O gereğince mol H ile birleşmiştir. Buna göre tepkimeye girmeyen hidrojen iyonu moldür. Bu anda çözelti hacmi de 50 ml den 60 ml ye yükselmiştir. Buna göre çözeltinin bu andaki ph'ı [ ] ( ) H 1000 x M ph dir. Çözeltiye 20 ml NaOH eklendiğinde, (20/1000)x mol OH - eklenmiştir. Bu, mol H ile birleştiğinden geride mol H kalır. Bu sıradaki ph ise [ ] ( ) H 1000 x M ph 1.37 ' dir 70 M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 35
36 Bu şekilde hesaplama ile elde edilen değerler çizelgede verilmiştir. Çizelge incelenirse ph değişiminin 49.9 ml NaOH ekleninceye kadar yavaş olduğu görülür. Bu noktada bazın 0.1 ml fazlası eklendiğinde, ortamdaki hidroklorik asitten gelen bütün hidrojen iyonları tepkimeye gireceğinden, geride yalnız suyun iyonlaşmasıyla meydana gelen hidrojen iyonları kalır. Bazın 0.1 ml daha fazlası eklendiğinde ise, ortamda artık asitin değil bazın fazlası vardır ve ph birden 9.99 a yükselir. Çizelgedeki veriler grafiğe geçirilirse şekil elde edilir. M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 36
37 Çizelge 0.1 M NaOH ile 50 ml 0.1 M HCl titrasyonu Eklenen NaOH (ml) Eklenen NaOH (mol) Geride kalan H (mol) [H ] (M) PH x x x x x x x x x x x x x x x x x x 10-5 * 1.0 x 10-4 * 5.0 x 10-4 * 1.0 x 10-3 * x x x x x x x x 10-5 ** 9.99 x 10-4 ** 4.76 x 10-3 ** 0.09 x 10-2 ** (*) mol olarak OH - sayısı (**) [OH - ] derişimi M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 37
38 0.1 M NaOH ile 50 ml 0.1 M HCl'nin titrasyonu eğrisi M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 38
39 M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 39
40 M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 40
41 M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 41
42 DERİŞİM ETKİSİ M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 42
43 İNDİKATÖR SEÇİMİ M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 43
44 M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 44
45 M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 45
46 M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 46
47 M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 47
48 M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 48
49 TİTRASYON EĞRİLERİ İÇİN GENEL EŞİTLİK Bu tür örneklerde eşdeğerlik noktasından önceki asit veya baz derişimi çok yüksek olduğundan OH - veya H derişimlerini ihmal edebilmekteyiz. Bu demektir ki eşdeğerlik noktasına yakın bölgelerdeki sonuçlar, ki en önemli bölgedir, tam doğru değildir. Kuvvetli bir asidin (HCl) derişimi C 0 ve hacmi V 0 olsun. Kuvvetli bir bazın (NaOH) derişimi de C, hacmi ise V olsun. Kuvvetli asidi kuvvetli bazla titre edelim: M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 49
50 (1) Kütle Denkliği ; [ Cl ] 0 0 (4) V c V V 0 [ Na ] V cv V 0 (5) M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 50
51 (2) Yük Denkliği ; [ ] [ ] [ ] [ ] Na OH Cl H (6) 4 ve 5 eşitlikleri 6 eşitliğinde yerine konursa ve suyun iyonlaşması olan [H ] [OH - ]K su dikkate alınırsa cv V c [ ] 0 V0 Ksu H (7) V 0 [ H ] Buradaki C, c 0 ve V 0 bilindiğine göre bu eşitlik [H ] nin V e göre bir fonksiyonudur. M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 51
52 Eşdeğerlik noktası ; cv c 0 V 0 sağlandığındaki noktadır. Bu noktaya ulaşmak için gerekli olan hacim ise titre edilen kısımdır. φ cv c V 0 0 (8) Eşdeğerlik noktasında φ 1 dir. Bu değişkene göre, titrasyon eğrisinin denklemi c V0 V V 0 φ 0 ( 1) K su [ H ] [ ] H (9) şeklindedir. M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 52
53 TİTRASYON HATASI Eşdeğerlik noktası ile dönüm noktası arasındaki fark titrasyon hatasıdır. M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 53
54 TİTRASYON HATASININ HESABI Vep dönüm noktası hacmi V' eşdeğerlik noktası hacmi Titrasyon hatası Vep V V Pozitif hata, dönüm noktasının eşdeğerlik noktasından sonra gelmesi, negatif hata dönüm noktasının eşdeğerlik noktasından önce gelmesi halidir. M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 54
55 Örnek Metil kırmızısı kullanılarak 50 ml 0.1 M HCl, 0.1 M NaOH ile titre edilmektedir. Eğer dönüm noktası ph ı 5 ise titrasyon hatası ne olur? M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 55
56 Önceki uygulamalardan biliyoruz ki 50 ml HCl ancak 50 ml NaOH ile titre edildiğinde eşdeğerlik noktasına ulaşılabilir ve burada ph7 dir. İndikatör ph5 de renk değiştirdiğine göre eşdeğerlik noktasından önce renk değiştirmiş demektir. M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 56
57 Dönüm noktası hacmi 50 V 50 V [ ] H ( 0.1) eşitliğinden hesaplanabilir. V, 50 ye yaklaştığında 50V yaklaşık 100 olacaktır. V [ ] x10 H M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 57
58 Dönüm noktası değeri olan [H ]1.0x10-5 yerine konulursa, V x10 2 ( x10 ) V x10 Titrasyon hatası V ep x100 ml Titrasyon hatası % M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 58
59 TİTRASYON HATASI İÇİN GENEL EŞİTLİK Titrasyon hatası için bir eşitlik türetebilmek için; gerçek (doğru) titrasyon eğrisi denklemini kullanabiliriz. c V0 V V 0 ( 1) K su [ H ] [ ] H 0 φ (9) M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 59
60 Eşdeğerlik noktasında eklenen hacim ; V c c 0 V0 dır. Titrasyon hatası ve kesikli titrasyon tanımlarını kullanarak ; Titrasyon hatası V ep V V cv c 0 ep V 0 1 Titrasyon hatası φ ep 1 bulunur. M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 60
61 9 nolu eşitlik eğer dönüm noktası ph ı biliniyorsa doğrudan titrasyon hatasını verir. Eğer dönüm noktası hacminin eşdeğerlik noktası hacmine eşit olduğu kabul edilirse ; V V V 0 0 ep V0 V V0 c c c 0 yazılabilir. M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 61
62 Dolayısıyla 9 eşitliği ; Titrasyon hatası φ ep 1 c c c c 0 0 K [ H ] [ ] H su ep ep (10) şekline döner. M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 62
63 Yukarıdaki örneği buna göre çözecek olursak ; [ ] H 1.0x10 5 c0 c 0.1 buradan ; Titrasyon hatası % bulunur. M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 63
64 Örnek 1.0x10-4 M HCl ile 1.0x10-4 M NaOH titrasyonunda titrasyon hatası % 0.1 in altında tutulmak istenmektedir. Hangi ph aralığında dönüm noktası gözlenebilmelidir? M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 64
65 φ ep 1 1.0x10 3 c c x eşitliğinde yerine konursa ; K su [ ] H [ ] H 0.5x10 7 ep ep M.DEMİR(ADU- AYDIN) KUVVETLİ ASİT VE BAZ TİTRASYONLARI 65
66 Bu, ikinci dereceden eşitlik çözülecek olursa ; [ ] x10 H ep 89 ph ep 6. Benzer şekilde φep 1 1.0x10 3 için phep 7.11 bulunur. M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 66
67 M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 67
68 M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 68
69 M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 69
70 M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 70
71 M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 71
72 M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 72
73 M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 73
74 M.DEMİR(ADU- AYDIN) 20-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 74
5.111 Ders Özeti #23 23.1
 5.111 Ders Özeti #23 23.1 Asit/Baz Dengeleri (Devam) Konu: Titrasyon Cuma günü ders notlarından Asidik tampon etkisi: Zayıf asit, HA, protonlarını ortamdaki kuvvetli bazın OH iyonlarına aktarır. Zayıf
5.111 Ders Özeti #23 23.1 Asit/Baz Dengeleri (Devam) Konu: Titrasyon Cuma günü ders notlarından Asidik tampon etkisi: Zayıf asit, HA, protonlarını ortamdaki kuvvetli bazın OH iyonlarına aktarır. Zayıf
DENEY 6. CH 3 COO - + Na + + H 2 O ve
 DENEY 6 İLETKENLİK TİTRASYONU İLE KUVVETLİ VE ZAYIF ASİTLERİN ANALİZİ Deneyin Yapılışı: Deney için sırasıyla,5 N HCl;,1 N Asetik asit ve ikisinin de bilinmeyen miktarlarda bulunduğu karışımı,1 N NaOH ile
DENEY 6 İLETKENLİK TİTRASYONU İLE KUVVETLİ VE ZAYIF ASİTLERİN ANALİZİ Deneyin Yapılışı: Deney için sırasıyla,5 N HCl;,1 N Asetik asit ve ikisinin de bilinmeyen miktarlarda bulunduğu karışımı,1 N NaOH ile
KOMPLEKS ASİT BAZ SİSTEMLERİ ASİT KARIŞIMLARI
 KOMPLEKS SİT BZ SİSTEMLERİ SİT KRIŞIMLRI Prof. Dr. Mustafa DEMİR http://web.adu.edu.tr/akademik/mdemir/ 009-1-KOMPLEKS SİT-BZ 1 İçinde 0.10 M Cl ve 0.080 M bulunan 5 ml çözeltinin 0. M KO ile titrasyonu.
KOMPLEKS SİT BZ SİSTEMLERİ SİT KRIŞIMLRI Prof. Dr. Mustafa DEMİR http://web.adu.edu.tr/akademik/mdemir/ 009-1-KOMPLEKS SİT-BZ 1 İçinde 0.10 M Cl ve 0.080 M bulunan 5 ml çözeltinin 0. M KO ile titrasyonu.
Genel Kimya 101-Lab (4.Hafta) Asit Baz Teorisi Suyun İyonlaşması ve ph Asit Baz İndikatörleri Asit Baz Titrasyonu Deneysel Kısım
 Genel Kimya 101-Lab (4.Hafta) Asit Baz Teorisi Suyun İyonlaşması ve ph Asit Baz İndikatörleri Asit Baz Titrasyonu Deneysel Kısım Asit Baz Teorisi Arrhenius Teorisi: Sulu çözeltlerine OH - iyonu bırakan
Genel Kimya 101-Lab (4.Hafta) Asit Baz Teorisi Suyun İyonlaşması ve ph Asit Baz İndikatörleri Asit Baz Titrasyonu Deneysel Kısım Asit Baz Teorisi Arrhenius Teorisi: Sulu çözeltlerine OH - iyonu bırakan
TAMPON ÇÖZELTİLER-2. Prof.Dr.Mustafa DEMİR M.DEMİR(ADU) 12-TAMPON ÇÖZELTİLER-2 1
 TAMPON ÇÖZELTİLER-2 Prof.Dr.Mustafa DEMİR M.DEMİR(ADU) 12-TAMPON ÇÖZELTİLER-2 1 Tampon çözelti Tampon çözelti: Konjuge asit-baz çiftinin bulunduğu ve ph değişmelerine karşı direnç gösteren çözeltilere
TAMPON ÇÖZELTİLER-2 Prof.Dr.Mustafa DEMİR M.DEMİR(ADU) 12-TAMPON ÇÖZELTİLER-2 1 Tampon çözelti Tampon çözelti: Konjuge asit-baz çiftinin bulunduğu ve ph değişmelerine karşı direnç gösteren çözeltilere
TAMPON ÇÖZELTİLER. Prof.Dr.Mustafa DEMİR M.DEMİR 09-TAMPON ÇÖZELTİLER 1
 TAMPON ÇÖZELTİLER Prof.Dr.Mustafa DEMİR M.DEMİR 09-TAMPON ÇÖZELTİLER 1 Tampon çözeltiler Kimyada belli ph larda çözelti hazırlamak ve bunu uzun süre kullanmak çok önemlidir. Ancak bu çözeltilerin saklanması
TAMPON ÇÖZELTİLER Prof.Dr.Mustafa DEMİR M.DEMİR 09-TAMPON ÇÖZELTİLER 1 Tampon çözeltiler Kimyada belli ph larda çözelti hazırlamak ve bunu uzun süre kullanmak çok önemlidir. Ancak bu çözeltilerin saklanması
Suda çözündüğünde hidrojen iyonu verebilen maddeler asit, hidroksil iyonu verebilenler baz olarak tanımlanmıştır.
 7. ASİTLER VE BAZLAR Arrhenius AsitBaz Tanımı (1884) (Svante Arrhenius) Suda çözündüğünde hidrojen iyonu verebilen maddeler asit, hidroksil iyonu verebilenler baz olarak tanımlanmıştır. HCl H + + Cl NaOH
7. ASİTLER VE BAZLAR Arrhenius AsitBaz Tanımı (1884) (Svante Arrhenius) Suda çözündüğünde hidrojen iyonu verebilen maddeler asit, hidroksil iyonu verebilenler baz olarak tanımlanmıştır. HCl H + + Cl NaOH
TİTRASYON. 01/titrasyon.html
 7. HAFTA Titrasyon TİTRASYON Derişi i bilinen bir çözelti ASİT-BAZ) ile tepkimeye giren derişi i bilinmeyen çözeltinin ASİT-BAZ) iktarı ı ve konsantrasyonunun belirlenmesidir. Bir titrasyonda türlerden
7. HAFTA Titrasyon TİTRASYON Derişi i bilinen bir çözelti ASİT-BAZ) ile tepkimeye giren derişi i bilinmeyen çözeltinin ASİT-BAZ) iktarı ı ve konsantrasyonunun belirlenmesidir. Bir titrasyonda türlerden
İletkenlik, maddenin elektrik akımını iletebilmesinin ölçüsüdür.
 İletkenlik, maddenin elektrik akımını iletebilmesinin ölçüsüdür. C= 1/R dir. Yani direncin tersidir. Birimi S.m -1 dir. (Siemens birimi Alman bilim insanı ve mucit Werner von Siemens e ithafen verilmiştir)
İletkenlik, maddenin elektrik akımını iletebilmesinin ölçüsüdür. C= 1/R dir. Yani direncin tersidir. Birimi S.m -1 dir. (Siemens birimi Alman bilim insanı ve mucit Werner von Siemens e ithafen verilmiştir)
DENEY 8 POLİPROTİK ASİTLER: ph TİTRASYON EĞRİLERİ KULLANILARAK pka DEĞERLERİNİN BELİRLENMESİ
 DENEY 8 POLİPROTİK ASİTLER: ph TİTRASYON EĞRİLERİ KULLANILARAK pka DEĞERLERİNİN BELİRLENMESİ 8.1. AMAÇ Bir asidin titrasyonunu yapmak. Poliprotik bir asidin gücünü belirlemek. Bir asidin pka değerlerini
DENEY 8 POLİPROTİK ASİTLER: ph TİTRASYON EĞRİLERİ KULLANILARAK pka DEĞERLERİNİN BELİRLENMESİ 8.1. AMAÇ Bir asidin titrasyonunu yapmak. Poliprotik bir asidin gücünü belirlemek. Bir asidin pka değerlerini
5.111 Ders Özeti #21 21.1
 5.111 Ders Özeti #21 21.1 AsitBaz Dengesi Bölüm 10 Okunsun Konular: Asit ve Bazların Sınıflandırılması, Suyun Öziyonlaşması, ph Fonksiyonları, Asit ve Baz Kuvvetleri, Zayıf Asit İçeren Dengeler. Asit ve
5.111 Ders Özeti #21 21.1 AsitBaz Dengesi Bölüm 10 Okunsun Konular: Asit ve Bazların Sınıflandırılması, Suyun Öziyonlaşması, ph Fonksiyonları, Asit ve Baz Kuvvetleri, Zayıf Asit İçeren Dengeler. Asit ve
KİMYA II DERS NOTLARI
 Yrd. Doç. Dr. Atilla EVCİN Afyonkarahisar Kocatepe Üniversitesi 007 KİYA II DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN Asit Baz Tanımları Asit ve baz, değişik zamanlarda değişik şekillerde tanımlanmıştır.
Yrd. Doç. Dr. Atilla EVCİN Afyonkarahisar Kocatepe Üniversitesi 007 KİYA II DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN Asit Baz Tanımları Asit ve baz, değişik zamanlarda değişik şekillerde tanımlanmıştır.
ASİT-BAZ DENGESİ ÖSS DE ÇIKMIŞ SORULAR
 1. Amonyağın, NH 3, baz özelliği gösterdiğini açıklayan denklem aşağıdakilerden hangisidir? A) NH 3(gaz) NH 3(sıvı) B) N 2(gaz) + 3H 2(gaz) 2NH 3(gaz) C) 2NH 3(gaz) +5/2O 2(gaz) 2NO (gaz) + 3H 2 O (gaz)
1. Amonyağın, NH 3, baz özelliği gösterdiğini açıklayan denklem aşağıdakilerden hangisidir? A) NH 3(gaz) NH 3(sıvı) B) N 2(gaz) + 3H 2(gaz) 2NH 3(gaz) C) 2NH 3(gaz) +5/2O 2(gaz) 2NO (gaz) + 3H 2 O (gaz)
ÇÖZELTILERDE DENGE. Asitler ve Bazlar
 ÇÖZELTILERDE DENGE Asitler ve Bazlar Zayıf Asit ve Bazlar Değişik asitler için verilen ph değerlerinin farklılık gösterdiğini görürüz. Bir önceki konuda ph değerinin [H₃O + ] ile ilgili olduğunu gördük.
ÇÖZELTILERDE DENGE Asitler ve Bazlar Zayıf Asit ve Bazlar Değişik asitler için verilen ph değerlerinin farklılık gösterdiğini görürüz. Bir önceki konuda ph değerinin [H₃O + ] ile ilgili olduğunu gördük.
5.111 Ders Özeti #22 22.1. (suda) + OH. (suda)
 5.111 Ders Özeti #22 22.1 Asit/Baz Dengeleri Devamı (Bölümler 10 ve 11) Konular: Zayıf baz içeren dengeler, tuz çözeltilerinin ph sı ve tamponlar Çarşamba nın ders notlarından 2. Suda Baz NH 3 H 2 OH Bazın
5.111 Ders Özeti #22 22.1 Asit/Baz Dengeleri Devamı (Bölümler 10 ve 11) Konular: Zayıf baz içeren dengeler, tuz çözeltilerinin ph sı ve tamponlar Çarşamba nın ders notlarından 2. Suda Baz NH 3 H 2 OH Bazın
BAZ KARIŞIMLARININ VOLUMETRİK ANALİZİ
 BAZ KARIŞIMLARININ VOLUMETRİK ANALİZİ NaOH-Na2CO3 Tayini Alkali ve toprak alkali metallerin hidroksitleri kuvvetli nem çekici özelliğe sahiptirler. Bu nedenle katı haldeki bu hidroksitlerin dış yüzeyleri
BAZ KARIŞIMLARININ VOLUMETRİK ANALİZİ NaOH-Na2CO3 Tayini Alkali ve toprak alkali metallerin hidroksitleri kuvvetli nem çekici özelliğe sahiptirler. Bu nedenle katı haldeki bu hidroksitlerin dış yüzeyleri
GENEL KİMYA 101 ÖDEV 3
 TOBB EKONOMİ VE TEKNOLOJİ ÜNİVERSİTESİ-27 Kasım 2013 Bütün Şubeler GENEL KİMYA 101 ÖDEV 3 ÖNEMLİ! Ödev Teslim Tarihi: 6 Aralık 2013 Soru 1-5 arasında 2 soru Soru 6-10 arasında 2 soru Soru 11-15 arasında
TOBB EKONOMİ VE TEKNOLOJİ ÜNİVERSİTESİ-27 Kasım 2013 Bütün Şubeler GENEL KİMYA 101 ÖDEV 3 ÖNEMLİ! Ödev Teslim Tarihi: 6 Aralık 2013 Soru 1-5 arasında 2 soru Soru 6-10 arasında 2 soru Soru 11-15 arasında
Üçüncü Tek Saatlik Sınav 5.111
 Sayfa 1 /10 Üçüncü Tek Saatlik Sınav 5.111 İsminizi aşağıya yazınız. Sınavda kitaplarınız kapalı olacaktır. 6 problemi de çözmelisiniz. Bir problemin bütün şıklarını baştan sona dikkatli bir şekilde okuyunuz.
Sayfa 1 /10 Üçüncü Tek Saatlik Sınav 5.111 İsminizi aşağıya yazınız. Sınavda kitaplarınız kapalı olacaktır. 6 problemi de çözmelisiniz. Bir problemin bütün şıklarını baştan sona dikkatli bir şekilde okuyunuz.
T TRASYONU. Ders Sorumlusu: Prof. Dr. Đnci. Morgil
 DENEYĐN N ADI: ASĐT T BAZ TĐTRASYONU T TRASYONU Ders Sorumlusu: Prof. Dr. Đnci Morgil H.Ü.. Eğitim E Fakültesi HAZIRLAYAN: Yalçın Azem KAYA Deneyin Amacı: Sodyum hidroksit çözeltisi, derişimi imi bilinen
DENEYĐN N ADI: ASĐT T BAZ TĐTRASYONU T TRASYONU Ders Sorumlusu: Prof. Dr. Đnci Morgil H.Ü.. Eğitim E Fakültesi HAZIRLAYAN: Yalçın Azem KAYA Deneyin Amacı: Sodyum hidroksit çözeltisi, derişimi imi bilinen
TAMPONLAR-pH ve pk HESAPLAMALARI
 Genel tanımlamalar TAMPONLAR-pH ve pk HESAPLAMALARI YRD. DOÇ.DR SEDAT MOTOR Tamponlarla ilgili açıklamalara geçmeden önce asit, baz, ph ve pk kavramlarını hatırlayalım. Suda çözündügü zaman (H + ) iyonu
Genel tanımlamalar TAMPONLAR-pH ve pk HESAPLAMALARI YRD. DOÇ.DR SEDAT MOTOR Tamponlarla ilgili açıklamalara geçmeden önce asit, baz, ph ve pk kavramlarını hatırlayalım. Suda çözündügü zaman (H + ) iyonu
ÇÖZÜNÜRLÜK (ORTAK İYON ETKİSİ ) (Çöktürme ile Ayırma)
 ÇÖZÜNÜRLÜ (ORTA İYON ETİSİ ) (Çöktürme ile Ayırma) Prof. Dr. ustafa DEİR 08ORTA İYON ETİSİ07B ÇÖZÜNÜRLÜ ÇÖTÜRE İLE AYIRA 1 ORTA İYON ETİSİ 08ORTA İYON ETİSİ07B ÇÖZÜNÜRLÜ ÇÖTÜRE İLE AYIRA ORTA İYON ETİSİ
ÇÖZÜNÜRLÜ (ORTA İYON ETİSİ ) (Çöktürme ile Ayırma) Prof. Dr. ustafa DEİR 08ORTA İYON ETİSİ07B ÇÖZÜNÜRLÜ ÇÖTÜRE İLE AYIRA 1 ORTA İYON ETİSİ 08ORTA İYON ETİSİ07B ÇÖZÜNÜRLÜ ÇÖTÜRE İLE AYIRA ORTA İYON ETİSİ
İnstagram:kimyaci_glcn_hoca H A 9.HAMLE SULU ÇÖZELTİLERDE DENGE ASİT VE BAZ DENGESİ 2.BÖLÜM. kimyaci_glcn_hoca
 13 H A M L E D E 9.HAMLE SULU ÇÖZELTİLERDE DENGE ASİT VE BAZ DENGESİ 2.BÖLÜM ZAYIF ASİT VE ZAYIF BAZ İYONLAŞMA YÜZDESİ 0,1 M Kuvvetli Asit HBr 1. Her iki asit çözeltisinin hacimleri ve derişimleri eşit
13 H A M L E D E 9.HAMLE SULU ÇÖZELTİLERDE DENGE ASİT VE BAZ DENGESİ 2.BÖLÜM ZAYIF ASİT VE ZAYIF BAZ İYONLAŞMA YÜZDESİ 0,1 M Kuvvetli Asit HBr 1. Her iki asit çözeltisinin hacimleri ve derişimleri eşit
DENEY 4 KUVVETLİ ASİT İLE KUVVETLİ BAZ TİTRASYONU
 DENEY 4 KUVVETLİ ASİT İLE KUVVETLİ BAZ TİTRASYONU 4.1. AMAÇ Asit ve baz çözeltilerinin hazırlanması, nötralleşme tepkimelerinin yapılışlarının öğrenilmesi. 4.2.TEORİ Asit ve baz kavramı günlük hayatta
DENEY 4 KUVVETLİ ASİT İLE KUVVETLİ BAZ TİTRASYONU 4.1. AMAÇ Asit ve baz çözeltilerinin hazırlanması, nötralleşme tepkimelerinin yapılışlarının öğrenilmesi. 4.2.TEORİ Asit ve baz kavramı günlük hayatta
DENEY 5. ASİDİK VE BAZİK ÇÖZELTİLER ph Skalası ve ph Ölçümleri
 DENEY 5 ASİDİK VE BAZİK ÇÖZELTİLER ph Skalası ve ph Ölçümleri AMAÇ: Çeşitli asit ve baz çözeltileri için ph nın ve ph skalasının ne olduğunun anlaşılması, ph kağıtları ve ph-metre yardımı ile hazırlanmış
DENEY 5 ASİDİK VE BAZİK ÇÖZELTİLER ph Skalası ve ph Ölçümleri AMAÇ: Çeşitli asit ve baz çözeltileri için ph nın ve ph skalasının ne olduğunun anlaşılması, ph kağıtları ve ph-metre yardımı ile hazırlanmış
ÇOKLU DENGELER -1. Prof.Dr.Mustafa DEMİR ÇOKLU DENGE PROBLEMİ ÇÖZÜMÜNDE SİSTEMATİK YAKLAŞIM M.DEMİR 08-ÇOKLU DENGELER-1 1
 ÇOKLU DENGELER -1 ÇOKLU DENGE PROBLEMİ ÇÖZÜMÜNDE SİSTEMATİK YAKLAŞIM Prof.Dr.Mustafa DEMİR M.DEMİR 08-ÇOKLU DENGELER-1 1 Kimyasal tepkimelerin bir çoğu, ortamda birden fazla tür olduğu ve bu türler arasında
ÇOKLU DENGELER -1 ÇOKLU DENGE PROBLEMİ ÇÖZÜMÜNDE SİSTEMATİK YAKLAŞIM Prof.Dr.Mustafa DEMİR M.DEMİR 08-ÇOKLU DENGELER-1 1 Kimyasal tepkimelerin bir çoğu, ortamda birden fazla tür olduğu ve bu türler arasında
ÇÖZELTİLERDE DENGE (Asit-Baz)
 ÇÖZELTİLERDE DENGE (AsitBaz) SUYUN OTOİYONİZASYONU Saf suyun elektrik akımını iletmediği bilinir, ancak çok hassas ölçü aletleriyle yapılan deneyler sonucunda suyun çok zayıf da olsa iletken olduğu tespit
ÇÖZELTİLERDE DENGE (AsitBaz) SUYUN OTOİYONİZASYONU Saf suyun elektrik akımını iletmediği bilinir, ancak çok hassas ölçü aletleriyle yapılan deneyler sonucunda suyun çok zayıf da olsa iletken olduğu tespit
ASİT BAZ TİTRASYONU TEORİ
 ASİT BAZ TİTRASYONU AMAÇ Bu deneyde öğrenciler asit-baz titrasyonu ve standart çözelti hazırlamayı öğreneceklerdir. Ayrıca aspirin tableti içindeki asetil salisilik asit yüzdesini ve aspirin çözeltisinin
ASİT BAZ TİTRASYONU AMAÇ Bu deneyde öğrenciler asit-baz titrasyonu ve standart çözelti hazırlamayı öğreneceklerdir. Ayrıca aspirin tableti içindeki asetil salisilik asit yüzdesini ve aspirin çözeltisinin
Araş. Gör. Can GÜNGÖREN
 1 ph KAVRAMI VE HESABI Araş. Gör. Can GÜNGÖREN 2 ph ın Önemi Sulu çözeltilerde hidrojen iyonu aktivitesi çok önemli bir rol oynar. Kimyada, çözünmüş hidrojen iyonu aktivitesinin ölçüsüne ph denir. ph bir
1 ph KAVRAMI VE HESABI Araş. Gör. Can GÜNGÖREN 2 ph ın Önemi Sulu çözeltilerde hidrojen iyonu aktivitesi çok önemli bir rol oynar. Kimyada, çözünmüş hidrojen iyonu aktivitesinin ölçüsüne ph denir. ph bir
CANLILARDA TAMPONLAMA
 CANLILARDA TAMPONLAMA ph= -log [H + ] / Sorensen, H potansiyeli örnekler Hücreler ve organizmalar özgül ve sabit bir sitozol ve hücre dışı sıvı ph sını korurlar Böylece biyomoleküllerin en uygun iyonik
CANLILARDA TAMPONLAMA ph= -log [H + ] / Sorensen, H potansiyeli örnekler Hücreler ve organizmalar özgül ve sabit bir sitozol ve hücre dışı sıvı ph sını korurlar Böylece biyomoleküllerin en uygun iyonik
ALKALİNİTE. 1 ) Hidroksitler 2 ) Karbonatlar 3 ) Bikarbonatlar
 ALKALİNİTE Bir suyun alkalinitesi, o suyun asitleri nötralize edebilme kapasitesi olarak tanımlanır. Doğal suların alkalinitesi, zayıf asitlerin tuzlarından ileri gelir. Bunların başında yer alan bikarbonatlar,
ALKALİNİTE Bir suyun alkalinitesi, o suyun asitleri nötralize edebilme kapasitesi olarak tanımlanır. Doğal suların alkalinitesi, zayıf asitlerin tuzlarından ileri gelir. Bunların başında yer alan bikarbonatlar,
NÖTRALĠZASYON TĠTRASYONLARI
 NÖTRALĠZASYON TĠTRASYONLARI Asit baz reaksiyonlarından yararlanılarak asidik numunelerin standart baz çözeltisi ile veya bazik numunelerin standart asit çözeltileri ile reaksiyona sokulması yoluyla miktar
NÖTRALĠZASYON TĠTRASYONLARI Asit baz reaksiyonlarından yararlanılarak asidik numunelerin standart baz çözeltisi ile veya bazik numunelerin standart asit çözeltileri ile reaksiyona sokulması yoluyla miktar
İÇERİK. Suyun Doğası Sulu Çözeltilerin Doğası
 İÇERİK Suyun Doğası Sulu Çözeltilerin Doğası Su içinde İyonik Bileşikler Su içinde Kovalent Bileşikler Çökelme Tepkimesi Asit-Baz Tepkimeleri (Nötürleşme) Yükseltgenme-İndirgenme Tepkimeleri Önemli Tip
İÇERİK Suyun Doğası Sulu Çözeltilerin Doğası Su içinde İyonik Bileşikler Su içinde Kovalent Bileşikler Çökelme Tepkimesi Asit-Baz Tepkimeleri (Nötürleşme) Yükseltgenme-İndirgenme Tepkimeleri Önemli Tip
DENEY 7 TAMPON ÇÖZELTİLER, TAMPON KAPASİTESİ ve TAMPONLAMA BÖLGESİ
 DENEY 7 TAMPON ÇÖZELTİLER, TAMPON KAPASİTESİ ve TAMPONLAMA BÖLGESİ 7.1. AMAÇ Bir tampon çözeltinin nasıl hazırlandığını öğrenmek. Bir tampon çözeltinin tampon kapasitesini belirlemek. Bir tampon çözeltinin
DENEY 7 TAMPON ÇÖZELTİLER, TAMPON KAPASİTESİ ve TAMPONLAMA BÖLGESİ 7.1. AMAÇ Bir tampon çözeltinin nasıl hazırlandığını öğrenmek. Bir tampon çözeltinin tampon kapasitesini belirlemek. Bir tampon çözeltinin
3. ASİTLER VE BAZLAR 3.1. GİRİŞ
 3. ASİTLER VE BAZLAR 3.1. GİRİŞ Asitler ve bazlar günlük yaşantımızda sıkça karşılaştığımız kavramlardan biridir. İnsanlar, her ne kadar asetil salisilik asit ve magnezyum hidroksit gibi kimyasal isimlerini
3. ASİTLER VE BAZLAR 3.1. GİRİŞ Asitler ve bazlar günlük yaşantımızda sıkça karşılaştığımız kavramlardan biridir. İnsanlar, her ne kadar asetil salisilik asit ve magnezyum hidroksit gibi kimyasal isimlerini
ASİT-BAZ TEORİSİ. (TİTRASYON) Prof. Dr. Mustafa DEMİR. M.DEMİR(ADU) ASİT-BAZ TEORİSİ (titrasyon) 1
 ASİT-BAZ TEORİSİ (TİTRASYON) Prof. Dr. Mustf DEMİR M.DEMİR(ADU) 009-05-ASİT-BAZ TEORİSİ (titrsyon) 1 Arhenius (su teorisi) 1990 Asit: Sud iyonlştığınd iyonu veren, bz ise O - iyonu veren mddelerdir. Cl,NO,
ASİT-BAZ TEORİSİ (TİTRASYON) Prof. Dr. Mustf DEMİR M.DEMİR(ADU) 009-05-ASİT-BAZ TEORİSİ (titrsyon) 1 Arhenius (su teorisi) 1990 Asit: Sud iyonlştığınd iyonu veren, bz ise O - iyonu veren mddelerdir. Cl,NO,
PROJENİN AMACI. İÇEÇEKLERİN ph DEĞERLERİNİN ÖLÇÜLÜP MİDENİN ph DERECESİ KARŞILAŞTIRILMASI VE DEĞERLENDİRİLMESİ
 PROJENİN AMACI İÇEÇEKLERİN ph DEĞERLERİNİN ÖLÇÜLÜP MİDENİN ph DERECESİ KARŞILAŞTIRILMASI VE DEĞERLENDİRİLMESİ Bir toplumun içecek kültürü, yaşam şekliyle yakından ilgilidir. Yaşam şeklinin değişmesi, içecek
PROJENİN AMACI İÇEÇEKLERİN ph DEĞERLERİNİN ÖLÇÜLÜP MİDENİN ph DERECESİ KARŞILAŞTIRILMASI VE DEĞERLENDİRİLMESİ Bir toplumun içecek kültürü, yaşam şekliyle yakından ilgilidir. Yaşam şeklinin değişmesi, içecek
6.4. Çözünürlük üzerine kompleks oluşumunun etkisi ------------ 6.5. Çözünürlük üzerine hidrolizin etkisi ---------------------------- 6.6.
 iii İÇİNDEKİLER 1. GİRİŞ ------------------------------------------------------------------- 2. TANIMLAR ------------------------------------------------------------ 2.1. Atom-gram -------------------------------------------------------
iii İÇİNDEKİLER 1. GİRİŞ ------------------------------------------------------------------- 2. TANIMLAR ------------------------------------------------------------ 2.1. Atom-gram -------------------------------------------------------
SULU ÇÖZELTİLERDE DENGE
 İMYASAL DENGE SULU ÇÖZELTİLERDE DENGE Prof. Dr. Mustafa DEMİR M.DEMİR 06-İMYASAL DENGE 1 SULU ÇÖZELTİLERDE DENGE Bileşikler suda, özelliklerine göre az veya çok oranda ayrışarak iyonlaşırlar. İyon içeren
İMYASAL DENGE SULU ÇÖZELTİLERDE DENGE Prof. Dr. Mustafa DEMİR M.DEMİR 06-İMYASAL DENGE 1 SULU ÇÖZELTİLERDE DENGE Bileşikler suda, özelliklerine göre az veya çok oranda ayrışarak iyonlaşırlar. İyon içeren
Kimya Mühendisliği Bölümü, 2014/2015 Öğretim Yılı, Bahar Yarıyılı 0102-Genel Kimya-II Dersi, Dönem Sonu Sınavı
 Kimya Mühendisliği Bölümü, 2014/2015 Öğretim Yılı, Bahar Yarıyılı 0102-Genel Kimya-II Dersi, Dönem Sonu Sınavı 20.05.2015 Soru (puan) 1 (20 ) 2 (20 ) 3 (20 ) 4 (25) 5 (20 ) 6 (20 ) Toplam Alınan Puan Not:
Kimya Mühendisliği Bölümü, 2014/2015 Öğretim Yılı, Bahar Yarıyılı 0102-Genel Kimya-II Dersi, Dönem Sonu Sınavı 20.05.2015 Soru (puan) 1 (20 ) 2 (20 ) 3 (20 ) 4 (25) 5 (20 ) 6 (20 ) Toplam Alınan Puan Not:
Doğal Rb elementinin atom kütlesi 85,47 g/mol dür ve atom kütleleri 84,91 g/mol olan 86 Rb ile 86,92 olan 87
 Doğal Rb elementinin atom kütlesi 85,47 g/mol dür ve atom kütleleri 84,91 g/mol olan 86 Rb ile 86,92 olan 87 Rb izotoplarından oluşmuştur. İzotopların doğada bulunma yüzdelerini hesaplayınız. Bir bileşik
Doğal Rb elementinin atom kütlesi 85,47 g/mol dür ve atom kütleleri 84,91 g/mol olan 86 Rb ile 86,92 olan 87 Rb izotoplarından oluşmuştur. İzotopların doğada bulunma yüzdelerini hesaplayınız. Bir bileşik
6. I. Sirke ruhu (CH 3 COOH)
 ph ve poh Kavramları - Asit Baz İndikatörleri BÖLÜM 08 Test 04 1. Aşağıdaki maddelerin standart koşullarda ph değerleri ile ilgili verilen bilgilerden hangisi yanlıştır? 4. mavi turnusol kağıdı kırmızı
ph ve poh Kavramları - Asit Baz İndikatörleri BÖLÜM 08 Test 04 1. Aşağıdaki maddelerin standart koşullarda ph değerleri ile ilgili verilen bilgilerden hangisi yanlıştır? 4. mavi turnusol kağıdı kırmızı
ASİT-BAZ VE ph. MÜHENDİSLİK KİMYASI DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN. Yrd. Doç. Dr. Atilla Evcin Afyonkarahisar Kocatepe Üniversitesi 2006
 ASİT-BAZ VE ph MÜHENDİSLİK KİMYASI DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN Asitler ve bazlar günlük yaşantımızda sıkça karşılaştığımız kavramlardan biridir.insanlar, her nekadar asetil salisilik asit ve
ASİT-BAZ VE ph MÜHENDİSLİK KİMYASI DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN Asitler ve bazlar günlük yaşantımızda sıkça karşılaştığımız kavramlardan biridir.insanlar, her nekadar asetil salisilik asit ve
ÇOKLU DENGELER-2. Prof.Dr.Mustafa DEMİR M.DEMİR 13-ÇOKLU DENGELER - 2 1
 ÇOLU DENGELER- Prof.Dr.Mustafa DEMİR M.DEMİR 1-ÇOLU DENGELER - 1 Örnek 1 : ph 4 tampon ortamında CaC O 4 çözünürlüğü nedir? Esitlikler CaC C HC H O O 4 O O 4-4 H H H Ca OH HC - H C O C O - 4 4 O 4. ütle
ÇOLU DENGELER- Prof.Dr.Mustafa DEMİR M.DEMİR 1-ÇOLU DENGELER - 1 Örnek 1 : ph 4 tampon ortamında CaC O 4 çözünürlüğü nedir? Esitlikler CaC C HC H O O 4 O O 4-4 H H H Ca OH HC - H C O C O - 4 4 O 4. ütle
ASİTLER- BAZLAR. Suyun kendi kendine iyonlaşmasına Suyun Otonizasyonu - Otoprotoliz adı verilir. Suda oluşan H + sadece protondur.
 ASİTLER- BAZLAR SUYUN OTONİZASYONU: Suyun kendi kendine iyonlaşmasına Suyun Otonizasyonu - Otoprotoliz adı verilir. Suda oluşan H + sadece protondur. H 2 O (S) H + (suda) + OH - (Suda) H 2 O (S) + H +
ASİTLER- BAZLAR SUYUN OTONİZASYONU: Suyun kendi kendine iyonlaşmasına Suyun Otonizasyonu - Otoprotoliz adı verilir. Suda oluşan H + sadece protondur. H 2 O (S) H + (suda) + OH - (Suda) H 2 O (S) + H +
7-2. Aşağıdakileri kısaca tanımlayınız veya açıklayınız. a) Amfiprotik çözücü b) Farklandırıcı çözücü c) Seviyeleme çözücüsü d) Kütle etkisi
 SKOOG 7-1. Aşağıdakileri kısaca tanımlayınız veya açıklayınız. a) Zayıf elektrolit b) Bronsted-Lowry asidi c) Bronsted-Lowry asidinin konjuge bazı d) Bronsted-Lowry tanımına dayanarak nötralleşme e) Amfiprotik
SKOOG 7-1. Aşağıdakileri kısaca tanımlayınız veya açıklayınız. a) Zayıf elektrolit b) Bronsted-Lowry asidi c) Bronsted-Lowry asidinin konjuge bazı d) Bronsted-Lowry tanımına dayanarak nötralleşme e) Amfiprotik
SULU DENGELERE KATILMA (İLAVE) DURUMLARI *BİR TAMPON ÇÖZELTİNİN NASIL FONKSİYON GÖSTERDİĞİNİ AÇIKLAMAK
 KONUNUN AMACI VE ANAHTAR KAVRAMLAR *ORTAK İYON ETKİSİNİ TANIMLAMAK SULU DENGELERE KATILMA (İLAVE) DURUMLARI *BİR TAMPON ÇÖZELTİNİN NASIL FONKSİYON GÖSTERDİĞİNİ AÇIKLAMAK *TAMPON ÇÖZELTİNİN PH INI HESAPLAMAK
KONUNUN AMACI VE ANAHTAR KAVRAMLAR *ORTAK İYON ETKİSİNİ TANIMLAMAK SULU DENGELERE KATILMA (İLAVE) DURUMLARI *BİR TAMPON ÇÖZELTİNİN NASIL FONKSİYON GÖSTERDİĞİNİ AÇIKLAMAK *TAMPON ÇÖZELTİNİN PH INI HESAPLAMAK
İnstagram:kimyaci_glcn_hoca H A 9.HAMLE SULU ÇÖZELTİLERDE DENGE ASİT VE BAZ DENGESİ. kimyaci_glcn_hoca
 13 H A M L E D E 9.HAMLE SULU ÇÖZELTİLERDE DENGE ASİT VE BAZ DENGESİ ASİTLER VE BAZLAR 1.Arrhenius Asit-Baz Tanımı Arrhenius a göre bir madde suda iyonlarına ayrışarak çözündüğünde ortamdaki; H + iyonları
13 H A M L E D E 9.HAMLE SULU ÇÖZELTİLERDE DENGE ASİT VE BAZ DENGESİ ASİTLER VE BAZLAR 1.Arrhenius Asit-Baz Tanımı Arrhenius a göre bir madde suda iyonlarına ayrışarak çözündüğünde ortamdaki; H + iyonları
ÇÖZÜNÜRLÜĞE ETKİ EDEN FAKTÖRLER
 ÇÖZÜNÜRLÜĞE ETKİ EDEN FAKTÖRLER 1- SICAKLIK 2- ORTAK İYON ETKİSİ 3- ÇÖZÜCÜ ÇÖZÜNEN CİNSİ 4- BASINCIN ETKİSİ 1- SICAKLIK ETKİSİ Sıcaklık etkisi Le Chatelier prensibine bağlı olarak yorumlanır. ENDOTERMİK
ÇÖZÜNÜRLÜĞE ETKİ EDEN FAKTÖRLER 1- SICAKLIK 2- ORTAK İYON ETKİSİ 3- ÇÖZÜCÜ ÇÖZÜNEN CİNSİ 4- BASINCIN ETKİSİ 1- SICAKLIK ETKİSİ Sıcaklık etkisi Le Chatelier prensibine bağlı olarak yorumlanır. ENDOTERMİK
kpss Önce biz sorduk 50 Soruda SORU Güncellenmiş Yeni Baskı ÖABT KİMYA Tamamı Çözümlü ÇIKMIŞ SORULAR
 Önce biz sorduk kpss 2 0 1 8 50 Soruda 35 SORU Güncellenmiş Yeni Baskı ÖABT KİMYA 2013 2014 2015 2016 2017 Tamamı Çözümlü ÇIKMIŞ SORULAR Komisyon ÖABT KİMYA TAMAMI ÇÖZÜMLÜ ÇIKMIŞ SORULAR ISBN 9786053189121
Önce biz sorduk kpss 2 0 1 8 50 Soruda 35 SORU Güncellenmiş Yeni Baskı ÖABT KİMYA 2013 2014 2015 2016 2017 Tamamı Çözümlü ÇIKMIŞ SORULAR Komisyon ÖABT KİMYA TAMAMI ÇÖZÜMLÜ ÇIKMIŞ SORULAR ISBN 9786053189121
YAZILI SINAV SORU ÖRNEKLERİ KİMYA
 YAZILI SINAV SORU ÖRNEKLERİ KİMYA SORU 1: 32 16X element atomundan oluşan 2 X iyonunun; 1.1: Proton sayısını açıklayarak yazınız. (1 PUAN) 1.2: Nötron sayısını açıklayarak yazınız. (1 PUAN) 1.3: Elektron
YAZILI SINAV SORU ÖRNEKLERİ KİMYA SORU 1: 32 16X element atomundan oluşan 2 X iyonunun; 1.1: Proton sayısını açıklayarak yazınız. (1 PUAN) 1.2: Nötron sayısını açıklayarak yazınız. (1 PUAN) 1.3: Elektron
Tamponlar üzerinde konuşmaya kaldığımız yerden devam edelim. Ben tamponları çok severim, onların büyük fanıyım, hakikaten, araştırmalarımda
 Tamponlar üzerinde konuşmaya kaldığımız yerden devam edelim. Ben tamponları çok severim, onların büyük fanıyım, hakikaten, araştırmalarımda tamponların çok faydasını gördüm, çünkü ortamın ph larını sabit
Tamponlar üzerinde konuşmaya kaldığımız yerden devam edelim. Ben tamponları çok severim, onların büyük fanıyım, hakikaten, araştırmalarımda tamponların çok faydasını gördüm, çünkü ortamın ph larını sabit
AMFİPROTİK TUZ ÇÖZELTİLERİNİN PH LARININ HESAPLANMASI. Prof. Dr. Mustafa DEMİR HESAPLAMALARI
 AMFİPROTİK TUZ ÇÖZELTİLERİNİN PH LARININ HESAPLANMASI Prof. Dr. Mustafa DEMİR Hem asidik hem de bazik özellik gösteren tuzlara amfiprotik(amfoterik) tuzlar denir. Bu tür tuzlar çok değerlikli asit ve tuzların
AMFİPROTİK TUZ ÇÖZELTİLERİNİN PH LARININ HESAPLANMASI Prof. Dr. Mustafa DEMİR Hem asidik hem de bazik özellik gösteren tuzlara amfiprotik(amfoterik) tuzlar denir. Bu tür tuzlar çok değerlikli asit ve tuzların
$e"v I)w ]/o$a+ s&a; %p,{ d av aa!!!!aaa!a!!!a! BASIN KİTAPÇIĞI 00000000
![$ev I)w ]/o$a+ s&a; %p,{ d av aa!!!!aaa!a!!!a! BASIN KİTAPÇIĞI 00000000 $ev I)w ]/o$a+ s&a; %p,{ d av aa!!!!aaa!a!!!a! BASIN KİTAPÇIĞI 00000000](/thumbs/29/13231412.jpg) BASIN KİTAPÇIĞI 00000000 AÇIKLAMA 1. Bu kitapç kta Lisans Yerle tirme S nav - Kimya Testi bulunmaktad r.. Bu test için verilen toplam cevaplama süresi 5 dakikadır.. Bu kitapç ktaki testlerde yer alan her
BASIN KİTAPÇIĞI 00000000 AÇIKLAMA 1. Bu kitapç kta Lisans Yerle tirme S nav - Kimya Testi bulunmaktad r.. Bu test için verilen toplam cevaplama süresi 5 dakikadır.. Bu kitapç ktaki testlerde yer alan her
00213 ANALİTİK KİMYA-I SINAV VE ÇALIŞMA SORULARI
 00213 ANALİTİK KİMYA-I SINAV VE ÇALIŞMA SORULARI A) TANIMLAR, KAVRAMLAR ve TEMEL HESAPLAMALAR: 1. Aşağıdaki kavramları birer cümle ile tanımlayınız. Analitik kimya, Sistematik analiz, ph, Tesir değerliği,
00213 ANALİTİK KİMYA-I SINAV VE ÇALIŞMA SORULARI A) TANIMLAR, KAVRAMLAR ve TEMEL HESAPLAMALAR: 1. Aşağıdaki kavramları birer cümle ile tanımlayınız. Analitik kimya, Sistematik analiz, ph, Tesir değerliği,
HACETTEPE ÜNĐVERSĐTESĐ KĐMYA EĞĐTĐMĐ ANABĐLĐM DALI ÖĞRETĐM TEKNĐKLERĐ VE MATERYAL GELĐŞTĐRME ASĐTLER VE BAZLAR KONU ANLATIMI ÇALIŞMA YAPRAĞI
 Asit ve Bazların Tanımı HACETTEPE ÜNĐVERSĐTESĐ KĐMYA EĞĐTĐMĐ ANABĐLĐM DALI ÖĞRETĐM TEKNĐKLERĐ VE MATERYAL GELĐŞTĐRME ASĐTLER VE BAZLAR KONU ANLATIMI ÇALIŞMA YAPRAĞI Hazırlayan: Beyza Ceren ÜNCÜ Asitler
Asit ve Bazların Tanımı HACETTEPE ÜNĐVERSĐTESĐ KĐMYA EĞĐTĐMĐ ANABĐLĐM DALI ÖĞRETĐM TEKNĐKLERĐ VE MATERYAL GELĐŞTĐRME ASĐTLER VE BAZLAR KONU ANLATIMI ÇALIŞMA YAPRAĞI Hazırlayan: Beyza Ceren ÜNCÜ Asitler
ÇÖKTÜRME TİTRASYONLARI (Çöktürmeye Dayanan Volumetrik Analizler)
 ÇÖKTÜRME TİTRASYONLARI (Çöktürmeye Dayanan Volumetrik Analizler) Prof. Dr. Mustafa DEMİR http://web.adu.edu.tr/akademik/mdemir/ M.DEMİR(ADU) 2009-15-ÇÖKTÜRME TİTRASYONLARI 1 Çöktürme ile, gravimetrik analizlerin
ÇÖKTÜRME TİTRASYONLARI (Çöktürmeye Dayanan Volumetrik Analizler) Prof. Dr. Mustafa DEMİR http://web.adu.edu.tr/akademik/mdemir/ M.DEMİR(ADU) 2009-15-ÇÖKTÜRME TİTRASYONLARI 1 Çöktürme ile, gravimetrik analizlerin
ASİTLER VE BAZLAR ASİT VE BAZ KAVRAMLARI
 ASİTLER VE BAZLAR ASİT VE BAZ KAVRAMLARI Prof. Dr. Mustafa DEMİR M.DEMİR 0ASİT VE BAZ KAVRAMLARI Asit ve baz, değişik zamanlarda değişik şekillerde tanımlanmıştır. Bugün bu tanımların hepsi de kullanılmaktadır.
ASİTLER VE BAZLAR ASİT VE BAZ KAVRAMLARI Prof. Dr. Mustafa DEMİR M.DEMİR 0ASİT VE BAZ KAVRAMLARI Asit ve baz, değişik zamanlarda değişik şekillerde tanımlanmıştır. Bugün bu tanımların hepsi de kullanılmaktadır.
Herşey birbiri ile ilişkili olabilir. Size birkaç ders öncesinden bazı örnekler vereceğim, Bir sisteme inert gaz eklersek ne olacağını düşünmüştük.
 Herşey birbiri ile ilişkili olabilir. Size birkaç ders öncesinden bazı örnekler vereceğim, Bir sisteme inert gaz eklersek ne olacağını düşünmüştük. Unutmayın, her şey kısmi basınçla ilgilidir. Kendinize
Herşey birbiri ile ilişkili olabilir. Size birkaç ders öncesinden bazı örnekler vereceğim, Bir sisteme inert gaz eklersek ne olacağını düşünmüştük. Unutmayın, her şey kısmi basınçla ilgilidir. Kendinize
Üçüncü Tek Saatlik Sınav 5.111
 Sayfa 1 /10 Üçüncü Tek Saatlik Sınav 5.111 İsminizi aşağıya yazınız. Sınavda kitaplarınız kapalı olacaktır. 6 problemi de çözmelisiniz. Bir problemin bütün şıklarını baştan sona dikkatli bir şekilde okuyunuz.
Sayfa 1 /10 Üçüncü Tek Saatlik Sınav 5.111 İsminizi aşağıya yazınız. Sınavda kitaplarınız kapalı olacaktır. 6 problemi de çözmelisiniz. Bir problemin bütün şıklarını baştan sona dikkatli bir şekilde okuyunuz.
ÇOK DEĞERLİKLİ ASİTLER ve BAZLA
 ÇOK DEĞERLİKLİ ASİTLER ve BAZLA Prof. Dr. Mustafa DEMİR http://web.adu.edu.tr/akademik/mdemir/ 00910ÇOK DEĞERLİKLİ ASİTLER ve 1 ÇOK DEĞERLİKLİ ASİTLER Çok değerli asitler, molekülünde birden fazla asidik
ÇOK DEĞERLİKLİ ASİTLER ve BAZLA Prof. Dr. Mustafa DEMİR http://web.adu.edu.tr/akademik/mdemir/ 00910ÇOK DEĞERLİKLİ ASİTLER ve 1 ÇOK DEĞERLİKLİ ASİTLER Çok değerli asitler, molekülünde birden fazla asidik
ASİTLER VE BAZLAR ASİT VE BAZ KAVRAMLARI M.DEMİR ASİT VE BAZ KAVRAMLARI 1
 ASİTLER VE BAZLAR ASİT VE BAZ KAVRAMLARI M.DEMİR ASİT VE BAZ KAVRAMLARI 1 Asit ve baz, değişik zamanlarda değişik şekillerde tanımlanmıştır. Bugün bu tanımların hepsi de kullanılmaktadır. Hangi tanımın
ASİTLER VE BAZLAR ASİT VE BAZ KAVRAMLARI M.DEMİR ASİT VE BAZ KAVRAMLARI 1 Asit ve baz, değişik zamanlarda değişik şekillerde tanımlanmıştır. Bugün bu tanımların hepsi de kullanılmaktadır. Hangi tanımın
KİMYA II DERS NOTLARI
 KİMYA II DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN Sulu Çözeltilerin Doğası Elektrolitler Metallerde elektronların hareketiyle elektrik yükü taşınır. Saf su Suda çözünmüş Oksijen gazı Çözeltideki moleküllerin
KİMYA II DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN Sulu Çözeltilerin Doğası Elektrolitler Metallerde elektronların hareketiyle elektrik yükü taşınır. Saf su Suda çözünmüş Oksijen gazı Çözeltideki moleküllerin
ASİTLERİN VE BAZLARIN TEPKİMELERİ
 2. BÖLÜM ASİTLERİN VE BAZLARIN TEPKİMELERİ Asitler ve bazlar kimyasal özellikleri ve tepkimeleri bakımından çok önemli maddeler olup oldukça sık kullanılırlar. Bu bölümde asitler ve bazlar arasındaki tepkimeleri;
2. BÖLÜM ASİTLERİN VE BAZLARIN TEPKİMELERİ Asitler ve bazlar kimyasal özellikleri ve tepkimeleri bakımından çok önemli maddeler olup oldukça sık kullanılırlar. Bu bölümde asitler ve bazlar arasındaki tepkimeleri;
Bazı α-amino Asitlerin Etil- ve Metil- Esterlerinin Protonasyon Sabitlerinin Su Ortamında Potansiyometrik Yöntemle Tayini
 G.Ü. Gazi Eğitim Fakültesi Dergisi Cilt 21, Sayı 3 (2001) 121-130 Bazı α-amino Asitlerin Etil- ve Metil- Esterlerinin Protonasyon Sabitlerinin Su Ortamında Potansiyometrik Yöntemle Tayini Determination
G.Ü. Gazi Eğitim Fakültesi Dergisi Cilt 21, Sayı 3 (2001) 121-130 Bazı α-amino Asitlerin Etil- ve Metil- Esterlerinin Protonasyon Sabitlerinin Su Ortamında Potansiyometrik Yöntemle Tayini Determination
8. SINIF KĠMYA DENEYLERĠ
 8. SINIF KĠMYA DENEYLERĠ DENEY NO : 1 DENEYĠN ADI : KÜTLENİN KORUNUMU KANUNU DENEYĠN AMACI : Doğada var olan maddelerin hiçbir şekilde yoktan var olamayacağı, varolanın da yok olamayacağını; başka şekillere
8. SINIF KĠMYA DENEYLERĠ DENEY NO : 1 DENEYĠN ADI : KÜTLENİN KORUNUMU KANUNU DENEYĠN AMACI : Doğada var olan maddelerin hiçbir şekilde yoktan var olamayacağı, varolanın da yok olamayacağını; başka şekillere
BORUSAL (TUBULAR) AKIŞ REAKTÖRÜ
 BORUSAL (TUBULAR) AKIŞ REAKTÖRÜ Bursa Teknik Üniversitesi DBMMF Kimya Mühendisliği Bölümü 1 1. Amaç Borusal akış reaktörde, sabunlaşma reaksiyonunun kalma zamanına bağlı olarak dönüşümünü ve bu dönüşüm
BORUSAL (TUBULAR) AKIŞ REAKTÖRÜ Bursa Teknik Üniversitesi DBMMF Kimya Mühendisliği Bölümü 1 1. Amaç Borusal akış reaktörde, sabunlaşma reaksiyonunun kalma zamanına bağlı olarak dönüşümünü ve bu dönüşüm
Hidroklorik asit ve sodyum hidroksitin reaksiyonundan yemek tuzu ve su meydana gelir. Bu kimyasal olayın denklemi
 KİMYASAL DENKLEMLER İki ya da daha fazla maddenin birbirleri ile etkileşerek kendi özelliklerini kaybedip yeni özelliklerde bir takım ürünler meydana getirmesine kimyasal olay, bunların formüllerle gösterilmesine
KİMYASAL DENKLEMLER İki ya da daha fazla maddenin birbirleri ile etkileşerek kendi özelliklerini kaybedip yeni özelliklerde bir takım ürünler meydana getirmesine kimyasal olay, bunların formüllerle gösterilmesine
DENEY 4. ASİT BAZ TİTRASYONLARI (indikatörlü, potansiyometrik)
 DENEY 4 ASİT BAZ TİTRASYONLARI (indikatörlü, potansiyometrik) AMAÇ: Asit baz titrasyon işlemini öğrenmek ve asit-baz titrasyonu ile derişimi bilinmeyen bir asit ve/veya bir baz çözeltisinin derişimini
DENEY 4 ASİT BAZ TİTRASYONLARI (indikatörlü, potansiyometrik) AMAÇ: Asit baz titrasyon işlemini öğrenmek ve asit-baz titrasyonu ile derişimi bilinmeyen bir asit ve/veya bir baz çözeltisinin derişimini
Sulu Çözeltilerde Asit - Baz Dengesi
 Bu notlara Youtube dan Kimya Elbistan kanalında ilgili videolarının açıklamalar kısmında ki linkten ücretsiz bir şekilde ulaşabilirsiniz. A. Asit ve Baz Tanımları Arrhenius Asit - Baz Tanımı Arrhenius
Bu notlara Youtube dan Kimya Elbistan kanalında ilgili videolarının açıklamalar kısmında ki linkten ücretsiz bir şekilde ulaşabilirsiniz. A. Asit ve Baz Tanımları Arrhenius Asit - Baz Tanımı Arrhenius
[H + ] > [OH ] ortam asidiktir. [H + ]. [OH ] = 10 14 'tür. [H + ] < [OH ] ise ortam baziktir. NİTELİK Yayıncılık [H + ] = [OH ] = 10 7 M
![[H + ] > [OH ] ortam asidiktir. [H + ]. [OH ] = 10 14 'tür. [H + ] < [OH ] ise ortam baziktir. NİTELİK Yayıncılık [H + ] = [OH ] = 10 7 M [H + ] > [OH ] ortam asidiktir. [H + ]. [OH ] = 10 14 'tür. [H + ] < [OH ] ise ortam baziktir. NİTELİK Yayıncılık [H + ] = [OH ] = 10 7 M](/thumbs/33/15881900.jpg) BÖLÜM - 3 Suyun Otoiyonizasyonu Çok hassas ölçüm aletleri ile yapılan ölçümlerde suyun mutlak bir yalıtkan olmadığı az da olsa elektriği ilettiği tespit edilmiştir. Bu durum suyun çok az iyonlaşabildiğini
BÖLÜM - 3 Suyun Otoiyonizasyonu Çok hassas ölçüm aletleri ile yapılan ölçümlerde suyun mutlak bir yalıtkan olmadığı az da olsa elektriği ilettiği tespit edilmiştir. Bu durum suyun çok az iyonlaşabildiğini
9. SINIF KONTEXT KĐMYA UYGULAMASI
 9. SINIF KONTEXT KĐMYA UYGULAMASI DERS SORUMLUSU: PROF. DR. ĐNCi MORGĐL HAZIRLAYAN: DERYA ÇAKICI 20338451 ANKARA, 2008 MİDEM NEDEN YANIYOR? Günlük yaşam olayı: Sindirim rahatsızlıklarından mide yanmasının
9. SINIF KONTEXT KĐMYA UYGULAMASI DERS SORUMLUSU: PROF. DR. ĐNCi MORGĐL HAZIRLAYAN: DERYA ÇAKICI 20338451 ANKARA, 2008 MİDEM NEDEN YANIYOR? Günlük yaşam olayı: Sindirim rahatsızlıklarından mide yanmasının
6. Aşağıdaki tablodan yararlanarak X maddesinin ne olduğunu (A, B,C? ) ön görünüz.
 1. Lavosier yasası nedir, açıklayınız. 2. C 2 H 4 + 3O 2 2CO 2 + 2 H 2 O tepkimesine göre 2,0 g etilenin yeterli miktarda oksijenle yanması sonucu oluşan ürünlerin toplam kütlesi nedir, hesaplayınız. 3.
1. Lavosier yasası nedir, açıklayınız. 2. C 2 H 4 + 3O 2 2CO 2 + 2 H 2 O tepkimesine göre 2,0 g etilenin yeterli miktarda oksijenle yanması sonucu oluşan ürünlerin toplam kütlesi nedir, hesaplayınız. 3.
KOMPLEKSOMETRİK TİTRASYONLAR
 KOMPLEKSOMETRİK TİTRASYONLAR Kompleks oluşması esasına dayanan titrasyonlardır. Mg 2+ + H2Y 2- MgY 2- + 2H + kelat kompleksi Kelatometrik titrasyonlar Mg 2+ + H2Y 2- [MgY] 2- + 2 H + KOMPLEKSOMETRİK TİTRASYONLAR
KOMPLEKSOMETRİK TİTRASYONLAR Kompleks oluşması esasına dayanan titrasyonlardır. Mg 2+ + H2Y 2- MgY 2- + 2H + kelat kompleksi Kelatometrik titrasyonlar Mg 2+ + H2Y 2- [MgY] 2- + 2 H + KOMPLEKSOMETRİK TİTRASYONLAR
Genel Kimya. Bölüm 7: ÇÖZELTİLER VE ÇÖZÜNÜRLÜK. Yrd. Doç. Dr. Mustafa SERTÇELİK Kafkas Üniversitesi Kimya Mühendisliği Bölümü
 Genel Kimya Bölüm 7: ÇÖZELTİLER VE ÇÖZÜNÜRLÜK Yrd. Doç. Dr. Mustafa SERTÇELİK Kafkas Üniversitesi Kimya Mühendisliği Bölümü ÇÖZELTİ VE TÜRLERİ Eğer bir madde diğer bir madde içinde molekül, atom veya iyonları
Genel Kimya Bölüm 7: ÇÖZELTİLER VE ÇÖZÜNÜRLÜK Yrd. Doç. Dr. Mustafa SERTÇELİK Kafkas Üniversitesi Kimya Mühendisliği Bölümü ÇÖZELTİ VE TÜRLERİ Eğer bir madde diğer bir madde içinde molekül, atom veya iyonları
Çevre Kimyası 1, Örnek Çalışma Soruları
 Çevre Kimyası 1, Örnek Çalışma Soruları 1. Çözelti Hazırlama ve ph S.1.1. Bir atıksu arıtma tesisinde ph ayarlamak için çözeltinin her bir litresine 1 ml 0.05N lik H 2 SO ilavesi yapılması gerekmektedir.
Çevre Kimyası 1, Örnek Çalışma Soruları 1. Çözelti Hazırlama ve ph S.1.1. Bir atıksu arıtma tesisinde ph ayarlamak için çözeltinin her bir litresine 1 ml 0.05N lik H 2 SO ilavesi yapılması gerekmektedir.
Asitler, Bazlar ve Tuzlar
 1.Ünite Asitler, Bazlar ve Tuzlar Maddelerin Asitlik ve Bazik Özellikleri Test-1 1. I. Tatlarının ekşi olması II. Tahriş edici olması III. Ele kayganlık hissi vermesi Yukarıdaki özelliklerden hangileri
1.Ünite Asitler, Bazlar ve Tuzlar Maddelerin Asitlik ve Bazik Özellikleri Test-1 1. I. Tatlarının ekşi olması II. Tahriş edici olması III. Ele kayganlık hissi vermesi Yukarıdaki özelliklerden hangileri
ÖN SÖZ. Üniversiteye hazırlık yolunda, yeni sınav sistemine uygun olarak hazırladığımız YKS Alan Yeterlilik
 ÖN SÖZ Sevgili Öğrenciler, Üniversiteye hazırlık yolunda, yeni sınav sistemine uygun olarak hazırladığımız YKS Alan Yeterlilik Testi Kimya Soru Bankası kitabımızı sizlere sunmaktan onur duyuyoruz. Başarınıza
ÖN SÖZ Sevgili Öğrenciler, Üniversiteye hazırlık yolunda, yeni sınav sistemine uygun olarak hazırladığımız YKS Alan Yeterlilik Testi Kimya Soru Bankası kitabımızı sizlere sunmaktan onur duyuyoruz. Başarınıza
KONU: MOLEKÜLER BİYOLOJİDE TEMEL TEKNİKLER; Çözeltiler ve Tamponlar
 KONU: MOLEKÜLER BİYOLOJİDE TEMEL TEKNİKLER; Çözeltiler ve Tamponlar AMAÇ: - Moleküler Biyoloji laboratuvarında kullanılan çözeltileri ve hazırlanışlarını öğrenmek. - Biyolojik tamponların kullanım amaçlarını,
KONU: MOLEKÜLER BİYOLOJİDE TEMEL TEKNİKLER; Çözeltiler ve Tamponlar AMAÇ: - Moleküler Biyoloji laboratuvarında kullanılan çözeltileri ve hazırlanışlarını öğrenmek. - Biyolojik tamponların kullanım amaçlarını,
Asidite ölçümünde titrasyondaki ideal son nokta, mevcut asitlerin nötralizasyonu için stokiyometrik eşdeğer noktaya karşı gelir.
 S a y f a 1 ASİDİTE TAYİNİ YÖNTEM YÖNTEMİN ESASI VE PRENSİBİ Çözünebilir maddelerin hidrolizi ve ayrılmasının bir sonucu olarak örnekte bulunan hidrojen iyonları standart alkali ilavesiyle reaksiyona girerler.
S a y f a 1 ASİDİTE TAYİNİ YÖNTEM YÖNTEMİN ESASI VE PRENSİBİ Çözünebilir maddelerin hidrolizi ve ayrılmasının bir sonucu olarak örnekte bulunan hidrojen iyonları standart alkali ilavesiyle reaksiyona girerler.
ve denge sabitleri gibi bilgilere ulaşı şılabilir.
 ELEKTROANALİTİK K KİMYAK Elektrokimya: Maddenin elektrik enerjisi ile etkileşmesi sonucu ortaya çıkan fiziksel ve kimyasal enerjinin elektrik enerjisine çevrilmesini inceleyen bilim dalı. Elektroanalitik
ELEKTROANALİTİK K KİMYAK Elektrokimya: Maddenin elektrik enerjisi ile etkileşmesi sonucu ortaya çıkan fiziksel ve kimyasal enerjinin elektrik enerjisine çevrilmesini inceleyen bilim dalı. Elektroanalitik
TOPRAKLARIN KİMYASAL ÖZELLİKLERİ
 TOPRAKLARIN KİMYASAL ÖZELLİKLERİ Toprakların kimyasal özellikleri denince, genel olarak toprak reaksiyonu = toprak asitliği ve toprağın besin maddeleri bakımından karakteristikleri anlaşılmaktadır. İyon
TOPRAKLARIN KİMYASAL ÖZELLİKLERİ Toprakların kimyasal özellikleri denince, genel olarak toprak reaksiyonu = toprak asitliği ve toprağın besin maddeleri bakımından karakteristikleri anlaşılmaktadır. İyon
REDOKS TİTRASYONLARI (çözümlü problemler)
 REDKS TİTRASYNLARI (çözümlü problemler) Prof. Dr. Mustafa DEMİR http://web.adu.edu.tr/akademik/mdemir/ 009-19-REDKS Örnek 1 İyodu ayarlamak için 0.10 g As tartılmış ve gerekli işlemlerden sonra 18.67 ml
REDKS TİTRASYNLARI (çözümlü problemler) Prof. Dr. Mustafa DEMİR http://web.adu.edu.tr/akademik/mdemir/ 009-19-REDKS Örnek 1 İyodu ayarlamak için 0.10 g As tartılmış ve gerekli işlemlerden sonra 18.67 ml
HAZIRLAYAN Mutlu ŞAHİN. Hacettepe Fen Bilgisi Öğretmenliği. DENEY NO: 6 DENEYİN ADI: DOYMUŞ NaCl ÇÖZELTİSİNİN ELEKTROLİZİ
 HAZIRLAYAN Mutlu ŞAHİN Hacettepe Fen Bilgisi Öğretmenliği DENEY NO: 6 DENEYİN ADI: DOYMUŞ NaCl ÇÖZELTİSİNİN ELEKTROLİZİ DENEYİN AMACI: Doymuş NaCl çözeltisinin elektroliz sonucu elementlerine ayrışmasının
HAZIRLAYAN Mutlu ŞAHİN Hacettepe Fen Bilgisi Öğretmenliği DENEY NO: 6 DENEYİN ADI: DOYMUŞ NaCl ÇÖZELTİSİNİN ELEKTROLİZİ DENEYİN AMACI: Doymuş NaCl çözeltisinin elektroliz sonucu elementlerine ayrışmasının
T.C. MİLLÎ EĞİTİM BAKANLIĞI KİMYA TEKNOLOJİSİ BAZ MİKTARI TAYİNİ 524KI0048
 T.C. MİLLÎ EĞİTİM BAKANLIĞI KİMYA TEKNOLOJİSİ BAZ MİKTARI TAYİNİ 524KI0048 Ankara, 2011 Bu modül, mesleki ve teknik eğitim okul/kurumlarında uygulanan Çerçeve Öğretim Programlarında yer alan yeterlikleri
T.C. MİLLÎ EĞİTİM BAKANLIĞI KİMYA TEKNOLOJİSİ BAZ MİKTARI TAYİNİ 524KI0048 Ankara, 2011 Bu modül, mesleki ve teknik eğitim okul/kurumlarında uygulanan Çerçeve Öğretim Programlarında yer alan yeterlikleri
BASIN KİTAPÇIĞI ÖSYM
 BASIN KİTAPÇIĞI 00000000 AÇIKLAMA 1. Bu kitapç kta Lisans Yerle tirme S nav - Kimya Testi bulunmaktad r.. Bu test için verilen toplam cevaplama süresi 5 dakikadır.. Bu kitapç ktaki testlerde yer alan her
BASIN KİTAPÇIĞI 00000000 AÇIKLAMA 1. Bu kitapç kta Lisans Yerle tirme S nav - Kimya Testi bulunmaktad r.. Bu test için verilen toplam cevaplama süresi 5 dakikadır.. Bu kitapç ktaki testlerde yer alan her
İÇİNDEKİLER TEMEL KAVRAMLAR - 2. 1. Atomlar, Moleküller, İyonlar...36. 1.2. Atomlar...36. 1.2. Moleküller...37. 1.3. İyonlar...37
 vi TEMEL KAVRAMLAR - 2 1. Atomlar, Moleküller, İyonlar...36 1.2. Atomlar...36 1.2. Moleküller...37 1.3. İyonlar...37 2. Kimyasal Türlerin Adlandırılması...38 2.1. İyonların Adlandırılması...38 2.2. İyonik
vi TEMEL KAVRAMLAR - 2 1. Atomlar, Moleküller, İyonlar...36 1.2. Atomlar...36 1.2. Moleküller...37 1.3. İyonlar...37 2. Kimyasal Türlerin Adlandırılması...38 2.1. İyonların Adlandırılması...38 2.2. İyonik
K213 ANALİTİK KİMYA I
 K213 ANALİTİK KİMYA I Prof. Dr. Mustafa DEMİR 2008-2009 Eğitim Öğretim yılı Yaz OKULU M.DEMİR(ADU-AYDIN) 01-TEMEL KAVRAMLAR 1 Ders Programı Perşembe : 08.15-12.00 Cuma : 08.15-12.00 M.DEMİR(ADU-AYDIN)
K213 ANALİTİK KİMYA I Prof. Dr. Mustafa DEMİR 2008-2009 Eğitim Öğretim yılı Yaz OKULU M.DEMİR(ADU-AYDIN) 01-TEMEL KAVRAMLAR 1 Ders Programı Perşembe : 08.15-12.00 Cuma : 08.15-12.00 M.DEMİR(ADU-AYDIN)
PERİYODİK CETVEL-ÖSS DE ÇIKMIŞ SORULAR
 PERİODİK CETVEL-ÖSS DE ÇIKMIŞ SORULAR 1. Bir elementin periyodik cetveldeki yeri aşağıdakilerden hangisi ile belirlenir? A) Atom ağırlığı B) Değerliği C) Atom numarası D) Kimyasal özellikleri E) Fiziksel
PERİODİK CETVEL-ÖSS DE ÇIKMIŞ SORULAR 1. Bir elementin periyodik cetveldeki yeri aşağıdakilerden hangisi ile belirlenir? A) Atom ağırlığı B) Değerliği C) Atom numarası D) Kimyasal özellikleri E) Fiziksel
GİRİŞ ASİDİK KALKAN: MİDE
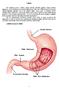 GİRİŞ Bir toplumun içecek kültürü, yaşam şekliyle yakından ilgilidir. Yaşam şeklinin değişmesi, içecek kültürünün de zamanla değişmesine neden olur. Doğal haliyle bu da içecek kültürü doğrudan ilişkilidir.
GİRİŞ Bir toplumun içecek kültürü, yaşam şekliyle yakından ilgilidir. Yaşam şeklinin değişmesi, içecek kültürünün de zamanla değişmesine neden olur. Doğal haliyle bu da içecek kültürü doğrudan ilişkilidir.
H 3 O + iyonuna hidronyum iyonu denir. Buna göre suyun iyon dengesi daha tam olarak şöyle yazılabilir : H 2 O(s) + H 2 O(s) H 3 O + (aq) + OH (aq)
 5. BÖLÜM ASİTLER, BAZLAR ve TUZLAR ASİTLER, BAZLAR ve TUZLAR Svante ARRHENIUS (1859-197) Elektrolitlerin ayrışması konusunda çağını aşandüşünceler üreten İsveç li kimyacı Arrhenius, 190 te Nobel Ödülünü
5. BÖLÜM ASİTLER, BAZLAR ve TUZLAR ASİTLER, BAZLAR ve TUZLAR Svante ARRHENIUS (1859-197) Elektrolitlerin ayrışması konusunda çağını aşandüşünceler üreten İsveç li kimyacı Arrhenius, 190 te Nobel Ödülünü
GRUP:İNDİKATÖR Mustafa ORDUERİ
 İLKÖĞRETİMDE DOĞAL BELİRTEÇLER KULLANILARAK ASİT ve BAZLARIN BELİRLENMESİ Asıl alt başlık stilini düzenlemek için tıklatın GRUP:İNDİKATÖR Mustafa ORDUERİ TUBİTAK BİDEB YİBO ÖĞRETMENLERİ FEN ve TEKNOLOJİ-FİZİK,KİMYA,BİYOLOJİ-MATEMATİK
İLKÖĞRETİMDE DOĞAL BELİRTEÇLER KULLANILARAK ASİT ve BAZLARIN BELİRLENMESİ Asıl alt başlık stilini düzenlemek için tıklatın GRUP:İNDİKATÖR Mustafa ORDUERİ TUBİTAK BİDEB YİBO ÖĞRETMENLERİ FEN ve TEKNOLOJİ-FİZİK,KİMYA,BİYOLOJİ-MATEMATİK
GENEL KİMYA. Yrd.Doç.Dr. Tuba YETİM
 GENEL KİMYA KİMYASAL REAKSİYONLAR Kimyasal Tepkime Kimyasal tepkime, Bir ya da birkaç maddenin (tepkenler) yeni bir bileşik grubuna (ürünler) dönüştürülmesi işlemidir. Tepkenler Ürünler NO + 1/2 O 2 NO
GENEL KİMYA KİMYASAL REAKSİYONLAR Kimyasal Tepkime Kimyasal tepkime, Bir ya da birkaç maddenin (tepkenler) yeni bir bileşik grubuna (ürünler) dönüştürülmesi işlemidir. Tepkenler Ürünler NO + 1/2 O 2 NO
ASİTLER-BAZLAR VE TUZLAR SU ARITIMI. Hazırlayan: Arif Özgür ÜLGER
 ASİTLER-BAZLAR VE TUZLAR SU ARITIMI Hazırlayan: Arif Özgür ÜLGER ASİTLER Sulu çözeltilerinde Hidrojen İyonu maddelere asit denir. veren HCI H + + CI CH 3 COOH CH 3 COO + H + ASİTLERİN GENEL ÖZELLİKLERİ
ASİTLER-BAZLAR VE TUZLAR SU ARITIMI Hazırlayan: Arif Özgür ÜLGER ASİTLER Sulu çözeltilerinde Hidrojen İyonu maddelere asit denir. veren HCI H + + CI CH 3 COOH CH 3 COO + H + ASİTLERİN GENEL ÖZELLİKLERİ
KLOR (Cl2) ANALİZ YÖNTEMİ
 S a y f a 1 KLOR (Cl2) ANALİZ YÖNTEMİ YÖNTEMİN ESASI VE PRENSİBİ Klor, ph 8 de veya daha düşük bir ph da potasyum iyodür çözeltisinden iyotu serbest bırakacaktır. Serbest iyot, indikatör olarak nişasta
S a y f a 1 KLOR (Cl2) ANALİZ YÖNTEMİ YÖNTEMİN ESASI VE PRENSİBİ Klor, ph 8 de veya daha düşük bir ph da potasyum iyodür çözeltisinden iyotu serbest bırakacaktır. Serbest iyot, indikatör olarak nişasta
ASĐTLĐK-BAZLIK KAVRAMI
 ASĐTLĐK-BAZLIK KAVRAMI DERS SORUMLUSU: PROF. DR. ĐNCi MORGĐL HAZIRLAYANLAR: NAZLI KIRCI ESRA ÇECE SUPHĐ SEVDĐ SÜRE:10 DERS SAATĐ HEDEF VE DAVRANIŞLAR HEDEF:Asitlik ve bazlık konusunu kavratabilme DAVRANIŞLAR
ASĐTLĐK-BAZLIK KAVRAMI DERS SORUMLUSU: PROF. DR. ĐNCi MORGĐL HAZIRLAYANLAR: NAZLI KIRCI ESRA ÇECE SUPHĐ SEVDĐ SÜRE:10 DERS SAATĐ HEDEF VE DAVRANIŞLAR HEDEF:Asitlik ve bazlık konusunu kavratabilme DAVRANIŞLAR
Her madde atomlardan oluşur
 2 Yaşamın kimyası Figure 2.1 Helyum Atomu Çekirdek Her madde atomlardan oluşur 2.1 Atom yapısı - madde özelliği Elektron göz ardı edilebilir kütle; eksi yük Çekirdek: Protonlar kütlesi var; artı yük Nötronlar
2 Yaşamın kimyası Figure 2.1 Helyum Atomu Çekirdek Her madde atomlardan oluşur 2.1 Atom yapısı - madde özelliği Elektron göz ardı edilebilir kütle; eksi yük Çekirdek: Protonlar kütlesi var; artı yük Nötronlar
A A A A A A A A A A A
 LYS 2 KİMYA TESTİ 1. Bu testte 30 soru vardır. 2. Cevaplarınızı, cevap kâğıdının Kimya Testi için ayrılan kısmına işaretleyiniz. 1. Eşit miktarlardaki suda; 3.. 36 gram Fe(NO 3 ) 2. n mol NaCl çözülerek
LYS 2 KİMYA TESTİ 1. Bu testte 30 soru vardır. 2. Cevaplarınızı, cevap kâğıdının Kimya Testi için ayrılan kısmına işaretleyiniz. 1. Eşit miktarlardaki suda; 3.. 36 gram Fe(NO 3 ) 2. n mol NaCl çözülerek
ASİT-BAZ TİTRASYONU ve UYGULAMALARI. (Çözümlü Problemler)
 ASİT-BAZ TİTRASYONU ve (Çözümlü Problemler) Prof. Dr. Mustafa DEMİR 1 ASİT-BAZ TİTRASYONU Ayarlı Asit Çözeltisinin Hazırlanması Asit Çözeltisinin Ayarlanması (Na CO 3, Na C O 4, KHCO 3, boraks Na B 4 O
ASİT-BAZ TİTRASYONU ve (Çözümlü Problemler) Prof. Dr. Mustafa DEMİR 1 ASİT-BAZ TİTRASYONU Ayarlı Asit Çözeltisinin Hazırlanması Asit Çözeltisinin Ayarlanması (Na CO 3, Na C O 4, KHCO 3, boraks Na B 4 O
KİMYASAL DENGE. AMAÇ Bu deneyin amacı öğrencilerin reaksiyon denge sabitini,k, deneysel olarak bulmalarıdır.
 KİMYASAL DENGE AMAÇ Bu deneyin amacı öğrencilerin reaksiyon denge sabitini,k, deneysel olarak bulmalarıdır. TEORİ Bir kimyasal tepkimenin yönü bazı reaksiyonlar için tek bazıları için ise çift yönlüdür.
KİMYASAL DENGE AMAÇ Bu deneyin amacı öğrencilerin reaksiyon denge sabitini,k, deneysel olarak bulmalarıdır. TEORİ Bir kimyasal tepkimenin yönü bazı reaksiyonlar için tek bazıları için ise çift yönlüdür.
ÜNİTE 11. Asitler ve Bazlar. Amaçlar. İçindekiler. Öneriler
 ÜNİTE 11 Asitler ve Bazlar Amaçlar Bu üniteyi çalıştıktan sonra, Asit ve baz kavramlarını bilecek, Zayıf asit, zayıf baz, kuvvetli asit, kuvvetli baz kavramlarını tanıyacak, Titrasyon ve ph kavramlarını
ÜNİTE 11 Asitler ve Bazlar Amaçlar Bu üniteyi çalıştıktan sonra, Asit ve baz kavramlarını bilecek, Zayıf asit, zayıf baz, kuvvetli asit, kuvvetli baz kavramlarını tanıyacak, Titrasyon ve ph kavramlarını
