MADDE-BİLEŞİK-KARIŞIM
|
|
|
- Altan Behçet
- 8 yıl önce
- İzleme sayısı:
Transkript
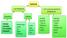
1 MADDE-BİLEŞİK-KARIŞIM MADDE SAF MADDELER KARIŞIMLAR ELEMENT BİLEŞİK HOMOJEN KAR. HETEROJEN KARIŞIM Metal Ametal Soygaz Süspansiyon Emilsiyon Adi karışım MADDE: Boşlukta yer kaplayan belli bir kütlesi ve eylemsizliği olan her şey madde denir. Kütle ve hacim maddelerde ortak olan iki özeliktir. HACİM: Maddenin uzayda kapladığı alana denir. Hacim birimleri: m3, dm3, cm 3, mm 3, Lt KÜTLE: Maddenin değişmeyen miktarıdır. Kütle birimleri: kg, gr EYLEMSİZLİK: Hareket halindeki bir cismi durdurmak istediğimizde veya duran bir cismi hareket ettirmek istediğimizde cismin göstermiş olduğu tepkiye denir. AYIRTEDİCİ ÖZELLİK: Maddelerin birbirinden ayrılmasını sağlayan özkütle, erime noktası, donma noktası, kaynama noktası, yanma gibi özellikler madde miktarıma bağlı değildir. ÖZKÜTLE (Yoğunluk): Bir maddenin birim hacminin kütlesine denir. Birimleri : gr/cm 3 SAF MADDE: Fiziksel yollarla kendisinden başka maddelere ayrışmayan maddelerdir. Saf maddelerin belirli erime ve kaynama noktaları vardır. Doğada 2 çeşit saf madde vardır. 1-ELEMENT: Aynı tür atomların bir araya gelerek oluşturdukları fiziksel ve kimyasal yollarla başka maddelere ayrıştırılamayan saf maddelerdir. Demir (Fe), karbon (C ) 2-BİLEŞİK: İki veya daha fazla türdeki atomların belli oranlarda birleşerek oluşturdukları değişik özellikteki saf maddelerdir. Su ( H 2 O ) KARIŞIMLAR KARIŞIM: İki veya daha fazla saf maddenin değişik oranlarda karıştırılmasıyla oluşur. Kum ve su karışımı. Karışımlar istenilen oranda yapılabilir. Yani rastgele yapılabilir. Karışımlar homojen ve heterojen karışımlar olmak üzere iki sınıfta incelenir. 1-HOMOJEN KARIŞIMLAR: Özellikleri her yerde aynı olan karışımlardır. Örneğin; çözeltiler, alaşımlar, gaz karışımları vb. 2-HETEROJEN KARIŞIM: Özellikleri her yerde aynı olmayan karışımlardır. a-) SÜSPANSİYON :Bir katının, bir sıvı içerisinde çözünmeden çok küçük zerreler halinde dağılmasıyla oluşan sistemlerdir. (Katı + Sıvı karışımlar) Örnek olarak ; şeker-su karışımı. b-) EMİLSİYON :Bir sıvının bir başka sıvı içinde çözünmeden çok küçük zerreler halinde dağılmasıyla oluşan heterojen karışımlara denir.(sıvı + Sıvı karışımlar) örnek: su-zeytinyağı. c-) ADİ KARIŞIM: İki veya daha fazla katı maddenin karıştırılmasıyla oluşan heterojen karışımlara denir. (Katı + Katı karışımı) Örnek olarak; kum ve taş karışımı. Karışımların özellikleri 1- Karışımları istediğimiz maddelerle yapabiliriz. 2- Karışımları istediğimiz oranlarda yapabiliriz. 3- Karışımı oluşturan maddeler özelliklerini kaybetmezler. 4- Homojen veya heterojen olabilir. 5- Belli bir formülleri yoktur.
2 6- Saf değildirler. 7- Karışımı oluşturan bileşenler her oranda karıştırılabilir. ELEMENT Tek cins atomdan oluşmuş saf maddelere element denir. Örnek olarak Demir (Fe), Bakır (Cu), vb. Saf yapıdadırlar bu nedenle belirli erime ve kaynama noktaları vardır. Homojendirler. En küçük yapıtaşları atomlardır. Kimyasal ve fiziksel yolarla daha küçük parçalara bölünemezler. Reaksiyonlara girerek bileşikleri oluştururlar. Doğada bulunan elementler 3 grupta incelenir. Bunlar: metal, ametal ve soygazlardır. BİLEŞİKLER İki veya daha fazla elementin belirli oranlarda bir araya gelerek, kendi özelliklerini kaybedip oluşturdukları yeni saf maddelere bileşik denir. Örnek olarak iki hidrojen atomu (H) ve bir oksijen (O) atomu birleşerek H 2 O (su) bileşiğini oluştururlar. Bileşikler kendilerini oluşturan elementlerin özelliğini göstermezler. Saf maddelerdir. Belirli erime ve kaynama noktalarına sahiptirler. Bileşiklerin özelliğini gösteren en küçük yapıtaşına molekül denir. Bileşikler farklı cins atomlardan oluşur. Kendini oluşturan atomlara kimyasal yöntemlerle ayrıştırılabilir. Bileşiği oluşturan atomlar arasında sabit kütle oranları vardır. Bileşikler formüllerle gösterilir. ÖRNEK: I. Saf madde olması II. Kendinden başka maddelere ayrışmaması. III. İki farklı maddenin birleşmesiyle oluşması. IV. Elektriği iletmesi. Yukardaki ifadelerden hangisi veya hangileri bir maddenin kesinlikle element olduğunu belirler. CEVAP: I. Saf maddeler element ve bileşik olabilir. II. Kendinden başka maddelere ayrışmayan maddeler elementlerdir. III. İki farklı maddenin birleşmesiyle oluşan maddelere bileşik denir. IV. elektriği ileten maddeler metal veya elektrolit çözeltiler olabilir. O halde doğru cevap sadece II. seçenektir. MADDEKİ DEĞİŞMELER Fiziksel Değişmeler Kimyasal Değişmeler Fiziksel Değişme: Maddenin molekül yapısı bozulmadan oluşan değişmelerdir. Maddenin şekli değişir. Madde katı, sıvı veya gaz halinde bulunabilir. Isı etkisi ile bir halden başka bir hale dönüşebilir. Bunların hepsi fiziksel değişime örnektir. Fiziksel değişmenin temel özelliği, maddenin tekrar eski haline dönebilmesidir. Eritilen mumun sonra donarak eski haline gelmesi vb.
3 Kimyasal Değişme: Maddenin molekül yapısındaki değişikliklerdir. Bu değişmelerde madde yeni özellikte başka maddelere dönüşür. Moleküller oluşurken, atomların özellikleri değişir. 2 Hidrojen + Oksijen = Su Hidrojen ve oksijen yanıcı ve yakıcı maddelerdir fakat su ne yanıcı ne de yakıcıdır. Kağıdın yakılması, un helvası yapımı, mumun yanması, demirin paslanması, sütün yoğurda dönüşmesi, birer kimyasal değişmedir. Kimyasal değişme sonrası eski madde yok olur. Başka bir örnek yanan kağıt kimyasal değişmeye örnektir. ÖRNEK: Aşağıdakilerden hangisi veya hangileri fiziksel olay değildir? (1) Odunun yanması (2) Suyun buharlaşması (3) Tuzun suda çözünmesi (4) Yazın elektrik tellerinin uzaması CEVAP : (1) Odunun yanması; yanma reaksiyonlar kimyasal bir olaydır. (2) Suyun buharlaşması fiziksel bir olaydır. Çünkü madde hal değiştirmiştir yapısı değişmemiştir. (3) Tuzun suda çözünmesi fiziksel bir olaydır. Maddenin yapısında bir değişme yok. (4) Yazın elektrik tellerinin uzaması fiziksel bir olaydır. Telin yapısı değişmemiş sadece genleşme olayı olmuştur. NOT: Yanma olayları, yeni bir bileşik oluşturma kimyasal olaylardır. Ancak genleşme, çözünme ve hal değişiklikleri fiziksel olaylardır. ATOM ve MOLEKÜLLER ATOM: Bir elementin tüm özelliklerini taşıyan en küçük yapıtaşına denir. MOLEKÜL: Bir bileşiğin tüm özelliklerini taşıyan ve bölünemeyen en küçük parçasıdır. ATOMUN YAPISI: Atomlar iki kısımdan oluşur. Çekirdek ve çekirdek etrafında belli yörüngede hareket eden elektronlardan oluşur. Çekirdekte proton protonlar ve nötronlar bulunur. PROTON: Atom çekirdeğinde yer alan +1 yüklü parçacıklardır Kütlesi 1 akb dir NÖTRON: Atom çekirdeğindeki yüksüz parçacıklardır. Kütlesi 1 akb dir. Çekirdekteki proton ve nötron sayıları toplamı kütle numarasını verir. ELEKTRON: - yüklü parçacıklardır. Kütlesi yok denecek kadar azdır. Kütlesi 1/2000 akb dir. Yüksüz atomlarda elektron sayısı proton sayısına eşittir. YÜK: Bir atomun aldığı ve verdiği elektron sayısıdır. Yük proton ve elektron sayıları farkına eşittir. Kütle Numarası = proton say. + nötron say. Atom Num.= proton say. K.N = p + n Nötr atomlarda: proton sayısı = elektron eşittir. A.N = p Örnek: Bir X atomunun nötron sayısı 18, elektron sayısı ise 17 olduğuna göre X in proton sayısı atom numarası ve kütle numarası nedir? Örnek: Bir A elementinin kütle numarası 28 ve proton sayısı nötron sayısından 2 eksik olduğuna göre A nın atom numarası nedir?
4 İYON: (+) ve (-) yüklü atom yada atom gruplarına İYON denir. (+) yüklü iyonlara KATYON ; (-) İyonlara da ANYON denir. İyon yükünü bulurken proton sayısından elektron sayısı çıkarılır. İ.Y. = p - e Örnek: X -3, Y +2, Z -1 iyonları 3 er elektron verirlerse iyon yükleri ne olur? Çözüm: X için İyon yükü = -3 demek iyonun elektron sayısı, proton sayısından 3 fazla demektir. 3 e verirse proton sayısı ile elektron sayısı birbirlerine eşit olur ve atom nötr olur. Y için İyon yükü = +2 demek elektron sayısı, proton sayısından 2 az demektir 3 elektron daha verirse ; elektron sayısı 5 eksik olur. O halde yükü -5 olur. Z için İyon yükü = -1 demek iyonun elektron sayısı, proton sayısından 1 fazladır. 3 elektron verirse. Elektron sayısı, proton sayısından 2 az olur. Yükü +2 olur. X 0, Y -5, Z +2 Örnek: X -1 ve X +3 iyonlarının toplam elektron sayısı 34 tür. X atomunun çekirdek yükü nedir? Çözüm: X atomunun elektron sayısına t diyelim. X -1 atomunun elektron sayısına t + 1 olur Toplam e. Sayısı = ( t + 1) + ( t 3) X +3 atomunun elektron sayısına t - 3 olur 34 = 2t 2 X = t = 16 elektron İZOTOP: Atom numaraları aynı kütle numaraları birbirinden farklı olan atomlar birbirinin izotopudur. Ör: C 12 6, C 13 6 birbirinin izotopudur. Hidrojenin 3 izotopu vardır. 1 Hidrojen : H 1 Proton sayısı : 1 ; nötron sayısı : 0 2 Döteryum : H 1 Proton sayısı : 1 ; nötron sayısı : 1 Trityum 3 : H 1 Proton sayısı : 1 ; nötron sayısı : 2 İzotop atomların kimyasal özellikleri aynıdır, fakat fiziksel özellikleri farklıdır. İzotop iyonlar için elektron sayıları farkı ise kimyasal özelikleri de farklıdır. ÖRNEK : Element Atom No Kütle No P + e - n 0 X Y Z Yukarıdaki çizelgede birbirinin izotopu olan atom çiftleri aşağıdakilerden hangisidir? A-) X-Z B-) Y-Z C-) X-Y D-) X-Y-Z PERİYODİK CETVEL Periyodik cetvel elementleri gösteren ve özellikleriyle ilgili bilgi veren bir tablodur. Bu tabloda elementler atom numaralarına göre sıralanmıştır. Yatay sıralara periyot ; düşey sıralara ise grup denir. Aynı gruptaki elementler birbirleriyle benzer özellik gösterirler. Periyodik cetvelin en sağındaki grupta yer alan elementlere soygaz (asalgaz) denir. Periyodik cetveli 3 ana grupta inceleyebiliriz. Bunlar metal, ametal ve soygazdır. Periyodik cetvelde bazı grupların özel adı vardır. 1. Grup elementler : Alkali metaller 7. Grup elementler : Halojenler 2. Grup elementler : Toprak alkali metaller 8. Grup elementler : Soygazlar
5 METALLER AMETALLER SOYGAZLAR 1-) e vermeye yatkındırlar 1-) e almaya yatkındırlar 1-) e alıp vermezler 2-) Tel ve levha haline alabilirler 2-)Dövülürlerse toz halini alırlar )Elektriği iletirler 3-)Elektriği iletmezler )Parlaktırlar 4-)Mattırlar )Genelde katı haldedirler 5-)katı,sıvı ve gaz haldedirler. 5-)Gaz haldedirler 6-)Aralarında bileşik yapmazlar. 6-)Kendi aralarında bileşik Ancak alaşım yapabilirler. yapabilirler. PERİYODİK CETVELİN ÖZELLİKLERİ Periyodik cetvelde soldan sağa gidildikçe: 1. Atom numarası ve kütle numarası artar. 2. Atom çapı azalır. 3. Elektron ilgisi artar periyot 4. Elektron koparmak zorlaşır. 5. Metallik özellik azalır, ametallik artar. 6. Bazik özellik azalır, asidik özellik artar. grup Per. cetvelde yukarıdan aşağıya inilince 1. Atom numarası ve kütle numarası artar. 2. Atom çapı artar. 3. Elektron ilgisi azalır 4. Elektron koparmak kolaylaşır. 5. Metallik özellik artar, ametallik azalır. 6. Bazik özellik artar, asidik özellik azalır. Örnek: 3. Periyot 6A grubunda bulunan X elementi ile 4. Periyot 1A grubunda bulunan Y elementinin oluşturacağı bileşiğin bir molekülünde kaç elektron vardır? Çözüm: X : 2, 8, 6 Yükü = - 2 olur. Y : 2, 8, 8, 1 Yükü = +1 olur. Y +1 X -2 çaprazlama yapılırsa Y 2 X bileşiği oluşur. 2.Y + 1.X = = 54 e Bileşiklerin Adlandırılması: Bileşik formülleri element sembollerinden yararlanılarak yazılır. Formül yazılırken önce pozitif değerli atom yazılır. Daha sonra negatif değerli atom veya kök yazılır. Bileşik oluşumundaki alınan ve verilen elektron sayıları eşitlenir. Al 3 +2 Br 2-3 H 2 +1 O -2 Ca 3 +2 N 2-3 Ametal Ametal Bileşiklerin Adlandırılması I. Ametalin atom sayısı + I. Ametalin adı + II. Ametalin sayısı + II. Ametalin adı + Ek Latince Sayılar: 1- Mono 2- Di 3- Tri 4- Tetra 5- Penta
6 6- Heksa 7- Hepta 8- Okta 9- Nona 10- Deka O : Oksit ÖRNEK: N 2 O 5 = di azot penta oksit S : Sülfür CO 2 = mono karbon di oksit F,Cl,Br,I ür eki CO = Karbon monoksit N : Nitrür PCl 3 = fosfor tri oksit P 2 O 5 = di fosfor penta oksit Metal Ametal Bileşiklerin Adlandırılması Metal Adı + Ametal Adı veya Metal Adı + Metal Değerliği + Ametal Adı Na +1 Cl -1 Sodyum klorür Fe +2-1 Cl 2 Demir II klorür Ca +2 O -2 Kalsiyum oksit Fe +3-1 Cl 2 Demir III klorür Metal Kök Bileşiklerin Adlandırılması Metal Adı + Kök Adı SO 4 Sülfat CO 3 Karbonat NO 3 Nitrat PO 4 Fosfat Na 2 CO 3 Sodyum Karbonat NaHCO 3 Soyum bikarbonat CaSO 4 Kalsiyum Sülfat Fe +3 2 (SO 4 ) -2 3 Demir III sülfat ELEKTRON DAĞILIMI Atomun çekirdeği etrafında elektronların dizildiği yörünge adını verdiğimiz enerji katmanları vardır. Çekirdeğin etrafından başlayarak yörünge şeklinde sıralanırlar. Her yörüngede bulunacak elektron sayısı ise 2n 2 ile hesaplanır. n = yörünge sayısıdır. 1.yörünge = 2 2.yörünge = 8 3.yörünge = 18 4.yörünge = 32 Dış yörüngedeki elektronlar kolayca atomdan ayrılabilir. İlk yörüngedeki elektronlar kolayca ayrılamaz. Son yörüngede en fazla 8 bir önceki yörüngesinde ise en fazla 18 elektron bulunur. Atomlar son yörüngelerini ya 8 ya da 2 ye tamamlamak ister. Böylece soygaza benzemek ister. (okted-dukted kuralı) Hidrojen = 1 Neon = 2 8 Potasyum = Helyum = 2 Sodyum = Kalsiyum = Lityum = 2 1 Magnezyum= Berilyum = 2 2 Alüminyum= Bor = 2 3 Silisyum = Karbon = 2 4 Fosfor = Azot = 2 5 Kükürt = Oksijen = 2 6 Klor = Flor = 2 7 Argon = NOT: Son yörüngesinde 1, 2 veya 3 elektron bulunan elementler metaldir. Son yörüngesinde 4, 5,6 veya 7 elektron bulunduran elementler ametaldir. Son yörüngesinde 8 elektron bulunduran elementler soygazdır.
7 ATOMLAR ARASI BAĞLAR : Atomları bir arada tutan kuvvetlere kimyasal bağ adı verilir. Tuğla arasına konan harç gibi. İyonik ve Kovalent bağ olmak üzere iki çeşittir. İYONİK BAĞ: Metal ve ametal atomlarının bir araya gelmesiyle oluşur. Ametal elektron alarak (-), metal ise elektron vererek (+) elektrikle yüklenir. Bu şekilde elektrikle yüklü atomlara İYON denir. Bu şekildeki elektron alışverişine ise İYONİK BAĞ veya Elektriksel Çekim Kuvveti denir. ÖRNEK: NaCl, LiF, MgCl, CaCl 2, CaO vb. KOVALENT BAĞ: İki ametal atomunun bir araya gelip karşılıklı olarak birbirlerinin elektronlarını ortak kullanmasıyla oluşan bağa Kovalent Bağ denir. Her iki ametalde elektron alarak (-) yüklenmek ister. Bu nedenle elektron çiftlerini ortak kullanırlar. ÖRNEK: H2, Cl 2, N 2, O 2, F 2, NH 3,H 2 O İYON NEDİR? : Elektrikle yüklü atom veya atom gruplarına İYON denir. ÖRNEK: Aşağıdaki bileşiklerin kimyasal bağlarının türünü söyleyiniz? [ Na: 11; CI: 17; C : 6; O: 8 Mg: 12; F: 9; H: 1 ] A-) NaCI B-) CO 2 C-) MgF 2 D-) H 2 O Cevap: A-) Na : > metal CI : > ametal metal--ametal arasında iyonik bağ vardır. B-) C : > ametal O : > ametal ametal ametal arasında kovalent bağ vardır. C-) Mg: > metal F : > ametal metal ametal arasında iyonik bağ vardır. D-) H : > ametal O : > ametal ametal ametal arasında kovalent bağ vardır. NOT: Hidrojenin son yörüngesinde bir elektron olmasına rağmen ametal özelliği gösterir. SORULAR: 1- İyonik bağ nasıl gerçekleşir? 2- Kovalent bağ nasıl gerçekleşir? 3- Kimyasal bağ nedir? 4- Elektronlar hangi yörüngede en zayıftır? 5- Elektronlar hani durumda yörüngeden kopmaz? ÇÖZELTİLER Çözelti: iki veya daha fazla saf maddenin birbiriyle homojen bir şekilde karıştırılmasıyla elde edilen karışımlara denir. Bir çözeltide çözücü ve çözünen diye iki bileşen vardır. Miktarca fazla olana çözücü az olana da çözünen denir. Çözeltiler madde miktarına göre Derişik ve Seyreltik çözelti diye ikiye ayrılır. 1-Derişik Çözelti: Çözüneni fazla, çözeni az olan çözeltidir. 2-Seyreltik Çözelti: Çözüneni az, çözücüsü fazla olan çözeltilerdir. Çözünürlüklerine göre de çözeltiler 3 e ayrılırlar. 1-Doymamış Çözeltiler 2-Doymuş Çözeltiler 3-Aşırı Doymuş Çözeltiler
8 DOYMUŞ ÇÖZELTİ: Belli sıcaklıkta daha fazla madde çözemeyen çözeltidir. DOYMAMIŞ ÇÖZELTİ: Belli sıcaklıkta daha fazla çözebilen çözeltidir. ( İYON ÇÖZELTİ) ELEKTROLİT ÇÖZELTİ: Yapılarında (+) ve (-) yüklü iyon bulunduran maddelerin çözeltileridir. Asit,baz ve tuzlar. Elektriği iletir. ELEKTROLİT OLMAYAN ÇÖZELTİ (MOLEKÜL ÇÖZELTİ): Yapılarında (+) veya (-) yüklü iyon bulundurmayan maddelerin çözeltileridir. Bunlar nötrdür. Şeker ve alkol gibi. Elektriği iletmez. ÖRNEK: Şeker ve tuz suda çözünür. Tuz alkolde, alkol suda çözünmez. ÇÖZÜNÜRLÜK: Belli şartlarda birim miktar çözücüde çözünecek olan maksimum çözünen miktarıdır. Katı ve sıvıların çözünürlüğü sıcaklık artışıyla artar. Gazların ise sıvılardaki çözünürlüğü sıcaklık artıkça azalır. Gazların sıvılardaki çözünürlüğü basınç artıkça artar. ÇÖZÜNÜRLÜK KATI VE SIVI ÇÖZÜNÜRLÜK GAZ GAZ SICAKLIK SICAKLIK ÇÖZÜNME HIZINA ETKİ EDEN FAKTÖRLER: 1-Sıcaklık 2-Karıştırma 3-Tanecik büyüklüğü ÇÖZELTİLERİN ÖZELLİKLERİ: 1-Homojendirler 2-İyonik katıların suda çözünmesiyle oluşan çözeltiler elektriği iletirler. Molekül yapılı katıların suda çözünmesiyle oluşan çözeltiler elektriği iletmezler. 3-Çözeltilerin kaynama noktaları sıvının kaynama noktasından büyüktür. Donma noktası ise küçüktür. Kısaca kaynama noktası yükselmesi; Donma noktası alçalması gerçekleşir. Aynı zaman da çözeltilerin yoğunluğu sıvının yoğunluğundan fazladır. ASİTLER VE BAZLAR Suda çözündüklerinde H +1 iyonu veren maddelere asit ; Suda çözündüklerinde OH -1 iyonu veren maddelere baz denir. Asitlerle bazların birleşmesiyle oluşan maddelere tuz denir. ASİT + BAZ TUZ + SU Bu olaya nötralleşme denir. ASİTLERİN ÖZELLİĞİ: 1. Tatları ekşi olup, yakıcı olan maddelerdir. 2. Sulu çözeltileri elektrik akımını iletir. 3. Mavi turnusol kağıdını kırmızıya çevirirler.
9 4. Bakır,civa, gümüş, altın ve platin dışındaki metallere etki ederek H 2 gazı çıkarırlar. 5. ph ları 7 den küçüktür.asit çözeltisine su eklendikçe ph büyür. BAZLARIN ÖZELLİĞİ: 1. Tatları acı olup kaygandırlar. 2. Sulu çözeltileri elektrik akımını iletir. 3. Kırmızı turnusol kağıdını maviye çevirirler. Fenoftalin ile pembeye dönerler. 4. Alüminyum, çinko, kalay, kurşun, krom gibi amfoter maddelerle tepkime verip H 2 gazı ve tuz oluşturur. Zn + 2KOH H 2 + K 2 ZnO 2 5. Asitlerle birleşerek tuz ve su oluştururlar. 6. ph ları 7 den büyüktür. Baz çözeltisine su eklendikçe ph azalır. TUZLARIN ÖZELLİKLERİ: 1. Suda çözündüklerinde iyonlara ayrışırlar. 2. Sulu çözeltileri elektriği iletir. 3. ph leri 7 dir. MOL KÜTLESİ Mol kilogram, saniye, metre gibi üretilmiş bir ölçü birimidir. Kimyada madde miktarını belirtmek için mol kavramı kullanılır. Tane ile atomları belirtmek pirinç alırken tane hesabıyla almak gibi bir şey olurdu. Bu nedenle bileşiklerin veya atomların madde miktarını belirtirken mol kavramı kullanılır. Bir elementin veya bileşiği oluşturan elementlerin toplam kütlesine Mol Kütlesi denir. Mol kütlesi; atom-gram, formül-gram ve molekül-gram terimlerinin yerine kullanılır. Her elementin bir atom ağırlığı (kütle No) vardır. Her elementin atom kütlesi kadar gram miktarında ise,eşit SAYIDA ATOM bulunur. Yani 12 gram C'da,56 gram Fe'de,32 gram S'de eşit sayıda atom bulunur. Bu sayı değeri ise 6, tanedir. Bu sayıya AVAGADRO SAYISI denir. ÖRNEKLER : Na ---> 1 atom-gram = 1 mol ( 23 gram) = 6, Na ---> 2 atom-gram =2 mol (2.23=46 gram) = 2. Avagadro sayısı H 2 SO 4 --->1 formül-gram = 1 molekül-gram = 1 mol = 98 gram = 6, H 2 SO > 2 formül-gram =2 molekül-gram = 2 mol = 2.98= 196 gram =2. Avagadro sayısı PROBLEM : 1 mol H 2 SO 4 de kaç tane atom vardır? ÇÖZÜM : H 2 SO 4 = 2mol H + 1 mol S + 4 mol O atomu vardır. H 2 SO 4 = = 7 mol atom vardır. O halde H 2 SO 4 = 7. 6, = 42, tane atom vardır. PROBLEM : 1 mol NH 3 molekülündeki atom sayısı kaçtır? ÇÖZÜM : NH 3 = 1 mol N + 3 mol H = 4 mol atom vardır. O halde NH 3 = 4. 6, = 24, tane atom vardır. PROBLEM : 1 mol H atomunda atom sayısı kaçtır? ÇÖZÜM : H = 1 mol H = 1 mol atom vardır. O halde H = 6, tane atom vardır. PROBLEM : 1 Mol H 2 molekülünde atom sayısı kaçtır? ÇÖZÜM : H 2 = 2 mol H = 2 mol atom vardır. O halde H 2 = 2 * 6, tane atom vardır. PROBLEM : 1 mol H 2 SO 4 de kaç tane H 2 SO 4 molekülü vardır? ÇÖZÜM : H 2 SO 4 = 1 mol = Avagadro sayısı kadar H 2 SO 4 molekülü vardır.
10 REAKSİYONDA MADDE DEĞİŞİMİ Reaksiyona giren elementler veya bileşikler reaksiyon sonucunda kendine benzemeyen ÜRÜN denilen yeni maddeler oluşturur. Reaksiyonlar denklemle gösterilir. Sol da giren madde,sağda çıkan maddeler yazılır. ÖRNEK : Demir + Kükürt +ısı > Demirsülfür Zn + 2HCI > ZnCI 2 + H 2 CuO + H > Cu + H 2 O EKZOTERMİK REAKSİYON ( ISI VEREN REAKSİYON ): Reaksiyonda dışarıya ısı enerjisi veriliyorsa Ekzotermik reaksiyondur. Kibritin, mumun, kömürün yanması gibi. ÖRNEKLER : C + O > CO 2 + Isı Na 2 CO 3 + H 2 SO > Na 2 SO 4 + CO 2 + H 2 O + Isı Mg + 1/2O > MgO + Isı K + 1/2CI > KCI + ısı(enerji) 2Fe + 3/2O > Fe 2 O 3 + ısı H 2 + 1/2O > H 2 O + ısı ENDOTERMİK REAKSİYON ( ISI ALAN REAKSİYON ) Reaksiyona ısı enerjisi veriliyorsa endotermik reaksiyondur. ÖRNEKLER : CaCO 3 + ısı > CaO + CO 2 KCIO 3 + ısı > KCI + 3/2 O 2 H 2 O + ısı > H 2 + 1/2O 2 NH 4 CI + ısı > NH 3 + HCI REAKSİYONDA KÜTLENİN KORUNUMU: Reaksiyonlarda giren ürün ile çıkan ürünün kütle miktarı daima birbirine eşittir. Giren madde 50 gram ise çıkan üründe daima 50 gramdır. Bu bilgiyi Fransız Lavosier bulmuştur. NÜKLEER REAKSİYON: Bir element atomunun başka bir element atomuna dönüştüğü olaylara Nükleer Reaksiyon, bu reaksiyonda çıkan enerjiye de Nükleer enerji denir. RADYOAKTİF MADDE: Işıma yaparak kendiliğinden parçalanan ve başka elementlere dönüşebilen maddelere Radyoaktif madde, bu olaya da Radyoaktivite denir. Örnek: Uranyum, radyum, toryum, polonyum, plütonyum vb. Radyoaktivitede Alfa, Beta, Gama gibi ışınlar yayılır. Gamma en girici, alfa en az giricidir. Alfa insan derisinden içeri giremez. Gamma X veya Röntgen ışını olarak ta bilinir. ALFA: Havada bir kaç cm ilerler. Canlı dokular için tehlikelidir. Elektrik yüklüdür. Magnetik alanda saparlar. Alfa ışınları (+) yüklü helyum çekirdeğidir. Alfa ışıması yapan bir atomun atom numarası 2, kütle numarası 4 azalır. 236 U ---> 90 Th + He BETA: Havada birkaç metre ilerler. Canlıya zarar verir. Bu tür maddelere dokunmak tehlikelidir. Elektrik yüklüdür. Magnetik alanda saparlar. Beta ışınları (-) yüklü elektronlardır. Beta ışıması yapan bir atomun atom numarası 1 artar kütle numarası değişmez. 225 Ra ---> 90 Th + -1 e GAMA: Havada kilometrelerce yol alır. Ancak kurşun gibi ağır metaller yolunu keser. Elektromagnetik dalgalardan oluşmuştur. Magnetik alanda sapmazlar. Atomun atom ve kütle numarasını değiştirmez sadece fazla enerjini ışımasını sağlar. Radyoaktif maddelerle ilk çalışmaları Henri Bekerel,Merie Curie,Pierre Curie yapmışlardır. FİSYON ( ÇEKİRDEK BÖLÜNMESİ ): Uranyum gibi atomlar parçalanırken iki çekirdeğe bölünür. Bu esnada ısı ve radyoaktif ışınlar oluşur. Bu olaya Fisyon denir. Atom bombası gibi. FÜZYON ( ÇEKİRDEK KAYNAŞMASI ): Hafif iki atom çekirdeği yüksek sıcaklık ve basın altında tek bir çekirdek oluşturmasına Füzyon denir. Hidrojen bombası, Güneşte oluşan enerji gibi.
11 RADYOAKTİF REAKSİYONLARDA AÇIĞA ÇIKAN ENERJİNİN KAYNAĞI : Bu reaksiyonlarda bir miktar kütle kaybolur. Bu kütle enerjiye dönüşür. Einstein teorisine göre bu enerji şöyle hesaplanır : E= m.c 2 E = Joule cinsinden enerji m = Kg olarak kayıp kütle c =Işık hızı ( m/sn) ÇÖZÜMLÜ ÖRNEKLER 1-) Atom numarası 19 olan K elementinin elektron dağılımını gösteriniz? Bileşiklerinde alacağı değerliği bulunuz? 19K = > A.N = p = e = 19 kararlı hale gelebilmek için Yük = p e 1 e vererek 18 Ar elementine benzer. Bir elektron kaybettiği için +1 yüklü olur. Yük = Elekron sayısı 18 olur. Yük = +1 2-) X -2 iyonunun 32 e bulunmaktadır. Çekirdeğinde 34 nötron olduğuna göre A.N sı ve K.N sı nedir? Yük = p e A.N = p K.N = p + n -2 = p 32 A.N = 30 K.N = p = 32 2 = 30 K.N = 64 3-) 12 Mg ile 17 Cl atomlarının birbirleriyle oluşturacağı bileşiğin formulünü yazınız? 12Mg : > Mg +2 : 2. 8 olur. Mg +2 Cl -1 17Cl : > Cl -1 : olur. MgCl 2 bileşiği oluşur. 4-) 56 gr Azot a-) Kaç atom gramdır? b-) Kaç mol azot molekülüdür? ( N = 14 gr/mol ) a-) 14 gr N 1 atom gram b-) Azot molekülü N 2 yapısındadır. 56 gr N X atom gram M.A = 2.14 = 28 gr/mol 56 X = = 4 atom- gram 14 m 56 n = = = 2 mol M. A 28 5-) 2 mol Na 2 CO 3 bileşiğinde ( Na : 23 C : 12 O : 16 ) a-) Kaç mol atom vardır? b-) Kaç gramdır? a-) 1 mol Na 2 CO 3 de 2 mol Na atomu + 1 mol C atomu + 3 mol O atomu = 7 mol atom var 2 mol Na 2 CO 3 de 14 mol atom vardır b-) Na 2 CO 3 ün M.A = 2. Na + 1.C + 3.O 2 mol Na 2 CO 3 = 2.96 = = 96 gr/mol = 192 gr
12 6-) CH 4 gazındaki elementlerin kütlece yüzdelerini bulunuz? ( C: 12 H:1 ) M.A: = 16 gr/mol 16 gr CH 4 12 gr C bulunur. 16 gr CH 4 4 gr H bulunur. 100 gr CH 4 X gr C 100 gr CH 4 X gr H X = = 75 gr % 75 C X = = 25 gr % 25 H 7-) Aşağıdaki olaylardan hangisi kimyasal olay hangisi fiziksel olaydır? I. Suyun buharlaşması II. Odunun yanması III. Tuzun suda çözünmesi IV. Odunun talaş haline gelmesi V. Besinlerin sindirilmesi Suyun buharlaşması, odunun talaş halini alması ve tuzun suda erimesi maddenin iç yapısını değiştirmediği için fiziksel değişmelerdir. Besinlerin sindirilmesi ve odunun yanması maddenin iç yapısında meydana gelen değişmelerdir. Dolayısıyla kimyasal olaylardır. 8-) Aşağıdakilerden hangisi bir katının sıvıdaki çözünme hızını artırır? I. Katının toz haline gelmesi. II. Karışımın karıştırılması. III. Sıçaklığın yükseltilmesi. IV. Çözücünün miktarının artırılması. V. Sıçaklığın artırılması. I, II, III ve IV çözünme hızını artırır. V çözünme hızını yavaşlatır. 9-) A : Bileşiklerinde herzaman (+) değerlik alır. B : Ayrı cins atomlardan oluşmuştur. C : Farklı cins atomlardan oluşmuş saf maddedir. D : Homojen karışımdır. Süzme ile tanecikleri ayrışmaz. E : Suda çözündüğünde H + iyonu verir. Yukarıdaki maddelerin türleri için neler söylenebilirsiniz A : Bileşiklerinde (+) değerlik aldığına göre metaldir. B : Aynı cins atomlardan oluştuğuna göre elementir. C : Farklı cins atomlardan oluşmuş o halde bileşiktir. D : Homojen karışım olduğuna göre çözeltidir. E : Suda iyonlaşınca H + iyonu verdiğine göre asittir. 10-) I. Tadları ekşidir. II. Kırmızı turnosol kağıdını maviye çevirir. III. Mavi turnosol kağıdını kırmızıya çevirir. IV.Tadları acıdır. Yukarıdaki özelliklerden hangisi asiylerin hangisi bazların özeliğidir. I ve III asitlerin özelliğidir.
13 II ve IV bazların özelliğidir.
PERİYODİK CETVEL Mendeleev Henry Moseley Glenn Seaborg
 PERİYODİK CETVEL Periyodik cetvel elementleri sınıflandırmak için hazırlanmıştır. İlkperiyodik cetvel Mendeleev tarafından yapılmıştır. Mendeleev elementleri artan kütle numaralarına göre sıralamış ve
PERİYODİK CETVEL Periyodik cetvel elementleri sınıflandırmak için hazırlanmıştır. İlkperiyodik cetvel Mendeleev tarafından yapılmıştır. Mendeleev elementleri artan kütle numaralarına göre sıralamış ve
MADDE NEDİR? Çevremize baktığımızda gördüğümüz her şey örneğin, dağlar, denizler, ağaçlar, bitkiler, hayvanlar ve hava birer maddedir.
 MADDE NEDİR? Çevremize baktığımızda gördüğümüz her şey örneğin, dağlar, denizler, ağaçlar, bitkiler, hayvanlar ve hava birer maddedir. Her maddenin bir kütlesi vardır ve bu tartılarak bulunur. Ayrıca her
MADDE NEDİR? Çevremize baktığımızda gördüğümüz her şey örneğin, dağlar, denizler, ağaçlar, bitkiler, hayvanlar ve hava birer maddedir. Her maddenin bir kütlesi vardır ve bu tartılarak bulunur. Ayrıca her
Nötr (yüksüz) bir için, çekirdekte kaç proton varsa çekirdeğin etrafındaki yörüngelerde de o kadar elektron dolaşır.
 ATOM ve YAPISI Elementin özelliğini taşıyan en küçük parçasına denir. Atom Numarası Bir elementin unda bulunan proton sayısıdır. Protonlar (+) yüklü olduklarından pozitif yük sayısı ya da çekirdek yükü
ATOM ve YAPISI Elementin özelliğini taşıyan en küçük parçasına denir. Atom Numarası Bir elementin unda bulunan proton sayısıdır. Protonlar (+) yüklü olduklarından pozitif yük sayısı ya da çekirdek yükü
ATOM ve YAPISI Maddelerin gözle görülmeyen (bölünmeyen) en parçasına atom denir. Atom kendinden başka hiçbir fiziksel ya da kimyasal metotlarla
 ATOM ve YAPISI Maddelerin gözle görülmeyen (bölünmeyen) en parçasına atom denir. Atom kendinden başka hiçbir fiziksel ya da kimyasal metotlarla kendinden farklı atomlara dönüşemezler. Atomda (+) yüklü
ATOM ve YAPISI Maddelerin gözle görülmeyen (bölünmeyen) en parçasına atom denir. Atom kendinden başka hiçbir fiziksel ya da kimyasal metotlarla kendinden farklı atomlara dönüşemezler. Atomda (+) yüklü
Örnek : 3- Bileşiklerin Özellikleri :
 Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani
Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani
BİLEŞİKLER VE FORMÜLLERİ
 BİLEŞİKLER VE FORMÜLLERİ Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur). Bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere
BİLEŞİKLER VE FORMÜLLERİ Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur). Bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere
maddelere saf maddeler denir
 Madde :Kütlesi olan her şeye madde denir. Saf madde: Aynı cins atom veya moleküllerden oluşan maddeye denir. Fiziksel yollarla kendisinden başka maddelere ayrışmayan maddelere saf maddeler denir Element:
Madde :Kütlesi olan her şeye madde denir. Saf madde: Aynı cins atom veya moleküllerden oluşan maddeye denir. Fiziksel yollarla kendisinden başka maddelere ayrışmayan maddelere saf maddeler denir Element:
İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA
 İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA İNCELENİR Her tarafında aynı özelliği gösteren, tek bir madde
İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA İNCELENİR Her tarafında aynı özelliği gösteren, tek bir madde
İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA İNCELENİR
 KARIŞIMLAR İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA İNCELENİR Her tarafında aynı özelliği gösteren, tek
KARIŞIMLAR İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA İNCELENİR Her tarafında aynı özelliği gösteren, tek
Yrd. Doç. Dr. H. Hasan YOLCU. hasanyolcu.wordpress.com
 Yrd. Doç. Dr. H. Hasan YOLCU hasanyolcu.wordpress.com En az iki atomun belli bir düzenlemeyle kimyasal bağ oluşturmak suretiyle bir araya gelmesidir. Aynı atomda olabilir farklı atomlarda olabilir. H 2,
Yrd. Doç. Dr. H. Hasan YOLCU hasanyolcu.wordpress.com En az iki atomun belli bir düzenlemeyle kimyasal bağ oluşturmak suretiyle bir araya gelmesidir. Aynı atomda olabilir farklı atomlarda olabilir. H 2,
Atomlar ve Moleküller
 Atomlar ve Moleküller Madde, uzayda yer işgal eden ve kütlesi olan herşeydir. Element, kimyasal tepkimelerle başka bileşiklere parçalanamayan maddedir. -Doğada 92 tane element bulunmaktadır. Bileşik, belli
Atomlar ve Moleküller Madde, uzayda yer işgal eden ve kütlesi olan herşeydir. Element, kimyasal tepkimelerle başka bileşiklere parçalanamayan maddedir. -Doğada 92 tane element bulunmaktadır. Bileşik, belli
Element atomlarının atom ve kütle numaraları element sembolleri üzerinde gösterilebilir. Element atom numarası sembolün sol alt köşesine yazılır.
 Atom üç temel tanecikten oluşur. Bunlar proton, nötron ve elektrondur. Proton atomun çekirdeğinde bulunan pozitif yüklü taneciktir. Nötron atomun çekirdeğin bulunan yüksüz taneciktir. ise çekirdek etrafında
Atom üç temel tanecikten oluşur. Bunlar proton, nötron ve elektrondur. Proton atomun çekirdeğinde bulunan pozitif yüklü taneciktir. Nötron atomun çekirdeğin bulunan yüksüz taneciktir. ise çekirdek etrafında
MADDENİN SINIFLANDIRILMASI
 MADDENİN SINIFLANDIRILMASI MADDE Saf madde Karışımlar Element Bileşik Homojen Karışımlar Heterojen Karışımlar ELEMENT Tek cins atomlardan oluşmuş saf maddeye element denir. ELEMENTLERİN ÖZELLİKLERİ Elementler
MADDENİN SINIFLANDIRILMASI MADDE Saf madde Karışımlar Element Bileşik Homojen Karışımlar Heterojen Karışımlar ELEMENT Tek cins atomlardan oluşmuş saf maddeye element denir. ELEMENTLERİN ÖZELLİKLERİ Elementler
MOL KAVRAMI I. ÖRNEK 2
 MOL KAVRAMI I Maddelerin taneciklerden oluştuğunu biliyoruz. Bu taneciklere atom, molekül ya da iyon denir. Atom : Kimyasal yöntemlerle daha basit taneciklere ayrılmayan ve elementlerin yapıtaşı olan taneciklere
MOL KAVRAMI I Maddelerin taneciklerden oluştuğunu biliyoruz. Bu taneciklere atom, molekül ya da iyon denir. Atom : Kimyasal yöntemlerle daha basit taneciklere ayrılmayan ve elementlerin yapıtaşı olan taneciklere
Paylaşılan elektron ya da elektronlar, her iki çekirdek etrafında dolanacaklar, iki çekirdek arasındaki bölgede daha uzun süre bulundukları için bu
 4.Kimyasal Bağlar Kimyasal Bağlar Aynı ya da farklı cins atomları bir arada tutan kuvvetlere kimyasal bağlar denir. Pek çok madde farklı element atomlarının birleşmesiyle meydana gelmiştir. İyonik bağ
4.Kimyasal Bağlar Kimyasal Bağlar Aynı ya da farklı cins atomları bir arada tutan kuvvetlere kimyasal bağlar denir. Pek çok madde farklı element atomlarının birleşmesiyle meydana gelmiştir. İyonik bağ
2+ 2- Mg SO 4. (NH 4 ) 2 SO 4 (amonyum sülfat) bileşiğini katyon ve anyonlara ayıralım.
 KONU: Kimyasal Tepkimeler Dersin Adı Dersin Konusu İYONİK BİLEŞİKLERİN FORMÜLLERİNİN YAZILMASI İyonik bağlı bileşiklerin formüllerini yazmak için atomların yüklerini bilmek gerekir. Bunu da daha önceki
KONU: Kimyasal Tepkimeler Dersin Adı Dersin Konusu İYONİK BİLEŞİKLERİN FORMÜLLERİNİN YAZILMASI İyonik bağlı bileşiklerin formüllerini yazmak için atomların yüklerini bilmek gerekir. Bunu da daha önceki
PERİYODİK CETVEL
 BÖLÜM4 W Periyodik cetvel, elementlerin atom numaraları esas alınarak düzenlenmiştir. Bu düzenlemede, kimyasal özellikleri benzer olan (değerlik elektron sayıları aynı) elementler aynı düşey sütunda yer
BÖLÜM4 W Periyodik cetvel, elementlerin atom numaraları esas alınarak düzenlenmiştir. Bu düzenlemede, kimyasal özellikleri benzer olan (değerlik elektron sayıları aynı) elementler aynı düşey sütunda yer
Bileşikteki atomların cinsini ve oranını belirten formüldür. Kaba formül ile bileşiğin molekül ağırlığı hesaplanamaz.
 BİLEŞİKLER Birden fazla elementin belirli oranlarda kimyasal yollarla bir araya gelerek, kendi özelligini kaybedip oluşturdukları yeni saf maddeye bileşik denir. Bileşikteki atomların cins ve sayısını
BİLEŞİKLER Birden fazla elementin belirli oranlarda kimyasal yollarla bir araya gelerek, kendi özelligini kaybedip oluşturdukları yeni saf maddeye bileşik denir. Bileşikteki atomların cins ve sayısını
5) Çözünürlük(Xg/100gsu)
 1) I. Havanın sıvılaştırılması II. abrika bacasından çıkan SO 3 gazının H 2 O ile birleşmesi III. Na metalinin suda çözünmesi Yukardaki olaylardan hangilerinde kimyasal değişme gerçekleşir? 4) Kütle 1
1) I. Havanın sıvılaştırılması II. abrika bacasından çıkan SO 3 gazının H 2 O ile birleşmesi III. Na metalinin suda çözünmesi Yukardaki olaylardan hangilerinde kimyasal değişme gerçekleşir? 4) Kütle 1
Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı
 Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani madde yani bileşik
Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani madde yani bileşik
MADDENİN YAPISI VE ÖZELLİKLERİ ATOM
 MADDENİN YAPISI VE ÖZELLİKLERİ ATOM ATOMUN YAPISI Elementlerin tüm özelliğini gösteren en küçük parçasına atom denir. Atomu oluşturan parçacıklar farklı yüklere sa-hiptir. Atomda bulunan yükler; negatif
MADDENİN YAPISI VE ÖZELLİKLERİ ATOM ATOMUN YAPISI Elementlerin tüm özelliğini gösteren en küçük parçasına atom denir. Atomu oluşturan parçacıklar farklı yüklere sa-hiptir. Atomda bulunan yükler; negatif
Yrd. Doç. Dr. H. Hasan YOLCU. hasanyolcu.wordpress.com
 Yrd. Doç. Dr. H. Hasan YOLCU hasanyolcu.wordpress.com En az iki atomun belli bir düzenlemeyle kimyasal bağ oluşturmak suretiyle bir araya gelmesidir. Aynı atomda olabilir farklı atomlarda olabilir. H 2,
Yrd. Doç. Dr. H. Hasan YOLCU hasanyolcu.wordpress.com En az iki atomun belli bir düzenlemeyle kimyasal bağ oluşturmak suretiyle bir araya gelmesidir. Aynı atomda olabilir farklı atomlarda olabilir. H 2,
SEZEN DEMİR MADDE DOĞADA KARIŞIK HALDE BULUNUR
 Kütlesi, hacmi ve eylemsizliği olan her şey maddedir. Buna göre kütle hacim ve eylemsizlik maddenin ortak özelliklerindendir. Çevremizde gördüğümüz, hava, su, toprak v.s gibi her şey maddedir. Maddeler
Kütlesi, hacmi ve eylemsizliği olan her şey maddedir. Buna göre kütle hacim ve eylemsizlik maddenin ortak özelliklerindendir. Çevremizde gördüğümüz, hava, su, toprak v.s gibi her şey maddedir. Maddeler
İSRAFİL ARSLAN KİM ÖĞR. YGS ÇALIŞMA KİMYA SORULARI I
 İSRAFİL ARSLAN KİM ÖĞR. YGS ÇALIŞMA KİMYA SORULARI I D) Elmas E) Oltu taşı 1. I. Civa II. Kil III. Kireç taşı Yukarıdaki maddelerden hangileri simyacılar tarafından kullanılmıştır? D) II ve III E) I, II
İSRAFİL ARSLAN KİM ÖĞR. YGS ÇALIŞMA KİMYA SORULARI I D) Elmas E) Oltu taşı 1. I. Civa II. Kil III. Kireç taşı Yukarıdaki maddelerden hangileri simyacılar tarafından kullanılmıştır? D) II ve III E) I, II
ÖĞRENME ALANI : MADDE VE DEĞİŞİM ÜNİTE 4 : MADDENİN YAPISI VE ÖZELLİKLERİ
 ÖĞRENME ALANI : MADDE VE DEĞİŞİM ÜNİTE 4 : MADDENİN YAPISI VE ÖZELLİKLERİ E BİLEŞİKLER VE FRMÜLLERİ (4 SAAT) 1 Bileşikler 2 Bileşiklerin luşması 3 Bileşiklerin Özellikleri 4 Bileşik Çeşitleri 5 Bileşik
ÖĞRENME ALANI : MADDE VE DEĞİŞİM ÜNİTE 4 : MADDENİN YAPISI VE ÖZELLİKLERİ E BİLEŞİKLER VE FRMÜLLERİ (4 SAAT) 1 Bileşikler 2 Bileşiklerin luşması 3 Bileşiklerin Özellikleri 4 Bileşik Çeşitleri 5 Bileşik
Elektronların Dağılımı ve Kimyasal Özellikleri
 Elektronların Dağılımı ve Kimyasal Özellikleri Helyum (2), neon (10), argon (18)in elektron dağılımları incelendiğinde Eğer bu üç elementin birer elektronu daha olsaydı, her birinde yeni bir katman oluşacaktı.
Elektronların Dağılımı ve Kimyasal Özellikleri Helyum (2), neon (10), argon (18)in elektron dağılımları incelendiğinde Eğer bu üç elementin birer elektronu daha olsaydı, her birinde yeni bir katman oluşacaktı.
Serüveni PERİYODİK ÖZELLİKLER DEĞİŞİMİ
 Serüveni PERİYODİK ÖZELLİKLER DEĞİŞİMİ PERİYODİK ÖZELLİKLERİN DEĞİŞİMİ ATOM YARIÇAPI Çekirdeğin merkezi ile en dış kabukta bulunan elektronlar arasındaki uzaklık olarak tanımlanır. Periyodik tabloda aynı
Serüveni PERİYODİK ÖZELLİKLER DEĞİŞİMİ PERİYODİK ÖZELLİKLERİN DEĞİŞİMİ ATOM YARIÇAPI Çekirdeğin merkezi ile en dış kabukta bulunan elektronlar arasındaki uzaklık olarak tanımlanır. Periyodik tabloda aynı
PERİYODİK CETVEL-ÖSS DE ÇIKMIŞ SORULAR
 PERİODİK CETVEL-ÖSS DE ÇIKMIŞ SORULAR 1. Bir elementin periyodik cetveldeki yeri aşağıdakilerden hangisi ile belirlenir? A) Atom ağırlığı B) Değerliği C) Atom numarası D) Kimyasal özellikleri E) Fiziksel
PERİODİK CETVEL-ÖSS DE ÇIKMIŞ SORULAR 1. Bir elementin periyodik cetveldeki yeri aşağıdakilerden hangisi ile belirlenir? A) Atom ağırlığı B) Değerliği C) Atom numarası D) Kimyasal özellikleri E) Fiziksel
ATOM BİLGİSİ I ÖRNEK 1
 ATOM BİLGİSİ I Elementlerin özelliklerini ta ıyan en küçük yapıta ı atomdur. Son çözümlemede, bütün maddelerin atomlar toplulu u oldu unu söyleyebiliriz. Elementler, aynı tür atomlardan, bile ik ve karı
ATOM BİLGİSİ I Elementlerin özelliklerini ta ıyan en küçük yapıta ı atomdur. Son çözümlemede, bütün maddelerin atomlar toplulu u oldu unu söyleyebiliriz. Elementler, aynı tür atomlardan, bile ik ve karı
Örneğin; İki hidrojen (H) uyla, bir oksijen (O) u birleşerek hidrojen ve oksijenden tamamen farklı olan su (H 2
 On5yirmi5.com Madde ve özellikleri Kütlesi, hacmi ve eylemsizliği olan herşey maddedir. Yayın Tarihi : 21 Ocak 2014 Salı (oluşturma : 2/9/2016) Kütle hacim ve eylemsizlik maddenin ortak özelliklerindendir.çevremizde
On5yirmi5.com Madde ve özellikleri Kütlesi, hacmi ve eylemsizliği olan herşey maddedir. Yayın Tarihi : 21 Ocak 2014 Salı (oluşturma : 2/9/2016) Kütle hacim ve eylemsizlik maddenin ortak özelliklerindendir.çevremizde
Fiziksel özellikleri her yerde aynı olan (homojen) karışımlara çözelti denir. Bir çözeltiyi oluşturan her bir maddeye çözeltinin bileşenleri denir.
 GENEL KİMYA 1 LABORATUARI ÇALIŞMA NOTLARI DENEY: 8 ÇÖZELTİLER Dr. Bahadır KESKİN, 2011 @ YTÜ Fiziksel özellikleri her yerde aynı olan (homojen) karışımlara çözelti denir. Bir çözeltiyi oluşturan her bir
GENEL KİMYA 1 LABORATUARI ÇALIŞMA NOTLARI DENEY: 8 ÇÖZELTİLER Dr. Bahadır KESKİN, 2011 @ YTÜ Fiziksel özellikleri her yerde aynı olan (homojen) karışımlara çözelti denir. Bir çözeltiyi oluşturan her bir
BİLEŞİKLER İki ya da daha fazla maddenin belli oranda kimyasal olarak birleşmeleri sonucu oluşturdukları yeni, saf maddeye bileşik denir.
 BİLEŞİKLER İki ya da daha fazla maddenin belli oranda kimyasal olarak birleşmeleri sonucu oluşturdukları yeni, saf maddeye bileşik denir. ÖZELLĠKLERĠ: 1. Yapılarında iki ya da daha fazla madde bulundururlar.
BİLEŞİKLER İki ya da daha fazla maddenin belli oranda kimyasal olarak birleşmeleri sonucu oluşturdukları yeni, saf maddeye bileşik denir. ÖZELLĠKLERĠ: 1. Yapılarında iki ya da daha fazla madde bulundururlar.
Hidroklorik asit ve sodyum hidroksitin reaksiyonundan yemek tuzu ve su meydana gelir. Bu kimyasal olayın denklemi
 KİMYASAL DENKLEMLER İki ya da daha fazla maddenin birbirleri ile etkileşerek kendi özelliklerini kaybedip yeni özelliklerde bir takım ürünler meydana getirmesine kimyasal olay, bunların formüllerle gösterilmesine
KİMYASAL DENKLEMLER İki ya da daha fazla maddenin birbirleri ile etkileşerek kendi özelliklerini kaybedip yeni özelliklerde bir takım ürünler meydana getirmesine kimyasal olay, bunların formüllerle gösterilmesine
ASİTLER- BAZLAR. Suyun kendi kendine iyonlaşmasına Suyun Otonizasyonu - Otoprotoliz adı verilir. Suda oluşan H + sadece protondur.
 ASİTLER- BAZLAR SUYUN OTONİZASYONU: Suyun kendi kendine iyonlaşmasına Suyun Otonizasyonu - Otoprotoliz adı verilir. Suda oluşan H + sadece protondur. H 2 O (S) H + (suda) + OH - (Suda) H 2 O (S) + H +
ASİTLER- BAZLAR SUYUN OTONİZASYONU: Suyun kendi kendine iyonlaşmasına Suyun Otonizasyonu - Otoprotoliz adı verilir. Suda oluşan H + sadece protondur. H 2 O (S) H + (suda) + OH - (Suda) H 2 O (S) + H +
7. Sınıf Fen ve Teknoloji Dersi 4. Ünite: Madde ve Yapısı Konu: Elementler ve Sembolleri
 ÖĞRETĐM TEKNOLOJĐLERĐ VE MATERYAL GELĐŞĐMĐ 7. Sınıf Fen ve Teknoloji Dersi 4. Ünite: Madde ve Yapısı Konu: Elementler ve Sembolleri Çalışma Yaprağı Konu Anlatımı-Değerlendirme çalışma Yaprağı- Çözümlü
ÖĞRETĐM TEKNOLOJĐLERĐ VE MATERYAL GELĐŞĐMĐ 7. Sınıf Fen ve Teknoloji Dersi 4. Ünite: Madde ve Yapısı Konu: Elementler ve Sembolleri Çalışma Yaprağı Konu Anlatımı-Değerlendirme çalışma Yaprağı- Çözümlü
Element ve Bileşikler
 Element ve Bileşikler Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere element denir. Bir elementi oluşturan bütün atomların
Element ve Bileşikler Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere element denir. Bir elementi oluşturan bütün atomların
ATOMİK YAPI. Elektron Yükü=-1,60x10-19 C Proton Yükü=+1,60x10-19 C Nötron Yükü=0
 ATOMİK YAPI Atom, birkaç türü birleştiğinde çeşitli molekülleri, bir tek türü ise bir kimyasal öğeyi oluşturan parçacıktır. Atom, elementlerin özelliklerini taşıyan en küçük yapı birimi olup çekirdekteki
ATOMİK YAPI Atom, birkaç türü birleştiğinde çeşitli molekülleri, bir tek türü ise bir kimyasal öğeyi oluşturan parçacıktır. Atom, elementlerin özelliklerini taşıyan en küçük yapı birimi olup çekirdekteki
ÖĞRENME ALANI : MADDE VE DEĞĐŞĐM ÜNĐTE 3 : MADDENĐN YAPISI VE ÖZELLĐKLERĐ
 ÖĞRENME ALANI : MADDE VE DEĞĐŞĐM ÜNĐTE 3 : MADDENĐN YAPISI VE ÖZELLĐKLERĐ C- BĐLEŞĐKLER VE BĐLEŞĐK FORMÜLLERĐ (4 SAAT) 1- Bileşikler 2- Đyonik Yapılı Bileşik Formüllerinin Yazılması 3- Đyonlar ve Değerlikleri
ÖĞRENME ALANI : MADDE VE DEĞĐŞĐM ÜNĐTE 3 : MADDENĐN YAPISI VE ÖZELLĐKLERĐ C- BĐLEŞĐKLER VE BĐLEŞĐK FORMÜLLERĐ (4 SAAT) 1- Bileşikler 2- Đyonik Yapılı Bileşik Formüllerinin Yazılması 3- Đyonlar ve Değerlikleri
ÖĞRETĐM TEKNĐKLERĐ VE MATERYAL GELĐŞTĐRME
 ÖĞRETĐM TEKNĐKLERĐ VE MATERYAL GELĐŞTĐRME DERS SORUMLUSU: PROF. DR. ĐNCĐ MORGĐL ÖĞRENME ALANI: MADDE VE ÖZELLĐKLERĐ HAZIRLAYAN: Gökçegül DUYGUN 2008 ANKARA KONU ANLATIMI MADDE ve ÖZELLĐKLERĐ MADDE Kütlesi,
ÖĞRETĐM TEKNĐKLERĐ VE MATERYAL GELĐŞTĐRME DERS SORUMLUSU: PROF. DR. ĐNCĐ MORGĐL ÖĞRENME ALANI: MADDE VE ÖZELLĐKLERĐ HAZIRLAYAN: Gökçegül DUYGUN 2008 ANKARA KONU ANLATIMI MADDE ve ÖZELLĐKLERĐ MADDE Kütlesi,
2. HAMLE web:
 2. HAMLE Nötron sayısı İZOTOP ATOM 1-Proton sayıları... nötron ve kütle numaraları.. atomlardır. 2-İzotop atomların fiziksel özellikleri. 3-Nötr izotop atomlar kimyasal özellikleri. 4-İzotop atomlar aynı
2. HAMLE Nötron sayısı İZOTOP ATOM 1-Proton sayıları... nötron ve kütle numaraları.. atomlardır. 2-İzotop atomların fiziksel özellikleri. 3-Nötr izotop atomlar kimyasal özellikleri. 4-İzotop atomlar aynı
ELEMENTLERİN SEMBOLLERİ VE ATOM
 ELEMENT VE SEMBOLLERİ SAF MADDE: Kendisinden başka madde bulundurmayan maddelere denir. ELEMENT: İçerisinde tek cins atom bulunduran maddelere denir. Yani elementlerin yapı yaşı atomlardır. BİLEŞİK: En
ELEMENT VE SEMBOLLERİ SAF MADDE: Kendisinden başka madde bulundurmayan maddelere denir. ELEMENT: İçerisinde tek cins atom bulunduran maddelere denir. Yani elementlerin yapı yaşı atomlardır. BİLEŞİK: En
Yrd.Doç.Dr. Emre YALAMAÇ. Yrd.Doç.Dr. Emre YALAMAÇ İÇERİK
 İÇERİK Elementlere, Bileşiklere ve Karışımlara atomik boyutta bakış Dalton Atom Modeli Atom Fiziğinde Buluşlar - Elektronların Keşfi - Atom Çekirdeği Keşfi Günümüz Atom Modeli Kimyasal Elementler Periyodik
İÇERİK Elementlere, Bileşiklere ve Karışımlara atomik boyutta bakış Dalton Atom Modeli Atom Fiziğinde Buluşlar - Elektronların Keşfi - Atom Çekirdeği Keşfi Günümüz Atom Modeli Kimyasal Elementler Periyodik
ATOM BİLGİSİ Atom Modelleri
 1. Atom Modelleri BÖLÜM2 Maddenin atom adı verilen bir takım taneciklerden oluştuğu fikri çok eskiye dayanmaktadır. Ancak, bilimsel bir (deneye dayalı) atom modeli ilk defa Dalton tarafından ileri sürülmüştür.
1. Atom Modelleri BÖLÜM2 Maddenin atom adı verilen bir takım taneciklerden oluştuğu fikri çok eskiye dayanmaktadır. Ancak, bilimsel bir (deneye dayalı) atom modeli ilk defa Dalton tarafından ileri sürülmüştür.
Elementlerin büyük bir kısmı tabiatta saf hâlde bulunmaz. Çoğunlukla başka elementlerle bileşikler oluşturmuş şekilde bulunurlar.
 Elementlerin büyük bir kısmı tabiatta saf hâlde bulunmaz. Çoğunlukla başka elementlerle bileşikler oluşturmuş şekilde bulunurlar. Elementlerin bileşik oluşturma istekleri onların kararlı yapıya ulaşma
Elementlerin büyük bir kısmı tabiatta saf hâlde bulunmaz. Çoğunlukla başka elementlerle bileşikler oluşturmuş şekilde bulunurlar. Elementlerin bileşik oluşturma istekleri onların kararlı yapıya ulaşma
ASİTLER, BAZLAR ve TUZLAR
 ASİTLER, BAZLAR ve TUZLAR 1. ASİTLER Sulu çözeltilerine Hidrojen İyonu veren maddelere asit denir. Ör 1 HCl : Hidroklorik asit HCl H + + Cl - Ör 2 H 2 SO 4 : Sülfürik asit H 2 SO 4 2H + + SO 4-2 Ör 3 Nitrik
ASİTLER, BAZLAR ve TUZLAR 1. ASİTLER Sulu çözeltilerine Hidrojen İyonu veren maddelere asit denir. Ör 1 HCl : Hidroklorik asit HCl H + + Cl - Ör 2 H 2 SO 4 : Sülfürik asit H 2 SO 4 2H + + SO 4-2 Ör 3 Nitrik
ATOMUN YAPISI. Özhan ÇALIŞ. Bilgi İletişim ve Teknolojileri
 ATOMUN YAPISI ATOMLAR Atom, elementlerin en küçük kimyasal yapıtaşıdır. Atom çekirdeği: genel olarak nükleon olarak adlandırılan proton ve nötronlardan meydana gelmiştir. Elektronlar: çekirdeğin etrafında
ATOMUN YAPISI ATOMLAR Atom, elementlerin en küçük kimyasal yapıtaşıdır. Atom çekirdeği: genel olarak nükleon olarak adlandırılan proton ve nötronlardan meydana gelmiştir. Elektronlar: çekirdeğin etrafında
ATOMİK YAPI. Elektron Yükü=-1,60x10-19 C Proton Yükü=+1,60x10-19 C Nötron Yükü=0
 ATOMİK YAPI Elektron Yükü=-1,60x10-19 C Proton Yükü=+1,60x10-19 C Nötron Yükü=0 Elektron Kütlesi 9,11x10-31 kg Proton Kütlesi Nötron Kütlesi 1,67x10-27 kg Bir kimyasal elementin atom numarası (Z) çekirdeğindeki
ATOMİK YAPI Elektron Yükü=-1,60x10-19 C Proton Yükü=+1,60x10-19 C Nötron Yükü=0 Elektron Kütlesi 9,11x10-31 kg Proton Kütlesi Nötron Kütlesi 1,67x10-27 kg Bir kimyasal elementin atom numarası (Z) çekirdeğindeki
Maarif Günlüğü FEN BİLİMLERİ MADDENİN YAPISI VE ÖZELLİKLERİ. Eğitim ve Kültür Yayıncılığı PERİYODİK SİSTEMİN TARİHÇESİ
 PERİYODİK SİSTEMİN TARİHÇESİ (1) benzer özellik gösteren elementleri üçerli gruplar hâlinde göstermiştir. (2)... Elementleri atom ağırlıklarına göre sıralamıştır. İlk sekiz elementten sonra benzer özelliklerin
PERİYODİK SİSTEMİN TARİHÇESİ (1) benzer özellik gösteren elementleri üçerli gruplar hâlinde göstermiştir. (2)... Elementleri atom ağırlıklarına göre sıralamıştır. İlk sekiz elementten sonra benzer özelliklerin
Element ve Bileşikler
 Element ve Bileşikler Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere element denir. Bir elementi oluşturan bütün atomların
Element ve Bileşikler Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere element denir. Bir elementi oluşturan bütün atomların
Malzeme Bilgisi. Madde ve Özellikleri
 Malzeme Bilgisi Madde: Boşlukta yer kaplayan, kütlesi ve hacmi olan katı, sıvı veya gaz şeklinde bulunan her şeye madde denir. Ayırt edici özellikler: Bir maddenin diğer maddelerden farklılık gösterenyanları,
Malzeme Bilgisi Madde: Boşlukta yer kaplayan, kütlesi ve hacmi olan katı, sıvı veya gaz şeklinde bulunan her şeye madde denir. Ayırt edici özellikler: Bir maddenin diğer maddelerden farklılık gösterenyanları,
Bir maddenin başka bir madde içerisinde homojen olarak dağılmasına ÇÖZÜNME denir. Çözelti=Çözücü+Çözünen
 ÇÖZÜCÜ VE ÇÖZÜNEN ETKİLEŞİMLERİ: Çözünme olayı ve Çözelti Oluşumu: Bir maddenin başka bir madde içerisinde homojen olarak dağılmasına ÇÖZÜNME denir. Çözelti=Çözücü+Çözünen Çözünme İyonik Çözünme Moleküler
ÇÖZÜCÜ VE ÇÖZÜNEN ETKİLEŞİMLERİ: Çözünme olayı ve Çözelti Oluşumu: Bir maddenin başka bir madde içerisinde homojen olarak dağılmasına ÇÖZÜNME denir. Çözelti=Çözücü+Çözünen Çözünme İyonik Çözünme Moleküler
Genel Kimya. Bölüm 7: ÇÖZELTİLER VE ÇÖZÜNÜRLÜK. Yrd. Doç. Dr. Mustafa SERTÇELİK Kafkas Üniversitesi Kimya Mühendisliği Bölümü
 Genel Kimya Bölüm 7: ÇÖZELTİLER VE ÇÖZÜNÜRLÜK Yrd. Doç. Dr. Mustafa SERTÇELİK Kafkas Üniversitesi Kimya Mühendisliği Bölümü ÇÖZELTİ VE TÜRLERİ Eğer bir madde diğer bir madde içinde molekül, atom veya iyonları
Genel Kimya Bölüm 7: ÇÖZELTİLER VE ÇÖZÜNÜRLÜK Yrd. Doç. Dr. Mustafa SERTÇELİK Kafkas Üniversitesi Kimya Mühendisliği Bölümü ÇÖZELTİ VE TÜRLERİ Eğer bir madde diğer bir madde içinde molekül, atom veya iyonları
7. Sınıf Fen ve Teknoloji
 KONU: Atomun Yapısı Saçlarımızın elektriklenmesi, araba kapısına çarpan parmak uçlarımızın elektriksel yük boşalmasından dolayı karıncalanması, cam çubuğun kumaşa sürtüldükten sonra kâğıdı çekmesi, kazağımızı
KONU: Atomun Yapısı Saçlarımızın elektriklenmesi, araba kapısına çarpan parmak uçlarımızın elektriksel yük boşalmasından dolayı karıncalanması, cam çubuğun kumaşa sürtüldükten sonra kâğıdı çekmesi, kazağımızı
MADDE NEDİR? Çevremize baktığımızda gördüğümüz her şey örneğin, dağlar, denizler, ağaçlar, bitkiler, hayvanlar ve hava birer maddedir.
 MADDE NEDİR? Çevremize baktığımızda gördüğümüz her şey örneğin, dağlar, denizler, ağaçlar, bitkiler, hayvanlar ve hava birer maddedir. Her maddenin bir kütlesi vardır ve bu tartılarak bulunur. Ayrıca her
MADDE NEDİR? Çevremize baktığımızda gördüğümüz her şey örneğin, dağlar, denizler, ağaçlar, bitkiler, hayvanlar ve hava birer maddedir. Her maddenin bir kütlesi vardır ve bu tartılarak bulunur. Ayrıca her
Serüveni 3. ÜNİTE KİMYASAL TÜRLER ARASI ETKİLEŞİM GÜÇLÜ ETKİLEŞİM. o İYONİK BAĞ o KOVALENT BAĞ o METALİK BAĞ
 Serüveni 3. ÜNİTE KİMYASAL TÜRLER ARASI ETKİLEŞİM GÜÇLÜ ETKİLEŞİM o İYONİK BAĞ o KOVALENT BAĞ o METALİK BAĞ KİMYASAL TÜR 1. İYONİK BAĞ - - Ametal.- Kök Kök Kök (+) ve (-) yüklü iyonların çekim kuvvetidir..halde
Serüveni 3. ÜNİTE KİMYASAL TÜRLER ARASI ETKİLEŞİM GÜÇLÜ ETKİLEŞİM o İYONİK BAĞ o KOVALENT BAĞ o METALİK BAĞ KİMYASAL TÜR 1. İYONİK BAĞ - - Ametal.- Kök Kök Kök (+) ve (-) yüklü iyonların çekim kuvvetidir..halde
BĐLEŞĐK FORMÜLLERĐNĐN ADLANDIRILMASI
 BĐLEŞĐK FORMÜLLERĐNĐN KONU ANLATIMI FĐGEN HASRET BĐLEŞĐK FORMÜLLERĐNĐN 1) METAL ĐLE AMETALDEN OLUŞAN BĐLEŞĐKLERĐN METALĐN ADI + AMETALĐN ADI + ÜR EKĐ ***Ametal oksijen ise oksit; azot ise nitrür; kükürt
BĐLEŞĐK FORMÜLLERĐNĐN KONU ANLATIMI FĐGEN HASRET BĐLEŞĐK FORMÜLLERĐNĐN 1) METAL ĐLE AMETALDEN OLUŞAN BĐLEŞĐKLERĐN METALĐN ADI + AMETALĐN ADI + ÜR EKĐ ***Ametal oksijen ise oksit; azot ise nitrür; kükürt
Aşağıdaki bileşiklerde atomlar arasmda oluşan bağlan noktalı yerlere yazınız. (fi» jh» w& 12^S»ııNa, çf, 17CI) ı. ch4... 2...
 Aşağıdaki bileşiklerde atomlar arasmda oluşan bağlan noktalı yerlere yazınız. (fi» jh» w& 12^S»ııNa, çf, 17CI) ı. ch4... 2.... 3. MgCI2... 4. NaF... Bileşik Formülleri Bileşik formüllerinin yazılması İki
Aşağıdaki bileşiklerde atomlar arasmda oluşan bağlan noktalı yerlere yazınız. (fi» jh» w& 12^S»ııNa, çf, 17CI) ı. ch4... 2.... 3. MgCI2... 4. NaF... Bileşik Formülleri Bileşik formüllerinin yazılması İki
ELEMENT VE BİLEŞİKLER
 ELEMENT VE BİLEŞİKLER ELEMENT : Aynı cins atomlardan meydana gelmiş saf maddelere denir. ÖZELLİKLERİ: 1.Yapılarında aynı cins atom bulundururlar. Demir elementi Demir atomları Demir elementinin yapısında
ELEMENT VE BİLEŞİKLER ELEMENT : Aynı cins atomlardan meydana gelmiş saf maddelere denir. ÖZELLİKLERİ: 1.Yapılarında aynı cins atom bulundururlar. Demir elementi Demir atomları Demir elementinin yapısında
ELEMENT Aynı tür atomlardan oluşmuş saf maddelere element denir. ELEMENTLERİN ÖZELLİKLERİ 1. Aynı tür atomlardan oluşurlar. 2. Saf ve homojendirler.
 SAF MADDE: Aynı cins atom ya da moleküllerden oluşmuş maddelere, saf medde ÖR. Elementler saf maddelerdir. Çünkü; hepsi aynı cins atomlardan oluşmuşlardır. Bileşikler saf maddelerdir. Çünkü; hepsi aynı
SAF MADDE: Aynı cins atom ya da moleküllerden oluşmuş maddelere, saf medde ÖR. Elementler saf maddelerdir. Çünkü; hepsi aynı cins atomlardan oluşmuşlardır. Bileşikler saf maddelerdir. Çünkü; hepsi aynı
1H: 1s 1 1.periyot 1A grubu. 5B: 1s 2 2s 2 2p 1 2.periyot 3A grubu. 8O: 1s 2 2s 2 2p 4 2.periyot 6A grubu. 10Ne: 1s 2 2s 2 2p 6
 PERİYODİK CETVEL Periyodik cetvel, benzer kimyasal özellik gösteren elementlerin alt alta gelecek şekilde artan atom numaralarına göre sıralandıkları çizelgelerdir. Periyodik cetveli oluşturan yatay satırlara
PERİYODİK CETVEL Periyodik cetvel, benzer kimyasal özellik gösteren elementlerin alt alta gelecek şekilde artan atom numaralarına göre sıralandıkları çizelgelerdir. Periyodik cetveli oluşturan yatay satırlara
GENEL KİMYA. 4. Konu: Kimyasal türler, Kimyasal türler arasındaki etkileşimler, Kimyasal Bağlar
 GENEL KİMYA 4. Konu: Kimyasal türler, Kimyasal türler arasındaki etkileşimler, Kimyasal Bağlar Kimyasal Türler Doğada bulunan bütün maddeler tanecikli yapıdadır. Maddenin özelliğini gösteren küçük yapı
GENEL KİMYA 4. Konu: Kimyasal türler, Kimyasal türler arasındaki etkileşimler, Kimyasal Bağlar Kimyasal Türler Doğada bulunan bütün maddeler tanecikli yapıdadır. Maddenin özelliğini gösteren küçük yapı
PERİYODİK SİSTEM VE ELEKTRON DİZİLİMLERİ#6
 PERİYODİK SİSTEM VE ELEKTRON DİZİLİMLERİ#6 Periyodik sistemde yatay sıralara Düşey sütunlara.. adı verilir. 1.periyotta element, 2 ve 3. periyotlarda..element, 4 ve 5.periyotlarda.element 6 ve 7. periyotlarda
PERİYODİK SİSTEM VE ELEKTRON DİZİLİMLERİ#6 Periyodik sistemde yatay sıralara Düşey sütunlara.. adı verilir. 1.periyotta element, 2 ve 3. periyotlarda..element, 4 ve 5.periyotlarda.element 6 ve 7. periyotlarda
KARIŞIMLAR. Birden çok maddenin kimyasal bağ oluşturmadan bir arada bulunmasıyla meydana gelen mad-delere karışım denir.
 KARIŞIMLAR Birden çok maddenin kimyasal bağ oluşturmadan bir arada bulunmasıyla meydana gelen mad-delere karışım denir. 1-HETEROJEN KARIŞIMLAR (ADİ KARIŞIMLAR) Karışımı oluşturan maddeler karışımın her
KARIŞIMLAR Birden çok maddenin kimyasal bağ oluşturmadan bir arada bulunmasıyla meydana gelen mad-delere karışım denir. 1-HETEROJEN KARIŞIMLAR (ADİ KARIŞIMLAR) Karışımı oluşturan maddeler karışımın her
4. SINIF KİMYA KONU ANLATIMI MADDE NEDİR?
 4. SINIF KİMYA KONU ANLATIMI MADDE NEDİR? Kütlesi, hacmi ve eylemsizliği olan herşey maddedir. Buna göre kütle hacim ve eylemsizlik maddenin ortak özelliklerindendir. Çevremizde gördüğümüz, hava, su, toprak
4. SINIF KİMYA KONU ANLATIMI MADDE NEDİR? Kütlesi, hacmi ve eylemsizliği olan herşey maddedir. Buna göre kütle hacim ve eylemsizlik maddenin ortak özelliklerindendir. Çevremizde gördüğümüz, hava, su, toprak
GENEL KİMYA. 4. Konu: Kimyasal türler, Kimyasal türler arasındaki etkileşimler, Kimyasal Bağlar
 GENEL KİMYA 4. Konu: Kimyasal türler, Kimyasal türler arasındaki etkileşimler, Kimyasal Bağlar Kimyasal Türler Doğada bulunan bütün maddeler tanecikli yapıdadır. Maddenin özelliğini gösteren küçük yapı
GENEL KİMYA 4. Konu: Kimyasal türler, Kimyasal türler arasındaki etkileşimler, Kimyasal Bağlar Kimyasal Türler Doğada bulunan bütün maddeler tanecikli yapıdadır. Maddenin özelliğini gösteren küçük yapı
Serüveni. 1.ÜNİTE: KİMYA BİLİMİ Kimyanın Sembolik Dili #3
 Serüveni 1.ÜNİTE: KİMYA BİLİMİ Kimyanın Sembolik Dili #3 MADDE SAF MADDE SAF OLMAYAN MADDE(KARIŞIM) ELEMENT BİLEŞİK HOMOJEN KARIŞIM HETEROJEN KARIŞIM METAL İYONİK BİLEŞİKLER SÜSPANSİYON AMETAL KOVALENT
Serüveni 1.ÜNİTE: KİMYA BİLİMİ Kimyanın Sembolik Dili #3 MADDE SAF MADDE SAF OLMAYAN MADDE(KARIŞIM) ELEMENT BİLEŞİK HOMOJEN KARIŞIM HETEROJEN KARIŞIM METAL İYONİK BİLEŞİKLER SÜSPANSİYON AMETAL KOVALENT
Maddenin Yapısı ve Özellikleri
 Maddenin Yapısı ve Özellikleri Madde ve Özellikleri Kütlesi hacmi ve eylemsizliği olan her şeye madde denir. Maddenin şekil almış haline cisim denir. Cam bir madde iken cam bardak bir cisimdir. Maddeler
Maddenin Yapısı ve Özellikleri Madde ve Özellikleri Kütlesi hacmi ve eylemsizliği olan her şeye madde denir. Maddenin şekil almış haline cisim denir. Cam bir madde iken cam bardak bir cisimdir. Maddeler
Serüveni 3.ÜNİTE:KİMYASAL TÜRLER ARASI ETKİLEŞİM FİZİKSEL VE KİMYASAL DEĞİŞİM KİMYASAL TEPKİME TÜRLERİ
 Serüveni 3.ÜNİTE:KİMYASAL TÜRLER ARASI ETKİLEŞİM FİZİKSEL VE KİMYASAL DEĞİŞİM KİMYASAL TEPKİME TÜRLERİ FİZİKSEL VE KİMYASAL DEĞİŞİM FİZİKSEL DEĞİŞİM Beş duyu organımızla algıladığımız fiziksel özelliklerdeki
Serüveni 3.ÜNİTE:KİMYASAL TÜRLER ARASI ETKİLEŞİM FİZİKSEL VE KİMYASAL DEĞİŞİM KİMYASAL TEPKİME TÜRLERİ FİZİKSEL VE KİMYASAL DEĞİŞİM FİZİKSEL DEĞİŞİM Beş duyu organımızla algıladığımız fiziksel özelliklerdeki
PERİYODİK CETVEL. Yanıt : D. www.kimyahocam.com. 3 Li : 1s2 2s 1 2. periyot 1A grubu. 16 S : 1s2 2s 2 2p 6 3s 2 3p 4 3.
 PERİODİK CETVEL Periyodik cetvel, elementlerin atom numaraları temel alınarak düzenlenmiş bir sistemdir. Periyodik cetvelde, nötr atomlarının elektron içeren temel enerji düzeyi sayısı aynı olan elementler
PERİODİK CETVEL Periyodik cetvel, elementlerin atom numaraları temel alınarak düzenlenmiş bir sistemdir. Periyodik cetvelde, nötr atomlarının elektron içeren temel enerji düzeyi sayısı aynı olan elementler
Radyoaktif elementin tek başına bulunması, bileşik içinde bulunması, katı, sıvı, gaz, iyon halinde bulunması radyoaktif özelliğini etkilemez.
 RADYOAKTİFLİK Kendiliğinden ışıma yapabilen maddelere radyoaktif maddeler denir. Radyoaktiflik çekirdek yapısıyla ilişkilidir. Radyoaktif bir atom hangi bileşiğin yapısına girerse o bileşiği radyoaktif
RADYOAKTİFLİK Kendiliğinden ışıma yapabilen maddelere radyoaktif maddeler denir. Radyoaktiflik çekirdek yapısıyla ilişkilidir. Radyoaktif bir atom hangi bileşiğin yapısına girerse o bileşiği radyoaktif
1. ÜNİTE: MODERN ATOM TEORİSİ İyon Yükleri ve Yükseltgenme Basamakları
 1. ÜNİTE: MODERN ATOM TEORİSİ 1.7. İyon Yükleri ve Yükseltgenme Basamakları Yüksüz bir atomun yapısındaki pozitif (+) yüklü protonlarla negatif () yüklü elektronların sayıları birbirine eşittir. Yüksüz
1. ÜNİTE: MODERN ATOM TEORİSİ 1.7. İyon Yükleri ve Yükseltgenme Basamakları Yüksüz bir atomun yapısındaki pozitif (+) yüklü protonlarla negatif () yüklü elektronların sayıları birbirine eşittir. Yüksüz
Soygazların bileşik oluşturamamasının sebebi bütün orbitallerinin dolu olmasındandır.
 KİMYASAL BAĞLAR Kimyasal bağ, moleküllerde atomları birarada tutan kuvvettir. Bir bağın oluşabilmesi için atomlar tek başına bulundukları zamankinden daha kararlı (az enerjiye sahip) olmalıdırlar. Genelleme
KİMYASAL BAĞLAR Kimyasal bağ, moleküllerde atomları birarada tutan kuvvettir. Bir bağın oluşabilmesi için atomlar tek başına bulundukları zamankinden daha kararlı (az enerjiye sahip) olmalıdırlar. Genelleme
DERSĐN SORUMLUSU : PROF.DR ĐNCĐ MORGĐL
 DERSĐN SORUMLUSU : PROF.DR ĐNCĐ MORGĐL HAZIRLAYAN : HALE ÜNAL KĐMYASAL REAKSĐYONLARA GĐRĐŞ -Değişmeler ve Tepkime Türleri- Yeryüzünde bulunan tüm maddeler değişim ve etkileşim içerisinde bulunur. Maddelerdeki
DERSĐN SORUMLUSU : PROF.DR ĐNCĐ MORGĐL HAZIRLAYAN : HALE ÜNAL KĐMYASAL REAKSĐYONLARA GĐRĐŞ -Değişmeler ve Tepkime Türleri- Yeryüzünde bulunan tüm maddeler değişim ve etkileşim içerisinde bulunur. Maddelerdeki
ELEMENT VE BİLEŞİKLER
 ELEMENT VE BİLEŞİKLER 1- Elementler ve Elementlerin Özellikleri: a) Elementler: Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere
ELEMENT VE BİLEŞİKLER 1- Elementler ve Elementlerin Özellikleri: a) Elementler: Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere
İnstagram:kimyaci_gln_hoca MODERN ATOM TEORİSİ-2.
 MODERN ATOM TEORİSİ-2 ATOM YARIÇAPI PERİYODİK ÖZELLİK DEĞİŞİMİ Kovalent Yarıçap: Tek bir kovalent bağla bağlanmış eşdeğer iki atomun çekirdekleri arasındaki uzaklığın yarısına kovalent yarıçap denir.(şekil1)
MODERN ATOM TEORİSİ-2 ATOM YARIÇAPI PERİYODİK ÖZELLİK DEĞİŞİMİ Kovalent Yarıçap: Tek bir kovalent bağla bağlanmış eşdeğer iki atomun çekirdekleri arasındaki uzaklığın yarısına kovalent yarıçap denir.(şekil1)
MADDENİN YAPISI VE ÖZELLİKLERİ
 MADDENİN YAPISI VE ÖZELLİKLERİ 1. Atomun Yapısı KONULAR 2.Element ve Sembolleri 3. Elektronların Dizilimi ve Kimyasal Özellikler 4. Kimyasal Bağ 5. Bileşikler ve Formülleri 6. Karışımlar 1.Atomun Yapısı
MADDENİN YAPISI VE ÖZELLİKLERİ 1. Atomun Yapısı KONULAR 2.Element ve Sembolleri 3. Elektronların Dizilimi ve Kimyasal Özellikler 4. Kimyasal Bağ 5. Bileşikler ve Formülleri 6. Karışımlar 1.Atomun Yapısı
GÜLEN MUHARREM PAKOĞLU ORTAOKULU FEN BİLİMLERİ 8 SORU BANKASI
 1- John Newlands: Bilinen elementleri artan atom ağırlıklarına göre sıralamıştır. Alexandre Beguyer de Chancourtois: İlk periyodik çizelgeyi oluşturmuştur. Elementler dışında bazı iyon ve bileşiklere de
1- John Newlands: Bilinen elementleri artan atom ağırlıklarına göre sıralamıştır. Alexandre Beguyer de Chancourtois: İlk periyodik çizelgeyi oluşturmuştur. Elementler dışında bazı iyon ve bileşiklere de
ÖĞRETĐM TEKNOLOJĐSĐ VE MATERYAL GELĐŞTĐRME
 ÖĞRETĐM TEKNOLOJĐSĐ VE MATERYAL GELĐŞTĐRME KONU: MADDE VE ÖZELLĐKLERĐ (Konu Anlatımı) Hazırlayan: Pınar ÖZCAN Ders Sorumlusu: Prof. Dr. Đnci MORGĐL ANKARA,2008 MADDE VE ÖZELLĐKLERĐ MADDE Kütlesi, hacmi
ÖĞRETĐM TEKNOLOJĐSĐ VE MATERYAL GELĐŞTĐRME KONU: MADDE VE ÖZELLĐKLERĐ (Konu Anlatımı) Hazırlayan: Pınar ÖZCAN Ders Sorumlusu: Prof. Dr. Đnci MORGĐL ANKARA,2008 MADDE VE ÖZELLĐKLERĐ MADDE Kütlesi, hacmi
3- KİMYASAL ELEMENTLER VE FONKSİYONLARI
 3- KİMYASAL ELEMENTLER VE FONKSİYONLARI Doğada 103 elementin olduğu bilinmektedir. Bunlardan 84 metal elementlerdir. Metal elementler toksik olan ve toksik olmayan elementler olarak ikiye ayrılmaktadır.
3- KİMYASAL ELEMENTLER VE FONKSİYONLARI Doğada 103 elementin olduğu bilinmektedir. Bunlardan 84 metal elementlerdir. Metal elementler toksik olan ve toksik olmayan elementler olarak ikiye ayrılmaktadır.
KİMYASAL BAĞLAR İYONİK BAĞ KOVALANT BAĞ POLAR KOVALENT BAĞ APOLAR KOVALENT BAĞ
 KİMYASAL BAĞLAR İYONİK BAĞ KOVALANT BAĞ POLAR KOVALENT BAĞ APOLAR KOVALENT BAĞ Atomlar bağ yaparken, elektron dizilişlerini soy gazlara benzetmeye çalışırlar. Bir atomun yapabileceği bağ sayısı, sahip
KİMYASAL BAĞLAR İYONİK BAĞ KOVALANT BAĞ POLAR KOVALENT BAĞ APOLAR KOVALENT BAĞ Atomlar bağ yaparken, elektron dizilişlerini soy gazlara benzetmeye çalışırlar. Bir atomun yapabileceği bağ sayısı, sahip
EYVAH ŞEKERĐM KAYBOLDU!!!!! 9. SINIF 4. ÜNĐTE KARIŞIMLAR
 EYVAH ŞEKERĐM KAYBOLDU!!!!! 9. SINIF 4. ÜNĐTE KARIŞIMLAR KĐMYA ĐLE ĐLĐŞKĐSĐ ve GÜNLÜK HAYATLA ĐLĐŞKĐSĐ ŞEKERĐN ÇAYDA YA DA BAŞKA BĐR SIVIDA KARIŞTIRILDIĞINDA KAYBOLMASI, KĐMYADA ÇÖZÜNME OLGUSUYLA AÇIKLANABĐLĐR.
EYVAH ŞEKERĐM KAYBOLDU!!!!! 9. SINIF 4. ÜNĐTE KARIŞIMLAR KĐMYA ĐLE ĐLĐŞKĐSĐ ve GÜNLÜK HAYATLA ĐLĐŞKĐSĐ ŞEKERĐN ÇAYDA YA DA BAŞKA BĐR SIVIDA KARIŞTIRILDIĞINDA KAYBOLMASI, KĐMYADA ÇÖZÜNME OLGUSUYLA AÇIKLANABĐLĐR.
MADDENİN HALLERİ VE TANECİKLİ YAPI
 MADDENİN HALLERİ VE TANECİKLİ YAPI MADDE BİLGİSİ Kütlesi hacmi ve eylemsizliği olan her şeye madde denir. Maddenin şekil almış haline cisim denir. Cam bir madde iken cam bardak bir cisimdir. Maddeler doğada
MADDENİN HALLERİ VE TANECİKLİ YAPI MADDE BİLGİSİ Kütlesi hacmi ve eylemsizliği olan her şeye madde denir. Maddenin şekil almış haline cisim denir. Cam bir madde iken cam bardak bir cisimdir. Maddeler doğada
Elektronların Dizilimi ve Kimyasal Bağlar
 Elektronların Dizilimi ve Kimyasal Bağlar Elektronların Dizilimi Elektronlar çekirdek çevresindeki yörüngelerde dönerek hareket ederler. Çekirdeğe en yakın yörünge 1 olmak üzere dışa doğru 2, 3,4... olarak
Elektronların Dizilimi ve Kimyasal Bağlar Elektronların Dizilimi Elektronlar çekirdek çevresindeki yörüngelerde dönerek hareket ederler. Çekirdeğe en yakın yörünge 1 olmak üzere dışa doğru 2, 3,4... olarak
STOKİYOMETRİ. Kimyasal Tepkimelerde Kütle İlişkisi
 STOKİYOMETRİ Kimyasal Tepkimelerde Kütle İlişkisi Sülfür oksijen içerisinde yanarak kükürt dioksit oluşturur. Modeller elementel sülfürü (S8), oksijeni ve kükürt dioksit moleküllerini göstermektedir. Her
STOKİYOMETRİ Kimyasal Tepkimelerde Kütle İlişkisi Sülfür oksijen içerisinde yanarak kükürt dioksit oluşturur. Modeller elementel sülfürü (S8), oksijeni ve kükürt dioksit moleküllerini göstermektedir. Her
ATOMUN YAPISI ATOMUN ÖZELLİKLERİ
 ATOM Elementlerin özelliğini taşıyan, en küçük yapı taşına, atom diyoruz. veya, fiziksel ve kimyasal yöntemlerle daha basit birimlerine ayrıştırılamayan, maddenin en küçük birimine atom denir. Helyum un
ATOM Elementlerin özelliğini taşıyan, en küçük yapı taşına, atom diyoruz. veya, fiziksel ve kimyasal yöntemlerle daha basit birimlerine ayrıştırılamayan, maddenin en küçük birimine atom denir. Helyum un
ELEMENTLER VE BİLEŞİKLER
 ELEMENTLER VE BİLEŞİKLER 1- Elementler ve Elementlerin Özellikleri a) ELEMENTLER Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere
ELEMENTLER VE BİLEŞİKLER 1- Elementler ve Elementlerin Özellikleri a) ELEMENTLER Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere
ELEKTRONLARIN DĠZĠLĠMĠ
 ELEKTRONLARIN DĠZĠLĠMĠ Eğer bu üç elementin birer elektronu daha olsaydı, her birinde yeni bir katman oluşacaktı. Çünkü her üçünün de en dıştaki katmanları tamamen dolu durumdadır. 1.Katmanda en çok 2
ELEKTRONLARIN DĠZĠLĠMĠ Eğer bu üç elementin birer elektronu daha olsaydı, her birinde yeni bir katman oluşacaktı. Çünkü her üçünün de en dıştaki katmanları tamamen dolu durumdadır. 1.Katmanda en çok 2
1 mol = 6, tane tanecik. Maddelerde tanecik olarak atom, molekül ve iyonlar olduğunda dolayı mol ü aşağıdaki şekillerde tanımlamak mümkündür.
 1 GENEL KİMYA Mol Kavramı 1 Mol Kavramı Günlük hayatta kolaylık olsun diye, çok küçük taneli olan maddeler tane yerine birimlerle ifade edilir. Örneğin pirinç alınırken iki milyon tane pirinç yerine ~
1 GENEL KİMYA Mol Kavramı 1 Mol Kavramı Günlük hayatta kolaylık olsun diye, çok küçük taneli olan maddeler tane yerine birimlerle ifade edilir. Örneğin pirinç alınırken iki milyon tane pirinç yerine ~
Periyodik Tablo(sistem)
 Periyodik Tablo(sistem) Geçmişten Günümüze Periyodik Tablo Bilim adamları elementlerin sayısı arttıkça bunları benzer özelliklerine göre sıralamaya çalışmışlardır.(bunu süpermarketlerdeki ürünlerin dizilişlerine
Periyodik Tablo(sistem) Geçmişten Günümüze Periyodik Tablo Bilim adamları elementlerin sayısı arttıkça bunları benzer özelliklerine göre sıralamaya çalışmışlardır.(bunu süpermarketlerdeki ürünlerin dizilişlerine
KİM-117 TEMEL KİMYA Prof. Dr. Zeliha HAYVALI Ankara Üniversitesi Kimya Bölümü
 KİM-117 TEMEL KİMYA Prof. Dr. Zeliha HAYVALI Ankara Üniversitesi Kimya Bölümü Bu slaytlarda anlatılanlar sadece özet olup ayrıntılı bilgiler ve örnek çözümleri derste verilecektir. BÖLÜM 5 ATOM ÇEKİRDEĞİNİN
KİM-117 TEMEL KİMYA Prof. Dr. Zeliha HAYVALI Ankara Üniversitesi Kimya Bölümü Bu slaytlarda anlatılanlar sadece özet olup ayrıntılı bilgiler ve örnek çözümleri derste verilecektir. BÖLÜM 5 ATOM ÇEKİRDEĞİNİN
CANLILARIN KİMYASAL İÇERİĞİ
 CANLILARIN KİMYASAL İÇERİĞİ Prof. Dr. Bektaş TEPE Canlıların Savunma Amaçlı Kimyasal Üretimi 2 Bu ünite ile; Canlılık öğretisinde kullanılan kimyasal kavramlar Hiyerarşi düzeyi Hiyerarşiden sorumlu atom
CANLILARIN KİMYASAL İÇERİĞİ Prof. Dr. Bektaş TEPE Canlıların Savunma Amaçlı Kimyasal Üretimi 2 Bu ünite ile; Canlılık öğretisinde kullanılan kimyasal kavramlar Hiyerarşi düzeyi Hiyerarşiden sorumlu atom
T.C. Ölçme, Seçme ve Yerleştirme Merkezi
 T.C. Ölçme, Seçme ve Yerleştirme Merkezi LİSANS YERLEŞTİRME SINAVI-2 KİMYA TESTİ 25 HAZİRAN 2016 CUMARTESİ Bu testlerin her hakkı saklıdır. Hangi amaçla olursa olsun, testlerin tamamının veya bir kısmının
T.C. Ölçme, Seçme ve Yerleştirme Merkezi LİSANS YERLEŞTİRME SINAVI-2 KİMYA TESTİ 25 HAZİRAN 2016 CUMARTESİ Bu testlerin her hakkı saklıdır. Hangi amaçla olursa olsun, testlerin tamamının veya bir kısmının
ÖĞRETĐM TEKNOLOJĐSĐ VE MATERYAL GELĐŞTĐRME ÇÖZELTĐLER
 ÖĞRETĐM TEKNOLOJĐSĐ VE MATERYAL GELĐŞTĐRME ÇÖZELTĐLER Ders Sorumlusu: Prof. Dr. Đnci MORGĐL HAZIRLAYAN: NAZLI KIRCI ANKARA,2008 KONU ANLATIMI ÇÖZELTĐLER Đki ya da daha fazla kimyasal maddenin herhangi
ÖĞRETĐM TEKNOLOJĐSĐ VE MATERYAL GELĐŞTĐRME ÇÖZELTĐLER Ders Sorumlusu: Prof. Dr. Đnci MORGĐL HAZIRLAYAN: NAZLI KIRCI ANKARA,2008 KONU ANLATIMI ÇÖZELTĐLER Đki ya da daha fazla kimyasal maddenin herhangi
2.ÜNİTE:ATOM VE PERİYODİK SİSTEM ATOM ALTI TANECİKLER
 2.ÜNİTE:ATOM VE PERİYODİK SİSTEM ATOM ALTI TANECİKLER ATOM ALTI TANECİKLER: Atom numarası=proton sayısı=çekirdek yükü Kütle numarası (Nükleon sayısı)=proton sayısı+ nötron sayısı Kütle No iyon yükü Atom
2.ÜNİTE:ATOM VE PERİYODİK SİSTEM ATOM ALTI TANECİKLER ATOM ALTI TANECİKLER: Atom numarası=proton sayısı=çekirdek yükü Kütle numarası (Nükleon sayısı)=proton sayısı+ nötron sayısı Kütle No iyon yükü Atom
6. I. Sirke ruhu (CH 3 COOH)
 ph ve poh Kavramları - Asit Baz İndikatörleri BÖLÜM 08 Test 04 1. Aşağıdaki maddelerin standart koşullarda ph değerleri ile ilgili verilen bilgilerden hangisi yanlıştır? 4. mavi turnusol kağıdı kırmızı
ph ve poh Kavramları - Asit Baz İndikatörleri BÖLÜM 08 Test 04 1. Aşağıdaki maddelerin standart koşullarda ph değerleri ile ilgili verilen bilgilerden hangisi yanlıştır? 4. mavi turnusol kağıdı kırmızı
ELEKTRONLARIN DİZİLİMİ, KİMYASAL ÖZELLİKLERİ VE
 ELEKTRONLARIN DİZİLİMİ, KİMYASAL ÖZELLİKLERİ VE ELEMENTLER ELEMENTLER METALLER AMETALLER SOYGAZLAR Hiçbir kimyasal ayırma yöntemi ile kendinden daha basit maddelere ayrıştırılamayan saf maddelere element
ELEKTRONLARIN DİZİLİMİ, KİMYASAL ÖZELLİKLERİ VE ELEMENTLER ELEMENTLER METALLER AMETALLER SOYGAZLAR Hiçbir kimyasal ayırma yöntemi ile kendinden daha basit maddelere ayrıştırılamayan saf maddelere element
Ġyon halindeki elektron sayısı: 10 Proton sayısı: Adı: Sembolü Periyodik tablodaki yeri:
 PERĠYODĠK TABLO ÇALIġMA KÂĞIDI Yandaki periyodik tabloda verilen yönlere göre cümlelerdeki yanlıģlıkları bulup doğru ifadeyi boģ bırakılan yere yazınız. ( Bütün cümlelerde yanlışlık vardır.) 1 yönünde
PERĠYODĠK TABLO ÇALIġMA KÂĞIDI Yandaki periyodik tabloda verilen yönlere göre cümlelerdeki yanlıģlıkları bulup doğru ifadeyi boģ bırakılan yere yazınız. ( Bütün cümlelerde yanlışlık vardır.) 1 yönünde
Birden çok maddenin kimyasal bağ oluşturmadan bir arada bulunmasıyla meydana gelen maddelere karışım denir.
 Anahtar Kavramlar Çözelti çözücü çözünen homojen hetorojen derişik seyreltik Birden çok maddenin kimyasal bağ oluşturmadan bir arada bulunmasıyla meydana gelen maddelere karışım denir. Solduğumuz hava;
Anahtar Kavramlar Çözelti çözücü çözünen homojen hetorojen derişik seyreltik Birden çok maddenin kimyasal bağ oluşturmadan bir arada bulunmasıyla meydana gelen maddelere karışım denir. Solduğumuz hava;
MADDENİN YAPISI VE ÖZELLİKLERİ
 MADDENİN YAPISI VE ÖZELLİKLERİ MADDENİN YAPISI VE ÖZELLİKLERİ Elementler ve Sembolleri Atomun Yapısı Elektronların Dizilimi ve Kimyasal Özellikleri Kimyasal Bağ Bileşikler ve Formülleri Karışımlar Bu ünitede
MADDENİN YAPISI VE ÖZELLİKLERİ MADDENİN YAPISI VE ÖZELLİKLERİ Elementler ve Sembolleri Atomun Yapısı Elektronların Dizilimi ve Kimyasal Özellikleri Kimyasal Bağ Bileşikler ve Formülleri Karışımlar Bu ünitede
Çözeltiler. MÜHENDİSLİK KİMYASI DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN. Yrd. Doç. Dr. Atilla EVCİN Afyonkarahisar Kocatepe Üniversitesi 2006
 Çözeltiler Çözelti, iki veya daha fazla maddenin homojen bir karışımı olup, en az iki bileşenden oluşur. Bileşenlerden biri çözücü, diğeri ise çözünendir. MÜHENDİSLİK KİMYASI DERS NOTLARI Yrd. Doç. Dr.
Çözeltiler Çözelti, iki veya daha fazla maddenin homojen bir karışımı olup, en az iki bileşenden oluşur. Bileşenlerden biri çözücü, diğeri ise çözünendir. MÜHENDİSLİK KİMYASI DERS NOTLARI Yrd. Doç. Dr.
