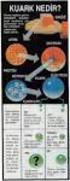
KMYASAL BALAR ATOM YARIÇAPI YONLAMA ENERJS ELEKTRON LGS ELEKTRONEGATFLK YONK BA KOVALENT BA YONK VE KOVALENT BA ARASINDAK GEÇ LEWS YAPILARI
|
|
|
- Su Kent
- 8 yıl önce
- İzleme sayısı:
Transkript
1 KMYASAL BALAR ATOM YARIÇAPI YONLAMA ENERJS ELEKTRON LGS ELEKTRONEGATFLK YONK BA KOVALENT BA YONK VE KOVALENT BA ARASINDAK GEÇ LEWS YAPILARI
2 Nötral Atomlarn Yarçaplar 1.Kovalent Yarçap 2.Metalik Yarçap 3.Van der Waals Yarçap 4.yonik Yarçap
3 Metalik ve Kovalent Yarçap Cl nun yarçap ve C-Cl ba uzunluu bilindii için C yarçap bulunabilir.
4 Van der Waals yarçap, birbiri ile temas halinde olan moleküller arasndaki uzakl temel alr. Çekirdekler arasndaki uzaklk, VDW yarçaplar toplamndan büyükse bir ba olu%mad söylenebilir.
5 Atom Yarçap Na 1.90 Mg 1.60 Al 1.43 Si 1.32 P 1.28 S 1.27 Metal yarıçapı Elektron says artt halde boyut niçin azalr?
6 Bir periyot boyunca, etkin çekirdek yükü (Z*) artt için yarçap azalr Bir grup boyunca, yeni kabuk ilave edildii için yarçap artar -stisna: Ga un yarçap Al dan dü%üktür Nedeni: d-blok büzülmesi Z* Ga > Z* Al çünkü, d orb. perdelenmesi dü%üktür
7
8 Grup boyunca - Kabuk says artmakta - p says artar buna bal Z * artar ancak grup boyunca ÇAP KÜÇÜLMEZ NEDEN? En d%taki kabukta bulunan e - lar iç kabuklarda bulunan e - larn perdeleme etkisi nedeniyle çekirdek yükünü tam olarak görmelerini engeller.
9 Grup boyunca - Perdeleyici e - says çekirdek yükünün art% hzyla ayn derecede artar ve en d%taki e - nn gördüü ETKN ÇEKRDEK YÜKÜ ayn kalr. Grup boyunca - Atom büyüklüü daha çok dolmu% elektron kabuklarnn says tarafndan tayin edilir.
10 Periyot boyunca IA VIIA atom r leri küçülür (ba% grup elementleri) Li F n=2 kabuu Ayn kabua e eklenir ve çekirdee p eklenir Perdeleme etkin de)il r küçülür
11 Geçi# ve iç geçi# elementlerinde atom çap büyüklüklerinde genellemeden sapmalar gözlenir. K Br Rb I olan 4. ve 5. periyotlarda; Geçi% elementlerinde atom yarçaplar e lar iç d-orbitallerini doldurur Bu e larn perdeleme etkisi ile en d%taki e larn etkin çekirdek yükünü görmesi azalr ve çap da azalma hz duraklar Sonrasnda d-orbitalleri doldukça r tekrar artmaya ba%lar
12 LANTANT BÜZÜLMES Farklla%trc elektronlar; 4f orbitallerine girerler ve burdaki elektronlarn 6s de bulunan eletronlar perdeleme etkisinin etkili olmamasndan dolay çapta sürekli bir küçülme gözlenir.lantanitleri izleyen geçi% elementleri tipik geçi% element modeli gösterirler. Z=72 Z= pm 145 pm
13 Elektronlarn perdeleme etkisi artarsa d% kabuktaki elektronlarn etkin çekirdek yükünü görmeleri azalr ve çap da art gözlenir tersi durumda; Perdeleme etkisi azalrsa etkin çekirdek yükü artar ve çapta küçülme gözlenir.
14 Pozitif yüklü iyonlarn yarçap, nötral atomlarndan daha küçüktür, çünkü etkin çekirdek yükü( Z*) artar. ATOM)K/)YON)K ÇAP
15 Negatif yüklü iyonlarn yarçap nötral atomlarndan daha büyüktür, çünkü Z* azalr. ATOM)K/)YON)K ÇAP
16 -zoelektronik Türler zoelektronik atomlar ve iyonlar ayn elektron diziliine sahiptir 1s 2 2s 2 2p 6 3s 2 3p 6 Cl pm Ar 174 pm K pm
17 Çekirdek yükü Elektron sayısı İyon yarıçapı (Å) O O 8 8 O Bal büyüküü açklaynz.
18 sorularrrrrrrrrrr
19 -yonla%ma Enerjisi Birinci iyonlama enerjisi, IE 1, izole bir atomdan bir elektron kopartmak için verilmesi gereken enerjidir. H ie artar H ie azalr
20 Ana grup elementlerinin 1. iyonla%ma enerjileri
21
22 Li dan Na a kadar olan elementlerin 1. -yonla%ma Enerjileri
23 I 1 < I 2 < I 3 < I 4 Al(g) Al + (g) + e - I 1 = 580 kj/mol Al + (g) Al 2+ (g) + e - I 2 = 1815 kj/mol Al 2+ (g) Al 3+ (g) + e - I 3 = 2740 kj/mol birinci ikinci üçüncü Al 3+ (g) Al 4+ (g) + e - I 4 = 11,600 kj/mol dördüncü )E (+) i#aretli olup endotermiktir (Sistem enerji so9urur)
24 Periyot boyunca birinci iyonlama enerjilerinde sapmalar Atom numarasna kar%lk 1. -yonla%ma Enerjisi B: [He]2s 2 2p 1 p orbitalleri, s orbitallerinden daha iyi perdelenir, bu nedenle Z* azalr ve H ie dü%er. O: [He]2s 2 2p 4 -lk e%le%en elektronlar arasnda olu%an itme, bir elektronun kaybedilmesini kolayla%trr.
25 grup boyunca birinci iyonla%ma enerjilerinde sapmalar Group 17 normal F > Cl > B r > I > At Sapma yok Group 13 sapma var B > Al < Ga > In < Tl Tl > Al ve Tl > Ga Ga da Z* büyüktür, çünkü 3d orbitallerine sahiptir. Tl da Z* büyüktür, çünkü inert çift etkisi (relativistik etki) mevcuttur.
26 E periyot boyunca artar NEDEN? Atomlar küçülür, EÇY artar ve -E artar E grup boyunca azalr NEDEN? ÇY artar atomlar büyür ve -E azalr(perdeleme) -E metal < 1000 kj, -E ametal > 1000 Kj -ç geçi% elementlerinin IE hemen hemen sabittir.
27 Periyotlardaki yonla-ma Enerjilerindeki sapmalar Periyot boyunca -E IA<3A <2A <4A <6A <5A <7A <8A %eklinde olup sapmalar; ns 2 tam dolu kabuklar (Be, Mg,Zn, Cd ve Hg) ns 2 np 3 yar dolmu% bir p alt kabuu içerenler (N, P ve As) görülmektedir.
28 Soru: 11 Na ve 10 Ne elementlerinin 1.!.E, 2.!.E ve 3.!.E. lerini k$yaslay$n$z 11 Na: 1s2 2s 2 2p 6 3s 1 10 Ne: 1s2 2s 2 2p 6 1.!.E si Ne>Na 11 Na+ : 1s 2 2s 2 2p 6 10 Ne+ : 1s 2 2s 2 2p 5 2.!.E si Na + >Ne + 11 Na2+ : 1s 2 2s 2 2p 5 10 Ne2+ : 1s 2 2s 2 2p 4 3.!.E si Na 2+ >Ne 2+ yonlama enerjileri kyaslanrken: 1) Son yörüngelerindeki / say$lar$na bak$l$r, / say$s$ fazla olan$n!.e si fazlad$r 2) Son yörüngelerindeki / say$lar$na bak$l$r, / say$lar$ ayn$ ise yörünge say$lar$na bak$l$r, yörünge say$s$ az olan$n!.e. si fazlad$r. 3) Hem yörünge say$s$ hem de / say$s$ ayn$ oldu4unda proton say$s$na bak$l$r, proton say$s$ fazla olan$n!.e. si fazlad$r. 4) Tam dolu simetri ve yar$ küresel simetri durumunda!.e si fazla olur
29 Örnek Problem: 1. )yonla#ma Enerjilerine Göre Sralama PROBLEM: Sadece periyodik tabloyu kullanarak, a%adaki elementleri -E 1 in azal% srasna göre sralaynz. (a) Kr, He, Ar (b) Sb, Te, Sn (c) K, Ca, Rb (d) I, Xe, Cs PLAN: IE bir grup içinde a%aya doru inildikçe azalr,bir periyotta saa doru gittikçe artar. ÇÖZÜM (a) He > Ar > Kr Group 8A(18) - IE bir grupta a%aya doru azalr. (b) Te > Sb > Sn (c) Ca > K > Rb 5. Periyot elementleri IE bir periyotta saa doru artar. Ca, K un sandadr; Rb K un a%asndadr. (d) Xe > I > Cs I Xe nun solundadr; Cs Iun bir periyot altnda ve daha a%adadr.
30 Örnek Problem: )yonla#ma Enerjisinden bir elementi tanmlamak IE 1 IE 2 IE 3 IE 4 IE 5 IE ,230 PLAN: Valans elektronlar ayrldn gösteren enerjideki büyük art% incelenecek ÇÖZÜM: Büyük art% IE 5 den sonra olu%ur bu 5. valans elektronu ayrldktan sonra olandr. Be% elektronunun konfigürasyonu 3s 2 3p 3 %eklindedir. Bu muhtemelen fosfor dur, P(15). Elektronik konfigürasyonun tamam: 1s 2 2s 2 2p 6 3s 2 3p 3.
31 Elektron )lgisi A(g) + ey A - (g) elektron ilgisi = U ( veya E) Gaz halindeki nötral bir atomun elektron almas ile aç9a çkan sdr (Genellikle E) ( - ) olup ekzotermiktir). (istisna: IIA ve VIIIA gruplar için endotermiktir) Toprak Alkalilerde E- (+) dir : ns 2 tam dolu simetri kararl yapdr. Soy gazlarda E- (+) dir : ns 2 np 6 tam dolu simetri kararl yapdr
32 E- artar E- azalr Na: [Ne]3s 1 ilave elektron ile dolu altkabuk oluur [Ne]3s 2, bu nedenle E yüksektir. Si: [Ne]3s 2 3p 2 ilave elektron ile [Ne]3s 2 3p 3 daha kararl" yar" dolu alt kabuk oluur, bu nedenle E yüksektir. P: [Ne]3s 2 3p 3 ilave elektron ile [Ne]3s 2 3p 4 elektron dizilii, e e itmesi oldu'u için E düüktür.
33 Ana Grup Elementlerinin Elektron )lgisi
34 stisnalar; Be (E- (+)) ns 2 tam dolu simetri N (E- (+)) ns 2 np 3 küresel simetri Ne (E- (+)) ns 2 np 6 tam dolu simetri Bu istisnalar 3p elementlerinde de görülür. Cl ün E, F ün E den büyüktür. NEDEN? E- atom çap ve çekirdek yükü ile ilgilidir. Cl ün çekirdek yükü büyüktür. Çekirdek yükü etkisi yarçap etkisinden büyüktür (elektron itmeleri younluu).
35 O (g) + e- ) O - (g) kj/mol birinci E- O - (g) + e- O2- (g) kj/mol ikinci E- ÖRNEK: ikinci E- niçin salan (endotermik) dir? O (negatif yüklü iyon ile e - itmeleri)
36 Elektronegatiflik, Molekül içindeki atomlarn ba! elektronlarn kendine çekme yetene!idir. X artar Kural X azalr 6 > 1.7 : iyonik ba 1.7 > X > 0.5 : polar kovalent ba X < 0.5 : apolar kovalent Geleneksel ölçek 0 ile 4 arasndadr. F için X = 4 kabul edilmi%tir.
37 Ba Polarl Ba9larn polarl9, ba9 elektronlarnn e#it olarak payla#lmamasndan kaynaklanr. Bütünn farkl atomlu ba9lar, bir miktar polariteye sahiptir.
38 Hangi ba9 daha polardr? O H O F OH ba9, OF den daha polardr ve polaritesi ters yönlüdür. - O + H + - O F
39 Molekül Polaritesi Apolar Polar
40 Apolar moleküller
41 Polar moleküller ller direction O of dipole moment H C H Formaldehyde µ = 2.33 D
42 DENEYSEL B-R ÖLÇÜM; D-POL MOMENT Dipol Moment, µ= Qd Q = Yük d= Yüklü tanecikler aras uzaklk Birimi Debye(D) dir.
43 D-POL MOMENT-N ÖLÇÜMÜ - + Metal plakalar arasnda voltaj uygulanmamken
44 D-POL MOMENT-N ÖLÇÜMÜ Metal plakalar üzerine voltaj uygulandnda
45 Apolar kovalent ba9:elektronlar e%it bir %ekilde payla%lm% Polar kovalent:elektronlar e%it olmayan %ekilde payla%lr )yonik Ba9: Elektron al%veri%i
46
47 ATOM-K BÜYÜKLÜK -YONLA^MA ENERJ-S- ELEKTRON -LG-S-
48 Atomlar Aras$ndaki Ba4lar!yonik Poliatomik iyonlar Kovalent Metalik Moleküler maddeler Polar Apolar Koordinatif Kovalent A4 örgülü Kat$lar
49 Kararl$ Ekzotermik Evlilik Bir ba n oluumu evlilik gibidir. Bir ba4$n k$r$lmas$ boanma ile ilgilidir. Boanma Az kararl$ Endotermik
50 )YON)K BAKLAR yonik Ba nedir? - yonik ba elektronlar n ba yapan atomlar n birinden dierine aktarlmasyla oluan kimyasal bir bad r. yonik ba ne zaman oluur? - Bir katyon(pozitif iyon) elektronlar n bir anyona (negatif iyon) aktard zaman oluur.
51 )yonik ba9n baz özellikleri nelerdir? Metallerle Ametaller arasnda gerçekle#ir. Elektron al# veri#i esasna dayanr. + ve yükler arasndaki elektrostatik çekimdir. En kuvvetli iyonik ba9; en aktif metalle en aktif ametal arasnda bulunur. (1A-7A)
52 Oda scaklnda katdr. Kovalent balarla kyaslandnda yüksek erime ve kaynama noktalarna sahiptirler. Eriyik veya çözelti halinde elektrii iletir ancak kat halde iletmez. Polar balardr.
53 + ve yükler arasndaki elektrostatik çekim
54 BÜYÜKK AÇGÖZLA ZLÜ HIRSIZ KÖPEKK -YON-K BA_
55
56 Kovalent Balar Kovalent Ba nedir? - Kovalent ba, ba yapan iki atom aras nda elektronlar n payla lmas sonucunda oluan kimyasal bir bad r. Bir kovalent ba nas l oluur? - Bir kovalent ba iki ametal aras nda oluur.
57
58 Kovalent Ba: Elektronlar ortaklaa kullan l r. Oksijen Molekülü(O 2 )
59 KOVALENT BAKIN ÖZELL)KLER) 1. Ametal-Ametal arasnda gerçekle#ir. (Ancak gaz faznda baz metal-ametal bile#iklerinde de kovalent ba9a rastlanr.) ÖR: BeCl 2, AlCl 3, BH 3... gibi.
60 2. Elektronlarnn ortakla#a kullanlmas esasna dayanr. ÖR: HF nin yapsn incelersek. H : F... gibi. Ba9 orbitalindeki 2 elektron her iki atoma aittir. DUBLET-N- TAMAMLADI : OKTED-N- TAMAMLADI Ortakla%a kullanlan elektronlar.
61 3. Bir atomun yapa bilece9i kovalent ba9 says ta#d9 ya da az bir enerjiyle ta#yabilece9i (Hibritle#me) yar dolu orbital saysna e#ittir. ÖR: 1H, 2He, 4Be, 5B, un yapa bilecei maksimum kovalent ba saylarn ara%trnz? ÇÖZÜM 1H : 1s 1 1KB 2He: 1s 2 KB YOK 4Be: 1s 2 2s 2 2p (2s 1 2pX 1 ) 2 KB 5B : 1s 2 2s 2 2p 1 (2s 1 2px 1 2py 1 ) 3 KB
62 ÖR: 7N, 8O, 9F un yapa bilecei maksimum kovalent ba saylarn ara%trnz? ÇÖZÜM 6C : 1s 2 2s 2 2p 2 (2s 1 2px 1 2py 1 2pz 1 ) 4 KB 7N : 1s 2 2s 2 2p 3 (2s 2 2px 1 2py 1 2pz 1 ) 3 KB 8 O : 1s2 2s 2 2p 4 (2s 2 2px 2 2py 1 2pz 1 ) 2 KB 9 F : 1s2 2s 2 2p 5 (2s 2 2px 2 2py 2 2pz 1 ) 1 KB
63 4. )ki ametal arasndaki tekli ba9lara S)GMA (V) ba9 denir. )ki ametal arasnda birden fazla kovalent ba9 varsa bunlardan biri sigma (kuvvetli) di9eri pi (W) (zayf) ba9dr. ÖRNEK pi (W) H-C C-H S)GMA (V)
64 5.Ayn ametaller arasnda gerçekle#en (Elektonegatiflikleri ayn) kovalent ba9a APOLAR KOVALENT BAK denir. ÖR: H 2, O 2, N 2... gibi A POLAR KOVALENT BA_ : V=0
65 Apolar Kovalent Ba, ba4 elektronlar$ eit bir ekide payla$ld$4$ zaman oluur. Bu çift apolard$r çünkü içece4i eit bir ekilde payla$yorlar.
66 6. Farkl ametaller arasnda gerçekle#en kovalent ba9a POLAR KOVALENT BAK denir. ÖR: HCl, AlCl 3, BH 3... gibi. : Polar kovalent ba
67 Polar kovalent ba4 ba4 elektronlar$n$n eit olmayan bir ekilde da4$lmas$ sonucu oluur. Çocuk yiyece4in hepsini kendisine al$yor, hiç kimseyle eit olarak paylam$yor.
68 E#it olmayan bir e#le#me var ancak payla#maya istekli Polar Kovalent Ba4
69 Su polar bir moleküldür, çünkü oksijen hidrojenden daha elektronegatiftir ve bu yüzden elektronlar oksijene doru çekilir..
70 7. Bir molekül üzerinde ba9larn olu#turdu9u çekimin vektörel toplam sfr ise molekül APOLARdr. Tüm C-H ba9lar Polar kovalent ba9 V = 0 OLDUKUNDAN MOLEKÜL APOLAR
71 ÖRN: BeCl 2, AlCl 3, BH 3, CH 4... Gibi moleküllerin Apolar olup olmad9n ara#trnz? V=0 CH 4 ün yap$s$. AlCl3 ün yaps BeCl2 nin yap$s$. V=0 apolar molekül V=0 apolar molekül V=0 apolar molekül
72 9. Bir molekül üzerinde ba9larn olu#turdu9u çekimin vektörel toplam sfr de9il ise MOLEKÜL POLAR dr. ÖR: HCl, NH 3, H 2 O... gibi
73 Koordinatif Kovalent Ba9 nedir? Bir kovalent ba olu%turan elektronlardan her ikisi de ayn atom tarafndan salanm%sa bu tür balara Koordinatif Kovalent Ba denir. -nsanlar ba%ka insanlara yardm etmek için kanlarn verir, atomlarsa kararl oktet yapsna ula%mak için elektronlarn verir.
74 Kovalent ba9l bile#iklerde ayn zamanda farkl moleküller arasnda da kovalent ba9 bulunur. Bu #ekilde kovalent ba9l a9 örgülü katlar meydana gelir. Elmas ve Grafitte oldu9u gibi...
75 Metalik Ba Metalleri bir arada tutan kuvvete denir. Metallerin De9erlik Elektronlar çok az, buna kar#lk bo# de9erlik orbitalleri çok fazladr. Ayrca metallerin de9erlik elektronlar çekirdek tarafndan çok sk tutulmazlar. Bu nedenle metal de9elik elektronlar, bo# de9erlik orbitallerde serbest hareket ederler.
76 Bu esnada kendine yakla#trlan kom#u metalin bo# de9erlik orbitallerine de sçrayarak dola#rlar. Bu i#i bir birine temas eden tüm metalin elektronlar da ayn zamanda yapar. Ancak her elektron azda olsa kendi merkezi tarafndan çekilirler. (Kom#ulu9a gitmi# evin haylaz çocuklar) Bu #ekilde olu#an ba9a METAL)K BAK denir.
77 Bu sebeple metaller; )#lenebilir. (Tel ve levha haline getirilebilir.) Serbest elektronlar sayesinde elektrik akmn iletirler. (scaklk arttkça titre#im artaca9ndan iletkenlik azalr.) Erime noktalar yüksektir.
78 -yonik ve Kovalent Ba arasndaki Geçi% Metal ve Ametaller asndaki balanmann karakteri; Anyonun ne dereceye kadar bozulmaya uradna baldr -yonik ba Bozulmaya uram% iyonlar Polarize kovalent ba Kovalent ba Anyonun bozulmas -Büyüklüüne -Yüküne baldr. Örnek : I - ( r= 216 pm) F - (r=136 pm) I daha kolay bozulur.
79 Katyonun anyonun elektron bulutunun biçimini bozma yetenei; - Büyüklüüne - Yükün miktarna baldr. Yüksek (+) yüklü, küçük katyon anyonu kolaylkla bozar. Be 2+ bile%ikleri kovalenttir. B 3+ bile%ikleride kovalenttir. KCl CaCl 2 ScCl 3 TiCl 4 en kovalent TiCl 4 dür. Küçük katyon hacmi ve büyük katyon yükü kovalent Karakteri artrr. SnCl 4 PbCl 4 SbCl 5 BiF 5 Kovalent bile%iklerdir.
80 Elementlerin Deerlik Elektronlar De9erlik erlik elektronlar,, elementlerin son yörüngesindekiy elektronlardr. r. Elementin periyodik tablodaki yeri önemlidir. Lewis Nokta GösterimiG
81 Lewis Yaps ve Oktet Kural Bile%ikler olu%urken oktet kuralna uyma eilimi gösterirler. Oktet Kural: Atomlarn n deerlik erlik elektron saylar larn sekize tamamlama isteidir. idir. Dublet Kural: Hidrojen atomunun son yörüngesindeki elektronlarn He a benzetme iste9idir.( idir.( Son yörüngesindekiy elektron saysn ikiye tamamlama iste9i
82 Atomlarn Balanmas Bir molekül için atomik düzenleme genellikle verilir CH 2 ClF HNO 3 Cl H C F H O N O H O CH 3 COOH H 2 Se H O H Se H H C C H O H H 2 SO 4 O 3 O H O S O H O O O O Genellikle molekülde bir tane merkez atom vardr, CH 2 ClF, SeCl 2, O 3 (CO 2, NH 3, PO 4 3- ), ve merkez atom kimyasal formüldeki ilk atomdur. &lk atomu Hidrojen (H) ya da Flor (F) olan moleküllerde ise merkez atom kimyasal formüldeki ikinci atomdur. A*a+daki moleküllerde merkez atomu bulunuz? 1) H 2 O a) H b) O 2) PCl 3 a) P b) Cl 3) SO 3 a) S b) O 4) CO 3 2- a) C b) O 5) BeH 2 a) Be b) H 6) IO 3- a) I b) O
83 Ba9 tablosunun olu#turulmas Ba9 tablosunun olu#turulmas turulmas içinin kimyasal formülünün n ve her bir atomun etrafndaki elektron saysnn n bilinmesi gereklidir A) Kimyasal Formül Örn., CO 2 B) Oe - Oktet Elektron tronlar (Oe daima 8 ya da 2 (H için) i in) dir) C) Tde T Toplam De9erlik erlik Elektronlar Kimyasal formül Oktet e-toplam De+. e- CO 2 Oe Tde C O 1 x 8 = 8 2 x 8 = 16 1 x 4 = 4 2 x 6 =
84 Ba9 says ve ba9 yapmadan kalan elektron saysnn hesaplanmas Ba9 tablosu yapld ldktan sonra ba9 yapan elektron says ve ba9 says hesaplanr. Ba9 yapmadan kalan elektronlar herbir atomun etrafna oktet kuralna uyacak #ekilde yerle#tirilir. CO 2 Ba+ Tablosu Ba+ says Ba+ yapmadan kalan e - Oe Tde Ba yapan e = 8 8/2 = 4 Tde(16) Ba+ yapan e- (8) = 8
85 Molekül olu%turma ve formal yükler... : Ȯ C O: Formal yük= Grup no ba says - ortaklanmam% b says O için Formal yük = = 0 C için Formal yük = = 0 Formal yüklere göre her bir atom için hesaplanan yük sfr olduundan molekül yüksüzdür.
86 Soru: NH 4+ in Lewis yap$s$n$ bulunuz ( 7 N; 1 H) 1) de4erlik / say$s$ =grup no x atom say$s$ H: 4 atom de4erlik / say$s$= 1 x 4= 4 N: 1 atom de4erlik / say$s$= 5 x 1= 5 TOPLAM = 9 / Molekül +1 yüklü oldu4undan 1 / kaybetmi, toplam de4erlik elektronu bu durumda 9-1= 8 4 olur. 2) Oktet/duplet kural$: N nin oktet kural$na son yörüngesindeki / say$s$n$ 8 e tamamlamas$, H nin ise duplet kural$na göre son yörüngesindeki / say$s$n$ 2 ye tamamlamas$ gerekmektedir Oktet / say$s$= atom say$s$ x 8 1 atom x 8 = 8 / Duplet / say$s$= atom say$s$ x 2 4 atom x 2 = 8 / TOPLAM=16 4 3) Ba4 için kullan$lan / say$s$= oktet/duplet toplam / say$s$ - de4erlik / say$s$= 16-8= 8 /
87 Ba4 say$s$ = Ba4 in kullan$lan / say$s$/ 2= 8/2 =4 ba4 4) Payla$lmam$ / say$s$=toplam de4erlik / say$s$-ba4 yapan / say$s$= 8-8= 0 5) 6) Formal yük= Grup no ba4 say$s$ - ortaklanmam$ / say$s$ N için Formal yük = = +1 H için Formal yük = = 0 Formal yüklere göre molekül +1 yüklüdür
88
89 Moleküller aras Çekim Kuvvetleri Moleküller aras balar (MAB) gazlarda etkili olan tek badr. Kat-sv molekülleri bir arada tutan kuvvetler MAB dr. Maddenin oda ko%ullarnda kat,sv ya da gaz olu%unu MAB belirler. Maddenin Erime ne Kaynama noktalar MAB larn kuvvetine baldr. Maddenin s ve elektrik iletkenlikleri,suda çözünürlükleri,kristal yaplar, sertlikleri gibi özellikleri MAB kuvvetine baldr.
90 Moleküller aras Balar (MAB) Van-der Waals (London) Dipol-Dipol etkile%imi H-Balar
91 Sv ve katlardaki apolar moleküller birbirlerini hangi tür molekül aras kuvvetlerle çekerler? LONDON KUVVETLER) (Da9lm Kuvvetleri) Van der Waals
92
93 MOLEKÜLLER ARASI BA:LAR 1. Van-der Waals Etkile#imi; He, Ne, Ar... gibi soy gazlarda ; H 2, O 2, N 2... gibi kovalent ba9l apolar moleküllerde; CH 4, BH 3, CCl 4... gibi kovalent ba9l apolar moleküllerde kat ve sv fazlarnda moleküller arasnda görülen etkile#ime denir. m1 m2 Van-der Waals Etkile#imi
94 Van-der Waals etkile#imi; a.kütlesel çekimden olu#mu#tur. -ki molekül bir birine yakla%tkça moleküller arasnda kütlesel çekim etkinle#ir ve bir çekim olu%ur. Bu çekime, Van-der Wals etkile%imi denir. Bu sebeple, Van-der Wals etkile%imi mol kütlesi arttkça artar. ÖR: He<Ne< Ar ve H 2 < N 2 < O 2 m1 m2 F= m1 m2 r 2 Van-der Waals Etkile#imi
95 b. Ani dipolle#meden olu#mu#tur. -ki apolar molekül bir birlerine yakla%trldklarnda - yükler bir birini itecek ve itilen taraf -\ iten +\ yükle yüklenecektir. Bu %ekilde iki molekül arasnda çok zayf bir çekim olu%ur. Bu çekime Van-der Wals etkile%imi denir. Bu sebeple etkile#me yüzeyi arttkça, Van-der Wals etkile%imi artar. -\ +\ -\ +\ Van-der Waals Etkile#imi
96 Kolayca biçimi bozulan veya polarize olan büyük elektron bulutlarna sahip ve kompleks moleküller arasnda etkin London kuvvetleri vardr. Polar moleküller arasnda da london kuv. Bulunur. Polar olmayan moleküller arasnda sadece london kuvvetleri bulunur.(apolar moleküllerde etken kuv.)
97 Molekül kütlesi artarsa London Kuv. Artar. CH 4, C 2 H 6, C 3 H 8 F 2, Cl 2, Br 2 Organik moleküllerde dallanma artkça london kuv. Azalr. (N-pentan ve neo-pentan) London Kuv. Artarsa Kaynama noktas yükselir ve Buhar basnc azalr.
98 HI ve HCl moleküllerinin hangisinin kaynama noktas yüksektir?
99 2. Dipol-Dipol Etkile#imi; Kovalent ba9l polar moleküllere D)POL moleküller diyoruz. )ki dipol molekül arasndaki etkile#ime D)POL- D)POL ba9 denir. Dipol Molekül D-POL-D-POL BA_I Dipol Molekül
100
101 ÖRNEK: NH3,H 2 O, CH 3 Cl...gibi çok atomlu moleküllerde ve CO, NO, HCl, HBr iki atomlu polar moleküller arasnda görülür. Dipol Dipol ba9lar Van-der Waals e göre daha kuvvetli ba9lardr. Molekülün polarl9 arttkça dipol-dipol ba9 kuvveti artar, erime ve kaynama noktalar yükselir.
102 -ki atomlu bir molekülde; EN fark ile + ve kutuplarn yerlerinin ve polarlk tahmininde kullanlabilir. -kiden fazla atom içeren moleküllerde; Molekülün geometrik yaps ve ba Yapmam% elektron çiftlerinin düzenleni%i hakknda bilgi verir. Bir molekülün Dipol Momenti; Moleküldeki balarn ayr ayr Dipol momenti ile ba yapmam% elektron çiftleri tarafndan olu%turulur.
103 HAZIRLIK SORUSU CH 4, NH 3, H 2 0 ve NF 3 moleküllerinin dipol moment büyüklüklerini tart%nz. Cevap: H 2 0 > NH 3 > NF 3 > CH 4 Polar moleküllerde ksmi yükler arasndaki dipol-dipol etkile%imi nedeniyle çou zaman kat veya svdr.
104 Dipol-dipol bal polar moleküller, - Kat iken elektrii iletmez - Sv iken elektrii çok az iletir - Sulu çözeltileri elektrik akmn iletir.
105
106
107 3. Hidrojen Ba9; Bir molekülde H atomu; Flor, Oksijen, Azot (FON) atomlarndan birine ba9lysa, bu tür moleküllerde Van-der Wals ve Dipol-Dipol ile beraber H ba9da bulunur. W-W D-D Hidrojen Ba9
108
109 Hidrojen ba9nn olu#mas için, 3 önemli faktör vardr. 1.Hidrojen ba9 olu#mas için ilk #art, H atomunun FON atomlarndan birine ba9l olmas gerekmektedir. Bu #ekilde H atomu büyük oranda + yükle yüklenirken, di9er atom, yükle yüklenir. Molekülün polarl9 maksimuma ula#r. Bu açdan Hidrojen ba9 Dipol-Dipol ba9nn farkl bir versiyonudur. 2. Di9er taraftan hidrojen ba9nda, hidrojenle di9er atom arasnda da zayf kovalent ba9a raslanr. H-F..H-F..H-F..H-F..H-F..H-F..H-F..H-F Kovalent Ba9 Hidrojen Ba9 Zayf Kovalent Ba9
110 3. Di9er bir faktörde H köprü ba9dr. Hidrojen köprü ba9 sayesinde hidrojen ba9, daha sa9lam bir yapya ula#yor. H F: H + :F Oldukça elektro negatif bir atoma ba9lanm# hidrojen atomlar, tamama yakn pozitif yükle yüklendi9inden, ba9l oldu9u F atomundan kopar kom#u durumdaki çiftle#memi# elektron çifti içeren atoma ba9lanr. Bu olay ayn anda tüm moleküldeki hidrojen atomlar yapar. Bu #ekilde F-H-F köprü ba9 olu#ur. Hidrojen ba9 içeren moleküller hidrojen ba9nn bu özel durumu sayesinde oldukça yüksek erime ve kaynama noktasna sahiptirler.
111 HF molekülünde 6 adet HF molekülü, biri biri arasnda yaptklar kuvvetli hidrojen ba9ndan dolay,altgen bir yap içersinde bulunur. (Krmz çizgiler hidrojen ba9n göstermektedir.)
112 HCl-HCl ÖR: HF, H 2 O, NH 3, R-COOH, R-OH, R-NH 2...gibi moleküllerde, moleküller arasnda di9er ba9larla birlikte hidrojen ba9da görülür. Hidrojen ba9 içeren moleküllerde, molekülleri bir arada tutan kuvvet artar, bu sebeple, erime-kaynama noktalarnda, di9er e#de9er moleküllere göre ani yükselmeler görülür.
113 Kaynama ve Erime Noktalar Tanecikler arasndaki etkile%im ne kadar büyükse molekülün erime ve ya kaynama noktas o kadar yüksek olur. Polar moleküllü bile%iklerin kaynama noktalar apolar moleküllü bile%iklerin kaynama noktalarnda büyüktür apolar bir moleküldeki çekim kuvvetinin kalc deilde anlk olduunu bir kez daha hatrlyalm. Tanecikler arasndaki çekme kuvvetinin en büyük olduu hallerden biri iyonik katlardr. Elektrostatik çekme kuvveti, iyonlarn yüküne ve iyonlar aras uzakla baldr.
114 NaF ve MgO sodyum klorür yapsnda katlardr. )yonlar aras uzaklk sras ile 251 pm ve 212 pm dir. Bu de9erlerden anala#labilece9i gibi iyonlar arasnda uzaklk fazla de9ildir. Ancak MgO in iyon yüklerinin NaF e göre iki kat fazla olmas erime ve kaynama noktalar arasndaki farkn çok büyük olmasna neden olur. Erime Noktas (ºC) Kaynama Nok. (ºC) NaF MgO
115 )yonlar arasnda uzaklklarn dikkate alnaca9 örnekte ise iyon yükleri ayn olan NaF (251 pm), KCl (319 pm), RbBr (348 pm) katlar incelenebilir Erime Nok ( o C) Kaynama Nok ( o C) NaF KCl RbBr
116
Serüveni 3. ÜNİTE KİMYASAL TÜRLER ARASI ETKİLEŞİM GÜÇLÜ ETKİLEŞİM. o İYONİK BAĞ o KOVALENT BAĞ o METALİK BAĞ
 Serüveni 3. ÜNİTE KİMYASAL TÜRLER ARASI ETKİLEŞİM GÜÇLÜ ETKİLEŞİM o İYONİK BAĞ o KOVALENT BAĞ o METALİK BAĞ KİMYASAL TÜR 1. İYONİK BAĞ - - Ametal.- Kök Kök Kök (+) ve (-) yüklü iyonların çekim kuvvetidir..halde
Serüveni 3. ÜNİTE KİMYASAL TÜRLER ARASI ETKİLEŞİM GÜÇLÜ ETKİLEŞİM o İYONİK BAĞ o KOVALENT BAĞ o METALİK BAĞ KİMYASAL TÜR 1. İYONİK BAĞ - - Ametal.- Kök Kök Kök (+) ve (-) yüklü iyonların çekim kuvvetidir..halde
Soygazların bileşik oluşturamamasının sebebi bütün orbitallerinin dolu olmasındandır.
 KİMYASAL BAĞLAR Kimyasal bağ, moleküllerde atomları birarada tutan kuvvettir. Bir bağın oluşabilmesi için atomlar tek başına bulundukları zamankinden daha kararlı (az enerjiye sahip) olmalıdırlar. Genelleme
KİMYASAL BAĞLAR Kimyasal bağ, moleküllerde atomları birarada tutan kuvvettir. Bir bağın oluşabilmesi için atomlar tek başına bulundukları zamankinden daha kararlı (az enerjiye sahip) olmalıdırlar. Genelleme
ATOMİK YAPI VE ATOMLAR ARASI BAĞLAR. Aytekin Hitit
 ATOMİK YAPI VE ATOMLAR ARASI BAĞLAR Aytekin Hitit Malzemeler neden farklı özellikler gösterirler? Özellikler Fiziksel Kimyasal Bahsi geçen yapısal etkenlerden elektron düzeni değiştirilemez. Ancak diğer
ATOMİK YAPI VE ATOMLAR ARASI BAĞLAR Aytekin Hitit Malzemeler neden farklı özellikler gösterirler? Özellikler Fiziksel Kimyasal Bahsi geçen yapısal etkenlerden elektron düzeni değiştirilemez. Ancak diğer
TOBB Ekonomi ve Teknoloji Üniversitesi. Genel Kimya 101. Yrd.Doç.Dr.Zeynep OBALI e-mail: zobali@etu.edu.tr Ofis: z-83/2
 Genel Kimya 101 Yrd.Doç.Dr.Zeynep OBALI e-mail: zobali@etu.edu.tr Ofis: z-83/2 İyonik Bağ; İyonik bir bileşikteki pozitif ve negatif iyonlar arasındaki etkileşime iyonik bağ denir Na Na + + e - Cl + e
Genel Kimya 101 Yrd.Doç.Dr.Zeynep OBALI e-mail: zobali@etu.edu.tr Ofis: z-83/2 İyonik Bağ; İyonik bir bileşikteki pozitif ve negatif iyonlar arasındaki etkileşime iyonik bağ denir Na Na + + e - Cl + e
Kimyasal Bağ. Atomları birarada tutan kuvvetlere kimyasal bağ denir
 Kimyasal Bağlar Kimyasal Bağ Atomları birarada tutan kuvvetlere kimyasal bağ denir İyonik bağ Kovalent bağ Polar Kovalent bağ Apolar Kovalent bağ Metalik bağ Lewis bağ teorisi Kimyasal bağlanma için atomun
Kimyasal Bağlar Kimyasal Bağ Atomları birarada tutan kuvvetlere kimyasal bağ denir İyonik bağ Kovalent bağ Polar Kovalent bağ Apolar Kovalent bağ Metalik bağ Lewis bağ teorisi Kimyasal bağlanma için atomun
KİMYASAL TÜRLER ARASI ETKİLEŞİMLER
 KİMYASAL TÜRLER KİMYASAL TÜRLER ARASI ETKİLEŞİMLER Atom: Molekül: İyon: Bir elementin tüm kimyasal özelliklerini gösteren yapı taşıdır... : :.. He Ne H.... : Ar : N. Ȯ.. :.. Cl.. Kararlı atomlar (Soygazlar)
KİMYASAL TÜRLER KİMYASAL TÜRLER ARASI ETKİLEŞİMLER Atom: Molekül: İyon: Bir elementin tüm kimyasal özelliklerini gösteren yapı taşıdır... : :.. He Ne H.... : Ar : N. Ȯ.. :.. Cl.. Kararlı atomlar (Soygazlar)
KİMYASAL BAĞLAR Kimyasal bağlar, Moleküllerde atomları birarada tutan
 KİMYASAL BAĞLAR Kimyasal bağlar, Moleküllerde atomları birarada tutan kuvvettir. Atomlar birleştiği zaman elektron dağılımındaki değişmelerin bir sonucu olarak kimyasal bağlar meydana gelir. Atomun sembolünün
KİMYASAL BAĞLAR Kimyasal bağlar, Moleküllerde atomları birarada tutan kuvvettir. Atomlar birleştiği zaman elektron dağılımındaki değişmelerin bir sonucu olarak kimyasal bağlar meydana gelir. Atomun sembolünün
Nötr (yüksüz) bir için, çekirdekte kaç proton varsa çekirdeğin etrafındaki yörüngelerde de o kadar elektron dolaşır.
 ATOM ve YAPISI Elementin özelliğini taşıyan en küçük parçasına denir. Atom Numarası Bir elementin unda bulunan proton sayısıdır. Protonlar (+) yüklü olduklarından pozitif yük sayısı ya da çekirdek yükü
ATOM ve YAPISI Elementin özelliğini taşıyan en küçük parçasına denir. Atom Numarası Bir elementin unda bulunan proton sayısıdır. Protonlar (+) yüklü olduklarından pozitif yük sayısı ya da çekirdek yükü
PERİYODİK CETVEL
 BÖLÜM4 W Periyodik cetvel, elementlerin atom numaraları esas alınarak düzenlenmiştir. Bu düzenlemede, kimyasal özellikleri benzer olan (değerlik elektron sayıları aynı) elementler aynı düşey sütunda yer
BÖLÜM4 W Periyodik cetvel, elementlerin atom numaraları esas alınarak düzenlenmiştir. Bu düzenlemede, kimyasal özellikleri benzer olan (değerlik elektron sayıları aynı) elementler aynı düşey sütunda yer
PERİYODİK SİSTEM VE ELEKTRON DİZİLİMLERİ#6
 PERİYODİK SİSTEM VE ELEKTRON DİZİLİMLERİ#6 Periyodik sistemde yatay sıralara Düşey sütunlara.. adı verilir. 1.periyotta element, 2 ve 3. periyotlarda..element, 4 ve 5.periyotlarda.element 6 ve 7. periyotlarda
PERİYODİK SİSTEM VE ELEKTRON DİZİLİMLERİ#6 Periyodik sistemde yatay sıralara Düşey sütunlara.. adı verilir. 1.periyotta element, 2 ve 3. periyotlarda..element, 4 ve 5.periyotlarda.element 6 ve 7. periyotlarda
BÖLÜM 2 ATOMİK YAPI İÇERİK. Atom yapısı. Bağ tipleri. Chapter 2-1
 BÖLÜM 2 ATOMİK YAPI İÇERİK Atom yapısı Bağ tipleri 1 Atomların Yapıları Atomlar başlıca üç temel atom altı parçacıktan oluşur; Protonlar (+ yüklü) Nötronlar (yüksüz) Elektronlar (-yüklü) Basit bir atom
BÖLÜM 2 ATOMİK YAPI İÇERİK Atom yapısı Bağ tipleri 1 Atomların Yapıları Atomlar başlıca üç temel atom altı parçacıktan oluşur; Protonlar (+ yüklü) Nötronlar (yüksüz) Elektronlar (-yüklü) Basit bir atom
Aşağıda verilen özet bilginin ayrıntısını, ders kitabı. olarak önerilen, Erdik ve Sarıkaya nın Temel. Üniversitesi Kimyası" Kitabı ndan okuyunuz.
 KİMYASAL BAĞLAR Aşağıda verilen özet bilginin ayrıntısını, ders kitabı olarak önerilen, Erdik ve Sarıkaya nın Temel Üniversitesi Kimyası" Kitabı ndan okuyunuz. KİMYASAL BAĞLAR İki atom veya atom grubu
KİMYASAL BAĞLAR Aşağıda verilen özet bilginin ayrıntısını, ders kitabı olarak önerilen, Erdik ve Sarıkaya nın Temel Üniversitesi Kimyası" Kitabı ndan okuyunuz. KİMYASAL BAĞLAR İki atom veya atom grubu
1H: 1s 1 1.periyot 1A grubu. 5B: 1s 2 2s 2 2p 1 2.periyot 3A grubu. 8O: 1s 2 2s 2 2p 4 2.periyot 6A grubu. 10Ne: 1s 2 2s 2 2p 6
 PERİYODİK CETVEL Periyodik cetvel, benzer kimyasal özellik gösteren elementlerin alt alta gelecek şekilde artan atom numaralarına göre sıralandıkları çizelgelerdir. Periyodik cetveli oluşturan yatay satırlara
PERİYODİK CETVEL Periyodik cetvel, benzer kimyasal özellik gösteren elementlerin alt alta gelecek şekilde artan atom numaralarına göre sıralandıkları çizelgelerdir. Periyodik cetveli oluşturan yatay satırlara
PERİYODİK ÖZELLİKLER 1.ATOMLARIN BÜYÜKLÜĞÜ VE ATOM YARIÇAPI: Kovalent yarıçap: Van der Waals yarıçapı: İyon yarıçapı:
 PERİYODİK ÖZELLİKLER 1.ATOMLARIN BÜYÜKLÜĞÜ VE ATOM YARIÇAPI: Elementlerin fiziksel ( erime ve kaynama noktaları, yoğunluk, iletkenlik vb.) ve kimyasal özellikleri ( elektron alma ve verme ) atom yarıçaplarıyla
PERİYODİK ÖZELLİKLER 1.ATOMLARIN BÜYÜKLÜĞÜ VE ATOM YARIÇAPI: Elementlerin fiziksel ( erime ve kaynama noktaları, yoğunluk, iletkenlik vb.) ve kimyasal özellikleri ( elektron alma ve verme ) atom yarıçaplarıyla
Chemistry, The Central Science, 10th edition Theodore L. Brown; H. Eugene LeMay, Jr.; and Bruce E. Bursten. Kimyasal Bağlar.
 Chemistry, The Central Science, 10th edition Theodore L. Brown; H. Eugene LeMay, Jr.; and Bruce E. Bursten Kimyasal Bağlar Kimyasal Bağlar 3 temel tip bağ vardır: İyonik İyonlar arası elektrostatik etkileşim
Chemistry, The Central Science, 10th edition Theodore L. Brown; H. Eugene LeMay, Jr.; and Bruce E. Bursten Kimyasal Bağlar Kimyasal Bağlar 3 temel tip bağ vardır: İyonik İyonlar arası elektrostatik etkileşim
Yrd. Doç. Dr. H. Hasan YOLCU. hasanyolcu.wordpress.com
 Yrd. Doç. Dr. H. Hasan YOLCU hasanyolcu.wordpress.com En az iki atomun belli bir düzenlemeyle kimyasal bağ oluşturmak suretiyle bir araya gelmesidir. Aynı atomda olabilir farklı atomlarda olabilir. H 2,
Yrd. Doç. Dr. H. Hasan YOLCU hasanyolcu.wordpress.com En az iki atomun belli bir düzenlemeyle kimyasal bağ oluşturmak suretiyle bir araya gelmesidir. Aynı atomda olabilir farklı atomlarda olabilir. H 2,
GENEL KİMYA. 4. Konu: Kimyasal türler, Kimyasal türler arasındaki etkileşimler, Kimyasal Bağlar
 GENEL KİMYA 4. Konu: Kimyasal türler, Kimyasal türler arasındaki etkileşimler, Kimyasal Bağlar Kimyasal Türler Doğada bulunan bütün maddeler tanecikli yapıdadır. Maddenin özelliğini gösteren küçük yapı
GENEL KİMYA 4. Konu: Kimyasal türler, Kimyasal türler arasındaki etkileşimler, Kimyasal Bağlar Kimyasal Türler Doğada bulunan bütün maddeler tanecikli yapıdadır. Maddenin özelliğini gösteren küçük yapı
Lewis Nokta Yapıları ve VSEPR
 6 DENEY Lewis Nokta Yapıları ve VSEPR 1. Giriş Bu deneyde moleküllerin Lewis Nokta yapıları belirlenecek ve VSEPR kuralları ile molekülün geometrisi ve polaritesi tayin edilecektir. 2. Lewis Nokta Yapıları
6 DENEY Lewis Nokta Yapıları ve VSEPR 1. Giriş Bu deneyde moleküllerin Lewis Nokta yapıları belirlenecek ve VSEPR kuralları ile molekülün geometrisi ve polaritesi tayin edilecektir. 2. Lewis Nokta Yapıları
İyonlar. İyon? Pozitif veya negatif yükü olan bir atoma yada atomlar grubuna iyon denir.
 İyonlar İyon? Pozitif veya negatif yükü olan bir atoma yada atomlar grubuna iyon denir. 1 Atomlardan İyon Oluşumu ve İyon Bir atomdan iyon denilen yüklü bir parçacık oluşturulabilir. Bunun için, nötral
İyonlar İyon? Pozitif veya negatif yükü olan bir atoma yada atomlar grubuna iyon denir. 1 Atomlardan İyon Oluşumu ve İyon Bir atomdan iyon denilen yüklü bir parçacık oluşturulabilir. Bunun için, nötral
GENEL KİMYA. 4. Konu: Kimyasal türler, Kimyasal türler arasındaki etkileşimler, Kimyasal Bağlar
 GENEL KİMYA 4. Konu: Kimyasal türler, Kimyasal türler arasındaki etkileşimler, Kimyasal Bağlar Kimyasal Türler Doğada bulunan bütün maddeler tanecikli yapıdadır. Maddenin özelliğini gösteren küçük yapı
GENEL KİMYA 4. Konu: Kimyasal türler, Kimyasal türler arasındaki etkileşimler, Kimyasal Bağlar Kimyasal Türler Doğada bulunan bütün maddeler tanecikli yapıdadır. Maddenin özelliğini gösteren küçük yapı
1. ÜNİTE: MODERN ATOM TEORİSİ İyon Yükleri ve Yükseltgenme Basamakları
 1. ÜNİTE: MODERN ATOM TEORİSİ 1.7. İyon Yükleri ve Yükseltgenme Basamakları Yüksüz bir atomun yapısındaki pozitif (+) yüklü protonlarla negatif () yüklü elektronların sayıları birbirine eşittir. Yüksüz
1. ÜNİTE: MODERN ATOM TEORİSİ 1.7. İyon Yükleri ve Yükseltgenme Basamakları Yüksüz bir atomun yapısındaki pozitif (+) yüklü protonlarla negatif () yüklü elektronların sayıları birbirine eşittir. Yüksüz
Oksijen, flor ve neon elementlerinin kullanıldığı alanları araştırınız.
 Oksijen, flor ve neon elementlerinin kullanıldığı alanları araştırınız. 3.2 KİMYASAL BAĞLAR Çevrenizdeki maddeleri inceleyiniz. Bu maddelerin neden bu kadar çeşitli olduğunu düşündünüz mü? Eğer bu çeşitlilik
Oksijen, flor ve neon elementlerinin kullanıldığı alanları araştırınız. 3.2 KİMYASAL BAĞLAR Çevrenizdeki maddeleri inceleyiniz. Bu maddelerin neden bu kadar çeşitli olduğunu düşündünüz mü? Eğer bu çeşitlilik
GENEL KİMYA. Yrd.Doç.Dr. Tuba YETİM
 GENEL KİMYA KİMYASAL BAĞLAR Lewis Kuramı Kimyasal bağlanmada esas rolü dış kabuk elektronları (değerlik) oynar. Bazı durumlarda elektronlar bir atomdan diğerine aktarılır. Böylece oluşan (+) ve (-) yüklü
GENEL KİMYA KİMYASAL BAĞLAR Lewis Kuramı Kimyasal bağlanmada esas rolü dış kabuk elektronları (değerlik) oynar. Bazı durumlarda elektronlar bir atomdan diğerine aktarılır. Böylece oluşan (+) ve (-) yüklü
KATILAR DA BALANMA L ( 3.2) R = A
 KATILAR DA BALANMA Katlar elektriksel iletkenliklerine göre üçe ayrlr: letken, Yar iletken, Yaltkan Metaller iletken katlardr. Bir metal ve bir yar iletken arasndaki fark, elektriksel iletkenliklerinin
KATILAR DA BALANMA Katlar elektriksel iletkenliklerine göre üçe ayrlr: letken, Yar iletken, Yaltkan Metaller iletken katlardr. Bir metal ve bir yar iletken arasndaki fark, elektriksel iletkenliklerinin
İnstagram:kimyaci_gln_hoca MODERN ATOM TEORİSİ-2.
 MODERN ATOM TEORİSİ-2 ATOM YARIÇAPI PERİYODİK ÖZELLİK DEĞİŞİMİ Kovalent Yarıçap: Tek bir kovalent bağla bağlanmış eşdeğer iki atomun çekirdekleri arasındaki uzaklığın yarısına kovalent yarıçap denir.(şekil1)
MODERN ATOM TEORİSİ-2 ATOM YARIÇAPI PERİYODİK ÖZELLİK DEĞİŞİMİ Kovalent Yarıçap: Tek bir kovalent bağla bağlanmış eşdeğer iki atomun çekirdekleri arasındaki uzaklığın yarısına kovalent yarıçap denir.(şekil1)
KİMYASAL BAĞLAR İYONİK BAĞ KOVALANT BAĞ POLAR KOVALENT BAĞ APOLAR KOVALENT BAĞ
 KİMYASAL BAĞLAR İYONİK BAĞ KOVALANT BAĞ POLAR KOVALENT BAĞ APOLAR KOVALENT BAĞ Atomlar bağ yaparken, elektron dizilişlerini soy gazlara benzetmeye çalışırlar. Bir atomun yapabileceği bağ sayısı, sahip
KİMYASAL BAĞLAR İYONİK BAĞ KOVALANT BAĞ POLAR KOVALENT BAĞ APOLAR KOVALENT BAĞ Atomlar bağ yaparken, elektron dizilişlerini soy gazlara benzetmeye çalışırlar. Bir atomun yapabileceği bağ sayısı, sahip
Serüveni PERİYODİK ÖZELLİKLER DEĞİŞİMİ
 Serüveni PERİYODİK ÖZELLİKLER DEĞİŞİMİ PERİYODİK ÖZELLİKLERİN DEĞİŞİMİ ATOM YARIÇAPI Çekirdeğin merkezi ile en dış kabukta bulunan elektronlar arasındaki uzaklık olarak tanımlanır. Periyodik tabloda aynı
Serüveni PERİYODİK ÖZELLİKLER DEĞİŞİMİ PERİYODİK ÖZELLİKLERİN DEĞİŞİMİ ATOM YARIÇAPI Çekirdeğin merkezi ile en dış kabukta bulunan elektronlar arasındaki uzaklık olarak tanımlanır. Periyodik tabloda aynı
İÇERİK. Lewis Kuramı. Kovalent Bağlar. Polar Kovalent Bağlar. Lewis Yapılarının Yazımı. Oktet Kuralının Istisnaları.
 İÇERİK Lewis Kuramı Kovalent Bağlar Polar Kovalent Bağlar Lewis Yapılarının Yazımı Oktet Kuralının Istisnaları Molekül Şekilleri Prentice-Hall 2002 LEWIS KURAMI Lewis Kuramı kimyasal bağı gösteren en basit
İÇERİK Lewis Kuramı Kovalent Bağlar Polar Kovalent Bağlar Lewis Yapılarının Yazımı Oktet Kuralının Istisnaları Molekül Şekilleri Prentice-Hall 2002 LEWIS KURAMI Lewis Kuramı kimyasal bağı gösteren en basit
ATOMLAR ARASI BAĞLAR Doç. Dr. Ramazan YILMAZ
 ATOMLAR ARASI BAĞLAR Doç. Dr. Ramazan YILMAZ Sakarya Üniversitesi, Teknoloji Fakültesi, Metalurji ve Malzeme Mühendisliği Bölümü Esentepe Kampüsü, 54187, SAKARYA Atomlar Arası Bağlar 1 İyonik Bağ 2 Kovalent
ATOMLAR ARASI BAĞLAR Doç. Dr. Ramazan YILMAZ Sakarya Üniversitesi, Teknoloji Fakültesi, Metalurji ve Malzeme Mühendisliği Bölümü Esentepe Kampüsü, 54187, SAKARYA Atomlar Arası Bağlar 1 İyonik Bağ 2 Kovalent
s, p, d Elementleri f Elementleri Asal Gazlar
 s, p, d Elementleri Hidrojen 1A Grubu: Alkali metaller 2A Grubu: Toprak Alkali Metaller 3A Grubu: Toprak Metalleri 4A Grubu 5A Grubu 6A Grubu: Kalkojenler 7A Grubu: Halojenler B Grubu: Geçiş Metalleri
s, p, d Elementleri Hidrojen 1A Grubu: Alkali metaller 2A Grubu: Toprak Alkali Metaller 3A Grubu: Toprak Metalleri 4A Grubu 5A Grubu 6A Grubu: Kalkojenler 7A Grubu: Halojenler B Grubu: Geçiş Metalleri
KİMYASAL TÜRLER ARASI ETKİLEŞİMLER
 KİMYASAL TÜRLER ARASI ETKİLEŞİMLER 1.Kimyasal Türler Atomlar, moleküller, iyonlar ve radikaller genel olarak kimyasal tür adıyla bilinir. ATOM: Bir elementin bütün özelliklerini taşıyan en küçük birimine
KİMYASAL TÜRLER ARASI ETKİLEŞİMLER 1.Kimyasal Türler Atomlar, moleküller, iyonlar ve radikaller genel olarak kimyasal tür adıyla bilinir. ATOM: Bir elementin bütün özelliklerini taşıyan en küçük birimine
5.111 Ders Özeti #12. Konular: I. Oktet kuralından sapmalar
 5.111 Ders Özeti #12 Bugün için okuma: Bölüm 2.9 (3. Baskıda 2.10), Bölüm 2.10 (3. Baskıda 2.11), Bölüm 2.11 (3. Baskıda 2.12), Bölüm 2.3 (3. Baskıda 2.1), Bölüm 2.12 (3. Baskıda 2.13). Ders #13 için okuma:
5.111 Ders Özeti #12 Bugün için okuma: Bölüm 2.9 (3. Baskıda 2.10), Bölüm 2.10 (3. Baskıda 2.11), Bölüm 2.11 (3. Baskıda 2.12), Bölüm 2.3 (3. Baskıda 2.1), Bölüm 2.12 (3. Baskıda 2.13). Ders #13 için okuma:
Periodic Table of the. Elements I A II A III B IV B V B VI B VII B VIII B I B II B III A IV A V A VI A VII A VIII A 1 1 2 1 H H He 1.008 1.008 4.
 PERİYODİK SİSTEM Periodic Table of the s d p Elements I A II A III B IV B V B VI B VII B VIII B I B II B III A IV A V A VI A VII A VIII A 1 1 2 1 H H He 1.008 1.008 4.0026 3 4 5 6 7 8 9 10 2 Li Be B C
PERİYODİK SİSTEM Periodic Table of the s d p Elements I A II A III B IV B V B VI B VII B VIII B I B II B III A IV A V A VI A VII A VIII A 1 1 2 1 H H He 1.008 1.008 4.0026 3 4 5 6 7 8 9 10 2 Li Be B C
MALZEME BİLGİSİ DERS 4 DR. FATİH AY.
 MALZEME BİLGİSİ DERS 4 DR. FATİH AY www.fatihay.net fatihay@fatihay.net GEÇEN HAFTA TEMEL KAVRAMLAR ATOMLARDA ELEKTRONLAR PERİYODİK TABLO BÖLÜM II ATOM YAPISI VE ATOMLARARASı BAĞLAR BAĞ KUVVETLERİ VE ENERJİLERİ
MALZEME BİLGİSİ DERS 4 DR. FATİH AY www.fatihay.net fatihay@fatihay.net GEÇEN HAFTA TEMEL KAVRAMLAR ATOMLARDA ELEKTRONLAR PERİYODİK TABLO BÖLÜM II ATOM YAPISI VE ATOMLARARASı BAĞLAR BAĞ KUVVETLERİ VE ENERJİLERİ
BÖLÜM 2 ATOMİK YAPI İÇERİK. Atom yapısı. Bağ tipleri. Chapter 2-1
 BÖLÜM 2 ATOMİK YAPI İÇERİK Atom yapısı Bağ tipleri 1 Atomların Yapıları Atomlar başlıca üç temel atom altı parçacıktan oluşur; Protonlar (+ yüklü) Nötronlar (yüksüz) Elektronlar (-yüklü) Basit bir atom
BÖLÜM 2 ATOMİK YAPI İÇERİK Atom yapısı Bağ tipleri 1 Atomların Yapıları Atomlar başlıca üç temel atom altı parçacıktan oluşur; Protonlar (+ yüklü) Nötronlar (yüksüz) Elektronlar (-yüklü) Basit bir atom
PERİYODİK CETVEL-ÖSS DE ÇIKMIŞ SORULAR
 PERİODİK CETVEL-ÖSS DE ÇIKMIŞ SORULAR 1. Bir elementin periyodik cetveldeki yeri aşağıdakilerden hangisi ile belirlenir? A) Atom ağırlığı B) Değerliği C) Atom numarası D) Kimyasal özellikleri E) Fiziksel
PERİODİK CETVEL-ÖSS DE ÇIKMIŞ SORULAR 1. Bir elementin periyodik cetveldeki yeri aşağıdakilerden hangisi ile belirlenir? A) Atom ağırlığı B) Değerliği C) Atom numarası D) Kimyasal özellikleri E) Fiziksel
ELEKTRONLARIN DİZİLİMİ, KİMYASAL ÖZELLİKLERİ VE
 ELEKTRONLARIN DİZİLİMİ, KİMYASAL ÖZELLİKLERİ VE ELEMENTLER ELEMENTLER METALLER AMETALLER SOYGAZLAR Hiçbir kimyasal ayırma yöntemi ile kendinden daha basit maddelere ayrıştırılamayan saf maddelere element
ELEKTRONLARIN DİZİLİMİ, KİMYASAL ÖZELLİKLERİ VE ELEMENTLER ELEMENTLER METALLER AMETALLER SOYGAZLAR Hiçbir kimyasal ayırma yöntemi ile kendinden daha basit maddelere ayrıştırılamayan saf maddelere element
PERİYODİK CETVEL. Yanıt : D. www.kimyahocam.com. 3 Li : 1s2 2s 1 2. periyot 1A grubu. 16 S : 1s2 2s 2 2p 6 3s 2 3p 4 3.
 PERİODİK CETVEL Periyodik cetvel, elementlerin atom numaraları temel alınarak düzenlenmiş bir sistemdir. Periyodik cetvelde, nötr atomlarının elektron içeren temel enerji düzeyi sayısı aynı olan elementler
PERİODİK CETVEL Periyodik cetvel, elementlerin atom numaraları temel alınarak düzenlenmiş bir sistemdir. Periyodik cetvelde, nötr atomlarının elektron içeren temel enerji düzeyi sayısı aynı olan elementler
Bölüm 10: Kimyasal Bağ (I)
 Bölüm 10: Kimyasal Bağ (I) Bu bölümde kimyasal bağı gösteren en basit yöntem olan Lewis Yapıları incelenecektir. 1. Lewis Kuramı: a) Elektronlar, özellikle dış kabuk (değerlik) elektronları kimyasal bağlarda
Bölüm 10: Kimyasal Bağ (I) Bu bölümde kimyasal bağı gösteren en basit yöntem olan Lewis Yapıları incelenecektir. 1. Lewis Kuramı: a) Elektronlar, özellikle dış kabuk (değerlik) elektronları kimyasal bağlarda
FİZ4001 KATIHAL FİZİĞİ-I
 FİZ4001 KATIHAL FİZİĞİ-I Dr. Aytaç Gürhan GÖKÇE Katıhal Fiziği - I Dr. Aytaç Gürhan GÖKÇE 1 Giriş Bir kristali bir arada tutan şey nedir? Elektrostatik etkileşme elektronlar (-) ile + iyonlar arasındaki
FİZ4001 KATIHAL FİZİĞİ-I Dr. Aytaç Gürhan GÖKÇE Katıhal Fiziği - I Dr. Aytaç Gürhan GÖKÇE 1 Giriş Bir kristali bir arada tutan şey nedir? Elektrostatik etkileşme elektronlar (-) ile + iyonlar arasındaki
PERĐYODĐK ÇĐZELGE. Yrd.Doç.Dr. İbrahim İsmet ÖZTÜRK
 PERĐYODĐK ÇĐZELGE Yrd.Doç.Dr. İbrahim İsmet ÖZTÜRK 8.1. PERĐYODĐK ÇĐZELGENĐN GELĐŞMESĐ 8.2. ELEMENTLERĐN PERĐYODĐK SINIFLANDIRILMASI Katyon ve Anyonların Elektron Dağılımları 8.3.FĐZĐKSEL ÖZELLĐKLERDEKĐ
PERĐYODĐK ÇĐZELGE Yrd.Doç.Dr. İbrahim İsmet ÖZTÜRK 8.1. PERĐYODĐK ÇĐZELGENĐN GELĐŞMESĐ 8.2. ELEMENTLERĐN PERĐYODĐK SINIFLANDIRILMASI Katyon ve Anyonların Elektron Dağılımları 8.3.FĐZĐKSEL ÖZELLĐKLERDEKĐ
ASİTLER- BAZLAR. Suyun kendi kendine iyonlaşmasına Suyun Otonizasyonu - Otoprotoliz adı verilir. Suda oluşan H + sadece protondur.
 ASİTLER- BAZLAR SUYUN OTONİZASYONU: Suyun kendi kendine iyonlaşmasına Suyun Otonizasyonu - Otoprotoliz adı verilir. Suda oluşan H + sadece protondur. H 2 O (S) H + (suda) + OH - (Suda) H 2 O (S) + H +
ASİTLER- BAZLAR SUYUN OTONİZASYONU: Suyun kendi kendine iyonlaşmasına Suyun Otonizasyonu - Otoprotoliz adı verilir. Suda oluşan H + sadece protondur. H 2 O (S) H + (suda) + OH - (Suda) H 2 O (S) + H +
Atom. Atom 9.11.2015. 11 elektronlu Na. 29 elektronlu Cu
 Atom Maddelerin en küçük yapı taşlarına atom denir. Atomlar, elektron, nötron ve protonlardan oluşur. 1.Elektronlar: Çekirdek etrafında yörüngelerde bulunurlar ve ( ) yüklüdürler. Boyutları çok küçüktür.
Atom Maddelerin en küçük yapı taşlarına atom denir. Atomlar, elektron, nötron ve protonlardan oluşur. 1.Elektronlar: Çekirdek etrafında yörüngelerde bulunurlar ve ( ) yüklüdürler. Boyutları çok küçüktür.
ELEMENTLERİN SINIFLANDIRILMASININ TARİHSEL GELİŞİMİ
 ELEMENTLERİN SINIFLANDIRILMASININ TARİHSEL GELİŞİMİ Dimitri Mendeleyev sıralamayı artan atom ağırlıklarına göre yapmıştır. Bu sıralama günümüzde kullanılan sıralamaya yakın bir sıralamadır. Elementler
ELEMENTLERİN SINIFLANDIRILMASININ TARİHSEL GELİŞİMİ Dimitri Mendeleyev sıralamayı artan atom ağırlıklarına göre yapmıştır. Bu sıralama günümüzde kullanılan sıralamaya yakın bir sıralamadır. Elementler
1. ÜNİTE: MODERN ATOM TEORİSİ
 . ÜNİTE: MODERN ATOM TEORİSİ.4. Elektron Dizilimi ve Periyodik Sisteme Yerleşim Atomun Kuantum Modeli oluşturulduktan sonra Bohr, yaptığı çalışmalarda periyodik cetvel ile kuantum teorisi arasında bir
. ÜNİTE: MODERN ATOM TEORİSİ.4. Elektron Dizilimi ve Periyodik Sisteme Yerleşim Atomun Kuantum Modeli oluşturulduktan sonra Bohr, yaptığı çalışmalarda periyodik cetvel ile kuantum teorisi arasında bir
KİMYASAL BAĞLAR İYONİK BAĞLAR KOVALENT BAĞLAR
 KİMYASAL BAĞLAR Kimyasal bağ, moleküllerde atomları bir arada tutan kuvvettir. Atomlar daha düşük enerjili duruma erişmek için bir araya gelirler. Bir bağın oluşabilmesi için atomlar tek başına bulundukları
KİMYASAL BAĞLAR Kimyasal bağ, moleküllerde atomları bir arada tutan kuvvettir. Atomlar daha düşük enerjili duruma erişmek için bir araya gelirler. Bir bağın oluşabilmesi için atomlar tek başına bulundukları
Atomlar ve Moleküller
 Atomlar ve Moleküller Madde, uzayda yer işgal eden ve kütlesi olan herşeydir. Element, kimyasal tepkimelerle başka bileşiklere parçalanamayan maddedir. -Doğada 92 tane element bulunmaktadır. Bileşik, belli
Atomlar ve Moleküller Madde, uzayda yer işgal eden ve kütlesi olan herşeydir. Element, kimyasal tepkimelerle başka bileşiklere parçalanamayan maddedir. -Doğada 92 tane element bulunmaktadır. Bileşik, belli
KOVALENT BAĞLARDA POLARLIK. Bileşikler 5. Bölüm
 KOVALENT BAĞLARDA POLARLIK Bileşikler 5. Bölüm Ametallerin Bağ Elektronlarına Sahip Çıkma Ġsteği Aynı periyottaki elementlerin soldan sağa: Çekirdek yükü artar Son katmandaki elektronların çekirdeğe uzaklığı
KOVALENT BAĞLARDA POLARLIK Bileşikler 5. Bölüm Ametallerin Bağ Elektronlarına Sahip Çıkma Ġsteği Aynı periyottaki elementlerin soldan sağa: Çekirdek yükü artar Son katmandaki elektronların çekirdeğe uzaklığı
Böyle molekülün negatif ve pozitif uçlarının birbirinden ayrıldığı moleküllere polar moleküller denir.
 Sayfa 1 / 6 01. Moleküllerin Polaritesi ve Dipol Moment 02. İyon-Dipol Etkileşimi 03. Dipol-Dipol Etkileşimi 04. İndüklenme ile Elektriklenme 04.01. İyon- İndüklenmiş Dipol (Apolar) Etkileşimi 04.02. Dipol-İndüklenmiş
Sayfa 1 / 6 01. Moleküllerin Polaritesi ve Dipol Moment 02. İyon-Dipol Etkileşimi 03. Dipol-Dipol Etkileşimi 04. İndüklenme ile Elektriklenme 04.01. İyon- İndüklenmiş Dipol (Apolar) Etkileşimi 04.02. Dipol-İndüklenmiş
Yrd. Doç. Dr. H. Hasan YOLCU. hasanyolcu.wordpress.com
 Yrd. Doç. Dr. H. Hasan YOLCU hasanyolcu.wordpress.com En az iki atomun belli bir düzenlemeyle kimyasal bağ oluşturmak suretiyle bir araya gelmesidir. Aynı atomda olabilir farklı atomlarda olabilir. H 2,
Yrd. Doç. Dr. H. Hasan YOLCU hasanyolcu.wordpress.com En az iki atomun belli bir düzenlemeyle kimyasal bağ oluşturmak suretiyle bir araya gelmesidir. Aynı atomda olabilir farklı atomlarda olabilir. H 2,
ÖĞRENME ALANI : MADDE VE DEĞĐŞĐM ÜNĐTE 3 : MADDENĐN YAPISI VE ÖZELLĐKLERĐ
 ÖĞRENME ALANI : MADDE VE DEĞĐŞĐM ÜNĐTE 3 : MADDENĐN YAPISI VE ÖZELLĐKLERĐ C- BĐLEŞĐKLER VE BĐLEŞĐK FORMÜLLERĐ (4 SAAT) 1- Bileşikler 2- Đyonik Yapılı Bileşik Formüllerinin Yazılması 3- Đyonlar ve Değerlikleri
ÖĞRENME ALANI : MADDE VE DEĞĐŞĐM ÜNĐTE 3 : MADDENĐN YAPISI VE ÖZELLĐKLERĐ C- BĐLEŞĐKLER VE BĐLEŞĐK FORMÜLLERĐ (4 SAAT) 1- Bileşikler 2- Đyonik Yapılı Bileşik Formüllerinin Yazılması 3- Đyonlar ve Değerlikleri
Atomlar birleştiği zaman elektron dağılımındaki değişmelerin bir sonucu olarak kimyasal bağlar meydana gelir. Üç çeşit temel bağ vardır:
 Atomlar birleştiği zaman elektron dağılımındaki değişmelerin bir sonucu olarak kimyasal bağlar meydana gelir. Üç çeşit temel bağ vardır: İyonik bağlar, elektronlar bir atomdan diğerine aktarıldığı zaman
Atomlar birleştiği zaman elektron dağılımındaki değişmelerin bir sonucu olarak kimyasal bağlar meydana gelir. Üç çeşit temel bağ vardır: İyonik bağlar, elektronlar bir atomdan diğerine aktarıldığı zaman
PERİYODİK CETVEL Mendeleev Henry Moseley Glenn Seaborg
 PERİYODİK CETVEL Periyodik cetvel elementleri sınıflandırmak için hazırlanmıştır. İlkperiyodik cetvel Mendeleev tarafından yapılmıştır. Mendeleev elementleri artan kütle numaralarına göre sıralamış ve
PERİYODİK CETVEL Periyodik cetvel elementleri sınıflandırmak için hazırlanmıştır. İlkperiyodik cetvel Mendeleev tarafından yapılmıştır. Mendeleev elementleri artan kütle numaralarına göre sıralamış ve
Yrd.Doç.Dr. Emre YALAMAÇ. Yrd.Doç.Dr. Emre YALAMAÇ İÇERİK
 İÇERİK Metal ve Ametallerin Genel Karşılaştırması Atom Özellikleri ve Kimyasal Bağlar Lewis Elektron-Nokta Simgeleri: Atomların Kimyasal Bağ Gösterimleri İyonik Bağ Modeli İyonik Bağ Enerji Durumu: Örgü
İÇERİK Metal ve Ametallerin Genel Karşılaştırması Atom Özellikleri ve Kimyasal Bağlar Lewis Elektron-Nokta Simgeleri: Atomların Kimyasal Bağ Gösterimleri İyonik Bağ Modeli İyonik Bağ Enerji Durumu: Örgü
PER YOD K S STEM. Elementler artan atom kütlelerine göre s raland klar nda baz özellikler periyodik olarak tekrarlanmaktad r.
 PER YOD K S STEM Atomlar n elektron yap s n n bilinmesi sayesinde bir atomun hangi halde bulundu u tespit edilebildi i gibi, atomun fiziksel ve kimyasal özellikleri hakk nda da birçok bilgiye ula labilmektedir.
PER YOD K S STEM Atomlar n elektron yap s n n bilinmesi sayesinde bir atomun hangi halde bulundu u tespit edilebildi i gibi, atomun fiziksel ve kimyasal özellikleri hakk nda da birçok bilgiye ula labilmektedir.
İyonlar. İyon? Pozitif veya negatif yükü olan bir atoma yada atomlar grubuna iyon denir.
 İyonlar İyon? Pozitif veya negatif yükü olan bir atoma yada atomlar grubuna iyon denir. 1 Atomlardan İyon Oluşumu ve İyon Bir atomdan iyon denilen yüklü bir parçacık oluşturulabilir. Bunun için, nötral
İyonlar İyon? Pozitif veya negatif yükü olan bir atoma yada atomlar grubuna iyon denir. 1 Atomlardan İyon Oluşumu ve İyon Bir atomdan iyon denilen yüklü bir parçacık oluşturulabilir. Bunun için, nötral
Moleküllerarası Etkileşimler, Sıvılar ve Katılar - 11
 Moleküllerarası Etkileşimler, Chemistry, The Central Science, 10th edition Theodore L. Brown; H. Eugene LeMay, Jr.; and Bruce E. Bursten Sıvılar ve Katılar - 11 Maddenin Halleri Maddenin halleri arasındaki
Moleküllerarası Etkileşimler, Chemistry, The Central Science, 10th edition Theodore L. Brown; H. Eugene LeMay, Jr.; and Bruce E. Bursten Sıvılar ve Katılar - 11 Maddenin Halleri Maddenin halleri arasındaki
1.5. Periyodik Özellikler
 1.5. Periyodik Özellikler 9. sınıfta öğrendiğiniz gibi Mendeleyev in (Mendeliiv) periyodik tablo ile ilgili çalışmalarını değerlendiren Henry Moseley (Henri Mozli), günümüzde kullanılan modern periyodik
1.5. Periyodik Özellikler 9. sınıfta öğrendiğiniz gibi Mendeleyev in (Mendeliiv) periyodik tablo ile ilgili çalışmalarını değerlendiren Henry Moseley (Henri Mozli), günümüzde kullanılan modern periyodik
Fen ve Teknoloji 8 KİMYASALBAĞLAR. Oksijen atomunun periyodik çizelgedeki yerini bulalım. Yük (değerlik e - sayısı) O 8 = 2) 6) Anahtar Kavramlar
 KİMYASALBAĞLAR Anahtar Kavramlar Kovalent Bağ İyonik Bağ KAZANIM 2.1 Metallerin elektron vermeye, ametallerin elektron almaya yatkın olduğunu fark eder. Oksijen atomunun periyodik çizelgedeki yerini bulalım.
KİMYASALBAĞLAR Anahtar Kavramlar Kovalent Bağ İyonik Bağ KAZANIM 2.1 Metallerin elektron vermeye, ametallerin elektron almaya yatkın olduğunu fark eder. Oksijen atomunun periyodik çizelgedeki yerini bulalım.
.NO 2,.ClO 2,.NO gibi moleküller radikal
 KİMYASAL TÜRLER Kimyasal türler maddelerin özelliklerini taşıyan en küçük yapı taşlarıdır. Bu türler atomlar, iyonlar, moleküller veya radikaller olabilir. Kimyasal türler Atom Molekül İyon Radikal ATOM
KİMYASAL TÜRLER Kimyasal türler maddelerin özelliklerini taşıyan en küçük yapı taşlarıdır. Bu türler atomlar, iyonlar, moleküller veya radikaller olabilir. Kimyasal türler Atom Molekül İyon Radikal ATOM
KİM-117 TEMEL KİMYA Prof. Dr. Zeliha HAYVALI Ankara Üniversitesi Kimya Bölümü
 KİM-117 TEMEL KİMYA Prof. Dr. Zeliha AYVALI Ankara Üniversitesi Kimya Bölümü Bu slaytlarda anlatılanlar sadece özet olup ayrıntılı bilgiler ve örnek çözümleri derste verilecektir. BÖLÜM 6 KİMYASAL BAĞLAR
KİM-117 TEMEL KİMYA Prof. Dr. Zeliha AYVALI Ankara Üniversitesi Kimya Bölümü Bu slaytlarda anlatılanlar sadece özet olup ayrıntılı bilgiler ve örnek çözümleri derste verilecektir. BÖLÜM 6 KİMYASAL BAĞLAR
MADDENİN YAPISI VE ÖZELLİKLERİ ATOM
 MADDENİN YAPISI VE ÖZELLİKLERİ ATOM ATOMUN YAPISI Elementlerin tüm özelliğini gösteren en küçük parçasına atom denir. Atomu oluşturan parçacıklar farklı yüklere sa-hiptir. Atomda bulunan yükler; negatif
MADDENİN YAPISI VE ÖZELLİKLERİ ATOM ATOMUN YAPISI Elementlerin tüm özelliğini gösteren en küçük parçasına atom denir. Atomu oluşturan parçacıklar farklı yüklere sa-hiptir. Atomda bulunan yükler; negatif
enerji seviyeli bir orbital tamamen elektron giremez (Aufbau İlkesi).
 GENEL KİMYA Elementlerin Elektronik Yapıları Bir atomda elektronların düzenlenme şekline atomun elektronik yapısı denir. Elektronlar, orbitalleri üç kurala uyarak doldururlar. Bunlar: Elektronlar, orbitalleri
GENEL KİMYA Elementlerin Elektronik Yapıları Bir atomda elektronların düzenlenme şekline atomun elektronik yapısı denir. Elektronlar, orbitalleri üç kurala uyarak doldururlar. Bunlar: Elektronlar, orbitalleri
Bölüm 2: Atomik Yapı & Atomarası Bağlar
 Bölüm 2: Atomik Yapı & Atomarası Bağlar Bağlanmayı ne sağlar? Ne tip bağlar vardır? Bağların sebep olduğu özellikler nelerdir? Chapter 2-1 Atomun yapısı (Birinci sınıf kimyası) atom electronlar 9.11 x
Bölüm 2: Atomik Yapı & Atomarası Bağlar Bağlanmayı ne sağlar? Ne tip bağlar vardır? Bağların sebep olduğu özellikler nelerdir? Chapter 2-1 Atomun yapısı (Birinci sınıf kimyası) atom electronlar 9.11 x
BÖLÜM 1 1. MALZEMELERİN ATOM YAPISI
 BÖLÜM 1 1. MALZEMELERİN ATOM YAPISI 1 1.2. Atom Yapısı ve Elektron Düzeni Bütün maddeler kimyasal elementlerden oluşur. Elementler ise atomlardan meydana gelir. Bir elementin kimyasal özelliklerini taşıyan
BÖLÜM 1 1. MALZEMELERİN ATOM YAPISI 1 1.2. Atom Yapısı ve Elektron Düzeni Bütün maddeler kimyasal elementlerden oluşur. Elementler ise atomlardan meydana gelir. Bir elementin kimyasal özelliklerini taşıyan
ELEKTRONLARIN DĠZĠLĠMĠ
 ELEKTRONLARIN DĠZĠLĠMĠ Eğer bu üç elementin birer elektronu daha olsaydı, her birinde yeni bir katman oluşacaktı. Çünkü her üçünün de en dıştaki katmanları tamamen dolu durumdadır. 1.Katmanda en çok 2
ELEKTRONLARIN DĠZĠLĠMĠ Eğer bu üç elementin birer elektronu daha olsaydı, her birinde yeni bir katman oluşacaktı. Çünkü her üçünün de en dıştaki katmanları tamamen dolu durumdadır. 1.Katmanda en çok 2
Bir atomdan diğer bir atoma elektron aktarılmasıyla
 kimyasal bağlar Kimyasal bağ, moleküllerde atomları bir arada tutan kuvvettir. Atomlar daha düşük enerjili duruma erişmek için bir araya gelirler. Bir bağın oluşabilmesi için atomlar tek başına bulundukları
kimyasal bağlar Kimyasal bağ, moleküllerde atomları bir arada tutan kuvvettir. Atomlar daha düşük enerjili duruma erişmek için bir araya gelirler. Bir bağın oluşabilmesi için atomlar tek başına bulundukları
Paylaşılan elektron ya da elektronlar, her iki çekirdek etrafında dolanacaklar, iki çekirdek arasındaki bölgede daha uzun süre bulundukları için bu
 4.Kimyasal Bağlar Kimyasal Bağlar Aynı ya da farklı cins atomları bir arada tutan kuvvetlere kimyasal bağlar denir. Pek çok madde farklı element atomlarının birleşmesiyle meydana gelmiştir. İyonik bağ
4.Kimyasal Bağlar Kimyasal Bağlar Aynı ya da farklı cins atomları bir arada tutan kuvvetlere kimyasal bağlar denir. Pek çok madde farklı element atomlarının birleşmesiyle meydana gelmiştir. İyonik bağ
Elementlerin büyük bir kısmı tabiatta saf hâlde bulunmaz. Çoğunlukla başka elementlerle bileşikler oluşturmuş şekilde bulunurlar.
 Elementlerin büyük bir kısmı tabiatta saf hâlde bulunmaz. Çoğunlukla başka elementlerle bileşikler oluşturmuş şekilde bulunurlar. Elementlerin bileşik oluşturma istekleri onların kararlı yapıya ulaşma
Elementlerin büyük bir kısmı tabiatta saf hâlde bulunmaz. Çoğunlukla başka elementlerle bileşikler oluşturmuş şekilde bulunurlar. Elementlerin bileşik oluşturma istekleri onların kararlı yapıya ulaşma
FZM 220. Malzeme Bilimine Giriş
 FZM 220 Yapı Karakterizasyon Özellikler İşleme Performans Prof. Dr. İlker DİNÇER Fakültesi, Fizik Mühendisliği Bölümü 1 Atomsal Yapı ve Atomlararası Bağ1 Ders Hakkında FZM 220 Dersinin Amacı Bu dersin
FZM 220 Yapı Karakterizasyon Özellikler İşleme Performans Prof. Dr. İlker DİNÇER Fakültesi, Fizik Mühendisliği Bölümü 1 Atomsal Yapı ve Atomlararası Bağ1 Ders Hakkında FZM 220 Dersinin Amacı Bu dersin
KİMYASAL TÜRLER VE ETKİLEŞİMLER. Kimya Ders Notu
 KİMYASAL TÜRLER VE ETKİLEŞİMLER Kimya Ders Notu KİMYASAL TÜRLER Atomlar, moleküller iyonlar ve radikaller genel olarak kimyasal tür adı ile bilinirler. Atom: Bir elementin bütün özelliğini taşıyan en küçük
KİMYASAL TÜRLER VE ETKİLEŞİMLER Kimya Ders Notu KİMYASAL TÜRLER Atomlar, moleküller iyonlar ve radikaller genel olarak kimyasal tür adı ile bilinirler. Atom: Bir elementin bütün özelliğini taşıyan en küçük
KİMYASAL BAĞLAR. Atomları Bir Arada Tutan Kuvvet
 KİMYASAL BAĞLAR Birleşiğin en küçük parçasın oluşturan ve en az iki atomun birleşmesinden meydana gelen kararlı yapı moleküldür. Moleküldeki atomları bir arada tutan kuvvet ise kimyasal bağlardır. Atomları
KİMYASAL BAĞLAR Birleşiğin en küçük parçasın oluşturan ve en az iki atomun birleşmesinden meydana gelen kararlı yapı moleküldür. Moleküldeki atomları bir arada tutan kuvvet ise kimyasal bağlardır. Atomları
Element atomlarının atom ve kütle numaraları element sembolleri üzerinde gösterilebilir. Element atom numarası sembolün sol alt köşesine yazılır.
 Atom üç temel tanecikten oluşur. Bunlar proton, nötron ve elektrondur. Proton atomun çekirdeğinde bulunan pozitif yüklü taneciktir. Nötron atomun çekirdeğin bulunan yüksüz taneciktir. ise çekirdek etrafında
Atom üç temel tanecikten oluşur. Bunlar proton, nötron ve elektrondur. Proton atomun çekirdeğinde bulunan pozitif yüklü taneciktir. Nötron atomun çekirdeğin bulunan yüksüz taneciktir. ise çekirdek etrafında
Çalışma Soruları 2: Bölüm 2
 Çalışma Soruları 2: Bölüm 2 2.1) Kripton(Kr) atomunun yarıçapı 1,9 Å dur. a) Bu uzaklık nanometre (nm) ve pikometre (pm) cinsinden nedir? b) Kaç tane kripton atomunu yanyana dizersek uzunlukları 1,0 mm
Çalışma Soruları 2: Bölüm 2 2.1) Kripton(Kr) atomunun yarıçapı 1,9 Å dur. a) Bu uzaklık nanometre (nm) ve pikometre (pm) cinsinden nedir? b) Kaç tane kripton atomunu yanyana dizersek uzunlukları 1,0 mm
KİM-117 TEMEL KİMYA Prof. Dr. Zeliha HAYVALI Ankara Üniversitesi Kimya Bölümü
 KİM-117 TEMEL KİMYA Prof. Dr. Zeliha HAYVALI Ankara Üniversitesi Kimya Bölümü Bu slaytlarda anlatılanlar sadece özet olup ayrıntılı bilgiler ve örnek çözümleri derste verilecektir. BÖLÜM 4 PERİYODİK SİSTEM
KİM-117 TEMEL KİMYA Prof. Dr. Zeliha HAYVALI Ankara Üniversitesi Kimya Bölümü Bu slaytlarda anlatılanlar sadece özet olup ayrıntılı bilgiler ve örnek çözümleri derste verilecektir. BÖLÜM 4 PERİYODİK SİSTEM
ATOMİK YAPI. Elektron Yükü=-1,60x10-19 C Proton Yükü=+1,60x10-19 C Nötron Yükü=0
 ATOMİK YAPI Elektron Yükü=-1,60x10-19 C Proton Yükü=+1,60x10-19 C Nötron Yükü=0 Elektron Kütlesi 9,11x10-31 kg Proton Kütlesi Nötron Kütlesi 1,67x10-27 kg Bir kimyasal elementin atom numarası (Z) çekirdeğindeki
ATOMİK YAPI Elektron Yükü=-1,60x10-19 C Proton Yükü=+1,60x10-19 C Nötron Yükü=0 Elektron Kütlesi 9,11x10-31 kg Proton Kütlesi Nötron Kütlesi 1,67x10-27 kg Bir kimyasal elementin atom numarası (Z) çekirdeğindeki
2. HAMLE web:
 2. HAMLE Nötron sayısı İZOTOP ATOM 1-Proton sayıları... nötron ve kütle numaraları.. atomlardır. 2-İzotop atomların fiziksel özellikleri. 3-Nötr izotop atomlar kimyasal özellikleri. 4-İzotop atomlar aynı
2. HAMLE Nötron sayısı İZOTOP ATOM 1-Proton sayıları... nötron ve kütle numaraları.. atomlardır. 2-İzotop atomların fiziksel özellikleri. 3-Nötr izotop atomlar kimyasal özellikleri. 4-İzotop atomlar aynı
MOL KAVRAMI I. ÖRNEK 2
 MOL KAVRAMI I Maddelerin taneciklerden oluştuğunu biliyoruz. Bu taneciklere atom, molekül ya da iyon denir. Atom : Kimyasal yöntemlerle daha basit taneciklere ayrılmayan ve elementlerin yapıtaşı olan taneciklere
MOL KAVRAMI I Maddelerin taneciklerden oluştuğunu biliyoruz. Bu taneciklere atom, molekül ya da iyon denir. Atom : Kimyasal yöntemlerle daha basit taneciklere ayrılmayan ve elementlerin yapıtaşı olan taneciklere
MOLEKÜLLERİN ŞEKİLLERİ
 MOLEKÜLLERİN ŞEKİLLERİ Moleküllerin ve İyonların Lewis Yapısıyla Gösterimi 1- Oktet Kuralı Kullanılarak Lewis Yapılarının Yazımı: - Tek Bağlı Moleküller için Lewis Yapıları - Çok Katlı Bağ Moleküller için
MOLEKÜLLERİN ŞEKİLLERİ Moleküllerin ve İyonların Lewis Yapısıyla Gösterimi 1- Oktet Kuralı Kullanılarak Lewis Yapılarının Yazımı: - Tek Bağlı Moleküller için Lewis Yapıları - Çok Katlı Bağ Moleküller için
MOLEKÜL GEOMETRİSİ ve HİBRİTLEŞME. (Kimya Ders Notu)
 MOLEKÜL GEOMETRİSİ ve HİBRİTLEŞME (Kimya Ders Notu) MOLEKÜL GEOMETRİSİ ve HİBRİTLEŞME Periyodik cetvelde A gruplarında bulunan elementler bileşik oluştururken kendilerine en yakın olan soygazın elektron
MOLEKÜL GEOMETRİSİ ve HİBRİTLEŞME (Kimya Ders Notu) MOLEKÜL GEOMETRİSİ ve HİBRİTLEŞME Periyodik cetvelde A gruplarında bulunan elementler bileşik oluştururken kendilerine en yakın olan soygazın elektron
X +5 iyonunda; n = p + 1 eflitli i vard r. ATOM VE PER YOD K CETVEL ÖRNEK 15: ÖRNEK 16:
 A ÖRNEK 15: I. X +5 iyonunun proton say s, nötron say s ndan 1 eksiktir II. 14 Y 2 iyonunun elektron say s, X +5 iyonunun elektron say s ndan 6 fazlad r Buna göre X elementinin izotopunun atom ve kütle
A ÖRNEK 15: I. X +5 iyonunun proton say s, nötron say s ndan 1 eksiktir II. 14 Y 2 iyonunun elektron say s, X +5 iyonunun elektron say s ndan 6 fazlad r Buna göre X elementinin izotopunun atom ve kütle
I. FOTOELEKTRON SPEKTROSKOPĠSĠ (PES) PES orbital enerjilerini doğrudan tayin edebilir. (Fotoelektrik etkisine benzer!)
 5.111 Ders Özeti #9 Bugün için okuma: Bölüm 1.14 (3.Baskıda, 1.13) Elektronik Yapı ve Periyodik Çizelge, Bölüm 1.15, 1.16, 1.17, 1.18, ve 1.20 (3.Baskıda, 1.14, 1.15, 1.16, 1.17, ve 1.19) Atom Özelliklerinde
5.111 Ders Özeti #9 Bugün için okuma: Bölüm 1.14 (3.Baskıda, 1.13) Elektronik Yapı ve Periyodik Çizelge, Bölüm 1.15, 1.16, 1.17, 1.18, ve 1.20 (3.Baskıda, 1.14, 1.15, 1.16, 1.17, ve 1.19) Atom Özelliklerinde
KĐMYASAL BAĞLAR. Molekül veya kimyasal bileşikler içerisinde atomların beraberce bulunmaları ancak kimyasal bağlar ile mümkün olmaktadır.
 KĐMYASAL BAĞLAR Molekül veya kimyasal bileşikler içerisinde atomların beraberce bulunmaları ancak kimyasal bağlar ile mümkün olmaktadır. Đki atom veya atom grubu arasında bir molekül oluşturmak üzere etkileşme,
KĐMYASAL BAĞLAR Molekül veya kimyasal bileşikler içerisinde atomların beraberce bulunmaları ancak kimyasal bağlar ile mümkün olmaktadır. Đki atom veya atom grubu arasında bir molekül oluşturmak üzere etkileşme,
ATOMİK YAPI. Elektron Yükü=-1,60x10-19 C Proton Yükü=+1,60x10-19 C Nötron Yükü=0
 ATOMİK YAPI Atom, birkaç türü birleştiğinde çeşitli molekülleri, bir tek türü ise bir kimyasal öğeyi oluşturan parçacıktır. Atom, elementlerin özelliklerini taşıyan en küçük yapı birimi olup çekirdekteki
ATOMİK YAPI Atom, birkaç türü birleştiğinde çeşitli molekülleri, bir tek türü ise bir kimyasal öğeyi oluşturan parçacıktır. Atom, elementlerin özelliklerini taşıyan en küçük yapı birimi olup çekirdekteki
MALZEME BİLGİSİ. Atomlar Arası Bağlar
 MALZEME BİLGİSİ Dr.- Ing. Rahmi ÜNAL Konu: Atomlar Arası Bağlar 1 Giriş Atomları bir arada tutarak iç yapıyı oluştururlar Malzemelerin mukavemeti, elektriksel ve ısıl özellikleri büyük ölçüde iç yapıya
MALZEME BİLGİSİ Dr.- Ing. Rahmi ÜNAL Konu: Atomlar Arası Bağlar 1 Giriş Atomları bir arada tutarak iç yapıyı oluştururlar Malzemelerin mukavemeti, elektriksel ve ısıl özellikleri büyük ölçüde iç yapıya
BileĢiklerin formülleri atom sayıları oranını yansıtan en basit formüldür.
 KATILAR KRĠSTAL KATI Sert SıkıĢtırılmayan Tanecikleri belirli geometrik Ģekle sahiptir. ĠYONĠK KRĠSTAL Anyon- katyonlar arasında elektrostatik çekim kuvveti sonucu oluģur (iyonik bağ içerir). Sert-sağlam-
KATILAR KRĠSTAL KATI Sert SıkıĢtırılmayan Tanecikleri belirli geometrik Ģekle sahiptir. ĠYONĠK KRĠSTAL Anyon- katyonlar arasında elektrostatik çekim kuvveti sonucu oluģur (iyonik bağ içerir). Sert-sağlam-
ANORGANİK KİMYA TEMEL KAVRAMLAR
 ANORGANİK KİMYA TEMEL KAVRAMLAR Prof. Dr. Halis ÖLMEZ Prof. Dr. Veysel T. YILMAZ Beşinci Baskı 2010 BEŞİNCİ BASKIYA ÖNSÖZ Z 1997 yılında birinci baskısı, 1998 yılında da ikinci, 2004 yılında üçüncü, 2008
ANORGANİK KİMYA TEMEL KAVRAMLAR Prof. Dr. Halis ÖLMEZ Prof. Dr. Veysel T. YILMAZ Beşinci Baskı 2010 BEŞİNCİ BASKIYA ÖNSÖZ Z 1997 yılında birinci baskısı, 1998 yılında da ikinci, 2004 yılında üçüncü, 2008
BÖLÜM. Kimyasal Türler Arası Etkileşimler. Zayıf Etkileşimler Test Kimyasal Tür Nedir? Test Zayıf Etkileşimler Test
 BÖLÜM 3 Kimyasal Türler Arası Etkileşimler Kimyasal Tür Nedir? Test - 1... 2 Lewis Sembolleri Test - 2...2 Kimyasal Türler Arası Etkileşimlerin Sınıflandırılması Test - 3...2 Kimyasal Türler Arası Etkileşimler
BÖLÜM 3 Kimyasal Türler Arası Etkileşimler Kimyasal Tür Nedir? Test - 1... 2 Lewis Sembolleri Test - 2...2 Kimyasal Türler Arası Etkileşimlerin Sınıflandırılması Test - 3...2 Kimyasal Türler Arası Etkileşimler
Bileşikteki atomların cinsini ve oranını belirten formüldür. Kaba formül ile bileşiğin molekül ağırlığı hesaplanamaz.
 BİLEŞİKLER Birden fazla elementin belirli oranlarda kimyasal yollarla bir araya gelerek, kendi özelligini kaybedip oluşturdukları yeni saf maddeye bileşik denir. Bileşikteki atomların cins ve sayısını
BİLEŞİKLER Birden fazla elementin belirli oranlarda kimyasal yollarla bir araya gelerek, kendi özelligini kaybedip oluşturdukları yeni saf maddeye bileşik denir. Bileşikteki atomların cins ve sayısını
KĠMYASAL ÖZELLĠKLER VE KĠMYASAL BAĞ
 Elektronların Dizilimi ve Kimyasal Özellikler Atomların katmanlarında belirli sayılarda elektron bulunmaktadır. Ancak bir atom, tek katmanlıysa ve bu katmanda iki elektronu varsa kararlıdır. Atomun iki
Elektronların Dizilimi ve Kimyasal Özellikler Atomların katmanlarında belirli sayılarda elektron bulunmaktadır. Ancak bir atom, tek katmanlıysa ve bu katmanda iki elektronu varsa kararlıdır. Atomun iki
Genel Kimya. Bölüm 6: Kimyasal Bağlar Temel Kavramlar- Bağ Kuramları. Yrd. Doç. Dr. Mustafa SERTÇELİK Kafkas Üniversitesi Kimya Mühendisliği Bölümü
 Genel Kimya Bölüm 6: Kimyasal Bağlar Temel Kavramlar- Bağ Kuramları Yrd. Doç. Dr. Mustafa SERTÇELİK Kafkas Üniversitesi Kimya Mühendisliği Bölümü KĠMYASAL BAĞLAR ĠYONĠK BAĞ KOVALENT BAĞ MOLKÜLLERĠN POLARLIĞI
Genel Kimya Bölüm 6: Kimyasal Bağlar Temel Kavramlar- Bağ Kuramları Yrd. Doç. Dr. Mustafa SERTÇELİK Kafkas Üniversitesi Kimya Mühendisliği Bölümü KĠMYASAL BAĞLAR ĠYONĠK BAĞ KOVALENT BAĞ MOLKÜLLERĠN POLARLIĞI
Bir maddenin başka bir madde içerisinde homojen olarak dağılmasına ÇÖZÜNME denir. Çözelti=Çözücü+Çözünen
 ÇÖZÜCÜ VE ÇÖZÜNEN ETKİLEŞİMLERİ: Çözünme olayı ve Çözelti Oluşumu: Bir maddenin başka bir madde içerisinde homojen olarak dağılmasına ÇÖZÜNME denir. Çözelti=Çözücü+Çözünen Çözünme İyonik Çözünme Moleküler
ÇÖZÜCÜ VE ÇÖZÜNEN ETKİLEŞİMLERİ: Çözünme olayı ve Çözelti Oluşumu: Bir maddenin başka bir madde içerisinde homojen olarak dağılmasına ÇÖZÜNME denir. Çözelti=Çözücü+Çözünen Çözünme İyonik Çözünme Moleküler
Malzemelerin Elektriksel. Özellikleri. Elektron hareketlili i letkenlik Enerji bant yap lar. Tan mlar
 Bölüm 7: Elektriksel Özellikler CEVAP ARANACAK SORULAR... Elektriksel iletkenlik ve direnç nasl tarif edilebilir? letkenlerin, yariletkenlerin ve yaltkanlarn ortaya çkmasnda hangi fiziksel süreçler bulunmaktadr?
Bölüm 7: Elektriksel Özellikler CEVAP ARANACAK SORULAR... Elektriksel iletkenlik ve direnç nasl tarif edilebilir? letkenlerin, yariletkenlerin ve yaltkanlarn ortaya çkmasnda hangi fiziksel süreçler bulunmaktadr?
Periyodik Tablo(sistem)
 Periyodik Tablo(sistem) Geçmişten Günümüze Periyodik Tablo Bilim adamları elementlerin sayısı arttıkça bunları benzer özelliklerine göre sıralamaya çalışmışlardır.(bunu süpermarketlerdeki ürünlerin dizilişlerine
Periyodik Tablo(sistem) Geçmişten Günümüze Periyodik Tablo Bilim adamları elementlerin sayısı arttıkça bunları benzer özelliklerine göre sıralamaya çalışmışlardır.(bunu süpermarketlerdeki ürünlerin dizilişlerine
ÖĞRENME ALANI : MADDE VE DEĞİŞİM ÜNİTE 4 : MADDENİN YAPISI VE ÖZELLİKLERİ
 ÖĞRENME ALANI : MADDE VE DEĞİŞİM ÜNİTE 4 : MADDENİN YAPISI VE ÖZELLİKLERİ E BİLEŞİKLER VE FRMÜLLERİ (4 SAAT) 1 Bileşikler 2 Bileşiklerin luşması 3 Bileşiklerin Özellikleri 4 Bileşik Çeşitleri 5 Bileşik
ÖĞRENME ALANI : MADDE VE DEĞİŞİM ÜNİTE 4 : MADDENİN YAPISI VE ÖZELLİKLERİ E BİLEŞİKLER VE FRMÜLLERİ (4 SAAT) 1 Bileşikler 2 Bileşiklerin luşması 3 Bileşiklerin Özellikleri 4 Bileşik Çeşitleri 5 Bileşik
ATOM BİLGİSİ I ÖRNEK 1
 ATOM BİLGİSİ I Elementlerin özelliklerini ta ıyan en küçük yapıta ı atomdur. Son çözümlemede, bütün maddelerin atomlar toplulu u oldu unu söyleyebiliriz. Elementler, aynı tür atomlardan, bile ik ve karı
ATOM BİLGİSİ I Elementlerin özelliklerini ta ıyan en küçük yapıta ı atomdur. Son çözümlemede, bütün maddelerin atomlar toplulu u oldu unu söyleyebiliriz. Elementler, aynı tür atomlardan, bile ik ve karı
KĐMYA EĞĐTĐMĐ. Prof. Dr. Đnci MORGĐL
 KĐMYA EĞĐTĐMĐ Prof. Dr. Đnci MORGĐL KONU:ATOMĐK, MOLEKÜLER VE ĐYON ÖRGÜLÜ YAPILAR SÜRE:8 DERS SAATĐ HAZIRLAYANLAR:DERYA ÇAKICI HALE SÜMERKAN PINAR ECE ÖZLEM ŞAHĐN HEDEF 1:Metallerin yapısı ve metalik bağı
KĐMYA EĞĐTĐMĐ Prof. Dr. Đnci MORGĐL KONU:ATOMĐK, MOLEKÜLER VE ĐYON ÖRGÜLÜ YAPILAR SÜRE:8 DERS SAATĐ HAZIRLAYANLAR:DERYA ÇAKICI HALE SÜMERKAN PINAR ECE ÖZLEM ŞAHĐN HEDEF 1:Metallerin yapısı ve metalik bağı
Atomlar birleştiği zaman elektron dağılımındaki değişmelerin bir sonucu olarak kimyasal bağlar meydana gelir. Üç çeşit temel bağ vardır.
 Atomlar birleştiği zaman elektron dağılımındaki değişmelerin bir sonucu olarak kimyasal bağlar meydana gelir. Üç çeşit temel bağ vardır. 1-İyonik bağlar, elektronlar bir atomdan diğerine aktarıldığı zaman
Atomlar birleştiği zaman elektron dağılımındaki değişmelerin bir sonucu olarak kimyasal bağlar meydana gelir. Üç çeşit temel bağ vardır. 1-İyonik bağlar, elektronlar bir atomdan diğerine aktarıldığı zaman
PROBLEM 1.1 a ) Örnek Çözüm b ) 9 F; 1s 2 2s 2 2p 5 (Değerlik elektronları: 2s 2 2p 5 ) c ) 16 S; 1s 2 2s 2 2p 6 3s 2 3p 4 (Değerlik elektronları: 3s
 PROBLEM 1.1 b ) 9 F; 1s 2 2s 2 2p 5 (Değerlik elektronları: 2s 2 2p 5 ) c ) 16 S; 1s 2 2s 2 2p 6 3s 2 3p 4 (Değerlik elektronları: 3s 2 3p 4 ) ç ) 14 Si; 1s 2 2s 2 2p 6 3s 2 3p 2 (Değerlik elektronları:
PROBLEM 1.1 b ) 9 F; 1s 2 2s 2 2p 5 (Değerlik elektronları: 2s 2 2p 5 ) c ) 16 S; 1s 2 2s 2 2p 6 3s 2 3p 4 (Değerlik elektronları: 3s 2 3p 4 ) ç ) 14 Si; 1s 2 2s 2 2p 6 3s 2 3p 2 (Değerlik elektronları:
BİLEŞİKLER VE FORMÜLLERİ
 BİLEŞİKLER VE FORMÜLLERİ Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur). Bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere
BİLEŞİKLER VE FORMÜLLERİ Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur). Bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere
