ESKİŞEHİR TEKNİK ÜNİVERSİTESİ BİLİM VE TEKNOLOJİ DERGİSİ C- YAŞAM BİLİMLERİ VE BİYOTEKNOLOJİ DERLEME GENO-SİTOTOKSİSİTE ÇALIŞMALARINA SİTOM YAKLAŞIMI
|
|
|
- Gülistan Müjde
- 3 yıl önce
- İzleme sayısı:
Transkript
1 ESKİŞEHİR TEKNİK ÜNİVERSİTESİ BİLİM VE TEKNOLOJİ DERGİSİ C- YAŞAM BİLİMLERİ VE BİYOTEKNOLOJİ Eskişehir Technical University Journal of Science and Technology C- Life Sciences and Biotechnology 2019, 8(2), syf , DOI: /estubtdc DERLEME GENO-SİTOTOKSİSİTE ÇALIŞMALARINA SİTOM YAKLAŞIMI Ceren BÖRÇEK KASURKA * Ordu Üniversitesi Fen Edebiyat Fakültesi Moleküler Biyoloji ve Genetik Bölümü, Ordu, Türkiye ÖZET DNA hasarının kromozom seviyesinde çalışılması, genetik toksikoloji araştırmalarının temel dayanaklarındandır. Mikronükleus yöntemi, kromozom hasarını değerlendirmek amacıyla geliştirilen yöntemlerden biridir. Mikronükleuslar; sentromeri olmayan kromozom veya kromatid fragmentlerinden ya da anafazda geç kalıp kutuplara göç edemeyen kromozom veya kromatidlerden oluşan ve telofazda hücre zarı ile kuşatılarak kardeş hücre çekirdeklerine dahil olmadan sitoplazmada kalan, çekirdek dışı küçük cisimciklerdir. Bu yöntemde mikronükleusların yanısıra nükleoplazmik köprüler (NPK) ve nükleer tomurcuklar (NT) değerlendirilebilmekte ve hücre ölümü ile nükleer bölünme indeksi de ölçülebilmektedir. Disentrik kromozomların sentromerlerinin farklı kutuplara göç etmesinden orjinlenen NPK, DNA nın yanlış onarımının; kromozom rearanjmanının, telomer uç birleşmesinin; NT ise gen amplifikasyonu ve/veya değişmiş gen dozajının göstergesi olarak sayılmaktadır. Ayrıca her hücrenin sahip olduğu çekirdek sayısının değerlendirilerek nükleer bölünme indeksinin hesaplanmasının yanısıra nekrotik ve apoptotik hücrelerin de belirlenebilmesi mitotik aktivite ve sitotoksisitenin tayinine olanak sağlamaktadır. Analiz edilebilen tüm bu parametreler mikronükleus yöntemini genetik kusurların, beslenme yetersizliklerinin veya ekzojen kaynaklı genotoksinlerin sebep olduğu kromozomal instabilite fenotipinin ve değişmiş hücresel canlılığın kapsamlı olarak ölçülebildiği sitom yöntemi haline getirmiştir. Bu derlemede mikronükleus yönteminin genotoksisite çalışmalarındaki yeri ve önemi ile sitom yaklaşımının bu yönteme kattığı yeniliklere değinilmiştir. Anahtar Kelimeler: Mikronükleus, Sitom, Genotoksisite, Sitotoksisite CYTOM APPROACH TO GENO-CYTOTOXICITY STUDIES ABSTRACT Working at the chromosomal level of DNA damage is the mainstay of the genetic toxicology researches. The micronucleus assay is one of the developed methods to evaluate chromosomal damage. Micronuclei are non-centromeric chromosomes/chromatids fragments, or chromosomes/chromatids which lagging in the anaphase and cannot migrate to the poles, located in the cytoplasm without being included in the sister cell nuclei and surrounded by cell membranes in telophase. In this method, besides micronuclei, nucleoplasmic bridges (NPBs) and nuclear buds (NBUDs) can be evaluated, cell death and nuclear division index (NDI) can be measured. NPBs originated from the centromeres of dicentric chromosomes migrating to different poles, are indicative of DNA mis-repair, chromosome rearrangement, telomere end-fusions. NBUDs are considered as markers of gene amplification and/or altered gene dosage. In addition to NDI, establishing to necrotic and apoptotic cells may allow the determination of mitotic activity and cytotoxicity. All these analysed parameters have transformed micronucleus method into "cytome" assay by which chromosomal instability phenotypes and altered cellular viability caused by genetic defects, nutritional deficiencies, genotoxins from exogenous sources can be measured comprehensively. In this review, the place and importance of micronucleus method in genotoxicity studies and the innovations caused by the cytome approach are mentioned. Keywords: Micronucleus, Cytome, Genotoxicity, Cytotoxicity *Sorumlu Yazar: cerenborcek@yahoo.com Geliş: Kabul:
2 1. GİRİŞ Bileşiklerin toksik etkisi, bileşiğin konsantrasyonu ve maruz kalma süresinin bileşkesidir. Bir toksine maruz kalan hücre popülasyonunda, hücre tipine ve yoğunluğa bağlı olmakla beraber dinamik değişiklikler ortaya çıkar. In vitro şartlarda yetişen hücrelerde bileşiklerin etkilerinin analiz edilmesi, tüm hayvanlarda potansiyel toksik etkilere dair öngörü oluşturmak amacıyla yapılmaktadır [1]. Çekirdekte, kromozomlarda ve/veya DNA yapısında meydana gelen hasarları nitelemek amacıyla genetik toksisite ya da genotoksisite terimleri kullanılmaktadır. Başka bir deyişle genotoksisite, kimyasal maddelerin DNA ya veya genomun doğruluğunu düzenleyen hücresel bileşenlere (iğ iplikçiklerine, topoizomerazlara, DNA onarım sistemine, DNA polimerazlara) zarar verme kapasitesini ve genetik bilgi üzerindeki yan etkileri ifade etmektedir. Genetik materyale potansiyel zararı olan maddelerin etkileri, doğrudan veya dolayı yoldan gerçekleşebilmektedir. Zararlı etkiler sadece mutajenik maddelerden kaynaklanmayabilir. Bu nedenle, genotoksisite, mutasyonlarda artış yapma yeteneği demek olan mutajeniteden daha kapsamlı bir biyolojik olaydır. Sitotoksisite terimi ise hücre ölümüne neden olan anlamını taşımaktadır [2-4]. Genotoksisitesi araştırılacak maddelerin güvenlik değerlendirmeleri yapılırken; gen mutasyonu, klastojenite ve anöploidi gibi anormallikleri değerlendiren farklı testlerin kombinasyonları uygulanır. Çünkü bu üç sonlanım noktası genel olarak insan hastalıkları ile ilişkilendirilen genetik hasarlara yol açmaktadır. Bu üç genetik değişim, eğer germ hücrelerinde oluşursa kalıtılabilir etkilere sahip olarak ileriki nesiller açısından ciddi risk oluşturma potansiyeli de taşımaktadırlar. Somatik hücrelerdeki benzer değişimler ise malignansi oluşumunda önemli rol üstlenirler. Maruziyet süresi ve maddenin konsantrasyonuna bağlı olarak genotoksik veya mutajenik maddelerin oluşturacağı genetik hasarın derecesi değişebilmektedir [3, 5, 6]. İnsanoğlunun genetik bütünlüğü kimyasal ve fiziksel genotoksinlere maruziyete sebep olan endüstriyel faaliyetlerin, beslenme alışkanlıkları gibi hayat stili faktörlerinin, çeşitli tıbbi tedavilerin, UV maruziyetinde artışa sebep olan iklimsel değişiklikler gibi etkenlerin giderek artan tehtidi altındadır. Bu nedenle, insan popülasyonunda genetik hasarın kabul edilebilir seviyesini, belirli genotoksinlere aşırı duyarlı olabilecek bireyleri, çevreye salınan yeni kimyasalların olası etkilerini, büyük bir kazadan sonra bir popülasyonda genetik hasar artış oranını belirleyebilmek ve mesleki açıdan genetik düzeyde zararlı olabilecek ajanlara maruz kalan kişileri rutin olarak izlemek önemlidir [7]. Birçok kronik dejeneretif hastalığın temelinde genetik hasar yatmaktadır. Hatasız ölçümler, hasarın önlenmesi ve genomik sağlık durumunun geliştirilmesi açısından önemlidir. Bu sebeple DNA hasarının ölçülebilmesi amacıyla çeşitli metotlar geliştirlmiştir. Son 50 yılda kimyasalların rutin analizinde, çevresel araştırmalarda ve ayrıca mesleki maruziyetin, yaşam tarzı faktörlerinin ve beslenmenin DNA bütünlüğü üzerindeki etkisine ilişkin insan çalışmalarında kullanmak amacıyla geliştirilen genotoksisite test prosedürleri geniş bir yelpazede oluşturmuştur [8, 9]. Genotoksik olduğu bilinen kimyasalların kromozom anomalileri ile kardeş kromatid değişimlerini indüklediği 1970 lerde belirlenmiştir [6]. Aradan geçen süre içinde çok çeşitli gentoksisite testleri geliştirilmiş olmakla birlikte hiçbir yöntem tek başına etkili bir tarama sağlayamamaktadır [7]. Çeşitli etki mekanizmaları ile doğrudan veya dolaylı olarak genetik hasarı indükleyen maddeleri belirlemek amacıyla in vitro ve in vivo olarak tanımlanan genotoksisite testleri uygulanmaktadır. Genotoksisite testlerinin uygulanışı, uzun dönemli karsinojenite çalışmalarının tasarlanması, yürütülmesi ve yorumlanması için de önemlidir. Yüksek hassasiyetleri ve hızlı sonuç vermeleri nedeniyle genotoksisite araştırmalarında in vitro yöntemlerin kullanımı tercih edilmektedir [5]. 262
3 Genotoksik ve mutajenik açıdan incelenecek maddelerin etkilerini ortaya çıkarmak amacıyla en yaygın kullanılan in vivo ve in vitro testler Ames Testi, Comet Testi, Kromozom Anormallikleri Testi, Mikronükleus Testi ve Kardeş Kromatid Değişim Testidir [2, 3, 5, 10-12]. 2. MİKRONÜKLEUS YÖNTEMİ Radyasyon tarafından indüklenen asentrik kromatid veya kromozom fragmanlarından kaynaklanan ve normal çekirdeklerden görece küçük olan; mikronükleus (MN) -ilk çalışmalarda fragment nükleus olarak da geçmekteydi- olarak isimlendirilen ilave çekirdeklerin varlığı; mikronükleus sıklığının kromozom aberasyon sıklığı ile ilişkili olduğu ve bu sebeple kromozomal hasar miktarının ölçülmesi amacıyla kullanılabileceği 1950 lerden beri bilinmektedir. İlk mikronükleus çalışmaları bitki kökleri üzerinde yapılmıştır [13-15]. Mikronükleus sayımının kemik iliği gibi bölünen hücrelerde in vivo kromozom hasarını değerlendirmek için bir alternatif olabileceği Schmid [16] ve Heddle [17] tarafından bağımsız olarak önerilmiştir. O tarihten bu yana mikronükleus yöntemi, genetik toksikoloji çalışmalarının vazgeçilmez testlerinden biri haline gelmiştir [14, 18]. Mikronükleus yönteminin farklı hücre tiplerine uygulanması yoluyla popülasyondaki genetik hasarın izlenmesi, genotoksik ilaçların araştırılması, radyosyona karşı tümör duyarlılığının tespiti ve radyasyon duyarlılığının değerlendirilmesi mümkün olmaktadır. Protokol farklılıklarına rağmen MN indüksiyonu, hastalıkların ve DNA hasarının indüksiyonu ile ilgili süreçlerde de etkli bir biomarker olarak dikkate alınmaktadır [14]. MN yöntemi, çevresel ajanlardan kaynaklanan genetik hasarın belirlenmesi için biyolojik bir belirteç olarak ya da nanopartikül veya ilaçlar gibi yeni ürünlerin biyolojik uyumluluğunu tanımlamak için de kullanılmaktadır [19]. MN tekniği ile hem klastojen hem de önojen maddeler testpit edilebilir. Ayrıca imminokimyasal etiketleme sayesinde kinetekor, sentromer veya telomer gibi spesifik nükleer elemanların MN doğası ve mekanizması üzerindeki rolü de incelenebilmektedir [3]. Artmış MN sıklığı kümülatif DNA hasarını ve bazı hastalıklar için yüksek riski göstermektedir. Bu sebeple normal bir populasyon için referans frekansı belirlemek, genomik hasarın derecesini ve farklı çevresel genotoksik faktörlere maruz kalan populasyonlar ile normal populasyon arasında kanser ve diğer hastalıklar açısından riski değerlendirmek ve karşılaştırmak için temel oluşturur [8, 19]. Bu amaçla, 1997 yılında, dünya çapında farklı laboratuvarlarda, farklı popülasyonlarda MN sıklığının referans değerini belirlemek amacıyla Michael Fenech ve Stefano Bonassi öndereliğinde HUman MicroNucleus projesi başlatılmıştır. MN sıklığının ölçümünde karışıklığa neden olan etkenleri tanımlamak, populasyon bazlı çalışmalarda standart protokol(ler) olarak kullanılan farklı teknikleri karşılaştırmak, olgu-kontrol çalışmaları olarak kontrollü giden prospektif çalışmalar uygulamak ve MN'nin yaşlanmayı da içeren kanser ve diğer hastalıklar için bir biyolojik belirteç olarak uygunluğunu incelemek projenin hedefleri arasındadır [20]. Mikronükleus yöntemi, nükleer bölünmesini tamamlayan ama sitoplazma bölünmesi aktin polimeraz inhibitörü sitokalasin-b ile engellenmiş hücrelerde çekirdek dışında kalmış genetik materyallerin belirlenmesi esasına dayanmaktadır. Bu yöntem ile kromozom kayıpları ve kromozom kırıkları hatasız şekilde ölçülüp değerlendirilmektedir. Standart protokole göre 44.saatte sitokalasin B eklenir ve 72. saatte kültür sonlandırılır. Oysa geç bölünen hücrelerin sayısını maksimuma çıkarmak için sitokalasin B yi 24. saatte eklemek ve 96. saatte kültürü sonlandırmak da standart protokolle aynı ölçüde kullanışlıdır Periferal lenfositler, toplandıkları zaman hasar belirlenmesi için ideal olan G 0 fazındadırlar. Oysa hücreler S, G 2 ve M fazlarında genotoksik etkenlere karşı daha hassastır, bu sebeple test edilecek maddeleri, hücrelerin çoğu bölünürken uygulamak esastır (Fenech, 2000; Mateuca et al., 2006; OECD, 2016b). 263
4 Klasik sitogenetik tekniklerde kromozomlar, metafazlarda aberasyonlar gözlenerek ve sayılarak doğrudan çalışılır. Bu yaklaşım en ayrıntılı analizi sağlasa da metafazlardaki aberasyonların değerlendirilmesinin zahmetli ve karmaşık oluşu ayrıca preparasyon tekniğinden kaynaklı kayıplar ve artifaktlar, kromozom hasarının değerlendirilmesi için daha basit bir sistem geliştirilmesi gerekliliğini doğurmuştur. Mikronükleus yöntemi, klasik kromozom analiz yöntemi kadar hassas bir DNA hasarı indikatörü olarak değerlendirilmektedir. İlaveten, MN tekniği, kromozom aberasyon tekniği ile karşılaştırıldığında skorlaması daha kolaydır. Buna ek olarak kromozom analiz yöntemi ile karşılaştırıldığında değerlendirme yapmak için sayımının görece basit olması, ileri tecrübe gerektirmemesi ve zaman kullanımı açısından da daha tasarruflu bir yöntem olduğu araştırmacılar tarafından öne sürülmektedir. Ama bu yöntemin asıl avantajı, daha fazla sayıda hücre incelenmesine dayanan istatistiksel değerlendirme sonucunun yüksek güvenilirlikte olmasıdır. Bu avantaj, kromozom analizinde kullanılan kolşisin blokajının 1-4 saat, mikronükleus yönteminde uygulanan sitokinez blokajının ise saat sürmesi ve akabinde etkilenen toplam hücre miktarından kaynaklanmaktadır [12, 21]. Mikronükleus tekniği ilk kullanılmaya başlandığında sadece bölünme sürecini tamamlamış hücrelerde MN oluşumu görülebilmekteydi. Bu sebeple ilk çalışmalarda maruziyetin ardından bölünen hücrelerde MN oluşumlarının değerlendirilebildiği biyolojik bir dozimetre olarak nitelendirilmiştir. Araştırmacıların bir küf mantarının metaboliti olan sitokalasin-b nin kültüre eklenmesi sonucu hücrelerde sitokinezin engellendiğini bulması sayesinde bu durum aşılmış oldu ve böylece bir nükleer bölünmesini tamamlamış hücrelerin binükleat görünümü ile tanınmasına olanak sağlandı. Bu gelişimin ardında teknik artık Sitokinezi Bloklanmış Mikronukleus Tekniği (The cytokinesis-block micronucleus technique-cbmn) olarak literatüre geçti [22]. Günümüzde CBMN tekniği, bölünen ve bölünmeyen hücreler arasında ayırım yapamayan konvansiyonel yöntemlerden daha kesin ve daha duyarlı bir teknik olarak kabul görmektedir. Ayrıca maruziyetin ardında bir bölünme geçiren hücrelerin ayırtedilebilmesi de yöntemsel gelişimde önemli bir basamaktır [20]. 3. MİKRONÜKLEUS YÖNTEMİNDE SİTOM YAKLAŞIMI İnsan hücrelerindeki MN indeksi, genetik toksikoloji araştırmaları için standart sitogenetik testlerden biri haline geldi. Geçen yıllar için CBMN tekniği kromozom kırığı, kromozom kaybı, ayrılamama, nekroz, apoptoz ve sitositazin ölçüldüğü karşılaştırmalı bir metoda dönüştü. Binükleat hücrelerde MN sayılırken nükleoplazmik köprülerin (NPK) de değerlendirilmesiyle kromozom rearanjmanlarının da kaydedilmesi sağlandı. "Sitom (cytome)" konsepti, incelenen sistemdeki her hücrenin canlılık durumu (nekroz, apoptoz), mitotik durum (mononükleotid, metafaz, anafaz, bır nukleuslu, çok çekirdekli) ve kromozomal instabilitesi ya da hasar durumu (MN, NPK ler, NT ler) açısından sitolojik olarak skorlandığını göstermektedir [23]. CBMN tekniğinin CBMN-cytome tekniğine evrilmesi ile MN, NPK ve NT sayesinde kromozomal instabilite veya hasar durumu; hücrelerin çekirdek sayısı ve hücre döngüsü evrelerinin değerlendirilmesi ile mitotik durum ve nekrotik ve apoptatik hücrelerin değerlendirilmesi ile de canlılık durumu hakkında bilgi sağlamaktadır (Şekil 1) [24]. Mikronükleusların oluşum mekanizmalarına baktığımızda; sentromeri olmayan kromozom veya kromatid fragmentlerinden ya da anafazda geç kalıp kutuplara göç edemeyen kromozom veya kromatidler karşımıza çıkmaktadır. Arta kalan bu genetik materyallerin çevresi telofazda hücre zarı ile kuşatılır ve kardeş hücre çekirdeklerine dahil olmadan sitoplazmada yeralan çekirdek dışı küçük cisimcikler olarak kalır. Mikronükleus adı da bu durumdan köken almaktadır. Mikronükleusları oluşturan kromozom fragmentleri; doğrudan çift zincir kırıkları, replikasyonun ardından çift zincir kırığına dönüşen tek zincir kırıkları veya DNA sentezinin inhibisyonu sonucu oluşmaktadır. Oluşan kırık tekrar birleşmez ise, bir delesyonlu kromozom ve bir asentrik fragment meydana gelir. Kromozom kırılması sonucu oluşan 264
5 asentrik parçalar ya metafazda kaybolur ya da anafazda mikronükleusları oluştururlar. Sentromerik ve perisentromerik tekrar bölgelerindeki sitozin rezidülerinin hipometilasyonu da mikronükleus oluşumunu etkileyen bir diğer faktördür. Metilasyon profili değişen tekrar bölgeleri, kinetekor proteinlerinin iğ iplikçikleri ile doğru bağlantı kurma yeteneğinin kaybolmasına ve dolayısıyla kromozom kayıplarına yol açmaktadır. Diğer yandan, mitoz kontrol noktalarındaki hatalar, anormal sentrozom amplifikasyonları ve mitotik iğ iplikçiklerinin toplanmasındaki kusurlar da kromozom kayıplarını arttırarak mikronükleus oluşumuna katkı sağlamaktadırlar. Mikronükleus oluşumunun satellit DNA bölgelerinin hipometilasyonunun sonucu olarak artabileceği de düşünülmektedir. Ayrıca hücre döngüsü kontrol noktalarında veya DNA tamirinde görevli housekeeping genlerin promotor bölgelerindeki ya da yakınlarındaki CpG adacıklarının hipermetilasyonu da genom hasarını arttırabimektedir [12, 14, 18, 25]. Spontan mikronükleus oluşumuna katkı sağlayabilecek mutasyonlar ise; kinetekor proteinleri, sentromerler ve iğ iplikçiklerinde meydana gelen ve eşit olmayan kromozom dağılımına veya anafazda kromozom kaybına sebebiyet veren mutasyonlar ile endojen veya ekzojen mutajenlerden kaynaklanan DNA zincir kırıklarının tamir edilmemesinin sebebiyet verdiği asentrik kromozom fragmentleri olarak sıralanabilir [7]. Şekil 1: CBMN-cyt analizi için değerlendirilen parametreler (a) Mononükleated hücre (b) Binükleat hücre; (c) Multinükleat hücre; (d) Erken nekrotik hücre; (e) Geç apoptotik hücre; (f) Mikronükleus taşıyan binükleat hücre; (g) Nükleoplazmik köprü ve mikronükleus taşıyan binükleat hücre (h) Nükleer tomurcuklar bulunduran binükleat hücre [23]. Mikronükleuslar, morfolojik olarak ana çekirdeğe benzemekle birlikte daha küçüktürler. Fenech [7]; mikronükleusların değerlendirme kriterlerini (i) Çapları, ana çekirdeğin 1/16 ile 1/3 olmalı; (ii) Işık 265
6 kırılmasına sebep olmamalı; (iii) Nükleoplasmik bir köprü ile ana çekirdeğe bağlı olmamalı şeklinde bildirmiştir. Binükleat hücrelerin çekirdekleri arasındaki köprüler; Nükleoplazmik köprüler de kromozom rearanjmanının ölçütü olarak CBMN-cyt tekniğinde MN ların yanısıra sayılmalıdır. Disentrik kromozomların sentromerlerinin anafazda hücrenin karşı kutuplarına çekilmesiyle NPK lerin meydana geldiği kabul edilmektedir. NPK lerin oluşumlarında rol alan temel mekanizmalar; disentrik veya multisentrik kromozomların sentromerlerinin anafazda farklı kutuplara çekilmesi; DNA kırıklarının yanlış onarımı; fazla kısa olan telomerlere, işlevsiz telomerlere ya da telomer olmamasına bağlı olarak telomer uç birleşmeleri; anafazda kardeş kromatidlerin hatalı ayrılması olarak sayılabilir [18, 23]. Nükleer tomurcukların oluşum süreci, gen amplifikasyonunu indükleyen kuvvetli seçici koşullar altında yetiştirilen kültürlerde gözlenmiştir. Gen amplifikasyonunun, metotreksat gibi ilaçlara karşı hücresel dirençte ve tümör progresyonunda önemli bir olay olduğu düşünülmektedir. Çekirdekten nükleer materyalin aktif eleminasyon süreci; kırık-birleşme-köprü döngüsü ile oluşan amplifiye DNA nın eleminasyonu; DNA tamirinde DNA-protein komplekslerinin eleminasyonu; kazla kromozomların eliminasyonu (polipoid hücrelerde anöploididen kurtulmayı kolaylaştırmak için); kırılmış NPK lerin kalıntılarının iki çekirdek arasında çekilmesi bir veya her iki çekirdekte de geçici bir NT ile sonuçlanabilir [18]. İlk çekirdek bölünmesini takiben kültüre eklenen sitokalasin-b, bölünen hücrelerin iki çekirdekli (binükleat) aşamada tutulmasını sağlamaktadır. Mikronükleus sayımında bu iki çekirdekli hücreler değerlendirilmektedir. Nükleer bölünme indeksi (NBİ) de birinci, ikinci, üçüncü ve dördüncü çekirdek bölünmelerini geçiren hücrelerin sayımıyla gerçekleşmektedir. Nükleer bölünme indeksi, hücre bölünmesinin inhibisyonu, yani sitotoksisite hakkında bilgi vermektedir [12, 14]. CBMN-cyt tekniğinde her slaytın analizinde en az 1000 binükleat hücre değerlendirilmeli ve MN lar, NPK ler ve NT lar sayılmalıdır. Sağlıklı bireylere ait lenfositlerde 1000 binükleat hücre değerlendrildiğinde MN oranı 0-3 arasında olmalıdır. Bu oran genotoksin maruziyetine ve yaşa bağlı olarak artabilmektedir. Nükleer bölünme indeksini (NBİ) hesaplamak üzere 500 hücre değerlendirip mononükleat, binükleat, trinükleat ve tetranükleat hücreler sayılmalıdır. NBİ ve binükleat hücrelerin oranı, lenfositlerin mitojenik cevabının ve kullanılan ajanın sitostatik etkilerinin karşılaştırılması için faydalı parametrelerdir. Nükleer bölünmenin daha doğru şekilde değerlendirmesi için skorlanan hücrelerin toplam sayısına nekrotik ve apoptotik hücreler eklenmesiyle sağanabilir. Çünkü test edilen kimyasalların toksik olan daha yüksek dozlarında, hücrelerin büyük bir bölümünün canlı olmaması beklenmektedir. Nekrotik ve apoptotoik hücrelerin dahil edilmediği değerlendirmelerde binükleat oranının ve NBİ nin var olandan daha yüksek belirlendiği unutulmamalıdır. Nükleer bölünme sitotoksisite indeksi (NBSİ) hesaplaması yapabilmek için 500 hücre değerlendirilerek mononükleat, binükleat, trinükleat ve tetranükleat hücrelerin yanı sıra apoptotik veya nekrotik hücreler de sayılmalıdır. Ama tam kan kültürü MN tekniğinde kullanılan hipotonik uygulaması nekrotik ve apoptotik hücrelerin morfolojilerini bozarak yok edebilmektedir. Bu sebeple nekrotik ve apoptotik hücrelerin de değerlendirilebilmesi için hipotonik uygulaması gerektirmeyen hücre hattı kültürleri veya izole edilmiş lenfositlerden kurulan kültürlerle çalışmak gerekmektedir. NBİ ve NBSİ parametrelerinin hesaplanması için kullanılan formüller [14, 26]; 266
7 NBİ = (M1 + 2(M2) + 3(M3) + 4(M4))/N NBSİ = (Ap + Nec + M1 + 2(M2) +3(M3) + 4(M4))/N (Ap: Apoptotik hücre sayısı; Nec: Nekrotik hücre sayısı; M1: Mononükleat hücre sayısı; M2: Binükleat hücre sayısı; M3: Trinükleat hücre sayısı; M4: tetranükleat hücre sayısı; N: Toplam değerlendirilen hücre sayısı) 4. SONUÇ CBMN-cyt tekniği sayesinde araştırmacılar; kromozomal instabilite fenotipi, kırık-füzyon-köprü döngüsü, DNA yanlış onarımı, kromozom kırığı ve asimetrik rearanjmanı, telemor uç birleşmesi, hücre döngüsü kontrol noktası işlev bozuklukları, kromozomların yanlış ayrılması (pansentromerik ve ya kromozom spesifik problarla kullanıldığında), gen amplifikasyonu ve fazla DNA nın nükleer eleminasyonu, DNA hipometilasyonu, değişmiş mitotik aktivite ve/veya sitostatiz, nekroz veya apoptoz yoluyla hücre ölümü gibi hücresel ve nükleer disfonksiyon çalışmaları yapabilmektedir. CBMN yönteminin, in vitro veya in vivo yaşlanma, mikro besin eksikliği veya fazlalığı, genotoksin maruziyeti ve genom muhafazasında genetik kusurların neden olduğu hücresel ve nükleer disfonksiyonun çalışması için etkili bir araç olduğu kanıtlanmıştır. Ayrıca bu yöntemin nutrigenomik ve toksikogenomik alanlarında da verimli sonuçlar ortaya koyduğu son çalışmalar tarafından gösterilmiştir [23]. Sonuç olarak, CBMN yöntemi, kromozom instabilitesi, hücre ölümü ve sitositazın çeşitli yönlerinin doğrudan ve/veya dolaylı olarak ölçülmesini sağlayan etkili bir "sitome" yöntemi haline gelmiştir. TEŞEKKÜR Bu çalışma Kasım.2017 tarihinde düzenlenen III. Uluslararası Multidisipliner Çalışmaları Sempozyumu (ISMS) nda sözlü bildiri olarak sunulmuş olup özet kısmı ilgili sempozyumun özet kitabında yer almaktadır. KAYNAKLAR [1] Riss TL, Moravec RA, Niles AL. Cytotoxicity testing: measuring viable cells, dead cells, and detecting mechanism of cell death. Methods Mol Biol. 2011; 740: [2] Atlı Şekeroğlu Z, Şekeroğlu V. Genetik toksisite testleri. TÜBAV Bilim Dergisi, 2011;4(3): [3] Eastmond DA, Hartwig A, Anderson D, Anwar WA, Cimino MC, Dobrev I, et al. Mutagenicity testing for chemical risk assessment: update of the WHO/IPCS Harmonized Scheme. Mutagenesis, 2009; 24(4): [4] Tokur O, Aksoy A. In Vitro Sitotoksisite Testleri, 2017; p. [5] Jena GB, Kaul CL, Ramarao P. Genotoxicity Testing, A Regulatory Requirement For Drug Discovery And Development: Impact Of Ich Guidelines. Indian Journal of Pharmacology, 2002; 34:
8 [6] Mark H, Naram R, Pham T, Shah K, Cousens LP, Wiersch C, et al. A practical cytogenetic protocol for in vitro cytotoxicity and genotoxicity testing. Annals of Clinical & Laboratory Science, 1994; 24(5): [7] Fenech M. The cytokinesis-block micronucleus technique: A detailed description of the method and its application to genotoxicity studies in human populations. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, 1993; 285(1): [8] Cho NY, Kim KW, Kim KK. Genomic health status assessed by a cytokinesis-block micronucleus cytome assay in a healthy middle-aged Korean population. Mutat Res. 2017; 814:7-13. [9] Knasmüller S, Nersesyan A, Mišík M, Gerner C, Mikulits W, Ehrlich V, et al. Use of conventional and -omics based methods for health claims of dietary antioxidants: a critical overview. British Journal of Nutrition, 2008; 99(E-S1):ES3-ES52. [10] Kocaman AY, Rencüzoğulları E, Topaktaş M. In vitro investigation of the genotoxic and cytotoxic effects of thiacloprid in cultured human peripheral blood lymphocytes. Environmental toxicology, 2014; 29(6): [11] Tucker JD, Preston RJ. Chromosome aberrations, micronuclei, aneuploidy, sister chromatid exchanges, and cancer risk assessment. Mutation Research/Reviews in Genetic Toxicology, 1996; 365(1-3): [12] Mateuca R, Lombaert N, Aka PV, Decordier I, Kirsch-Volders M. Chromosomal changes: induction, detection methods and applicability in human biomonitoring. Biochimie, 2006; 88(11): [13] Evans HJ, Neary GJ, Williamson FS. The Relative Biological Efficiency of Single Doses of Fast Neutrons and Gamma-rays on Vicia Faba Roots and the Effect of Oxygen. International Journal of Radiation Biology and Related Studies in Physics, Chemistry and Medicine, 1959; 1(3): [14] Fenech M. The in vitro micronucleus technique. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis. 2000; 455(1 2): [15] Thoday J. The Effect of Ionizing Radiations on the Broad Bean Root Part IX. The British journal of radiology, 1951; 24(286): [16] Schmid W. The micronucleus test. Mutation Research/Environmental Mutagenesis and Related Subjects, 1975; 31(1):9-15. [17] Heddle JA. A rapid in vivo test for chromosomal damage. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, 1973; 18(2):
9 [18] Fenech M, Kirsch-Volders M, Natarajan AT, Surralles J, Crott JW, Parry J, et al. Molecular mechanisms of micronucleus, nucleoplasmic bridge and nuclear bud formation in mammalian and human cells. Mutagenesis, 2011; 26(1): [19] Coskun M, Cayir A, Coskun M, Tok H. Evaluation of background DNA damage in a Turkish population measured by means of the cytokinesis-block micronucleus cytome assay. Mutat Res. 2013; 757(1):23-7. [20] Fenech M, Holland N, Chang WP, Zeiger E, Bonassi S. The HUman MicroNucleus Project An international collaborative study on the use of the micronucleus technique for measuring DNA damage in humans. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis. 1999; 428(1 2): [21] Duan H, Leng S, Pan Z, Dai Y, Niu Y, Huang C, et al. Biomarkers measured by cytokinesisblock micronucleus cytome assay for evaluating genetic damages induced by polycyclic aromatic hydrocarbons. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 2009; 677(1-2):93-9. [22] Fenech M, Morley AA. Measurement of micronuclei in lymphocytes. Mutation Research/Environmental Mutagenesis and Related Subjects. 1985; 147(1): [23] Fenech M. Cytokinesis-block micronucleus assay evolves into a "cytome" assay of chromosomal instability, mitotic dysfunction and cell death. Mutat Res. 2006; 600(1-2): [24] Donmez-Altuntas H, Bitgen N. Evaluation of the genotoxicity and cytotoxicity in the general population in Turkey by use of the cytokinesis-block micronucleus cytome assay. Mutat Res. 2012;748(1-2):1-7. [25] Üstüner D. Kromozom kırıkları ve mikronükleus-apoptoz. TÜBAV Bilim Dergisi, 2011; 4(1). [26] OECD. Test No. 487: In Vitro Mammalian Cell Micronucleus Test. Paris: OECD Publishing;
GENOTOKSİK MADDELERİN BİTKİLER ÜZERİNE ETKİLERİ
 Lise Öğretmenleri Fizik, Kimya, Biyoloji, Matematik Proje Danışmanlığı Eğitimi Çalıştayı LİSE-2 (Çalıştay 2012) GENOTOKSİK MADDELERİN BİTKİLER ÜZERİNE ETKİLERİ Doç. Dr. Cüneyt AKI ÇOMÜ FEN EDEBİYAT FAKÜLTESİ
Lise Öğretmenleri Fizik, Kimya, Biyoloji, Matematik Proje Danışmanlığı Eğitimi Çalıştayı LİSE-2 (Çalıştay 2012) GENOTOKSİK MADDELERİN BİTKİLER ÜZERİNE ETKİLERİ Doç. Dr. Cüneyt AKI ÇOMÜ FEN EDEBİYAT FAKÜLTESİ
GENETİK LABORATUVARI
 GENETİK LABORATUVARI Laboratuvar sorumluları: Prof. Dr. Mehmet TOPAKTAŞ Prof. Dr. Hasan Basri İLA Temel Araştırma Alanımız: Genetik, Sitogenetik, Genotoksikoloji Genetik laboratuvarında günlük hayatta
GENETİK LABORATUVARI Laboratuvar sorumluları: Prof. Dr. Mehmet TOPAKTAŞ Prof. Dr. Hasan Basri İLA Temel Araştırma Alanımız: Genetik, Sitogenetik, Genotoksikoloji Genetik laboratuvarında günlük hayatta
HÜCRE BÖLÜNMESİ. 1- Amitoz Bölünme 2- Mitoz Bölünme 3- Mayoz bölünme. -G1 -Profaz -S -Metafaz -G2 -Anafaz -Telofaz
 HÜCRE BÖLÜNMESİ 1- Amitoz Bölünme 2- Mitoz Bölünme 3- Mayoz bölünme A:İNTERFAZ B: MİTOZ -G1 -Profaz -S -Metafaz -G2 -Anafaz -Telofaz TERİMLER Sentromer Metafaz aşamasında kromozomlar üzerindeki boğumlanma
HÜCRE BÖLÜNMESİ 1- Amitoz Bölünme 2- Mitoz Bölünme 3- Mayoz bölünme A:İNTERFAZ B: MİTOZ -G1 -Profaz -S -Metafaz -G2 -Anafaz -Telofaz TERİMLER Sentromer Metafaz aşamasında kromozomlar üzerindeki boğumlanma
İyonize Radyasyonun Hücresel Düzeydeki Etkileri ve Moleküler Yaklaşımlar
 İyonize Radyasyonun Hücresel Düzeydeki Etkileri ve Moleküler Yaklaşımlar Aysun Manisalıgil, Ayşegül Yurt Dokuz Eylül Üniversitesi Sağlık Bilimleri Enstitüsü Medikal Fizik Anabilim Dalı Hücre ve Moleküller
İyonize Radyasyonun Hücresel Düzeydeki Etkileri ve Moleküler Yaklaşımlar Aysun Manisalıgil, Ayşegül Yurt Dokuz Eylül Üniversitesi Sağlık Bilimleri Enstitüsü Medikal Fizik Anabilim Dalı Hücre ve Moleküller
ÖZGEÇMİŞ (Tüm gelişmeleri bugünden başlayarak geriye doğru sıralayınız)
 1. GENEL ÖZGEÇMİŞ (Tüm gelişmeleri bugünden başlayarak geriye doğru sıralayınız) DÜZENLEME TARİHİ 13/04/2014 SOYADI, ADI ÖNER, Deniz DOĞUM TARİHİ 05/10/1962 YAZIŞMA ADRESİ: Feyzullah Mah. Nuray Sok. No:4
1. GENEL ÖZGEÇMİŞ (Tüm gelişmeleri bugünden başlayarak geriye doğru sıralayınız) DÜZENLEME TARİHİ 13/04/2014 SOYADI, ADI ÖNER, Deniz DOĞUM TARİHİ 05/10/1962 YAZIŞMA ADRESİ: Feyzullah Mah. Nuray Sok. No:4
ÇOK HÜCRELİ ORGANİZMALARIN GELİŞİMİ
 ÇOK HÜCRELİ ORGANİZMALARIN GELİŞİMİ Seçici gen ifadesi embriyonun gelişmesini sağlayan 4 temel işlevi denetler: 1. Hücre çoğalması 2. Hücre farklılaşması 3. Hücre etkileşimleri 4. Hücre hareketi HÜCRE
ÇOK HÜCRELİ ORGANİZMALARIN GELİŞİMİ Seçici gen ifadesi embriyonun gelişmesini sağlayan 4 temel işlevi denetler: 1. Hücre çoğalması 2. Hücre farklılaşması 3. Hücre etkileşimleri 4. Hücre hareketi HÜCRE
Artan bilgi ile birlikte hasta ve ailelerin bilinçlendirilmesi
 Bugün gelinen noktada genetik Artan bilgi ile birlikte hasta ve ailelerin bilinçlendirilmesi «Genetik bilgiden hastaların ve ailelerin yararlanması için tüm sağlık çalışanları insan genetiğinin temelinde
Bugün gelinen noktada genetik Artan bilgi ile birlikte hasta ve ailelerin bilinçlendirilmesi «Genetik bilgiden hastaların ve ailelerin yararlanması için tüm sağlık çalışanları insan genetiğinin temelinde
HÜCRENİN YAŞAM DÖNGÜSÜ
 HÜCRENİN YAŞAM DÖNGÜSÜ *Hücrenin yaşam döngüsü: Hücrenin; bir bölünme sonundan, ikinci bir bölünme sonuna kadar olan zaman sürecinde; geçirdiği yaşamsal olaylara hücrenin yaşam döngüsü denir. Hücreler,
HÜCRENİN YAŞAM DÖNGÜSÜ *Hücrenin yaşam döngüsü: Hücrenin; bir bölünme sonundan, ikinci bir bölünme sonuna kadar olan zaman sürecinde; geçirdiği yaşamsal olaylara hücrenin yaşam döngüsü denir. Hücreler,
Mitoz. - Mitozda 2 yavru hücre oluşur ve bunların genetik yapısı birbirinin ve ana hücrenin aynıdır.
 Mitoz - Mitozda 2 yavru hücre oluşur ve bunların genetik yapısı birbirinin ve ana hücrenin aynıdır. - 2n --- 4n (anafaz) ------2n - İdentik kardeş kromatidler ayrılarak yavru hücrelere giderler. - Somatik
Mitoz - Mitozda 2 yavru hücre oluşur ve bunların genetik yapısı birbirinin ve ana hücrenin aynıdır. - 2n --- 4n (anafaz) ------2n - İdentik kardeş kromatidler ayrılarak yavru hücrelere giderler. - Somatik
Arş.Gör. ÖZLEM SULTAN ASLANTÜRK
 Arş.Gör. ÖZLEM SULTAN ASLANTÜRK Fen-edebiyat Fakültesi Biyoloji Bölümü Genel Biyoloji Anabilim Dalı Eğitim Bilgileri 1995-2000 Lisans Hacettepe Üniversitesi Eğitim Fakültesi Matematik Ve Fen Bilimleri
Arş.Gör. ÖZLEM SULTAN ASLANTÜRK Fen-edebiyat Fakültesi Biyoloji Bölümü Genel Biyoloji Anabilim Dalı Eğitim Bilgileri 1995-2000 Lisans Hacettepe Üniversitesi Eğitim Fakültesi Matematik Ve Fen Bilimleri
2n n. Kromozom sayısı. Zaman
 Mitoz Döllenme Mitoz MAYOZ BÖLÜNME 10. SINIF ÜNİTE, KONU, KAZANIM VE AÇIKLAMALARI 10.1.2. ve Eşeyli Üreme 10.1.2.1. u açıklar. a. un evreleri temel düzeyde işlenir. Evreler açıklanırken mikroskop, görsel
Mitoz Döllenme Mitoz MAYOZ BÖLÜNME 10. SINIF ÜNİTE, KONU, KAZANIM VE AÇIKLAMALARI 10.1.2. ve Eşeyli Üreme 10.1.2.1. u açıklar. a. un evreleri temel düzeyde işlenir. Evreler açıklanırken mikroskop, görsel
Şekil 1. Mitoz bölünmenin profaz evresi.
 KONU 9. HÜCRE BÖLÜNMESİ MİTOZ BÖLÜNME Mitoz bölünme tek hücreli canlılardan, çok hücreli canlılara ve insana kadar birçok canlı grubu tarafından gerçekleştirilebilir. Mitoz bölünme sonunda bölünen hücrelerden
KONU 9. HÜCRE BÖLÜNMESİ MİTOZ BÖLÜNME Mitoz bölünme tek hücreli canlılardan, çok hücreli canlılara ve insana kadar birçok canlı grubu tarafından gerçekleştirilebilir. Mitoz bölünme sonunda bölünen hücrelerden
GENETİK TOKSİSİTE TESTLERİ GENETIC TOXICITY TESTS
 Yıl: 2011, Cilt:4, Sayı:3, Sayfa:221-229 TÜBAV BİLİM DERGİSİ GENETİK TOKSİSİTE TESTLERİ Zülal Atlı Şekeroğlu*, Vedat Şekeroğlu Ordu Üniversitesi, Fen-Edebiyat Fakültesi, Biyoloji Bölümü, Ordu Üniversitesi,
Yıl: 2011, Cilt:4, Sayı:3, Sayfa:221-229 TÜBAV BİLİM DERGİSİ GENETİK TOKSİSİTE TESTLERİ Zülal Atlı Şekeroğlu*, Vedat Şekeroğlu Ordu Üniversitesi, Fen-Edebiyat Fakültesi, Biyoloji Bölümü, Ordu Üniversitesi,
24- HÜCRESEL RADYASYON CEVABININ GENETİK KONTROLÜ
 24- HÜCRESEL RADYASYON CEVABININ GENETİK KONTROLÜ Radyasyona aşırı duyarlı bazı hücreler kullanılarak hücresel radyasyon cevabının genetik kontrolü ile ilgili önemli bilgiler sağlanmıştır.bu hücreler genellikle
24- HÜCRESEL RADYASYON CEVABININ GENETİK KONTROLÜ Radyasyona aşırı duyarlı bazı hücreler kullanılarak hücresel radyasyon cevabının genetik kontrolü ile ilgili önemli bilgiler sağlanmıştır.bu hücreler genellikle
İstanbul Tıp Fakültesi Tıbbi Biyoloji ABD Prof.Dr. Filiz AYDIN
 İstanbul Tıp Fakültesi Tıbbi Biyoloji ABD Prof.Dr. Filiz AYDIN Fertilizasyonda 46 kromozom Her bir kromozom çift kromadit-(92) Hücre bölündükten sonra her hücre de 46 kromozom bulunur Mitoz bölünme G1
İstanbul Tıp Fakültesi Tıbbi Biyoloji ABD Prof.Dr. Filiz AYDIN Fertilizasyonda 46 kromozom Her bir kromozom çift kromadit-(92) Hücre bölündükten sonra her hücre de 46 kromozom bulunur Mitoz bölünme G1
YAZILIYA HAZIRLIK SORULARI. 10. Sınıf 1 MİTOZ BÖLÜNME EŞEYSİZ ÜREME
 YAZILIYA HAZIRLIK SORULARI 10. Sınıf 1 MİTOZ BÖLÜNME EŞEYSİZ ÜREME Hücre döngüsü uzun bir interfaz ve kısa bir bölünme evresinden oluşur. Hücre bölünmesi tüm canlılarda büyüme, gelişme ve onarım sağlar.
YAZILIYA HAZIRLIK SORULARI 10. Sınıf 1 MİTOZ BÖLÜNME EŞEYSİZ ÜREME Hücre döngüsü uzun bir interfaz ve kısa bir bölünme evresinden oluşur. Hücre bölünmesi tüm canlılarda büyüme, gelişme ve onarım sağlar.
ayxmaz/biyoloji 2. DNA aşağıdaki sonuçlardan hangisi ile üretilir Kalıp DNA yukarıdaki ana DNAdan yeni DNA molekülleri hangi sonulca üretilir A B C D
 1. DNA replikasyonu.. için gereklidir A) sadece mitoz B) sadece mayoz C) mitoz ve mayoz D) sadece gamet oluşumu E) sadece protein sentezi 2. DNA aşağıdaki sonuçlardan hangisi ile üretilir Kalıp DNA yukarıdaki
1. DNA replikasyonu.. için gereklidir A) sadece mitoz B) sadece mayoz C) mitoz ve mayoz D) sadece gamet oluşumu E) sadece protein sentezi 2. DNA aşağıdaki sonuçlardan hangisi ile üretilir Kalıp DNA yukarıdaki
Canlılarda mitoz, amitoz ve mayoz olmak üzere üç çeşit bölünme görülür.
 HÜCRE BÖLÜNMELERİ Canlılarda mitoz, amitoz ve mayoz olmak üzere üç çeşit bölünme görülür. I. MİTOZ BÖLÜNME Mitoz bölünme tek hücreli canlılardan, çok hücreli canlılara ve insana kadar bir çok canlı grubu
HÜCRE BÖLÜNMELERİ Canlılarda mitoz, amitoz ve mayoz olmak üzere üç çeşit bölünme görülür. I. MİTOZ BÖLÜNME Mitoz bölünme tek hücreli canlılardan, çok hücreli canlılara ve insana kadar bir çok canlı grubu
Mitoz bölünme, hücredeki kalıtım maddesinin yavru hücrelere eşit miktarda bölünmesini sağlayan karmaşık bir olaydır.
 Mitoz bölünme, hücredeki kalıtım maddesinin yavru hücrelere eşit miktarda bölünmesini sağlayan karmaşık bir olaydır. Hücre mitozla bölünmeden önce DNA eşlemesi olur. Hücre mitozla bölünmeye başlamadan
Mitoz bölünme, hücredeki kalıtım maddesinin yavru hücrelere eşit miktarda bölünmesini sağlayan karmaşık bir olaydır. Hücre mitozla bölünmeden önce DNA eşlemesi olur. Hücre mitozla bölünmeye başlamadan
10. SINIF KONU ANLATIMI 6 MAYOZ BÖLÜNME-3
 10. SINIF KONU ANLATIMI 6 MAYOZ BÖLÜNME-3 Mayoz Bölünmenin Genel Özellikleri Üreme ana hücrelerinde görülür. Üreme hücrelerinin oluşmasını sağlar. Sadece 2n kromozomlu hücrelerde görülür. 4 yeni hücre
10. SINIF KONU ANLATIMI 6 MAYOZ BÖLÜNME-3 Mayoz Bölünmenin Genel Özellikleri Üreme ana hücrelerinde görülür. Üreme hücrelerinin oluşmasını sağlar. Sadece 2n kromozomlu hücrelerde görülür. 4 yeni hücre
S evresi: Organellerin iki katına çıkarılması devam ederken DNA sentezi olur.
 HÜCRE DÖNGÜSÜ İnterfaz: Bölünmeyen bir hücre interfaz durumundadır. Bu safhada replikasyon ve bölünme için hazırlık yapılır. Çekirdek belirgindir, bir yada daha fazla çekirdekçik ayırt edilebilir. Kromozomlar
HÜCRE DÖNGÜSÜ İnterfaz: Bölünmeyen bir hücre interfaz durumundadır. Bu safhada replikasyon ve bölünme için hazırlık yapılır. Çekirdek belirgindir, bir yada daha fazla çekirdekçik ayırt edilebilir. Kromozomlar
KANSER EPİDEMİYOLOJİSİ VE KARSİNOGENEZ
 KANSER EPİDEMİYOLOJİSİ VE KARSİNOGENEZ Gökhan Erdem GATA Tıbbi Onkoloji BD 19 Mart 2014 5. Türk Tıbbi Onkoloji Kongresi, 19-23 Mart 2014, Antalya EPİDEMİYOLOJİ Epidemiyoloji, sağlık olaylarının görünme
KANSER EPİDEMİYOLOJİSİ VE KARSİNOGENEZ Gökhan Erdem GATA Tıbbi Onkoloji BD 19 Mart 2014 5. Türk Tıbbi Onkoloji Kongresi, 19-23 Mart 2014, Antalya EPİDEMİYOLOJİ Epidemiyoloji, sağlık olaylarının görünme
HÜCRE SİKLUSU. Hücrenin bir bölünme sonundan diğer ikinci bölünme sonuna kadar geçen devrine hücre siklusu adı verilir.
 HÜCRE SİKLUSU Hücrenin bir bölünme sonundan diğer ikinci bölünme sonuna kadar geçen devrine hücre siklusu adı verilir. Mitoz (M), G 1 (= 1. Aralık), Sentez (S) ve G 2 olmak üzere birbirini izleyen dört
HÜCRE SİKLUSU Hücrenin bir bölünme sonundan diğer ikinci bölünme sonuna kadar geçen devrine hücre siklusu adı verilir. Mitoz (M), G 1 (= 1. Aralık), Sentez (S) ve G 2 olmak üzere birbirini izleyen dört
KROMOZOMLAR ve KALITIM
 KROMOZOMLAR ve KALITIM 2 https://en.wikipedia.org/wiki/chimpanzee_genome_project GENETİK KOD RNA da üçlü gruplar halinde bulunan ve protein sentezleme sırasında üretilen aminoasit dizilerinin düzenini
KROMOZOMLAR ve KALITIM 2 https://en.wikipedia.org/wiki/chimpanzee_genome_project GENETİK KOD RNA da üçlü gruplar halinde bulunan ve protein sentezleme sırasında üretilen aminoasit dizilerinin düzenini
CANLILARDA ÜREME. Üreme canlıların ortak özelliğidir. Her canlının kendine benzer canlı meydana getirebilmesi üreme ile gerçekleşir
 CANLILARDA ÜREME EYLÜL 3.HAFTA MİTOZ VE EŞEYSİZ ÜREME Her canlının kendine benzer canlı meydana getirebilmesi üreme ile gerçekleşir Üreme canlıların ortak özelliğidir 3 4 Canlılar hücrelerden meydana gelir
CANLILARDA ÜREME EYLÜL 3.HAFTA MİTOZ VE EŞEYSİZ ÜREME Her canlının kendine benzer canlı meydana getirebilmesi üreme ile gerçekleşir Üreme canlıların ortak özelliğidir 3 4 Canlılar hücrelerden meydana gelir
Doç. Dr. Fatih ÇALIŞKAN Sakarya Üniversitesi, Teknoloji Fak. Metalurji ve Malzeme Mühendisliği EABD
 BİYOUYUMLULUK (BIO-COMPATIBILITY) 10993-1 Bir materyalin biyo-uyumluluğunun test edilmesi için gerekli testlerin tümünü içerir. (Toksisite, Hemoliz, sitotoksisite, sistemik toksisite,...vs.) Hammaddelerin
BİYOUYUMLULUK (BIO-COMPATIBILITY) 10993-1 Bir materyalin biyo-uyumluluğunun test edilmesi için gerekli testlerin tümünü içerir. (Toksisite, Hemoliz, sitotoksisite, sistemik toksisite,...vs.) Hammaddelerin
b. Amaç: Gen anatomisi ile ilgili genel bilgi öğretilmesi amaçlanmıştır.
 TIBBİ GENETİK I-DERS TANIMLARI 1-Tanım: DNA ve RNA yapısının öğretilmesi. b. Amaç: DNA nın genetik materyal olmasında moleküler yapısının önemi ve RNA yapısının proteine geçiş ve gen ekspresyonu kontrolündeki
TIBBİ GENETİK I-DERS TANIMLARI 1-Tanım: DNA ve RNA yapısının öğretilmesi. b. Amaç: DNA nın genetik materyal olmasında moleküler yapısının önemi ve RNA yapısının proteine geçiş ve gen ekspresyonu kontrolündeki
Hücre Proliferasyonu ve Testleri
 1 Hücre Proliferasyonu ve Testleri Normal Hücre Çoğalması Normal dokularda, hücre bölünmesi ve çoğalması organizmanın devamlılığı için bir gereklilik;r. Hücre çoğalmasının olması gerekenden farklı olması
1 Hücre Proliferasyonu ve Testleri Normal Hücre Çoğalması Normal dokularda, hücre bölünmesi ve çoğalması organizmanın devamlılığı için bir gereklilik;r. Hücre çoğalmasının olması gerekenden farklı olması
Teori (saat/hafta) Laboratuar (saat/hafta) BES114 2. BAHAR 3 0 0 2
 TIBBİ BİYOLOJİ VE GENETİK Dersin Adı Kodu Yarıyıl TIBBİ BİYOLOJİ VE GENETİK Önkoşullar Dersin dili Dersin Türü Dersin öğrenme ve öğretme teknikleri Dersin sorumlusu(ları) Dersin amacı Dersin öğrenme çıktıları
TIBBİ BİYOLOJİ VE GENETİK Dersin Adı Kodu Yarıyıl TIBBİ BİYOLOJİ VE GENETİK Önkoşullar Dersin dili Dersin Türü Dersin öğrenme ve öğretme teknikleri Dersin sorumlusu(ları) Dersin amacı Dersin öğrenme çıktıları
RİSK DEĞERLENDİRMESİ
 RİSK DEĞERLENDİRMESİ *Kimyasallar ile biyolojik sistemler arasındaki etkileşimleri zararlı, sonuçları yönünden inceleyen bilim dalıdır. *Kimyasalların zararsızlık limitlerini belirleyen bilim dalıdır.
RİSK DEĞERLENDİRMESİ *Kimyasallar ile biyolojik sistemler arasındaki etkileşimleri zararlı, sonuçları yönünden inceleyen bilim dalıdır. *Kimyasalların zararsızlık limitlerini belirleyen bilim dalıdır.
MAYOZ VE EŞEYLİ YAŞAM DÖNGÜLERİ
 MAYOZ VE EŞEYLİ YAŞAM DÖNGÜLERİ Kalıtıma giriş Ebeveynler yavrularına gen adı verilen kodlanmış bilgileri verirler. Genler DNA parçalarıdır. Çoğu gen, hücreyi özgün enzimler ve diğer proteinleri sentezlemesi
MAYOZ VE EŞEYLİ YAŞAM DÖNGÜLERİ Kalıtıma giriş Ebeveynler yavrularına gen adı verilen kodlanmış bilgileri verirler. Genler DNA parçalarıdır. Çoğu gen, hücreyi özgün enzimler ve diğer proteinleri sentezlemesi
FEN EDEBİYAT FAKÜLTESİ MOLEKÜLER BİYOLOJİ VE GENETİK BÖLÜMÜ
 EĞİTİM-ÖĞRETİM PLANI I. YIL I II MBG 101 Z Genel Biyoloji I General Biology I (4-0) 4 5 MBG 103 Z Genel Biyoloji Laboratuvarı I General Biology Laboratory I (0-4) 2 4 KIM 105 Z Genel Kimya I General Chemistry
EĞİTİM-ÖĞRETİM PLANI I. YIL I II MBG 101 Z Genel Biyoloji I General Biology I (4-0) 4 5 MBG 103 Z Genel Biyoloji Laboratuvarı I General Biology Laboratory I (0-4) 2 4 KIM 105 Z Genel Kimya I General Chemistry
ÖZEL TOKSİK ETKİLER KİMYASAL MUTAJENEZİS, KARSİNOJENEZİS, TERATOJENEZİS KAYNAKLAR: 1. Toksikoloji, Prof. Dr. Nevin VURAL
 ÖZEL TOKSİK ETKİLER KİMYASAL MUTAJENEZİS, KARSİNOJENEZİS, TERATOJENEZİS KAYNAKLAR: 1. Toksikoloji, Prof. Dr. Nevin VURAL 2. Casarett and Doll s Toxicology. The Basic Science of Poisions. KİMYASAL MUTAJENEZİS
ÖZEL TOKSİK ETKİLER KİMYASAL MUTAJENEZİS, KARSİNOJENEZİS, TERATOJENEZİS KAYNAKLAR: 1. Toksikoloji, Prof. Dr. Nevin VURAL 2. Casarett and Doll s Toxicology. The Basic Science of Poisions. KİMYASAL MUTAJENEZİS
Hücre bölünmesinin asal görevleri
 HÜCRE DÖNGÜSÜ Hücre bölünmesinin asal görevleri Hücre döngüsünü ya da hücre bölünmesini incelemeden önce, hücre çoğalmasının organizmaların yaşamında ne gibi roller oynadığını gözden geçirmek gerekmektedir.
HÜCRE DÖNGÜSÜ Hücre bölünmesinin asal görevleri Hücre döngüsünü ya da hücre bölünmesini incelemeden önce, hücre çoğalmasının organizmaların yaşamında ne gibi roller oynadığını gözden geçirmek gerekmektedir.
Brown ve Wu 1977 de Triasulfuron gibi sulfonylurea grubu ilaçlarından biri olan Chlorpropamide in in vitro V79 Çin hamster hücrelerinde KKD sayısını
 1 1.GİRİŞ Günümüzde hızlı endüştrileşmeye bağlı olarak çevre kirliliğinin giderek artması canlıların daha fazla fiziksel ve kimyasal etmene maruz kalmasına neden olmaktadır. Fiziksel ve kimyasal etmenlerin
1 1.GİRİŞ Günümüzde hızlı endüştrileşmeye bağlı olarak çevre kirliliğinin giderek artması canlıların daha fazla fiziksel ve kimyasal etmene maruz kalmasına neden olmaktadır. Fiziksel ve kimyasal etmenlerin
HAFTA I Genetiğe Giriş Hücre Döngüsü ve Düzenlenmesi Mitoz Mayoz Bölünme
 Biyoteknoloji ve Genetik I HAFTA I Genetiğe Giriş Hücre Döngüsü ve Düzenlenmesi Mitoz Mayoz Bölünme Prof. Dr. Hilâl Özdağ Genetiğe Giriş 50 milyar hücre/insan 2 metre DNA/hücre 3.2 milyar baz/hücre 2 birey
Biyoteknoloji ve Genetik I HAFTA I Genetiğe Giriş Hücre Döngüsü ve Düzenlenmesi Mitoz Mayoz Bölünme Prof. Dr. Hilâl Özdağ Genetiğe Giriş 50 milyar hücre/insan 2 metre DNA/hücre 3.2 milyar baz/hücre 2 birey
Hücre çekirdeği (nucleus)
 Hücre çekirdeği (nucleus) Toplam hücre hacmının 1/20-1/10'unu kapsar. Değişik hücrelerde mekanik etkilerle, yer ve şekil değiştirebilir, bu nedenle hücrelerde farklı şekillerde görülebilir. Çekirdek, hücre
Hücre çekirdeği (nucleus) Toplam hücre hacmının 1/20-1/10'unu kapsar. Değişik hücrelerde mekanik etkilerle, yer ve şekil değiştirebilir, bu nedenle hücrelerde farklı şekillerde görülebilir. Çekirdek, hücre
KROMOZOM DÜZENSİZLİKLERİ
 KROMOZOM DÜZENSİZLİKLERİ KROMOZOM ANOMALİLERİ 1- Sayısal kromozom anomalileri 2- Yapısal kromozom anomalileri SAYISAL KROMOZOM ANOMALİLERİ 1- Öploidi: Bir organizmanın hücrelerinde normal kromozom sayısının
KROMOZOM DÜZENSİZLİKLERİ KROMOZOM ANOMALİLERİ 1- Sayısal kromozom anomalileri 2- Yapısal kromozom anomalileri SAYISAL KROMOZOM ANOMALİLERİ 1- Öploidi: Bir organizmanın hücrelerinde normal kromozom sayısının
HÜCRELER NASIL BÖLÜNÜR
 HÜCRELER NASIL BÖLÜNÜR Hazırlayan: Yrd.Doç.Dr. Yosun MATER Prokaryotik/Bakteriyal Hücre Bölünmesi İkiye bölünme hücre bölünmesi, basit bir formudur. Prokaryotik hücre bölünmesi birbirinin aynısı iki hücre
HÜCRELER NASIL BÖLÜNÜR Hazırlayan: Yrd.Doç.Dr. Yosun MATER Prokaryotik/Bakteriyal Hücre Bölünmesi İkiye bölünme hücre bölünmesi, basit bir formudur. Prokaryotik hücre bölünmesi birbirinin aynısı iki hücre
Mayoz Bölünmenin Oluşumu
 MAYOZ BÖLÜNME NEDİR? 03 Ocak 2012, 23:39 Osman BEDEL MAYOZ BÖLÜNME NEDİR? Kromozom sayılarının nesiller boyu sabit tutulması mayoz bölünme ile sağlanır. Mayoz özel bir hücre bölünmesidir. Bu bölünme ile
MAYOZ BÖLÜNME NEDİR? 03 Ocak 2012, 23:39 Osman BEDEL MAYOZ BÖLÜNME NEDİR? Kromozom sayılarının nesiller boyu sabit tutulması mayoz bölünme ile sağlanır. Mayoz özel bir hücre bölünmesidir. Bu bölünme ile
YAZILIYA HAZIRLIK TEST SORULARI. 10. Sınıf
 YAZILIYA HAZIRLIK TEST SORULARI 10. Sınıf 1) Hücre döngüsünün interfaz evresini yeni tamamlamış bir hücre ile bu hücrenin döngü sonunda oluşturduğu yeni hücrelerde; I. DNA miktarı II. Gen Sayısı III. Gen
YAZILIYA HAZIRLIK TEST SORULARI 10. Sınıf 1) Hücre döngüsünün interfaz evresini yeni tamamlamış bir hücre ile bu hücrenin döngü sonunda oluşturduğu yeni hücrelerde; I. DNA miktarı II. Gen Sayısı III. Gen
TIBBİ BİYOLOJİ VE GENETİK ANABİLİM DALI
 TIBBİ BİYOLOJİ VE GENETİK ANABİLİM DALI Programın Yürütücüsü Programın Kadrolu Öğretim Üyeleri : Prof. Dr. Elif YEŞİLADA : Prof. Dr. Başak KAYHAN Doç. Dr. Yılmaz ÇİĞREMİŞ Doç. Dr.Şengül YÜKSEL Doç. Dr.
TIBBİ BİYOLOJİ VE GENETİK ANABİLİM DALI Programın Yürütücüsü Programın Kadrolu Öğretim Üyeleri : Prof. Dr. Elif YEŞİLADA : Prof. Dr. Başak KAYHAN Doç. Dr. Yılmaz ÇİĞREMİŞ Doç. Dr.Şengül YÜKSEL Doç. Dr.
Anahtar Kelimeler: Apoptoz, Hücre döngüsü, Kanser kök hücresi, Multiselüler tümör sferoid, Prostat,Trabectedin
 [PS14] Trabectedin in (Yondelis; ET-743) CD133+/ CD44+ İnsan Prostat Kanser Kök Hücresi Üzerindeki Etkilerinin İki Boyutlu (2D) ve Üç Boyutlu (3D) Sistemde İncelenmesi Eda Açıkgöz 1, Ümmü Güven 2, Fahriye
[PS14] Trabectedin in (Yondelis; ET-743) CD133+/ CD44+ İnsan Prostat Kanser Kök Hücresi Üzerindeki Etkilerinin İki Boyutlu (2D) ve Üç Boyutlu (3D) Sistemde İncelenmesi Eda Açıkgöz 1, Ümmü Güven 2, Fahriye
Sevcan MAMUR 1, Nazmiye ATASEVEN 2, Fatma ÜNAL 2, Deniz YÜZBAŞIOĞLU 2,*
 Araştırma Makalesi BAUN Fen Bil. Enst. Dergisi, 20(2), 235245, (208) DOI: 0.25092/baunfbed.428958 J. BAUN Inst. Sci. Technol., 20(2), 235245, (208) Gıdalarda koruyucu katkı maddesi olarak kullanılan sodyum
Araştırma Makalesi BAUN Fen Bil. Enst. Dergisi, 20(2), 235245, (208) DOI: 0.25092/baunfbed.428958 J. BAUN Inst. Sci. Technol., 20(2), 235245, (208) Gıdalarda koruyucu katkı maddesi olarak kullanılan sodyum
Hücre Yapısı: Somatik ve Germ Hücrelerinin Bölünme ve Farklanmaları. Yrd.Doç.Dr.Sevda Söker
 Hücre Yapısı: Somatik ve Germ Hücrelerinin Bölünme ve Farklanmaları Yrd.Doç.Dr.Sevda Söker Embriyonal yaşamın başlangıcından itibaren hücre bölünmesi başlar ve gelişmeyle ilgili her aşama hücre bölünmesiyle
Hücre Yapısı: Somatik ve Germ Hücrelerinin Bölünme ve Farklanmaları Yrd.Doç.Dr.Sevda Söker Embriyonal yaşamın başlangıcından itibaren hücre bölünmesi başlar ve gelişmeyle ilgili her aşama hücre bölünmesiyle
KOLOREKTAL KANSERLERİN MOLEKÜLER SINIFLAMASI. Doç.Dr.Aytekin AKYOL Hacettepe Üniversitesi Tıp Fakültesi Tıbbi Patoloji Anabilim Dalı 23 Mart 2014
 KOLOREKTAL KANSERLERİN MOLEKÜLER SINIFLAMASI Doç.Dr.Aytekin AKYOL Hacettepe Üniversitesi Tıp Fakültesi Tıbbi Patoloji Anabilim Dalı 23 Mart 2014 Kolorektal Kanserler; Sunum Planı Genel bilgiler Moleküler
KOLOREKTAL KANSERLERİN MOLEKÜLER SINIFLAMASI Doç.Dr.Aytekin AKYOL Hacettepe Üniversitesi Tıp Fakültesi Tıbbi Patoloji Anabilim Dalı 23 Mart 2014 Kolorektal Kanserler; Sunum Planı Genel bilgiler Moleküler
HANDAN TUNCEL. İstanbul Üniversitesi, Cerrahpaşa Tıp Fakültesi Biyofizik Anabilim Dalı
 HÜCRENİN ÇOĞALMASI VE FARKLILAŞIMININ BİYOFİZİĞİ HANDAN TUNCEL İstanbul Üniversitesi, Cerrahpaşa Tıp Fakültesi Biyofizik Anabilim Dalı hntuncel@istanbul.edu.tr G1; presentetik, S; DNA sentez fazı G2;
HÜCRENİN ÇOĞALMASI VE FARKLILAŞIMININ BİYOFİZİĞİ HANDAN TUNCEL İstanbul Üniversitesi, Cerrahpaşa Tıp Fakültesi Biyofizik Anabilim Dalı hntuncel@istanbul.edu.tr G1; presentetik, S; DNA sentez fazı G2;
Tıbbın Geleceğine dair.. Genetik Testler ve Kişiselleşmiş Tıp Anlayışı. B. Aysin Sermen
 Tıbbın Geleceğine dair.. Genetik Testler ve Kişiselleşmiş Tıp Anlayışı B. Aysin Sermen Daha güçlü.. Daha atletik.. Daha genç.. Daha huzurlu.. Daha mutlu.. Daha akıllı.. Daha sağlıklı.. Daha akıllı ve sağlıklı
Tıbbın Geleceğine dair.. Genetik Testler ve Kişiselleşmiş Tıp Anlayışı B. Aysin Sermen Daha güçlü.. Daha atletik.. Daha genç.. Daha huzurlu.. Daha mutlu.. Daha akıllı.. Daha sağlıklı.. Daha akıllı ve sağlıklı
HÜCRE BÖLÜNMESİ VE ÜREME. Mitoz Bölünme ve Eşeysiz Üreme 1
 HÜCRE BÖLÜNMESİ VE ÜREME Mitoz Bölünme ve Eşeysiz Üreme 1 Hücrenin bölünmeye başlamasından itibaren onu takip eden diğer hücre bölünmesine kadar geçen zaman aralığına hücre döngüsü denir. Hücreler belli
HÜCRE BÖLÜNMESİ VE ÜREME Mitoz Bölünme ve Eşeysiz Üreme 1 Hücrenin bölünmeye başlamasından itibaren onu takip eden diğer hücre bölünmesine kadar geçen zaman aralığına hücre döngüsü denir. Hücreler belli
SAĞ VE SOL KOLON YERLEŞİMLİ TÜMÖRLER: AYNI ORGANDA FARKLI PATOLOJİK BULGULAR VE MİKROSATELLİT İNSTABİLİTE DURUMU
 SAĞ VE SOL KOLON YERLEŞİMLİ TÜMÖRLER: AYNI ORGANDA FARKLI PATOLOJİK BULGULAR VE MİKROSATELLİT İNSTABİLİTE DURUMU Ezgi Işıl Turhan 1, Nesrin Uğraş 1, Ömer Yerci 1, Seçil Ak 2, Berrin Tunca 2, Ersin Öztürk
SAĞ VE SOL KOLON YERLEŞİMLİ TÜMÖRLER: AYNI ORGANDA FARKLI PATOLOJİK BULGULAR VE MİKROSATELLİT İNSTABİLİTE DURUMU Ezgi Işıl Turhan 1, Nesrin Uğraş 1, Ömer Yerci 1, Seçil Ak 2, Berrin Tunca 2, Ersin Öztürk
Çekirdek 4 bölümden oluşur Çekirdek zarı: karyolemma Kromatin: Chromatin Çekirdekcik: Nucleolus Çekirdek sıvısı: karyolymph
 NUKLEUS Bir hücrenin tüm yapılarının ve etkinliklerinin kodlandığı kromozomu Ayrıca, DNA sını dublike edecek ve 3 tip RNA yı ribozomal (rrna), haberci (mrna) ve transfer (trna)-sentezleyecek ve işleyecek
NUKLEUS Bir hücrenin tüm yapılarının ve etkinliklerinin kodlandığı kromozomu Ayrıca, DNA sını dublike edecek ve 3 tip RNA yı ribozomal (rrna), haberci (mrna) ve transfer (trna)-sentezleyecek ve işleyecek
Artan bilgi ile birlikte hasta ve ailelerin bilinçlendirilmesi
 2 Artan bilgi ile birlikte hasta ve ailelerin bilinçlendirilmesi «Genetik bilgiden hastaların ve ailelerin yararlanması için tüm sağlık çalışanları insan genetiğinin temelinde yatan prensipleri anlamalıdır»
2 Artan bilgi ile birlikte hasta ve ailelerin bilinçlendirilmesi «Genetik bilgiden hastaların ve ailelerin yararlanması için tüm sağlık çalışanları insan genetiğinin temelinde yatan prensipleri anlamalıdır»
YAŞLANMA /YAŞLANMA ÇEŞİTLERİ VE TEORİLERİ BEYZA KESKINKARDEŞLER 0341110024
 YAŞLANMA /YAŞLANMA ÇEŞİTLERİ VE TEORİLERİ BEYZA KESKINKARDEŞLER 0341110024 YAŞLANMA Hücre yapısını ve organelleri oluşturan moleküler yapılarından başlayıp hücre organelleri,hücre,doku,organ ve organ sistemlerine
YAŞLANMA /YAŞLANMA ÇEŞİTLERİ VE TEORİLERİ BEYZA KESKINKARDEŞLER 0341110024 YAŞLANMA Hücre yapısını ve organelleri oluşturan moleküler yapılarından başlayıp hücre organelleri,hücre,doku,organ ve organ sistemlerine
En Etkili Kemoterapi İlacı Seçimine Yardımcı Olan Moleküler Genetik Test
 En Etkili Kemoterapi İlacı Seçimine Yardımcı Olan Moleküler Genetik Test Yeni Nesil DNA Dizileme (NGS), İmmünHistoKimya (IHC) ile Hastanızın Kanser Tipinin ve Kemoterapi İlacının Belirlenmesi Kanser Tanı
En Etkili Kemoterapi İlacı Seçimine Yardımcı Olan Moleküler Genetik Test Yeni Nesil DNA Dizileme (NGS), İmmünHistoKimya (IHC) ile Hastanızın Kanser Tipinin ve Kemoterapi İlacının Belirlenmesi Kanser Tanı
DNA Tamiri ve Rekombinasyonu
 DNA Tamiri ve Rekombinasyonu Bitkilerdeki 3 genom UV ve radyosyonun diğer formları, kimyasallar, ve diğer streslerle (örneğin oksidatif, ısı vb.) devamlı hasar görür. Bazı proteinler onarımda ve rekombinasyonda
DNA Tamiri ve Rekombinasyonu Bitkilerdeki 3 genom UV ve radyosyonun diğer formları, kimyasallar, ve diğer streslerle (örneğin oksidatif, ısı vb.) devamlı hasar görür. Bazı proteinler onarımda ve rekombinasyonda
Kanser Tedavisi: Günümüz
 KANSER TEDAVİSİNDE MOLEKÜLER HEDEFLER Doç. Dr. Işık G. YULUĞ Bilkent Üniversitesi Moleküler Biyoloji ve Genetik Bölümü yulug@fen.bilkent.edu.tr Kanser Tedavisi: Günümüz Geleneksel sitotoksik ilaçlar ve
KANSER TEDAVİSİNDE MOLEKÜLER HEDEFLER Doç. Dr. Işık G. YULUĞ Bilkent Üniversitesi Moleküler Biyoloji ve Genetik Bölümü yulug@fen.bilkent.edu.tr Kanser Tedavisi: Günümüz Geleneksel sitotoksik ilaçlar ve
AVRASYA ÜNİVERSİTESİ
 Ders Tanıtım Formu Dersin Adı Öğretim Dili Sitogenetik Laboratuarı Türkçe Dersin Verildiği Düzey Ön Lisans () Lisans (X) Yüksek Lisans( ) Doktora( ) Eğitim Öğretim Sistemi Örgün Öğretim (X) Uzaktan Öğretim(
Ders Tanıtım Formu Dersin Adı Öğretim Dili Sitogenetik Laboratuarı Türkçe Dersin Verildiği Düzey Ön Lisans () Lisans (X) Yüksek Lisans( ) Doktora( ) Eğitim Öğretim Sistemi Örgün Öğretim (X) Uzaktan Öğretim(
TARTRAZİNİN İNSAN PERİFERAL LENFOSİTLERİNDEKİ IN VITRO SİTOTOKSİSİTE VE GENOTOKSİSİTESİ BÜŞRA GÜNEŞ
 T.C. ORDU ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ TARTRAZİNİN İNSAN PERİFERAL LENFOSİTLERİNDEKİ IN VITRO SİTOTOKSİSİTE VE GENOTOKSİSİTESİ BÜŞRA GÜNEŞ YÜKSEK LİSANS TEZİ ORDU 2016 ÖZET TARTRAZİNİN İNSAN
T.C. ORDU ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ TARTRAZİNİN İNSAN PERİFERAL LENFOSİTLERİNDEKİ IN VITRO SİTOTOKSİSİTE VE GENOTOKSİSİTESİ BÜŞRA GÜNEŞ YÜKSEK LİSANS TEZİ ORDU 2016 ÖZET TARTRAZİNİN İNSAN
Biyoteknoloji ve Genetik I Hafta 13. Ökaryotlarda Gen İfadesinin Düzenlenmesi
 Biyoteknoloji ve Genetik I Hafta 13 Ökaryotlarda Gen İfadesinin Düzenlenmesi Prof. Dr. Hilal Özdağ A.Ü Biyoteknoloji Enstitüsü Merkez Laboratuvarı Tel: 2225826/125 Eposta: hilalozdag@gmail.com Gen İfadesi
Biyoteknoloji ve Genetik I Hafta 13 Ökaryotlarda Gen İfadesinin Düzenlenmesi Prof. Dr. Hilal Özdağ A.Ü Biyoteknoloji Enstitüsü Merkez Laboratuvarı Tel: 2225826/125 Eposta: hilalozdag@gmail.com Gen İfadesi
EĞİTİM - ÖĞRETİM YILI DÖNEM I. III. KURULDERS PROGRAMI GENETİK BİLGİNİN AKIŞI- DOKUYA GİRİŞ (16 Ocak Mart 2017 )
 2015 2016 EĞİTİM - ÖĞRETİM YILI DÖNEM I III. KURULDERS PROGRAMI GENETİK BİLGİNİN AKIŞI- DOKUYA GİRİŞ (16 Ocak 2017-10 Mart 2017 ) Dekan Baş Koordinatör Dönem I Koordinatörü Dönem I Koordinatör Yardımcısı
2015 2016 EĞİTİM - ÖĞRETİM YILI DÖNEM I III. KURULDERS PROGRAMI GENETİK BİLGİNİN AKIŞI- DOKUYA GİRİŞ (16 Ocak 2017-10 Mart 2017 ) Dekan Baş Koordinatör Dönem I Koordinatörü Dönem I Koordinatör Yardımcısı
Farmasötik Toksikoloji
 Farmasötik Toksikoloji 2015-2016 II Prof.Dr.Buket Alpertunga Farmasötik Toksikoloji Anabilim Dalı 1 Doz-cevap ilişkisi «Her madde zehirdir, zehir olmayan madde yoktur, zehir ile ilacı birbirinden ayıran
Farmasötik Toksikoloji 2015-2016 II Prof.Dr.Buket Alpertunga Farmasötik Toksikoloji Anabilim Dalı 1 Doz-cevap ilişkisi «Her madde zehirdir, zehir olmayan madde yoktur, zehir ile ilacı birbirinden ayıran
b. Amaç: Hücre zarının yapı ve fonksiyonları ile ilgili genel bilgi öğretilmesi amaçlanmıştır.
 TIBBİ BİYOLOJİ I-DERS TANIMLARI 1-Tanım: Hücre ve Komponentlerinin öğretilmesi. b. Amaç: Hücrenin yapı, işlev ve çeşitliliği ile ilgili genel bilgi öğretilmesi c. Öğrenim Hedefleri: Prokaryot ve ökaryot
TIBBİ BİYOLOJİ I-DERS TANIMLARI 1-Tanım: Hücre ve Komponentlerinin öğretilmesi. b. Amaç: Hücrenin yapı, işlev ve çeşitliliği ile ilgili genel bilgi öğretilmesi c. Öğrenim Hedefleri: Prokaryot ve ökaryot
1. Sınıf Güz Dönemi I. Hafta Pazartesi Salı Çarşamba Perşembe Cuma Ders Saati
 I. Hafta Ders Saati 15.09.2014 16.09.2014 17.09.2014 18.09.2014 19.09.2014 Atatürk İlkeleri ve İnkılap Tarihi I: Atatürk İlkeleri ve İnkılap Tarihi I: Makromoleküller (Yrd. Doç. Dr. Mehmet Ataş) Türk Dili
I. Hafta Ders Saati 15.09.2014 16.09.2014 17.09.2014 18.09.2014 19.09.2014 Atatürk İlkeleri ve İnkılap Tarihi I: Atatürk İlkeleri ve İnkılap Tarihi I: Makromoleküller (Yrd. Doç. Dr. Mehmet Ataş) Türk Dili
DÜŞÜK SICAKLIK STRESİ
 DÜŞÜK SICAKLIK STRESİ Düşük sıcaklık stresi iki kısımda incelenir. Üşüme Stresi Donma stresi Düşük sıcaklık bitkilerde nekrozis, solma, doku yıkımı, esmerleşme, büyüme azalışı ve çimlenme düşüşü gibi etkiler
DÜŞÜK SICAKLIK STRESİ Düşük sıcaklık stresi iki kısımda incelenir. Üşüme Stresi Donma stresi Düşük sıcaklık bitkilerde nekrozis, solma, doku yıkımı, esmerleşme, büyüme azalışı ve çimlenme düşüşü gibi etkiler
TÜBİTAK BİDEB LİSE ÖĞRETMENLERİ FİZİK, KİMYA, BİYOLOJİ, MATEMATİK- PROJE DANIŞMANLIĞI EĞİTİMİ ÇALIŞTAYI LİSE3 (Çalıştay 2013) BİYOLOJİ GRUP TUHAF
 TÜBİTAK BİDEB LİSE ÖĞRETMENLERİ FİZİK, KİMYA, BİYOLOJİ, MATEMATİK- PROJE DANIŞMANLIĞI EĞİTİMİ ÇALIŞTAYI LİSE3 (Çalıştay 2013) BİYOLOJİ GRUP TUHAF PROJE ÖNERİSİ ADI TUHAF MATERYALLERDEN İZOLE EDİLEN DNA
TÜBİTAK BİDEB LİSE ÖĞRETMENLERİ FİZİK, KİMYA, BİYOLOJİ, MATEMATİK- PROJE DANIŞMANLIĞI EĞİTİMİ ÇALIŞTAYI LİSE3 (Çalıştay 2013) BİYOLOJİ GRUP TUHAF PROJE ÖNERİSİ ADI TUHAF MATERYALLERDEN İZOLE EDİLEN DNA
MAYOZ BÖLÜNME ve EŞEYLİ ÜREME
 MAYOZ BÖLÜNME ve EŞEYLİ ÜREME MBG 111 BİYOLOJİ I Hazırlayan: Yrd.Doç.Dr. Yosun MATER Türe ait genetik özelliklerin soylar arası aktarılmasına kalıtım adı verilir. Bu işleyişte türlerin genetik bilgisinin
MAYOZ BÖLÜNME ve EŞEYLİ ÜREME MBG 111 BİYOLOJİ I Hazırlayan: Yrd.Doç.Dr. Yosun MATER Türe ait genetik özelliklerin soylar arası aktarılmasına kalıtım adı verilir. Bu işleyişte türlerin genetik bilgisinin
ÇUKUROVA ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ
 ÇUKUROVA ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ DOKTORA TEZİ Ayşe YAVUZ KOCAMAN ACETAMIPRID VE ALPHA-CYPERMETHRIN PESTİSİDLERİNİN TEK BAŞINA VE KARIŞIM HALİNDE KULLANILDIKLARI ZAMAN İNSAN PERİFERAL LENFOSİTLERİNDEKİ
ÇUKUROVA ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ DOKTORA TEZİ Ayşe YAVUZ KOCAMAN ACETAMIPRID VE ALPHA-CYPERMETHRIN PESTİSİDLERİNİN TEK BAŞINA VE KARIŞIM HALİNDE KULLANILDIKLARI ZAMAN İNSAN PERİFERAL LENFOSİTLERİNDEKİ
Moleküler biyolojiye giriş. Doç.Dr.Pınar AKSOY SAĞIRLI
 Moleküler biyolojiye giriş Doç.Dr.Pınar AKSOY SAĞIRLI Molecular biology terimi ilk kez Warren Weaver tarafından 1938 de kullanıldı. Hayatın fiziksel ve kimyasal olarak açıklanması olarak tanımlandı. 1977
Moleküler biyolojiye giriş Doç.Dr.Pınar AKSOY SAĞIRLI Molecular biology terimi ilk kez Warren Weaver tarafından 1938 de kullanıldı. Hayatın fiziksel ve kimyasal olarak açıklanması olarak tanımlandı. 1977
Mikronükleus tekniği ve kullanım alanları
 Mikronükleus tekniği ve kullanım alanları Sennur Demirel, Ayşe Gül Zamani Selçuk Üniversitesi Meram Tıp Fakültesi Tıbbi Biyoloji ve Genetik Anabilim Dalı, Konya Amaç: Bu derlemenin amacı sayısal ve yapısal
Mikronükleus tekniği ve kullanım alanları Sennur Demirel, Ayşe Gül Zamani Selçuk Üniversitesi Meram Tıp Fakültesi Tıbbi Biyoloji ve Genetik Anabilim Dalı, Konya Amaç: Bu derlemenin amacı sayısal ve yapısal
MİTOZ ÇALIŞMA KÂĞIDI A. Aşağıdaki resimli bulmacayı çözünüz.
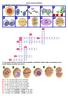 MİTOZ ÇALIŞMA KÂĞIDI A. Aşağıdaki resimli bulmacayı çözünüz. B. Numaralandırılmış evrelerle ilgili aşağıdaki cümlelerde ifadeyi doğru tamamlayan koyu renkli ifadeyi yuvarlak içine alınız. 2. / 5. resimde
MİTOZ ÇALIŞMA KÂĞIDI A. Aşağıdaki resimli bulmacayı çözünüz. B. Numaralandırılmış evrelerle ilgili aşağıdaki cümlelerde ifadeyi doğru tamamlayan koyu renkli ifadeyi yuvarlak içine alınız. 2. / 5. resimde
AMAÇ: Ökaryotik hücrelerin bölünme mekanizmasını ve kromozom morfolojilerini öğrenmek.
 19.11.2014/Çarşamba Lab 6 KONU: Hücre Bölünmesi ve Kromozom Morfolojisi AMAÇ: Ökaryotik hücrelerin bölünme mekanizmasını ve kromozom morfolojilerini öğrenmek. KAZANIMLAR: Ökaryotik hücrelerin nasıl çoğaldıkları
19.11.2014/Çarşamba Lab 6 KONU: Hücre Bölünmesi ve Kromozom Morfolojisi AMAÇ: Ökaryotik hücrelerin bölünme mekanizmasını ve kromozom morfolojilerini öğrenmek. KAZANIMLAR: Ökaryotik hücrelerin nasıl çoğaldıkları
Konu: Mitoz Bölünme ve Eşeysiz Üreme
 Konu: Mitoz Bölünme ve Eşeysiz Üreme Hücre bölünmesi tüm canlılarda görülen ortak bir özelliktir. Hücre büyüyüp gelişirken madde ve enerji gereksinimleri artar. Sitoplâzma hücre zarına oranla daha hızlı
Konu: Mitoz Bölünme ve Eşeysiz Üreme Hücre bölünmesi tüm canlılarda görülen ortak bir özelliktir. Hücre büyüyüp gelişirken madde ve enerji gereksinimleri artar. Sitoplâzma hücre zarına oranla daha hızlı
Hücre içinde bilginin akışı
 Hücre içinde bilginin akışı 1 DNA Çift Zincir Heliks 2 Hücre Çekirdeği ve Çekirdek Zarının Yapısal Organizasyonu Hatırlıyor musunuz? DNA Kromatin Kromatid Kromozom RNA Protein Çekirdek Çekirdekcik Nükleotid
Hücre içinde bilginin akışı 1 DNA Çift Zincir Heliks 2 Hücre Çekirdeği ve Çekirdek Zarının Yapısal Organizasyonu Hatırlıyor musunuz? DNA Kromatin Kromatid Kromozom RNA Protein Çekirdek Çekirdekcik Nükleotid
YGS YE HAZIRLIK DENEMESi #5
 YGS YE HAZIRLIK DENEMESi #5 Miktar 1) I.Hemoglobinin yapısındaki karbon atomu sayısını tespit etmek II. Solunumda kullanılacak gazların hangi molekülle taşınacağını tespit etmek III. Kanın ph ını tespit
YGS YE HAZIRLIK DENEMESi #5 Miktar 1) I.Hemoglobinin yapısındaki karbon atomu sayısını tespit etmek II. Solunumda kullanılacak gazların hangi molekülle taşınacağını tespit etmek III. Kanın ph ını tespit
ARI ÜRÜNLERİNİN SAĞLIK ÜZERİNE ETKİLERİ
 ARI ÜRÜNLERİNİN SAĞLIK ÜZERİNE ETKİLERİ PROF.DR.OĞUZ ÖZTÜRK İSTANBUL ÜNİVERSİTESİ DENEYSEL TIP ARAŞTIRMA ENSTİTÜSÜ (DETAE) MOLEKÜLER TIP ANABİLİM DALI Bal ve Diğer Arı Ürünleri ile Sağlıklı Yaşam Platformu
ARI ÜRÜNLERİNİN SAĞLIK ÜZERİNE ETKİLERİ PROF.DR.OĞUZ ÖZTÜRK İSTANBUL ÜNİVERSİTESİ DENEYSEL TIP ARAŞTIRMA ENSTİTÜSÜ (DETAE) MOLEKÜLER TIP ANABİLİM DALI Bal ve Diğer Arı Ürünleri ile Sağlıklı Yaşam Platformu
EĞİTİM - ÖĞRETİM YILI DÖNEM I. III. KURUL DERS PROGRAMI GENETİK BİLGİNİN AKIŞI- DOKUYA GİRİŞ (15 Ocak Mart 2018 )
 2017 2018 EĞİTİM - ÖĞRETİM YILI DÖNEM I III. KURUL DERS PROGRAMI GENETİK BİLGİNİN AKIŞI- DOKUYA GİRİŞ (15 Ocak 2018-9 Mart 2018 ) Dekan Baş Koordinatör Dönem I Koordinatörü Dönem I Koordinatör Yardımcısı
2017 2018 EĞİTİM - ÖĞRETİM YILI DÖNEM I III. KURUL DERS PROGRAMI GENETİK BİLGİNİN AKIŞI- DOKUYA GİRİŞ (15 Ocak 2018-9 Mart 2018 ) Dekan Baş Koordinatör Dönem I Koordinatörü Dönem I Koordinatör Yardımcısı
Epigenetik ve Kanser. Tayfun ÖZÇELİK Bilkent Üniversitesi Moleküler Biyoloji ve Genetik Bölümü
 Epigenetik ve Kanser Tayfun ÖZÇELİK Bilkent Üniversitesi Moleküler Biyoloji ve Genetik Bölümü tozcelik@fen.bilkent.edu.tr Conrad Waddington (1905-1975) Edinburgh Üniversitesi Embriyoloji ve Genetik Profesörü
Epigenetik ve Kanser Tayfun ÖZÇELİK Bilkent Üniversitesi Moleküler Biyoloji ve Genetik Bölümü tozcelik@fen.bilkent.edu.tr Conrad Waddington (1905-1975) Edinburgh Üniversitesi Embriyoloji ve Genetik Profesörü
GENETİK TANI YÖNTEMLERİ. Prof.Dr.Mehmet Alikaşifoğlu
 GENETİK TANI YÖNTEMLERİ Prof.Dr.Mehmet Alikaşifoğlu S Genetik Tanı Yöntemleri S Sitogenetik Tanı Yöntemleri S Moleküler Sitogenetik Tanı Yöntemleri S Moleküler Genetik Tanı Yöntemleri Sitogenetik Tanı
GENETİK TANI YÖNTEMLERİ Prof.Dr.Mehmet Alikaşifoğlu S Genetik Tanı Yöntemleri S Sitogenetik Tanı Yöntemleri S Moleküler Sitogenetik Tanı Yöntemleri S Moleküler Genetik Tanı Yöntemleri Sitogenetik Tanı
EĞİTİM - ÖĞRETİM YILI DÖNEM I. III. KURULDERS PROGRAMI GENETİK BİLGİNİN AKIŞI - DOKUYA GİRİŞ (15 Ocak Mart 2018 )
 2017 2018 EĞİTİM - ÖĞRETİM YILI DÖNEM I III. KURULDERS PROGRAMI GENETİK BİLGİNİN AKIŞI - DOKUYA GİRİŞ (15 Ocak 2018-9 Mart 2018 ) Dekan Baş Koordinatör Dönem I Koordinatörü Dönem I Koordinatör Yardımcısı
2017 2018 EĞİTİM - ÖĞRETİM YILI DÖNEM I III. KURULDERS PROGRAMI GENETİK BİLGİNİN AKIŞI - DOKUYA GİRİŞ (15 Ocak 2018-9 Mart 2018 ) Dekan Baş Koordinatör Dönem I Koordinatörü Dönem I Koordinatör Yardımcısı
ACEPHATE VE MEPHOSFOLAN İNSEKTİSİTLERİNİN İNSAN LENFOSİT KÜLTÜRÜNDE GENOTOKSİK ETKİLERİ. Deniz ÖZKAN YÜKSEK LİSANS TEZİ BİYOLOJİ
 ACEPHATE VE MEPHOSFOLAN İNSEKTİSİTLERİNİN İNSAN LENFOSİT KÜLTÜRÜNDE GENOTOKSİK ETKİLERİ Deniz ÖZKAN YÜKSEK LİSANS TEZİ BİYOLOJİ GAZİ ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ ŞUBAT 2009 ANKARA Deniz ÖZKAN tarafından
ACEPHATE VE MEPHOSFOLAN İNSEKTİSİTLERİNİN İNSAN LENFOSİT KÜLTÜRÜNDE GENOTOKSİK ETKİLERİ Deniz ÖZKAN YÜKSEK LİSANS TEZİ BİYOLOJİ GAZİ ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ ŞUBAT 2009 ANKARA Deniz ÖZKAN tarafından
ÇUKUROVA ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ
 ÇUKUROVA ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ YÜKSEK LİSANS TEZİ Erman Salih İSTİFLİ AMOXICILLIN ANTİBİYOTİĞİNİN İNSAN PERİFERAL LENFOSİTLERİNDE IN VITRO GENOTOKSİK ETKİLERİ BİYOLOJİ ANABİLİM DALI ADANA,
ÇUKUROVA ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ YÜKSEK LİSANS TEZİ Erman Salih İSTİFLİ AMOXICILLIN ANTİBİYOTİĞİNİN İNSAN PERİFERAL LENFOSİTLERİNDE IN VITRO GENOTOKSİK ETKİLERİ BİYOLOJİ ANABİLİM DALI ADANA,
Dichlorvos un (DDVP) Allium cepa L. Kök Ucu Meristem Hücrelerinde Mitoz Bölünme ve Kromozomlar Üzerine Etkileri
 Cumhuriyet Üniversitesi Fen Fakültesi Fen Bilimleri Dergisi (CFD), Cilt 35, No. 3 (2014) ISSN: 1300-1949 Cumhuriyet University Faculty of Science Science Journal (CSJ), Vol. 35, No. 3 (2014) ISSN: 1300-1949
Cumhuriyet Üniversitesi Fen Fakültesi Fen Bilimleri Dergisi (CFD), Cilt 35, No. 3 (2014) ISSN: 1300-1949 Cumhuriyet University Faculty of Science Science Journal (CSJ), Vol. 35, No. 3 (2014) ISSN: 1300-1949
EÜFBED - Fen Bilimleri Enstitüsü Dergisi Cilt-Sayı: 6-2 Yıl:
 EÜFBED - Fen Bilimleri Enstitüsü Dergisi Cilt-Sayı: 6-2 Yıl: 2013 145-155 145 1,4-DİOKSAN VERİLEN SWISS ALBİNO FARELERDE( ) YEŞİL ÇAYIN BAZI FİZYOLOJİK VE GENOTOKSİK PARAMETRELER ÜZERİNE KORUYUCU ETKİSİ
EÜFBED - Fen Bilimleri Enstitüsü Dergisi Cilt-Sayı: 6-2 Yıl: 2013 145-155 145 1,4-DİOKSAN VERİLEN SWISS ALBİNO FARELERDE( ) YEŞİL ÇAYIN BAZI FİZYOLOJİK VE GENOTOKSİK PARAMETRELER ÜZERİNE KORUYUCU ETKİSİ
15- RADYASYONUN NÜKLEİK ASİTLER VE PROTEİNLERE ETKİLERİ
 15- RADYASYONUN NÜKLEİK ASİTLER VE PROTEİNLERE ETKİLERİ İyonlaştırıcı radyasyonların biyomoleküllere örneğin nükleik asitler ve proteinlere olan etkisi hakkında yeterli bilgi yoktur. Ancak, nükleik asitlerden
15- RADYASYONUN NÜKLEİK ASİTLER VE PROTEİNLERE ETKİLERİ İyonlaştırıcı radyasyonların biyomoleküllere örneğin nükleik asitler ve proteinlere olan etkisi hakkında yeterli bilgi yoktur. Ancak, nükleik asitlerden
Telomeraz enzim eksikliğinin tedavisinde yeni yaklaşımlar. Prof. Dr. Fatma İnanç Tolun 08.11.2013 / Kahramanmaraş
 Telomeraz enzim eksikliğinin tedavisinde yeni yaklaşımlar Prof. Dr. Fatma İnanç Tolun 08.11.2013 / Kahramanmaraş Sunum Akışı DNA replikasyonu Telomer Telomeraz Telomeraz eksikliğinde görülen hastalıklar
Telomeraz enzim eksikliğinin tedavisinde yeni yaklaşımlar Prof. Dr. Fatma İnanç Tolun 08.11.2013 / Kahramanmaraş Sunum Akışı DNA replikasyonu Telomer Telomeraz Telomeraz eksikliğinde görülen hastalıklar
YGS YE HAZIRLIK DENEMESi #13
 YGS YE HAZIRLIK DENEMESi #13 1) Canlılarda özelliklerin genlerle kontrol edildiği ve her genin en az bir özellikten sorumlu olduğu bilindiğine göre, I. Diploid canlılarda her özellik için iki gen bulunması
YGS YE HAZIRLIK DENEMESi #13 1) Canlılarda özelliklerin genlerle kontrol edildiği ve her genin en az bir özellikten sorumlu olduğu bilindiğine göre, I. Diploid canlılarda her özellik için iki gen bulunması
Onkolojide Sık Kullanılan Terimler. Yrd.Doç.Dr.Ümmügül Üyetürk 2013
 Onkolojide Sık Kullanılan Terimler Yrd.Doç.Dr.Ümmügül Üyetürk 2013 Kanser Hücrelerin aşırı kontrolsüz üretiminin, bu üretime uygun hücre kaybıyla dengelenemediği, giderek artan hücre kütlelerinin birikimi..
Onkolojide Sık Kullanılan Terimler Yrd.Doç.Dr.Ümmügül Üyetürk 2013 Kanser Hücrelerin aşırı kontrolsüz üretiminin, bu üretime uygun hücre kaybıyla dengelenemediği, giderek artan hücre kütlelerinin birikimi..
SNP TEK NÜKLEOTİD POLİMORFİZMLERİ (SINGLE NUCLEOTIDE POLYMORPHISMS)
 SNP TEK NÜKLEOTİD POLİMORFİZMLERİ (SINGLE NUCLEOTIDE POLYMORPHISMS) Herhangi iki bireyin DNA dizisi %99.9 aynıdır. %0.1 = ~3x10 6 nükleotid farklılığı sağlar. Genetik materyalde varyasyon : Polimorfizm
SNP TEK NÜKLEOTİD POLİMORFİZMLERİ (SINGLE NUCLEOTIDE POLYMORPHISMS) Herhangi iki bireyin DNA dizisi %99.9 aynıdır. %0.1 = ~3x10 6 nükleotid farklılığı sağlar. Genetik materyalde varyasyon : Polimorfizm
FISH ve in situ melezleme
 FISH ve in situ melezleme In situ melezleme belirli bir mrna nın doku içinde nerede bulunduğunu görmemize yarar. Bu metod inceleyenin ilgilendiği mrna nın normal yerini görmesine olanak sağlar. In situ
FISH ve in situ melezleme In situ melezleme belirli bir mrna nın doku içinde nerede bulunduğunu görmemize yarar. Bu metod inceleyenin ilgilendiği mrna nın normal yerini görmesine olanak sağlar. In situ
Derece Bölüm/Program Üniversite Yıl Lisans Biyoloji İnönü Üniversitesi 1990 Y. Lisans SBE-Biyokimya Anadolu Üniversitesi 1993 Doktora/S.
 ÖZGEÇMİŞ VE ESERLER LİSTESİ ÖZGEÇMİŞ Adı Soyadı: MUSTAFA ÇELİK Doğum Tarihi: 01-01-1967 Öğrenim Durumu: DOKTORA Derece Bölüm/Program Üniversite Yıl Lisans Biyoloji İnönü Üniversitesi 1990 Y. Lisans SBE-Biyokimya
ÖZGEÇMİŞ VE ESERLER LİSTESİ ÖZGEÇMİŞ Adı Soyadı: MUSTAFA ÇELİK Doğum Tarihi: 01-01-1967 Öğrenim Durumu: DOKTORA Derece Bölüm/Program Üniversite Yıl Lisans Biyoloji İnönü Üniversitesi 1990 Y. Lisans SBE-Biyokimya
DNA ve Özellikleri. Şeker;
 DNA ve Özellikleri Hücrelerdeki hayatsal olayların yönetimini çekirdek sağlar. Çekirdek içinde, hücrenin beslenme, solunum, üreme gibi canlılık faaliyetlerin yönetilmesini sağlayan genetik madde bulunur.
DNA ve Özellikleri Hücrelerdeki hayatsal olayların yönetimini çekirdek sağlar. Çekirdek içinde, hücrenin beslenme, solunum, üreme gibi canlılık faaliyetlerin yönetilmesini sağlayan genetik madde bulunur.
Kimya ö rencilerinde, kimyasallar n genotoksik etkisinin kromozom aberasyon testiyle belirlenmesi
 217 Kimya ö rencilerinde, kimyasallar n genotoksik etkisinin kromozom aberasyon testiyle belirlenmesi Bilge EROL 1, *Songül BUDAK D LER 2 1 Ni de Üniversitesi, Fen Bilimleri Enstitüsü, N DE 2 Ni de Üniversitesi,
217 Kimya ö rencilerinde, kimyasallar n genotoksik etkisinin kromozom aberasyon testiyle belirlenmesi Bilge EROL 1, *Songül BUDAK D LER 2 1 Ni de Üniversitesi, Fen Bilimleri Enstitüsü, N DE 2 Ni de Üniversitesi,
HİDROJEN PEROKSİT, SAÇ BOYALARI ve KANSER
 HİDROJEN PEROKSİT, SAÇ BOYALARI ve KANSER A)HİDROJEN PEROKSİT Hidrojen peroksit; ısı, kontaminasyon ve sürtünme ile yanıcı özellik gösteren, renksiz ve hafif keskin kokuya sahip olan bir kimyasaldır ve
HİDROJEN PEROKSİT, SAÇ BOYALARI ve KANSER A)HİDROJEN PEROKSİT Hidrojen peroksit; ısı, kontaminasyon ve sürtünme ile yanıcı özellik gösteren, renksiz ve hafif keskin kokuya sahip olan bir kimyasaldır ve
DÜŞÜK DOZ RADYASYONA MESLEKİ OLARAK MARUZ KALMANIN GENOTOKSİKOLOJİK AÇIDAN DEĞERLENDİRİLMESİ
 T.C. ADNAN MENDERES ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ BİYOLOJİ ANABİLİM DALI 2016-YL-005 DÜŞÜK DOZ RADYASYONA MESLEKİ OLARAK MARUZ KALMANIN GENOTOKSİKOLOJİK AÇIDAN DEĞERLENDİRİLMESİ Serap YÜCE Tez Danışmanı:
T.C. ADNAN MENDERES ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ BİYOLOJİ ANABİLİM DALI 2016-YL-005 DÜŞÜK DOZ RADYASYONA MESLEKİ OLARAK MARUZ KALMANIN GENOTOKSİKOLOJİK AÇIDAN DEĞERLENDİRİLMESİ Serap YÜCE Tez Danışmanı:
KROMOZOMLAR ve KALITIM
 KROMOZOMLAR ve KALITIM SİTOGENETİK Kromozomları ve kalıtımdaki görevlerini inceler Bu görevlerin incelenmesinde kullanılan en temel teknikler: - Karyotipleme (Hücre nükleusundaki kromozomların 23 çift
KROMOZOMLAR ve KALITIM SİTOGENETİK Kromozomları ve kalıtımdaki görevlerini inceler Bu görevlerin incelenmesinde kullanılan en temel teknikler: - Karyotipleme (Hücre nükleusundaki kromozomların 23 çift
KROMOZOM YAPISINDAKİ BOZUKLUKLAR
 KROMOZOM YAPISINDAKİ BOZUKLUKLAR http://radyolojii.blogspot.com.tr/2014_08_01_archive.html http://tr.wikipedia.org/wiki/dna_onar%c4%b1m%c4%b1 Kromozomun yapısal formunun değişmesiyle oluşur. Kırıklar gibi
KROMOZOM YAPISINDAKİ BOZUKLUKLAR http://radyolojii.blogspot.com.tr/2014_08_01_archive.html http://tr.wikipedia.org/wiki/dna_onar%c4%b1m%c4%b1 Kromozomun yapısal formunun değişmesiyle oluşur. Kırıklar gibi
BİYOLOJİ ANABİLİM DALI
 ÇUKUROVA ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ YÜKSEK LİSANS TEZİ Ümit ZAN ESMERON (ROCURONIUM BROMÜR) UN İNSAN PERİFERAL LENFOSİTLERİNDE IN VITRO GENOTOKSİK ETKİLERİ BİYOLOJİ ANABİLİM DALI ADANA, 2007
ÇUKUROVA ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ YÜKSEK LİSANS TEZİ Ümit ZAN ESMERON (ROCURONIUM BROMÜR) UN İNSAN PERİFERAL LENFOSİTLERİNDE IN VITRO GENOTOKSİK ETKİLERİ BİYOLOJİ ANABİLİM DALI ADANA, 2007
SODYUM BENZOAT VE POTASYUM BENZOAT IN İNSAN PERİFERAL LENFOSİTLERİNDE GENOTOKSİK ETKİLERİNİN BELİRLENMESİ. Nazmiye ZENGİN YÜKSEK LİSANS TEZİ BİYOLOJİ
 SODYUM BENZOAT VE POTASYUM BENZOAT IN İNSAN PERİFERAL LENFOSİTLERİNDE GENOTOKSİK ETKİLERİNİN BELİRLENMESİ Nazmiye ZENGİN YÜKSEK LİSANS TEZİ BİYOLOJİ GAZİ ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ MAYIS 2009
SODYUM BENZOAT VE POTASYUM BENZOAT IN İNSAN PERİFERAL LENFOSİTLERİNDE GENOTOKSİK ETKİLERİNİN BELİRLENMESİ Nazmiye ZENGİN YÜKSEK LİSANS TEZİ BİYOLOJİ GAZİ ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ MAYIS 2009
 ADI SOYADI SINIFI - NO TENZİLE ERDOĞAN ANADOLU LİSESİ 2014 2015 ÖĞRETİM YILI 10. SINIFLAR SEÇMELİ BİYOLOJİ DERSİ I. DÖNEM II. YAZILI SINAVI PUAN GRUP B RAKAMLA YAZIYLA 1- Aşağıda verilen mayoz bölünme
ADI SOYADI SINIFI - NO TENZİLE ERDOĞAN ANADOLU LİSESİ 2014 2015 ÖĞRETİM YILI 10. SINIFLAR SEÇMELİ BİYOLOJİ DERSİ I. DÖNEM II. YAZILI SINAVI PUAN GRUP B RAKAMLA YAZIYLA 1- Aşağıda verilen mayoz bölünme
TEMEL VETERĠNER GENETĠK
 DİKKATİNİZE: BURADA SADECE ÖZETİN İLK ÜNİTESİ SİZE ÖRNEK OLARAK GÖSTERİLMİŞTİR. ÖZETİN TAMAMININ KAÇ SAYFA OLDUĞUNU ÜNİTELERİ İÇİNDEKİLER BÖLÜMÜNDEN GÖREBİLİRSİNİZ. TEMEL VETERĠNER GENETĠK KISA ÖZET KOLAYAOF
DİKKATİNİZE: BURADA SADECE ÖZETİN İLK ÜNİTESİ SİZE ÖRNEK OLARAK GÖSTERİLMİŞTİR. ÖZETİN TAMAMININ KAÇ SAYFA OLDUĞUNU ÜNİTELERİ İÇİNDEKİLER BÖLÜMÜNDEN GÖREBİLİRSİNİZ. TEMEL VETERĠNER GENETĠK KISA ÖZET KOLAYAOF
