BİYOKİMYA - II DERS NOTLARI
|
|
|
- Esin Özer
- 7 yıl önce
- İzleme sayısı:
Transkript
1 NDKUZ MAYIS ÜNİVERSİTESİ FEN EDEBİYAT FAKÜLTESİ KİMYA BÖLÜMÜ BİYKİMYA ANABİLİM DALI BİYKİMYA - II DERS NTLARI Prof. Dr. alil KRKMAZ Prof. Dr. Nihat TINKILIÇ Doç. Dr. Tevfik ÖZEN Yrd. Doç. Dr. Aytaç GÜDER SAMSUN 2012 i
2 ÖNSÖZ BÖLÜM: VİTAMİNLER SUDA ÇÖZÜNEN VİTAMİNLER Tiamin (B1Vitamini) Riboflavin (B2vitamini) Nikotinamid (B3 vitamini) Pantotenik Asit (B5 vitamini) Piridoksin (B6 vitamini) Biyotin Folik asit Lipoik Asit Kobalamin (B12 vitamini) vitamini (Askorbik asit) YAĞDA ÇÖZÜNEN VİTAMİNLER A vitamini D vitamini E vitamini K vitamini BÖLÜM: METABLİZMA VE BİYENERJETİK ÜRELERİN KARBN VE ENERJİ KAYNAKLARI KARBN VE AZT DEVRİ BİYENERJETİĞİN İLKELERİ Biyoenerjetikler ve Termodinamik ATP (ADENZİN TRİFSFAT) ATP Aktif Taşıma ve Kas Kasılmasında Enerji Sağlar ATP idrolizinin Reaksiyon Dengesine Etkisi METABLİZMADAKİ ELEKTRN TAŞIYIILARI ii
3 9.6. KATABLİZMA VE ANABLİZMA METABLİK YLLARIN ÜRE İÇİ KNTRLÜ BÖLÜM: KARBİDRAT METABLİZMASI KARBİDRATLARIN SİNDİRİMİ VE EMİLİMİ GLİKLİZ Glikoliz Reaksiyonları Glikoliz Yolunun Enerji Bilançosu Glikoliz MetabolikYolunun Kontrol Mekanizması Glukoz Dışındaki Diğer Monosakkaritlerin Glikolize Girişi Pirüvatın Etanol, Laktat ve Asetil oa ya Çevrilmesi ,3 Bisfosfogliseratın (2,3 BPG) 2 Taşımasındaki Rolü SİTRİK ASİT (TA) ÇEVRİMİ TA Çevrimi Reaksiyonları Sitrik Asit Çevriminin Düzenlenmesi Pirüvatın Dehidrogenaz Kompleksinin Kontrolü Sitrik Asit Çevriminin Kontrolü TA Çevrimi Ara Bileşiklerinin Biyosentetik Önemi GLİKSİLAT ÇEVRİMİ KSİDATİF FSFRİLASYN İndirgenme Potansiyelleri ve Serbest Enerji Değişimleri ELEKTRN TAŞIMA ZİNİRİ (SLUNUM ZİNİRİ) ksijenin Eksik İndirgenmesinden Doğan Zararların Giderilmesi Karışık İşlevli ksidazlar, ksigenazlar ve Sitokrom P Fosforilasyon ve Kemiozmotik Teori Glikolizde luşan NAD ın Solunum Zincirine Girişi Glukoz ksidasyonunun ATP Bilançosu PENTZ FSFAT YLUYLA GLUKZ KSİDASYNU iii
4 Pentoz Fosfat Yolu ızının Kontrolü Pentoz fosfat Yolunun Bazı Doku ve ücrelerdeki Önemi GLUKNEGENEZ Glukoneogenezin Reaksiyonları Glukoneogenezin Enerji Bilançosu Pirüvat Karboksilaz Enziminin Allosterik Özellikleri ve Biyotinin Etki Mekanizması GLİKJEN METABLİZMASI Glikojenin Yıkımı (Glikojenoliz) Glikojen Biyosentezi (Glikojenez) Glikojen Metabolizmasının Kontrolü ve Düzenlenmesi FTSENTEZ VE FTSENTETİK KARBİDRAT SENTEZİ Fotofosforilasyonun Genel Özellikleri Yüksek Bitkilerdeki Fotosentez Işık Kloroplastlarda Elektron Akışını Sağlar Klorofil Tutulan Enerjiyi Reaksiyon Merkezlerine, Uyarım Transferiyle Aktarır Yüksek Bitkilerde İki Reaksiyon Merkezi Ardarda Çalışır Fotofosforilasyonla ATP Sentezi Çevrimsel (Döngüsel) Elektron Akışı ATP Üretir, NADP veya 2 Üretmez Kloroplastın ATP Sentazı Mitokondridekine Benzer FTSENTETİK KARBİDRAT SENTEZİ Karbondioksit Asimilasyonu (Karbon-Özümlemesi) Üç Safhada luşur BÖLÜM: LİPİD METABLİZMASI YAĞLARIN SİNDİRİMİ VE TAŞINMASI YAĞ ASİTLERİNİN YIKIMI Yağ Asitlerinin Aktifleştirilmesi ve Mitokondri Matriksine Taşınmaları Doymuş Yağ Asitlerinin β ksidasyonu iv
5 Doymamış Yağ Asitlerinin β ksidasyonu Tek Karbon Sayılı Yağ Asitlerinin ksidasyonu Karaciğerde luşan Keton isimleri Diğer rganlara Taşınır LİPİD BİYSENTEZİ Yağ Asitlerinin Biyosentezi Malonil oa, Asetil oa ve Bikarbonattan luşur Yağ Asitleri Tekrarlayan Reaksiyon Dizileri Şeklinde Sentezlenir Yağ Asidi Sentaz Kompleksi Yedi Farklı Aktif Bölgeye Sahiptir Yağ Asidi Sentaz Asetil ve Malonil Gruplarını Alır Yağ Asidi Sentaz Reaksiyonları Palmitat luşturmak Üzere Tekrarlanır Yağ Asidi Sentezi Birçok rganizmanın Sitozolünde Fakat Bitkilerin Kloroplastlarında luşur Asetat Mitokondrinin Dışına Sitrat larak Çıkar Yağ Asidi Biyosentezi Kuvvetlice Düzenlenir Uzun Zincirli Doymuş Yağ Asitleri Palmitattan Sentezlenir Bazı Yağ Asitleri Doymamıştır TRİAÇİLGLİSERLLERİN BİYSENTEZİ Triaçilgliseroller ve Gliserofosfolipitler Aynı Öncüllerden Sentezlenir ayvansal rganizmalarda Triaçilgliserol Biyosentezi ormonlarla Düzenlenir BÖLÜM: PRTEİN VE AMİNASİT METABLİZMASI PRTEİNLERİN SİNDİRİMİ AMİNASİTLERİN YIKIMI VE ÜRE ÇEVRİMİ α Amino Grubunun Uzaklaştırılması Üre Çevrimi Aminoasitlerin Karbon İskeletlerinin Yıkım Yolları Aminoasit Yıkımında Birkaç Enzim Kofaktörü Önemli Rol ynar v
6 n Aminoasit Asetil oa ya Yıkılır Beş Aminoasit α Ketoglutarata Dönüştürülür Dört Aminoasit Süksinil oa ya Dönüştürülür Dallı Yan Zincirli Aminoasitler Karaciğerde Yıkılmaz Asparagin ve Aspartat kzalasetata Yıkılır Bazı Aminoasitler Glukoza Diğerleri Keton isimlerine Dönüştürülebilir BÖLÜM: NÜKLEPRTEİN ve NÜKLEİK ASİT METABLİZMASI NÜKLETİT KATABLİZMASI Pürinlerin Katabolizması Pirimidinlerin Katabolizması NÜKLETİT BİYSENTEZİ De Novo (yeni baştan sentez) Pürin Ribonükleotitlerin Sentezi Pürin Biyoentezi Pürin Nükleotit Biyosentezinin Regülasyonu Pürin Nükleotidlerinin Salvaj (kurtarma) Yolu ile Sentezi De Novo Pirimidin Ribonükleotitlerin Sentezi De Novo Pirimidin Nükleotit Biyosentezinin Regülasyonu Salvaj Yolu ile Pirimidin Nükleotidlerinin Sentezi NÜKLETİD METABLİZMASINDAKİ KALITSAL BZUKLUKLAR Pürin Metabolizmasındaki Kalıtsal Bozukluklar Pirimidin Metabolizmasındaki Kalıtsal Bozukluklar PÜRİN VE PİRİMİDİN NÜKLETİTLERİNİN SENTEZİNİN EKZJEN MADDELERLE İNİBİSYNU DEKSİRİBNÜKLETİTLERİN SENTEZİ Deoksiribonükleotid Sentezinin Düzenlenmesi BÖLÜM: METABLİZMANIN ENTEGRASYNU ve DÜZENLENMESİ DKUYA ÖZGÜ METABLİZMA: İŞ BÖLÜMÜ vi
7 Karaciğer Besinleri İşler ve Dağıtır Adipoz Doku Yağ Asitlerini Alır ve Depolar Kas Mekanik İş İçin ATP Kullanır Beyin Elektriksel Uyarıları İletmek İçin Enerji Kullanır Kan; ksijeni, Metabolitleri ve ormonları Taşır Yakıt Metabolizmasının ormonal Düzenlenmesi Epinefrin Yaklaşan Aktiviteyi aber Verir Glukagon Düşük Kan Glukozunun abercisidir Açlık ve Uzamış Açlık Süresince Beyine Enerji Sağlamak İçin Metabolizma Değişir İnsülin Yüksek Kan Glukozunun abercisidir Kortizol Düşük Kan Glukozuna Bağlı Stresin abercisidir Diyabet İnsülin Üretimi ya da Etkisindeki bir atanın Sonucudur RMNLAR: FARKLI İŞLEVLER İÇİN FARKLI YAPILAR ormonlar Spesifik ücresel Reseptörler Aracılığıyla Etki Gösterir ormonlar Kimyasal larak Farklıdır VÜUT AĞIRLIĞININ UZUN SÜRELİ DÜZENLENMESİ KAVERENGİ YAĞDAKİ EŞLEŞMEMİŞ MİTKNDRİ ISI ÜRETİR. 286 KAYNAKLAR vii
8 ÖNSÖZ Biyokimya, canlı organizmaların en küçük yapısal birimi olan hücrenin kimyasal yapısını ve hayatın devamı boyunca hücrede, moleküler düzeyde meydana gelen kimyasal olayları inceleyen bir bilim dalıdır. Biyokimya, biyolojik olayları kimyasal ilkeler çerçevesinde inceler ve analiz eder. Biyoloji ve kimya temel bilimlerinin bir çalışma alanı olan biyokimya, günümüzde başta tıp olmak üzere tarım, beslenme ve endüstride de uygulama alanı bulan bir bilim dalı haline gelmiştir. Netice olarak biyokimya bilimi, canlının meydana gelişindeki, canlılığın devamındaki ve nihayet yok oluşundaki kimyasal mekanizmaları inceleyen bir bilimdir. Biyokimya II notlarında, kimya öğrencileri için gerekli biyolojik açıklamalarla birlikte, biyoloji ve sağlık bilimleri eğitimi görenler için de gerekli kimyasal açıklamalar yapılmıştır. Bu notlar, hepsi ayrı olarak ele alınmış 7 bölümden oluşmaktadır ve her bölüm kendi konularıyla sınırlıdır. Biyokimya II notlarında, metabolizma ve biyoenerjetik temel bilgileri verildikten sonra; karbohidrat, lipid ve aminoasit metabolizmaları, nükleoprotein ve nükleik asit metabolizması, metabolizmanın entegrasyonu ve düzenlenmesi açıklanmıştır. Son bölüm geniş metabolik ilişkileri kapsamaktadır. Bu yaklaşımın öğrencinin biyokimya bilgisinin temelini oluşturacağını düşünmekteyiz. Biyokimyada, kimya öğrencilerine ayrı bir tat, çeşni sunmaya çalışacağız. anlılığın yani yaşamın temelde, hücrede cereyan eden bir takım kimyasal olayların bir sonucu olduğunu anlayabilirsek amacımıza ulaşmış olacağız. Bu notlar uzun, zorlu ve sabır dolu bir sürecin sonunda ellerinize ulaştı. Bu notlarımızı biyokimya ve ilgili disiplinlerde lisans ve lisansüstü öğrencilerinin kullanımına sunuyoruz. Notlarımızın geliştirilmesi, eksikliklerinin ve kusurlarının giderilmesinde meslektaşlarımızın değerli eleştiri ve katkılarını bekliyoruz. Bu notların yazılmasında büyük emeği olan Dr. Aytaç GÜDER e katkılarından dolayı teşekkür etmeyi bir borç biliyoruz. Öğrencilerimize ve meslektaşlarımıza yararlı olması dileklerimizle. Prof. Dr. alil KRKMAZ 1
9 8. BÖLÜM: VİTAMİNLER ücrenin yapısını oluşturan proteinler, nükleik asitler, karbohidratlar ve lipidlerin yanında eser miktarda mevcut vitamin adı verilen belirli organik maddeler vardır. Vitaminin kelime anlamı hayat aminidir. Bugün vitamin sınıfına giren maddelerin birçoğunun amin yapısında olmadığı bilinmektedir. Vitaminler insan ve hayvanların gelişmesi ve canlılıklarını sürdürmesi için gerekli olan, küçük miktarlarda etkilerini gösteren organik maddelerdir. Vitaminler diğer organik besin maddelerinden farklı olarak doku yapısına girmezler ve organizmaya enerji sağlamazlar. Fakat vitaminler enerji değişimi ve metabolizmanın düzenlenmesinde hayati öneme sahiptirler. Vitaminler bazı organizmalar tarafından sentezlenemez, dışarıdan diyetle alınması gereken esansiyel maddelerdir. Vitaminler suda çözünenler ve yağda çözünenler olarak iki büyük sınıfa ayrılır (Tablo 8.1.). Suda çözünen vitaminler; B grubu vitaminler ve vitaminidir. vitamini hariç bütün suda çözünen vitaminlerin koenzim fonksiyonları vardır. Yağda çözünen vitaminler ise A, D, E ve K vitaminleridir. Bu vitaminleri hayvansal organizmalar dışarıdan diyetle almalıdır; bitkiler ve mikroorganizmalar için esansiyel rolleri belirlenememiştir. Yağda çözünen vitaminler, koenzimlerin bileşeni değildir ve bazı metabolik olaylara eser miktarda katılması gereken bileşiklerdir. Tablo 8.1. Vitaminler ve fonksiyonları VİTAMİNİN TİPİ VE ADI KENZİM VEYA AKTİF FNKSİYNU FRMU Suda Çözünenler Tiamin (B1 vitamini) Tiaminpirofosfat (TPP) Aldehid grubu taşınması Riboflavin (B2 vitamini) Flavinmononükleotid idrojen atomu (elektron) taşınması (FMN) Flavin adenin dinükleotid idrojen atomu (elektron) taşınması (FAD) Nikotinamid (B3 vitamini) Nikotinamid adenin dinükleotid idrojen atomu (elektron) taşınması (NAD + ) Nikotinamid adenin dinükleotid idrojen atomu (elektron) taşınması fosfat (NADP + ) Pantotenik asit (B5 vitamini) Koenzim A (o A) Açil grubu taşınması Pridoksin (B6 vitamini) Pridoksal fosfat Amino grubu taşınması Biyotin ( vitamini veya koenzim R) Biyositin Karboksil grubu taşınması Folik asit (B10 veya B11 vitamini) Tetrahidrofolat 1- gruplarının taşınması Kobalamin (Vitamin B12) Koenzim B12 idrojen atomlarının 1,2-kayması Lipoik asit Lipoillisin idrojen atomu ve açil grubu taşınması Askorbik asit idroksilasyonlarda kofaktör Yağda Çözünenler A vitamini 11-cis-Retinal Görme siklüsü D vitamini 1,25-Dihidroksikolekalsiferol Kalsiyum ve fosfat metabolizması 2
10 E vitamini Antioksidan K vitamini Protrombin biyosentezi Bu bölümde vitaminlerin kimyasal yapısı ve var ise koenzim rolleri örnekleriyle anlatılacaktır SUDA ÇÖZÜNEN VİTAMİNLER Tiamin (B1Vitamini) Tiamin, bütün omurgalılar ve bazı mikroorganizmalar için zorunlu olan bir vitamindir. Tiamin bir metilen grubu üzerinden substitüe bir tiyazol halkasının bir piridine bağlanmasıyla meydana gelmiştir (Şekil 8.1.). ücrelerde büyük oranda aktif koenzim şekli olan tiaminpirofosfat (TPP) halinde bulunur. P N N 2 2 N 2 S N N 2 2 N 2 S P 3 N N Tiamin Tiaminpirofosfat Şekil 8.1. Tiamin ve tiaminpirofosfatın kimyasal yapıları: Substitüe tiyazol molekülün aktif kısmıdır. Tiaminpirofosfat, metabolizmanın iki tip reaksiyonunda; 1) α ketoasitlerin dekarboksilasyonu ve 2) α keto bileşiklerinin oluşumu veya yıkımında koenzim rolü oynar. Bu reaksiyonlarda TPP, tiyazol halkasına kovalent ve aktifleşmiş halde bağladığı aldehid gruplarının uzaklaştırılması ve/veya taşınması fonksiyonunu görür. Tiaminpirofosfatın α keto asitlerinin dekarboksilasyonunda oynadığı rolü, pirüvatın asetaldehide dönüşümü reaksiyonu ile açıklayabiliriz (Şekil 8.2.) Pirüvat dekarboksilaz (Mg +2 ) 3 Pirüvat Asetaldehid 3
11 N 2 3 S TPP' in tiyazol halkasi 3 Pirüvik asit 3 3 N 2 S 2 3 N 2 S Asetaldehid N 2 3 S idroksietil türevi TPP' in tiyazol halkasi Şekil 8.2. Pirüvatın, pirüvat dekarboksilaz enzimiyle dekarboksilasyonunda tiaminpirofosfat (TPP) etkisinin basamakları. Tiamin en çok bira mayasında ve buğday, pirinç gibi tahılların kabuğunda bulunur. Bundan başka fasulye, bezelye, ceviz vb. gibi besinlerde yeterli miktarda bulunmaktadır. Tiamin (B1 vitamini) eksikliğinde gözlenen belirtiler; 1. İştah azalması, yorgunluk, baş dönmesi ve sindirim sistemi bozuklukları, 2. Sinir sistemi bozuklukları şeklinde gözlenen beriberi hastalığında eklemlerde şişmeler, refleks hareketlerinin durması ve denge kaybı görülür Riboflavin (B2vitamini) B2 vitamini ilk defa sütten elde edilmiştir. Bütün bitkiler ve birçok organizma tarafından sentezlenebildiği halde hayvansal organizmalarca sentezlenemez. Riboflavin, bir izoalloksazin türevidir. İzoalloksazinin 10 nolu azotuna riboz şekerinin indirgenmesiyle oluşan ribitol bağlıdır (Şekil 8.3.). 4
12 3 N N 3 10 N N Şekil 8.3. Riboflavin (B 2 vitamini) Riboflavinin ribitol grubunun 5' karbon atomuna fosfat grubunun bağlanması sonucu flavin mono nükleotid (FMN), FMN ye adenilat (AMP) bağlanmasıyla flavin adenin dinükleotid (FAD) meydana gelir (Şekil 8.4.). 3 N N 3 N N 3 N N 3 N N Riboflavin 2 P 3-2 FMN 2 P Adenilat (AMP) P 2 N N N 2 N N FAD Şekil 8.4. FMN ve FAD nin kimyasal yapısı. 5
13 Flavin nükleotidler (FMN ve FAD), flavoproteinler veya flavoenzimler olarak bilinen indirgeme yükseltgeme (dehidrogenaz) enzimlerinin prostetik gruplarıdırlar. Bu enzimler pirüvatın, yağ asitlerinin, amino asitlerin oksidatif yıkımına ve elektron taşınma olayına katılırlar. Koenzimi oldukları enzimin katalitik etkisi sırasında, FMN ve FAD nin izoalloksazin halkası dönüşümlü olarak indirgenir. Bu nükleotidlerin indirgenmiş halleri FMN2 ve FAD2 şeklinde gösterilir: 3 N N e - 3 N N 3 N R Yükseltgenmiş form (FAD) N e - 3 N R İndirgenmiş form (FAD2) Besin maddelerinin oksidasyonunda bazı dehidrogenazların koenzimi olarak rol alan FAD, FAD2 ye indirgenir ve FAD2 de elektronlarını solunum zincirine aktararak ATP sentezlenmesini sağlar. FAD2 enzime sıkı bağlı olduğundan, elektronlarını mitokondri iç membranında bulunan solunum zincirine (ETS) aktarır ve ATP sentezlenir. Farklı flavoproteinlerin yükseltgenmiş (FMN, FAD içeren) şekilleri, görünür bölgede kuvvetli absorpsiyon bantlarından dolayı karakteristik sarı, kırmızı veya yeşil renklidirler. Flavoproteinlerin indirgenmesi (FMN2 ve FAD2) sonucu renksizleşmesinden yararlanılarak bu enzimlerin aktivite ölçümleri yapılır. Riboflavin en çok süt ve süt ürünleri, bira ve ekmek mayası, karaciğer, böbrek, et, ıspanak gibi yeşil sebzeler, domates, kuru fasulye, balık ve yumurtada bulunur. Tahıllarda ise yetersizdir. Riboflavin (B2 vitamini) yetersizliğinde; 1. Gözde kan damarları genişler ve gözde yanma ile görme zorlaşır, 2. Deride ve özellikle dudak kenarlarında yaralar, 3. Sinir sistemi bozuklukları ve anemi görülür. N Nikotinamid (B3 vitamini) Niasinamid adı da verilen B3 vitamininin diğer adı PP vitaminidir. Pellegra adı verilen bir hastalığı önlemesi nedeniyle pellegra preventive den baş harfleri alınarak bu vitamine PP vitamini adı verilmiştir. rganizmada nikotinik asit, nikotinamide dönüştürülebildiği için nikotinik asidin de vitamin etkisi vardır. 6
14 Bitkiler ve çoğu hayvanlar nikotinik asidi, değişik yollarla özellikle triptofandan sentezleyebilirler. ayvanlar, triptofan bakımından zengin proteinlerle beslenirse nikotinik asit eksikliği görülmez. N 2 N Nikotinik asit (niasin) N Nikotinamid Nikotinamid içeren başlıca iki koenzim vardır: Nikotinamid adenin dinükleotid (NAD + ) ve nikotinamid adenin dinükleotid fosfat (NADP + ). er iki koenzim, piridin koenzimi veya piridin nükleotidi olarak da adlandırılır (Şekil 8.5.). NADP +, NAD + den farklı olarak, adenine bağlı riboz biriminin 2' hidroksil grubu fosfat esteri halindedir. 4-5 N P 2 N 1 N 2 - N N P 2 5 N N R Şekil 8.5. Nikotinamid adenin dinükleotid (NAD + ) in yapısı. (R grubu ise NAD + ; -P -2 3 ise NADP + olur.) 7
15 NAD + ve NADP +, piridine bağımlı dehidrogenaz enzimlerinin koenzimi olarak fonksiyon görür. Substrat moleküllerinden hidrojen atomlarının uzaklaştırılması (yükseltgenme) sırasında elektron alıcısı rolünü oynarlar. Bu reaksiyonlarda substrat üzerindeki hidrojen atomlarının birisi, doğrudan NAD + ve NADP + nin nikotinin halkasına aktarılırken, diğeri de + iyonu halinde çözeltiye geçer (Şekil 8.6.) e - N 2 N N e - N R R NAD + (NADP + ) NAD (NADP) + + Buna örnek olarak, malatın okzalasetata dönüşümü reaksiyonu verilmiştir. + N 2 Malat dehidrogenaz + N N 2 N R R Malat NAD + kzalasetat NAD + + Şekil 8.6. Malat dehidrogenazın katalizlediği reaksiyonda hidrojen ve elektron alışverişi; bunlardan biri pridinin 4 pozisyonuna hidrid iyonu olarak taşınır, diğeri ortama + iyonu olarak salınır. Genellikle pridine bağımlı dehidrogenazlar ya NAD + veya NADP + için spesifiktir; bununla birlikte glutamat dehidrogenaz gibi bazı enzimler her iki koenzimle de aktivite gösterebilir. NADP tamamen indirgeyici biyosentez olaylarında görev alırken, bunu koenzim olarak kullanan enzimlere redüktazlar denir. NAD ise elektronlarını mitokondri iç membranında solunum zincirine aktarır ve ATP sentezini sağlar. Biyosentez olaylarının büyük bölümü sitoplazmada ve ER membranının sitoplazmaya bakan yüzeyinde gerçekleştiğinden; NADP + li enzimler daha çok sitoplazmada, NAD + li dehidrogenaz enzimleri ise daha çok mitokondri matriksinde yer alır. NAD + ve NADP + nin indirgenmiş formları (NAD ve NADP), 340 nm de maksimum absorpsiyon verir ve bu özelliklerinden 8
16 piridin nükleotide bağımlı enzimlerin katalizlediği reaksiyonların gerçekleşme derecesini takip etmede yararlanılır. Enzim katalizli reaksiyon süresince NAD oluşumunun 340 nm deki absorbansı izlenir. B3 vitamini en çok et ve özellikle karaciğerde bulunur. Bunlardan başka bira mayası, yeşil sebzeler, ceviz, fındık, çay, kahve, buğday, baklagillerde bu vitamin için iyi bir kaynaktır. B3 vitamini, karbohidrat, yağ ve protein metabolizması için gereklidir. Yetersizliğindeki hastalık ve belirtiler şunlardır: 1. Sinir sistemi bozuklukları, hal ve hareketlerde anormallikler, 2. Sindirim sistemi bozuklukları, 3. Deride simetrik yaralar. Bu belirtileri olan hastalık pelegradır Pantotenik Asit (B5 vitamini) Bir β alanin türevi olan pantotenik asit; 2,4-dihidroksi-3,3-dimetil butirik asit olan pantoik asidin karboksil grubuyla β alaninin amino grubunun amid bağıyla bağlanmasından meydana gelmiştir. Bitkiler ve çoğu mikroorganizmaların sentezleyebildiği pantotenik asit, omurgalılar için mutlak esansiyel bir vitamindir. 3 2 N Pantoik asit kısmı Pantotenik asit β-alanin kısmı İnsan ve hayvan organizmasında pantotenik asidin önemi, koenzim A (o A) nın bileşeni olmasından ileri gelir. Koenzim A başlıca üç birimden oluşmuştur: β merkaptoetilamin, pantotenik asit ve riboz şekerinin 3' hidroksil grubu fosforillenmiş ADP (Şekil 8.7.). 9
17 Reaktif tiyol grubu S 2 2 N -merkaptoetilamin 2 2 N 3 2 P P 2 3 N N N 2 N N Adenin Pantotenik asit Riboz-3'-fosfat P 3-Fosfoadenozin difosfat Şekil 8.7. Koenzim A (o A). Pantotenik asidin hidroksil grubu fosfat ester bağıyla modifiye ADP parçasına bağlanır ve bunun karboksil grubu amid bağıyla β merkaptoetile bağlanır. ADP parçasında 3' hidroksil grubu, ADP nin kendinde bulunmayan bir fosforil grubuna sahiptir. Koenzim A nın aktif kısmı uçtaki sülfidril ( S) grubudur. Koenzim A, açil grubu taşıyıcısı olarak; yağ asitlerinin oksidasyonu, yağ asitlerinin sentezi, pirüvatın oksidasyonu ve enzimatik biyolojik açilleme reaksiyonlarına iştirak eder. o A ya açil grubu olarak en fazla bağlanan asetil grubudur. R SoA 3 SoA Açil oa Asetil oa Asetil oa çok negatif bir hidroliz ΔG o değerine sahiptir. Asetil oa + 2 Asetat + oa + + G o =-7.5 kcal/mol Bir başka deyişle, asetil oa nın asetil grubu transfer potansiyeli yüksektir. ATP nin aktifleşmiş fosfat grubu taşıyıcısı olması gibi, oa da aktifleşmiş açil ve asetil grupları taşıyıcısıdır. Açilleme ve asetilleme reaksiyonlarında gerekli olan enerji tiyoester bağının hidrolizi ile sağlanır. Pantotenik asit; karaciğer, böbrek, yumurta, bira mayası, bezelye, kuru fasulye, süzme bal, karnabahar ve lahanada çok miktarda bulunmaktadır. ayvansal ve bitkisel besinlerde yeterince bulunur. Karbohidrat, yağ ve protein metabolizması için gereklidir. Eksikliğinde deride yaralar, saç dökülmesi ve sinir sistemi bozuklukları görülür. 10
18 Piridoksin (B6 vitamini) Bir pridin türevi olan piridoksin (piridoksol), biyolojik olarak pridoksal ve piridoksamine dönüşebilir. B6 vitamininin aktif koenzimleri de pridoksal fosfat (PLP) ve piridoksamin fosfattır (Şekil 8.8.) N Piridoksin 2 2 P 3 N Piridoksal 3 N Piridoksal fosfat 2 N 2 2 N P 3 N 3 N Piridoksamin Piridoksamin fosfat Şekil 8.8. Piridoksin ve koenzim şekilleri. Piridoksin koenzimleri çok çeşitli enzimatik reaksiyonlara katılırlar. Piridoksal fosfatın (PLP) zorunlu koenzim olarak katıldığı genel bir enzimatik reaksiyon tipi transaminasyondur. Transaminasyon reaksiyonunda bir aminoasidin α amino grubu, bir keto asidin α karbon atomuna taşınır. Bu tip reaksiyonları katalizleyen enzimler transaminazlar olarak adlandırılır. N 3 R 1 + R 2 Transaminaz PLP R 1 + N 3 R 2 Transaminasyon reaksiyonlarında, bir aminoasidin α amino grubuyla enzime bağlı piridoksal fosfat arasında bir Schiff bazı oluşur. Daha sonra bu amino grubu aminoasitten ayrılır ve bir keto asit oluşur. 11
19 2 N R 1 + E R 1 N E R 1 N 2 E -Amino asit Piridoksal fosfat - enzim Ara ürün (Schiff BazI) N 2 E + R Piridoksamin fosfat - enzim -Keto asit Meydana gelen enzime bağlı pridoksamin fosfat, bu reaksiyon dönüşümüyle bir başka α keto asitle reaksiyona girer. Sonuçta yeni bir aminoasit ve piridoksal fosfat enzim kompleksi oluşur. 2 N 2 E + R E + 2 N Piridoksamin fosfat - enzim -Keto asit R Piridoksal fosfat - enzim -Amino asit Piridoksal fosfat; transaminasyon reaksiyonları dışında aminoasitlerin ara metabolizmasının; α amino asitlerin dekarboksilasyonu, molekülden 2 ve 2S in uzaklaştırılması ve rasemizasyon reaksiyonlarında da koenzim rolü oynar. B6 vitamini en çok bira mayasında, tahıl ve özellikle pirinç kabukları, yumurta sarısı ve sebzelerde; daha az miktarda karaciğer, böbrek, balık ve sütte bulunur. B6 vitamini; karbohidrat, yağ, protein ve hemoglobin sentezi için gereklidir. Eksikliğinde merkezi sinir sistemi arızaları nedeni ile havale, anemi ve deride yaralar meydana gelir. 12
20 Biyotin Biyotin birbiriyle kondanse olmuş bir imidazol halkası ile tiyofen halkası ve tiyofen halkasına bağlı bir valerik asitten ibarettir (Şekil 8.9.). 3 N N Enzimin lizin kalintisi N N S Biyotin N N S N N - N-Karboksi biyotinillisin Biyotin S N N - Karboksibiyotinillizin-enzim Şekil 8.9. Biyotin ve bir enzim-lizin kalıntısının biyotinil türevinin karboksillenmiş şekli. Biyotin 2 nin enzimatik taşınmasında rol alır. Mesela biyotin, propiyonil oa karboksilaz enziminin yapısındaki spesifik bir lizinin yan zincirindeki ε-amino grubuna amid bağıyla bağlanır. Bu bileşik biyotin lizin veya biyositin olarak adlandırılır. Propiyonil oa karboksilaz, pirüvat karboksilaz ve asetil oa karboksilaz gibi belirli karboksilleyici enzimlerde biyotin, karboksi biyotinil lizin halinde 2 nin taşıyıcısı rolünü oynar (Şekil 8.10.). Karboksilaz enzimlerinin substratı 3 - anyonudur. Böyle bir karboksilasyon reaksiyonu aşağıdaki reaksiyonların toplamı olan eşitliğe göre gerçekleşir. ATP Biyotin - enzim Karboksibiyotin-enzim + Substrat ADP + P i + Karboksibiyotin-enzim Biyotin-enzim + Karboksillenmis. substrat 13
21 Memeli karaciğer ve böbreğindeki en önemli telafi edici reaksiyon, pirüvat karboksilazla katalizlenen ve pirüvatın 2 ile tersinir karboksillenmesi sonucu okzalasetattın oluşumudur. Pirüvat karboksilaz - Pirüvat ATP kzalasetat + ADP + P i Pirüvat karboksilazın reaksiyonu için, enzimin prostetik grubu (koenzimi) olan biyotin gerekir (Şekil 8.10.). P P P Riboz Adenin.. N N Bikarbonat ( 2 ) 4 1 S N ADP + P i Biyotinil-enzim N N ( 2 ) 4 S N Karboksibiyotinil-enzim E Pirüvat Pirüvat (enolat formu) 2 Şekil Biyotinin pirüvat karboksilaz reaksiyonundaki ATP rolü. Biyotin, biyotinil-enzim kompleksini oluşturmak için, Lys kalıntısının ε-amino grubuna bağlı amid üzerinden enzime katılır. Enzim iki basamaklı süreci katalizler. Basamak 1 de biyotinin azot atomu, bikarbonat iyonuna nükleofilik olarak E katılarak karboksibiyotinil enzim oluşur. Basamak 2 de enolat formundaki pirüvat, aktif 2 üzerine nükleofilik olarak saldırır ve okzalasetatı oluşturur. Benzer mekanizmalar, propiyonil oa karboksilaz ve asetil oa karboksilaz gibi diğer biyotin bağımlı karboksillenme reaksiyonlarında da görülür... N N 2 kzalasetat + S ( 2 ) 4 N Biyotinil-enzim E 14
22 Biyotin en çok yumurta sarısında, karaciğerde, sütte, böbrekte ve mayada bulunur. Yiyeceklerde yeteri kadar bulunur. Çiğ yumurta yendiği zaman yumurta beyazında bulunan avidin adı verilen glikoprotein, biyotinle birleşerek sindirilemeyen bir kompleks meydana getirir ve dışkı ile atılır. Pişmiş yumurtada avidin denatüre olur ve biyotini bağlayamaz. Biyotin üre sentezi, yağ asitleri ve aminoasitlerin metabolizması için gereklidir Folik asit İlk olarak ıspanakta bulunmuş olup, folik asit bitkilerde oldukça yaygındır. Folik asit bağırsaklardaki mikroorganizmalar tarafından da sentezlenir ve memelilerce sentezlenemez. Folik asit üç çeşit yapı taşından oluşur: Substitüe bir pteridin, p amino benzoik asit ve glutamik asit.folik asidin türevi olan tetrahidrofolik asit (F4 veya TF), folik asidin 5,6,7 ve 8 nolu atomlarının hidrojenasyonuyla meydana gelir (Şekil 8.11.). N N 2 N N N N N 2-Amino- 4-hidroksi-6-metil pteridin p-amino benzoik asit Glutamik asit Folik asit 2 N N 3 2 N N N N N Tetrahidrofolik asit (TF) 2 2 Şekil Folik asit ve tetrahidrofolik asidin yapısı. N 5 ve N 10 taşınmasında görev alır. azot atomları 1 grubunun Tetrahidrofolat tarafından taşınan bir karbonlu birimler, 5 veya 10 nolu azot atomu veya her ikisine birden bağlanırlar. Bu bir karbonlu birimler üç yükseltgenme basamağında olabilirler (Tablo 8.2.). En çok yükseltgenmiş bir karbon birimi olan 2 in ise biyotin tarafından taşındığı daha önce anlatılmıştı. 15
23 Tablo 8.2. TF tarafından taşınan bir karbonlu birimler. ksidasyon Derecesi En çok indirgenmiş Az indirgenmiş En çok yükseltgenmiş Grup 3, metil 2, metilen, formil =N, formimino =, metenil Metabolizma olaylarında en önde gelen bir karbonlu birim kaynağı serin olup, bu birimi glisine dönüşürken verir. Tetrahidrofolatın çoğu formları birbirine dönüşebilir, metabolik reaksiyonların bir kısmında tetrahidrofolat tek karbon vericisidir. Tetrahidrofolat için tek karbon biriminin ana kaynağı, serin-glisin dönüşümünden alınan karbondur ve N 5,N 10 metilen TF oluşur ve bu da N 5 metil tetrahidrofolata indirgenebilir. Tetrahidrofolat türevlerinin katıldığı reaksiyonlara örnek olarak homosisteinden metiyonin oluşum reaksiyonunu verebiliriz. Serinin hidroksimetil grubu N 5 metil türevine dönüşür ve metil grubu homosisteine aktarılarak metiyonin oluşur (Şekil 8.12.). N 5 metil tetrahidrofolat karaciğerde metiyonin sentezinde rol alır. Metiyonin bir esansiyel aminoasit olmasına karşın insanlarca sadece homosistein kısmı sentezlenemez. 16
24 N 5 N 2 2 N 10 Tetrahidrofolat (aktif kisim) 3 N 2 Serin PLP 3 N Transferaz Glisin 3 N 2 - N 5 N N 10 N 5,N 10 -metilentetrahidrofolat NAD Redüktaz 3 N S Metiyonin N 5 + N 2 2 N 10 Tetrahidrofolat (aktif kisim) 2 S omosistein Metiyonin sentaz N 5 N 3 2 NAD + 2 N 10 N 5 -metiltetrahidrofolat Şekil Tetrahidrofolat üzerindeki tek karbonlu birimlerin dönüşümü ve metiyonin sentezi. N 5,N 10 metilen tetrahidrofolatın N 5 metil tetrahidrofolata dönüşümü etkin olarak dönüşümsüzdür. Bazı organizmalarda metiyonin sentezinde metil grubu vericisi metil kobalamindir. Folik asit; en çok yeşil yapraklarda, karaciğer, et, yumurta ve sütte bulunur. Folik asit, aminoasit metabolizması ve kan hücrelerinin yapımı ve olgunlaşması için gereklidir. Eksikliğinde üreme zayıflığı, anemi ve deride yaralar görülür. Günde mg folik asit almak belleği koruma bakımından önemli bir yarar sağlayabilir Lipoik Asit Lipoik asit bitkilerin çoğunda ve tiroid bezi hariç bütün hayvansal dokularda bulunur. Siklik bir disülfid yapıda olan lipoik asit ve 6 ile 8 pozisyonunda birer sülfidril grubu taşıyan indirgenmiş açık zincirli dihidrolipoik asit olmak üzere iki şekilde bulunur (Şekil 8.13.). Redoks reaksiyonlarıyla bu iki şekil birbirine dönüşebilir. 17
25 S S Lipoik asit S S Dihidrolipoik asit (indirgenmis). a N S S N 2 N-Lipoillisin (Lipoamid) Lipoik asit Enzimin lizin kalintisi Yükseltgenmis form 2 N N S S Enzimin polipeptid zinciri b. indirgenmis form S S Şekil a) Lipoik asit ve türevleri. b) Lipoik asitin lizin kalıntısının yan zinciriyle oluşturduğu amid bağı. Lipoillizil (lipoamid) parçası, dihidrolipoil trans asetilazın prostetik grubudur. Lipoil grubu oksitlenmiş (disülfid) ve redüklenmiş (ditiyol) formunda bulunur ve hidrojen ve asetil (ya da açil) grubu taşıyıcısı olarak davranır. Lipoik asit, pirüvat ve diğer α keto asitlerinin oksidatif dekarboksilasyonunda koenzimlerden biri olarak etki eder; bu kompleks reaksiyonlara birçok koenzim katılır. Pirüvat, önce karboksil grubunu kaybeder ve enzime bağlı tiaminpirofosfatın hidroksietil türevi oluşur. Son olarak dihidrolipoil trans asetilaz enzimine bağlı lipoik asitle reaksiyon olur; bu sırada elektronlar ve açil grubu taşınarak 6 asetil dihidrolipoik asit oluşur (Şekil 8.14.). Daha sonra lipoik asit rejenere olur, açil grubu koenzim A üzerine taşınır ve tiyol grupları okside olarak siklik yapıda lipoik asit meydana gelir. Lipoik asit, dihidrolipoil trans asetilazın spesifik bir lizinin ε-amino grubuna amid bağıyla bağlanır; bu lipoillizin (lipoamid) olarak adlandırılır. 18
26 3 N 3 S S S S N S 2 S 3 TPP' in tiyazol halkasinin hidroksietil türevi Lipoik asidin disülfid halkasi TPP' in serbest tiyazol halkasi 6-Asetil dihidrolipoik asit Şekil Tiaminpirofosfatın hidroksietil türevinden bir asetil grubunun ve hidrojen atomlarının lipoik asit üzerine taşınması Kobalamin (B12 vitamini) Normal koşullarda izole edildiğinde siyanokobalamin olarak adlandırılan B12 vitamini iki kısımdan ibarettir. Bunlardan birisi hemoglobinin porfirin halka sistemine benzeyen korrin halka sistemidir. em grubundan farklı olarak dört pirol halkasından ikisi birbirine metenil köprüsü olmaksızın doğrudan bağlıdır. alka sisteminin içinde merkezi pozisyonda bulunan kobalt (o +3 ), dört pirol halkasının azot atomlarından birindeki hidrojenin yerine geçmiş ve diğer üç azot atomu ile koordine kovalent bağ meydana getirmiştir. B12 vitamininin ikinci bileşeni; D riboza, α N glikozid bağı ile bağlanmış 5,6 dimetilbenzimidazol bazıdır. Ribonükleotid; diğer azot atomuyla kobalta (o +3 ) bir koordinasyon bağı, 3' fosfat grubu ile de korrin halkasının yan zincirine bir ester bağı ile bağlanır. Kobaltın altıncı koordinasyon yerinde bir siyanür anyonu bağlanmışsa, siyanokobalamin adını alır. Koenzim B12 de siyanür ligandı yerine 5' deoksiadenozil grubu geçmiştir. Bu bileşikte 5'-deoksiadenozil grubunun 5 atomu merkezdeki kobalt atomuna kovalent bir bağla bağlıdır (Şekil 8.15.).B12 vitamini kobalt içeren ilk doğal üründür. ayvanlar ve bitkiler B12 vitamini sentezleyemez ancak belirli mikroorganizmalar sentezleyebilir. Besinlerde bulunan B12 vitamini, mide öz suyunda bulunan intrinsik faktör adı verilen bir glikoproteine bağlanarak ince bağırsaktan emilir ve daha sonra transkobalamin proteinince bağlanarak dokulara taşınır. Koenzim B12, değişik enzimlerin etkileri için gereklidir. Koenzim B12 nin katıldığı enzimatik reaksiyonlarda, substrat molekülünün bir karbon atomuna bağlı bir hidrojen atomunun komşu karbona 1,2 kayması gözlenir. Aynı zamanda hidroksil, amino, alkil veya karboksil gibi gruplar farklı olarak 2,1 kayması gösterir. 19
27 koenzim B X X Bu reaksiyon mekanizması henüz tam olarak aydınlatılamamıştır. B12 vitamininin katıldığı ikinci bir sınıf enzimatik reaksiyonda koenzim B12 türevi olan metilkobalamin, N 5 metiltetrahidrofolat ile birlikte bir metil grubunun belirli akseptör moleküllere taşınmasında taşıyıcı rolü oynar. Bu akseptör moleküllerin başında metiyonine dönüşen homosistein gelir. Bakterilerde metiyonin sentazın bir şekli metil vericisi olarak N 5 metiltetrahidrofolat kullanır (Şekil 8.12.). Bakteri ve memelilerde bulunan metiyonin sentazın diğer şekli ya N 5 metiltetrahidrofolatı ya da koenzim B12 türevi olan metilkobalamini kullanır. Metilkobalaminin metil grubu N 5 metiltetrahidrofolattan gelir. B12 vitamini etkisini gösteren maddeler en çok karaciğer ve böbrekte olmak üzere et, süt (yoğurt, peynir), yumurta ve balıkta bulunur. B12 vitamini eksikliğinde unutkanlık, yorgunluk ve halsizlik gözlenir. B12 vitamini, böbrek kanamaları ve karaciğer hastalıklarının önlenmesinde etkilidir. B12 vitamini eksikliği, persiniyöz anemiye neden olur. Persiniyöz anemide diyetsel bir eksiklik söz konusu değildir ve gastrointestinal kanaldan vitaminin emilim kusuru yüzünden eksiklik vardır. Mide mukozasında normalde sentezlenen, bağırsaktan B12 vitamini emilimi için gereken intrinsik faktör denilen glikoproteinin yokluğu bu duruma sebep olur. Bundan dolayı persiniyöz anemi tedavisinde parenteral (sindirim kanalı dışında diğer bir yol) yoldan B12 vitamini vermek gerekir. 20
28 N N 5'-Deoksi adenozin N N 2 N 2 N 2 -N R N N N N o +3 3 N N 3 2 N N 2 Korin halka sistemi N N 2 Amino izopropanol 3 3 N P Dimetilbenzimidazol ribonükleotid 3 N 2 Şekil B 12 vitamini ve türevleri. Siyanokobalaminde R siyanürdür. Deoksiadenozilkobalaminde (koenzim B 12) R, bir 5' deoksiadenozil grubudur. B 12 vitamini Robert Woodward ın başında bulunduğu araştırma grubu tarafından sentezlenmiştir. Bu başarısından dolayı Woodward 1965 Kimya Nobel ödülünü almıştır. 21
29 vitamini (Askorbik asit) Yapı itibariyle en basit vitaminlerden biri olan vitamini bir şeker asidinin laktonudur. Birçok hayvansal organizma ve bitki askorbik asidi glukozdan ve diğer basit ön basamaklardan sentezleyebilir. vitamini insan dahil bazı omurgalılar için esansiyeldir. Bazı hayvan türleri örneğin maymun, bazı kuşlar ve bazı balıklar glukonolakton oksidaz enzimine sahip olmadıkları için askorbik asit sentezi yapamazlar ve diyetle almak zorundadırlar. L Askorbik asit, kolayca hidrojen atomu veren ve L dehidroaskorbik aside dönüşen kuvvetli bir indirgen yani antioksidanttır. L Dehidroaskorbik asit de vitamini etkisine sahiptir. Bu aktivite dehidroaskorbik asidin lakton halkasının diketogulonik aside hidroliziyle kaybolur (Şekil 8.16.) e L-Askorbik asit 2 L-Dehidroaskorbik asit Şekil Askorbik asit ve türevleri. 2 L-Diketogulonik asit Besinlerin ısıtılması sırasında askorbik asit vitamini aktivitesini büyük ölçüde kaybeder. Vitaminler içerisinde en kararsız olanı vitaminidir ve gıdaların hazırlanması ve depolanması sırasında da bozunur. Diğer suda çözünen vitaminlerle karşılaştırıldığında, askorbik asit hayvansal ve bitkisel dokularda oldukça yüksek konsantrasyonda mevcuttur. İnsan kan plazması 100 ml de 1 mg kadar askorbik asit içerir ve 0.4 mg a düşerse eksikliği söz konusudur. Günlük vitamini ihtiyacı mg dır. Narenciye ürünleri ve domates vitamininin en zengin kaynaklarıdır. Kuşburnu, çilek, yeşil sebzeler (ıspanak, maydanoz, biber, vb.) ve meyveler de askorbik asit bakımından zengindir(tablo 8.3.). 22
30 Tablo 8.3. Bazı gıdaların vitamini içeriği Besin maddesi Askorbik asit (mg/100g) Kuşburnu 200 Portakal 50 Limon 50 Ispanak 60 Domates 24 Marul 15 Patates (çiğ) 30 Elma 20 avuç 6 Süt 2.4 Dokularda askorbik asit konsantrasyonu nispeten fazla olmasına ve basit yapısına rağmen, vitamin olarak esas önemi henüz bilinmemektedir. vitamini kofaktör olarak prolinin hidroksiproline enzimatik hidroksilasyonu gibi hidroksilasyon reaksiyonlarına ve katekolamin vb. sentezine katılır ancak bu reaksiyonlar için hiçbir spesifitesi yoktur. Askorbik Asidin Biyolojik Fonksiyonu 1. vitamini kılcal damar duvarlarının geçirgenliğini azaltır. Yeterli vitamini alamayan insanlarda; vitamin eksikliğine bağlı olarak bağ dokuyu oluşturan kollagen sentezlenemediğinden ciddi bir hastalık olan skorbüt gelişir. Şişmiş ve kanayan diş etleri, sallanan dişler, eklem ağrıları, deri altı kılcal damarlarda çatlamalar ve yaraların yavaş iyileşmesi bu hastalığın belirtilerindendir de bu hastalığı iyileştiren faktörün limon suyunda bulunan vitamini olduğu gösterilmiştir. 2. Bazı aminoasitlerin metabolizması ve folik asidin etkin duruma geçmesi için gereklidir. 3. Kuvvetli indirgendir. Antioksidant aktivitesinden dolayı vücudu zehirlenme ve enfeksiyonlara karşı korur. 4. a +2 ve Fe +2 iyonlarının emilimini kolaylaştırır. 23
31 8.2. YAĞDA ÇÖZÜNEN VİTAMİNLER Yağda çözünen A, D, E ve K vitaminlerinin hepsi de izopren birimlerinden meydana gelmişlerdir. Yağda çözünen vitaminlerin spesifik biyolojik fonksiyonları hakkında suda çözünen vitaminlere göre daha az şey bilinmektedir. Şimdiye kadar yağda çözünen vitaminlerin hiçbirisi için spesifik bir koenzim fonksiyonu bulunamamıştır. Bu vitaminlerden sadece A ve D vitaminleri etkisinin moleküler mekanizması tanımlanabilmiştir A vitamini A vitamini doğada iki yaygın şekliyle mevcuttur. Memeli dokularında ve deniz suyu balıklarında A1 vitamini(retinol); tatlı su balıklarında A2 vitamini(retinol2) şeklinde bulunur (Şekil 8.17.). er iki A vitamini de, altı üyeli bir karbon halkası ve 11 karbonlu bir yan zincirden oluşur A 1 vitamini 2 A 2 vitamini Şekil A 1 vitamini (retinol), A 2 vitamini (retinol 2). A 2 vitamini 3' ve 4' nolu karbonlar arasında ek bir çift bağ içermektedir. avuç, patates ve diğer sebzelerin karakteristik rengini veren β karoten adlı pigment, omurgalılarda enzimatik olarak A vitaminine dönüşebilir. Simetrik bir yapıya sahip olan α-, β, ve γ-karotenler, bağırsak zarında ve karaciğerdeki enzimatik reaksiyonlarla ortadan ikiye bölünür ve iki molekül A1 vitamini (retinol) meydana gelir (Şekil 8.18.). 24
32 3 3 Aldehidin aside oksidasyonu Retinoik asit (d) Epitel hücrelere hormonal sinyal Görünür IsIk. 3 3 KIrIlma NoktasI Alkolün aldehide oksidasyonu Beyine nöronal sinyal A 1 vitamini (Retinol) (b) 11-cis-Retinal (görme pigmenti) (c) tüm-trans-retinal (e) karoten (a) Şekil (a) β karoten, A vitamininin öncülüdür. (b) β-karotenin parçalanması iki molekül A 1 (retinol) ortaya çıkarır. (c) 15 deki oksidasyon retinolü, retinale dönüştürür. (d) Daha ileri oksidasyon sonucunda, derideki gen ifadelenmesini düzenleyen bir hormon olan retinoik asit üretilir. Retinal, opsin proteini ile birleşerek, doğada birçok canlı tarafından görme pigmenti olarak kullanılan rodopsini oluşturur. Karanlıkta, rodopsinin retinali 11 cis retinal(c) şeklindedir. Rodopsin molekülü, görünür ışık tarafından uyarıldığında, 11 cis retinal bir seri fotokimyasal reaksiyonla tüm trans-retinale (e) çevrilerek, bütün rodopsin molekülünün şeklinde bir değişikliğin oluşmasına sebep olur. murgalı retinasının rod (çubuk) hücresindeki bu değişim, beyine görsel iletimin temeli olan bir elektriksel sinyal gönderir. Retinol, memeli hayvan dokularında bulunur ve kanda uzun zincirli yağ asidiyle ester oluşturarak taşınır. A vitamini (retinol) nin çeşitli şekilleri, hormon olarak ve omurgalıların görme pigmentleri (Şekil 8.18.) olarak görev yapar. ücre çekirdeğindeki reseptör proteinler aracılığıyla etki eden A vitamini türevi retinoik asit, deriyi de içeren epitelyum dokuların gelişmesindeki gen ifadelenmesini düzenler. Retinoik asit, şiddetli akne ve buruşuk cilt 25
33 tedavisinde kullanılan ilacın (Retin A) aktif maddesidir. A vitamini türevi olan retinal, retinadaki çubuk (rod) ve tıpa (kon) hücrelerinin ışığa tepkilerini başlatan ve beyine giden sinir uyarısı oluşturan pigmenttir. A vitamininin genel biyolojik fonksiyonunun belirlenmemesine karşılık, omurgalıların görme olayındaki rolü hakkında sağlam bilgiler vardır. A vitamininin omurgalıların görme olayındaki rolü şöyle açıklanabilir: 1. Retinada (Ağ tabaka) fotoreseptör hücrelerin bir pigmenti vasıtasıyla ışık enerjisi absorplanır, bu sırada bir fotokimyasal ürün meydana gelir, 2. Bu fotokimyasal ürün vasıtasıyla bir sinir impulsu ortaya çıkar, 3. Görme renk maddesi ışığa hassas şekline tekrar döner (Şekil 8.19.). IsIk. enerjisi Rodopsin (glikoprotein) psin 11-cis-Retinal (Protein) tüm-trans-retinal NAD+ + NAD+ + Retinol redüktaz Retinol redüktaz NAD + 11-cis-Retinol Retinol izomeraz NAD + tüm-trans-retinol Şekil Çubuk hücrelerde görme siklüsü (çevrimi). Diğer memeli hayvanlarda olduğu gibi insan gözü ağ tabakasında ışığa hassas iki farklı fotoreseptör hücre bulunur. Çubuk(rod) lar zayıf ışık şiddetini algılayacak yapıda olup, hiçbir rengi ayırt edemezler. Bu hücreler gece görmekten sorumludur ve A vitamini eksikliğinden etkilenirler. Buna karşılık tıpa şeklinde olanlar (koniler) rengi algılarlar ve kuvvetli ışığa uyum sağlarlar. Ağ tabakanın çubuk hücreleri birbiri üzerine kümelenmiş membran vezikülleri şeklinde, retinanın ışığa hassas yüzeyinde paralel sıralanmışlardır. Bu veziküllerin membran proteinlerinin yaklaşık yarısı, ışık absorplayan rodopsin proteininden (M.A ) ibarettir. Çubuk hücrelerde en önemli ışık reseptörü olan rodopsin, opsin proteini ve ona çok sıkı bağlı 11 cis retinalden meydana gelmiştir. 26
34 Rodopsinin opsin ve tüm trans retinalden rejenere edilmesi için, tüm trans retinol, 11 cis retinal izomerine dönüştürülmelidir. Böylece oluşan 11 cis retinal tekrar opsinle birleşerek rodopsini meydana getirir. Görme olayının son kısmında, ağ tabakada rodopsin molekülünün beyazlamasıyla sinir impulsu oluşur ve bu da beyinde özel ışık olarak algılanır. A vitamini eksikliğinde sadece retina değil memeli organizmanın bütün dokuları etkilenir. A vitamininin a +2 iyonlarının belirli membranlar arasından taşınmasında önemli rol oynadığı düşünülmektedir. A vitamini eksikliği genç hayvanlarda; büyüme geriliğine, kemik ve sinir sisteminin doğru gelişmemesine sebep olur. Deri kurur ve kalınlaşır, böbrekler ve değişik bezler dejenerasyona uğrar ve kısırlık görülür. İnsanlarda, A vitamini eksikliğinin çok çeşitli belirtileri vardır. Bunlar deride, gözlerde ve mukozada kuruluk, gelişme ve büyüme geriliği ve genellikle A vitamini eksikliğinin tanısında kullanılan erken bir belirti olan gece körlüğüdür. A vitamini eksikliğinden en fazla etkilenen gözlerdir. İnsanlar daha basit öncül maddelerden retinal oluşturamazlar, bu nedenle retinali diyetle A vitamini şeklinde almaları gerekir. A vitamini, ilk kez balıkların karaciğer yağından izole edilmiştir. Karaciğer, yumurta, süt ve tereyağı iyi birer A vitamini kaynağıdır. İnsanın günlük A vitamini ihtiyacı 1 mg ın altındadır. Bu ihtiyaç büyük ölçüde salata, ıspanak, patates gibi karotence zengin yeşil ve sarı bitkisel besinlerden karşılanır. A vitamininin fazla alınması toksiktir; karaciğerde depolanarak hasara ve çocuklarda kolay kırılan kemiklere sebep olur D vitamini D vitamini etkisi gösteren on kadar farklı bileşik bilinmektedir. D vitaminlerine kalsiferoller de denir. En önemli olanları D2 vitamini (ergokalsiferol) ve D3 vitamini (kolekalsiferol) dür. Bu bileşikler B halkası açılmış steroidler olarak düşünülebilir. D2 vitamininin ön maddesi (provitamini) maya ve bitkilerde bulunan ergosterol ve D3 vitamininin provitamini ise kolesterol sentezi ara bileşiği olan 7 dehidrokolesteroldür. Bu provitaminler UV ışınlarının etkisiyle B halkasının açılması sonucu vitamin türevlerine dönüşür (Şekil 8.20). 27
35 A B Ergosterol D (a) UV 2 3 D 2 vitamini (ergokalsiferol) UV 2 basamak deride Dehidrokolesterol D 3 vitamini (Kolekalsiferol) Karacigerde - 1 basamak Böbrekte 1 basamak (b) 1,25-Dihidroksikolekalsiferol Şekil (a) D 2 vitamininin provitamininden oluşumu, (b)d 3vitamininin provitamininden oluşumu ve metabolizması.kolekalsiferol (D 3vitamini), deride 7 dehidrokalsiferolün UV ışınına maruz kalmasıyla üretilir. Karaciğerde, 25 e bir hidroksil grubu eklenir. Böbrekte de 1 deki ikinci bir hidroksillenme; aktif bir hormon olan 1,25 dihidrokolekalsiferolü üretir. Bu hormon, böbreklerdeki, bağırsak ve kemiklerdeki kalsiyum metabolizmasını düzenler. 28
36 Yetişkin bir insanın D vitamini ihtiyacı günlük 20 µg dır. D vitamini, karaciğerde depolanır ve haftalarca kullanılabilir. D vitamini eksikliği hatalı kemik oluşumuna yol açar. A vitaminin de olduğu gibi, D vitamininin aşırı alınması da kemik iskeletinin kırılabilirliğini artırır. Bu gözlemler her iki vitaminin kalsiyumun biyolojik taşınması ve depolanmasında rol oynadığını göstermektedir. D vitaminleri, kalsiyum ve fosfat iyonlarının ince bağırsaktan emilmesini hızlandırırlar. D3 vitamininin kendisi biyolojik olarak etkin değildir. Fakat karaciğerde ve böbreklerdeki enzimler tarafından bağırsaktaki kalsiyum emilimini, kemikler ve böbreklerdeki kalsiyum seviyelerini düzenleyen bir hormon olan 1,25 dihidrokolekalsiferole çevrilir (Şekil 8.20.). Daha sonra bu hormon kan yoluyla geldiği bağırsak mukozası hücrelerine etki ederek kalsiyum iyonlarının emilmesini kolaylaştırır. Bu sırada fosfat iyonlarının emilmesi de elektronötrallikten dolayı kendiliğinden artar. D vitamini metabolizması ürünü olan 1,25 dihidrokolekalsiferol; steroid hormonları gibi gen ifadelenmesini düzenler. Örneğin, a +2 bağlayan bir protein sentezini harekete geçirir. a +2 iyonlarının emilmesi, bağırsak mukozasında sentezlenen taşıyıcı bir protein tarafından kolaylaştırılır. 1,25 dihidrokolekalsiferolün rolü parathormon etkisiyle sınırlıdır. a +2 konsantrasyonu normalin altına düşerse; paratiroid bezinden parathormon salgılanır. Bu hormon böbreğe etki ederek 1,25 dihidrokolekalsiferol oluşumunu uyarır. rganizmaya yeteri kadar kalsiyum alınmazsa, 1,25 dihidrokolekalsiferolün kemiklerden kalsiyum ve fosfat iyonlarının mobilizasyonunu hızlandırma etkisi de görülür. Plazma kalsiyum düzeyi 9 10 mg/100ml arasında tutulmalıdır. Bu düzeyin altında tüm kaslarda (solunum kasları da dahil) tetanik kasılmalar, kramplar görülür, ölüm oluşur. a +2 iyonları, kalsiyum tuzları, 3a3(P4)2.a()2 şeklinde kemiklerde tespit edilir, dolayısıyla büyümeyi yani iskelet sisteminin normal gelişmesini sağlar. Raşitizmde, bilhassa uzayan kemikler de çarpıklıklar, normal gelişememe ve eklemlerde şişlikler görülür. Güneşle temas edenlerde raşitizm daha az görülür. D2 vitamini (ergokalsiferol), mayada bulunan ergosterolün UV ışığına maruz tutulmasıyla oluşturulan ticari bir üründür. D2 vitamini D3 vitaminine benzer, sterol halkasına bağlı zincirde ufak değişiklikler vardır. D2 vitamini genelde besinsel destekleyici olarak süte ve tereyağına eklenir. D vitaminleri en çok balıkların karaciğer yağlarında, bundan başka az miktarda yumurta sarısı, süt ve tereyağında bulunur. D2 provitamini olan ergosterol mantar ve mayalarda, D3 provitamini olan 7 dehidrokolesterol ise deri altındaki yağda bulunmaktadır. 29
37 E vitamini E vitamini etkisi gösteren α, β, γ, δ vb. tokoferoller olarak adlandırılan sekiz bileşik bilinmektedir. Bütün tokoferoller tokol türevleridir. Tokoferoller bir kroman halka sistemi ve izoprenoid bir yan zincir içerir. Kroman halka sistemi, bir benzen halkası ile bir piran halkasının kondenzasyonundan meydana gelir. Tokoferoller içinde en bol bulunan ve en aktif olan α tokoferoldür (Şekil 8.21.). Kroman halka sistemi izoprenoid Tokol Tokoferol (5,7,8-trimetiltokol) Tokoferol (5,8-dimetiltokol) 3 -Tokoferol (7,8-dimetiltokol) Şekil Tokol ve bazı türevleri. Tokoferoller hidrofobik oldukları için, hücre zarlarıyla, lipid depolarıyla ve kandaki lipoproteinlerle yakından ilişkilidir. E vitamini (tokoferoller) biyolojik antioksidantlardır, lipoproteinlerdeki lipid oksidasyonunu önlemede belirleyici rol oynar. α-tokoferol bu etkiden sorumlu esas E vitaminidir. Çünkü peroksi radikallerinin en yaygın ve en iyi temizleyicisidir. Aromatik halka, oksijen radikalleri ve diğer serbest radikallerle reaksiyona girip onları yok ederek; doymamış yağ asitlerini oksidasyondan korur ve hücre parçalanmasına neden olabilecek membran lipidlerinin oksidatif hasarını engeller. Tokoferollerin, doymamış yağ asitlerinin oksidasyonunu azalttığı belirlenmiştir. Bu gibi oksidasyonlar doymamış yağ asitlerinin polimerleşmesine sebep olur. Gerçekten, hayvanlarda tokoferol eksikliğinin bazı belirtileri, antioksidant özellikli bileşiklerle de giderilebilir. Normal olarak dokularda 30
38 doymamış yağların hiçbir oksidasyon ürünü görülmez. Ancak E vitamini eksikliğinde bu durum yağ depo yerlerinde görülebilir. Tokoferollerin biyolojik fonksiyonları henüz tam olarak aydınlatılamamıştır. Diyetlerinde, az miktarda E vitamini verilen laboratuvar hayvanlarında; deride pul pul dökülme, kaslarda güçsüzlük ve yıkım ve kısırlık görülür. E vitamini eksikliğinin insanda kısırlığa sebep olup olmadığı bilinmemektedir. E vitamini eksikliği insanlarda oldukça nadirdir. Başlıca belirtisi, eritrositlerin parçalanmaya yatkın olmasıdır. Tokoferoller en çok yumurta ve bitkisel sıvı yağlarda (mısır özü, soya yağı) özellikle buğday tohumunda, cevizde boldur. Süt ve süt ürünlerinde, yeşil yapraklı bitkilerde bulunur. Et ve meyvede çok az vardır K vitamini Naftokinon halkası ihtiva eden K vitamininin etkisini gösteren doğal ve sentetik birçok bileşik vardır. K1 ve K2 vitamini şeklinde gösterilen iki doğal K vitamini bilinmektedir. K2 vitamini aktif şekil olarak görünmektedir. Sentetik K vitamini olan K3 vitamini (diğer adıyla menadion) uzun yan zincire sahip değildir (Şekil 8.22.) [ ] K 1 vitamini ( 2 2 ) n K 2 vitamini (n=6,7,8,9 veya 10) Şekil K vitaminleri. K 3 vitamini Laboratuvar hayvanlarında ve diğer memelilerde K vitamini eksikliğinin belirlenmesi çok zordur. Çünkü bu vitamin söz konusu canlıların bağırsak bakterilerince sentezlenebilir. K vitamini eksikliğinin bilinen tek sonucu, karaciğerde prokonvertin enziminin biyosentezinin meydana gelmemesidir. Bu enzim protrombin oluşumu reaksiyon serisinde bir basamağı katalizler. Protrombin, trombinin ön maddesidir. Trombin, bir kan plazma proteini olan fibrinojendeki bazı peptid bağlarını kırarak; kan pıhtılarını bir arada tutan ve suda 31
39 çözünmeyen bir fibröz protein olan fibrine dönüşmesini sağlayan bir proteolitik enzimdir. K vitamini eksikliğinin kanın pıhtılaşmasını yavaşlattığı keşfedilmiştir; bu durum ölümcül olabilir. K vitamini eksikliği, insanlarda az rastlanan bir durumdur. Bu yüzden K vitaminine bir pıhtılaşma faktörü olarak da bakılmaktadır. K vitaminine benzer bir bileşik olan dikumarol (Şekil 8.23.a.) hayvanlarda K vitamini etkinliği bloke ettiğinden, klinikte pıhtılaşmanın azaltılması için kullanılmaktadır. Warfarin (Şekil 8.23.b.) karaciğerde aktif protrombin oluşmasını inhibe eden bir bileşiktir. Özellikle farelere karşı zehirlidir, iç kanama sonucu ölüme sebep olur. Bu güçlü rodentisit, aynı zamanda cerrahi hastalar ve kroner trombozlu kişiler gibi kan pıhtılaşması riski yüksek olan insanların tedavisinde kullanılan antikoagulant bir ilaçtır. 2 (a) 2 3 (b) Şekil (a) K vitamininin antagonisti olan dikumarol (K vitamininin tersi etkiye sahip), (b) Bir kan antikoagulanı olan Warfarin. K vitamini birçok mikroorganizmalar ve çoğu bitkiler tarafından sentezlenebildiği ve bütün organizmaların dokularında bulunduğu için, kan pıhtılaşmasının yanında başka genel bir görevi olup olmadığı sorusu ortaya çıkmaktadır. Bazı araştırmalar K vitamininin hayvansal dokularda bazı spesifik elektron transport yollarında koenzim fonksiyonu yaptığını göstermektedir. K vitamini hidrokinona dönüşümlü indirgenebilen bir kinon olduğu için, elektron taşıyıcısı görevini üstlenmesi mümkün gözükmektedir. K1 ve K2 vitaminleri birlikte bulunur. K1 vitamini, yeşil bitki yapraklarında özellikle ıspanak ve maydanozda bulunur. Ayrıca lahana, karnabahar, domates, soya fasulyesi, pirinç kepeği ve yulaf filizlerinde de bulunur. K2 vitamini, omurgalıların bağırsaklarında yaşayan bakteriler tarafından üretilir. 32
40 9. BÖLÜM: METABLİZMA VE BİYENERJETİK Geçen bölümlerde, canlı organizmalarda bulunan biyomoleküllerin yapı, çeşit ve özellikleri anlatılmıştı. Şimdi sıra biyokimyanın en önemli iki sorusunun cevaplandırılmasına gelmiştir. 1. ücreler çevrelerinden enerji ve indirgeyici gücü nasıl elde ederler? 2. ücreler kendi makromoleküllerinin yapı taşlarını nasıl sentezlerler? İşte bu iki sorunun cevabını teşkil eden son derece karmaşık kimyasal reaksiyonların tümüne birden metabolizma adı verilir. Metabolizma, çoklu enzim sistemlerinin (metabolik yollar) görev yaptığı çok düzenli hücresel bir aktivite olup; şu dört işlevi yerine getirmektedir: 1. Güneş enerjisinden veya çevredeki yüksek enerjili besinleri parçalayarak kimyasal enerji elde etmek, 2. Besin moleküllerini, makromoleküllerin öncül bileşikleri de dahil olmak üzere hücrenin kendi karakteristik moleküllerine dönüştürmek, 3. Monomerik öncül bileşiklerin makromoleküllere polimerizasyonu sonucunda proteinler, nükleik asitler ve polisakkaritleri oluşturmak, 4. Özel hücresel işlevler için membran lipidleri, hücre içi haberciler, pigmentler gibi biyomoleküllerin sentezi ve yıkımını sağlamak. anlı organizmada meydana gelen kimyasal olayların tümü metabolizmayı oluşturur. Metabolizmada değişik enzimlerle katalizlenen yüzlerce reaksiyon bulunmakla birlikte, bizim ilgi odağımız canlının tüm formlarında önemli ölçüde benzerlik gösteren ve az sayıda olan merkezi metabolik yollar olacaktır. E. coli gibi basit bir organizmada bile bin kadar kimyasal reaksiyon olmaktadır. Yüksek canlı yapılarını göz önüne aldığımızda biyokimyasal reaksiyonların sayısı büyük rakamlara ulaşır. Bununla birlikte, bu reaksiyon çokluğunun yanı sıra reaksiyon çeşitlerinin o kadar çok olmadığı görülür. Bu reaksiyonların mekanizmaları da oldukça basittir. Örneğin bir çift bağ genellikle dehidratasyon yoluyla oluşur. Bütün canlı çeşitlerinde yalnız 100 kadar molekül anahtar rol oynar. Metabolik yollar ortak tarzda düzenlenirler. Bu bölümde, metabolizmanın genel prensipleri ve motifleri biyoenerjetik adı verilen ve canlı organizmadaki enerji dönüşümlerini kapsayan temel ilkelerle beraber ele alınacaktır. Önce hücre hayatı için gerekli olan karbon ve enerji kaynakları ile ilgili bir sınıflandırma yapılıp; daha sonra karbon ve azot devirleri (çevrimleri) açıklanacaktır. 33
41 9.1. ÜRELERİN KARBN VE ENERJİ KAYNAKLARI anlı organizmalar çevreden aldıkları karbon atomunun kimyasal şekline bağlı olarak iki büyük gruba ayrılırlar: totroflar ve heterotroflar. totroflar (fotosentetik bakteri ve yüksek bitkiler gibi) karbon kaynağı olarak yalnız atmosferdeki karbondioksiti kullanarak karbon içeren biyomolekülleri oluştururlar (Şekil 9.1.). Siyanobakteriler (mavi yeşil algler) gibi bazı ototrof organizmalar, atmosferik azotu da kullanarak tüm azotlu bileşikleri sentezlerler (Şekil 9.3.). eterotroflar, atmosferik karbondioksiti kullanamadıkları için karbonu, çevrelerinden glukoz gibi daha kompleks organik moleküllerden sağlarlar. Yüksek hayvan hücreleri ve mikroorganizmaların çoğu heterotroftur. totrof hücreler ve organizmalar, kendi kendilerine yeterken; heterotrof hücreler ve organizmalar karbonu daha karmaşık yapılardan alabildikleri için diğer hücrelerin ürünleriyle beslenmek zorundadırlar. ücreler enerji kaynaklarına göre de sınıflandırılabilir. Enerji kaynağı olarak ışığı kullanan hücrelere fototrof, indirgenme-yükseltgenme reaksiyonunu kullananlara da kemotrof hücreler adı verilir. Kemotroflar, enerji elde etmek için yükseltgedikleri elektron vericilerinin doğasına göre de ikiye ayrılırlar: Elektron vericisi olarak glukoz gibi kompleks organik bileşiklere ihtiyaç duyan kemotroflara kemoorganotroflar; 2, 2S, N3 ve S gibi basit inorganik elektron vericileri kullananlara da kemolitotroflar denilir. Benzer sınıflama fototrof hücreler için de söz konusudur. Tablo 9.1. de bütün hücrelerin enerji ve karbon kaynaklarına göre; fotolitotrof, fotoorganotrof, kemolitotrof ve kemoorganotrof grupları altında sınıflandırılması yapılmıştır. rganizmaların büyük çoğunluğu fotolitotrof veya kemoorganotroftur; diğer iki grupta nispeten çok az sayıda tür vardır. Fakat kemolitotrof grubundaki organizmalardan moleküler azotun fiksasyonunu ve amonyağın nitratlara oksitlenmesini sağlayan toprak mikroorganizmalarının canlı kürede çok önemli rolleri vardır. Bu arada yeryüzündeki canlıların hemen hemen yarısının mikroorganizmalardan ibaret olduğunu ve bunların büyük bir çoğunluğunun toprak ve denizlerde yaşadığını hatırlatmakta fayda vardır. 34
42 Tablo 9.1. rganizmaların karbon ve enerji kaynaklarına göre sınıflandırılması. rganizma Tipi Karbon Kaynağı Enerji Kaynağı Elektron Vericisi Fotolitotroflar 2 Işık İnorganik bileşikler ( 2, 2S, S) Fotoorganotroflar rganik Işık rganik bileşikler bileşikler Fototroflar Örnek Yüksek bitkilerin hücreleri, mavi-yeşil algler, fotosentetik bakteriler Nonsülfür mor bakteriler Kemotroflar Kemolitotroflar 2 İndirgenmeyükseltgenme reaksiyonları Kemoorganotroflar rganik bileşikler İndirgenmeyükseltgenme reaksiyonları İnorganik bileşikler ( 2, 2S, S, Fe +2, N 3) rganik bileşikler (glukoz vb.) idrojen, kükürt, demir ve denitrifiye bakteriler. Bütün yüksek hayvanlarla, mikroorganizmaların çoğu ve fotosentetik olmayan bitki hücreleri eterotroflar, aynı zamanda aerobik ve anaerobik hücreler şeklinde de sınıflandırılabilir. Aerobik hücreler organik bileşikler tarafından verilen elektronların son alıcısı olarak oksijen kullanan, anaerobik hücreler ise elektron alıcısı olarak oksijen dışında bir bileşik kullanan organizmalardır. Birçok hücre hem aerobik hem de anaerobik halde yaşayabilir. Bunlara fakültatif organizmalar adı verilir. eterotrofik hücrelerden çoğu, bilhassa yüksek organizmaların hücreleri fakültatiftir. erhangi bir canlı organizmanın bütün hücreleri aynı sınıftan olmayabilir. Mesela yüksek bitkilerin klorofil ihtiva eden yaprakları fotosentetik ototrof iken, kök hücreleri heterotroftur. Aynı zamanda yeşil yaprak hücrelerinin çoğu gün ışığında ototrof olarak davranırken, karanlıkta heterotroftur KARBN VE AZT DEVRİ Tabiattaki canlı organizmalar beslenme yönünden birbirlerine bağımlıdır. Eğer canlı küreyi geniş anlamda ele alırsak, fotosentetik ve heterotrof hücrelerin birbirlerini besledikleri gözlenir. Biyosferde ototrof ve heterotroflar birlikte yaşarlar. totrof organizmaların çoğu fotosentetik olup enerjilerini güneş ışığından, heterotroflar ise ototrofların ürettikleri organik ürünleri parçalayarak elde ederler. Fotosentetik hücreler atmosferdeki 2 den glukoz gibi organik bileşikler sentezlerken, dışarıya 2 verir. eterotrof hücreler ise, bu glukoz ve 2 yi kullanarak atmosfere 2 bırakır (Şekil 9.1.). Biyosferdeki karbon devri, bir enerji akımıyla beraberce seyreder. Fotosentezde, güneş enerjisi, glukoz ve diğer indirgenmiş ürünlerdeki kimyasal enerjiye dönüştürülür. Bu bileşikler de heterotroflar tarafından enerji isteyen aktivitelerinde kullanılır (Şekil 9.2.). Bu şekilde karbon, oksijen ve su; heterotrof ve ototrof 35
43 organizmalar arasında güneş enerjisinin de eşliğinde sabit devir oluştururlar. Böylece ister ototrof isterse fototrof olsun, bütün organizmalar için nihai enerji kaynağı güneş enerjisidir. Güneş enerjisi Glukoz 2 Fotosentetik ototroflar ENERJİ eterotroflar 2 2 Isı, entropi (kullanılmayan enerji) Şekil 9.1. Biyosferdeki karbon ve oksijen devri. anlılarda enerji dönüşümlerinde iki yapı önem kazanır: Yeşil bitkilerde kloroplastlar, hem bitki hem de hayvan hücrelerinde mitokondriler. anlı sistemlerde enerji dönüşümleri: 1. Güneş enerjisi, fotosentezle kimyasal enerjiye dönüşür, 2. Karbohidrat ve diğer moleküllerin kimyasal enerjisi, solunumla ATP de fosfat bağı enerjisine dönüşür, 3. Fosfat bağı kimyasal enerjisi, canlıların kullandığı serbest enerjiye dönüşür. 36
44 Fotosentez Güneş enerjisi Kimyasal enerji (ATP, NADP, glukoz) Mekanik hareket Taşıma Biyosentez Kullanılmayan enerji (Isı, entropi) Şekil 9.2. Biyosferdeki enerji akımı. Enerji, biyosferde bir devir oluşturmaz daha ziyade bir yöne doğru akar. Biyolojik enerji akımı büyük miktarlarda enerjiyi gerektirmektedir. Biyosferde yılda yaklaşık kalorilik güneş enerjisi fotosentez hücreleri tarafından alınmakta ve bununla yaklaşık 4 x ton karbon indirgenerek heterotroflara enerji ve biyomolekül yapı taşı kaynağı temin edilmektedir. Tüm canlı organizmalar; aminoasitler, nükleotidler ve diğer azotlu bileşiklerin sentezi için gerekli bir azot kaynağına muhtaçtırlar. Bitkiler genel olarak amonyak veya çözünür nitratları tek azot kaynağı olarak kullanırken, omurgalılar azotu aminoasit veya diğer azotlu organik bileşikler şeklinde alırlar. Siyanobakteriler ve bazı bitki köklerinde simbiyotik olarak yaşayan toprak bakterileri gibi az sayıda organizma atmosferik azotu (N2) bağlayarak bunu amonyak şekline çevirir (azot fiksasyonu). Rhizibium bakterileri baklagillerin köklerini işgal ederek nodüller oluşturur ve burada azot fiksasyonu (tespiti) gerçekleşir. Mikroorganizmalar tarafından yılda yaklaşık 2x10 8 ton atmosferik azot (N2) tespit edildiği tahmin edilmektedir. Diğer bakteriler (nitrifiye edici) amonyağı nitrat ve nitrite oksitlerken, bazıları da nitratı nitrite dönüştürürler. Bu şekilde biyosferde karbon ve oksijen devrine ek olarak yüksek oranda azotun çevrimi gerçekleşir (Şekil 9.3.). Biyosferdeki karbon, oksijen ve azot devri; üreticilerin (ototroflar) ve tüketicilerin (heterotroflar) aktivitelerindeki dengeye bağlı olarak tüm canlı türlerinde gerçekleşir. 37
45 Kendi kendine en yeterli hücreler azot fiksasyonu yapabilen ve toprak, temiz su veya okyanusta bulunan siyanobakteriler (mavi yeşil algler) dir. Bu organizmalar enerjilerini güneşten, karbonlarını 2 den ve 2 nin indirgenmesi için elektronları da sudan alırlar. İlk oksijen üreten fotosentetik organizmalar olan siyanobakteriler ortaya çıkıncaya kadar, atmosferde oksijen çok azdı veya hiç yoktu. Denitrifikasyon bakterileri anaerobik şartlarda (toprağın alt tabakalarında) yaşarlar ve nitratı (N3 - ), azot (N2) ve amonyağa dönüştürler. Atmosferik azot (N2) Azot bağlayıcı bakteriler Denitrifikasyon bakterileri Amonyak ayvanlar Nitrifikasyon bakterileri Aminoasitler Nitratlar, nitritler Bitkiler Şekil 9.3. Biyosferdeki azot devri. Atmosferik azot (N 2) dünya atmosferinin yaklaşık % 80 nini oluşturmaktadır BİYENERJETİĞİN İLKELERİ anlı hücrelerin ve organizmaların; yaşamak, büyümek ve üremek için bir iş yapmaları gerekmektedir. Değişik kaynaklardan enerji elde etmek ve bu enerjiyi biyolojik işe çevirmek canlı organizmaların başlıca özelliğidir. Gelişmiş organizmalar, enerjiyi bir formdan başka bir forma dönüştürebilirler. Basit öncül moleküllerden kompleks ancak yüksek oranda düzenliliğe sahip moleküllerin sentezinde, besinlerden elde ettikleri kimyasal enerjiyi kullanırlar. Yakıtlardan elde ettikleri bu kimyasal enerjiyi derişim gradyanı ve elektriksel gradyana, hareket ve ısıya ayrıca ateş böceklerinde olduğu gibi ışığa dönüştürürler. Fotosentez yapan organizmalar ışık enerjisini tüm enerji formlarına çevirirler. 38
46 Enerji çevriminin kimyasal mekanizmasının açıklanması asırlarca biyologların ilgi odağı olmuştur. Biyolojik enerji çevrimleri, tüm doğal olayları idare eden bazı fizik yasalarına göre gerçekleşir. Bir biyokimya öğrencisi için esas olan bu yasaları anlamak ve evrendeki enerji akışına nasıl uygulandıklarını öğrenmektir. Bu bölümde ilk olarak termodinamiğin yasalarıyla; serbest enerji, entalpi ve entropi arasındaki nicel ilişkiyi inceleyeceğiz. Daha sonra biyolojik enerji değişimlerinde ATP nin özel rolünü tanımlayacağız. Son olarak, canlı hücrelerde yükseltgenme-indirgenme reaksiyonlarının önemini, elektron transfer reaksiyonlarının enerjetiklerini ve reaksiyonları katalizleyen enzimlerin kofaktörleri olan elektron taşıyıcılarını inceleyeceğiz Biyoenerjetikler ve Termodinamik Biyoenerjetikler, canlı hücrelerde, doğada ve enerji çevrimlerinin temelini oluşturan kimyasal olaylar sırasında meydana gelen enerji dönüşümlerinin nicel ölçüsüdür. Metabolizma olaylarındaki enerji dönüşümlerini daha iyi anlamak için, bazı termodinamik prensipleri kısaca gözden geçirmek faydalı olacaktır. Biyolojik enerji değişimleri termodinamiğin yasalarına uyar. Evrende hiçbir olay termodinamik yasalara zıt olarak gerçekleşemez. Termodinamik enerji çeşitleri arasındaki dönüşümleri inceleyen bir bilim dalıdır ve maddeyi moleküler seviyede değil de, bir yığın halinde ele alır. Termodinamiğin incelediği madde topluluğuna sistem, sistemin dışındaki her şeye çevre adı verilir. Çevre ve sistemin toplamı evreni (kainatı) oluşturur. Eğer bir sistem, çevresi ile madde ve enerji alışverişi içindeyse açık sistem; madde alışverişi yapmayıp yanlıca enerji alışverişi içindeyse kapalı sistem; her ikisine de kapalıysa yalıtılmış sistem adını alır. anlı hücreler ve organizmalar ise açık sistemler olup; çevreleriyle madde ve enerji alışverişinde bulunurlar. Bir termodinamik büyüklükteki değişim miktarı, o değişimin gerçekleştiği yola yani mekanizmaya bağlı değilse; ona hal fonksiyonu denir. Mesela ileride daha ayrıntılı anlatılacak olan iç enerji (E), entalpi (), entropi (S) ve serbest enerji (G) birer hal fonksiyonudur. Termodinamiğin birinci kanununa göre, bir sistem ve çevresinin toplam enerjileri sabittir. Diğer bir deyimle enerji korunur. Birinci kanunun matematiksel ifadesi; E = E2 E1 = q w şeklindedir. Burada, E sistemin iç enerjisini yani sahip olduğu enerji çeşitlerinin (potansiyel, kinetik, dönme, titreşim vb.) toplamını ifade eder. E1, sistemin başlangıçtaki; E2 ise değişme sonundaki enerjisidir. q, sistem tarafından absorbe edilen ısı; w ise sistem tarafından yapılan iştir. 39
47 Sistemlerdeki değişimin mesela, bir kimyasal reaksiyonun yönünü, iki eğilim belirler: 1) Enerjisini en aza indirme, 2) Maksimum düzensizliği kazanma. Termodinamiğin birinci kanunu ile bir reaksiyonun kendiliğinden olup olmayacağı tahmin edilemez. Entropi (S), olayın olma eğilimi bu işte faydalanılacak fonksiyonlardan birisidir ve bir sistemin düzensizlik derecesinin bir ölçüsü olarak tanımlanır. Bir sistem daha düzensiz ve dağınık bir hale geçtiğinde entropi artar ve S pozitif ( S > 0) olur. Termodinamiğin ikinci kanununa göre bir olay, ancak ve ancak sistem ve çevre entropilerinin toplamı arttığı zaman, kendiliğinden cereyan eder (Şekil 9.4.). Kendiliğinden yürüyen (istemli) bir olay için daima Ssis+ Sçev.> 0, yani Sevren > 0 dır. Burada dikkat edilecek nokta, kendiliğinden yürüyen bir olayda sistemin entropisi azalabilir fakat bu durumda çevrenin entropisi Ssis+ Sçev.>0 olacak kadar artmalıdır. anlı organizmalar kendilerini oluşturan çevredeki maddelerden çok daha düzenli hale gelmiş molekülleri içerirler. rganizmalar bir düzenlilik oluşturur ve bunu korurlar. Bu durum termodinamiğin ikinci yasasına uymuyor gibi görünmektedir. Son derece teşkilatlı bir yapıya sahip bulunan canlılarda, atomların ve yapı taşı moleküllerin bir araya gelmesiyle ortaya çıkan düzenli yapıdan dolayı sistemin entropisi azalmaktadır fakat çevredeki entropi artışı bu azalmadan daha fazla olduğu için toplamları pozitif olmaktadır. rganizmalar en düşük enerji düzeyine inme eğilimine karşı sürekli enerji harcamak zorundadır. 60 o 20 o 1 M Nal 2 40 o 40 o 0.5 M Nal 0.5 M Nal (1) (2) Şekil 9.4. Sistemin entropisinin artışıyla yürüyen olaylara iki örnek: 1) Isı difüzyonu, 2) Çözünen difüzyonu. Bir kimyasal olayın kendiliğinden olup olmayacağı termodinamiğin ikinci kanunu kullanılarak belirlenemez. Çünkü burada sistemimiz olan kimyasal reaksiyonlar ve çevresinin entropi değişmeleri kolayca ölçülemez. Bu zorluk serbest enerji fonksiyonunun ortaya atılmasıyla aşılmıştır. G sembolüyle gösterilen serbest enerji, termodinamiğin birinci ve ikinci kanunlarının birleştirilmesi ile elde edilmiştir. Bu fonksiyonun temel denklemi G = T S 40
48 olup, burada G, değişime maruz kalan sistemin sabit basınç (P) ve sıcaklıktaki (T) serbest enerji değişimini, S de sistemin entropisindeki değişimdir. Görüldüğü gibi bu denklemde çevrenin özellikleri yer almamaktadır. Entalpi değişimi, = E + P V ile verilir. Entalpi bir hal fonksiyonu olup, sistemlerin ısı içeriğini yansıtır., sabit basınçta sistemin ısı alışverişine eşittir. Kimyasal reaksiyonlar ve canlılar sabit basınç altında açık sistemler olduğundan ve özellikle, biyokimyasal reaksiyonların hepsinde hacim değişimi ( V) çok küçük olacağından, E alınırsa; canlı sistemin toplam enerjisindeki değişimi tam olarak yansıtmayabilir. Yani, = E + P V ve canlılarda V=0 olduğundan W= 0 olur ve E dir. G = T S eşitliğinden G = E T S olur. yazılabilir. Sonuç olarak, bir reaksiyonun G değeri sistemin iç enerjisi ve entropisindeki değişime bağlıdır. ücreler için ısı önemli bir enerji kaynağı değildir. Isı, hücre için sadece optimum yaşama sıcaklığı sağlar. ücreler tarafından kullanılan serbest enerji sabit sıcaklık ve basınçta iş yapmaktadır. ücreler, sabit sıcaklık ve basınçta iş yapan makineye benzer. Bir reaksiyonun serbest enerjisindeki değişme ( G), sistemdeki değişimle ilgili iki eğilimi de (minimum enerji ve maksimum düzensizlik) ve S şeklinde içinde bulundurduğundan, bir reaksiyonun kendiliğinden yürüyüp yürümeyeceğinin önemli bir kriteri olarak kullanılabilir. Buna göre bir reaksiyonda; 1. G < 0 ise, reaksiyon belirtilen yönde kendiliğinden gerçekleşir, 2. G = 0 ise, reaksiyon dengede olup, bileşenlerin konsantrasyonunda hiçbir net değişme olmaz, 3. G > 0 ise, reaksiyon belirtilen yönde kendiliğinden gerçekleşmez. Bu reaksiyonun belirtilen yönde yürütülmesi için dışarıdan serbest enerji verilmesi gerekir. Yukarıdaki kriterleri canlı sistemler için yorumlarsak, canlılardaki tüm olaylarda G < 0 dır. anlı sistemler çevreleriyle hiç dengeye ulaşmazlar. anlılarda denge hali yani G = 0, canlının ölümü manasını taşır. Bir reaksiyonun G değeri, ürünlerin toplam serbest enerjileri ile (son hal), reaktantların toplam serbest enerjilerinin (ilk hal) arasındaki farka eşittir ve değişimin izlediği yola bağımlı değildir. Reaksiyon mekanizmasının G üzerine hiçbir etkisi yoktur. Mesela glukozun 2 ve 2 ya oksidasyonunda glukoz ister in vitro (hücre dışı) olarak yakılsın, ister in vivo (hücre içi) olarak enzimli reaksiyonlarla yükseltgensin; ortaya çıkan G aynıdır. G reaksiyon hızı hakkında da hiçbir bilgi vermez, yalnızca olabilirliğini ifade eder. 41
49 G ve Denge Sabiti A + B denge reaksiyonunun serbest enerji değişimi, + D ifadesiyle verilir. Burada G o, standart serbest enerji değişimi, R gaz sabiti, T mutlak sıcaklıktır. G o, standart şartlardaki serbest enerji değişimi olup, 25 o de ve A, B, ve D nin konsantrasyonları 1.0 M iken ölçülür. Özet olarak, bir reaksiyonun serbest enerji değişimi, reaksiyona katılanların özelliğine ve konsantrasyonlarına bağlı bir değerdir. Biyokimyasal reaksiyonlardaki serbest enerji hesaplamalarını basitleştirmek üzere bazı kabuller yapılmıştır. Standart halde p nın 7.0 olduğu, bu p daki + ve 2 aktivitesinin 1.0 olarak alınması kabul edilmiştir. Biyokimyasal reaksiyonlar p = 7.0 de meydana geldiği için G o yerine G o yazılır. Ancak, biz bu farklılığı unutmayacağız ve G o kullanmaya devam edeceğiz. Denge durumunda G = 0 olacağından, ifadesinden G o = RT lnk yazılır. Çünkü denge durumunda konsantrasyonlar denge konsantrasyonu olacağından, ifadesi gerçekleşir. G o = RT lnk denkleminin logaritmasının 10 tabanına göre alınmasıyla G o = RT logk şeklinde yazılabilir. Buda düzenlenirse, ifadesi çıkar ve burada R=1.98 x 10-3 kcal/ mol x K ve T=298 K değerleri yerine konulursa, bulunur. Görüldüğü gibi standart serbest enerji değişimi ile denge sabiti arasında basit bir bağıntı vardır. Denge sabiti büyüdükçe, reaksiyona giren moleküllerin ürüne dönüşüm eğilimi artar, yani G o daha negatif değer alır. Mesela K = 10 iken 25 o de G o = 1,36 kcal/mol; K=100 ise G o = 2,72 kcal/mol dür. Bir reaksiyonun kendiliğinden oluşma kriteri, G o değil, G değeridir. Şimdi dihidroksiaseton fosfatın, gliseraldehid 3 fosfat izomerine dönüştüğü reaksiyonun G o ve G değerini hesaplayalım. 42
50 2 izomeraz 2 P P 3-2 Dihidroksiaseton fosfat Gliseraldehid 3 fosfat Bu glukoz metabolizmasında yer alan glikoliz yolu reaksiyonlarındandır. 25 o de dengede gliseraldehid 3 fosfatın, dihidroksiaseton fosfata oranı 0,0475 olduğundan ; K da 0,0475 tir. Yukarıda çıkardığımız eşitlikten, G o = 2,303 RT logk = 2,303 x 1.98 x 10-3 x 298 x log 0,0475 = kcal/mol bulunur. Şimdi dihidroksiaseton fosfat başlangıç konsantrasyonunun 2 x 10-4 M ve gliseraldehid 3 fosfatın başlangıç konsantrasyonunun da 3 x 10-6 M olduğu bir hücre içi halinin G değerini bulalım. Verilenleri yerine koyduğumuz zaman, olacağı için; = 1.8 2,5 = 0,7 kcal/mol olarak bulunur. G için bulunan negatif değer, izomerleşme reaksiyonunun her iki reaktifin yukarıda verilen konsantrasyonlarında kendiliğinden yürüyeceğini göstermektedir. Burada bu reaksiyon için G o pozitif iken, G negatif değerde olmaktadır. Sonuç olarak, hücre içi bir reaksiyonun kendiliğinden olabilirliğini o reaksiyonun G o değeri değil, hücre içi konsantrasyonlarının vereceği G değerleri belirler. Önemli bir başka husus da birden fazla basamaklı bir reaksiyonun toplam serbest enerji değişimi, her bir basamağın serbest enerji değişimlerinin toplamına eşit olmasıdır. Şimdi aşağıdaki reaksiyonu ele alalım: A B A B + D + D G o = + 5 kcal/mol G o = -8 kcal/mol G o = -3 kcal/mol Standart şartlarda A; B ve ye kendiliğinden dönüştürülemez çünkü G o pozitiftir. Bununla birlikte aynı şartlarda B; D ye dönüştürülebilir ( G o = 8,0 kcal/mol dür). Serbest 43
51 enerji değişimleri toplanabilir olduğundan, A nın ve D ye dönüşmesinin G o değeri -3 kcal/mol çıkar ve bu da söz konusu reaksiyonun standart şartlarda kendiliğinden gerçekleşebileceğini göstermektedir. Bundan da anlaşılmaktadır ki, termodinamik yönden mümkün olmayan reaksiyonlar; termodinamik yönden kolayca gerçekleşebilen bir başka reaksiyonun beraberliğinde olabilmektedir. Metabolizmada bu tip enerji bağlantılarına sıkça rastlanılmaktadır. Mesela 6 mol 2 ve 6 mol 2 dan 1 mol glukoz oluşumunun G o değeri +686 kcal dir. Yani, standart şartlarda bu reaksiyon gerçekleşmez. Fakat bu serbest enerjiyi karşılayacak bir mekanizma beraberliğinde kısacası fotosentez mekanizmasıyla güneş enerjisinden elde edilen kimyasal enerji ile söz konusu glukoz sentezi yapılır. ksidasyon G o = 686kcal/mol Fotosentez 9.4. ATP (ADENZİN TRİFSFAT) anlı varlıklar aşağıdaki fonksiyonların yerine getirilmesi için devamlı bir serbest enerji kaynağına ihtiyaç duyarlar: 1. Kas kasılmasındaki ve diğer hücresel hareketlerdeki mekanik iş, 2. Molekül ve iyonların aktif taşınması, 3. Makromolekül ve biyomoleküllerin basit başlangıç bileşiklerinden sentezlenmesi (biyosentez). Bu olaylarda kullanılan serbest enerji çevreden sağlanır. Kemotroflar bu enerjiyi gıda maddelerinden; fototroflar da ışık enerjisinden elde ederler. Gıdaların oksidasyonundan ve ışıktan türetilen serbest enerjinin bir kısmı hareket, aktif taşıma ve biyosentezde kullanılmadan önce özel bir şekle sokulur. Bu özel serbest enerji taşıyıcısı adenozin trifosfat (ATP) dır (Şekil 9.5.). ATP, biyolojik sistemlerdeki enerji alışverişinde anahtar rolü olan evrensel enerji molekülüdür. ATP; bir adenin, bir riboz ve bir de trifosfat birimi içeren bir bileşiktir. Açık formülü aşağıda gösterilmiştir. 44
52 N 2 Yüksek enerjili fosfoanhidrit baglari - N N N N P P P 2 Şekil 9.5. Adenozin trifosfat (ATP). (p=7.0 de) ATP nin aktif şekli Mg +2 veya Mn +2 iyonları ile kompleks teşkil eden yapısıdır (Şekil 9.6.). ATP nin enerji taşıyıcısı özelliğinde en önemli rolü trifosfat birimi oynamaktadır. Çünkü molekül bu kısmından hidrolizlendiği zaman yüksek oranda serbest enerjinin açığa çıktığı iki adet fosfoanhidrit bağı mevcuttur. ATP, adenozin difosfat (ADP) ve fosfata (Pi) hidrolizlendiği gibi; adenozin monofosfat (AMP) ve pirofosfata (PPi) da parçalanabilir. Bu reaksiyonlar için G o değeri, ortamın iyonik şiddetine ve Mg +2, a +2 konsantrasyonlarına bağlıdır. Biz G o = 7,3 kcal/mol alacağız. P P P Riboz Adenin Mg +2 Mg ATP -2 P P Riboz Adenin Mg +2 Mg ADP - Şekil 9.6. Mg +2 ve ATP. Mg +2 ile kompleks oluşması; negatif yükleri kısmen korumakta, ATP ve ADP gibi nükleotidlerdeki fosfat gruplarının konformasyonunu etkilemektedir. 45
53 ATP + 2 ADP + P i + + G o = -7.3kcal/mol ATP + 2 AMP + PP i + + G o = -7.3kcal/mol Pirofosfatın (PPi) oluştuğu reaksiyonların gerçekleşmesi için, bir ATP nin hidroliziyle elde edilenden daha fazla enerjiye ihtiyaç gösteren reaksiyonlardır. luşan PPi daha sonra, hücrede bulunan pirofosfataz enzimi katalizörlüğünde hidrolizlenir. Pirofosfataz PPi + 2 2P i G o = -7.3kcal/mol Bu enerji de reaksiyonun gerçekleşmesine katkıda bulunur. Standart koşullar altında ATP hidrolizinin serbest enerji değişikliği 7,3 kcal/mol dür. Ancak, canlı hücrelerde ATP hidrolizinin gerçek serbest enerji değişikliği çok farklıdır. anlı hücrelerde ATP, ADP ve P i konsantrasyonları aynı değildir ve standart koşullardaki 1.0 M konsantrasyondan çok düşüktür. Örneğin insan eritrositlerindeki ATP; ADP ve Pi derişimleri sırasıyla 2,25, 0,25 ve 1,65 mm dır. rtamın p sını 7,0 ve sıcaklığını 25 o varsayarsak, bu koşullar altında eritrositlerdeki ATP hidrolizinin gerçek serbest enerjisi yaklaşık 12 kcal/mol dür. ATP + 2 ADP + P i + + G o = -7.3kcal/mol ATP, ADP ve AMP aşağıdaki reaksiyonla adenilat kinaz enzimi katalizörlüğünde birbirlerine çevrilebilir: Adenilat kinaz ATP + AMP 2ADP Bazı biyosentez reaksiyonları ATP ye benzer nükleotidler tarafından yürütülür. Bunlar protein, polisakkarit ve lipidlerin biyosentezinde serbest enerji molekülü olan guanozin trifosfat (GTP), üridin trifosfat (UTP) ve sitidin trifosfat (TP) dır. Bu bileşiklerin fosforil grupları bir nükleotidden diğerine enzimler tarafından taşınabilir. ATP + GDP ADP + GTP ATP Aktif Taşıma ve Kas Kasılmasında Enerji Sağlar ATP, biyolojik sistemlerde serbest enerjinin depolanma şeklinden çok ihtiyaç olduğu anda enerjinin acil kaynağı olarak görev yapar. Enerjinin gerektiği olaylarda rol alan enzimler, transport proteinleri, kas enzim ve proteinleri enerji kaynağı olarak yalnız ATP yi tanır ve hidrolizler. Diğer GTP, UTP gibi nükleotidler bile, yüksek enerjili olmalarına rağmen bu amaçla kullanılmazlar. ücrelerde ATP, oluşumundan sonra birkaç dakika içinde kullanılır. ADP ve ATP arasındaki devir çok hızlıdır. Mesela, istirahat halinde bir insan 24 46
54 saat içinde 40 kg ATP kullanır. Eksersiz halinde ise dakikada 0.5 kg kadar ATP harcar. Söz konusu ATP sarfiyatının 1/3 ünü Na + /K + pompasında olmaktadır. Bir iyon veya molekülün zardan, derişimlerin daha yüksek olduğu sıvı ortama geçebilmesi için gerekli enerji ATP den sağlanır. Aktif taşıma olayları, enerjinin harcandığı başlıca yerlerdir. Örneğin, insan böbrek ve beyninde istirahat halinde harcanan enerjinin 2/3 ü Na + K + ATPaz aracılığıyla zarın bir tarafından diğer tarafına Na + ve K + pompalanmasında kullanılır. Taşıma olayının her bir devrinde ATP, ADP ve Pi ye dönüşmekte, protein konformasyonunda çevrimsel değişiklik oluşturan ATP hidrolizinin serbest enerji değişikliği de, Na + ve K + un pompalanmasını sağlamaktadır. Burada ATP substratla değil, fosforil grubu transferiyle enzimle kovalent olarak etkileşir. İskelet kası hücrelerinin kontraktil (kasılabilen) sisteminde, miyozin ve aktin ATP nin kimyasal enerjisini harekete dönüştürmek üzere özelleşmiştir. ATP, kovalent olmayan bir şekilde miyozinin bir konformasyonuna bağlanarak proteini bu konformasyonda tutar. Miyozine bağlı ATP nin hidrolizinde ADP ve Pi proteinden ayrılır. Bu durumda bir sonraki ATP molekülü bağlanıncaya kadar ikinci bir konformasyonun hakimiyetiyle kas gevşer. ATP nin bağlanması ve bunu izleyen hidrolizden sağlanan enerji ile miyozin moleküllerindeki konformasyonel değişiklik, miyozin fibrillerinin aktin flamentleri boyunca kaymasına neden olur. Bu kayma sonucunda kas lifinde makroskopik düzeyde kasılma gözlenir. anlılardaki hareket, aktif taşıma, sinyal kuvvetlendirilmesi ve biyosentez ancak ve ancak ATP nin sürekli olarak üretilmesiyle mümkündür (Şekil 9.7.). Fototroflar ATP yi ışık enerjisini yakalayarak, kemotroflar da besin maddelerini oksitleyerek üretirler. YAKIT (rganik bilesik). 2 YakIt oksidasyonu veya katabolizma 2 2 ADP + P i ATP Mekanik iṣ Aktif tasima. Biyosentez Sinyal kuvvetlendirme Şekil 9.7. Biyolojik sistemlerdeki ATP ADP devri. 47
55 Acaba ATP nin fosfat grubunun transferiyle yani hidroliziyle niçin yüksek bir serbest enerji açığa çıkmaktadır? ATP hidrolizinin nispeten büyük ve negatif olan standart serbest enerji değişikliğinin kimyasal temeli Şekil 9.8. de özetlenmektedir. ATP molekülündeki uç (terminal) fosfoanhidrit bağının hidrolitik kopması, negatif yüklü üç fosfat grubundan birinin ayrılmasını sağlar. Bu şekilde ATP içinde bazı elektrostatik itmeler meydana gelir. Salınan Pi (P4-2 ), ATP içinde mümkün olmayan bazı rezonans formlarıyla kararlılık kazanır. idrolizin diğer ürünü olan ADP -2 hemen iyonize olarak, düşük [ + ] (~10-7 M) derişimli ortama + iyonu salar. ATP hidrolizinin standart serbest enerjisi yüksek oranda egzergonik (negatif) ise de ( G o = 7.3 kcal/mol), ATP hidrolizinin aktifleşme enerjisi nispeten yüksek olduğu için, molekül p=7.0 da kinetik olarak kararlıdır. Fosfoanhidrit bağının hızlı hidrolizi, reaksiyon ancak bir enzimle katalizlendiğinde gerçekleşir. P P P Riboz Adenin ATP -4 : Yük itilmesiyle hidroliz P + P P Riboz Adenin ADP -2 P i Rezonans - kararliligi iyonizasyon P P P Riboz Adenin ADP -3 ATP ADP -3 + P i G o = -7.3kcal/mol Şekil 9.8. ATP hidroliziyle birleşmiş büyük serbest enerji değişikliğinin kimyasal temeli. İlk olarak yük ayrılmasının neden olduğu hidrolizde, ATP üzerindeki dört negatif yük arasında elektrostatik itmeler meydana gelir. İkinci aşamada, hidrolizle açığa çıkan inorganik fosfat (P i) yapısındaki dört P bağının her birinin aynı derecede çift bağ karakteri ve oksijenlerinden herhangi birinin hidrojenle kalıcı bağ yapmayan bir rezonans hibrit oluşumuyla kararlı hale gelir. Anhidrit veya ester bağlarına katılan fosfatlarda da belli bir derecede rezonans kararlılığı oluşur. Ancak rezonans formları P i ye göre çok azdır. Üçüncü aşamada hidrolizle oluşan ADP -2, iyonize olarak düşük [ + ] ya sahip ortama (p=7.0) bir proton salar. ATP hidrolizine yardımcı olan dördüncü faktör (şekilde gösterilmemiştir), ADP ve P i ürünlerinin ATP ye göre yüksek olan hidrasyon derecesidir. 48
56 ATP nin hidroliziyle yüksek bir serbest enerji açığa çıkmasının sebebini ortaya koymak için ATP nin yapısını incelememiz gerekmektedir. Bu konuda üç faktörün etkili olduğu görülür: 1) Elektrostatik itme, 2) Rezonans kararlılığı, 3) Entropi artışı. p=7.0 de ATP nin trifosfat birimi, dört tane negatif yük taşımaktadır. Bunlar birbirlerine yakın olduklarından aralarında kuvvetli bir itme meydana gelir. ATP nin yüksek grup transferi potansiyeline sebep olan ikinci faktör de, ADP ve Pi nin ATP ye göre daha yüksek bir rezonans kararlılığına sahip olmasıdır. Mesela fosfatın (Pi) aynı enerjide dört rezonans şekli varken (Şekil 9.9.), ATP deki her bir fosfat grubu daha az sayıda rezonans hali gösterir. ATP nin uç fosfat gruplarının her biri daha az sayıda rezonans şekillerine sahip olmasının nedeni, oksijen üzerindeki elektron çifti için iki fosforun yarışmaya girmesinin mümkün olmamasıdır. P P P P Şekil 9.9. Fosfatın (P i) rezonans şekilleri. ATP hidroliz G o değerinin çok negatif olmasını sağlayan üçüncü faktör de ürün veya iyon sayısının daha fazla olmasıyla ortaya çıkan entropi artışıdır. ATP ADP P i + + ATP hidrolizine, ADP ve Pi ürünlerinin ATP ye göre hidrasyon derecesinin yüksek olması da yardımcı olur. Biyokimyacıların kullandığı yüksek enerjili bağ terimi, bağ enerjisinin yüksek olmasıyla karıştırılmamalıdır. Çünkü bağ enerjisi, bir bağı parçalamak için ihtiyaç duyulan yani dışarıdan verilmesi gereken enerji olup; yüksek enerjili bir bağ ise, bu bağın hidrolizlenmesi olayının G o değerinin çok negatif olması demektir. Fosfat bileşiklerinin hidroliziyle salınan serbest enerji, kırılan özgül P bağından gelmez; reaksiyon sonucu oluşan ürünlerin, reaksiyona girenlere göre daha küçük serbest enerjili olmalarından kaynaklanır. Biz kolaylık olması açısından negatif hidroliz standart enerjili ATP veya diğer fosfat bileşiklerini yüksek enerjili fosfat bileşiği olarak tanımlıyoruz. anlı organizmalarda bulunan fosfat bileşikleri, hidrolizin serbest enerjisine bağlı olarak kendi aralarında iki gruba ayrılır (Şekil 9.10.). Yüksek enerjili bileşiklerin hidroliz G o değeri 25 kj/mol den daha negatiftir (5.98 kcal/mol 6 kcal/mol). Bu kriter temel alındığında ATP 30.5 kj/mol ( 7.3 kcal/mol) olan hidroliz G o değeri ile yüksek enerjili; 49
57 glukoz 6 fosfat ise, 13.8 kj/mol ( 3.3 kcal/mol) olan G o değeriyle düşük enerjili bir bileşiktir P idrolizin G o degeri - (kj/mol) -30 P 2 Fosfoenolpirüvat P Kreatin Fosfokreatin 2 P Yüksek enerjili 1,3-Bisfosfogliserat bilesikler. Adenin Riboz P P P ATP Glukoz-6- P Gliserol- P Düsük. enerjili bilesikler. 0 P i Şekil Biyolojik fosfat bileşiklerinin hidroliz standart serbest enerjilerine göre sıralanması. Burada P ile gösterilen fosfat gruplarının yüksek enerjili fosfat vericilerinden ATP yoluyla düşük enerjili fosfat türevlerini oluşturmak üzere alıcı moleküllere (glukoz ve gliserol vb.) akışı gösterilmektedir. Bu fosfat grubu akışı kinazlar adı verilen enzimler ile katalizlenmekte ve hücre koşulları altında bir serbest enerji kaybına eşlik etmektedir. Düşük enerjili fosfat bileşiklerinin hidrolizi, düşük fosfat grup transfer potansiyeline sahip P i yi serbestleştirir. Kreatin fosfat (fosfokreatin), yüksek enerjili fosfat grubunun iskelet kasında geçici depolama şeklidir. Kas dokusu hücrelerinde fosfokreatin, ATP den 5 kat fazladır. Kreatin fosfat, ADP den ATP nin hızlı sentezi için hazır fosforil grubu kaynağı olarak görev yapar. Fosfokreatin molekülünde (Şekil 9.11.), P N bağı serbest kreatin ve Pi oluşturmak üzere hidrolizlenebilir. Pi nin salınması ve kreatinin rezonans kararlılığı reaksiyonu ileriye doğru hızlandırır. 50
58 - - - P N N 2 Fosfokreatin 2 N 3 2 Fosfokreatin P i idroliz 2 N 2 N 3 N 2 Kreatin Rezonans - kararliligi 2 + N N 3 + N + Kreatin + Pi -2 G' o = kj/mol Şekil Fosfokreatin hidrolizi. Fosfokreatindeki P N bağının kırılması, bir rezonans hibrit oluşumuyla kararlı duruma gelen kreatini oluşturur. Diğer ürün olan P i de rezonansla kararlı hale gelir. Birbirini izleyen reaksiyonlarda serbest enerji değişikliklerinin birbirine eklenebildiği nasıl açıksa; fosfatlı herhangi bir bileşiğin sentezi için, hidroliz serbest enerjisi daha negatif olan bir başka fosfat bileşiğinin yıkılması gereklidir. Örneğin, fosfoenolpirüvat (PEP) ın hidroliz standart serbest enerjisi; Pi nin ADP ye kondanse olması için gerekli enerjiden daha negatif olduğu için, fosforil grubunun PEP den ADP ye verilmesi termodinamik açıdan istemlidir. (1) PEP + 2 Pirüvat + P i G kcal/mol (2) ADP + P i ATP + 2 G kcal/mol PEP + ADP Pirüvat + ATP G kcal/mol Biyolojik sistemlerde yüksek enerjili fosfat bağı ihtiva eden bazı bileşikler Tablo 9.2. de verilmiştir. atta bunlardan fosfoenolpirüvat ve kreatin fosfat gibi bileşiklerin hidroliz G o değeri ATP ninkinden daha negatiftir. Bu fosfoenolpirüvatın fosfat grubunun ADP ye transfer edilerek ATP meydana getirebileceğini göstermektedir. Gerçekten, glukoz metabolizmasının bir basamağında bu yolla ATP sentezlenmektedir. Buna substrat seviyesinden fosforilasyon adı verilir ve gerçekleşmesi için de fosforil grubu vericisinin hidroliz G o değerinin 7,3 kcal/mol den daha negatif olması gerekir. 51
59 Tablo 9.2. Biyolojik önemi olan bazı fosforilli moleküllerin hidroliz standart serbest enerjileri. Bileşik G 0 (kcal/mol) Fosfoenolpirüvat 14.8 Karbomoil fosfat 12.3 Asetil fosfat 10.3 Kreatin fosfat (Fosfokreatin) 10.3 Pirofosfat 8.0 ATP (ADP ye dönüşümü) 7.3 Glukoz 1 fosfat 5.0 Glukoz 6 fosfat 3.3 Gliserol 3 fosfat ATP idrolizinin Reaksiyon Dengesine Etkisi Termodinamik yönden yürümesi mümkün olmayan bir reaksiyonun ATP beraberliğinde nasıl cereyan ettiğini göstermek için, A B G = +4.0 kcal/mol reaksiyonunu ele alalım. 25 o de bu reaksiyonun denge sabiti olarak bulunur. Bu da [B]/[A] oranının 1.15 x 10-3 e eşit veya daha büyük değerlerinde A nın B ye kendiliğinden dönüştürülmeyeceğini göstermektedir. Fakat bu reaksiyon ATP hidoliziyle beraber gerçekleştiği zaman [B]/[A] oranı 1.15 x 10-3 den büyük bile olsa A nın B ye çevrilmesi gerçekleşebilir. Böyle bir reaksiyon denklemini aşağıdaki şekilde yazılabilir. A B G = +4.0 kcal/mol ATP + 2 ADP + P i + + G o =-7.3 kcal/mol A + ATP + 2 B + ADP + P i + + G o = -3.3 kcal/mol Bu reaksiyonun denge sabiti K yı yazarsak, bulunur. ifadesini de yazabiliriz. ATP üreten hücrelerde [ATP]/[ADP][Pi] oranı 500 civarındadır. Bu değeri ve K yı yerine koyduğumuz zaman, 52
60 bulunur. Bu da ATP nin hidrolizi sayesinde, [B]/[A] oranı 1.34 x 10 5 değerine ulaşıncaya kadar A nın B ye çevrilmesinin kendiliğinden gerçekleşeceğini göstermektedir. Diğer bir deyimle ATP hidrolizi [B]/[A] denge oranını 10 8 defa artırmış olmaktadır. Yukarıdaki örnekte bir ATP hidroliziyle reaksiyon dengesinin 10 8 defa ürünler lehine kaydığını gördük. Eğer n molekül ATP hidrolizlense, denge sabiti 10 8 defa büyüyecektir. 3 ATP nin hidrolizlendiği bir reaksiyonun dengesi oranında değişecektir. Verilen örnekteki A ve B yi genelleştirirsek, bunlar bir proteinin iki farklı konformasyonunu temsil edebilir. Mesela, kas proteini göz önüne alındığında, kasın gevşek az enerjili hali A, gerilmiş çok enerjili hali de B olabilir. Bir iyon veya molekülün hücre içindeki ve dışındaki konsantrasyonu da aynen besin maddelerinin aktif transportunda olduğu gibi, verilen örnekteki A ve B tarafından temsil edilebilir. Kompleks organik bileşiklerin basit başlangıç maddelerinden sentezinde de, A ve B bu molekülleri gösterebilir. ATP canlılarda acil enerji kaynağı rolünün yanı sıra bir başka fonksiyon daha görür. emen hemen tüm fosforilasyon olaylarında fosforil grubu vericisi ATP dir. Bu rolü hem ara metabolizmada hem de metabolik regülasyonda oldukça önemlidir METABLİZMADAKİ ELEKTRN TAŞIYIILARI Kemotroflar serbest enerji ihtiyaçlarını glukoz ve yağ asitleri gibi besin maddelerinin oksidasyonundan sağlar. Aerobik organizmalarda en son elektron alıcısı 2 dir. Yakıt molekülleri ve onların parçalanma ürünlerinden elektronlar 2 ye doğrudan doğruya transfer edilemez. Bu substratlar, elektronlarını önce özel yapıdaki piridin nükleotidlere (NAD + ) ve flavinlere (FAD) aktarır. Bu taşıyıcıların indirgenmiş formları (NAD ve FAD2) yüksek potansiyelli elektronlarını, mitokondri iç membranında yerleşmiş bulunan bir elektron transport zinciri vasıtasıyla 2 ye aktarırlarken ATP sentezlenir. Bu olaya oksidatif fosforilasyon adı verilir. Bunun yanı sıra yakıt moleküllerinin oksidasyonundan ortaya çıkan yüksek potansiyelli elektronlar, ATP den başka indirgeyici güce (NADP) ihtiyaç gösteren biyosentez olaylarında da kullanılır. Nikotinamid adenin dinükleotid (NAD + ), besin moleküllerinin oksidasyonunda en başta gelen elektron alıcısıdır (Şekil 8.5.). NAD + nın reaktif kısmı onun nikotinamid halkasıdır. Bu substratın oksidasyonunda, NAD + nın nikotinamid halkası bir hidrür iyonuna eşdeğer olan iki elektron ve bir hidrojen iyonunu kabul eder. NAD + nın indirgenmiş hali NAD ile gösterilir. NAD +, aşağıda bir örnekle verilen birçok dehidrogenasyon reaksiyonunda elektron alıcısı olarak görev yapmaktadır: 53
61 NAD + + R 1 R 2 Dehidrogenaz NAD + R 1 R 2 Dehidrogenasyon reaksiyonlarında, substrat üzerindeki hidrojen iyonlarından birisi doğrudan NAD + ya transfer edilirken diğeri de çözeltiye geçer. Substrat tarafından kaybedilen her iki elektron da nikotinamid halkasına aktarılır. Aşağıda NAD + nın yükseltgenmiş ve indirgenmiş formları gösterilmiştir. + + N e - N N R NAD + (yüks.) N R NAD + + (ind.) Besin moleküllerinin oksidasyonunda görev yapan ikinci bir elektron taşıyıcısı da flavin adenin dinükleotiddir (Şekil 8.4.). kside ve redükte formları kısaca FAD ve FAD2 ile gösterilen bu nükleotid aşağıdaki tipte dehidrogenasyon reaksiyonlarında elektron taşır. FAD + R 1 R 2 FAD 2 + FAD nın reaktif kısmı izoalloksazin halkasıdır. FAD ve NAD + gibi iki elektron taşıyıcısıdır fakat substratın iki hidrojen atomunu da kabul eder. FAD nın indirgenmiş ve yükseltgenmiş şekilleri aşağıda gösterilmiştir. 3 3 N N R FAD (yük.) N N e R 1 N N R N FAD 2 (ind.) FAD2 elektronlarını solunum zincirine aktarır ve ATP sentezinde görev alır. Birçok biyosentez olayında ön maddeler, ürünlerden daha yükseltgenmiş halde bulunur ve ATP nin yanı sıra indirgeyici güce de ihtiyaç duyulur. Mesela yağ asitlerinin biyosentezinde eklenen iki karbon birimindeki keto grubu birkaç basamak reaksiyonla metilen grubuna indirgenir. Bu reaksiyon basamaklarında dört elektrona ihtiyaç vardır. R 2 N R 1 2 R e - R R
62 İndirgeyici biyosentez olaylarının çoğunda elektron vericisi, nikotinamid adenin dinükleotid fosfat (NADP) dır. NADP da NAD dan farklı olarak riboz biriminin 2' hidroksil grubu, fosfat ile ester yapmış haldedir (Şekil 8.5.). NADP aynen NAD gibi elektron taşır. Bununla beraber NADP, tamamen indirgeyici biyosentez olaylarında kullanılırken; NAD, elektronlarını solunum zincirine aktararak ATP sentezinde görev alır. NADP üzerindeki fosfat grubu, bu molekülün indirgemeyi katalizleyen enzimler tarafından tanınmasını sağlar. Burada NAD, NADP ve FAD2 nin katalizörlerin yani enzimlerin yokluğunda 2 ile çok yavaş reaksiyona girdiklerini belirtmeliyiz. Aynı şekilde ATP de enzimsiz çok yavaş bir hızda hidrolizlenir. Bu moleküllerin, reaksiyon vermeleri termodinamik yönden çok kolay olduğu halde, kinetik yönden kararlılıkları yüksektir. Spesifik enzimlerin yokluğunda gözlenen bu kararlılık, bunların biyolojik fonksiyonları için son derece önemlidir. Çünkü bu yolla serbest enerji ve indirgeyici güç akışının enzimler tarafından kontrol edilmeleri mümkün olur KATABLİZMA VE ANABLİZMA Metabolik yolları oluşturan bir seri enzimatik reaksiyonla hücre veya organizmada meydana gelen tüm kimyasal dönüşümlerin toplamına metabolizma denir. Bir metabolik yolda birbirini izleyen basamaklardan her birinde genellikle bir atom veya işlevsel grubun eklenmesi, aktarılması ve uzaklaştırılması gibi küçük özgül kimyasal değişiklikler oluşur. Bir öncül madde, metabolitler olarak adlandırılan bir seri metabolik ara ürünün oluşumundan sonra ana ürüne dönüşür. Ara metabolizma terimi, düşük molekül ağırlıklı öncül madde, metabolit ve ürünlerin birbirine dönüşümünün gerçekleştiği tüm metabolik yolların birleşmiş aktivitelerini tanımlar. Metabolik yollar; 1) Doğrusal, 2) Çevrimsel ve 3) Sarmal şekilde olabilir. Doğrusal yolun örneği olarak glukozun pirüvata dönüştüğü glikoliz reaksiyonlarını; çevrimsel yola Krebs ve üre devirlerini; sarmal tarzdaki metabolik yola da ardarda benzer reaksiyon basamaklarıyla gerçekleşen yağ asitleri sentez ve yıkımıyla protein sentezi reaksiyonlarını gösterebiliriz. Metabolik yolları bir şehrin yol ağını gösteren bir haritaya benzetebiliriz. Bu yollardan bir kısmı ana yol, bazıları da yan yollardır. Dışarıdan alınan besin maddelerinin yıkım ve depolama işlemleri canlı metabolizmasının ana yollarını oluşturur. Metabolizma, katabolizma ve anabolizma olarak ikiye ayrılır. Katabolizma, hücrenin çevresinden aldığı veya kendi depolarından kullandığı büyük besin moleküllerini (karbohidratlar, lipidler ve proteinler) çoğunluğu oksidatif nitelikteki enzimatik 55
63 reaksiyonlarla; laktik asit, asetik asit, 2, 2, amonyak veya üre gibi bir seri daha küçük moleküllere parçalanması olayıdır. Katabolik yollardan elde edilen enerjinin bir kısmı ATP ve indirgenmiş elektron taşıyıcılarının (NAD, NADP ve FAD2) oluşumu için harcanırken, diğer kısmı ısı olarak çevreye salınır. Biyosentez olarak adlandırılan anabolizma ise; küçük, basit öncül bileşiklerden polisakkaritler, nükleik asitler, lipidler ve proteinler gibi hücrenin bileşenlerini oluşturan büyük kompleks moleküllerin sentezlenmesi olayıdır. Anabolik olaylar, genel olarak ATP deki fosforil grup transfer potansiyeli ve NAD, NADP ve FAD2 nin indirgeme gücü şeklinde bir enerjiye ihtiyaç gösterir (Şekil 9.12.). Biyosentez olayı yapının daha büyümesi ve daha da kompleks bir düzene girmesiyle sonuçlandığından, bir entropi azalması söz konusudur. anlı organizma en düşük enerji düzeyine inme eğilimine karşı sürekli enerji harcamak zorundadır. Bu entropi azalışı da ATP nin hidroliziyle ortaya çıkan serbest enerji tarafından karşılanır. anlı organizmalar; çok düzenli, gelişigüzel hiçbir yapı içermeyen, bilgi yönünden zengin ve entropi açısından fakir oluşumlardır. Sentezlenen bileşikler başlangıç maddelerine oranla daha indirgenmiş olduklarından, gerekli elektron ve hidrojenler indirgeyici güç kaynağı olan NADP tarafından sağlanır. Katabolizma ve anabolizma hücre içinde beraberce meydana gelir. Enerji içeren besinler Karbohidratlar Yağlar Proteinler Katabolizma Enerjiden yoksun son ürünler 2 2 ADP + P i NAD + NADP + FAD ATP NAD NADP FAD2 Kimyasal enerji ücre makromolekülleri Proteinler Polisakkaritler Lipidler Anabolizma Öncül moleküller Aminoasitler Şekerler Yağ asitleri Azotlu bazlar Şekil Katabolik ve anabolik yollar arasındaki enerji ilişkisi. Katabolik yollar kimyasal enerjiyi ATP, NAD, NADP ve FAD 2 şeklinde verir. Bu enerji taşıyıcıları, küçük öncül moleküllerin hücre makromoleküllerine dönüştürüldüğü anabolik (yapım) yollarda kullanılır. 56
64 Şimdi ileride ayrıntılı şekilde inceleyeceğimiz metabolizma olaylarını genel olarak ele alacağız. ans Krebs, besin maddelerinin oksidasyonundan enerji üretiminin, yani katabolizmanın üç safhada gerçekleştiğini ileri sürmüştür. Birinci safhada besin maddelerindeki büyük moleküller daha küçük birimlere parçalanır. Proteinler yirmi çeşit aminoasitlere, polisakkaritler glukoz gibi basit şekerlere ve yağlar da gliserol ve yağ asitlerine hidrolizlenirler. Bu olaylar sindirim sisteminde olduğu gibi, hücre içinde de gerçekleşir. Bu safhada iş görecek enerji üretilmez. İkinci safhada, bu çok sayıdaki küçük moleküller, metabolizmada merkezi rolleri olan birkaç basit bileşiğe dönüştürülür. Gerçekten şekerler, yağ asitleri, gliserol ve bazı aminoasitler asetil oa nın asetil grubuna çevrilir. Bu basamakta substrat seviyesinde birkaç ATP sentezlenir fakat asetil oa nın tümünün oksidasyonundan elde edilecek ATP miktarının yanında çok az kalır. Üçüncü safha, sitrik asit (TA) çevrimi ve oksidatif fosforilasyondan ibarettir ve yakıt moleküllerinin yıkımındaki son ortak yolu oluşturur. Bu çevrime, asetil oa şekline getirilen asetil birimleri, tamamen 2 ye yükseltgenir ve bu arada her bir asetil grubu başına dört çift elektron, 3 adet NAD + ve 1 adet de FAD ye transfer edilir. Daha sonra da bu elektronların NAD ve FAD2 dan solunum zinciri vasıtasıyla 2 ye kadar akışı sonucu, oksidatif fosforilasyon adı verilen olayla ATP sentezlenir. Besin maddelerinin yakılmasıyla meydana gelen ATP nin büyük bir bölümü bu üçüncü safhada oluşur. Şekil de söz konusu katabolizma safhaları şematize edilmiştir. Şekil Besin maddelerinin katabolizma safhaları. 57
65 Anabolizma da katabolizmanın üçüncü safhadaki küçük yapı taşlarından başlayarak üç safhada gerçekleşir. Mesela protein sentezi, sitrik asit devrinde yer alan α-keto asitlerinin ikinci safhadaki aminasyonu ile meydana gelen α amino asitlerden birinci safhada gerçekleşir. İlerideki bölümlerde anlatacağımız gibi üçüncü safha hem katabolizma hem de anabolizmanın ortak basamağıdır. Katabolik ve anabolik olayların en önemli özelliklerinden birisi de aynı reaksiyon basamaklarına sahip olmamalarıdır. Mesela glikojenin laktik aside çevrilmesi çok iyi bilinen 12 enzimatik basamakla gerçekleşmektedir. Fakat laktik asitten glikojen sentezinde, katabolik 12 enzimatik basamaktan 9 u kullanılmakta ve 4 tane değişik enzim de görev almaktadır. Aynı şekilde proteinler ve aminoasitler, yağ asitleri ve asetil oa arasındaki katabolik ve anabolik yollar da birbirinden farklıdır. Katabolizma için ayrı, anabolizma için ayrı iki metabolik yol israf gibi görünmesine rağmen; katabolizma yolu enerji noktasından anabolizma için uygun olmadığından farklı yollar mutlak bir ihtiyaçtan doğmaktadır. Çünkü katabolizma enerji yönünden yokuş aşağı bir durum arzederken; sentez olayları yokuş yukarı çıkmaya benzemektedir. Yokuştan aşağı itilen bir kaya parçası en kestirme yoldan dikine inerken; aynı taşı yukarı çıkarırken takip edilecek ve en az enerji sarfedilecek yol mutlaka farklı olacaktır. Özellikle ökaryotik hücrelerde katabolizma ve anabolizma yolları, hücre içi yerleşim noktalarında da farklılık gösterir. Mesela yağ asitlerinin asetil oa ya kadar parçalanmasını katalizleyen enzimler mitokondri matriksinde yer alırken; yağ asitlerinin asetil oa dan sentezi sitoplazmada bulunan enzimlerle gerçekleşir. Birbirine paralel katabolik ve anabolik yolların hücrenin ayrı bölümlerinde yer alması, bu iki olayın birbirinden bağımsız olarak aynı zamanda gerçekleşmesini sağlar. Metabolizmanın hemen hemen bütün reaksiyonları bir diğerine bağlantılıdır çünkü bir enzimatik reaksiyonun ürünü, bir sonraki reaksiyon serisinin substratı olur. Böyle reaksiyon serileri metabolik moleküllerin spesifik fonksiyonel gruplarının enzimatik reaksiyonlarla uzaklaştırılıp; alıcı moleküllere transferiyle mümkün olmaktadır. Ara metabolizmanın birçok reaksiyonları amino, asetil, fosforil, metil, formil, karboksil gruplarının veya hidrojen atomlarının basamak basamak transferlerini içermektedir METABLİK YLLARIN ÜRE İÇİ KNTRLÜ Genellikle bir hücredeki katabolik hız, besin maddelerinin konsantrasyonlarından daha çok ATP şeklindeki enerji ihtiyacı tarafından belirlenir. ATP oluşturan metabolik yollar (katabolik); yüksek enerji yükü ile inhibe edilirken, ATP kullanan yollar (anabolik) yüksek 58
66 enerji yükü ile uyarılır. Kısacası, hücreler fonksiyonlarını yerine getirmek için gereken enerjiyi üretecek miktarda yakıt yani besin maddesi kullanırlar. Aynı şekilde hücre bileşenlerinin biyosentez hızı acil ihtiyaçlarına göre ayarlanır. Mesela, hücrelerdeki aminoasit sentezi, protein sentezi için gerekli olan minimum seviyede aminoasit sağlayacak hızda gerçekleşir. Özetle, hücredeki metabolizma olaylarında hiçbir besin maddesi israf edilmez, ihtiyaç duyulan kadarı kullanılır, gerektiği kadar sentez yapılır. Kısacası, hücre maksimum ekonomi prensiplerine uygun çalışan bir sistemdir. Metabolik yolların düzenlenmesi çeşitli seviyelerde olur. Bunları komplekslik sırasına göre ele alacağız. 1. En basit düzenleme tipi, enzimatik reaksiyon hızına etki eden parametreleri kapsar. Multienzim serisindeki her bir enzimin karakteristik bir optimum p sı, substratları, ürünleri ve hatta koenzim veya metal iyonlarına özel ilgisi vardır. ücrede böyle bir multienzim sistemi reaksiyonlarının net hızı, her bir enzim konsantrasyonunun, hücre içi p sının, her bir ara bileşiğin ve aktivite için gerekli olan metal iyonu veya koenzimlerin konsantrasyonlarının fonksiyonudur. Belirli bir metabolik yolun hızı da hücre içi p yı değiştirebilen herhangi bir hücre içi proses tarafından etkilenebilir. Aynı şekilde her bir metabolik ara bileşiğin hücre içindeki konsantrasyonu, onun oluşum ve kullanılma hızlarının bileşkesidir. Bu da incelenen enzim sisteminin aktivitesinin yanı sıra, bu ara bileşiği sentezleyen ve kullanan diğer enzimatik reaksiyon hızlarına bağlıdır. 2. İkinci düzenleme mekanizması, enzimler konusunda incelediğimiz allosterik enzimler tarafından gerçekleştirilir. Bu enzimlerin çoğu son ürün tarafından inhibe edilir (feed back inhibisyonu). L-treonin deaminaz E L-treonin B 2 E 3 E 4 E 5 D E L-izolösin feed-back (geri beslenme) inhibisyonu Bazıları da modülatörler tarafından aktive veya inhibe edilebilir. Mesela ADP, birçok katabolizma reaksiyonlarındaki düzenleyici enzimleri aktive eder. Bazı allosterik enzimler çok değerli olup; iki veya daha fazla reaksiyonun ürünlerine cevap verebilir. Anabolik ve katabolik reaksiyon dizilerinin düzenleyici enzimleri ve bunları etkileyen faktörler farklı olduğundan, bunlar birbirlerinden bağımsız olarak düzenlenir ve kontrol edilirler. 3. Metabolik düzenlenmenin üçüncü seviyesi enzim sentezi hızının genetik yoldan kontrolüdür. Belirli bir metabolik yolun hızı, o yolda görev yapan enzimlerin hücre içi konsantrasyonuna yakından bağlıdır. Bazı enzimlerin intrasellüler konsantrasyonu sabit iken, 59
67 bazılarının konsantrasyonu da belirli substratların varlığına bağlıdır. Bu enzimlerin sentezi ile ilgili bilgileri taşıyan genler bir baskı altındadırlar ve bu baskı bazı bileşikler vasıtasıyla ortadan kaldırılabilir. atta bir multienzim sistemindeki enzimlerin tamamının sentezi beraberce baskılanabilir veya uyarılabilir. Çünkü bunların sentezi, DNA üzerindeki operon adı verilen, birbirlerini takip eden genler tarafından şifrelenir. Bunlarda beraberce baskılanır veya uyarılır. Özellikle bakterilerde bu mekanizma daha önemlidir. Kısacası metabolik yolun hızı, genetik denetim altında bulunan enzim sentez hızı ile ilgilidir. peronlar; bakterilerde çok sayıda genlerin kümelendiği ve bu genlerin regülasyonunu da sağlayan dizilişleri taşıyan gen bölgeleridir. 4. En kompleks seviyede metabolik kontrol, endokrin sistemi tarafından gerçekleştirilir. Endokrin sisteminden, hedef doku ve organlardaki metabolik aktiviteleri uyaran veya inhibe eden; hormon adı verilen kimyasal haberciler salgılanır. Mesela pankreas tarafından salgılanan insülindeki yetersizlik, glukozun hücre içine girişini azaltır ve bunun sonucu olarak keton cisimleri artar, yağ asitlerinin biyosentezi azalır. Az miktarda insülin enjeksiyonu durumu düzeltir. Bugün birçok hormunun etki mekanizmaları bilinmektedir. Bazıları hücre membranı yüzeyine bağlanır ve sinyaller oluşturarak hücre içi metabolizma olaylarını ve DNA yı etkiler. Bazıları da hücre içine girerek, sitoplazma veya nükleusta bulunan reseptör proteinlerine bağlanır. luşan kompleks DNA nın belirli bölgelerine yapışarak, transkripsiyonu düzenlemektedir. Bölüm 13 de hormonlar ve etki mekanizmaları hakkında detaylı bilgi verilecektir. 60
68 10. BÖLÜM: KARBİDRAT METABLİZMASI Bu bölümde, daha önce yapıları incelenen biyomoleküllerin metabolizması yani canlı organizmada karşılaştıkları dönüşüm ve değişmeler karbohidratlardan başlanarak anlatılacaktır. Karbohidrat metabolizması sözü hemen hemen glukoz metabolizmasıyla eşdeğerdir. Çünkü heterotroflar karbohidratların tamamına yakınını glukoz şeklinde alırlar. Diğer şeker türleri (fruktoz, galaktoz, mannoz ve pentozlar) organizmada ya önce glukoza çevrilir ya da glukoz metabolizmasına bir ara basamakta dahil olur. Metabolizma olayları incelenirken, bunların insan biyokimyası ile ilgili bazı yönleri de verilecektir. Bundan dolayı, bu bölüme karbohidratların sindirimi ile başlayıp; daha sonra sırasıyla glukoz ve glikojenin pirüvat ve laktata kadar anaerobik oksidasyonu (anaerobik glikoliz), sitrik asit (TA) çevrimi ve glioksilat devirleri, oksidatif fosforilasyon, pentoz fosfat yolu ve glukozun karbohidrat yapısında olmayan bileşiklerden sentezi (glukoneogenez) açıklanacaktır. Ayrıca glikojen yıkım ve sentez mekanizması da anlatılacaktır KARBİDRATLARIN SİNDİRİMİ VE EMİLİMİ Sindirim; polisakkarit, protein, lipid ve nükleik asit gibi büyük moleküllerin emilimleri ve metabolize olabilmeleri için sindirim kanalında enzimatik olarak daha küçük moleküllere yıkımdır. İnsan diyetindeki başlıca karbohidrat kaynakları; nişasta ve glikojen gibi α-glikozid bağlarına ve glukoz birimlerine sahip olan polisakkaritler ile sükroz ve laktoz gibi disakkaritlerdir. Karbohidratların sindirimi ağızda başlar (Şekil 10.1.a.). Diyetteki polisakkaritler ve disakkaritlerin monosakkaritlere yıkımı ince bağırsaktan emilmeleri için zorunludur. Bunlar bir enzim serisi tarafından monosakkaritlere kadar hidrolizlenir (Şekil 10.1.b.). Bu enzimler şunlardır: 1) Tükrük amilazı (α amilaz); bir α(1 4) glikozidaz olup nişasta ve glikojeni dallanmış ve düz zincir yapıda oligosakkaritlere (dekstrinlere) parçalarken çok az miktarda da maltoz ve glukoz meydana gelir. Yiyeceğin ağızda kısa süreli kalışı ve bu enzimin de midede aktivitesini kaybetmesinden (optimum p) dolayı, diyetle alınan karbohidratların çok az bir kısmı ağızda hidrolizlenir. 2) Pankreas salgısı ince bağırsağa giren materyali alkalileştirir. Pankreas amilazı; diyetle alınan karbohidratların sindirilmesinden başlıca sorumlu olan enzimdir. Tükrük 61
69 amilazına benzer parçalayıcı özelliklere sahiptir. Pankreatik amilaz; başlıca maltoz, dekstrin denilen oligosakkaritleri ve α(1 6) dallanma noktaları içeren amilopektin (limit dekstrin) parçacıklarını açığa çıkarır. 3) Besinsel ve α amilazların etkisiyle oluşan disakkaritler ve dekstrinlerin sindirimi ince bağırsakta tamamlanır. İnce bağırsak epitel hücreleri mukozasının fırçamsı yüzeyince salgılanan ve burada tutunmuş olarak fonksiyon gören maltaz, sükraz, laktaz ve α(1 6) glikozidaz gibi oligosakkaridazlar sırası ile; maltoz, sükroz, laktoz disakkaritlerini ve limit dekstrin yapısındaki α(1 6) glikozid bağlarını hidrolizler. Sonuçta, polisakkaritler ve disakkaritler; glukoz, fruktoz ve galaktoza kadar hidrolizlenirler. Böylece oluşan monosakkaritler epitel hücreleri içine taşınır; sonra kana geçerek dokulara aktarılır. Şekil Sindirim kanalı ve karbohidratların sindirimi. Sindirim kanalı duvarlarını döşeyen kasların dalga şeklindeki kasılmaları, yiyeceklerin ve bunların sindirim ürünlerinin kanal boyunca hareketini sağlar. 62
70 Bağırsaktan yalnız monosakkaritler emilebilir ve hücreler tarafından kullanılabilir. Disakkaritler ve bazı polisakkaritler kana enjekte edildiği zaman hiçbir değişikliğe uğramadan vücuttan atılırlar. Monosakkaritler farklı hızlarda emilirler. D glukozun emilme hızını 100 alırsak; D galaktoz 110, D fruktoz 43, D mannoz 19, D ksiloz 15 ve D arabinoz 9 luk bir hızla bağırsak duvarını aşarlar. Bunlardan glukoz ve galaktoz kan dolaşımındaki daha yüksek bir konsantrasyona karşı serbest enerji kullanılmasıyla aktif olarak emilirken, diğerleri kolaylaştırılmış difüzyonla geçer. ayvan hücrelerinde glukozun hücre membranlarından aktif olarak taşınmasını glukoz taşıyıcı(glut) adı verilen bir integral membran protein ailesi gerçekleştirir. Bu taşıyıcı protein ailesinin farklı hücrelerde fonksiyon gören ve GLUT1 den 5 e kadar isimlendirilen 5 üyesi vardır. Bunlar yapısal olarak benzerlik göstermelerine rağmen, glukoza karşı afiniteleri ve insülin hormonuna karşı davranışları farklı farklıdır. Mesela, GLUT1 ve GLUT3 hemen hemen bütün memeli hücrelerinde bulunur ve bazal glukoz alımından sorumludur. GLUT5 ise, bağırsak epitelyum hücresinin hem absorpsiyon yapan hem de kana glukoz aktaran bölgelerinde yer alır ve Na + iyonu gradientinin enerjisinden yararlanarak, glukozu Na + iyonu beraberliğinde taşır (Şekil 10.2.). Böbrekte de GLUT5 benzer iş görür. GLUT4 ün hücre membranı üzerindeki sayısı insüline bağımlı olup, glukoz girişinin bu hormonca çok arttırıldığı kas, yağ ve kalp hücrelerinde yer alır. Karaciğer ve pankreas hücrelerinde de (glukoz için KM değeri yüksek olan), GLUT4 bulunur ve ancak yemek sonrası kanda glukoz seviyesi çok yükseldiğinde devreye girer. Şekil Barsak epitelyum hücrelerinde glukozun aktif taşınması. 63
71 Absorpsiyondan sonra monosakkaritler taşıyıcı dolaşımla (portal dolaşım) karaciğere ulaştırılır. Bağırsak tarafından emilen suda çözünebilir her bileşiğin ilk ulaştığı doku karaciğer olup; diğer dokulara karaciğer tarafından alınmayanlar gider. Karaciğer karbohidratların metabolize edildiği ana merkezdir. Karaciğerde glukoz hızla glikojen halinde depolanır ve açlık döneminde kan glukoz seviyesinin normalde tutulması için çok önemli bir kaynak görevini yapar. Dokulara giden glukoz ise hemen kullanılır. Ancak kasta kullanılmayan kısmı hazır bir enerji kaynağı olan glikojen şeklinde depolanır. Karaciğer, depoladığı glikojeni iki öğün arasında tekrar glukoza parçalayıp kana aktarır ve kandaki glukoz seviyesini normalde tutmaya çalışırken, kas dokusu depoladığı glikojeni kendi acil enerji ihtiyacını karşılamada kullanır (Şekil 10.3.). Kandaki normal glukoz konsantrasyonu mg/dl iken; bu değerlerin altındaki seviyeye hipoglisemi, üstündeki seviyeye de hiperglisemi adı verilir. Glukoz miktarı yaklaşık 170 mg/dl den yukarı çıkarsa, böbrek eşiğini aşarak idrara geçer. Bu olaya glukozüri adı verilir. 64
72 GLUKZ KAYNAKLARI Besin Glukoz, fruktoz v.b. (karaciğerde) glukoz, fruktoz, diğer karbohidratların sindirimi Kas glikojeni Aminoasitler Propiyonat Diğer glukogenik bileşikler Laktik asit Adipoz doku Gliserol Karaciğerde glukoneogenez Karaciğerde glikojenin yıkımı KAN GLUKZU Normal düzey: Karbohidratlı besinlerin emilmesinden sonra: mg/100ml mg/100ml Kan glukoz düzeyi mg/100ml aştığında glukozuri ortaya çıkar. Glikojen oluşumu ÇEŞİTLİ DKULARDA GLUKZUN KULLANILMASI Karbohidratları içeren sentez Yağ oluşumu Katabolizma ile glukozun 2 ve 2 ya yıkılması Şekil Kan glukozu 65
73 10.2. GLİKLİZ Glikoliz, bütün canlı hücre çeşitlerinde glukozun pirüvata çevrilmesi ve bir miktar ATP üretimini gerçekleştiren reaksiyon serisine verilen isimdir. Glikolizde bir molekül glukoz bir seri enzimatik reaksiyon ile iki molekül üç karbonlu bileşik olan pirüvata yıkılır. Bütün canlı hücre çeşitlerinde glikoliz hemen hemen evrensel bir merkezi yoldur. Glikolizin birbirini izleyen reaksiyonları sırasında, glukozun serbest enerjisinin bir kısmı ATP ve NAD şekline dönüştürülür. Glikoliz bazı memeli doku ve hücre tiplerinde örneğin eritrositler, beyin ve sperm hücrelerinde tek metabolik enerji kaynağıdır. Nişastayı depolamak üzere özelleşen bazı bitki dokuları (patates yumruları gibi) enerjilerinin büyük bir kısmını glikolizden sağlar. Birçok anaerobik organizma tamamen glikolize bağımlıdır. Glikolize Kısa Bir Bakış Altı karbonlu glukozun iki molekül üç karbonlu pirüvata parçalanması on basamakta olur. Bu reaksiyon basamaklarından ilk beşi hazırlık fazını oluşturur (Şekil 10.4.a.). Glukoz molekülünün iki molekül üç karbonlu pirüvat birimlerine bölünmesi için aktifleştirilmesinde iki molekül ATP harcanır. Özetle; glikolizin hazırlık fazında bileşiklerin serbest enerjileri artırılır ve matabolize olan tüm heksozların (altı karbonlu şekerler) karbon zincirleri genel bir ürün olan iki molekül gliseraldehid 3 fosfata dönüştürülür. Enerji kazancı glikolizin hizmet fazında olur (Şekil 10.4.b.). Glikolizin bu ikinci fazının son ürünü pirüvattır. er glukoz molekülü için hazırlık fazında 2 ATP harcanır ve hizmet fazında 4 ATP üretilir; glukoz molekülü başına net verim 2 ATP dir. Enerji, hizmet fazında her glukoz molekülü için 2 NAD şeklinde de saklanır. ücrenin sitoplazmasında olan glikolizde oluşan NAD ler mitokondri iç membranına taşınır ve elektronlarını 2 ye aktararak ATP sentezlenir. 66
74 Şekil Glikolizin iki fazı. a) azırlık fazı, b) izmet fazı. 67
75 Glikoliz için toplam reaksiyon aşağıdaki şekildedir. Glukoz + 2NAD + 2Pirüvat + 2NAD G o = -146 kj/mol 2ADP + P i 2ATP G o = 2(+30.5kj/mol) Glukoz + 2NAD + + 2ADP + P i 2Pirüvat + 2NAD ATP G o = -85 kj/mol G o -20kcal/mol Glikoliz, hücre içinde ve standart şartlar altında enerjide net bir azalma ile sürdürülerek tamamlanan aslında dönüşümsüz bir işlemdir. Glikolizde bir glukoz molekülü için 2 ATP oluşur. Enerjinin büyük kısmı pirüvatta kalır. Glikoliz, glukoz molekülünün toplam enerjisinin küçük bir kısmını açığa çıkarır. Glukoz, 2 ve 2 ya tam yükseltgendiği (oksitlendiği) zaman standart serbest enerji değişimi 2840 kj/mol dür. Bu nedenle, glukozun iki pirüvat molekülüne glikolitik yıkımı (ΔG o = 146 kj/mol), glukozun tam oksidasyonuyla elde edilecek olan toplam enerjinin sadece (146 / 2840) x 100 = % 5.2 sini açığa çıkarır. Pirüvatın enerjisinin büyük kısmı sitrik asit çevrimi ve oksidatif fosforilasyon ile ATP nin serbest enerjisine dönüştürülür. Glikoliz ile oluşan pirüvat üç yıkım yolundan biriyle daha ileri metabolize edilir. Glikoliz aerobik organizmalar ve dokularda aerobik şartlarda glukozun tam oksidasyonunda sadece ilk aşamadır (Şekil 10.5.). Glukoz Anaerobik şartlarda 2 mol Piruvat Anaerobik şartlarda 2 mol Etanol + 2 mol 2 2 mol Laktat Mayada alkole fermentasyon Şiddetli kasılan kaslarda, Aerobik eritrositlerde, bazı hücrelerde ve şartlarda bazı mikroorganizmalarda laktata fermentasyon 2 mol 2 2 mol Asetil oa 4 mol mol 2 Aerobik şartlarda, hayvan, bitki ve birçok mikrobiyal hücre Şekil Glikoliz ürünü pirüvatın olası üç katabolik sonu. 68
76 Aerobik şartlarda yani yeterli oksijen bulunması durumunda pirüvat, mitokondriye girer ve oksidatif dekarboksilasyonu ile asetil oa nın asetil grubunu oluşturur. Asetil grubu daha sonra sitrik asit (TA) çevrimi ve oksidatif fosforilasyon ile tamamen 2 ve 2 ya yükseltgenir. Bu yükseltgenmede açığa çıkan elektronlar asetil birimi başına 3 NAD ve 1 FAD2 tarafından 2 oluşturmak üzere mitokondride bir dizi taşıyıcı aracılığıyla solunum zincirinde 2 ye aktarılır. Elektron transfer reaksiyonlarından açığa çıkan enerji mitokondride ATP sentezini sürdürür. Eğer 2 yetersiz ise (yoğun kas faaliyeti ve mitokondrisi bulunmayan eritrositlerde) pirüvat, laktata indirgenir. Glikojenin kaslardaki yıkımı sonucu oluşan laktat, kan dolaşımı ile karaciğere taşınarak tekrar glikojene çevrilir. Karaciğer glikojeninden kan glukozuna, kas glikojenine, laktata ve buradan tekrar karaciğer glikojenine kadar olan bu dönüşüme ori çevrimi adı verilir. Kasta glukozun laktata ve karaciğerde laktatın glukoza çevrildiği reaksiyonların yer aldığı ori çevrimi aşağıda şematik olarak gösterilmiştir (Şekil 10.6.). Glikojen Glukoz Glukoz Glikojen K Pirüvat Laktat Karaciger - A N Pirüvat Laktat Kas Dokusu Şekil ori çevrimi Maya hücresi gibi bazı anaerobik organizmalarda pirüvat etanole dönüştürülür. Glukozdan etanol ve laktat oluşumu fermentasyon örnekleridir. Fermentasyon; organik bileşiklerin hem elektron vericisi, hem de elektron alıcısı olarak davrandığı ATP üreten olaydır. 2 yokluğunda da gerçekleşebilir. Glikoliz reaksiyonlarının tamamı 1940 larda aydınlatılmıştır. Bu konuda katkısı olan başlıca biyokimyacılar Gustav Embden, tto Meyerhof, arl Neuberg, Jacop Parnas, tto Warburg, Getty ori ve arl ori adlı bilim adamlarıdır. 69
77 Glikoliz Reaksiyonları Glikolizin hazırlık fazında iki molekül ATP harcanır ve heksoz zinciri iki trioz fosfata bölünür. Glikoliz yolu reaksiyonları hücre sitoplazmasında meydana gelmektedir. Glukozun, fruktoz 1,6 bisfosfata dönüşmesinden ibaret olan ilk safhası bir fosforilasyon, bir izomerleşme ve ikinci bir fosforilasyon reaksiyonlarını kapsamaktadır. Glikolizdeki bu başlangıç reaksiyonlarının hedefi, fosforillenmiş üç karbon birimlerine parçalanacak yapıda bir bileşik oluşturmaktadır. Daha sonra bu üç karbonlu birimlerden kullanılabilecek kimyasal enerji çıkarılmaktadır P 3 2 P 3-2 Glukoz Fruktoz-1,6-bisfosfat 1. Glukozun Fosforillenmesi Glukoz hücrelere, daha önce anlatılan taşıyıcı proteinler aracılığıyla aktif taşıma sistemi ile girer. ücreye dahil olan glukoz ATP tarafından fosforillenerek glukoz 6 fosfota (G 6 P) çevrilir. Bu şekilde glukozun hücre dışına çıkışı engellenmiş ve hücre içi konsantrasyonu da azaltılarak, ekstrasellüler ortamdan pasif taşıma glukoz girişi kolaylaştırılmış olur. ATP den fosforil grubunun glukozun 6 no lu karbonuna transfer reaksiyonu hekzokinaz enzimi tarafından katalizlenir. 2 2 P ATP ekzokinaz Mg +2 + ADP + + G o = kj/mol Glukoz Glukoz-6-fosfat Fosforil grubu transferi biyokimyada temel bir reaksiyondur. ATP den bir alıcı bileşiğe fosforil grubu transferini gerçekleştiren enzimlere kinaz adı verilir. Kinazlar, transferazların bir alt grubudur. ekzokinaz, glukozun yanı sıra diğer bazı heksozlara (D fruktoz, 70
78 D mannoz) da fosforil grubu transfer edebilen bir enzimdir. Diğer kinazlarda olduğu gibi, hekzokinaz da aktivitesi için Mg +2 gibi iki değerlikli metal iyonlarına ihtiyaç duyar. D-glukoz ve ATP den glukoz-6-fosfat sentezini katalizleyen bir diğer enzim glikokinazdır. Bu enzim glukoza özgüdür. Glukokinaz karaciğerde bulunur ve glukoz düzeyi yükselince aktivite gösterir. Glikokinazın görevi: 1) Glikojen sentezi, 2) Pentoz fosfat yolu için glukoz 6 fosfat sağlamaktır. ekzokinaz ve glikokinaz aktiviteleri farklı şekilde düzenlenir ve metabolizmada farklı rolleri vardır. 2. Glukoz 6 fosfatın Fruktoz 6 fosfata Dönüşmesi Glikolizin ikinci reaksiyonu, glukoz 6 fosfatın fruktoz 6 fosfata (F 6 P) izomerleşmesidir. Burada glukoz 6 fosfatın altı atomlu piran halkası, fruktoz 6 fosfatın beş atomlu furan halkasına çevrilmektedir P 3 Fosfoglukoz izomeraz -2 2 P 3 2 G o = +1.7 kj/mol Glukoz-6-fosfat Fruktoz-6-fosfat 3. Fruktoz 6 fosfatın fruktoz 1,6 bisfosfata Fosforillenmesi Bir önceki basamağı ikinci bir fosforilasyon basamağı takip eder ve fruktoz 6 fosfat ATP tarafından fruktoz 1,6 bisfosfata (F 1,6 BP) fosforillenir P P 3 2 P 3 Fosfofruktokinaz-I + ATP + ADP + + G o = kj/mol Fruktoz-6-fosfat Fruktoz-1,6-bisfosfat ücre şartlarında dönüşümsüz olan bu reaksiyon allosterik bir enzim olan fosfofruktokinaz I tarafından katalizlenir. İleride de izah edileceği gibi, glikoliz yolunun hızı bu enzimin aktivite seviyesiyle yakından alakalıdır. Bu enzim, fruktoz 6 fosfatı; fruktoz 71
79 2,6 bisfosfata çeviren fosfofruktokinaz 2 enziminden farklıdır. Fosfofruktokinaz I, hücrede oluşan fruktoz-6-fosfatların tamamına yakınını fosforiller. 4. Fruktoz 1,6 bisfosfatın Bölünmesi Glikolizin ikinci safhası dört basamakta gerçekleşir. İlk reaksiyonla fruktoz 1,6 bisfosfat aldolaz enzimi katalizörlüğünde gliseraldehid 3 fosfat (GA 3 P) ve dihidroksiaseton fosfata (DAP) parçalanır. Glikolizin bundan sonraki basamakları üç karbonlu bileşiklerle devam eder. Aldolaz enzimi ismini, aşağıdaki reaksiyonun tersine yürümesi aldol kondenzasyonu olmasından almaktadır. 2 P 3-2 Aldolaz -2 2 P 3 + G o = kj/mol 2 2 P P 3-2 Fruktoz-1,6-bisfosfat Dihidroksiaseton fosfat Gliseraldehid-3-fosfat 5. Trioz Fosfatların Birbirine Dönüştürülmesi Gliseraldehid 3 fosfat glikoliz yolunun bir ara bileşiği iken, onun izomeri olan dihidroksiaseton fosfat bu yolda doğrudan yer almaz. Fakat DAP, trioz fosfat izomeraz enziminin katalizörlüğünde hemen gliseraldehid 3 fosfata dönüştürülür. Bu reaksiyon dönüşümlü ve çok hızlıdır. Reaksiyon dengesi % 96 DAP lehine olmasına rağmen, gliseraldehid 3 fosfatın hemen kullanılması yüzünden reaksiyon sağ tarafa doğru kolayca yürür P 3 2 Dihidroksiaseton fosfat Trioz fosfat izomeraz G o = +7.5 kj/mol -2 2 P 3 Gliseraldehid-3-fosfat 72
80 Böylece, bir glukoz molekülünden iki molekül gliseraldehid 3 fosfat meydana gelmiş olur. Buraya kadar ki reaksiyonlarda henüz hiçbir enerji elde edilmemiştir. Aksine, 2 molekül ATP harcanmıştır. Glikolizin hizmet fazı ATP ve NAD üretir. Glikolizin hizmet fazı (Şekil 10.4.b.), glukoz molekülünde ATP şeklinde saklanan serbest enerjinin bir kısmını içeren enerji saklayan fosforillenme basamaklarını içerir. İki molekül gliseraldehid 3 fosfatın iki molekül pirüvata çevrilmesi, ADP den dört molekül ATP oluşumuyla birlikte gider. Fakat parçalanan her glukoz molekülü başına ATP nin net verimi sadece ikidir. Çünkü iki ATP glikolizin hazırlık fazında glukoz molekülünün iki ucunu fosforillemek için kullanılmıştır. 6. Gliseraldehid 3 fosfatın 1,3 Bisfosfogliserata Yükseltgenmesi Bundan sonraki reaksiyonlarla gliseraldehid 3 fosfaın ihtiva ettiği enerji açığa çıkarılmaktadır. Bunlardan birincisi, gliseraldehid 3 fosfatın yükseltgenip fosforillenmesi sonucu; 1,3 bisfosfogliserata (1,3 BPG) çevrilmesidir. Bu reaksiyonu gliseraldehid 3 fosfat dehidrogenaz enzimi katalizlemektedir. Bu reaksiyon, fosfata (P4-3 ) benzerliği dolayısıyla arsenat (As4-3 ) iyonu tarafından inhibe edilir. P 3-2 Gliseraldehid-3-fosfat + NAD + dehidrogenaz + P i + NAD + + G o = +6.3 kj/mol 2 P 3-2 Gliseraldehid-3-fosfat 2 P 3-2 1,3-Bisfosfogliserat Buradaki redoks reaksiyonu sonucunda yüksek enerjili bir fosfat bağı meydana gelmektedir. Aldehid karboksilik asit yükseltgenmesiyle elektronlar NAD + e verilirken, açığa çıkan enerji de fosforilasyonda kullanılmaktadır. 7. 1,3 Bisfosfogliserattan ADP ye Fosforil Transferi ve 3 Fosfogliseratın luşumu Bu basamak; 1,3 bisfosfogliserattaki yüksek enerjili fosfat bağının ADP ye transferiyle ATP nin sentezlendiği reaksiyondur. 73
81 P Fosfogliserat kinaz + ADP + ATP G o = kj/mol -2 2 P P 3 1,3-Bisfosfogliserat 3-Fosfogliserat Fosfogliserat kinaz enzimi tarafından katalizlenen bu reaksiyon substrat seviyesinde ATP nin sentezlendiği bir basamaktır. anlı organizmalarda ATP başlıca; 1) Substrat seviyesinde fosforilasyon, 2) ksidatif fosforilasyon, 3) Fotosentetik fosforilasyon (fotosentez) olmak üzere 3 yolla sentezlenmektedir. İleride ayrıntılı olarak ele alacağımız oksidatif fosforilasyon, mitokondri iç membranındaki elektron taşıma zinciri vasıtasıyla NAD ve FAD2 deki elektronların 2 ye iletilmesi esnasında açığa çıkan redoks enerjisinden kemozmotik bir mekanizma ile ATP sentezlenmesidir. Substrat seviyesindeki fosforilasyon ise, reaksiyonlar sonucu ara bileşiklerde oluşan yüksek enerjili fosfat bağının ADP ye transferiyle ATP nin meydana gelmesidir Fosfogliseratın 2 Fosfogliserata Çevrilmesi Glikoliz yolunun son safhasında 3 fosfogliserat üç reaksiyonla pirüvata çevrilmekte ve ikinci bir ATP oluşmaktadır. Fosfogliseromutaz enzimi katalizörlüğünde molekül içi düzenleme ile 3 fosfogliserat, 2 fosfogliserata (2 PG) dönüştürülmektedir. Biyokimyasal reaksiyonlarda molekül içinde bir grubun kaydırılmasını katalizleyen enzimlere mutaz adı verilir. - - Fosfogliseromutaz P 3-2 G o = +4.4 kj/mol 2 P Fosfogliserat 2 2-Fosfogliserat 9. 2 Fosfogliseratın Fosfoenolpirüvata Dehidrasyonu Bundan sonraki reaksiyon 2 fosfogliseratın dehidrasyonu ile fosfoenolpirüvat (PEP) oluşumudur. Enolaz enzimin katalizlediği bu reaksiyon sonucu, yüksek bir fosforil grubu aktarma potansiyeline sahip olan bir enol fosfat bileşiği meydana gelmektedir. 74
82 - 2 - P 3-2 P 3-2 G o = +7.5 kj/mol Fosfogliserat Fosfoenolpirüvat Normal bir alkol fosfat esterinin hidrolizlenme ΔG o değeri 12.6kJ/mol iken, fosfoenolpirüvatınki ise 61.9 kj/mol civarındadır. Bu artışın sebebi, fosforil grubunun aktarılmasıyla beraber enolün bir ketona yani pirüvata dönüşmesidir. 10. Fosforil Grubunun Fosfoenolpirüvattan ADP ye Transferi ve Pirüvat luşumu Glikoliz yolunun son reaksiyonu, fosfoenolpirüvatın bir ATP oluşumu beraberliğinde pirüvata dönüştürülmesidir. Bu basamak pirüvat kinaz enzimi tarafından katalizlenmektedir ve dönüşümsüzdür. - - P 3-2 Pirüvat kinaz + ADP ATP G o = kj/mol 2 Fosfoenolpirüvat 3 Pirüvat Glikoliz Yolunun Enerji Bilançosu Bir glukoz molekülünün iki molekül pirüvata dönüşümü olayının net reaksiyon denklemi: Glukoz + 2P i + 2ADP + 2NAD + 2Pirüvat + 2ATP + 2NAD G o = -85kj/mol şeklindedir. Böylece glukozun pirüvata dönüştürülmesi sonucu, iki molekül ATP de sentezlenmiş olmaktadır. Glikoliz olayında ATP nin harcandığı ve sentezlendiği basamaklar Tablo 10.1 de yer almaktadır. 75
83 Tablo Glikoliz yolunda ATP nin harcandığı ve sentezlendiği reaksiyonlar Reaksiyon Glukoz Glukoz 6 fosfat Fruktoz 6 fosfat Fruktoz 1,6 bisfosfat 2 mol (1,3 Bisfosfogliserat 3 Fosfogliserat) 2 mol (Fosfoenolpirüvat Pirüvat) Glukoz başına ATP değişmesi TPLAM Glikoliz MetabolikYolunun Kontrol Mekanizması ayvansal organizmalarda glikolizin ikisi yakıt metabolizmasıyla ilgili olmak üzere üç farklı rolü vardır: 1) ksijen yokluğunda glukozu ATP sentezlemek üzere yıkmak (anaerobik glikoliz), 2) Glukozu pirüvata çevirerek sitrik asit çevriminde tam yakılacak hale getirmek (aerobik glikoliz), 3) Uzun zincirli yağ asitleri, aminoasitler ve fosfolipidler gibi bileşiklerin sentez reaksiyonları için yapı taşları oluşturmak. Glukozun pirüvata çevrilme hızı da hücrenin bu üç ihtiyacını karşılayacak şekilde düzenlenir. Metabolik yollarda dönüşümsüz reaksiyonları katalizleyen enzimler metabolizmanın kontrol noktalarıdır. Glikolizde; hekzokinaz, fosfofruktokinaz-i ve pirüvat kinaz tarafından katalizlenen reaksiyonlar gerçek anlamda dönüşümsüzdür. Bu yüzden her üç enzim de glikolizin kontrol noktalarını teşkil etmektedir. Metabolik yolların düzenlenmesinde dokudan dokuya farklılıklar da gözlenir. Çünkü her dokunun öncelikleri farklı olabilir. Mesela kas ve karaciğer dokuları, glukozu glikoliz yoluyla farklı bir amaç için pirüvata kadar yıkarlar. Kasın hedefi glukozdaki tüm kimyasal enerjiyi açığa çıkararak kullanmak iken; karaciğer, glukozu yağ asitlerini sentezleyeceği yapı taşlarına (asetil oa) dönüştürür. Kanda glukoz seviyesi düştüğü zaman karaciğerde glikoliz inhibe edilir. Çünkü kana glukoz sağlamak üzere senteze başlamıştır. Fakat açlık durumunda da bir hayvansal organizma, yoğun kas aktivitesine ihtiyaç duyar. Yakıt olarak kastaki glukoz deposu olan glikojeni kullanır ve aktif bir glikoliz olayı gerçekleştirir. Yani karaciğerde glikolizin inhibe edildiği aynı şartlarda, kas hücrelerinde glukoz yıkımı çok etkili olabilir. Bu ise her iki dokuda glikolizin farklı düzenlenmesiyle mümkündür. Düzenlenme farklılığı birkaç seviyede gerçekleşebilir. Birincisi, düzenleyici enzimin farklı dokularda farklı izomerleri görev yapabilir. İkincisi de, dokuların dış sinyallere, özellikle hormonlara karşı cevap oluşturmasıdır. Bu husus ileride daha ayrıntılı olarak ele alınacaktır. Fosfofruktokinaz I, glikolizin en önemli kontrol elemanıdır. Glikoliz hızı başlıca fosfofruktokinaz I aktivite düzeyi ile kontrol edilir. Bu enzim, yüksek ATP seviyesinde, 76
84 allosterik olarak inhibe edilir ve enzimin fruktoz 6 fosfata afinitesi azalır. Yüksek bir ATP konsantrasyonu, enzimin fruktoz 6 fosfata ilgisini azaltır ve hiperbolik karakterde olan bağlanma eğrisini sigmoid şekle dönüştürür (Şekil 10.7.). Bu allosterik etki katalitik bölgenin uzağında yer alan oldukça spesifik bir düzenleyici bölgeye bağlanmakla gerçekleştirilir. ATP nin inhibisyon etkisi AMP tarafından önlenir ve enzim aktivitesi ATP/AMP oranının düşmesiyle tekrar artar. Diğer bir deyişle glikoliz, hücrenin enerji yükü azaldığında yeniden uyarılır. Düşük [ATP] Yüksek [ATP] Şekil Fosfofruktokinaz I in allosterik kontrolü: Yüksek ATP konsantrasyonu enzimin fruktoz 6 fosfata olan ilgisini azaltır. AMP, ATP nin inhibisyon etkisini azaltırken sitrat da artırır. Önceden de söylediğimiz gibi glikoliz yolu vasıtasıyla biyosentez için kullanılacak karbon iskeletleri de üretilir ve bu yüzden fosfofruktokinaz I in aktivitesi yapı taşlarının bolluğu veya azlığına göre de düzenlenmesi beklenir. Gerçekten bu enzim, sitrik asit çevriminin ilk ara bileşiği olan sitrat tarafından inhibe edilir. Yüksek bir sitrat seviyesi, biyosentetik ön maddelerin bol olduğuna bir işarettir ve glukozun yıkımına ihtiyaç olmadığını bildirir. Sitrat, ATP nin inhibisyon etkisini kuvvetlendirir. Fosfofruktokinaz-I, hücrenin enerji veya karbon iskeleti ihtiyacı durumunda oldukça aktiftir, her ikisinin de bol olduğu şartlarda glikoliz olayı hemen hemen durur. Fosfofruktokinaz-I in en önemli allosterik regülatörü, fruktoz 2,6 bisfosfattır. Bu bileşik, enzimi kuvvetlice aktive eder. Fruktoz 2,6 bisfosfat (F 2,6-BP) fosfofruktokinaz 2 enzimi tarafından katalizlenen bir reaksiyonla, fruktoz 6 fosfatın fosforilasyonuyla oluşur. Bu bileşik, fruktoz 2,6 bisfosfataz enzimi tarafından tekrar fruktoz 6 fosfata hidroliz edilir. Ayrıca fosfofruktokinaz I ve fruktoz 2,6 bisfosfatazın aktiviteleri, karşılıklı olarak tek bir serin rezidüsünün fosforilasyonu ile kontrol edilir. Glukoz seviyesi düştüğünde, kan glukagon hormonu seviyesi artar ve bu da karaciğerde bu bifonksiyonel enzimin fosforilasyonuna sebep olur. Bu kovalent modifikasyon fosfofruktokinaz I i inhibe ve fruktoz 2,6 bisfosfatazı aktive eder. Sonuçta düşük fruktoz 2,6 bisfosfat seviyesine yol açar ve glikoliz inhibe edilir. Tersine kan glukoz seviyesi yükselirse; enzim, insülin etkisiyle bağlı 77
85 fosfat grubunu kaybeder ve F 2,6-BP seviyesi artar, onu takıben glikoliz hızlanır. Kas dokusu glukagon hormonu reseptörleri taşımadığından bu inhibisyona maruz kalmaz. Pirüvat kinaz da glikoliz hızını düzenleyen bir enzimdir. Kas ve karaciğerde pirüvat kinaz, ATP tarafından allosterik olarak inhibe edilir ve böylece yüksek enerji yükü durumunda fosfoenolpirüvatın pirüvata çevrilmesi bloke edilir. Ayrıca karaciğer pirüvat kinazı, glukagon ve epinefrinin etkisiyle camp aracılığıyla fosforillenir ve inhibe olur. Aynı etki kas pirüvat kinazında görülmez. Bir canlıda aynı reaksiyonu katalizleyen ve farklı kimyasal yapıya sahip olan enzimlere izoenzim adı verilir. İzoenzimlerin aktiviteleri, substrat, kofaktör ve inhibitörlere ilgileri farklıdır. Pirüvatın aminasyon ( N2 grubu takılması) ürünü olan alanin de bu enzimi inhibe eder. Çünkü alanin çokluğu pirüvat çokluğuna işaret eder. ekzokinaz da, glukoz 6 fosfat tarafından allosterik olarak inhibe edilir. Fosfofruktokinaz inhibe edildiği zaman, hücrede glukoz 6 fosfat konsantrasyonu yükselir ve hekzokinaz otomatikman inhibe edilir. Fakat karaciğerde yüksek glukoz 6 fosfat seviyelerinde de glukoz fosforillenerek glukoz 6 fosfata çevrilir. Bu işi hekzokinazın bir izoenzimi olan glukokinaz enzimi gerçekleştirir. Bu enzimin glukoz için KM değeri diğer hekzokinazdan daha büyüktür ve glukoz düzeyi yükselince aktivite gösterir. Bu yüzden glukokinaz yüksek glukoz konsantrasyonunda etkili olabilir. Bu enzimin hücre içi miktarı karbohidratça zengin diyet ve insülin tarafından artırılır. Aynı zamanda glukokinaz, hekzokinazdan farklı olarak kendi ürünü olan glukoz 6 fosfat tarafından inhibe edilmez. Bu enzimin görevi glukozun depolanma şekli olan glikojen sentezi ve pentoz fosfat yolu için glukoz 6 fosfat sağlamaktır. Fosfofruktokinaz glikoliz hızını belirlemekte niçin hekzokinazdan daha etkilidir? Bu sorunun cevabı, glukoz 6 fosfatın yalnız glikoliz ara bileşiği olarak değil de, glikojen sentezi ve pentoz fosfat yolu için de gerekli olmasının altında yatmaktadır Glukoz Dışındaki Diğer Monosakkaritlerin Glikolize Girişi İnsan besinindeki karbohidratların önemli bir kısmı fruktozdan ibarettir. Fruktoz, günde ortalama 100 gram kadar sükrozun bileşeni halinde diyetle alınır. Balda, sebze ve meyvelerde monosakkarit halinde bol bulunur. Fruktozun hücre içine girişi insülinden bağımsızdır ve glukozdan bir başka farklılığı da insülin salgılanmasını uyarmamasıdır. Sindirim yoluyla ince bağırsaklardan kana karışan fruktozun büyük bir kısmı, karaciğerde fruktoz 1 fosfat metabolik yolunda metabolize edilir. Bu yolun ilk basamağı fruktozun 1 no lu karbonunun fruktokinaz ile fosforilasyonudur. 78
86 Mg +2 Fruktoz + ATP Fruktoz-1-fosfat + ADP + Fruktokinaz + Meydana gelen fruktoz 1 fosfat, daha sonra fruktoz 1 fosfat aldolaz enzimi tarafından D-gliseraldehid ve dihidroksiaseton fosfata parçalanır. 2 P 3-2 Fruktoz-1-fosfat aldolaz -2 2 P Fruktoz-1-fosfat Dihidroksiaseton fosfat (DAP) D-Gliseraldehid Burada oluşan serbest D gliseraldehid, triozkinaz tarafından gliseraldehid 3 fosfata fosforillenir. Gliseraldehid + ATP Mg +2 Triozkinaz Gliseraldehid-3-fosfat + ADP Böylece oluşan dihidroksiaseton fosfat (DAP) ve gliseraldehid 3 fosfat (GA 3 P) glikolizin ara ürünleri olarak pirüvata kadar yıkılırlar. DAP, GA 3 P a izomerleşir ve glikoliz yoluna devam eder. Dihidroksiaseton fosfat Trioz fosfat izomeraz Gliseraldehid-3-fosfat Fruktoz, hekzokinaz vasıtasıyla da fruktoz 6 fosfata fosforillenebilir: Mg +2 Fruktoz + ATP Fruktoz-6-fosfat + ADP + + Fruktoz 6 fosfat glikoliz yolu ara ürünüdür. Ancak hekzokinazın glukoza ilgisi fruktozdan 20 kat daha büyüktür. Karaciğerde glukoz seviyesi yüksek olduğundan, fruktozun fruktoz 6 fosfata dönüşümü çok az miktarda gerçekleşir. Yağ dokusunda fruktoz seviyesi glukozdan çok daha yüksektir ve fruktozun büyük kısmı fruktoz 6 fosfat üzerinden metabolize edilir. Sorbitol, glukoz ve onun keton izomeri olan fruktozun şeker alkolüdür. Sorbitol yolu adı verilen iki enzimin görev yaptığı reaksiyonlarla, hayvan organizmasında, glukoz fruktoza çevrilebilir. Önce aldoz redüktaz enzimi, 79
87 Glukoz + NADP + + Sorbitol + NADP + dönüşümünü sağlar. Aldol redüktaz enzimi; eritrosit, böbrek, göz lensi, retinada bulunur ve şeker hastalarında hücre içi glukoz miktarı çok yükseldiğinden, özellikle lenste ve retinada bol miktarda sorbitol yığılması ve sonucunda ozmotik basınç artışı meydana gelerek görme kusurlarına yol açabilir. Sorbitol bazı hücrelerde sorbitol dehidrogenaz enzimi aracılığıyla fruktoza dönüştürülür: Sorbitol+ NAD + Fruktoz + NAD + + Sperm hücreleri gibi beslenmesinde fruktoza bağımlı olan hücreler için glukozdan fruktoz sentezi bu iki enzim tarafından gerçekleştirilir. Bir monosakkarit olan galaktoz, süt şekeri olan laktozun hidroliziyle meydana gelir. Galaktoz, 4 basamakta enzimatik reaksiyonla glukoz 6 fosfata dönüşür (Şekil 10.8.). İlk basamakta galaktoz, galaktokinaz vasıtasıyla galaktoz 1 fosfata fosforillenir: Mg Galaktoz + ATP +2 Galaktoz-1-fosfat + ADP + + Galaktokinaz Bu enzim, başta karaciğer olmak üzere birçok dokuda bulunur. İkinci basamakta galaktoz 1 fosfat, üridil transferaz tarafından katalizlenen aşağıdaki reaksiyonla UDP galaktoz meydana gelir. Bu enzimin eksikliğinde galaktozemi adı verilen genetik hastalık meydana gelir. Galaktoz-1-fosfat + UDP-Glukoz Üridil transferaz UDP-Galaktoz + Glukoz-1-fosfat 80
88 Şekil Galaktozun, glukoz 1 fosfata dönüştürülmesi. Dönüşüm bir şeker nükleotid türevi olan UDP glukozdan; galaktoz 1 fosfatın glukoz 1 fosfatla yer değiştirmesi sonucunda oluşan, UDP galaktoz aracılığıyla olur. UDP galaktoz daha sonra UDP glukoz epimerazla UDP glukoza dönüştürülür. UDP glukoz diğer tur için çevrime girer. Daha sonra, UDP galaktoz, UDP galaktoz 4 epimeraz vasıtasıyla UDP glukoza dönüşür. NAD + bu basamakta koenzim olarak görev yapar. UDP-Galaktoz NAD + UDP-Glukoz 4-epimeraz UDP-Glukoz 81
89 Böylece 2. basamakta kullanılan UDP glukoz tekrar kazanılmış olur. Son basamakta glukoz 1 fosfat fosfoglukomutaz vasıtasıyla glukoz 6 fosfata dönüşür ve bu da glikolize girer. Glukoz-1-fosfat Fosfoglukomutaz Glukoz-6-fosfat UDP galaktoz, aktifleşmiş galaktoz birimi vericisi olarak süt bezlerinde laktoz senteziyle glikoproteinlerin ve glikolipidlerin yapımında rol alır. Mannoz, diyetle alınan karbohidratlarda monosakkarit halinde çok az bulunur ve doğal besinlerdeki polisakkaritler ve glikoproteinlerin sindiriminden ortaya çıkar. D mannoz hekzokinaz vasıtasıyla fosforillenir. Mannoz + ATP ekzokinaz Mg +2 Mannoz-6-fosfat + ADP D mannoz 6 fosfat, mannoz fosfat izomeraz beraberliğinde dönüşümlü olarak bir glikoliz ara ürünü olan fruktoz 6 fosfata izomerize edilir: Mannoz fosfat izomeraz Mannoz-6-fosfat Fruktoz-6-fosfat Vücut ihtiyacı olan mannozu da bu reaksiyon dönüşümü ile sağlar Pirüvatın Etanol, Laktat ve Asetil oa ya Çevrilmesi Glukozun pirüvata çevrilmesini gerçekleştiren reaksiyon serisi bütün organizmalarda ve her çeşit hücrede hemen hemen aynıdır. Bunun aksine metabolik enerjinin elde edilmesi için pirüvatın daha sonraki geleceği farklılık arzetmektedir. Şimdi pirüvatın maruz kaldığı üç metabolik yolu özetleyelim: 1. Maya hücrelerinde ve bazı mikroorganizmalarda pirüvattan, etanol sentezlenir. Bu dönüşümün ilk reaksiyonu pirüvatın dekarboksilasyonudur. Pirüvat + + Pirüvat dekarboksilaz Asetaldehid + TPP 2 Bu reaksiyon koenzim olarak tiamin pirofosfat (TPP) içeren pirüvat dekarboksilaz enzimi tarafından katalizlenir (Şekil 8.2.). Pirüvat dekarboksilaz karakteristik olarak bira ve ekmek mayasında, bazı bitkiler dahil alkol fermentasyonu yapan diğer tüm organizmalarda vardır. İkinci reaksiyon ise asetaldehidin etanole indirgenmesidir. Bu reaksiyon koenzim olarak NAD + içeren alkol dehidrogenaz tarafından katalizlenmektedir. İnsan dahil, alkolü metabolize eden pek çok organizmada alkol dehidrogenaz vardır. Bu enzim, insan karaciğerinde diyetle alınan veya bağırsak mikroorganizmalarının ürettiği etanolün yükseltgenmesini, NAD + nin NAD ye indirgenmesiyle katalizler. 82
90 - 3 Pirüvat + 2 Pirüvat dekarboksilaz TPP 3 Asetaldehid NAD + + NAD + Alkol dehidrogenaz 3 Etanol Glukozun etanole çevrilmesi olayına alkolik fermentasyon adı verilir. Bu anaerobik prosesin net reaksiyonu şöyledir: Glukoz + 2P i + 2ADP Etanol ATP Net reaksiyonda NAD + ve NAD ın bulunmadığı görülmektedir. Asetaldehidin etanole indirgenmesiyle oluşan NAD +, glikolizde gliseraldehid 3 fosfat dehidrogenaz enzimi tarafından katalizlenen 1,3 bisfosfogliserat oluşumu reaksiyonda (6. reaksiyon basamağı) tekrar kullanılmaktadır. 2. Birçok mikroorganizmalar (anaerobik), mitokondrisi olmayan eritrositler ve eksersiz halindeki kaslarda olduğu gibi, yeterli oksijeni bulamayan bazı yüksek organizma hücrelerinde pirüvat, laktata çevrilir. murgalıların çoğu esasında aerobik organizmalardır; glukozu glikolizle pirüvata çevirirler. Sonra 2 yi kullanarak pirüvatı tamamen 2 ve 2 ya yükseltgerler. Glukozun laktata anaerobik yıkımı, şiddetli kas aktivitesi esnasında olur. Çünkü oksijen kaslarda pirüvata yükseltgeyecek hızda taşınamaz. Pirüvatın NAD tarafından indirgenmesiyle laktatın oluşumu, laktat dehidrogenaz enzimi tarafından katalizlenir. - - Laktat dehidrogenaz + NAD NAD + G o =-25.1 kj/mol 3 Pirüvat 3 Laktat Glukozun, laktata çevrilmesi reaksiyonlarının net denklemi şöyledir: Glukoz + 2P i + 2ADP 2Laktat + 2ATP Aynen alkolik fermentasyonda olduğu gibi net bir redoks olayı yani herhangi bir elektron alış verişi yoktur. Gliseraldehid 3 fosfatın yükseltgenmesiyle ortaya çıkan NAD, pirüvatın indirgenmesinde kullanılmıştır. Bu indirgenme sonucu ortaya çıkan NAD +, yine anaerobik şartlarda glikolizin devamını sağlar. Eğer NAD + rejenere edilmezse, glikoliz olayı gliseraldehid 3 fosfattan ileri yürüyemez ve ATP sentezlenemez. Bir bakıma pirüvatın laktata çevrilmesiyle organizma zaman kazanır. 83
91 Glukoz 2NAD 2NAD + 2Pirüvat 2Laktat luşan laktat, karaciğerde glukoneogenez ile tekrar glukoz ve glikojene çevrilir. Bir anlamda da kas yükünün bir bölümünü karaciğere devredilmiş olur. 3. Laktat veya etanole çevrilme esnasında glukozdaki kimyasal enerjinin yalnız küçük bir bölümü açığa çıkar. Sitrik asit çevrimi ve elektron transport zinciri vasıtasıyla aerobik olarak daha fazla enerji elde edilebilir. Bu oksidatif yola giriş asetil oa ile olur. Asetil oa, pirüvatın mitokondri matriksinde oksidatif dekarboksilasyonu ile oluşur: Pirüvat + NAD + + oa PD Asetil oa NAD + + Pirüvat dehidrogenaz enzim kompleksi (PD) tarafından katalizlenen bu reaksiyon sitrik asit çeviriminde daha geniş olarak anlatılacaktır. Bu reaksiyon ve gliseraldehid 3 fosfatın oksidasyonu için gerekli olan NAD +, NAD ın mitokondri iç membranındaki taşıma zincirinde elektronlarını 2 ye aktarması sonucu yeniden oluşur ,3 Bisfosfogliseratın (2,3 BPG) 2 Taşımasındaki Rolü 2,3 Bisfosfogliserat, eritrositlerdeki 2 taşınmasında düzenleyici bir role sahiptir. emoglobine oksijen bağlanması 2,3 BPG tarafından düzenlenir. Kırmızı kan hücreleri, yüksek konsantrasyonda 2,3 BPG ihtiva ederken, diğer hücrelerde eser miktarda bulunur. emoglobinin 2(g) bağlaması, +, 2 ve 2,3 BPG ile düzenlenir (Bohr etkisi). Yoğun çalışan iskelet kasında + ve 2 artması 2 nin hemoglobinden ayrılmasını uyarır. b b emoglobin, derişimin yüksek olduğu akciğerde 2(g) bağlar ve periferal dokulara taşır. Eritrositlerdeki proteinin % 95 i hemoglobindir. Eritrositlerde yüksek oranda 2,3 BPG bulunur ve hemoglobinin 2 e ilgisini azaltır. Deniz seviyesinde hemoglobin 2 e doygun, dokularda % 60 doygundur. Dokulara bırakılan oksijen % 40 a yakındır. Yüksek irtifada, dokulara bırakılan 2 miktarı kanda taşınabilen miktarın % 30 una düşer. Yüksek irtifada, 2,3 BPG derişimindeki artış, 84
92 hemoglobinin oksijene ilgisini azaltır, taşınabilen oksijenin yaklaşık % 40 ı tekrar dokulara bırakılabilir. Glikolizin 6. reaksiyon basamağında alternatif bir reaksiyon 2,3 bisfosfogliserat oluşturur. 1,3 bisfosfogliserat, eritrositlerde hemoglobinin oksijen taşımasında önemli bir rol oynayan 2,3 BPG a izomerleştirilir. 2,3 BPG nin sentez ve yıkımı glikoliz dışında bazı yan reaksiyonlar vasıtasıyla gerçekleştirilir. Gliseraldehid-3-fosfat 1,3-Bisfosfogliserat Mutaz Fosfataz 2,3-Bisfosfogliserat (2,3-BPG) 3-Fosfogliserat 2 P i 2-Fosfogliserat Bisfosfogliserat mutaz, 1,3 BPG yi 2,3 BPG ye çevirir. 2,3 BPG de 3 fosfogliserata 2,3 bisfosfogliserat fosfataz enzimi katalizörlüğünde hidrolizlenir. Eritrositlerde glikoliz yolu ve oksijen taşınması birbirine 2,3 BPG ile bağlantılıdır. Bu yüzden glikoliz yolundaki bir arıza oksijen taşınmasını etkileyecektir. Gerçekten kırmızı kan hücrelerinde kalıtsal glikoliz yolu bozukluğu olan bazı hastalara ait kan oksijen ayrışma eğrilerinde bazı değişmelere rastlanmıştır (Şekil 10.9.). Şekil Normal (ortadaki eğri), hekzokinaz ve pirüvat kinaz yetersizliğine sahip kırmızı kan hücrelerinin oksijen ayrışma eğrileri. 85
93 ekzokinaz yetersizliğinde glikoliz ara ürünlerinin konsantrasyonu düşük bulunur. Çünkü ilk reaksiyon basamağı olan glukoz fosforillenmesi bozulmuştur. Bunun sonucu düşük 2,3 BPG seviyesi hemoglobinin anormal yükseklikte oksijen afinitesine ve dokulara bırakılan 2 nin azalmasına sebep olur. Bu olayın tam tersi pirüvat kinaz yetersizliğinde görülür. Son basamağın inhibisyonu yüzünden 2,3 BPG nin konsantrasyonu normalin yaklaşık iki misline çıkar. Bu da düşük oksijen afinitesine ve dokulara bırakılan 2 nin artmasına yol açar SİTRİK ASİT (TA) ÇEVRİMİ Glikoliz olayında glukoz, iki mol pirüvat molekülüne çevrilmektedir. Aerobik şartlarda glukozdan enerji üretiminin daha sonraki basamağı, mitokondri matriksinde pirüvatın oksidatif dekarboksilasyonu ile asetil oa oluşumudur. Bu aktifleşmiş asetil biriminin, mitokondri matriksinde 2 ye kadar tamamen oksitlenmesi reaksiyonları serisine sitrik asit çevrimi, trikarboksilik asit çevrimi (TA) veya Krebs çevrimi adı verilir. Sitrik asit çevrimi; aminoasitler, yağ asitleri ve karbohidratlar gibi yakıt bileşikleri oksidasyonunun en son ortak yoludur. Yakıt bileşiklerinin birçoğu çevrime asetil oa olarak girer. TA çevrimi, aynı zamanda biyosentezde kullanılan ara bileşiklerin sağlandığı bir metabolik yoldur. Pirüvat Dehidrogenaz Enzim Kompleksi (PD) Başlıca glikoliz yoluyla olmak üzere, sitoplazmada oluşan pirüvat; iç membranda bulunan spesifik taşıyıcı protein tarafından bir + beraberliğinde veya - karşılığında mitokondri matriksine taşınır. Glikoliz ile TA çevrimi arasındaki bağlantı, mitokondri matriksinde pirüvatın asetil oa ya oksidatif dekarboksilasyonla çevrilmesi sonucu kurulmaktadır. - 3 Pirüvat + oas + NAD + PD 3 S oa NAD + + G o = kj/mol Asetil oa Glikoliz ürünü olan pirüvatın asetil oa ya dönüşümsüz olarak çevrilmesini sağlayan bu reaksiyonun pirüvat dehidrogenaz enzim kompleksi (PD) tarafından katalizlendiğini daha önceden belirtmiştik. Bu enzim kompleksi üç çeşit enzimin organize bir topluluğudur (Tablo 10.2.). Bu reaksiyon, stokiyometrisinde görüldüğünden çok daha karmaşıktır. oa ve NAD + gibi denklemde yer alan kofaktörlerin yanı sıra, prostetik grup olarak tiamin pirofosfat (TPP), lipoamid ve FAD koenzimlerini de ihtiva eder. 86
94 Pirüvatın asetil oa ya çevrilmesi dört basamakta gerçekleştirilir. Önce pirüvat TPP ile birleşerek dekarboksile olur. Bu reaksiyon, multienzim kompleksinin pirüvat dehidrogenaz bileşeni tarafından kataliz edilir. Pirüvat dehidrogenaz bileseni. (E 1 ) Pirüvat + TPP idroksietil-tpp + 2 İkinci basamak reaksiyonda, TPP ye bağlı hidroksietil oksitlenerek asetil grubu halinde lipoamide aktarılır. Bu reaksiyon multienzim kompleksinin bir kısmı olan dihidrolipoil transasetilaz enzimi tarafından katalizlenir ve asetillipoamid oluşur. Dihidrolipoil transasetilaz (E idroksietil-tpp + Yükselgenmis lipoamid 2 ). Asetil lipoamid + TPP Üçüncü basamakta, asetil grubu oa ya aktarılarak asetil oa oluşur. Bu reaksiyon da dihidrolipoil transasetilaz tarafından katalizlenir. Asetil lipoamid + oas Dihidrolipoil transasetilaz (E 2 ) Asetil oa + indirgenmis. lipoamid Tablo E.coli nin pirüvat dehidrogenaz kompleksi Enzim Zincir Prostetik Katalizlediği Reaksiyon Sayısı Grup Pirüvat dehidrogenaz birimi (E 1) 24 TPP Pirüvatın dekarboksilasyonu Dihidrolipoil transasetilaz (E 2) 12 Lipoamid 2 nolu karbonun oksidasyonu ve oa ya transferi Dihidrolipoil dehidrogenaz (E 3) 12 FAD Lipoamidin yükseltgenmiş formunun tekrar oluşumu Dördüncü reaksiyon basamağında lipoamidin yükseltgenmiş hali tekrar kazanılarak reaksiyon tamamlanır. Bu reaksiyonda yükseltgeyici NAD + olup, olay dihidrolipoil dehidrogenaz tarafından katalizlenir. FAD, bu enzimin prostetik grubudur. Dihidrolipoil dehidrogenaz (E indirgenmis lipoamid + FAD 3 ). Yükselgenmis. lipoamid + FAD 2 FAD 2 + NAD + FAD + NAD + + Şimdi bu karmaşık reaksiyonu aşağıdaki şema ile özetleyelim: 87
95 3 - TPP (E 1 ) 3 S (E 2 ) L S oa-s 2 3 TPP L S S L S S 3 S oa FAD 2 (E 3 ) FAD NAD + NAD + + Üç çeşit enzimin yapı olarak iç içe organizasyonu, bu karışık reaksiyonun koordineli olarak katalizine fırsat vermektedir. Bu reaksiyonun bütün ara bileşikleri komplekse sıkıca bağlı olarak bir enzimden diğerine aktarılmaktadır TA Çevrimi Reaksiyonları Pirüvatın oksidatif dekarboksilasyonu sonucu oluşan asetil oa, sitrik asit çevrimine girer. ans Krebs tarafından aydınlatılan bu çevrimdeki olayları kısaca ve şematik olarak gözden geçirelim: 2 (Asetil oa) 6 (Sitrat) NAD 2 4 (kzalasetat) 5 ( -ketoglutarat) NAD FAD 2 GTP 4 (Süksinat) 2 NAD TA çevriminin ilk reaksiyonunda dört karbonlu bir bileşik (okzalasetat) ile iki karbonlu bir asetil birimi kondanze olarak, altı karbonlu bir trikarboksilik asit (sitrat) meydana getirirler. Sitrat da dekarboksile olarak, beş karbonlu bir bileşik (α ketoglutarat) oluşur ve bunun da oksidatif dekarboksilasyonu ile dört karbonlu dikarboksilik asit (süksinat) meydana gelir. Daha sonra süksinat çeşitli oksidasyon basamaklarından geçerek tekrar okzalasetata 88
96 çevrilerek çevrim tamamlanır. Bu suretle asetil birimi halinde çevrime giren iki karbon, iki adet 2 halinde çevrimden ayrılır. Bu olayda asetil birimi başına dışarı verilmiş olan 8 elektron, metabolizmadaki elektron taşıyıcıları tarafından alınacaktır. Gerçekten 6 elektron üç tane NAD + ya transfer olurken, iki elektron da FAD ye aktarılır. Burada oluşan 3NAD ve 1FAD2 elektron transport zincirinde 2 tarafından oksitlenirken 11 molekül ATP meydana getirirler. Bunun yanı sıra bir çevrimde, yüksek enerjili fosfat bağına sahip bir de GTP sentezlenir. Böylece, asetil birimi başına 12 ATP sentezlenmiş olur. Sitrik asit çevriminin sekiz basamağı vardır. Sitrik asit çevriminin sekiz ardışık reaksiyonunun incelenmesinde, asetil oa ve okzalasetatdan sitratın oluşmasına ve 2 oluşturmak için sitratın oksitlenmesine ve bu oksidasyon enerjisinin NAD ve FAD2 de korunmasında yer alan dönüşümlere özel önem verilecektir. Şimdi sitrik asit çevriminin ardışık reaksiyonlarını enzimleriyle beraber tek tek inceleyelim: 1. Sitrat luşumu Çevrim; okzalasetatın, asetil oa nın asetil grubuyla birleşme reaksiyonu ile başlar. Bu reaksiyonun bir basamağı bir hidroliz reaksiyonu olduğundan bir 2 molekülü de kullanılır Sitrat sentaz S oa 2 - kzalasetat Asetil oa Sitrat S oa G o =-32.2 kj/mol Bir aldol kondenzasyonunu hidrolizin takip ettiği bu reaksiyon, sitrat sentaz enzimi tarafından katalizlenir. Önce okzalasetat, asetil oa ile kondanse olarak sitroil oa oluşturur, bu da sitrat ve oa ya hidroliz olur. 2 S oa Sitroil oa 89
97 2. cis Akonitat Üzerinden İzositrat luşumu İkinci reaksiyon, sitratın önce bir dehidrasyon, daha sonra da bir hidrasyon olayı ile izositrata dönüştürülmesidir. Bunun sonucu olarak, molekül karbon atomları arasında ve değişimi görülür. er iki basamağı da katalizleyen enzime, ara bileşik cis akonitatdan dolayı akonitaz adı verilir Akonitaz - 2 Akonitaz - 2 G o = kj/mol - Sitrat - cis-akonitat - izositrat 3. İzositratın α Ketoglutarat ve 2 ye ksidasyonu İzositratın α ketoglutarata oksidatif dekarboksilasyonu, izositrat dehidrogenaz enzimi tarafından katalizlenir. Reaksiyonun ara bileşiği okzalosüksinat olup; enzime bağlı iken hemen 2 ve α ketoglutarata parçalanır izositrat NAD(P) + NAD(P) izositrat dehidrogenaz - 2 G o = kj/mol kzalosüksinat -Ketoglutarat α-ketoglutaratın oluşum hızı ileride ayrıntılı olarak anlatacağımız gibi, çevrimin toplam hızını belirlemede önemli bir role sahiptir. ücrelerde iki çeşit izositrat dehidrogenaz enzimi vardır. Bunlardan birisi NAD + yı, diğeri de NADP + yı koenzim olarak kullanır. Sitrik asit çevriminde önemli olan NAD + lı enzim mitokondride yer alırken, NADP + bağımlı enzim hem mitokondri hem de sitozolde bulunur ve farklı bir metabolik role sahiptir. 4. α Ketoglutaratın Süksinil oa ve 2 ye ksidasyonu TA çevriminin dördüncü reaksiyonu, α ketoglutaratın oksidatif dekarboksilasyonu ile süksinil oa ya çevrilmesidir. 90
98 - NAD + NAD + + S oa 2 + S 2 - -Ketoglutarat oa 2 -Ketoglutarat dehidrogenaz 2 multi enzim kompleksi - Süksinil oa + 2 G o = kj/mol Bu reaksiyon, üç çeşit enzimin yer aldığı organize bir yapıya sahip α-ketoglutarat dehidrogenaz multienzim kompleksi tarafından katalizlenir. Bu reaksiyon mekanizması, pirüvatın asetil oa ya çevrilmesine çok benzemektedir. Aynı kofaktörler (NAD +, oa, TPP, lipoamid ve FAD) kullanılır. Gerçekten pirüvat dehidrogenaz ve α ketoglutarat dehidrogenaz multienzim komplekslerin birçok ortak yapısal özellikleri vardır. 5. Süksinil oa nın Süksinata Dönüşümü Beşinci basamakta, süksinil oa sentetaz enzimi tarafından katalizlenen aşağıdaki reaksiyon yer alır: 2 2 S - Süksinil oa oa + GDP + P i Süksinil oa sentetaz Süksinat + GTP + oa G o = -2.9 kj/mol Süksinil oa daki tiyoester bağı enerjice zengin bir bağdır ve hidroliz ΔG o değeri -8.0kcal/mol dür. Bu tiyoester bağının parçalanması guanozin difosfat (GDP) ın fosforillenmesiyle beraber yürür. GTP deki fosforil grubu kolayca ADP ye aktarılarak ATP sentezlenir. ATP ve GTP enerji yönünden eşdeğerdir. Nükleosit difosfat kinaz GTP + ADP GDP + ATP G o = 0 kj/mol şeklinde gösterilen bu transfer reaksiyonu nükleosit difosfat kinaz enzimi tarafından katalizlenir. Süksinil oa dan yüksek enerjili bir fosfat bağının oluşumu, substrat seviyesinde fosforilasyona bir örnektir. 6. Süksinatın Fumarata ksidasyonu Süksinatın fumarata oksidasyonu süksinat dehidrogenaz enzimi tarafından katalizlenir. 91
99 - FAD FAD Süksinat dehidrogenaz G o = 0 kj/mol - Süksinat - Fumarat Burada hidrojen alıcısı NAD + yerine FAD dır. Çünkü bu reaksiyonun serbest enerjisi NAD + yi indirgemeye yeterli değildir. Bu tip reaksiyonlarda elektron alıcısı olarak genellikle FAD rol alır. Süksinat dehidrogenaz enziminde bir histidin yan grubu, FAD nın izoalloksazin halkasıyla kovalent bağlandığında enzim E FAD şeklinde gösterilebilir. Süksinat dehidrogenaz FAD nin yanı sıra dört adet Fe ve dört adet de inorganik sülfür (S) ihtiva eder. Bu tipteki bir protein, demir-sülfür (Fe S) proteini adını alır. Bu proteinler mitokondri ve kloroplastların elektron taşıyıcı sistemlerinde önemli bir rol oynarlar. Süksinat dehidrogenaz, birisi bir FAD ve iki Fe S kümesi; diğeri de tek bir Fe S kümesi taşıyan iki alt birimden ibarettir. Bu enzim, iç mitokondri zarının bir integral proteini olarak da TA çevriminin diğer enzimlerinden ayrılır. Gerçekten süksinat dehidrogenaz elektron transport sistemine (ETS) direkt bağlıdır. FAD2 oluştuğu zaman NAD gibi enzimden ayrılmaz ve yapısındaki iki elektronu doğrudan enzimdeki Fe +3 atomlarına ve oradan da ETS deki oq ya aktarır. 7. Fumaratın Malata idrasyonu Fumaratın, L-malata tersinir hidrasyonu, fumaraz enzimi tarafından katalizlenir. Bu enzim yüksek derecede stereospesifiktir. Fumaratın trans çift bağının hidrasyonunu katalizler. + ve -, fumarata trans halde katılarak yalnız L malat izomerini oluşturur. - 2 Fumaraz - G o = -3.8 kj/mol - Fumarat - L-Malat 8. Malatın kzalasetata ksidasyonu Sitrik asit çevriminin son reaksiyonunda NAD + bağlı L malat dehidrogenaz, malatın okzalasetata oksidasyonunu katalizler. 92
100 - NAD + NAD L-Malat dehidrogenaz 2 G o = 29.7 kj/mol - L-Malat - kzalasetat Bu reaksiyonun standart şartlar altında, okzalasetat oluşumu yönünde ilerlemesi olasılığı çok zayıftır. Ancak, okzalasetat yüksek egzergonik sentez reaksiyonuyla (basamak 1) sürekli olarak uzaklaştırılır ve hücre içindeki derişimi ileri düzeyde düşük (<10-6 M) olur. Sonuçta malat dehidrogenaz, reaksiyonu okzalasetat oluşumu yönünde sürükler. Sitrik asit çevriminin stokiyometrik denklemi aşağıdaki gibidir: Asetil oa+3nad + +FAD+GDP+P i NAD +FAD 2 +GTP oas Bu stokiyometrik eşitliği veren TA çevriminin bütün reaksiyonları Tablo de ve Şekil da özetlenmiştir. Tablo Sitrik asit çevrimi reaksiyonları. Reaksiyon Enzim Kofaktör ΔG o (kj/mol) Asetil oa+zalasetat Sitrat + oa + Sitrat sentaz oa 32,2 Sitrat cis-akonitat + 2 izositrat Akonitaz Fe ,3 izositrat + NAD + -ketoglutarat NAD + + İzositrat NAD + 20,9 dehidrogenaz -ketoglutarat + NAD + + oa Süksinil oa NAD + + α ketoglutarat dehidrogenaz kompleksi Süksinil oa + GDP + P i Süksinat + GTP + oa Süksinil NAD +, oa, TPP, lipoat, FAD 33,5 oa 2,9 oa sentetaz Süksinat + FAD Fumarat + FAD 2 Süksinat FAD 0,0 dehidrogenaz Fumarat + 2 L-Malat Fumaraz 3,8 L-Malat + NAD + kzalasetat + NAD + + Malat dehidrogenaz NAD + +29,7 93
101 Şekil Sitrik asit çevriminin reaksiyonları. Kutu içindeki karbon atomları döngünün ilk turunda asetil oa nın asetatından türetilmiş olanlardır. Bunlar ilk turda 2 olarak ayrılan karbonlar değildir. er bir reaksiyon basamağının yanındaki numara, metinde geçen numaraya karşılıktır. İnce oklar, FAD 2 ve NAD + + oluşturmak için elektronun FAD veya NAD + ya transferiyle enerjinin nerede depolanacağını göstermektedir. Basamak 1, 3 ve 4 hücrede esas olarak tersinmezdir; diğer tüm basamaklar tersinirdir. Basamak 5 in ürünü; katalizörün hangi süksinil oa sentaz izozimi olduğuna bağımlı olarak, ya ATP yada GTP dir. 94
102 Sitrik asit çevrimindeki oksidasyonların enerjisi verimli bir şekilde depolanır. Buraya kadar sitrik asit çevriminin tam bir turunu gözden geçirdik (Şekil ). Bir tane iki karbonlu asetil grubu, okzalasetatla birleşerek çevrime girdi. İki karbon atomu; izositrat ve α ketoglutaratın oksidasyonu ile iki molekül 2 olarak açığa çıktı. Bu oksidasyonla açığa çıkan enerji, üç NAD + ve bir FAD nin indirgenmesinde ve bir GTP veya ATP nin oluşumunda korundu. Çevrimin sonunda bir molekül okzalasetat yeniden elde edilir. Şekil Sitrik asit çevriminin bir turunun ürünleri. Üç NAD, bir FAD 2, bir GTP (veya ATP) ve iki 2 oksidatif dekarboksilasyon reaksiyonlarında salınır. Burada ve gelecek şekillerin bir kısmında, döngü (çevrim) reaksiyonlarının hepsi tek yönde gösterilmiştir. Şekil da görüldüğü gibi, reaksiyonların çoğunun tersinir olduğunu unutmayınız Sitrik Asit Çevriminin Düzenlenmesi Çevreleri ile dengede olmamalarına karşın, yetişkin organizmalar genellikle kararlı bir durumdadır. rganizma sabit bir şekilde enerji ve besin maddelerinin alımını ve sabit bir şekilde artık ürünleri bırakmayı başararak, sabit bir bileşimi korur. Kararlı durum, dış çevre şartlarındaki veya enerji destekli bazı değişikliklerle bozulduğu zaman; tek tek metabolik yollarda geçici olarak değişen akış, her bir metabolik yolun iç düzenleyici mekanizmasını tetikler. 95
103 Metabolik yollardaki anahtar enzimlerin allosterik etkenlerle ve kovalent modifikasyonla düzenlenmesi, hücrenin kararlı denge durumunda kalmasını sağlayacak gerekli oranlardaki ara maddelerin ve ürünlerin meydana getirilmesini, savurganlığın önlenmesini sağlar. Karbon atomlarının, sitrik asit çevrimi boyunca pirüvattan akışı iki düzeyde sıkı düzenlenme altındadır: sitrik asitin başlangıç maddesi olan pirüvatın asetil oa ya dönüşümü (pirüvat dehidrogenaz kompleksi reaksiyonu) ve asetil oa nın çevrime girişi (sitrat sentaz reaksiyonu). Pirüvat, asetil oa nın tek kaynağı değildir ve birçok hücrede yağ asitlerinin ve belirli aminoasitlerin oksidasyonundan da elde edilir. Ara maddelerin diğer yollarla sağlanması, pirüvatın oksidasyonu ve sitrik asit çevriminin düzenlenmesinde de önemlidir. Ayrıca çevrim, izositrat dehidrogenaz ve α ketoglutarat reaksiyonlarıyla da düzenlenir Pirüvatın Dehidrogenaz Kompleksinin Kontrolü Pirüvattan asetil oa nın oluşumu, metabolizmada kilit konumda bulunan dönüşümsüz bir reaksiyondur. Pirüvat + NAD + + oa PD Asetil oa NAD + + G o = kj/mol Çünkü hayvansal organizmalar asetil oa yı glukoza dönüştürecek metabolik yoldan yoksundur. Bu reaksiyon sonunda, glukozun karbon atomlarından oluşan asetil oa iki metabolik yola girebilir. Birincisi, beraberinde enerjinin açığa çıktığı TA çevrimiyle 2 ye yükseltgenmesi ve ikincisi de, lipidlere çevrilmesidir. Bundan dolayı pirüvat dehidrogenaz kompleksinin aktivitesi çok yönlü olarak düzenlenmelidir. Asetil oa nın pirüvat dehidrogenaz kompleksinin katalizlediği reaksiyonla oluşumu allosterik ve kovalent mekanizmalarla düzenlenir (Şekil ). Bu düzenleme üç seviyede gerçekleştirilir: 1. Ürün inhibisyonu ile:pirüvat oksidasyonunun ürünleri olan NAD ve asetil oa, enzim kompleksini inhibe eder. Bu etki oa ve NAD + tarafından ortadan kaldırılır. 2. Nükleotidlerin inhibisyonu: Enzim kompleksinin aktivitesi enerji yükü tarafından da kontrol edilir. Enzimin pirüvat dehidrogenaz bileşeni GTP ile inhibe edilirken, AMP tarafından tekrar aktive edilir. Yine kompleks aktivitesi, kullanılabilecek enerji yükü olduğu zaman azaltılır. 3. Kovalent modifikasyon ile düzenlenmesi: Kompleksinin pirüvat dehidrogenaz bileşeni üzerindeki spesifik bir serin rezidüsü, ATP tarafından fosforillendiği zaman, kompleks aktivitesini tamamen kaybeder. Fosforilasyon, yeterli metabolik enerjinin göstergesi olan yüksek ATP/ADP, asetil oa/oa ve NAD/NAD + oranlarında artarken, enzim kompleksi aktivitesini tamamen kaybeder ve pirüvat tarafından, fosforilasyon inhibe 96
104 edilir. Enzim kompleksi fosforil grubunun spesifik bir fosfataz enzimi tarafından hidrolizlenmesi sonucu tekrar aktif hale geçer. Buradaki fosforilasyon hormona bağımlı ve AMP aracılı değildir. Şekil Sitrik asit çevrimi boyunca pirüvattan metabolit akışının düzenlenmesi. Pirüvat dehidrogenaz kompleksi, yeterli metabolik enerji durumunun göstergesi olan yüksek [ATP]/[ADP] ve [NAD]/[NAD + ] ve [asetil oa]/[oa] oranlarıyla allosterik olarak inhibe edilir. Bu oranların azalması, pirüvat oksidasyonunun allosterik aktivasyonuna yol açar. Çevrimin akış hızı, okzalasetat ve asetil oa gibi sitrat sentaz substratlarının veya üç NAD + ya bağımlı oksidasyon basamağını yavaşlatan NAD + (NAD ye dönüşümü) ile sınırlandırılabilir. Ayrıca süksinil oa, sitrat ve ATP ile olan geri beslemeli (feed back) inhibisyon; ilk basamakları inhibe ederek çevrimi yavaşlatır. Kas dokusunda a +2, kasılmayla harcanan ATP nin yerine konması için enerji üreten metabolizmayı uyarır. 97
105 Sitrik Asit Çevriminin Kontrolü Sitrik asit çevrimindeki metabolitlerin akışı sıkı düzenlenme altındadır. TA çevrimindeki akışı üç faktör yönetir: Substrat varlığı, ürünlerin birikimiyle inhibisyon ve çevrimin ilk basamaklarını katalizleyen enzimlerin allosterik geri beslemeli (feed back) inhibisyonu. TA çevrimindeki kuvvetli ekzotermik dönüşümsüz basamaklardan sitrat sentaz, izositrat dehidrogenaz ve α-ketoglutarat dehidrogenazla katalizlenen her biri (Şekil ve Şekil ) bazı şartlar altında devrin hızını kontrol edebilir. kzalasetat ve asetil oa dan sitratın sentezlendiği reaksiyon, çevrimdeki önemli bir kontrol noktasıdır. ATP, sitrat sentazın allosterik bir inhibitörüdür ve enzimin asetil oa ya karşı KM değerini artırır. Bunun sonucu olarak; ATP seviyesi yükseldikçe, daha az enzim asetil oa ile doyacağından daha az sitrat oluşacaktır. TA çevriminin en önemli kontrol noktası izositrat dehidrogenazdır. Bu enzim allosterik olarak ADP tarafından uyarılarak substratlarına afinitesi artırılır. İzositratın NAD +, Mg +2 ve ADP ye bağlanması kooperatif bir olaydır. NAD ise doğrudan NAD + nın yerini alarak enzimi inhibe eder. TA çevriminin üçüncü kontrol noktası, α-ketoglutarat dehidrogenaz enzimidir. Bu enzim kompleksinin kontrolü, pirüvat dehidrogenaz kompleksindeki duruma çok benzemektedir. Ürünleri olan NAD ile süksinil oa ve yüksek enerji yükü tarafından inhibe edilir. murgalı kasında, kasılmanın sinyali olan a +2 ve aynı zamanda ATP ihtiyacının artmış olması, izositrat dehidrogenaz, α-ketoglutarat dehidrogenazın her ikisini de ve pirüvat dehidrogenaz kompleksini de aktifleştirir. Kısaca yoldaki akış hızı, çevrimdeki substrat ve ara maddelerin derişimi, ATP ve NAD nın optimal derişimini sağlayacak şekilde ayarlanır. Normal koşullar altında, glikoliz ve sitrik asit çevriminin hızı, sitrik asit çevriminin kendi yakıtı olan asetil oa nın asetil gruplarını sağlamak için gerekli olan yeterli glukozun pirüvata metabolize edilmesi için entegre edilmiştir. Pirüvat, laktat ve asetil oa normalde sabit denge derişiminde tutulur. Glikolizin hızının sitrik asit çevriminin hızıyla uyuşması, sadece ATP ve NAD nın yüksek düzeylerinin inhibisyonu ile olmaz, aynı zamanda sitrat derişimiyle de olur. Sitrik asit çevriminin ilk ürünü olan sitrat, glikolitik yoldaki fosfofruktokinaz I enziminin önemli bir inhibitörüdür. 98
106 TA Çevrimi Ara Bileşiklerinin Biyosentetik Önemi TA çevriminin aynı zamanda biyosentez olaylarında kullanılmak üzere birtakım ara bileşikleri sağladığını da belirtmiştik. Mesela, porfirinlerdeki karbon atomlarının çoğu süksinil oa dan gelmektedir. Aminoasitlerin birçoğu α ketoglutarattan ve okzalasetattan aminasyonla türetilir (Şekil ). Aminoasit metabolizmasında bunu daha ayrıntılı olarak ele alacağız. Pirüvat Asetil oa Aminoasitler kzalasetat Sitrat Porfirinler Süksinil oa α-ketoglutarat Aminoasitler Şekil Sitrik asit çevriminin biyosentetik rolleri. Biyosentez için harcanan ara bileşikler, pirüvattan okzalasetatın oluşumu ile telafi edilirler. Burada önemli bir nokta da, sitrik asit çevriminin biyosentez olaylarında kullanılan ara bileşikleri telafi edebilmesidir. Mesela, okzalasetat protein sentezinde kullanılmak üzere aminoasitlere çevrildiği zaman, eğer yeniden okzalasetat üretilmezse TA çevrimi durur. Memelilerde asetil oa dan okzalasetat ve diğer TA çevrimi ara bileşiklerini sentezleyecek enzimler yoktur. Bunun yerine pirüvat, koenzimi biyotin olan pirüvat karboksilaz enzimi katalizörlüğü ile okzalasetata çevrilir (Şekil 8.10.). Burada, bütün karboksilaz tipi enzimlerin substrat olarak bikarbonat iyonunu (3 - ) kullandığının bilinmesinde fayda vardır. Pirüvat karboksilaz - Pirüvat ATP kzalasetat + ADP + P i Pirüvatın karboksilasyonu TA çevrimi ara bileşiklerinin telafi edildiği bir reaksiyon olmanın yanı sıra, pirüvattan glukozun sentezlendiği glukoneogenez yolunun önemli bir basamağıdır. 99
107 10.4. GLİKSİLAT ÇEVRİMİ Pirüvat dehidrogenaz multienzim kompleksi tarafından katalizlenen pirüvatın asetil oa ya dönüştürülmesi reaksiyonu dönüşümsüz olduğundan, hayvansal organizmalarda asetil oa dan karbohidratların sentezi mümkün değildir. İleride yağ asitlerinin metabolizmasında göreceğimiz gibi, yağ asitlerinin oksidasyonunda da asetil oa birimleri oluşur. Bu yüzden hayvansal organizmalarda lipidlerden şekerlerin sentez yolu kapalıdır. Fakat yüksek bitkilerde, E.coli gibi mikroorganizmalarda ve alglerde bulunan iki farklı enzim; bu organizmalarda lipidlerden şekerlerin ve diğer biyosentetik ara bileşiklerin oluşumuna fırsat verir. Bu enzimler, glioksilat çevrimi adı verilen ve TA çevriminin modifiye şekli olan bir metabolik yolda yer alırlar. TA çevriminde yer alan izositrattan malata kadar reaksiyon serisinin yerini, izositrat liyaz ve malat sentazın katalizlediği iki reaksiyon alır. Bu çevrimde önce bir asetil oa, izositrat oluşturmak üzere okzalasetatla kondanse olur. Bu noktada ilk farklı enzim olan izositrat liyaz katalizörlüğünde bir aldol parçalanmasıyla izositrat, süksinat ve glioksilata ayrılır: izositrat liyaz izositrat - Süksinat Glioksilat Meydana gelen glioksilat, ikinci farklı enzim malat sentaz katalizörlüğünde ikinci bir asetil oa ile kondanse olarak malat oluşturur: 3 S oa Asetil oa + - Glioksilat + 2 Malat sentaz oa-s - Malat Koenzim A Malat daha sonra bir başka asetil oa ile kondanse olabilecek okzalasetata oksitlenir (Şekil ). Glioksilatın her devrinde iki asetil oa girer ve biyosentetik yolda (özellikle glukoneogenezde ön bileşik olarak) kullanılacak bir süksinat ve elektron taşıyıcı bir NAD meydana gelir. 2Asetil oa + NAD Süksinat + 2oA + NAD
108 Şekil Glioksilat çevrimi. Sitrat sentaz, akonitaz ve malat dehidrogenaz, sitrik asit çevrimi enzimlerinin izozimleridir. İzositrat liyaz ve malat sentaz glioksilat devrine özgüdür. İki asetil grubunun çevrime girdiğine ve dört karbonun süksinat olarak ayrıldığına dikkat ediniz. Bu çevrim hücreye hem enerji hem de dört karbonlu bir biyosentetik ara bileşiği (süksinat) sağlar. Bu çevrime hayvansal organizmalarda rastlanılmaz, yüksek bitki tohumlarında çok bulunur. Bu tohumlarda trigliserid depolarındaki yağ asitlerinden türetilen asetil birimleri, süksinat yoluyla karbohidratlara çevrilir. Glioksilat çevrimiyle oluşan süksinat, mitokondriye gönderilir ve TA çevrimi enzimleriyle malata dönüştürülür. Malat dehidrogenazın sitozolik izoenzimi, malatı glukoneogenez öncülü olan okzalasetata oksitler. Böylece filizlenen tohumlar depo lipidlerinin karbonlarını glukoza dönüştürebilir. Yüksek bitkilerde TA çevrimi reaksiyonları mitokondrilerde meydana gelmesine rağmen; glioksilat devri, özellikle izositrat liyaz ve malat sentaz enzimleri başka sitoplazmik 101
109 organellerde yani glioksizomlarda bulunur. Glioksizomlar, bazı bitki dokularında bulunan özelleşmiş peroksizomlardır. Glioksizomlar tüm bitki dokularında her zaman bulunmaz. Gelişme öncesi dönemde bitkiler fotosentezle glikoz üretme yeteneğini kazanmadan, çok yağlı tohumlarda filizlenme sırasında glioksizomlar meydana gelirler. Böylece, filizlenen tohumlar depo lipidlerinin karbonlarını glukoza dönüştürebilir KSİDATİF FSFRİLASYN ksidatif fosforilasyon, aerobik organizmalarda enerji üreten metabolizmanın ulaştığı son noktadır. Karbohidratların, yağların ve aminoasitlerin parçalanmalarındaki tüm oksidatif basamaklar, oksidasyon enerjisi ile ATP nin sentezlendiği, hücresel solunumun son safhası olan bu noktada birleşir. Glikoliz, yağ asitleri oksidasyonu ve sitrik asit çevriminde oluşan NAD ve FAD2, enerjice zengin moleküllerdir. Çünkü, her biri yüksek indirgeme potansiyeline sahip olan bir elektron çifti taşır. Bu elektronlar 2 ye aktarıldığı zaman, büyük miktarda enerji salınır ve bu enerji de ATP sentezinde kullanılabilir. İşte NAD ve FAD2 den elektronların bir seri elektron taşıyıcıları vasıtasıyla 2 ye transferi beraberliğinde ATP nin sentezlendiği olaya oksidatif fosforilasyon adı verilir. Aerobik organizmalarda ATP nin en önemli kaynağı oksidatif fosforilasyondur. Mesela, glukozun 2 ve 2 ya oksidasyonunda elde edilen 36 ATP den 32 si oksidatif fosforilasyonla sağlanır. Bu olayın bazı önemli özellikleri şöyle özetlenebilir: 1. ksidatif fosforilasyon mitokondri iç membranında yer alan bir solunum zinciri (elektron taşıma sistemi (ETS) de denir) tarafından yürütülür. NAD ve FAD2 nin önemli bir kısmını sağlayan TA çevrimi ve yağ asitlerinin oksidasyonu, mitokondri iç membranına bitişik olan matriks sıvısında gerçekleşir. 2. NAD nin oksidasyonu 3 ATP, FAD2 nin ki ise 2 ATP verir (son yapılan araştırmalar, bu bileşiklerin sentezine sebep oldukları ATP nin tam sayıda olmadığını; sırasıyla 2.5 ve 1.5 olabileceğini göstermekte olsa da 3 ve 2 sayıları esas alınacaktır). ksidasyon ve fosforilasyon beraber yürüyen mekanizmalardır. 3. Solunum zinciri aralarında protein yapısındaki sitokromların da bulunduğu birçok çeşit elektron taşıyıcılarından ibarettir. Bu elektron taşıyıcıları artan indirgenme potansiyeline göre sıralanmıştır. NAD ve FAD2 den elektronların 2 ye taşıyıcılar tarafından basamak basamak transferi esnasında mitokondri matriksi dışına protonlar pompalanır ve bir membran potansiyelinin oluşmasına yol açar (proton motif kuvvet). Protonlar, üç çeşit elektron transfer kompleksi tarafından pompalanır. Bu protonların, bir enzim kompleksi içinden 102
110 mitokondri matriksine geri akışı esnasında da ATP sentezlenir. Yani oksidasyon ve fosforilasyon olayları, iç mitokondri membranı üzerindeki, bir proton gradienti ile bağlantılıdır. Solunum zinciri enzimleri, iç mitokondri membranının integral proteinleridir. Dış membran birçok küçük molekül ve iyonlara karşı geçirgen olmasına karşılık; mitokondri iç membranı hemen hemen bütün iyonları ve yüksüz moleküllerin çoğunu geçirmez. ADP ve uzun zincirli yağ asitleri gibi bazı molekül ve iyonların matrikse taşınması, iç mitokondri membranında bulunan spesifik protein yapısında taşıyıcılar aracılığıyla gerçekleşir İndirgenme Potansiyelleri ve Serbest Enerji Değişimleri Standart indirgenme potansiyelleri, serbest enerji değişikliğini hesaplamak için kullanılır. ksidatif fosforilasyonda NAD ve FAD2 nin elektronlarını 2 ye transfer etme potansiyelleri, ATP nin fosfat transfer potansiyeline dönüştürülmektedir. Fosfat transfer potansiyelinin ölçüsü olarak, önceden ΔG o değerini tanımlamıştık. Elektron transfer potansiyeline karşılık gelen E o ile gösterilen redoks (indirgenme yükseltgenme) potansiyelidir. Redoks potansiyeli elektrokimyasal bir kavramdır. Yükseltgenmiş ve indirgenmiş hali X ve X - olan madde, bir ikili redoks çifti olarak isimlendirilir. Bu çiftin redoks potansiyeli, bir numune yarı pilinin, bir standart referans yarı piline göre ortaya çıkan elektromotor kuvvetin ölçüsüyle tayin edilir. Numune yarı pili, 1 M yükseltgeyici (X) ve 1 M indirgeyici (X - ) içeren çözeltiye bir elektrot batırılmasıyla elde edilirken; standart referans yarı pili de içine bir elektrot batırılmış 1 atm basınçta 2 gazıyla dengede olan 1 M lık + çözeltisinden ibarettir (Şekil ). Elektrotlar birbirine bir voltmetre ile, yarı piller de elektrik akımını geçirecek bir tuz köprüsüyle bağlanır. Elektronlar yükseltgenmenin olduğu yarı pilden indirgenmenin olduğu diğerine akarlar. Eğer reaksiyon; X X + ½ 2 yönünde ise, yarı pillerdeki reaksiyonlar şunlardır: X - X + e - ve + + e - ½ 2 Numune yarı pilinden standart referans yarı pile elektronların akışı sonucu numune elektrodu diğerine göre negatif olur. X / X - çiftinin redoks potansiyeli deneyde okunan voltajdır. Çünkü + / 2 çiftinin redoks potansiyeli E o =0 volt olarak tanımlanmıştır. Elektronları alma eğilimi yüksek olan yarı hücrenin E o değeri pozitif olarak kabul edilir. Negatif bir indirgeme potansiyeli o maddenin, aynen yukarıdaki örnekte olduğu gibi, elektronlara 2 den daha az afinitesi, pozitif bir redoks potansiyeli de 2 den daha yüksek bir elektron afinitesi olduğunu gösterir. Bu karşılaştırmalar standart şartlarda, yani 1M 103
111 indirgeyici, 1M yükseltgeyici, 1M + ve 1 atm 2 durumunda geçerlidir. Nitekim kuvvetli bir indirgeyici (NAD gibi) negatif redoks potansiyeline, kuvvetli bir yükseltgeyici de (2 gibi) pozitif redoks potansiyeline sahiptir. Şekil Bir redoks çiftinin standart indirgenme yükseltgenme potansiyelinin (E o ) ölçülmesi. Elektronlar numune elektrodundan, referans elektroda veya tersi yönünde hareket ederler. Başlıca referans yarı hücre şekilde de gösterildiği gibi hidrojen elektrodudur. Bu elektrodun elektron hareket ettirici kuvveti (emf) 0.00 V olarak kabul edilmektedir. idrojen elektrodu için p=7 de, E o = V tur. verilmiştir. Tablo de biyolojik öneme sahip bazı redoks çiftlerinin redoks potansiyelleri Tablo Biyolojik yönden önemli bazı yarı-reaksiyonların 25 o ve p=7 de standart indirgenme potansiyelleri (E o ) Yarı reaksiyon E o (V) Ferredoksin (Fe +3 ) + e - ferredoksin (Fe +2 ) 0, e - 2 (p=7 de) 0,414 NADP e - NADP 0,324 NAD e - NAD 0,320 Lipoik asit e - dihidrolipoik asit 0,290 Glutatyon e - 2 indirgenmiş glutatyon 0,230 FAD e - FAD 2 0,219 * Asetaldehid e - etanol 0,
112 Pirüvat e - laktat - 0,185 kzalasetat e - malat -2 0, e - 2 (standart koşullarda, p=0) 0,000 Fumarat e - süksinat -2 0,031 Ubikinon e - Ubikinol + 2 0,045 Sitokrom b (Fe +3 ) + e - Sitokrom b (Fe +2 ) 0,077 Sitokrom c 1 (Fe +3 ) + e - Sitokrom c 1 (Fe +2 ) 0,220 Sitokrom c (Fe +3 ) + e - Sitokrom c (Fe +2 ) 0,254 Sitokrom a (Fe +3 ) + e - Sitokrom a (Fe +2 ) 0, e ,295 Sitokrom a 3 (Fe +3 ) + e - Sitokrom a 3 (Fe +2 ) 0,350 N e - N ,421 Fe +3 + e - Fe +2 0,771 ½ e - 2 0,816 *Bu serbest FAD değeridir. FAD farklı, E o a sahip özgül bir flavoproteine bağlanır (örneğin, süksinat dehidrogenaza bağlı ise E FAD e - E FAD 2 E o = 0,181 V olur.). Biyokimyacıları ilgilendiren yarı reaksiyonların çoğuna protonlar katılmaktadır. ΔG o tanımında olduğu gibi, biyokimyacılar indirgenme-yükseltgenme reaksiyonlarının standart durumunu p=7 deki indirgenme potansiyeli (E o ) olarak belirlemişlerdir. Tablo de verilen standart indirgenme potansiyelleri, E o olup, yalnız nötral p daki sistemler için geçerlidir. er değer, redoks çiftinin 1M derişimde, p=7 de ve standart hidrojen elektrodu (p=0) ile bağlı olduğundaki potansiyel farkını göstermektedir. Konjuge redoks çifti 2 + /2, p=7 de standart hidrojen elektrodu (p=0) bağlandığında, elektronlar p nın 7 olduğu hücreden standart hücreye (p=0) hareket etmektedir. 2 + /2 redoks çifti için ölçülen, E o = V dur. Biyolojik şartlarda 2 + /2 çifti için ölçülen E o değerinin olduğuna dikkat ediniz. İki yarı hücre için E o değerleri standart hidrojen elektroduna bağlı olarak belirlendiğinden; iki yarı hücre bir dış devre aracılığıyla birbirine bağlandığında veya her iki yarı hücrenin bileşenleri aynı çözelti içinde bulunduğunda elektronların hareket etmeye eğilimli oldukları yön tahmin edilebilir. Elektronlar daha pozitif E o ye sahip yarı hücreye doğru hareket ederler. Bu hareketin şiddeti, standart indirgenme potansiyelleri arasındaki farklılık ΔE o ile orantılıdır. Kendiliğinden meydana gelen bu elektron akımının oluşturduğu 105
113 enerji (indirgenme yükseltgenme reaksiyonunun standart serbest enerji değişikliği) ΔE o ile orantılıdır. ΔG o = nfδe o Yarı hücrenin indirgenme potansiyeli, yalnız bulunan kimyasal türlere değil, derişimlerden kaynaklanan aktivitelerine de bağlıdır. W. Nernst, standart indirgenme potansiyelini (E o ), hücredeki indirgen ve yükseltgen türlerin herhangi bir derişimdeki indirgenme potansiyeli (E) ile ilişkilendiren bir eşitlik bulmuştur. 25 o de eşitlik aşağıdaki şekli almaktadır. İlk önce her iki hücrenin E değerleri hesaplanır ve ΔE değeri bulunur. ΔE, ΔG nin hesaplanmasında kullanılır. ΔG= nfδe Bu şekilde redoks çiftinin herhangi bir derişimde, herhangi bir biyolojik redoks reaksiyonunun serbest enerji değişikliği hesaplanabilir. Bir indirgenme-yükseltgenme reaksiyonunun serbest enerji değişimi (ΔG o ), reaktantların redoks potansiyellerinden faydalanılarak bulunabilir. Mesela pirüvatın NAD tarafından indirgenme reaksiyonunu ele alalım: Pirüvat + NAD + + Laktat + NAD + NAD + / NAD çiftinin redoks potansiyeli 0,32V, pirüvat / laktat çiftinin ise 0,19 V dur. Yukarıdaki reaksiyon yönüne göre yarı pil reaksiyonlarını yazdığımızda, ikinci reaksiyon (NAD NAD + ) Tablo deki E o değerlerinin verildiği yönün tersine cereyan ettiğinden; indirgenme potansiyelinin işareti değişir. Pirüvat e - Laktat E o = V NAD NAD e - E o = V Pirüvat + NAD + + Laktat + NAD E o = V er iki reaksiyonu ve karşılığındaki redoks potansiyellerini topladığımız zaman, istenilen reaksiyon ve onun elektromotor kuvvetini elde ederiz. Bunun serbest enerji karşılığı nedir? ΔG o ile ΔE o arasında aşağıdaki bağıntı vardır: ΔG o = nfδe o Burada n, transfer edilen elektron sayısı; F, bir Faradayın kilojoule (kj) eşdeğeri (96.5kJ V -1 mol -1 ) dir. Pirüvatın indirgenmesinde n=2 olduğundan,
114 ΔG o = 2 x 96,5kJ V -1 mol -1 x 0,13 V = 25,1 kj/mol çıkar. Pozitif bir E o değeri, standart şartlarda reaksiyonun ekzergonik yani gösterilen yönde kendiliğinden gerçekleşebilir olduğunu gösterir. Şimdi aynı hesaplamayı NAD nın 2 tarafından yükseltgenmesi reaksiyonu için yapalım. Önce yarı reaksiyonları yazarak toplayalım: 1/ e - 2 E o = V NAD NAD e - E o = V 1/2 2 + NAD NAD + E o = V Bu reaksiyonun serbest enerji değişimi de ΔG o = 2 x 96,5kJ V -1 mol -1 x 1,14 V = 220 kj/mol olarak bulunur. Bu enerji 3 ATP sentezi için yeterlidir. ADP + P i + + ATP + 2 G o = kj/mol ELEKTRN TAŞIMA ZİNİRİ (SLUNUM ZİNİRİ) Elektronlar NAD tan 2 ye flavinlerden, Fe S protein komplekslerinden, kinonlardan ve hem gruplarından ibaret elektron taşıyıcıları tarafından aktarılır (Şekil ). Kinonların dışında bu elektron taşıyıcılarının tamamı proteinlerin prostetik gruplarıdır. İlk reaksiyon NAD ın NAD dehidrogenaz multienzim kompleksi tarafından yükseltgenmesidir. NAD dan iki elektron enzimin prostetik grubu olan flavin mononükleotid (FMN) e aktarılarak FMN2 ye indirgenir (Şekil 8.4.). NAD FMN FMN2 + NAD + Daha sonra elektronlar FMN2 den NAD dehidrogenaz kompleksinin bir başka prostetik grubunu teşkil eden bir seri Fe S protein komplekslerine aktarılır. Burada demir atomları hem grubuna ait değildir. 107
115 Şekil Solunum zincirlerinde yer alan elektron taşıyıcıları. Protonlar çerçeve içine alınmış üç kompleks tarafından pompalanır.*demir-sülfür proteinleri. Son yıllarda yapılan araştırmalar Fe S proteinlerinin biyolojik sistemlerdeki birçok redoks reaksiyonlarında çok önemli roller oynadığını ortaya koymuştur. Üç tip Fe S merkezi bilinmektedir. Bu komplekslerde demir atomu, Fe +2 ve Fe +3 yükseltgenme basamaklarındadır. NAD dehidrogenaz sisteminde hem Fe2S2 hem de Fe4S4 tipindeki merkezler vardır. NAD dehidrogenaz enzimindeki Fe S merkezlerinden elektronlar, koenzim Q ya transfer edilir. NAD FMN Fe.S (+2) oq NAD + FMN 2 Fe.S (+3) oq 2 NAD dehidrogenaz enzim kompleksi Koenzim Q (oq) uzun bir izopren zinciri takılı bir kinon türevi olup; ubikinon adı verilir. İzopren birimlerinin sayısı türden türe değişir. Memelilerde en bol bulunanı 10 izopren birimine sahiptir ve oq10 olarak gösterilir: ( 2 2 ) 10 oq 10 (yükseltgenmiş şekli) 108
116 İzopren zinciri oq yu oldukça apolar yapar ve iç mitokondri membranında kolayca difüze olmasını sağlar. oq solunum zincirinde bir proteinin prostetik grubu olmayan tek elektron taşıyıcısıdır ve zincirin flavoproteinleri ile sitokromları arasında oldukça hareketli bir taşıyıcılık görevi yapabilmesine yol açar. Sitrik asit çevriminde süksinat dehidrogenaz enzimi tarafından, süksinatın fumarata yükseltgenmesiyle, FAD2 nin oluştuğunu biliyoruz. Bu enzim süksinat oq redüktaz enzim kompleksinin bir bileşeni olup, diğer bileşeni de bir Fe S proteinidir. Bu kompleks de NAD dehidrogenaz gibi mitokondri iç membranının integral proteinidir. FAD2 deki yüksek potansiyele sahip elektronlar kompleksdeki bir flavoprotein ve çeşitli Fe S merkezleri üzerinden solunum zincirinde oq ya aktarılır. Aynı şekilde ileride göreceğimiz glikoliz olayında meydana gelen NAD elektronlarını mitokondri içine taşıyan gliserol fosfat dehidrogenaz ve yağ asitlerinin oksidasyonunda görev alan yağ açil oa dehidrogenaz enzimleri de, FAD2 prostetik gruplarındaki elektronlarını farklı yollarla oq ya aktararak oq2 yi oluştururlar. oq2 ile 2 arasındaki elektron taşıyıcılarının bir tane Fe-S proteinin dışında, hepsi sitokromlardır. Sitokromlar prostetik grup olarak hem grubu ihtiva eden elektron taşıyıcı proteinlerdir. Sitokromlardaki Fe atomları, indirgenmiş Fe +2 hali ile, yükseltgenmiş Fe +3 hali arasında mekik dokur. em grubu bir Fe S merkezi gibi tek elektron taşıyabilir. Fakat NAD, flavinler ve oq iki elektron transfer edebilir. oq2 molekülü yüksek potansiyelli iki elektronunu solunum zincirinin daha sonraki üyesi olan iki adet sitokrom b ye aktarır. oq2 ile 2 arasında beş çeşit sitokrom vardır. Sitokrom b,c1 ve c, bir tane Fe S proteini ile beraber oq2 Sit c redüktaz multienzim kompleksinin bileşenleridir. Sitokrom c, elektronları bu kompleksten bileşen olarak sitokrom a ve a3 ihtiva eden, sitokrom oksidaz (veya Sit c oksidaz) kompleksine transfer ederler. Bu sitokromlar artan indirgenme potansiyellerine göre sıralanmıştır. oq2 Sit b Fe-S Sit c1 Sit c Sit a Sit a3 2 Bu sitokromların yapıları, birbirinden farklı özelliklere sahiptir. Sitokrom b, c1 ve c de prostetik grup hem adı verilen bir demir protoporfirin IX dur. Bu, hemoglobin ve miyoglobindeki hem grubuyla aynıdır. Sitokrom b de hem, proteine kovalent bağlanmamıştır. Sitokrom c ve c1 de hem, proteine tiyoeter bağlarıyla bağlanmıştır. Bu bağlar, protein yapısında bulunan iki sisteinin S gruplarının hem grubunun vinil gruplarına katılmasıyla oluşmuştur (Şekil ). 109
117 3 3 3 N N Fe S 2 N 3 P r o t e i n N S Şekil Sitokrom c ve c 1 in yapısı ve tiyoeter bağı oluşumu. oq2 Sit c redüktaz kompleksi elektronları oq2 den, suda çözünebilen bir periferal membran proteini olan sitokrom c ye transfer eder. oq 2 Sit.b (+3) FeS (+2) Sit.c 1 (+3) Sit.c (+2) oq Sit.b (+2) FeS (+3) Sit.c 1 (+2) Sit.c (+3) oq 2 - Sit.c redüktaz Daha sonra indirgenmiş sitokrom c, elektronunu sitokrom c oksidaz kompleksine aktarır. Sitokrom c nin rolü oq ya benzemektedir ve solunum zincirindeki kompleksler arasında hareketli bir elektron taşıyıcısı görevini görür. Sitokrom a ve a3, hem A adı verilen farklı bir demir-porfirin prostetik grubuna sahiptir (Şekil ). em den farklı olarak metil gruplarından birinin yerini bir formil grubu, vinil gruplarından birinin yerini de bir hidrokarbon zinciri alır. Sitokrom a ve a3, solunum zincirinin son üyeleridir. 110
118 3 3 ( ) 3 N 3 N Fe N N Şekil em A nın yapısı. Sit.c (+2) Sit.a (+3) Sit.a 3 (+2) u (+2) 2 Sit.c (+3) Sit.a (+2) Sit.a 3 (+3) u (+1) 2 Elektronlar önce kompleksin sitokrom a bileşenine, oradan da bakır ihtiva eden sitokrom a3 e aktarılır. Bu bakır atomu sit a3 den 2 ye elektronu transfer ederken +2 ve +1 yükseltgenme basamakları arasında mekik dokur. Bir 2 molekülünden iki 2 molekülünün oluşumu dört elektron gerektiren bir olaydır fakat hem grupları birer elektron aktarabilmektedir e ksijenin Eksik İndirgenmesinden Doğan Zararların Giderilmesi Mitokondrial solunum zincirinde elektronların oksijene taşınması sırasında, oksijenin kısmi indirgenmiş ürünleri oluşur. Bu ürünlerin en önemlileri; süperoksit radikali.- (2 ) ve hidrojen peroksittir (22). er ikisi de oldukça reaktif olup; birçok biyomoleküllerin dönüşümsüz zarar görmesine yol açarlar. Özellikle membran lipidlerinin doymamış yağ asit bileşenlerinin peroksidasyonu ile membran yapısını bozarlar. Reaktif oksijen türleri DNA hasarına yol açabilir. 111
119 I.Fridovich ve arkadaşlarının araştırmaları sonucunda, aerobik hücrelerde bulunan süperoksit dismutaz enziminin süperoksit radikalini hidrojen peroksit ve moleküler oksijene dönüştürebileceği anlaşılmıştır Süperoksit dismutaz Süperoksit dismutazın; biri sitoplazmada diğeri de mitokondrilerde olmak üzere iki izoenzimi bulunur. Ökaryotlardaki mitokondrial süperoksit dismutaz, karakteristik Mn +2 muhtevası ve aminoasit dizilişi bakımından birçok bakterilerinkine benzer. Buna karşılık sitoplazmadaki ise, tamamen farklı yapıya sahiptir ve u +2 ile Zn +2 iyonları ihtiva eder. Bu enzimler yüksek konsantrasyonda ve oldukça aktif olarak bulunur. Çünkü mitokondrilerde kullanılan oksijenin % 1 5 arası süperoksite dönüşmekte ve ancak yüksek konsantrasyonda bir SD tarafından bertaraf edilebilmektedir. Süperoksit dismutaz ve flavine bağımlı oksidazlar vasıtasıyla oluşan hidrojen peroksit, hem grubu ihtiva eden bir enzim olan katalaz enzimiyle aşağıdaki reaksiyona göre parçalanır: Katalaz ½ 2 Katalaz hayvan hücrelerinin peroksizomlarında bol bulunur. Süperoksit dismutaz ve katalaz enzimlerinin beraberce koruyucu fonksiyonu; askorbik asit, glutatyon, E ve K vitaminleri tarafından güçlendirilir; çünkü bu bileşikler kolayca elektron verebilir ve serbest radikali süpürür. Antioksidantlar olarak da anılan bu grupta yer alan enzim ve bileşiklerinin başka üyelerine de ileride temas edilecektir Karışık İşlevli ksidazlar, ksigenazlar ve Sitokrom P 450 Moleküler oksijenin elektron alıcısı olduğu oksidasyonları katalizleyen enzimlerin genel adı oksidazdır, fakat oksijen atomları oksitlenmiş üründe bulunmaz. ksidazların birçoğu flavoproteindir. Bazı biyolojik oksidasyonlarda, bir karbon atomu bir oksijen atomuna bağlanır. Bu yükseltgenme reaksiyonlarını katalizleyen enzimler genellikle oksidazlar olarak veya oksijen atomu moleküler oksijenden geliyorsa oksigenazlar olarak adlandırılır. Aerobik yaşayan hücrelerin kullandığı moleküler oksijenin yaklaşık % 95 i solunum zincirinde oksidazlar tarafından suya indirgenir. Geri kalan kısmı ise, ya 22 oluşturan oksidazlar yada oksijen molekülünün bir veya her iki atomunun hidroksil grubuna dönüşüp; direkt olarak organik substrat moleküllerinin yapısına girdiği reaksiyonları katalizleyen oksigenaz enzimleri tarafından kullanılır. ksigenazlar, oksijen atomlarının yeni bir hidroksil yada karboksil grubu oluşturmak üzere substrat molekülüne doğrudan girdiği oksidatif reaksiyonları katalizler. Dioksigenazlar, 2 nin her iki oksijen atomunun organik substrat 112
120 molekülüne girmesini katalizler. ksijen transferazlar olarak da adlandırılan dioksigenazlar aşağıdaki tipten reaksiyonları katalizlerler: A2 + 2 A()2 Bu reaksiyona göre substrat molekülü dihidroksi formuna dönüşmektedir. Daha yaygın olan ve etki mekanizması daha karmaşık olan monooksigenazlar 2 nin iki oksijen atomundan yalnız birinin organik substrata girmesini katalizler, diğer oksijen 2 ya indirgenir. Monooksigenazlar, 2 nin iki oksijen atomunun indirgeyicisi olarak görev yapan iki substrata gereksinim duyar. Esas substrat iki oksijen atomundan birini alır ve yardımcı substrat diğer oksijen atomunu 2 ya indirgemek için hidrojen atomlarını sağlar. Monooksigenazlar için genel reaksiyon eşitliği şöyledir: A + B2 + A + B + 2 A, esas substrat ve B2 yardımcı substrattır. Esas substratın hidroksillenmesini katalizleyen birçok monooksigenaz, hidroksilaz olarak da adlandırılır. İki farklı substratı eş zamanlı olarak oksitlediğini belirtmek için, bunlar bazen karışık işlevli oksidazlar ya da karışık işlevli oksigenazlar olarak adlandırılır. Fenilalaninin fenil halkasını, hidroksilleyerek tirozin oluşturan enzim (fenilalanin hidroksilaz) bir monooksigenazdır ve yardımcı substrat tetrahidrobiopteridindir. İnsan genetik hastalığı olan fenilketonürideki (PKU) hatalı enzim budur. En karmaşık monooksigenaz reaksiyonları sitokrom P 450 denilen hem protein tipinin katılımıyla olanıdır. Bu tip sitokrom, genellikle mitokondriden çok düz endoplazmik retikulumda bulunur. Mitokondri sitokrom oksidazı gibi, sitokrom P 450 de 2 ile reaksiyona girebilir ve karbon monoksit bağlar. Sitokrom P 450, 2 nin bir oksijen atomunun R organik substratına sokulmasıyla R a hidroksillendiği hidroksilasyon reaksiyonlarını katalizler. Diğer oksijen atomu, NAD veya NADP tarafından 2 ya indirgenir. Fakat genellikle bir Fe S proteini tarafından sitokrom P 450 ye geçirilir. NADP. Yülseltgenmis indirgenmiṣ R P-450 sitokrom redüktaz (FeS) Sitokrom P NADP +. indirgenmis Yülseltgenmiṣ R 113
121 Sitokrom P 450, birbirine çok benzeyen gerçek bir protein ailesidir. Örneğin, özgül bir sitokrom P 450 adrenal kortekste steroid (adrenokortikal) hormonları üretmek için steroidlerin hidroksillenmesine katılır Fosforilasyon ve Kemiozmotik Teori NAD deki elektronların 2 ye akışı esnasındaki serbest enerji değişiminin 220 kj/mol olduğunu hesaplamıştık. Bu enerji; ADP + P i + + ATP + 2 G o = kj/mol reaksiyonuyla ATP nin sentezinde kullanılmaktadır. Bu reaksiyon mitokondri iç membranında yer alan F0F1ATPaz enzim kompleksi (ATP sentaz) tarafından katalizlemektedir. Acaba NAD oksidasyonu ile ADP nin fosforilasyonu arasındaki bağlantı nasıldır? Buraya kadar 1 mol ATP oluşması için her mol elektron çifti başına elektron transferinden açığa çıkan ve proton motif kuvvetinde (proton hareket gücünde) saklanan, gerekenden fazla serbest enerji (220 kj kadar) sağlandığını gördük. Bu yüzden mitokondrideki oksidatif fosforilasyonda termodinamik bir problem yoktur. Şimdi proton akışıyla, fosforilasyon eşleşmesinin kimyasal mekanizmasını ele alalım. Mitokondride ATP sentezi hakkındaki güncel bilgilerimiz Peter Mitchell tarafından önerilen kemiozmotik teoriye (1961) dayanmaktadır. Kemiozmotik teoriye göre, membran yüzeyleri arasındaki proton konsantrasyonu farkı, biyolojik oksidasyon reaksiyonlarında sağlanan enerjinin temel kaynağıdır. Bu modele göre solunum zincirindeki elektron transferi esnasında; mitokondri matriksinden protonlar, iç mitokondri membranının sitoplazma tarafına pompalanır. Bunun sonucu olarak bu tarafta + konsantrasyonu artar ve bir membran potansiyeli oluşur (Şekil ). Burada ATPaz enzimi tarafından ATP nin sentezlenmesi olayının proton motif (proton hareket) kuvveti tarafından yürütüldüğü kabul edilmektedir. Bu modele göre mekanizmanın işleyebilmesi için; 1) Solunum zincirindeki elektron taşıyıcılarının ve ATPaz enziminin mitokondri iç membranının iki yüzüne göre dizilmiş olmaları ve 2) İç membranın protonlara karşı geçirgen olmaması gerekir. İleri sürülen bu mekanizmaya göre; NAD ın oksidasyonu ile açığa çıkan enerji ( 220kj/mol), yüksek bir proton konsantrasyonuna karşı proton pompalanmasıyla korunmakta ve bu protonların tekrar matrikse dönmeleriyle ATP sentezlenmektedir. 114
122 Şekil Elektron transportu sonucu, iç mitokondri membranında oluşan proton gradienti ve membran potansiyeli. Mitchell in bu hipotezi, bugün birçok deneysel sonuçlar tarafından desteklenmektedir. 1. Elektron transportu sonucu mitokondri iç membranı üzerinde bir proton gradienti meydana gelmektedir. Bunun sonucunda dışarıdaki p içeriden 1.4 birim daha düşük (Δp) ve dış taraf pozitif olmak üzere 0.14 V luk bir membran potansiyeli (Δψ) oluşur. Toplam elektrokimyasal potansiyel de V civarında olur ki, bu da 5.2 kcal/mol proton değerindedir. 2. Solunum zinciri çeşitli inhibitörlerle durdurularak suni yoldan mitokondri ve kloroplastlarda oluşturulan p gradienti sonucunda ATP sentezlendiği gözlenmiştir. 3. alobakterilerde bulunan mor membran proteini ışık altında proton pompalamaktadır. Bu bakteri proteini ve sığır kalp ATPaz ından sentetik olarak hazırlanan fosfolipid veziküllerinin ATP sentezledikleri bulunmuştur. Burada adı geçen protein, solunum zincirinin görevini yapmaktadır. Elde edilen sonuç, solunum zincirinin faaliyeti ile ATPaz ın fonksiyonunun farklı olduğunu ve bunların proton gradienti ile bağlantılı olduğunu göstermiştir. Solunum zincirindeki bazı proteinlerin aktivitelerini inhibe eden antibiyotik ve inhibitörlerden faydalanılarak zincirin hangi noktalarında proton pompalandığı belirlenmiştir. Bu noktalar üç tanedir ve daha önce bahsettiğimiz solunum zinciri enzim kompleksleridir: NAD dehidrogenaz, oq2 sitokrom c oksidoredüktaz ve sitokrom oksidaz kompleksleri. er bir bölgeden pompalanan protonlar bir ATP nin sentezini gerçekleştirmektedir. FAD2 den gelen elektronlar zincire ikinci yerden girdiği için, bir mol FAD2 nin oksidasyonu ile 2 ATP sentezlenir. F0F1ATPaz enzim kompleksi: ATPaz enzim kompleksi F1 ve F0 ile gösterilen başlıca iki kısım polipeptid zincirlerden ibarettir. ATP sentezini gerçekleştiren F1, iç mitokondri 115
123 membranının matriks yüzünde bulunur, F0 ise membran içine gömülmüş halde bulunur ve proton geçişi için bir kanal görevi yapmaktadır. ATPaz kompleksinin şekli genel olarak bir elma şekerini andırmakta olup; ATP sentezi Şekil deki gibi şematize edilebilir. Şekil Kemiozmotik teori ve ATP sentezinin şematik gösterilişi. Acaba protonların F0 kanalından matrikse geçişiyle, F1 tarafından ATP nasıl sentezlenmektedir? Bu konuda proton akışının doğrudan ATP sentezleyen kısmı etkilediği ve bunun sonucu olarak da Pi nin aktifleşerek aynı anda ADP ile birleştiği ileri sürülmektedir. Ayrıca proton akışının enzim kompleksinde bir konformasyon değişikliğine yol açıp, ATP sentezini sağladığı da iddia edilmektedir. Mitokondriye ADP girişi ve ATP çıkışı: ATP, ADP ve fosfat (Pi) iç mitokondri zarından serbestçe difüze olamazlar. Bu çok yüklü bileşikler özel taşıyıcı proteinler tarafından taşınır. ATP-ADP taşıyıcısı matrikse bir ADP molekülünü geçirirken aynı zamanda da bir ATP molekülünü dışarı çıkarır. Bu olay ATP ADP translokaz (adenin nükleotid taşıyıcısı da denir) tarafından yürütülür. Bu protein mitokondri iç zarında bol miktarda bulunur, toplam proteinlerin yaklaşık % 14 ünü oluşturur. Aynı şekilde, Pi de ATP-ADP translokazla uyumlu çalışan bir fosfat taşıyıcısı tarafından - karşılığında matrikse geçirilir. Mitokondri iç membranında, çok sayıda molekül ve iyonların takas ve taşınmasını gerçekleştiren 116
124 translokazlar ve taşıyıcı proteinler vardır. Mesela, trikarboksilat ve pirüvat taşıyıcılarıyla, yağ asitlerinin matrikse taşınmalarını gerçekleştiren karnitin-açil karnitin translokaz önemli olanlarıdır Glikolizde luşan NAD ın Solunum Zincirine Girişi Sağlam bir mitokondri zarı NAD ve NAD + ya karşı geçirgen değildir. Bu durumda glikolizde gliseraldehid 3 fosfatın oksidasyonu sonucu meydana gelen NAD ın mitokondri içine özel taşıyıcılarla girmesi lazımdır. Bu taşıyıcılardan birisi gliserol 3 fosfattır. Bu molekül kolayca mitokondri dış membranından membranlar arası boşluğa difüze olabilmektedir. İskelet kası, sinir ve beyin hücrelerinde glikolizde oluşan NAD elektronlarının bu yolla mitokondri içine alınması mekanizmasına gliserol fosfat mekiği adı verilmektedir (Şekil ). Bu mekikteki ilk basamak, NAD daki elektronların dihidroksiaseton fosfata aktarılıp, gliserol 3 fosfatın oluşmasıdır. Bu reaksiyon sitoplazmada olmakta ve gliserol 3 fosfat dehidrogenaz enzimi tarafından katalizlenmektedir. Daha sonra gliserol 3 fosfat, mitokondride membranlar arası boşluğa difüze olur ve burada tekrar dihidroksiaseton fosfata okside olur. Bu oksidasyonu FAD prostetik grubuna sahip olan ve mitokondri iç zarının dış yüzeyine yapışık bir başka gliserol 3 fosfat dehidrogenaz enzimi katalizler. Bu enzim sitozoldeki NAD + bağlı enzimden farklıdır. Dihidroksiaseton fosfat tekrar sitozole geçerek mekiği tamamlar. Mekiği şematik olarak şöyle gösterebiliriz: 117
125 Glikoliz NAD + + NAD + 2 Gliserol-3-fosfat -2 2 P dehidrogenaz 3 Sitozolde Dihidroksiaseton fosfat P 3 Gliserol-3-fosfat Sitozolde difüze olur Mitokondri dis. membrani Mitokondriye (intermembran bosluga) - difüze olur 2 E-FAD 2 E-FAD P 3 Gliserol-3-fosfat dehidrogenaz Mitokondride (iç membranin dis. yüzeyinde) -2 2 P 3 Şekil Gliserol 3 fosfat mekiği. İndirgeyici eşdeğerliklerin, iskelet kası ve beyinde sitozolden mitokondri matriksine taşınması. Mitokondri iç membranı üzerinde oluşan FAD2 de elektronlarını doğrudan oq yoluyla solunum zincirine aktarır. Gliserol fosfat mekiği vasıtasıyla mitokondriye eşdeğer elektronları giren sitoplazmik NAD lar, 3 yerine 2 molekül ATP sentezine sebep olur. Kalp, karaciğer ve böbrekte sitoplazmik NAD elektronları mitokondriye bir başka mekanizma, malat aspartat mekiği ile taşınır (Şekil ). Bu mekikte iki taşıyıcı membran proteini ile dört enzim görev alır. Sitoplazmik NAD dan elektronlar, sitozoldeki okzalasetata aktarılarak malat oluşur. Malat da spesifik taşıyıcı protein tarafından mitokondri içine taşınır ve orada tekrar okzalasetata okside olarak elektronlarıyla yeniden NAD oluşturur. kzalasetatı taşıyan yeni bir protein olmadığından aminasyon reaksiyonu ile aspartata dönüştürülür ve sitozele çıkar. rada bir deaminasyon reaksiyonu ile tekrar okzalasetata çevrilir. Malat aspartat mekiğini kısaca şema ile şöyle özetleyebiliriz: 118
126 NAD + + NAD + kzalasetat Sitoplazmik malat dehidrogenaz Malat Glutamat Sitoplazmik aspartat transaminaz -ketoglutarat Aspartat Sitoplazma Aspartat-glutamat -Ketoglutarat-malat tasiyici. iç membran tasiyici. Aspartat Mitokondrial aspartat transaminaz -ketoglutarat NAD + + Glutamat kzalasetat NAD + Malat Mitokondrial malat dehidrogenaz Mitokondri matriksi Şekil Malat aspartat mekiği. Sitozolik NAD den indirgeyici eşdeğerliklerin, mitokondri matriksine taşınmasını sağlayan bu mekik; karaciğer, böbrek ve kalp kasında kullanılır. Gliserol fosfat mekiği tek yönlü işleyen bir mekanizma iken; malat-aspartat mekiği dönüşümlü bir olaydır. Mitokondri içine NAD ın taşınması NAD/NAD + oranı yüksek iken gerçekleştirilir. Burada ATP kaybı yoktur ve bir mol sitoplazmik NAD başına üç mol ATP sentezlenir Glukoz ksidasyonunun ATP Bilançosu Şimdi glukozun tamamen 2 ve 2 ya oksitlenmesi sonucu kaç ATP sentezlendiğini hesaplayabiliriz. Bir glukoz molekülü başına glikoliz, TA çevrimi ve oksidatif fosforilasyon safhalarındaki ATP verimlerini toplarsak bilançoyu çıkarabiliriz (Tablo 10.5.). 119
127 Tablo Glukozun tam oksidasyonundan elde edilen ATP. ksidasyon safhası Glikoliz Substrat seviyesinde 2NAD (sitoplazmik) Glukoz başına ATP verimi Malat-aspartat mekiği 2 6 Gliserol fosfat mekiği Pirüvatın asetil oa ya çevrilmesi 2NAD 6 6 TA çevrimi Substrat seviyesinde 6NAD 2FAD TPLAM Görüldüğü gibi sitoplazmik NAD ın malat-aspartat mekiği ile mitokondriye girişinde bir molekül glukoz oksidasyonu ile 38 ATP sentezlenmektedir. Eğer gliserol fosfat mekiği kullanılırsa 36 ATP oluşur. Bu esnada 12 oksijen atomu kullanıldığından P:0 oranı 36/12=3 olur. anlı organizmalarda glukoz oksidasyonu sonucu ATP sentezi, verimi yüksek bir mekanizmadır. Glukoz G o = 686 kcal/mol reaksiyonunun standart serbest enerji değişimi 686 kcal/mol olduğuna ve 36 ATP her biri kcal/mol den toplam 263 kcal/mol lük bir serbest enerjiyi yapılarında bulundurduğuna göre, ATP üretimi verimi 263 / 686 x 100= % 38 olarak bulunur. ücre içi şartlarda bu oran % lere çıkabilir. Bu dönüşüm oranı kömür, doğalgaz ve benzeri yakıtları yakarak çıkan ısıyla iş yapan veya elektrik enerjisi üreten makinelerde erişilemeyen bir verimdir PENTZ FSFAT YLUYLA GLUKZ KSİDASYNU Birçok hayvan dokusunda, glukozun yıkıldığı glikoliz yolu, sitrik asit çevrimi ve oksidatif fosforilasyonda başlıca hedef glukozun kimyasal enerjisinden ATP nin sentezlenmesidir. Glukozun başka katabolik sonları da vardır. Bununla beraber hücrenin ihtiyacı olan özelleşmiş ürünlere çevrilir. Şimdi yeni bir metabolik enerjinin, yani indirgeyici gücün üretilmesini inceleyeceğiz. Yakıt moleküllerindeki hidrojen atomları ve elektronların bazılarının biyosentezde kullanılmak üzere korunmaları gerekmektedir. ücrelerde indirgeyici gücün hemen kullanılabilir şekli NADP dır. Fosfoglukonat yolu olarak da adlandırılan pentoz fosfat yolu, NADP ve riboz 5 fosfat üretir. Bölüm 9 dan hatırlanacağı üzere, NADP kimyasal enerjiyi indirgen güç 120
128 şeklinde taşır ve çoğunlukla anabolik yollarda bir indirgen olarak kullanılır. Memelilerde NADP ın rolü ve böylece pentoz fosfat yolunun aktivitesi özellikle aktif olarak yağ asidi ve steroid sentezleyen meme dokusu, adrenal korteks, karaciğer ve yağ dokusu gibi dokularda baskındır. Bu dokular NADP ı biyosentetik işlemlerdeki ara maddelerin çift bağlarını ve karbonil gruplarını indirgemek için kullanır. Yağ asitlerini sentezlemede iskelet kası gibi daha az aktif olan dokular, pentoz fosfat yolundan hemen hemen yoksundur. Pentoz fosfat yolunun ikinci işlevi, nükleik asit biyosentezi için gerekli olan, özellikle D riboz gibi pentozları üretmektir. Nükleik asit biyosentezi büyüyen ve yenilenen dokularda ve tümörlerde yüksek hızla gerçekleşir. Pentoz fosfat yolundaki ilk tepkime glukoz 6 fosfatın, glukoz 6 fosfat dehidrogenaz enzimiyle bir molekül içi ester olan 6 fosfoglukono δ lakton a dehidrojenlenmesidir (Şekil ). NADP + elektron alıcısıdır ve tüm denge NADP üretimi yönündedir. Lakton, özgül bir laktonazla serbest yağ asidi olan 6 fosfoglukonata hidrolizlenir. Daha sonra 6 fosfoglukonat, 6 fosfoglukonat dehidrogenazla ketopentoz olan D ribuloz 5 fosfatı oluşturmak üzere oksidatif dekarboksillenmeye uğrar. Bu tepkime ikinci NADP ı üretir. Fosfopentoz izomeraz, ribuloz 5 fosfatı bunun bir aldoz izomeri olan riboz 5 fosfata çevirir. Bazı dokularda pentoz fosfat yolu bu noktada biter ve tüm tepkime şöyledir: Glukoz 6 fosfat + 2NADP Riboz 5 fosfat NADP Bu net denklemi veren 4 tepkime basamağına pentoz fosfat yolunun oksidatif reaksiyonları adı verilir. Net sonuç biyosentetik reaksiyonlarda kullanılan indirgen olan NADP ve nükleotid sentezinde kullanılan bir öncül olan riboz 5 fosfatın üretimidir. Bu reaksiyonların tamamı sitoplazmada cereyan eder. Öncelikli olarak riboz 5 fosfatın daha çok NADP gereksinimi olan dokularda pentoz fosfatlar, bir seri tepkimeyle glukoz 6 fosfata dönüştürülür. İlk önce, riboz 5 fosfat, ksiluloz 5 fosfata epimerleştirilir. Daha sonra karbon iskeletlerinin bir seri yeniden düzenlendiği bir seride altı tane beş karbonlu şeker fosfat, beş tane altı karbonlu şeker fosfat çevrimi tamamlayarak ve glukoz 6 fosfatın NADP üretmek üzere sürekli yükseltgenmesine izin vererek dönüştürülür. Eritrositlerde bu yolla üretilen NADP, hücreyi oksidatif hasardan korumak için zorunludur. Bu indirgen, hücreyi 22 ve süperoksit anyon radikalinin hasarından korur. Glukoz 6 fosfat dehidrogenazdaki genetik hatanın ciddi sonuçları olabilir. 121
129 Şekil Pentoz fosfat yolunun oksidatif reaksiyonları. Pentoz fosfat yolunun oksidatif olmayan bölümünde (Şekil a.) TPP bağımlı bir enzim olan transketolaz, yedi karbonlu bir ürün olan sedoheptuloz 7 fosfatı oluşturmak üzere, ksiluloz-5-fosfatın iki karbonlu parçasının, ( 1 ve 2) riboz 5 fosfata transferini katalizler. Ksilulozun geride kalan üç karbonlu parçası gliseraldehid 3 fosfattır. Transaldolaz daha sonra glikolizdeki aldolaz reaksiyonuna benzer bir reaksiyonu katalizler; sedoheptuloz 7 fosfattan üç karbonlu bir parça ayrılır ve fruktoz 6 fosfatı oluşturmak üzere gliseraldehid 3 fosfatla birleşir. Sedoheptulozun geride kalan dört karbonlu parçası, eritroz 4 fosfattır. Şimdi transketolaz yeniden rol alır ve eritroz 4 fosfat ve ksiluloz 5 fosfattan; fruktoz 6 fosfatı ve gliseraldehid 3 fosfatı oluşturur. Tekrarlayan iki tepkimeyle iki molekül gliseraldehid 3 fosfat bir molekül fruktoz 1,6 bisfosfata çevrilir (Şekil b.). Çevrim daha sonra tamamlanır: altı adet pentoz fosfat, beş adet heksoz fosfata çevrilmiş olur. Pentoz fosfatın oksidatif olmayan bölümündeki bütün reaksiyonlar tersinirdir ve böylece heksoz fosfatların da pentoz fosfatlara çevrilmesini sağlar. Bitkilerde pentoz fosfat yolunun bir bölümü, fotosentez olayı ile 2 den glukozun sentezlenmesinde rol alır. 122
130 Şekil a. Pentoz fosfat yolunun oksidatif olmayan reaksiyonları. Bu tepkimeler pentoz fosfatları; oksidatif reaksiyonların (Şekil ) devamına izin vererek heksozfosfatlara çevirir. Transketolaz ve transaldolaz enzimleri, bu yola özgüldür. Diğer enzimler ise glikolitik veya glukoneojetik yollarda da hizmet görür. 123
131 Şekil b. Beş karbonlu (5) pentozlardan, altı karbonlu (6) heksozlara giden yolları gösteren şematik bir çizelge. Bunun Şekil a. da gösterilen iki seri dönüşümü içerdiğine dikkat ediniz. Burada gösterilen her reaksiyon tersinirdir. Tek yönlü oklar glukoz 6 fosfatın sürekli oksidasyonu sırasındaki reaksiyonların yönünü açıklamak için kullanılmıştır. Fotosentezin ışığa bağımlı reaksiyonlarında bu reaksiyonların yönü terstir Pentoz Fosfat Yolu ızının Kontrolü Pentoz fosfat yolunun glukoz 6 fosfat dehidrogenaz tarafından katalizlenen ilk reaksiyonu olan glukoz 6 fosfatın dehidrogenasyonu, dönüşümsüz bir olaydır. Gerçekten bu basamak fizyolojik şartlarda bu yolun kontrol noktasıdır. NADP + da en önemli düzenleyici 124
132 faktördür. NADP, NADP + ile ATP de glukoz 6 fosfatla enzime bağlanmak için yarış halindedirler. Pentoz fosfat yolunun oksidatif reaksiyonları üzerindeki NADP + seviyesinin etkisi, indirgeyici biyosentez olaylarında kullanılan NADP ın üretimini böylece düzenlemiş olur. Glukoz 6 fosfat dehidrogenaz klinik yönden de çok önemli bir enzimdir. Eksikliğinde eritrositlerin hemoliz olduğu bir genetik anemi hastalığı görülür Pentoz fosfat Yolunun Bazı Doku ve ücrelerdeki Önemi Pentoz fosfat yolu ile ilgili radyoaktif 14 ile işaretlenmiş glukoz ile yapılan denemeler, bu yolun kas dokularından çok adipoz dokuda (yağ dokusunda) aktif olduğunu göstermiştir. Bu sonuç pentoz fosfat yolunun başlıca rolünün, indirgeyici biyosentez olaylarında kullanılmak üzere NADP üretmek olduğu iddiasını desteklemektedir. Çünkü, yağ dokusu hücrelerinde asetil oa dan yağ asitlerinin biyosentezinde büyük miktarda NADP kullanılmaktadır. Aynı şekilde, karaciğer ve süt bezlerinde de yağ sentezi ileri seviyede gerçekleştiğinden, bunların hücrelerinde de pentoz fosfat yolu çok aktiftir. Pentoz fosfat yolunun eritrositlerde çok hayati bir rolü vardır. Çünkü üretilen NADP, okside glutatyonun indirgenmesinde kullanılır. Glutatyon serbest sülfhidril grubuna sahip bir tripeptiddir (γ glutamilsisteinilglisin). - Gly N ys 2 S N N İndirgenmiş glutatyon (γ Glu ys Gly) S Alyuvarlarda glutatyonun indirgenmiş şekli (GS), hemoglobin ve diğer eritrosit proteinlerinde bulunan sistein rezidülerini indirgenmiş halde tutarak sülfhidril tamponu görevi yapar. Kırmızı kan hücrelerinde GS/GSSG oranı yaklaşık 500 dür. İndirgenmiş glutatyon, glutatyon peroksidaz enzimi katalizörlüğünde hidrojen peroksit ve organik peroksitlerle - 125
133 reaksiyona girerek antioksidant etki sergiler. Bu enzim aktif bölgelerinde Se (selenyum) içerir. 2GS + R GSSG R GS + 22 Glutatyon peroksidaz GSSG + 2 Yükseltgenmiş glutatyon (GSSG) da, bir FAD li enzim olan ve NADP ı kullanan glutatyon redüktaz aracılığıyla tekrar glutatyona (GS) indirgenir. -Glu-ys-Gly S S -Glu-ys-Gly Glutatyon + NADP + + redüktaz Yükseltgenmiş glutatyon (GSSG) -Glu-ys-Gly + NADP + S İndirgenmiş glutatyon (GS) Antioksidant enzimler olarak bilinen bu iki enzim ve glutatyon, söz konusu etki ve özellikleriyle karaciğerde de önemlidir. Karaciğerde ayrıca ksenobiyotiklerin (vücuttan atılması gereken ilaç, kimyasal kirleticiler ve suda çözünmeyen metabolizma atıkları) detoksifikasyonunda NADP a ihtiyaç vardır. Çünkü, detoksifikasyonun ilk basamağı hidroksilasyon ile 1) çözünürlük artırılmış ve 2) sülfat ve glukuronat ile konjugasyona hazır bir grup oluşturulmuş olur. Bunun sonucu olarak da böbreklerden veya başka yollarla atılmaları kolaylaşır. Normal eritrosit hücre yapısının devamı ve hemoglobinin Fe +2 halinde korunması için GS zorunludur GLUKNEGENEZ Glukoneogenez, karbohidrat yapısında olmayan ön maddelerden glukozun sentezlenmesi olayıdır. Bu metabolik yol, yakıt olarak en çok glukoz kullanan beyin gibi bazı dokular için çok önemlidir. Yetişkin bir kişide beyin, tek başına günlük olarak 120 gram glukoza ihtiyaç duyar. Bu günlük 160 gram olan ihtiyacın, önemli bir bölümünü oluşturmaktadır. Vücut sıvılarındaki glukoz 20 gram ve glikojenden kolayca sağlanabilecek glukoz da 190 gram civarındadır. Bu glukoz depoları vücudun bir günlük ihtiyacı için yeterlidir. Daha uzun bir açlık döneminde glukozun karbohidrat olmayan kaynaklardan sentezlenmesi gerekmektedir. Glukoneogenez yoğun eksersiz süresinde de önemlidir. 126
134 Glukoneogenezin önde gelen çıkış maddeleri; laktat, glukogenik aminoasitler ve gliseroldür. Laktat; mitokondrisi olmayan eritrositlerde, glikoliz hızının sitrik asit çevriminin ve solunum zincirinin metabolik hızlarını aştığı çok aktif kaslarda meydana gelir. Bu dokulardan kana difüze olan laktat, kalp ve karaciğer tarafından alınır ve laktat dehidrogenaz katalizörlüğünde L-Laktat + NAD + Pirüvat + NAD + + reaksiyonuyla pirüvata çevrilir. Pirüvat; kalp hücreleri tarafından yakıt olarak kullanılırken, karaciğerde, glukoneogenezle Şekil de verilen reaksiyon dizisiyle glukoza çevrilir. Aminoasitler diyette bulunan proteinlerden ve açlık durumunda kas proteinlerinin parçalanmasıyla ortaya çıkar. Bunlardan glukogenik olanları (Bölüm 12) pirüvat ile TA çevrimi ara bileşikleri olan α ketoglutarat, süksinil oa, fumarat ve okzalasetata dönüşür (Şekil ) ve hepsi de okzalasetat üzerinden glukoneogenez yoluna dahil olur. 127
135 Laktat Pirüvat Bazı aminoasitler * Pirüvat karboksilaz kzalasetat Bazı aminoasitler * PEP karboksikinaz Fosfoenolpirüvat 2 Fosfogliserat 3 Fosfogliserat 1,3 Bisfosfogliserat Gliseraldehid 3 fosfat Dihidroksiaseton fosfat Gliserol Fruktoz 1,6 bisfosfat * F 1,6 bisfosfataz Fruktoz 6 fosfat Glukoz 6 fosfat * Glukoz 6 fosfataz Glukoz Şekil Glukoneogenez yolu. Bu yolun glikolizden farklı reaksiyonlarının okları üzerinde * işareti vardır. Diğer reaksiyon basamakları glikolizle aynıdır. 128
136 Gliserol ise, triaçilgliserollerin lipazlar tarafından yağ asitleri ve gliserole hidroliziyle oluşur ve kan vasıtasıyla başlıca karaciğere gider. Burada gliserol, gliserol kinaz enzimi katalizörlüğünde fosforillenir ve daha önce bir mekik enzimi olarak tanıdığımız sitoplazmik gliserol fosfat dehidrogenaz aracılığıyla dihidroksiaseton fosfata yükseltgenir. Daha sonra, gliseraldehid-3-fosfata izomerize edilir. Bu bileşik hem glikoliz, hem de glukoneogenez ara maddesidir ve bu enzimlerin bulunduğu karaciğerde pirüvat veya glukoza dönüştürülür. 2 ATP ADP Gliserol 2 kinaz 2 2 P 3-2 NAD + NAD + + Gliserol fosfat dehidrogenaz 2 2 P 3-2 Gliserol L-Gliserol-3-fosfat Dihidroksiaseton fosfat Dihidroksiaseton fosfat, trioz fosfat izomerazın katalizlediği reaksiyonla gliseraldehid 3 fosfata izomerleşerek glikoliz yoluna dahil olur. Trioz fosfat izomeraz Dihidroksiaseton fosfat Gliseraldehid-3-fosfat Glukoneogenez yolu, pirüvatın glukoza dönüştürülmesi reaksiyonlarından ibarettir. Bu yolun reaksiyonlarından yedi tanesi glikoliz reaksiyonlarının dönüşümüdür (Şekil ). Glukoneogenez yolunun glikolizden farklı dört enziminden pirüvat karboksilaz mitokondride, PEP karboksikinaz hem mitokondri, hem de sitoplazmada; glukoz 6 fosfataz endoplazmik retikulum membranında ve fruktoz 1,6 bisfosfataz sitozolde yer alır. Glukoneogenezin gerçekleştiği başlıca organ karaciğerdir (% 90 ı). Böbrek korteksinde de önemli oranda glukoneogenez görülmesine rağmen; küçük hacminden dolayı karaciğerinkinin onda biri kadardır ve uzun süreli açlıkta önemlidir. Beyin, iskelet kasları ve kalp kasında çok az miktarda glukoneogenez meydana gelir. Zaten karaciğer ve böbrekteki glukoneogenezin amacı; kandaki glukoz seviyesini sabit tutmak ve eritrositler ile beyin ve kas hücrelerinin glukoza olan metabolik ihtiyaçlarını karşılamaktır Glukoneogenezin Reaksiyonları Glikolizde, glukoz pirüvata; glukoneogenezde de pirüvat glukoza dönüştürülmektedir. Bununla birlikte, glukoneogenez glikolizin dönüşümünden ibaret bir yol değildir. Pirüvatın glukozdan oluşumunun serbest enerji değişimi (ΔG o ) 85 kj/mol dür. Bu serbest enerji düşüşü; hekzokinaz, fosfofruktokinaz ve pirüvat kinaz enzimleri tarafından katalizlenen üç dönüşümsüz reaksiyonda ortaya çıkmaktadır. Glikolizin dönüşümsüz üç reaksiyon basamağı: 129
137 ekzokinaz 1. Glukoz + ATP Glukoz-6-fosfat + ADP + + Fosfofruktokinaz-I 2. Fruktoz-6-fosfat + ATP Fruktoz-1,6-bisfosfat + ADP Fosfoenolpirüvat + ADP + + Pirüvat kinaz Pirüvat + ATP Glukoneogenezde, glikolizin bu dönüşümsüz reaksiyonları dört farklı enzim tarafından katalizlenen reaksiyonların oluşturdukları üç basamakta tersine işleyebilir. 1. Pirüvatın okzalasetat üzerinden fosfoenolpirüvata dönüşümü: Pirüvat öncelikle sitozolden mitokondriye taşınır veya mitokondride alaninin transaminasyonuyla oluşturulur. Sonra pirüvat biyotin içeren bir mitokondri enzimi olan pirüvat karboksilazla karboksillenerek okzalasetata dönüştürülür (Şekil ). Pirüvat ATP Pirüvat karboksilaz kzalasetat + ADP + P i Pirüvat karboksilaz glukoneogenez yolunda ilk düzenleyici enzimdir. Bu reaksiyon sitrik asit çevrimine ara ürün sağlar. Pirüvattan oluşturulan okzalasetat NAD kullanan mitokondri malat dehidrogenazıyla malata indirgenir. kzalasetat + NAD + + Malat dehidrogenaz L-Malat + NAD + Böylece mitokondri malat dehidrogenazı, hem sitrik asit çevriminde hem de glukoneogenezde yer alır. Malat mitokondri iç membranından sitozole taşınır ve tekrar okzalasetata yükseltgenirken NAD oluşturulur. Malat + NAD + kzalasetat + NAD + + Sonra okzalasetat, fosfoenolpirüvat karboksikinazla fosfoenolpirüvat (PEP) a çevrilir. Bu enzim fosfat vericisi olarak GTP yi kullanır (Şekil ). kzalasetat + GTP PEP karboksikinaz Fosfoenolpirüvat GDP Reaksiyon hücre içi şartlarda dönüşümlüdür; yüksek enerjili bir fosfat bileşiği fosfoenolpirüvat (PEP) oluşumu, GTP nin hidroliziyle karşılanır. Bu reaksiyonlar toplu olarak şöyle yazılabilir: Pirüvat + ATP + GTP Fosfoenolpirüvat + ADP + GDP + P i + 2 G o =0.9kJ/mol ücre içi koşullarda, iki yüksek enerjili fosfat bağının hidroliziyle açığa çıkan enerji; pirüvatın fosforillenmesiyle PEP sentezinde harcanır. Pirüvat kinaz tarafından aynı 130
138 reaksiyonun katalizlenmesinin ΔG o değeri +30.5kJ/mol olduğu göz önüne alınırsa, bu basamağın yüksek enerjili bağın (GTP) kullanılmasıyla termodinamik yönden uygun hale geldiği görülür. Pirüvatın PEP e dönüşümündeki iki basamaklı yolda G o = 0.9kJ/mol olsa da, gerçek hücre içinde hesaplanan serbest enerji değişimi ( G) çok daha negatiftir ( 25kJ/mol). Bu karboksilasyon-dekarboksilasyon dizisi pirüvatı aktifleştirerek, PEP oluşumunu kolaylaştırır. Şekil Pirüvattan fosfoenolpirüvat sentezi. a) Mitokondride pirüvat karboksilaz tarafından katalizlenen biyotin gerektiren bir reaksiyonla pirüvat okzalasetata çevrilir. b) Sitozolde okzalasetat PEP karboksikinazla fosfoenolpirüvata dönüşür. Pirüvat karboksilaz reaksiyonuna katılan 2 burada 2 olarak kaybedilir. 131
139 2. Fruktoz 1,6 bisfosfatın hidrolizlenerek fruktoz 6 fosfata dönüştürülmesi: Bu ekzergonik hidroliz reaksiyonu sitozolde fruktoz 1,6 bisfosfataz enzimi tarafından katalizlenir. F-1,6-bisfosfataz Fruktoz-1,6-bisfosfat + 2 Fruktoz-6-fosfat + P i 3. Glukoz 6 fosfatın hidrolizi ile glukozun oluşumu: Bu reaksiyon, glukoz 6 fosfataz enzimi tarafından katalizlenir. G-6-fosfataz Glukoz-6-fosfat + 2 Glukoz + P i Glukoz 6 fosfataz endoplazmik retikulum membran proteinidir. Bu enzim; böbrek, karaciğer ve bağırsak hücrelerinde bol miktarda bulunur. Beyin ve kasta mevcut değildir. Bu dokular sentezledikleri az miktardaki glukozu, glukoz 6 fosfattan itibaren kendileri kullanır Glukoneogenezin Enerji Bilançosu Glukoneogenezin net denklemi şöyledir: 2Pirüvat + 4ATP + 2GTP + 2NAD Glukoz + 4ADP + 2GDP + 6P i + 2NAD G o = kj/mol Eğer glukoz sentezi glikolizin dönüşümüyle olsaydı, 2ATP + 2Pirüvat + 2NAD Glukoz + 2ADP + 2P i + 2NAD + G o = kj/mol +85 kj/mol lük bir enerji engeli ortaya çıkacaktı. Glukoneogenezle glukoz sentezinde altı yüksek enerjili fosfat bağı kullanılırken, glikolizin dönüşümünde iki molekül ATP harcanmaktadır. Yani glukoneogenezin ekstra masrafı, bir glukoz molekülü başına dört adet yüksek enerjili fosfat bağıdır. Bu sayede +85 kj/mol lük enerji engeli aşılarak, ΔG o değeri 37.6kJ/mol olan termodinamik yönden yürüyebilen bir olay meydana getirilmektedir. Glukoneogenez ve glikoliz yolları koordineli olarak çalışıp, birisi nispeten inaktif iken diğeri oldukça aktiftir. er bir yolun birbirinden farklı enzimleri öyle etkilenmektedir ki, iki yol aynı anda aktif olmamaktadır. Mesela AMP, fosfofruktokinaz I i uyarırken, fruktoz 1,6 bisfosfatazı inhibe eder. Sitrat bu enzimler üzerinde zıt etkide bulunur. Fruktoz 2,6 bisfosfat, karaciğer fosfofruktokinaz I in güçlü bir aktivatörü iken, fruktoz 1,6 bisfosfatazı inhibe eder. Glukoz kanda arttığında, hormonal düzenleme ile fruktoz 2,6 bisfosfat seviyesi yükselir ve bu da fosfofruktokinazın aktivasyonu ile fruktoz 1,6 bisfosfatazın inhibisyonuna yol açar. Böylece glikoliz hızlanırken, glukoneogenez yavaşlar. Açlık esnasında fruktoz 2,6 132
140 bisfosfat, glukozun yıkımı veya sentezini belirleme de önemli bir rol oynar. Pirüvat kinaz ve pirüvat karboksilaz enzimlerinin katalizledikleri reaksiyonlar da birbirine zıt etkilerle düzenlenirler. Fruktoz 1,6 bisfosfat, pirüvat kinazı uyarırken, ATP inhibe eder. Glukagon ve insülin hormonlarının protein kinazlar ve protein fosfatazlar aracılığıyla sebep oldukları fosforilasyon ve defosforilasyon mekanizmasıyla düzenlemenin yanı sıra, bazı glikoliz ve glukoneogenez enzimlerinin sentezlerini transkripsiyon seviyesinde baskılama veya uyarma şeklinde de kontrol edici etkileri vardır. Mesela, insülin glukokinazı uyarırken, fosfoenolpirüvat karboksikinazı baskılar Pirüvat Karboksilaz Enziminin Allosterik Özellikleri ve Biyotinin Etki Mekanizması Pirüvat karboksilaz, katalitik ve allosterik özellikleri yönünden çok ilgi çekicidir. Pirüvat karboksilaz, aktifleşmiş 2 taşıyan biyotin prostetik grubunu kovalent bağlamıştır. Biyotinin karboksil ucu, enzim proteininin lizin rezidüsünün ε amino grubuna amid bağıyla bağlıdır (Şekil 8.10.). Pirüvatın karboksilasyonu iki basamakta meydana gelir: - Asetil oa Biyotin-enzim + ATP Biyotin-enzim + Pirüvat Mn +2 2 Biyotin-enzim + ADP + P i Biyotin - enzim + kzalasetat Karboksibiyotin-enzim ara bileşiğinin karboksil grubu, biyotin halkasının 1 nolu N atomuna bağlıdır. Bu aktifleşmiş karboksil grubu, okzalasetat oluşturmak üzere pirüvata transfer edilir. Pirüvat karboksilazın aktivitesi asetil oa nın varlığı ile yakından ilgilidir. Asetil oa (veya benzer bir açil oa) olmaksızın biyotin karboksillenemez. Pirüvat karboksilazın, asetil oa tarafından allosterik etkilenmesi fizyolojik yönden çok önemlidir. Bu enzim reaksiyonunun ürünü olan okzalasetat, hem glukoneogenezin hem de sitrik asit çevriminin ara bileşiğidir. Yüksek seviyedeki asetil oa nın TA çevriminde oksidasyonu için, daha fazla okzalasetata ihtiyaç vardır. Aynı zamanda yüksek asetil oa, glukoz azaldığı için yağların yakılmaya başladığını ve glukoz sentezi için de okzalasetat gerektiğini gösterir. Eğer, ATP fazla ise, okzalasetat glukoneogenezde az ise sitrik asit çevriminde kullanılır. Böylece pirüvat karboksilaz enzimi; yalnız glukoneogenezde değil, sitrik asit çevrimi ara bileşiklerinin seviyesini sabit tutmakla da görevlidir. 133
141 kzalasetat, mitokondride malat dehidrogenaz enzimi reaksiyonuyla malata dönüştürülerek sitoplazmaya taşınır ve tekrar okzalasetata yükseltgenerek fosfoenolpirüvat kinazın substratı olur. NAD + + NAD + kzalasetat Malat dehidrogenaz Malat GLİKJEN METABLİZMASI ayvansal organizmalarda glukozun kolayca mobilize edilerek kullanılabileceği bir depolama şekli olan glikojenin yapısı daha önceden incelenmişti. Çok sayıda glukoz molekülünün, glikojen makromolekülü halinde bir araya gelmesi osmotik basınç açısından hücreye bir avantaj sağlamaktadır. Glikojen, glukoz alt birimlerinin α(1 4) glikozid bağlarıyla oluşturdukları ve yaklaşık on glukoz biriminde bir α(1 6) dallanmalarının olduğu bir polisakkarittir. Dallanmalar, bu polisakkaritin hem çözünürlüğünü artırmakta hem de yıkım ve sentezin gerçekleştiği indirgeyici olmayan uçların sayılarını artırarak metabolizmasının çok hızlı olmasını sağlamaktadır. Glikojen, başlıca karaciğer ve kaslarda depolanmıştır. İstirahat halinde kas ağırlığının % 1 2 sini ve yemek sonrası karaciğer ağırlığının % 6 8 ini oluşturur. Bu dokuların sitoplazmalarında çapları Å arasında değişen granüller halinde bulunur ve granül yapılarında yapım ve yıkımında katalizörlük görevi yapan enzimleri de ihtiva ederler. Glikojen, yemekler arasında veya kas aktivitesi esnasında kullanılabilecek glukoz sağlamada çok önemlidir. 70 kg lık bir kişide, vücut sıvılarındaki glukoz 60 kcal lük bir enerji sağlayabilirken, toplam glikojen miktarının enerji karşılığı 1600 kcal den fazladır. Bu bölümde glikojen sentez (glikojenez) ve yıkımını (glikojenoliz) ayrıntılı olarak ele alınacaktır. Bu konunun ayrıntılı incelenmesinin nedenleri şunlardır: Birincisi, bu olaylar kan glukoz seviyesini düzenlemeleri ve kas aktivitesi için bir glukoz kaynağı olmaları yönünden çok önemlidir. İkincisi, glikojenin sentez ve yıkımı birbirinden farklı yol ve mekanizmalarla gerçekleştiğinden, katabolizma ve anabolizma yollarının özellikleri için çarpıcı bir örnek teşkil etmektedir. Üçüncüsü, glikojen metabolizması, canlı organizmadaki olayların hormonal düzenlenmesine çok güzel bir örnektir. Siklik adenozin monofosfat (camp) ın glikojen sentez ve yıkımını nasıl koordineli olarak kontrol ettiği tam olarak anlaşılmıştır. Dördüncü olarak, bugün artık glikojen metabolizmasındaki enzimlerin kalıtsal bozukluklarından ortaya 134
142 çıkan hastalıkların (glikojen depo hastalıkları) iç yüzü anlaşılmıştır. Bunlardan bazıları çocuk yaşlarda çok tehlikeli olup; bazıları da tedavi ile düzeltilebilmektedir Glikojenin Yıkımı (Glikojenoliz) Glikojenin dış dallarındaki glukoz birimleri iki enzimin; glikojen fosforilaz ve fosfoglukomutazın birbirini izleyen etkileriyle glukolitik yola girer. Glikojen, aşağıdaki reaksiyonu katalizleyen glikojen fosforilaz enzimi tarafından glukoz 1 fosfat halinde parçalanmaktadır. Glikojen fosforilaz Glikojen (n birim) + P i Glukoz-1-fosfat + Glikojen (n-1 birim) Koenzimi piridoksal fosfat olan glikojen fosforilaz, glikojendeki iki glukozu birleştiren α(1 4) glikozidik bağına inorganik fosfatın katılmasını sağlayan reaksiyonu katalizler. İndirgen olmayan uçtaki glukoz, α D glukoz 1 fosfat olarak uzaklaştırılır (Şekil ). Bu fosforilaz tepkimesi bağırsakta glikojen ve nişastanın glikozidik bağlarının amilazla hidrolizlenmesinden farklıdır. Fosforilizde, glikozidik bağ enerjisinin bir kısmı fosfat esteri olan glukoz 1 fosfat oluşumuyla saklanır. Glikojenin fosforilitik parçalanması, ayrılan glukozun fosforillenmiş olmasından dolayı enerji yönünden avantajlı bir reaksiyondur. Çünkü glukoz, hem glikoliz hem de pentoz fosfat yoluna glukoz 6 fosfat şeklinde girerken bir ATP harcanarak fosforillenmesi gerekmektedir. Fosforilli bir ürünün kas hücreleri için bir diğer avantajı da, glukozdan farklı olarak glukoz 1 fosfatın hücre dışına difüzyonla çıkamamasıdır. Şekil Glikojen zincirinin indirgen olmayan ucundan bir uç glukoz kalıntısının glikojen fosforilazla uzaklaştırılması. Bu tekrarlayan bir işlem olup; enzim, ardışık glukoz birimlerini, bir dallanma noktasına dört birim glukoz kalana kadar uzaklaştırır. 135
143 Fosforilaz enzimi katalizörlüğünde, glikojen sınırlı olarak parçalanabilir. Çünkü dallanma noktalarındaki α(1 6) glikozid bağları bu enzimin substratı değildir. Dallanma noktasına dört birim kala fosforilaz parçalanmayı durdurur. Şekil de glikojen yıkımı basamak basamak gösterilmiştir. Şekil Bir α(1 6) dallanma noktası yakınında glikojen yıkımı. Uç glukozun glikojen fosforilazla sırasıyla uzaklaştırılmasını takiben (Şekil ), bir dala yakın glukoz iki basamaklı bir işlemle uzaklaştırılır. Bu işlem bir iki işlevli dal kırıcı enzimi gerektirir. Önce enzimin transferaz aktivitesi üç glukozdan oluşan bir yapıyı daldan koparıp, yakındaki indirgen olmayan uca α(1 4) bağı yaparak yeniden takar. Dallanma noktasında tek kalan α(1 6) bağlı glukoz, dal kırıcı enzimin α(1 6) glukozidaz aktivitesiyle serbest glukoz şeklinde kopartılır ve salınır. Burada önce bir daldaki beş ve diğer daldaki üç α(1 4) glikozid bağı, fosforilaz tarafından parçalanır. Parçalanma bu noktada durur. Glikojen fosforilaz, glikojenin indirgen olmayan ucundan bir α(1 6) dallanma noktasına dört glukoz birimi kalana kadar, defalarca etki eder. Bu safhada yeni bir enzim gerekmektedir. Dış daldaki üç birimi diğerine transfer etme görevini yerine getirecek bu dal kırıcı enzim bir transferazdır. Bu transfer sonucunda dallanma noktasında tek kalan α(1 6) bağlı glukoz, dal kırıcı enzimin α(1 6) glikozidaz aktivitesiyle serbest glukoz şeklinde kopartılır ve salınır. Böylece transferaz ve α(1 6) 136
144 glikozidaz enzimlerinin etkisi sonucu lineer bir yapı ortaya çıkar ve bu da 1 birime kadar defalarca fosforilaz tarafından parçalanır. Transferaz ve α(1 6) glikozidaz iki ayrı enzim olmayıp; tek bir polipeptid zinciri (dal kırıcı enzim) üzerinde yer alan katalitik bölgeler tarafından yerine getirilir. Glikojen fosforilaz reaksiyonunun son ürünü olan glukoz 1 fosfat, fosfoglukomutaz enzimi katalizörlüğünde glukoz 6 fosfata çevrilir. Denge karışımının % 95 i glukoz 6 fosfattır. Fosfoglukomutaz Glukoz-1-fosfat Glukoz-6-fosfat Karaciğerin başlıca fonksiyonu kanda nispeten sabit bir glukoz seviyesi sağlamaktır. Bu amaçla kas faaliyeti esnasında ve yemek aralarında kana glukoz salıverir. Daha önceden, fosforilli glukozun hücre dışına glukoz gibi difüze olamayacağını, bundan dolayı fosforil grubunun hidrolizlenmesi gerektiğini belirtmiştik. Bu hidroliz reaksiyonu, glukoneogenez için de gerekli olan glukoz-6-fosfat, glukoz 6 fosfataz enzimi tarafından katalizlenir. Glukoz-6-fosfataz Glukoz-6-fosfat + 2 Glukoz + P i Glikojen Biyosentezi (Glikojenez) Glukoz pek çok organizmada, depolanmak üzere polisakkaritlere ve taşınma amacıyla disakkaritlere dönüştürülür. Glukozun başlıca depolama şekli omurgalılarda glikojen, mikroorganizmalarda ve bitkiler de ise nişastadır. murgalılarda genellikle glukozun kendisi kanda taşınır fakat bitkilerde taşınma şekli sükrozdur. eksozların dönüşümü veya polimerleşmesi reaksiyonlarının çoğunda şeker nükleotidleri yer alır. Şeker nükleotidlerinde şekerin anomerik karbon atomu nükleotide fosfodiester bağı ile bağlanarak aktifleştirilir. Şeker nükleotidleri; monosakkaritlerin disakkaritlere, glikojene, nişastaya, selüloza ve daha karmaşık polisakkaritlere polimerleşmesinin substratlarıdır. Glikojen sentezi hemen hemen bütün hayvansal dokularda görülür fakat özellikle karaciğer ve kas dokularında yoğun glikojen sentezi olur. Glikojen karaciğerde glukozun depolanma şeklidir. Diğer dokulara dağıtılmak üzere kolayca kan glukozuna çevrilir. Kas dokusunda glikojenin yıkımından oluşan glukoz, glikoliz yolundan metabolize olarak kas kasılmasında gerekli olan ATP yi oluşturur. Glikojen sentezinin başlangıç noktası glukoz 6 fosfattır. Bu serbest glukozdan glukokinaz (karaciğerde) veya hekzokinazla (kasta) oluşturulur. 137
145 D-Glukoz + ATP Glikokinaz veya ekzokinaz D-Glukoz-6-fosfat + ADP Glukozun glikojene, UDP glukoz un parçalanması sonucu takıldığı gösterilmiştir. Glikojen sentezi, yıkımının dönüşümü değildir. Sentez: Glikojen (n birim) + UDP-Glukoz YIkIm: Glikojen (n birim) + P i Glikojen (n+1 birim) + UDP Glikojen (n-1 birim) + Glukoz-1-fosfat Daha önceden glukoneogenez olayında gördüğümüz gibi, biyolojik sistemlerde biyosentez ve yıkım yolları hemen hemen tamamen farklıdır. Glikojen metabolizması buna çok güzel bir örnektir. Ayrı yollar; hem enerji hem de kontrol noktasından kolaylık sağlamaktadır. Glikojen biyosentezinde glukoz vericisi görevini üstlenen UDP glukoz, glukozun aktifleşmiş şeklidir. Glukozun 1 nolu karbonuna bağlı hidroksil grubu, UDP nin difosfat kısmıyla ester bağı yaparak yüksek transfer potansiyeline sahip olur. Glikojen sentezini başlatmak için glukoz 6 fosfat, fosfoglukomutazla glukoz 1 fosfata dönüştürülür. Glukoz-6-fosfat Fosfoglukomutaz Glukoz-1-fosfat UDP glukozpirofosforilaz etkisiyle UDP glukoz oluşturulması, glikojen biyosentezinde anahtar tepkimedir. Glukoz-1-fosfat + UTP UDP-glukoz pirofosforilaz UDP-Glukoz + PP i ücre içinde bu reaksiyon UDP glukozun oluşumu yönünde çalışır çünkü pirofosfat (PPi) inorganik pirofosfataz tarafından hızla inorganik fosfata (Pi) hidrolizlenir (ΔG o = 25 kj/mol). Glukoz-1-fosfat + UTP PP i + 2 UDP-Glukoz + PP i 2P i Glukoz-1-fosfat + UTP + 2 UDP-Glukoz + 2P i Toplam reaksiyon dönüşümsüzdür. Bu reaksiyon, biyokimyada çok rastlanan bir temel olaya yani birçok biyosentez olaylarının pirofosfat hidrolizi ile yürümesine örnektir. UDP glukoz, glikojen sentazla katalizlenen reaksiyonda glukoz vericisidir. Glikojen sentaz, kas ve karaciğerde aktiftir. Enzim, UDP glukozdan glukozun, dallanmış glikojen molekülünün indirgen olmayan ucuna transferini sağlar (Şekil ). Aktifleşmiş glukoz birimi, glikojenin 4 karbonundaki hidroksile aktarılarak bir α(1 4) glikozid bağı oluşur. Glukoz 6 fosfattan, uzayan glikojene giden yolun toplam dengesi glikojen sentezini çok kolaylaştırır. Glikojen sentazin başlatıcı olarak glukoz birimlerini ilave edebilmesi için en az 138
146 dört glukoz molekülü uzunluğunda glikojen zinciri veya en az sekiz glukoz molekülü bulunan bir glikojen dalı olması gerekmektedir. Yani glikojen sentaz, bir primere ihtiyaç duyar. Bu durumda başka sentazların oluşturduğu primer adı verilen bir glikojen zinciri gerekmektedir. Şekil Glikojen sentezi. Bir glikojen zinciri, glikojen sentazla uzatılır. Enzim (glikojen sentaz) UDP glukozun glukozunu, glikojenin bir dalındaki indirgen olmayan uca taşır ve yeni bir α(1 4) bağı yapar. Glikojen sentaz, glikojen molekülünün dallanma noktalarında bulunan α(1 6) bağlarını sentezleyemez; bu bağlar, amilo(1 4) (1 6) transglikozilaz veya glikozil(4 6) transferaz olarak adlandırılan glukozun dallanma enzimiyle oluşturulur. Glikozil(4 6) transferaz; en az 11 glukoz molekülü bulunan bir glikojen dalının indirgen olmayan ucundan altı veya yedi glukoz içeren bir terminal parçanın, aynı veya başka bir glikojen molekülünün daha iç tarafında bulunan bir glukoz molekülünün 6 hidroksil grubuna transfer ederek yeni bir dal oluşmasını sağlar (Şekil ). Yeni dalın ucuna glikojen sentazla başka glukoz molekülleri bağlanabilir. Dallanmanın artması glikojen molekülünün suda çözünürlüğünü artırdığı gibi, aynı zamanda indirgen olmayan uçların sayısını da artırır. Bu artış glikojen 139
147 sentazın ve glikojen fosforilazın bağlanma yerlerinin sayısını artırır. Bu enzimlerin her ikisi de sadece indirgen olmayan uçlarda etkindir. Şekil Glikojen dalının sentezi. Glikojen sentezi sırasında glikojen dallandırıcı enzim, glikozil(4 6) transferaz, yeni dallanma noktaları oluşturur. Şimdi glukoz 6 fosfatın, glikojene ve tekrar glukoz 6 fosfata çevrilmesi olayının enerji maliyetini hesaplayalım. Bu hesaplarımızda UTP nin bir ATP kullanarak, nükleosit difosfokinaz enzimi katalizörlüğünde UDP den oluşum reaksiyonunu kullanacağız. Fosfoglukomutaz (1) Glukoz-6-fosfat Glukoz-1-fosfat UDP-Glukoz pirofosforilaz (2) Glukoz-1-fosfat + UTP UDP-Glukoz + PP i Pirofosfataz (3) PP i + 2 2P i (4) UDP-Glukoz + Glikojen (n birim) Glikojen (n+1 birim) + UDP (5) UDP + ATP UTP + ADP Toplam: Glukoz-6-fosfat + ATP + Glikojen (n birim) + 2 Glikojen (n+1 birim) + ADP + 2P i Sonuç olarak, glukoz 6 fosfatın glikojene dahil edilmesi olayında bir adet yüksek enerjili fosfat bağı kullanılır. Glikojen yıkımından elde edilen enerji verimi çok yüksektir. Glukoz birimlerinin yaklaşık % 90 ı fosforilitik olarak glukoz 1 fosfata parçalanır ve bu da hiçbir enerji maliyeti olmaksızın glukoz 6 fosfata çevrilir. Geride kalan % 10 u ise, dallanma noktasında tek kalan glukoz olup; glukoz birimlerine hidrolizlendikleri için, her biri bir ATP kullanarak glukoz 6 fosfata dönüşebilir Glikojen Metabolizmasının Kontrolü ve Düzenlenmesi Glikojen metabolizması glikojen fosforilaz ve glikojen sentaz enzimleri aracılığıyla düzenlenir. Bu düzenleme, hem allosterik etkileşimlerle hem de kovalent modifikasyonla yani hormon etkili fosforilasyon ve defosforilasyon mekanizmasıyla gerçekleştirilir. Glikojenin 140
148 sentez ve yıkımının ayrı ayrı yollarla gerçekleşmesi, bu olayların kolay kontrol edilmelerini sağlar. Eğer, her iki yolun enzimleri aynı anda aktif olsa, çok miktarda ATP boş yere hidrolizlenecektir. Gerçekten, glikojen sentaz ve fosforilaz enzimlerinden birisi tam aktif iken, diğeri inaktif olmaktadır. Glikojen sentaz, fosforillenmiş ve fosforillenmemiş olarak iki forumda bulunur (Şekil ). Fosforillenmemiş formu olan glikojen sentaz a, aktif olan halidir. Özgül protein kinazlarla çok sayıda serin grubundan fosforillendiğinden, daha az aktif olan glikojen sentaz b formuna çevrilir. Serin kalıntılarınından fosfatları, hidrolizle uzaklaştıran fosfoprotein fosfataz enzimiyle b formu, aktif a formuna geri dönüşür. Glikojen fosforilaz enziminin aktif formu olan glikojen fosforilaz a; daha az aktif olan glikojen fosforilaz b formunun, fosforilaz b kinaz ile serin grubundan fosforillenmesiyle oluşmuştur. Fosforilaz a fosfataz, fosfat grubunu hidrolizleyerek, daha az aktif olan fosforilaz b formunu oluşturur. Daha az aktif olan fosforilaz b, allosterik modülatörü olan AMP yle uyarılır. Glikojen fosforilaz ve glikojen sentaz fosforillenme/defosforillenme devriyle ters düzenlenir. Enzimlerden biri aktif iken, diğerinin aktivitesi azalmış olur (Şekil ). Bu iki metabolik yolun hormonal kontrolü; normal şartlarda insülin ve glukagon, stres ve aşırı aktivite gerektiren durumlarda ise epinefrin (adrenalin) tarafından sağlanmaktadır. Burada, önce glukagonun karaciğer glikojen metabolizması üzerine olan etkisi özetle anlatılacaktır. Konuya glukagon etkisiyle artan camp nin aktifleştirdiği protein kinaz ile başlayalım: Protein kinaz, bazı enzim ve proteinleri serin ve treonin grupları üzerinden fosforiller ve onların fizyolojik ve metabolik özelliklerinde değişim meydana getirir. Protein kinaz glikojen metabolizmasıyla ilgili (1) glikojen sentaz a ve (2) fosforilaz b kinaz enzimlerini de fosforiller. Birincisinin inhibisyonuna ve ikincisinin aktivasyonuna sebep olur. Glikojen fosforilaz, karaciğerde glukagon hormonuyla ve allosterik mekanizmalarla düzenlenir. Kan glukoz düzeyi çok düşük olduğunda glukagon, fosforilaz b kinazı aktifleştirir. Fosforilaz b kinaz, glikojen fosforilaz b yi fosforilasyonla aktif fosforilaz a haline getirir. Sonuçta, glikojen sentezi aktivitesini kaybederken; glikojen yıkımı hızlanır ve kana glukoz verilmeye başlanır. Kan glukozu normale döndüğü zaman, glukoz hepatositlere girer ve fosforilaz a nın allosterik bölgesine bağlanır. Bu yapısal değişiklik, fosforilaz a nın fosforil gruplarını fosforilaz a fosfatazla uzaklaştırır ve fosforilaz a inhibe olur. Epinefrin 141
149 (adrenalin), glukagon benzeri etki gösterir. Ancak bunun hedefi öncelikle kas dokusu hücreleridir. ysa glukagonun birinci hedefi karaciğer üzerinedir. İnsülin, yukarıda özetlenen glukagon etkisini iki enzimi aktifleştirerek tersine çevirir. (1) camp i yıkan fosfodiesteraz ve (2) serin ve treonin üzerinden fosforillenmiş proteinleri defosforile eden protein fosfataz. Bu iki enzimin allosterik düzenlenmesi de tamamen birbirine zıt şekilde gerçekleşmektedir. Kas ve karaciğer farklılaşması da söz konusudur. Glukoz 6 fosfat, ATP ile beraber her iki dokunun fosforilazını da inhibe ederken; glikojen sentazları aktifleştirir. Glukoz bizzat karaciğerde fosforilazı inhibe eder. Kasta ise a +2 ve AMP nin, glikojen yıkımını artırıcı etkisi vardır. Kas kasılması için bir sinyal olan a +2, fosforilaz b kinaza bağlanır ve aktifleştirir. İnaktif fosforilaz b nin aktif a şekline çevrilmesini sağlar. ATP düzeyi uygun olduğu zaman fosforilaz a inaktifleşir. Şekil Glikojen sentaz ve glikojen fosforilazın karşılıklı düzenlenmesi. Düzenlenme osforillenme / defosforillenme çevriimiyle gerçekleşir. er iki enzimde de fosforillenme yeri, serin kalıntılarıdır (burada 2 ile gösterilmiştir). Glikojen yıkımı enzimleri (fosforilaz a ve b) koyu renkli gösterilmiştir. 142
150 FTSENTEZ VE FTSENTETİK KARBİDRAT SENTEZİ Fotosentetik organizmalar tarafından güneş enerjisinin yakalanıp, organik bileşiklerde kimyasal enerjiye dönüşümü neredeyse tüm biyolojik enerjilerin en büyük kaynağıdır. Fotosentetik ve heterotrofik organizmalar yeryüzünde bir dengede yaşarlar (Şekil ). Fotosentetik organizmalar güneş enerjisini ATP ve NADP şeklinde yakalar, bunu 2 ve 2 dan karbohidratları ve diğer organik bileşikleri yapmak için enerji kaynağı olarak kullanırken, aynı zamanda atmosfere de 2 verirler. Aerobik heterotroflar (örneğin insanlar) yüksek enerjili organik bileşikleri 2 ile yakıp kendisi için ATP oluştururken sonuçta fotosentezin kullandığı 2 ve 2 yu verir. eterotroflarda solunumla oluşan 2 atmosfere döner ve fotosentetik organizmalarca tekrar kullanılır. Güneş enerjisi yeryüzünde 2 ve 2 döngüsünün sürekliliğini ve fotosentetik olmayan organizmaların kullandığı indirgenmiş substratları (yakıtları) örneğin glukozu sağlar. Fotosentez yüksek bitkilerde olduğu gibi tek hücreli ökaryotlarda (su yosunları) ve bir grup bakteride (siyanobakteri) de gözlenir. İşlev, bu organizmalarda ayrıntıda farklı olmamasına karşın, temel mekanizma oldukça benzerdir ve yüksek bitkilerde fotosentezi açıklamak için yapılan çalışmaların çoğu basit organizmalardan elde edilmiştir. Yüksek bitkilerde 2 nin karbohidrata (2) indirgenmesi için, 2 nun elektron vericisi (hidrojen olarak) olduğu bir yükseltgenme-indirgenme reaksiyonu olarak tanımlanan fotosentezin tüm dengesi şu şekilde yazılabilir: Işık (2) Şekil Güneş enerjisi tüm biyolojik enerjilerin en büyük kaynağıdır. Fotosentetik organizmalar güneş ışığı enerjisini, heterotrofik hücrelerin enerji ve karbon kaynağı olarak kullandığı glukoz ve diğer organik ürünleri yapmak için kullanırlar. 143
151 Fotofosforilasyonun Genel Özellikleri Yüksek bitkilerdeki fotosentez iki işlemle donatılmıştır: (1) Işığa bağlı reaksiyonlar veya ışık reaksiyonları, bunlar sadece bitki ışık aldığında oluşur, (2) karbon-özümleme veya karbon-fiksasyon (tespit) reaksiyonları, bazen hatalı olarak karanlık reaksiyonları denir, bunlar ışık reaksiyonlarından gelen ürünleri kullanır (Şekil ). Işık reaksiyonlarında fotosentetik hücrelerin klorofil ve diğer pigmentleri ışık enerjisini alıp onu ATP ve NADP halinde tutarken, 2 üretir. Karbon-özümleme reaksiyonlarında ise 2 yi trioz fosfat, nişasta, sükroz ve bunlardan türeyen diğer ürünlere dönüştürmek için ATP ve NADP kullanılır. Şekil Güneş enerjisinin harcandığı fotosentezin ışık reaksiyonları, enerji bakımından zengin NADP ve ATP oluşturur. Bu ürünler karbon-özümleme reaksiyonlarında kullanılır, karanlıkta veya ışıkta oluşabilen bu reaksiyonlarla 2 triozlara ve triozlardan türeyen daha karmaşık bileşiklere (glukoz gibi) dönüştürülür Yüksek Bitkilerdeki Fotosentez Fotosentetik ökaryotik hücrelerde, hem ışığa-bağımlı reaksiyonlar hem de karbonözümleme reaksiyonları kloroplastlarda yer alır (Şekil ); kloroplastlar, genelde bir kaç mikron çapında zara bağlı hücre içi organellerdir. Mitokondri gibi iki membranı vardır, dış membran küçük molekül ve iyonlara geçirgendir, iç zar ise iç kısmı çevreler. İç kısımda tilakoitler olarak adlandırılan birkaç kez katlanmış membranla çevrili veziküller bulunur, genelde grana adı verilen demetler şeklinde istiflenmiştir (Şekil b.). Tilakoit reaksiyonları yerleşmiş fotosentetik pigmentler ve enzim kompleksleri, ışık reaksiyonlarını ve ATP sentezini gerçekleştirir. Stroma (iç zarla çevrelenmiş sıvı kısım) karbon-özümleme reaksiyonları için gereken çok sayıda enzim bulundurmaktadır. 144
152 Şekil Kloroplast. (a) Elektron mikrografisi (b) Şematik çizim. Büyük büyütmede grana yani tilakoit membran demetleri görülmektedir Işık Kloroplastlarda Elektron Akışını Sağlar Robert ill 1937 de kloroplast içeren yaprak özlerini aydınlattığında bunların ill reaksiyonuna göre (1) 2 ürettiğini ve (2) ortama eklenen biyolojik olmayan bir elektron alıcısını indirgediğini buldu: Işık A 2A2 +2 A bir elektron alıcısını göstermektedir. Birkaç yıl sonra, kloroplastlarda biyolojik elektron alıcısının NADP + olduğunu aşağıdaki eşitlikle göstermiştir; NADP + Işık 2NADP Klorofiller fotosentez için ışık enerjisini tutar. Işık enerjisini tutan en önemli pigmentler tilakoit membranlardaki klorofillerdir, polisiklik, düzlemsel yapıdaki bu yeşil pigmentler hemoglobinin protoporfirinine benzer ancak bunlarda merkezde Fe +2 yerine Mg +2 bulunur (Şekil ). Bütün klorofillerin uzun bir fitol yan zinciri vardır, bu IV. halkadaki bir karboksil grubuyla esterleşmiştir. Klorofilin içe doğru yönelen dört azot atomu Mg +2 a bağlanmıştır. Yüksek bitki kloroplastları klorofil a ve klorofil b içerir (Şekil a). er ikisi de yeşil olmasına karşın absorbsiyon spektrumları, görünür bölgede ışık absorbsiyon sınırlarıyla birbirinden ayırt edilecek kadar farklıdır. Su yosunları ve fotosentetik bakterilerin pigmentlerinden çok az fark göstermektedir. 145
153 Şekil Birincil ve ikincil fotopigmentler. (a) klorofil a ve b ışık enerjisinin birincil toplayıcılarıdır. (b) β-karoten (bir karotenoit) ve (c) Lutein (ksantofil de denir) bitkilerdeki aksesuar pigmentlerdir. Klorofiller her zaman özgül bağlayıcı proteinlerle birlikte ışık-toplayan kompleksler halinde membrana tutunurlar (Şekil a.). Tilakoit membran klorofillere ek olarak, ikincil ışık-tutan pigmentler (aksesuar pigmentler) de içerir, bunlar karotenoitlerdir. Karotenoitler sarı, kırmızı ya da mor olabilir. En önemlileri kırmızı-turuncu bir izoprenoid olan β-karoten (Şekil b.) ve sarı karotenoit lutein (Şekil c.) dir. Aksesuar pigmentler ışık absorblama sınırını genişletir. Karotenoit pigmentler, ışığı klorofillerin tutmadığı dalga boylarında tutar Klorofil Tutulan Enerjiyi Reaksiyon Merkezlerine, Uyarım Transferiyle Aktarır Tilakoit veya bakteri membranlarının ışık-tutan pigmentleri fotosistem denilen işlevsel bir düzenlenme göstermektedir. Örneğin ıspanak kloroplastında, her bir fotosistem 200 molekül kadar klorofil ve 50 molekül kadar karotenoit içerir. Bir fotosistemdeki tüm pigment molekülleri fotonları tutabilir, ancak sadece birkaç klorofil molekülü fotokimyasal reaksiyon merkezi ile ilişkilidir ve ışığı kimyasal enerjiye çevirebilir. Fotosistemdeki diğer 146
154 pigment molekülleri ışık-toplayan veya anten moleküller olarak adlandırılır. Bunlar ışık enerjisini tutar, hızla ve verimli olarak reaksiyon merkezine geçirir (Şekil ). Şekil Fotosistemlerin tilakoit membrandaki organizasyonu. Fotosistemler tilakoit membranda sıkıca, bir fotoreaksiyon merkezini çevreleyen yüzlerce anten klorofil ve aksesuar pigment ile paketlenmiştir. Bir foton herhangi bir anten klorofil tarafından tutulunca, uyarım transferi yoluyla reaksiyon merkezine uyarı ulaşır. Tilakoit membrana yerleşmiş sitokrom b 6f kompleksi ve ATP sentaz da bulunur (bkz. Şekil ) Yüksek Bitkilerde İki Reaksiyon Merkezi Ardarda Çalışır Kloroplast tilakoit membranlarının iki farklı fotosistemi ve ikisinin de kendine ait fotokimyasal reaksiyon merkezi ve anten molekülleri topluluğu bulunmaktadır. Bu iki sistem farklı ve birbirini tamamlayan işlevlere sahiptir (Şekil ). Fotosistem II (PSII) feofitinkinon tipi sistemdir ve kabaca eş miktarda klorofil a ve b içermektedir. Reaksiyon merkezi P680 nin uyarılması, elektronları sitokrom b6f kompleksine yöneltir, beraberinde protonlar tilakoit membranı geçer. Fotosistem I (PSI) ferrodoksin tiptir, reaksiyon merkezi P700 dür ve klorofil a nın klorofil b e oranı yüksektir. P700 uyarımı elektronları Fe-S protein ferrodoksine, sonrasında NADP + ye geçirir ve NADP oluşturur. Tek bir ıspanak kloroplastının tilakoit membranları bu fotosistem tiplerinden yüzlercesini bulundurmaktadır. Bitkilerdeki bu iki reaksiyon merkezi, elektronların 2 dan NADP + ye ışıkaracılıklı hareketlerini katalizlemek için birlikte eşleşerek çalışır (Şekil ). Elektronlar, iki fotosistem arasında işlevsel olarak mitokondrideki sitokrom c e benzeyen bir elektron 147
155 taşıyıcısı olan çözünür protein plastosiyanin aracılığıyla taşınmaktadır. Siyanobakteriler ve bitkiler, elektronlar PSII den PSI e ve NADP + akarken, 2 u yükseltgeyerek (yeşil sülfür bakterilerin 2S oksidasyonu gibi) 2 oluşturur (Şekil sol alt). Bu işleme oksijenik fotosentez denir ve bu şekilde yeşil sülfür ve mor bakterilerin anoksijenik fotosentezinden ayrılır. Bütün 2 oluşturan fotosentetik hücreler (yüksek bitkiler, suyosunları ve siyanobakteriler) hem PSI hem de PSII içerir; sadece bir fotosistem bulunduran organizmalar 2 üretemezler. İki fotosistem arasındaki elektron akış yollarını ve ışık reaksiyonlarının enerji ilişkilerini tümüyle kapsadığı için Z şeması elektronların 2 dan NADP + ye aşağıdaki eşitlik doğrultusunda akışının tüm yolunu tanımlar; NADP + + 8foton 2 + 2NADP Absorblanan her iki foton için (her bir fotosistem tarafından) bir elektron 2 dan NADP + ye aktarılır. Bir molekül 2 oluşumu için, iki 2 dan iki NADP + ye dört elektronun transferi, her bir fotosistem tarafından dörder olmak üzere toplam sekiz fotonun tutulması gerekir. P680 (PSII de) in uyarımı P680* oluşturur, bu mükemmel bir elektron vericisidir pikosaniyeler içinde bir elektronu feofitine aktararak onu negatif yükler (Feo - ) (Şekil , sol yan). Kendi elektronlarının kaybı P680* i radikal bir katyona dönüştürür (P680 + ). Feo - gelen fazla elektronları hızla protein bağlı plastokinon (PQA) a verir, bu da ardından elektronunu daha gevşek bağlı plastokinon (PQB) a aktarır. PQB, bu şekilde PQA dan iki elektron ve sıvı ortam sudan iki proton kazanınca, tam olarak indirgenmiş kinol (PQB2) formuna döner. Neticede PQB2 deki elektronlar sitokrom b6f kompleksine doğru geçer. PSII deki ışık ile başlatılan tüm reaksiyon şöyledir; 4P PQB + 4foton 4P PQB2 PSI in (P700 reaksiyon merkezinde) uyarımı ile gelişen fotokimyasal olaylar şeklen PSII de gelişene benzer. Uyarılmış reaksiyon merkezi (P700*) bir elektronunu bir alıcıya (Ao, klorofilin özel bir formu olduğuna inanılır ve işlevsel olarak PSII nin feofitinine benzerdir) verir ve Ao ile P700 + oluşur (Şekil , sağ yan). P700 +, kuvvetli yükseltgendir, u-içeren elektron taşıyıcı çözünür bir protein olan plastosiyaninden kolayca bir elektron alır. Ao, elektronunu zincir taşıyıcıları üzerinden NADP + e ileten kuvvetli bir indirgeyicidir. Önce, filokinon (A1) bir elektron alır ve onu bir demir-sülfür proteine (PSI deki üç Fe-S merkez üzerinden) aktarır. Buradan elektronlar, tilakoit membranla gevşek bağlı bir diğer demir-sülfür protein olan ferrodoksin (Fd) e geçer. Zincirde bulunan dört elektron taşıyıcı flavoprotein ferrodoksin: NADP oksidoredüktaz, bu elektronları redükte ferrodoksinden (Fdred) NADP + ye aktarır: 148
156 2Fdred NADP + 2Fdoks + NAD + + Şekil Kloroplastlarda fotosistem I ve II nin bütünleşmesi. Bu Z şeması çevrimsel olmayan fotosentezde 2 dan (sol aşağıda) NADP + ye (sağ uçta) elektron transferi yolunu göstermektedir. er elektron taşıyıcısının düşey eksene göre pozisyonu kendi standart indirgenme potansiyeline karşılık gelir. 2 dan gelen elektron enerjisinin, NADP + yi NADP a indirgeyebilecek enerji düzeyine çıkarılması için, her bir elektronun PSI ve PSII de tutulan fotonlarca iki kez (kalın oklar) yüksek enerji düzeyine uyarılması gerekmektedir. er bir fotosistemde elektron başına bir foton gerekir. Uyarım sonrasında yüksek enerjili elektronların zincir taşıyıcıları boyunca düşük enerji düzeyine inişleri görülmektedir. Protonlar su-yıkım reaksiyonu ve sitokrom b 6f kompleksinden elektron transferi boyunca tilakoit membrandan geçer ve temel olarak ATP oluşumu için proton gradyanı oluşturur. Kesikli ok sadece PSI de bulunan çevrimsel elektron transfer yolunu gösterir (metinde ileride anlatılmıştır); elektronlar NADP + yi NADP a indirgemeden çevrimsel yolla PSI e geri döner. PSI (P700) uyarımı için gereken enerji PSII (P680) uyarımı için gerekenden (daha kısa dalga boyu, daha yüksek enerji demektir) daha azdır. PSI ve PSII fiziksel olarak bitişik olsaydı, uyarılar PSII nin anten sisteminden başlayıp PSI in reaksiyon merkezine ulaşacak, PSII sürekli olarak uyarım altında ve iki reaksiyon sisteminin işleviyle ilişkili kalacaktı. Bu 149
157 şekildeki bir uyarım kaçağı PSI ve PSII nin tilakoit membranda ayrı ayrı yerleşmeleri sayesinde önlenmiştir (Şekil ). PSII her zaman için tilakoit grananın (granal lamel) kümelenmiş, membran (zar) kısmında sıkıca tutunmuş ve ışık-toplayan kompleksle sıkı sıkıya bitişik konumda bulunur. PSI ve ATP sentaz kompleksi her zaman için kümelenmemiş tilakoit membranlarda (stromal lamel) bulunur, her ikisi de ADP ve NADP + gibi stroma içeriğinde yer alan bileşiklerle ilişkilidir. Sitokrom b6f kompleksi ise tilakoit membran boyunca mevcuttur. Şekil Tilakoit membranda PSI ve PSII nin yerleşimi. Işık toplayan kompleks ve ATP sentaz tilakoit membranın hem kümelenmiş hem de kümelenmemiş bölgesinde yer alır ve stromada kullanımlarına hazır ADP ve NADP + bulunmaktadır. PSII stromada her zaman bol olarak kümelenmiş bölgede PSI de her zaman kümelenmemiş bölgede yer alır. PSII de P680 uyarımının bir sonucu olarak plastokinonda depolanan elektronlar, sitokrom b6f kompleksi ve çözünür protein plastosiyanin aracılığıyla PSI deki P700 e taşınır (Şekil l0.37., orta). Elektronlar, sitokrom b6f kompleksi üzerinden PQB2 den sitokrom f ye daha sonra plastosiyanine akar ve dolayısıyla P700 ü indirger. 150
158 Sitokrom b6f elektronları, PQB2 den tek elektron taşıyan suda çözünebilen bir proteine (plastosiyanin) taşır. Bu şekilde elektronlar her seferinde bir tane olmak üzere PQB2 den sitokrom b6 ya geçer. Protonlar bu çevrimle membrandan pompalanır; kloroplastta proton hareketinin yönü stromal kısımdan tilakoit lümene doğrudur ve her elektron çifti için dört proton geçer. Tilakoit membranda meydana gelen bu proton farkının sonucu olarak elektronlar PSII den PSI e geçer. Böylece sitokrom b6f kompleksi fotosistem II ve I i bağlar. Bitki (oksijenik) fotosentezinde NADP + a geçen elektronların en büyük kaynağı sudur. Feofitine bir elektronun gelişiyle, P680 + (PSII deki) in kendi temel durumuna dönmek için mutlaka bir elektron kazanması gerekir ki bir diğer protonu yakalayabilmek için hazır olsun. Gereken elektron ilke olarak, herhangi bir organik veya inorganik bileşikten alınabilir. Yaklaşık üç milyar yıl önce ilkel fotosentetik bakterilerin (modern siyanobakterilerin ataları) evrimi, elektronları her zaman var olan bir vericiden yani sudan alabilecek bir fotosistem oluşturmuştur. Su, oksijen üreten bir kompleks tarafından parçalanır. Bu işlemde iki su molekülü parçalanırken, dört elektron, dört proton ve moleküler oksijen oluşur: e Görünür ışığın tek bir fotonu, sudaki bağları kırmak için yeterli enerjiye sahip değildir; bu fotolitik ayırma reaksiyonu için dört foton gerekir Fotofosforilasyonla ATP Sentezi İki bitki fotosisteminin birlikte çalışmalarıyla elektronlar sudan NADP + ye geçerken tutulan ışığın enerjisinin bir kısmı NADP olarak saklanır (Şekil ). Protonlar eş zamanlı olarak tilakoit membrandan pompalanır ve enerji elektrokimyasal bir potansiyel olarak saklanır. Şimdi işlemin bu proton gradyanıyla yürütülen ATP sentezi kısmına ye ışığabağımlı reaksiyonlardaki enerjiyi koruyan diğer ürünlere bakalım. Bir proton gradyanı elektron akışı ve fosforilasyonu eşleştirir. Kloroplastlardaki, fotosentetik elektron transferi ve fotofosforillenmenin çeşitli özellikleri, proton gradyanının, mitokondrideki oksidatif fosforillenmedekiyle aynı rolü oynadığını göstermektedir: (1) Reaksiyon merkezleri, elektron taşıyıcıları ve ATP oluşturan enzimler proton geçirmeyen bir membranda bulunur (tilakoit membran) ve fosforillenme bütünüyle burada gelişir, (2) Fotofosforillenme ayıraçlarla elektron akışından ayrılabilir böylece protonlar tilakoit membrana doğru yönelir. (3) Fotofosforillenme bazı ajanlarla engellenebilir. (4) ATP sentezi 151
159 tilakoit membranın dış yüzeyinde bulunan F0F1 kompleksiyle katalizlenir, bu da mitokondrinin F0F1 kompleksine yapı ve işlev olarak çok benzemektedir. PSII ve PSI i bağlayan taşıyıcılar zincirinde elektron taşıyan moleküller, tilakoit membranda asimetrik dizilmiştir; böylece ışığın neden olduğu elektron akışı, protonların stromal taraftan tilakoit lümene doğru membrandan geçişine neden olur (Şekil ). Şekil Tilakoitlerdeki proton ve elektron çevrimi. 2 dan alınan elektronlar PSII üzerinden, zincir taşıyıcıların ara ürünlerine ve sonuçta NADP + ye kadar hareket eder. Protonlar PSII ve PSI arasındaki zincir taşıyıcıları boyunca akarken tilakoit lümene pompalanır ve ATP sentazın F o kısmı (kloroplasttaki enzimde F o olarak belirtilir) tarafından oluşturulan proton kanallarından tekrar stromaya girer. F 1 alt birimi (F 1) ATP sentezini katalizler Çevrimsel (Döngüsel) Elektron Akışı ATP Üretir, NADP veya 2 Üretmez Işıkla oluşan elektron akışının bir diğer yolu, kloroplastın ışıkta farklı oranda NADP ve ATP oluşturmasına imkan sağlar; çevrimsel elektron akışı denilen bu yol, normalde tek 152
160 yönlü veya çevrimsel olmayan elektron akışından farklıdır. Çevrimsel elektron akışı (Şekil ) sadece PSI i kapsar. Elektronlar P700 den ferrodoksine geçer, NADP + e devam etmez; buradan sitokrom b6f kompleksi yoluyla plastosiyanine geri döner. Plastosiyanin elektronları P700 e verir ve ışık altında onları ferrodoksine aktarır. Böylece aydınlıkta PSI elektronların, PSI in reaksiyon merkezi dışına çıkarak ve geri içine girerek sürekli olarak dönebilmelerine neden olur, her bir elektron bir fotonun tutulmasıyla elde edilen enerjiyle döngüye katılır. Çevrimsel elektron akışında net bir NADP oluşumu veya 2 açığa çıkışı olmaz. Ancak bu, sitokrom b6f kompleksiyle proton pompalar ve ADP yi ATP ye fosforiller, bundan dolayı çevrimsel (döngüsel) fotofosforilasyon denir. Çevrimsel elektron akışı ve fosforillenmenin tüm denklemi basitçe şöyledir; ADP + Pi Işık ATP + 2 Elektronların NADP + nin indirgenmesi ve çevrimsel fosforillenme arasında paylaşılarak düzenlenmesiyle, bir bitki ışığa bağımlı reaksiyonlarda ürettiği ATP ve NADP oranını kendi gereksinimine göre ayarlayabilir, bu ürünleri karbon-özümleme reaksiyonlarında kullanır. Karbon-özümleme reaksiyonları 3:2 oranında ATP ve NADP gerektirir Kloroplastın ATP Sentazı Mitokondridekine Benzer Kloroplastların ATP sentezleyen enzimi, Fo ve F1 ( kloroplast kökeni ifade etmektedir) olmak üzere iki işlevsel kısım içeren büyük bir komplekstir. Fo çeşitli integral membran proteinlerinden oluşmuş, membran proton taşıma kanalıdır ve mitokondrideki F o ile türdeştir. F1 periferik bir membran protein kompleksidir ve alt birimlerin duruş, yapı ve işlevleri mitokondrideki F1 e çok benzer. ATP sentaz kompleksi tilakoit zarın dış yüzü (stroma) ne çıkıntı yapmış tokmak gibi yapısıyla gözlenir; bu kompleksler mitokondri iç membranının iç yüzü (matriks) ne ATP sentazın çıkıntı yapmış görünümüne eş görünümdedir. Kloroplastlardaki ATP sentazın duruşu ve proton pompalama yönü mitokondridekinin tam tersi konumdadır (Şekil ). Kloroplast ATP sentaz mekanizmasının da, mitokondrideki benzerine tam eşdeğer olduğuna inanılmaktadır; ADP ve Pi enzim yüzeyinde kolayca birleşip ATP oluşturur ve bu enzime bağlı ATP proton-hareket gücüyle serbestleştirilir. 153
161 Şekil Mitokondri, kloroplast ve E. coli bakteri membranlarında ATP sentezinin ve proton hareketinin karşılaştırmalı yerleşimi. Proton gradyanının ATP sentaza göre yerleşimi her üç durumda da aynıdır FTSENTETİK KARBİDRAT SENTEZİ ayvan hücrelerinde karbohidrat sentezi daima 2 deki karbondan daha düşük yükseltgenme basamağında bulunan üç karbonlu öncüllerle başlar. Buna karşın, fotosentetik organizmalar karbohidratlarını 2 ve 2 kullanarak, ATP ve NADP katkısıyla, oluşturulan fotosentetik elektron transferi yardımıyla 2 yi indirgeyerek sentezler. totrof (fototrof ve kemlitotrof) ve heterotrof organizmalar arasındaki temel fark budur. Bitkiler gibi ototroflar, sadece 2 nin karbon atomlarını kullanarak selüloz, nişasta, lipit, protein ve pek çok diğer organik molekülü sentezler. Buna karşın heterotroflar, genellikle yeni bir glukoz molekülü oluşturmak için, 2 nin net indirgemesini gerçekleştirmezler. 2 hayvan dokularında bazı organik moleküllere katılabilir, örneğin glukoneogenezdeki pirüvat karboksilaz reaksiyonunda olduğu gibi, ancak bir sonraki reaksiyonda bir karbon 2 olarak kaybedilir (Şekil ). Yeşil bitkiler kloroplastlarında 2 indirgeyerek, basit (indirgenmiş) organik moleküller oluşturma özelliğine sahip özgün enzim sistemleri bulundurur. Bu işleme 2 asimilasyonu (özümlemesi) denir. Aynı zamanda bu işlemle oluşan basit madde 3- fosfogliserat, daha kompleks büyük ürünlerin (şekerler, polisakkaritler ve türevleri gibi) 154
162 öncülüdür. Karbondioksit, anahtar ara ürünlerin sürekli yenilendiği bir çevrimde sabitlenir. Bu çevrim M. alvin ve arkadaşları tarafından bulunduğundan (1950) alvin Çevrimi olarak adlandırılır Karbondioksit Asimilasyonu (Karbon-Özümlemesi) Üç Safhada luşur Fotosentez yapan organizmalarda, 2 nin biyomoleküllere asimilasyonunda (Şekil ) ilk safha karbon fiksasyon reaksiyonudur: 2 ve beş karbonlu alıcı ribuloz-1,5- bisfosfat birleşerek, iki molekül 3-fosfogliserat oluşturur. İkinci safhada 3-fosfogliserat, trioz fosfatlara indirgenir. Böylece, üç 2 molekülü üç ribuloz-1,5-bisfosfata sabitlenir ve altı molekül gliseraldehit-3-fosfat (18 karbon) (dihidroksiaseton fosfatla dengededir) oluşturur. Üçüncü safhadaki altı molekül trioz fosfatın (18 karbon) beşi (15 karbon), kullanılarak başlangıç maddesi olan ribuloz-1,5-bisfosfat (15 karbon) yeniden yapılır. Böylece çevrim 2 nin trioz ve heksoz fosfatlara kesintisiz dönüştürülmesiyle tamamlanır. Fruktoz-6-fosfat, ribuloz-1,5-bisfosfatın yeniden oluşumu veya nişastanın sentezi arasındaki yol ayırımında üçüncü safhanın anahtar ara ürünüdür. eksoz fosfattan pentoz bisfosfata giden yoldaki reaksiyonlar hayvan hücrelerinde glukoz oksitlenmesinin alternatif yolu olan pentoz fosfat yolundaki (Şekil ) reaksiyonlarla aynıdır, ancak ters yönde (indirgenme reaksiyonları yönünde) çalışır ve heksoz fosfatları pentoz fosfatlara çevirir. Enzimleri ve ara ürünleri aynıdır, ancak geri dönüşümsüz bazı reaksiyonlar da bulunur. 155
163 Şekil Fotosentetik organizmalarda 2 asimilasyonunun üç safhası. Şekilde görüldüğü gibi üç adet 2 molekülünden, bir molekül gliseraldehit-3-fosfat sentezlenmiştir. Bu çevrim fotosentetik karbon indirgenme çevrimi veya alvin çevrimi olarak adlandırılır. 1. Safha: 2 nin 3-fosfogliserata Sabitlenmesi Fotosentez yapan organizmalarda 2 nin asimilasyonu, 1940 ların sonunda aydınlatıldı. Kloroplastlarda, 2 nin ribuloz- 1,5-bisfosfata bağlanmasını gerçekleştiren enzim, ribuloz-1,5-bisfosfat karboksilaz veya kısaca rubisko olarak adlandırılır. Bir karboksilaz olarak rubisko, 2 nin beş karbonlu ribuloz-1,5-bisfosfata katılmasını ve kararsız bir yapıda olan altı karbonlu bileşiğin, iki molekül 3-fosfogliserata bölünmesini katalizler. Üç 3-fosfogliserat molekülünden biri katılan 2 nin karbon atomunu içerir (Şekil ). Bitkilerde bu enzim kloroplast stromasında yerleşiktir ve toplam kloroplast proteinlerinin % 50 sini oluşturur. Atmosferdeki 2 den biyokütle üreten rubisko, biyosferde miktarca en bol bulunan enzimdir. 156
164 Şekil asimilasyonunun birinci safhası. 2 sabitlenmesi ribuloz-1,5-bisfosfat karboksilazla (rubisko) gerçekleştirilir. Karboksillenmiş altı-karbonlu ara ürün olduğu düşünülen ve burada gösterilen β-ketoasit enzime bağlı bulunur. Enzim yüzeyinden hidrolizle ayrılınca, biri 2 den gelen karbon atomunu (kutu içerisinde) taşıyan iki adet üç karbonlu benzer ürün meydana gelir. 2. Safha: 3-Fosfogliserattan Gliseraldehit 3-Fosfat luşumu 1. Safhada oluşturulan 3-fosfogliserat, gliseraldehit-3-fosfata çevrilir. Tek fark dehidrogenaz enziminin kofaktör olarak NAD yerine NADP kullanmasıdır (Şekil ). Kloroplast stromasında fosfogliserat mutaz dışında diğer glikoliz enzimlerinin hepsi mevcuttur. Bu stroma enzimleri sitozolde bulunan glikoliz enzimlerinin izozimleridir. er iki takım enzim de aynı reaksiyonları katalizler ama farklı genlerin ürünleridir. Dizinin ilk basamağında, stromadaki 3-fosfogliserat kinaz önce, ATP den bir fosforil grubunun 3-fosfogliserata aktarılarak 1,3-bisfosfogliserat oluşumunu katalizler (Şekil ). Sonra, NADP den elektronlar gliseraldehit-3-fosfat dehidrogenazla 1,3-bisfosfogliserata aktarılarak indirgenir ve gliseraldehit-3-fosfat oluşur. Trioz fosfat izomeraz, gliseraldehit-3- fosfat ve dihidroksiaseton fosfatı birbirine dönüştürür. Trioz fosfat kloroplastta nişastaya çevrilir ve daha sonra kullanılmak üzere depolanır veya hemen sitoplazmaya transfer edilerek, 157
165 bitkinin gelişmekte olan bölgelerine yollanmak üzere sükroza çevrilir. Gelişmekte olan yapraklarda, trioz fosfatın büyük bir miktarı, büyümeye ek enerji sağlamak üzere glikolizle yıkılır (Şekil ). Şekil asimilasyonunun ikinci safhası. 3-Fosfogliserat, gliseraldehit-3-fosfata çevrilir. Gliseraldehit-3-fosfatın kullanıldığı alternatif yollar da gösterilmiştir. Şekil da görüleceği gibi bunun çoğu ribuloz-1,5-bisfosfata geri dönüşür. Nişasta sentezi için (eğer gerek duyulursa) gliseraldehit-3-fosfat, önce dihidroksiaseton fosfatla stromada birleşerek fruktoz-1,6-bisfosfatı, nişastanın bir öncülünü oluşturur. Dihidroksiaseton fosfat sitozolde glikolizle yıkılıp enerji üretebilir veya fruktoz-6-fosfat ve böylece sükroz oluşturmakta kullanılabilir. 3. Safha: Ribuloz-1,5-Bisfosfatın Trioz Fosfatlardan Yeniden luşumu Daha önce gördüğümüz gibi, trioz fosfata 2 asimilasyonundaki ilk reaksiyon ribuloz-1,5-bisfosfatın harcanmasına yol açar. 2 nin karbohidratlara devamlı akışının sağlanması için ribuloz-1,5- bisfosfatın yenilenmesi gerekir. Bu, yukarıda açıklanan 1. ve 2. safha ile birlikte, süregelen bir 158
166 çevrim halinde ilk reaksiyonun ürünü (3-fosfogliserat) bir seri değişimden geçerek, ribuloz- 1,5-bisfosfatın yeniden oluşturulmasıyla sağlanır. Bu değişimler gliseraldehit-3-fosfat ve dihidroksiaseton fosfat yapılarında karbon iskelette düzenlemeler gerektirir. Metabolik yolun ara ürünleri üç-, dört-, beş-, altı- ve yedi-karbonlu şekerlerdir. İzleyen açıklamalarda tüm basamak numaraları Şekil deki gibidir. Şekil asimilasyonunun üçüncü safhası. Bu şematik diyagram, trioz fosfatlarla (3 lu bileşikler) pentoz fosfatların (5 lu bileşikler) birbirine çevrilmesini gösterir. Başlangıç maddeleri gliseraldehit-3-fosfat ve dihidroksiaseton fosfattır. Bunlar transaldolaz (1) ve (4) ve transketolaz (3) ve (6) reaksiyonlarıyla ribuloz-1,5-bisfosfata dönüşen pentoz fosfatları (riboz-5-fosfat) riboz-5-fosfat izomerazla (7) ve ksiluloz-5-fosfatı, ribuloz-5- fosfat epimerazla (8) oluşturur. Basamak (9) da ribuloz-5-fosfat fosforillenerek ribuloz- 1,5-bisfosfat oluşturulur. 159
167 Basamak (1) ve (4) glikolizdeki gibi, gliseraldehit-3-fosfat ve dihidroksiaseton fosfatın (basamak (1)) ve eritroz-4-fosfatın dihidroksiaseton fosfatla, yedi karbonlu sedoheptuloz-1,7- bisfosfat oluşturan (basamak (4)) geri dönüşümlü kondenzasyonunu katalizleyen transaldolazla gerçekleşir. Basamak (3) ve (6) Mg +2 a gereksinen ve tiaminpirofosfat (TPP) prostetik grubu olan transketolazla gerçekleşir. Transketolaz bir ketoz fosfat vericisi olan basamak (3) teki fruktoz-6-fosfattan, bir aldoz fosfat alıcısı olan gliseraldehit-3-fosfata bir ketol (2--) grubunun transferini gerçekleştirir (Şekil a. ve b.). Aynı temel reaksiyon sedoheptuloz-7-fosfatı ve gliseraldehit-3-fosfatı, basamak (6) daki iki adet pentoz fosfata dönüştürür. Şekil alvin çevriminde transketolazla katalizlenen reaksiyonlar. (a) Transketolazlarla katalizlenen genel reaksiyon. İki karbonlu bir grup bir ketoz vericiden, bir aldoz alıcıya geçici olarak TPP ye bağlanarak taşınır. (b) Bir heksoz ve bir triozun, dört-karbonlu bir şekere ve pentoza çevrilmesi (Şekil de 3. basamak). (c) Yedi-karbonlu ve üçkarbonlu şekerlerden iki adet beş karbonlu şeker oluşması (Şekil de 6. basamak). 160
168 Transketolaz reaksiyonlarında oluşan pentoz fosfatlar (riboz-5-fosfat ve ksiluloz-5- fosfat) ribuloz-5-fosfata dönüşür (basamak (7) ve (8)). Çevrimin son reaksiyonunda, (basamak (9)) riboz-5-fosfat, ribuloz-5-fosfat kinazla fosforillenerek ribuloz-1,5-bisfosfata çevrilir (Şekil ). Bu alvin çevriminin üçüncü çok yüksek egzergonik reaksiyonudur. Şekil Ribuloz-1,5-bisfosfatın yenilenmesi. alvin çevriminin başlangıç maddesi olan ribuloz- 1,5-bisfosfat, çevrim sırasında oluşturulan iki pentoz fosfattan yeniden oluşturulur. Bu yol bir izomeraz ve bir epimerazın etkinliğini daha sonra bir kinazla fosforillenmeyi içerir (Şekil basamak (7), (8) ve (9)). 161
169 11.BÖLÜM: LİPİD METABLİZMASI Bu bölümde lipidlerin sindirimi ile yağ asitlerinin yıkımı ve sentezi anlatılacaktır. Yetişkin bir insan besin maddeleri vasıtasıyla günde yaklaşık g arasında lipid alır. Bunların % 90 ından fazlasını triaçilgliseroller teşkil eder. Bunun yanı sıra fosfolipidler, kolesterol veya kolesterol esterleri, serbest yağ asitleri ile yağda çözünen A, D, E ve K vitaminleri de alınan diyette bulunur. Daha önceden açıklandığı gibi, nötral yağlar bitki ve hayvanlarda yağların depo şekli olup; yağ asitlerinin gliserolle yapmış oldukları mono, di veya triaçilgliserol esterleridir. Triaçilgliseroller (trigliseridler, nötral yağlar) metabolik enerjinin en verimli ve konsantre depolanma şeklidir. 1 gram karbohidrat ve protein 4 kcal lik bir enerji sağlarken; 1 gram yağın oksidasyonu ile 9 kcal lik enerji açığa çıkar. Çünkü yağlar, karbohidratlar ve proteinlere göre daha indirgenmişlerdir. Bunun yanı sıra yağlar, çok apolar olduklarından susuz depolanırlar. Fakat proteinler ve karbohidratlar, polar yapılarından dolayı hidratlanmış şekilde depo edilirler. Mesela 1 gram glikojen, 2 gram su bağlar. Bunun sonucu olarak, 1 gram susuz yağ, hidratlanmış 1 gram glikojenden 6 kat daha fazla metabolik enerji depolayabilir. Bu da enerjinin glikojen yerine triaçilgliseroller halinde depolanmasını daha avantajlı kılmaktadır. 70 kg ağırlığında bir yetişkinin, metabolik enerji kaynaklarının yaklaşık kcal si triaçilgliseroller; kcal si çoğunluğu kaslarda olmak üzere proteinler; 1600 kcal si glikojen ve 60 kcal si glukoz halindedir. Toplam vücut ağırlığının yaklaşık 11 kg ı triaçilgliseroldür. Eğer bu miktar enerji, glikojen halinde depolansaydı; vücut ağırlığı 55 kg daha fazla olurdu. Memelilerde triaçilgliserollerin depolandığı doku, adipoz doku yani yağ dokusudur. Bu doku hücrelerinin büyük bölümünü triaçilgliserol kütleleri oluşturmaktadır. Bu hücreler, triaçilgliserollerin sentez, depolanma ve mobilizasyonu için özelleşmiştir YAĞLARIN SİNDİRİMİ VE TAŞINMASI Besinlerden alınan yağların sindirim yolunda karşılaştığı ilk enzim, dil altından salgılanan lingual lipazdır. Ağızdaki kısa süreli temastan dolayı, burada kayda değer bir triaçilgliserol hidrolizi gözlenmez. Bu enzim, asidik ortamda da aktif olduğu için, midede de etkisini sürdürür. Ayrıca mideden salgılanan gastrik lipazın, mide p ları nötral olan bebeklerde sütteki yağların sindirimi fonksiyonu gördüğü ve yetişkin kişilerde çok önemli olmadığı bildirilmektedir. Yağlar, midede safra asitlerinin mevcut olmaması sebebiyle emülsiyonlaşmış halde değildir. Dolayısıyla lingual ve gastrik lipazlar ancak daha az 162
170 hidrofobik olan kısa zincirli yağ asitli triaçilgliseroller üzerinde etkili olabilirler. Bu yağ asitlerinin bir kısmı, mide mukoza hücrelerine ve oradan da kana geçerek karaciğere ulaşır. Sonuç olarak, midede önemli ölçüde bir yağ sindirimi söz konusu değildir. Diyet lipidlerin sindirimi ve emilimi ince bağırsakta olur (Şekil 11.1.). Diyetle alınan yağlar, ince bağırsağın üst kısmından girdiği zaman, kolesistokinin hormonu salgılanarak kana karışır ve bu da safra kesesinden bağırsağa safra sıvısının salgılanmasını uyarır. Safra sıvısının önemli bir bölümünü oluşturan kolesterolün, polar türevleri olan safra asitleri etkili deterjan özelliği gösterirler. Safra asitleri karaciğerde sentezlenir, safra kesesinde depolanırlar. Safra asitleri suda çözünmeyen lipidleri dağıtarak emülsiyon oluştururlar. Böylece lipidlerin lipaz enzimleri tarafından hidrolizi için uygun fiziksel ortam hazırlanır. Safra asitleri miseller oluşturarak, lipidlerin absorpsiyonuna katkıda bulunurlar. Ayrıca yağlar, on iki parmak bağırsağından (duodenum) geçerken, sekretin hormonunun salgılanmasını uyarır. Bu hormon da, 3 - bakımından zengin ve mideden gelen karışımın p sını nötralize eden pankreas sıvısının bağırsaklara salgılanmasını sağlar. Pankreas salgısı, yağların sindirimi ile ilgili 1) pankreas lipazı, 2) kolesterol esteraz ve 3) fosfolipaz A2 (PLA2) enzimleriyle; lipazın etkinliği için gerekli olan kolipaz proteini içerir. Kolipaz, lipazın bu kompleksi içinde adsorpsiyonunu kolaylaştırır. Bu şekilde triaçilgliserollerin hidrolizini de aktive etmiş olur. Bunlardan fosfolipaz A2 ve kolipaz zimojen halde salgılanır ve tripsin tarafından aktifleştirilir. Safra asitlerinin oluşturduğu lipid emülsiyonu sulu ortam ara yüzeyinde kolipazla 1:1 oranında teşkil edilen kompleks halinde iş görebilen pankreas lipazı, triaçilgliserol omurgasındaki 1 ve 3 no lu karbonlardaki ester bağlarını hidrolizler. Ürün olarak, iki yağ asidi ve 2 monoaçilgliserol oluşur: R R 1 R 3 2 R Pankreas 1 LipazI R R 3 Triaçilgliserol 2 Monoaçilgliserol + 2 Yağ asidi 163
171 Şekil murgalılarda diyet lipidlerin işlenmesi. Diyet lipidlerin sindirimi ve emilimleri ince bağırsaklarda olur ve triaçilgliserollerden salınan yağ asitleri, kas ve adipoz dokuya salınır ve depolanır. Burada sekiz basamak tartışılacaktır. 1-Safra asitleri, ince bağırsaklarda diyet yağlarını emülsifiye eder ve karışık miselleri oluşturur. 2-İnce bağırsak lipazları triaçil gliserolleri parçalar. 3-Yağ asitleri ve diğer yıkım ürünleri, ince bağırsak mukazası tarafından alınır ve triaçilgliserollere çevrilir. 4-Triaçilgliseroller, kolesterol ve apolipoproteinlerle birleşerek şilomikronları oluşturur. 5-Şilomikronlar, kolesterol ve apolipoproteinlerle birleşerek şilomikronları oluşturur. 6-Kapilerde, Ap--II ile aktifleştirilen lipoprotein lipaz; yağ asitleri ve gliserol salınımını sağlar. 7-Yağ asitleri hücreye girer. 8-Yağ asitleri, yakıt olarak oksitlenir veya yeniden esterleştirilerek depo edilir. 164
172 Kolesterol esteraz ise, kolesterol esterlerini serbest kolesterol ve yağ asidine parçalar. Fosfolipaz A2, bağırsakta tripsin tarafından aktifleştirildikten sonra, fosfogliseridlerin 2 no lu karbonundaki yağ asidini uzaklaştırarak lizofosfogliseridleri oluşturur: 2 R 1 2 R 1 R 2 2 Fosfatidil kolin P PLA ( 2 ) 2 N 2 P ( 2 ) 2 3 N R 2 1-Açil lizofosfogliserid Lizofosfogliserit ya ince bağırsak mukoza hücrelerine girer ya da yapılarındaki diğer yağ asidi de lizofosfolipazlarca daha ileri parçalanmaya uğrar. Diyetle alınan lipidlerin sindirimi sonucu oluşan karışımda başlıca, 1) yağ asitleri, 2) serbest kolesterol, 3) 2 monoaçilgliserol ve 4) lizofosfogliseridler bulunmaktadır. Bunlar safra asitleriyle birlikte miseller teşkil ederler. Yağda çözünen vitaminlerin de yer aldığı misel yapısında bu moleküllerin polar kısımları dışarıya; apolar hidrofobik kısımları da içeriye yönelmiştir. Miseller ince bağırsak mukoza hücreleri tarafından emilir karbon uzunluğundaki yağ asitleri, ince bağırsak tarafından emilir ve taşıyıcı kan dolaşımı (portal ven)yoluyla karaciğere taşınır. Bağırsak mukoza hücreleri ER lümeninde, yağ asitlerinin aktifleşmesi ve tekrar esterleşme reaksiyonları ile triaçilgliseroller ve kolesterol esterleri sentezlenir. Bu nötral lipidler; çok hidrofobik oldukları için fosfolipid, serbest kolesterol ve özgül proteinlere bağlanarak lipid tabakası içinde toplanmış şilomikron adı verilen lipoprotein kümelerini oluşturur (Şekil 11.1.). Şilomikronlar, ekzositozla bağırsak mukoza hücrelerinden lenf dolaşımına aktarılır ve buradan da kan dolaşımına geçerler. Şilomikronlar; % 89 triaçilgliserol, % 8 fosfolipid, % 1 protein ve % 2 kolesterolden ibarettir. Normal bir yemek sonrası kanda bir hiperlipidemi (kanda yüksek lipid konsantrasyonu) gözlenir. Bu durum 2 saati maksimumda olmak üzere 4 5 saat sürer. Şilomikronlar, plazmaya bulanık görünüm verirler. Bu bulanık plazma, çeşitli organlardan geçerken lipoprotein lipaz enzimi tarafından berraklaştırılır. Lipoprotein lipaz, başlıca kas ve yağ dokusunda sentezlenerek salgılanır ve periferal dokuların kapiler damarları endotel hücrelerin dış tarafına tutunmuş halde bulunur. Şilomikronların yapısındaki triaçilgliseroller, yağ asitleri ve gliserole hidrolizlenir. Yağ asitleri hücrelerin içine girerken, gliserol karaciğere giderek glikoneogenezle glukoza çevrilir (Bölüm 10. Glukoneogenez). Adipoz doku hücrelerinde, 165
173 gliserolün ATP ile fosforilasyonunu katalizleyen gliserol kinaz enzimi bulunmadığı için gliserolü kullanamazlar. Kolesterol, triaçilgliseroller ve diğer lipidler, vücut sıvılarında artan yoğunluklarına göre sınıflandırılan bir seri lipoproteinler tarafından taşınır. Yukarıda sözü edilen şilomikronlar, bunların bir çeşididir. Diğerleri ise, çok düşük dansiteli lipoproteinler (VLDL), düşük dansiteli lipoproteinler (LDL), yüksek dansiteli lipoproteinler (DL) dir (Tablo 11.1.). Bu lipoproteinler, aynen şilomikronlarda anlatıldığı gibi; polar lipidler tarafından sarılmış bir hidrofobik lipid çekirdeğinden ve bunun etrafında da apolipoproteinlerden ibaret bir kabuktan oluşmuştur. A dan ye kadar birçok apolipoprotein sınıfı ve apo A I veya apo II gibi alt sınıfları belirlenmiştir. Bu kompleksler son derece hidrofobik lipidleri çözünebilir hale getirir. Ayrıca apolipoproteinler, lipoproteinlerin metabolizma ve fonksiyonlarını da düzenlerler. Mesela şilomikronlar ve VLDL yapısındaki apo II proteini lipoprotein lipaz enzimine bağlanarak onu aktifleştirir. epsinin spesifik fonksiyonları henüz aydınlatılamamıştır. Tablo Plazma lipoproteinleri. TG:Triaçilgliserol Lipoprotein çeşidi Çap (nm) Yoğunluğu (g/ml) Başlıca polipeptidler Lipoprotein bileşim (%) Protein Fosfolipit Kolesterol TG Şilomikronlar < apo A, B, VLDL apo B,, E LDL apo B DL apo A Şilomikronların tamamı ve VLDL nin az bir bölümü bağırsaklarda ve diğerleri tamamen karaciğerde sentezlenir ve salgılanır. Bunların en büyüğü olan şilomikronlar, diyetle alınan triaçilgliserolleri ve diğer lipidleri bağırsaktan karaciğere ve adipoz dokuya taşırlar. Çok miktarda triaçilgliserol ve düşük oranda (% 2 den az) protein ihtiva ettiklerinden dansiteleri çok düşüktür (< 0.940). Şilomikronlardaki triaçilgliserollerin periferal dokulardaki lipoprotein lipazlar tarafından birkaç dakika içinde hidrolizlenmesi sonucu geride kalan kolesterolce zengin şilomikron kalıntıları, karaciğer tarafından alınır. Yani diyetle alınan eksojen kolesterolün tamamına yakını, karaciğere taşınmış olur. VLDL; vücutta (büyük ölçüde karaciğerde) sentezlenmiş olan triaçilgliserolleri, adipoz dokuya ve iskelet kaslarına ulaştırır. VLDL den lipoprotein lipazla triaçilgliserollerin uzaklaştırılması sonucu geriye 166
174 kalan kısım, DL ye apo A II ve apo E vererek kolesterol esterlerince zengin olan düşük dansiteli lipoproteinlere (LDL) dönüştürülür. LDL nin görevi karaciğerden kolesterolü periferal dokulara taşımak ve buralarda yeniden kolesterol sentezini düzenlemektir. LDL kolesterolü arter duvarlarına taşıdığı için, yüksek plazma LDL veya apo B düzeyleri arteroskleroz için artmış riskin en iyi göstergesidir. Bu hücrelerde LDL; spesifik reseptörlere bağlanarak, endositozla hücre içine alınır ve lizozomlarda yıkılır. Bu reseptörlerden yoksun kişilerin kanında yüksek kolesterol görülür. Yüksek dansiteli lipoproteinlerin (DL) görevi ise, periferal dokulardan kolesterolü karaciğere taşımak ve diğer lipoproteinlerin fonksiyonlarını yönlendirmektir. erhangi bir andaki plazma lipid seviyeleri, lipid metabolizmasının ve diyet depo yağlarının kullanım dengesinin genel durumu hakkında bilgi verir. Tablo de normal bir yetişkin plazmasındaki başlıca lipidlerin açlık seviyeleri yaklaşık olarak sıralanmıştır. Tablo Plazma açlık lipid seviyeleri (mg/100 ml plazma) Toplam lipid Triaçilgliseroller Fosfolipidler Toplam kolesterol Esterleşmiş kolesterol Toplam kolesterolün % i YAĞ ASİTLERİNİN YIKIMI Yağ asitleri vücutta triaçilgliseroller halinde depo edildiklerinden, önce lipaz enzimleri tarafından hidrolizlenir. Yağ hücrelerindeki lipazlar, hormonal kontrol altındadır ve camp ile aktifleştirilen protein kinazların fosforillenmesi ile aktif hale geçer. R R 1 R 3 2 Lipazlar R 1 R 3 - R Lipazların hidrolizi ile oluşan gliserol, kan vasıtasıyla karaciğere gider ve metabolize olur (Bölüm 10. Glukoneogenez). Yağ asitleri ise kana verilir ancak kanda serbest halde değil de, albümin proteinlerine bağlanarak taşınır. 167
175 Franz Knoop (1904), yağ asidi oksidasyonu mekanizmasını aydınlatmada büyük katkıları olan bir seri deneyler yapmıştır. Köpeklere, ω karbon atomuna fenil takılmış düz zincirli yağ asitleri vermiştir. Knoop, fenil bütiratla beslenen köpeklerin idrarında, bir fenil asetik asit türevi; fenil propiyonatla beslenenlerin idrarında ise, bir benzoik asit türevi tespit etti. Gerçekten çift karbon sayılı yağ asitleri verildiği zaman fenil asetik asit; tek karbon sayılı yağ asitleri verildiği zaman da benzoik asit oluşmaktaydı. Knoop, bu buluşlarından sonra yağ asitlerinin β karbonu üzerinden oksitlenerek; iki karbonlu birimler halinde yıkıldığı sonucuna varmıştır (Şekil 11.2.). Tek karbon sayılı yağ asidi Çift karbon sayılı yağ asidi 2 2 Fenil propiyonat Fenil bütirat - Benzoat - 2 Fenil asetat - Şekil Knoop un yağ asitlerinin ikişer karbon birimi uzaklaştırılmasıyla yıkıldığını gösteren deneyi Yağ Asitlerinin Aktifleştirilmesi ve Mitokondri Matriksine Taşınmaları Albümine bağlı yağ asitleri, kas ve karaciğere gelerek hücre içine girer ve bu hücrelere enerji sağlamak amacıyla yakılır. Beyin ise yağ asidi albümin kompleksi, kan beyin engelini aşamadığı için; yağ asitlerini yakıt olarak kullanamaz. Yağ asitleri, mitokondri matriksinde yükseltgenir. Daha sonraki araştırmalar yağ asitlerinin, mitokondri matriksine girmeden önce aktifleştirildiklerini ortaya koymuştur. Aktifleştirilme işlemi, bir ATP nin AMP ye kadar hidrolizlenmesi sonucu, bir yağ asidinin karboksil grubuyla oa nın sülfhidril grubunun bir tiyoester bağı oluşturması sonucu gerçekleşir. Bu reaksiyon, mitokondri membranı üzerinde bulunan açil oa sentetaz enzimi tarafından katalizlenir. Reaksiyon iki basamakta oluşur ve yağ açil adenilat ara ürünü içerir (Şekil 11.3.). Önce yağ asidi, bir açil adenilat oluşturmak üzere ATP ile reaksiyona girer. ATP nin diğer iki fosforil grubu, pirofosfat (PPi) olarak ayrılır. Daha sonra oa nın 168
176 sülfhidril grubu, enzime sıkıca bağlanmış olan açil adenilatla reaksiyona girerek; açil oa ve AMP yi meydana getirir. R R + ATP R - AMP Yag - asidi Açil adenilat Açil adenilat AMP + S oa R S oa Yag - açil oa + PP i + AMP Şekil Yağ asidinin yağ açili oa ya dönüşümü. Dönüşüm yağ açili oa sentetaz ve inorganik pirofosfataz ile katalizlenir. Yağ açili oa türevleri yoluyla yağ asidi aktifleşmesi, iki basamakta olur. Birincisinde, karboksil iyonu ATP nin iki dış fosfatıyla (β ve γ) yer değiştirerek; yağ açili adenilatı oluşturur. Diğer ürün olan PP i, anında 2 P i ye hidrolizlenerek; tepkimenin devamını sağlayan bir gruptur. oa nın tiyol grubu, enzime bağlı açil adenilata atak yapar; AMP ayrılır ve tiyoester yağ açili oa oluşur. Toplu tepkime yüksek oranda ekzergoniktir. Bu reaksiyonlar dönüşümlüdür fakat birinci basamakta oluşan pirofosfatın (PPi) hidrolizi, bu reaksiyonu büyük ölçüde ürünler lehine çevirerek dönüşümsüz yapar. Toplu reaksiyon aşağıdaki gibidir: 169
177 Yağ asidi + S-oA + ATP Yağ açil oa + AMP + 2Pi G o = 34 kj/mol Açil oa ların önünde iki yol vardır; ya mitokondriye geçerek yıkılır ya da triaçilgliserol sentezinde kullanılır. Yağ asitleri, dış mitokondri membranı üzerinde aktifleştirilirken; mitokondri matriksinde oksitlenir. Uzun zincirli yağ açil oa molekülleri, iç mitokondri membranından geçemezler ve matrikse karnitin adı verilen polar bir bileşiğe bağlanarak açil karnitin şeklinde taşınırlar. Önce açil grubu, oa nın kükürt atomundan karnitinin hidroksil grubuna aktarılır ve böylece açil karnitin oluşur. Bu reaksiyon, iç mitokondri membranının sitozol tarafına lokalize olmuş karnitin açiltransferaz I tarafından katalizlenir. 2 3 R S oa + 3 N 2 3 Açil oa Karnitin 3-3 N R Açil karnitin + oa S - Daha sonra açil karnitin, iç mitokondri membranından translokaz taşıyıcı proteini aracılığıyla matrikse aktarılır. Açil grubu, membranın matriks tarafında tekrar oa ya transfer olur. Karnitin açiltransferaz II tarafından katalizlenen bu reaksiyon, termodinamik yönden mümkündür. Çünkü karnitindeki açil bağı yüksek bir grup transfer potansiyeline sahiptir. Son olarak karnitin, translokaz tarafından sitozol tarafına geri döner (Şekil 11.4.). Bu sistem sayesinde, mitokondri ve sitoplazma oa havuzları birbirine karışmamış olur. Şekil Bir translokaz enzimiyle, açil karnitinin mitokondrial matrikse girişi ve karnitinin iç mitokondri membranının sitozol tarafına geri dönüşü. 170
178 Kısa ve orta zincirli (4 12 karbonlu) yağ asitleri, sitoplazmada aktifleşmeden ve karnitine bağlanmadan matrikse geçebilirler. Matrikste aktifleşerek β oksidasyonla yıkılırlar Doymuş Yağ Asitlerinin β ksidasyonu Mitokondri matriksine taşınan doymuş açil oa, dört reaksiyonun tekrarlanmasıyla yıkılmaktadır: 1) FAD ye bağlı bir oksidasyon, 2) hidrasyon, 3) NAD + ya bağlı ikinci bir oksidasyon ve 4) oa tarafından tiyoliz. Yağ açil zincirleri, bu reaksiyonların sonucu iki karbon kısalır ve FAD2, NAD ile asetil oa oluşur (Şekil 11.5.). Bu reaksiyon serisine, yağ asitlerinin β oksidasyonu yolu adı verilir. Şimdi bu reaksiyonları ayrıntılı olarak inceleyelim: 171
179 Şekil β-oksidasyon yolu. a) Dört basamaklı dizinin her devrinde, bir asetil kalıntısı (koyu ile gösterilmiştir) yağ açil zincirinin karboksil ucundan asetil oa oluşturularak ayrılır. Örnekte palmitoil oa olarak reaksiyona giren palmitat ( 16) verilmiştir. b) Devrin altı kez daha tekrarıyla,sonuçta sekiz molekül asetil oa oluşmuştur. Yıkımın her devrinde ilk reaksiyon, açil oa nın bir açil oa dehidrogenaz enzimi tarafından bir enoil oa vermek üzere katalizlenen reaksiyondur. 2 ile 3 arasındaki çift bağ transdır. Açil oa + E FAD trans Δ 2 enoil oa + E FAD2 Açil oa nın dehidrogenasyonu, TA çevriminde süksinatın dehidrogenasyonuna çok benzemektedir. Gerçekten β oksidasyonunun ilk üç reaksiyonu, sitrik asit çevrinin son basamaklarına benzemektedir. Açil oa Enoil oa idroksiaçil oa Ketoaçil oa Süksinat Fumarat Malat kzalasetat 172
180 Daha sonraki reaksiyon, 2 ve 3 arasındaki çift bağın, enoil oa hidrataz enzimi katalizörlüğünde hidrasyonudur: trans- 2 -Enoil oa + 2 L-3-idroksiaçil oa Enoil oa nın hidrasyonu, sitrik asit çevrimindeki fumaratın hidrasyonuna benzemektedir. Bu enzim tarafından trans Δ 2 çift bağı hidrasyonu ile, L 3 hidroksiaçil oa meydana gelir. Üçüncü reaksiyon ise, 3 (β) hidroksil grubunun, bir NAD açığa çıkarılmasıyla keto haline oksidasyonudur. Bu yükseltgenme reaksiyonu, hidroksiaçil substratın L izomerine mutlak anlamda spesifik olan L 3 hidroksiaçil oa dehidrogenaz enzimi tarafından katalizlenir. L-3-idroksiaçil oa + NAD + 3-Ketoaçil oa + NAD + + Son basamak, 3 ketoaçil oa nın ikinci bir oa molekülü tiyol grubu tarafından parçalanmasıdır. Bu tiyolitik parçalanma reaksiyonu, β ketotiyolaz enzimi tarafından katalizlenir ve ürün olarak bir molekül asetil oa ve iki karbon kısaltılmış açil oa meydana gelir. Böylece bir devir tamamlanmış olur. Kısaltılmış açil oa, tekrar açil oa dehidrogenaz tarafından katalizlenen reaksiyondan başlayarak bir başka oksidasyon devrine girer. Buradaki β ketotiyolaz, hidroksil açil oa dehidrogenaz ve enoil oa hidrataz enzimleri hemen hemen her uzunluktaki açil zincirleri için spesifiktir. Şimdi bir yağ asidinin oksidasyonu sonucu enerji (ATP) verimini hesaplayabiliriz. er bir reaksiyon devrinde, yani iki karbon biriminin yağ asidinden asetil oa olarak koparılmasıyla bir FAD2 ile bir NAD oluşur. n -Açil oa + FAD + NAD oa n-2 -Açil oa + FAD 2 + NAD Asetil oa Yağ asitlerinin β oksidasyonu sonucu oluşan asetil oa lar, sitrik asit çevrimi ve onu takip eden solunum zincirinde tamamen 2 ve 2 ya yükseltgenir. 16 karbonlu doymuş bir yağ asidi olan palmitik asidin yıkımı, 7 reaksiyon devriyle gerçekleşir. Buradan palmitoil oa nın oksidasyon reaksiyonunun stokiyometrik denklemini şu şekilde yazabiliriz: Palmitoil oa + 7FAD + 7NAD oA 8Asetil oa + 7FAD 2 + 7NAD Bir NAD molekülünün oksidatif fosforilasyonla 3 ATP, bir FAD2 nin de 2 ATP oluşumuna sebep olduğu göz önüne alınır ve asetil oa nın sitrik asit çevrimi ve oksidatif fosforilasyonla 12 ATP verdiği hatırlanırsa; bir palmitoil oa nın tam oksidasyonu ile (7x3) 173
181 + (7x2) + (8x12) = 131 ATP sentezlendiği görülür. Palmitatın aktifleştirilmesi esnasında, ATP nin AMP ye ve 2Pi ye parçalanmasıyla iki yüksek enerjili fosfat bağı harcanmaktadır. Böylece bir palmitat molekülünün tam oksidasyonu ile net olarak 129 ATP oluşmaktadır Doymamış Yağ Asitlerinin β ksidasyonu Doymamış yağ asitlerinin oksidasyonu reaksiyonlarının birçoğu, doymuş yağ asitlerininki ile aynıdır. Farklı olarak bir izomeraz ve memelilerde 2,4 dienoil oa redüktaz rol almaktadır. emen hemen bütün biyolojik kaynaklı doymamış yağ asitleri, sadece cis çift bağı içerirler. Bu çift bağlar, 9 ve 10 arasından itibaren başlar. Diğer çift bağlar, konjugasyon göstermezler. Doymamış yağ asitlerine örnek olarak; oleatın ve linoleatın β oksidasyonunu açıklayalım leat cis- 9 -ktadekenoik asit Linoleat cis- 9,12 -ktadekadienoik asit leat; 18 karbonlu ve 9 ile 10 arasında doymamış cis çift bağı içeren bol bulunan tekli doymamış bir yağ asididir. leat, aynen doymuş yağ asitleri gibi aktifleştirilerek oleil oa ya çevrilir ve mitokondri membranından oleil karnitin olarak taşınarak; matrikste yeniden oleil oa ya çevrilir. Daha sonra oleil oa, üç tur β oksidasyonuna girerek üç mol asetil oa ve cis Δ 3 dodekenoil oa ya dönüşür (Şekil 11.6.). Bu ürün, sadece trans-çift bağlarını etkiyen enoil oa hidratazın substratı değildir. Yardımcı enzim enoil oa izomeraz; cis Δ 3 enoil oa nın, trans Δ 2 enoil oa ya izomerleşmesini katalizler. Böylece oluşan bileşik, enoil oa hidratazın normal susbtratı olduğundan β oksidasyonunu beş tur daha geçirerek; altı molekül asetil oa ya dönüşür. Sonuçta 18 karbonlu oleat molekülünden 9 molekül asetil oa üretilir. Ancak bu sırada, β oksidasyonun dördüncü turunda FAD bağımlı ilk basamağı atlandığı (hidrasyon basamağından devam edileceği) için FAD2 oluşmaz. 174
182 Şekil Tekli doymamış yağ asitlerinin oksidasyonu. Burada oleat, oleil oa (Δ 9 ) olarak örnek verilmiştir. Enoil oa izomeraz, çift bağa yer değiştirterek; cis izomerini β-oskidasyonun normal bir ara bileşiği olan trans izomerine çevirir. leil oa nın yıkımı sekiz reaksiyon turunda gerçekleşir. leil oa + 7FAD + 8NAD + + 8oA Asetil oa + 7FAD2 + 8NAD Bir mol oleil oa nın tam oksidasyonu ile (9x12) + (7x2) + (8x3) = 146 ATP sentezlenir. leatın aktifleştirilmesinde, iki yüksek enerjili fosfat bağı (2ATP) harcanmaktadır. Böylece bir mol oleatın tam oksidasyonu ile, net 144 ATP oluşmaktadır. Linoleik asidin çift bağlarının birisi tek numaralı karbon atomunda ve diğeri de çift numaralı karbon atomundadır. Yağ asitlerinin bu pozisyonlardaki çift bağlarının varlığı, β oksidasyon yolu için iki ilave enzimin fonksiyon görmesini gerektirir. Diğer yardımcı enzim (redüktaz), çoklu doymamış yağ asitlerinin β oksidasyonunda gereklidir. Örneğin 18 karbonlu linoleat, cis Δ 9, cis Δ 12 konfigürasyonuna sahiptir (Şekil 11.7.). Linoleil oa, β oksidasyonu basamaklarından üç tur geçerek; üç molekül asetil oa ve 12 karbonlu doymamış cis Δ 3, cis Δ 6 ara bileşiğini oluşturur. Linoleil oa nın üç tur β oksidasyonundan sonra ilk enzimatik zorluk ortaya çıkar. Enoil oa nın, cis Δ 3 çift bağı, enoil oa hidrataz enziminin substratı değildir. Bu zorluk, farklı bir enzim olan enoil oa izomeraz ın cis Δ 3 çift bağını daha sağlam trans Δ 2 formuna dönüştürmesiyle aşılır. 175
183 luşan bu bileşik, enoil oa hidratazın normal substratı olduğundan, β oksidasyon bu safhadan itibaren bir tur daha devam eder. Ancak bu sırada, β oksidasyonun FAD bağımlı ilk reaksiyonu atlanır ve dolayısıyla bu basamakta FAD2 oluşmaz. Şekil Çoklu doymamış yağ asitlerinin oksidasyonu. Burada linoleat, linoleil oa (Δ 9,12 ) olarak örnek verilmiştir. ksidasyon, enoil oa izomeraza ek olarak ikinci bir yardımcı enzimi gerektirir: NADP bağımlı 2,4 dienoil oa redüktaz. Bu iki enzimin birlikte etkisiyle trans Δ 2, cis Δ 4 dienoil oa ara bileşiği; β oksidasyonda gerekli trans Δ 2 enoil oa substratına dönüşür. Linoleik asidin β oksidasyonunun diğer zorluğu, 5. oksidasyon turunda ortaya çıkar. Çift numaralı bir karbon atomunda bir çift bağın varlığı, enoil oa hidratazın zayıf bir substratı olan 2,4 dienoil oa nın oluşumuna yol açar. Bu zorluk, ikinci farklı enzim olan NADP bağımlı 2,4 dienoil oa redüktazın 2,4 dienoil oa nın, cis Δ 4 çift bağını indirgemesiyle aşılır. Memelilerde bulunan bir redüktaz enzimi, trans Δ 3 enoil oa oluşumunu katalizler; bu bileşik de β oksidasyonunun devamı için yukarıda gördüğümüz 176
184 enoil oa izomeraz aracılığıyla trans Δ 2 enoil oa ya dönüşür. Bu enzimler sayesinde, linoleik asidin 12 ile 13 numaralı karbonları arasındaki çift bağdan dolayı FAD2 sentezinde eksiklik olmaz. Yani ATP kaybı yoktur. E.coli 2,4 dienoil oa redüktazı, β oksidasyonunun normal bir substratı olan trans Δ 2 enoil oa oluşturur. Linoleil oa nın β oksidasyonunun net denklemi: Linoleil oa + 7FAD + 8NAD oA 9Asetil oa + 7FAD 2 + 8NAD :2 cis- 9,12 Buna göre linoleatın (18:2 cis Δ 9,12 ) 2 ve 2 ya kadar tamamen oksidasyonunun ATP bilançosunu çıkarırsak; 1 linoleat başına 9 asetil oa, 8 NAD ve 7 FAD2 oluşur. Asetil oa ların sitrik asit çevrimine girmesi sonucu oksidatif fosforilasyonla 12 ATP oluştuğu hatırlanırsa; (9x12) + (7x2) + (8x3) = 146 ATP sentezlenir. Linoleatın aktifleşmesi esnasında ATP nin AMP ye hidroliziyle iki yüksek enerjili fosfat bağı harcandığından; linoleatın tam oksidasyonundan 144 ATP oluşmaktadır Tek Karbon Sayılı Yağ Asitlerinin ksidasyonu Doğal olarak oluşmuş birçok lipid, çift sayıda karbon atomuna sahip yağ asidi içermesine karşın, bazı bitki ve deniz organizmalarının lipidleri tek karbon sayılı yağ asidi içermektedir. Uzun zincirli tek karbon sayılı yağ asitleri, çift karbon sayılı asitler gibi; zincir ucundaki karboksil grubundan başlayarak aynı yolla oksitlenir. Bununla birlikte yıkımın son turunda asetil oa yerine propiyonil oa meydana gelmektedir. Propiyonil oa, kofaktör olarak biyotin içeren propiyonil karboksilazla metil malonil oa nın D izomerine karboksillenir (Şekil 11.8.). D metilmalonil oa, metilmalonil oa epimerazla L izomerine epimerleştirilir. Daha sonra L metilmalonil oa, koenzim B12 yi kullanan metilmalonil oa mutazla süksinil oa ya çevrilir ve sitrik asit çevrimine girer. Propiyonil oa, bazı aminoasitlerin de yıkım ürünüdür. Geviş getiren hayvanların sindirim sisteminde (lümeninde) bakteriler bol miktarda propiyonik asit oluşturmakta ve bu da karaciğere giderek propiyonil oa üzerinden metabolize olmaktadır. 177
185 Şekil Tek karbon sayılı yağ asitlerinin β oksidasyonuyla üretilen propiyonil oa nın oksitlenmesi Karaciğerde luşan Keton isimleri Diğer rganlara Taşınır Yağ asitleri oksidasyonunda oluşan asetil oa lar, eğer yağ ve karbohidrat yıkımları dengeli ise; sitrik asit çevrimine girerler. Asetil oa nın TA ya girişi, sitrat oluşumu için ortamda okzalasetatın varlığına bağlıdır. Eğer yağ yıkımı fazla ise, asetil oa farklı bir yola gider. Açlık ve şeker hastalığı durumunda okzalasetat, glukoneogenez yolunda kullanılacağından asetil oa ile birleşebilecek seviyenin altına düşer. Bu şartlar altında asetil oa, asetoasetat ve D 3 hidroksibütirata dönüştürülür. İşte bu mekanizma ile oluşan aseton, asetoasetat ve D 3 hidroksibütirat, keton cisimleri adını alır. Asetoasetat karaciğerde asetil oa dan üç basamakta oluşur (Şekil 11.9.). Önce iki asetil oa β ketotiyolaz (tiyolaz) (1) enzimi katalizörlüğünde birleşerek; asetoasetil oa oluşturur. Bu reaksiyon yağ asitleri oksidasyonunun tiyolitik parçalanma basamağının (son basamak) dönüşümünden ibarettir. Daha sonra asetoasetil oa, asetil oa ile hidroksimetilglutaril oa (MGoA) sentetaz (2) enzimi katalizörlüğünde, 3 hidroksi 3 metilglutaril oa yı meydana getirir. Bu da daha sonra hidroksimetilglutaril oa 178
186 parçalayıcı enzim (MGoA liyaz) (3) vasıtasıyla asetil oa ve asetoasetata ayrılır. D-3 hidrokibütirat, D 3 hidroksibütirat dehidrogenaz (4) katalizörlüğünde asetoasetatın mitokondri matriksinde indirgenmesi sonucu oluşur. Asetoasetat, kendiliğinden veya asetoasetat dekarboksilaz enzimiyle kolayca dekarboksilasyonla asetona çevrilir (Şekil 11.9.). Bu yüzden tedavi edilmeyen diyabetli bireylerin kanlarında, önemli miktarda toksik bir bileşik olan aseton bulunur. Kanında asetoasetat seviyesi yüksek olan bireylerin nefesleri aseton kokar. Şekil Asetil oa dan keton cisimlerinin oluşumu. İyi beslenen bireylerde keton cismi üretim hızı düşüktür. Asetil oa biriktiğinde, tiyolaz iki mol asetil oa nın asetoasetil oa ya kondenzasyonunu katalizler. luşan ana bileşikler, üç tane keton cismidir. Keton cisimlerinin oluşum reaksiyonları, karaciğer mitokondrilerinin matriksinde yürütülür. Asetoasetat ve D 3 hidroksibütiratın üretildiği başlıca organ karaciğerdir (matrikste). Daha sonra karaciğer mitokondrilerinin matriksinden difüze olarak periferal dokulara kan 179
187 dolaşımıyla taşınırlar. Asetoasetat ve D 3 hidroksibütirat bazı dokuların normal yakıt maddeleri şeklinde enerji kaynağı olarak önemli miktarda kullanılmaktadır. Gerçekten kalp kası ve böbrek korteksi hücreleri, asetoasetatı yakıt olarak glukoza tercih eder. Beyin dokusu ise, başlıca yakıt kaynağı olarak dengeli beslenme durumunda glukoz kullanır. Bununla birlikte açlık ve şeker hastalığında asetoasetattan faydalanacak şekle adapte olur. Uzun açlık döneminde beynin yakıt ihtiyacının % 75 i asetoasetat tarafından sağlanır. Kanda D 3 hidroksibütirat olarak taşınan ve girdiği periferal doku hücrelerinde tekrar asetoasetata yükseltgenen keton cisimleri; spesifik bir oa transferaz enzimi tarafından katalizlenen bir reaksiyonla, süksinil oa dan oa transferi sonucu aktifleştirilir. Asetoasetil oa daha sonra iki molekül asetil oa vermek üzere parçalanır. Süksinil oa Süksinat oa Asetoasetat Asetoasetil oa 2Asetil oa oa transferaz Asetil oa lar daha sonra enerji (ATP) oluşturmak üzere sitrik asit çevrimine girerler. Karaciğerde spesifik oa transferaz enzimi bulunmadığı ve eritrositlerde de mitokondri olmadığı için keton cisimlerini yakıt olarak kullanamazlar. Asetoasetat, asetil oa nın suda çözünebilir ve taşınabilir bir şekli olarak değerlendirilebilir. Yağ asitleri adipoz doku tarafından salıverilir, karaciğer tarafından asetoasetata çevrilerek diğer dokulara gönderilir. Asetoasetatın düzenleyici bir rolü de vardır. Kandaki yüksek asetoasetat seviyesi, asetil birimlerinin bolluğuna işarettir ve adipoz dokuda lipolizin azalmasına yol açar LİPİD BİYSENTEZİ Lipidlerin çeşitli hücresel rolleri vardır. Lipidler hücre membranlarının başlıca bileşenleri oldukları gibi birçok organizmada depolanmış enerjinin temel şeklidir. Özelleşmiş lipidler; pigmentler (retinol, karoten), kofaktörler (vitamin K), deterjanlar (safra tuzları), hormonlar (vitamin D türevleri, cinsiyet hormonları), hücre içi ve hücre dışı mesaj ileticileri (eikosanoitler) ve membran proteinleri için tutunma yerleri (fosfatidil inositol) olarak hizmet etmektedir. Değişik lipidleri sentezleme yeteneği tüm canlılar için gereklidir. Bu bölümde, birçok hücrede bulunan başlıca lipidlerden bazıları için biyosentetik yollar açıklanacaktır. Bu reaksiyonlar dizisi, diğer biyosentetik yollar gibi endergonik ve indirgeyicidir. Metabolik enerji kaynağı olarak ATP ve indirgeyici olarak elektron taşıyıcı NADP kullanılır. 180
188 Önce triaçilgliserol ve fosfolipidlerin temel bileşenleri olan yağ asitlerinin biyosentezini sonra da yağ asitlerinden triaçilgliserollerin biyosentezini açıklayacağız Yağ Asitlerinin Biyosentezi Yağ asidi oksidasyonunun iki karbonlu (asetil oa) birimlerin ardı ardına oksidatif uzaklaştırılması yoluyla olduğu bulunduğu zaman, biyokimyacılar yağ asitleri biyosentezinin, oksidasyonlarındaki aynı enzimatik reaksiyonların basitçe tersine dönmesiyle oluştuğunu düşündüler. Bununla birlikte, yağ asidi sentez ve yıkımı farklı yollarda farklı enzimler tarafından katalizlenmekte ve hücrenin farklı bölmelerinde oluşmaktadır. Yağ asitlerinin oksidatif yıkımı mitokondri matriksinde olurken, biyosentezi sitozolde gerçekleşir. Bundan başka, üç karbonlu bir ara ürün olan malonil oa, yalnızca yağ asitlerinin biyosentezinde yer alır. Önce yağ asitlerinin biyosentez yolunu ele alacağız, sonra uzun zincirli yağ asitlerinin, doymamış yağ asitlerinin ve bunların türevlerinin biyosentezini inceleyeceğiz Malonil oa, Asetil oa ve Bikarbonattan luşur Yağ asitlerinin sentezi malonil oa ile başlamaktadır. Yağ asidi sentezinde zincir uzaması malonil oa dan iki karbonun zincire katılması ile olmaktadır. Malonil oa nın asetil oa dan tek yönlü oluşumu asetil oa karboksilazla katalizlenir. Bakteri asetil oa karboksilazı üç farklı polipeptid alt birimine sahiptir (Şekil ). ayvan hücrelerinde üç aktivitenin tümü de çok işlevli tek bir polipeptidin parçasıdır. Şekil Asetil oa karboksilaz reaksiyonu. Asetil oa karboksilaz üç işlevsel bölgeye sahiptir. Biyotin taşıyıcı protein; 2 i ATP bağımlı bir reaksiyonla biyotin halkasındaki azota 181
189 bağlayarak aktifleştiren biyotin; karboksilaz ve biyotinden asetil oa ya aktif 2 taşıyarak malonil oa oluşturan transkarboksilaz. Bikarbonattan (3 - ) gelen karboksil grubu ATP bağımlı bir reaksiyonla önce biyotine taşınır. Biyotinli grup, geçici bir 2 taşıyıcısı olarak hizmet eder ve karbondioksiti ikinci adımda, malonil oa oluşturmak üzere asetil oa ya aktarır. - Biyotin-enzim + ATP Biyotin-enzim + Asetil oa 2 Biyotin-enzim + ADP + P i Malonil oa + Biyotin-enzim Yağ Asitleri Tekrarlayan Reaksiyon Dizileri Şeklinde Sentezlenir Yağ asitlerinin uzun karbon zincirleri tekrarlayan dört basamaklı dizide oluşturulmaktadır (Şekil ). Bu reaksiyon dizisi tarafından oluşturulan doymuş açil grupları, aktifleştirilmiş sonraki malonil grubuyla birleşecek substrattır. Çevrimin her bir turunda yağ asidi zinciri iki karbon uzatılır. Ürün (palmitat, 16:0) zincir uzunluğu 16 karbona ulaştığı zaman çevrimi terk eder. Asetil grubunun metil ve karboksil karbon atomları palmitatın sırasıyla 16 ve 15 i olur, diğer karbon atomları malonil oa yoluyla asetil oa dan gelir. Yağ asitleri biyosentezinde indirgeyici güç NADP dır ve aktifleştiren gruplar aşağıda tanımlanan enzim kompleksine bağlı iki farklı S grubudur. Sentez işlemlerindeki reaksiyonların tümü çoklu enzim kompleksi olan yağ asidi sentazla katalizlenir. Ökaryotlarda ve E.coli gibi prokaryotlarda enzim yapısının ayrıntısının farklı olmasına karşın, yağ asidi sentezinin dört adımlı işlemi tüm organizmalarda aynıdır. Önce E.coli deki işlemleri tanımlayacak, sonra da diğer organizmalardaki enzim yapısındaki farklılıkları anlatacağız Yağ Asidi Sentaz Kompleksi Yedi Farklı Aktif Bölgeye Sahiptir E.coli yağ asidi sentazının çekirdeği yedi farklı polipeptitten oluşur ve işlemlerin bazı bölümlerinde en az üç başka protein görev yapmaktadır (Tablo 11.3.). Proteinler birlikte çalışarak asetil oa ve malonil oa dan yağ asitlerinin oluşumunu katalizler. Yağ asidi sentaz sistemi, fonksiyonel iki tiyol ( S) grubu içermektedir. İşlem boyunca ara ürünler kompleksin iki tiyol grubundan birine kovalent olarak bağlı kalır. Bağlanmanın birinci noktası yedi proteinden birindeki sisteinin S grubu; diğeri ise yağ asidi sentezi açil ara ürünüyle bir tiyoester oluşturan açil taşıyıcı proteinin S grubudur. 182
190 Tablo E.coli Yağ Asidi Sentaz Kompleksinin Proteinleri Protein Rolü 1- Açil taşıyıcı protein (AP) Tiyoester bağlı açil gruplarını taşır 2- Asetil oa AP transasetilaz (AT) Açil grubunu oa dan KS nin ys aminoasidine taşır. 3-3 Ketoaçil AP sentaz (KS) Açil ve malonil gruplarını birleştirir (KS nin en az 3 izozimi vardır.) 4- Malonil oa AP transferaz (MT) Malonil grubunu oa dan AP ye taşır. 5-3 Ketoaçil AP redüktaz (KR) 3 keto grubunu 3 hidroksi grubuna indirger 6-3 idroksiaçil AP dehidrataz (D) 3 hidroksiaçil AP den 2 uzaklaştırarak, çift bağ oluşturur. 7- Enoil AP redüktaz (ER) Doymuş açil AP oluşturmak üzere çift bağı indirger. Şekil Uzayan yağ açili zincirinin iki karbonla dört basamaklı uzatılma işlemi. er bir malonil ve asetil grubu yağ asidi sentaza bağlı bir tiyoester tarafından aktifleştirilir. 1) Birinci basamak aktif açil grubunun (birinci açil grubu bir asetil grubudur) 2 kaybeden malonil oa dan gelen iki karbonla birleşmesidir; net etki açil zincirinin iki karbon uzamasıdır. Bu birleşmenin β keto ürünü, hemen hemen β oksidasyon reaksiyonlarına benzeyen fakat ters sırada olan üç basamakta indirgenir, 2) β keto grubu bir alkole indirgenir, 3) 2 nun uzaklaştırılması bir çift bağ oluşturur ve 4) Çift bağ ilgili doymuş yağ açili grubunu oluşturmak üzere indirgenir. E.coli nin açil taşıyıcı proteini (AP) 4' fosfopantetein prostetik grubu taşıyan küçük bir proteindir (Mr 8860) (Şekil ),oA nın pantotenik asit ve β merkaptoetilamin kısımlarıyla karşılaştırınız. 183
191 Şekil Açil taşıyıcı protein (AP). 4' fosfopantetein prostetik grubu AP de bir Ser aminoasidinin hidroksil grubuna kovalent olarak tutunmuştur. Fosfopantetein oa molekülünde de bulunan B vitamini pantotenatı içerir. Bunun S grubu yağ asidi sentezi sırasında malonil gruplarının giriş yeridir Yağ Asidi Sentaz Asetil ve Malonil Gruplarını Alır Yağ asidi zincirini oluşturmaya başlayan birleştirme reaksiyonlarından önce, enzim kompleksi üzerindeki iki tiyol grubu doğru açil gruplarıyla yüklenmelidir (Şekil ün üst tarafı). Önce asetil oa nın asetil grubu 3 ketoaçil AP sentazın sistein S grubuna taşınır. Bu reaksiyon asetil oa AP transferazla katalizlenir. İkinci reaksiyon malonil oa dan malonil grubunun, kompleksin bir parçası olan malonil oa AP transferazla katalizlenen işlemle AP nin S grubuna taşınmasıdır. Yüklenmiş sentaz kompleksi de asetil ve malonil grupları birbirine çok yakındır ve daha önce dört basamaktan oluştuğu açıklanan zincir uzatılma işlemleri için aktifleştirilmiştir Şekil te gösterilen bu basamaklar şimdi daha ayrıntılı olarak incelenecektir. Basamak 1. Birleştirme (Kondenzasyon): Yağ asidi zincirinin oluşmasında birinci adım aktif asetil ve malonil gruplarının asetoasetil AP oluşturmak üzere birleşmesidir. Asetoasetil grubu fosfopantetein S grubu aracılığıyla AP ye bağlanırken, eş zamanlı olarak bir molekül 2 oluşur (Şekil ). 3 ketoaçil AP sentaz tarafından katalizlenen bu reaksiyonda bu enzimin sistein S grubundan bir asetil grubu, yeni asetoasetil grubunun metille sonlanan iki karbon birimini oluşturmak üzere AP nin S ındaki malonil grubuna taşınır. Bu reaksiyonda oluşan 2 deki karbon atomu, asetil oa karboksilaz reaksiyonuyla başlangıçta 3 - tan malonil oa ya sokulmuş olan aynı karbon atomudur. Böylece 2, yağ asidi biyosentezi sırasında geçici olarak kovalent şekilde bağlı olup; her iki karbon biriminin eklenmesiyle uzaklaştırılmaktadır. Basamak 2. Karbonil Grubunun İndirgenmesi:Kondenzasyonda oluşan asetoasetil AP, D 3 hidroksibutiril AP oluşturmak üzere 3 teki karbonil grubu indirgenir. Bu reaksiyon, 3 ketoaçil AP redüktazla katalizlenir ve elektron vericisi NADP tır. 184
192 Basamak 3. Dehidrasyon: Üçüncü basamakta su, D 3 hidroksibutiril AP nin 2 ve 3 ünden trans Δ 2 butenoil AP ürününde çift bağ oluşturmak üzere uzaklaştırılır. Bu dehidrasyonu 3 hidroksiaçil AP dehidrataz enzimi katalizler. Basamak 4. Çift Bağın İndirgenmesi: Son olarak trans Δ 2 butenoil AP nin çift bağı, butiril AP oluşturmak üzere enoil AP redüktazla indirgenir (doyurulur); elektron vericisi NADP tır. Şekil Yağ asidi sentezi sırasındaki olaylar dizisi. Yağ asidi sentaz kompleksi şematik olarak gösterilmiştir. Diskin her dilimi kompleksin altı enzimatik aktivitesinden birini temsil etmektedir. Merkezde bir diğer S la sonlanan fosfopantetein kolu olan açil taşıyıcı protein (AP) bulunmaktadır. 185
193 Yağ Asidi Sentaz Reaksiyonları Palmitat luşturmak Üzere Tekrarlanır Dört karbonlu doymuş yağ açili AP (butiril AP) nin oluşumuyla yağ asidi sentaz kompleksinde bir tur tamamlanır. Şimdi butiril grubu AP nin fosfopantetein S grubundan, 3 ketoaçil AP sentazın (KS) (başlangıçta asetil grubu taşıyan) sistein S grubuna taşınır (Şekil ün son kısmı). Zinciri iki karbon daha uzatacak dört reaksiyonlu bir sonraki çevrimi başlatmak için bir başka malonil grubu, AP nin boş olan fosfopantetein S grubuna bağlanır (Şekil ). Kondenzasyon birinci çevrimdeki asetil grubu gibi davranan butiril grubunun 2 kaybıyla malonil AP grubunun iki karbonuna bağlanmasıyla oluşur. Bu kondenzasyonun ürünü, fosfopanteteinin S grubuna kovalent olarak bağlı altı karbonlu bir açil grubudur. Bunun 3 keto grubu, sentaz çevriminin sonraki üç adımında altı karbonlu doymuş açil grubunu oluşturmak üzere tam olarak reaksiyonların birinci turundaki gibi indirgenir. Kondenzasyon ve indirgenmenin yedi turu, hala AP ye bağlı olan 16 karbonlu doymuş palmitoil grubunu oluşturur. İyi anlaşılamamış olan nedenlerle, zincir uzatılması genellikle bu noktada durur ve serbest palmitat, sentaz kompleksinin hidrolitik aktivitesi tarafından AP molekülünden uzaklaştırılır. Küçük miktarlarda stearat (18:0) gibi daha uzun yağ asitleri de oluşturulur. Bazı bitkilerde (hindistan cevizi ve palmiye) zincir sonlanması daha erken olmaktadır. Bu bitkilerin yağlarındaki yağ asitlerinin % 90 kadarı 8 14 karbon uzunluğundadır. Asetil oa dan palmitat sentezi için toplam reaksiyon iki kısımda düşünülebilir. Birincisi yedi malonil oa oluşumudur: 7Asetil oa ATP 7Malonil oa + 7ADP + 7Pi sonra yedi kondenzasyon ve indirgenme çevrimi: Asetil oa+7malonil oa+14nadp+14 + Palmitat+7 2+8oA+14NADP Tüm işlemler (İki eşitliğin toplamı): 8Asetil oa+7atp+14nadp+14 + Palmitat+8oA+62+7ADP+7Pi + 14NADP + Bir palmitat molekülünün sentezlenmesi için 8 molekül asetil oa, 14NADP ve 7ATP gereklidir. Böylece palmitat gibi yağ asitlerinin biyosentezi, ATP nin grup transfer potansiyeli ve NADP ın indirgeyici gücü olarak iki formda kimyasal enerji girdisini ve asetil oa yı gerektirir. ATP, asetil oa yı 2 bağlayarak malonil oa sentezi için gereklidir. NADP ise çift bağları indirgemek için gereklidir. Asetil oa ve NADP ın kaynaklarına çok geçmeden döneceğiz. 186
194 Şekil Yağ asidi sentezi çevriminin ikinci turunun başlangıcı. Butiril grubu sistein S grubu üzerindedir. Gelen malonil grubu önce fosfopantetein S grubuna tutunur. Sonra kondenzasyon basamağında sistein S daki butiril grubu bütünüyle malonilin, 2 olarak kaybedilen karboksil grubuyla yer değiştirir. Bu basamak Şekil teki basamak 1 in analoğudur. Ürün, yani altı karbonlu 3 ketoaçil grubu şimdi reaksiyonu başlatan asetil oa dan iki ve malonil oa dan dört karbon taşımaktadır. Sonra 3 ketoaçil grubu Şekil teki gibi basamakları 2 den 4 e doğru geçer. 187
195 Yağ Asidi Sentezi Birçok rganizmanın Sitozolünde Fakat Bitkilerin Kloroplastlarında luşur Yüksek ökaryotlarda yağ asidi sentaz kompleksi nükleotitler, aminoasitler ve glukoz biyosentetik enzimlerin de olduğu gibi, büyük oranda sitozolde bulunur (Şekil ). Bu yerleşim sentetik işlemleri, birçoğu mitokondri matriksinde yer alan yıkım reaksiyonlarından ayırır. Anabolizma için elektron taşıyan kofaktörlerin ve katabolizma için olanların birbiriyle uyumlu bir dağılımı vardır. Genellikle NADP anabolik reaksiyonlar için elektron taşıyıcısıdır ve NAD + katabolik reaksiyonlarda yer alır. epatositlerde [NADP]/[NADP + ] oranı yağ asidi ve diğer biyomoleküllerin biyosentezleri için kuvvetli indirgeyici bir ortam hazırlamak üzere sitozolde çok yüksektir. Mitokondri içindeki [NAD]/[NAD + ] oranı NAD ye yağ asitleri, aminoasitler, pirüvat ve asetil oa oksidasyonundan elektron akışı nedeniyle sitozoldekinden çok daha yüksektir. Bu yüksek [NAD]/[NAD + ] oranı solunum zincirinde oksijenin indirgenmesini sağlamaktadır. Şekil Lipit metabolizmasının hücre içi yerleşimi. Maya ve omurgalı hayvan hücreleri lipit metabolizmasının yerleşiminde yüksek bitki hücrelerininkinden farklılık gösterir. epatositler ve adipositlerde sitozol NADP ı büyük oranda pentoz fosfat yolu ve malik enzim tarafından üretilmektedir. epatositlerde ve emziren hayvanların meme bezlerinde yağ asidi sentezi için gerekli olan NADP öncelikle pentoz fosfat yolundan sağlanır (Şekil ). 188
196 Şekil NADP üretimi. NADP a giden a) Malik enzim ve b) Pentoz fosfat yolu tarafından katalizlenen iki yol Asetat Mitokondrinin Dışına Sitrat larak Çıkar Fotosentez yapamayan ökaryotlarda yağ asidi sentezinde kullanılan tüm asetil oa mitokondride, aminoasitlerin karbon iskeletlerinin yıkımından ve pirüvat oksidasyonundan oluşturulur. Yağ asitlerinin oksidasyonundan gelen asetil oa hayvanlarda yağ asidi sentezi için önemli bir kaynak teşkil etmez çünkü iki metabolik yol, aşağıda tanımlandığı gibi karşılıklı olarak düzenlenir. Mitokondri iç membranı asetil oa ya geçirgen değildir. Bu nedenle asetil grubu eşdeğerlikleri iç membrandan dolaylı mekik yollarıyla taşınır (Şekil ). Mitokondri içindeki asetil oa, sitrat oluşturmak üzere önce okzalasetatla reaksiyona girer. Reaksiyon sitrik asit çevriminde sitrat sentazla katalizlenir (Şekil ). Sonra sitrat mitokondri iç membranı üzerindeki sitrat taşıyıcısı aracılığıyla sitozole geçer. Sitrat sitozolde ATP bağımlı bir reaksiyonda sitrat liyazla parçalanarak asetil oa yeniden açığa çıkar. kzalasetat taşıyıcısı olmadığı için, okzalasetat mitokondri matriksine doğrudan dönemez. Bunu yerine okzalasetat sitozol malat dehidrogenazı tarafından malata indirgenir, bu da sitratla yer değiştiren malat α ketoglutarat taşıyıcısı üzerinden mitokondriye döner. rada, mekik sistemini tamamlamak için tekrar okzalasetata yükseltgenir. Alternatif olarak sitozolde oluşan malat, malik enzim aktivitesiyle sitozol NADP ını üretmekte kullanılır (Şekil a.). 189
197 Şekil Mitokondriden sitozole asetil gruplarını taşıyan mekik. Mitokondri dış membranı bu bileşiklerin tümüne geçirgendir. Mitokondri matriksinde aminoasit katabolizmasından yada sitozolde glikolizle glukozdan türetilen pirüvat, matrikste asetil oa ya çevrilir. Asetil grupları sitrat olarak mitokondri dışına çıkar. Sitozolde yağ asidi sentezi için asetil oa olarak dağıtılır. kzalasetat malata indirgenerek mitokondri matriksine döner ve okzalasetata çevrilir. Sitozol malatı için alternatif bir yol sitozol NADP ını üretmek üzere malik enzim tarafından oksidasyondur. luşan pirüvat mitokondri matriksine geri döner Yağ Asidi Biyosentezi Kuvvetlice Düzenlenir Bir hücre ya da organizma enerji ihtiyacını karşılamak için elverişli metabolik yakıtın yeterinden fazlasına sahip olduğu zaman, fazlası yağ asitlerine çevrilerek triaçilgliserol gibi lipit olarak depo edilmektedir. Asetil oa karboksilaz tarafından katalizlenen reaksiyon, yağ asidi biyosentezinde hız sınırlayıcı bir basamaktır ve bu enzim önemli bir düzenlenme bölgesidir. murgalılarda yağ asidi sentezinin başlıca ürünü olan palmitoil oa, enzimin geri beslemeli (feed back) inhibitörü olarak davranır ve sitrat Vmax ı artıran allosterik bir 190
198 aktivatördür (Şekil ). Sitrat, hücre metabolizmasının yönlendirilmesinde metabolik yakıtın alınmasından (oksidasyon) yağ asidi olarak depolanmasına kadar merkezi bir rol oynar. Mitokondride ATP ve asetil oa konsantrasyonu yükseldiği zaman, sitrat mitokondri dışına taşınarak hem sitozol asetil oa sının öncülü olur hem de asetil oa karboksilazın aktifleşmesi için allosterik sinyal oluşturur. Sitrat aynı zamanda glikolize karbon akışını azaltarak fosfofruktokinaz I in aktivitesini inhibe eder. Asetil oa karboksilaz aktivitesi kovalent modifikasyonla da düzenlenir. Glukagon ve epinefrin hormonları tarafından tetiklenen fosforillenme bunu inaktifleştirerek yağ asidi sentezinin yavaşlamasına neden olur. Yağ asidi sentezi ve β oksidasyonu eş zamanlı gerçekleşseydi iki olay enerjiyi boşa harcayan, yararsız bir çevrim oluşturacaktı. Daha önce değindiğimiz gibi β oksidasyon karnitin asetil transferaz I i inhibe eden, malonil oa tarafından durdurulmaktadır. Böylece yağ asidi sentezi sırasında ilk ara ürün olan malonil oa nın oluşumu, β oksidasyonu mitokondri iç membranında taşıyıcı sistem düzeyinde kapatır. Şekil Yağ asidi sentezinin düzenlenmesi. murgalıların hücrelerinde hem allosterik düzenlenme hem de hormona bağımlı kovalent modifikasyon öncüllerin malonil oa ya akışını etkiler Uzun Zincirli Doymuş Yağ Asitleri Palmitattan Sentezlenir ayvan hücrelerinde yağ asidi sentaz sisteminin başlıca ürünü olan palmitat, diğer uzun zincirli yağ asitlerinin öncülüdür (Şekil ). Stearat (18:0) veya daha uzun doymuş yağ 191
199 asitleri, mitokondri ve düz endoplazmik retikulumda bulunan yağ asidi uzatma sistemlerinin etkisiyle asetil gruplarının eklenmesi yoluyla uzatılabilir. Endoplazmik retikulumun daha aktif uzatma sistemi stearoil oa oluşturmak üzere palmitoil oa nın 16 karbonlu zincirini iki karbon kadar uzatır. Endoplazmik retikulumdaki uzatma mekanizması farklı enzim sistemlerinin olaya karışması açil taşıyıcısının AP den daha ziyade koenzim A olması dışında, malonil oa dan iki karbonun verilmesini, indirgenme, dehidrasyon ve 18 karbonlu ürün olan stearil oa ya indirgenmesinin izlenmesiyle, palmitat sentezindekiyle aynıdır. Şekil Diğer yağ asitlerinin sentez yolları. Palmitat tekli doymamış asitler olan oleat ve palmitoleatın yanı sıra, stearat ve daha uzun zincirli doymuş yağ asitlerinin de öncülüdür. Memeliler oleatı linoleata veya α linolenata çeviremezler (koyu gölgeli). Bu nedenle bunlara diyette esansiyel yağ asidi olarak ihtiyaç duyulur. Linoleatın diğer çoklu doymamış yağ asitlerine ve eikosanoitlere çevrilmesi özetlenmiştir. 192
200 Bazı Yağ Asitleri Doymamıştır Palmitat ve stearat hayvan dokularının en çok bilinen tekli doymamış iki yağ asidi olan palmitoleat 16:1(Δ 9 ) ve oleat 18:1(Δ 9 ) ın öncülleri olarak hizmet eder (Şekil ). Bu yağ asitlerinin her biri Δ 9 pozisyonunda ( 9 ve 10 arasında) tek bir cis çift bağına sahiptir. Çift bağ, bir karışık işlevli oksidaz olan yağ açili oa desatüraz (Şekil ) tarafından katalizlenen oksidatif bir reaksiyonla yağ asidi zincirine sokulur. İki farklı substrat olan yağ asidi ve NADP, eş zamanlı olarak iki elektron oksidasyonuna uğrar. Elektron akış yolu bir sitokrom (sitokrom b5) ve bir flavoproteini (sitokrom b5 redüktaz) içerir. er ikisi de yağ açili oa desatüraz gibi düz endoplazmik retikulumda bulunur. Şekil murgalılarda yağ asitlerinin desatürasyonunda elektron taşınması. Koyu oklar, moleküler oksijen tarafından oksidasyona uğratılan iki farklı substrat (yağ açili oa ve NADP) için elektron akış yönünü göstermektedir. Bu reaksiyonlar düz endoplazmik retikulumun lümene bakan yüzünde gerçekleşir. Memeli hepatositleri yağ asitlerinin Δ 9 pozisyonuna kolaylıkla çift bağ sokar. Ancak 10 ve metil ucu arasına ek bir çift bağı sokamaz. Linoleat 18:2(Δ 9,12 ) ve α linolenat 18:3(Δ 9,12,15 ) memeliler tarafından sentezlenemez fakat bitkiler her ikisini de sentezleyebilir. Linoleat ve linolenat diğer ürünlerin sentezi için gerekli öncüller olduklarından, memeliler için esansiyel yağ asitleridir ve bitkisel kaynaklı besinlerden sağlanmalıdır. Linoleat bir kez alındıktan sonra, sadece linoleattan yapılabilen diğer bilinen çoklu doymamış asitlere dönüştürülebilir (Şekil ) TRİAÇİLGLİSERLLERİN BİYSENTEZİ Bir organizma tarafından alınan yada sentezlenen yağ asitlerinin çoğu iki sondan birine uğrar. Yağ asitleri metabolik enerjinin depolanması için triaçilgliserollere katılır yada membranın fosfolipit bileşenlerine katılır. Bu alternatif yollar arasındaki dağılım organizmanın gereksinimlerine bağlıdır. ızlı büyüme sırasında yeni membranların sentezi 193
201 membran fosfolipit sentezini gerektirir. rganizma çok çeşitli yiyecek maddesine sahiptir ancak bunların yağ asitlerinin çoğu aktif olarak büyümeye değil depo yağlarına yönlenir. er iki yol da gliserolün yağ açili esterlerinin oluşumu ile başlar. Biz triaçilgliserollere giden yolu ve düzenlenmesini inceleyerek başlayacağız Triaçilgliseroller ve Gliserofosfolipitler Aynı Öncüllerden Sentezlenir ayvanlar daha sonra yakıt olarak kullanmak üzere büyük miktarda triaçilgliserol sentezler ve depolayabilirler. İnsanlar karaciğer ve kas hücrelerinde ancak birkaç yüz gram glikojen depolayabilirler. Bu nedenle ancak 12 saatlik enerji gereksimini karşılayabilir. Aksine ortalama 70 kg olan bir erkekte depolanmış triaçilgliserol miktarı yaklaşık 15 kg dır ve bazal enerji gereksimini 12 hafta kadar süreyle karşılamak için yeterlidir. Triaçilgliseroller depolanmış besinlerin en fazla enerji taşıyanıdır (~38 kj/g dan fazla). Karbohidrat glikojen depolama kapasitesinden daha fazla alındığı zaman, triaçilgliserollere çevrilir ve adipoz dokuda depolanır. Bitkiler triaçilgliserolleri başlıca meyvelerde, kabuklu yemişlerde ve tohumlarda depolanan enerjice zengin bir yakıt olarak yapar. Triaçilgliseroller ve gliserofosfolipitler (fosfatidiletanolamin gibi) hayvan dokularında iki öncülü (yağ açili oa lar ve L gliserol 3 fosfat) ve birçok biyosentez basamağını paylaşır. Gliserol 3 fosfat iki yolda oluşabilir (Şekil ). Glikoliz sırasında üretilen dihidroksiaseton fosfattan sitozolik NAD + bağlı gliserol 3 fosfat dehidrogenaz etkisiyle oluşabilir (Bölüm 10.). Karaciğer ve böbrekte gliserol kinaz etkisiyle gliserolden de oluşur (Bölüm 10. Glukoneogenez). Triaçilgliserollerin diğer öncülleri açil oa sentetazlar tarafından yağ asitlerinden oluşturulan yağ açili oa lardır (Şekil ). Aynı enzim β oksidasyon için yağ asitlerinin aktifleştirilmesinden sorumludur. Triaçilgliserollerin biyosentezindeki ilk basamak diaçilgliserol 3 fosfat (fosfatidik asit veya fosfatidat) oluşturmak üzere L gliserol 3 fosfatın iki serbest hidroksil grubunun iki molekül yağ açil oa yla açilasyonudur (Şekil ). Fosfatidik asit hücrelerde ancak eser miktarda yer alır fakat lipit biyosentezinde merkezi ara üründür; ya triaçilgliserole yada gliserofosfolipide çevrilir. Fosfatidik asit triaçilgliserole dönüşüm yolunda 1,2 diaçilgliserol vermek üzere fosfatidik asit fosfataz tarafından hidrolizlenir (Şekil ). Daha sonra diaçilgliserolle üçüncü bir yağ açili oa ile trans esterleşmeyle triaçilgliserole çevrilir. 194
202 Şekil Fosfatidik asidin biyosentez yolu. Yağ açili grupları önce yağ açili oa molekülleri oluşturarak aktifleştirilir, sonra gösterilen iki yoldan birinde oluşan L gliserol 3 fosfatla ester bağı yapmak için taşınır. 195
203 ayvansal rganizmalarda Triaçilgliserol Biyosentezi ormonlarla Düzenlenir Enerji gereksiniminden fazla alınan karbohidrat, yağ ya da protein triaçilgliserol şeklinde depolanır ve vücudun açlığa dayanabilmesi için enerji kaynağı olarak kullanılır. Triaçilgliserollerin biyosentez ve yıkımları anlık gereksinim ve metabolik ihtiyaçlara bağlı elverişli bir yolla karşılıklı olarak düzenlenir. Triaçilgliserollerin biyosentez hızı birçok hormonun etkisiyle tümüyle değiştirilir. Örneğin insülin, karbohidratların triaçilgliserollere çevrilmesini teşvik eder (Şekil ). Ağır diabetes mellituslu insanlar yalnız glukozu kullanamamakla kalmaz aynı zamanda karbohidrat ve aminoasitlerden yağ asitleri de sentezleyemezler, keton cisimleri oluşur. Triaçilgliserol metabolizması glukagondan, hem hipofiz büyüme hormonu hem de adrenal korteks hormonlarından etkilenir. Şekil Triaçilgliserol sentezinin insülinle düzenlenmesi. İnsülin diyetle alınan karbohidrat ve proteinlerin lipitlere çevrilmesini uyarır. Tedavi edilmemiş diabetes mellituslu bireylerde insülin yoktur. Sonuçta karbohidrat ve protein katabolizmasından gelen asetil oa azalan yağ asidi sentezi nedeniyle keton cismi sentezine kaydırılır. 196
204 12.BÖLÜM: PRTEİN VE AMİNASİT METABLİZMASI Proteinlerin diyetle alınmalarındaki amaç, içerdikleri aminoasitlerden vücudun kendi spesifik proteinlerinin sentezlenmesidir. Sağlıklı kişilerde ve yeterli beslenmede, proteinlerin yakıt metabolizmasına katkısı % arasında değişir. Ayrıca azot içeren porfirinler, pürin ve pirimidin nükleotidleri, DNA, RNA ve kreatin gibi birçok molekül sentezinde aminoasitlerin ya kendileri ya da azotları kullanılır. Bu bölümde önce memeliler tarafından aminoasit kaynağı olarak alınan proteinlerin sindirimi ve hücre içi yıkımı açıklandıktan sonra aminoasitlerin yıkımı üre çevrimiyle birlikte anlatılacaktır PRTEİNLERİN SİNDİRİMİ Diyetteki proteinler, önce enzimatik reaksiyonlarla tamamen aminoasitlerine kadar hidrolizlenirler. Çünkü proteinler ve birçok polipeptidler hücre membranlarını aşamazlar. Fakat aminoasitler kolayca hücre içine alınabilirler. anlılarda, sindirim sisteminde ya da hücre içinde proteinleri parçalayan enzimlere proteolitik enzimler, proteazlar veya peptidazlar adı verilir. Bu enzimlerden proteinleri iç peptid bağlarından hidrolizleyenlere endopeptidazlar, karboksil veya amino uçlarındaki aminoasitlerini hidrolizleyenlere de ekzopeptidazlar denir. Memelilerde proteinlerin hidrolizi midede başlar. Mide özsuyunda bulunan pepsin, mide mukozası hücrelerinden aktif olmayan pepsinojen şeklinde salınır. Mide mukozası hücrelerinden salgılanan ve mide özsuyunda bulunan l den kaynaklanan düşük p (p= ) etkisi ile küçük bir miktar pepsinojen kendi kendine aktive olur. Bu şekilde oluşan pepsin geri kalan pepsinojeni hidrolizleyerek aktive eder. Pepsinojen Midede, + Pepsin (321 aa) + Peptidler (42 aa) Besin Proteinleri Pepsin Proteazlar + Peptonlar Pepsin enziminin hidrolitik ürünlerinin çoğu büyük peptidlerdir. Bunların vücut tarafından kullanılabilmesi için diğer bağırsak proteolitik enzimleri tarafından hidroliz edilmeleri gerekir. Midede, pepsin protein moleküllerinin iç kısmındaki Trp, Tyr, Phe aromatik aminoasitlerin amino ucundaki peptid bağlarını hidrolizleyerek uzun polipeptid zincirlerini daha küçük peptid karışımlarına parçalar. Pepsinin özgüllük sınırı geniş olup ucu peptid bağlarını da parçalayabilir. Pepsinin etkilediği basamak önemlidir ancak gerekli 197
205 değildir. Midesinin tamamı çıkarılmış bazı hastalar pozitif azot dengesi sağlayabilecek kadar protein sindirebilir. Asidik mide içeriği ince bağırsağa girince sekretin hormonu kana salgılanır. Sekretin pankreastan ince bağırsağa bikarbonat (3- ) salınımını uyararak p yı aniden 7.0 civarına yükseltir. Proteinlerin sindirimi ince bağırsakta devam eder. Mideden gelen polipeptid zincirleri ince bağırsakta bir takım proteolitik enzimlerle karşılaşır. Mideden gelen kısa peptidler karışımının bağırsağın üst kısmına (duodenum) ulaşması, optimum p sı olan birkaç pankreatik enzimin salınımını uyaran, kolesistokinin hormonunun kana salınımına neden olur. Tripsin, kimotripsin, karboksipeptidaz A ve B ile elastaz ın zimojenleri olan tripsinojen, kimotripsinojen, prokarboksipeptidaz A ve B ile proelestaz pankreas hücreleri tarafından sentezlenir ve salgılanır. Tripsinojen aktif formu olan tripsine bağırsak hücrelerinden salınan proteolitik bir enzim olan enteropeptidaz A tarafından çevrilir. Tripsin de pankreastan salgılanan tüm zimojenleri aktifleştirir. Enteropeptidaz A Tripsinojen Kimotripsinojen Prokarboksipeptidaz A ve B Proelestaz Tripsin + ekzapeptid Kimotripsin Tripsin Karboksipeptidaz A ve B Elestaz p = 7.0 de optimum aktivite gösteren tripsin polipeptid zincirindeki Arg, Lys rezidülerinin peptid bağlarını karboksil ucundan hidroliz ile parçalar. Kimotripsinde başlıca aromatik aminoasitlerin (Phe, Trp, Tyr) çok az oranda da lösin ve metiyoninin peptid bağlarını karboksil ucundan hidrolizler. Peptid zincirinin seçimli hidrolizi: N N R 1 R 2 aa1 aa2 Tripsin, aa1: Lys veya Arg Kimotripsin, aa1: Phe, Trp, Tyr ve çok az Leu ve Met Pepsin, aa2: Phe, Trp, Tyr. Karboksipeptidazlar ekzopeptidazlar olup, yalnız karboksil uçlarındaki peptid bağlarını hidrolizler. Karboksipeptidaz A (Zn +2 içerir) ucu peptid bağlarını lizin ve 198
206 arginine veya prolinden bir önceki aminoaside kadar olan ve karboksipeptidaz B de yalnız ucundaki lizin ve arginin rezidülerinin bağlı bulunduğu peptid bağlarını hidrolizler. Elestaz nötral aminoasitleri içeren peptid bağlarını parçalayabilirken özellikle elastin üzerinde etkilidir. İnce bağırsak mukozası hücrelerinin dış yüzeylerinde bulunan amino peptidaz da bir ekzopeptidaz olup polipeptid zincirinin N2 ucundaki peptid bağlarını hemen hemen hiçbir aminoasit ayırt etmeksizin hidrolizler. Bağırsak mukozası yüzeyinde dipeptid ve tripeptidleri parçalayabilecek dipeptidaz ve tripeptidaz enzimleri de tutunmuş olarak bulunur. Mide ve bağırsakta enzimlerin birlikte etkisi sonucu proteinler tamamen aminoasitlere hidrolizlenir. Aminoasitler daha sonra kan dolaşımı yoluyla bütün dokulara taşınırlar. Doku hücrelerine de aktif taşıma ile giren aminoasitler, burada protein sentezinde kullanılırlar veya yıkıma uğrarlar. Bir hücrede protein sentezinin başlaması için 20 çeşit aminoasidin de ortamda mevcut olması gerekir. Vücuttaki proteinler devamlı olarak yenilenme içindedir. Bu yenilenme ve değişimin süresi, proteinin yarı ömrü şeklinde ifade edilir. Bu süre kan, karaciğer ve diğer iç organ proteinleri için gün arasında, toplam kas proteinlerinin 180 gün, kollagenin ise 1000 gündür. Kas proteinlerinin miktarı çok olduğundan birim zamanda yıkılan ve sentezlenen protein miktarı karaciğerdekine eşittir. Sağlıklı kişilerde protein sentez hızı, yıkılan proteinlerin yerine yenisi sentezlemek için yeterli olduğundan, vücuttaki toplam protein miktarı sabit kalır. Protein turnover i denilen bu olayla günde ortalama g proteinin yıkım ve sentezi gerçekleşir. Yaşlılarda ve özellikle yetersiz beslenme durumunda yıkım sentezden fazla olduğu için, dışarıdan alınan azottan (N) daha fazla azot (N) vücuttan idrar, ter veya dışkı yoluyla atılır. Bu duruma negatif azot dengesi denir. Yeterli beslenen sağlıklı kişilerde azot dengesi vardır. Büyüme çağında, hastalıktan iyileşme ve hamilelik döneminde pozitif azot dengesi gözlenir. İnsan vücudunda 100 g kadar serbest aminoasit vardır. Bunun yaklaşık yarısı Glu+Gln, % 10 u da esansiyel (temel) aminoasitlerdir. Glu ve Gln azotlu bileşiklerin metabolizmasında hem amino grubu vericisi hem de taşıyıcısıdır. Özetle vücudun aminoasit havuzunu (Şekil 12.1.); 1. Diyetle alınan proteinlerin sindirimi, 2. Sindirim enzimleri ve bağırsak epiteli proteinlerinin parçalanması 3. ücre içinde, özellikle plazma proteinlerinin karaciğerde hidroliz sonucu oluşan aminoasitlerden ibarettir. 199
207 Aminoasitler, karbohidrat veya yağlar gibi depolanmazlar. Vücutta sentezlenen her protein molekülü fonksiyoneldir ve hiçbir zaman aminoasit deposu değildir. Fakat uzun süreli açlıkta kas proteinleri, aminoasit sağlamak amacıyla değil de, kan glikozunu normal seviyede tutmak için aminoasitlerden glikozun sentezlenmesi amacıyla yıkılır. Süt ve yumurta proteinleri istisna olarak aminoasit deposu fonksiyonu görürler. Aminoasitlerden vücutta ihtiyaç duyulan proteinlerin ve diğer biyomoleküllerin sentezinden arta kalan kısmı atılamadığı ve depolanamadığına göre, hücre içinde bunların tek akıbeti yakıt metabolizmasına dahil olmak ve enerji oluşturmaktır (Şekil 12.1.). Aminoasit Metabolizmasının Genel Planı Kaynaklar (a c) a)besin proteini aminoasitlerine hidroliz olur ve bağırsaktan emilir. Kullanım (d g) d)vücut proteinlerinin sentezi. Örneğin: Yapısal proteinler, plazma proteinleri, enzimler, süt proteinleri, hormonlar b)doku proteini yıkılması c) Sentez (başlıca karaciğerde) KANDA AMİN ASİTLER e)protein olmayan gerekli azotlu bileşiklerin sentezi. ormonlar, kolin, kreatin, pürinler, pirimidinler, koenzimler, glutation, melanin, transaminasyon ile diğer aminoasitlerin oluşumu; üre, N 3 sentezinde. g) Enerji oluşumu f) Glukoz gibi azot içermeyen moleküllerin sentezi Şekil Protein metabolizmasının genel görünümü AMİNASİTLERİN YIKIMI VE ÜRE ÇEVRİMİ Tüm metabolik durumlarda aminoasitler amino gruplarını kaybederek, aminoasitlerin karbon iskeletleri olan α keto asitleri oluşturur. Aminoasitlerin yıkım yolları çoğu organizmada oldukça benzerdir. Memelilerde karbohidrat ve yağ asidi yıkımında olduğu gibi, aminoasit yıkım işlemleri çoğu aminoasidin karbon iskeletlerinin sitrik asit çevrimine katılmasıyla merkezi yıkım yollarında birbirine yaklaşır. Aminoasit yıkım yolu tepkimelerinin bazıları yağ asitlerinin yıkım yolu basamaklarıyla yakın benzerlik gösterir (Bölüm 11. ). Aminoasit yıkımını diğer yıkım işlemlerinden ayıran önemli bir özellik her aminoasidin bir amino grubu içermesidir. Bu nedenle aminoasit yıkımı için yollar α amino 200
208 grubunun karbon iskeletten ayrıldığı ve amino grubu metabolizmasının yollarına bağlandığı bir anahtar basamak içerir (Şekil 12.2.). ücreiçi protein Diyet proteini Amino asitler Amino asitler, nükleotidler ve biyolojik aminlerin biyosentezi N 4 + Karbon iskeletleri Karbamoil fosfat - Keto asitler Üre çevrimi Sitrik asit çevriminin aspartat - arginino süksinat mekigi - Sitrik asit çevrimi ÜRE (azot atim ürünü) ksaloasetat ATP Glukoz (glukoneogenezle sentezlenen) Şekil Memelilerde aminoasitlerin yıkımına genel bakış. Amino grupları ve karbon iskeletleri, ayrı fakat birbirine ara bağlantılı yollar izler. Biz önce amino grubu metabolizması ve azot atımını, sonra aminoasitlerden kaynaklanan karbon iskeletlerinin akıbetini ve bu yoldan giderek metabolik yolların nasıl birbirine bağlandığını inceleyeceğiz. Aminoasitlerin α amino grubu transaminasyon ve oksidatif deaminasyon reaksiyonlarıyla uzaklaştırılıp çoğu üreye çevrilirken, karbon iskeletleri de asetil oa, asetoasetil oa, piruvat veya TA çevriminin ara bileşiklerinden birine dönüştürülür. Aminoasitlerin karbon iskeletleri ya 2 ve 2 ya kadar yükseltgenerek organizmaya enerji sağlar yada yağ asitlerine, keton cisimlerine ve beyin, 201
209 iskelet kası ve diğer dokuların yakıtı olan glukoza dönüştürülür. Memelilerde aminoasit yıkımının meydana geldiği en önemli organ karaciğerdir α Amino Grubunun Uzaklaştırılması Birçok aminoasidin α amino grupları glutamat oluşturmak üzere α ketoglutarata aktarılır (Şekil 12.3.). Bu olaya transaminasyon adı verilir. Daha sonra glutamatın oksidatif deaminasyonu sonucu N4 + oluşur. Bir α aminoasitten bir α keto aside α amino grubunun transferini katalizleyen enzimlere aminotransferazlar veya transaminazlar adı verilir. Bu enzimler genelde, sitoplazmada ve az miktarda da mitokondri de bulunur. Transaminasyon reaksiyonu aşağıda olduğu gibi gerçekleşir: N N 3 Aminotransferaz PLP 2 R 1 R L- -Aminoasit -Ketoglutarat -Ketoasit L- -Glutamat Şekil Enzimle katalizlenen transaminasyonlar. Birçok aminotransferaz reaksiyonunda α- ketoglutarat amino grubu alıcısıdır. Tüm aminotransferazlarda kofaktör olarak pridoksal fosfat (PLP) bulunur. Memeli dokularında iki transaminaz enzimi öne çıkar. Bunlardan en önemlisi aspartat aminotransaminaz (AST) olup aspartat yapısındaki bir amino grubunun α ketoglutarata aktarılması reaksiyonu katalizler. Aspartat + α Ketoglutarat kzalaasetat + Glutamat Memeli dokularında önemli olan bir başka transaminaz enzimi de, Alanin + α Ketoglutarat Piruvat + Glutamat reaksiyonunu katalizleyen alanin aminotransaminaz (ALT) dır. Burada oluşan reaksiyon ile alanin de amino grubunu α ketoglutarata transfer ederek glutamatı oluşturur. Bu iki transaminazın katalizlediği reaksiyonlar sonucu α amino grupları, sonradan oksidatif deaminasyona uğrayacak olan glutamat moleküllerinde, bir başka deyimle bir glutamat havuzunda toplanmış olur. Alanin aminotransaminaz (ALT) ve aspartat aminotransaminaz (AST); kalp ataklarının, ilaç toksisitesinin ve karaciğer hasarlarının tanısında önemlidir. Bir kalp atağından 202
210 sonra bu aminotransaminazları da içeren bir grup enzim, hasarlı kalp hücrelerinden sızarak kan dolaşımına geçer. Bütün transaminaz enzimlerinde koenzim olarak piridoksinin (B6 vitamini) bir türevi olan piridoksal fosfat (PLP) görev yapar. Transaminasyon reaksiyonunda piridoksal fosfat, piridoksamin fosfat ara bileşiğine dönüşür (Bölüm 8.). Glutamatın oksidatif deaminasyonu, koenzim olarak hem NAD + hemde NADP + kullanan glutamat dehidrogenaz enzimi tarafından gerçekleştirilir. Glutamat dehidrogeneaz birçok doku mitokondrilerinde belirlenmiş olup karaciğerde çok aktiftir. Glutamat dehidrogeneazın reaksiyonu dönüşümlü olarak katalizlemesine karşın olayın dengesi glutamat sentezi yönünedir. Yemek sonrası glutamat seviyesi yükseldiği zaman oksidatif deaminasyon reaksiyonu gerçekleşir. N NAD(P) Glutamat dehidrogenaz 2 + NAD(P) + N Glutamat α Keto glutarat Glutamat dehidrogenaz enziminin aktivitesi allosterik olarak düzenlenmektedir. ATP ve GTP, enzimi allosterik olarak inhibe ederken ADP ve GDP nükleotidleri de allosterik olarak aktive eder. Yani hücre enerji yükündeki bir azalma aminoasit oksidasyonunu hızlandırır. + Karada yaşayan omurgalılarda N 4 üreye çevrilir ve atılır. Bu reaksiyonların tümünü bir arada şematize edersek α amino grubunun metabolik yolunu özetlemiş oluruz. ÜRE α Aminoasit α Ketoglutarat NAD(P) + N4 + 2 N N 2 α Keto asit Glutamat NAD(P) Serin ve treonin aminoasitlerinin deaminasyonu farklı bir yolla da doğrudan gerçekleştirilebilir. Bu özellikleri her iki aminoasidin yan zincirlerinde bir hidroksil grubu içermelerinden kaynaklanmaktadır. Bu deaminasyon reaksiyonları yine piridoksal fosfat koenzimi taşıyan serin dehidrataz ve treonin dehidrataz enzimleri tarafından katalizlenir. Serin Piruvat + N4 + Treonin α Ketobütirat + N
211 Bu enzimlere dehidrataz adı verilmesinin nedeni deaminasyondan önce bir dehidratasyon olayının meydana gelmesidir. Serinin piruvat ve N4 + ya parçalanması reaksiyonu şöyledir: N 2 N + + N Serin Aminoakrilat Piruvat D ve L Aminoasit ksidazlar D aminoasitler bitkilerde ve mikroorganizmaların hücre çeperlerinde mevcut olup, hayvan proteinlerinde yer almaz. Bununla beraber, yukardaki kaynaklardan dolayı diyette bulunduğundan karaciğer tarafından metabolize edilirler. D aminoasit oksidaz, karaciğer ve böbrekte bulunan FAD bağlı bir peroksizom enzimidir ve D aminoasitlerin oksidatif deaminasyonunu sağlar. luşan α keto asitler, daha sonra transaminasyonla L izomerlerine dönüşürken, 22 de katalaz enzimi tarafından parçalanır. D aminoasit oksidazın katalizlediği reaksiyonun net denklemi: D aminoasit α Keto asitler N /22 Burada oluşan α keto asitler, L α aminoasitlerin transaminasyonuyla oluşan α-ketoasitlerin girdiği metabolik yollara dahil olur. L Aminoasit oksidaz enzimleri de yine karaciğer ve böbrekte aktivite gösteren peroksizomal moleküllerdir. Yukardakine benzer bir reaksiyonla hemen hemen tüm L aminoasitleri etkiler. Aminoasitlerin yıkımında bu enzimlerin önemi azdır Üre Çevrimi Aminoasitlerin yıkımında oluşan N4 + ın bir kısmı azotlu bileşiklerin biyosentezinde kullanılır. Karada yaşayan omurgalılarda, N4 + üreye çevrilerek atılır. Kuşlarda ve sürüngenlerde N4 + ürik aside dönüştürülerek atılırken, deniz hayvanlarında N4 + olduğu gibi atılır. İnsanlarda N4 + ın tek kaynağı aminoasitler değildir: 1. Bağırsaklardaki bakteriyel faaliyetlerde oluşan ve emilerek kana karışan, 2. Diyetle alınan ve amin oksidaz enzimlerince yıkılan aminlerden gelen, 204
212 3. Pürin ve pirimidin katabolizmasından oluşan N4 + iyonları da karaciğere taşınarak üreye dönüştürülmelidir. Kara omurgalılarında üre yalnız karaciğerde üre çevrimi tarafından sentezlenmektedir. Üre sentezindeki azotlardan biri amonyaktan (N4 + ), diğeri ise aspartattan sağlanır. Karbon atomu da 2 den gelir. Üre, bir anlamda metabolizmanın artık toksik maddeleri olan 2 ve amonyağın beraberce atılma şeklidir. rnitin aminoasidi üredeki karbon ve azot atomlarının taşıyıcısı rolünü oynar. Üre amonyaktan beş enzimatik basamakta sentezlenir.üre çevrimi karaciğer mitokondrisi içinde başlar fakat izleyen üç basamak sitozolde gerçekleşir. Böylece çevrim iki hücresel bölümü kateder (Şekil 12.4.). Üre çevriminin ilk reaksiyonu, 2 ile glutamatın oksidatif deaminasyonu sonucu oluşan N4 + ün reaksiyonudur. 2 mol ATP nin harcandığı bu dönüşümsüz reaksiyonla yüksek enerjili bir bileşik olan karbamoil fosfat oluşur. Bu kompleks reaksiyonu, bir mitokondri enzimi olan karbamoil fosfat sentetaz katalizler. 2 + N ATP N P + 2ADP + P i Karbamoil fosfat Karbamoil fosfat, karbamoil grubunu ornitine aktararak sitrulini oluşturur ve fosfat grubu da serbest hale (Pi) geçer. Bu reaksiyon ornitin transkarbamoilaz enzimi tarafından katalizlenir. Sitrülin bir translokaz proteini vasıtasıyla ornitin karşılığında sitoplazmaya taşınır. N 3 N 3 3 N ( 2 ) N -2 P 3 2 N N ( 2 ) rnitin Karbamoil fosfat Sitrulin P i Üçüncü reaksiyonla, üre çevriminin ikinci amino grubu aspartattan devreye girer. Aspartatın amino grubu da ileride göreceğimiz gibi glutamattan sağlanmaktadır. Sonuç itibariyle ürenin iki azotu da glutamat havuzundan sağlanmaktadır. 205
213 N 2 - N N ATP N 3 N AMP + PP 3 i ( 2 ) 3 ( 2 ) 3-2 N N N - - Sitrulin Aspartat Argininosüksinat Bu kondenzasyon reaksiyonu, arginosüksinat sentetaz tarafından katalizlenir; bir ATP ve PPi nin hidrolizi ile ürünler yönüne ilerler. Arginosüksinat, arginosüksinazla arginin ve fumarata parçalanır. 3 N N 2 - N 2 N N N N 2 - ( 2 ) 3 2 ( 2 ) N - - Argininosüksinat Arginin Fumarat Burada oluşan fumarat, sitrik asit çevrimine gider (Şekil 12.4.). Aspartatın fumarata dönüşmesi, aspartatın amino grubu vericisi olduğu reaksiyonlara bir örnektir. Bu reaksiyon basamakları birçok canlılarda arginin sentezinde kullanılmaktadır. Karada yaşayan omurgalıların karaciğerinde bulunan arginaz enzimi, arginini ornitin ve üreye parçalar. Arginaz Arginin N N 2 + rnitin Böylece ortaya çıkan ornitin, bir başka karbamoil fosfatla reaksiyona girmek üzere mitokondriye geri dönerek çevrim tamamlanır. 206
214 Şekil Üre çevrimi ve sitrik asit çevrimi arasındaki bağlantılar. Sitrik asit ve üre çevrimlerini bağlayan çevrim aspartat arjininosüksinant mekiği olarak da adlandırılır. Bu yollar aminoasitlerin karbon iskeletleri ve amino gruplarının sonlarıyla etkin olarak ilişkilidir. Bu ara bağlantılı durum okların gösterdiğinden daha ayrıntılıdır. Sitozolde sentezlenen fumarat üre çevrimi, pürin biyosentezi veya diğer süreçlerden herhangi birinde oluşturulursa da sitozolik malat ve okzaloasetata dönüşerek sitozolde kullanılabilir. kzaloasetat glukoz ve bazı aminoasitler için öncüldür. Alternatif olarak, sitozolik malat ve okzaloasetat mitokondriye taşınabilir, sitrik asit çevriminde kullanılır. Mitokondri içine malat taşınması şekilde gösterilen malat aspartat mekiğinin parçasıdır. Üre çevrimi reaksiyonlarının bir bölümü karaciğer hücrelerinin mitokondri matriksinde bir bölümü de sitoplazmasında cereyan eder. N4 + ün glutamat dehidrogenaz enzimi ile oluşumu ve karbamoil fosfata dönüşümü ve daha sonra bunun da ornitinle birleşerek sitrulinin meydana getirişi mitokondri matriksinde cereyan eder. Üre çevriminin geri kalan üç reaksiyonu da sitoplazmada gerçekleşir (Şekil 12.4.). Üre sentezinin net denklemi şöyle özetlenebilir. 2 + N ATP + Aspartat + 2 Üre + 2ADP + 2 Pi + AMP + PPi + Fumarat Pirofasfatın da hemen hidrolizlendiği göz önüne alınırsa; PPi + 2 2PiΔG o = 8.0 kcal/mol bir mol ürenin sentezi için dört yüksek enerjili fosfat bağının harcandığı görülür. Sonuç olarak üre sentezinin net denklemi aşağıdaki şekilde yazılabilir. 2 + N ATP + Aspartat + 2 Üre + 2ADP + 4 Pi + AMP + Fumarat Üre çevriminde oluşan fumarat üzerinden üre çevrimi ve TA çevrimi birbirine bağlanır (Şekil 12.4.). Fumarat önce hidrasyonla malata dönüşür ve daha sonra okzalasetata 207
215 yükseltgenir. kzalasetat üç metabolik yolda daha ileri metabolize edilir; (1) aminasyonla aspartata dönüşür, (2) glukoneogenezle glukoza çevrilebilir, (3) asetil oa ile kondense olarak sitrat oluşturabilir (TA çevrimi). İnsanlarda yüksek N4 + seviyeleri, özellikle beyin için toksiktir. Karaciğerdeki üre sentezi N4 + ün uzaklaştırılması için en önemli yoldur. Üre çevriminin herhangi bir basamağının bloke olması hayati tehlike arz eder. Çünkü bu durumda kanda N4 + seviyesi artar. Bunun sonucu olarak da glutamat dehidrogenaz enziminin katalizlediği reaksiyonun dengesi glutamat yönüne kayar ve α ketoglutarat miktarı azalır. luşan glutamat da bir başka N4 + ile reaksiyona girerek glutamini oluşturur. N4 α ketoglutarat + N4 + Glutamat Glutamin Glutamat Glutamin dehidrogenaz sentetaz Bu reaksiyonla bir TA çevrimi ara bileşiği olan α ketoglutaratın mitokondrideki konsantrasyonu azalır ve TA çevriminin yavaşlamasından dolayı ATP sentez hızı düşer. Beyin hücreleri ATP seviyesindeki azalmalara karşı son derece hassastır ve geri dönüşümsüz bir hasar meydana gelebilir. Burada karaciğer dışındaki dokularda, özellikle aminoasitlerin yakıtı olarak kullanılabildiği beyin ve kas dokusu hücrelerinde oluşan N4 + ün kandaki miktarını toksik seviyeye çıkarmadan atılabilmesi önemlidir. Bir karaciğer hastalığı sonucu üre sentez eden sistem çalışmazsa N4 + iyonları sistematik dolaşıma geçer ve amonyak zehirlenmesi görülür, koma ve ölümle sonuçlanır. Kanda N4 + ün toksik seviyeye çıkması iki mekanizma ile önlenir: (1) Kas ve karaciğer dokuları arasında gerçekleşen glukoz alanin çevrimi (2) periferal dokularla böbrek ve karaciğer arasındaki glutamin yolu. Glukoz alanin çevrimi şöyle özetlenebilir: Glutamatın N2 grubu glikoliz yoluyla kasta oluşan pirüvata aktarılır ve oluşan alanin kan yoluyla karaciğere taşınır. Karaciğerde alanin karaciğer alanin transaminaz (ALT) enzimi ile tekrar pirüvata dönüştürülür. Kas dokusu Glutamat + Pirüvat α Ketoglutarat + Alanin Karaciger - Karaciğerde oluşan pirüvat glukoneogenezle glukoza çevrilir ve glukoz kan yoluyla tekrar kas dokusuna ulaştırılır. Bu şekilde devir tamamlanmış olur. Karaciğerde ALT enzimiyle oluşturulan glutamatın, oksidatif deaminasyonuyla uzaklaştırılan N4 +, üre çevrimine dahil olur. Glutamin yolunda periferal dokularda, N4 + önce glutamin sentetaz enziminin katalizlediği reaksiyonla glutamatla birleşerek glutamin oluşturur. 208
216 3 N 2 + N ATP Glutamin sentetaz 3 N 2 + ADP + P i N 2 Glutamat Glutamin Sonra glutamin, başta böbrek ve karaciğere ulaştırılmak üzere kan dolaşımına aktarılır. er iki dokuda glutamin glutaminaz enziminin katalizlediği bir reaksiyon ile glutamat ve N4 + a hidrolizlenir. Glutaminaz Glutamin + 2 Glutamat + N4 + Böbrekte N4 + idrarla dışarı atılırken, karaciğerde üreye dönüştürülür. Bu mekanizmada böbrek karaciğerden daha etkilidir Aminoasitlerin Karbon İskeletlerinin Yıkım Yolları Aminoasitlerin karbon iskeletleri metabolik enerji elde etmek için kullanılır. Aminoasitlerin yıkım yolları birlikte ele alınırsa, insan vücudunun enerji üretiminin normalde sadece % ini karşılar. Bu yollar, glikoliz ve yağ asidi oksidasyonu kadar aktif değildir. Bu yollarda akış, biyosentetik işlemler için gereksinimler ve özel bir aminoasidin varlığı arasındaki dengeye bağlı olarak büyük ölçüde değişir. Yirmi aminoasit için yirmi katabolik yol, sadece beş ürün oluşturarak birbirine yaklaşır ve bunların tümü de sitrik asit çevrimine girer (Şekil 12.5.). Karbon iskeletleri buradan glukoneogenez veya ketogeneze yönlenir ya da tamamen 2 ve 2 ya yükseltgenir. n aminoasidin karbon iskeletleri tamamen veya kısmen asetil oa ya kadar yıkılır. Beş aminoasit α ketoglutarata; dördü süksinil oa ya; ikisi fumarata ve ikisi de okzalasetata dönüşür. Akış şemalarında 20 aminoasidin ayrı yollarını, her birinin sitrik asit çevrimine özel giriş noktalarını özetledik. Bu şemalarda sitrik asit çevrimine giren karbon atomları koyu renkli gösterilmiştir. Bazı aminoasitlerin birden fazla görülmesinin sebebi, karbon iskeletlerinin değişik kısımlarının akıbetinin farkını göstermektir. Biz aminoasit katabolizmasında, her yolun her basamağını izlemekten ziyade mekanizmaları tartışacağız. 209
217 Şekil Standart aminoasitlerin sitrik asit çevrimine giriş noktalarının özeti. Bazı aminoasitlerin birden fazla son ürünü olduğundan bir kereden fazla listelenmiştir. Bu şekil omurgalı hayvanların başlıca aminoasit yıkım yollarını göstermektedir fakat omurgalı türler arasında ufak değişiklikler vardır. Örneğin treonin bazı organizmalarda asetil oa ya pirüvat yoluyla yıkılır Aminoasit Yıkımında Birkaç Enzim Kofaktörü Önemli Rol ynar Aminoasitlerin katabolik yollarında ilginç kimyasal düzenlemelerin bir karışımı görülür. Bu yolları incelemeye başlarken reaksiyon sınıflarını tekrarlamak ve enzim kofaktörlerini tanıtmak uygun olacaktır. Önemli bir sınıfı daha önce göz önüne aldık: transaminasyon reaksiyonları pridoksal fosfata ihtiyaç duyar. Aminoasit yıkımında diğer bir yaygın reaksiyon tek karbon transferleri olup; genellikle şu kofaktörlerden birini gerektirir: biotin, tetrahidrofolat veya S adenozil metiyonin (Şekil 12.6.). Bu kofaktörler tek karbon gruplarını farklı yükseltgenme durumlarında transfer eder. Biotin karbonun en yükseltgenmiş şekli olan 2 yi transfer eder (Şekil 8.10.); tetrahidrofolat tek karbon gruplarını ara yükseltgenme durumunda bazen metil grubu olarak transfer eder (Şekil 8.12.); S 210
218 adenozilmetiyonin karbonun en indirgenmiş şekli olan metil gruplarını transfer eder. Son 2 kofaktör özellikle aminoasit ve nükleotid metabolizmasında önemlidir. Şekil Tek karbon transferi reaksiyonlarındaki bazı önemli enzim kofaktörleri. Tetrahidrofolatta tek karbon gruplarının bağlandığı azot atomları (5 ve 10 nolu) koyu gösterilmiştir n Aminoasit Asetil oa ya Yıkılır n aminoasidin karbon iskeletleri asetil oa üreterek sitrik asit çevrimine doğrudan girebilir (Şekil 12.5.) veya yağ asidi sentezi için kullanılabilir. n aminoasitten beşi pirüvat yoluyla asetil oa ya yıkılarak glukoz sentezinde kullanılabilir. Diğer beşi doğrudan asetil oa ya ve/veya asetoasetil oa ya dönüşür sonra asetil oa ya parçalanır. Pirüvat yoluyla katılan aminoasitler alanin, triptofan, sistein, serin ve glisindir (Şekil 12.7.). Bazı organizmalarda treonin de asetil oa ya yıkılır; insanlarda daha sonra bahsedileceği gibi süksinil oa ya yıkılır. Alanin α ketoglutaratla transaminasyon üzerinden doğrudan pirüvata dönüşür, triptofanın yan zinciri alanine dönüşerek kopar ve böylece pirüvat oluşur. Sistein iki basamakla pirüvata dönüşür; birinci basamakta sülfür atomu uzaklaşır, ikinci basamak ise transaminasyondur. Serin, serin dehidratazla pirüvata çevrilir. Serinin hem β hidroksil hem de α amino grupları bu tek basamaklı piridoksal fosfata bağımlı reaksiyonla uzaklaştırılır (benzer bir reaksiyon Şekil de treoninle gösterilmiştir). 211
219 Şekil Alanin, glisin, serin, sistein, triptofan ve treonin için yıkım yolları. Triptofanın indol grubunun sonu Şekil da görülmektedir. Glisinin serine dönüşümünün ayrıntıları ve glisin için ikinci bir son Şekil da görülmektedir. Treonin insanda farklı bir yolla yıkılır (Şekil ). Sistein yıkımının birkaç yolu pirüvata gider. 212
220 Şekil Glisinin iki metabolik sonu. a)serine dönüşümü ve b) 2 ve N 4 + a yıkımı. Bu reaksiyonların her ikisinde de tek karbon birimlerini tetrahidrofolat taşır. Bakterideki bir ana yolda glisin, bir hidroksimetil grubunun enzimatik olarak eklenmesiyle serine dönüştürülür (Şekil 12.8.a.). Bu reaksiyon serin hidroksimetil transferazla katalizlenirken ayrıca tetrahidrofolat ve pridoksal fosfat koenzimlerine ihtiyaç duyar. ayvanlarda öncelikle baskın olan ikinci yolda glisin, 2, N4 + ve bir metilen ( 2 ) grubu şeklinde oksidatif parçalanmaya uğrar (Şekil 12.8.b.). Bu geri dönüşümlü reaksiyon glisin sentazla katalizlenir ve metilen grubu alıcısı olarak tetrahidrofolata ihtiyaç duyar. Bu oksidatif yıkım yolunda glisinin iki karbon atomu sitrik asit çevrimine girmez. Bir karbon 2 olarak kaybolur ve diğeri bazı biyosentetik yollarda tek karbon grup vericisi olan N 5,N 10 metilen tetrahidrofolatın metilen grubunu oluşturur (Şekil 8.12.). Altı aminoasidin (triptofan, lizin, fenilalanin, tirozin, lösin ve izolösin) karbon iskeletlerinin kısımları asetil oa, asetoasetil oa veya her ikisini oluşturur ve daha sonra asetil oa ya dönüştürülür (Şekil 12.9.). Lösin, lizin ve triptofan için yıkım yollarında son basamakların bazıları yağ asidi oksidasyonundaki basamaklara benzer. Bu altı aminoasidin ikisinin yıkım yolu özel bir şekilde değinmeyi gerektirir. Triptofan yıkımı hayvan dokularındaki aminoasit yıkımının tüm yollarının en karmaşık olanıdır. Triptofanın kısımları (toplam karbonunun altısı) iki farklı yolla asetil oa ya dönüşür. Bunlardan birisi pirüvat aracılığıyla diğeri asetoasetil oa aracılığıyla gerçekleşir. Triptofan katabolizmasının ara ürünlerinin bazıları diğer biyomoleküllerin sentezi için öncüldür (Şekil ): hayvanlarda NAD + ve NADP + nin bir öncülü olan nikotinat; omurgalılardaki bir nörotransmitör olan serotonin ve bitkilerdeki bir büyüme faktörü olan indolasetat. 213
221 Şekil Triptofan, lizin, fenilalanin, tirozin, lösin ve izolösin için yıkım yolları. Bu aminoasitler bazı karbonlarını (koyu) asetil oa ya verir. Triptofan, fenilalanin, tirozin ve izolösin; pirüvat veya sitrik asit çevrimi aracılarının karbonlarına katkıda bulunur. Azot atomlarının sonu bu şemada izlenmemiş olup; çoğu durumda α ketoglutarata transfer edilerek glutamat oluşur. 214
222 Şekil Öncül olarak triptofan. Triptofanın aromatik halkaları nikotinat, indolasetat ve serotonini verir. Fenil alaninin yıkımı aşağıda tartışıldığı gibi, bu yoldaki enzimlerin genetik hataları, çeşitli kalıtsal insan hastalıklarına yol açtığından önemlidir (Şekil 12.9.) Bazı kişilerde fenilalanin yıkımı genetik olarak hatalıdır. İnsanlarda aminoasit metabolizmasının birçok genetik hataları saptanmıştır. Bu tür hastalıkların çoğunda özel ara ürünler birikerek kusurlu nöral gelişime ve zihinsel geriliğe yol açar. Örneğin fenilalanin yıkım yolunun (Şekil ) ilk enzimi fenilalanin hidroksilazdaki genetik hata fenilalanin düzeyinin yükselmesinin (hiperfenilalaninemi) en yaygın nedeni olan, fenilketonüri (PKU) hastalığından sorumludur. Fenilalanin hidroksilaz, karışık işlevli oksidazlar olarak adlandırılan genel bir grup enzimden biridir (Bölüm 10. Karışık İşlevli ksidazlar, ksigenazlar ve Sitokrom P 450). Fenilalanin hidroksilaz tetrahidrobiopterin kofaktörüne ihtiyaç duyar ve bu yapı süreç içinde elektronları NAD den 2 ye taşır ve dihidrobiopterine yükseltgenir. 215
223 Şekil Fenilalanin ve tirozin için yıkım yolları. Bu aminoasitler insanlarda normalde asetoasetil oa ve fumarata dönüştürülür Beş Aminoasit α Ketoglutarata Dönüştürülür Beş aminoasidin (prolin, glutamat, glutamin, arginin ve histidin) karbon iskeletleri sitrik asit çevrimine α-ketoglutarat olarak girer (Şekil ). Prolin, glutamat ve glutamin; beş karbonlu iskelete sahiptir. Prolinin halkalı yapısı, karboksil grubundan en uzak karbondan yükseltgenmeyle açılarak bir Schiff bazı oluşur. Daha sonra Schiff bazı doğrusal bir semialdehid olan glutamat ã semialdehide hidrolizlenir. Bu da aynı karbonun ileri yükseltgenmesiyle glutamata dönüşür. Glutamin, glutaminazın etkisiyle glutamata dönüşür. Glutamat transaminasyon veya deaminasyonla α ketoglutarat oluşturur. Arginin ve histidin beş bitişik karbon içerir ve altıncı karbon azot atomu aracılığıyla bağlanır. Bu aminoasitlerin glutamata katabolik dönüşümü; bundan dolayı prolin veya glutamin yolundan biraz daha karmaşıktır (Şekil ). Arginin üre çevrimindeki ornitinin beş karbonlu iskeletine dönüştürülür ve ornitin transamine edilerek; glutamat γ semialdehid oluşur. istidinin beş karbonlu glutamata dönüşümü çok basamaklı bir yolla gerçekleşir; ekstra karbon, kofaktör olarak tetrahidrofolat kullanan bir basamakla uzaklaştırılır. 216
224 Şekil Arginin, histidin, glutamat, glutamin ve prolin için katabolik yollar. Bu aminoasitler ketoglutarata çevrilir. istidin yolundaki numaralandırılmış basamaklar (1) histidin amonyak liyaz, (2) ürokonat hidrataz, (3) imidazolpropionaz ve (4) glutamat formimino transferazla katalizlenir. 217
225 Dört Aminoasit Süksinil oa ya Dönüştürülür Metiyonin, izolösin, treonin ve valinin karbon iskeletleri sitrik asit çevriminin bir ara ürünü olan süksinil oa ya dönüşerek yıkılır (Şekil ). Metiyonin metil grubunu S adenozilmetiyonin yoluyla birkaç olası alıcıdan birine verir. Geriye kalan dört karbon atomundan üçü süksinil oa nın bir öncülü olan propiyonil oa nın propiyonatına çevrilir. İzolösin transaminasyon geçirir ve bunu izleyen oksidatif dekarboksillenme ile α keto asit oluşur. Geri kalan beş karbonlu iskelet asetil oa ve propiyonil oa ya kadar daha ileri bir yükseltgenme geçirir. Valin transaminasyon ve dekarboksilasyon geçirir. Daha sonra bir geri yükseltgenme reaksiyonuyla geri kalan dört karbon, propiyonil oa ya çevrilir. Valin ve izolösin bazı kısımlarının yıkım yolları, yağ asidi yıkımının basamaklarıyla birbirine yakındır (Şekil 11.5.). İnsan dokularında treonin propiyonil oa ya da dönüşür. Bu üç aminoasitten çıkan propiyonil oa Bölüm 11 de tanımlanan bir yolla süksinil oa ya dönüştürülür (Şekil 11.8.). 218
226 Şekil Metiyonin, izolösin, treonin ve valin için yıkım yolları. Bu aminoasitler süksinil oa ya dönüştürülür. İzolösin aynı zamanda karbon atomlarından ikisiyle asetil oa ya katkıda bulunur (Şekil 12.9.). Burada insanlardaki treonin yıkımının yolu gösterilmiştir; diğer organizmalarda bulunan bir yol Şekil de gösterilmektedir. 219
227 Dallı Yan Zincirli Aminoasitler Karaciğerde Yıkılmaz Aminoasitlerin yıkımının çoğu karaciğerde yer almakla birlikte dallı yan zincirli üç aminoasit (lösin, izolösin ve valin) birincil olarak kas, adipoz, böbrek ve beyin dokusunda yakıt olarak yükseltgenebilir. Bu ekstrahepatik dokular karaciğerde olmayan bir aminotransferaz içerir. Bu enzimin üç dallı yan zincirli aminoasitlere etkisi, karşılık gelen α keto asitlerini üretir (Şekil ). Sonra dallı zincirli α keto asit dehidrogenaz kompleksi tüm üç α keto asidin oksidatif dekarboksillenmesini katalizler ve her birinden 2 olarak karboksil grubu açığa çıkar ve açil oa türevleri oluşur. Bu reaksiyon pirüvatın asetil oa ya pirüvat dehidrogenaz kompleksiyle oksidatif dekarboksillenmesine yapısal olarak benzerdir. Burada beş kofaktöre (tiamin pirofosfat, FAD, NAD +, lipoat ve koenzim A) ihtiyaç duyulmaktadır. Şekil Üç dallı yan zincirli aminoasit; valin, lösin ve izolösin için yıkım yolları. Ekstrahepatik dokularda gerçekleşen üç yol ilk iki enzimi paylaşır. Dallı zincirli α keto asit dehidrogenaz kompleksi, pirüvat ve α ketoglutarat dehidrogenaz kompleksleriyle benzerdir ve beş aynı kofaktöre ihtiyaç duyar. Bu enzim Akçaağaç şurubu idrar hastalığı olan kişilerde hatalıdır. 220
228 Üç dallı yan zincirli aminoasidin α keto asitlerinin kanda biriktiği ve fazlasının idrara geçtiği göreceli ender genetik bir hastalık vardır. Bu durum α keto asitlerin idrara verdiği karakteristik koku nedeniyle akçaağaç şurubu idrar hastalığı olarak adlandırılır ve dallı zincirli α keto asit dehidrogenaz kompleksinin bir hatası sonucudur. Bu hastalık tedavi edilmediğinde, beyinin anormal gelişimi, zihinsel gerilik ve bebeğin erken ölümüyle sonuçlanır. Tedavi normal büyümeye izin veren en az valin, izolösin ve lösinin sınırlı alımının diyetle sıkı kontrolünü gerektirir Asparagin ve Aspartat kzalasetata Yıkılır Asparagin ve aspartatın karbon iskeletleri, sonunda okzalasetat olarak sitrik asit çevrimine girer. Asparaginaz enzimi asparaginin aspartata hidrolizini katalizler, bu da α ketoglutaratla transaminasyon geçirerek glutamat ve okzalasetata dönüşür (Şekil ). Şimdiye kadar 20 standart aminoasidin azot atomlarını kaybettikten sonra; dehidrojenlenme, dekarboksillenme ve diğer reaksiyonlarla karbon iskeletlerinin parçalarını sitrik asit çevrimine girebilen, beş merkezi metabolit yapıyı oluşturma için yıktıklarını gördük. Asetil oa ya yıkılan bu parçalar, oksidatif fosforillenmeyle ATP oluştururken; tamamen 2 ve 2 ya yükseltgenir. Böylece aminoasitlerin karbon iskeletlerinin bazı alternatif sonlarının kısa tartışmasını bitiriyoruz. Şekil Asparagin ve aspartat için yıkım yolu. er iki aminoasit de okzalasetata dönüşür. 221
229 Bazı Aminoasitler Glukoza Diğerleri Keton isimlerine Dönüştürülebilir Asetoasetil oa ve/veya asetil oa ya yıkılan altı aminoasit (triptofan, fenilalanin, tirozin, izolösin, lösin ve lizin) karaciğerde keton cisimlerine dönüşebilir. Asetoasetil oa, burada asetoasetat ve β hidroksibutirata dönüştürülür (Şekil 11.9.). Bunlar ketojenik aminoasitlerdir (Şekil ). Bunların keton cisimlerini oluşturma eğilimleri özellikle tedavi edilmemiş diabetes mellitusta belirgindir. Bu durumda karaciğer, hem yağ asitlerinden hem de ketojenik aminoasitlerden çok miktarda keton cisimleri üretir. Pirüvat, α ketoglutarat, süksinil oa, fumarat ve/veya okzalasetata yıkılan aminoasitler, açlık durumunda glukoz ve glikojene dönüştürülebilir (Bölüm 10. Glukoneogenez). Bunlar glukojenik aminoasitlerdir. Ketojenik ve glukojenik aminoasitler arasındaki ayrım kesin değildir. Dört aminoasit (triptofan, fenilalanin, tirozin ve izolösin) hem ketojenik hem de glukojeniktir. Yirmi α aminoasitten yalnız lösin ve lizin tamamen ketogeniktir. Aminoasitlerin yıkımı, hayvanların yüksek proteinli diyette veya açlık sırasında yaşamlarını sürdürmesinde özellikle kritiktir. Özellikle ketojenik bir aminoasit olan lösin proteinlerde çok yaygındır. nun yıkımı açlık durumlarında ketozise önemli bir katkı sağlar. Şekil Glukojenik ve ketojenik aminoasitlerin özeti. Aminoasitlerden dördünün hem glukojenik (koyu) hem ketojenik (açık) olduğuna dikkat ediniz. Pirüvata yıkılan beş aminoasit aynı zamanda potansiyel ketojeniktir. Yalnız iki aminoasit (lösin ve lizin) sadece ketojeniktir. 222
230 13. BÖLÜM: NÜKLEPRTEİN ve NÜKLEİK ASİT METABLİZMASI Bilgiyi depolamaları, canlı organizmaların büyüme, gelişme ve çoğalması (kendini yenilemesi) için gerekli olan tüm genetik bilgiyi içermelerinden dolayı nükleik asitler oldukça önemli biyolojik moleküllerdir. Nükleik asitlerin birimlerini de oluşturan nükleotitler hemen hemen tüm biyokimyasal işlemlere katılırlar. Ayrıca nükleotitler; 1. Nükleik asitlerin monomerik birimlerini oluştururlar. Gerçekte, nükleik asitler nükleotidlerin aktifleştirilmiş şekilleri olan nükleozit trifosfatlardan doğrudan sentez edilirler. 2. Nükleozit trifosfatlar ve özellikle ATP, pek çok enerji salıveren metabolik yolun enerjice zengin nihai ürünleridirler ve bu moleküllerin kullanılması ile enerji gerektiren işlemlerin gerçekleşmesi sağlanır. 3. Metabolik yolların çoğu kısmen de olsa ATP, ADP ve AMP gibi nükleotıtlerin konsantrasyon düzeyleri ile regüle edilir. 4. Adenin nükleotitler NAD, NADP, FMN, FAD2 ve koenzim A gibi koenzimlerin yapısal bileşenleridirler. Besin maddelerinde bulunan nükleoproteinler mide öz suyunun asitliği ile temasa gelince nükleik asit-protein bağı açılır ve protein kısmı, diğer proteinlerde olduğu gibi, midede kısmen sindirilir. Protein sindirimi ince bağırsaklarda tamamlanırken nükleik asitler (RNA, DNA) pankreas özsuyunun nükleaz (ribonükleaz ve dezoksiribonükleaz) adlı enzimleri tarafından hidroliz edilirler. Böylece mono- ve oligonükleotidler meydana gelir. ligonukleotidler bağırsak mukozasında bulunan ve daha az spesifık olan fosfodiesteraziar tarafından mononukleotidlere parçalanırlar. Bağırsak mukozasında ve buradan ayrılan hücreler dolayısıyla bağırsak boşluğunda bulunan nükleotidazlar (fosforikmonoester hidrolazlar) mononukleotidlerin pentoz-fosfat bağını nukleozid ve inorganik fosfat meydana getirerek hidroliz ederler. Bu şekilde meydana gelen nukleozidler emilir ve sindirim bağırsak mukozası hücrelerinde devam eder. Bağırsak mukozası hücreleri tarafından emilen bu nükleozidler bağırsak mukozası hücrelerinde bulunan nükleozidaz veya nükleozit fosjorilazlar tarafından inorganik fosfat varlığında serbest pürin veya pirimidin ve pentoz fosfat vermek üzere parçalanırlar. Bununla beraber nukleozitler kana da karışırlar (Şekil 13.1.). 223
231 Şekil Nükleoproteinlerin sindirimi NÜKLETİT KATABLİZMASI ücreler tarafından oluşturulan yani hücre esaslı besin maddelerinin çoğu nükleik asitleri içerir. Bu şekilde alınan nükleik asitler sindirim sisteminde çeşitli nükleaz ve fosfodiesterazlar tarafından kendi bileşenleri olan nükleotitlerine parçalanırlar. ücre membranmı geçemeyen bu iyonik bileşikler daha sonra çeşitli nükleotidaz ve spesifik olmayan fosfataz tarafından kendilerini oluşturan nükleozitlere hidrolizlenirler ve daha ileri bir parçalanma ile nükleozidaz ve nükleozit fosforilazların da etkisiyle serbest bazlar ve riboz veya riboz-1-fosfatlar oluşturulur. 224
232 Diğer hücre bileşenlerinde olduğu gibi nükleik asitler de yenilenmek üzere parçalanırlar. Nükleik asitlerin sindirim ürünleri ile bağırsak metabolizması ürünleri, vena porta yolu ile önce karaciğere gelir sonra büyük dolaşıma geçerler. Kana geçen nukleozidler de karaciğer, böbrek, dalak, kemik iliği vb. dokularda, bu dokularda bulunan nükleozid fosforilazlar tarafından inorganik fosfat varlığında pürin veya pirimidin ile pentoz fosfata parçalanırlar. Guanozine bir nukleozid fosforilaz'ın etkisiyle serbest guanin oluşurken, adenozin adenozin aminohidrolaz in etkisiyle önce inozine ve sonra bir nukleotid fosforilaz'ın etkisiyle hipoksantine değişir (Şekil 13.2.). Gerek kan yolu ile dokulara gelen ve gerekse dokularda serbest hale geçen pürin ve pirimidinler de yıkılır. Şekil Kan yolu ile dokulara gelen nükleozitler Pürinlerin Katabolizması İnsanlarda, maymunlarda, kuşlarda, sürüngenlerde pürin halka sistemi metabolizma esnasında yıkılmaz, son ürün yine pürin türevi olan ürik asitdir. Dokularda bulunan özel enzimler pürinleri hidrolitik dezaminasyonla hidroksipürinlere dönüştürürler. Gerek guanin gerekse adenin bu şekilde ksantin ve hipoksantine dönüşürler. Bundan sonra, ksantin oksidaz hipoksantini ksantine ve ksantini ürik asite çevirir (Şekil 13.3.). Şekil Pürin katabolizmasının farklı hayvansal organizmalardaki farklı ürünleri Sonuçta bütün pürinlerin dezaminasvonu veya yükseltgenmesi ile ürik asit meydana gelir. Ürik asit trihidroksipürindir. Ürik asit hem besin maddeleri ile alınan (eksojen) ve hem 225
233 organizmanın yaptığı (endojen) pürinlerden meydana gelir. Normal halde kanda % 2-5 mg kadar ürik asit bulunur. İdrarla günde çıkarılan miktar 0,5-0,85 g kadardır. Lösemide, böbrek yetersizliğinde kandaki ürik asit miktarı fazlalaşır. Gut (nikris) adı verilen bir hastalıkta da kandaki ürik asit miktarı artar ve sodyum ürat seklinde kristalleşen ürik asit eklemlerde, bağ dokusunda toplanarak, özellikle ayak baş parmağında odaklanan şiddetli ağrılara neden olur. Ürik asit ve suda az çözünen üratların (ürik asit tuzlarının) idrarla atılmasının çoğaldığı bazı hallerde idrar yollarında ürat taşları oluşabilir. Gut hastalığı ksantin oksidaz' ın kompetjtif inhibitörü olan allopürinol ile tedavi edilebilir (Şekil 13.4.). iperürisemi oluşturarak primer guta yol açan diğer kalıtsal bozukluk, glutatyon redüktaz aktivitesinin artmasına bağlı olarak NADP + düzeyinin yükselmesi ile ortaya çıkmaktadır. NADP + artışı riboz 5-fosfat sentezini hızlandırır. Buda von Gierke hastalığına benzer şekilde primer gut oluşumuna yol açar. Ayrıca, lösemi gibi nükleik asit yapım ve yıkımının arttığı durumlarda, kronik böbrek yetmezliğinde ve ürik asitin atılamamasına yol açan diğer nedenlerle sekonder gut görülmektedir. Gut tedavisinde nükleoprotein içeriği bakımından zengin besinler kısıtlanmalıdır. Ayrıca serum ürat düzeyinin azalmasına yol açan bazı ilaçlar, özellikle ksantin oksidaz inhibitörü ve hipoksantin analogu olan allopürinol tedavide kullanılır. Allopürinolün ksantin oksidaz ile hidroksillenmesi alloksantin oluşumuna yol açar. Alloksantin, ksantin oksidazın inhibitörüdür. Böylece ürik asit oluşumu azalırken serum hipoksantin ve ksantin düzeyleri artar. Ancak bu bileşiklerin serum düzeylerinin artışı hiperürisemide görülen bozukluklara yol açmaz. Tedavide ayrıca, idrarla ürat atılımını kolaylaştıran ürikozürik ilaçlar da etkilidir. Gut ağrılarının azaltılmasında kolşisinden yararlanılmaktadır. Lesch-Nyhan Sendromu: 2-3 yaşlarında nörolojik belirtilerle ortaya çıkan X' e bağlı resesif kalıtsal bir bozukluktur. El ve ayak parmakları ile dudaklarını ısırarak kendilerine zarar veren bu çocuklar başkalarına karşı da saldırgan davranışlar gösterir. Bu hastalarda zekâ geriliği ve spastik kusurlar görülmektedir. Lesch-Nyhan sendromu, pürin salvaj yolunda hipoksantin-guanin fosforibozil transferaz (GPRT) aktivitesinin düşüklüğü veya yokluğu sonucunda ortaya çıkmaktadır. Enzim eksikliğinde PRPP' nin pürin salvaj yoluna girmemesi nedeniyle de novo pürin sentezi artar. Guanin ve hipoksantin katabolizmasının artmasına bağlı olarak ürik asit düzeyi yükselir. Bu enzim eksikliği ile nörolojik belirtiler arasındaki ilişki henüz tam olarak bilinmemektedir. Normal şartlarda, beyinde hipoksantin-guanin fosforibozil transferaz düzeyi diğer dokulardan daha fazla, pürinlerin de novo sentezinde görev yapan amidotransferaz düzeyleri ise daha azdır. Bu sebeple beyin IMP ve GMP sentezi için salvaj yoluna diğer dokulara göre daha bağımlıdır. 226
234 Pürinler insan, maymunlar, kuşlar ve sürüngenlerde ürik asit halinde dışarı atıldığı halde, memeli hayvanlarda pürin metabolizmasının son ürünü allantoindir. Bu hayvanlarda ürik asit karaciğer ve böbreklerde bulunan ürat oksidaz yardımıyla allantoine çevrilir. Bu reaksiyon esnasında 6 numaralı atomu 2 şeklinde ayrılır, altı üyeli halka kapanır, beşli olur ve beşli halka açılır. Şekil Pürinlerin katabolizması ve ürik asit oluşumu. Kurbağa ve balıklarda allantoin, allatıtoinaz' ın etkisiyle allantoik asite ve allantoik asit, allantoikaz aracılığı ile, iki molekül üre ve bir molekül glioksilik asite dönüşür. Buna göre kurbağa ve balıklarda pürin metabolizmasının son ürünü üredir. Adenozin ve deoksiadenozin, pürin nükleotit fosforilaz ile parçalanamaz. Daha ziyade, adenin nükleozitler ve nükleotitler adenozin deaminaz ile karşılık gelen inozin türevlerini vermek üzere amin grubu uzaklaştırıldıktan (deaminasyon) sonra parçalanırlar. Adenozin monofosfatın (AMP) inozin monofosfata (IMP) deaminasyonu, AMP nin IMP tan sentezi ile birleştirildiğinde asparattın fumarata deaminasyonu ile ilişkilidir. Dolayısıyla pürin nükleotit çevrimi iskelet kasında önemli bir metabolik göreve sahiptir. Böylece kas dokusu sitrik asit çevrimi ara ürünlerini pürin nükleotit çevriminde üretilen fumarattan sağlar. 227
235 Pürin katabolizmasında önemli bir görev yapan ksantin oksidaz, hipoksantini ksantine ve ksantini de ürik asite dönüştürür. Dimerik bir protein olan ksantin oksidaz birbirinin benzeri ve 130 kda luk iki altbirim içerir. Ayrıca prostetik grup olarak bir FAD, Mo(IV) ile Mo(VI) yükseltgenme basamaklarına sahip bir molibden kompleksi ve iki farklı Fe-S kümesi içerir. Bu bilgilerden de anlaşılacağı gibi bu enzim küçük bir elektron-transfer proteinidir. Bu işlemlerde nihai elektron kabul edici molekül oksijendir ve hücre hasan yapabilecek bir türev olan 22 'e dönüştürülür ancak katalazın etkisiyle bu molekül 2 ve 2 'e parçalanır. İnsanlarda pürin parçalanmasının nihai ürünü ürik asittir. Diğer tüm organizmalarda ise ürik asit daha ileri işlemlere uğrar ve bir organizmadan diğerine oluşan nihai ürünler farklılıklar gösterirler. Bu ürünler allantoin, allantoik asit, üre ve amonyum iyonu olarak sıralanabilir (Şekil 13.5.). Şekil Ürük asitten N 4 + oluşumu 228
236 Pirimidinlerin Katabolizması İnsan ve hayvan hücreleri pirimidin nükleotitleri bazlarına parçalarlar. Pürin nükleotitlerinde olduğu gibi bu reaksiyonlar defosforillenme, deaminasyon ve glikozidik bağ parçalanması üzerinden gerçekleşir. luşan urasil ve timin daha sonra karaciğerde indirgenme ile parçalanırlar. Gerek kan yolu ile dokulara gelen ve gerekse dokularda serbest hale geçen pirimidin bazları karaciğerde yıkılırlar. Pirimidin azotu, amino asit azotu gibi, idrarla üre va amonyak halinde çıkarılır. Pirimidin yıkılmasının son ürünleri olan -alanin ve -aminoizobutirik asit amino asit olduklarından transaminasyon ile yıkılırlar (Şekil 13.6.). -Alaninin transaminasyonu ile maloniksemialdehid ve bunun transaçilasyonu ile malonil-oa ve metilmalonil- oa meydana gelir. Pirimidin katabolizmasımn nihai ürünleri (3-alanin ve P-aminoizobutirattır. Bunlar daha ileri işlemlerde kullanılmak üzere transaminasyon ve aktivasvon reaksiyonlan ile malonil- oa ve metilmalonil-oa' ya dönüştürülürler. 229
237 Şekil Pirimidinlerin katabolizması ve malonil oa oluşumu NÜKLETİT BİYSENTEZİ Nükleik asitler ve nükleoproteinler endojen maddelerdir. Nükleotidlerin yapı taşlarından olan pürin ve pirimidinlerin sentezi, izotop atomlarla işaretlenmiş maddelerin organizmaya verilmesi ile aydınlatılmıştır. Yüksek organizmalarda pürinler, pirimidinler ve bunlara karşılık 230
238 gelen nükleozitler bir seri enzimatik reaksiyonla sentez edilir. rganizma bu maddelerin sentezi için protein ve karbohidrat metabolizması ürünlerini kullanır. ücre metabolizmasındaki önemli görevleri ile nükleotitler hemen hemen tüm hücreler tarafından baştan sona kadar ve nükleik asitlerin parçalanma ürünlerinden sentezlenirler. Karaciğer, bağırsak mukozası ve timus pürin halka sistemini içeren nukleotitleri sentez edebilir, fakat başlıca kaynak karaciğerdir De Novo (yeni baştan sentez) Pürin Ribonükleotitlerin Sentezi Pürin Biyoentezi ücre metabolizmasındaki önemli görevleri ile nükleotitler hemen hemen tüm hücreler tarafından baştan sona kadar ve nükleik asitlerin parçalanma ürünlerinden sentezlenirler. Çeşitli bilimsel çalışmalar sonucu, pürinlerin yapısındaki N(l) azotun aspartatın amin grubundan kaynaklandığı, (2) ve (8) karbonlarının formattan geldiği, N(3) ve N(9) azotlanmn ise glutaminin amit grubundan katıldığı, (4), (5) ve N(7) atomlannın ise glisinden türediği ve son olarak (6) atomunun ise 2 ten geldiği tespit edilmiştir (Şekil 13.7.). Şekil Pürin biosentezinde karbon ve azot atomlarının kaynakları Bu taşıyıcı moleküllerden sentezlenen ilk pürin türevi inozin monofosfattır (IMP) ve daha sonra da bu molekülden farklı yollarla adenozin monofosfat (AMP) ve guanozin monofosfat (GMP) sentezlenir. Dolayısıyla pürinler başlangıçta ribonükleotit olarak oluşturulurlar ve bu işlemler hemen hemen tüm organizmalarda benzer yollarla gerçekleştirilir. Pürin biyosentezinin başlangıç maddesi pentoz fosfat yolunun bir ürünü olan riboz-5- fosfattır. İlk basamakta, bu molekül riboz fosfat pirofosfokinaz tarafindan ATP ile 231
239 aktifleştirilir ve 5-fosforibozil- -pirofosfat (FRPF). FRPF aynı zamanda hem pirimidin biyosentezinin ve hem de histidin ile triptofanın da ön maddesidir. Riboz-5-fosfat + ATP 5-fosforibozil- -pirofosfat + AMP Pürin biyosentezine has bir reaksiyonla amidofosforibozil transferaz FRPF nin pirofosfat grubunu glutaminin amit azotu ile yer değiştirmesini katalizler ve moleküliçi bir konfigürasyon değişimine bağlı olarak -5-fosforibozilamin oluşur. Glisinin karboksil grubunun fosforillenmesi ile kolaylaştınlan bir reaksiyonla glisinin karboksil grubu fosforibozilaminin amino grubu ile glisinamit ribotit (GAR) adı verilen bir amit oluşturur (Şekil 13.8.). Şekil Pürin biyosentezinin başlaması 232
240 GAR ın serbest -amino grubu formilglisinamit ribotit (FGAR) vermek üzere formillendirilir. Bu reaksiyondaki formil salıcı grup N 10 - formiltetrahidrofolattır. Bu kofaktör serin, glisin ve format gibi salıcı moleküllerden 1 lu üniteleri biyosentetik reaksiyonlardaki alıcı moleküllere transfer eder. İkinci bir glutaminin amid fonksiyonundaki amino grubu formilglisinamit ribotit (FGAM) oluşturmak üzere büyüyen pürin halkasına transfer edilir. ATP nin hidrolizini gerektiren bu endergonik reaksiyon FGAM sentetaz ile katalizlenir. Pürin imidazol halkası yine ATP-gerektiren bir moleküliçi kondenzasyon ile kapanır ve 5- aminoimidazol ribotit (AIR) oluşur (Şekil 13.9.). Şekil Pürin biyosentezinin devamı 233
241 Pürindeki (6) atomu bir karboksillenme reaksiyonu ile 2 'den gelir ve bu reaksiyon karboksiaminoimidazol ribotit (KAIR) verir. Bu karboksillenme reaksiyonu biyotin gerektirmediği gibi ATP nin hidrolizine de gereksinim duymaz. Pürin N(l) atomu bir amit oluşumu reaksiyonuyla aspartattan sağlanır ve bu kondenzasyon reaksiyonu 5- aminoimidazol- 4(N - süksinilokarboksamit) ribotit (SAKAIR) oluşturur. SAKAIR 'den fumarat ayrılmasıyla 5- aminoimidazol- 4-karboksamit ribotit (AKAR) oluşur (Şekil ). Şekil Pürin biyosentezinin devamı 234
242 Pürin halkasına katılacak en son grup formildir ve yine N - formiltetrahidrofolat ile sağlanır. Böylece 5-formaminoimidazol-4-karboksamit ribotit (FAIKAR) oluşturulmuş olur. Bu biyosentez reaksiyonlanndaki son adım IMP oluşturmak üzere FAIKAR 'ten su ayrılmasıyla gerçekleşen bir halka kapanma reaksiyonudur (Şekil ). Şekil Pürin biyosentezinin devamı IMP oluştuktan sonra çabucak AMP ve GMP' a dönüştürülür. er iki üründe IMP den birbirinden farklı iki ayrı basamakta sentezlenir. AMP nin sentezi adenilosüksinat üzerinden gerçekleşir. Önce aspartatın amino grubunun IMP' a katılması ile adenilosüksinat oluşturulur ve daha sonra bu üründen fumaratın ayrılması ile AMP sentezlenmiş olur ki bu reaksiyon adenilosüksinat liyaz ile katalizlenir. 235
243 GMP' nin sentezinde ise önce bir yükseltgenme-indirgenme reaksiyonu ile ksantozin monofosfat (XMP) ve daha sonra da GMP sentaz ile katalizlenen ve ATP hidrolizi gerektiren bir reaksiyonla glutaminin amid fonksiyonundaki amin grubu XMP' a transfer edilerek GMP oluşturulur. Bu biyosentetik yollarla oluşturulan nükleozit monofosfatlann nükleik asit sentezine katılabilmeleri için nükleozit trifosfatlara dönüştürülmeleri gerekir. Önce nükleozit monofosfatlardan nükleozit monofosfat kinazlar tarafından katalizlenen bir reaksiyonla nükleozit difosfatlar oluşturulur. Nükleozit difosfatlar ise nükleozit difosfat kinazlarla katalizlenen işlemlerle karşılık gelen nükleozit trifosfatlara dönüştürülür (Şekil 13.12). Şekil Nükleozit di- ve trifosfatların kinazlarla sentezi 236
244 Pürin Nükleotit Biyosentezinin Regülasyonu Nükleik asit metabolizmasındaki yollar oldukça sıkı bir şekilde regüle edilirler. IMP, ATP ve GMP sentezleyen yollar pek çok hücrede ayrı ayrı regüle edilirler ve böylece sadece üretilen pürin nükleotitlerin toplam miktarları kontrol edilmekle kalmaz ayrıca ATP ve GTP nin bağıl miktarları da koordine edilir. IMP yolu ilk iki reaksiyonda regüle edilir ki bunlar FRPF ve 5-fosforibozilamin sentezini sağlayan reaksiyonlardır. İlk reaksiyonu katalizleyen riboz fosfat pirofosfokinaz hem ADP ve hem de GDP ile inhibe edilir. IMP yolunun hız tayin basamağı olan ikinci reaksiyonu katalizleyen amidofosforibozil transferaz ise nihai ürünlerle yani ilk reaksiyonları besleme ile önlenir. Bu enzimin aktivitesi allosterik olarak FRPF tarafından uyarılır (ileriye doğru besleme ile aktivasyon) (Şekil ). Şekil Pürin biyosentez yolunun kontrolü Bu metabolik yollardaki ikincil düzeyde bir regülasyon IMP den AMP ve GMP ye geçiş noktasında gerçekleşir. Bu aşamada regülasyon bu iki molekül tarafından sağlanır yani 237
245 kendi sentezleri için birer yarışmalı inhibitör olarak görev yaparlar. Böylece bu ürünlerin aşın miktarlarının sentezlenmesi engellenmiş olur. Bu reaksiyonlarla sentezlenen ATP, IMP den GMP sentezinin ve GTP de IMP den AMP sentezinin gerçekleşmesinde sürücü birer güç olarak rol oynayarak kendi sentezlerinden ziyade zıt bir etkiyle birbirlerinin sentezini sağlayan AMP ve GMP üretimini dengelerler. Böylece, GMP nin sentez hızı ATP konsantrasyonundaki artma ile ve AMP nin sentez hızı da GTP nin konsantrasyonundaki artma ile artar Pürin Nükleotidlerinin Salvaj (kurtarma) Yolu ile Sentezi Nükleik asitlerin yıkımı ile serbest hale geçen pürin bazları yeniden nükleotid sentezinde kullanılabilmekte ve bu yolla daha az enerji harcanmaktadır. Adenin, guanin ve hipoksantin, tek aşamada FRPF ile reaksiyona girerek sırasıyla AMP, GMP ve IMP sentezlenir ve PPi açığa çıkar. AMP sentezinde adenin fosforibozil transferaz, IMP ve GMP sentezlerinde hipoksantin-guanin fosforibozil transferaz (GPRT) enzimleri görev alır (Şekil ). Kısaca, salvaj yolunun özelliği mevcut baza riboz-fosfatın eklenmesidir. De novo sentezde ise aktiflenmiş riboz-fosfatın üzerine pürin halkası elemanları bir dizi reaksiyonla eklenmektedir. Memelilerde pürin nükleotidlerinin de novo sentezi en fazla karaciğerde olur. Yeterli derecede de novo pürin nükleotit sentezi yapmayan dokular salvaj yolunu kullanır. Örneğin, beyinde FRPF amidotransferaz aktivitesi düşük olduğundan daha çok salvaj yolu ile pürin nükleotit sentezi olmaktadır. 238
246 Şekil Pürin nükleotitlerinin salvaj yolu ile sentezi De Novo Pirimidin Ribonükleotitlerin Sentezi Pirimidinlerin biyosentezi pürinlerinkinden daha basit bir işlemdir ve çeşitli teknikler yardımıyla sistemin üyesi olan atomların kaynaklandığı moleküller belirlenmiştir. Bu çalışmalarda, pirimidin halkasının N(l), (4), (5) ve (6) atomlarının aspartik asit, N(3) atomunun glutamin ve (2) atomunun da bikarbonattan kaynaklandığı tespit edilmiştir (Şekil ). Şekil Pirimidin biyosentezinin karbon ve azot kaynakları 239
247 Pürin biyosentezinin aksine pirimidin halkası sentezlendikten sonra riboz-5-fosfata katılır. Bu şekilde, UMP biyosentezinin 6- basamaklı bir yolla gerçekleştiği ortaya konmuştur. Pirimidin biyosentezinin ilk basamağında, sitozolik bir enzim olan karbamoil fosfat sentetaz II enzimi yardımıyla bikarbonat ve glutaminden karbamoil fosfat sentezlenir ve böylece bir nevi aktive edilmiş olur. Aspartat transkarbomilaz enzminin de etkisiyle oluşturulan karbamoil fosfat aspartat ile reaksiyona girerek karbamoil aspartat oluşur ki bu basamak UMP sentezinin akışını sağlar. Takiben karbamoil aspartat dihidroorotata ve bu molekül de dihidroorotat dehidrojenaz enzimi ile dönüşümsüz olarak orotata yükseltgenir (Şekil ). Şekil Pirimidin biyosentezi ve oratat oluşumu 240
248 luşturulan orotat, fosforibozilpirofosfat ile ve orotat fosforibozil transferaz ile katalizlenen bir işlem yoluyla orotidin-5'- monofosfata dönüştürülür ve bu bileşiğin orotidin monofosfat dekarboksilaz enzimi ile ve bir kofaktör gerektirmeksizin dekarboksillenmesi sonucu UMP sentezi tamamlanmış olur (Şekil ). Şekil Pirimidin biyosentezi ve UMP oluşumu 241
249 luşturulan UMP tan UDP ve UTP ların oluşturulmaları nükleozit monofosfat kinaz ve nükleozit difosfat kinaz enzimleri aracılığıyla gerçekleşir. Sitidin trifosfat ise TP sentaz ile katalizlenen bir işlemle UTP nin aminlendirilmesi sonucu sentezlenir De Novo Pirimidin Nükleotit Biyosentezinin Regülasyonu Bakterilerde pirimidin biyosentezi esasen aspartat transkarbomilaz reaksiyonunda regüle edilir. Bu enzimin uyarılması allosterik olarak ve ATP ile sağlanır inhibisyonu ise yine allosterizm ile ancak TP tarafından gerçekleştirilir (Şekil A). Ancak bazı bakterilerde aspartat transkarbomilaz inhibitörü UTP dir. 242
250 Şekil A. Prokaryotlarda pirimidin biyosentezi Şekil B. Ökaryotlarda pirimidin Biyosentezi İnsan ve hayvanlarda ise pirimidin biyosentezi, karbamoil fosfat sentetaz II' ın aktivitesinin kontrolü ile gerçekleştirilir. Bu enzimin aktivitesinin inhibisyonu UDP ve UTP ile sağlanırken aktivasyonu ATP ve FRPF ile sağlanır (Şekil B). Buraya kadar izah edilen işlemlerle 4 temel ribonükleotitin biyosentezinden bahsedilmiştir. Deoksiribonükleik asit yapısına katılan nükleotitler riboz birimlerinden ziyade deoksiriboz birimlerini içerirler. Dolayısıyla sentezlenen ribonükleotitlere karşılık gelen deoksiribonükleotitlerin üretilmesi, riboz biriminin 2'-grubunun indirgenmesi ile sağlanır ve bu işlem ribonükleotit redüktazlarla katalizlenir. 243
251 Böyle bir indirgenme reaksiyonu ile oluşturulan dndp moleküllerinin nükleozitdifosfat kinaz yardımıyla fosforillenmesi ile karşılık gelen deoksiribonükleozit trifosfatlar (dntp) sentezlenir. RNA moleküllerinden farklı olarak DNA molekülleri urasil bazı yerine timin (5-metil urasil) bazım içerirler. Bu bazı içeren nükleotitin (dtmp) sentezi dump nin timidilat sentaz yardımıyla metillendirilmesi ile sağlanır. Yaklaşık 70 kda moleküler ağırlığa sahip olan bu enzim bir metil grubu salıcısı olarak N 5,N 10 -metilentetrahidrofolat adlı bir kofaktörü içerir. Bu enzim, tetrahidrofolatı dihidrofolata yükseltgemesi yönüyle ilginçtir ve bu olay da biyokimyasal olaylarda az görülen yegane bir işlem olarak kabul edilir. DNA ve RNA yapısına katılan bu nükleotitler yanında oldukça önemli biyokimyasal fonksiyonları ile NAD, NADP, FMN, FAD ve koenzim A gibi nükleotit birimleri içeren nükleotit koenzimlerin sentezi, insan ve hayvanlarda çeşitli vitamin ön moleküllerinden başlanarak gerçekleştirilir. Bu koenzimlerin oluşturulmasında kullanılan nikotin amit, riboflavin ve pantotenat gibi vitaminler ise bitki ve bakteriler tarafından baştan sona (de novo) sentezlenirler Salvaj Yolu ile Pirimidin Nükleotidlerinin Sentezi Salvaj yolu ile pirimidin nükleotidlerinin sentezi diğer yönteme göre daha az enerji gerektirir. Gelişmiş canlılarda ve insanda önemi az olan bu yolun mikroorganizmalarda aktif 244
252 olduğu bilinmektedir. Yıkım yoluna giren pirimidin nükleozit trifosfatlar önce nükleozitlerine, sonra azotlu bazlarına ayrılır. Atılım ürünlerine dönüşmeden önce azotlu bazlar veya nükleozitler iki farklı yolla yeniden pirimidin nükleotid sentezinde kullanılır. Birinci yolda, urasilin FRPF ile birleşmesiyle, ikinci yolda ise üridin, sitidin ve timidin nükleozidlerinin fosforillenmesiyle sentez tamamlanır. Üridin ve sitidin ribonükleozidleri üridin-sitidin kinaz ile; dezoksiribonükleozid olan timidin spesifik timidin kinaz ile nükleotidlerine çevrilir. 2'-deoksisitidin, özgünlüğü zayıf olan ve deoksipürin nükleozidlerini de fosforilleyen deoksisitidin kinazı kullanır (Şekil ). Şekil Pirimidin nükleotidlerinin salvaj yolu reaksiyonları ile sentezi NÜKLETİD METABLİZMASINDAKİ KALITSAL BZUKLUKLAR Pürin Metabolizmasındaki Kalıtsal Bozukluklar Kalıtsal olarak adenozin deaminaz ve pürin nükleozid fosforilaz enzimlerinin aktivitelerinin eksikliği, insanda immün sistem yetersizliğine yol açar. Adenozin deaminaz (ADA) eksikliği: Bu otozomal resesif hastalıkta timus kökenli T lenfositler ve kemik iliğinden türeyen B lenfositler az sayıda ve immün fonksiyonları yetersizdir. Pürin nükleotidlerinin katabolizmasında görev yapan adenozin deaminaz eksikliğine bağlı olarak hücre içi datp konsantrasyonu 100 kat artar. Ribonükleotid redüktazın her iki düzenleyici bölgesine bağlanan datp, enzimi kuvvetle inhibe eder. Bu enzimin inhibisyonuyla T lenfositlerdeki diğer deoksiribonükleozid trifosfatların oluşumu durur ve dolayısıyla DNA sentezi azalır. Ancak B lenfositlerin hangi yolla etkilendiği açık değildir. 245
253 Adenozin deaminaz eksikliği olan kişilerin immün sistem yetersizliği nedeniyle steril ortamda yaşamaları gerekmektedir. Pürin nükleozid fosforilaz eksikliği: Bu hastalıkta B lenfositlerin fonksiyonu normal, T lenfositlerin fonksiyonu bozuktur. Pürin nükleozid fosforilaz eksikliğine bağlı olarak pürin nükleotid katabolizması azalmıştır. Buna bağlı olarak ürik asit sentezi azalmış, pürin nükleozidlerinin (guanozin, deoksiguanozin, inozin, deoksiinozin) düzeyleri artmıştır. Ribonükleotid redüktazı allosterik olarak inhibe eden, böylece hücrede DNA sentezini engelleyen dgtp ve datp' nin birikimi sonucunda immün sistemde bozukluklar meydana gelir. ipoürisemiler: Pürin yıkımı sırasında ürik asit oluşumunun azalmasına bağlı olarak görülmektedir. Ağır karaciğer hasarında veya kalıtsal ksantin oksidaz eksikliğinde gelişen hipoürisemide hipoksantin ve ksantin oluşumu artar ve bu maddeler idrarla atılır (ksantinüri). Ağır ksantin oksidaz eksikliğinde böbrekte ksantin taşları oluşur Pirimidin Metabolizmasındaki Kalıtsal Bozukluklar Pürin katabolizmasından farklı olarak pirimidin katabolizması ürünlerinin çözünürlüğü yüksektir. Böylece aşırı pirimidin sentezinin meydana geldiği durumlarda bile bozukluklar oldukça nadir görülmektedir. Pirimidin metabolizması bozukluklarının en önemlisi orotik asitüridir. Tip I orotik asitüride hem orotat fosforibozil transferaz, hem de orotidilat dekarboksilaz aktivitelerinde defekt vardır. Tip I' e göre daha seyrek olan tip II formunda sadece orotidilat dekarboksilaz aktivitesi eksiktir. astalara gerekli olan pirimidin nükleotidlerinden üridin ve sitidin verilmesi karbamoil fosfat sentetaz II yi feed-back inhibisyona uğratmakta ve orotik asit oluşumu azalmaktadır PÜRİN VE PİRİMİDİN NÜKLETİTLERİNİN SENTEZİNİN EKZJEN MADDELERLE İNİBİSYNU Kanser hücrelerinin normal hücrelere göre çok daha hızlı büyümeleri, DNA ve RNA sentezi için daha fazla nükleotidin oluşumuyla gerçekleşmektedir. Bu nedenle kanser tedavisinde de novo pürin ve pirimidin nükleotid sentezini engelleyen bileşiklerin bulunması için pek çok araştırma yapılmıştır. Kanser tedavisinde kullanılan azaserin ve asivisin, glutamin analogları olarak pürin ve pirimidin sentezinde glutaminin girdiği reaksiyonları inhibe eder. Aminopterin ve metotreksat (ametopterin), dihidrofolat redüktaz inhibitörü olarak bir çok kanser türünde tedavi amacıyla 246
254 kullanılmaktadır. Tetrahidrofolat yeniden oluşamayınca timidilat sentazın katalizlediği reaksiyon durur. Bu şekilde DNA ve RNA sentezi önlenerek hücre çoğalması yavaşlatılabilir. 5-fluoroürasil, timidilat sentaz inhibitörü olarak tedavide kullanılmaktadır (Şekil ). 5-fluoroürasil hücrelerde fluorodeoksiüridin monofosfata (f-dump) dönüşür ve dump analogu olarak timidilat sentazı yarışmalı inhibisyona uğratır. Antikarsinojenik ilaçlar özellikle fetus, kemik iliği, deri, gastrointestinal yollar, saç folikülleri gibi hızla büyüyen hücrelerle birlikte normal hücreleri de etkilediğinden bu ilâçları kullanan kişilerde anemi, pullu-kepekli deri, saç dökülmesi görülür. Şekil dump' den TMP sentezi ve inhibitörlerin etki ettiği reaksiyonlar DEKSİRİBNÜKLETİTLERİN SENTEZİ DNA' daki şeker deoksiriboz olduğundan DNA sentezinde kullanılacak nükleotidlerde ribozun 2. karbonundaki hidroksil grubunun indirgenmesi gerekir. Bu reaksiyon, ribonükleotid redüktaz kataliziyle gerçekleşir (Şekil ). Substrat olarak nükleozid difosfatlann 247
255 kullanıldığı bu reaksiyonda ribonükleotid redüktazın yapısındaki -S grupları yükseltgenirken nükleozitteki riboz indirgenir. Böylece ADP, GDP, DP ve UDP' den dadp, dgdp, ddp ve dudp sentez edilir. dudp ve ddp daha sonra timidilat sentezinde kullanılır. ksitlenmiş enzimin tekrar aktif hale geçebilmesi, NADP' dan hidrojen aktarılmasıyla yapılır. Bu aktarım, aracı bir proteinin (tiyoredoksin veya glutaredoksin) ve ikinci bir enzimin (tiyoredoksin redüktaz veya glutaredoksin redüktaz) kullanıldığı bir sistemle gerçekleştirilir. Aracı protein tiyoredoksinin (glutaredoksinin) iki sülfidril grubundaki hidrojen atomları, yükseltgenmiş ribonükleotid redüktazın disülfit bağına aktarılarak enzim rejenerasyonu tamamlanır. ksitlenmiş olan tiyoredoksinin (glutaredoksinin) indirgenmesi ise ikinci enzim tarafından gerçekleştirilir. Bir flavoprotein olan tiyoredoksin redüktaz, NADP' dan aldığı indirgeme ekivalanlarını prostetik grubunu oluşturan FAD aracılığıyla tiyoredoksine aktarır. Glutaredoksin redüktaz ise, glutatyonu oksitlemek suretiyle glutaredoksini indiıgemektedir (Şekil ). Ancak glutatyonun rejenerasyonu, koenzimi NADP olan glutatyon redüktaz tarafından yapıldığından indirgeyici son kaynak bu yolda da NADP' tır. Kısaca tiyoredoksin (veya glutaredoksin) sisteminde, ribonükleotidlerin yapısındaki ribozun indirgenmesinde NADP' dan ribonükleotid redüktaza aktarılan hidrojen atomları kullanılmaktadır. Şekil Deoksiribonükleozit difosfat sentezi 248
256 Şekil Ribonükleotidlerin deoksiribonükleotidlere dönüşüm mekanizması. (1)Ribozun deoksiriboza ribonükleotid redüktazla indirgenmesi; (2) Ribonükleotid redüktazın disülfit bağının (a) tiyoredoksin ile, (b) glutaredoksin ile indirgenmesi Deoksiribonükleotid Sentezinin Düzenlenmesi Tetramerik ribonükleotid redüktaz, ikişer tane B1 ve B2 altbirimlerinden oluşur. Bj altbirimleri ribozun indirgenmesinde rol oynayan sülfıdril gruplarını, B2 altbirimleri serbest radikal oluşturan tirozin ve Fe 3+ içermektedir. Enzimin yapısındaki Fe 3+, tirozil radikalinin oluşması ve stabil halde tutulmasında etkilidir. Ribonükleotid redüktaz, yapısında bir radikal bulunan ve katalitik aktivitesi sırasında bu radikali geçici olarak substratına aktaran bir enzimdir. Bu mekanizma şu şekilde işlemektedir. a) Enzimin katalitik bölgesinden uzakta bulunan tirozil radikali, tek elektronunu aktif bölgede yer alan amino asite (muhtemelen sistein) aktarır. Enzim substratla bağlanmamış halde iken aktif bölgesinden uzağında tirozil radikali, enzim-substrat kompleksinde ise enzimin aktif bölgesinde tiyil radikali (S ) bulunur. b) Tiyil radikalindeki tek elektron, substratın riboz halkasındaki 3. karbona aktarılarak substrat radikal haline dönüştürülür. Bu aşamadaki amaç, ribozun 2. karbonu enzim tarafından indirgenirken oluşan pozitif yükün radikalle dengelenmesidir. c) İkinci karbonundan indirgenmesi tamamlanan substratın 3. karbonundaki radikal (tek elektron), önce aktif bölgedeki sisteine, daha sonra tirozine aktarılır. Ribonükleotid redüktazın Bı altbiriminde modülatörlerin bağlandığı primer düzenleyici bölge, aktivitenin kontrolünden başlıca sorumlu olan yerdir. Substrat-spesifik bölge ise 249
257 buraya bağlanan düzenleyici substratların (allosterik; effektör) türüne göre etkilenmektedir. Enzimin gerçek substratları, B1 ve B2 altbirimleri arasındaki boşluğa yerleşir (Şekil ). Şekil Ribonükleotid redüktaz yapısı. Primer düzenleyici bölge ve substrat spesifik spesifik bölgeye allosterik effektörler (dntp ve NTP ler) bağlanır. Deoksiribonükleotid sentezinin düzenlenmesinde görevli nükleotidler üç grupta toplanır: 1. Pürinli ribonükleotidler: ATP 2. Pürinli deoksiribonükleotidler: datp, dgtp 3. Pirimidinli deoksiribonükleotidler: ddp, dudp, TTP ATP ve datp, hem primer düzenleyici bölgeye, hem de substrat-spesifık bölgeye bağlanır. ATP düzenleyici bölgeye bağlandığında deoksiribonükleozid difosfat sentezi artmakta, datp bağlandığında inhibe olmaktadır. Substrat-spesifik bölgeye bağlanan ATP veya datp, pirimidin deoksinükleotidlerinin (ddp ve dudp) sentezini arttırır. Substratspesifik bölgeye bağlanan TTP, kendi benzerlerinin (ddp ve dudp) sentezini inhibe ederken dgdp sentezini uyarır. Substrat spesifik bölgeye bağlanan dgtp ise, kendi oluşumuna giden dgdp senteziyle birlikte (negatif feed-back) pirimidin deoksinükleotid sentezini (ddp, dudp) de azaltmakta, dadp sentezini ise arttırmaktadır (Şekil ). Bu düzenleme ile DNA sentezi için gerekli deoksiribonükleotidlerin sentezi ve dolayısıyla birbirlerine oranları dengelenmektedir. 250
258 Şekil NTP ve dntp ler tarafından nükleotit redüktaz aktivitesinin düzenlenmesi 251
Prof. Dr. Şule PEKYARDIMCI
 13. Hafta: Vitaminler ve Koenzimler: Vitamin tanımı, vitaminlerin görevleri, vitaminlerin sınıflandırılmaları, koenzim tanımı, önemli vitaminler, suda çözünen vitaminler, yağda çözünen vitaminler, vitaminlerin
13. Hafta: Vitaminler ve Koenzimler: Vitamin tanımı, vitaminlerin görevleri, vitaminlerin sınıflandırılmaları, koenzim tanımı, önemli vitaminler, suda çözünen vitaminler, yağda çözünen vitaminler, vitaminlerin
14. Hafta: Prof. Dr. Şule PEKYARDIMCI Biyotin (B7 Vitamini) Biyotin Siyanokobalamin (B12 Vitamini)
 14. Hafta: Vitaminler ve Koenzimler: Vitamin tanımı, vitaminlerin görevleri, vitaminlerin sınıflandırılmaları, koenzim tanımı, önemli vitaminler, suda çözünen vitaminler, yağda çözünen vitaminler, vitaminlerin
14. Hafta: Vitaminler ve Koenzimler: Vitamin tanımı, vitaminlerin görevleri, vitaminlerin sınıflandırılmaları, koenzim tanımı, önemli vitaminler, suda çözünen vitaminler, yağda çözünen vitaminler, vitaminlerin
Suda eriyen vitaminler Organizma için fazla olanı atılır Yağda eriyen vitaminler Depo edilir.
 VİTAMİNLER Hücrelerin normal metabolizması için gerekli organik maddelerdir. Organizmaya doğal besin kaynaklarından alınırlar. Vitaminlerin besin maddesi ve farmakolojik madde olarak iki farklı görevi
VİTAMİNLER Hücrelerin normal metabolizması için gerekli organik maddelerdir. Organizmaya doğal besin kaynaklarından alınırlar. Vitaminlerin besin maddesi ve farmakolojik madde olarak iki farklı görevi
Normal büyüme ve gelişme için mutlaka gereklidirler Farklı biyokimyasal işlevler için gereklidirler (koenzim) Genellikle vücut tarafından sentez
 VİTAMİNLER Normal büyüme ve gelişme için mutlaka gereklidirler Farklı biyokimyasal işlevler için gereklidirler (koenzim) Genellikle vücut tarafından sentez edilemediği için diyetle alınmaları zorunludur
VİTAMİNLER Normal büyüme ve gelişme için mutlaka gereklidirler Farklı biyokimyasal işlevler için gereklidirler (koenzim) Genellikle vücut tarafından sentez edilemediği için diyetle alınmaları zorunludur
LİPİTLERİN ORGANİZMADAKİ GÖREVLERİ SAFRA ASİTLERİ
 8. Hafta: Lipit Metabolizması: Prof. Dr. Şule PEKYARDIMCI LİPİTLERİN ORGANİZMADAKİ GÖREVLERİ 1. Yapısal fonksiyon görevi: Lipitler fosfolipitler başta olmak üzere hücre ve organel zarlarının yapısına girer
8. Hafta: Lipit Metabolizması: Prof. Dr. Şule PEKYARDIMCI LİPİTLERİN ORGANİZMADAKİ GÖREVLERİ 1. Yapısal fonksiyon görevi: Lipitler fosfolipitler başta olmak üzere hücre ve organel zarlarının yapısına girer
Hücrelerde gerçekleşen yapım, yıkım ve dönüşüm olaylarının bütününe metabolizma denir.
 METABOLİZMA ve ENZİMLER METABOLİZMA Hücrelerde gerçekleşen yapım, yıkım ve dönüşüm olaylarının bütününe metabolizma denir. A. ÖZÜMLEME (ANABOLİZMA) Metabolizmanın yapım reaksiyonlarıdır. Bu tür olaylara
METABOLİZMA ve ENZİMLER METABOLİZMA Hücrelerde gerçekleşen yapım, yıkım ve dönüşüm olaylarının bütününe metabolizma denir. A. ÖZÜMLEME (ANABOLİZMA) Metabolizmanın yapım reaksiyonlarıdır. Bu tür olaylara
M. (arpa şekeri) +su S (çay şekeri) + su L.. (süt şekeri)+ su
 KARBONHİDRATLAR Karbonhidratlar yapılarında.. (C),.. (H) ve. (O) atomu bulunduran organik bileşiklerdir. Karbonhidratların formülü ( ) ile gösterilir. Nükleik asitlerin, ATP nin, hücre, bitkilerde yapısına
KARBONHİDRATLAR Karbonhidratlar yapılarında.. (C),.. (H) ve. (O) atomu bulunduran organik bileşiklerdir. Karbonhidratların formülü ( ) ile gösterilir. Nükleik asitlerin, ATP nin, hücre, bitkilerde yapısına
TEST 1. Hücre Solunumu. 4. Aşağıda verilen moleküllerden hangisi oksijenli solunumda substrat olarak kullanılamaz? A) Glikoz B) Mineral C) Yağ asidi
 1. Termometre Çimlenen bezelye tohumlar Termos Çimlenen bezelye tohumları oksijenli solunum yaptığına göre yukarıdaki düzenekle ilgili, I. Termostaki oksijen miktarı azalır. II. Termometredeki sıcaklık
1. Termometre Çimlenen bezelye tohumlar Termos Çimlenen bezelye tohumları oksijenli solunum yaptığına göre yukarıdaki düzenekle ilgili, I. Termostaki oksijen miktarı azalır. II. Termometredeki sıcaklık
Akıllı Defter. 9.Sınıf Biyoloji. vitaminler,hormonlar,nükleik asitler. sembole tıklayınca etkinlik açılır. sembole tıklayınca ppt sunumu açılır
 9.Sınıf Biyoloji 1 Akıllı Defter vitaminler,hormonlar,nükleik asitler sembole tıklayınca etkinlik açılır sembole tıklayınca ppt sunumu açılır sembole tıklayınca video açılır 1 VİTAMİNLER ***Vitaminler:
9.Sınıf Biyoloji 1 Akıllı Defter vitaminler,hormonlar,nükleik asitler sembole tıklayınca etkinlik açılır sembole tıklayınca ppt sunumu açılır sembole tıklayınca video açılır 1 VİTAMİNLER ***Vitaminler:
OKSİJENLİ SOLUNUM
 1 ----------------------- OKSİJENLİ SOLUNUM ----------------------- **Oksijenli solunum (aerobik): Besinlerin, oksijen yardımıyla parçalanarak, ATP sentezlenmesine oksijenli solunum denir. Enzim C 6 H
1 ----------------------- OKSİJENLİ SOLUNUM ----------------------- **Oksijenli solunum (aerobik): Besinlerin, oksijen yardımıyla parçalanarak, ATP sentezlenmesine oksijenli solunum denir. Enzim C 6 H
DOYMAMIŞ YAĞ ASİTLERİNİN OLUŞMASI TRİGLİSERİTLERİN SENTEZİ
 9. Hafta: Lipit Metabolizması: Prof. Dr. Şule PEKYARDIMCI DOYMAMIŞ YAĞ ASİTLERİNİN OLUŞMASI Palmitoleik ve oleik asitlerin sentezi için palmitik ve stearik asitler hayvansal organizmalardaki çıkş maddeleridir.
9. Hafta: Lipit Metabolizması: Prof. Dr. Şule PEKYARDIMCI DOYMAMIŞ YAĞ ASİTLERİNİN OLUŞMASI Palmitoleik ve oleik asitlerin sentezi için palmitik ve stearik asitler hayvansal organizmalardaki çıkş maddeleridir.
Vitaminler organik maddeler
 Vitaminler Vitaminler sağlıklı beslenme için küçük miktarlarda alınmaları zorunlu olan, herhangi birinin eksikliği spesifik bir bozukluk ve hastalık meydana getiren organik maddeler Vitaminlerin sınıflandırılmaları
Vitaminler Vitaminler sağlıklı beslenme için küçük miktarlarda alınmaları zorunlu olan, herhangi birinin eksikliği spesifik bir bozukluk ve hastalık meydana getiren organik maddeler Vitaminlerin sınıflandırılmaları
Yağ Asitlerinin β Oksidayonu. Prof. Dr. Fidancı
 Yağ Asitlerinin β Oksidayonu Prof. Dr. Fidancı Yağ Asitlerinin Beta Oksidasyonu Yağ asitlerinin enerji üretimi amacı ile yıkımında (yükseltgenme) en önemli yol β oksidasyon yoldudur. β oksidasyon yolu
Yağ Asitlerinin β Oksidayonu Prof. Dr. Fidancı Yağ Asitlerinin Beta Oksidasyonu Yağ asitlerinin enerji üretimi amacı ile yıkımında (yükseltgenme) en önemli yol β oksidasyon yoldudur. β oksidasyon yolu
21.11.2008. I. Koenzim A nedir? II. Tarihsel Bakış III. Koenzim A nın yapısı IV. Asetil-CoA nedir? V. Koenzim A nın katıldığı reaksiyonlar VI.
 Hazırlayan: Sibel ÖCAL 0501150027 I. Koenzim A nedir? II. Tarihsel Bakış III. Koenzim A nın yapısı IV. Asetil-CoA nedir? V. Koenzim A nın katıldığı reaksiyonlar VI. Eksikliği 1 2 Pantotenik asit (Vitamin
Hazırlayan: Sibel ÖCAL 0501150027 I. Koenzim A nedir? II. Tarihsel Bakış III. Koenzim A nın yapısı IV. Asetil-CoA nedir? V. Koenzim A nın katıldığı reaksiyonlar VI. Eksikliği 1 2 Pantotenik asit (Vitamin
2) Kolekalsiferol (D 3)
 Sunum İçeriği Öğretim Görevlisi :Yrd.Doç.Dr.Bekir ÇÖL Hazırlayan ve Sunan : Fulya ÇELEBİ Konu : D Vitamini 31/10/2008 D vitamini formları kaynaklarına genel bakış Deride ve vücutta D vitamini sentezi İnce
Sunum İçeriği Öğretim Görevlisi :Yrd.Doç.Dr.Bekir ÇÖL Hazırlayan ve Sunan : Fulya ÇELEBİ Konu : D Vitamini 31/10/2008 D vitamini formları kaynaklarına genel bakış Deride ve vücutta D vitamini sentezi İnce
Hücre zarının yapısındaki yağlardan eriyerek hücre zarından geçerler.fazlalıkları karaciğerde depo edilir.
 DERS: BİYOLOJİ KONU: C.T.B(Vitaminler e Nükleik Asitler) VİTAMİNLER Bitkiler ihtiyaç duydukları bütün vitaminleri üretip, insanlar ise bir kısmını hazır alır. Özellikleri: Yapıcı, onarıcı, düzenleyicidirler.
DERS: BİYOLOJİ KONU: C.T.B(Vitaminler e Nükleik Asitler) VİTAMİNLER Bitkiler ihtiyaç duydukları bütün vitaminleri üretip, insanlar ise bir kısmını hazır alır. Özellikleri: Yapıcı, onarıcı, düzenleyicidirler.
Metabolizma. Metabolizmaya giriş. Metabolizmaya giriş. Metabolizmayı tanımlayacak olursak
 Metabolizma Yaşamak için beslenmek zorundayız. Çünkü; Besinlerden enerji elde ederiz ve bu enerji; Hücresel faaliyetleri sürdürmemiz, Hareket etmemiz, Taşınım olaylarını gerçekleştirebilmemiz, Vücut sıcaklığını
Metabolizma Yaşamak için beslenmek zorundayız. Çünkü; Besinlerden enerji elde ederiz ve bu enerji; Hücresel faaliyetleri sürdürmemiz, Hareket etmemiz, Taşınım olaylarını gerçekleştirebilmemiz, Vücut sıcaklığını
ĐÇERĐK. Vitamin B6 Formları. LOGO www.themegallery.com. Tarihsel Bakış. Yapısal Formüller. 4 Piridoksin Piridoksal Piridoksamin Piridoksal-fosfat
 LOGO ĐÇERĐK Tarihsel Bakış B6 Vitamininin Genel Özellikleri Kimyasal Ve Biyolojik Fonksiyonları Biyokimyasal Fonksiyonları YRD. DOÇ. DR. BEKİR ÇÖL SUNAN: DUYGU BAHÇE Emilim, Transport ve Metabolizma İmmün
LOGO ĐÇERĐK Tarihsel Bakış B6 Vitamininin Genel Özellikleri Kimyasal Ve Biyolojik Fonksiyonları Biyokimyasal Fonksiyonları YRD. DOÇ. DR. BEKİR ÇÖL SUNAN: DUYGU BAHÇE Emilim, Transport ve Metabolizma İmmün
BİYOİNORGANİK KİMYA 5. HAFTA
 BİYOİNORGANİK KİMYA 5. HAFTA ESER ELEMENTLER İnsan vücudunda en yüksek oranda bulunan element oksijendir. İkincisi ise karbondur. İnsan vücudunun kütlesinin %99 u sadece 6 elementten meydana gelir. Bunlar:
BİYOİNORGANİK KİMYA 5. HAFTA ESER ELEMENTLER İnsan vücudunda en yüksek oranda bulunan element oksijendir. İkincisi ise karbondur. İnsan vücudunun kütlesinin %99 u sadece 6 elementten meydana gelir. Bunlar:
Can boğazdan gelir.. Deveyi yardan uçuran bir tutam ottur..
 Can boğazdan gelir.. Deveyi yardan uçuran bir tutam ottur.. 1 BESLENME BİLİMİ 2 Yaşamımız süresince yaklaşık 60 ton besin tüketiyoruz. Besinler sağlığımız ve canlılığımızın devamını sağlar. Sağlıklı bir
Can boğazdan gelir.. Deveyi yardan uçuran bir tutam ottur.. 1 BESLENME BİLİMİ 2 Yaşamımız süresince yaklaşık 60 ton besin tüketiyoruz. Besinler sağlığımız ve canlılığımızın devamını sağlar. Sağlıklı bir
Yağ Asitlerinin Metabolizması- I Yağ Asitlerinin Yıkılması (Oksidasyonu)
 Yağ Asitlerinin Metabolizması- I Yağ Asitlerinin Yıkılması (Oksidasyonu) Yrd. Doç. Dr. Bekir Engin Eser Zirve Üniversitesi EBN Tıp Fakültesi Tıbbi Biyokimya A.B.D. Yağ Asitleri Uzun karbon zincirine sahip
Yağ Asitlerinin Metabolizması- I Yağ Asitlerinin Yıkılması (Oksidasyonu) Yrd. Doç. Dr. Bekir Engin Eser Zirve Üniversitesi EBN Tıp Fakültesi Tıbbi Biyokimya A.B.D. Yağ Asitleri Uzun karbon zincirine sahip
Canlılarda Enerjitik Olaylar, Fotosentez ve Kemosentez, Aerobik Solunum ve Fermantasyon
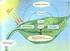 Canlılarda Enerjitik Olaylar, Fotosentez ve Kemosentez, Aerobik Solunum ve Fermantasyon SOLUNUM İki çeşit solunum vardır HÜCRE DIŞI SOLUNUM: Canlıların dış ortamdan O 2 alıp, dış ortama
Canlılarda Enerjitik Olaylar, Fotosentez ve Kemosentez, Aerobik Solunum ve Fermantasyon SOLUNUM İki çeşit solunum vardır HÜCRE DIŞI SOLUNUM: Canlıların dış ortamdan O 2 alıp, dış ortama
Vitaminlerin Sınıflandırılması. Vitaminler. Suda Çözünen Vitaminler. Yağda Çözünen Vitaminler. C ve B vitaminleri. A,D,K,E vitaminleri
 VİTAMİNLER Vitaminler, normal büyüme ve yaşamın sürdürülebilmesi için gıdalarla dışardan alınması zorunlu olan bileşiklerdir. Her vitaminin vücutta belirli ve kendine özgü bir işlevi olduğundan, yiyeceklerle
VİTAMİNLER Vitaminler, normal büyüme ve yaşamın sürdürülebilmesi için gıdalarla dışardan alınması zorunlu olan bileşiklerdir. Her vitaminin vücutta belirli ve kendine özgü bir işlevi olduğundan, yiyeceklerle
Yağ Asitlerinin Biyosentezi. Prof. Dr. Fidancı
 Yağ Asitlerinin Biyosentezi Prof. Dr. Fidancı Yağ asitlerinin sentezi özellikle karaciğer ve yağ dokusu hücrelerinde iki şekilde gerçekleşir. Bu sentez şekillerinden biri yağ asitlerinin, hücrenin sitoplazma
Yağ Asitlerinin Biyosentezi Prof. Dr. Fidancı Yağ asitlerinin sentezi özellikle karaciğer ve yağ dokusu hücrelerinde iki şekilde gerçekleşir. Bu sentez şekillerinden biri yağ asitlerinin, hücrenin sitoplazma
Solunumda organik bileşikler karbondioksite yükseltgenir ve absorbe edilen oksijen ise suya indirgenir.
 Solunum bütün aktif hücrelerde oksijenin absorbe edilmesi ve buna eşdeğer miktarda karbondioksitin salınması şeklinde sürekli olarak devam eden bir prosestir. Solunumda organik bileşikler karbondioksite
Solunum bütün aktif hücrelerde oksijenin absorbe edilmesi ve buna eşdeğer miktarda karbondioksitin salınması şeklinde sürekli olarak devam eden bir prosestir. Solunumda organik bileşikler karbondioksite
ADIM ADIM YGS-LYS 14. ADIM CANLININ TEMEL BİLEŞENLERİ ORGANİK MADDELER 8- VİTAMİNLER
 ADIM ADIM YGS-LYS 14. ADIM CANLININ TEMEL BİLEŞENLERİ ORGANİK MADDELER 8- VİTAMİNLER 4) VİTAMİN Vücut metabolizması için gerekli olan ancak insan vücudunda üretilemeyen organik maddelerdir. Dışarıdan hazır
ADIM ADIM YGS-LYS 14. ADIM CANLININ TEMEL BİLEŞENLERİ ORGANİK MADDELER 8- VİTAMİNLER 4) VİTAMİN Vücut metabolizması için gerekli olan ancak insan vücudunda üretilemeyen organik maddelerdir. Dışarıdan hazır
C vitamini (Askorbik asit)
 C vitamini (Askorbik asit) C vitamini suda eriyen, kemik, diş ve damar sağlığını koruyan, çeşitli hastalıklara direnç kazandıran ve bazı besin ögelerinin vücutta kullanılmasına yardımcı bir vitamindir
C vitamini (Askorbik asit) C vitamini suda eriyen, kemik, diş ve damar sağlığını koruyan, çeşitli hastalıklara direnç kazandıran ve bazı besin ögelerinin vücutta kullanılmasına yardımcı bir vitamindir
Kloroform, eter ve benzen gibi organik çözücülerde çözünen bunun yanı sıra suda çözünmeyen veya çok az çözünen organik molekül grubudur.
 Kloroform, eter ve benzen gibi organik çözücülerde çözünen bunun yanı sıra suda çözünmeyen veya çok az çözünen organik molekül grubudur. Yağların suda çözünmemesi canlılığın devamı içi önemlidir. Çünkü
Kloroform, eter ve benzen gibi organik çözücülerde çözünen bunun yanı sıra suda çözünmeyen veya çok az çözünen organik molekül grubudur. Yağların suda çözünmemesi canlılığın devamı içi önemlidir. Çünkü
Hücre solunumu ve fermentasyon enerji veren katabolik yollardır. (ΔG=-686 kcal/mol)
 hücre solunumu Hücre solunumu ve fermentasyon enerji veren katabolik yollardır. (ΔG=-686 kcal/mol) C 6 H 12 O 6 + 6 O 2 6 CO 2 + 6 H 2 0 + enerji (ATP + ısı) Hücre solunumu karbonhidratlar, yağlar ve protein
hücre solunumu Hücre solunumu ve fermentasyon enerji veren katabolik yollardır. (ΔG=-686 kcal/mol) C 6 H 12 O 6 + 6 O 2 6 CO 2 + 6 H 2 0 + enerji (ATP + ısı) Hücre solunumu karbonhidratlar, yağlar ve protein
Kolesterol Metabolizması. Yrd. Doç. Dr. Bekir Engin Eser Zirve Üniversitesi EBN Tıp Fakültesi Tıbbi Biyokimya A.B.D.
 Kolesterol Metabolizması Yrd. Doç. Dr. Bekir Engin Eser Zirve Üniversitesi EBN Tıp Fakültesi Tıbbi Biyokimya A.B.D. Steroidler Steroidlerin yapı taşı birbirine yapışık 4 halkalı karbon iskelehdir, bu yapı
Kolesterol Metabolizması Yrd. Doç. Dr. Bekir Engin Eser Zirve Üniversitesi EBN Tıp Fakültesi Tıbbi Biyokimya A.B.D. Steroidler Steroidlerin yapı taşı birbirine yapışık 4 halkalı karbon iskelehdir, bu yapı
ÜNİTE 8 Vitaminler. Amaçlar. İçindekiler. Öneriler
 ÜNİTE 8 Vitaminler Amaçlar Bu üniteyi çalıştıktan sonra; Vitaminlerin genel özelliklerini ve sınıflandırılmasını, Vitaminlerin hangi besin maddelerinde bulunduklarını, Organizmadaki görevlerini, Yetersizliklerinde
ÜNİTE 8 Vitaminler Amaçlar Bu üniteyi çalıştıktan sonra; Vitaminlerin genel özelliklerini ve sınıflandırılmasını, Vitaminlerin hangi besin maddelerinde bulunduklarını, Organizmadaki görevlerini, Yetersizliklerinde
Hücre Solunumu: Kimyasal Enerji Eldesi
 Hücre Solunumu: Kimyasal Enerji Eldesi Hücre solunumu ve fermentasyon enerji veren katabolik yollardır. Organik moleküllerin atomları enerji depolamaya müsaittir. Hücreler enzimler aracılığı ile organik
Hücre Solunumu: Kimyasal Enerji Eldesi Hücre solunumu ve fermentasyon enerji veren katabolik yollardır. Organik moleküllerin atomları enerji depolamaya müsaittir. Hücreler enzimler aracılığı ile organik
Sitrik Asit Döngüsü. (Trikarboksilik Asit Döngüsü, Krebs Döngüsü)
 Sitrik Asit Döngüsü (Trikarboksilik Asit Döngüsü, Krebs Döngüsü) Prof. Dr. İzzet Hamdi Öğüş hamdiogus@gmail.com Yakın Doğu Ünversitesi Tıp Fakültesi Tıbbi Biyokimya Anabilim Dalı, Le>oşa, KKTC Sir Hans
Sitrik Asit Döngüsü (Trikarboksilik Asit Döngüsü, Krebs Döngüsü) Prof. Dr. İzzet Hamdi Öğüş hamdiogus@gmail.com Yakın Doğu Ünversitesi Tıp Fakültesi Tıbbi Biyokimya Anabilim Dalı, Le>oşa, KKTC Sir Hans
Dr. Hülya ÇAKMAK Gıda Mühendisliği Bölümü ANTİOKSİDANLAR
 Dr. Hülya ÇAKMAK Gıda Mühendisliği Bölümü ANTİOKSİDANLAR ANTİOKSİDANLAR Aktif oksijen türevleri (ROS) normal metabolizma sırasında vücudumuzun ürettiği yan ürünlerdir. Ancak bazı dış kaynaklardan da serbest
Dr. Hülya ÇAKMAK Gıda Mühendisliği Bölümü ANTİOKSİDANLAR ANTİOKSİDANLAR Aktif oksijen türevleri (ROS) normal metabolizma sırasında vücudumuzun ürettiği yan ürünlerdir. Ancak bazı dış kaynaklardan da serbest
III-Hayatın Oluşturan Kimyasal Birimler
 III-Hayatın Oluşturan Kimyasal Birimler MBG 111 BİYOLOJİ I 3.1.Karbon:Biyolojik Moleküllerin İskeleti *Karbon bütün biyolojik moleküllerin omurgasıdır, çünkü dört kovalent bağ yapabilir ve uzun zincirler
III-Hayatın Oluşturan Kimyasal Birimler MBG 111 BİYOLOJİ I 3.1.Karbon:Biyolojik Moleküllerin İskeleti *Karbon bütün biyolojik moleküllerin omurgasıdır, çünkü dört kovalent bağ yapabilir ve uzun zincirler
İ. Ü İstanbul Tıp Fakültesi Tıbbi Biyoloji Anabilim Dalı Prof. Dr. Filiz Aydın
 İ. Ü İstanbul Tıp Fakültesi Tıbbi Biyoloji Anabilim Dalı Prof. Dr. Filiz Aydın Hücre iletişimi Tüm canlılar bulundukları çevreden sinyal alırlar ve yanıt verirler Bakteriler glukoz ve amino asit gibi besinlerin
İ. Ü İstanbul Tıp Fakültesi Tıbbi Biyoloji Anabilim Dalı Prof. Dr. Filiz Aydın Hücre iletişimi Tüm canlılar bulundukları çevreden sinyal alırlar ve yanıt verirler Bakteriler glukoz ve amino asit gibi besinlerin
Enzimlerin Yapısı. Enzimler biyokatalizörlerdir,
 Enzimler biyokatalizörlerdir,, Prof. Dr. Muhsin KONUK H 2 O 2 H 2 O + ½ O 2 A.E = 18.16 kkal/mol Kollaidal platin A.E= 11.71 kkal/mol Katalaz A.E = 1.91 kkal/mol Enzimlerin Yapısı Basit enzimler: Pepsin,
Enzimler biyokatalizörlerdir,, Prof. Dr. Muhsin KONUK H 2 O 2 H 2 O + ½ O 2 A.E = 18.16 kkal/mol Kollaidal platin A.E= 11.71 kkal/mol Katalaz A.E = 1.91 kkal/mol Enzimlerin Yapısı Basit enzimler: Pepsin,
ayxmaz/biyoloji Adı: 1.Aşağıda verilen atomların bağ yapma sayılarını (H) ekleyerek gösterin. C N O H
 Adı: 1.Aşağıda verilen atomların bağ yapma sayılarını (H) ekleyerek gösterin. C N O H 2.Radyoaktif izotoplar biyologları için önemlidir? Aşağıda radyoakif maddelerin kullanıldığı alanlar sıralanmıştır.bunlarla
Adı: 1.Aşağıda verilen atomların bağ yapma sayılarını (H) ekleyerek gösterin. C N O H 2.Radyoaktif izotoplar biyologları için önemlidir? Aşağıda radyoakif maddelerin kullanıldığı alanlar sıralanmıştır.bunlarla
BİY 315 Lipid Metabolizması-II. Yrd. Doç. Dr. Ebru SAATÇİ Güz Yarı Dönemi
 BİY 315 Lipid Metabolizması-II Yrd. Doç. Dr. Ebru SAATÇİ 2008-2009 Güz Yarı Dönemi Yağ Asidi Oksidasyonu Besinlerin sindirimi sonucu elde edilen yağlar, bağırsaktan geçerek lenf sistemine ulaşır ve bu
BİY 315 Lipid Metabolizması-II Yrd. Doç. Dr. Ebru SAATÇİ 2008-2009 Güz Yarı Dönemi Yağ Asidi Oksidasyonu Besinlerin sindirimi sonucu elde edilen yağlar, bağırsaktan geçerek lenf sistemine ulaşır ve bu
HÜCRE SOLUNUMU: KİMYASAL ENERJİ ELDESİ
 HÜCRE SOLUNUMU: KİMYASAL ENERJİ ELDESİ Güneş: Temel enerji kaynağı!!! Güneş ışığı bitkiler ve diğer organizmalar için temel enerji kaynağıdır. 2 Katabolik yollar Hücreler, enzimler aracılığı ile, potansiyel
HÜCRE SOLUNUMU: KİMYASAL ENERJİ ELDESİ Güneş: Temel enerji kaynağı!!! Güneş ışığı bitkiler ve diğer organizmalar için temel enerji kaynağıdır. 2 Katabolik yollar Hücreler, enzimler aracılığı ile, potansiyel
METABOLİZMA REAKSİYONLARI. Hazırlayanlar Prof. Dr. Ayşe CAN Prof.Dr. Nuriye AKEV
 METABOLİZMA REAKSİYONLARI Hazırlayanlar Prof. Dr. Ayşe CAN Prof.Dr. Nuriye AKEV METABOLİZMA Canlı sistemde maddelerin uğradığı kimyasal değişikliklerin hepsine birden metabolizma, bu değişiklikleri meydana
METABOLİZMA REAKSİYONLARI Hazırlayanlar Prof. Dr. Ayşe CAN Prof.Dr. Nuriye AKEV METABOLİZMA Canlı sistemde maddelerin uğradığı kimyasal değişikliklerin hepsine birden metabolizma, bu değişiklikleri meydana
DÖNEM II DERS YILI SİNDİRİM VE METABOLİZMA DERS KURULU ( 24 ARALIK MART 2019)
 2018-2019 DERS YILI SİNDİRİM VE METABOLİZMA DERS KURULU ( 24 ARALIK 2018 01 MART 2019) DERSLER TEORİK PRATİK TOPLAM Anatomi 26 5X2 36 Fizyoloji 22 4X2 30 Histoloji ve Embriyoloji 12 6X2 24 Tıbbi Biyokimya
2018-2019 DERS YILI SİNDİRİM VE METABOLİZMA DERS KURULU ( 24 ARALIK 2018 01 MART 2019) DERSLER TEORİK PRATİK TOPLAM Anatomi 26 5X2 36 Fizyoloji 22 4X2 30 Histoloji ve Embriyoloji 12 6X2 24 Tıbbi Biyokimya
Kolesterol Metabolizması. Prof. Dr. Fidancı
 Kolesterol Metabolizması Prof. Dr. Fidancı Kolesterol oldukça önemli bir biyolojik moleküldür. Membran yapısında önemli rol oynar. Steroid hormonların ve safra asitlerinin sentezinde öncül maddedir. Diyet
Kolesterol Metabolizması Prof. Dr. Fidancı Kolesterol oldukça önemli bir biyolojik moleküldür. Membran yapısında önemli rol oynar. Steroid hormonların ve safra asitlerinin sentezinde öncül maddedir. Diyet
Organik Bileşikler. Karbonhidratlar. Organik Bileşikler YGS Biyoloji 1
 Organik Bileşikler YGS Biyoloji 1 Hazırladığımız bu yazıda; organik bileşikler ve organik bileşiklerin yapısını, canlılarda bulunan organik bileşikleri ve bunların görevlerini, kullanım alanlarını, canlılar
Organik Bileşikler YGS Biyoloji 1 Hazırladığımız bu yazıda; organik bileşikler ve organik bileşiklerin yapısını, canlılarda bulunan organik bileşikleri ve bunların görevlerini, kullanım alanlarını, canlılar
2. Kanun- Enerji dönüşümü sırasında bir miktar kullanılabilir kullanılamayan enerji ısı olarak kaybolur.
 Enerji Dönüşümleri Enerji Enerji; bir maddeyi taşıma veya değiştirme kapasitesi anlamına gelir. Enerji : Enerji bir formdan diğerine dönüştürülebilir. Kimyasal enerji ;moleküllerinin kimyasal bağlarının
Enerji Dönüşümleri Enerji Enerji; bir maddeyi taşıma veya değiştirme kapasitesi anlamına gelir. Enerji : Enerji bir formdan diğerine dönüştürülebilir. Kimyasal enerji ;moleküllerinin kimyasal bağlarının
Canlıların yapısına en fazla oranda katılan organik molekül çeşididir. Deri, saç, tırnak, boynuz gibi oluşumların temel maddesi proteinlerdir.
 Canlıların yapısına en fazla oranda katılan organik molekül çeşididir. Deri, saç, tırnak, boynuz gibi oluşumların temel maddesi proteinlerdir. Proteinlerin yapısında; Karbon ( C ) Hidrojen ( H ) Oksijen
Canlıların yapısına en fazla oranda katılan organik molekül çeşididir. Deri, saç, tırnak, boynuz gibi oluşumların temel maddesi proteinlerdir. Proteinlerin yapısında; Karbon ( C ) Hidrojen ( H ) Oksijen
Canlının yapısında bulunan organik molekül grupları; o Karbonhidratlar o Yağlar o Proteinler o Enzimler o Vitaminler o Nükleik asitler ve o ATP
 Tamamı karbon ( C ) elementi taşıyan moleküllerden oluşan bir gruptur. Doğal organik bileşikler canlı vücudunda sentezlenir. Ancak günümüzde birçok organik bileşik ( vitamin, hormon, antibiyotik vb. )
Tamamı karbon ( C ) elementi taşıyan moleküllerden oluşan bir gruptur. Doğal organik bileşikler canlı vücudunda sentezlenir. Ancak günümüzde birçok organik bileşik ( vitamin, hormon, antibiyotik vb. )
DÖNEM II DERS YILI SİNDİRİM VE METABOLİZMA DERS KURULU ( 25 ARALIK 02 MART 2018)
 2017-2018 DERS YILI SİNDİRİM VE METABOLİZMA DERS KURULU ( 25 ARALIK 02 MART 2018) DERSLER TEORİK PRATİK TOPLAM Anatomi 26 5X2 31 Biyofizik 4-4 Fizyoloji 22 5X2 27 Histoloji ve Embriyoloji 12 6X2 18 Tıbbi
2017-2018 DERS YILI SİNDİRİM VE METABOLİZMA DERS KURULU ( 25 ARALIK 02 MART 2018) DERSLER TEORİK PRATİK TOPLAM Anatomi 26 5X2 31 Biyofizik 4-4 Fizyoloji 22 5X2 27 Histoloji ve Embriyoloji 12 6X2 18 Tıbbi
İstanbul Tıp Fakültesi Tıbbi Biyoloji ABD Prof. Dr. Filiz Aydın
 İstanbul Tıp Fakültesi Tıbbi Biyoloji ABD Prof. Dr. Filiz Aydın Mitokondri, ökaryotik organizmanın farklı bir organeli Şekilleri küremsi veya uzun silindirik Çapları 0.5-1 μm uzunlukları 2-6 μm Sayıları
İstanbul Tıp Fakültesi Tıbbi Biyoloji ABD Prof. Dr. Filiz Aydın Mitokondri, ökaryotik organizmanın farklı bir organeli Şekilleri küremsi veya uzun silindirik Çapları 0.5-1 μm uzunlukları 2-6 μm Sayıları
Vitaminlerin yararları nedendir?
 Vitaminlerin yararları nedendir? Vitamin ve mineraller vücudun normal fonksiyonlarının yerine getirilmesinde, büyüme ve gelişiminde çok önemlidir. Az miktarlarda yeterlidirler. Gebelikte anne yanında bebeğin
Vitaminlerin yararları nedendir? Vitamin ve mineraller vücudun normal fonksiyonlarının yerine getirilmesinde, büyüme ve gelişiminde çok önemlidir. Az miktarlarda yeterlidirler. Gebelikte anne yanında bebeğin
MİNERALLER. Dr. Diyetisyen Hülya YARDIMCI
 MİNERALLER Dr. Diyetisyen Hülya YARDIMCI MİNERALLER İnsan vücudunun yaklaşık %4-5 i minareldir.bununda yarıya yakını Ca, ¼ ü fosfordur. Mg, Na, Cl, S diğer makro minerallerdir. Bunların dışında kalanlar
MİNERALLER Dr. Diyetisyen Hülya YARDIMCI MİNERALLER İnsan vücudunun yaklaşık %4-5 i minareldir.bununda yarıya yakını Ca, ¼ ü fosfordur. Mg, Na, Cl, S diğer makro minerallerdir. Bunların dışında kalanlar
Bitki Fizyolojisi. 6. Hafta
 Bitki Fizyolojisi 6. Hafta 1 Fotosentezin karanlık tepkimelerinde karbondioksit özümlemesi; 1. C 3 bitkilerinde (Calvin-Benson mekanizması ile), 2. C 4 bitkilerinde (Hatch-Slack mekanizması ile), 3. KAM
Bitki Fizyolojisi 6. Hafta 1 Fotosentezin karanlık tepkimelerinde karbondioksit özümlemesi; 1. C 3 bitkilerinde (Calvin-Benson mekanizması ile), 2. C 4 bitkilerinde (Hatch-Slack mekanizması ile), 3. KAM
6. BÖLÜM MİKROBİYAL METABOLİZMA
 6. BÖLÜM MİKROBİYAL METABOLİZMA 1 METABOLİZMA Hücrede meydana gelen tüm reaksiyonlara denir Anabolizma: Basit moleküllerden kompleks moleküllerin sentezlendiği enerji gerektiren reaksiyonlardır X+Y+ENERJİ
6. BÖLÜM MİKROBİYAL METABOLİZMA 1 METABOLİZMA Hücrede meydana gelen tüm reaksiyonlara denir Anabolizma: Basit moleküllerden kompleks moleküllerin sentezlendiği enerji gerektiren reaksiyonlardır X+Y+ENERJİ
Karbohidratlar. Karbohidratların sınıflandırılması. Monosakkaritler
 Karbohidratlar Yeryüzünde en çok bulunan organik molekül grubudur, (CH 2 O) n genel formülüyle ifade edilebilirler. Genelde suda çözünürler, Güneş ışığının fotosentez yapan organizmalar tarafından tutulmasıyla
Karbohidratlar Yeryüzünde en çok bulunan organik molekül grubudur, (CH 2 O) n genel formülüyle ifade edilebilirler. Genelde suda çözünürler, Güneş ışığının fotosentez yapan organizmalar tarafından tutulmasıyla
11. SINIF KONU ANLATIMI 2 ATP-2
 11. SINIF KONU ANLATIMI 2 ATP-2 Fotosentez ve kemosentez reaksiyonları hem endergonik hem ekzergonik reaksiyonlardır. ATP molekülü ile hücrenin endergonik ve ekzergonik reaksiyonları arasında enerji transferini
11. SINIF KONU ANLATIMI 2 ATP-2 Fotosentez ve kemosentez reaksiyonları hem endergonik hem ekzergonik reaksiyonlardır. ATP molekülü ile hücrenin endergonik ve ekzergonik reaksiyonları arasında enerji transferini
Bornova Vet.Kont.Arst.Enst.
 Yemlerde Amino asitler ve B Grubu Vitaminlerinin Önemi ve Test Metotları Süreyya ÖZCAN Besin Öğeleri Canlının yaşamını devam ettirmesi için gerekli olan kimyasal element veya bileşiklerdir. Hücrelerin
Yemlerde Amino asitler ve B Grubu Vitaminlerinin Önemi ve Test Metotları Süreyya ÖZCAN Besin Öğeleri Canlının yaşamını devam ettirmesi için gerekli olan kimyasal element veya bileşiklerdir. Hücrelerin
VİTAMİN NEDİR? Vitaminler organik besinler grubunda bulunup
 VİTAMİN NEDİR? Vitaminler organik besinler grubunda bulunup normal yaşamın sürdürülmesi için gerekli olan, yiyecekler içerisinde doğal olarak bulunan basit yapılı bileşiklerdir. VİTAMİNLERİN GENEL ÖZELLİKLERİ=)
VİTAMİN NEDİR? Vitaminler organik besinler grubunda bulunup normal yaşamın sürdürülmesi için gerekli olan, yiyecekler içerisinde doğal olarak bulunan basit yapılı bileşiklerdir. VİTAMİNLERİN GENEL ÖZELLİKLERİ=)
6. glikolizde enerji kazanım hesaplamalarında; Substrat düzeyinde -ATP üretimi yaklaşık yüzde kaç hesaplanır? a. % 0 b. % 2 c. % 10 d. % 38 e.
 www.lisebiyoloji.com ayxmaz/biyoloji Test Çoktan Seçmeli 1. Hangi terim moleküllerin parçalanması ile açığa çıkan enerjinin depolandığı metabolik yolları ifade eder? a. anabolik yollar b. Katabolik yollar
www.lisebiyoloji.com ayxmaz/biyoloji Test Çoktan Seçmeli 1. Hangi terim moleküllerin parçalanması ile açığa çıkan enerjinin depolandığı metabolik yolları ifade eder? a. anabolik yollar b. Katabolik yollar
YAZILIYA HAZIRLIK TEST SORULARI. 11. Sınıf
 YAZILIYA HAZIRLIK TEST SORULARI 11. Sınıf 1) Oksijenli solunumda, oksijen molekülleri, I. Oksidatif fosforilasyon II. Glikoliz II. Krebs Evrelerinden hangilerinde kullanılır? A) Yalnız I B) Yalnız II C)
YAZILIYA HAZIRLIK TEST SORULARI 11. Sınıf 1) Oksijenli solunumda, oksijen molekülleri, I. Oksidatif fosforilasyon II. Glikoliz II. Krebs Evrelerinden hangilerinde kullanılır? A) Yalnız I B) Yalnız II C)
CANLILARIN YAPISINDA BULUNAN TEMEL BİLEŞENLER
 CANLILARIN YAPISINDA BULUNAN TEMEL BİLEŞENLER Canlıların yapısında bulunan moleküller yapısına göre 2 ye ayrılır: I. İnorganik Bileşikler: Bir canlı vücudunda sentezlenemeyen, dışardan hazır olarak aldığı
CANLILARIN YAPISINDA BULUNAN TEMEL BİLEŞENLER Canlıların yapısında bulunan moleküller yapısına göre 2 ye ayrılır: I. İnorganik Bileşikler: Bir canlı vücudunda sentezlenemeyen, dışardan hazır olarak aldığı
Yemlerde Amino asitler ve B Grubu Vitaminlerinin Önemi ve Test Metotları. Süreyya ÖZCAN
 Yemlerde Amino asitler ve B Grubu Vitaminlerinin Önemi ve Test Metotları Süreyya ÖZCAN Besin Öğeleri Canlının yaşamını devam ettirmesi için gerekli olan kimyasal element veya bileşiklerdir. Hücrelerin
Yemlerde Amino asitler ve B Grubu Vitaminlerinin Önemi ve Test Metotları Süreyya ÖZCAN Besin Öğeleri Canlının yaşamını devam ettirmesi için gerekli olan kimyasal element veya bileşiklerdir. Hücrelerin
FOTOSENTEZ. 1. Fotosentez, güneş enerjisini, besin içindeki saklı kimyasal bağ enerjisine çeviren olaydır.
 1 FOTOSENTEZ *Fotosentez: Klorofilli canlıların, ışık enerjisini kullanarak; inorganik maddelerden organik besin sentezlemesine fotosentez denir. 1. Fotosentez, güneş enerjisini, besin içindeki saklı kimyasal
1 FOTOSENTEZ *Fotosentez: Klorofilli canlıların, ışık enerjisini kullanarak; inorganik maddelerden organik besin sentezlemesine fotosentez denir. 1. Fotosentez, güneş enerjisini, besin içindeki saklı kimyasal
Biyoloji Canlılarda Solunum Enerjinin Açığa Çıkışı
 Biyoloji Canlılarda Solunum Enerjinin Açığa Çıkışı Canlılarda Enerji Dönüşümleri Canlılarda Solunum: Enerjinin Açığa Çıkışı Canlı hücrede gerçekleşen tüm metabolik olaylar enerji gerektirir. Hayvanlar
Biyoloji Canlılarda Solunum Enerjinin Açığa Çıkışı Canlılarda Enerji Dönüşümleri Canlılarda Solunum: Enerjinin Açığa Çıkışı Canlı hücrede gerçekleşen tüm metabolik olaylar enerji gerektirir. Hayvanlar
13 HÜCRESEL SOLUNUM LAKTİK ASİT FERMANTASYONU
 13 HÜCRESEL SOLUNUM LAKTİK ASİT FERMANTASYONU Laktik Asit Fermantasyonu Glikozdan oksijen yokluğunda laktik asit üretilmesine LAKTİK ASİT FERMANTASYONU denir. Bütün canlılarda sitoplazmada gerçekleşir.
13 HÜCRESEL SOLUNUM LAKTİK ASİT FERMANTASYONU Laktik Asit Fermantasyonu Glikozdan oksijen yokluğunda laktik asit üretilmesine LAKTİK ASİT FERMANTASYONU denir. Bütün canlılarda sitoplazmada gerçekleşir.
Organik bileşikler; karbonhidratlar, lipidler, proteinler, vitaminler ve nükleik asitler olmak üzere beş gruba ayrılır.
 ORGANİK BİLEŞİKLER **Organik bileşikler: Canlılar tarafından sentezlenirler. Yapılarında C, H, atomlarını bulundururlar. Organik bileşikler; karbonhidratlar, lipidler, proteinler, vitaminler ve nükleik
ORGANİK BİLEŞİKLER **Organik bileşikler: Canlılar tarafından sentezlenirler. Yapılarında C, H, atomlarını bulundururlar. Organik bileşikler; karbonhidratlar, lipidler, proteinler, vitaminler ve nükleik
4.Sınıf Fen Bilimleri
 Fen Bilimleri Adı: Soyadı: Numara: Besinler ve İçerikleri Canlıların yaşamlarını sürdürebilmek için yedikleri ve içtikleri maddelere besin denir.canlılar büyüyüp gelişmek, üremek ( çoğalmak ) ve solunum
Fen Bilimleri Adı: Soyadı: Numara: Besinler ve İçerikleri Canlıların yaşamlarını sürdürebilmek için yedikleri ve içtikleri maddelere besin denir.canlılar büyüyüp gelişmek, üremek ( çoğalmak ) ve solunum
Prof.Dr. Yeşim ÖZKAN G.Ü. Eczacılık Fakültesi Biyokimya Anabilim Dalı
 YAĞ ASİTLERİNİN OKSİDASYONU Prof.Dr. Yeşim ÖZKAN G.Ü. Eczacılık Fakültesi Biyokimya Anabilim Dalı YAĞ ASİTLERİNİN ADİPOSİTLERDEN MOBİLİZASYONU ATGL; adiposit triaçilgliserol lipaz, HSL; hormona duyarlı
YAĞ ASİTLERİNİN OKSİDASYONU Prof.Dr. Yeşim ÖZKAN G.Ü. Eczacılık Fakültesi Biyokimya Anabilim Dalı YAĞ ASİTLERİNİN ADİPOSİTLERDEN MOBİLİZASYONU ATGL; adiposit triaçilgliserol lipaz, HSL; hormona duyarlı
* Yapılarında C, H, O bulunur. Bazılarında C, H, O dan başka N, P, S bulunur.
 Lipitler ortak özellikleri su ile karışmamak olan organik maddelerdir ve kimyasal olarak yağ asitlerinin bir alkolle esterleşmesinden oluşur. 1.1. Lipitlerin Yapısı ve Ortak Özellikleri * Yapılarında C,
Lipitler ortak özellikleri su ile karışmamak olan organik maddelerdir ve kimyasal olarak yağ asitlerinin bir alkolle esterleşmesinden oluşur. 1.1. Lipitlerin Yapısı ve Ortak Özellikleri * Yapılarında C,
Vitaminler büyüme, sağlık, her türlü verim performansı gibi yaşamsal fonksiyonların devamlılığı için çok az miktarlarda ihtiyaç duyulan organik
 VİTAMİNLER Vitaminler büyüme, sağlık, her türlü verim performansı gibi yaşamsal fonksiyonların devamlılığı için çok az miktarlarda ihtiyaç duyulan organik bileşiklerdir. Vitaminlerin Sınıflandırılması
VİTAMİNLER Vitaminler büyüme, sağlık, her türlü verim performansı gibi yaşamsal fonksiyonların devamlılığı için çok az miktarlarda ihtiyaç duyulan organik bileşiklerdir. Vitaminlerin Sınıflandırılması
PROF. DR. SERKAN YILMAZ
 PROF. DR. SERKAN YILMAZ Hücrede enzimler yardımıyla katalizlenen reaksiyonlar hücre metabolizması adını alır. Bu metabolik olaylar; A) Beslenme (anabolizma) B) Yıkım (katabolizma) olaylarıdır. Hücrede
PROF. DR. SERKAN YILMAZ Hücrede enzimler yardımıyla katalizlenen reaksiyonlar hücre metabolizması adını alır. Bu metabolik olaylar; A) Beslenme (anabolizma) B) Yıkım (katabolizma) olaylarıdır. Hücrede
YAZILIYA HAZIRLIK SORULARI. 11. Sınıf 1 CANLILARDA ENERJİ DÖNÜŞÜMLERİ
 YAZILIYA HAZIRLIK SORULARI 11. Sınıf 1 CANLILARDA ENERJİ DÖNÜŞÜMLERİ Fotosentez ile ışık enerjisi kimyasal bağ enerjisine dönüştürülür. Kloroplastsız hücreler fotosentez yapamaz. DOĞRU YANLIŞ SORULARI
YAZILIYA HAZIRLIK SORULARI 11. Sınıf 1 CANLILARDA ENERJİ DÖNÜŞÜMLERİ Fotosentez ile ışık enerjisi kimyasal bağ enerjisine dönüştürülür. Kloroplastsız hücreler fotosentez yapamaz. DOĞRU YANLIŞ SORULARI
www.demiraylisesi.com
 YÖNETİCİ MOLEKÜLLER C, H, O, N, P atomlarından meydana gelir. Hücrenin en büyük yapılı molekülüdür. Yönetici moleküller hücreye ait genetik bilgiyi taşır, hayatsal faaliyetleri yönetir, genetik bilginin
YÖNETİCİ MOLEKÜLLER C, H, O, N, P atomlarından meydana gelir. Hücrenin en büyük yapılı molekülüdür. Yönetici moleküller hücreye ait genetik bilgiyi taşır, hayatsal faaliyetleri yönetir, genetik bilginin
Hücreler Enerjiyi Nasıl Elde Eder?
 Hücreler Enerjiyi Nasıl Elde Eder? MBG 111 BİYOLOJİ I Hazırlayan: Yrd.Doç.Dr. Yosun MATER Ekosistem ve Enerji Ekosistemde enerjinin akışı güneş ışığı ve ısı şeklinde gözlenir. Tam tersine canlı hücrelerde
Hücreler Enerjiyi Nasıl Elde Eder? MBG 111 BİYOLOJİ I Hazırlayan: Yrd.Doç.Dr. Yosun MATER Ekosistem ve Enerji Ekosistemde enerjinin akışı güneş ışığı ve ısı şeklinde gözlenir. Tam tersine canlı hücrelerde
Yağ ihtiyacı nereden karşılanır?
 Besinde Lipitler Besinsel Yağlar 1. Trigliseritler (%90) 2. Kolesterol (serbest ya da yağ asitlerine bağlı halde) 3. Serbest Yağ Asitleri 4. Fosfolipitler 5. Yağda Çözünen Vitaminler (A,D,E,K) Suda çözünmezler
Besinde Lipitler Besinsel Yağlar 1. Trigliseritler (%90) 2. Kolesterol (serbest ya da yağ asitlerine bağlı halde) 3. Serbest Yağ Asitleri 4. Fosfolipitler 5. Yağda Çözünen Vitaminler (A,D,E,K) Suda çözünmezler
YAZILIYA HAZIRLIK SORULARI. 9. Sınıf 2 KARBONHİDRAT LİPİT (YAĞ)
 YAZILIYA HAZIRLIK SORULARI 9. Sınıf 2 KARBONHİDRAT LİPİT (YAĞ) DOĞRU YANLIŞ SORULARI Depo yağlar iç organları basınç ve darbelerden korur. Steroitler hücre zarının yapısına katılır ve geçirgenliğini artırır.
YAZILIYA HAZIRLIK SORULARI 9. Sınıf 2 KARBONHİDRAT LİPİT (YAĞ) DOĞRU YANLIŞ SORULARI Depo yağlar iç organları basınç ve darbelerden korur. Steroitler hücre zarının yapısına katılır ve geçirgenliğini artırır.
OKSİDATİF FOSFORİLASYON. Prof. Dr. Yeşim ÖZKAN
 OKSİDATİF FOSFORİLASYON Prof. Dr. Yeşim ÖZKAN Canlı organizmalarda; Biyosentez Aktif Transport Hareket gibi süreçlerde enerjiye ihtiyaç vardır. Bu enerji tüketilen yiyeceklerden sağlanmaktadır. Enerji
OKSİDATİF FOSFORİLASYON Prof. Dr. Yeşim ÖZKAN Canlı organizmalarda; Biyosentez Aktif Transport Hareket gibi süreçlerde enerjiye ihtiyaç vardır. Bu enerji tüketilen yiyeceklerden sağlanmaktadır. Enerji
ÇİSEM İLGİN ( ) LÜTFİYE ALAÇAM ( ) Prof. Dr. Figen ERKOÇ GAZİ ÜNİVERSİTESİ
 HAZIRLAYLANLAR ÇİSEM İLGİN (040559015) LÜTFİYE ALAÇAM (040559003) ZEYNEP HALICI (040559014) Prof. Dr. Figen ERKOÇ Gazi Eğitim Fakültesi GAZİ ÜNİVERSİTESİ 1 TRANSAMİNAZLAR Transaminazlar veya Aminotransferazlar
HAZIRLAYLANLAR ÇİSEM İLGİN (040559015) LÜTFİYE ALAÇAM (040559003) ZEYNEP HALICI (040559014) Prof. Dr. Figen ERKOÇ Gazi Eğitim Fakültesi GAZİ ÜNİVERSİTESİ 1 TRANSAMİNAZLAR Transaminazlar veya Aminotransferazlar
KAFKAS ÜNİVERSİTESİ TIP FAKÜLTESİ DÖNEM I 2015-2016 DERS YILI 4. KOMİTE: HÜCRE BİLİMLERİ DERS KURULU IV
 KAFKAS ÜNİVERSİTESİ TIP FAKÜLTESİ DÖNEM I 2015-2016 DERS YILI 4. KOMİTE: HÜCRE BİLİMLERİ DERS KURULU IV (5 Hafta) (04 Ocak-26 Şubat) DERSLER TEORİK PRATİK TOPLAM Biyokimya 36 10 46 Tıbbi Genetik 18 10
KAFKAS ÜNİVERSİTESİ TIP FAKÜLTESİ DÖNEM I 2015-2016 DERS YILI 4. KOMİTE: HÜCRE BİLİMLERİ DERS KURULU IV (5 Hafta) (04 Ocak-26 Şubat) DERSLER TEORİK PRATİK TOPLAM Biyokimya 36 10 46 Tıbbi Genetik 18 10
BİYOLOJİ DERS NOTLARI YGS-LGS YÖNETİCİ MOLEKÜLLER
 www.benimdershanem.esy.es Bilgi paylaştıkça çoğalır. BİYOLOJİ DERS NOTLARI YGS-LGS YÖNETİCİ MOLEKÜLLER NÜKLEİK ASİTLER Nükleik asitler, bütün canlı hücrelerde ve virüslerde bulunan, nükleotid birimlerden
www.benimdershanem.esy.es Bilgi paylaştıkça çoğalır. BİYOLOJİ DERS NOTLARI YGS-LGS YÖNETİCİ MOLEKÜLLER NÜKLEİK ASİTLER Nükleik asitler, bütün canlı hücrelerde ve virüslerde bulunan, nükleotid birimlerden
Bileşik karbonhidratlar. Mukopolisakkaritler -Hiyaluronik asit -Heparin -Kondroitin sülfatlar Kan grubu polisakkaritleri
 KARBONHİDRATLAR Karbonhidratlar Karbon, hidrojen ve oksijen atomlarından oluşan organik bileşiklerdir Vücuda enerji sağlayan besin öğeleridir Özellikle bitkisel besinlerde çok yaygındır İnsanlar ve hayvanlar
KARBONHİDRATLAR Karbonhidratlar Karbon, hidrojen ve oksijen atomlarından oluşan organik bileşiklerdir Vücuda enerji sağlayan besin öğeleridir Özellikle bitkisel besinlerde çok yaygındır İnsanlar ve hayvanlar
YAĞ ASİTLERİNİN OKSİDASYONU
 YAĞ ASİTLERİNİN KSİDASYNU Prof.Dr. Yeşim ÖZKAN G.Ü. Eczacılık Fakültesi Biyokimya Anabilim Dalı YAĞ ASİTLERİNİN ADİPSİTLERDEN MBİLİZASYNU Adrenalin Glukagon İnsülin reseptör Adenilat siklaz G protein ATP
YAĞ ASİTLERİNİN KSİDASYNU Prof.Dr. Yeşim ÖZKAN G.Ü. Eczacılık Fakültesi Biyokimya Anabilim Dalı YAĞ ASİTLERİNİN ADİPSİTLERDEN MBİLİZASYNU Adrenalin Glukagon İnsülin reseptör Adenilat siklaz G protein ATP
BİYOKİMYA II EK NOT. Ortak biyokimyasal tepkimeler
 BİYOKİMYA II EK NOT Dr. NaĢit ĠĞCĠ Ortak biyokimyasal tepkimeler Ġndirgenme-yükseltgenme (redüksiyon-oksidasyon, redoks) tepkimeleri de biyokimya açısından çok önemli tepkimelerdir. Basitçe, elektron kaybı
BİYOKİMYA II EK NOT Dr. NaĢit ĠĞCĠ Ortak biyokimyasal tepkimeler Ġndirgenme-yükseltgenme (redüksiyon-oksidasyon, redoks) tepkimeleri de biyokimya açısından çok önemli tepkimelerdir. Basitçe, elektron kaybı
HÜCRE SOLUNUMU ve FERMENTASYON
 HÜCRE SOLUNUMU ve FERMENTASYON 1 Bakteriler yoğurt, peynir, pizza üretimi gibi mayalanma olaylarını gerçekleştirirler. Kaslarınız çok çalışırsa, oksijen yokluğundan dolayı kasılamazlar. Yediğiniz bütün
HÜCRE SOLUNUMU ve FERMENTASYON 1 Bakteriler yoğurt, peynir, pizza üretimi gibi mayalanma olaylarını gerçekleştirirler. Kaslarınız çok çalışırsa, oksijen yokluğundan dolayı kasılamazlar. Yediğiniz bütün
LİPOPROTEİN METABOLİZMASI. Prof.Dr. Yeşim ÖZKAN Gazi Üniversitesi Eczacılık Fakültesi Biyokimya Anabilim Dalı
 LİPOPROTEİN METABOLİZMASI Prof.Dr. Yeşim ÖZKAN Gazi Üniversitesi Eczacılık Fakültesi Biyokimya Anabilim Dalı Lipoprotein Nedir? 1- Lipidler Hidrofobik lipidler çekirdekte (Trigliserit, Kolesterol esterleri)
LİPOPROTEİN METABOLİZMASI Prof.Dr. Yeşim ÖZKAN Gazi Üniversitesi Eczacılık Fakültesi Biyokimya Anabilim Dalı Lipoprotein Nedir? 1- Lipidler Hidrofobik lipidler çekirdekte (Trigliserit, Kolesterol esterleri)
Beslenmeden hemen sonra, artan kan glikoz seviyesi ile birlikte insülin hormon seviyesi de artar. Buna zıt olarak glukagon hormon düzeyi azalır.
 Seçmeli Ders: Dokular ve Organlar Arası Metabolik İlişkiler 1.HAFTA Normal metabolizmada aktif olan günlük akış; Yaşamak için gerekli olan enerji akışı, dışardan alınan gıdalardan elde edilir. Kullanılan
Seçmeli Ders: Dokular ve Organlar Arası Metabolik İlişkiler 1.HAFTA Normal metabolizmada aktif olan günlük akış; Yaşamak için gerekli olan enerji akışı, dışardan alınan gıdalardan elde edilir. Kullanılan
Öğr. Gör. Dr. İlker BÜYÜK (Botanik, 10. Hafta): Fotosentez FOTOSENTEZ
 FOTOSENTEZ Elektron Koparılması ve Floresans Enerjisi Elektronlar negatif (e - ) ve protonlar pozitif (p + ) yüklüdür. Bu nedenle protonlar elektronları çekerler. Elektronlar ise, belli bir enerjiye sahiptir
FOTOSENTEZ Elektron Koparılması ve Floresans Enerjisi Elektronlar negatif (e - ) ve protonlar pozitif (p + ) yüklüdür. Bu nedenle protonlar elektronları çekerler. Elektronlar ise, belli bir enerjiye sahiptir
Referans:e-TUS İpucu Serisi Biyokimya Ders Notları Sayfa:368
 21. Aşağıdakilerden hangisinin fizyolojik ph'de tamponlama etkisi vardır? A) CH3COC- / CH3COOH (pka = 4.76) B) HPO24- / H2PO-4 (pka = 6.86) C) NH3/NH+4(pKa =9.25) D) H2PO-4 / H3PO4 (pka =2.14) E) PO34-/
21. Aşağıdakilerden hangisinin fizyolojik ph'de tamponlama etkisi vardır? A) CH3COC- / CH3COOH (pka = 4.76) B) HPO24- / H2PO-4 (pka = 6.86) C) NH3/NH+4(pKa =9.25) D) H2PO-4 / H3PO4 (pka =2.14) E) PO34-/
Solunum. Solunum ve odunsu bitkilerin büyümesi arasında yüksek bir korelasyon bulunmaktadır (Kozlowski ve Pallardy, 1997).
 SOLUNUM Solunum Solunum, canlı hücrelerdeki organik maddelerin oksidasyonuyla, enerjinin açığa çıkarılması olayı olarak tanımlanır. Açığa çıkan enerji, kimyasal enerji (ATP) olarak depolanır. Solunum ürünleri,
SOLUNUM Solunum Solunum, canlı hücrelerdeki organik maddelerin oksidasyonuyla, enerjinin açığa çıkarılması olayı olarak tanımlanır. Açığa çıkan enerji, kimyasal enerji (ATP) olarak depolanır. Solunum ürünleri,
BESİN GRUPLARININ YETERLİ VE DENGELİ BESLENMEDEKİ ÖNEMİ
 BESİN GRUPLARININ YETERLİ VE DENGELİ BESLENMEDEKİ ÖNEMİ SÜT VE SÜT ÜRÜNLERİ SÜT VE SÜT ÜRÜNLERİ YETERLİ VE DENGELİ BESLENMEDEKİ ÖNEMİ Büyüme ve gelişmeyi sağlar. Özellikle çocuk ve adölesanlarda protein,
BESİN GRUPLARININ YETERLİ VE DENGELİ BESLENMEDEKİ ÖNEMİ SÜT VE SÜT ÜRÜNLERİ SÜT VE SÜT ÜRÜNLERİ YETERLİ VE DENGELİ BESLENMEDEKİ ÖNEMİ Büyüme ve gelişmeyi sağlar. Özellikle çocuk ve adölesanlarda protein,
Enjeksiyonluk Çözelti Veteriner Vitamin
 Prospektüs Betakin sarı renkli, berrak çözelti olup, her ml'si 5 mg Thiamin HC1 (Vit. B,), 2 mg Riboflavin (Vit. B 2 ), 2 mg Pridoksin HC1 (Vit. B 6 ), 4 mcg Siyanokobalamin (Vit B] 2 ), 20 mg Niasin,
Prospektüs Betakin sarı renkli, berrak çözelti olup, her ml'si 5 mg Thiamin HC1 (Vit. B,), 2 mg Riboflavin (Vit. B 2 ), 2 mg Pridoksin HC1 (Vit. B 6 ), 4 mcg Siyanokobalamin (Vit B] 2 ), 20 mg Niasin,
Yağda eriyen vitaminlerden biridir. Retinoidler adı verilen kimyasal bileşik ile, provitamin A karotenoidleri adı verilen kimyasal moleküller vitamin
 A vitamini Yağda eriyen vitaminlerden biridir. Retinoidler adı verilen kimyasal bileşik ile, provitamin A karotenoidleri adı verilen kimyasal moleküller vitamin A ailesini oluşturur. All-trans retinol
A vitamini Yağda eriyen vitaminlerden biridir. Retinoidler adı verilen kimyasal bileşik ile, provitamin A karotenoidleri adı verilen kimyasal moleküller vitamin A ailesini oluşturur. All-trans retinol
1-GİRİ 1.1- BİYOKİMYANIN TANIMI VE KONUSU.-
 1-GİRİ 1.1- BİYOKİMYANIN TANIMI VE KONUSU.- Biyokimya sözcüğü biyolojik kimya (=yaşam kimyası) teriminin kısaltılmış şeklidir. Daha eskilerde, fizyolojik kimya terimi kullanılmıştır. Gerçekten de Biyokimya
1-GİRİ 1.1- BİYOKİMYANIN TANIMI VE KONUSU.- Biyokimya sözcüğü biyolojik kimya (=yaşam kimyası) teriminin kısaltılmış şeklidir. Daha eskilerde, fizyolojik kimya terimi kullanılmıştır. Gerçekten de Biyokimya
6. glikolizde enerji kazanım hesaplamalarında; Substrat düzeyinde -ATP üretimi yaklaşık yüzde kaç hesaplanır? a. % 0 b. % 2 c. % 10 d. % 38 e.
 www.lisebiyoloji.com ayxmaz/biyoloji Test Çoktan Seçmeli 1. Hangi terim moleküllerin parçalanması ile açığa çıkan enerjinin depolandığı metabolik yolları ifade eder? a. anabolik yollar b. Katabolik yollar
www.lisebiyoloji.com ayxmaz/biyoloji Test Çoktan Seçmeli 1. Hangi terim moleküllerin parçalanması ile açığa çıkan enerjinin depolandığı metabolik yolları ifade eder? a. anabolik yollar b. Katabolik yollar
NATURAZYME Naturazyme enzim grubu karbohidrazlar, proteaz ve fitaz enzimlerini içerir.
 NATURAZYME Naturazyme enzim grubu karbohidrazlar, proteaz ve fitaz enzimlerini içerir. Tüm hayvanlar besinleri sindirmek için enzimleri kullanırlar. Bunlar hem hayvanın kendi sentezlediği hem de bünyelerinde
NATURAZYME Naturazyme enzim grubu karbohidrazlar, proteaz ve fitaz enzimlerini içerir. Tüm hayvanlar besinleri sindirmek için enzimleri kullanırlar. Bunlar hem hayvanın kendi sentezlediği hem de bünyelerinde
12 HÜCRESEL SOLUNUM GLİKOLİZ VE ETİL ALKOL FERMANTASYONU
 12 HÜCRESEL SOLUNUM GLİKOLİZ VE ETİL ALKOL FERMANTASYONU HÜCRESEL SOLUNUM HÜCRESEL SOLUNUM Besinlerin hücre içerisinde parçalanması ile ATP üretimini sağlayan mekanizmaya HÜCRESEL SOLUNUM denir. Canlılar
12 HÜCRESEL SOLUNUM GLİKOLİZ VE ETİL ALKOL FERMANTASYONU HÜCRESEL SOLUNUM HÜCRESEL SOLUNUM Besinlerin hücre içerisinde parçalanması ile ATP üretimini sağlayan mekanizmaya HÜCRESEL SOLUNUM denir. Canlılar
KARBON ve CANLILARDAKİ MOLEKÜL ÇEŞİTLİLİĞİ
 KARBON ve CANLILARDAKİ MOLEKÜL ÇEŞİTLİLİĞİ Karbonun önemi Hücrenin % 70-95ʼ i sudan ibaret olup, geri kalan kısmın çoğu karbon içeren bileşiklerdir. Canlılığı oluşturan organik bileşiklerde karbon atomuna
KARBON ve CANLILARDAKİ MOLEKÜL ÇEŞİTLİLİĞİ Karbonun önemi Hücrenin % 70-95ʼ i sudan ibaret olup, geri kalan kısmın çoğu karbon içeren bileşiklerdir. Canlılığı oluşturan organik bileşiklerde karbon atomuna
SÜT VE SÜT ÜRÜNLERİ YETERLİ VE DENGELİ BESLENMEDEKİ ÖNEMİ
 SÜT VE SÜT ÜRÜNLERİ YETERLİ VE DENGELİ BESLENMEDEKİ ÖNEMİ Büyüme ve gelişmeyi sağlar. Özellikle çocuk ve adölesanlarda protein, kalsiyum ve fosfor alımı nedeniyle; kemiklerin ve dişlerin gelişiminde Önemlidir.
SÜT VE SÜT ÜRÜNLERİ YETERLİ VE DENGELİ BESLENMEDEKİ ÖNEMİ Büyüme ve gelişmeyi sağlar. Özellikle çocuk ve adölesanlarda protein, kalsiyum ve fosfor alımı nedeniyle; kemiklerin ve dişlerin gelişiminde Önemlidir.
Doğadaki Enerji Akışı
 Doğadaki Enerji Akışı Güneş enerjisi Kimyasal enerjisi ATP Fotosentez olayı ile enerjisi Hareket enerjisi Isı enerjisi ATP Enerjinin Temel Molekülü ATP + H 2 O ADP + H 2 O ADP + Pi + 7300 kalori AMP +
Doğadaki Enerji Akışı Güneş enerjisi Kimyasal enerjisi ATP Fotosentez olayı ile enerjisi Hareket enerjisi Isı enerjisi ATP Enerjinin Temel Molekülü ATP + H 2 O ADP + H 2 O ADP + Pi + 7300 kalori AMP +
Biochemistry Chapter 4: Biomolecules. Hikmet Geçkil, Professor Department of Molecular Biology and Genetics Inonu University
 Biochemistry Chapter 4: Biomolecules, Professor Department of Molecular Biology and Genetics Inonu University Biochemistry/Hikmet Geckil Chapter 4: Biomolecules 2 BİYOMOLEKÜLLER Bilim adamları hücreyi
Biochemistry Chapter 4: Biomolecules, Professor Department of Molecular Biology and Genetics Inonu University Biochemistry/Hikmet Geckil Chapter 4: Biomolecules 2 BİYOMOLEKÜLLER Bilim adamları hücreyi
LİPOPROTEİN METABOLİZMASI. Prof.Dr. Yeşim ÖZKAN Gazi Üniversitesi Eczacılık Fakültesi Biyokimya Anabilim Dalı
 LİPOPROTEİN METABOLİZMASI Prof.Dr. Yeşim ÖZKAN Gazi Üniversitesi Eczacılık Fakültesi Biyokimya Anabilim Dalı Lipoprotein Nedir? 1- Lipidler Hidrofobik lipidler çekirdekte (Trigliserit, Kolesterol esterleri)
LİPOPROTEİN METABOLİZMASI Prof.Dr. Yeşim ÖZKAN Gazi Üniversitesi Eczacılık Fakültesi Biyokimya Anabilim Dalı Lipoprotein Nedir? 1- Lipidler Hidrofobik lipidler çekirdekte (Trigliserit, Kolesterol esterleri)
