CERRAHPAŞA ÖĞRENCİ BİLİMSELDERGİSİ
|
|
|
- Nergis Derici
- 8 yıl önce
- İzleme sayısı:
Transkript
1 İSTANBULÜNİVERSİTESİ CERRAHPAŞA ÖĞRENCİ BİLİMSELDERGİSİ ISTANBULUNIVERSITY STUDENTSCIENTIFICJOURNALOF CERRAHPASA CÖBİDGÜZ2012;CİLT5,SAYI6 FALL2012;VOLUME5,ISSUE6 KANSEREKARŞIEDİNİLMİŞİMMUNOTERAPİYÖNTEMİ: THÜCRELERİNİNYANITININKULLANILMASI ADOPTIVEIMMUNOTHERAPYFORCANCER: HARNESSINGTHETCELLRESPONSE NicholasP.Res fo,marke.dudleyandstevena.rosenberg İmmunolojiÇalışmaGrubu,CTF-ÖBAK obakdergi.org
2 KANSERE KARŞI EDİNİLMİŞ İMMUNOTERAPİ YÖNTEMİ: T HÜCRELERİNİN YANITININ KULLANILMASI ADOPTIVE IMMUNOTHERAPY FOR CANCER: HARNESSING THE T CELL RESPONSE Nicholas P. Restifo, Mark E. Dudley and Steven A. Rosenberg İmmunoloji Çalışma Grubu, CTF - ÖBAK 2012 ÖZET Vücutta doğal olarak bulunan veya genetiği değiştirilmiş T hücrelerinin dışarıdan transferine dayalı immunoterapi, metastatik kanserli hastalarda tümör regresyonuna aracılık edebilmektedir. Burada, T hücrelerinin tümör hücresi eradikasyonuna nasıl aracılık edebildikleri konusunu temel alarak sonradan nakledilmiş T hücrelerinin kullanımındaki ilerlemeyi tartışacağız. Son yıllardaki gelişmeler sayesinde, tümörler ve ilişkili damar sistemi tarafından eksprese edilen antijenler daha doğru bir şekilde hedef alınabilir duruma gelmiş, hastaya naklinden önce T hücrelerinin hedeflerinin yeniden belirlenmesinde gen mühendisliği başarılı bir şekilde kullanılır olmuştur. Bununla birlikte, bu yeni araştırmanın T hücrelerinin tümör eradikasyonunda en etkili unsur olan özelleşmiş alt gruplarının tanımlanmasına nasıl yardımcı olduğunu anlatacağız. Anahtar Kelimeler: T hücresi, immunoterapi, kanser immunolojisi ABSTRACT: Immunotherapy based on the adoptive transfer of naturally occurring or gene-engineered T cells can mediate tumour regression in patients with metastatic cancer. Here, we discuss progress in the use of adoptively transferred T cells, focusing on how they can mediate tumour cell eradication. Recent advances include more accurate targeting of antigens expressed by tumours and the associated vasculature, and the successful use of gene engineering to re-target T cells before their transfer into the patient. We also describe how new research has helped to identify the particular T cell subsets that can most effectively promote tumour eradication. Keywords: T cell, immunotherapy, cancer immunology T hücreleri, T hücresi reseptörlerine (TCR) spesifik olup onları aktive eden MHC-peptid komplekslerini tarayarak dokular arasında gezinir. T hücreleri aynı zamanda potansiyel tehlike arz eden patojenlere ve kansere karşı kendilerini alarm durumuna geçirebilen çeşitli sinyalleri algılama özelliğine de sahiptir. Tümöre spesifik T hücreleri büyük olasılıkla, dendritik hücrelerin (DC) de içinde bulunduğu özelleşmiş antijen sunan hücrelerce (APC) eksprese edilen tümör ilişkili antijenlerle karşılaşmaları sonucu aktive olurlar. Bunun yanında, aktive olmuş T hücreleri tümör hücre yüzeyinde sunulan antijenleri direkt tanıma yeteneğine sahiptir. Organizma içi (intravital) görüntüleme yöntemine dayanarak tümöre spesifik T hücrelerinin aynı kökene sahip antijenleriyle karşılaştıklarında göçünün hızlı bir şekilde durduğunu gösteren kanıt giderek geçerlik kazanmaktadır (1). T hücrelerinin göçünün durdurulmasına yol açan bu antijenlerin temel alındığı gözlemler göstermiştir ki; melanomalı hastalarda tümöre infiltre olan lenfosit (TIL) populasyonu, basit bir şekilde tümör kitlesini kesip çıkarıldıktan sonra, hücreleri tek hücreli süspansiyonlara veya tümör fragmanlarına ayırıp T hücresi büyüme faktörü interleukin-2 (IL-2) eklenerek tümör hücrelerinden izole edilebilir ve çoğaltılabilir (Şekil-1). Çeşitli tümör histolojilerinin tedavisinde genetiği değiştirilmiş T hücreleri de kullanılabilir (Şekil-2).
3 Bu makale, vücutta doğal olarak bulunan veya genetiği değiştirilmiş tümöre spesifik T hücrelerinin dışarıdan transferine dayalı immunoterapi yöntemini konu almıştır. T hücrelerinin tümör kitlesinde ne gördüğü, tümör hücrelerinin ölmesi için T hücrelerinin ne yapması gerektiği, T hücrelerinin olgunlaşma sürecinde fenotiplerini ve işlevlerini çok önemli ölçüde etkileyen değişiklikleri nasıl geçirdiği hakkında bilinenleri özetleyeceğiz. Son olarak, tümöre spesifik T hücrelerinin kanserli hastalarda kullanılan diğer tedavi yöntemleriyle nasıl en iyi şekilde birleştirilebileceği sorusuna yanıt arayacağız. Tümöre infiltre olan lenfositler tümör hücrelerini öldürebilir mi? Organizma dışı (ex vivo) çoğaltılmış hücre populasyonlarıyla tedavi yöntemi, edinilmiş (adoptif) hücre transferi (ACT-Adoptive Cell Transfer) olarak adlandırılır. Organizma dışında (ex vivo) çoğaltılarak hastaya tekrar aşılanan hücreler tümöre giderek onun yok edilmesini sağlayabilir. Hazırlanmış lenfotükenim (preparative lymphodepletion) -kanserli hastalarda immun sistemin geçici olarak fonksiyon dışı bırakılması- kemoterapinin tek başına kullanılması veya tüm vücuda uygulanan ışın tedavisiyle kombine halde uygulanmasıyla sağlanabilir ve bu basamak, transfer edilmiş T hücrelerinin kalıcılığının artırılmasıyla ilişkilidir. Öte yandan, lenfotükenimi hazırlayıcı bir uygulamanın ACT ile kombinasyonu ve T hücresi büyüme faktörü IL-2 nin verilmesi metastatik melanomalı veya diğer tedavi seçeneklerine cevapsız kalmış bazı tümör histolojisine sahip hastalarda (lösemi ve sinoviyal hücre sarkomu dahil) uzamış tümör eradikasyonuna sebep olabilir (2-7). Tümör hücrelerince eksprese olunan antijenlere spesifik T hücre sayısının artmasına karşın tümörün varlığını koruması oldukça kafa karıştırıcı görünmektedir. Bu belki de tümörde bulunan tümöre spesifik T hücrelerinin kronik aktivasyona maruz kalması ve immun baskılayıcı faktörlerce çevrilmiş olmasından kaynaklanmaktadır. TIL ler organizma içinde (in vivo) T hücresi immunoglobulini, müsin alt birimi (mucin domain) içeren protein 3 (TIM3), lenfosit aktivasyonu gen 3 proteini (LAG3), programlanmış hücre ölümü proteini 1 (PD1) ve sitotoksik T lenfositi antijeni 4 (CTL4) gibi bağışıklık baskılayıcı moleküllerce engellenir (8,9). Ancak, T hücrelerinin büyük olasılıkla bağışıklık baskılayıcı olan tümör çevresinden uzaklaştırılması bu hücrelerin aktivasyon ve klonal çoğalmasına olanak tanır. TIL populasyonlarının hücre kültüründe çoğaltılması sırasında tümör hücreleri ölür ya da aktive olmuş doğal öldürücü (NK) hücreler veya yeni çoğalan T hücre populasyonları tarafından öldürülür. TIL ler, myeloid kökenli baskılayıcı hücreler (MDSC ler) gibi bağışıklık baskılayıcı hücre populasyonlarından ayrılır ve kültürün bu erken evresinde daha düşük miktarlarda bağışıklık baskılayıcı sitokinlere maruz kalır. TIL populasyonlarının organizma dışı (ex vivo) daha uygun sayılara ulaşana kadar çoğaltılmasının ardından bu hücrelerin konakçıya yeniden nakledilmesi, yerleşmiş kanserlerde dayanıklı ve tam remisyonu sağlayarak tümörün tamamen yok edilmesine ve hatta iyileşmesine (cure) olanak tanıyabilir (4). T hücreleri tümörü nasıl hedefler? Kanser immünoterapisi üzerinde çalışanların karşılaştıkları belki de en büyük zorluk uygun tümör antijenlerinin saptanmasıdır (10). Antijenler, büyük çoğunlukla bir tümör türüne özgü olan mutasyona uğramış genler tarafından kodlanmıştır. Acaba tümör hücreleri ve vazgeçilebilir normal doku hücrelerinde ortak bulunan antijenler de var mıdır? T hücrelerinin tümör hücrelerini tanıdığı ancak normal hücreleri tanımadığı bir pencere var mıdır? Tümördeki malign hücrelerin ne kadarı aday antijenleri stabil olarak açığa çıkarır ve bu durum hangi seviyede olur? Tüm kanser hücrelerini hedeflemek kesinlikle gerekli midir, yoksa malign olmayan ve tümör hücrelerini besleyen çevredeki stromal hücreleri öldürmek tümör sterilizasyonuyla sonuçlanacak mıdır? Aday bir antijenik molekül, bir kısmı CD8+ T hücrelerini uyarırken diğerleri CD4+ T hücrelerini uyaran değişik antijenik epitoplar sağlayabilir mi? Tümörlere özgü olan MHC Sınıf 1-sınırlı T hücreleri (ya doğal olarak ya da genetik mühendisliğinin bir sonucu olarak) teorikte birçok tümör hücre tipini tanıma yeteneğine sahiptir, çünkü fiilen vücuttaki her çekirdekli hücre MHC Sınıf-1 i oluşturur. Ancak, herkesin bildiği gibi neoplastik hücreler stabil olmayan
4 hedeflerdir, genellikle MHC Sınıf- 1 ekspresyonlarını baskılayarak düzenlerler (11-13). Profesyonel APC ler ekzojen antijenleri işleyip MHC Sınıf-2 ler ile veya cross-priming olarak bilinen bir mekanizmayla MHC Sınıf-1 moleküllerini kullanarak T hücrelerine sunarlar. MHC ekspresyonu kaybolmuş tümör kitleleriyle ilişkili antijenlerin T hücrelerine böyle bir dolaylı yol izlenerek tanıtılması doğal bağışıklığı ve vasküler yıkımı tetikleyerek bu kitleleri hedeflememizi sağlayabilir. İmmün denetleme, birçok mikroskobik tümörü belirgin hale gelmeden önce yok ediyor olabilir. Farelerle yapılan deneylere dayanarak birçok araştırmacı tümörlerin immuneditleme (immunoediting) mekanizmasından geçtiğini öne sürmüşlerdir (13,14,163). Ancak, kontrolsüz büyüyen ve konaklarını eninde sonunda öldüren tümör kitleleri immünolojik hedef antijenleri açık bir şekilde eksprese ederler. Bu nedenle tümör kitleleri tanınmaktan; sadece kendi ürettikleri antijenik hedefleri yok ederek değil, konağın adaptif immün sistemini yetersiz gördüğünde ya da yetersiz hale getirerek kaçarlar (164). Şekil.1 Tümör-infiltre lenfositlerin izolasyonu ve tümöre spesifik T hücre popülasyonun ekspansiyonu Tümörler genellikle farklı hücre tipleri içeren kompleks hücre yığınlarıdır. Bu kitleler cerrahi olarak rezekte edilir ve parçalara ayrılır; ardından da IL-2 gibi T hücresi büyüme faktörü içeren kuyucuklara yerleştirilir. İstenen T hücre reseptörü (TCR) spesifitesine sahip T hücre populasyonları seçilir ve çoğaltılır, ardından kanserli hastaya nakledilir. Bu nakil öncesinde, taşıyıcı immünitesi kemoterapiyle veya total vücut radyoterapiyle kombine kemoterapiyle tüketilir. Lenfoid seri tüketimi hazırlayıcı rejimle kombine adaptif hücre transferi ve IL-2 gibi T hücre büyüme faktörü ilavesi metastatik melanomlu hastalarda tümör eredikasyonunun sürdürülmesini sağlar. MDSC, myeloid ilişkili baskılayıcı hücre; NK, doğal katil hücresi; TReg, regülatuar T hücresi. İnsanda ilk tanımlanan tümör-ilişkili antijen geni, dizi seviyesinde tanımlanan MZ2E genini kodlayan Melanoma-İlişkili Antijen Geni 1 (MAGEA1) idi (15). O zamandan beri tümör hücre yüzeyinde doğal olarak oluşan ve sunulan yüzlerce antijen bulunmuştur. Burada bahsetmek için çok fazla olmalarına rağmen, T hücreleri tarafından tanınan yüzlerce epitoptan birkaçı Cancer Immunity Peptide Database de ( listelenmiştir. Aslında, tümör immünologları T hücrelerinin hangi tümör-ilişkili antijenleri tanıyabildiği hakkında daha derin bilgiye sahipler. Hedeflenebilir moleküler yapılar aşağıda listelendiği gibi beş ana kategoriye ayrılmıştır. T hücreleri tümör üzerindeki değişmemiş dokufarklılaşma antijenlerini tanıyabilir. Tümör hücreleri farklılaştıktan sonra da genellikle kökenleri olan dokuya özgü antijenleri üretmeye devam ederler. Doku-farklılaşma antijenleri ACT ye dayalı terapi için mükemmel hedefler olabilir, ama bu yalnızca hayati önemi olmayan dokular için geçerlidir. Örneğin, CD19 hedefli immünoterapiye başarılı cevaplar veren B hücreli lenfoma hastalarında aynı zamanda, normal poliklonal CD19+ B hücrelerinin uzun süreli baskılandığı gösterildi (5,7). Aynı şekilde,
5 Şekil.2 Tümör ilişkili antijenlere spesifite göstermelerini sağlamaları için T hücrelerini işlemenin üç yolu T hücrelerini, günümüz klinik çalışmalarında, tümör-ilişkili antijenleri tanıyabilecek biçimde işlemenin çeşitli yolları bulunmaktadır. Eğer bir hasta hali hazırda var olan reseptör yapılarıyla tanınabilecek bir tümör-ilişkili antijen eksprese ediyorsa, hastanın otolog T hücreleri bu reseptörleri eksprese edecek şekilde genetik olarak işlenebilir. Bu yeni reseptörleri oluşturmanın çeşitli yolları vardır: A) Göreceli olarak iyi antitümör cevabı veren T hücreleri hastada saptanır ve bunlar klonlanır. Bu hücrelerin reseptörleri (TCRs); tedavi edilecek hastanın otolog T hücrelerini enfekte edecek olan retrovirüslere veya lentivirüslere klonlanır ve yerleştirilir. B) Kimerik antijen reseptörleri (CARs) de çeşitli yollarla oluşturulabilir. En sık olarak yapılanı; antikorların değişken bölgelerini kodlayan sekansların, T hücrelerini aktive edecek olan TCRların hücre içi domainlerine yerleştirilecek olan tek bir zincir haline dönüştürülecek biçimde işlenmesidir. Bu CARların hedef hücrelerin üzerindeki yapıların MHC ye bağımlı olmadan tanıyabilmelerini sağlayan antikor benzeri spesifiteleri vardır. C) Tümör antijenlerini tanıyabilecek biçimde humanize edilmiş farelerden de TCRlar elde edilebilir. Bu fareler insan MHC I ve II moleküllerini eksprese edebilir ve ilgilenilen tümör antijenine karşı immünize edilebilir. İlgilenilen MHC kısıtlı epitoplara spesifik fare T hücreleri izole edilir ve TCR genleri rekombinant vektörlere aktarılır ki bu vektörler hastanın otolog T hücrelerinin genetik olarak işlenmesinde kullanılır. karsinoemriyojenik antijen (CEA) e özgü T hücreleri kolon kanseri hastalarında ve farelerde kullanıldığında kanser yıkımını sağlamasıyla birlikte geçici olarak normal kolon mukozasının yıkımına da yol açmıştır (16,17). Melanosit Farklılaşma Antijenleri (MDAs) PMEL (gp100 olarak da bilinir) gibi, T hücreleri tarafından tanınan melanoma antijenleri-1 (MART1), tirozinaz, tirozinaz bağımlı protein 1 (TYRP1) ve TYRP2 birçok melanoma tümörü tarafından üretilir ancak, aynı zamanda melanin üretimiyle bağlantılı olan derinin stratum bazale sindeki normal melanositlerde, gözdeki retinal pigmentli epitelde ve iç kulakta da üretimi olur (18,19). Önceki antijen klonlama çalışmalarına göre, mutasyona uğramamış bireysel MDA lar, TIL bağlantılı immünoterepide hedefleme
6 için güçlü adaylar olarak önerilmiştir (20). Ancak, PMEL ya da MART1 e özgü gen mühendisliğiyle üretilmiş TCR lü T hücreleri, tedavi edilen hastaların deri, göz ve kulaklarındaki normal melanosit yıkımını meydana getirmiştir. Ve bu zararlı etkiler bazen kortikosteroit tedavisiyle müdahale gerektirebilir (21). Oküler toksisite, bir fare modelinde PMEL e özgü T hücreleri kullanıldığında da gözlenmiştir (22). Tarafsız klinik verilerine göre 36 hastadan 9 u (%25) bu denemelerde tedavi oldu, ancak yalnızca bir hasta tedaviye komple cevap vermiştir (21). Tam tersine, bazı durumlarda mutasyona uğramamış bireysel antijene yönelik TCR lere sahip olmalarına rağmen, TIL toplulukları göz ve kulak toksisitesine sebep olmamaktadırlar (4,23). Tümör hücrelerinin tamamını öldürebilen uzun süre dayanıklı immün cevaplar; T hücrelerine bağlı olan toksisiteye sebep olmadan başarmaktadırlar. Bu durum bizlere doğal olarak oluşan TIL lerin melanomadaki mutasyona uğramamış bireysel antijenler dışındaki antijenlere yanıt oluşturduğunu düşündürmektedir. Tümör-spesifik T hücreleri mutant gen ürünlerini tanıyabiliyor. İnsan melanomunun ekzomik sekanslamasını da içeren son çalışmalar göstermiştir ki çok sayıda mutasyonel olayların varlığı kanser immünolojistlerinin eş anlamlı olmayan birçok mutasyonu hedeflemesine olanak sağlamaktadır (24). Bu da yeni epitopların oluşumuyla sonuçlanır. Tümörlerin doğasında olan genetik dengesizlik bir çok potansiyel tümör-ilişkili antijenlerin oluşumuna neden olmaktadır. Bu antijenler, gen kodlama bölgelerinde somatik tek-baz mutasyonları, açık okuma gövdeleri oluşturan stop kodon mutasyonları, füzyon proteinlerini oluşturan genlerin yeniden düzenlenmesi, çerçeve kayması mutasyonları sonucunda gelişmektedir. Özellikle ekzomik sekanslamadan elde edilmiş bilgilere göre melanomlardaki mutasyon sayısı diğer kanserlere nazaran daha fazladır (25). Melanomların içerdiği çok sayıda mutasyon özellikle ultraviyole ışınlarıyla oluşan hasarların sonucudur. Ultraviyole ışınlarına en hassas olan pirimidinler (sitozin ve timin) karakteristik olarak C den T ye ve CC den TT ye geçişleri oluştururlar. Daha uzun dalga boyları DNA üzerinde oksidatif hasara yol açar. Ultraviyole ışınları aynı zamanda mitojenik özelliklere sahiptir. Bu etkisini melanositlerdeki melanotropin ekspresyonunu tetiklemekle ortaya çıkarır ve bu mutajenlerde potansiyel bir şiddetlenme oluşturur (26). Neo antijenleri tanıyan potansiyel T hücreleri timusta tolere edilmezler. Ayrıca T hücreleri tarafından hedeflenen bu mutasyonlardan bazıları kanser fenotipini belirlemek için gereklidir. Belirli nokta motasyonlarının sonucunda ortaya çıkan tumorspesifik antijenleri regulator T hücreleri tarafından tanındığı gösterilmiştir (27). Viral antijenlerin tanınması. Transforme virüslerle birliktelik gösteren bazı kanserler viral ürünler eksprese edebilirler. Bu ürünler normal dokuda bulunmadıklarından, çekici hedefler olarak algılanırlar. Belirli bir kanser histolojisinin alt tipine uygulanabilir olmasına rağmen, EBV ve HPV gibi kanser ilişkili virüslerden üretilmiş onkojenik proteinleri hedeflemek mümkündür (28,29). Farelerde yapılan çalışmalar gösteriyor ki özellikle transforme onkojenlerden veya driver mutasyonlardan türemiş tümor ilişkili mutant epitopların başarılı hedeflenmesi tümörlerin tam destrüksiyonuna neden olabilir (30). Tümör hücreleri tarafından eksprese edilmiş virüslerde kodlanmış transforme proteinlerin hedeflenmesi de tümör eliminasyonunu destekleyebilir. Tümör-spesifik T hücreleri, epigenetik değişiklerle üretilmiş antijenleri tanıyabilir. Kanıtlara göre kanser hücrelerindeki epigenetik değişimler bazı tümör histolojilerinin primer oluşturucusu olabilir (31). Epigenetik dönüşümler, non-mutant proteinler kategorisinden kanser germline antijeni veya kansertestis antijenleri olarak adlandırılan antijenlerin ekspresyonunu tetikleyebilir (32). Kanser-testis antijenleri normalde testisler ve fetal overlerdeki germinal hücrelerden sentezlenir, ama aynı zamanda birçok tümör tarafından da üretilebilirler. Kansertestis antijenleri normal hücrelerde az oldukları ve birçok tümör tipi tarafından üretildikleri için en çekici immünoterapötik hedefler arasında yer alırlar. Kanser-testis antijenleri normal non-germinal dokuda (plasenta istisnası hariç) inaktif olan genlerin
7 ürünleridirler. T hücreleri bu antijenleri erkek germinal hücreler üzerinde tanımazlar çünkü bu hücreler MHC I veya MHC II molekülleri eksprese etmezler (33). Kanser-testis antijenlerini kodlayan genomik DNA genelde tümörlerde dimetiledirler (33) ve disregule kanser epigenomu germinal hücre epigenomuyla bazı özel karakteristikleri paylaşabilir (34). Bu özelliğe dayanarak epigenomu modüle eden ve kanser-testis antijenini hedef alan immunterapilerin kombine tedavi yaklaşımları önerilmiş, fare modeli ve insanın in-vitro sistemi üzerinde denenmiştir (35,36). Tümörtestis antijenlerini yaygın bir şekilde eksprese eden tümörler şunlardır: melanom, akciğer karsinomu, baş boyun, özefagus ve mesane kanserleri (37). Regülatör veya genetik mühendislikle değiştirilmiş T hücreleri tarafından hedeflenebilen 110 kadar kansertestis antijeni mevcuttur. Genlerin birçoğu gen duplikasyonundan türetilmiş multigen ailelerin bir kısmıdır. Bu genlerin fonksiyonları tam olarak bilinmemektedir. Kanser-testis antijenlerinin yaklaşık otuzu X kromozomu tarafından kodlanır. Bu antijenler özellikle, kanser immünologlarının arasında büyük ilgi uyandırmıştır. Bu antijenlerin çoğu örn. Kanser-testis antijen 1 (CTAG1; aynı zamanda NY-ESO1 olarakda bilinir), MAGEA3 [REF. 38] ve sinovyal sarkoma X breakpoint 2 (SSX2) klinik çalışmaların güncel odağı olmuştur. Genetik mühendislikle değiştirilmiş T hücre reseptörleriyle otolog T hücrelerini kullanarak hedeflenmiş CTAG1 çalışmasında 17 metastatik melanom hastasından 7 si (%47) ve 10 metastatik sinovyal sarkom hastasından 8 inde (%80) objektif klinik yanıt gözlenmiştir bu hastaların tamamı standard ön tedaviye tabii tutulmuşlardır. Normal dokuya karşı hiçbir toksisite görülmemiştir (6). Bu çalışma epigenomdaki kanser ilişkili dönüşümlerden türemiş neo-antijenlerin T hücre aracılıklı terapötik yaklaşımı onaylamaktadır. Farklılaşmamış tümör damar ağı ve stroması üzerindeki antijenlerin tanınması. Birçok çalışma T hücrelerinin tümör kitlesindeki değişmiş hücreleri nasıl öldürdüğü üzerine odaklanmış durumdadır. Ancak, tümörler büyük miktarlarda stroma hücreleri ve NK hücreleri, myeloid diziden farklılaşmış hücreler, B hücreleri ve tabi ki değişik T hücre popülasyonları gibi lökositler barındırırlar (39). Yakın zamandaki bulgular gösteriyor ki bu hücreleri hedef almak, tümörün ortadan kaldırılmasını destekleyebilir (40). Örneğin araştırmalardan biri, fibroblast aktive edici protein salgılayan tümör filtre eden mezenşimal hücrelerin ameliyatla çıkarılmasının tümör nekrozunu sağladığını göstermiştir (41). Bu da bu hücreleri tanımak için ayarlanmış T hücrelerinin tümörü direkt hedef almadan tümör karşıtı bağışıklığı sağlayabileceği anlamına gelmektedir. Son olarak, tümör hücreleri besin elde etmek için düzenli olarak canlının şu anki damarlarından veya kemik iliğindeki endotelyal hücrelerden köken alan yeni damar ağına ihtiyacı vardır. Yeni damar ağı var olan damar ağına göre vasküler endotel büyüme faktörü 2(VEGFR2) gibi belirli moleküleri daha fazla salgılamasından ötürü bağışıklık saldırısının asıl konusu haline gelmektedir (42-44). Ayrıca buradaki önemli bir nokta da şu ki fare tümörlerindeki damar ağı normal dokudan ayırt edilebilir olmasına rağmen çoğu çalışmada genellikle bir aydan daha yeni. Bu yeni damarlar, tanıdan yıllar önce oluşmuş insan tümörlerinde bulunanlardan farklı olabilir. T hücrelerinin tümör karşıtı işlevi. Klinik ve klinik öncesi verilere dayanarak fark edilen şaşırtıcı bir gerçek var ki o da literatürde tümörün reddedilmesini oluşturan karışık hücresel mekanizmalara dair hiç bir genel kanı yok. T hücreleri antijenlerinin salgılandığı ve sitokin, kemokin ve anti-anjiyojenik faktörleri salgılayabilecekleri bölgelere doğru yönelirler. Etkili tümör karşıtı cevabı oluşturan T hücreleri, apoptoz uyarıcı molekül ya da sitotoksik granül salgısıyla tümör hücrelerine karşı direkt sitotoksik cevabı oluşturabilir. Farklılaşmış olgun CD8+T hücreleri ve bazı tip CD4+T hücreleri, interferon-y(ifny)yı ve hem tümör hücrelerinde hem de tümörde bulunan antijen sunucu hücrelerde sınıf I ve II MHC molekülerinin salınımını upregule ederek bağışık cevabı arttıran tümör nekroz faktörünü salgılar. CD4+T hücreleri, sitotoksik CD4+T hücrelerinin işleyişi de dahil olmak üzere, doğumdan gelen ve adaptif bağışıklığın aktivasyonu ve düzenlenmesini kontrol edebilir. Ayrıca sonucunda yeni T hücrelerini olgunlaştırmakta ve doğuştan gelen
8 bağışıklığı aktive edecek şekilde APClerle birleşip onları lisans layabilmektedir (165). ACT immunoterapisi tümörleri yok edebilir Tümöre özel lenfositlerin transferine dayanan bağışıklık tedavisinin birkaç on yıl öncesine dayanan zengin bir geçmişi vardır (45-47). ACT temelli tedavilerin bağışıklığı güçlendiren kanser aşıları gibi diğer bağışıklık tedavilerinden farkını ayırt etmek önemlidir. Tedavi amaçlı aşılar kullanımı kolay olduğundan ve Birleşik Devletler Ulusal Kanser Enstitüsü gibi yerlerdeki klinik ve klinik öncesi denemelerde düşük toksisite gösterdiği için daha çekici gelmektedir (48-56). Aşılar prime-boost rejimleri, çapa MHC düzenlemeleri, sitokinler ve yan uyarımlarla geliştirilebilir (57-62). Ancak aşıların klinik denemelerinin geri dönüşleri gösterdi ki aşılar hastaların ancak %4 ünde objektif kanser gerilemesini başlatabilmektedir (63-64). Tedavi amaçlı kanser aşılarından US FDAnın da testislerin alınmasına dayanıklı prostat kanserine yönelik tedavisini onayladığı sipuleucel-t, hayatta kalımı 4.1 ay kadar uzatmış olsa da aşının, hastalığın ilerlemesinde önemli bir fark oluşturduğu gözlenmedi ve hastalarda hiç bir kanser gerilemesi ve ya uzun zamanlı bir etki deneyimlenmedi (65). Önemli olan bir nokta da şu ki, yüzlerce klinik denemesinden hiç biri metastatik kanserlerde istenen tedavi kavramına ulaşabilmiş değil ve eğer ölçülebilir bir tedavi avantajı varsa bu ortalama bir değerde ve yıllarla değil aylarla ölçülebilecek bir seviyededir. TIL esas alınarak yapılan güncel terapiler. Metastaz yapmış melanomlu hastalar için TIL lerin edinilmiş hücre transferiyle yapılan immünoterapi en iyi tedavi yöntemidir. Ancak, bu terapilerin de limitleri var. Her hasta bu denemelere giremiyor; hastaların şu anda kullanılan IL-2 ve lenfotükenim tedavilerinin yoğunluğuna dayanacak kapasitede olması gerektiğinden, bu tedavi yöntemi ancak iyi performans gösteren hastalara uygulanabiliyor. 4. evre melanomu olan 93 hastayla yapılan yeni bir çalışma üç sıralı denemeyi tanımlıyor, bu denemelerde hastalara otolog TILlerin edinilmiş hücre transferi, IL-2 ile birlikte verilmekte ve bunu takiben hazırlama rejimleri de uygulanmaktadır. Tarafsız klinik yanıt dereceleri, solid tümorlerde yanıt değerlendirme kriterleri (RECIST) kullanarak değerlendirildiğinde 49% ila 72% arasında değiştiği bulundu (4). Bazı hastalar kısmi yanıtlardan büyük ölçüde fayda sağlasalar da, her hastanın asıl amacı kanserden tamamen kurtulmaktır. Kısmi yanıtın hastalığın ilerlemesinin geçici olarak ertelemesi ise melanomlu hastalar için kabullenmesi zor bir gerçektir. Önemli olan, 93 hastanın 20sinde (%22) tümor tamamen gerilemiştir ve bu 20 kişinin 19unda (%93) en az 57 aylık takip altında devam eden gerileme sağlanmıştır. Hatta bu hastaların bazıları 8 yıldan fazladır hayatta ve hastalıksız yaşamakta ve muhtemelen metastatik melanomu tamamen tedavi edilmiştir. Tamamen yanıt alınma olasılığı önceden yapılan terapinin önemi olmaksızın benzerdir. Bu sebeple, otolog TILlerle yapılan ACT terapisi metastatik melanomu olan hastalarda uzun ömürlü tam bir yanıt sağlayabilir ve önceden yapılmış tedaviye bakmaksızın benzer bir fayda sağlamaktadır (4). Yeni raporlara göre bazı diğer gruplar %48 tarafsız yanıt oranı elde etmişlerdir (66,67). Başarıya rağmen, neden bazı hastaların bu tedaviye iyi yanıt verip diğerlerinin vermediği halen bilinmemektedir. Başarılı ACT-immünoterapisinin etkenler fareler üzerinde çalışılmıştır (68) ve T hücre farklılaşmasının iç yüzü hakkındaki yeni bilgiler insan çalışmalarından elde edilmiştir (4), bu konu daha ayrıntılı anlatılacaktır. Tümorlerin birçok değişik mekanizma kullanarak, bazı durumlarda T hücre terapisinden kaçabildiği gösterilmiştir (11,12,69). Ek olarak, fare ve insanlarda yapılan çalışmalar transfer edilmiş T hücrelerinin hedef spesifikliğini, mikroçevrenin doğasını ve nasıl hedeflendirildiğini (arttırılmış-yoğunluklu lenfotükenim kullanılımı dahil olmak üzere) ve kullanılan hücrelerin farklılaşma durumlarını araştırmıştır. Aşağıda tarif edildiği üzere, genetik olarak değiştirilmiş T hücreleri değişik histolojik yapıdaki kanserleri yok etmede kullanılabilir. Ancak, tamamen anlaşılamayan sebeplerle, doğal oluşan TILlerin faydası sadece melanom ile sınırlıdır. Diğer tümörler, kolon ve meme kaynaklı olanlar gibi, T hücresi içeriyorlar (39,70), ama
9 bu T hücrelerinin özgünlüğü ve işlevi belirsizliğini korumaktadır. Terapötik TILlerin melanomlar için daha verimli olmasının bir açıklaması da melanomların diğer hemen her tür kansere göre daha fazla mutasyon içermesidir (25). Bazı tümörler özellikle çocukluk çağında ortaya çıkan, testiküler germ hücreli tümörler ve lösemiler- çok az mutasyon içermektediler. Bunların kanserli fenotipleri büyük ölçüde epigenetik bozuklukların sonucu olarak gözükmektedir (31,71). İlginç olarak, melanomlar yüksek mutasyonlu genom içermekte yalnız değillerdir, bazı primer akciğer tümörleri de onlara katılmaktadır (71), ışıktan ziyade tütün dumanıyla uyarılmış aşırı çevresel mutasyona uğrayabilirler. Bu gözlem, akciğer kanserindeki çok sayıdaki mutasyonun da T-hücreli ACT tedavisinin hedefi olabileceği görüşüne yöneltmektedir. Şimdilerde, doğal olarak oluşup tümörlere infiltre olan T hücre populasyonu sadece melanomlardan izole edilip geliştirilmesine rağmen, hemen hemen tüm tümör hücre türleri tümör hücre yüzeyini tanımak üzere geliştirilmiş T hücreleri (5, 6, 16, 72, 73) tarafından lizise uğratılabilir ve bu T hücrelerinden sitokin ve kemokin salınımını uyarabilirler. Bu da, T hücrelerinin, tümörleri hedef alan özgül reseptör eksprese etmesi için genetik olarak değiştirilmesini içeren yaklaşımın gelişmesine neden olmuştur. ACT için T hücrelerinin genetiğinin değiştirilmesi. T hücrelerinin genetikleri, hedef antijenler için yüksek özgüllük ve afiniteli T hücre reseptörü üretmek üzere çeşitli teknikler kullanılıp değişikliğe uğratılabilir (74-76). En son olarak, araştırmacılar hedef antijene özgül reseptör antijen kodlayan retrovirus ve lentivirus kullanmaktadır. Gen mühendisliği bu tedaviye duyarlı tümör histolojilerinin çeşitliliğini büyük ölçüde arttırabilir; yeni literatürdeki birkaç örneği vermek gerekirse, bu çeşitlilik şimdilerde nörüblastom (77), sinovial hücre sarkomu (6), lösemi ve lenfoma (3, 5, 7) içermektedir. Güncel çabalar burada özetlemek için çok sayıda: sadece Amerika daki 1119 gen-terapi protokollerinin 765 i Rekombinant DNA Danışma Komitesi tarafından, kanser tedavisine yoğunlaştığı kabul edilmektedir (78). Gen mühendisliği, hemen hemen tüm kanser histolojilerini hedef alabilecek kapasitededir, çünkü T hücreleri, tümör kitlesinin içindeki transforme olmuş ve olmamış hücrelerden eksprese edilen hedef antijenleri hedef alması için farklılaştırılabilir. Bu tanıma yönelik ayrıntılar aşağıda daha ayrıntılı anlatılmıştır. Güncel klinik denemelerde kullanılan T hücre reseptörlerinin birkaç kaynağı olabilir (Şekil-2). Eğer yüksek afiniteli T hücre reseptörleri hastadan izole edilebilirse, özellikle ACT ye mükemmel yanıt veren bir hastadan, bu T hücre reseptörü kodlayan genler retrovirus ya da lentiviruse klonlanabilir, ve daha sonra bunlar da HLA kısıtlayan elementleri uyan diğer hastalardan alınan otolog T hücrelerinin transdüksiyonu için kullanılabilirler (21). Değiştirilmiş reseptörlerin afinitesi tamamlayıcı-belirleyici bölgeler ya da yönlenmiş evrim yoluyla arttırılabilir, ancak bu değişimler özgüllüğü azaltabilir (79). Fareden izole edilmiş T hücre reseptörleri kullanmak da mümkündür. Fare T hücre reseptörü eksprese etmesi için değiştirilmiş insan T hücreleri, insan klinik denemelerinde CEA ve PMEL yi hedef almak için kullanılmaktadırlar ve bunları alan hastalarda, hedefte zehirlenme yaratabilme olasılığı olmasına rağmen, tarafsız klinik yanıt sağlanmaktadır. Kimerik antijen reseptörleri (CAR) transdüklenmiş T hücrelerine özgüllük sağlamak için başka bir yöntemdir ve antikorlardan kaynak alabilir (Şekil-2). Antikor genlerinin değişken bölümleri, T hücrelerini aktive edebilen T hücre reseptörü intraselüler alana kaynaştırılmış tek-zincir yapıları kodlayabilecek şekilde değiştirilebilir. Daha sonra rekombinant retrovirusler T hücrelerini antikor benzeri özgüllüğe sahip olan CAR ile birlikte transdüklemek için kullanılabilir. Bu sebeple CARler, hedef hücrelerin yüzeyindeki MHCkısıtlanmamış yapıları tanıyabilir, öte yandan TCRler genel olarak, peptid kompleksi olarak hazırlanıp MHC moleküllerine sunulan intraselüler antijenleri tanıyabilirler (80,81). Son olarak söylemeye değer bir diğer yaklaşım da, T hücrelerinin kendisini değiştirmek yerine, bispesifik antikorları değiştirip tümörlerin T hücre tarafından tanınmasını arttırmaktır (82,83). Bunların bir alt grubu, bispesifik T hücre bağlayanlar (BITE) olarak bilinen, aynı kökenli TCR-MHC etkileşimi olmasa da T hücrelerini tümöre bağlayıp tümör eliminasyonunu sağlayabilir.
10 Geni Düzenlenmiş T hücrelerinin Avantajları ve Dezavantajları. Geni düzenlenmiş T hücrelerinin birkaç avantajı vardır. Bunlar kullanılan reseptörün biyofiziksel özelliklerinin ve kullanılan hücre popülâsyonlarının (84)(mesela diferensiyasyonun erken evrelerinde bulunan hücreler)(85) immünoterapist tarafından seçilebilmesidir. ACT için yapılan T hücrelerinin genetik modifikasyonu alıcı T hücrelerine yeni antijen reaktivitesi sunmakla kalmaz, iletimi yapılan T hücrelerine verimlerini arttırmak adına genler de eklenebilir. Bu genler; kostimulasyon (86), apoptozun önlenmesi (87), inflamasyonun başlatılması (88-90) ya da homeostatik proliferasyon ile T hücresi dönüşünü (91) başlatan kemokin reseptörlerini kodlayan genleri kapsamaktadır. Son olarak, T hücrelerinin diferansiyasyonunu ve kaderini kontrol eden transkripsiyon faktörlerini ekspres edebilen T hücrelerini düzenlemenin mümkün olduğu söylemeye değer. Tabii, bu manipulasyonların her biri doğal olarak meydana gelen tümör spesifik T hücrelerinde yapılabilir veya reaktivite kazandıran gen düzenlemeleriyle birlikte uyum içerisinde yapılabilir. Geni düzenlenmiş T hücrelerini kullanmanın bir de dezavantajları var. Güncel yaklaşım sadece monoklonal spesifikliğe sahiptir ve bu da tümöre karşı dar bir saldırı gibi görülebilir, bu da antijenden yoksun varyantların gelişmesini kolaylaştırmaktadır. Ek olarak, TCR α- ve β zincirlerinin yanlış eşleşmesi meydana gelebilir (92), bunların insan hücrelerindeki verimliliği sorgulanmaktadır (93). Hematopoetik kök hücrelerin (HSCs) transdüksiyonu, rekombinasyon-aktivasyon genlerinin ekspresyonunu allelik dışlaması ile (94,95) kapatarak yanlış eşleşmeyi bastırabilmektedir. Alternatif olarak, fare reseptörlerinden alınan transmembran domainleri kullanmak veya insan γδ hücrelerini iletmek yanlış eşleşmeyi (96) sınırlayabilir. Düzenlenmiş genli T hücrelerinin kullanımındaki bir başka sorun, beklenmeyen toksisitenin oluşmasıdır. Hedef dışı toksisite, antijenik mimikri veya çapraz reaktivite (hem de TCR yanlış eşleşmesi (92)) yüzünden istenmeyen yapının tanınmasından doğmaktadır, hedefli toksisite ise T hücreleri istenilen moleküler hedefi tanımaktadır. Her iki tanıma da doku zararına sonuç verebilir ve sekonder etkileri, mesela sitokin fırtınasını (81,97) tetikleyebilir. Fakat ACT terapilerinin güvenliği, ters toksisite durumunda T hücrelerinin çabuk tahribini sağlayan yeni teknolojilerle geliştirilebilir. Örnek vermek gerekirse, T hücreleri, aksi halde bioinert küçük molekül ilaçlar (98) ile aktive edilince hızlı hücre ölümüne neden olan kaspaz 9 un indüklenebilir formunu eksprese edebilecek şekilde modifiye edilebilir. Gen terapisinin halledilecek en büyük engeli olarak normal dokularda istenmeyen toksisiteyi yaratmadan kanseri yok edebilmek için hedef alınacak antijenlerin belirlenmesi kalmaktadır. Bozulmuş host mikroçevresini tüketmek Kanserli hastaların küresel olarak immünsüprese olduğu konusundaki erken iddialara karşı, çoğu kanserli hastada anlamlı immünsüpresyon geç evrelere kadar görülmemiştir. Fakat tümör mikroçevresindeki immünsüpresif hücresel elementler uzun olarak gözlemlenmiştir (99-101). İmmünsüpresyonu kaldırmak amacına yönelik olarak, araştırmacılar tedavi öncesi, lenfoid hücreleri yok edebilecek tüm vücut ışınlanması veya kemoterapisi rejimleri geliştirmiştir. ACT bazlı tümör immünterapinin host immün sistemi ortadan kaldırarak etkisinin arttırılacağı düşünülene aykırı gibi görünmesine rağmen, farelerde ACTden önce lenfotükenim rejimlerinin kullanılmasını destekleyen data açık ve güçlüdür (102,103). Bu yaklaşımların insan klinik deneylerinde kullanılan ACT bazlı immünterapileri geliştirebileceği yönünde kanıtlar da vardır (2,104,105). Lenfopenik çevrede tümör-reaktif T hücrelerinin artan etkisinin altında birkaç mekanizma yatıyor olabilir. Bu faktörler immünosüpresif myeloid kökenli baskılayıcı hücrelerin(mdsc) elenmesini veya yeniden programlanmasını da içermektedir, bunlar odak konumuzda başka bir yerde tartışılmıştır (106). Kısaca, MDSC ler kronik infeksiyonlarda (101,107) ve tümörlerde artmış sıklıkta bulunan CD11b+GR1+hücrelerin heterojen bir popülasyonudur. Yaklaşık iki dekat önce yapılan klasik bir deneyde, MDSClerin GR1-spesifik antikorların kullanılarak yok edilmesi tümör saldırısından korunma ile sonuçlanabilir (108). Daha güncel olarak, IL-12
11 Şekil.3 Progresif T hücre farklılaşması bu hücrelerin çoğalma ve antitümör kapasitesinin düşmesine sebep olur. Antijenik uyarımı takiben T hücreleri progresif fenotipik değişimlere maruz kalır. Uyarının şiddetine ve süresine bağlı olarak; çoğalma ve farklılaşma sürecine girerler. T hücreleri, antitümör etki gösterebilmeleri için farklılaşma sürecini tamamlamak zorundadırlar. Ancak adoptif transfer hakkında yapılan deneyler gösteriyor ki transfer edilecek hücrenin farklılaşması ile antitümör kapasitesi ters orantılıdır. T hücre farklılaşma süreci, çoğalma ve kendini yenileme yetilerindeki azalmayla sonuçlanmaktadır. Mesela CD8+ T hücrelerini ele alırsak; tümörlere karşı T hafıza kök(t SCM ) hücreleri merkezi hafıza T (T CM ) hücrelerinden daha etkiliyken, T CM hücreleri de efektör hafıza T (T EM ) hücrelerinden daha etkilidir. APC, antijen-sunan hücre; CCR7, CC-kemokin reseptörü 7; IL-2Rβ, IL-2 reseptörünün β zinciri; TCR, T hücre reseptörü. (Şekil, (117) (2011) Macmillan Publishers Ltd. ın izniyle değiştirilmiştir. Tüm hakları saklıdır.) (89,90) kullanarak kemik iliği kaynaklı myeloid hücrelerin immünsüpresif özelliklerini kaybetmek üzere yeniden programlanabildiği gösterilmiştir. Böylece, MDSClerin baskılayıcı aktivitelerin modülasyonu ACT sonrası görülen antitümör T hücre cevaplarının artışına katkı sağlayabilir. Ek olarak, aktive eden sitokinler (109) için yarışan endojen hücrelerin tüketilmesi, HSC transplantasyonu (102) yolu ile adoptif olarak transfer edilmiş T hücrelerinin artışı ve tüm vücut ışınlanmasına (110) eşlik eden bakteriyal translokasyona aracı olarak fonksiyonu artan APCler ile ACT güçlendirilmiştir. Son olarak, farelerdeki ACT bazlı immünoterapiyi efektör T hücreleri arttırmasına rağmen, muhtemelen direkt hücresel inhibisyon ile ve ayrıca IL-2(112) nin mevcudiyetini azaltarak regülatör T hücreleri bu terapilerin (111) etkisini azaltmaktadır. Efektör ve regülatör T hücreleri arasındaki, IL-2 ile yönetilen, bu yin ve yang ilişkisi literatürde tartışılmıştır (113,114). Bir araya getirildiklerinde, kanserli hastalarda bulunan fazlaca disregüle olan immün mikroçevresini yenme amaçlı stratejilerin T hücre bazlı immünoterapileri çarpıcı biçimde geliştirdiği çok açıktır. T hücre farklılaşma evresi ve ACT Lenfotükenimi, ACT bazlı immünoterapilerle olan tedavilerde dikkat çekici etkiye sahip olabilir, fakat klinik cevapları etkileyen tek faktör değildir. Hem fare çalışmalarından hem de klinik deneylerden elde edilen gelişmekte olan bulgular, edinilmiş olarak transfer edilen T hücre popülasyonlarının farklılaşma evresine bağlı olan intrinsik özelliklerin ACT bazlı yaklaşımların başarısında önemli olduğunu göstermektedir (4,115,116).
12 Şekil.4- Yüksek derecede bireyselleştirilmiş tıp Ucuz ve hızlı uygulanabilen DNA sekans analizi teknolojilerinin gelişmesi; yeni tümör-ilişkili antijenlerin saptanmasında yüksek derecede bireyselleştirilmiş bir yaklaşımı mümkün kılmıştır. Aday mutant T hücre epitoplarını saptamak amacıyla bir hastanın tümörünün eksprese ettiği genlerin sekans analizi yapılabilir. Hastanın MHC moleküllerine bağlanabilecek ilgili epitoplar peptit tahmin algoritmaları yardımıyla öngörülebilir (bkz. HLA Peptide Binding Predictions websitesi). Eğer mutant proteinlerden elde edilen peptitler yeni MHC-kısıtlı hedef molekül olabilme kapasitesi gösteriyorlarsa bu aday peptitleri kullanmak için en az üç yoldan biri seçilir. Bu yolların birincisi, tetramersi ayıraçlar yardımıyla ilgili antijenleri (driver onkogenlerden türetilenler gibi) eksprese eden hücreler saptanır veya sınıflandırılır. İkinci olarak, aday peptitler hastanın tümör içinde veya periferik kanında hali hazırda var olan T hücrelerini stimule etmek amacıyla kullanılabilir. Üçüncü olaraksa; tümör antijenleri, insan MHC molekülleri için transgenik olan humanize farelerin tümörspesifik T hücrelerini başlatmak için kullanılabilir. Eğer oluşturulan T hücre popülasyonları hastanın tümörüne spesifite gösteriyorsa bunlar çoğaltılabilir ve insan orijinlilerse edinilmiş olarak transfer edilebilirler. Alternatif olarak, fare T hücreleri genetik mühendisliği uygulamaları için uygun TCRların tespitinde kullanılabilir. TIL, tümörinfiltre lenfosit. CD8+ T Hücre Farklılaşması. CD8+ T hücreleri, hem farelerde hem insanda tümör reddini tetikler ve farklılaşma durumlarına göre farklı hafıza alttiplerine sınıflandırılırlar (85,117). Mevcut bilgiler göre, CD8+ T hücreleri, merkezi hafıza T hücrelerine(=central memory T cells=tcm cells) ve efektör hafıza T hücreleri(=effector memory T cells =TEM cells)ne doğru progresif bir farklılaşma geçirmektedirler (85,116,118)(Şekil-3). Farklılaşmanın derecesi, T hücresinin antijen spesifik aktivasyonu sırasında karşılaştığı TCR (T hücre reseptör) sinyalinin kuvvetine ve sitokin ortamına bağlıdır. TCR transgenik farelerin kullanıldığı deneyler, kendi spesifik antijeni ve IL-2 ile birden fazla sayıda stimule edilen CD8+ hücrelerin hayatta kalma ve proliferasyon oranının yalnızca bir kez uyarılmış veya hiç uyarılmamış hücrelere göre daha düşük olduğunu göstermiştir. Bu CD8+ T hücreleri, hedef hücreleri sindirme ve IFNγ üretme gibi antitümöral etkinliklerinde(22) önemli olduğu düşünülen özellikleri kazanmalarına rağmen; edinilmiş transfer nedeniyle asıl antitümoral aktivitelerinde düşüş olmuştur (115). Tumor-spesifik T hücrelerin fonksiyonundaki bu düşüş, hücre içi kontradüzenleme (cell intrinsic counterregulation) de dahil bir takım faktörlere bağlanmıştır (119). T hücre farklılaşması, granzim ve
13 aktif oksijen ürünlerinin artmış üretimine, bunun yanında da IL-2 üretim yeteneklerini kaybetmelerine (bu da lenf nodlarına yerleşmelerini ve apoptozla ölmelerini engeller) bağlıdır. Bu bulgular şu hipotezi ortaya koyuyor ki; CD8+ hücrelerin farklılaşma dereceleri, bu hücrelerin çoğalması ve devamlılığıyla ters orantılıdır (116)(Şekil-3). Kansere karşı ACT tedavisinin etkililiği söz konusu olduğunda, naif T hücrelerinin hafıza T hücrelerinden daha verimli olduğu gösterilmiştir (115,120,121). Farelerde(122,123), insan olmayan primatlarda(124), hümanize edilmiş fare modellerinde(125) hafıza havuzunun içinde (memory pool) TCM hücreleri, TEM hücreleriyle karşılaştırıldığında artmış antitümör aktivite göstermiştir. Yeni bulgular, TCM hücrelerinden kaynak alan hücrelerinin insanda devamlılığının sağlanması ve fonksiyon göstermesinin CD62L nin tekrar kazanılmasına bağlı olduğuna işaret etmektedir (126). Klinik çalışmalarda daha genç T hücrelerinde daha yüksek verimlilikle olarak çalışılmasına rağmen(85); bu T hücrelerinin yüksek verimliliğinin edinilmiş transferden önce tamamen farklılaşmış efektör hücrelerden ayrılmasına bağlı olup olmadığı henüz açıklanamamıştır. Son zamanlarda, ilk kez Emerson ve arkadaşları tarafından transplantasyon modellerinde karakterize edilmiş farklı bir CD8+ T hücre hafıza kök hücreleri(tscm) üzerinde ilgi artmıştır (127). Bu hücreler yüksek miktarda kök hücre antijen-1(sca1), B Hücre lenfoma 2 (BCL-2) ve IL-2 reseptörünün β zincirini eksprese etmekte ve diğer hafıza T hücre çeşitleriyle karşılaştırıldığında farelerde daha üstün antitümoral özellik göstermektedir (128). İnsanlarda TSCM hücreleri, CD45RA+ CD45RO- fenotip göstermeleri bakımından naif T hücrelerine benzerlik göstermektedirler. Bu hücreler, IL-7 reseptörünün α zincirini sentezlemeleri bu hücrelerin hayatta kalma şanslarını artırmaktadır (127). Bunun yanında da lenf nodlarına yerleşmelerini sağlayacak CD62L ve CCkemokin reseptörü 7 (CCR7) yi sentezleyebilmektedirler. Ek olarak, insan TSCM hücreleri proliferatif kapasitelerini artıracak eş uyaranları (CD27 ve CD28 dahil) ve yüksek miktarda CD95 ile IL-2Rβ eksprese edebilmektedirler (130,85,117). TSCM hücrelerinin büyük ölçüde prolifere olabilmelerini sağlayan bir genetik programı vardır ve TCM ile TEM hücrelerine de farklılaşabilirler (Şekil-3). Başka bir önemli nokta da insan TSCM hücrelerinin TCM ve TEM hücreleriyle karşılaştırıldığında artmış antitümör aktivitesi göstermesidir ki bu da bu hücrelerin kanserli hastaların ACT tedavisinde daha verimli olabileceğini düşündürmektedir (85,117,128,131). T hücreleri CD62L ekspresyonunu tekrar kazanabilmesine rağmen, farklılaşmanın esas aşamaları sadece tek yönde etkili olarak yürümektedir (124). Bu nedenle ACT ile kanser tedavisinde bazı durumlarda T hücre farklılaşmasını durdurmak veya ters çevirmek istenebilir. Geleceğin ACT temelli immünoterapilerinde hangi hücrelerin transfer edileceği seçilirken daha çok fenotip, telomer uzunluğu, IL-2 üretim kapasitesi ve T hücrelerinin TCR affinitesi etkili olması beklenmektedir. Terapinin etkisinin artırılması amacıyla T hücre farklılaşmasının modülasyonu. Yukarıda da tartışıldığı gibi, efektör CD8+ hücrelerinin farklılaşma durumu antitümoral etkinliklerini belirler. Bununla beraber, hastalardan izole edilmiş TIL popülasyonunda bulunan CD8+ T hücrelerinin farklılaşma derecesi henüz bilinmemektedir. Bazı hastalarda, mevcut tümörspesifik T hücrelerinin son aşamaya kadar TEM hücrelerine farklılaşmış olması da mümkündür. Ek olarak ACT için TIL hazırlanmasında kullanılan kültür koşulları (2 hafta veya daha uzun süren kültür, yüksek dozda IL-2,CD3-spesifik antikor ve bazı durumlarda ışınlanmış allogenik uyarıcı hücreler) de izole edilmiş TIL hücrelerinin ek farklılaşmasına yol açabilir. Bu kuvvetli farklılaşma faktörlerinin kısıtlanmasının TIL hücrelerinin etkinliğini artırıp artırmayacağı ise bilinmemektedir. Üstelik T hücrelerinin antitümoral aktivitelerindeki bu artışın-eğer gerçekleşirse- bu faktörlerin kısıtlanmasının yol açtığı TIL hücrelerinin sayıca azalışını kompanse edip edemeyeceği bilinmiyor. Bununla beraber, IL-2 efektör T hücrelerinin farklılaşmasını sağladığından ve apoptoza hassasiyetini artırdığından, kültürde IL-2 konsantrasyonunu düşürmenin ACT için yarar sağlayıp
14 Şekil.5 Hedeflenmiş terapilerin edinilmiş hücre transferi tabanlı immünoterapilerle kombine edilmesinin gerekçesi A) Bir hedeflenmiş terapi (vemurafenib gibi) tümör hücrelerinde apoptozisi tetiklemek için kullanılabilir. B) Ölmekte olan tümör hücrelerinden salınan antijenler; lokal drene edici lenf nodlarında veya dokunun içinde bulunan APCler tarafından gittikçe artan hızda edinilir. Bu APCler; tümör antijenlerini işler ve elde ettikleri tümör kökenli peptitleri T hücrelerine sunarlar. Bu; adoptif olarak trasnfer edilen tümör-spesifik T hücrelerinin uyarımına yol açabileceği gibi, diğer endojen T hücre popülasyonlarını da uyarabilir. İşte bu noktada, tümör-spesifik T hücrelerinin aktivasyonunun etkinliğinin artırılması immünstimüle edici sitokin ve kemokinlerle tedavi sayesinde mümkündür. C) Tümör mikroçevresi içinde var olan immünbaskılayıcı etkili faktör ve hücreleri hedefleyen terapiler de (regülatuar T(T Reg ) hücreleri ve myeloid kökenli baskılayıcı hücreler (MDSCs) gibi) artan tümör spesifik T hücre aktivasyonunun tetikleyicisi olabilir. sağlamayacağı keşfedilmesi gereken önemli bir noktadır. Araştırılmaya değer diğer sitokinler ise TCM farklılaşmasını sağlayan IL-15 ve T hücre farklılaşmasını durdurarak daha genç hücrelerin elde edilmesini sağlayan IL-21 dir (132,133). Ek olarak, WNT sinyal yolunun farmakolojik modülatörleri de yararlı etki gösterebilirler (85,131,134,135). Tümöre özgü CD4+ T hücrelerinin farklılaşması. Var olan birçok kanser immünoterapisi çalışmaları CD4+ T hücrelerine yoğunlaşmış bulunmaktadır. Buna karşın, CD4+ T hücreleri tümör reddini, kısmen IL-2 (111) salgılama ve tümöre özgü CD8+ T hücrelerini (136) destekleme ve kuvvetlendirme özelliği sayesinde, etkili bir şekilde desteklemektedir. Ayrıca CD4+ T hücreleri antijen sunan hücrelerin (özellikle dendritik hücreler) ve doğal bağışıklık hücrelerinin görevlerini değiştirebilirler (165). Üstelik CD4+ T hücrelerin, CD8+ T hücrelerinin görevlerini arttırmanın yanında tümör eliminasyonunda da daha doğrudan bir rolü vardır (137,138). Bazı klinik öncesi çalışmalar tümöre özgü CD4+ T hücrelerinin kanser immünoterapisi için potansiyel kullanımını örneklerle tanımlamaktadır (95, ) ve yakın zamanda metastatik melanomaya sahip dokuz hastanın tümöre özgü CD4+ T hücre klonlarıyla tedavi edildiği bir klinik çalışmada
15 (145) bir hastanın tam bir cevap gösterdiği vurgulanmıştır (146). CD4+ T hücrelerinin antitümör bağışıklık cevaplarındaki rolü onların kutuplaşmasına kritik olarak bağlıdır, bu kutuplaşma anahtar transkripsiyon faktörlerin ifadesi tarafından belirlenir ve başka yerlerde de yeniden gözden geçirilmiştir (147). Önceden bahsedildiği gibi T regülatör hücreler kuvvetli immünoinhibitör görevlere sahiptir ve immunosüpresif tümör mikro çevresine katkıda bulunabilirler. Antitümör immün cevapta, Th2 hücrelerinin (T helper 2 hücreleri) rolü hala kesin olarak bilinmemektedir fakat Th1 hücreleri IFNγ üretmeleri sayesinde (148) fare modelleri üzerinde antitümör cevap oluşturabilmektedirler. Yeni bulgular göstermektedir ki uygun transfer edilmiş Th17 hücreleri uzun ömürlü antitümör bağışıklığı destekleyebilirler (143,149). Buna karşılık IL-17 kendisi karsinogenezle birbirine bağlanmıştır (150,151), Th17- tip polarizasyon koşulları ayrıca CD8+ T hücrelerinin antitümör fonksiyonlarını arttırdığı kesindir (152,153). Th17 hücreleri etkili tümör reddini oluşturma kapasitesine sahiptirler (141,142), ama sadece Th1 benzeri özelliklerle birlikte efektör T hücrelerine farklılaşma kapasiteleri varsa (143). İlginç biçimde, Th17 hücreleri gen ekspresyonu profili, apoptosise karşı direnç, kendini yenileme kapasitesi ve multi potent olma özellikleriyle kök hücrelerle benzerlik göstermektedirler (143,166). Özetle, CD4+ T hücreleri birçok farklı efektör bağışıklık cevabı oluşmasında önemlidir ve bu hücrelerden yararlanmak daha iyi kanser terapilerinin gelişmesini sağlayabilirler. Gelecek istikametler Lymphotükenim sonrası ACT, kanser immünoterapisinde umut verici bir gelişme ortaya çıkardı. Preklinik ve klinik çalışmalar sonucu ortaya çıkan veriler başarılı immünoterapinin altında yatan mekanizmayı anlamamızda ve en etkili T hücreleri popülasyonlarını tanımlamamızda bize yardımcı oldu. Buna ek olarak gen mühendisliği ACT dayalı immünoterapiden yararlanabilecek potensiyel hedef popülasyonu genişletti. Önemli olan bir nokta: ACT dayalı immünoterapi FDA onaylı değildir ve dünyada sadece limitli sayıda ülkede bulunmaktadır. Bu terapinin en önemli kısıtlaması masrafıdır ve tedavi özelleşmiş hücre üretme imkanları ve yüksek düzeyde yetiştirilmiş laboratuar ve medikal personel gerektirmektedir. Buna rağmen, tüm kısıtlamalara karşı şahsa özel hücre terapilerini kliniğe taşımada gelişmeler olmuştur(hücre izolasyonu ve kültür teknikleri dahil), bu da yeni deneysel terapilerin artmasını sağlamıştır. Kan bankalarının klinik kullanım için tümöre özgü T hücreleri büyütmesi ya da otolog (aynı canlıdan alınan)ya da allojeneik( başka canlıdan alınan) hücreler merkezi bir tesiste ya da ticari bir kuruluşta seri olarak üretilmesi akla yatkındır (154,155). Gelecekte, immün ablasyon oluşturma metodlarını keşfetmek önem kazanacaktır. Buna rağmen öncü denemeler göstermiştir ki tüm vücudun radyasyona tabi tutulması ACT dayalı terapinin daha etkili olmasını sağlayabilir, yüksek şiddetli lenfotükenim rejimlerini kıyaslamak için rastgele denemelere bugünlerde başlanmıştır (bakınız, ClinicalTrials.gov; çalışma tanımlayıcı NCT ). Ucuz ve rutin DNA sekansı teknikleri yakında hastaya özgü tümör antijenleri tanımlamalarına olanak vererek kanser immünoterapilerinde köklü değişiklikler yapabilir (Şekil-4). Sonuç olarak, ACT dayalı terapilerin (156) diğer kanser terapileriyle kombinasyonunu kullanmak için güçlü bir gerekçe vardır (Şekil-5). Fareler üzerindeki çalışmalar göstermiştir ki T hücrelerinin akut aktivasyonu antitümör başarısını arttırmaktadır (157). Bunun aynısı transfer edilmiş hücrelerle bir aşı uygulamasıyla in vivo olarakta yerine getirilebilir (158). Onkojen çekilmesi sonrası tümör hücre ölümü T hücrelerinin oluşturacağı antijenik uyarımı sağlayabilir (159,160). Onkojen çekilmesi ayrıca tümör hücrelerinin immünosüpresif sitokin üretmesini de azaltabilir (161). Hedeflendirilmiş ajanların kullanımı tümör hücrelerinin pro ve antiapoptotik moleküllerinin dengesini bozup onları tümöre özgü T hücreleri veya onların toksik metabolitleriyle karşılaşınca ölüme doğru meylettirir. Buna ek olarak, vemurafenib( RAF- MEK-ERK sinyal yolunda küçük moleküllü bir inhibitör)
16 uygulanması melanomada tümörle birleşmiş antijenlerin upregülasyonuna öncülük edip bu sayede T hücrelerinin tümörü tanımasını sağladığı gösterilmiştir (162). Sonuçlar 1950 yılında Dr William Castle tarafından lösemi açıklamasını yorumlamak: her ne kadar onkologların günlük görevi kanseri hafifletmek olsa da kanserin komple tedavisi hala içimizde yanan umudumuzdur. Şurası açıktır ki ilaç tabanlı tedaviler yalnız başına tüm kanser hücrelerini ortadan kaldıramamaktadır, germ hücresi tümörleri ve bazı hematolojik maligniteleri bundan tenzih etmek gereklidir. Ayrıca ilaç terapisinin getirdikleri eninde sonunda ölümcül sonuçları olan hastalıklara ilerleyecektir. Ama immün sistem, kendini sönümleyebilen ve muhtemelen küratif olan uzun dönemli, sağlam yanıtlar oluşturma yetisine sahiptir. Bu manada adaptif T hücre tabanlı tedavilerin kanser eradikasyonunda kullanımı, temel immünoloji ve kliniksel manada tedavi arasındaki nadir bağlardan birini oluşturmaktadır. SÖZLÜK Tümöre Infiltre Lenfosit (TIL) Tümörde bulunan heterojen T hücresi popülasyonunun bir üyesidir. TIL ler fenotip çeşitliliği, antijen spesifikliği, avidite ve fonksiyonel özellikleri ile karakterizedirler. TIL popülasyonu organizma dışı (ex vivo) aktive edilip çoğaltılarak tümör taşıyan konağa tekrar nüfuz edilebilir. Interlökin-2(IL-2) Hem efektör T hücre hem de regülatör T hücre popülasyonlarının çoğalmasını tetikleyen kapasiteye sahip bir T hücresi büyüme faktörüdür. IL-2, melanomlu hastaların tedavisinde kullanılmıştır ve ACT-temelli tedavi rejimlerinin bir parçasıdır. Adaptif Hücre Transferi(ACT) Tümör-spesifik lenfositlerin (hastadan(otolog) veya donörden(allojenik) elde edilen) uygulanması lenfoid seriyi tüketici bir hazırlık rejimini takip eder. Lenfotükenim (Lymphodepletion) Hastanın lenfoid bölümlerin azaltılmasında tüm vücut ışın tedavisi veya sitotoksik ilaçlar kullanımı. Myeloid-türevi Süpresör Hücreler(MDSCs) Çeşitli tümör türevi sitokinlere karşı cevap olarak üretilen bir grup olgunlaşmamış CD11b +GR1+ hücreleridir(makrofaj, granülosit, dendritik ve myeloid hücrelerinin prekürsörlerini kapsarlar). Bu hücreler tümörle ilişkili CD8+ T hücrelerinde tolerans indükleyici olarak gösterilmiştir. Çapraz Ateşleme (Cross-priming) Antijen içeren hücrelerin ekzojen antijenlerden elde edilmiş peptidleri MHC sınıf 1 moleküllerine yüklemesini sağlayan yetenek. Bu özellik atipiktir, çünkü çoğu hücre MHC sınıf 1 moleküllerinde yalnızca endojen proteinlerinden peptidler taşır. İmmuneditleme (Immunoediting) Konağın immün sisteminin gelişmekte olan bir tümörün gen ekspresyonunu değiştirebilmesi olayıdır, böylece immünojenik epitoplar silinmiş veya değişmiş olur, bu sayede tümörün immün sistemden kaçması kolaylaşır. Karsinoembriyonik Antijen Fetal gastrointestinal dokuda bulunan, gastrointestinal kanserlerde artan ve tümör markeri sayılan bir proteindir. Objektif Klinik Cevaplar (Objective clinical responses) Solid tümörlerde yanıt tahmin kriterlerine (RECIST=The response evaluation criteria in solid tumours) göre objektif bir cevap, ölçülebilir tümör lezyonlarının tedavi sonrasında tedavi öncesine göre en uzun çaplarının toplamındaki %30 düşüştür. WHO kriterlerine göre ise objektif cevap, ölçülebilir lezyonların dikey çaplarının ürünlerinin toplamındaki %50 düşüştür. İki kriter setinde de yeni lezyon görülemez. Sadece kontrollü hasta kohortlarıyla tespit edilebilecek olsa da en önemli klinik son nokta belki de artan hayatta kalma oranı baz alınarak belirlenen tedaviden sağlanan yarardır.
17 Kanser Yapıcı Mutasyonlar (Driver Mutations) Kanser hücresinin hayatta kalmasına ve büyüme avantajlarına sahip olmasına sebep olan bir nonsense mutasyondur. Kanser-Testis Antijenleri (Ayrıca kanser germline antijenleri olarak bilinir) Testis ve fetal overler haricinde normal adult dokulardan üretilmeyen fakat pek çok insan kanserinde üretilen bir >100 protein sınıfıdır. Bu antijenler CTAG1, MAGEA3 ve SSX1 i kapsar. Tamamlayıcı-Belirleyici Bölgeler Antijen reseptör proteinlerinin değişken bölgelerinde bulunan kısa aminoasit dizisidir. Bunlar reseptöre antijene göre spesifiklik sağlarlar. Yönlenmiş Evrim Genelde in vitro koşullarda yapılan; doğada olup olmaması fark etmese de, araştırmacılar tarafından istenen özellikleri gösteren protein veya nükleik asitleri geliştirmek için uygulanan modifikasyon, seleksiyon ve amplifikasyonu içeren siklik adım dizisi. Kimerik Antijen Reseptörleri(CARs) Birden fazla kaynaktan dizilimler içeren antijen reseptörü, örneğin bir antikor molekülü, bir T hücresi reseptör sinyalizasyon zinciri ve bir aktivasyon motifidir. Homeostatik Çoğalma Lökositlerin lenfopenik çevrede aktivasyon ve çoğalması işlemi. T hücresi homeostatik çoğalması, T hücresinin reseptörlerinin kendi peptid-mhc komplexleriyle etkileşimi ve T hücresinin interlökin- 7(IL-7), IL-15 ve IL-21 e yanıt vermesiyle sürdürülür. Rekombinasyon-Aktivasyon Genleri Bu genler(rag1 ve Rag2) lenfositlerin gelişimiyle eksprese edilir. Bu RAG proteinlerinden yoksun olan fareler antijen reseptör ekspresyonu için gerekli olacak gen düzenlemelerinde oluşan gelişimsel engel nedeniyle B ve T hücrelerini oluşturamazlar. Allelik Dışlama (Allelic exclusion) Bir lenfositin hücre yüzeyinde tek bir spesifikliğe sahip antijen reseptörü üretmesini sağlayan mekanizma. Bu lenfosit kökeninde klonal bağlantı sağlayan bir basamaktır. Sitokin Fırtınası Inflamasyon öncesi dolaşımdaki sitokin seviyesinin ani dalgalanması durumu( IL-1, IL-6, tümör nekroz faktörü ve interferon-γ). Klinik olarak, bu olay hipotansiyon, akut renal yetmezlik, yetersiz akciğer fonksiyonu ve hatta ölümle sonuçlanabilir. Merkezi T Hafıza Hücreleri (Central Memory T cell (TCM cell)) Anında cevap verme fonksiyonu olmasa da hızlı hafıza reaksyonlarına aracılık edebilecek olan antijenle karşılaşmış CD8+ T hücresidir. Bu hücreler aynı zamanda antijenle yeniden karşılaşmadan sonra hızla hafıza T hücresi fenotip ve fonksiyonu gösterebilme yetisine de sahiptir. TCM hücreleri naif T hücrelerinin migrasyon özelliğini de gösterebildikleri için ikincil lenfoid organlar arasında dolaşım halindedirler. Efektör Hafıza T hücresi (Effector Memory T Cell (TEM cell)) Lenf nodu hedefleyici reseptörleri olmasa da enflamasyonlu dokuları hedefleyici reseptörleri olan tam farklılaşmış T hücreleridir. TEM hücreleri daha fazla farklılaşmaya ihtiyaç duymaksızın anında efektör fonksiyon gösterebilme yetisine sahiptir. Telomer Kromozom kollarının ucundaki bölme, hücre bölünmesinde kromozom replikasyonunu kontrol eden tekrarlı DNA dizileri (TTAGGG tüm omurgalılarda var) içeriyor. Allojenik MHC lokuslarındaki bireyler arası farklılıklar. Mesela komple cross-match göstermeyen bireyler arasındaki transplantasyonlarda bazı MHC molekülleri ortak olsa da bazıları donör ve alıcı arasında farklılık gösterir. TH2 Hücreleri (T yardımcı 2 hücreleri) CD4+ T hücrelerinin hümoral immünite ve alerjik reaksyonlarda önemli yeri olan alt grubu. GATA3 ve
18 STAT6 transkripsiyon faktörlerini eksprese eder ve IL- 4, IL-5, IL-9 ve IL13 gibi sırasıyla IgE sentezini, eozinofil artışını, mast hücresi artışı ve havayolu aşırıduyarlılığını regüle eden sitokinleri üretirler. IgE üretimi ve eozinofili ile alakalı olan alerjik ve parazitik reaksiyonlarda TH2 hücresi sitokin ekspresyon modeli gözlenmiştir. TH1 hücreleri (T Yardımcı 1 hücreleri ) CD4+ T hücrelerinin T-bet transkripsiyon faktörü eksprese eden ve hücresel bağışıklıkla alakalı olan alt grubu. Yüksek konsantrasyonda interferon- γ, IL-2 ve TNF salgılayarak sitotoksik T hücrelerine destek olur. Ayrıca RA ve MS gibi bazı otoimmün hastalıkların immünopatolojisinin temelini oluştururlar. TH17 hücreleri (T yardımcı 17 hücreleri) CD4+ T hücrelerinin IL-17 salgılayan ve antibakteriyel, antifungal immünite için öenmli olduğu ve otoimmün hastalıklarda da rolü olabileceği düşünülen alt grubu. Bunların üretimi, IL-23 ve IL-21, hem de transkripsiyon faktörleri RORγt ve STAT3 içerir. Referanslar 1. Deguine, J., Breart, B., Lemaitre, F., Di Santo, J. P. & Bousso, P. Intravital imaging reveals distinct Dynamics for natural killer and CD8+ T cells during tumor regression. Immunity 33, (2010). 2. Kochenderfer, J. N. et al. Eradication of B-lineage cells and regression of lymphoma in a patient treated with autologous T cells genetically engineered to recognize CD19. Blood 116, (2010). 3. Brentjens, R. J. et al. Safety and persistence of adoptively transferred autologous CD19-targeted T cells in patients with relapsed or chemotherapy refractory B-cell leukemias. Blood 118, (2011). 4. Rosenberg, S. A. et al. Durable complete responses in heavily pretreated patients with metastatic melanom using T-cell transfer immunotherapy. Clin. Cancer Res. 17, (2011). 5. Porter, D. L., Levine, B. L., Kalos, M., Bagg, A. & June, C. H. Chimeric antigen receptor-modified T cells in chronic lymphoid leukemia. N. Engl. J. Med. 365, (2011). 6. Robbins, P. F. et al. Tumor regression in patients with metastatic synovial cell sarcoma and melanoma using genetically engineered lymphocytes reactive with NY-ESO-1. J. Clin. Oncol. 29, (2011). 7. Kochenderfer, J. N. et al. B cell depletion and remissions of malignancy along with cytokine associated toxicity in a clinical trial of anti-cd19 chimeric-antigen-receptor-transduced T cells. Blood 8 Dec 2011 (doi: /blood ). 8. Baitsch, L. et al. Exhaustion of tumor-specific CD8 T cells in metastases from melanoma patients. J. Clin. Invest. 121, (2011). 9. Ahmadzadeh, M. et al. Tumor antigen-specific CD8 T cells infiltrating the tumor express high levels of PD-1 and are functionally impaired. Blood 114, (2009). 10. Offringa, R. Antigen choice in adoptive T-cell therapy of cancer. Curr. Opin. Immunol. 21, (2009). 11. Restifo, N. P. et al. Identification of human cancers deficient in antigen processing. J. Exp. Med. 177, (1993). 12. Restifo, N. P. et al. Loss of functional β2-microglobulin in metastatic melanomas from five patients receiving immunotherapy. J. Natl Cancer Inst. 88, (1996). 13. Schreiber, R. D., Old, L. J. & Smyth, M. J. Cancer immunoediting: integrating immunity s roles in cancer suppression and promotion. Science 331, (2011). 14. Matsushita, H. et al. Cancer exome analysis reveals a T-cell dependent mechanism of cancer immunoediting. Nature 482, (2012). 15. van der Bruggen, P. et al. A gene encoding an antigen recognized by cytolytic T lymphocytes on a human melanoma. Science 254, (1991). 16. Parkhurst, M. R. et al. T cells targeting carcinoembryonic antigen can mediate regression of metastatic colorectal cancer but induce severe transient colitis. Mol. Ther. 19, (2011). 17. Bos, R. et al. Balancing between antitumor efficacy and autoimmune pathology in T-cell-mediated targeting of carcinoembryonic antigen. Cancer Res. 68, (2008). 18. Overwijk, W. W. & Restifo, N. P. Autoimmunity and the immunotherapy of cancer: targeting the self to destroy the other. Crit. Rev. Immunol. 20, (2000). 19. Overwijk, W. W. et al. gp100/pmel 17 is a murine tumor rejection antigen: induction of self -reactive, tumoricidal T cells using high-affinity, altered peptide ligand. J. Exp. Med. 188, (1998). 20. Kawakami, Y. et al. Cloning of the gene coding for a shared human melanoma antigen recognized by autologous T cells infiltrating into tumor. Proc. Natl Acad. Sci. USA 91, (1994). 21. Johnson, L. A. et al. Gene therapy with human and mouse T cell receptors mediates cancer regression and targets normal tissues expressing cognate antigen. Blood 114, (2009). 22. Palmer, D. C. et al. Effective tumor treatment targeting a melanoma/melanocyte-associated antigen triggers severe ocular autoimmunity. Proc. Natl Acad. Sci. USA 105, (2008). 23. Yeh, S. et al. Ocular and systemic autoimmunity after successful tumorinfiltrating lymphocyte immunotherapy for recurrent, metastatic melanoma. Ophthalmology 116, (2009). 24. Davies, M. A. & Samuels, Y. Analysis of the genome to personalize therapy for melanoma. Oncogene 29, (2010). 25. Walia, V., Mu, E. W., Lin, J. C. & Samuels, Y. Delving into somatic variation in sporadic melanoma. Pigment Cell Melanoma Res. 25, (2012). 26. Gilchrest, B. A. Molecular aspects of tanning. J. Invest. Dermatol. 131, e14 e17 (2011). 27. Robbins, P. F. et al. A mutated β-catenin gene encodes a melanomaspecific antigen recognized by tumor infiltrating lymphocytes. J. Exp. Med. 183, (1996). 28. Brenner, M. K. & Heslop, H. E. Adoptive T cell therapy of cancer. Curr. Opin. Immunol. 22, (2010). 29. Kenter, G. G. et al. Vaccination against HPV-16 oncoproteins for vulvar intraepithelial neoplasia. N. Engl. J. Med. 361, (2009). 30. Anders, K. et al. Oncogene-targeting T cells reject large tumors while oncogene inactivation selects escape variants in mouse models of cancer. Cancer Cell 20, (2011). 31. Zhang, J. et al. A novel retinoblastoma therapy from genomic and epigenetic analyses. Nature 481, (2012). 32. Hofmann, O. et al. Genome-wide analysis of cancer/testis gene expression. Proc. Natl Acad. Sci. USA 105, (2008). 33. Almeida, L. G. et al. CTdatabase: a knowledge-base of high-throughput and curated data on cancer-testis antigens. Nucleic Acids Res. 37, D816 D819 (2009).
19 34. Baylin, S. B. & Jones, P. A. A decade of exploring the cancer epigenome biological and translational implications. Nature Rev. Cancer 11, (2011). 35. Guo, Z. S. et al. De novo induction of a cancer/testis antigen by 5 aza 2ʹ-deoxycytidine augments adoptive immunotherapy in a murine tumor model. Cancer Res.66, (2006). 36. Wargo, J. A. et al. Recognition of NY-ESO-1+ tumor cells by engineered lymphocytes is enhanced by improved vector design and epigenetic modulation of tumor antigen expression. Cancer Immunol. Immunother. 58, (2009). 37. Simpson, A. J., Caballero, O. L., Jungbluth, A., Chen, Y. T. & Old, L. J. Cancer/testis antigens, gametogenesis and cancer. Nature Rev. Cancer 5, (2005). 38. Chinnasamy, N. et al. A TCR targeting the HLA-A*0201-restricted epitope of MAGE-A3 recognizes multiple epitopes of the MAGE-A antigen superfamily in several types of cancer. J. Immunol. 186, (2011). 39. Ruffell, B. et al. Leukocyte composition of human breast cancer. Proc. Natl Acad. Sci. USA 8 Aug 2011 (doi: /pnas ). 40. Engels, B., Rowley, D. A. & Schreiber, H. Targeting stroma to treat cancers. Semin. Cancer Biol. 22, (2012). 41. Kraman, M. et al. Suppression of antitumor immunity by stromal cells expressing fibroblast activation protein-α. Science 330, (2010). 42. Chinnasamy, D. et al. Gene therapy using genetically modified lymphocytes targeting VEGFR 2 inhibits the growth of vascularized syngenic tumors in mice. J. Clin. Invest. 120, (2010). 43. Shrimali, R. K. et al. Antiangiogenic agents can increase lymphocyte infiltration into tumor and enhance the effectiveness of adoptive immunotherapy of cancer. Cancer Res. 70, (2010). 44. Chung, A. S., Lee, J. & Ferrara, N. Targeting the tumour vasculature: insights from physiological angiogenesis. Nature Rev. Cancer 10, (2010). 45. Fefer, A. Immunotherapy and chemotherapy of Moloney sarcoma virus-induced tumors in mice. Cancer Res. 29, (1969). 46. Greenberg, P. D., Cheever, M. A. & Fefer, A. Eradication of disseminated murine leukemia by chemoimmunotherapy with cyclophosphamide and adoptively transferred immune syngeneic Lyt-1+2 lymphocytes. J. Exp. Med. 154, (1981). 47. Rosenberg, S. A. & Terry, W. D. Passive immunotherapy of cancer in animals and man. Adv. Cancer Res. 25, (1977). 48. Wang, M. et al. Active immunotherapy of cancer with a nonreplicating recombinant fowlpox virus encoding a model tumor-associated antigen. J. Immunol. 154, (1995). 49. Palmer, D. C. et al. Vaccine-stimulated, adoptively transferred CD8+ T cells traffic indiscriminately and ubiquitously while mediating specific tumor destruction. J. Immunol. 173, (2004). 50. Chen, P. W. et al. Therapeutic antitumor response after immunization with a recombinant adenovirus encoding a model tumor-associated antigen. J. Immunol. 156, (1996). 51. Bronte, V. et al. IL-2 enhances the function of recombinant poxvirusbased vaccines in the treatment of established pulmonary metastases. J. Immunol. 154, (1995). 52. Cormier, J. N. et al. Enhancement of cellular immunity in melanoma patients immunized with a peptide from MART-1/Melan A. Cancer J. Sci. Am. 3, (1997). 53. Leitner, W. W. et al. Alphavirus-based DNA vaccine breaks immunological tolerance by activating innate antiviral pathways. Nature Med. 9, (2003). 54. Ying, H. et al. Cancer therapy using a self-replicating RNA vaccine. Nature Med. 5, (1999). 55. Overwijk, W. W. et al. Vaccination with a recombinant vaccinia virus encoding a self antigen induces autoimmune vitiligo and tumor cell destruction in mice: requirement for CD4+ T lymphocytes. Proc. Natl Acad. Sci. USA 96, (1999). 56. Rosenberg, S. A. et al. Tumor progression can ocur despite the induction of very high levels of self/tumor antigen-specific CD8+ T cells in patients with melanoma. J. Immunol. 175, (2005). 57. Irvine, K. R. et al. Enhancing efficacy of recombinant anticancer vaccines with prime/boost regimens that use two different vectors. J. Natl Cancer Inst. 89, (1997). 58. Rao, J. B. et al. IL-12 is an effective adjuvant to recombinant vaccinia virus-based tumor vaccines: enhancement by simultaneous B7 1 expression. J. Immunol. 156, (1996). 59. Irvine, K. R. et al. Recombinant virus vaccination against self antigens using anchor-fixed immunogens. Cancer Res. 59, (1999). 60. Irvine, K. R., Rao, J. B., Rosenberg, S. A. & Restifo, N. P. Cytokine enhancement of DNA immunization leads to effective treatment of established pulmonary metastases. J. Immunol. 156, (1996). 61. Carroll, M. W. et al. Construction and characterization of a triplerecombinant vaccinia virus encoding B7 1, interleukin 12, and a model tumor antigen. J. Natl Cancer Inst. 90, (1998). 62. Schlom, J. Recent advances in therapeutic cancer vaccines. Cancer Biother. Radiopharm. 27, 2 5 (2012). 63. Rosenberg, S. A., Yang, J. C. & Restifo, N. P. Cancer immunotherapy: moving beyond current vaccines. Nature Med. 10, (2004). 64. Klebanoff, C. A., Acquavella, N., Yu, Z. & Restifo, N. P. Therapeutic cancer vaccines: are we there yet? Immunol. Rev. 239, (2011). 65. Kantoff, P. W. et al. Sipuleucel-T immunotherapy for castrationresistant prostate cancer. N. Engl. J. Med. 363, (2010). 66. Itzhaki, O. et al. Establishment and large-scale expansion of minimally cultured young tumor infiltrating lymphocytes for adoptive transfer therapy. J. Immunother. 34, (2011). 67. Besser, M. J. et al. Clinical responses in a phase II study using adoptive transfer of short-term cultured tumor infiltration lymphocytes in metastatic melanoma patients. Clin. Cancer Res. 16, (2010). 68. Klebanoff, C. A. et al. Determinants of successful CD8+ T-cell adoptive immunotherapy for large established tumors in mice. Clin. Cancer Res. 17, (2011). 69. Khong, H. T. & Restifo, N. P. Natural selection of tumor variants in the generation of tumor escape phenotypes. Nature Immunol. 3, (2002). 70. Ogino, S., Galon, J., Fuchs, C. S. & Dranoff, G. Cancer immunologyanalysis of host and tumor factors for personalized medicine. Nature Rev. Clin. Oncol. 8, (2011). 71. Stratton, M. R. Exploring the genomes of cancer cells: progress and promise. Science 331, (2011). 72. Louis, C. U. et al. Antitumor activity and long-term fate of chimeric antigen receptor-positive T cells in patients with neuroblastoma. Blood 118, (2011). 73. Kochenderfer, J. N., Yu, Z., Frasheri, D., Restifo, N. P. & Rosenberg, S. A. Adoptive transfer of syngeneic T cells transduced with a chimeric antigen receptor that recognizes murine CD19 can eradicate lymphoma and normal B cells. Blood 116, (2010). 74. Kerkar, S. P. et al. Genetic engineering of murine CD8+ and CD4+ T cells for preclinical adoptive immunotherapy studies. J. Immunother. 34, (2011). 75. Abad, J. D. et al. T-cell receptor gene therapy of established tumors in a murine melanoma model. J. Immunother. 31, 1 6 (2008). 76. Morgan, R. A. et al. Cancer regression in patients after transfer of genetically engineered lymphocytes. Science 314, (2006). 77. Pule, M. A. et al. Virus-specific T cells engineered to coexpress tumorspecific receptors: persistence and antitumor activity in individuals with neuroblastoma. Nature Med. 14, (2008).
20 78. Recombinant DNA Advisory Committee. Human gene transfer protocols. National Institutes of Health [online], (2011). 79. Varela-Rohena, A. et al. Control of HIV-1 immune escape by CD8 T cells expressing enhanced T-cell receptor. Nature Med. 14, (2008). 80. Sadelain, M., Brentjens, R. & Riviere, I. The promise and potential pitfalls of chimeric antigen receptors. Curr. Opin. Immunol. 21, (2009). 81. Morgan, R. A. et al. Case report of a serious adverse event following the administration of T cells transduced with a chimeric antigen receptor recognizing ERBB2. Mol. Ther. 18, (2010). 82. Baeuerle, P. A. & Itin, C. Clinical experience with gene therapy and bispecific antibodies for T cell-based therapy of cancer. Curr. Pharm. Biotechnol. 14 Feb 2012 [epub ahead of print]. 83. Choi, B. D. et al. Bispecific antibodies engage T cells for antitumor immunotherapy. Expert Opin. Biol. Ther. 11, (2011). 84. Merhavi-Shoham, E., Haga-Friedman, A. & Cohen, C. J. Genetically modulating T cell function to target cancer. Semin. Cancer Biol. 22, (2011). 85. Gattinoni, L. et al. A human memory T cell subset with stem cell-like properties. Nature Med. 17, (2011). 86. Stephan, M. T. et al. T cell-encoded CD80 and 4 1BBL induce auto- and transcostimulation, resulting in potent tumor rejection. Nature Med. 13, (2007). 87. Charo, J. et al. Bcl2 overexpression enhances tumorspecific T-cell survival. Cancer Res. 65, (2005). 88. Pegram, H. J. et al. Tumor-targeted T cells modified to secrete IL12 eradicate systemic tumors without need for prior conditioning. Blood 21 Feb 2012 (doi: /blood ). 89. Kerkar, S. P. et al. IL 12 triggers a programmatic change in dysfunctional myeloid-derived cells within mouse tumors. J. Clin. Invest. 121, (2011). 90. Kerkar, S. P. et al. Tumor-specific CD8+ T cells expressing interleukin12 eradicate established cancers in lymphodepleted hosts. Cancer Res. 70, (2010). 91. Peng, W. et al. Transduction of tumor-specific T cells with CXCR2 chemokine receptor improves migration to tumor and antitumor immune responses. Clin. Cancer Res. 16, (2010). 92. Bendle, G. M. et al. Lethal graft-versus-host disease in mouse models of T cell receptor gene therapy. Nature Med. 16, (2010). 93. Rosenberg, S. A. Of mice, not men: no evidence for graft-versus-host disease in humans receiving T-cell receptor-transduced autologous T cells. Mol. Ther. 18, (2010). 94. Vatakis, D. N. et al. Antitumor activity from antigenspecific CD8 T cells generated in vivo from genetically engineered human hematopoietic stem cells. Proc. Natl Acad. Sci. USA 108, e1408 e1416 (2011). 95. Ha, S. P. et al. Transplantation of mouse HSCs genetically modified to express a CD4-restricted TCR results in long-term immunity that destroys tumors and initiates spontaneous autoimmunity. J. Clin. Invest. 120, (2010). 96. Jorritsma, A., Schotte, R., Coccoris, M., de Witte, M. A. & Schumacher, T. N. Prospects and limitations of T cell receptor gene therapy. Curr. Gene Ther. 11, (2011). 97. Brentjens, R., Yeh, R., Bernal, Y., Riviere, I. & Sadelain, M. Treatment of chronic lymphocytic leukemia with genetically targeted autologous T cells: case report of an unforeseen adverse event in a phase I clinical trial. Mol. Ther. 18, (2010). 98. Di Stasi, A. et al. Inducible apoptosis as a safety switch for adoptive cell therapy. N. Engl. J. Med. 365, (2011). 99. North, R. J. Cyclophosphamide-facilitated adoptive immunotherapy of an established tumor depends on elimination of tumor-induced suppressor T cells. J. Exp. Med. 155, (1982) Cheever, M. A., Greenberg, P. D. & Fefer, A. Specificity of adoptive chemoimmunotherapy of established syngeneic tumors. J. Immunol. 125, (1980) Bronte, V. et al. Identification of a CD11b+/Gr-1+/ CD31+ myeloid progenitor capable of activating or suppressing CD8+T cells. Blood 96, (2000) Wrzesinski, C. et al. Hematopoietic stem cells promote the expansion and function of adoptively transferred antitumor CD8 T cells. J. Clin. Invest. 117, (2007) Wrzesinski, C. et al. Increased intensity lymphodepletion enhances tumor treatment efficacy of adoptively transferred tumor-specific T cells. J. Immunother. 33, 1 7 (2010) Dudley, M. E. et al. Cancer regression and autoimmunity in patients after clonal repopulation with antitumor lymphocytes. Science 298, (2002) Dudley, M. E. et al. Adoptive cell therapy for patients with metastatic melanoma: evaluation of intensive myeloablative chemoradiation preparative regimens. J. Clin. Oncol. 26, (2008) Gabrilovich, D. I., Ostrand-Rosenberg, S. & Bronte, V. Coordinated regulation of myeloid cells by tumours. Nature Rev. Immunol. 12, (2012) Bronte, V. et al. Apoptotic death of CD8+ T lymphocytes after immunization: induction of a suppressive population of Mac-1+/Gr-1+ cells. J. Immunol. 161, (1998) Seung, L. P., Rowley, D. A., Dubey, P. & Schreiber, H. Synergy between T-cell immunity and inhibition of paracrine stimulation causes tumor rejection. Proc. Natl Acad. Sci. USA 92, (1995) Gattinoni, L. et al. Removal of homeostatic cytokine sinks by lymphodepletion enhances the efficacy of adoptively transferred tumorspecific CD8+ T cells. J. Exp. Med. 202, (2005) Paulos, C. M. et al. Microbial translocation augments the function of adoptively transferred self/tumorspecific CD8+ T cells via TLR4 signaling. J. Clin. Invest. 117, (2007) Antony, P. A. et al. CD8+ T cell immunity against a tumor/self-antigen is augmented by CD4+ T hepler cells and hindered by naturally occurring T regulatory cells. J. Immunol. 174, (2005) Kastenmuller, W. et al. Regulatory T cells selectively control CD8+ T cell effector pool size via IL2 restriction. J. Immunol. 187, (2011) Antony, P. A. & Restifo, N. P. CD4+CD25+ T regulatory cells, immunotherapy of cancer, and interleukin-2. J. Immunother. 28, (2005) Bluestone, J. A. The yin and yang of interleukin-2 mediated immunotherapy. N. Engl. J. Med. 365, (2011) Gattinoni, L. et al. Acquisition of full effector function in vitro paradoxically impairs the in vivo antitumor efficacy of adoptively transferred CD8+ T cells. J. Clin. Invest. 115, (2005) Gattinoni, L., Powell, D. J. Jr, Rosenberg, S. A. & Restifo, N. P. Adoptive immunotherapy for cancer: building on success. Nature Rev. Immunol. 6, (2006) Sallusto, F. & Lanzavecchia, A. Memory in disguise. Nature Med. 17, (2011) Klebanoff, C. A., Gattinoni, L. & Restifo, N. P. CD8+ T cell memory in tumor immunology and immunotherapy. Immunol. Rev. 211, (2006) Palmer, D. C. & Restifo, N. P. Suppressors of cytokine signaling (SOCS) in T cell differentiation, maturation, and function. Trends Immunol. 30, (2009).
KANSER AŞILARI. Prof. Dr. Tezer Kutluk Hacettepe Üniversitesi
 KANSER AŞILARI Prof. Dr. Tezer Kutluk Hacettepe Üniversitesi Bir Halk Sağlığı Sorunu Şu an dünyada 24.600.000 kanserli vardır. Her yıl 10.9 milyon kişi kansere yakalanmaktadır. 2020 yılında bu rakam %50
KANSER AŞILARI Prof. Dr. Tezer Kutluk Hacettepe Üniversitesi Bir Halk Sağlığı Sorunu Şu an dünyada 24.600.000 kanserli vardır. Her yıl 10.9 milyon kişi kansere yakalanmaktadır. 2020 yılında bu rakam %50
İMMÜN YANITIN EFEKTÖR GRUPLARI VE YANITIN DÜZENLENMESİ. Güher Saruhan- Direskeneli İTF Fizyoloji AD
 İMMÜN YANITIN EFEKTÖR GRUPLARI VE YANITIN DÜZENLENMESİ Güher Saruhan- Direskeneli İTF Fizyoloji AD HÜCRE İÇİ MİKROBA YANIT Veziküle alınmış mikroplu fagosit Sitoplazmasında mikroplu hücre CD4 + efektör
İMMÜN YANITIN EFEKTÖR GRUPLARI VE YANITIN DÜZENLENMESİ Güher Saruhan- Direskeneli İTF Fizyoloji AD HÜCRE İÇİ MİKROBA YANIT Veziküle alınmış mikroplu fagosit Sitoplazmasında mikroplu hücre CD4 + efektör
Adaptif İmmünoterapi. Prof.Dr.Ender Terzioğlu Akdeniz Üniversitesi Antalya
 Adaptif İmmünoterapi Prof.Dr.Ender Terzioğlu Akdeniz Üniversitesi Antalya Adaptif immünoterapi İmmün Sistemin kanser oluşumunda koruyucu rolü daha iyi anlaşılmıştır. Monoklonal antikor teknolojisi, Tümör
Adaptif İmmünoterapi Prof.Dr.Ender Terzioğlu Akdeniz Üniversitesi Antalya Adaptif immünoterapi İmmün Sistemin kanser oluşumunda koruyucu rolü daha iyi anlaşılmıştır. Monoklonal antikor teknolojisi, Tümör
ÇEKİRDEK EĞİTİM PROGRAMI
 ÇEKİRDEK EĞİTİM PROGRAMI Tıp Fakülteleri Mezuniyet Öncesi İmmünoloji Eğitim Programı Önerisi in hücre ve dokuları ilgi hücrelerini isim ve işlevleri ile bilir. Kemik iliği, lenf nodu, ve dalağın anatomisi,
ÇEKİRDEK EĞİTİM PROGRAMI Tıp Fakülteleri Mezuniyet Öncesi İmmünoloji Eğitim Programı Önerisi in hücre ve dokuları ilgi hücrelerini isim ve işlevleri ile bilir. Kemik iliği, lenf nodu, ve dalağın anatomisi,
I- Doğal-doğuştan (innate)var olan bağışıklık
 I- Doğal-doğuştan (innate)var olan bağışıklık Fagositik hücreler (makrofajlar, mast hücreleri) Kompleman sistemi(direkt bakteri hücre membranı parçalayarak diğer immün sistem hücrelerin bunlara atak yapmasına
I- Doğal-doğuştan (innate)var olan bağışıklık Fagositik hücreler (makrofajlar, mast hücreleri) Kompleman sistemi(direkt bakteri hücre membranı parçalayarak diğer immün sistem hücrelerin bunlara atak yapmasına
T Lenfositleri. Dr. Göksal Keskin
 T Lenfositleri Dr. Göksal Keskin Lenfositlerin ortak özellikleri-1 Kazanılmış bağışıklık sisteminin en önemli elemanlarıdır Spesifite özellikleri var Bellekleri var Primer lenfoid organlarda üretilirler
T Lenfositleri Dr. Göksal Keskin Lenfositlerin ortak özellikleri-1 Kazanılmış bağışıklık sisteminin en önemli elemanlarıdır Spesifite özellikleri var Bellekleri var Primer lenfoid organlarda üretilirler
KANSER EPİDEMİYOLOJİSİ VE KARSİNOGENEZ
 KANSER EPİDEMİYOLOJİSİ VE KARSİNOGENEZ Gökhan Erdem GATA Tıbbi Onkoloji BD 19 Mart 2014 5. Türk Tıbbi Onkoloji Kongresi, 19-23 Mart 2014, Antalya EPİDEMİYOLOJİ Epidemiyoloji, sağlık olaylarının görünme
KANSER EPİDEMİYOLOJİSİ VE KARSİNOGENEZ Gökhan Erdem GATA Tıbbi Onkoloji BD 19 Mart 2014 5. Türk Tıbbi Onkoloji Kongresi, 19-23 Mart 2014, Antalya EPİDEMİYOLOJİ Epidemiyoloji, sağlık olaylarının görünme
Kanser Tedavisi: Günümüz
 KANSER TEDAVİSİNDE MOLEKÜLER HEDEFLER Doç. Dr. Işık G. YULUĞ Bilkent Üniversitesi Moleküler Biyoloji ve Genetik Bölümü yulug@fen.bilkent.edu.tr Kanser Tedavisi: Günümüz Geleneksel sitotoksik ilaçlar ve
KANSER TEDAVİSİNDE MOLEKÜLER HEDEFLER Doç. Dr. Işık G. YULUĞ Bilkent Üniversitesi Moleküler Biyoloji ve Genetik Bölümü yulug@fen.bilkent.edu.tr Kanser Tedavisi: Günümüz Geleneksel sitotoksik ilaçlar ve
Edinsel İmmün Yanıt Güher Saruhan- Direskeneli
 Edinsel İmmün Yanıt Güher Saruhan- Direskeneli İTF Fizyoloji AD Doğal bağışıklık Edinsel bağışıklık Hızlı yanıt (saatler) Sabit R yapıları Sınırlı çeşidi tanıma Yanıt sırasında değişmez Yavaş yanıt (Gün-hafta)
Edinsel İmmün Yanıt Güher Saruhan- Direskeneli İTF Fizyoloji AD Doğal bağışıklık Edinsel bağışıklık Hızlı yanıt (saatler) Sabit R yapıları Sınırlı çeşidi tanıma Yanıt sırasında değişmez Yavaş yanıt (Gün-hafta)
DİCLE ÜNİVERSİTESİ TIP FAKÜLTESİ DÖNEM II. KAN-DOLAŞIM ve SOLUNUM DERS KURULU
 DİCLE ÜNİVERSİTESİ TIP FAKÜLTESİ DÖNEM II KAN-DOLAŞIM ve SOLUNUM DERS KURULU Doç.Dr. Engin DEVECİ İMMÜN SİSTEM TİPLERİ I- Doğal-doğuştan (innate)var olan bağışıklık Fagositik hücreler (makrofajlar, mast
DİCLE ÜNİVERSİTESİ TIP FAKÜLTESİ DÖNEM II KAN-DOLAŞIM ve SOLUNUM DERS KURULU Doç.Dr. Engin DEVECİ İMMÜN SİSTEM TİPLERİ I- Doğal-doğuştan (innate)var olan bağışıklık Fagositik hücreler (makrofajlar, mast
İMMUNİZASYON. Bir bireye bağışıklık kazandırma! Bireyin yaşı? İmmunolojik olarak erişkin mi? Maternal antikor? Konak antijene duyarlı mı? Sağlıklı mı?
 İMMUNİZASYON Bir bireye bağışıklık kazandırma! Bireyin yaşı? İmmunolojik olarak erişkin mi? Maternal antikor? Konak antijene duyarlı mı? Sağlıklı mı? Canlıya antijen verdikten belli bir süre sonra, o canlıda
İMMUNİZASYON Bir bireye bağışıklık kazandırma! Bireyin yaşı? İmmunolojik olarak erişkin mi? Maternal antikor? Konak antijene duyarlı mı? Sağlıklı mı? Canlıya antijen verdikten belli bir süre sonra, o canlıda
Rastgele (Stokas7k) kanser modeli - Tümör içindeki her hücre yeni bir kanseri başla5r
 Kanser Kök Hücre Kanser Modelleri Rastgele (Stokas7k) kanser modeli - Tümör içindeki her hücre yeni bir kanseri başla5r Kök hücre (Hiyerarşi) modeli - Tümör içindeki bazı hücreler yeni bir kanseri başla5r
Kanser Kök Hücre Kanser Modelleri Rastgele (Stokas7k) kanser modeli - Tümör içindeki her hücre yeni bir kanseri başla5r Kök hücre (Hiyerarşi) modeli - Tümör içindeki bazı hücreler yeni bir kanseri başla5r
Hücresel İmmünite Dicle Güç
 Hücresel İmmünite Dicle Güç dguc@hacettepe.edu.tr kekik imus Kalbe yakınlığı ve Esrarengiz hale Ruhun oturduğu yer Ruh cesaret yiğitlik Yunanlı Hekim MS 1.yy Kalp, pankreas, timus imus yaşla küçülür (timik
Hücresel İmmünite Dicle Güç dguc@hacettepe.edu.tr kekik imus Kalbe yakınlığı ve Esrarengiz hale Ruhun oturduğu yer Ruh cesaret yiğitlik Yunanlı Hekim MS 1.yy Kalp, pankreas, timus imus yaşla küçülür (timik
En Etkili Kemoterapi İlacı Seçimine Yardımcı Olan Moleküler Genetik Test
 En Etkili Kemoterapi İlacı Seçimine Yardımcı Olan Moleküler Genetik Test Yeni Nesil DNA Dizileme (NGS), İmmünHistoKimya (IHC) ile Hastanızın Kanser Tipinin ve Kemoterapi İlacının Belirlenmesi Kanser Tanı
En Etkili Kemoterapi İlacı Seçimine Yardımcı Olan Moleküler Genetik Test Yeni Nesil DNA Dizileme (NGS), İmmünHistoKimya (IHC) ile Hastanızın Kanser Tipinin ve Kemoterapi İlacının Belirlenmesi Kanser Tanı
Yapay Bağışık Sistemler ve Klonal Seçim. Bmü-579 Meta Sezgisel Yöntemler Yrd. Doç. Dr. İlhan AYDIN
 Yapay Bağışık Sistemler ve Klonal Seçim Bmü-579 Meta Sezgisel Yöntemler Yrd. Doç. Dr. İlhan AYDIN Bağışık Sistemler Bağışıklık sistemi insan vücudunun hastalıklara karşı savunma mekanizmasını oluşturan
Yapay Bağışık Sistemler ve Klonal Seçim Bmü-579 Meta Sezgisel Yöntemler Yrd. Doç. Dr. İlhan AYDIN Bağışık Sistemler Bağışıklık sistemi insan vücudunun hastalıklara karşı savunma mekanizmasını oluşturan
MEME KANSERİ KÖK HÜCRELERİNİN GEN EKSPRESYON PROFİLİ
 MEME KANSERİ KÖK HÜCRELERİNİN GEN EKSPRESYON PROFİLİ Sait Murat Doğan, A. Pınar Erçetin, Zekiye Altun, Duygu Dursun, Safiye Aktaş Dokuz Eylül Üniversitesi Onkoloji Enstitüsü, İzmir Slayt 1 / 14 Meme Kanseri
MEME KANSERİ KÖK HÜCRELERİNİN GEN EKSPRESYON PROFİLİ Sait Murat Doğan, A. Pınar Erçetin, Zekiye Altun, Duygu Dursun, Safiye Aktaş Dokuz Eylül Üniversitesi Onkoloji Enstitüsü, İzmir Slayt 1 / 14 Meme Kanseri
İmmun sistemi baskılanmış hastalarda lenfomagenezde rol alan faktörler ve etkileşimleri. Blood Reviews (2008) 22, 261
 İmmun sistemi baskılanmış hastalarda lenfomagenezde rol alan faktörler ve etkileşimleri Blood Reviews (2008) 22, 261 Onkojenik viruslar Annu. Rev. Pathol. Mech. Dis. 2014.9:49 EBV Doğada çok yaygın İnsan
İmmun sistemi baskılanmış hastalarda lenfomagenezde rol alan faktörler ve etkileşimleri Blood Reviews (2008) 22, 261 Onkojenik viruslar Annu. Rev. Pathol. Mech. Dis. 2014.9:49 EBV Doğada çok yaygın İnsan
Böbrek nakli hastalarında akut rejeksiyon gelişiminde CTLA-4 tek gen polimorfizmlerinin ve soluble CTLA-4 düzeylerinin rolü varmıdır?
 Böbrek nakli hastalarında akut rejeksiyon gelişiminde CTLA-4 tek gen polimorfizmlerinin ve soluble CTLA-4 düzeylerinin rolü varmıdır? Çağlar Ruhi 1, Nilgün Sallakçı 2, Fevzi Ersoy 1, Olcay Yeğin 2, Gültekin
Böbrek nakli hastalarında akut rejeksiyon gelişiminde CTLA-4 tek gen polimorfizmlerinin ve soluble CTLA-4 düzeylerinin rolü varmıdır? Çağlar Ruhi 1, Nilgün Sallakçı 2, Fevzi Ersoy 1, Olcay Yeğin 2, Gültekin
HUMORAL İMMUN YANIT 1
 HUMORAL İMMUN YANIT 1 Antijen B lenfosit... HUMORAL İMMUN YANIT Antikor üretimi 2 Antijenini işlenmesi ve sunulması Yardımcı T-lenfosit aktivasyonu Yardımcı T hücre- B hücre ilişkisi B hücre aktivasyonu
HUMORAL İMMUN YANIT 1 Antijen B lenfosit... HUMORAL İMMUN YANIT Antikor üretimi 2 Antijenini işlenmesi ve sunulması Yardımcı T-lenfosit aktivasyonu Yardımcı T hücre- B hücre ilişkisi B hücre aktivasyonu
İyonize Radyasyonun Hücresel Düzeydeki Etkileri ve Moleküler Yaklaşımlar
 İyonize Radyasyonun Hücresel Düzeydeki Etkileri ve Moleküler Yaklaşımlar Aysun Manisalıgil, Ayşegül Yurt Dokuz Eylül Üniversitesi Sağlık Bilimleri Enstitüsü Medikal Fizik Anabilim Dalı Hücre ve Moleküller
İyonize Radyasyonun Hücresel Düzeydeki Etkileri ve Moleküler Yaklaşımlar Aysun Manisalıgil, Ayşegül Yurt Dokuz Eylül Üniversitesi Sağlık Bilimleri Enstitüsü Medikal Fizik Anabilim Dalı Hücre ve Moleküller
MİDE KANSERİNDE APOPİTOZİSİN BİYOLOJİK BELİRTEÇLERİNİN PROGNOSTİK ÖNEMİ
 MİDE KANSERİNDE APOPİTOZİSİN BİYOLOJİK BELİRTEÇLERİNİN PROGNOSTİK ÖNEMİ Cem Sezer 1, Mustafa Yıldırım 2, Mustafa Yıldız 2, Arsenal Sezgin Alikanoğlu 1,Utku Dönem Dilli 1, Sevil Göktaş 1, Nurullah Bülbüller
MİDE KANSERİNDE APOPİTOZİSİN BİYOLOJİK BELİRTEÇLERİNİN PROGNOSTİK ÖNEMİ Cem Sezer 1, Mustafa Yıldırım 2, Mustafa Yıldız 2, Arsenal Sezgin Alikanoğlu 1,Utku Dönem Dilli 1, Sevil Göktaş 1, Nurullah Bülbüller
Prof.Dr.Kemal NAS Dicle Üniversitesi Tıp Fakültesi Fizik Tedavi ve Rehabilitasyon AD, Romatoloji BD
 Prof.Dr.Kemal NAS Dicle Üniversitesi Tıp Fakültesi Fizik Tedavi ve Rehabilitasyon AD, Romatoloji BD Kronik enflamatuar hastalıklar, konak doku ve immun hücreleri arasındaki karmaşık etkileşimlerinden
Prof.Dr.Kemal NAS Dicle Üniversitesi Tıp Fakültesi Fizik Tedavi ve Rehabilitasyon AD, Romatoloji BD Kronik enflamatuar hastalıklar, konak doku ve immun hücreleri arasındaki karmaşık etkileşimlerinden
Onkolojide Sık Kullanılan Terimler. Yrd.Doç.Dr.Ümmügül Üyetürk 2013
 Onkolojide Sık Kullanılan Terimler Yrd.Doç.Dr.Ümmügül Üyetürk 2013 Kanser Hücrelerin aşırı kontrolsüz üretiminin, bu üretime uygun hücre kaybıyla dengelenemediği, giderek artan hücre kütlelerinin birikimi..
Onkolojide Sık Kullanılan Terimler Yrd.Doç.Dr.Ümmügül Üyetürk 2013 Kanser Hücrelerin aşırı kontrolsüz üretiminin, bu üretime uygun hücre kaybıyla dengelenemediği, giderek artan hücre kütlelerinin birikimi..
Prof Dr Özlem Durmaz İ.Ü. İstanbul Tıp Fakültesi Çocuk Gastroenteroloji, Hepatoloji ve Beslenme Bilim Dalı
 Prof Dr Özlem Durmaz İ.Ü. İstanbul Tıp Fakültesi Çocuk Gastroenteroloji, Hepatoloji ve Beslenme Bilim Dalı Karaciğer naklinde sağkalım Cerrahi başarı: 1963 Thomas Starzl (Colorado) İmmunolojik başarı:
Prof Dr Özlem Durmaz İ.Ü. İstanbul Tıp Fakültesi Çocuk Gastroenteroloji, Hepatoloji ve Beslenme Bilim Dalı Karaciğer naklinde sağkalım Cerrahi başarı: 1963 Thomas Starzl (Colorado) İmmunolojik başarı:
VİROLOJİ -I Antiviral İmmunite
 VİROLOJİ -I Antiviral İmmunite Prof.Dr. Yılmaz Akça Prof.Dr. Feray Alkan Prof.Dr. Aykut Özkul Prof. Dr. Seval Bilge-Dağalp Prof.Dr. M. Taner Karaoğlu Prof.Dr. Tuba Çiğdem Oğuzoğlu DOĞAL SAVUNMA HATLARI-DOĞAL
VİROLOJİ -I Antiviral İmmunite Prof.Dr. Yılmaz Akça Prof.Dr. Feray Alkan Prof.Dr. Aykut Özkul Prof. Dr. Seval Bilge-Dağalp Prof.Dr. M. Taner Karaoğlu Prof.Dr. Tuba Çiğdem Oğuzoğlu DOĞAL SAVUNMA HATLARI-DOĞAL
Patolog bakış açısı ile immunoterapi. Dr Büge Öz İÜ Cerrahpaşa Tıp Fakültesi Patoloji AD
 Patolog bakış açısı ile immunoterapi Dr Büge Öz İÜ Cerrahpaşa Tıp Fakültesi Patoloji AD Konuşmanın akışı; Tümör- immunite fizyopatolojisi Kuş bakışı İmmunterapi İmmunoterapide patolojinin yeri 1890 li
Patolog bakış açısı ile immunoterapi Dr Büge Öz İÜ Cerrahpaşa Tıp Fakültesi Patoloji AD Konuşmanın akışı; Tümör- immunite fizyopatolojisi Kuş bakışı İmmunterapi İmmunoterapide patolojinin yeri 1890 li
Tarifname P53 AKTİVASYONU VESİLESİ İLE ANTİ-KARSİNOJENİK ETKİ GÖSTEREN BİR FORMÜLASYON
 1 Tarifname P3 AKTİVASYONU VESİLESİ İLE ANTİ-KARSİNOJENİK ETKİ GÖSTEREN BİR Teknik Alan FORMÜLASYON Buluş, p3 aktivasyonu vesilesi ile anti-karsinojenik etki göstermeye yönelik oluşturulmuş bir formülasyon
1 Tarifname P3 AKTİVASYONU VESİLESİ İLE ANTİ-KARSİNOJENİK ETKİ GÖSTEREN BİR Teknik Alan FORMÜLASYON Buluş, p3 aktivasyonu vesilesi ile anti-karsinojenik etki göstermeye yönelik oluşturulmuş bir formülasyon
Kanserin sebebi, belirtileri, tedavi ve korunma yöntemleri...
 Kanser Nedir? Kanserin sebebi, belirtileri, tedavi ve korunma yöntemleri... Kanser, günümüzün en önemli sağlık sorunlarından birisi. Sık görülmesi ve öldürücülüğünün yüksek olması nedeniyle de bir halk
Kanser Nedir? Kanserin sebebi, belirtileri, tedavi ve korunma yöntemleri... Kanser, günümüzün en önemli sağlık sorunlarından birisi. Sık görülmesi ve öldürücülüğünün yüksek olması nedeniyle de bir halk
b. Amaç: Bakterilerin patojenitesine karşı konakçının nasıl cevap verdiği ve savunma mekanizmaları ile ilgili genel bilgi öğretilmesi amaçlanmıştır.
 İMMÜNOLOJİİ I-DERS TANIMLARI 1- Tanım: Konakçı savunma mekanizmalarının öğretilmesi. b. Amaç: Bakterilerin patojenitesine karşı konakçının nasıl cevap verdiği ve savunma mekanizmaları ile ilgili genel
İMMÜNOLOJİİ I-DERS TANIMLARI 1- Tanım: Konakçı savunma mekanizmalarının öğretilmesi. b. Amaç: Bakterilerin patojenitesine karşı konakçının nasıl cevap verdiği ve savunma mekanizmaları ile ilgili genel
ADIM ADIM YGS LYS Adım DOLAŞIM SİSTEMİ 5 İNSANDA BAĞIŞIKLIK VE VÜCUDUN SAVUNULMASI
 ADIM ADIM YGS LYS 177. Adım DOLAŞIM SİSTEMİ 5 İNSANDA BAĞIŞIKLIK VE VÜCUDUN SAVUNULMASI İNSANDA BAĞIŞIKLIK VE VÜCUDUN SAVUNULMASI Hastalık yapıcı organizmalara karşı vücudun gösterdiği dirence bağışıklık
ADIM ADIM YGS LYS 177. Adım DOLAŞIM SİSTEMİ 5 İNSANDA BAĞIŞIKLIK VE VÜCUDUN SAVUNULMASI İNSANDA BAĞIŞIKLIK VE VÜCUDUN SAVUNULMASI Hastalık yapıcı organizmalara karşı vücudun gösterdiği dirence bağışıklık
ORGANİZMALARDA BAĞIŞIKLIK MEKANİZMALARI
 ORGANİZMALARDA BAĞIŞIKLIK MEKANİZMALARI Organizmalarda daha öncede belirtildiği gibi hücresel ve humoral bağışıklık bağışıklık reaksiyonları vardır. Bunlara ilave olarak immünoljik tolerans adı verilen
ORGANİZMALARDA BAĞIŞIKLIK MEKANİZMALARI Organizmalarda daha öncede belirtildiği gibi hücresel ve humoral bağışıklık bağışıklık reaksiyonları vardır. Bunlara ilave olarak immünoljik tolerans adı verilen
Transplantasyonda Regülatör T Hücrelerin Rolü. H. Barbaros Oral Uludağ Üniversitesi Tıp Fakültesi İmmünoloji Anabilim Dalı
 Transplantasyonda Regülatör T Hücrelerin Rolü H. Barbaros Oral Uludağ Üniversitesi Tıp Fakültesi İmmünoloji Anabilim Dalı Liu Z et al. Immunol Rev 152, 2013 Shalev I et al. Liver Transpl 18, 2012 Wood
Transplantasyonda Regülatör T Hücrelerin Rolü H. Barbaros Oral Uludağ Üniversitesi Tıp Fakültesi İmmünoloji Anabilim Dalı Liu Z et al. Immunol Rev 152, 2013 Shalev I et al. Liver Transpl 18, 2012 Wood
ADIM ADIM YGS LYS Adım EVRİM
 ADIM ADIM YGS LYS 191. Adım EVRİM EVRİM İLE İLGİLİ GÖRÜŞLER Evrim, geçmiş ile gelecekteki canlıların ve olayların yorumlanmasını sağlayarak, bugün dünyada yaşayan canlılar arasındaki akrabalık derecesini
ADIM ADIM YGS LYS 191. Adım EVRİM EVRİM İLE İLGİLİ GÖRÜŞLER Evrim, geçmiş ile gelecekteki canlıların ve olayların yorumlanmasını sağlayarak, bugün dünyada yaşayan canlılar arasındaki akrabalık derecesini
Nöroinflamasyon nedir? Temel mekanizmaları ve ölçümleme
 Nöroinflamasyon nedir? Temel mekanizmaları ve ölçümleme Uz. Dr. Tevfik Kalelioğlu Bakırköy Ruh ve Sinir Hastalıkları Hastanesi Nöroinflamasyon nedir? Temel mekanizmaları ve ölçümleme Uz. Dr. Tevfik Kalelioğlu
Nöroinflamasyon nedir? Temel mekanizmaları ve ölçümleme Uz. Dr. Tevfik Kalelioğlu Bakırköy Ruh ve Sinir Hastalıkları Hastanesi Nöroinflamasyon nedir? Temel mekanizmaları ve ölçümleme Uz. Dr. Tevfik Kalelioğlu
Chapter 10. Summary (Turkish)-Özet
 Chapter 10 Summary (Turkish)-Özet Özet Vücuda alınan enerjinin harcanandan fazla olması durumunda ortaya çıkan obezite, günümüzde tüm dünyada araştırılan sağlık sorunlarından birisidir. Obezitenin görülme
Chapter 10 Summary (Turkish)-Özet Özet Vücuda alınan enerjinin harcanandan fazla olması durumunda ortaya çıkan obezite, günümüzde tüm dünyada araştırılan sağlık sorunlarından birisidir. Obezitenin görülme
Kanserin İmmün Şekillendirilmesinin. Moleküler ve Biyolojik. Temelleri
 Kanserin İmmün Şekillendirilmesinin Moleküler ve Biyolojik Temelleri Dicle Güç 1. 2. 3. 4. 5. 6. Büyüme sinyalleri açısından kendi kendine yeterlidir Büyümeyi durduran sinyallere duyarsızdır Sınırsız bölünebilme
Kanserin İmmün Şekillendirilmesinin Moleküler ve Biyolojik Temelleri Dicle Güç 1. 2. 3. 4. 5. 6. Büyüme sinyalleri açısından kendi kendine yeterlidir Büyümeyi durduran sinyallere duyarsızdır Sınırsız bölünebilme
PAPİLLER TİROİD KARSİNOMLU OLGULARIMIZDA BRAF(V600E) GEN MUTASYON ANALİZİ. Klinik ve patolojik özellikler
 PAPİLLER TİROİD KARSİNOMLU OLGULARIMIZDA BRAF(V600E) GEN MUTASYON ANALİZİ Klinik ve patolojik özellikler Neslihan KURTULMUŞ,, Mete DÜREN, D Serdar GİRAY, G Ümit İNCE, Önder PEKER, Özlem AYDIN, M.Cengiz
PAPİLLER TİROİD KARSİNOMLU OLGULARIMIZDA BRAF(V600E) GEN MUTASYON ANALİZİ Klinik ve patolojik özellikler Neslihan KURTULMUŞ,, Mete DÜREN, D Serdar GİRAY, G Ümit İNCE, Önder PEKER, Özlem AYDIN, M.Cengiz
Reed Sternberg Hücreleri
 CD40 RSH Reed Sternberg Hücreleri Antijen sunumuyla ilgili yüzey molekülleri HLA Klas II, CD40, CD86 Sitotoksik moleküller Granzim B, Perforin Dendritik Hücre marker ları Fascin, Kemokin CCL17 (TARC) Myeloid
CD40 RSH Reed Sternberg Hücreleri Antijen sunumuyla ilgili yüzey molekülleri HLA Klas II, CD40, CD86 Sitotoksik moleküller Granzim B, Perforin Dendritik Hücre marker ları Fascin, Kemokin CCL17 (TARC) Myeloid
Prediktör Testler ve Sıradışı Serolojik Profiller. Dr. Dilara İnan Isparta
 Prediktör Testler ve Sıradışı Serolojik Profiller Dr. Dilara İnan 04.06.2016 Isparta Hepatit B yüzey antijeni (HBsAg) HBV yüzeyinde bulunan bir proteindir; RIA veya EIA ile saptanır Akut ve kronik HBV
Prediktör Testler ve Sıradışı Serolojik Profiller Dr. Dilara İnan 04.06.2016 Isparta Hepatit B yüzey antijeni (HBsAg) HBV yüzeyinde bulunan bir proteindir; RIA veya EIA ile saptanır Akut ve kronik HBV
HLA MOLEKÜLLERİ VE KLİNİK ÖNEMİ. Prof. Dr. Göksal Keskin
 HLA MOLEKÜLLERİ VE KLİNİK ÖNEMİ Prof. Dr. Göksal Keskin 2017-18 1 HLA Human LÖKOSİT Antijen human MHC Hücre yüzey proteinleri Self ve nonself ayırımında önemli T lenfositlerine peptid yapıda antijenleri
HLA MOLEKÜLLERİ VE KLİNİK ÖNEMİ Prof. Dr. Göksal Keskin 2017-18 1 HLA Human LÖKOSİT Antijen human MHC Hücre yüzey proteinleri Self ve nonself ayırımında önemli T lenfositlerine peptid yapıda antijenleri
TİP I HİPERSENSİTİVİTE REAKSİYONU. Prof. Dr. Bilun Gemicioğlu
 TİP I HİPERSENSİTİVİTE REAKSİYONU Prof. Dr. Bilun Gemicioğlu HİPERSENSİTİVİTE REAKSİYONLARI TİP I TİP II TİPII TİPIII TİPIV TİPIV TİPIV İmmün yanıt IgE IgG IgG IgG Th1 Th2 CTL Antijen Solübl antijen Hücre/
TİP I HİPERSENSİTİVİTE REAKSİYONU Prof. Dr. Bilun Gemicioğlu HİPERSENSİTİVİTE REAKSİYONLARI TİP I TİP II TİPII TİPIII TİPIV TİPIV TİPIV İmmün yanıt IgE IgG IgG IgG Th1 Th2 CTL Antijen Solübl antijen Hücre/
YAŞLILIK VE KANSER. Prof.Dr.A.Önder BERK
 YAŞLILIK VE KANSER Prof.Dr.A.Önder BERK Kanser ve diğer hastalıkların yaşla değişen sıklığı (%) YAŞ HASTALIKLAR 45 45-59 60-74 75+ Kanser 3,8 8,3 14,0 16,0 Kalp Hastalıkları 0,4 14,0 14,0 20,0 Periferik
YAŞLILIK VE KANSER Prof.Dr.A.Önder BERK Kanser ve diğer hastalıkların yaşla değişen sıklığı (%) YAŞ HASTALIKLAR 45 45-59 60-74 75+ Kanser 3,8 8,3 14,0 16,0 Kalp Hastalıkları 0,4 14,0 14,0 20,0 Periferik
Ankara Üniversitesi Tıp Fakültesi Kanser Çalışmaları. Dr Fikri İçli
 Ankara Üniversitesi Tıp Fakültesi Kanser Çalışmaları Dr Fikri İçli AÜTF Onkoloji Birimleri Tıbbi Onkoloji BD Cerrahi Onkoloji BD Radyasyon Onkolojisi AnaBD Pediatrik Onkoloji BD Onkoloji Uygulama ve Araştırma
Ankara Üniversitesi Tıp Fakültesi Kanser Çalışmaları Dr Fikri İçli AÜTF Onkoloji Birimleri Tıbbi Onkoloji BD Cerrahi Onkoloji BD Radyasyon Onkolojisi AnaBD Pediatrik Onkoloji BD Onkoloji Uygulama ve Araştırma
Kök Hücre Biyolojisi. Prof. Dr. Gönül KANIGÜR Prof. Dr. Melek ÖZTÜRK
 Kök Hücre Biyolojisi Prof. Dr. Gönül KANIGÜR Prof. Dr. Melek ÖZTÜRK Kök hücre nedir? Kök hücreler organizmanın tüm dokularını ve organlarını oluşturan ana hücrelerdir. Henüz farklılaşmamış olan bu hücreler
Kök Hücre Biyolojisi Prof. Dr. Gönül KANIGÜR Prof. Dr. Melek ÖZTÜRK Kök hücre nedir? Kök hücreler organizmanın tüm dokularını ve organlarını oluşturan ana hücrelerdir. Henüz farklılaşmamış olan bu hücreler
BİRİNCİ BASAMAKTA PRİMER İMMÜN YETMEZLİK
 1 LERDE LABORATUVAR İPUÇLARI GENEL TARAMA TESTLERİ Tam kan sayımı Periferik yayma İmmünglobulin düzeyleri (IgG, A, M, E) İzohemaglutinin titresi (Anti A, Anti B titresi) Aşıya karşı antikor yanıtı (Hepatit
1 LERDE LABORATUVAR İPUÇLARI GENEL TARAMA TESTLERİ Tam kan sayımı Periferik yayma İmmünglobulin düzeyleri (IgG, A, M, E) İzohemaglutinin titresi (Anti A, Anti B titresi) Aşıya karşı antikor yanıtı (Hepatit
HÜCRESEL İMMÜNİTENİN EFEKTÖR MEKANİZMALARI. Hücre İçi Mikropların Yok Edilmesi
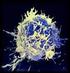 HÜCRESEL İMMÜNİTENİN EFEKTÖR MEKANİZMALARI Hücre İçi Mikropların Yok Edilmesi Hücre içi mikropları yok etmekle görevli özelleşmiş immün mekanizmalar hücre aracılı immüniteyi oluştururlar. Hücresel immünitenin
HÜCRESEL İMMÜNİTENİN EFEKTÖR MEKANİZMALARI Hücre İçi Mikropların Yok Edilmesi Hücre içi mikropları yok etmekle görevli özelleşmiş immün mekanizmalar hücre aracılı immüniteyi oluştururlar. Hücresel immünitenin
ANTİJENLER VE YAPILARI
 ANTİJENLER VE YAPILARI IMMUNOJEN VE ANTIJEN nedir? Immun cevap oluşturan yabancı maddeler antijen veya immunojen olabilir. Immunojen; İmmun yanıt meydana getirme kabiliyetindeki herhangi bir madde Antijen
ANTİJENLER VE YAPILARI IMMUNOJEN VE ANTIJEN nedir? Immun cevap oluşturan yabancı maddeler antijen veya immunojen olabilir. Immunojen; İmmun yanıt meydana getirme kabiliyetindeki herhangi bir madde Antijen
Kan Bankacılığı ve Transfüzyon Tıbbında HLA Sisteminin Önemi
 Kan Bankacılığı ve Transfüzyon Tıbbında HLA Sisteminin Önemi 1 HLA TAŞIYAN HÜCRELER VE TRANSFÜZYONDA ÖNEMİ Dr. İshak Özel TEKİN Bülent Ecevit Üniversitesi Tıp Fakültesi İmmünoloji A.D. 2 3 Baruj Benacerraf
Kan Bankacılığı ve Transfüzyon Tıbbında HLA Sisteminin Önemi 1 HLA TAŞIYAN HÜCRELER VE TRANSFÜZYONDA ÖNEMİ Dr. İshak Özel TEKİN Bülent Ecevit Üniversitesi Tıp Fakültesi İmmünoloji A.D. 2 3 Baruj Benacerraf
METASTATİK PROSTAT KANSERİ TEDAVİSİNDE İMMUNOTERAPİ VE DENDRİTİK HÜCRE AŞILAMA YÖNTEMİ
 METASTATİK PROSTAT KANSERİ TEDAVİSİNDE İMMUNOTERAPİ VE DENDRİTİK HÜCRE AŞILAMA YÖNTEMİ Op.Dr.Murat Binbay Haseki Eğitim ve Araştırma Hastanesi, Üroloji Kliniği, İstanbul GİRİŞ Kanser tedavisine standart
METASTATİK PROSTAT KANSERİ TEDAVİSİNDE İMMUNOTERAPİ VE DENDRİTİK HÜCRE AŞILAMA YÖNTEMİ Op.Dr.Murat Binbay Haseki Eğitim ve Araştırma Hastanesi, Üroloji Kliniği, İstanbul GİRİŞ Kanser tedavisine standart
Doç. Dr. Fadime Akman
 RADYOTERAPİNİN TÜMÖR ÜZERİNE ETKİSİ Dr. Fadime Akman DEÜTF Radyasyon Onkolojisi AD 2005 TÜMÖR HÜCRELERİ NELER YAPIYOR? Prolifere olan steril Veya farklılaşmış Dinlenme veya G0 ÖLÜ Radyasyonun etki mekanizmaları
RADYOTERAPİNİN TÜMÖR ÜZERİNE ETKİSİ Dr. Fadime Akman DEÜTF Radyasyon Onkolojisi AD 2005 TÜMÖR HÜCRELERİ NELER YAPIYOR? Prolifere olan steril Veya farklılaşmış Dinlenme veya G0 ÖLÜ Radyasyonun etki mekanizmaları
LENFOİD SİSTEM DR GÖKSAL KESKİN ARALIK-2014
 LENFOİD SİSTEM DR GÖKSAL KESKİN ARALIK-2014 Lenfoid Sistem Lenfositlerin, mononükleer fagositlerin ve diğer yardımcı rol oynayan hücrelerin bulunduğu, yabancı antijenlerin taşınıp yoğunlaştırıldığı, Antijenin
LENFOİD SİSTEM DR GÖKSAL KESKİN ARALIK-2014 Lenfoid Sistem Lenfositlerin, mononükleer fagositlerin ve diğer yardımcı rol oynayan hücrelerin bulunduğu, yabancı antijenlerin taşınıp yoğunlaştırıldığı, Antijenin
İLAÇ ARAŞTIRMALARINDA SURROGATE MARKERLAR
 İLAÇ ARAŞTIRMALARINDA SURROGATE MARKERLAR YENİ GELİŞMELER VE GELECEK DR. BURÇAK KARACA 3.TIBBİ ONKOLOJİ KONGRESİ FARMAKOGENOMİK KURSU 24/MART/2010, ANTALYA Giriş Preklinik çalışmalardan elde edilen temel
İLAÇ ARAŞTIRMALARINDA SURROGATE MARKERLAR YENİ GELİŞMELER VE GELECEK DR. BURÇAK KARACA 3.TIBBİ ONKOLOJİ KONGRESİ FARMAKOGENOMİK KURSU 24/MART/2010, ANTALYA Giriş Preklinik çalışmalardan elde edilen temel
ÇOK HÜCRELİ ORGANİZMALARIN GELİŞİMİ
 ÇOK HÜCRELİ ORGANİZMALARIN GELİŞİMİ Seçici gen ifadesi embriyonun gelişmesini sağlayan 4 temel işlevi denetler: 1. Hücre çoğalması 2. Hücre farklılaşması 3. Hücre etkileşimleri 4. Hücre hareketi HÜCRE
ÇOK HÜCRELİ ORGANİZMALARIN GELİŞİMİ Seçici gen ifadesi embriyonun gelişmesini sağlayan 4 temel işlevi denetler: 1. Hücre çoğalması 2. Hücre farklılaşması 3. Hücre etkileşimleri 4. Hücre hareketi HÜCRE
Virüslere Karşı İmmün Yanıt
 Virüslere Karşı İmmün Yanıt Enfeksiyon İmmünolojisi Kursu Doç. Dr. Uluhan Sili Marmara Üniversitesi Tıp Fakültesi Enfeksiyon Hast. ve Klin. Mikro. AD 1.11.2017 Anlatım Planı Virüslere karşı oluşan immün
Virüslere Karşı İmmün Yanıt Enfeksiyon İmmünolojisi Kursu Doç. Dr. Uluhan Sili Marmara Üniversitesi Tıp Fakültesi Enfeksiyon Hast. ve Klin. Mikro. AD 1.11.2017 Anlatım Planı Virüslere karşı oluşan immün
GENETİK I BİY 301 DERS 6
 GENETİK I BİY 301 DERS 6 İçerik Kısım 1: Genler, Kromozomlar ve Kalıtım Kısım 2: DNA-Yapısı, Replikasyonu ve Varyasyonu Kısım 3: Genetik bilginin ifadesi ve düzenlenmesi Kısım 4: Genomik Analiz Kısım 5:
GENETİK I BİY 301 DERS 6 İçerik Kısım 1: Genler, Kromozomlar ve Kalıtım Kısım 2: DNA-Yapısı, Replikasyonu ve Varyasyonu Kısım 3: Genetik bilginin ifadesi ve düzenlenmesi Kısım 4: Genomik Analiz Kısım 5:
Cisplatine Bağlı Akut Böbrek Yetersizliğinde İnterleukin-33 ün Rolü. Uzm. Dr. Kültigin Türkmen S.Ü.M.T.F Nefroloji B.D
 Cisplatine Bağlı Akut Böbrek Yetersizliğinde İnterleukin-33 ün Rolü Uzm. Dr. Kültigin Türkmen S.Ü.M.T.F Nefroloji B.D Konuşmanın Akışı Genel bilgiler Cisplatine bağlı ABY IL-33 Cisplatine bağlı ABY de
Cisplatine Bağlı Akut Böbrek Yetersizliğinde İnterleukin-33 ün Rolü Uzm. Dr. Kültigin Türkmen S.Ü.M.T.F Nefroloji B.D Konuşmanın Akışı Genel bilgiler Cisplatine bağlı ABY IL-33 Cisplatine bağlı ABY de
Nat. Rev. Immunology, 3:199-210, 2003). Belkaid Y ve ark. Nature 420:502-507, 2002).
 DÜZENLEYİCİ T HÜCRELER Yrd. Doç. Dr. Gülderen Yanıkkaya Demirel Yeditepe Üniversitesi Tıp Fakültesi Tıbbi Mikrobiyoloji Anabilim Dalı İmmunoloji Alt Birimi ve Yeditepe Üniversitesi Tıp Fakültesi Hastanesi
DÜZENLEYİCİ T HÜCRELER Yrd. Doç. Dr. Gülderen Yanıkkaya Demirel Yeditepe Üniversitesi Tıp Fakültesi Tıbbi Mikrobiyoloji Anabilim Dalı İmmunoloji Alt Birimi ve Yeditepe Üniversitesi Tıp Fakültesi Hastanesi
Klasik Hodgkin Lenfoma Vakalarında PD-L1 Ekspresyonunun Sıklığı, EBV ile İlişkisi, Klinik ve Prognostik Önemi
 Klasik Hodgkin Lenfoma Vakalarında PD-L1 Ekspresyonunun Sıklığı, EBV ile İlişkisi, Klinik ve Prognostik Önemi Dr. Süleyman ÖZDEMİR, Uzm. Dr Özlem TON, Prof Dr. Fevziye KABUKÇUOĞLU Sağlık Bilimleri Üniversitesi
Klasik Hodgkin Lenfoma Vakalarında PD-L1 Ekspresyonunun Sıklığı, EBV ile İlişkisi, Klinik ve Prognostik Önemi Dr. Süleyman ÖZDEMİR, Uzm. Dr Özlem TON, Prof Dr. Fevziye KABUKÇUOĞLU Sağlık Bilimleri Üniversitesi
SOLİD ORGAN TRANSPLANTASYONLARINDA İMMÜN MONİTORİZASYON
 SOLİD ORGAN TRANSPLANTASYONLARINDA İMMÜN MONİTORİZASYON Ali ŞENGÜL MEDICALPARK ANTALYA HASTANE KOMPLEKSİ İMMÜNOLOJİ BÖLÜMÜ Organ nakli umudu Beklenen Başarılı Operasyonlar Hayaller ve Komplikasyonlar?
SOLİD ORGAN TRANSPLANTASYONLARINDA İMMÜN MONİTORİZASYON Ali ŞENGÜL MEDICALPARK ANTALYA HASTANE KOMPLEKSİ İMMÜNOLOJİ BÖLÜMÜ Organ nakli umudu Beklenen Başarılı Operasyonlar Hayaller ve Komplikasyonlar?
Probiyotik suşları. Prof Dr Tarkan Karakan Gazi Üniversitesi Gastroenteroloji Bilim Dalı
 Probiyotik suşları Prof Dr Tarkan Karakan Gazi Üniversitesi Gastroenteroloji Bilim Dalı İnsan ve bakteri ilişkisi İnsan vücudundaki bakterilerin yüzey alanı = 400 m 2 (Tenis kortu kadar) İnsandaki gen
Probiyotik suşları Prof Dr Tarkan Karakan Gazi Üniversitesi Gastroenteroloji Bilim Dalı İnsan ve bakteri ilişkisi İnsan vücudundaki bakterilerin yüzey alanı = 400 m 2 (Tenis kortu kadar) İnsandaki gen
Kan Kanserleri (Lösemiler)
 Lösemi Nedir? Lösemi bir kanser türüdür. Kanser, sayısı 100'den fazla olan bir hastalık grubunun ortak adıdır. Kanserde iki önemli özellik bulunur. İlk önce bedendeki bazı hücreler anormalleşir. İkinci
Lösemi Nedir? Lösemi bir kanser türüdür. Kanser, sayısı 100'den fazla olan bir hastalık grubunun ortak adıdır. Kanserde iki önemli özellik bulunur. İlk önce bedendeki bazı hücreler anormalleşir. İkinci
KHDAK da Güncel Hedef Tedaviler
 KHDAK da Güncel Hedef Tedaviler Prof.Dr. Adnan Aydıner İstanbul Üniversitesi Onkoloji Enstitüsü İstanbul William, WN et al. Nature Reviews, 2009 a Güncel Hedef Tedaviler EGFR İnhibitörleri EGFR: transmembran
KHDAK da Güncel Hedef Tedaviler Prof.Dr. Adnan Aydıner İstanbul Üniversitesi Onkoloji Enstitüsü İstanbul William, WN et al. Nature Reviews, 2009 a Güncel Hedef Tedaviler EGFR İnhibitörleri EGFR: transmembran
Bağışıklık sistemi nasıl çalışır?
 On5yirmi5.com Bağışıklık sistemi nasıl çalışır? İnsanda bağışıklık sistemi, özellik ve görevleri nelerdir? Kaç çeşit bağışıklık sistemi vardır? Yayın Tarihi : 23 Ekim 2012 Salı (oluşturma : 10/3/2017)
On5yirmi5.com Bağışıklık sistemi nasıl çalışır? İnsanda bağışıklık sistemi, özellik ve görevleri nelerdir? Kaç çeşit bağışıklık sistemi vardır? Yayın Tarihi : 23 Ekim 2012 Salı (oluşturma : 10/3/2017)
İMMÜNOBİYOLOJİ. Prof. Dr. Nursel GÜL. Ankara Üniversitesi Fen Fakültesi Biyoloji Bölümü
 İMMÜNOBİYOLOJİ Prof. Dr. Nursel GÜL Ankara Üniversitesi Fen Fakültesi Biyoloji Bölümü GİRİŞ İmmünoloji, organizmaların dışarıdan gelen mikroorganizmalara, parazitlere vb. birçok yabancı ajana karşı veya
İMMÜNOBİYOLOJİ Prof. Dr. Nursel GÜL Ankara Üniversitesi Fen Fakültesi Biyoloji Bölümü GİRİŞ İmmünoloji, organizmaların dışarıdan gelen mikroorganizmalara, parazitlere vb. birçok yabancı ajana karşı veya
İLAÇ, KOZMETİK ÜRÜNLER İLE TIBBİ CİHAZLARDA RUHSATLANDIRMA İŞLEMLERİ ECZ HAFTA
 İLAÇ, KOZMETİK ÜRÜNLER İLE TIBBİ CİHAZLARDA RUHSATLANDIRMA İŞLEMLERİ ECZ 961 1. HAFTA İLAÇ Hastalıkların teşhisi, tedavisi, profilaksisi (hastalıktan korunma) cerrahi girişimlerin kolaylaştırılması ve
İLAÇ, KOZMETİK ÜRÜNLER İLE TIBBİ CİHAZLARDA RUHSATLANDIRMA İŞLEMLERİ ECZ 961 1. HAFTA İLAÇ Hastalıkların teşhisi, tedavisi, profilaksisi (hastalıktan korunma) cerrahi girişimlerin kolaylaştırılması ve
Mustafa EMREM
 Mustafa EMREM 162161022 Bakterilerdeki transformasyonun ilk kanıtları İngiliz bilim adamı Frederick Griffith tarafından elde edilmiştir. Genetik materyal aktarımı Dikey Gen Transferi ebeveyn ile yavru
Mustafa EMREM 162161022 Bakterilerdeki transformasyonun ilk kanıtları İngiliz bilim adamı Frederick Griffith tarafından elde edilmiştir. Genetik materyal aktarımı Dikey Gen Transferi ebeveyn ile yavru
6 ay önce kadavradan kalp nakli olan 66 yaşındaki kadın hastada inguinal bölgede 3X3 cm da lenf düğümü saptandı. Lenf düğümü cerrahi olarak eksize
 6 ay önce kadavradan kalp nakli olan 66 yaşındaki kadın hastada inguinal bölgede 3X3 cm da lenf düğümü saptandı. Lenf düğümü cerrahi olarak eksize edildi. CD20 CD10 Bcl-6 Bcl-2 Ki-67 MUM-1
6 ay önce kadavradan kalp nakli olan 66 yaşındaki kadın hastada inguinal bölgede 3X3 cm da lenf düğümü saptandı. Lenf düğümü cerrahi olarak eksize edildi. CD20 CD10 Bcl-6 Bcl-2 Ki-67 MUM-1
Ankilozan Spondilit te Patogenez: Yeni Gelişmeler
 Ankilozan Spondilit te Patogenez: Yeni Gelişmeler 1 Prof. Dr. Pamir Atagündüz Marmara Üniversitesi Romatoloji Bilim Dalı 21 Nisan 2017 Genel Bilgiler Kronik, progressif, inflamatuar hastalık grubu Prevalans
Ankilozan Spondilit te Patogenez: Yeni Gelişmeler 1 Prof. Dr. Pamir Atagündüz Marmara Üniversitesi Romatoloji Bilim Dalı 21 Nisan 2017 Genel Bilgiler Kronik, progressif, inflamatuar hastalık grubu Prevalans
Sitokinler. Dr. A. Gökhan AKKAN İ.Ü. Cerrahpaşa Tıp Fakültesi Farmakoloji ve Klinik Farmakoloji Ab. Dalı www.farmakoloji.org
 Sitokinler Dr. A. Gökhan AKKAN İ.Ü. Cerrahpaşa Tıp Fakültesi Farmakoloji ve Klinik Farmakoloji Ab. Dalı www.farmakoloji.org Sitokinler Doğal ve adaptif immünitede rol alan ve hücrelerin immün fonksiyonlarını
Sitokinler Dr. A. Gökhan AKKAN İ.Ü. Cerrahpaşa Tıp Fakültesi Farmakoloji ve Klinik Farmakoloji Ab. Dalı www.farmakoloji.org Sitokinler Doğal ve adaptif immünitede rol alan ve hücrelerin immün fonksiyonlarını
Regülatör T hücreleri ve İnsan Hastalıkları
 Regülatör T hücreleri ve İnsan Hastalıkları Haner Direskeneli Marmara Tıp Fakültesi İmmün-tolerans Adaptif immün yanıt etkili anti-bakteryal immünite ile antiself yanıtın dengede tutulmasına bağlıdır.
Regülatör T hücreleri ve İnsan Hastalıkları Haner Direskeneli Marmara Tıp Fakültesi İmmün-tolerans Adaptif immün yanıt etkili anti-bakteryal immünite ile antiself yanıtın dengede tutulmasına bağlıdır.
EĞİTİM-ÖĞRETİM BAHAR YARI YILI LİSANSÜSTÜ DERS PROGRAMI. Tarih Saat Konu Yer Anlatan
 2016- EĞİTİM-ÖĞRETİM BAHAR YARI YILI LİSANSÜSTÜ DERS PROGRAMI EĞİTİM-ÖĞRETİM BAŞLANGIÇ: 13 Şubat EĞİTİM-ÖĞRETİM BİTİŞ: 18 Mayıs Bitirme sınav tarihleri : 22 Mayıs-2 Haziran Bütünleme sınav tarihleri: 12-23
2016- EĞİTİM-ÖĞRETİM BAHAR YARI YILI LİSANSÜSTÜ DERS PROGRAMI EĞİTİM-ÖĞRETİM BAŞLANGIÇ: 13 Şubat EĞİTİM-ÖĞRETİM BİTİŞ: 18 Mayıs Bitirme sınav tarihleri : 22 Mayıs-2 Haziran Bütünleme sınav tarihleri: 12-23
PODOSİT HÜCRE MODELİNDE PROTEİNÜRİDE, SLİT DİYAFRAM PROTEİNLERİ GENLERİNİN EKSPRESYONU VE FARMAKOLOJİK MODÜLASYONU
 PODOSİT HÜCRE MODELİNDE PROTEİNÜRİDE, SLİT DİYAFRAM PROTEİNLERİ GENLERİNİN EKSPRESYONU VE FARMAKOLOJİK MODÜLASYONU Mesude Angın 1, Ender Hür 1, Çiğdem Dinçkal 1, Cenk Gökalp 1, Afig Berdeli 1, Soner Duman
PODOSİT HÜCRE MODELİNDE PROTEİNÜRİDE, SLİT DİYAFRAM PROTEİNLERİ GENLERİNİN EKSPRESYONU VE FARMAKOLOJİK MODÜLASYONU Mesude Angın 1, Ender Hür 1, Çiğdem Dinçkal 1, Cenk Gökalp 1, Afig Berdeli 1, Soner Duman
Malignite ve Transplantasyon. Doç. Dr. Halil Yazıcı İstanbul Tıp Fakültesi Nefroloji Bilim Dalı
 Malignite ve Transplantasyon Doç. Dr. Halil Yazıcı İstanbul Tıp Fakültesi Nefroloji Bilim Dalı Sunum Planı -Pretransplant malignitesi olan alıcı -Pretransplant malignitesi olan donör -Posttransplant de
Malignite ve Transplantasyon Doç. Dr. Halil Yazıcı İstanbul Tıp Fakültesi Nefroloji Bilim Dalı Sunum Planı -Pretransplant malignitesi olan alıcı -Pretransplant malignitesi olan donör -Posttransplant de
Kronik Hastalığı Olanlarda ve İmmünsüpresif Hastalarda Bağışıklama. Dr. Hüsnü Pullukçu Ege ÜTF Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji AD
 Kronik Hastalığı Olanlarda ve İmmünsüpresif Hastalarda Bağışıklama Dr. Hüsnü Pullukçu Ege ÜTF Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji AD Bağışıklığın Baskılanması Birincil İkincil B hücre hastalıkları
Kronik Hastalığı Olanlarda ve İmmünsüpresif Hastalarda Bağışıklama Dr. Hüsnü Pullukçu Ege ÜTF Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji AD Bağışıklığın Baskılanması Birincil İkincil B hücre hastalıkları
ALLOJENİK KORDON KANI BANKACILIĞINDA UMUTLAR
 ALLOJENİK KORDON KANI BANKACILIĞINDA UMUTLAR Prof. Dr. İhsan Karadoğan Akdeniz Üniversitesi Tıp Fakültesi Hematoloji Bilim Dalı Öğretim Üyesi Kök Hücre Nedir? Kendileri için uygun olan bir çevre içinde
ALLOJENİK KORDON KANI BANKACILIĞINDA UMUTLAR Prof. Dr. İhsan Karadoğan Akdeniz Üniversitesi Tıp Fakültesi Hematoloji Bilim Dalı Öğretim Üyesi Kök Hücre Nedir? Kendileri için uygun olan bir çevre içinde
Romatoid Artrit Patogenezinde SitokinAğı
 Romatoid Artrit Patogenezinde SitokinAğı Prof. Dr. Ahmet Gül İ. Ü. İstanbul Tıp Fakültesi İç Hastalıkları Anabilim Dalı Romatoloji Bilim Dalı Romatoid Artrit Kronik simetrik poliartrit q Eklemde İnflammasyon
Romatoid Artrit Patogenezinde SitokinAğı Prof. Dr. Ahmet Gül İ. Ü. İstanbul Tıp Fakültesi İç Hastalıkları Anabilim Dalı Romatoloji Bilim Dalı Romatoid Artrit Kronik simetrik poliartrit q Eklemde İnflammasyon
56Y, erkek hasta Generalize LAP ( servikal, inguinal, aksiller, toraks ve abdomende ) Ateş Gece terlemesi Lenfopeni IgG, IgA, IgM yüksek
 56Y, erkek hasta Generalize LAP ( servikal, inguinal, aksiller, toraks ve abdomende ) Ateş Gece terlemesi Lenfopeni IgG, IgA, IgM yüksek Sedimantasyon (77mm/saat) CRP 7.67(N:0-0.8mg/dl) Servikal lenf nodu
56Y, erkek hasta Generalize LAP ( servikal, inguinal, aksiller, toraks ve abdomende ) Ateş Gece terlemesi Lenfopeni IgG, IgA, IgM yüksek Sedimantasyon (77mm/saat) CRP 7.67(N:0-0.8mg/dl) Servikal lenf nodu
(ZORUNLU) MOLEKÜLER İMMÜNOLOJİ I (TBG 607 TEORİK 3, 3 KREDİ)
 T. C. İSTANBUL BİLİM ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ TIBBİ BİYOLOJİ VE GENETİK ANABİLİM DALI YÜKSEK LİSANS PROGRAMI 2015-2016 EĞİTİM-ÖĞRETİM YILI DERS İÇERİKLERİ I. YARIYIL (ZORUNLU) MOLEKÜLER
T. C. İSTANBUL BİLİM ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ TIBBİ BİYOLOJİ VE GENETİK ANABİLİM DALI YÜKSEK LİSANS PROGRAMI 2015-2016 EĞİTİM-ÖĞRETİM YILI DERS İÇERİKLERİ I. YARIYIL (ZORUNLU) MOLEKÜLER
Bölünme Kapasitelerine Göre Hücre Çeşitleri
 Ye#şkin Kök Hücre Bölünme Kapasitelerine Göre Hücre Çeşitleri 1. Değişken hücreler (Labile cells) - Sürekli bir kayıp ve yenilenme vardır. - Skuamöz ve salgı bezi hücreleri - Kemik iliğindeki hematopoe>k
Ye#şkin Kök Hücre Bölünme Kapasitelerine Göre Hücre Çeşitleri 1. Değişken hücreler (Labile cells) - Sürekli bir kayıp ve yenilenme vardır. - Skuamöz ve salgı bezi hücreleri - Kemik iliğindeki hematopoe>k
HIV ENFEKSİYONUNUN İMMÜNOLOJİ LABORATUARINDA TAKİBİ
 HIV ENFEKSİYONUNUN İMMÜNOLOJİ LABORATUARINDA TAKİBİ Doç. Dr. Gülderen Yanıkkaya Demirel Yeditepe Üniversitesi Tıp Fakültesi İmmunoloji Anabilim Dalı Bşk Yeditepe Universitesi Hastanesi, Doku Tipleme Laboratuvarı
HIV ENFEKSİYONUNUN İMMÜNOLOJİ LABORATUARINDA TAKİBİ Doç. Dr. Gülderen Yanıkkaya Demirel Yeditepe Üniversitesi Tıp Fakültesi İmmunoloji Anabilim Dalı Bşk Yeditepe Universitesi Hastanesi, Doku Tipleme Laboratuvarı
İMMİNOLOJİ YÜKSEK LİSANS PROGRAMI DERS TANITIM TABLOSU
 İMMİNOLOJİ YÜKSEK LİSANS PROGRAMI DERS TANITIM TABLOSU Dersin Kodu ve Adı İMM610 İmmünolojinin esasları Dersin Kredisi 2 0 2 Prof. Dr. Özden Sanal, Prof. Dr. İlhan Tezcan Yok 1 yarıyıl (haftada toplam
İMMİNOLOJİ YÜKSEK LİSANS PROGRAMI DERS TANITIM TABLOSU Dersin Kodu ve Adı İMM610 İmmünolojinin esasları Dersin Kredisi 2 0 2 Prof. Dr. Özden Sanal, Prof. Dr. İlhan Tezcan Yok 1 yarıyıl (haftada toplam
BCC DE GÜNCEL Prof. Dr. Kamer GÜNDÜZ
 BCC DE GÜNCEL Prof. Dr. Kamer GÜNDÜZ Celal Bayar Üniversitesi Deri ve Zührevi Hastalıklar Anabilim Dalı-MANİSA Bazal Hücreli Kanser (BCC) 1827 - Arthur Jacob En sık rastlanan deri kanseri (%70-80) Açık
BCC DE GÜNCEL Prof. Dr. Kamer GÜNDÜZ Celal Bayar Üniversitesi Deri ve Zührevi Hastalıklar Anabilim Dalı-MANİSA Bazal Hücreli Kanser (BCC) 1827 - Arthur Jacob En sık rastlanan deri kanseri (%70-80) Açık
3. Sınıf Klinik İmmünoloji Vize Sınav Soruları (Kasım 2011)
 3. Sınıf Klinik İmmünoloji Vize Sınav Soruları (Kasım 2011) 1- Virgin B lenfositleri ile ilişkili aşağıda yer alan ifadelerden ikisi yanlıştır. Yanlış ifadelerin ikisini de birlikte içeren seçeneği işaretleyiniz.
3. Sınıf Klinik İmmünoloji Vize Sınav Soruları (Kasım 2011) 1- Virgin B lenfositleri ile ilişkili aşağıda yer alan ifadelerden ikisi yanlıştır. Yanlış ifadelerin ikisini de birlikte içeren seçeneği işaretleyiniz.
KANSER NEDİR? ONKOGEN VE KANSER. Hücre döngüsü. Siklin-Siklin Kinaz 1/30/2012 HÜCRE DÖNGÜSÜ. Siklin Kinaz inhibitörleri BÜYÜME FAKTÖRLERİ
 KANSER NEDİR? ONKOGEN VE KANSER Prof.Dr.Dildar Konukoğlu Bir hücre veya hücre grubunun kontrol dışı büyümesi ve çoğalması ve Bu hücrelerin bulundukları yerden ayrılarak farklı lokalizasyonlarda bu faaliyetlerini
KANSER NEDİR? ONKOGEN VE KANSER Prof.Dr.Dildar Konukoğlu Bir hücre veya hücre grubunun kontrol dışı büyümesi ve çoğalması ve Bu hücrelerin bulundukları yerden ayrılarak farklı lokalizasyonlarda bu faaliyetlerini
Beyin Omurilik ve Sinir Tümörlerinin Cerrahisi. (Nöro-Onkolojik Cerrahi)
 Beyin Omurilik ve Sinir Tümörlerinin Cerrahisi (Nöro-Onkolojik Cerrahi) BR.HLİ.018 Sinir sisteminin (Beyin, omurilik ve sinirlerin) tümörleri, sinir dokusunda bulunan çeşitli hücrelerden kaynaklanan ya
Beyin Omurilik ve Sinir Tümörlerinin Cerrahisi (Nöro-Onkolojik Cerrahi) BR.HLİ.018 Sinir sisteminin (Beyin, omurilik ve sinirlerin) tümörleri, sinir dokusunda bulunan çeşitli hücrelerden kaynaklanan ya
Kök Hücre ve Farklılaşma
 Kök Hücre ve Farklılaşma Kök Hücre Erişkin ve embriyonik kök hücreler farklılaşarak soma7k hücreleri oluştururlar. Kök hücre Progenitör hücre Farklılaşmış hücre Neden Farklılaşmaya İh7yaç Duyulur Tek hücreli
Kök Hücre ve Farklılaşma Kök Hücre Erişkin ve embriyonik kök hücreler farklılaşarak soma7k hücreleri oluştururlar. Kök hücre Progenitör hücre Farklılaşmış hücre Neden Farklılaşmaya İh7yaç Duyulur Tek hücreli
BAĞIŞIKLIK SİSTEMİ FARMAKOLOJİSİ
 BAĞIŞIKLIK SİSTEMİ FARMAKOLOJİSİ Bağışıklık sistemini etkileyen (uyaran veya baskılayan) maddeler özellikle kanser ve oto-bağışıklık hastalıklarının sağaltımında kullanılan ilaçlar Organ nakillerinde reddin
BAĞIŞIKLIK SİSTEMİ FARMAKOLOJİSİ Bağışıklık sistemini etkileyen (uyaran veya baskılayan) maddeler özellikle kanser ve oto-bağışıklık hastalıklarının sağaltımında kullanılan ilaçlar Organ nakillerinde reddin
Doksorubisin uygulanan PARP-1 geni silinmiş farelerde FOXO transkripsiyon faktörlerinin ekspresyonları spermatogenez sürecinde değişiklik gösterir
 Doksorubisin uygulanan PARP-1 geni silinmiş farelerde FOXO transkripsiyon faktörlerinin ekspresyonları spermatogenez sürecinde değişiklik gösterir Çiler Çelik-Özenci*, Nilay Kuşcu*, Nayçe Bektaş*, Ece
Doksorubisin uygulanan PARP-1 geni silinmiş farelerde FOXO transkripsiyon faktörlerinin ekspresyonları spermatogenez sürecinde değişiklik gösterir Çiler Çelik-Özenci*, Nilay Kuşcu*, Nayçe Bektaş*, Ece
Wnt/β-katenin Yolağı
 Wnt/β-katenin Yolağı Wnt/β-katenin Yolağı Memeli canlılarda oldukça korunmuş ve gelişim için oldukça önemli olan bir yolak7r. Drosophila da yapılan gene>k çalışmalar sırasında keşfedilmiş>r. Özellikle
Wnt/β-katenin Yolağı Wnt/β-katenin Yolağı Memeli canlılarda oldukça korunmuş ve gelişim için oldukça önemli olan bir yolak7r. Drosophila da yapılan gene>k çalışmalar sırasında keşfedilmiş>r. Özellikle
SNP TEK NÜKLEOTİD POLİMORFİZMLERİ (SINGLE NUCLEOTIDE POLYMORPHISMS)
 SNP TEK NÜKLEOTİD POLİMORFİZMLERİ (SINGLE NUCLEOTIDE POLYMORPHISMS) Herhangi iki bireyin DNA dizisi %99.9 aynıdır. %0.1 = ~3x10 6 nükleotid farklılığı sağlar. Genetik materyalde varyasyon : Polimorfizm
SNP TEK NÜKLEOTİD POLİMORFİZMLERİ (SINGLE NUCLEOTIDE POLYMORPHISMS) Herhangi iki bireyin DNA dizisi %99.9 aynıdır. %0.1 = ~3x10 6 nükleotid farklılığı sağlar. Genetik materyalde varyasyon : Polimorfizm
7. PROKARYOTLARDA GEN İFADESİNİN DÜZENLENMESİ
 7. PROKARYOTLARDA GEN İFADESİNİN DÜZENLENMESİ Başlıklar 1. Prokaryotlar gen ifadesini çevre koşullarına göre düzenler 2. E. Coli de laktoz metabolizması 3. Lac operonu negatif kontrol 4. CAP pozitif kontrol
7. PROKARYOTLARDA GEN İFADESİNİN DÜZENLENMESİ Başlıklar 1. Prokaryotlar gen ifadesini çevre koşullarına göre düzenler 2. E. Coli de laktoz metabolizması 3. Lac operonu negatif kontrol 4. CAP pozitif kontrol
HANDAN TUNCEL. İstanbul Üniversitesi, Cerrahpaşa Tıp Fakültesi Biyofizik Anabilim Dalı
 HÜCRENİN ÇOĞALMASI VE FARKLILAŞIMININ BİYOFİZİĞİ HANDAN TUNCEL İstanbul Üniversitesi, Cerrahpaşa Tıp Fakültesi Biyofizik Anabilim Dalı hntuncel@istanbul.edu.tr G1; presentetik, S; DNA sentez fazı G2;
HÜCRENİN ÇOĞALMASI VE FARKLILAŞIMININ BİYOFİZİĞİ HANDAN TUNCEL İstanbul Üniversitesi, Cerrahpaşa Tıp Fakültesi Biyofizik Anabilim Dalı hntuncel@istanbul.edu.tr G1; presentetik, S; DNA sentez fazı G2;
TÜMÖR BELİRTEÇLERİNİN KLİNİK TANIDA ÖNEMİ. Doç.Dr. Mustafa ALTINIŞIK ADÜTF Biyokimya AD 2006
 TÜMÖR BELİRTEÇLERİNİN KLİNİK TANIDA ÖNEMİ Doç.Dr. Mustafa ALTINIŞIK ADÜTF Biyokimya AD 2006 1 Tümör (kanser), Vücudumuzun herhangi bir hücre veya hücre topluluğunun kontrolsüz bir şekilde çoğalması, büyümesi,
TÜMÖR BELİRTEÇLERİNİN KLİNİK TANIDA ÖNEMİ Doç.Dr. Mustafa ALTINIŞIK ADÜTF Biyokimya AD 2006 1 Tümör (kanser), Vücudumuzun herhangi bir hücre veya hücre topluluğunun kontrolsüz bir şekilde çoğalması, büyümesi,
KARSİNOGENEZ Prof.Dr.Şevket Ruacan
 KARSİNOGENEZ 2007 Prof.Dr.Şevket Ruacan Kanser anormal bir doku kitlesidir. Büyümesi normal dokulardan daha hızlıdır ve onlarla uyumlu değildir. Bu bozukluk değişimi başlatan uyarı ortadan kalktıktan sonra
KARSİNOGENEZ 2007 Prof.Dr.Şevket Ruacan Kanser anormal bir doku kitlesidir. Büyümesi normal dokulardan daha hızlıdır ve onlarla uyumlu değildir. Bu bozukluk değişimi başlatan uyarı ortadan kalktıktan sonra
TAKD olgu sunumları- 21 Kasım Dr Şebnem Batur Dr Büge ÖZ İÜ Cerrahpaşa Tıp Fakültesi Patoloji AD
 TAKD olgu sunumları- 21 Kasım 2012 Dr Şebnem Batur Dr Büge ÖZ İÜ Cerrahpaşa Tıp Fakültesi Patoloji AD Konuşma akışı; ALK mutasyonu değerlendirmedeki sorunlar ROS-1 mutasyonu Avrupa pulmoner patoloji çalışma
TAKD olgu sunumları- 21 Kasım 2012 Dr Şebnem Batur Dr Büge ÖZ İÜ Cerrahpaşa Tıp Fakültesi Patoloji AD Konuşma akışı; ALK mutasyonu değerlendirmedeki sorunlar ROS-1 mutasyonu Avrupa pulmoner patoloji çalışma
HÜCRE SĠNYAL OLAYLARI PROF. DR. FATMA SAVRAN OĞUZ
 HÜCRE SĠNYAL OLAYLARI PROF. DR. FATMA SAVRAN OĞUZ Çok hücreli organizmaların kompleks omurgalılara evrimi, hücreler birbirleriyle iletişim kuramasalardı mümkün olmazdı. Hücre-hücre Hücre-matriks etkileşimini
HÜCRE SĠNYAL OLAYLARI PROF. DR. FATMA SAVRAN OĞUZ Çok hücreli organizmaların kompleks omurgalılara evrimi, hücreler birbirleriyle iletişim kuramasalardı mümkün olmazdı. Hücre-hücre Hücre-matriks etkileşimini
KANSER TEDAVİSİNE BAĞLI ORTAYA ÇIKAN MUKOZİTLER İÇİN MASSC/ISOO KANITA DAYALI KLİNİK UYGULAMA REHBERİ
 KANSER TEDAVİSİNE BAĞLI ORTAYA ÇIKAN MUKOZİTLER İÇİN MASSC/ISOO KANITA DAYALI KLİNİK UYGULAMA REHBERİ ÖZET BELGE TARİHİ: 7 KASIM 2014 ORAL MUKOZİT (listelenmiş tedavi uygulamalarının etkinliğini destekleyen
KANSER TEDAVİSİNE BAĞLI ORTAYA ÇIKAN MUKOZİTLER İÇİN MASSC/ISOO KANITA DAYALI KLİNİK UYGULAMA REHBERİ ÖZET BELGE TARİHİ: 7 KASIM 2014 ORAL MUKOZİT (listelenmiş tedavi uygulamalarının etkinliğini destekleyen
J Popul Ther Clin Pharmacol 8:e257-e260;2011
 SİTOMEGALOVİRUS (CMV) Prof. Dr. Seyyâl ROTA Gazi Ü.Tıp Fakültesi LOW SYSTEMIC GANCICLOVIR EXPOSURE AND PREEMPTIVE TREATMENT FAILURE OF CYTOMEGALOVIRUS REACTIVATION IN A TRANSPLANTED CHILD J Popul Ther
SİTOMEGALOVİRUS (CMV) Prof. Dr. Seyyâl ROTA Gazi Ü.Tıp Fakültesi LOW SYSTEMIC GANCICLOVIR EXPOSURE AND PREEMPTIVE TREATMENT FAILURE OF CYTOMEGALOVIRUS REACTIVATION IN A TRANSPLANTED CHILD J Popul Ther
METASTATİK BEYİN TÜMÖRLERİ Hazırlayan: Türk Nöroşirürji Derneği Nöroonkoloji Eğitim ve Araştırma Grubu (TURNOG)
 METASTATİK BEYİN TÜMÖRLERİ Hazırlayan: Türk Nöroşirürji Derneği Nöroonkoloji Eğitim ve Araştırma Grubu (TURNOG) Metastatik tümörler en sık görülen beyin tümörleridir. Her geçen yıl çok daha fazla sayıda
METASTATİK BEYİN TÜMÖRLERİ Hazırlayan: Türk Nöroşirürji Derneği Nöroonkoloji Eğitim ve Araştırma Grubu (TURNOG) Metastatik tümörler en sık görülen beyin tümörleridir. Her geçen yıl çok daha fazla sayıda
Yatan ve Poliklinik Takipli Kanserli Hastalarda İlaç Etkileşimlerinin Sıklığı ve Ciddiyetinin Değerlendirilmesi
 Yatan ve Poliklinik Takipli Kanserli Hastalarda İlaç Etkileşimlerinin Sıklığı ve Ciddiyetinin Değerlendirilmesi Dr. Ali Ayberk Beşen Başkent Üniversitesi Tıbbi Onkoloji BD Giriş Sitotoksik tedaviler herhangi
Yatan ve Poliklinik Takipli Kanserli Hastalarda İlaç Etkileşimlerinin Sıklığı ve Ciddiyetinin Değerlendirilmesi Dr. Ali Ayberk Beşen Başkent Üniversitesi Tıbbi Onkoloji BD Giriş Sitotoksik tedaviler herhangi
