T.C. SAĞLIK BAKANLIĞI Dr.LÜTFĐ KIRDAR KARTAL EĞĐTĐM VE ARAŞTIRMA HASTANESĐ PATOLOJĐ BÖLÜMÜ ŞEF: Dr. NĐMET KARADAYI
|
|
|
- Bariş Şimşek
- 9 yıl önce
- İzleme sayısı:
Transkript
1 T.C. SAĞLIK BAKANLIĞI Dr.LÜTFĐ KIRDAR KARTAL EĞĐTĐM VE ARAŞTIRMA HASTANESĐ PATOLOJĐ BÖLÜMÜ ŞEF: Dr. NĐMET KARADAYI OVERĐN PRĐMER SERÖZ VE MÜSĐNÖZ TÜMÖRLERĐNDE COX-2, p53 VE HER-2/neu (c-erbb-2) EKSPRESYONUNUN PROGNOSTĐK VE KLĐNĐKOPATOLOJĐ PAREMETRELERLE KARŞILAŞTIRMALI DEĞERLENDĐRĐLMESĐ (Uzmanlık Tezi) Dr.Ramazan GEYYAS Đstanbul
2 ĐÇĐNDEKĐLER GĐRĐŞ VE AMAÇ 4 GENEL BĐLGĐLER.6 MATERYAL VE METOD.39 BULGULAR...43 TARTIŞMA..82 SONUÇLAR.94 RESĐMLER..97 KAYNAKLAR 103 2
3 ÖNSÖZ Uzmanlık eğitimim boyunca bilgi ve deneyimlerinden yararlandığım ve asistanı olmaktan onur ve mutluluk duyduğum klinik şefim Uzm. Dr. Nimet KARADAYI ya; Eğitimim süresince bilimsel deneyimlerini ve patoloji bilgilerini benimle paylaşan şef yardımcısı Uzm. Dr. Dilek YAVUZER e; Eğitimim sırasında her zaman desteklerini gördüğüm öncelikle tez danışmanım başasistan Uzm. Dr. Sevinç Hallaç KESER e, başasistan Uzm. Dr. Aylin Ege GÜL ve Nagehan Özdedmir BARIŞIK a: Olguya yaklaşımı, tanı koyabilme yeteneği ve cesaretini aşılayan Uzm. Dr. Sibel KAYAHAN, Melin Özgün GEÇER, Çağlar ÇAKIR ve yeni uzman Dr. Mine Tuğcu ÇAYIRCI ya; Birlikte çalışmaktan mutluluk duyduğum kliniğimizdeki değerli tekniker, bilgi işlem personeli, yardımcı personel ve asistan doktorlara; Beni her konuda destekleyen ailem, eşim ve biricik canım kızım KIVILCIM a TEŞEKKÜR EDĐYORUM.. Dr. Ramazan GEYYAS 3
4 GĐRĐŞ VE AMAÇ Kadın genital sistem kanserleri arasında sıklık itibariyle over kanserleri, serviks ve endometrium kanserlerinden sonra gelmektedir. Kadınlarda görülen tüm kanserlerin % 6 sını, genital kanserlerin ise % 30 unu oluşturur. Over kanserleri kansere bağlı ölümler arasında akciğer, meme ve kolondan sonra dördüncü sırada, jinekolojik kanserlere bağlı ölümlerde ise birinci sırada yer almaktadır (1). Đsveçli kadınlar yaşamları boyunca % 1,7 oranında over kanser gelişme riski taşırken; Brezilya, Hindistan, Cezayir ve Gambiya yüz binde 5 den az oranda over kanser gelişme riski taşımaktadırlar. ABD de 2000 yılında yeni over kanseri tanısı konmuş olup, over kanserli hasta ölmüştür (2). Ülkemizde, T.C. Sağlık Bakanlığının yayınladığı Sağlık Đstatistiklerine göre 2002 de over kanseri tüm kadın kanserleri içerisinde dördüncü, jinekolojik kanserler içerisinde ise en sık gözlenen malignite olmuştur. Đnsidansı 1,7/ dir (3). Çok sayıda alt tip içeren over tümörlerinin % 80 i benign olup görülme yaşı dir. Malign formları daha çok ileri yaşlarda yaşları arasında ortaya çıkar (1). Over tümörleri şaşırtıcı derecede farklı patolojik antitelerdir. Bu farklılık normal overi oluşturan üç hücre tipine bağlanabilir: Multipotansiyel yüzey (çölemik) örtücü epiteli, totipotansiyel germ hücreleri ve multipotansiyel seks kord stromal hücreleridir. Over yüzey epitel kökenli tümörler primer over tümörlerinin % ni; malign tümörlerinin ise % 90 nını oluşturur (4). Over yüzey epitel tümörleri; hücre tipine (seröz, müsinöz, endometrioid vs ), büyüme paternine (kistik, solid, yüzeyel), fibröz stroma miktarına, atipi ve invazyon (benign, borderline ve malign) parametrelerine göre sınıflandırılır (5). 4
5 Over karsinomlarında prognozu belirlemede en çok histolojik grade, evre, lenf nodu metastazı gibi paremetreler kullanılmaktadır. Bazı biyolojik faktörlerin (protoonkogen, onkogen, düzenleyici faktörler, tümör supresör genler) prognozu belirlemede rollerinin olup olmadığı araştırılmaktadır. Over karsinogenezinde araştırılan biyolojik faktörlerden başlıcaları CK-7, CK-20, EMA, CEA, COX-2, p53 ve c-erbb-2 dir (2, 6,7,8 ). Tümör baskılayıcı bir gen olan p53 insan kanserlerinde en sık görülen genetik anormallik olması nedeniyle üzerinde oldukça fazla çalışma yapılan bir gendir. p kromozomun kısa kolunda lokalizedir. Müsinöz tümörlerde nadir görülen p53 gen mutasyonu, başta seröz karsinomlar olmak üzere over kanserlerinin % ında saptanmıştır (2). COX 2 inflamasyonu uyarır, mitojeniktir, büyüme faktörleri ve sitokinlerin indüksiyonunu sağlar. Đnflamasyonun ürettiği toksik oksidanlar DNA hasarına yol açar ve karsinogenezde rol oynar. COX 2 ekspresyonu karsinogenezis ile bağlantılıdır ve proliferasyon, neoanjiogenez, yüksek damar yoğunluğu ve apopitozisin inhibisyonu ile ilişkili olduğu bulunmuştur (6). HER-2/neu (c-erbb-2) reseptörü hem malign hem de normal dokuların büyümesinde önemli bir rol oynayan epidermal growth faktör reseptör ailesine bağlıdır. c-erbb-2 gen ürününün malign transformasyon esnasında potent onkofetal protein olarak görev yaptığı düşünülmüştür (7). Çalışmamızdaki amacımız seröz ve müsinöz over tümörlerinde COX-2, p53 ve c-erbb-2 ekspresyonun prognostik paremetrelerle ilişkisini belirlemek ve borderline tümörler ile karsinomlardaki ekspresyon oranlarını karşılaştırmaktır. Dr. Lütfi Kırdar Kartal Eğitim ve Araştırma Hastanesi Patoloji Kliniği nde borderline seröz tümör, borderline müsinöz tümör, primer seröz karsinom ve primer müsinöz karsinom tanısı almış 85 over tümörü retrospektif olarak klinik ve histopatolojik özellikleri incelenerek, p53 gen mutasyon varlığı, c-erbb-2 ve COX-2 ekspresyonu immünhistokimyasal yöntemle değerlendirilmiştir. 5
6 GENEL BĐLGĐLER EMBRĐYOLOJĐ Embriyonik hayatın yedinci haftasına kadar dişi ve erkek embriyodaki gonadlar morfolojik olarak aynıdır. Fertilizasyondan dört hafta sonra, primordiyal germ hücreleri yolk sak duvarında belirir (9). Beşinci haftada çölemik epitel (mezotelyum) mezonefrozun medial ve ventral sınırlar boyunca kalınlaşarak genital çatı yapısını oluşturur. Mezenkim kökenli bu epitel sürekli prolifere olarak gonadal organları meydana getirir. Eş zamanlı olarak embriyonik yaşamın 5 6. haftalarında yolk sak endodermden gonadlara primordial germ hücrelerinin göçü gerçekleşir. Bu hücreler (oogonia) mitotik aktivite geçirerek gestasyonun ortasında her bir ovaryumda 3 milyona ulaşır; fakat termde 2/3 ü atreziye uğrar gestasyon haftalarında oogoniumlar mayoz bölünmeye başlar ve mayotik profazda durur. Bu dönemdeki hücreler primer oosit olarak bilinir (10). 2. aydan sonra primitif gonad over olarak tanımlanır. Gestasyonun 7 9 haftalarında overin dıştaki zonu son korteks şeklinde genişler ki bu az sayıda küçük pregranüloza hücreleri ile karışık primitif germ hücre tabakalarının karışması ile oluşur. Vasküler bağ doku septaları haftalarda korteksin iç kısmında bulunan medüller mezenkimden yayılmaya başlar ve 20. haftada korteksin yüzey kısmına yayılır. Oositler ve pregranüloza hücrelerinden meydana gelen hücresel grupların ayrılmasıyla korteks oluşur. Aynı dönemde pregranüloza hücreleri tek germ hücrelerinin etrafında primordial follikülleri oluşturur gestasyon haftalarında başlayan follikülogenezis korteksin iç kısmından neonatal döneme doğru dış kortekse hareket eder (10). 6
7 Erkek ve dişi embriyoda mezonefrik ve paramezonefrik iki çift genital kanal mevcuttur. Paramezonefrik kanal ürogenital sırtın anterolateral yüzeyindeki epitelin uzunlamasına bir invajinasyonu sonucu ortaya çıkar. Çölemik kaviteyi döşeyen mezoderm peritonal kavitenin mezotelini oluşturur. Nefrogenital tomurcuğu örten bu epitelyum özelleşerek paramezonefrik kanalları yapar. Paramezonefrik kanal dişide endoserviks, endometrium ve tuba uterina gibi ana uterin kanalları oluşturur (11). Postnatal over epiteli embriyonal hayattaki nefrogenital tomurcuğu örten epitelle aynı özeliktedir. Bundan dolayı endoserviks, endometrium tuba ve overlerde aynı morfolojide tümörler görülebilmektedir (5). ANATOMĐ Overler çift pelvik organlardır. Uterusun her iki tarafına uzanarak lateral pelvik duvarı kapatırlar. Broad ligamentinin arkasında rektumun önündedir (10). Broad ligament uterus üzerinde bulunan periton katlantısıdır. Over peritonla sarılı olmamasına rağmen direkt olarak peritoneal kaviteye ekspozedir (12). Her bir over ön kenardan, peritonun çift kıvrımı olan broad ligamanın arka yüzüne birlikte bağlanır (10). Ovariumlar basık oval şekilli, pelvisin yan kısımlarında fossa ovarica içine yerleşmişlerdir. 2,5 5 cm uzunluk, 1,5 3 cm genişlik ve 0,7 1,5 cm kalınlık gösterir. 4 8 gr ağırlığındadır. Đç yüzü yuvarlak, üst kısmı fimbrialarla örtülü olup kalan kısmı ince barsak kıvrımları ile komşudur. Yan yüzü pelvis duvarına dayanmıştır. Bu yüzün oturduğu fossa ovarica yukarıda a.iliaca eksterna, ön aşağıda ligamentum latum tarafından sınırlandırılmıştır. Arka sınır üretere kadar uzanır. Altından a.v.n obturatorius geçer. Ön kenara mezoovaryum tutunur. Damarlar, sinirler ve lenfatikler organa bu kenardan girerler. Buraya hilus denir. Arka kenarı serbest ve yuvarlak olup ekscavatio rektouterinaya bakar. Üst ucuna ligamentum suspansorium ovarii tutunur, içerisinden a.v.ovarica ile pleksus ovaricus geçer. Alt ucuna ligamentum ovarii propriuma tutunur (10, 13). 7
8 Overin arterleri, aorta abdominalis ten çıkan, sağ ve sol a.ovarica lardan gelir. Bunlar mezosalpinks içinde a.uterina nın ramus ovaricus denilen dallarıyla anastomoz yaparlar. Venleri ovaryum hilusundan başlayan pleksus pampiniformis i yaparlar. Bunlardan başlayan vena ovarica dekstra vena cava inferiora, vena ovarica sinistra vena renalis sinistra ya dökülür. Uterus ve ovaryumun lenfatikleri a.ovarica yı izleyerek 1 ve 2. lomber vertebra düzeyindeki nodi lymphatici paraaorticusa (lateral lomber nodlara) giderler (13). Bununla birlikte aksesuar kanallar subovaryan pleksusu atlayıp, broad ligamentini geçerek internal iliak, eksternal iliak ve interaortik lenf nodlarına veya bazen round ligament yolu ile iliak ve inguinal lenf nodlarına drene olurlar (10). HĐSTOLOJĐ Over, gevşek bağ dokusu içinde damardan zengin bir yapı gösteren bir medüller bölge ile oosit içeren ovaryum folliküllerinin bol miktarda bulunduğu bir kortikal bölgeden meydana gelir. Ovaryum yüzeyi germinal epitel ismini alan tek katlı yassı ya da kübik epitel ile örtülüdür (14). Overin yüzey epitelinde esasen mitoz yoktur (15). Yüzey epiteli alttaki stromadan ince bir bazal membranla ayrılır. Histokimyasal çalışmalar yüzey epitel hücrelerinin glikojen, asit ve nötral mukopolisakkarit içerdiğini ve immünohistokimyasal olarak sitokeratin, Ber-EP4, desmoplakin, vimentin, transforming growth faktör-alfa, östrojen ve progesteron reseptör, epidermal growth faktör eksprese ettiğini göstermiştir. Yüzey epitelinin korteks içerisine invajinasyonu inklüzyon gland ve kistlerini oluşturur (10). Bunlarda displastik değişiklikler olabilir, yüzey epitel tümörlerinin çoğunun orjini birçok otorce bu invajinasyondan kaynaklanmaktadır (16). Germinal epitel altında stroma, tunika albuginea denen sınırları belirsiz bir tıkız bağ dokusu tabakası oluşturur. Tunika albuginea ovaryumun açık renkte görülmesini sağlar (14). Korteks ile medulla bölgeleri arasında kesin bir sınır 8
9 görülmez. Korteks bölgesinin stroması karakteristik iğsi şekilli fibroblastlardan meydana gelir. Bu hücreler hormonal uyarılara karşı diğer organlardaki fibroblastlardan farklı bir yanıt oluşturur (14). Kortikal ve medüller stroma dar sitoplazmalı iğsi şekilli stromal hücrelerden oluşur, tipik olarak whorl veya storiform yapılar meydana getirirler. Bunlar vimentin, aktin ve desmin ile sitoplazmik pozitiflik gösterirler. Reprodüktif dönem ve postmenopzal dönemlerde ince sitoplazmik lipid damlaları immünohistokimyasal boyalarla gösterilebilir. Stromal hücreler özellikle kortekste yoğun olmak üzere yoğun bir retiküler ağ ve kollojen ile birbirlerinden ayrılır. Stromada fibroblastlardan geliştiği düşünülen lüteinize stromal hücreler, enzimatik aktif stromal hücreler, desidual hücreler, düz kas hücreleri endometrial stromal hücreler, matür adipositler, stromal leydig hücreleri ve nöroendokrin hücreler mevcuttur (2, 10). Over korteksinde doğumda yaklaşık primordial follikül mevcuttur. 400 ü ovulasyonla maturasyona uğrar iken % 99,9 u atreziye gider. Ortalama 28 gün süren her menstruel siklusta ovaryumlar tarafından genellikle sadece bir ovum serbest bırakılır. Follikülogenezis, foliküler maturasyonun başında luteal faz ve devamında foliküler faz olarak sürer. Folliküllerin büyümesi esas olarak folikül hücrelerinin ve bununla birlikte primer oositin ve folikülü çevreleyen stromanın büyümesi ile olur. Folikül hücreleri tek tabakalı kübik hücreler haline geldiğinde foliküle unilaminer primer folikül ismi verilir. Folikül hücreleri mitozla çoğalırlar ve çok katlı folikül epiteli ya da granüloza tabakasını oluşturarak multilaminer primer folikülü oluştururlar. Oosit en az üç farklı glikoproteinden oluşan zona pellusida denen kalın bir örtü ile çevrelenmiştir. Folikül çevresindeki stroma farklılaşma göstererek hormon sekrete eden hücrelerden oluşan teka interna ve esasen bağ dokusu içerikli teka eksterna tabakalarını oluşturur (17). Teka interna ile granüloza hücreleri arasında kalın bir bazal membran mevcuttur. Follikül gelişimi esnasında hücreler arası boşluklarda follikül sıvısı toplanmaya başlar ve bu boşluklar birleşerek antrumu oluştururlar. Bu aşamaya sekonder (veziküler) follikül ismi verilir. Gelişim 9
10 devam ederek granüloza tabakası hücreleri follikül duvarında bir alanda yoğunlaşır ve oositi de içeren kumulus ooforus adı verilen bir tepecik oluştururlar. Bu yapı follikül antrumuna doğru uzanır ve oosit büyümesi sona erer. Ovulasyondan önceki son aşama olan Graff follikülü ortalama 2,5 cm çaptadır ve overin dış yüzünden görülebilen dışarı doğru şişkinlik yapan saydam bir vezikül şeklindedir. Ovulasyon sonrasında granüloza ve teka hücrelerinde luteinizasyon artar ve korpus luteum oluşur. Siklus sonunda fertilizasyon olmamışsa çevre bağ doku regrese olur, korpus luteumu sarar ve zamanla skar dokusu olan korpus albikansa dönüşür. Overin hilus hücreleri morfolojik olarak testiküler leydig hücrelerine benzer. Fetal yaşamda vardır fakat çocukluk döneminde yoktur. Pubertede tekrar görülür ve tüm postmenapozal kadınlarda görülebilir. Sayısı ve lokalizasyonu oldukça değişkendir; gebelikte ve menopozdan sonra sayısı artar (5, 10, 18). Walthard adaları mezoovaryumda, mezosalpinkste ve ovaryan hilusta görülebilen ürotelial görünümde, muhtemelen mezotel kökenli hücrelerden oluşan solid ya da kistik adalardır. Hilus hücre kümeleri değişen boyut ve şekilde olup tipik olarak ovarian hilus ve mezoovaryum komşuluğunda görülür. Rete ovarii, rete testisin overdeki analoğudur. Tüm overlerin hiluslarında mevcuttur. Düzensiz yarıklar, tübüller, kistler ve intraluminal papillalardan oluşur. Epiteli değişken olup basık, küboidal yada kolumnar olabilir. Hücreler sitokeratin, vimentin ve dezmoplakin ile sitoplazmik immünreaktivite verir (5, 10, 18). 10
11 OVER ĐN YÜZEY EPĐTELYAL TÜMÖRLERĐ SERÖZ TÜMÖRLER Seröz tümörler tüm over tümörlerinin % 30 unu oluşturmaktadır. Epitelyal over tümörleri içerisinde en sık görülendir. Benign over tümörlerinin % 22 sini, primer malign over tümörlerinin % 50 sini oluşturur. Seröz tümörlerin % i benign, %10-15 i borderline ve %20-35 i malign formdadır. Benign tümörlerin % si, borderline tümörlerin % ı ve invaziv seröz karsinomların % 65 i bilateraldir. Benign ve borderline tümörler 4. ve 5. dekadda, invaziv seröz karsinomlar 5 7. dekadlarda (45 65) sık görülür. Seröz tümörlerde görülen hücre tipleri, tuba uterina nın sekretuar, silialı, interkalar ya da intraepitelial vakuollü hücreleri şeklindedir (19, 20). BENĐGN SERÖZ TÜMÖRLER Benign seröz tümörler overin özellikle korteksinde veya yüzeyinde ortaya çıkar (%8). Özellikle yaşlı kadınlarda sıklıkla bilateraldir. Genellikle asemptomatiktir ve diğer jinekolojik hastalıkların ultrasonografi ile araştırılması sırasında tesadüfen bulunur. En yaygın semptomlar ağrı, vajinal kanama ve abdominal şişmedir. Kistik, papiller ve adenofibrom olmak üzere 3 şekilde görülür. Makroskopik olarak ortalama 10 cm çapında olmakla birlikte 30 cm ye kadar büyüyebilir. Genellikle uniloküle, nadiren multiloküle olur. Serozal inklüzyon kistleri ve over yüzeyindeki papiller yapılardan ayrım için lezyonun 1 cm den büyük olması gerekmektedir. Dış yüzeyi düzgündür ve iç yüzünde küçük papiller çıkıntılar olabilir. Kistin içeriği sulu ve çok nadiren bulanık veya kanlıdır. Adenofibromlar solid, kesit yüzü süngerimsi olup renksiz sıvı içerir. Kistik adenofibromlar solid ve kistik alanlar içerir. Yüzey papillomları overin yüzeyinde değişen boyutlarda siğilimsi çıkıntılar olarak görülür (19). Epitel tubal tipte psödostrafiyedir. Sekretuar ve silyalı hücreler kümeler oluştururlar. Stroma sellüler veya fibröz yapıdadır. Ödemli stroma ile epitelyal hücreler 11
12 arasında asellüler dar bir zon görülür. Tedavisi tümörün eksizyonu veya unilateral salpingooferektomidir (20). BORDERLĐNE SERÖZ TÜMÖRLER Đlk 1929 yılında tanımlanan overin seröz boderline tümörleri günümüzde tüm over malignitelerinin yaklaşık %15 ini oluşturmaktadır (21). Low malign potansiyelli over tümörü olarak da isimlendirilirler. Tümör sıklıkla asemptomatiktir; fakat nadiren abdominal şişme veya kistik tümörün torsiyonu ya da rüptürü esnasında ağrı olabilir. Seröz borderline tümörlü genç kadınlarda yüksek oranda infertilite görülür (19). Büyük multiloküle kistik tümörlerdir. Kistin iç yüzü papiller yapılar içerir. %40 70 olguda dış yüze doğru ekzofitik olarak büyümüş papiller yapılar görülür. Solid büyüme adenofibromatöz borderline tümörlerde bulunur ve seyrektir. Nekroz ve kanama alanı içermezler. Seröz borderline tümörlerin evrelendirilmesinde karsinomlar için olan TNM/FIGO sistemi kullanılır (19). Seröz borderline tümörlerde epitel proliferasyonu, proliferatif spektrumun alt ucunda (fokal proliferatif aktivite gösteren seröz kistadenom) yer alırken mikropapiller seröz karsinom spektrumun yüksek gradeli ucunda bulunabilir. Seröz borderline tümörler tipik ve mikropapiller tip olarak ayrılır. Tipik olan form, seröz borderline tümörlerin % 90 ını oluşturur. Papillalar fibrovasküler ve ödemli görünümdedir. Sıralanması artmış kolumnar hücreler ile döşelidir. Nükleer atipi hafif olup mitoz 10 büyük büyütme alanında (BBA) 4 ü geçmez, bizar ve dev hücre görülmez. Psammom cisimcikleri ve stromal lenfositik infiltrasyon görülebilir; fakat stromal invazyon yoktur (19, 20, 22 ). Mikropapiller paternli borderline seröz tip ya da mikropapiller seröz karsinom olarak isimlendirilen tümörler küçük bir kısmı oluşturur (% 5-10). Bu grupta ekzofitik büyüme, bilateralite ve peritonal implantlar daha sık görülmektedir. Fibroblastik stromal komponentin belirgin olduğu adenofibrom ya da kistadenofibrom varyantlarında glandları ve/veya kistleri döşeyen epitel 12
13 seröz borderline tümör görünümündedir (22). Stromadan zengin tümörlerde osseöz metaplazi görülebilir. Borderline tümörlerin % 10 unda stromal mikroinvazyon görülür. Mikroinvazyon tümörün bir veya daha fazla odakta maksimal doğrusal boyutu 3 mm yi veya 10mm 2 yi aşmayan invazyondur. Mikroinvazyon iki paternde görülür. Stromal reaksiyonun görülmediği ve inflame ya da miksoid stromanın bulunduğu paterndir. Borderline seröz tümörlerde mikroinvazyon prognozu değiştirmez. Peritoneal implantlar borderline seröz tümörlerde % oranında bildirilmektedir. Omentum invaziv implantların en sık rastlandığı alandır. Đnvaziv implantlar benign epitelyal inklüzyonlar ve endosalpingiozis odağından ayırt edilmelidir. Benign epitelyal inklüzyonlar küçük, genellikle yuvarlak glandlarda tek tabakalı basık veya alçak kolumnar hücrelerle döşeli, atipi ve mitoz izlenmeyen hücrelerle karakterizedir. Sıklıkla fibröz stroma mevcuttur. Küçük yuvarlak glandlar endosalpingiozisde de karakteristiktir: fakat tipik tubal epitelle döşeli (silialı, sekretuar veya intercalated hücreler) papiller yapılar olabilir (19). Peritonal implantların orjininin metastaz mı ya da multifokal intraperitonal neoplazi mi olduğu tartışmalıdır. Đmplantlar invaziv ve noninvaziv olarak iki grupta toplanırlar. Noninvaziv implantlar da epitelyal ve desmoplastik olarak ayrılırlar. Epitelyal noninvaziv implantlarda periton yüzeyinde çok katlı atipik seröz hücreli bazen dallanan papiller proliferasyon ile çok az stromal komponent görülür. Desmoplastik non invaziv implantlar reaktif stromanın üstünlüğü ile karekterizedir. Peritonda destüksiyon oluşturmaz, akut ve kronik hücreler içerir bazen de fibrin, hemoraji ve nekroz görülebilir. Đnvaziv implantlar alttaki dokuya düzensiz infiltrasyon ve destrüksiyon ile karakterizedir. Çevre stroma immatür, desmoplastik ve inflame görünümdedir. Noninvaziv implantlar 10 yıllık sağkalıma negatif etkili değildir. Đnvaziv form kötü prognozla birliktedir. Örneğin % 50 den fazla rekürrens mevcuttur ve 10 yıllık sağkalım yaklaşık % 35 civarındadır (20). 13
14 Ekstraovaryan yayılımı olan borderline seröz tümörlere bağlı ölüm oranı 5 yılda % 4, 10 yılda % 13 olarak bildirilmiştir. Lenf düğümü tutulumu paraaortik ve pelvik lenf nodları başta olmak üzere % 20 oranında gösterilmiş olup klinik seyir üzerine etkisi yoktur. p53 mutasyonu mikropapiller seröz tümörlerde rastlanmaz, buna karşın invaziv seröz karsinomlarda % 88 dir. Seröz borderline tümörlerin yaklaşık % 95 i diploid DNA histogramı gösterir. Borderline seröz tümörlerde 5 yıllık sağ kalım % 90 95, 10 yıllık sağ kalım % dır. Evre III seröz borderline tümörlerde (örneğin abdominal kavitede ve peritonda implantlar varsa) 5 yıllık sağkalım % arasındadır (19). Tedavide genç hastalarda unilateral salpingooferektomi ve staging laparotomi yapılır. Fertilite korunmak isteniyorsa over dokusu bırakılır, konservatif cerrahi uygulanır. Yaşlı, bilateral tutulum ya da peritonal implantı olan hastalarda Total Abdominal Histerektomi + Bilateral salpingooferektomi (TAH+BSO) +omentektomi uygulanır (19, 20, 22). SERÖZ ADENOKARSĐNOM Overin invaziv epitelyal tümörlerinden iyi differansiye tümörler tuba epiteline benzer görünümde hücre gruplarından oluşurken az differansiye tümörlerde ise şiddetli nükleer atipi içeren anaplastik epitelyal hücreler dikkati çeker. Makroskopik olarak mikroskobik boyutlardan, 20 cm ya da daha fazla boyutlara dek ulaşabilir. Đyi diferansiye karsinomlar çoğunlukla kistik multilokulerdir, yumuşak kolay parçalanabilen papillalar kaviteleri doldurabilir. Eksternal yüzey düzgündür, bazen yüzey papillaları içerir. Daha az differansiye tümörler solid nekrotik ve hemorajik alanlar gösterebilir. Orta derece differansiye seröz karsinomlarda papillalar daha sık ve incedir. Đnce mikropapiller yapıların birleşmesi sonucu tipik olarak dantele benzer görünüm ortaya çıkar. Aradaki yarıklar ince, uniform ve radial dizilim gösterir. Az diferansiye seröz karsinomlar küçük üniform hücreler ya da bazen iğsi hücrelerden oluşan solid patern gösterir. Kitlelerin kenarında hücreler palizad 14
15 oluşturmazlar nadiren mikropapiller yapılar bulunur. Bizar dev hücrelerin bulunması önemli bir ayırıcı tanı kriteridir ( 19, 20, 22, 23). Seröz karsinomların patogenezinde over yüzey epitelinin invaginasyonu ya da epitelyal inkluzyonların proliferayonu ağırlık olarak düşünülmektedir. Đleri evre seröz over karsinomlarının % 60 nda P53 gen mutasyonu saptanmıştır. KRAS ın mediatörü olan BRAF gen mutasyonu seröz over karsinomlarında görülürken KRAS gen mutasyonu nadiren görülür (19, 20). Seröz karsinomlarda CK 7 pozitif ve CK 20 negatiftir. Seröz karsinomların immunohistokimyasal boyanma özellikleri Tablo 1 de verilmiştir( 19, 20, 22, 23). Tablo: 1 Overin primer seröz adenokarsinomlarda immunhistokimyasal boyanma özellikleri Antikor Görülme Oranı Sitokeratin (AE1/AE3,LAM5.2) %100 EMA %100 HMF-G III C12 %100 CA 125 antigen %85 OV-TL3 %85 B72.3 antigen %85 Ber-EP4 %85 S 100 protein %80 Mov 18 %80 OV 632 %75 GFAP %60 Leu (M1 (CD.15) %45 Vimentin %40 CEA %10 15
16 Ayırıcı tanıda over seröz karsinomlarını, primer peritoneal seröz adenokarsinomlardan ayırmak gerekmektedir. GOG (Gynecologic Oncology Group) kriterlerine göre, primer peritoneal seröz adenokarsinom tanısı için overdeki tümörün yüzeyel olması ya da overdeki invazyonun boyutlarının 5x5 mm 2 nin üzerinde olması gerekmektedir (19, 20). Mikroskobik olarak solid, glandüler ve papiller tipler içerirler. Đyi differansiye seröz karsinomlarda papillalar belirgin olup immatür veya desmoplastik stroma bulunur. Psammom cisimleri over tümörlerinin % inde bulunur. Psammom cisimleri dokunun %75 inden fazlasını oluşturuyorsa psammokarsinom yada psammomatöz karsinom olarak isimlendirilir (19, 20). Endometrioid tip over karsinomu, az differansiye müsinöz karsinom, metastatik meme karsinomu küçük hücreli indiferansiye karsinomlar ve malign mezotelyoma diğer ayırıcı tanıya alınması gereken tümörlerdir (20). Prognoz: olguların % 40 ında 5 yıllık sağkalım mevcuttur. Vakaların %85 inde yaygın metastatik hastalık mevcut olup bu grupta 5 yıllık sağkalım % dir. Over veya pelvise sınırlı hastalarda ise 5 yıllık sağkalım % 80 dir (19, 20). Tedavide TAH+BSO, omentektomi; periton, paraaortik ve pelvik lenf nodu disseksiyonu ile batın sıvısını içeren staging laparotomi yapılır (20). MÜSĐNÖZ TÜMÖRLER Overin müsinöz tümörleri, epitel hücreleri intrasitoplazmik müsin içeren tümörlerdir. Bu epitel hücreleri endoservikal, gastrik pylorus veya intestinal tipte hücrelere benzerlik gösterebilirler. Non-müsinöz tümörlerin aksine epitel hücreleri arasında goblet hücreleri bulunur (19). Benign müsinöz tümörler genellikle endoservikal (Müllerian tip) içerirken, borderline müsinöz tümörlerin %85 i, müsinöz karsinomların tamamı intestinal patern gösterirler (20). Müsinöz tümörler tüm over tümörlerinin % 25 ini, tüm over kanserlerinin yaklaşık %10 unu oluşturur (24). Epitelyal over tümörleri içinde ikinci sıklıkta 16
17 görülür. Müsinöz kistadenom müsinöz tümörler içerisinde en fazla görülendir. Müsinöz tümörlerin % i benign, % i borderline, % 5-10 u malign formda görülmektedir. % vaka bilateraldir (5). Benign müsinöz kistadenomlar 3 5. dekadlar arası görülürler. % 2 3 oranında bilateral olup gebelikte en sık görülen tümördür; ve bundan dolayı en fazla akut torsiyon ile prezente olan over tümörü özelliği taşır (20). Borderline tümörler 4. dekadda sık görülür. Đntestinal tipte bilateralite % 6 8 iken, Müllerian tipte % 40 a ulaşmaktadır. Müsinöz karsinomlar 4 7 dekadlar arası görülmekte olup % si bilateraldir. Laparotomi sırasında % 90 ı over sınırlı görünümdedir (20). BENĐGN MÜSĐNÖZ TÜMÖRLER Makroskopik olarak 50 cm boyutlara kadar ulaşabilen dış yüzü düzgün kistik tümörlerdir. Unilateral ve multiloküle görünümdedir. Đçeriğinde sulu veya koyu yapışkan mukoid materyal bulunur. Fibröz stroma ender olup torsiyona bağlı hemoraji ve nekroz görülebilir (19, 20). Mikroskopik olarak benign müsinöz tümörler kistadenomlar, kistadenofibromlar ve adenofibromlar olarak ayrılırlar. Epitel tek katlı kolumnar yapıda, nüvesi bazale yerleşmiş olan, intrasellüler nötral asidik ve nötral müsin içeren hücrelerden oluşmuştur. Epitel hücreleri arasında goblet, argirofil ve argentaffin hücreler bulunur. Stromada müsine karşı yabacı cisim reaksiyonu görülebilir. Epitele yakın alanda stromada sellülarite artar, luteinize hücreler seyrek olarakda leydig ve düz kas hücreleri bulunur (19). Tedavide unilateral salpingooferektomi yeterlidir (20). BORDERLĐNE MÜSĐNÖZ TÜMÖRLER 1988 yılında Rutgers Scully tarafından Müllerian müsinöz borderline tümörlerin tanımlanmasından sonra overin borderline müsinöz tümörleri intestinal müsinöz borderline tümör (IMBT) ve endoservikal ya da Müllerian 17
18 müsinöz borderline tümör (MMBT) ikiye ayrılmıştır. Bu iki grup arasındaki farklar Tablo 2 de verilmiştir (20). Tablo: 2 Özellikler ĐMBT MMBT Sıklık %85 %15 Median(yaş) Ortalama çap(cm) Bilateralite Đpsilateral endometriozis Psödomiksoma peritoneeii Peritoneal implant Lenf nodu tutulumu Makroskopik papilla Tümör kesit yüzü Mikroskopik papilla Hücre tipi % % %17 Genellikle Multiloküle Filiform Müköz kolumnar hücre Absortif hücre Goblet hücresi Argirofilik hücre Panet hücresi 34 8 % 40 % % %87 Genellikle uniloküle yada pauciloküle Geniş - Yuvarlak Müköz kolumnar hücre Eosinofilik hücre Seyrek argirofilik hücre Hücre sıralanması Akut inflamatuar yanıt Đmmunohistokimya Az (en çok 3) Hafif Fazla(20 ye kadar) Şiddetli CK-20 (+) CK-7 (+ CEA (+++) ER/PR (-) CK-20 (-) CK-7 (+) CEA (+,-) ER/PR (+) 18
19 Düşük malign potensiyelli müsinöz over tümörleri, benign karşılığında görülen tümörlerden daha fazla oranda epitel proliferasyonunu gösterirler. Fakat kanıtlanmış stromal invazyon yoktur. Đntestinal tipte borderline tümörlerin kist duvarını döşeyen epitel hücreleri sitolojik olarak malign görünümlü olabildikleri gibi solid, papiller veya kribriform patternde dört veya daha fazla tabaka halinde sıralanma artışı gösterebilirler. Bu durum intraepitelyal karsinom içeren borderline tümör olarak tanımlanır (19, 20). Psödomiksoma peritoneii (PP) periton boşluğunda jöle şeklinde müsin birikmesidir. Orjini tartışmalı olmakla birlikte müsinöz ovaryan tümör veya gastrointestinal müsinöz tümörden yayılıma bağlıdır. Eşlik eden over tümörü genellikle bilateral borderline müsinöz tümörlerdir. PP spesifik tanı yerine jelatinöz ya da müsinöz materyal ile dolu abdominal kavitenin gros intraoperatif görününüme dayanılarak yapılır. PP, daha çok düşük malign potansiyelli müsinöz tümörler ile birliktedir, daha az olarak karsinom ile birlikte görülür. Mikroskopik olarak üç patern içerir, birincisinde müsin asellüler olup epitelyal hücre içermez; fibrozis ve granülasyon dokusu alanları içerir. Đkinci ve en sık görülen patern benign görünümlü müsinöz epitelyal şeritler içeren organize mukus şeklindedir. Üçüncü paternde ise mukus belirgin nükleer atipi içeren bol epitelyal hücre ya da adenokarsinom özellikleri taşıyan malign glandlar, solid kitleler ya da taşlı yüzük hücreleri içerir. Yalnız overde müsinöz tümör olduğunda PP insidansı % 4.5, yalnız appendikste müsinöz tümör olduğunda ise % 14 6 dır (19, 20, 25). Stromal invazyonun değerlendirilmesi müsinöz tümörlerde zor ve subjektif olduğundan borderline müsinöz tümörleri, müsinöz karsinomlardan ayırmak oldukça zor ve güçtür te Hart ve Norris, 1977 de tekrar Hart bazı kriterler önermişlerdir. Bunlar stromaya girmeksizin glandların sırt sırta dizilmesi, kribriform intraglandüler proliferasyon, bağ dokusu içermeyen solid hücresel 19
20 kitlelerin parmaksı çıkıntıntıları, glandüler yapılarda atipili epitel hücrelerinin dört ya da daha fazla sıralanışı ve belirgin nükleer atipi bulunmasıdır (19, 20). Tedavide fertilitesi korunmak istenen genç hastalarda tümörektomi, ileri yaşlarda TAH+BSO yapılır. PP li hastalar da 5 yıllık sağ kalım % 66, 10 yıllık sağ kalım % 50 dir (20). MÜSĐNÖZ KARSĐNOM Overin malign epitelyal tümörlerindendir. Barsakta görülen müsin sekrete eden adenokarsinomlara benzerler. Borderline müsinöz tümörlerden stromal invazyonun bulunması ile ayrılırlar. Makroskobik olarak cm boyutlarında unilateral, düzgün yüzeyli, multilokule ya da unilokule, mukoid materyal içeren kistik kitlelerdir. Solid alanlar ve lüminal nodüller içerbilirler. Hemoraji ve nekroz görülebilir (19). Mikroskopik olarak stroması over stromasına benzeyebilir veya desmoplastik olup infiltrasyon genellikle görülmez. Belirgin stromal invazyon saptanmadığı kompleks papiller yapılar, arada stromanın az miktarda olduğu veya hiç olmadığı malign epitelyal hücrelerle döşeli sırt sırta vermiş glanduler yapılar ve bu yapıların en az 10 mm² alanda ve boyutlarından en az ikisinin en az 3 mm uzunlukta olması invazyon olarak değerlendirilir. Đnfiltratif stromal invazyon varlığı biyolojik olarak expansil invazyondan daha agresiftir. 10 mm² den daha küçük, tek invaziv odak varsa mikroinvaziv olarak değerlendirilir. Alternatif olarak invazyon infiltratif glandlar, tubuller, kordlar ve hücre nestleri şeklinde görülebilir (19, 20). Müsinöz kistik tümörlerden malign ve borderline formlarda seyrek olarak da benign formlarda solid mural nodüller görülebilir. Mural nodüller, reaktif sarkom benzeri özellikte olabileceği gibi, anaplastik karsinom ve sarkom şeklinde de görülebilir. Primer over müsinoz karsinomu ile metastatik müsinöz karsinomu ayırd etmek güçtür. Metastatik müsinöz karsinomların orjini genellikle kolon, appendiks, pankreas, safra yolu, mide veya servikstir. Primer müsinöz over tümörleri genellikle düzgün yüzeyli, tek taraflı büyük çaplara 20
21 ulaşabilen ekspansil büyüme paterni gösteren kompleks papiller yapılar oluşturan bir tümördür. Metastatik müsinöz tümörlerde genellikle bir primer müsinöz tümör öyküsü mevcuttur. Bilateral frajil ve nekrotik kitle, değişken ya da noduler büyüme paterni, over yüzey invazyonu, vasküler invazyon metastazdan yanadır. Primer ve metastatik müsinöz over tümörlerinin ayrımında kullanılan immunohistokimyasal yöntemler Tablo 3 de gösterilmiştir (19, 20). Tablo: 3 Overin primer müsinöz karsinomlarının immunhistokimyasal boyanma özellikleri Antikor Görülme Oranı Sitokeratin (AE1/AE3,LAM5.2) %100 Sitokeratin 7 (CK7) %100 Sitokeratin 20 (CK20) %25 EMA %100 HMF-G III C12 %100 CA-19.9 %90 CEA %85 HAM-56 %75 a-amylase %75 Vimentin %0 S-100 protein %0 CA-125 antigen %0 Müsinöz karsinomlarda 5 yıllık sağ kalım % 40 dır. Evre l de sağ kalım 5 yılda % 66; 10 yılda % 59 dur. Evre l de TAH+BSO + omentektomi ve kemoterapi uygulanır (20). 21
22 OVER TÜMÖRLERĐNĐN SINIFLANDIRILMASI (WHO 2002) YÜZEY EPĐTELYAL STROMAL-TÜMÖRLER SERÖZ TÜMÖRLER MÜSĐNÖZ TÜMÖRLER Malign Adenokarsinom Yüzey papiller adenokarsinomu Adenokarsinofibrom (malign adenofibrom) Borderline Papiller kistik tümör Yüzey papiller tümörü Adenofibrom, kistadenofibrom Benign Kistadenom Papiller kistadenom Yüzey papillomu Adenofibrom ve kistadenofibrom Malign Adenokarsinom Adenokarsinofibrom (malign adenofibrom) Borderline Đntestinal tip Endoservikal benzeri Benign Kistadenom Adenofibrom ve kistadenofibrom Müsinöz kistik tümör ve mural nodüller Müsinöz kistik tümör ve psödomiksoma peritonei ENDOMETRĐOĐD TÜMÖRLER Malign Adenokarsinom-NOS Adenokarsinofibrom ( malign adenofibrom) Malign müllerian mikst tümör (karsinosarkom) Adenosarkom 22
23 Endometrial stromal sarkom (düşük grade) Đndifferansiye over sarkomu Borderline Kistik tümör Adenofibrom, kistadenofibrom Benign Kistadenom Adenofibrom, kistadenofibrom BERRAK HÜCRELĐ TÜMÖRLER Malign Adenokarsinom Adenokarsinofibrom (malign adenofibrom) Borderline Kistik tümör Adenofibrom, kistadenofibrom Benign Kistadenom Adenofibrom, kistadenofibrom TRANSĐZYONEL HÜCRELĐ TÜMÖRLER Malign Transizyonel hücreli karsinom (non-brenner tip) Malign Brenner tümörü Borderline Brenner tümörü Prolifere tip Benign Brenner tümörü Metaplastik tip SKUAMÖZ HÜCRELĐ TÜMÖRLER Skuamöz hücreli karsinom Epidermoid kist MĐKST EPĐTELYAL TÜMÖRLER (spesifik komponentleri) Malign Borderline 23
24 Benign ĐNDĐFERANSĐYE VE KLASĐFĐYE EDĐLEMEYEN TÜMÖRLER Đndifferansiye karsinom Adenokarsinom-NOS SEKS KORD-STROMAL TÜMÖRLER GRANÜLOZA-STROMAL HÜCRELĐ TÜMÖRLER Granüloza hücreli tümör grubu Adult Granüloza hücreli tümör Jüvenil Granüloza hücreli tümör Tekoma-fibrom grubu Tekoma-NOS -Tipik -Luteinize Fibrom Sellüler fibrom Fibrosarkom Stromal tümör ve minör seks kord elemanları Sklerozan stromal tümör Taşlı yüzük hücreli stromal tümör Klasifiye edilemeyen (fibrotekoma) SERTOLĐ-STROMAL HÜCRELĐ TÜMÖRLER Sertoli-Leydig hücreli tümör grubu (Androblastom) Đyi differansiye Orta derecede differansiye -Heterolog elemanlar içeren spesifik tip Kötü differansiye (sarkomatoid) -Heterolog elemanlar içeren spesifik tip Retiform -Heterolog elemanlar içeren spesifik tip Sertoli hücreli tümör Stromal, Leydig hücreli tümör Klasifiye edilemeyen ya da mikst tipte seks kordstromal tümörler Annuler tübüller içeren seks kord stromal tümör Gynandroblastom (spesifik komponentleri) Klasifiye edilemeyen seks kord stromal tümör Steroid hücreli tümörler 24
25 Stromal luteoma Leydig hücreli tümör grubu Hilus hücreli tümör Leydig hücreli tümör, Non-hiler tip Leydig hücreli tümör -NOS Steroid hücreli tümör-nos Đyi differansiye Malign GERM HÜCRELĐ TÜMÖRLER PRĐMĐTĐF GERM HÜCRELĐ TÜMÖRLER Disgerminom Yolk sak tümörü Poliveziküler vitellin tümör Glandüler tip Hepatoid tip Embriyonel karsinom Poliembriyom Nongestasyonel koryokarsinom Mikst germ hücreli tümör (spesifik komponentleri) BĐFAZĐK YA DA TRĐFAZĐK TERATOM Đmmatür teratom Matür teratom Solid Kistik Dermoid kist Fetiform teratom (Homunkulus) MONODERMAL TERATOM VE DERMOĐD KĐST ĐLE ĐLĐŞKĐLĐ SOMATĐK TĐP TÜMÖRLER Tiroid tümör grubu Struma ovarii. Benign Malign Karsinoid grubu Đnsüler Trabeküler Müsinöz Strumal karsinoid Mikst Nöroektodermal tümör grubu Ependimom Primitif nöroektodermal tümör Medülloepitelyom 25
26 Glioblastoma multiforme Diğer Karsinom grubu Skuamöz hücreli karsinom Adenokarsinom Diğer Melanositik grup Malign melanom Melanositik nevüs Sarkomlar Sebasöz tümörler Adenom Karsinom Pitüiter tip tümörler Retinal anlage tümörleri Diğer GERM HÜCRELĐ-SEKS KORD STROMAL TÜMÖRLER Gonadoblastom Malign germ hücreli tümör ile birlikte olan tip Mikst germ hücreli-seks kord-stromal tümör Malign germ hücreli tümör ile birlikte olan tip RETE OVARĐĐ TÜMÖRLERĐ -Adenokarsinom -Adenom -Kistadenom -Kistadenofibrom OVERĐN DĐĞER TÜMÖRLERĐ Küçük hücreli karsinom, hiperkalsemik tip Küçük hücreli karsinom, pulmoner tip Büyük hücreli nöroendokrin karsinom Hepatoid karsinom Primer ovarian mezotelyoma Wilms tümörü Gestasyonel koryokarsinom Mol hidatiform Adenoid kistik karsinom Bazal hücreli karsinom Ovarian wolfian tümör Paraganglioma Miksom Overe spesifik olmayan yumuşak doku tümörleri Diğer 26
27 TÜMÖR BENZERĐ DURUMLAR Gebelik luteoması Stromal hipertekozis Stromal hiperplazi Fibromatozis Masif over ödemi Diğer LENFOĐD VE HEMATOPOETĐK TÜMÖRLER Malign lenfoma Lösemi Plazmositom SEKONDER TÜMÖRLER 27
28 OVER TÜMÖRLERĐNĐN TNM VE FIGO KLASĐFĐKASYONU (TNM/FIGO Evreleme Sistemi 2002) T-Primer Tümör TX: Primer tümör değerlendirilememiştir. T0: Primer tümöre ait bulgu yoktur. T1: I Tümör overlere sınırlıdır. T1a IA Tümör bir overe sınırlı, kapsül intakt, over yüzeyinde tümör yok asit ya da batın yıkama sıvısında malign hücre yok. T1b: IB Tümör her iki overe sınırlı, kapsül intakt, over yüzeyinde tümör yok, asit ya da batın yıkama sıvısında malign hücre yok T1c: IC Tümör bir ya da her iki overe sınırlıdır. Kapsül rüptürü, over yüzeyinde tümör varlığı, asit ya da batın yıkama sıvısında malign hücre varlığından herhangi birinin varlığı. T2: II Tümör bir ya da her iki overdedir. Pelvik yayılım mevcuttur. T2a: IIA Uterus ve / veya tubada tümör yayılımı ve / veya tümör Đmplantı. Asit sıvısında ya da batın yıkama sıvısında malign hücre yok. T2b: IIB Diğer pelvik dokulara yayılım, asit veya batın yıkama sıvısında malign hücre yok. T2c: IIC Pelvik yayılım (2a veya 2b) ve asit veya batın yıkama sıvısında malign hücre varlığı. T3 ve/veya III Tümör bir ya da her iki overdedir ve pelvis dışında N1 intraperitoneal metastazlar mevcuttur ve/veya bölgesel lenf nodları tutulmuştur. Karaciğer kapsül metastazı T3/stage III olarak kabul edilir. T3a: IIIA Mikroskobik olarak periton metastazının varlığı. T3b: IIIB Makroskopik olarak 2 cm den küçük periton metastazının varlığı. 28
29 T3c ve/veya IIIC Makroskopik olarak 2 cm den büyük periton metastazının N1 varlığı ve/veya bölgesel lenf nodu metastazı. M1 IV Uzak metastaz mevcuttur (peritoneal metastaz uzak metastaz kabul edilmez), karaciğer parankim metastazı M1/Evre IV, pozitif plevral effüzyon MI/Evre IV kabul edilir. N-Bölgesel lenf Nodları NX: Bölgesel lenf nodları değerlendirilememekte. N0: Bölgesel lenf nodu metastazı yok. N1: Bölgesel lenf nodu metastazı mevcut. M-Uzak metastaz MX: Uzak metastaz değerlendirilememekte. M0: Uzak metastaz yok. M1: Uzak metastaz mevcut. EVRE GRUPLARI Evre IA T1a N0 M0 Evre IB T1b N0 M0 Evre IC T1a N0 M0 Evre IIA T2a N0 M0 Evre IIB T2b N0 M0 Evre IIC T2c N0 M0 Evre IIIA T3a N0 M0 Evre IIIB T3b N0 M0 Evre IIIC T3c N0 M0 Herhangi bir T N1 M0 Evre IV Herhangi bir T Herhangi bir N M1 29
30 OVER KANSERLERĐNDE PROGNOSTĐK FAKTÖRLER 1. Yaş: Genç hastalarda borderline, iyi differansiye ve evre I tümörlerin daha yüksek oranda görülmesi nedeniyle prognoz daha iyidir (5). 2. BRCA1 mutasyonu ve aile hikayesi: BRCA1 mutasyonu sonucu gelişen over kanserleri daha iyi klinik gidişe sahiptir (26). Over kanserlerinin %95 ni oluşturan sporadik over kanserlerinde ise BRCA1 mutasyonu saptanmamıştır. Buna karşılık 17. kromozomda BRCA1 geninin de yer aldığı bölgede allellik kayıp olduğu anlaşılmıştır (27). 3. Tümör yayılımı: En önemli prognostik belirleyicidir (5). 4. Asid: Kötü prognostik işarettir (5). 5. Karsinoma karşı borderline tümörler: Bordeline müsinoz ve endometoid tümörler ile seröz ve serö-müsinöz borderline tümörlerin yaklaşık % 20 sinde nüks oranı neredeyse sıfıra yakındır. Borderline tümörlerde mikroinvazyon,peritoneal kavitede tutulum ve nüks olduğunda dahi prognoz çok iyidir (5). Bir çalışmada evre I borderline tümörlerde sağ kalım % 99 iken, şaşırtıcı olarak ileri evre tümörlerde bu oran % 92 dir (28). 6. Tümör grade ve atipi: Grade 1 veya iyi diferansiye tümörlerde papiller ve glandüler yapılar mevcut olup solid komponent % 5 den azdır. Nukleusda hafif polarite kaybı, stratifikasyon, anizonükleozis ve hiperkromazi mevcuttur. Grade 2 veya orta derecede diferansiye karsinomlarda kompleks papiller yapılar ve glandüler yapılar mevcuttur. Solid alanlar %5-50 arasında görülür. Nükleer atipi artmıştır. Grade 3 veya az diferansiye tümörlerde solid komponent baskındır ve belirgin nükleer pleomorfizm mevcuttur (29). Karsinomlar için tümör grade i yaşam süresi ile bağlantılı olup mikroskopik tipten daha önemlidir (5). 7. Psammom cisimcikleri: Stromada, tümöre karşı oluşan immünolojik yanıtın sonucu olarak papiller yapılarda dejenerasyon ve sonrasında kalsifiye odaklar (psammom cisimcikleri) oluşur (19, 30). Aure ve ark. psammom cisimlerinin immünolojik bir cevap sonucu oluştuğunu ileri sürmüşlerdir (31). 30
31 Đyi differansiyasyon göstergesi oldukları için bu yapıya sahip seröz tümörler daha iyi prognoza gösterirler (10, 32). En uç örnek olan psammokarsinomlar, borderline tümörlerden farklı davranış göstermez (5). 8. Over kapsül rüptürü: Bu ıntraoperativ komplikasyonun yaşam süresi üzerine ikna edici bir etkisi yoktur (5). 9. DNA ploidi: Düşük evreli over kanserleri diploid olmaya, yüksek evreli kanserler ise aneuploidi olma eğilimindedir. Diploid tümörlü hastaların sağ kalımı aneuploidi olanlardan belirgin olarak daha uzundur ve ortalama 5 yıla 1 yıl olarak kabul edilmektedir (7). 10. CA-125: Serum değeri erken evrelerde over kanserini tespit edememesinden dolayı sınırlıdır (33). Ek olarak serum CA-125 değerlerindeki yükselme endometriomalar, overin inflamatuvar hastalıkları ve seröz kistadenomlar gibi benign over tümörlerinde de görülmektedir. Bu belirteçler ayrıca pankreas, kolon, mide, meme, akciğer gibi jinekolojik kökenli olmayan kanserlerde de yükselmektedir (34). Ayrıca CA-125 nin tarama testlerinde kullanımının giderek azalmasında CA-125 değerinin endometriozis, pelvik inflamatuvar hastalık ve gebelik gibi bir çok benign durumda yükselmesi etkili olmuştur. Bu serum belirteçi hastaların rekürenslerinin takibinde önemlidir. Bağımsız bir prognostik faktör olduğu düşünülür (5, 35). 11. Intratümöral T hücreleri: Đyi prognoz göstergesidir (5) 12. Tümör anjiogenezis: Artan peritümöral damar yoğunluğu kötü prognostik göstergedir (36). 13. Cerrahi sonrası residüel volum: Evrensel kabul görmüş prognostik bir paremetredir (2). 14. Diğer belirteçler: Yağ asid sentaz (OA-519), nm23 (metastaz supressör geni), P-glikoprotein (çoklu ilaç rezistansından sorumlu), CD24, HER-2 overekspresyonu bağımsız prognostik faktörler olarak değerlendirilmiştir (5). 15. p53: Bir çok çalışmada kötü prognostik belirteç olduğu iddia edilir (5). 31
32 KANSERĐN MOLEKÜLER TEMELĐ Neoplazi nin sözcük anlamı yeni büyüme dir. Willis neoplazmı normal dokuyu aşan ve onunla koordine olmayan, değişime yol açan, uyarı durduktan sonra bile aynı şekilde aşırı büyümeye devam eden anormal doku kitlesi olarak tanımlar. Esas olarak bütün neoplazmaların kökeni, normal büyüme kontrollerine yanıtın kaybıdır (4). Karsinogenezdeki temel mekanizmaların özünde, hücredeki öldürücü olmayan genetik zedelenme bulunur. Bu tip zedelenmeler kimyasallar, radyasyon veya virüsler gibi çevresel ajanların etkisi ile ya da kalıtsal olarak oluşabilir. Bu zedelenmeler öncelikle hücre proliferasyonunu indükleyen genlerde aktivasyon, hücre proliferasyonunu baskılayan genlerde inaktivasyon ve hücre ölümünü ilgilendiren genler (apoptoz genleri) ile DNA tamir genlerinde değişiklikler şeklinde oluşabilmektedir. Karsinogenez fenotipik düzeyde olduğu gibi genetik bakımdan da çok basamaklı bir olaydır. Genetik hasarın esas hedefi 3 tip düzenleyici gendir; Büyümeyi sağlayan protonkogenler, büyümeyi inhibe eden tümör süpressör genler, programlı hücre ölümü veya apopitozu düzenleyen genler. Bu 3 tip gene ek olarak hasarlı DNA tamirini düzenleyen genler de karsinogenez ile ilgilidir (7). Karsinogenez hem fenotipik hem de genetik düzeyde çok basamaklı bir işlemdir. Kanserle ilişkili genlerin hücre fizyolojisini malign fenotipe ilerletmesindeki temel değişiklikler büyüme uyarısında kendiliğinden olan yetmezlik, büyümeyi inhibe eden uyarılara duyarsızlık, apoptozdan kaçınma, sınırsız çoğalma yeteneği, devam eden anjiogenez, invazyon ve metastaz yeteneğidir. Over kanserlerinde karyotip çalışmaları tümörgenezisinde rol alan spesifik genleri ve bu genlerin lokalizasyonun belirlenmesine yardımcı olmuştur (Tablo 4) (7). Sıklıkla 3,6,11ve 17.kromozomlarda delesyon saptanması bu bölgelerde over tümörgenezi için önemli genlerin bulunabileceğini düşündürmüştür. En fazla heterozigosite kaybı (LOH) olan kromozomların 6p, 32
33 6q, 9q, 13q, 17p ve 17q olduğu ortaya çıkmıştır. En çok LOH nın 17. kromozomun kısa kolunda ve özellikle p53 lokusunda yer aldığı distal bölümde (17p 13,3) ve BRCA1 geninin yer aldığı uzun kolun distal bölümünde (17q22 23) olduğu saptanmıştır (7). Tablo 4: Over kanseri ile ilgili genler Sınıf Gen Onkogenler HER 2/neu, K-ras, c-fms, c-mos, c-erbb 1 c-myc, c-myb Tümör supresör genler p53, BRCA1 Mismatch onarım genleri MSH2, MLH1, PMS1, PMS2 Apoptoz ile ilgili genler Bcl 2, bax Bu genlerden over kanser patogenezinde en önemli rollerden birini oynadığı düşünülen protoonkogen, 17. kromozomun q kolunun proksimal bölümünde yerleşim gösteren HER2/neu (=c-erbb-2, HER2/ neu) genidir. Epidermal büyüme faktörüne benzer tirozin aktivitesi olan bir büyüme faktörü reseptörü kodlayan HER2/neu geninin normal hücre büyüme ve farklılaşmasında rol oynadığı bilinmektedir. Over kanserleri gelişiminde HER2/neu overekspresyonu gen amplifikasyonuna bağlı ortaya çıkmaktadır (7). 17. kromozom üzerine lokalize olan ve epidermal büyüme faktörü reseptörünü kodlayan bir diğer protoonkogen olan c-erbb 1 genidir. Over tümörlerindeki bu gendeki mutasyonları ligand bağlayan bölgenin kaybına neden olan delesyonlar veya kinaz enziminin sürekli aktivasyonu sonucu değiştiği belirlenmiştir. Over kanser gelişiminde rol alan Ras gen ailesi (c-haras,c-ki-ras ve N-ras) hücre membranı iç yüzünde yer alan, intrasellüler sinyal iletiminde görev alan p21 proteinini kodlar. Over kanserlerinde p53 geninde bir allelde nokta mutasyonu olmakta ve diğer allelin kaybı görülmektedir. Nokta mutasyonu sonucunda oluşan protein normal fonksiyonunu yerine 33
34 getirememekte ve p53 mutasyonu saptanan over kanserlerinin %90 nında bu mutasyonlara bağlı olarak p53 yarı ömrü artmaktadır (7). Onkogenez ve kanser: Onkogenler, protoonkogenlerden kaynaklanırlar. Bunlar normal büyüme ve differansiasyonu sağlayan genlerdir. Protoonkogenler ilk olarak retrovirüslerde ortaya çıkarılmışlardır. Onkogenler aktive edici etkilerini genellikle nokta mutasyonu, translokasyon veya gen amplifikasyonları gibi genetik değişiklikler ile gösterir (7). Onkogenlerin protein ürünleri: Onkogenler, onkoprotein adı verilen proteinleri kodlar. Onkoproteinlerin fonksiyonlarının normal hücre proliferasyonuna da etkisi şu şekildedir. Normal hücre proliferasyonu; Hücre membranındaki spesifik reseptöre büyüme faktörünün bağlanması, plazma membranı iç yaprağındaki değişik uyarı ileten proteinleri aktive eden büyüme faktörü reseptörünün geçici ve sınırlı aktivitesi, iletilen uyarının ikincil ulaklar aracılığı ile sitozolden çekirdeğe taşınması, DNA kopyalanmasını başlatan nükleer düzenleyici faktörlerin göreve başlaması ve aktivasyonu, hücre bölünmesi ile sonuçlanacak hücrenin siklusa girişi ve ilerleme izler (7). c-erbb-2 EGF reseptörü yapısal olarak benzerlikler taşıyan 4 üyeli erb-b reseptör ailesinin ilk tanımlanmış üyesidir. Bu ailedeki diğer reseptörler HER 2/neu (c-erbb-2), HER 3 (c-erbb-3) ve HER 4 (c-erbb-4) dür. Bu reseptörler ligand ve substrat özgüllüğü itibariyle farklılıklar göstermesine rağmen uyarıldıklarında homodimer veya heterodimer oluştururarak birlikte etkileşim gösterirler (37). c-erbb-2 reseptörünün bilinen bir ligandı yoktur. Bundan dolayı EGFR,c-erbB-3 ve c-erbb-4 heterodimerlerin formasyonları ile aktive olurlar. Aktive olan reseptörler büyümeyi, motiliteyi, hücre proliferasyonunu ve apoptozisi düzenler HER 2/neu (c-erbb 2) kromozom 17q21 de haritalanmış bir protoonkogendir. HER 2 onkogeni 185 kda transmembran proteinini kodlar (7, 38). Bu 34
35 reseptörler sisteinden zengin ekstrasellüler büyüme faktör ligand bağlayan alan, lipofilik bir transmembran protein ve düzenleyici bir segment içeren bir intrasellüler tirozin kinaz alanı kapsayan benzer bir yapıyı paylaşırlar (39). HER ailesi insan embriyogenezinde önemli bir rol oynar. c-erbb-2 protoonkojen ürünü fetüste; ürotelyum, proksimal ve distal renal tübüller, gastrointestinal epitel ve bronşiolar epitelde yüksek düzeyde eksprese edilir. Erişkinde ise; sadece renal tübüllerde nadiren eksprese edilmekte olup bununla birlikte meme, over, mide, mesane, özofagus, tükrük bezleri, akciğer ve böbrek karsinomlarında amplifikasyon ve ekspresyon fazlalığı gösterirler (40). Epitelyal over karsinomlarında c-erbb-2 nin overekspresyonunun kötü prognozla ilgili olduğu beirtilmiş fakat beklenen yaşam süresi için bağımsız bir prognostik faktör olduğu doğrulanmamıştır (6). p53 Son yirmibeş yıl boyunca, moleküler biyolojide üzerinde en çok çalışılan protein olma özelliğini koruyan p53 genomun koruyucusu olarak bilinir (41). Dünyada her yıl yaklaşık olarak 6,5 milyon yeni kanser olgusu görülmektedir. Bu olguların yaklaşık 2,4 milyonunda (%37) ise p53 mutasyonlarının varlığından söz edilmektedir. p53 insan kanserlerinde en sık değişikliğe uğrayan gendir ve inaktivasyonu insan karsinogenezisinde anahtar olay olarak kabul edilmektedir. Đnsan kanserlerinde saptanan yüksek p53 geni mutasyon görülme sıklığı, p53 ün tümör gelişimindeki önemli ve kritik olaylar dizgesinde işlevlere sahip olduğunun göstergesidir (42). p53 geni 17. kromozomun p13.1 bölgesinde yer almaktadır ve 11 eksona ayrılmış olup DNA da 12 kb alan kaplar (43, 44). 393 aminoasit içeren, 53 kda ağırlığında bir tümör süpresör gendir. Đmmünohistokimyasal olarak saptanabilmektedir. Wild tip, mutasyona uğramamış p53 proteini yaklaşık 20 dakika yarılanma ömrüne sahiptir ve hücre proliferasyonu ve transformasyonunda inhibitör etkilidir. Hücre büyümesinin 35
36 durdurulması, programlanmış hücre ölümü, hücre farklılaşması ve DNA tamir mekanizmasının başlatılmasında rol alır (24). p53 geni, CDK-siklin bağımlı kinaz- inhibitörü olan p21 protein genini uyarır. Bu gen normalde hücrenin G1'den S'ye geçişini kontrol eder. Bu gen aktive olur ve iki olası yanıtı başlar. 1. Hücre döngüsünü G1/S kontrol noktasında durdurarak DNA'nın onarımı için gereken zamanı sağlar. 2. Apopitozisi tetikler ve hücre programlı bir şekilde öldürülür (45, 46). Đmmunohistokimyasal olarak, p53 ekspresyonu gösteren hücrelerin büyük bir kısmı p53 mutasyonu içerir. Mutasyon içermeyen (Wild-type) p53 bulunan tümörlerin, farklı karsinogenik mekanizmaya sahip olabilecekleri düşünülmektedir (47). Bundan dolayı borderline ve malign epitelyal over tümörlerinde p53 ekspresyonu ile ilgili sonuçlar çelişkilidir. p53 gen mutasyonu sonucu oluşan mutant p53 proteini, Wild tip p53'e göre daha uzun yarılanma ömrüne sahiptir ve süpresör fonksiyonu yoktur (48). p53'ün 4000'den fazla mutasyonu tanımlanmıştır (49). Normal over dokusunda da p53 proteini saptanmıştır. Gastrointestinal sistem karsinomları, akciğer karsinomları, melanom, over karsinomları, meme karsinomlarının büyük kısmında ve premalign lezyonların bazılarında p53 immünreaksiyonu saptanabilir. Over karsinomlarında p53 mutant protein prognostik belirleyici faktör olarak değerli bulunmuştur (50).Kanser hücrelerinde Wild tip p53 fonksiyonunun kaybı tümör büyümesinin daha agresif olmasına neden olabilir. p53 immünreaktivitesi kötü prognoz göstergesidir (51). COX 2 Prostoglandinler 20 karbonlu, hücre membran fosfolipidi olan araşidonik asidin hidrolizi ile oluşur. Hidrolizin ilk basamağında fosfolipaz A2, ikinci basamakta araşidonik asite COX enziminin sikloosijenaz aktivitesi ile moleküler oksijen eklenerek kararsız bir molekül olan PGG 2 nin oluşumu, bunu da son olarak COX enziminin peroksidaz aktivitesi ile PGH2 ye dönüşmesi izler. 36
37 PGH2 de spesifik sentetazlar ile diğer prostonoidleri oluşturur. Cyclooxygenase (COX) prostoglandin biyosentezinde anahtar enzimdir (59, 60). ŞEKĐL:1 PROSTAGLANDĐN SENTEZĐ COX enziminin ayrı genler tarafından kodlanan başlıca üç izoformu vardır: 1. COX 1 (yapısal form), 2. COX 2 (indüklenebilir form), 3. COX 3 Araştırmacılar ilk olarak 1970 lerin başlarında birden fazla COX enzimi olduğunu düşünmüşlerdir yılında farklı laboratuarlar tarafından COX 2 37
38 enzimi tanımlanmıştır. COX 1, memeli dokularında normal koşullarda bulunan, çeşitli fizyolojik işlevlere sahip yapısal bir enzimdir. COX 2 mrna ve proteini ise dokularda normal koşullarda ölçülemeyecek kadar az miktarda bulunan, proinflamatuar ve mitojenik uyarılar ile hızla indüklenen bir enzimdir. COX 1 ve COX 2 enzimleri nükleer zarfın lümeninde ve endoplazmik retikulumda yer alır. COX 1 ve COX-2 nin aminoasit yapıları % 60 oranında aynıdır. Hidrofobik amino grup terminal peptitleri COX-2 de daha uzun olup daha az hidrofobiktir. Her iki izoformun enzimatik aktiviteleri benzerdir. Ancak biyolojik fonksiyonları farklıdır. COX 1 gastrik mukozanın sitoproteksiyonu, renal kan akımının düzenlenmesi, platelet agregasyonunun kontrolü gibi fizyolojik olaylarda görevli prostaglandinlerin yapımında yer alır. COX 2 ise sitokinler, endotoksinler, interlökinler ve forbol esteri gibi uyarılarla artarak, patolojik ve inflamatuar süreçlerde rol oynar. Birçok deneysel çalışmada transforme hücrelerde ve pek çok kanser türünde (deri, pankreas, kolon, akciğer, baş boyun, mesane, vb.) COX 1 enzimi sabit düzeylerde saptanmış iken, COX 2 ekspresyonunun arttığı gösterilmiştir. Son zamanlarda tanımlanan COX-3 ün inflamasyonda rolü olmayıp asetaminofenin etkisi ile ilgili olabileceği öne sürülmüştür (13, 59). COX 2 ekspresyonunun kanser hücre proliferasyonu ile anjiogenezis ve apoptozisin supresyonu ile bağlantılı olduğu görülmüştür (51). COX 1 birçok normal dokuda bulunur. Zıt olarak COX 2 artışı proliferasyon, apoptozisin inhibisyonu ve neoanjiogenezis ile bağlantılıdır. COX 2 overekspresyonu over kanserini de içeren birçok malignitede rapor edilmiştir (52,62). COX 2 enzimi ile insan kanserleri arasındaki ilişki ilk olarak 1994'de kolorektal karsinomlarda COX 2 mrna düzeylerinin belirgin arttığı tespit edilerek rapor edilmiştir (61). Over kanserlerinde COX-2 ekspresyonunun artışı bağımsız prognostik faktör olarak tanımlanmıştır ve azalmış sağkalım ve standart kemoterapi kombinasyonlarına kötü yanıt ile ilişkili olarak bulunmuştur (62). 38
39 MATERYAL Arşiv kayıtları incelenerek tarihleri arasında Dr. Lütfi Kırdar Kartal Eğitim ve Araştırma Hastanesi Patoloji Kliniği nde tanı almış toplam 85 adet primer seröz ve müsinöz over tümörü vakası çalışmaya alındı. Vakalara ait H&E boyalı preparatlar tekrar değerlendirilerek tümörü en iyi örnekleyen lama ait parafin bloklar immünohistokimyasal inceleme için seçildi. 57 adet seröz karsinom, 8 adet müsinöz karsinom, 12 adet borderline seröz tümör, 8 adet borderline müsinöz tümör vakası çalışmaya dahil edildi. METOD ĐMMÜNOHĐSTOKĐMYA Seçilen parafin bloklardan elde edilen 2 µm lik kesitler önceden poly-l-lysin ile kaplanmış lamlara alındı. Kesitler bir gece 37 Cº lık ısıda etüvde bekletildi. Deparafinizasyon işlemi için etüvden alınan kesitler 15 dakika süresince 3 ayrı şalede ksilolden geçirildi. Kesitler derecesi % 99 9 den başlayarak azalan alkollerden 15 dakika süresince 3 kez geçirildi. Daha sonra distile suyla yıkandı. Antijen retrieval aşaması için plastik taşıyıcıya alınan kesitler, kesit yüzeyini örtecek şekilde PH 6 sitrat buffer solüsyonu içine yerleştirildi. 4 kez 5 er dakikalık sürelerle toplam 20 dakika mikrodalga fırında 800 watt, 600 wattx2, 360 watt ta şoklandı. Oda sıcaklığında 20 dakika bekledikten sonra kesitler distile suyla yıkandı. Dokuların etrafı hidrofobik kalem ile çizildi ve kesitler PBS (phosphate buffered saline) ile yıkandı. Dokudaki endojen peroksidaz aktivitesini önlemek için kesitler üzerine %3 lük hidrojen peroksit çözeltisi damlatıp 10 dakika beklendi. 39
40 Kesitler tekrar PBS ile yıkanıp nonspesifik bağlanmaları önlemeye yönelik 10 dakika blokaj DakoCytomation protein block serum-free, ref x0909, lot ) yapıldı ve sonrasında distile suyla yıkandı. Ardından 3 ayrı PBS banyosunda hızlı bir şekilde yıkanan kesitler p53 protein Monoclonal Mouse anti-human (DakoCytomation EnVision Clone DO 7, Code N1581 1:100 dilüsyon oranında 90 dakika), COX 2 Monoclonal Mouse antihuman (DakoCytomation EnVision Clone CX294, Code M3617, 1:100 dilüsyon oranında 90 dakika), c-erbb 2 Oncoprotein Polyclonal Rabbit Anti- Human (DakoCytomation EnVision A0485 Affinity isolated /10 90 dakika) ile inkübe edildi. Tekrar ayrı PBS banyosunda 15 dakika yıkandı ve üzerine (link) sekonder antikorlar Primary antbody enhancer (spring bioscience cat: DPE-125, Lot:70828 ) uygulandı ve 30 dakika bekletildi. Kesitler tekrar 4 ayrı PBS banyosunda yıkandı ve kesitlerin üzerine immünreaksiyonu gözlemlemek için işaret (label) olarak polyvalent HRP Polymer (spring bioscience cat:dpe-125, Lot:70918 ) damlatılarak 30 dakika beklendi. PBS ile yıkanan kesitlerin üzerine immünreaksiyonu gözlemlemek için AEC kromojen sistemi ( spring bioscience catalog: ASS 125 ready to use) kullanıldı. Kesitlere damlatılarak 15 dakika süreyle uygulandı. Kesitler tüm işlemlerden sonra distile su ile yıkanıp Mayer -Hematoksilen ile kontras boyama yapılarak su bazlı kapama maddesi damlatılarak kapatıldı. Pozitif kontrol olarak p53 ve COX 2 için kolon adenokarsinomuna ait kesitler, c-erbb-2 için pozitif kontrol olarak, daha önce + 3 pozitif immünreaktivite göstermiş, meme dokusuna ait invaziv duktal karsinom tanısı almış kesitler kullanıldı. 40
41 ĐMMÜNREAKTĐVĐTENĐN DEĞERLENDĐRĐLMESĐ Đmmunohistokimyasal COX 2 ekspresyonu değerlendirmesi, Olympus BX 51 ışık mikroskobunda 400x (40xobjektif lens, 10xoküler lens) büyütmede yapıldı. Preparatlar tümör hücrelerinde boyanma yoğunluğu ve boyanma yaygınlığı açısından değerlendirildi. Kolon adenokarsinom olgusu dış kontrol olarak alındı. Đnternal kontrol olarak iltihap hücreleri ve düz kas hücrelerinde değişen şiddet ve oranlarda boyanma saptandı. Boyanma yoğunluğu 0 (negatif), 1 (zayıf), 2 (orta derecede), 3 (kuvvetli) olarak alındı. Tümör dokusunda boyanma yaygınlığı; boyanma yok ise 0, % 1 10 arası 1, %11 50 arası 2, %51 80 arası 3 ve % arası 4 olarak değerlendirildi. Final skorlama yoğunluk ve yaygınlığın çarpılması ile 0 12 arası skorlandı.bu skorlama 0 4 arası hafif, 5 8 arası orta ve 9 12 arası kuvvetli olarak ölçüldü. Bu değerlendirme istatiksel kullanım için iki grupta yapılandırıldı. 1) 0 ve hafif immünreaktivite negatif olarak, 2) Orta ve kuvvetli immünreaktivite pozitif (Resim 1, 2, 3,4) olarak değerlendirildi (53).COX-2'nin değerlendirilmesinde sayım işleminde herhangi bir düzeydeki sitoplazmik ve/veya membranöz boyanma immünreaktif olarak değerlendirildi. p53 ün değerlendirilirken en yoğun boyanmanın olduğu alanlar seçildi. Daha sonra x400 objektif kullanılarak p53 tümör hücrelerinin % 10 undan fazlası boyandığında pozitif (Resim5, 6, 7,8) kabul edildi (54, 55). c-erbb 2 antikor boyanmasının değerlendirilmesinde c-erbb 2 ile membranöz boyanma esas alındı, sitoplazmik boyanma negatif immünreaktivite olarak değerlendirildi. Boyanma değerlendirilirken kesitteki tümör alanlarının bütünü göz önüne alındı. Membranöz boyanma keskinliği zayıf membranöz boyanma, şiddetli membranöz boyanma ve tam (komplet), kısmi (inkomplet) membranöz boyanma özelliklerine göre değerlendirildi. Bu bilgilere göre; 41
42 Tümör dokusunda hiçbir boyanma olmaması durumunda c-erbb 2 için immünreaktivite negatif (-) olarak değerlendirildi. Tümöral alanların tamamının % 10 undan daha az bir alanında zayıf veya şiddetli, tam (komplet) membranöz bir immünreaktivite olması veya % 10 undan daha fazla alanında kısmi (inkomplet) immünreaktivite bulunması durumunda c-erbb 2 için immünreaktivite + 1 (negatif) olarak değerlendirildi Tümöral alanların tamamının %10 undan daha fazlasında zayıf ve tam (komplet) membranöz boyanma olması durumunda c-erbb 2 için immünreaktivite + 2 (pozitif) olarak % 10 undan fazlasında şiddetli ve tam (komplet) membranöz boyanma olması durumunda ise c-erbb 2 için immünreaktivite + 3 pozitif (Resim 9, 10, 11) olarak değerlendirildi (14, 51, 56, 57). Đstatistiksel Đncelemeler Çalışmada elde edilen bulgular değerlendirilirken, istatistiksel analizler için NCSS 2007&PASS 2008 Statistical Software (Utah, USA) programı kullanıldı. Çalışma verileri değerlendirilirken tanımlayıcı istatistiksel metodların (ortalama, standart sapma, frekans) yanısıra niteliksel verilerin karşılaştırılmasında Ki-Kare testi, Fisher s Exact Test, Cochran Q test ve Mc Nemar test kullanıldı. Sonuçlar %95 lik güven aralığında, anlamlılık p<0.05 düzeyinde değerlendirildi. 42
43 BULGULAR Çalışma tarihleri arasında yaşları 23 ile 79 arasında değişmekte olan toplam 85 olgu üzerinde yapılmıştır. Olguların ortalama yaşları 52.07±12.04 tür. Evreleme de erken evre I-II, ileri evre III-IV olarak değerlendirilmiştir. Olguların özellikleri Tablo 5 de özetlenmiş ve şekil 2, 3, 4, 5, 6, 7, 8, 9, 10 da grafikle gösterilmiştir. Tablo 5: Borderline ve Malign Seröz ve Müsinöz Tümörlerde c-erbb-2, p53 ve COX-2 ile boyanma ve klinikopatolojik parametrelerle ilişkisi Vaka Sayısı CERB B2 P53 COX-2 N n (%) n (%) n (%) < (%8,2) 37 (%75,5) 26 (%53,1) Yaş (%8,3) 28 (%77,8) 19 (%52,8) P 1,000 0,808 0,979 Erken evre 18 3 (%16,7) 15 (%83,3) 11 (%61,1) Evre Đleri evre 47 2 (%4,3) 33 (%70,2) 22 (%46,8) P 0,125 0,281 0,302 Unilateral 31 4 (%12,9) 24 (%77,4) 16 (%51,9) Lateralite Bilateral 54 3 (%5,6) 41 (%75,9) 29 (%53,7) P 0,252 0,876 0,853 Negatif 26 3 (%11,5) 24 (%92,3) 15 (%57,7) Over Yüzey Pozitif 55 2 (%3,6) 39 (%70,9) 27 (%49,1) Tutulumu P 0,321 0,031* 0,469 Negatif 31 3 (%9,7) 26 (%83,9) 19 (%61,3) Appendiks Pozitif 20 2 (%10,0) 12 (%60,0) 10 (%50,0) tutulumu P 1,000 0,050* 0,427 Az diferansiye 5-4 (%80,0) 1 (%20,0) Histolojik Grade Orta diferansiye 45 4 (%8,9) 35 (%77,8) 24 (%53,3) Đyi diferansiye 15 1 (%6,7) 9 (%60,0) 8 (%53,3) P 0,767 0,378 0,358 Negatif 31 4 (%12,9) 27 (%87,1) 18 (%58,1) Omentum Pozitif 36 2 (%5,6) 24 (%66,7) 17 (%47,2) tutulumu P 0,404 0,050* 0,376 Negatif 34 4 (%11,8) 28 (%82,4) 20 (%58,8) Lenf Nodu Pozitif 11-5 (%45,5) 5 (%45,5) Metastazı P 0,558 0,016* 0,438 Negatif 29 2 (%6,9) 26 (%89,7) 15 (%51,7) Asit Pozitif 32 2 (%6,3) 20 (%62,5) 13 (%40,6) P 1,000 0,014* 0,385 Ki-kare veya Fisher s Exact Test kullanıldı * p<
44 Yaş, evre, lateralite, over yüzey tutulumu, appendiks, histolojik grade, omentum, lenf nodu metastazı ve asit parametrelerinde c-erbb-2 pozitifliği görülme oranları arasında istatistiksel olarak anlamlı bir farklılık bulunmamaktadır (p>0.05). Yaş, evre, lateralite ve histolojik grade parametrelerinde p53 pozitifliği görülme oranları arasında istatistiksel olarak anlamlı bir farklılık bulunmamaktadır (p>0.05). Over yüzey tutulumu pozitif olanlarda p53 boyanması pozitifliği (%70,9), negatif olanlardan (%92,3) anlamlı düzeyde düşüktür (p<0.05). Appendiks tutulumu pozitif olanlarda p53 boyanmas pozitifliği (%60), negatif olanlardan (%83,9) anlamlı düzeyde düşüktür (p<0.05). Omentum tutulumu pozitif olanlarda p53 boyanma pozitifliği (%66,7), negatif olanlardan (%87,1) anlamlı düzeyde düşüktür (p<0.05). Lenf nodu metastazı pozitif olanlarda p53 boyanması pozitifliği (%45,5), negatif olanlardan (%82,4) anlamlı düzeyde düşüktür (p<0.05). Asit pozitif olanlarda p53 boyanması pozitifliği (%62,5), negatif olanlardan (%89,7) anlamlı düzeyde düşüktür (p<0.05). Yaş, evre, lateralite, over yüzey tutulumu, appendiks, histolojik grade, omentum, lenf nodu metastazı ve asit parametrelerinde COX 2 pozitifliği görülme oranları arasında istatistiksel olarak anlamlı bir farklılık bulunmamaktadır (p>0.05). 44
45 Yaş 55 42,4% <55 57,6% Şekil 2: Yaş Dağılımı Evre Erken evre 27,7% Đleri evre 72,3% Şekil 3: Evre Dağılımı 45
46 Lateralite Unilateral 36% Bilateral 64% Şekil 4: Lateralite Dağılımı Over Yüzey Tutulumu Negatif 32,1% Pozitif 67,9%. Şekil 5: Over Yüzey Tutulumu Dağılımı 46
47 Appendiks Pozitif 39,2% Negatif 60,8% Şekil 6: Appendiks Tutulumunun Dağılımı Histolojik Grade Đyi diferansiye 23,1% Az diferansiye 7,7% Orta diferansiye 69,2% Şekil 7: Histolojik Grade Dağılımı 47
48 Omentum Negatif 46,3% Pozitif 53,7% Şekil 8: Omentum Tutulumunun Dağılımı Lenf Nodu Metastazı Pozitif 24,4% Negatif 75,6% Şekil 9: Lenf Nodu Metastazı Dağılımı 48
49 Asit Negatif 47,5% Pozitif 52,5% Şekil 10: Batın sıvısı Dağılımı Tablo 6: Tüm olgularda c-erbb-2, p53 ve COX 2 Frekans Dağılımı n % c-erbb-2 p53 COX 2 Negatif 78 91,8 Pozitif 7 8,2 Negatif 20 23,5 Pozitif 65 76,5 Negatif 40 47,1 Pozitif 45 52,9 pozitiftir. Olguların %8,2 sinde c-erbb-2, %76,5 inde p53 ve %52,9 unda COX 2 49
50 % Negatif Pozitif Negatif Pozitif Negatif Pozitif CERB B2 P53 COX-2 Şekil 11: c-erbb-2, p53, COX 2 Dağılımı 50
51 Tablo 7: Borderline Seröz Tümör Vakalarında c-erbb-2, p53 ve COX-2 ye Göre Frekans Dağılımı ve değerlendirmeler. Vaka Sayısı c-erbb-2(+) p53 (+) COX-2 (+) N n (%) n (%) n (%) Yaş Lateralite Over Yüzey Tutulumu Appendiks Tutulumu Omentum Tutulumu Lenf Nodu Metastazı Asit < (%100) 7 (%70,0) (%100) 0 (%0) P Unilateral 8-8 (%100) 5 (%62,5) Bilateral 4-4 (%100) 2 (%50,0) P Negatif (%100) 6 (%54,5) Pozitif 1-1 (%100) 1 (%100,0) P Negatif 3-3 (%100) 1 (%33,3) Pozitif P Negatif 6-6 (%100) 3 (%50,0) Pozitif 1-1 (%100) 1 (%100) P Negatif 5-5 (%100) 3 (%60,0) Pozitif P Negatif 5-5 (%100) 2 (%40,0) Pozitif 1-1 (%100) 1 (%100) P Ki-kare veya Fisher s Exact Test kullanıldı * p<
52 12 borderline seröz olgusunun hiçbirinde c-erbb-2 (+) liği görülmezken, %100 ünde P53 pozitif boyanmıştır. 7 (%58,3) olguda COX 2 (+) boyanmıştır. 55yaş altı ve 55 yaş üzeri olguların tamamında p53 boyanması pozitif boyanmıştır. 55 yaş altı olguların %70 inde COX 2 boyanması pozitif iken, 55 yaş üzeri olguların hiçbirinde COX 2 boyanması gözlenmedi. Unilateral ve bilateral olguların tamamında p53 boyanması pozitif idi. Unilateral olguların %62,5 inde COX 2 boyanması pozitif iken, bilateral olguların %50 sinde COX 2 boyanması pozitiftir. Over yüzey tutulumu negatif ve pozitif olan olguların tamamında p53 pozitif boyanmıştır. Over yüzey tutulumu negatif olan olguların %54,5 inde, pozitif olan 1 olguda da COX 2 pozitif boyanmıştır. Appendiks tutulumu olmayan olguların tamamında p53 pozitif boyanmıştır. Appendiks tutulumu olmayan 1 olguda da COX 2 pozitif boyanmıştır. Omentum tutulumu negatif ve pozitif olan olguların tamamında p53 pozitif boyanmıştır. Omentum tutulumu negatif olan olguların %50 sinde ve pozitif olan 1 olguda da COX 2 pozitif boyanmıştır. Lenf nodu metastazı negatif olan olguların tamamında p53 pozitif boyanmıştır. Lenf nodu metastazı negatif olan olguların %60 ında COX 2 pozitif boyanmıştır. Asit negatif ve pozitif olan olguların tamamında p53 pozitif boyanmıştır. Asit negatif olan olguların %40 ında ve pozitif olan 1 olguda da COX 2 pozitif boyanmıştır. 52
53 Tablo:8 Borderline Müsinöz Tümör Grubunda c-erbb-2, COX-2 ve p53 e Göre Frekans Dağılımı Vaka Sayısı c-erbb-2 p53 COX-2 N n (%) n (%) n (%) Yaş Lateralite Over Yüzey Tutulumu Appendiks Tutulumu Omentum Tutulumu Lenf Nodu Metastazı < (%14.3) 4 (%57.1) 4 (%57.1) (%100) 1(%100) 1(%100) P Unilateral 7 2 (%28,6) 4 (%57,1) 4 (%57,1) Bilateral 1-1 (%100) 1 (%100) P Negatif 5 1(%20.0) 2 (%40,0) 3 (%60,0) Pozitif 3 1(%33.3) 3 (%100) 2 (%66,7) P Negatif 2 1 (%50,0) 2 (%100) 2 (%100) Pozitif P Negatif 2 1 (%50,0) 2 (%100) 2 (%100) Pozitif 1-1 (%100) 1 (%100) P Negatif 2 1 (%50,0) 2 (%100) 2 (%100) Pozitif P Negatif 4-2 (%50,0) 2 (%50,0) Asit Pozitif P Ki-kare veya Fisher s Exact Test kullanıldı * p<
54 Borderline müsinöz tümör olgusunun 2 sinde (%25) c-erbb-2 pozitif boyanma görüldü. 5 olguda (%62,5) p53 pozitif boyanmıştır. 5 (%62,5) olguda COX 2 pozitif boyanmıştır. 55 yaş altı olguların 1 inde (%14,3) c-erbb-2 (+) iken, 55 yaş üzeri 1 olguda1 inde c-erbb-2 (+) idi. 55 yaş altı olguların %57,1 inde p53 (+) iken, 55 yaş üzeri 1 olguda p53 boyanması pozitif idi. 55 yaş altı olguların %57,1 inde COX 2 boyanması pozitif iken, 55 yaş üzeri 1 olguda COX 2 boyanması pozitifti. Unilateral olguların %28,6 sında c-erbb-2 (+) iken, bilateral olan 1 olguda da c-erbb-2 (-) idi. Unilateral olguların %57,1 inde p53 (+) iken, bilateral olan 1 olguda da p53 (+) idi. Unilateral olguların %57,1 inde COX-2 (+) iken, bilateral olan 1 olguda da COX-2 (+) idi. Over yüzey tutulumu negatif olan 5 olgunun 1 inde (% 20) c-erbb-2 (+) Over yüzey tutulumu pozitif olan 3 olgunun 1 inde (% 33,3) c-erbb-2 (+) bulundu. Over yüzey tutulumu negatif olan 5 olgunun 2 sinde (%40) p53 (+) iken, pozitif olan 3 olgunun tamamında p53 (+) idi. Over yüzey tutulumu negatif olan 5 olgunun 3 ünde (%60) COX 2 (+) iken, pozitif olan 3 olgudan 2 sinde (% 66,7) COX 2 (+) idi. Appendiks tutulumu negatif olan 2 olgunun 1 inde (%50) c-erbb-2 pozitif boyanmıştır. Appendiks tutulumu negatif olan 2 olguda da p53 (+) idi. Appendiks tutulumu negatif olan 2 olguda da COX 2 boyanması pozitif idi. Omentum tutulumu negatif olan 2 olgunun 1 inde (%50) c-erbb-2 pozitif boyanmıştır. Omentum tutulumu negatif olan 2 olgunun 2 sinde ve pozitif olan 1 olguda p53 (+) boyanmıştır. Omentum negatif olan 2 olgunun 2 sinde ve pozitif olan 1 olguda COX 2 pozitif boyanmıştır. Lenf nodu metastazı negatif olan 2 olgunun 1 inde (%50) c-erbb-2 pozitif boyanmıştır. Lenf nodu metastazı negatif olan 2 olguda da p53 (+) idi. Lenf nodu metastazı negatif olan 2 olguda da COX 2 pozitif boyanmıştır. Asit 54
55 negatif olan olguların %50 sinde p53 (+) idi. Asit negatif olan olguların %50 sinde COX 2 pozitif boyamıştır. Tablo 9: Seröz Karsinom Grubunda c-erbb-2, p53 ve COX-2 ye Göre Frekans Dağılımı Vaka Sayısı c-erbb-2 p53 COX-2 N n (%) n (%) n (%) Yaş Evre Lateralite Over Yüzey Tutulumu Appendiks Tutulumu Histolojik Grade Omentum Tutulumu Lenf Nodu Metastazı < (%3,4) 21 (%72.4) 13 (%44.8) (%7.1) 21 (%75.0) 15 (%53.6) P Erken evre 13 1 (%7,7) 11 (%84,6) 8 (%61,5) Đleri evre 44 2 (%4,5) 31 (%70,5) 20 (%45,5) P Unilateral 10-8 (%80,0) 4 (%40,0) Bilateral 47 3 (%6,4) 34 (%72,3) 24 (%51,1) P Negatif 10 1 (%10,0) 9 (%90,0) 6 (%60,0) Pozitif 47 2 (%4,3) 33 (%70,2) 22 (%46,8) P Negatif (%81,0) 12 (%57,1) Pozitif 19 2 (%10,5) 11 (%57,9) 9 (%47,4) P Az diferansiye 3-3 (%100,0) - Orta diferansiye 40 2 (%5,0) 30 (%75,0) 21 (%52,5) Đyi diferansiye 14 1 (%7,1) 9 (%64,3) 7 (%50,0) P Negatif 20 1 (%5,0) 16 (%80,0) 11 (%55,0) Pozitif 31 2 (%6,5) 20 (%64,5) 13 (%41,9) P Negatif 23 1 (%4,3) 17 (%73,9) 13 (%56,5) Pozitif 10-4 (%40,0) 4 (%40,0) P Negatif 18 1 (%5,6) 17 (%94,4) 10 (%55,6) Asit Pozitif 30 2 (%6,7) 18 (%60,0) 11 (%49,1) P Ki-kare veya Fisher s Exact Test kullanıldı * p<
56 57 seröz karsinom olgusunun 3 ünde (%5,3) c-erbb-2 pozitif boyanma görüldü. 42 olguda (%73,7) p53 pozitif boyanmıştır. 28 (%49,1) olguda COX 2 pozitif boyanmıştır. 55 yaş altı olguların 1 inde (%3,4) c-erbb-2 (+) iken, 55 yaş üzeri olguların %7,1 inde c-erbb-2 (+) idi. 55 yaş altı olguların %72,4 ünde p53 (+) iken, 55 yaş üzeri olguların %75 inde p53 boyanması pozitif idi. 55 yaş altı olguların %44,8 inde COX 2 boyanması pozitif iken, 55 yaş üzeri olguların %53,6 sında COX 2 boyanması pozitifti. Erken evrede olan olguların 1 inde (%7,7) c-erbb-2 (+) iken, ileri evre olan olguların %4,5 inde c-erbb-2 (+) idi. Erken evre olan olguların %84,6 sında p53 (+) iken, ileri evre olan olguların %70,5 inde p53 boyanması pozitif idi. Erken evre olan olguların %61,5 inde COX 2 boyanması pozitif iken, ileri evre olguların %45,5 inde COX 2 boyanması pozitifti. Unilateral olan olguların hiçbirinde c-erbb-2 pozitif boyanmazken; bilateral olan olguların %6,4 ünde c-erbb-2 pozitif boyanmıştır. Unilateral olan olguların %80 inde p53 (+) iken, bilateral olan olguların %72,3 ünde p53 boyanması pozitif idi. Unilateral olan olguların %40 ında COX 2 boyanması pozitif iken, bilateral olan olguların %51,1 inde COX 2 boyanması pozitifti. Over yüzey tutulumu negatif olan olguların 1 inde (%10) c-erbb-2 (+) iken, over yüzey tutulumu pozitif olan olguların %4,3 ünde c-erbb-2 (+) idi. Over yüzey tutulumu negatif olan olguların %90 nında p53 (+) iken, pozitif olan olguların %70,2 sinde p53 boyanması pozitif idi. Over yüzey tutulumu negatif olan olguların %60 ında COX 2 boyanması pozitif iken, pozitif olguların %46,8 inde COX 2 boyanması pozitifti. Appendiks tutulumu negatif olan olguların hiçbirinde c-erbb-2 pozitif boyanmamış, tutulumun pozitif olduğu olguların %10,5 inde c-erbb-2 pozitif boyanmıştır. Appendiks tutulumu negatif olan olguların %81 inde p53 pozitif boyanmış, tutulumun pozitif olduğu olguların %57,9 unda p53 pozitif boyanmıştır. Appendiks tutulumu negatif olan olguların %57,1 inde COX 2 56
57 pozitif boyanmış, pozitif olan olguların %47,4 ünde COX 2 pozitif boyanmıştır. Az diferansiye olan olguların hiçbirinde c-erbb-2 pozitif boyanmazken; orta diferansiye olan olguların %5 inde ve iyi diferansiye olan olguların %7,1 inde c-erbb-2 pozitif boyanmıştır. Az diferansiye olan olguların %100 ünde, orta diferansiye olan olguların %75 inde ve iyi diferansiye olan olguların %64,3 ünde p53 pozitif boyanmıştır. Az diferansiye olan olguların hiçbirinde COX 2 pozitif boyanmazken; orta diferansiye olan olguların %52,5 inde ve iyi diferansiye olan olguların %50 sinde COX-2 pozitif boyanmıştır. Omentum tutulumu negatif olan olguların 1 inde (%5) ve pozitif olan olguların %6,5 inde c-erbb-2 pozitif boyanmıştır. Omentum tutulumu negatif olan olguların %80 ninde p53 pozitif boyanmış, tutulumun pozitif olduğu olguların %64,5 inde p53 pozitif boyanmıştır. Omentum tutulumu negatif olan olguların %55 inde COX 2 pozitif boyanmış, tutulumun pozitif olduğu olguların %41,9 unda COX 2 pozitif boyanmıştır. Lenf nodu metastazı negatif olan olguların %4,3 ünde c-erbb-2 pozitif boyanırken; pozitif olan olguların hiçbirinde c-erbb-2 pozitif boyanmamıştır. Lenf nodu metastazı negatif olan olguların %73,9 unda p53 pozitif boyanmış, pozitif olan olguların %40 ında p53 pozitif boyanmıştır. Lenf nodu negatif olan olguların %56,5 inde COX 2 pozitif boyanmış, lenf nodu pozitif olan olguların %40 ında COX 2 pozitif boyanmıştır. Asit negatif olan olguların 1 inde (%5,6) ve pozitif olan olguların %6,7 sinde c-erbb-2 pozitif boyanmıştır. Asit negatif olan olguların %94,4 ünde p53 pozitif boyanmış, pozitif olan olguların %60 ında p53 pozitif boyanmıştır. Asit negatif olan olguların %55,6 sında COX 2 pozitif boyanmış, pozitif olan olguların %49,1 inde COX 2 pozitif boyanmıştır. 57
58 Tablo 10: Müsinöz Karsinom Grubunda c-erbb-2, p53 ve COX-2 ye Göre Frekans Dağılımı Vaka Sayısı c-erbb-2 p53 COX-2 N n (%) n (%) n (%) < (%33.3) 4 (%66,7) 3 (%50) Yaş (%100) 2 (%100) P Erken evre 5 2 (%40,0) 4 (%80,0) 3 (%60,0) Evre Đleri evre 3-2 (%66,7) 2 (%66,7) P Unilateral 6 2 (%33,3) 4 (%66,7) 3 (%50,0) Lateralite Bilateral 2-2 (%100,0) 2 (%100) P Negatif 3 2 (%66,7) 3 (%100,0) 2 (%66,7) Over Yüzey Pozitif 5-3 (%60,0) 3 (%60,0) Tutulumu P Negatif 5 2 (%40,0) 4 (%80,0) 4 (%80,0) Appendiks Tutulumu Pozitif 1-1 (%100,0) 1 (%100) P Az diferansiye 2-1 (%50,0) 1 (%50,0) Histolojik Orta diferansiye 5 2 (%40,0) 5 (%100,0) 3 (%60,0) Grade Đyi diferansiye (%100,0) P Negatif 3 2 (%66,7) 3 (%100,0) 2 (%66,7) Omentum Pozitif 3-2 (%66,7) 2 (%66,7) Tutulumu P Negatif 4 2 (%50,0) 4 (%100,0) 2 (%50,0) Lenf Nodu Pozitif 1-1 (%100,0) 1 (%100,0) Metastazı P Negatif 2 1 (%50,0) 2 (%100,0) 1 (%50,0) Asit Pozitif 1-1 (%100,0) 1 (%100) P Ki-kare veya Fisher s Exact Test kullanıldı * p<
59 8 müsinöz karsinom olgusunun 2 sinde (%25) c-erbb-2 pozitif boyanma görüldü. 6 olguda (%75) p53 pozitif boyanmıştır. 5 (%62,5) olguda COX 2 pozitif boyanmıştır. 55 yaş altı olguların %33,3 ünde c-erbb-2 (+) iken, 55 yaş üzeri olguların hiçbirinde c-erbb-2 ile boyanma görülmedi. 55 yaş altı olguların %66,7 sinde p53 (+) iken, 55 yaş üzeri olguların %100 ünde p53 boyanması pozitif idi. 55 yaş altı olguların %50 sinde COX 2 boyanması pozitif iken, 55 yaş üzeri olguların tamamında COX 2 boyanması pozitifti. Erken evrede olan olguların %40 ında c-erbb-2 (+) iken, ileri evre olan olguların hiçbirinde c-erbb-2 pozitif boyanmamıştır. Erken evre olan olguların %80 ninde p53 (+) iken, ileri evre olan olguların %66,7 sinde p53 boyanması pozitif idi. Erken evre olan olguların %60 ında COX 2 boyanması pozitif iken, ileri evre olguların %66,7 sinde COX 2 boyanması pozitifti. Unilateral olan olguların %33,3 ünde c-erbb-2 (+) iken, bilateral olan olguların hiçbirinde c-erbb-2 pozitif boyanmamıştır. Unilateral olan olguların %66,7 sinde p53 (+) iken, bilateral olan olguların %100 ünde p53 boyanması pozitif idi. Unilateral olan olguların %50 sinde COX 2 boyanması pozitif iken, bilateral olan olguların %100 ünde COX 2 boyanması pozitifti. Over yüzey tutulumu negatif olan olguların %66,7 sinde c-erbb-2 (+) iken, over yüzey tutulumu pozitif olan olguların hiçbirinde c-erbb-2 pozitif boyanmamıştır. Over yüzey tutulumu negatif olan olguların %100 ünde p53 (+) iken, tutulumun pozitif olduğu olguların %60 ında p53 boyanması pozitif idi. Over yüzey tutulumu negatif olan olguların %66,7 sinde COX 2 boyanması pozitif iken, pozitif olguların %60 ında COX 2 boyanması pozitifti. Appendiks tutulumunun pozitif olduğu olguların hiçbirinde c-erbb-2 pozitif boyanmazken, negatif olguların %40 ında c-erbb-2 pozitif boyanmıştır. Appendiks tutulumunun negatif olduğu olguların %80 ninde p53 pozitif boyanmış, tutulumun pozitif olduğu 1 olguda da p53 pozitif boyanmıştır. 59
60 Appendiks tutulumunun negatif olduğu olguların %80 ninde COX 2 pozitif boyanmış ve tutulumun pozitif olduğu 1 olguda da COX 2 pozitif boyanmıştır. Az diferansiye ve iyi diferansiye olan olguların hiçbirinde c-erbb-2 pozitif boyanmazken; orta diferansiye olan olguların %40 ında c-erbb-2 pozitif boyanmıştır. Az diferansiye olan olguların %50 sinde ve orta diferansiye olan olguların %100 ünde p53 pozitif boyanmıştır. Az diferansiye olan olguların %50 sinde; orta diferansiye olan olguların %60 ında ve iyi diferansiye olan olguların 1 olguda da COX-2 pozitif boyanmıştır. Omentum tutulumu pozitif olan olguların hiçbirinde c-erbb-2 pozitif boyanmazken, negatif olan olguların %66,7 sinde c-erbb-2 pozitif boyanmıştır. Omentum tutulumu negatif olan olguların %100 ünde p53 pozitif boyanmış, tutulumun pozitif olduğu olguların %66,7 sinde p53 pozitif boyanmıştır. Omentum tutulumu negatif olan olguların %66,7 sinde COX 2 pozitif boyanmış, pozitif olan olguların %66,7 sinde COX 2 pozitif boyanmıştır. Lenf nodu metastazı negatif olan olguların %50 sinde c-erbb-2 pozitif boyanmıştır. Lenf nodu metastazı negatif olan olguların %100 ünde p53 pozitif boyanmış, pozitif olan 1 olguda da p53 pozitif boyanmıştır. Lenf nodu metastazı negatif olan olguların %50 sinde COX 2 pozitif boyanmış, pozitif olan 1 olguda da COX 2 pozitif boyanmıştır. Asit negatif olan olguların %50 sinde c-erbb-2 pozitif boyanırken; pozitif olan olguların hiçbirinde c-erbb-2 pozitif boyanmamıştır. Asit negatif olan olguların %100 ünde p53 pozitif boyanmış, pozitif olan 1 olguda da p53 pozitif boyanmıştır. Asit negatif olan olguların %50 sinde COX 2 pozitif boyanmış, pozitif olan 1 olguda da COX 2 pozitif boyanmıştır. 60
61 Tablo 11: Seröz ve Müsinöz Karsinom, Borderline Seröz ve Müsinöz Tümörlerin Sınıflamasına Đlişkin Değerlendirmeler Karsinom (n=65) Borderline (n=20) P n (%) n (%) Yaş <55 33 (%50,8) 16 (%80,0) (%49,2) 4 (%20,0) Evre Erken evre 18 (%27,7) - Đleri evre 47 (%72,3) - Lateralite Unilateral 16 (%24,6) 15 (%75,0) Bilateral 49 (%75,4) 5 (%25,0) Over Yüzey Negatif 13 (%20,0) 13 (%81,3) Tutulumu Pozitif 52 (%80,0) 3 (%18,8) Appendiks Negatif 26 (%56,5) 5 (%100,0) Tutulumu Pozitif 20 (%43,5) 0 (%0) Az diferansiye 5 (%7,7) - Histolojik Orta Grade diferansiye 45 (%69,2) - Đyi diferansiye 15 (%23,1) - Omentum Negatif 23 (%40,4) 8 (%80,0) Tutulumu Pozitif 34 (%59,6) 2 (%20,0) Lenf Nodu Negatif 27 (%71,1) 7 (%100) Metastazı Pozitif 11 (%28,9) 0 (%0) Batın sıvısı Negatif 20 (%39,2) 9 (%90,0) Pozitif 31 (%60,8) 1 (%10,0) Ki-kare testi kullanıldı + Fisher s Exact test * p<0.05 ** p<0.01 0,021* - 0,001** 0,001** 0,143-0,020* 0,101 0,003** 61
62 Karsinom olan olguların 55 yaş ve üzerinde olma oranları (%49,2), borderline olgulardan (%20) istatistiksel olarak anlamlı düzeyde yüksektir (p<0.05). 100% 90% 80% 70% 60% 50% 40% 30% 20% 10% 0% Karsinom Borderline Yaş <55 55 Şekil 12: Karsinom-Borderline Gruplarına Göre Yaş Dağılımı Karsinom olguların %27,7 si erken evre iken, %72,3 ü ileri evredir. Karsinom olan olgulardaki bilateralite oranı (%75,4), borderline olgulardan (%25) istatistiksel olarak ileri düzeyde anlamlı yüksektir (p<0.01). 100% 90% 80% 70% 60% 50% 40% 30% 20% 10% 0% Karsinom Borderline Lateralite Unilateral Bilateral Şekil 13: Karsinom-Borderline Gruplarına Göre Lateralite Dağılımı 62
63 Karsinom olan olgulardaki over yüzey tutulumu pozitifliği (%80), borderline olgulardan (%18.8) istatistiksel olarak ileri düzeyde anlamlı yüksektir (p<0.01). 100% 90% 80% 70% 60% 50% 40% 30% 20% 10% 0% Karsinom Borderline Over Yüzey Tutulumu Negatif Pozitif Şekil 14: Karsinom-Borderline Gruplarına Göre Over Yüzey Tutulumu Dağılımı Karsinom (%43,5) ile Borderline (%0) olgularda appendiks pozitifliği oranları arasında istatistiksel olarak anlamlı bir farklılık bulunmamaktadır (p>0.05). Karsinom olguların %7,7 sinin histolojik grade i az diferansiye iken, %69,2 si orta diferansiye ve %23,1 i iyi diferansiyedir. Karsinom olan olgulardaki omentum pozitifliği (%59,6), borderline olgulardan (%20) istatistiksel olarak anlamlı düzeyde yüksektir (p<0.05). 63
64 100% 90% 80% 70% 60% 50% 40% 30% 20% 10% 0% Karsinom Borderline Omentum Negatif Pozitif Şekil 15: Karsinom-Borderline Gruplarına Göre Omentum Dağılımı Karsinom (%28,9) ile Borderline (%0) olgularda lenf nodu pozitifliği oranları arasında istatistiksel olarak anlamlı bir farklılık bulunmamaktadır (p>0.05). Karsinom olan olgulardaki asit pozitifliği (%60,8), borderline olgulardan (%10) istatistiksel olarak ileri düzeyde anlamlı yüksektir (p<0.01). 100% 90% 80% 70% 60% 50% 40% 30% 20% 10% 0% Karsinom Borderline Asit Negatif Pozitif Şekil 16: Karsinom-Borderline Gruplarına Göre Asit Dağılımı 64
65 Tablo 12: Seröz ve Müsinöz Karsinom, Borderline Seröz ve Müsinöz Tümörlerin c-erbb-2, p53 ve COX-2 ile Değerlendirmeleri Karsinom (n=65) Borderline (n=20) P n (%) n (%) c-erbb-2 Negatif 60 (%92,3) 18 (%90,0) Pozitif 5 (%7,7) 2 (%10,0) p53 Negatif 17 (%26,2) 3 (%15,0) Pozitif 48 (%73,8) 17 (%85,0) COX 2 Negatif 32 (%49,2) 8 (%40,0) Pozitif 33 (%50,8) 12 (%60,0) Ki-kare testi kullanıldı 0,743 0,304 0,470 Karsinom olgular (%7,7) ile Borderline olgularda (%10) c-erbb-2 pozitifliği oranları arasında istatistiksel olarak anlamlı bir farklılık bulunmamaktadır (p>0.05). Karsinom olgular (%73,8) ile Borderline olgularda (%85) p53 pozitifliği oranları arasında istatistiksel olarak anlamlı bir farklılık bulunmamaktadır (p>0.05). Karsinom olgular (%50,8) ile Borderline olgularda (%60) COX 2 pozitifliği oranları arasında istatistiksel olarak anlamlı bir farklılık bulunmamaktadır (p>0.05). 65
66 Tablo 13: Seröz ve Müsinöz Tümörlerin Sınıflamasına Đlişkin Değerlendirmeler Seröz (n=69) Müsinöz (n=16) P n (%) n (%) Yaş <55 38 (%55,1) 11 (%68,8) (%44,9) 5 (%31,2) Evre Erken evre 13 (%22,8) 5 (%62,5) Đleri evre 44 (%77,2) 3 (%37,5) Lateralite Unilateral 18 (%26,1) 13 (%81,3) Bilateral 51 (%73,9) 3 (%18,7) Over Yüzey Negatif 21 (%30,4) 5 (%41,7) Tutulumu Pozitif 48 (%69,6) 7 (%58,3) + Appendiks Negatif 24 (%55,8) 7 (%87,5) Tutulumu Pozitif 19 (%44,2) 1 (%12,5) Az diferansiye 3 (%5,3) 2 (%25,0) Histolojik Orta Grade diferansiye 40 (%70,2) 5 (%62,5) Đyi diferansiye 14 (%24,6) 1 (%12,5) + Omentum Negatif 26 (%44,8) 5 (%55,6) Tutulumu Pozitif 32 (%55,2) 4 (%44,4) Lenf Nodu Negatif 28 (%73,7) 6 (%85,7) Metastazı Pozitif 10 (%26,3) 1 (%14,3) + Batın sıvısı Negatif 23 (%42,6) 6 (%85,7) Pozitif 31 (%57,4) 1 (%14,3) Ki-kare testi kullanıldı + Fisher s Exact test * p<0.05 ** p<0.01 0,318 0,019* 0,001** 0,442 0,127 0,132 0,723 0,496 0,046* 66
67 Seröz tümör (%44,9) ile Müsinöz tümör (%31,2) olgularında 55 yaş ve üzerinde olma oranları arasında istatistiksel olarak anlamlı bir farklılık bulunmamaktadır (p>0.05). Seröz tümörlerde ileri evre (%77,2) görülme oranı, müsinöz tümör olgularından (%37,5) istatistiksel olarak anlamlı düzeyde yüksektir (p<0.05). 100% 90% 80% 70% 60% 50% 40% 30% 20% 10% 0% Seröz Müsinöz Erken evre Đleri evre Şekil 17: Seröz-Müsinöz Tümör Gruplarına Göre Evre Dağılımı Seröz tümörlerde bilateralite (%73,9) görülme oranı, müsinöz tümör olgularından (%18,7) istatistiksel olarak ileri düzeyde anlamlı yüksektir (p<0.01). 67
68 100% 90% 80% 70% 60% 50% 40% 30% 20% 10% 0% Seröz Müsinöz Lateralite Unilateral Bilateral Şekil 18: Seröz-Müsinöz Tümör Gruplarına Göre Lateralite Dağılımı Seröz tümör (%69,6) ile Müsinöz tümör (%58,3) olgularında over yüzey tutulumu görülme oranları arasında istatistiksel olarak anlamlı bir farklılık bulunmamaktadır (p>0.05). Seröz tümör (%44,2) ile Müsinöz tümör (%12,5) olgularında, appendiks tutulum pozitifliği görülme oranları arasında, istatistiksel olarak anlamlı bir farklılık bulunmamaktadır (p>0.05). Seröz tümör ve Müsinöz tümör olgularında histolojik grade dağılımları arasında, istatistiksel olarak anlamlı bir farklılık bulunmamaktadır (p>0.05). Seröz tümör (%55,2) ile Müsinöz tümör (%44,4) olgularında omentum tutulum pozitifliği görülme oranları arasında, istatistiksel olarak anlamlı bir farklılık bulunmamaktadır (p>0.05). Seröz tümör (%26,3) ve Müsinöz tümör (%14,3) olgularında, lenf nodu pozitifliği görülme oranları arasında, istatistiksel olarak anlamlı bir farklılık bulunmamaktadır (p>0.05). Serözlerde tümör asit pozitifliği (%57,4) görülme oranı, müsinöz tümör olgulardan (%14,3) istatistiksel olarak anlamlı düzeyde yüksektir (p<0.05). 68
69 100% 90% 80% 70% 60% 50% 40% 30% 20% 10% 0% Seröz Müsinöz Asit Negatif Pozitif Şekil 19: Seröz ve Müsinöz Tümör Gruplarına Göre Asit Dağılımı Tablo 14: Seröz ve Müsinöz Tümörlerin c-erbb-2, p53 ve COX-2 ile Değerlendirmeleri Seröz (n=69) Müsinöz (n=16) P c-erbb-2 p53 COX 2 n (%) n (%) Negatif 66 (%95,7) 12 (%75,0) Pozitif 3 (%4,3) 4 (%25,0) Negatif 15 (%21,7) 5 (%31,3) Pozitif 54 (%78,3) 11 (%68,8) Negatif 34 (%49,3) 6 (%37,5) Pozitif 35 (%50,7) 10 (%62,5) 0,007** 0,419 0,395 Ki-kare testi kullanıldı ** p<0.01 Seröz tümörlerde c-erbb-2 pozitifliği (%4,3) oranı; Müsinöz tümörlerden (%25) istatistiksel olarak ileri düzeyde anlamlı düşüktür (p<0.01). 69
70 100% 90% 80% 70% 60% 50% 40% 30% 20% 10% 0% Seröz Müsinöz CERB B2 Negatif Pozitif Şekil 20: Seröz ve Müsinöz Tümör Gruplarına Göre c-erbb-2 Dağılımı Seröz tümör olguları (%78,3) ile Müsinöz tümör olgularında (%68,8) p53 pozitifliği oranları arasında istatistiksel olarak anlamlı bir farklılık bulunmamaktadır (p>0.05). Seröz tümör olguları (%50,7) ile Müsinöz tümör olgularında (%62,5) COX 2 pozitifliği oranları arasında istatistiksel olarak anlamlı bir farklılık bulunmamaktadır (p>0.05). 70
71 Tablo 15: Seröz tümörlerde c-erbb-2, p53 ve COX-2 ye Göre Frekans Dağılımı Vaka Sayısı c-erbb-2 p53 COX-2 N n (%) n (%) n (%) < (%2.6) 31(%79.4) 20(%51,3) Yaş Evre Lateralite Over Yüzey Tutulumu Appendiks Tutulumu Histolojik Grade Omentum Tutulumu Lenf Nodu Metastazı (%6.7) 23(%76.7) 15(%50 ) P Erken evre 13 1(%7,7) 11(%84.7) 8(%61.5) Đleri evre 44 2(%4.5) 31(%70.5) 20(%45.5) P Unilateral 18-16(%88.9) 9(%50.0) Bilateral 51 3(%6.0) 38(%74,5) 26(%51.0) P Negatif 21 1(%4.8) 20(%95.2) 12(%57.1) Pozitif 48 2(%4.2) 34(%70.8) 23(%47.9) P Negatif 24-20(%87.0) 13(%54.2) Pozitif 19 2(%10.5) 11(%57.9) 9(%47.4) P Az diferansiye 3-3(%100) - Orta diferansiye 40 2(%5.0) 30(%75.0) 21(%52.5) Đyi diferansiye 14 1(%7.1) 9(%64.3) 7(%50.0) P Negatif 26 1(%3.8) 22(%84.7) 14(%53.8) Pozitif 32 2(%6.3) 21(%65.6) 14(%43.8) P Negatif 28 1(%3.6) 22(%78.6) 16(%57.1) Pozitif 10-4(%40.0) 4(%40.0) P Negatif 23 1(%4.5) 22(%95.6) 12(%52.2) Asit Pozitif 31 2(%6.4) 19(%61.3) 12(%38.7) P
72 Tablo 16: Müsinöz tümörlerin Grubunda c-erbb-2, p53 ve COX-2 ye Göre Frekans Dağılımı Vaka Sayısı c-erbb-2 p53 COX-2 n n (%) n (%) n (%) < (%23.1) 8(%61.5) 7(%53.9) Yaş Evre Lateralite Over Yüzey Tutulumu Appendiks Tutulumu Histolojik Grade Omentum Tutulumu Lenf Nodu Metastazı (%33.3) 3(%100) 3(%100)) p Erken evre 5 2(%40.0) 4(%80.0) 3(%60)) Đleri evre 3-2(%66.7) 2(%66.7)) p Unilateral 13 4(%30.8) 8(%61.5) 7(%53.9)) Bilateral 3-3(%100.0) 3(%100.0 p Negatif 8 3(%37.5) 5(%62.5) 5(%62.5) Pozitif 8 1(%12.5) 6(%75.0) 5(%62.5) p Negatif 7 3(%42.9) 6(%75.0) 6(%75.0) Pozitif 1-1(%100) 1(%100) p Az diferansiye 2-1(%50.0) 1(%50.0) Ortadiferansiye 5 2(%40.0) 5(%100) 3(%60)) Đyi diferansiye (%100) p Negatif 5 3(%60)) 5(%100) 4(%80)) Pozitif 4-3(%75.0) 3(%75.0)) p Negatif 6 3(%50.0) 6(%100) 4(%66.7)) Pozitif 1-1(%100) 1(%100)) p Negatif 6 1(%16.7) 4(%66.7)) 3(%50.0) Asit Pozitif 1-1(%100) 1(%100) p
73 Tablo 17: Seröz Ve Müsinöz Karsinom Grubunda c-erbb-2, p53 ve COX-2 ye Göre Frekans Dağılımı Vaka Sayısı c-erbb-2 p53 COX-2 n n (%) n (%) n (%) < (%8,6) 25 (%71,4) 16 (%48,5) Yaş (%6,7) 23 (%76,7) 17 (%53,1) p ,779 0,459 Erken evre 18 3 (%16,7) 15 (%83,3) 11 (%61,1) Evre Lateralite Over Yüzey Tutulumu Appendiks Histolojik Grade Omentum Lenf Nodu Metastazı Asit Đleri evre 47 2 (%4,3) 33 (%70,2) 22 (%46,8) p ,357 0,408 Unilateral 16 2 (%12,5) 12 (%75,0) 7 (%43,8) Bilateral 49 3 (%6,1) 36 (%73,5) 26 (%53,1) p ,574 Negatif 13 3 (%23,1) 12 (%92,3) 8 (%61,5) Pozitif 52 2 (%3,8) 36 (%69,2) 25 (%48,1) p 0,051 0,157 0,537 Negatif 26 2 (%7,7) 21 (%80,8) 16 (%61,5) Pozitif 20 2 (%10,0) 12 (%60,0) 10 (%50,0) p ,187 0,552 Az diferansiye 5-4 (%80,0) 1 (%20,0) Orta diferansiye 45 4 (%8,9) 35 (%77,8) 24 (%53,3) Đyi diferansiye 15 1 (%6,7) 9 (%60,0) 8 (%53,3) p ,378 0,358 Negatif 23 3 (%13,0) 19 (%82,6) 13 (%56,5) Pozitif 34 2 (%5,9) 22 (%64,7) 15 (%44,1) p 0,384 0,229 0,424 Negatif 27 3 (%11,1) 21 (%77,8) 15 (%55,6) Pozitif 11-5 (%45,5) 5 (%45,5) p 0,542 0,068 0,724 Negatif 20 2 (%10,0) 19 (%95,0) 11 (%55,0) Pozitif 31 2 (%6,5) 19 (%61,3) 12 (%38,7) p 0,640 0,008 0,388 73
74 65 karsinom olgusunun 5 inde (%7,7) c-erbb-2 pozitif boyanma görüldü. 48 olguda (%73,8) p53 pozitif boyanmıştır. 33 (%50,8) olguda COX 2 pozitif boyanmıştır. 55 yaş altı olguların 3 ünde (%9,1) c-erbb-2 (+) iken, 55 yaş üzeri olguların %6,3 ünde c-erbb-2 (+) idi. 55 yaş altı olguların %72,7 sinde p53 (+) iken, 55 yaş üzeri olguların %75 inde p53 boyanması pozitif idi. 55 yaş altı olguların %48,5 inde COX 2 boyanması pozitif iken, 55 yaş üzeri olguların %53,1 inde COX 2 boyanması pozitifti. Erken evrede olan olguların %16,7 sinde c-erbb-2 (+) iken, ileri evre olan olguların %4,3 ünde c-erbb-2 (+) idi. Erken evre olan olguların %83,3 ünde p53 (+) iken, ileri evre olan olguların %70,2 sinde p53 boyanması pozitif idi. Erken evre olan olguların %61,1 inde COX 2 boyanması pozitif iken, ileri evre olguların %46,8 inde COX 2 boyanması pozitifti. Unilateral olan olguların %12,5 inde c-erbb-2 (+) iken; bilateral olan olguların %6,1 inde c-erbb-2 pozitif boyanmıştır. Unilateral olan olguların %75 inde p53 (+) iken, bilateral olan olguların %73,5 inde p53 boyanması pozitif idi. Unilateral olan olguların %43,8 inde COX 2 boyanması pozitif iken, bilateral olan olguların %53,1 inde COX 2 boyanması pozitifti. Over yüzey tutulumu negatif olan olguların %23,1 inde c-erbb-2 (+) iken, over yüzey tutulumu pozitif olan olguların %3,8 inde c-erbb-2 (+) idi. Over yüzey tutulumu negatif olan olguların %92,3 ünde p53 (+) iken, pozitif olan olguların %69,2 sinde p53 boyanması pozitif idi. Over yüzey tutulumu negatif olan olguların %61,5 inde COX 2 boyanması pozitif iken, pozitif olguların %48,1 inde COX 2 boyanması pozitifti. Appendiks tutulumu negatif olan olguların %7,7 sinde c-erbb-2 (+) iken, pozitif olan olguların %10 unda c-erbb-2 pozitif boyanmıştır. Appendiks tutulumu negatif olan olguların %80,8 inde p53 pozitif boyanmış, tutulum 74
75 pozitif olan olguların %60 ında p53 pozitif boyanmıştır. Appendiks tutulum negatif olan olguların %61,5 inde COX 2 pozitif boyanmış, pozitif olan olguların %50 sinde COX 2 pozitif boyanmıştır. Az diferansiye olan olguların hiçbirinde c-erbb-2 pozitif boyanmazken; orta diferansiye olan olguların %8,9 unda ve iyi diferansiye olan olguların %6,7 sinde c-erbb-2 pozitif boyanmıştır. Az diferansiye olan olguların %80 inde, orta diferansiye olan olguların %77,8 inde ve iyi diferansiye olan olguların %60 ında p53 pozitif boyanmıştır. Az diferansiye olan olguların %20 sinde, orta diferansiye olan olguların %53,3 ünde ve iyi diferansiye olan olguların %53,3 ünde COX-2 pozitif boyanmıştır. Omentum tutulumu negatif olan olguların %13 ünde ve pozitif olan olguların %5,9 unda c-erbb-2 pozitif boyanmıştır. Omentum negatif olan olguların %82,6 sında P53 pozitif boyanmış, pozitif olan olguların %64,7 sinde p53 pozitif boyanmıştır. Omentum tutulum negatif olan olguların %56,5 inde COX 2 pozitif boyanmış, pozitif olan olguların %44,1 inde COX 2 pozitif boyanmıştır. Lenf nodu metastazı negatif olan olguların %11,1 inde c-erbb-2 pozitif boyanırken; pozitif olan olguların hiçbirinde c-erbb-2 pozitif boyanmamıştır. Lenf nodu metastazı negatif olan olguların %77,8 inde p53 pozitif boyanmış, pozitif olan olguların %45,5 inde p53 pozitif boyanmıştır. Lenf nodu metastazı negatif olan olguların %55,6 sında COX 2 pozitif boyanmış, pozitif olan olguların %45,5 inde COX 2 pozitif boyanmıştır. Asit negatif olan olguların %10 unda ve pozitif olan olguların %6,5 inde c-erbb-2 pozitif boyanmıştır. Asit negatif olan olguların %95 inde p53 pozitif boyanmış, pozitif olan olguların %61,3 ünde p53 pozitif boyanmıştır. Asit negatif olan olguların %55 inde COX 2 pozitif boyanmış, pozitif olan olguların %38,7 sinde COX 2 pozitif boyanmıştır. 75
76 Tablo 18: Borderline Grubunda c-erbb-2, p53 ve COX-2 ye Göre Frekans Dağılımı Vaka Sayısı c-erbb-2 p53 COX-2 n n (%) n (%) n (%) Yaş Lateralite Over Yüzey Tutulumu Appendiks Omentum Lenf Nodu Metastazı Asit < (%5,9) 14 (%82,3) 10 (%64,7) (%33,3) 3 (%100) 1 (%33,3) p ,537 Unilateral 15 2 (%13,3) 12 (%80,0) 9 (%60,0) Bilateral 5-5 (%100) 3 (%60,0) p Negatif 16 1 (%6,2) 13 (%81,25) 9 (%56,2) Pozitif 4 1 (%25) 4 (%100) 3 (%66,7) p Negatif 5 1 (%20) 5 (%100) 3 (%60,0) Pozitif p Negatif 8 1 (%12,5) 8 (%100) 5 (%62,5) Pozitif 2-2 (%100) 2 (%100) p Negatif 7 1 (%14,3) 7 (%100) 5 (%71,4) Pozitif p Negatif 9-7 (%77,8) 4 (%44,4) Pozitif 1-1 (%100) 1 (%100) p borderline olgusunun 2 sinde (%10) c-erbb-2 pozitif boyanma görüldü. 17 olguda (%85) p53 pozitif boyanmıştır. 12 (%60) olguda COX 2 pozitif boyanmıştır. 76
77 55 yaş altı olguların (%6,3) ve 55 yaş üzeri olguların (%25) 1 inde c-erbb-2 (+) idi. 55 yaş altı olguların %81,3 ünde p53 (+) iken, 55 yaş üzeri olguların hepsinde p53 boyanması pozitif idi. 55 yaş altı olguların %62,5 inde COX 2 boyanması pozitif iken, 55 yaş üzeri olguların %50 inde COX 2 boyanması pozitifti. Unilateral olan olguların %13,3 ünde c-erbb-2 (+) iken; bilateral olan olguların hiçbirinde c-erbb-2 pozitif boyanmamıştır. Unilateral olan olguların %80 inde p53 (+) iken, bilateral olan olguların %100 ünde p53 boyanması pozitif idi. Unilateral olan olguların %60 ında COX 2 boyanması pozitif iken, bilateral olan olguların da %60 ında COX 2 boyanması pozitifti. Over yüzey tutulumu negatif ve pozitif olan olguların hiçbirinde c-erbb-2 pozitif boyanmamıştır. Over yüzey tutulumu negatif olan olguların %92,3 ünde p53 (+) iken, over yüzey tutulumu pozitif olan olguların %100 ünde p53 boyanması pozitif idi. Over yüzey tutulumu negatif olan olguların %53,8 inde COX 2 boyanması pozitif iken, over yüzey tutulumu pozitif olan olguların %66,7 sinde COX 2 boyanması pozitifti. Appendiks tutulumu negatif olan 5 olgunun 1 inde (%20) c-erbb-2 (+) iken, %100 ünde p53 (+) ve %60 ında COX 2 pozitif boyanmıştır. Omentum tutulumu negatif olan olguların 1 inde (%12,5) c-erbb-2 pozitif boyanırken; omentum tutulumu pozitif olan olguların hiçbirinde c-erbb-2 pozitif boyanmamıştır. Omentum tutulumu negatif ve pozitif olan olguların %100 ünde p53 boyanması pozitif idi. Omentum tutulumu negatif olan olguların %62,5 inde COX 2 boyanması pozitif iken, omentum tutulum pozitif olan olguların %100 ünde COX 2 boyanması pozitifti. Lenf nodu metastazı negatif olan 7 olgunun 1 inde (%14,3) c-erbb-2 (+) iken, %100 ünde p53 (+) ve %71,4 ünde COX 2 pozitif boyanmıştır. Asit negatif ve pozitif olan olguların hiçbirinde c-erbb-2 pozitif boyanmamıştır. Asit negatif olan olguların %77,8 inde p53 (+) iken, asit pozitif olan 1 olguda da p53 boyanması pozitif idi. Asit negatif olan olguların 77
78 %44,4 ünde COX 2 (+) iken, asit pozitif olan 1 olguda da COX 2 boyanması pozitiftir. Tablo 19: Borderline ve Malign Seröz vemüsinöz Tümörlerde c-erbb-2, p53 ve COX-2 belirteçlerinin karşılaştırmalı değerlendirilmesi Pozitiflik n (%) c-erbb-2 7 (%8,2) + p p53 65 (%76,5) 0,001** COX 2 45 (%52,9) c-erbb-2-p53 ++ p 0,001** c-erbb-2-cox 2 ++ p 0,001** p53-cox 2 ++ p 0,002** + Cochran Q Test ++ Mc Nemar Test ** p<0.01 c-erbb-2, p53 ve COX 2 boyanmalarından elde edilen pozitif boyanma yüzdeleri arasında istatistiksel olarak ileri düzeyde anlamlı farklılık bulunmaktadır (p<0.01). c-erbb-2 pozitif boyanma oranı (%8,2), p53 (%76,5) ve COX-2 nin (%52,9) pozitif boyanma oranlarından ileri düzeyde anlamlı düşüktür (p<0.01). COX-2 nin pozitif boyanma oranı (%52,9), p53 ten (%76,5) ileri düzeyde anlamlı düşüktür (p<0.01). 78
79 Tablo 20 : Borderline tümörlerde p53 ve c-erbb-2 c-erbb-2 N Pozitif Negatif Pozitif P53 p>0.05 Negatif Toplam Tablo 23: Malign tümörlerde p53 ve c-erbb-2 Tablo 22: Borderline tümörlerde p53 ve COX-2 N COX-2 Pozitif Negatif P53 Pozitif Negatif Toplam p>0.05 P53 n c-erbb-2 Pozitif Negatif Pozitif Negatif Toplam p>0.05 Tablo 25: Malign tümörlerde p53 ve COX-2 Tablo 24: Malign tümörlerde COX-2 ve c-erbb-2 Tablo 21 : Borderline tümörlerde COX-2 ve c-erb-2 n c-erbb-2 Pozitif Negatif Pozitif COX- Negatif p> Toplam COX- 2 c-erbb-2 n Pozitif Negatif Pozitif Negatif Toplam p>0.05 COX-2 n Pozitif Negatif Pozitif P53 Negatif Toplam p>0.05 Tablo 26: Seröz tümörlerde COX-2 ve c-erbb-2 c-erbb-2 N Pozitif Negatif Pozitif P53 p>0.05 Negatif Toplam Tablo 27 :Seröz tümörlerde p53 ve c-erbb-2 n c-erbb-2 Pozitif Negatif COX-2 Pozitif p>0.05 Negatif Toplam Tablo 28: Seröz tümörlerde p53 ve COX-2 N COX-2 Pozitif Negatif P53 Pozitif Negatif Toplam p>0.05 Tablo 29: Müsinöz tümörlerde p53 ve c-erbb-2 P53 c-erbb-2 n Pozitif Negatif Pozitif Negatif p>0.05 Toplam Tablo 30: Müsinöz tümörlerde p53 vecox-2 COX-2 N Pozitif Negatif Pozitif P53 p>0.05 Negatif Toplam i Tablo 31: Müsinöz tümörlerde COX-2ve p53 COX- 2 c-erbb-2 n Pozitif Negatif Pozitif Negatif Toplam p>
80 Tablo 32: Seröz borderline tümörlerde p53 ve c-erbb-2 Tablo 34: Seröz borderline tümörlerde p53 ve COX-2 P53 N - COX-2 Pozitif Negatif Pozitif Negatif Tablo 33: Seröz borderline tümörlerde COX-2 ve c-erbb-2 c-erbb-2 n Pozitif Negatif c-erbbn 2 Poz itif Neg atif Pozitif P53 2 Negati f Toplam COX- 2 Toplam Pozitif Negatif Tablo 35::Müsinöz borderline tümörlerde p53 ve c-erbb-2 P53 n c-erbb-2 Pozitif Negatif Pozitif Negatif Toplam p>0.05 Toplam Tablo 36 :Müsinöz borderline tümörlerde COX-2 ve c-erbb-2 COX-2 Toplam c-erbb-2 N Pozitif Negatif Pozitif Negatif p>0.05 Tablo 38: Seröz karsinomlarda p53 ve c-erbb-2 P53 c-erbb-2 N Pozitif Negatif Pozitif Negatif Toplam p>0.05 Tablo 37: Müsinöz borderline tümörlerde p53 ve COX-2 COX-2 n Pozitif Negatif P53 Pozitif Negatif Toplam p>0.05 Tablo 39:Seröz karsinomlarda COX-2 ve c-erbb-2 COX- 2 c-erbb-2 n Pozitif Negatif Pozitif Negatif Toplam p>0.05 Tablo 41: Müsinöz karsinomlarda p53 ve c-erbb-2 Tablo 40:Seröz karsinomlarda p53 ve COX-2 COX-2 N Pozitif Negatif Pozitif P53 Negatif p>0.05 P53 n c-erbb-2 Pozitif Negatif Pozitif Negatif Toplam p>0.05 Toplam Tablo 43: Müsinöz karsinomlarda p53 ve COX-2 Tablo 42: Müsinöz karsinomlarda COX-2 ve c-erbb-2 COX- 2 n c-erbb-2 Pozitif Negatif Pozitif Negatif Toplam p>0.05 COX-2 n Pozitif Negatif Pozitif P53 Negatif Toplam p>
81 Tablo :44 81
82 TARTIŞMA Benign ve malign over neoplazileri arasındaki ilişki tam olarak bilinmemektedir. Benign veya borderline tümörlerin invaziv kansere dönüşümü olabileceği gibi bunların tamamen farklı antiteleri yansıttığı ve invaziv karsinoma ilerlemeyeceğide düşünülmüştür (63). Over karsinomlarının patogenezinde ve progresyonunda rol oynadığı düşünülen bazı biyolojik faktörler araştırmaya başlanmış ve bazıları üzerinde yoğunlaşılmıştır. Ferrandina ve ark. 51 borderline, 26 benign ve 37 malign over kanserinde; Đmmünohistokimyasal olarak COX-2 çalışmış ve 51 borderline over tümörü vakasından 34'ünde (% 66,7) COX-2 pozitif bulunmuşlardır. Benign vakaların % 50 sinde, malign over tümörlerin %51,3 COX-2 pozitif tespit edilmiş olup fark anlamlı bulunmamıştır. 24 seröz borderline tümörün 24'ünde (%100) COX- 2 pozitif olup borderline müsinöz tümörlerden oldukça yüksektir. 26 müsinöz borderline tümörün 9'unda (%34.6) COX-2 pozitif olup fark anlamlı bulunmuştur. Seröz benign tümörlerde de COX-2 pozitifliği %81.8'i (9/11), müsinöz benign tümörlerden yüksek ( %26.7'si (4/15) ) olup aralarındaki fark anlamlı bulunmuştur. Seröz karsinomlarda %48.3 (14/29) ve müsinöz karsinomlarda %62.5 (5/8) COX-2 pozitif olup fark anlamlı bulunmamıştır. Borderline over tümörlerinde ortalama yaş 35 (14-80 arası) olarak tespit edilmiş ve 7/51 %13.3 vakada mikroinvazyon gözlenmiştir. COX-2 immünboyanma değerleri seröz tümörlerde müsinöz tümörlerden anlamlı olarak yüksek tespit edilmiştir. Seröz borderline over tümörlerinde COX-2 ile yaş, hastalığın evresi ve primer tümörün çapı arasında ilişki saptanmamıştır. Müsinöz tümörlerde ise COX-2 ile tümör çapı arasında ters yönde ilişki saptanmıştır (64). 82
83 Çalışmamızda da benzer olarak borderline over tümörlerinde COX-2 pozitifliği, malign olgulardan yüksektir. Borderline primer epitelyal over tümörlerinde COX-2 pozitifliği 12 (%60) olguda, malign 33 (%50,8) olguda COX 2 pozitif pozitif boyanmış olup aralarında anlamlı fark bulammıştık. Çalışmamızda benzer olarak seröz karsinomlarda % 49.1, müsinöz karsinomlarda %62.5 oranında COX-2 pozitif olup farkı istatistiksel olarak anlamlı değildir. Bizim çalışmamızda farklı olarak müsinöz tümörlerde COX-2 ekspresyonunu, seröz tümörlerden daha yüksek oranda tespit ettik. Seröz tümörlerin %50,7 si, müsinöz tümörlerin ise %62,5 i COX-2 pozitif olup farkı istatistiksel olarak anlamlı değildir. Evre ile COX-2 pozitifliği arasında anlamlı bir ilişki saptamadık, seröz borderline tümörlerde %58.3, müsinöz borderline tümörlerde %62.5 oranında COX-2 pozitifliği saptadık. Çalışmamızda borderline tümörlerde ortalama yaş 43,6 (23-68) idi. Ferrandina ve arkadaşları over kanserlerinde COX-2 pozitivitesinin prognostik anlamı olmadığını düşünmüşlerdir (64). Evre III-IV olan 76 over kanseri vakasında yaptıkları çalışmada 36/76 (%47.4) vakada COX-2 pozitifliği saptamışlardır. 2/2 (%100) müsinöz karsinomda COX-2 pozitif, 28/57 (%49.1) seröz karsinomda COX-2 pozitifliği bulmuşlardır. COX-2 pozitifliği ile yaş, FIGO evre, asit varlığı veya yokluğu arasında ilişki gözlememişlerdir. Bu çalışmada ortalama yaş 57 (27-81 arası) bulunmuştur (65). Çalışmamızda dört evredeki over kanserleri değerlendirilmiş olup, seröz kanserlerde benzer COX-2 pozitifliği bulmamıza rağmen müsinöz kanserlerde bu oran daha düşük saptanmıştır. COX-2 pozitifliği ile yaş, FIGO evre, lenf nodu tutulumu, omentum ve appendiks metastazı, asit varlığı veya yokluğu arasında ilişki gözlemedik. 83
84 Denkert ve ark.'nın 117 epitelyal over tümörünü içeren çalışmasında, over karsinomlarında 36/86 (%42) vakada COX-2 pozitif, low malign potansiyelli tümörlerde 7/19 (%37) vakada COX-2 pozitif bulunmuştur. COX-2 pozitifliği ile histolojik tip, Lenf nodu metastazı, FIGO evre, histolojik grade ve tanı anında yaş ile ilişki saptanmamıştır (66). Matsumo ve ark.'nın 28 over kanserinden oluşan çalışmalarında vakaların %79'unda COX-2 immünreaktivitesi saptanmış, bunların %61'i güçlü pozitif, %18'i ise zayıf pozitif olarak değerlendirilmiştir. Borderline tümörlerin 14/21'i (%66.7) COX-2 pozitif ve benign kistadenomların 4/8'i (%50) COX-2 pozitif saptanmıştır. Over karsinomlarındaki COX-2 pozitifliği benign kistadenomlardan anlamlı olarak yüksek bulunmuştur (67). Ali-Fehmi ve ark. 117 ileri evre ve yüksek grade seröz over karsinomu vakasında yaptıkları çalışmada %32 düşük ve %68 yüksek COX-2 ekspresyonu saptamışlardır. COX-2 ekspresyonu ile hasta yaşı ve FIGO evre arasında ilişki saptanmamıştır (68). Lou ve ark.'nın 70 over karsinomu vakasında yaptıkları çalışmada vakaların %60'ında COX-2 pozitif bulmuşlardır. COX-2 ekspresyonu ile lenf nodu metastazı olan over kanserleri arasında anlamlı ilişki saptamışlardır. Histopatolojik tip, klinik evre, histolojik grade ve tanı anındaki yaş ile ilişki saptanmamıştır (69). Çalışmamızda lenf nodu metastazlı olgularla COX-2 arasında ilişki saptamadık. Li ve ark. 83'ü primer, 54'ü metastatik olmak üzere toplam 137 epitelyal over kanseri hastasında yaptıkları çalışmada immünohistokimyasal olarak COX- 1 ve COX-2'yi araştırmışlardır. 97/137 (%70.8) hastada COX-2 pozitif olup 84
85 53/83 (%63.9) primer tümörde COX-2 pozitif olarak değerlendirilmiştir. 5 müsinöz karsinomda da (%100) COX-2 pozitifliği saptanmıştır. COX-2 immün boyanması ile tümör grade'i, proliferatif aktivite, cerrahi sırasındaki hasta yaşı arasında ilişki saptanmamıştır (70). Çalışmamızda COX-2 pozitifliğini daha düşük bulduk ve müsinöz karsinomlu 5 olguda %62.5 oranında COX-2 pozitifliği saptadık. COX-2 immünreaktivitesi ile primer over kanserleri arasında ilişki saptamadık. Raspollini ve ark. kanser gelişiminde önemli rolü olduğunu düşündükleri COX-2 ve ĐNOS (indicuible nitrix oxid synthase) ile yaptıkları çalışmada 78 stage III over seröz kanserli vakaların %69'unu COX-2 pozitif olarak değerlendirmiştir. Bu vakalarda ĐNOS ve COX-2 ile FIGO stage, cerrahi sonrası residueal hastalık ve beklenen yaşam süresi arasında anlamlı ilişki saptanmıştır. ĐNOS ve COX-2 ekspresyonlarının değerlendirmesinin over kanserli hastalarda klinik sonuçları içeren ek prognostik bilgiler verebileceği düşünülmüştür (71). Çalışmamızda farklı olarak seröz kanserlerde COX-2 ekspresyonu daha düşük tespit ettik ve FIGO stage arasında anlamlı ilişki bulamadık. Tang ve ark.'nın 33 seröz over karsinomu, 10 borderline seröz over tümörü, 11 benign seröz over tümörü ve 10 normal over dokusundan oluşan çalışmalarında, 27/33 (%82) seröz over karsinomu vakasında, 9/10 (%90) borderline seröz tümörde COX-2 pozitif bulunmuştur. Malign ve borderline tümörlerdeki COX-2 pozitivitesi oranı overin benign seröz tümörleri ve normal over dokusundan istatistiksel olarak yüksek bulunmuştur. COX-2 ile klinik evre, histolojik grade, asit veya lenfatik metastaz ile ilişki saptanmamıştır (72). Biz de çalışmamızda benzer olarak borderline seröz tümörlerde COX-2 pozitifliğini, seröz karsinomlardan daha yüksek bulduk fakat aralarında anlamlı ilişki tespit etmedik. 85
86 Birçok araştırmacı over kanserleri ve borderline tümörler ile seröz ve müsinöz tümörler arasında COX-2 ekspresyonu yönünden farklı sonuçlar tespit etmişler. Bazen aynı çalışmacının farklı iki çalışmasında COX-2 pozitifliği farklı bulunmuştur (64, 65). Bizim çalışmamızda seröz ve müsinöz tümörler ile malign ve borderline tümörlerin COX-2 ekspresyonu yönünden anlamlı ilişki tespit etmedik. Bu tümörler ile evre, yaş, lenf nodu metastazı, over yüzey tutulumu, histolojik grade, omentum tutulumu ve batın sıvısı pozitifliği yönünden COX-2 ekspresyonu arasında anlamlı ilişki bulamadık. Yapılan bu çalışmalardaki farklılıklar vaka sayısına, immünöhistokimyasal yöntem ve değerlendirme farklılığına bağlı olabilir. Tümör baskılayıcı gen p53 ün mutasyonları, tümör hücresi çekirdeğinde nonfonksiyonel protein artışına, apoptozisin gerçekleşmemesine ve bu transforme hücrelerin öncelikle çoğalmasına neden olur. Over karsinomunda p53 gen mutasyonu sıklıkla izlenir ve immünohistokimyasal olarak saptanmasının prognostik öneme sahip olduğu gösterilmiştir (73). Lee H. ve meslektaşlarının çalışmalarında overin borderline tümörlerin %32 sinde p53 immünreaktivitesi, tümör hücrelerinin %50 sinden azında görülmüştür. p53 ekspresyonu malign tümörlerde, borderline ve benign tümörlere oranla anlamlı derecede yüksek çıkmıştır. Ayrıca müsinöz borderline tümörlerde seröz olanlara göre daha yüksek saptanmıştır (74). Henriksen R. ve arkadaşları çalışmalarında, over tümörleri ile birlikte normal overde de p53 ekspresyonunu incelemişlerdir. p53 ekspresyonu, borderline ve malign tümörlerde saptanırken, benign over tümörlerinde ve normal over dokusunda saptamamışlardır (50). 86
87 Caduf RF ve arkadaşlarının yaptığı çalışmada malign over tümörlerinde diffuz p53 immünreaktivitesi, borderline tümörlerden daha yüksektir. Bir çalışma da malign tümörlerde %44, borderline tümörlerde %8 p53 pozitifliği görülürken, bu oran invaziv seröz karsinomlarda %62 olarak saptanmıştır (75). Over kanserlerinde p53 ekspresyonunu araştıran en geniş çalışmalardan birisi Estrid V.S ve arkadaşlarının yaptığı 774 vakalı MALOVA (malign ovarian cancer study) çalışmasıdır. Low malign potansiyelli over tümörlerinde %13, over karsinomlarında %48 oranında p53 ekspresyonunu saptanmıştır (76). Bizim çalışmamızda borderline tümörlerde, malign tümörlerden daha yüksek oranda p53 ekspresyonunu mevcut olup, aralarında anlamlı bir ilişki bulunmamaktadır. Cho EY. ve arkadaşlarının çalışmalarında, seröz over tümörlerinde, yüksek mutasyon seviyeleri ve p53 overekspresyonu karsinomlarda bildirilmiş ancak borderline tümörlerde nadir olarak saptanmıştır (47). Bizim çalışmamızda malign epitelyal tümörlerin %73.8 inde ve borderline epitelyal tümörlerin %85 inde p53 immünreaktivitesi gözlenmiş olup, aralarında istatiksel olarak anlamlı bir fark saptanmamıştır. Fauvet R. ve arkadaşlarının yaptığı çalışmalarda, seröz tümörlerde p53 mutasyonu, borderline tümörlerde nadir, invaziv olanlarda sık; müsinöz tümörlerde ise p53 mutasyonu hem invaziv hemde borderline tümörlerde nadir olarak izlenmiştir (77). Çalışmamızda seröz ve müsinöz malign ve borderline p53 overekspresyon oranlarını, seröz karsinomlarda %73.7, müsinöz karsinomlarda %75, borderline seröz tümörlerde % 100, borderline müsinöz tümörlerde %62.5 olarak saptadık. Seröz tümörler ile müsinöz tümörler arasındaki fark istatiksel olarak anlamlı değildi. 87
88 Epitelyal over tümörlerinde appendiks, omentum ve over yüzey tutulumu olmayan olgularda p53 ekspresyonu, appendiks, omentum ve over yüzey tutulumu olan olgulardan daha yüksekti ve aralarındaki ilişkiyi anlamlıydı ( p<0.05). Çalışmamızda epitelyal over tümörlerinde lenf nodu metastazı pozitif ve asit pozitif olan tümörlerde p53 ekspresyonu lenf nodu metastazı negatif ve asit negatif olgularda düşük olup, aralarındaki ilişkiyi anlamlı saptadık. Litertürde bu alanda yeterli çalışma bulunmamaktadır. Erkinheimo ve ark. 442 seröz over karsinomu örneğinde immünohistokimyasal olarak COX-2 ve p53 çalışmışlar ve 310/442 (%70) hastada COX-2 pozitif saptanmıştır. COX-2 pozitifliği ile >57 yaş, yüksek histolojik grade, ile ilişkili bulunmuştur. COX-2 ile evre arasında saptanmayıp, COX-2 pozitifliği ile p53 pozitifliği arasında ilişki olduğunu görmüşlerdir. Bu çalışmada median yaş 57 (15-88) olarak bulunmuştur (78). Shigemasa ve ark.'nın 86 over adenokarsinomu ve 6 normal over dokusundan oluşan çalışmalarında adenokarsinomların %31,4'ünde COX-2 pozitif ve %30.2'sinde p53 pozitif bulmuşlardır. COX-2 ekspresyonu endometrioid adenokarsinomlarda, müsinöz ve clear cell adenokarsinomlardan belirgin olarak yüksek tespit edilmiştir. p53 ekspresyonu seröz adenokarsinomlarda clear cell adenokarsinomlardan belirgin yüksek gözlenmiş olup p53 ile evre arasında anlamlı ilişkili bulunmuştur. COX-2 ekspresyonu ile klinik evre arasında ilişki saptanmamıştır. COX-2 ve p53 arasında anlamlı ilişki bulunmamıştır (79). Çalışmamızda malign tümörlerin %50.8 inde COX-2 pozitif, %73.8 inde p53 pozitif saptadık. Erken evre olan olguların %83,3 ünde p53 (+) iken, ileri evre olan olguların %70,2 sinde p53 boyanması pozitif idi Evre ile p53 pozitifliği arasında bir ilişki saptamadık. 88
89 Seo ve ark.'nın 35'i seröz, 18'i müsinöz, 11'i endometrioid tipte olmak üzere toplam 64 epitelyal over kanseri hastasında yaptıkları çalışmada 30/46 (%65.2) oranında nonmüsinöz vakada COX-2 pozitifliği saptamışlardır. Seröz karsinomların %71.4'ü COX-2 pozitif ve 18 müsinöz over kanserinin %5.6'sı COX-2 pozitif olarak değerlendirilmiştir. COX-2 pozitifliği histolojik tip, ileri evre, tümör grade'i ve asit varlığı ile ilişkili bulunmuştur. Seröz ve endometrioid tümörlerde COX-2 pozitifliği ileri evre ve asit varlığı ile ilişkili bulunmuştur, fakat tümör grade'i ile ilişki saptanmamıştır. Ancak COX-2 pozitifliği ile p53 pozitifliği arasında anlamlı ilişkili bulunmuştur. p53 pozitifliği ile klinikopatolojik faktörler arasında ilişki saptanmamıştır. Bu çalışmada median yaş 51 (18-75 arası) olarak bulunmuştur (80). Çalışmamızda 5 müsinöz karsinom vakasında da COX-2 pozitif saptadık. 57 seröz karsinom vakasında ise %49.1 oranında COX-2 pozitifliği izledik. 69 seröz tümörde %50.7, 16 müsinöz tümörde %62.5 oranında COX-2 pozitif olup farkı istatistiksel olarak anlamlı bulmadık. Bizim çalışmamızda yaş, evre, lateralite, over yüzey tutulumu, appendiks, histolojik grade, omentum, lenf nodu metastazı ve batın sıvısı parametrelerinde COX-2 pozitifliği görülme oranları arasında istatistiksel olarak anlamlı bir farklılık bulunmamaktadır. Benzer olarak çalışmamızda da epitelyal over tümörlerinde COX-2 nin pozitif (% 52 9) boyanma oranını, p53 ten (%76,5) ileri düzeyde anlamlı düşük bulunmuştur. COX-2 ekspresyonu ile p53 ekspresyonu arasında anlamlı ilişki saptanmıştır. 89
90 Lee J.S ve ark. 54 malign 23 borderline over tümöründe yaptıkları çalışmada COX-2 ekspresyonu over karsinomlarında (%77), borderline over tümörlerinden (%26,1) anlamlı derecede yüksektir (p<0,001). p53 ekspresyonu over karsinomlarında % 64.8, borderline tümörlerde %4,31 olup önemli oranda yüksektir; fakat klinikopatolojik özellikler ile COX-2 ve p53 ekspresyonları arasında anlamlı ilişki bulunamamıştır (8). Biz çalışmamızda farklı olarak borderline seröz ve müsinöz tümörlerde COX-2 ekspresyonu (%60), overin seröz ve müsinöz kanserlerinden (% 50,8) daha yüksek olup aralarında korelasyon görülmemiştir. Ayrıca p53 ekspresyonu borderline tümörlerde de (%85), over kanserlerinden (%73,8) daha yüksek ve aralarında anlamlı ilişki yoktu. Đyi tanımlanmış bir protoonkogen olan c-erbb-2 nin artmış ekspresyonu over ve meme kanserlerinde agresif davranış ve kötü prognozla ilişkili olarak bilinmektedir (55). c-erbb-2 ekspresyonu over karsinomlarında, benign tümör ve normal over epiteline göre belirgin olarak yüksek bulunmuştur. Ayrıca ileri evre karsinom olgularında c-erbb-2 ekspresyonunun artırdığı bildirilmektedir. Tanner ve arkadaşlarının çalışmasında, tüm evrelerdeki over karsinomları göz önüne alındığında c-erbb-2 nin prognostik bir parametre olmadığı gösterilmiştir. Bu çalışmada, c-erbb-2 ekspresyonunun sadece evre III ve IV olgularda ortalama sağ kalım süresini kısalttığı ileri sürülmüştür. Aynı zamanda c-erbb-2 ekspresyonu fazla olan over kanserlerinin kemoterapiye dirençli olduğu ve kötü yanıt verdiği kabul edilmektedir (81).Matias ve arkadaşları over karsinomlarının benign veya borderline tümörlerin progresyonu ile oluştuğunu ve c-erbb-2 nin tümör progresyonunda rol oynadığını ileri sürmüşlerdir (82). Over kanserlerinde; c-erbb-2 gen ekspresyonu yanısıra, diğer genetik değişikliklerin, tümörün biyolojik özellikleri ve kişisel faktörlerle birlikte etki gösterdiği ve prognozu belirlediği düşünülmektedir (83, 84 85). 90
91 Tapia C. ve arkadaşları 120 den fazla farklı tümörde c-erbb-2 boyanmasını araştırmışlardır farklı tümörde immünohistokimyasal ve floresan insitu hibridizasyon yöntemiyle örnekler çalışılmış ve c-erbb-2 overekspresyonu (skor 2/3 +) ve en sık meme tümöründe izlemiştir. Mesane tümöründe %6.7, mide tümöründe %4.9, endometrium tümöründe %6.8, akciğer tümöründe %3.1 ve over tümörlerinde %1.2 overekspresyon izlenmiştir. 42 seröz karsinom vakasının %2,4 skor 1+, %2,4 skor 2/3+ olarak izlenmiştir (86). Yaptığımız çalışmada 57 seröz karsinomda %5.3 skor 2/3+ boyanma ile daha yüksek bir seviyede ekspresyon tespit ettik. Tuefferd M. Ve arkadaşları multisentrik jinekolojik çalışmada 320 over karsinomlu hastada c-erbb-2 ekspresyonunu araştırmışlardır. c-erbb-2 overekspresyonu 21 vakada (skor 2/3 +) olarak tespit edilmiştir (%6,6). Bizim çalışmamızda da benzer olarak 65 karsinom olgusunun 5 inde (%7,7) c-erbb-2 ile pozitif boyanma görüldü. Literatürde c-erbb-2 ekspresyonu ile over karsinomlarında %8 ile % 66 arasında geniş bir aralık bulunmaktadır (87). Özkal ve arkadaşları yaşları arasında değişen ortalama yaşı 43.8 olan 102 primer epitelyal over tümörlerinden oluşan bir seride çalışma yapmışlardır. c-erbb-2 benign tümörlerin 17 sinde (%44,7) zayıf ve 2 sinde (%5,3) kuvvetli boyanma göstermiştir. Borderline tümörlerde ise olguların 8 inde (%76,6) ve malign tümörlerde olguların tümünde (%100) c-erbb-2 ekspresyonu olduğu görülmüştür. Ayrıca malign tümörlerde ileri evre ve yüksek derece olgularda c-erbb-2 ekspresyonunun belirgin olarak farklılık gösterdiği bulunmuştur. Düşük dereceli olguların 8 inde (%61,5) yüksek dereceli olguların ise tümünde (n=15) kuvvetli boyanma görülmüştür (88). Bizim çalışmamızda c-erbb-2 ile borderline tümörlerin 2 sinde (%10) kuvvetli boyanma izlendi. Seröz ve müsinöz karsinom 5 olguda (%7,7) kuvvetli boyanma görüldü ve c-erbb-2 pozitifliği oranları arasında istatistiksel olarak anlamlı bir farklılık bulunmadı 91
92 Rosaria M. Ve arkadaşları yaşları arasında değişen, yaş ortalaması 59.4 olan FIGO stage III ve histolojik grade III 44 seröz over karsinomunda c-erbb-2 çalışmışlardır. 7 vakada 1+, (%15,9), 4 vakada 3+ (%9) boyanma görmüşlerdir. Fakat 2+ izlememişlerdir (89). Çalışmamızda 57 seröz over karsinomun 3 ünde (%5,3) skor 2/3+pozitif boyanma saptadık. Erken evrede olan olguların 1 inde (%7.7) c-erbb-2 (+) iken, ileri evre olan olguların %4.5 inde c-erbb-2 (+) idi. Seröz ve müsinöz over tümörlerinin c-erbb-2 ekspresyonunun karşılaştırılması ile ilgili literatürlere ulaşamamıza rağmen, yaptığımız çalışmada c-erbb-2 ekspresyonunu müsinöz tümörlerde (%25), seröz tümörlerden (%4,3) yüksek olup arasındaki farkı anlamlı bulduk. Steffensen K.D. ve ark. over karsinomlu 160 hastada FIGO stage (IIB-IV) hastada 10 yıldan fazla gözlem yapmışlardır. Over karsinomlu 32 vakada (%20) COX-2 ekspresyonu saptamışlardır. COX-2 pozitifliği FIGO stage, grade, rezidüel tümör volümü ile korelasyon gösterirken; c-erbb-2, yaş ve histopatolojik tip ile anlamlı bir ilişki saptamamışlardır. Az diferansiye tümörlerde COX-2 ekspresyonu düşük, iyi diferansiye tümörlerde COX-2 ekspresyonu yüksek olup aralarındaki ilişki anlamlı bulunmuştur. c-erbb-2 ile %64,4 ünde 0, %24,4 ünde 1+, % 6,9 unda 2+ ve %4,4 ünde 3+ boyanma tespit etmişlerdir. c-erbb-2 ekspresyonu ile yaş, residüel tümör volümü, ve COX-2 ekspresyonu arasında belirgin bir korelasyon görülmemiştir. c-erbb-2 ekspresyonu FIGO stage, grade ve histopatolojik tip arasında anlamlı ilişki bulunmuştur (6). Over kanserlerinde c-erbb-2/cox-2 koekspresyonu Erkinheioma tarafından araştırılmış ve over karsinomlarında yükselmiş COX-2 ekspresyonu ve c-erbb-2 amplifikasyonu arasında anlamlı ilişki bulmuştur. Buna karşın Ferrandina ise over kanserlerinde COX-2/ c-erbb-2 ekspresyonu arasında korelasyon saptamamışlardır (6). 92
93 Çalışmamızda epitelyal over tümörlerinde c-erbb-2, p53 ve COX 2 boyanmalarından elde edilen pozitif boyanma yüzdeleri arasında istatistiksel olarak ileri düzeyde anlamlı farklılık bulunmaktadır. c-erbb-2 pozitifliği (%8,2), COX-2 pozitifliği (52,9) ve p53 pozitifliği (%76,5) dır. Literatürdeki sonuçlara benzer olarak, seröz tümörlerde bilateral görülme oranını (%73,9), müsinöz tümör olgularından (%18,7); malign tümörlerdeki bilateralite görülme oranını (%75,4), borderline olgulardan (%25) istatistiksel olarak ileri düzeyde anlamlı yüksek bulmamız literatür bulgularıyla uyumludur (5, 19, 20). Malign epitelyal over tümörleri ileri yaşlarda görülmektedir. Çalışmamızda malign olguların 55 yaş ve üzerinde olma oranı (%49,2), borderline tümörlerden (%20) istatistiksel olarak yüksek olup arasındaki farkı literatür bilgileriyle de benzerlik gösteren şekilde anlamlı bulduk (1, 20). Çalışmamızda malign epitelyal over tümörlerinde over yüzey tutulumu, omentum tutulumu ve asit pozitifliği,borderline tümörlerden daha yüksek ve aralarındaki ilişkiyi anlamlı tespit ettik. Ancak bu konuda literatür bilgilerine ulaşamadık. Seröz tümörlerde ileri evre ve asit pozitifliği, müsinöz tümörlerden daha yüksek orandaydı ve aralarındaki ilişki anlamlıydı. 93
94 SONUÇ Bu çalışmada overin borderline seröz ve müsinöz tümörleri ile malign seröz ve müsinöz epitelyal tümörlerinde c-erbb-2, p53 ve COX-2 ekspresyon paternlerini araştırmak; her bir belirteçin primer histopatolojik parametrelerle ilişkisini sorgulamak; farklı histopatolojik ve prognostik özelliklerdeki olgu gruplarında c-erbb-2, p53 ve COX-2 ekspresyonlarını birbiri ile karşılaştırmak; elde edilecek bulgu ve sonuçlarla, güncel literatür bilgileri ışığında, over karsinogenez teorilerini tartışmak amaçlandı. Ocak 2004-Mayıs 2008 tarihleri arasında Dr.Lütfi Kırdar Kartal Eğitim ve Araştırma Hastanesi Kadın Doğum Kliniğinde over tümörü nedeniyle opere edilen ve arasında Dr.Lütfi Kırdar Kartal Eğitim ve Araştırma Hastanesi Patoloji Kliniğinde tanı almış 85 olgu çalışma kapsamına alındı. *Tümör hücrelerinde c-erbb-2 ekspreyonu müsinöz tümörlerde (%25), seröz tümörlerden (%4,3) yüksek olup arasındaki farkı anlamlı bulduk (p<0.01). *Epitelyal over tümörlerinde p53 pozitifliği (%76,5) COX-2 pozitifliği (52,9) ile arasında anlamlı bir ilişki saptadık ( p<0.02). *Epitelyal over tümörlerinde p53 ekspresyonu ile lenf nodu metastazı, batın sıvısı pozitifliği, over yüzey tutulumu, appendiks tutulumu ve omentum tutulumu arasında negatif korelasyon saptadık ( p<0.05). *Epitelyal over tümörlerinde c-erbb-2, p53 ve COX 2 boyanmalarından elde edilen pozitif boyanma yüzdeleri arasında istatistiksel olarak ileri düzeyde anlamlı farklılık bulunmaktadır (p<0.01). c-erbb-2 pozitifliği (%8,2), COX-2 pozitifliği (52,9) ve p53 pozitifliği (%76,5) dır. 94
95 *Malign, borderline, seröz ve müsinöz tümör hücrelerinde p53 ekspresyonu ile yaş, bilateralite, histolojik grade ve tümör evresi arasında istatistiksel olarak anlamlı bir ilişki saptanmadı (P>0,05). *Malign, borderline, seröz ve müsinöz tümör hücrelerinde COX-2 ve c-erbb-2 ekspresyonu ile yaş, lateralite, histolojik grade, tümör evresi, lenf nodu tutulumu, over yüzey tutulumu, appendiks tutulumu ve batın sıvısı pozitifliği arasında istatistiksel olarak anlamlı bir ilişki saptanmadı (P>0,05). COX-2 ekspresyonunun, birçok malignitede metastaz ve kötü prognoz ile ilişkili olduğu ve over tümörlerinde nüks ve sağkalımı belirlemede prognostik değeri olduğu bildirilmiştir. Daha önce yapılan çalışmalarda araştırmacılar over karsinomlarında COX-2 ekspresyonunu %20 ile %83 gibi geniş bir aralıkta saptamışlardır. Çalışmamızda COX-2 ekspresyonunu over kanserlerinde % 50,8 olarak bulduk. Çalışılan farklı populasyonlar ve kullanılan farklı metodlar bu çelişkiyi açıklayabilir. Kullanılan çeşitli antikorlar, COX-2 için farklı bir skorlama sistemi ve bir çok çalışma az vakayla yapılmış olup (100 örnekten küçük) bu da karşılaştırmayı zorlaştırmışdır. Literatürde c-erbb-2 oran çeşitliliği geniştir. Çünkü farklı yöntemler kullanılmıştır. c-erbb-2 nin over kanserlerinde prognostik değerini gösteren raporlar olmasına rağmen, bir çok çalışmada klinik sonuçları desteklememektedir. c-erbb-2 ekspresyonunun prognozda farklı etkileri ve farklı inceleme yöntemlerine ek olarak, belki de farklı histolojik tiplerin prognozda etkisi olabilir. Sonuç olarak bizim çalışmamızda müsinöz olgularda c-erbb-2 pozitifliği, seröz olgulardan istatistiksel olarak ileri düzeyde anlamlı yüksek olması bu belirteçin literatür bilgileri ışığında bağımsız bir prognostik faktör olabileceğini düşündürmektedir. 95
96 COX 2 ekspresyonunun tümör hücre proliferasyonu ile anjiogenezis ve apoptozisin supresyonu ile bağlantılıdır. p53 tümör supressor geni ise genetik hasarlı hücrelerin kontrolünde apoptozun tetiklenmesini sağlayarak tümöral süreçlerin sınırlandırılmasında etkili olur. Protoonkogen olan c-erbb-2 ekspresyonu ise tümör hücre büyümesi, motilite, hücre proliferasyonunu ve apoptozisinde rol alır. Over tümörlerinde günümüze değin yapılan birçok çalışmada prognoz üzerindeki etkileri her yönüyle bilinen over yüzey tutulumu, batın sıvısı pozitifliği, lenf nodu tutulumu başta olmak üzere TNM sınıflaması ve tümöre ait histopatolojik paremetrelerdir. Literatürde prognozu belirlemek ve tedavi yaklaşımlarını daha iyi planlayabilmek amacıyla son yıllarda çok sayıda moleküler ajan ilgi odağı olmuş ve bu çalışmalarda farklı ve çelişkili sonuçlar bildirilmiştir. COX-2, p53 ve c-erbb-2 beliteçlerindeki moleküler değişikliklerin biyolojik mekanizmasının daha iyi anlaşılması, over kanser tedavileri için yeni bir yol açabileceği gibi, over tümörlerinde bağımsız prognostik faktör olabileceğini düşünmekteyiz. Daha geniş serilerle yapılacak çalışmalardan elde edilecek sonuçların, hastaların prognozunu ve tedavi seçeneklerini belirlemede bize ışık tutacağını düşünmekteyiz. 96
97 RESĐMLER Resim 1: Borderline seröz tümörde COX-2 immünreaktivitesi (COX-2X400) Resim 2: Borderline müsinöz tümörde COX-2 immünreaktivitesi (COX-2X400) 97
98 Resim 3: Overin seröz karsinomunda COX-2 immünreaktivitesi (COX-2X400) Resim 4: Overin müsinöz karsinomunda COX-2 immünreaktivitesi (COX-2X400) 98
99 Resim 5: Borderline seröz tümörde p53 immünreaktivitesi (p53x200) Resim 6: Borderline müsinöz tümörde p53 immünreaktivitesi ( p53x400) 99
100 Resim 7: Overin seröz karsinomunda p53 immünreaktivitesi (p53x200) Resim 8: Overin müsinöz karsinomunda p53 immünreaktivitesi (p53x400) 100
101 Resim 9: Overin seröz karsinomunda 2+cerbB 2 immünreaktivitesi (c-erbb-2x200) 101
102 Resim 10: Overin (c-erbb-2x200) müsinöz karsinomunda 3+ c-erbb-2 immünreaktivitesi Resim 11: Borderline müsinöz tümörde 3+ c-erbb-2 immünreaktivitesi (c-erbb-2x100) 102
T.C. Sağlık Bakanlığı Đstanbul Eğitim ve Araştırma Hastanesi Patoloji Bölümü Şef: Doç. Dr. Erol Rüştü Bozkurt
 T.C. Sağlık Bakanlığı Đstanbul Eğitim ve Araştırma Hastanesi Patoloji Bölümü Şef: Doç. Dr. Erol Rüştü Bozkurt KLĐ ĐĞĐMĐZDE TA I ALA GASTROĐ TESTĐ AL VE PA KREATĐK ÖROE DOKRĐ TÜMÖRLERĐ PROG OSTĐK PARAMETRELER
T.C. Sağlık Bakanlığı Đstanbul Eğitim ve Araştırma Hastanesi Patoloji Bölümü Şef: Doç. Dr. Erol Rüştü Bozkurt KLĐ ĐĞĐMĐZDE TA I ALA GASTROĐ TESTĐ AL VE PA KREATĐK ÖROE DOKRĐ TÜMÖRLERĐ PROG OSTĐK PARAMETRELER
T.C TRAKYA ÜNİVERSİTESİ TIP FAKÜLTESİ İÇ HASTALIKLARI ANABİLİM DALI TIBBİ ONKOLOJİ BİLİM DALI. Dr. İrfan ÇİÇİN. Tez Yöneticisi Doç. Dr.
 T.C TRAKYA ÜNİVERSİTESİ TIP FAKÜLTESİ İÇ HASTALIKLARI ANABİLİM DALI TIBBİ ONKOLOJİ BİLİM DALI Tez Yöneticisi Doç. Dr. Hakan KARAGÖL HORMON RESEPTÖRÜ NEGATİF VE HER-2 NEGATİF MEME KANSERLİ HASTALARLA HORMON
T.C TRAKYA ÜNİVERSİTESİ TIP FAKÜLTESİ İÇ HASTALIKLARI ANABİLİM DALI TIBBİ ONKOLOJİ BİLİM DALI Tez Yöneticisi Doç. Dr. Hakan KARAGÖL HORMON RESEPTÖRÜ NEGATİF VE HER-2 NEGATİF MEME KANSERLİ HASTALARLA HORMON
NODAL DİFFÜZ BÜYÜK B- HÜCRELİ LENFOMA
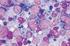 T.C. Sağlık Bakanlığı İstanbul Eğitim ve Araştırma Hastanesi Patoloji Kliniği Şef: Doç. Dr. Erol Rüştü Bozkurt NODAL DİFFÜZ BÜYÜK B- HÜCRELİ LENFOMA OLGULARINDA ZAP-70 EKSPRESYONUNUN MORFOLOJİK VARYANT
T.C. Sağlık Bakanlığı İstanbul Eğitim ve Araştırma Hastanesi Patoloji Kliniği Şef: Doç. Dr. Erol Rüştü Bozkurt NODAL DİFFÜZ BÜYÜK B- HÜCRELİ LENFOMA OLGULARINDA ZAP-70 EKSPRESYONUNUN MORFOLOJİK VARYANT
KÜÇÜK HÜCRELİ AKCİĞER KANSERİNDE TEDAVİ ÖNCESİ PROGNOSTİK FAKTÖRLER VE TEDAVİ SONUÇLARI
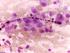 T.C. SAĞLIK BAKANLIĞI DR. LÜTFİ KIRDAR KARTAL EĞİTİM VE ARAŞTIRMA HASTANESİ GÖĞÜS HASTALIKLARI KLİNİĞİ DOÇ. DR. BENAN ÇAĞLAYAN KÜÇÜK HÜCRELİ AKCİĞER KANSERİNDE TEDAVİ ÖNCESİ PROGNOSTİK FAKTÖRLER VE TEDAVİ
T.C. SAĞLIK BAKANLIĞI DR. LÜTFİ KIRDAR KARTAL EĞİTİM VE ARAŞTIRMA HASTANESİ GÖĞÜS HASTALIKLARI KLİNİĞİ DOÇ. DR. BENAN ÇAĞLAYAN KÜÇÜK HÜCRELİ AKCİĞER KANSERİNDE TEDAVİ ÖNCESİ PROGNOSTİK FAKTÖRLER VE TEDAVİ
İNTRAKRANYAL YER KAPLAYICI LEZYONLARIN AYIRICI TANISINDA MR SPEKTROSKOPİNİN YERİ
 T.C. SAĞLIK BAKANLIĞI ŞİŞLİ ETFAL EĞİTİM VE ARAŞTIRMA HASTANESİ RADYOLOJİ KLİNİĞİ Şef. Doç. Dr. MUZAFFER BAŞAK İNTRAKRANYAL YER KAPLAYICI LEZYONLARIN AYIRICI TANISINDA MR SPEKTROSKOPİNİN YERİ Radyoloji
T.C. SAĞLIK BAKANLIĞI ŞİŞLİ ETFAL EĞİTİM VE ARAŞTIRMA HASTANESİ RADYOLOJİ KLİNİĞİ Şef. Doç. Dr. MUZAFFER BAŞAK İNTRAKRANYAL YER KAPLAYICI LEZYONLARIN AYIRICI TANISINDA MR SPEKTROSKOPİNİN YERİ Radyoloji
EGE ÜNİVERSİTESİ BİLİMSEL ARAŞTIRMA PROJE KESİN RAPORU EGE UNIVERSITY SCIENTIFIC RESEARCH PROJECT REPORT
 EGE ÜNİVERSİTESİ BİLİMSEL ARAŞTIRMA PROJE KESİN RAPORU EGE UNIVERSITY SCIENTIFIC RESEARCH PROJECT REPORT PROJE NO: 2008- DİŞ- 003 (Doktora) TEDAVİSİ PLANLANMIŞ VİTAL SÜT DİŞİ PULPALARINDAKİ ENFLAMASYONUN
EGE ÜNİVERSİTESİ BİLİMSEL ARAŞTIRMA PROJE KESİN RAPORU EGE UNIVERSITY SCIENTIFIC RESEARCH PROJECT REPORT PROJE NO: 2008- DİŞ- 003 (Doktora) TEDAVİSİ PLANLANMIŞ VİTAL SÜT DİŞİ PULPALARINDAKİ ENFLAMASYONUN
TEDAVİ GÖRMÜŞ BAŞ BOYUN KANSERLİ HASTALARDA DİŞHEKİMİNİN YAKLAŞIMI
 T.C. Ege Üniversitesi Dişhekimliği Fakültesi Periodontoloji Anabilim Dalı TEDAVİ GÖRMÜŞ BAŞ BOYUN KANSERLİ HASTALARDA DİŞHEKİMİNİN YAKLAŞIMI BİTİRME TEZİ Stj. Dişhekimi Gülter Devrim AKYOL Danışman Öğretim
T.C. Ege Üniversitesi Dişhekimliği Fakültesi Periodontoloji Anabilim Dalı TEDAVİ GÖRMÜŞ BAŞ BOYUN KANSERLİ HASTALARDA DİŞHEKİMİNİN YAKLAŞIMI BİTİRME TEZİ Stj. Dişhekimi Gülter Devrim AKYOL Danışman Öğretim
Çalışmanın hastalığın erken teşhis ve tanısının konmasında izlenecek sağlık politikalarına yardımcı bilgiler vermesi beklenmektedir.
 1. GİRİŞ ve AMAÇ Pineal bez ve salgıladığı en önemli madde olarak bilinen melatonin son yıllarda gittikçe artan sayıda bilimsel araştırmaya konu olmuş ve olmaya devam edeceği düşünülmektedir. Melatonin
1. GİRİŞ ve AMAÇ Pineal bez ve salgıladığı en önemli madde olarak bilinen melatonin son yıllarda gittikçe artan sayıda bilimsel araştırmaya konu olmuş ve olmaya devam edeceği düşünülmektedir. Melatonin
AKUT FAZ REAKTANLARININ İSKEMİK İNMEDEKİ YERİ (CRP, Fibrinojen ve Seruloplazmin Düzeyleri)
 T.C. Sağlık Bakanlığı Okmeydanı Eğitim ve Araştırma Hastanesi Nöroloji Kliniği Klinik Şef Yrd.: Cihat ÖRKEN AKUT FAZ REAKTANLARININ İSKEMİK İNMEDEKİ YERİ (CRP, Fibrinojen ve Seruloplazmin Düzeyleri) (Uzmanlık
T.C. Sağlık Bakanlığı Okmeydanı Eğitim ve Araştırma Hastanesi Nöroloji Kliniği Klinik Şef Yrd.: Cihat ÖRKEN AKUT FAZ REAKTANLARININ İSKEMİK İNMEDEKİ YERİ (CRP, Fibrinojen ve Seruloplazmin Düzeyleri) (Uzmanlık
AKUT ROMATİZMAL ATEŞ TANISI ALAN HASTALARIN KLİNİK, EPİDEMİYOLOJİK VE LABORATUVAR YÖNÜNDEN DEĞERLENDİRİLMESİ
 T.C. SAĞLIK BAKANLIĞI Zeynep Kamil Kadın ve Çocuk Hastalıkları Eğitim ve Araştırma Hastanesi Çocuk Sağlığı ve Hastalıkları Kliniği Şef: Uzm. Dr. Feyza Yıldız AKUT ROMATİZMAL ATEŞ TANISI ALAN HASTALARIN
T.C. SAĞLIK BAKANLIĞI Zeynep Kamil Kadın ve Çocuk Hastalıkları Eğitim ve Araştırma Hastanesi Çocuk Sağlığı ve Hastalıkları Kliniği Şef: Uzm. Dr. Feyza Yıldız AKUT ROMATİZMAL ATEŞ TANISI ALAN HASTALARIN
ÇOCUKLUK ÇAĞI ÜRİNER SİSTEM İNFEKSİYONLARINA YOL AÇAN ETKENLERİN DAĞILIMI VE ANTİBİYOTİK DUYARLILIKLARININ ARAŞTIRILMASI
 T. C. Sağlık Bakanlığı Zeynep Kamil Kadın ve Çocuk Hastalıkları Eğitim ve Araştırma Hastanesi ŞEF: DOÇ.DR.ABDÜLKADİR BOZAYKUT ÇOCUKLUK ÇAĞI ÜRİNER SİSTEM İNFEKSİYONLARINA YOL AÇAN ETKENLERİN DAĞILIMI VE
T. C. Sağlık Bakanlığı Zeynep Kamil Kadın ve Çocuk Hastalıkları Eğitim ve Araştırma Hastanesi ŞEF: DOÇ.DR.ABDÜLKADİR BOZAYKUT ÇOCUKLUK ÇAĞI ÜRİNER SİSTEM İNFEKSİYONLARINA YOL AÇAN ETKENLERİN DAĞILIMI VE
Bizde Böbrek Kanseri var
 2011 Baskısı Böbrek Kanseri Derneği Sunar... Bizde Böbrek Kanseri var Hastalar ve aileleri için pratik bir rehber. Böbrek Kanseri Derneği KidneyCancer.org ÖNSÖZ Hastalar, aileleri ve bakıcıları için hazırlanmış
2011 Baskısı Böbrek Kanseri Derneği Sunar... Bizde Böbrek Kanseri var Hastalar ve aileleri için pratik bir rehber. Böbrek Kanseri Derneği KidneyCancer.org ÖNSÖZ Hastalar, aileleri ve bakıcıları için hazırlanmış
YENİ TANI KONMUŞ TİP I DİYABETLİ ÇOCUKLARDA PLAZMA GLUCAGON-LIKE PEPTIT 1 DÜZEYLERİNİN İNCELENMESİ
 T.C. ÇUKUROVA ÜNİVERSİTESİ TIP FAKÜLTESİ ÇOCUK SAĞLIĞI VE HASTALIKLARI ANABİLİM DALI YENİ TANI KONMUŞ TİP I DİYABETLİ ÇOCUKLARDA PLAZMA GLUCAGON-LIKE PEPTIT 1 DÜZEYLERİNİN İNCELENMESİ Dr. Abdi Burak USLU
T.C. ÇUKUROVA ÜNİVERSİTESİ TIP FAKÜLTESİ ÇOCUK SAĞLIĞI VE HASTALIKLARI ANABİLİM DALI YENİ TANI KONMUŞ TİP I DİYABETLİ ÇOCUKLARDA PLAZMA GLUCAGON-LIKE PEPTIT 1 DÜZEYLERİNİN İNCELENMESİ Dr. Abdi Burak USLU
ORTA SEREBRAL ARTER DAL İNFARKTLARINDA İSKEMİK MODİFİYE ALBUMİN DÜZEYİ VE PROGNOZLA İLİŞKİSİ
 T.C SAĞLIK BAKANLIĞI ŞİŞLİ ETFAL EĞİTİM VE ARAŞTIRMA HASTANESİ 1.NÖROLOJİ KLİNİĞİ DOÇ. DR. HULKİ FORTA ORTA SEREBRAL ARTER DAL İNFARKTLARINDA İSKEMİK MODİFİYE ALBUMİN DÜZEYİ VE PROGNOZLA İLİŞKİSİ Dr. Emel
T.C SAĞLIK BAKANLIĞI ŞİŞLİ ETFAL EĞİTİM VE ARAŞTIRMA HASTANESİ 1.NÖROLOJİ KLİNİĞİ DOÇ. DR. HULKİ FORTA ORTA SEREBRAL ARTER DAL İNFARKTLARINDA İSKEMİK MODİFİYE ALBUMİN DÜZEYİ VE PROGNOZLA İLİŞKİSİ Dr. Emel
EDİRNE ŞEHİR MERKEZİNDE Kİ SON TRİMESTER GEBELERİN SOSYODEMOGRAFİK ÖZELLİKLERİ, YAŞAM KALİTELERİ, KAYGI DÜZEYLERİ
 T.C. TRAKYA ÜNİVERSİTESİ TIP FAKÜLTESİ AİLE HEKİMLİĞİ ANABİLİM DALI Tez Yöneticisi Yrd. Doç.Dr. E. Melih ŞAHİN EDİRNE ŞEHİR MERKEZİNDE Kİ SON TRİMESTER GEBELERİN SOSYODEMOGRAFİK ÖZELLİKLERİ, YAŞAM KALİTELERİ,
T.C. TRAKYA ÜNİVERSİTESİ TIP FAKÜLTESİ AİLE HEKİMLİĞİ ANABİLİM DALI Tez Yöneticisi Yrd. Doç.Dr. E. Melih ŞAHİN EDİRNE ŞEHİR MERKEZİNDE Kİ SON TRİMESTER GEBELERİN SOSYODEMOGRAFİK ÖZELLİKLERİ, YAŞAM KALİTELERİ,
İskemik İnme ve Akut Faz Reaktanları
 ARŞİV 2010; 19: 85 İskemik İnme ve Akut Faz Reaktanları Uzm.Dr. Mustafa ŞAHAN * Doç.Dr. Salim SATAR ** Doç.Dr. A. Filiz KOÇ *** Doç.Dr. Ahmet SEBE **** İnme olarak tanımlanan serebrovasküler hastalıklar
ARŞİV 2010; 19: 85 İskemik İnme ve Akut Faz Reaktanları Uzm.Dr. Mustafa ŞAHAN * Doç.Dr. Salim SATAR ** Doç.Dr. A. Filiz KOÇ *** Doç.Dr. Ahmet SEBE **** İnme olarak tanımlanan serebrovasküler hastalıklar
SENDROMLU HASTALARDA ÜRODİNAMİ BULGULARI
 T.C. SAĞLIK BAKANLIĞI BAKIRKÖY DR. SADİ KONUK EĞİTİM ve ARAŞTIRMA HASTANESİ ÜROLOJİ KLİNİĞİ Şef: Prof. Dr. Ali İhsan TAŞÇI KATEGORİ IIIB KRONİK PELVİK AĞRI SENDROMLU HASTALARDA ÜRODİNAMİ BULGULARI UZMANLIK
T.C. SAĞLIK BAKANLIĞI BAKIRKÖY DR. SADİ KONUK EĞİTİM ve ARAŞTIRMA HASTANESİ ÜROLOJİ KLİNİĞİ Şef: Prof. Dr. Ali İhsan TAŞÇI KATEGORİ IIIB KRONİK PELVİK AĞRI SENDROMLU HASTALARDA ÜRODİNAMİ BULGULARI UZMANLIK
ORTODONTİK DİŞ HAREKETLERİ VE ETKİ EDEN FAKTÖRLER. Elif ARSLAN BAĞIŞ DOKTORA SEMİNERİ. Danışman Prof. Dr. Tancan UYSAL
 T.C İZMİR KATİP ÇELEBİ ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ ORTODONTİK DİŞ HAREKETLERİ VE ETKİ EDEN FAKTÖRLER Elif ARSLAN BAĞIŞ DOKTORA SEMİNERİ Danışman Prof. Dr. Tancan UYSAL Diş Hekimliği Fakültesi
T.C İZMİR KATİP ÇELEBİ ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ ORTODONTİK DİŞ HAREKETLERİ VE ETKİ EDEN FAKTÖRLER Elif ARSLAN BAĞIŞ DOKTORA SEMİNERİ Danışman Prof. Dr. Tancan UYSAL Diş Hekimliği Fakültesi
LOMBER DİSK HERNİLİ HASTALARDA EGZERSİZ VE ELEKTRİK STİMÜLASYONUNUN ETKİNLİĞİ
 1 T.C. SAĞLIK BAKANLIĞI 70.YIL İSTANBUL FİZİK TEDAVİ VE REHABİLİTASYON EĞİTİM VE ARAŞTIRMA HASTANESİ LOMBER DİSK HERNİLİ HASTALARDA EGZERSİZ VE ELEKTRİK STİMÜLASYONUNUN ETKİNLİĞİ Uzmanlık Tezi Dr. F. Banu
1 T.C. SAĞLIK BAKANLIĞI 70.YIL İSTANBUL FİZİK TEDAVİ VE REHABİLİTASYON EĞİTİM VE ARAŞTIRMA HASTANESİ LOMBER DİSK HERNİLİ HASTALARDA EGZERSİZ VE ELEKTRİK STİMÜLASYONUNUN ETKİNLİĞİ Uzmanlık Tezi Dr. F. Banu
GENTAMİSİNLE NEFROTOKSİSİTE OLUŞTURULAN SIÇANLARDA L-ARGİNİNİN KORUYUCU ETKİSİ ÜZERİNE KATYONİK KOMPETİSYONUN OLASI KATKISI
 T.C. ÇUKUROVA ÜNİVERSİTESİ TIP FAKÜLTESİ FARMAKOLOJİ ANABİLİM DALI GENTAMİSİNLE NEFROTOKSİSİTE OLUŞTURULAN SIÇANLARDA L-ARGİNİNİN KORUYUCU ETKİSİ ÜZERİNE KATYONİK KOMPETİSYONUN OLASI KATKISI Dr. Perihan
T.C. ÇUKUROVA ÜNİVERSİTESİ TIP FAKÜLTESİ FARMAKOLOJİ ANABİLİM DALI GENTAMİSİNLE NEFROTOKSİSİTE OLUŞTURULAN SIÇANLARDA L-ARGİNİNİN KORUYUCU ETKİSİ ÜZERİNE KATYONİK KOMPETİSYONUN OLASI KATKISI Dr. Perihan
Cerrahi İşlem Öncesi Koagülasyon Testleri Bozuk Olan Hastada Ne Yapmalıyım?
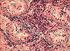 Cerrahi İşlem Öncesi Koagülasyon Testleri Bozuk Olan Hastada Ne Yapmalıyım? Dr. Mehmet ŞENCAN Cumhuriyet Üniversitesi Tıp Fakültesi Hematoloji Bilim Dalı Giriş Cerrahi işlemler sırasında hemostatik sistem
Cerrahi İşlem Öncesi Koagülasyon Testleri Bozuk Olan Hastada Ne Yapmalıyım? Dr. Mehmet ŞENCAN Cumhuriyet Üniversitesi Tıp Fakültesi Hematoloji Bilim Dalı Giriş Cerrahi işlemler sırasında hemostatik sistem
ÇOK DÜŞÜK DOĞUM AĞIRLIKLI RİSKLİ PREMATÜRELERİN SOMATİK GELİŞİMLERİNE ETKİ EDEN FAKTÖRLER
 T.C. SAĞLIK BAKANLIĞI BAKIRKÖY DOĞUMEVİ KADIN VE ÇOCUK HASTALIKLARI EĞİTİM VE ARAŞTIRMA HASTANESİ. ÇOK DÜŞÜK DOĞUM AĞIRLIKLI RİSKLİ PREMATÜRELERİN SOMATİK GELİŞİMLERİNE ETKİ EDEN FAKTÖRLER (UZMANLIK TEZİ)
T.C. SAĞLIK BAKANLIĞI BAKIRKÖY DOĞUMEVİ KADIN VE ÇOCUK HASTALIKLARI EĞİTİM VE ARAŞTIRMA HASTANESİ. ÇOK DÜŞÜK DOĞUM AĞIRLIKLI RİSKLİ PREMATÜRELERİN SOMATİK GELİŞİMLERİNE ETKİ EDEN FAKTÖRLER (UZMANLIK TEZİ)
Fotodinamik Tedavi. Uzm. Dr. Zekayi KUTLUBAY*, Uzm. Dr. Özer PEHLİVAN**, Doç. Dr. Burhan ENGİN*
 Fotodinamik Tedavi Uzm. Dr. Zekayi KUTLUBAY*, Uzm. Dr. Özer PEHLİVAN**, Doç. Dr. Burhan ENGİN* *İstanbul Üniversitesi Cerrahpaşa Tıp Fakültesi, Deri ve Zührevi Hastalıkları Anabilim Dalı **Serbest Dermatolog
Fotodinamik Tedavi Uzm. Dr. Zekayi KUTLUBAY*, Uzm. Dr. Özer PEHLİVAN**, Doç. Dr. Burhan ENGİN* *İstanbul Üniversitesi Cerrahpaşa Tıp Fakültesi, Deri ve Zührevi Hastalıkları Anabilim Dalı **Serbest Dermatolog
10. Sınıf BİYOLOJİ. Konu Anlatımlı BİYOLOJİ. Öğretim programında yaptığı son güncelleme doğrultusunda YENİDEN DÜZENLENMİŞTİR.
 10. Sınıf BİYOLOJİ Konu Anlatımlı Banu KARAAĞAÇ Bilgehan PERİ T.C MİLLİ EĞİTİM BAKANLIĞI Talim Terbiye Kurulu Başkanlığı BİYOLOJİ Öğretim programında yaptığı son güncelleme doğrultusunda YENİDEN DÜZENLENMİŞTİR.
10. Sınıf BİYOLOJİ Konu Anlatımlı Banu KARAAĞAÇ Bilgehan PERİ T.C MİLLİ EĞİTİM BAKANLIĞI Talim Terbiye Kurulu Başkanlığı BİYOLOJİ Öğretim programında yaptığı son güncelleme doğrultusunda YENİDEN DÜZENLENMİŞTİR.
Patoloji Dernekleri Federasyonu Baş-Boyun Patolojisi Çalışma Grubu
 Patoloji Dernekleri Federasyonu Baş-Boyun Patolojisi Çalışma Grubu Baş Boyun Lezyonları Patolojik Değerlendirme Standartları Ve Kılavuzları İçindekiler: 1- Kapsanan doku ve organlar 2- Temel Kaynak Değerlendirme
Patoloji Dernekleri Federasyonu Baş-Boyun Patolojisi Çalışma Grubu Baş Boyun Lezyonları Patolojik Değerlendirme Standartları Ve Kılavuzları İçindekiler: 1- Kapsanan doku ve organlar 2- Temel Kaynak Değerlendirme
İSTANBUL İLİNİN MALTEPE İLÇESİNDEKİ OKUL ÇOCUKLARINDA MİGREN VE GERİLİM TİPİ BAŞ AĞRISI PREVALANSI İLE KLİNİK ÖZELLİKLERİ
 T.C. Sağlık Bakanlığı Dr. Lütfi Kırdar Kartal Eğitim ve Araştırma Hastanesi Nöroloji Kliniği Klinik Şefi: Doç. Dr. Ülkü Türk Börü İSTANBUL İLİNİN MALTEPE İLÇESİNDEKİ OKUL ÇOCUKLARINDA MİGREN VE GERİLİM
T.C. Sağlık Bakanlığı Dr. Lütfi Kırdar Kartal Eğitim ve Araştırma Hastanesi Nöroloji Kliniği Klinik Şefi: Doç. Dr. Ülkü Türk Börü İSTANBUL İLİNİN MALTEPE İLÇESİNDEKİ OKUL ÇOCUKLARINDA MİGREN VE GERİLİM
HASTANEMİZİN İKİNCİ TRİMESTER GENETİK AMNİYOSENTEZ SONUÇLARI
 T.C. Sağlık Bakanlığı İstanbul Bakırköy Kadın Doğum ve Çocuk Hastalıkları Eğitim ve Araştırma Hastanesi HASTANEMİZİN İKİNCİ TRİMESTER GENETİK AMNİYOSENTEZ SONUÇLARI UZMANLIK TEZİ Dr. Gülseren Özşeker Rafioğlu
T.C. Sağlık Bakanlığı İstanbul Bakırköy Kadın Doğum ve Çocuk Hastalıkları Eğitim ve Araştırma Hastanesi HASTANEMİZİN İKİNCİ TRİMESTER GENETİK AMNİYOSENTEZ SONUÇLARI UZMANLIK TEZİ Dr. Gülseren Özşeker Rafioğlu
