Enzimatik bir reaksiyonun hızını etkileyen faktörler
|
|
|
- Turgay Akgün
- 6 yıl önce
- İzleme sayısı:
Transkript
1 1
2 Enzimatik bir reaksiyonun hızını etkileyen faktörler 1. Enzim konsantrasyonunun enzimatik reaksiyonların hızına etkisi Substratın çok bol olduğu bir ortamda optimal şartlarda enzimatik bir reaksiyonun ölçülen ilk hızı (V o ), enzim konsantrasyonu E ile doğru orantılıdır: 2
3 Esasen bir enzimatik tepkimenin hızı, tüm substrat konsantrasyonlarında enzim konsantrasyonu ile orantılı olarak değişir. Örneğin, enzim konsantrasyonu yarıya indiğinde tepkimenin başlangıç hızı da yarıya düşer. E + S ES E + P E + S E + P 3
4 Denge halinde, tepkimenin sağa doğru olan hızı (Hız 1 = k 1 E S ), sola doğru olan hıza (Hız 2 = k 2 E P ) eşittir: k 1 E S )=k 2 E P ) Buradan denge sabitinin K denge = k 1 /k 2 = P / S olduğu bulunur. Buna göre de denge halinde enzim konsantrasyonunun denge sabiti üzerine etkisi yoktur; enzimler hıza etki etmekle birlikte hız sabitlerini ve denge sabitlerini değiştirmezler. 4
5 Bir enzimin bir doku ekstratı veya biyolojik bir sıvı içindeki miktarını ölçmek için, örnek içinde bulunan enzimin katalize ettiği tepkimenin hızı ölçülür; ölçülen hız, var olan aktif enzimin miktarıyla doğru orantılıdır. 5
6 2. Substrat konsantrasyonunun enzimatik reaksiyonların hızına etkisi Enzim konsantrasyonu ve diğer bütün şartların sabit olduğu bir ortamda çok küçük bir substrat konsantrasyonunda, enzim moleküllerinin çoğu serbest kalır, ES kompleksi az miktarda oluşur ve dolayısıyla ürüne dönüşen substrat miktarı veya reaksiyonun hızı küçüktür. Substrat konsantrasyonunun belirli artışları ile enzim moleküllerinin yarısının serbest kalıp yarısının ES kompleksi oluşturduğu yarı maksimal hız (1/2 V max ) noktasına ulaşılır. 6
7 Substrat konsantrasyonunun belirli artışlarının devamında enzim moleküllerinin hepsinin ES kompleksi oluşturduğu bir noktada, reaksiyon hızı maksimumdur (V max ) ve bu noktadan sonra substrat konsantrasyonunun artışı ile reaksiyon hızı artmaz: 7
8 Enzim konsantrasyonu ve diğer bütün şartların sabit olduğu bir ortamda enzimatik tepkimenin hızı, substrat konsantrasyonunun artırılmasıyla başlangıçta doğrusal bir artış gösterir; fakat substrat ilave edildikçe hız giderek daha az artar ve belirli bir V max düzeyinde sabit kalır. 8
9 V max noktasındaki substrat konsantrasyonu enzimi doyuran ve bunun üzerinde her hangi bir değer olabileceğinden bunun ölçülmesi pratik olarak zordur. Buna karşılık enzimatik bir reaksiyonda enzim moleküllerinin yarısının substrata doyduğu ve böylece yarı maksimal hızın (1/2 V max ) gözlendiği noktadaki substrat konsantrasyonu ölçülebilir. 9
10 Bir enzimatik reaksiyonda enzim moleküllerinin yarısının substrata doyduğu ve böylece yarı maksimal hızın gözlendiği noktadaki substrat konsantrasyonuna Michaelis-Menten sabiti denir ve K m ile gösterilir. 10
11 Bir enzim için K m (Michaelis-Menten sabiti), enzim ile verilen substratın karşılıklı etkileşimlerini karakterize eden bir sabit sayıdır. K m enzim konsantrasyonundan bağımsız bir değerdir; maksimum hızın yarısına erişildiği andaki substrat konsantrasyonunu gösterir. 11
12 Enzimatik bir reaksiyon için K m, başlangıç hızını (V o ) substrat konsantrasyonunun ( S ) bir fonksiyonu kabul ederek, grafik çizmek suretiyle deneysel olarak saptanabilir: 12
13 Birçok enzim için K m, enzimin substratının fizyolojik konsantrasyonuna yakın bulunmuştur Enzimatik bir reaksiyon için V o, V max, K m ve S arasındaki ilişki, Michaelis-Menten denklemi denen eşitlikle ifade edilir: 13
14 Michaelis-Menten denklemi, enzimatik bir reaksiyon için başlangıç hızını (V o ) substrat konsantrasyonunun ( S ) bir fonksiyonu kabul ederek çizilen hiperbolik eğrinin matematiksel ifadesidir: 14
15 Michaelis-Menten denklemi, bir enzimin etkili olduğu reaksiyonda, substrat konsantrasyonuna göre ne şekilde davranacağını tanımlar: a) K m çok büyük, ( S K m den çok çok küçük ise, enzimatik reaksiyonun hızı substrat konsantrasyonuna bağlıdır ve hız substrat konsantrasyonu ile orantılı olarak değişir. Böyle reaksiyonlar, birinci dereceden reaksiyon olarak tanımlanırlar. 15
16 16
17 b) K m çok küçük, ( S K m den çok çok büyük) ise, enzimatik reaksiyonun hızı substrat konsantrasyonuna bağlı değildir; V=V max olur. Böyle reaksiyonlar sıfırıncı dereceden reaksiyon olarak tanımlanır. 17
18 c) K m S ye eşit ise, enzimatik reaksiyonun hızı substrat konsantrasyonuna bağlı değildir; 1/2V max değerine eşittir: 18
19 Michaelis-Menten denklemine göre; K m (Michaelis- Menten sabiti), enzimin substratına karşı olan ilgisini göstermektedir. K m değeri küçük olan enzim, substratı için yüksek bir affinite gösterir; enzim düşük bir substrat konsantrasyonunda doyarak maksimal hız sağlar. K m değeri 10 6 M (10 3 mm) ve daha düşük olan enzimler yüksek affiniteli enzimlerdir ki bunların metabolizmada büyük önemi vardır. 19
20 K m değeri büyük olan enzim, substratı için düşük bir affinite gösterir; enzimin yarı doygunluğa ulaşması için daha fazla substrat konsantrasyonu gerekmektedir. Bir enzim için K m değeri, enzim ile verilen substratın karşılıklı etkileşimini karakterize eden bir sabit sayıdır. 20
21 Michaelis-Menten denklemi bir hiperbolik eğrinin denklemi olduğundan ve hiperbolik eğrinin karakteristik noktalarını belirlemek zor olduğundan, bir enzime ait V max ve K m yi deneysel olarak incelemeyi kolaylaştırmak için grafiği doğrusal olan başka denklemler de önerilmiştir. Bunlardan Michaelis-Menten denklemini tersine çevirip çarpanlarına ayırmakla elde edilen Lineweaver-Burk denklemi, en sık kullanılanıdır: 21
22 22
23 3. ph ın enzimatik reaksiyonların hızı üzerine etkisi Enzimlerin aktiviteleri, H + iyonu konsantrasyonu veya ph değişmelerinden etkilenir. Çünkü; gerek enzimlerin aktif yerleri gerekse substratları, iyonizasyonu ph ın fonksiyonu olan asidik ve bazik gruplar içerir: 23
24 ph değişimi, enzimin aktif merkezinin iyonizasyonunu bozar ya da substrat molekülünün çözünürlüğünü değiştirerek enzim-substrat etkileşimi değiştirir. 24
25 Ayrıca ph değişimiyle katalitik olarak aktif olan enzimin amino asit zincirindeki iyonik karakter değiştiği için, enzim denatüre olarak katalitik aktivitesini kaybedebilir. 25
26 Her enzimin maksimum aktivite gösterdiği bir ph değeri vardır ki, bu ph değerine enzimin optimal ph değeri denir. Çeşitli enzimlerin optimum ph değerleri farklıdır. Bir enzimin aktivitesi, ph ı enzimin optimal ph ına eşit olan bir tampon çözelti içinde ölçülür. 26
27 4. Isı veya sıcaklığın enzimatik reaksiyonların hızı üzerine etkisi Bazı enzimler 100 o C sıcaklığa kadar oldukça yüksek ısıya birkaç dakika dayanabildikleri halde, enzimlerin çoğu o C gibi sıcaklıklarda denatüre olurlar. Ancak ısıya maruz kalma süresi çok önemlidir; örneğin oda sıcaklığında birkaç saatlik süre, 100 o C de birkaç saniyelik süreden daha yıkıcı etki yapar. Bu nedenle canlı dokulardan ekstrakte edilen enzimler, soğuk oda, buzdolabı, derin dondurucu gibi yerlerde saklanırlar. 27
28 Enzimatik reaksiyonların hızı, sıcaklık değişmelerinden etkilenir. Aktivasyon enerjisinin 50 kj/mol olduğu reaksiyonlarda sıcaklığın 25 o C den 35 o C ye yükseltilmesi, reaksiyon hızını iki kat artırır; aktivasyon enerjisinin 85 kj/mol olduğu reaksiyonlarda sıcaklığın 10 o C yükseltilmesi, reaksiyon hızını üç kat artırır. 28
29 Genel olarak sıcaklıkta her 1 o C artış %10 daha yüksek bir enzim aktivitesi sağlar. Sıcaklık artışıyla enzimatik reaksiyonun hızındaki artış, sıcaklık belli bir değere yükselinceye kadar devam eder; daha yüksek sıcaklıklarda enzim denatüre olarak aktivitesini kaybeder ve reaksiyon hızı azalır. 29
30 Enzim analizleri, 1 o C den daha büyük sıcaklık dalgalanmaları önlenerek yapılmalıdır. Enzimatik reaksiyonun hızının maksimum olduğu sıcaklık derecesine optimal sıcaklık denir. 30
31 Enzimlerin en büyük kısmı için optimal sıcaklık, ilgili enzimin bulunduğu hücre ortamının sıcaklığında veya onun biraz üzerinde olmak üzere o C dir. Doğal sıcak su kaynaklarında çoğalmak üzere adapte olan mikroorganizmalardan elde edilen enzimler, suyun kaynama noktasına yakın optimal sıcaklık gösterirler. 31
32 5. Zamanın enzimatik reaksiyonların hızı üzerine etkisi Bir enzim tarafından katalizlenen bir reaksiyonun hızı, zamanla azalır. Bunun sebebi, reaksiyon ürünlerinin kendi aralarında birleşerek aksi yönde bir reaksiyon meydana getirmeleri, enzimin zamanla inaktive olması, reaksiyonu önleyen maddelerin oluşması ve substratın tükenmesidir. 32
33 Enzimlerle yapılan ölçümler, çoğu kez substratın yaklaşık %10 kadarının kullanıldığı reaksiyonun başlangıç kısmında yapılır. 6. Işığın enzimatik reaksiyonların hızı üzerine etkisi Işık, enzimlerin aktivitesini artırır veya azaltır. 33
34 7. İyonların enzimatik reaksiyonların hızı üzerine etkisi Birçok enzim, aktiviteleri için metal iyonlarına gereksinim gösterirler. Metal iyonlarının katalitik fonksiyonları, çoğu kez karbonil bağındaki elektronlar veya alkollerdeki oksijen üzerinde bulunan elektron çiftleri gibi elektron çiftleriyle kompleks yaparak fonksiyonel grubu polarize etmek ve yönlendirmektir. Metal iyonlarının ayrıca yapısal fonksiyonu da vardır. 34
35 Metal iyonlarının enzimatik katalizde oynadıkları rol, beş mekanizma ile özetlenebilir: I) Metalloenzimlerdeki metal iyonları, katalize doğrudan katılırlar. Örneğin, sitokromlardaki demir iyonu değer değiştirerek elektron transportunda rol oynar. 35
36 II) Bir metal iyonu enzimde, biçimsel bir değişiklik yapar; aktif olan tersiyer veya kuarterner yapıyı sürdürmede rol oynar. Örneğin Zn 2+ iyonu, alkol dehidrojenazda aktif olan kuarterner yapıyı sürdürmede rol oynar. Enzime bir metalin eklenmesi aktif bir şekli inaktif şekle de çevirebilir. 36
37 III) Bir enzim için esas substrat, metal-substrat kompleksi (MS) olabilir; enzim ancak MS kompleksine bağlanabilir. Örneğin, birçok fosfat transferi reaksiyonlarında enzim için gerçek substrat, Mg 2+ -ATP 4 kompleksidir. 37
38 IV) Bir enzim metal ile, enzim-metal kompleksi (EM) oluşturduktan sonra substrata bağlanabilir ve EMS kompleksi üzerinden ürün oluşur. 38
39 V) Bir metal, ürün ile kompleks yapar ve ürünün tekrar substrata dönüşümünü engelleyerek reaksiyonu hızlandırabilir. Örneğin, trigliseridlerin lipaz ile parçalanmasında oluşan yağ asitleri, Ca 2+ iyonları ile çözünmeyen tuzlar halinde ortamdan uzaklaşınca lipaz stimüle olur. 39
40 Metaller, reaksiyona giren türlerin doğasını değiştirerek tüm reaksiyonun denge sabitini de değiştirirler. 40
41 8. Hormonlar ve diğer biyokimyasal faktörlerin enzimatik reaksiyonların hızı üzerine etkisi Hormonlar, amino asitler ve diğer bazı maddeler enzimin durumunu etkileyerek reaksiyon hızını değiştirebilirler. Örneğin, östrojenik, androjenik ve bazı steroid gebelik hormonları, glutamat dehidrojenaz enziminin dört alt ünitesini dissosiye ederek enzimin aktivitesini kaybetmesine neden olurlar ki bu durum, lösin, metiyonin, izolösin, ADP tarafından geri çevrilebilir. 41
42 9. Reaksiyon ürünlerinin enzimatik reaksiyonların hızı üzerine etkisi Reaksiyon ürünleri oluştukça enzimatik reaksiyonun hızı azalır. Çünkü enzimatik reaksiyonlar reversibldir; reaksiyon ürünleri kendi aralarında birleşerek aksi yönde bir reaksiyon meydana getirirler: A B + C reaksiyonu, ancak B ve C oluşur oluşmaz ortamdan uzaklaştırılırlarsa hep soldan sağa yürür. Reaksiyon ürünlerinden bir kısmı substrat ile yapısal benzerlik gösterir ve enzimle birleşerek onun aktivitesini azaltabilir. 42
43 Düzenleyici enzimler Hücre metabolizmasında enzim grupları, iskelet kaslarında glukozun laktata dönüştürülmesi reaksiyonları ve bakteriyel hücrede daha basit preküksörlerden amino asit sentezi gibi belli bir metabolik süreci gerçekleştirmek için art arda gelen yollarda birlikte iş görürler. Böyle enzim sistemlerinde ilk enzimin reaksiyon ürünü, daha sonraki reaksiyonun substratı olur ve böyle devam eder: 43
44 Enzim sistemlerindeki enzimlerin çoğu, daha önce tanımlanan kinetik örnekleri izler. Ancak her enzim sisteminde en az bir enzim vardır ki, bu tüm dizinin hızını ayarlar. Çoğu multienzim sisteminde dizinin ilk enzimi olan böyle enzimler, düzenleyici enzimler diye tanımlanır ve en yavaş veya hız sınırlayan reaksiyonu katalizlerler. 44
45 Düzenleyici enzimlerin etkisi vasıtasıyla her metabolik dizinin hızı, hücre büyüme ve onarımında gerekli enerji ve biyomoleküller için hücrenin taleplerindeki değişiklikleri karşılamak üzere, sabit olarak ayarlanır. Düzenleyici enzimlerin aktiviteleri, genellikle küçük metabolitler veya kofaktörler olan sinyal moleküllerinin çeşitli tipleri vasıtasıyla ayarlanır. 45
46 Düzenleyici enzimler, belli sinyallere cevapta artan veya azalan katalitik aktivite gösterirler. Metabolik yollardaki düzenleyici enzimlerin iki büyük sınıfı vardır: 1) Allosterik enzimler, düzenleyici enzimlerin birinci sınıfını oluştururlar ki, bunlar genellikle bir metabolik yolun ilk aşamalarında etkili enzimlerdir ve modülatör (effektör) denen düzenleyici bir metabolitin reversibl nonkovalent bağlanmasıyla fonksiyon görürler. 46
47 2) Düzenleyici enzimlerin ikinci sınıfı, reaksiyon hızlarını reversibl kovalent modifikasyon vasıtasıyla düzenlerler. Her iki sınıf düzenleyici enzimler, birçok alt üniteye sahip olma eğilimindedirler ki, bazı hallerde düzenleyici yer ve aktif yer ayrı alt ünitelerde bulunur. 47
48 Düzenleyici enzimlerin iki büyük sınıfını oluşturan allosterik enzimler ve aktiviteleri reversibl kovalent modifikasyon vasıtasıyla ayarlanan enzimlerden başka mekanizmalarla etkili olan düzenleyici enzimler de vardır: Bazı enzimler, kendilerine bağlanan ve aktivitelerini etkileyen ayrı kontrol proteinleri vasıtasıyla stimüle edici veya inhibe edicidirler. 48
49 Zimojenler denen bazı enzimler, diğer irreversibl mekanizmalara benzemeyen proteolitik yıkılım vasıtasıyla aktive edilirler. 49
50 Allosterik enzimler ve enzim aktivitesinin nonkovalent düzenlenmesi Bazı multienzim sistemlerinde düzenleyici enzim, son ürün gerektiğinden aşırı fazla olduğunda, yolun son ürünü tarafından spesifik olarak inhibe edilir. Düzenleyici enzim reaksiyonu böylece yavaşladığında, bütün sıralı enzimler düşük hızda çalışırlar; yolun son ürününün üretim hızı bu suretle hücrenin ihtiyaçları ile dengeye getirilir. 50
51 Enzim aktivitesinin bu tür düzenlenmesi, allosterik feedback inhibisyon olarak adlandırılır. Allosterik feedback inhibisyonda bir son ürün, genellikle tepkimenin irreversibl olan ilk aşamasında görevli allosterik enzime bağlanarak onu inhibe eder. 51
52 Allosterik feedback inhibisyonun ilk keşfedilen örneklerinden biri, L-Treoninin L- İzolösine dönüşümünü katalizleyen bakteriyel enzim sisteminde incelenir. 52
53 L-Treoninin L-İzolösine dönüşümünü katalizleyen bakteriyel enzim sisteminde ilk enzim olan treonin dehidrataz, bir allosterik enzimdir ve dizideki en son reaksiyonun ürünü olan izolösin vasıtasıyla inhibe edilir. İzolösin, bir inhibitör olarak oldukça spesifiktir; diğer ara ürünlerin hiçbiri treonin dehidratazı inhibe etmez ve dizideki diğer enzimlerin hiçbiri izolösin tarafından inhibe edilmez. 53
54 İzolösin, treonin dehidratazın aktif yerine değil, enzim üzerinde bir başka spesifik yer olan düzenleyici yere bağlanır ki, bu bağlanma nonkovalenttir ve bu nedenle kolayca geri dönebilir; izolösin konsantrasyonu azalırsa, treonin dehidrataz aktivitesi artar. Böylece treonin dehidrataz aktivitesi, hücrede izolösin konsantrasyonundaki dalgalanmalara hızlı ve reversibl olarak cevap verir. 54
55 Allosterik enzimlerin özellikleri, düzenleyici olmayan enzimlerinkinden önemli derecede farklıdır: 1) Farklılıkların bazısı yapısaldır ki, allosterik enzimler aktif veya katalitik yere ek olarak, modülatörü (effektör) bağlamak için genellikle bir veya daha fazla düzenleyici veya allosterik yere sahiptirler. Tıpkı bir enzimin aktif yerinin substratı için spesifik olması gibi, allosterik yer de modülatör (effektör) için spesifiktir. 55
56 Allosterik enzimlerin modülatörleri, inhibitör (negatif effektör) veya stimülatör (pozitif effektör) olabilir. Pozitif effektörler, enzimin aktivitesini artırırlar; negatif effektörler ise enzimin aktivitesini azaltırlar. 56
57 Bazı enzimlerin iki veya daha fazla modülatörü vardır ki, birkaç modülatörlü enzimler genellikle her bir modülatör için farklı spesifik allosterik yere sahiptirler. Birçok enzim için substrat, stimülatör etkili modülatördür (pozitif effektör) ki, modülatörü ve substratı aynı olan düzenleyici enzimler homotropik enzim olarak adlandırılırlar; homotropik enzimlerde aktif yer ve allosterik yer aynıdır. 57
58 Homotropik enzimlerin effektörleri homotropik effektör olarak tanımlanır. Modülatörü substratından farklı olan düzenleyici enzimler ise heterotropik enzim olarak adlandırılırlar: 58
59 Heterotropik enzimlerde aktif yer ve allosterik yer aynı değildir. Heterotropik enzimlerin effektörleri heterotropik effektör olarak tanımlanır ki, bu tür effektörler substrat dışı maddelerdir ve çoğunlukla metabolik olaylar sırasında oluşan son ürünlerdir. 59
60 Allosterik enzimlerin düzenleyici olmayan basit enzimlerden bir başka farkı, daha büyük ve daha kompleks yapıda olmalarıdır. Allosterik enzimlerin çoğu iki veya daha fazla polipeptit zincire veya alt üniteye sahiptirler: 60
61 2) Allosterik enzimlerle düzenleyici olmayan enzimler arasında kinetik özelliklerde de farklılıklar vardır. Allosterik enzimler, birçok genel kural için istisnadırlar; V o ve S arasında normal Michaelis- Menten denklemine uymayan ilişki gösterirler; substrat-aktivite grafiği hiperbolikten daha çok sigmoiddir: 61
62 Bir allosterik enzim vasıtasıyla katalizlenen reaksiyonun yarı maksimal hızını veren substrat konsantrasyonunu göstermek için K 0,5 veya S 0,5 sembolleri kullanılır. 62
63 Homotropik allosterik enzimler genellikle birçok alt üniteye sahiptirler ve her alt ünite üzerindeki aynı bağlanma yerleri hem aktif yer, hem düzenleyici yer olarak işlev görür; enzimin substratı bir pozitif modülatör (stimülatör, aktivatör) dür. Bir bağlanma yerine bir substrat molekülünün bağlanması, enzimin konformasyonunu değiştirir ve substrat moleküllerinin art arda bağlanmasını büyük ölçüde artırır ki, bu S artışıyla V 0 daki artışın sigmoid oluşunun nedenini açıklar. 63
64 Heterotropik enzimlerde modülatör, enzimin substratından başka bir molekül olduğundan, substrat-aktivite grafiğinin şekli hakkında genelleştirme yapmak zordur. 64
65 Bir pozitif modülatör (stimülatör, aktivatör), K 0,5 i azaltma fakat V max u değiştirmeme suretiyle, substrat-aktivite grafiğinin hiperboliğe yakın olmasına neden olabilir. Bir negatif modülatör (inhibitör) ise, K 0,5 i artırarak daha sigmoid substrat-aktivite grafiği oluşturabilir: 65
66 Allosterik enzimlerin bazıları inhibitör modülatörlere sahiptirler, bazıları aktivatör modülatörlere sahiptirler, bazıları her iki tür modülatöre de sahiptirler. Bu nedenle allosterik enzimler, substrat-aktivite grafiklerinde farklı tür yanıtlar gösterirler. Modülasyonun daha az görülen tipinde K 0,5 sabit kalırken V max değişir: 66
67 Aktiviteleri reversibl kovalent modifikasyon vasıtasıyla düzenlenen düzenleyici enzimler ve enzim aktivitesinin kovalent modifikasyon ile düzenlenmesi Düzenleyici enzimlerin ikinci büyük sınıfında aktivite, enzim molekülünün kovalent modifikasyonu suretiyle düzenlenir. 67
68 Enzim molekülünü kovalent modifiye edici gruplar şunlardır: -Fosfat (P), -adenozin monofosfat (AMP), -Uridin monofosfat (UMP), -adenozin difosfat riboz (ADP-Riboz), -metil ( CH 3 ) grupları: 68
69 69
70 Enzim aktivitesinin kovalent modifikasyon ile düzenlenmesinin önemli bir örneği, kas ve karaciğer glikojen fosforilazının aktivitesinin düzenlenmesidir: glikojen fosforilaz, reaksiyonunu katalize eder; oluşan glukoz-1-fosfat, daha sonra kasta laktata yıkılabilir, karaciğerde serbest glukoza dönüşebilir. 70
71 Glikojen fosforilaz; aktif fosforilaz a ve nispeten inaktif fosforilaz b olmak üzere iki formda bulunur. Fosforilaz a iki alt üniteye sahiptir ve bunların her biri spesifik serin kalıntılarının hidroksil gruplarında fosforillenmiştir: 71
72 İskelet kaslarında ve karaciğerde glikojenin yıkılması, glikojen fosforilazın iki formunun oranındaki değişimler vasıtasıyla düzenlenir 72
73 Birçok hormon etkilerini, fosforilasyonda rol oynayan protein kinazlar tarafından düzenlenen enzimler üzerinden gösterir: Protein kinazlar, enzimin serin veya tirozin amino asitlerinin hidroksil gruplarına ATP den fosfat transferi yaparlar. Fosfat, taşıdığı negatif yüklerden dolayı, proteinin aktif katalitik merkezinde konformasyonel bir değişiklik oluşturur ve enzim bu değişiklik sonucu daha çok aktif veya daha az aktif yapıya dönebilir. 73
74 Örneğin fosforilasyon glikojeni yıkan glikojen fosforilazın aktivitesini artırdığı halde, glikojen sentezinde görevli glikojen sentazın aktivitesini azaltmaktadır. Enzime bağlanan fosfat grupları, fosfoprotein fosfatazlar tarafından uzaklaştırılırlar. 74
75 Glikojen fosforilazın aktivitesinin esas düzenlenmesi kovalent modifikasyon vasıtasıyla olduğu halde AMP vasıtasıyla nonkovalent düzenlenme tarzında da olur; AMP, fosforilaz b nin ve birkaç başka inhibitör molekülün aktivatörüdür. Glikojen fosforilaz gibi, metabolizmada çok önemli noktalarda lokalize ve daha fazla kompleks düzenleyici enzimlerin bazılarının aktiviteleri, hem nonkovalent olarak hem kovalent modifikasyon vasıtasıyla düzenlenir. 75
76 Zimojenler ve proteolitik yıkılım vasıtasıyla enzim aktivasyonu Bir enzimin aktivitesinin düzenlenmesinin biraz farklı bir tipi, proteolitik yıkılım vasıtasıyla enzim aktivasyonudur. Proteolitik yıkılım vasıtasıyla aktive edilen enzimlerin inaktif prekürsörü, zimojen olarak isimlendirilir. 76
77 Zimojen proteolitik yıkılım sonunda aktif forma dönüşür; spesifik yıkılım enzimin aktif yerinde konformasyonal değişikliklere neden olur. Mide ve pankreasın birçok enzimi inaktif prekürsörlerinin proteolitik yıkılımı sonunda aktif forma dönüşürler: 77
78 78
79 Aktivasyonun bu şekli irreversibl olduğundan, bu enzimleri inaktive etmek için başka mekanizmalar gereklidir. Bu enzimler, genellikle enzimin aktif yerine çok sıkı olarak inhibitör proteinlerin bağlanması suretiyle inaktive edilirler. 79
80 Zimojen aktivasyonun diğer örnekleri, hormonlar, bağ dokusu ve kan pıhtılaştırıcı sistemde meydana gelir: İnsülin hormonu, proinsülinin yıkılması suretiyle oluşturulur; kollajen, başlangıçta prokollajen denen solubl bir prekürsör olarak sentezlenir; kan pıhtılaşmasında zimojen aktivasyonun komplike şelale şekli etkili olur. 80
81 Enzim sentezinin indüksiyonu ve reperesyonu Hücrede enzim aktivitesini düzenleyen bir mekanizma da, enzimin sentez hızının kontrolüdür. Bu mekanizma, indüksiyon veya reperesyon ile düzenlenim olarak tanımlanır. Gereksinime göre enzim aktivitesi, indüksiyon veya reperesyon ile düzenlenebilmektedir. Örneğin glukoz metabolizmasındaki anahtar enzimlerin sentezi, kan glukozunun yükseldiği durumlarda artar (indüksiyon); kan glukozunun düştüğü durumlarda ise azalır (reperesyon). 81
82 ENZİM İNHİBİSYONU Enzim inhibisyonu, enzimatik bir tepkimenin hızının inhibitör adı verilen bazı maddeler tarafından azaltılması veya tamamen durdurulmasıdır. Bazı hastalıkların nedeni, bir enzimin işlevini yerine getirmemesi olabilir; herhangi bir etken bir enzimi inhibe ederek enzimin katalize ettiği kimyasal olayı bozabilir veya bir farmakolojik ajan, bir hastalığı enzim inhibisyonu üzerinden tedavi edebilir. 82
83 Bazı ilaçlar ve bir kısım kimyasal maddeler enzimlerin katalitik etkilerine engel olurlar ki enzimlerin etkilerini önleyen maddelere enzim inhibitörleri denir. Enzim inhibitörleri ile enzim inhibisyonu reversibl veya irreversibl olabilir. 83
84 Reversibl enzim inhibisyonları 1) Kompetitif (yarışmalı) enzim inhibisyonu: Yarışmalı enzim inhibisyonudur; reversibl enzim inhibisyonunun yaygın bir tipidir. Kompetitif enzim inhibisyonunda, bir kompetitif inhibitör, enzimin aktif yeri için substrat ile yarışır. Enzimin aktif yerine inhibitör bağlanınca reaksiyon gerçekleşmez; inhibitör aktif yeri işgal ederken substratın enzime bağlanmasını önler. Kompetitif enzim inhibisyonunda inhibitör madde, enzimin substratına olan ilgisini azaltır; K m değeri büyür. 84
85 Kompetitif inhibitör, sıklıkla yapısal olarak substrata benzeyen ve substrat gibi, enzime reversibl bağlanma özelliği gösteren bir bileşiktir; EI kompleksi oluşturmak üzere enzim ile reversibl olarak birleşir: 85
86 Süksinik aside (HOOC CH 2 CH 2 COOH) yapıca çok benzeyen malonik asit (HOOC CH 2 COOH), süksinat dehidrojenazın kompetitif inhibitörüdür. Kompetitif enzim inhibisyonunda inhibitör, enzime reversibl olarak bağlandığından, yarışma basit olarak daha fazla substrat ekleyerek substrat lehine çevrilebilir. 86
87 Yeterli substrat varsa bir kompetitif inhibitörün enzime bağlanma olasılığı çok azdır. Bu durumda reaksiyon, az çok normal bir V max değeri gösterir; fakat kompetitif inhibitörün varlığında, yarı maksimal hızın gözlendiği noktadaki substrat konsantrasyonu olan K m değeri, artar. 87
88 K m değeri üzerine belirgin etki ve V max değeri üzerine etkinin az veya yok oluşu, kompetitif enzim inhibisyonunun karakteristiğidir: Michaelis-Menten grafiği Lineweaver-Burk grafiği Kompetitif inhibitör, Lineweaver-Burk grafiğinin eğimini artırır. 88
89 89
90 Anti-hiperlipidemik ilaçlar kolesterol sentezindeki ilk basamağı, yarışmalı olarak inhibe ederler. Bu reaksiyon β-hidroksimetilglutaril-coa redüktaz tarafından kataliz edilir. Atorvastatin (lipitor) ve simvastatin gibi statin ilaçları bu enzimin doğal subtraratlarının yapısal analoğudur ve HMG-CoA redüktazı inhibe etmek için etkili olarak yarışırlar. Bu mekanizmalarla de nova kolesterol sentezi ni inhibe ederler ve sonuçta plazma kolesterol düzeyini düşürürler. 90
91 Kompetitif inhibisyon, metanol içeren hastaları tedavi etmek için yararlı olarak kullanılır. Metanol (sahte rakı), alkol dehidrojenaz enziminin etkisi vasıtasıyla formaldehite dönüştürülür; oluşan formaldehit, birçok dokuyu harap eder ki gözler özellikle duyarlı olduğundan sıklıkla körlüğe neden olur. 91
92 Etanol, alkol dehidrojenaz için bir substrat olarak metanol ile etkili bir şekilde yarışır. Metanol ile zehirlenmede tedavi, etanolün hastaya intravenöz infüzyonudur. İntravenöz verilen etanol, formaldehit oluşumunu yeterince yavaşlatarak fazla metanolün zararsız bir şekilde idrarla atılımını sağlar. 92
93 2) Nonkompetitif (yarışmasız) enzim inhibisyonu: Yarışmalı olmayan enzim inhibisyonudur. Nonkompetitif enzim inhibisyonunda, nonkompetitif inhibitör, enzim üzerinde substratın bağlandığı aktif yerden ayrı bir yere reversibl olarak bağlanır; Enzime nonkompetitif inhibitörün bağlanması substrat bağlanmasını bloke etmez, substrat bağlanması da nonkompetitif inhibitörün bağlanmasını bloke etmez. 93
94 Nonkompetitif inhibitör, kimyasal yapı yönünden substrata benzemez; serbest enzime veya ES kompleksi oluştuktan sonra enzimin substratın bağlı olduğu aktif yerden başka bir yerine reversibl bağlanarak enzimi inaktive eder: 94
95 ESI kompleksi ürün vermek üzere ES kompleksinden daha yavaş parçalandığı için tepkimenin hızı yavaşlamaktadır. Bu tür inhibisyon ile, tepkimenin V max değeri azaldığı halde K m değeri değişmez. 95
96 Nonkompetitif inhibitör, aktif enzimin konsantrasyonunu ve dolayısıyla V max değerini belirgin olarak azaltır; yarı maksimal hızın gözlendiği noktadaki substrat konsantrasyonu olan K m değeri üzerine etkisi sıklıkla çok azdır veya yoktur: Lineweaver-Burk grafiği Michaelis-Menten grafiği 96
97 97
98 İlaç olarak enzim inhibitörleri Penisilin ve amoksisilin gibi yaygın kullanılan β- laktam antibiyotikleri bakteri sentezine ait bir veya daha fazla enzimi inhibe ederek etki ederler. İlaçlar ektraselüler reaksiyonları inhibe ederek etki gösterirler. Anjiotensin I i vazokonstriktör etkili anjiyotensin II ye yıkan enzimi bloke ederek kan basıncını düşüren anjiotensin enzim inhibitörleri (ACE) buna örnektir. Captoril, enapril ve lisinopril gibi ilaclarvazodilatasyona neden olarak sonuçta kan basıncını düşürürler. 98
99 3) Ankompetitif enzim inhibisyonu: Bir enzime bir ankompetitif inhibitörün bağlanması sonucu meydana gelen enzim inhibisyonudur. Ankompetitif inhibitör, nonkompetitif inhibitör gibi, enzim üzerinde substratın bağlandığı aktif yerden ayrı bir yere reversibl olarak bağlanır; fakat nonkompetitif inhibitör serbest enzime veya ES kompleksine bağlanabildiği halde, ankompetitif inhibitör, yalnızca ES kompleksi oluştuktan sonra enzimin substratın bağlı olduğu aktif yerden başka bir yerine reversibl bağlanarak enzimi inaktive eder: 99
100 Ankompetitif inhibitör, ES konsantrasyonunu azaltır 100
101 Ankompetitif inhibisyon sonucu hem V max hem K m değeri değişmektedir; V max değeri azalırken K m değeri küçülür: Lineweaver-Burk grafiği Michaelis-Menten grafiği 101
102 İrreversibl enzim inhibisyonları İrreversibl enzim inhibisyonu, bir irreversibl inhibitörün, enzim üzerinde bulunan ve aktivite için esas olan bir fonksiyonel grubu yıkması veya onunla irreversibl olarak birleşmesi sonucu meydana gelir. Bir irreversibl inhibitör ve bir enzim arasında kovalent bağ oluşması yaygındır: İnhibitör Siyanür p-merkuribenzoat Diizopropilfluorofosfat İyodoasetat İnhibitör ile kovalent bağ oluşturan gruplar Fe, Cu, Zn ve diğer metaller Sülfhidril Serin hidroksili Sülfhidril, imidazol, karboksil, tiyoeter 102
103 İyodoasetamit, aktif yerinde sistein kalıntısı içeren birçok enzim için bir irreversibl inhibitördür; Diizopropilfluorofosfat, aktif yerinde serin kalıntısı içeren tripsin ve kimotripsin gibi enzimler için bir irreversibl inhibitördür: 103
104 İrreversibl inhibitörlerin çok özel bir sınıfı, suisid inhibitörlerdir. Suisid inhibitörler, bir spesifik enzimin aktif yerine bağlanınca normal enzim reaksiyonunun ilk birkaç basamağını gerçekleştirmek için hazırlanır. Ancak suisid inhibitör, normal ürüne değişme yerine enzim ile irreversibl olarak birleşen birçok etkili bileşiğe dönüştürülür: Suisid inhibitörler, enzimi inaktive etmek için normal enzim reaksiyon mekanizması kullandıklarından mekanizmaya dayanan inaktivatörler diye de adlandırılırlar. 104
105 İki veya daha fazla substratlı enzimatik reaksiyonlar Birçok enzimatik reaksiyonda iki veya daha fazla farklı substrat molekülleri enzime bağlanır ve reaksiyona katılırlar. Örneğin, heksokinaz tarafından katalizlenen reaksiyonda ATP ile glukoz, substrat molekülleridirler ve ADP ile glukoz-6-fosfat üretirler: ATP + D-glucose ADP + D-glucose-6-phosphate Böyle iki substratlı reaksiyonların hızı da Michaelis-Menten yaklaşımı ile analiz edilebilir. 105
106 İki substratın olduğu enzimatik reaksiyonlar, genellikle bir atom veya fonksiyonel grubun bir substrattan diğerine transferini kapsar ve böyle reaksiyonlar birkaç farklı yoldan yürür: 1) Bazı durumlarda her iki substrat, reaksiyon sırasında enzime birkaç noktada aynı anda bağlanıp bir üçlü kompleks oluşturur ki böyle bir üçlü kompleks, substratların rastgele sırada veya özel bir düzende bağlanması suretiyle oluşturulabilir: 106
107 Ardışık mekanizma olarak tanımlanan bu model için kinetik formül ve grafikler şu şekildedir: Formüldeki K d1, ES 1 kompleksi için dissosiasyon (ayrışma) sabitidir. 107
108 2) Bazı durumlarda ilk substrattan oluşan ürün ikinci substrat bağlanmadan önce ayrılır; üçlü kompleks oluşmaz ki, bunun bir örneği, ping-pong veya çift kaydırım (çift yer değiştirme) mekanizması olarak tanımlanır: Bu model için kinetik formül ve grafikler şu şekildedir 108
109 İzoenzimler (izozimler) Belli bir enzimin katalitik aktivitesi aynı, fakat elektriksel alanda göç, doku dağılımı, ısı, inhibitör ve aktivatörlere yanıtları farklı olan formlarına o enzimin izoenzimleri denir. İzoenzimler, amino asit dizinleri farklı proteinler olduğu halde aynı tepkimeyi katalize eden enzimlerdir; farklı dokularda veya farklı intrasellüler kompartmanlarda farklı rollere sahiptirler. Eğer bir reaksiyon hücrenin hem sitozolünde hem mitokondrisinde oluyorsa, genellikle farklı izoenzimler tarafından katalize edilir. 109
110 Günümüzde gelişmiş tekniklerle, aynı tepkimeyi katalizlediği halde farklı yapısal özellik gösteren izoenzimler ayrı ayrı analiz edilerek miktarları veya aktiviteleri belirlenebilmektedir. İzoenzimlere karşı ilgi, 1957 de insan serumlarının birçok laktat dehidrojenaz (LD, LDH) izoenzimi içerdiğinin ve bunların nisbi oranlarının belli patolojik şartlarda önemli derecede değiştiğinin bulunmasıyla artmıştır. Bir hastada kan serumunda artan total enzim aktivitesinin hangi organa ait hasarı gösterdiğini saptayabilmek, ancak izoenzimlerin tayini ile mümkün olmaktadır. 110
111 Doku spesifik izoenzimler, doku hasarının yerinin belirlenmesinde tanısal amaçla kullanılır; izoenzim aktivitelerinin bilinmesi, klinisyenler için tanı koymada yol göstericidir. Laktat dehidrojenaz (LD, LDH) izoenzimleri, bir serum örneğine 8,6 ph da nişasta, agar veya poliakrilamid jel destek üzerinde elektroforez uygulamak suretiyle gösterilebilirler: 111
112 Laktat dehidrojenaz (LD, LDH) izoenzimleri, kuarterner yapı düzeyinde birbirinden farklılıklar gösterirler. Aktif LD molekülü, H ve M tiplerinde dört monomerden oluşur; bu monomerler beş farklı şekilde birbirleriyle birleşirler ve beş farklı LD izoenzimi meydana gelir: 112
113 LD izoenzimi İzoenzimin monomerleri İzoenzimin özellikleri LD 1 HHHH Elektroforezde anoda en hızlı göçen izoenzimdir; kalp kası, eritrositler, blast hücreler ve böbreklerde bulunur; miyokard enfarktüsünde serum düzeyi artar. LD 2 HHHM Kalp kasında ve eritrositlerde bulunur. LD 3 HHMM Akciğer, endokrin bezler, dalak, lenf bezleri ve trombositlerde bulunur. LD 4 HMMM Karaciğer ve iskelet kasında bulunur. LD 5 MMMM İskelet kasında ve karaciğerde bulunur; karaciğer hastalıklarında serum düzeyi artar. 113
114 Kreatin kinaz (CK, CPK) enziminin üç izoenzimi vardır: CK izoenzimi İzoenzimin özellikleri CK 1 (CK-BB) Beyinde bulunur; serumda her zaman aktivitesi gösterilemez. CK 2 (CK-MB) Kalp kasında bulunur; plazma düzeyi normalde total CK düzeyinin %2 sinden daha azdır; miyokard enfarktüsünden sonra plazma düzeyi artar. CK 3 (CK-MM) İskelet kasında bulunur; normalde plazma total CK aktivitesinin %98 ini oluşturur. 114
115 115
116 Kaynaklar: 1. Richard A. Harvey, Pamela C. Champe: Lippincott s Illustrated Reviews Serisinden Biyokimya 3. baskı Çeviri editörü: Doç. Dr. Engin Ulukaya. Nobel Tıp Kitabevi David L. Nelson, Michael M. Cox. Lehninger Biyokimyanın ilkeleri Çeviri editörü: Prof. Dr. Nedret Kılınç. Palme Yayıncılık. Ankara Taner Onat, Kaya Emerk, Eser Y. Sözmen. İnsan biyokimyası Palme yayıncılık, Ankara, Rex Montgomery, Thomas W. Conway, Arthur A. Spector Biyokimya olgu sunumlu yaklaşım. Çeviri editörü: Nilgün Altan Palme Yayıncılık. Ankara, Robert K. Murray, Daryl K. Granner, Peter A. Mayes, Victor V. Rodwell Harper biyokimya, Çeviri editörü: Nurten Dikmen, Tuncay Özgünen. Nobel Tıp Kitabevi Ankara, Not: Sunumdaki bazı materyaller (bilgi, belge, resimleri, vs) internet ortamından alınmış olup sadece eğitim amacıyla kullanılmaktadır. Note: Some of the material above has been taken from the internet media and only used for educational purposes. 116
ENZİMLERİN GENEL ÖZELLİKLERİ - II. Doç Dr. Nurzen SEZGİN
 ENZİMLERİN GENEL ÖZELLİKLERİ - II Doç Dr. Nurzen SEZGİN bstrate Enzyme substrate Enzyme substrate Enzyme substrate Enzyme substrate Enzyme substrate Enzyme substrate Enzyme substrate Enzyme substrate
ENZİMLERİN GENEL ÖZELLİKLERİ - II Doç Dr. Nurzen SEZGİN bstrate Enzyme substrate Enzyme substrate Enzyme substrate Enzyme substrate Enzyme substrate Enzyme substrate Enzyme substrate Enzyme substrate
Enzimler Enzimler metabolizma reaksiyonlarını hızlandıran moleküllerdir. Katalitik RNA moleküllerinin küçük bir grubu hariç, bütün enzimler
 Enzimler Enzimler metabolizma reaksiyonlarını hızlandıran moleküllerdir. Katalitik RNA moleküllerinin küçük bir grubu hariç, bütün enzimler proteindir. Katalitik aktiviteleri doğal protein konformasyonunun
Enzimler Enzimler metabolizma reaksiyonlarını hızlandıran moleküllerdir. Katalitik RNA moleküllerinin küçük bir grubu hariç, bütün enzimler proteindir. Katalitik aktiviteleri doğal protein konformasyonunun
Enzimler. Yrd.Doç.Dr.Funda GÜLCÜ BULMUŞ Fırat Üniversitesi SHMYO
 Enzimler Yrd.Doç.Dr.Funda GÜLCÜ BULMUŞ Fırat Üniversitesi SHMYO Enzimler Biyokimyasal olayların vücutta yaşam ile uyumlu bir şekilde gerçekleşmesini sağlayan katalizörlerdir. Katalitik RNA moleküllerinin
Enzimler Yrd.Doç.Dr.Funda GÜLCÜ BULMUŞ Fırat Üniversitesi SHMYO Enzimler Biyokimyasal olayların vücutta yaşam ile uyumlu bir şekilde gerçekleşmesini sağlayan katalizörlerdir. Katalitik RNA moleküllerinin
ENZİM KATALİZİNİN MEKANİZMALARI
 ENZİMLER 3. Hafta Ders Konuları 1) Enzim Katalizinin Mekanizmaları -Kovalan Kataliz -Yakınlığa (proximity) bağlı kataliz -Asit-Baz katalizi -Metal iyon katalizi 2) Enzimlerin Regülasyonu -Allosterik Regülasyon
ENZİMLER 3. Hafta Ders Konuları 1) Enzim Katalizinin Mekanizmaları -Kovalan Kataliz -Yakınlığa (proximity) bağlı kataliz -Asit-Baz katalizi -Metal iyon katalizi 2) Enzimlerin Regülasyonu -Allosterik Regülasyon
Hücrelerde gerçekleşen yapım, yıkım ve dönüşüm olaylarının bütününe metabolizma denir.
 METABOLİZMA ve ENZİMLER METABOLİZMA Hücrelerde gerçekleşen yapım, yıkım ve dönüşüm olaylarının bütününe metabolizma denir. A. ÖZÜMLEME (ANABOLİZMA) Metabolizmanın yapım reaksiyonlarıdır. Bu tür olaylara
METABOLİZMA ve ENZİMLER METABOLİZMA Hücrelerde gerçekleşen yapım, yıkım ve dönüşüm olaylarının bütününe metabolizma denir. A. ÖZÜMLEME (ANABOLİZMA) Metabolizmanın yapım reaksiyonlarıdır. Bu tür olaylara
Enzimler. Fiziksel İlkeler. Enzim Etkinliğinin Düzenlenmesi
 Enzimler Fiziksel İlkeler Enzim Etkinliğinin Düzenlenmesi Doç. Dr. Handan Akçakaya E+S k 1 ES k 2 E+Ü k 2 =k kat k -1 ES nin oluşum hızı = ES nin parçalanma hızı = k 1 [E] [ S] k -1 [ES]+ k 2 [ES] Denge
Enzimler Fiziksel İlkeler Enzim Etkinliğinin Düzenlenmesi Doç. Dr. Handan Akçakaya E+S k 1 ES k 2 E+Ü k 2 =k kat k -1 ES nin oluşum hızı = ES nin parçalanma hızı = k 1 [E] [ S] k -1 [ES]+ k 2 [ES] Denge
GLİKOJEN FOSFORİLAZ HAZIRLAYAN: HATİCE GÜLBENİZ ( ) Prof. Dr. Figen ERKOÇ GAZİ EĞİTİM FAKÜLTESİ GAZİ ÜNİVERSİTESİ
 GLİKOJEN FOSFORİLAZ HAZIRLAYAN: HATİCE GÜLBENİZ (050559016) Prof. Dr. Figen ERKOÇ GAZİ EĞİTİM FAKÜLTESİ GAZİ ÜNİVERSİTESİ Karaciğer ve kas glikojeninin kana ve kas dokusuna glukoz sağlamak üzere kısmen
GLİKOJEN FOSFORİLAZ HAZIRLAYAN: HATİCE GÜLBENİZ (050559016) Prof. Dr. Figen ERKOÇ GAZİ EĞİTİM FAKÜLTESİ GAZİ ÜNİVERSİTESİ Karaciğer ve kas glikojeninin kana ve kas dokusuna glukoz sağlamak üzere kısmen
GLİKOLİZİN KONTROLU Prof. Dr. İzzet Hamdi Öğüş
 GLİKOLİZİN KONTROLU Prof. Dr. İzzet Hamdi Öğüş hamdiogus@gmail.com Yakın Doğu Üniversitesi Tıp Fakültesi Biyokimya Anabilim Dalı, Le>oşa, KKTC GLİKOLİZİN ALLOSTERİK DÜZENLENMESİ Metabolik düzenleme: Bütün
GLİKOLİZİN KONTROLU Prof. Dr. İzzet Hamdi Öğüş hamdiogus@gmail.com Yakın Doğu Üniversitesi Tıp Fakültesi Biyokimya Anabilim Dalı, Le>oşa, KKTC GLİKOLİZİN ALLOSTERİK DÜZENLENMESİ Metabolik düzenleme: Bütün
15- RADYASYONUN NÜKLEİK ASİTLER VE PROTEİNLERE ETKİLERİ
 15- RADYASYONUN NÜKLEİK ASİTLER VE PROTEİNLERE ETKİLERİ İyonlaştırıcı radyasyonların biyomoleküllere örneğin nükleik asitler ve proteinlere olan etkisi hakkında yeterli bilgi yoktur. Ancak, nükleik asitlerden
15- RADYASYONUN NÜKLEİK ASİTLER VE PROTEİNLERE ETKİLERİ İyonlaştırıcı radyasyonların biyomoleküllere örneğin nükleik asitler ve proteinlere olan etkisi hakkında yeterli bilgi yoktur. Ancak, nükleik asitlerden
GLİKOJEN METABOLİZMASI
 METABOLİZMASI DİLDAR KONUKOĞLU TIBBİ BİYOKİMYA 8.4.2015 DİLDAR KONUKOĞLU 1 YAPISI Alfa-[1,6] glikozid Alfa- [1-4] glikozid bağı yapısal olarak D-glukozdan oluşmuş dallanmış yapı gösteren homopolisakkarittir.
METABOLİZMASI DİLDAR KONUKOĞLU TIBBİ BİYOKİMYA 8.4.2015 DİLDAR KONUKOĞLU 1 YAPISI Alfa-[1,6] glikozid Alfa- [1-4] glikozid bağı yapısal olarak D-glukozdan oluşmuş dallanmış yapı gösteren homopolisakkarittir.
6. BÖLÜM MİKROBİYAL METABOLİZMA
 6. BÖLÜM MİKROBİYAL METABOLİZMA 1 METABOLİZMA Hücrede meydana gelen tüm reaksiyonlara denir Anabolizma: Basit moleküllerden kompleks moleküllerin sentezlendiği enerji gerektiren reaksiyonlardır X+Y+ENERJİ
6. BÖLÜM MİKROBİYAL METABOLİZMA 1 METABOLİZMA Hücrede meydana gelen tüm reaksiyonlara denir Anabolizma: Basit moleküllerden kompleks moleküllerin sentezlendiği enerji gerektiren reaksiyonlardır X+Y+ENERJİ
Enzimler ENZİMLER ENZİMLER ENZİMLER İSİMLENDİRME ENZİMLER
 Enzimler Yrd.Doç.Dr. Ahmet GENÇ Sağlık Hizmetleri Meslek Yüksekokulu q Vücuttaki tüm reaksiyonlar, tüm işlem sonunda kendileri değişmeden reaksiyonların hızını artıran protein katalizörler olan enzimler
Enzimler Yrd.Doç.Dr. Ahmet GENÇ Sağlık Hizmetleri Meslek Yüksekokulu q Vücuttaki tüm reaksiyonlar, tüm işlem sonunda kendileri değişmeden reaksiyonların hızını artıran protein katalizörler olan enzimler
1.Oksidoredüktazlar Oksidoredüktazların en önemli koenzimleri a) Nikotinamid-adenin Dinükleotidler (NAD) b) Nikotinamid-Adenin-Dinükleotid-fosfat
 1.Oksidoredüktazlar Oksidoredüktazların en önemli koenzimleri a) Nikotinamid-adenin Dinükleotidler (NAD) b) Nikotinamid-Adenin-Dinükleotid-fosfat (NADP) Prostatik grupları a) Flavinnükleotidler flavinmononükleotid
1.Oksidoredüktazlar Oksidoredüktazların en önemli koenzimleri a) Nikotinamid-adenin Dinükleotidler (NAD) b) Nikotinamid-Adenin-Dinükleotid-fosfat (NADP) Prostatik grupları a) Flavinnükleotidler flavinmononükleotid
Aktivasyon enerjisi. Enzim kullanılmayan. enerjisi. Girenlerin toplam. enerjisi. Enzim kullanılan. Serbest kalan enerji. tepkimenin aktivasyon
 ENZİMLER Enzimler Canlı sistemlerde meydana gelen tüm yapım ve yıkım reaksiyonlarına metabolizma denir Metabolizma faaliyetleri birer biyokimyasal tepkimedir. Ve bu tepkimelerin başlayabilmesi belirli
ENZİMLER Enzimler Canlı sistemlerde meydana gelen tüm yapım ve yıkım reaksiyonlarına metabolizma denir Metabolizma faaliyetleri birer biyokimyasal tepkimedir. Ve bu tepkimelerin başlayabilmesi belirli
Pentoz Fosfat Yolu ve Üronik Asit Yolu. YRD. DOÇ. DR. HAYRULLAH YAZAR SAKARYA ÜNIVERSITESI TıP FAKÜLTESI TıBBI BIYOKIMYA ANABILIM DALı SAKARYA, 2015
 Pentoz Fosfat Yolu ve Üronik Asit Yolu YRD. DOÇ. DR. HAYRULLAH YAZAR SAKARYA ÜNIVERSITESI TıP FAKÜLTESI TıBBI BIYOKIMYA ANABILIM DALı SAKARYA, 2015 1 PENTOZ FOSFAT YOLUYLA GLUKOZ OKSİDASYONU Pentoz fosfat
Pentoz Fosfat Yolu ve Üronik Asit Yolu YRD. DOÇ. DR. HAYRULLAH YAZAR SAKARYA ÜNIVERSITESI TıP FAKÜLTESI TıBBI BIYOKIMYA ANABILIM DALı SAKARYA, 2015 1 PENTOZ FOSFAT YOLUYLA GLUKOZ OKSİDASYONU Pentoz fosfat
Prof.Dr.Gül ÖZYILMAZ
 Prof.Dr.Gül ÖZYILMAZ ENZİMLER; Tüm canlıların yapısında bulunan, Esas olarak proteinden oluşmakla beraber, organik-inorganik maddeleri de bünyesinde barındıran, Biyokimyasal tepkimeleri gerçekleştiren
Prof.Dr.Gül ÖZYILMAZ ENZİMLER; Tüm canlıların yapısında bulunan, Esas olarak proteinden oluşmakla beraber, organik-inorganik maddeleri de bünyesinde barındıran, Biyokimyasal tepkimeleri gerçekleştiren
III-Hayatın Oluşturan Kimyasal Birimler
 III-Hayatın Oluşturan Kimyasal Birimler MBG 111 BİYOLOJİ I 3.1.Karbon:Biyolojik Moleküllerin İskeleti *Karbon bütün biyolojik moleküllerin omurgasıdır, çünkü dört kovalent bağ yapabilir ve uzun zincirler
III-Hayatın Oluşturan Kimyasal Birimler MBG 111 BİYOLOJİ I 3.1.Karbon:Biyolojik Moleküllerin İskeleti *Karbon bütün biyolojik moleküllerin omurgasıdır, çünkü dört kovalent bağ yapabilir ve uzun zincirler
ENZİMLER Enzim tanımı ve enzim araştırmalarının tarihçesi substrat
 ENZİMLER Enzim tanımı ve enzim araştırmalarının tarihçesi Enzimler, biyolojik sistemlerin reaksiyon katalizörleridirler; biyokimyasal olayların vücutta yaşam ile uyumlu bir şekilde gerçekleşmesini sağlayan
ENZİMLER Enzim tanımı ve enzim araştırmalarının tarihçesi Enzimler, biyolojik sistemlerin reaksiyon katalizörleridirler; biyokimyasal olayların vücutta yaşam ile uyumlu bir şekilde gerçekleşmesini sağlayan
ÇİSEM İLGİN ( ) LÜTFİYE ALAÇAM ( ) Prof. Dr. Figen ERKOÇ GAZİ ÜNİVERSİTESİ
 HAZIRLAYLANLAR ÇİSEM İLGİN (040559015) LÜTFİYE ALAÇAM (040559003) ZEYNEP HALICI (040559014) Prof. Dr. Figen ERKOÇ Gazi Eğitim Fakültesi GAZİ ÜNİVERSİTESİ 1 TRANSAMİNAZLAR Transaminazlar veya Aminotransferazlar
HAZIRLAYLANLAR ÇİSEM İLGİN (040559015) LÜTFİYE ALAÇAM (040559003) ZEYNEP HALICI (040559014) Prof. Dr. Figen ERKOÇ Gazi Eğitim Fakültesi GAZİ ÜNİVERSİTESİ 1 TRANSAMİNAZLAR Transaminazlar veya Aminotransferazlar
21.11.2008. I. Koenzim A nedir? II. Tarihsel Bakış III. Koenzim A nın yapısı IV. Asetil-CoA nedir? V. Koenzim A nın katıldığı reaksiyonlar VI.
 Hazırlayan: Sibel ÖCAL 0501150027 I. Koenzim A nedir? II. Tarihsel Bakış III. Koenzim A nın yapısı IV. Asetil-CoA nedir? V. Koenzim A nın katıldığı reaksiyonlar VI. Eksikliği 1 2 Pantotenik asit (Vitamin
Hazırlayan: Sibel ÖCAL 0501150027 I. Koenzim A nedir? II. Tarihsel Bakış III. Koenzim A nın yapısı IV. Asetil-CoA nedir? V. Koenzim A nın katıldığı reaksiyonlar VI. Eksikliği 1 2 Pantotenik asit (Vitamin
İ. Ü İstanbul Tıp Fakültesi Tıbbi Biyoloji Anabilim Dalı Prof. Dr. Filiz Aydın
 İ. Ü İstanbul Tıp Fakültesi Tıbbi Biyoloji Anabilim Dalı Prof. Dr. Filiz Aydın Hücre iletişimi Tüm canlılar bulundukları çevreden sinyal alırlar ve yanıt verirler Bakteriler glukoz ve amino asit gibi besinlerin
İ. Ü İstanbul Tıp Fakültesi Tıbbi Biyoloji Anabilim Dalı Prof. Dr. Filiz Aydın Hücre iletişimi Tüm canlılar bulundukları çevreden sinyal alırlar ve yanıt verirler Bakteriler glukoz ve amino asit gibi besinlerin
Kloroform, eter ve benzen gibi organik çözücülerde çözünen bunun yanı sıra suda çözünmeyen veya çok az çözünen organik molekül grubudur.
 Kloroform, eter ve benzen gibi organik çözücülerde çözünen bunun yanı sıra suda çözünmeyen veya çok az çözünen organik molekül grubudur. Yağların suda çözünmemesi canlılığın devamı içi önemlidir. Çünkü
Kloroform, eter ve benzen gibi organik çözücülerde çözünen bunun yanı sıra suda çözünmeyen veya çok az çözünen organik molekül grubudur. Yağların suda çözünmemesi canlılığın devamı içi önemlidir. Çünkü
DOYMAMIŞ YAĞ ASİTLERİNİN OLUŞMASI TRİGLİSERİTLERİN SENTEZİ
 9. Hafta: Lipit Metabolizması: Prof. Dr. Şule PEKYARDIMCI DOYMAMIŞ YAĞ ASİTLERİNİN OLUŞMASI Palmitoleik ve oleik asitlerin sentezi için palmitik ve stearik asitler hayvansal organizmalardaki çıkş maddeleridir.
9. Hafta: Lipit Metabolizması: Prof. Dr. Şule PEKYARDIMCI DOYMAMIŞ YAĞ ASİTLERİNİN OLUŞMASI Palmitoleik ve oleik asitlerin sentezi için palmitik ve stearik asitler hayvansal organizmalardaki çıkş maddeleridir.
ENZİMLER Enzim tanımı ve enzim araştırmalarının tarihçesi Enzimler, biyolojik sistemlerin reaksiyon katalizörleridirler; biyokimyasal olayların
 1 ENZİMLER Enzim tanımı ve enzim araştırmalarının tarihçesi Enzimler, biyolojik sistemlerin reaksiyon katalizörleridirler; biyokimyasal olayların vücutta yaşam ile uyumlu bir şekilde gerçekleşmesini sağlayan
1 ENZİMLER Enzim tanımı ve enzim araştırmalarının tarihçesi Enzimler, biyolojik sistemlerin reaksiyon katalizörleridirler; biyokimyasal olayların vücutta yaşam ile uyumlu bir şekilde gerçekleşmesini sağlayan
Enerji, Enzimler ve Metabolizma
 8 Enerji, Enzimler ve Metabolizma 8 Başlıklar 8.1 Biyolojik enerji dönüşümlerinde fizik yasaları 8.2 Biyokimyasal enerjide ATP 8.3 Enzimler 8.4 Enzimler nasıl çalışır? 8.5 Enzim aktivitelerinin kontrolü
8 Enerji, Enzimler ve Metabolizma 8 Başlıklar 8.1 Biyolojik enerji dönüşümlerinde fizik yasaları 8.2 Biyokimyasal enerjide ATP 8.3 Enzimler 8.4 Enzimler nasıl çalışır? 8.5 Enzim aktivitelerinin kontrolü
PROTEİN. Mısırdan. İzolasyon Kiti. Öğretmen Kılavuzu. Öğrenci Kılavuzu
 Mısırdan PROTEİN İzolasyon Kiti Öğretmen Kılavuzu a. Konu b. Kullanıcı Kitlesi c. Deney Süresi d. Materyaller e. Güvenlik f. Genel Bilgi g. Deney Öncesi Hazırlık h. Ön Bilgi i. Deneyin Yapılışı j. Deney
Mısırdan PROTEİN İzolasyon Kiti Öğretmen Kılavuzu a. Konu b. Kullanıcı Kitlesi c. Deney Süresi d. Materyaller e. Güvenlik f. Genel Bilgi g. Deney Öncesi Hazırlık h. Ön Bilgi i. Deneyin Yapılışı j. Deney
Toksisiteye Etki Eden Faktörler
 Toksisiteye Etki Eden Faktörler Toksik etki (toksisite) Tüm ksenobiyotiklerin biyolojik sistemlerde oluşturdukları zararlı etki. 2 Kimyasal Madde ile İlgili Faktörler Bir kimyasal maddenin metabolizmasında
Toksisiteye Etki Eden Faktörler Toksik etki (toksisite) Tüm ksenobiyotiklerin biyolojik sistemlerde oluşturdukları zararlı etki. 2 Kimyasal Madde ile İlgili Faktörler Bir kimyasal maddenin metabolizmasında
2. Kanun- Enerji dönüşümü sırasında bir miktar kullanılabilir kullanılamayan enerji ısı olarak kaybolur.
 Enerji Dönüşümleri Enerji Enerji; bir maddeyi taşıma veya değiştirme kapasitesi anlamına gelir. Enerji : Enerji bir formdan diğerine dönüştürülebilir. Kimyasal enerji ;moleküllerinin kimyasal bağlarının
Enerji Dönüşümleri Enerji Enerji; bir maddeyi taşıma veya değiştirme kapasitesi anlamına gelir. Enerji : Enerji bir formdan diğerine dönüştürülebilir. Kimyasal enerji ;moleküllerinin kimyasal bağlarının
METABOLİK DEĞİŞİKLİKLER VE FİZİKSEL PERFORMANS
 METABOLİK DEĞİŞİKLİKLER VE FİZİKSEL PERFORMANS Aerobik Antrenmanlar Sonucu Kasta Oluşan Adaptasyonlar Miyoglobin Miktarında oluşan Değişiklikler Hayvan deneylerinden elde edilen sonuçlar dayanıklılık antrenmanları
METABOLİK DEĞİŞİKLİKLER VE FİZİKSEL PERFORMANS Aerobik Antrenmanlar Sonucu Kasta Oluşan Adaptasyonlar Miyoglobin Miktarında oluşan Değişiklikler Hayvan deneylerinden elde edilen sonuçlar dayanıklılık antrenmanları
REAKSİYON KİNETİĞİ, REAKSİYONLARLA İLGİLİ TEMEL KAVRAMLAR VE METABOLİZMA. Doç.Dr. Mustafa ALTINIŞIK ADÜTF Biyokimya AD 2004
 REAKSİYON KİNETİĞİ, REAKSİYONLARLA İLGİLİ TEMEL KAVRAMLAR VE METABOLİZMA Doç.Dr. Mustafa ALTINIŞIK ADÜTF Biyokimya AD 2004 1 Reaksiyon (tepkime) türleri 1 Gerçekte tüm organik tepkimeler dört sınıftan
REAKSİYON KİNETİĞİ, REAKSİYONLARLA İLGİLİ TEMEL KAVRAMLAR VE METABOLİZMA Doç.Dr. Mustafa ALTINIŞIK ADÜTF Biyokimya AD 2004 1 Reaksiyon (tepkime) türleri 1 Gerçekte tüm organik tepkimeler dört sınıftan
11. SINIF KONU ANLATIMI 2 ATP-2
 11. SINIF KONU ANLATIMI 2 ATP-2 Fotosentez ve kemosentez reaksiyonları hem endergonik hem ekzergonik reaksiyonlardır. ATP molekülü ile hücrenin endergonik ve ekzergonik reaksiyonları arasında enerji transferini
11. SINIF KONU ANLATIMI 2 ATP-2 Fotosentez ve kemosentez reaksiyonları hem endergonik hem ekzergonik reaksiyonlardır. ATP molekülü ile hücrenin endergonik ve ekzergonik reaksiyonları arasında enerji transferini
KARBON ve CANLILARDAKİ MOLEKÜL ÇEŞİTLİLİĞİ
 KARBON ve CANLILARDAKİ MOLEKÜL ÇEŞİTLİLİĞİ Karbonun önemi Hücrenin % 70-95ʼ i sudan ibaret olup, geri kalan kısmın çoğu karbon içeren bileşiklerdir. Canlılığı oluşturan organik bileşiklerde karbon atomuna
KARBON ve CANLILARDAKİ MOLEKÜL ÇEŞİTLİLİĞİ Karbonun önemi Hücrenin % 70-95ʼ i sudan ibaret olup, geri kalan kısmın çoğu karbon içeren bileşiklerdir. Canlılığı oluşturan organik bileşiklerde karbon atomuna
OKSİJENLİ SOLUNUM
 1 ----------------------- OKSİJENLİ SOLUNUM ----------------------- **Oksijenli solunum (aerobik): Besinlerin, oksijen yardımıyla parçalanarak, ATP sentezlenmesine oksijenli solunum denir. Enzim C 6 H
1 ----------------------- OKSİJENLİ SOLUNUM ----------------------- **Oksijenli solunum (aerobik): Besinlerin, oksijen yardımıyla parçalanarak, ATP sentezlenmesine oksijenli solunum denir. Enzim C 6 H
BİY 315 BİYOKİMYA GİRİŞ. Yrd. Doç. Dr. Ebru SAATÇİ Güz Yarı Dönemi
 BİY 315 BİYOKİMYA GİRİŞ Yrd. Doç. Dr. Ebru SAATÇİ 2008-2009 Güz Yarı Dönemi 1 Anlatım Planı 1. Makromoleküller ve Su 2. Amino asitler ve Peptidler 3. Proteinler 4. Enzimler 5. Karbohidratlar 6. Nükleik
BİY 315 BİYOKİMYA GİRİŞ Yrd. Doç. Dr. Ebru SAATÇİ 2008-2009 Güz Yarı Dönemi 1 Anlatım Planı 1. Makromoleküller ve Su 2. Amino asitler ve Peptidler 3. Proteinler 4. Enzimler 5. Karbohidratlar 6. Nükleik
Canlıların yapısına en fazla oranda katılan organik molekül çeşididir. Deri, saç, tırnak, boynuz gibi oluşumların temel maddesi proteinlerdir.
 Canlıların yapısına en fazla oranda katılan organik molekül çeşididir. Deri, saç, tırnak, boynuz gibi oluşumların temel maddesi proteinlerdir. Proteinlerin yapısında; Karbon ( C ) Hidrojen ( H ) Oksijen
Canlıların yapısına en fazla oranda katılan organik molekül çeşididir. Deri, saç, tırnak, boynuz gibi oluşumların temel maddesi proteinlerdir. Proteinlerin yapısında; Karbon ( C ) Hidrojen ( H ) Oksijen
METABOLİZMA. Prof. Dr. Arif ALTINTAŞ
 METABOLİZMA Prof. Dr. Arif ALTINTAŞ altintas@veterinary.ankara.edu.tr Canlı organizmaların özelliği olarak Metabolizma Canlıların yapı taşlarının devamlı yapım, yıkım ve değişim içinde bulunması ve bu
METABOLİZMA Prof. Dr. Arif ALTINTAŞ altintas@veterinary.ankara.edu.tr Canlı organizmaların özelliği olarak Metabolizma Canlıların yapı taşlarının devamlı yapım, yıkım ve değişim içinde bulunması ve bu
YAZILIYA HAZIRLIK SORULARI. 9. Sınıf
 YAZILIYA HAZIRLIK SORULARI 9. Sınıf DOĞRU YANLIŞ SORULARI Nitel gözlemlerin güvenilirliği nicel gözlemlerden fazladır. Ökaryot hücrelerde kalıtım materyali çekirdek içinde bulunur. Ototrof beslenen canlılar
YAZILIYA HAZIRLIK SORULARI 9. Sınıf DOĞRU YANLIŞ SORULARI Nitel gözlemlerin güvenilirliği nicel gözlemlerden fazladır. Ökaryot hücrelerde kalıtım materyali çekirdek içinde bulunur. Ototrof beslenen canlılar
Bitki Fizyolojisi. 6. Hafta
 Bitki Fizyolojisi 6. Hafta 1 Fotosentezin karanlık tepkimelerinde karbondioksit özümlemesi; 1. C 3 bitkilerinde (Calvin-Benson mekanizması ile), 2. C 4 bitkilerinde (Hatch-Slack mekanizması ile), 3. KAM
Bitki Fizyolojisi 6. Hafta 1 Fotosentezin karanlık tepkimelerinde karbondioksit özümlemesi; 1. C 3 bitkilerinde (Calvin-Benson mekanizması ile), 2. C 4 bitkilerinde (Hatch-Slack mekanizması ile), 3. KAM
Kolesterol Metabolizması. Prof. Dr. Fidancı
 Kolesterol Metabolizması Prof. Dr. Fidancı Kolesterol oldukça önemli bir biyolojik moleküldür. Membran yapısında önemli rol oynar. Steroid hormonların ve safra asitlerinin sentezinde öncül maddedir. Diyet
Kolesterol Metabolizması Prof. Dr. Fidancı Kolesterol oldukça önemli bir biyolojik moleküldür. Membran yapısında önemli rol oynar. Steroid hormonların ve safra asitlerinin sentezinde öncül maddedir. Diyet
5.111 Ders Özeti #12. Konular: I. Oktet kuralından sapmalar
 5.111 Ders Özeti #12 Bugün için okuma: Bölüm 2.9 (3. Baskıda 2.10), Bölüm 2.10 (3. Baskıda 2.11), Bölüm 2.11 (3. Baskıda 2.12), Bölüm 2.3 (3. Baskıda 2.1), Bölüm 2.12 (3. Baskıda 2.13). Ders #13 için okuma:
5.111 Ders Özeti #12 Bugün için okuma: Bölüm 2.9 (3. Baskıda 2.10), Bölüm 2.10 (3. Baskıda 2.11), Bölüm 2.11 (3. Baskıda 2.12), Bölüm 2.3 (3. Baskıda 2.1), Bölüm 2.12 (3. Baskıda 2.13). Ders #13 için okuma:
Atomlar ve Moleküller
 Atomlar ve Moleküller Madde, uzayda yer işgal eden ve kütlesi olan herşeydir. Element, kimyasal tepkimelerle başka bileşiklere parçalanamayan maddedir. -Doğada 92 tane element bulunmaktadır. Bileşik, belli
Atomlar ve Moleküller Madde, uzayda yer işgal eden ve kütlesi olan herşeydir. Element, kimyasal tepkimelerle başka bileşiklere parçalanamayan maddedir. -Doğada 92 tane element bulunmaktadır. Bileşik, belli
HISTOLOJIDE BOYAMA YÖNTEMLERI. Dr. Yasemin Sezgin. yasemin sezgin
 HISTOLOJIDE BOYAMA YÖNTEMLERI Dr. Yasemin Sezgin yasemin sezgin HÜRESEL BOYAMANIN TEMEL PRENSİPLERİ Hem fiziksel hem kimyasal faktörler hücresel boyamayı etkilemektedir BOYAMA MEKANIZMASı Temelde boyanın
HISTOLOJIDE BOYAMA YÖNTEMLERI Dr. Yasemin Sezgin yasemin sezgin HÜRESEL BOYAMANIN TEMEL PRENSİPLERİ Hem fiziksel hem kimyasal faktörler hücresel boyamayı etkilemektedir BOYAMA MEKANIZMASı Temelde boyanın
7. PROKARYOTLARDA GEN İFADESİNİN DÜZENLENMESİ
 7. PROKARYOTLARDA GEN İFADESİNİN DÜZENLENMESİ Başlıklar 1. Prokaryotlar gen ifadesini çevre koşullarına göre düzenler 2. E. Coli de laktoz metabolizması 3. Lac operonu negatif kontrol 4. CAP pozitif kontrol
7. PROKARYOTLARDA GEN İFADESİNİN DÜZENLENMESİ Başlıklar 1. Prokaryotlar gen ifadesini çevre koşullarına göre düzenler 2. E. Coli de laktoz metabolizması 3. Lac operonu negatif kontrol 4. CAP pozitif kontrol
7. PROKARYOTLARDA GEN İFADESİNİN DÜZENLENMESİ
 7. PROKARYOTLARDA GEN İFADESİNİN DÜZENLENMESİ Başlıklar 1. Prokaryotlar gen ifadesini çevre koşullarına göre düzenler 2. E. Coli de laktoz metabolizması 3. Lac operonu negatif kontrol 4. CAP pozitif kontrol
7. PROKARYOTLARDA GEN İFADESİNİN DÜZENLENMESİ Başlıklar 1. Prokaryotlar gen ifadesini çevre koşullarına göre düzenler 2. E. Coli de laktoz metabolizması 3. Lac operonu negatif kontrol 4. CAP pozitif kontrol
TEST 1. Hücre Solunumu. 4. Aşağıda verilen moleküllerden hangisi oksijenli solunumda substrat olarak kullanılamaz? A) Glikoz B) Mineral C) Yağ asidi
 1. Termometre Çimlenen bezelye tohumlar Termos Çimlenen bezelye tohumları oksijenli solunum yaptığına göre yukarıdaki düzenekle ilgili, I. Termostaki oksijen miktarı azalır. II. Termometredeki sıcaklık
1. Termometre Çimlenen bezelye tohumlar Termos Çimlenen bezelye tohumları oksijenli solunum yaptığına göre yukarıdaki düzenekle ilgili, I. Termostaki oksijen miktarı azalır. II. Termometredeki sıcaklık
Metabolizma. Metabolizmaya giriş. Metabolizmaya giriş. Metabolizmayı tanımlayacak olursak
 Metabolizma Yaşamak için beslenmek zorundayız. Çünkü; Besinlerden enerji elde ederiz ve bu enerji; Hücresel faaliyetleri sürdürmemiz, Hareket etmemiz, Taşınım olaylarını gerçekleştirebilmemiz, Vücut sıcaklığını
Metabolizma Yaşamak için beslenmek zorundayız. Çünkü; Besinlerden enerji elde ederiz ve bu enerji; Hücresel faaliyetleri sürdürmemiz, Hareket etmemiz, Taşınım olaylarını gerçekleştirebilmemiz, Vücut sıcaklığını
Hücreler, kimyasal yasaların geçerli olduğu kimyasal fabrikalar olarak da kabul edilmektedir.
 Hücreler, kimyasal yasaların geçerli olduğu kimyasal fabrikalar olarak da kabul edilmektedir. Yaşamın temelini oluşturan kimyasal tepkimelerin tümü Metabolizma olarak adlandırılmaktadır. Bitki hücrelerinde
Hücreler, kimyasal yasaların geçerli olduğu kimyasal fabrikalar olarak da kabul edilmektedir. Yaşamın temelini oluşturan kimyasal tepkimelerin tümü Metabolizma olarak adlandırılmaktadır. Bitki hücrelerinde
FİZYOLOJİ Yrd.Doç.Dr. Önder AYTEKİN
 FİZYOLOJİ Yrd.Doç.Dr. Önder AYTEKİN Fizyolojide Temel Kavramlar FİZYOLOJİ Fizyolojinin amacı; Yaşamın başlangıcı- gelişimi ve ilerlemesini sağlayan fiziksel ve kimyasal etkenleri açıklamaktır (tanımlamak)
FİZYOLOJİ Yrd.Doç.Dr. Önder AYTEKİN Fizyolojide Temel Kavramlar FİZYOLOJİ Fizyolojinin amacı; Yaşamın başlangıcı- gelişimi ve ilerlemesini sağlayan fiziksel ve kimyasal etkenleri açıklamaktır (tanımlamak)
HORMONLAR VE ETKİ MEKANİZMALARI
 HORMONLAR VE ETKİ MEKANİZMALARI Receptörler İntrasellüler hidrofobik(llipofilik)ligandlara baglananlar Nükleer hormon reseptörleri Guanylate siklaz(nitrikoksid receptor) Hücre yüzey hidrofilik ligandlara
HORMONLAR VE ETKİ MEKANİZMALARI Receptörler İntrasellüler hidrofobik(llipofilik)ligandlara baglananlar Nükleer hormon reseptörleri Guanylate siklaz(nitrikoksid receptor) Hücre yüzey hidrofilik ligandlara
KİMYA-IV. Yrd. Doç. Dr. Yakup Güneş
 KİMYA-IV Yrd. Doç. Dr. Yakup Güneş Organik Kimyaya Giriş Kimyasal bileşikler, eski zamanlarda, elde edildikleri kaynaklara bağlı olarak Anorganik ve Organik olmak üzere, iki sınıf altında toplanmışlardır.
KİMYA-IV Yrd. Doç. Dr. Yakup Güneş Organik Kimyaya Giriş Kimyasal bileşikler, eski zamanlarda, elde edildikleri kaynaklara bağlı olarak Anorganik ve Organik olmak üzere, iki sınıf altında toplanmışlardır.
BİYOKİMYADA METABOLİK YOLLAR DERSİ VİZE SINAV SORULARI ( ) (Toplam 4 sayfa olup 25 soru içerir) (DERSİN KODU: 217)
 BİYOKİMYADA METABOLİK YOLLAR DERSİ VİZE SINAV SORULARI (05.11.2012) (Toplam 4 sayfa olup 25 soru içerir) (DERSİN KODU: 217) Adı Soyadı: A Fakülte No: 1- Asetil KoA, birçok amaçla kullanılabilir. Aşağıdakilerden
BİYOKİMYADA METABOLİK YOLLAR DERSİ VİZE SINAV SORULARI (05.11.2012) (Toplam 4 sayfa olup 25 soru içerir) (DERSİN KODU: 217) Adı Soyadı: A Fakülte No: 1- Asetil KoA, birçok amaçla kullanılabilir. Aşağıdakilerden
BİYOİNORGANİK KİMYA. Prof. Dr. Ahmet KARADAĞ
 BİYOİNORGANİK KİMYA Prof. Dr. Ahmet KARADAĞ 2018 Biyoinorganik Kimya 10.HAFTA İÇİNDEKİLER 1. Asit Katalizi İşleten Enzimler 2. Demir-Kükürt Proteinler ve Hem dışı Demir 1.Asit Katalizi İşleten Enzimler
BİYOİNORGANİK KİMYA Prof. Dr. Ahmet KARADAĞ 2018 Biyoinorganik Kimya 10.HAFTA İÇİNDEKİLER 1. Asit Katalizi İşleten Enzimler 2. Demir-Kükürt Proteinler ve Hem dışı Demir 1.Asit Katalizi İşleten Enzimler
ENZİMLER. Biyokimyasal reaksiyonları katalizleyen protein yapısındaki maddelere enzim
 ENZİMLER Biyokimyasal reaksiyonları katalizleyen protein yapısındaki maddelere enzim denir (Küçük bir grup katalitik RNA moleküllerinin haricinde tüm enzimler protein yapısındadırlar). Protein yapısında
ENZİMLER Biyokimyasal reaksiyonları katalizleyen protein yapısındaki maddelere enzim denir (Küçük bir grup katalitik RNA moleküllerinin haricinde tüm enzimler protein yapısındadırlar). Protein yapısında
İstanbul Tıp Fakültesi Tıbbi Biyoloji ABD Prof. Dr. Filiz Aydın
 İstanbul Tıp Fakültesi Tıbbi Biyoloji ABD Prof. Dr. Filiz Aydın Mitokondri, ökaryotik organizmanın farklı bir organeli Şekilleri küremsi veya uzun silindirik Çapları 0.5-1 μm uzunlukları 2-6 μm Sayıları
İstanbul Tıp Fakültesi Tıbbi Biyoloji ABD Prof. Dr. Filiz Aydın Mitokondri, ökaryotik organizmanın farklı bir organeli Şekilleri küremsi veya uzun silindirik Çapları 0.5-1 μm uzunlukları 2-6 μm Sayıları
PROKARYOTLARDA GEN EKSPRESYONU. ve REGÜLASYONU. (Genlerin Gen Ürünlerine Dönüşümünü Kontrol Eden Süreçler)
 PROKARYOTLARDA GEN EKSPRESYONU ve REGÜLASYONU (Genlerin Gen Ürünlerine Dönüşümünü Kontrol Eden Süreçler) Nihal EYVAZ (050559015) Şerife OKAY (050559025) Prof. Dr. Figen ERKOÇ Gazi Eğitim Fakültesi Gen
PROKARYOTLARDA GEN EKSPRESYONU ve REGÜLASYONU (Genlerin Gen Ürünlerine Dönüşümünü Kontrol Eden Süreçler) Nihal EYVAZ (050559015) Şerife OKAY (050559025) Prof. Dr. Figen ERKOÇ Gazi Eğitim Fakültesi Gen
Replikasyon, Transkripsiyon ve Translasyon. Yrd. Doç. Dr. Osman İBİŞ
 Replikasyon, Transkripsiyon ve Translasyon Yrd. Doç. Dr. Osman İBİŞ DNA replikasyonu DNA nın replikasyonu, DNA molekülünün, sakladığı genetik bilgilerin sonraki nesillere aktarılması için kendi kopyasını
Replikasyon, Transkripsiyon ve Translasyon Yrd. Doç. Dr. Osman İBİŞ DNA replikasyonu DNA nın replikasyonu, DNA molekülünün, sakladığı genetik bilgilerin sonraki nesillere aktarılması için kendi kopyasını
Serbest radikal. yörüngelerinde) eşleşmemiş tek. gösteren, nötr ya da iyonize tüm atom veya moleküllere denir.
 Superoxide Dismutase Hazırlayanlar: Funda İLHAN (050559017) Ebru KORKMAZ (050559021) Mehtap BİRKAN (050559008) Nihan BAŞARAN (050559007) Prof. Dr. Figen ERKOÇ Gazi Eğitim Fakültesi GAZİ İ ÜNİVERSİTESİİ
Superoxide Dismutase Hazırlayanlar: Funda İLHAN (050559017) Ebru KORKMAZ (050559021) Mehtap BİRKAN (050559008) Nihan BAŞARAN (050559007) Prof. Dr. Figen ERKOÇ Gazi Eğitim Fakültesi GAZİ İ ÜNİVERSİTESİİ
Hücre Solunumu: Kimyasal Enerji Eldesi
 Hücre Solunumu: Kimyasal Enerji Eldesi Hücre solunumu ve fermentasyon enerji veren katabolik yollardır. Organik moleküllerin atomları enerji depolamaya müsaittir. Hücreler enzimler aracılığı ile organik
Hücre Solunumu: Kimyasal Enerji Eldesi Hücre solunumu ve fermentasyon enerji veren katabolik yollardır. Organik moleküllerin atomları enerji depolamaya müsaittir. Hücreler enzimler aracılığı ile organik
Enzimlerin Yapısı. Enzimler biyokatalizörlerdir,
 Enzimler biyokatalizörlerdir,, Prof. Dr. Muhsin KONUK H 2 O 2 H 2 O + ½ O 2 A.E = 18.16 kkal/mol Kollaidal platin A.E= 11.71 kkal/mol Katalaz A.E = 1.91 kkal/mol Enzimlerin Yapısı Basit enzimler: Pepsin,
Enzimler biyokatalizörlerdir,, Prof. Dr. Muhsin KONUK H 2 O 2 H 2 O + ½ O 2 A.E = 18.16 kkal/mol Kollaidal platin A.E= 11.71 kkal/mol Katalaz A.E = 1.91 kkal/mol Enzimlerin Yapısı Basit enzimler: Pepsin,
Enzimlerin Tanımı ve Özellikleri. Dr. Akın Yeşilkaya 2014-2015 Eğitim Dönemi
 Enzimlerin Tanımı ve Özellikleri Dr. Akın Yeşilkaya 2014-2015 Eğitim Dönemi Amaç Biyokimyasal katalizörlerin yapısını ve fonksiyonunu tanımlamak Enzimatik reaksiyonların kinetiği kullanılarak özelliklerini
Enzimlerin Tanımı ve Özellikleri Dr. Akın Yeşilkaya 2014-2015 Eğitim Dönemi Amaç Biyokimyasal katalizörlerin yapısını ve fonksiyonunu tanımlamak Enzimatik reaksiyonların kinetiği kullanılarak özelliklerini
Referans:e-TUS İpucu Serisi Biyokimya Ders Notları Sayfa:368
 21. Aşağıdakilerden hangisinin fizyolojik ph'de tamponlama etkisi vardır? A) CH3COC- / CH3COOH (pka = 4.76) B) HPO24- / H2PO-4 (pka = 6.86) C) NH3/NH+4(pKa =9.25) D) H2PO-4 / H3PO4 (pka =2.14) E) PO34-/
21. Aşağıdakilerden hangisinin fizyolojik ph'de tamponlama etkisi vardır? A) CH3COC- / CH3COOH (pka = 4.76) B) HPO24- / H2PO-4 (pka = 6.86) C) NH3/NH+4(pKa =9.25) D) H2PO-4 / H3PO4 (pka =2.14) E) PO34-/
HÜCRE SĠNYAL OLAYLARI PROF. DR. FATMA SAVRAN OĞUZ
 HÜCRE SĠNYAL OLAYLARI PROF. DR. FATMA SAVRAN OĞUZ Çok hücreli organizmaların kompleks omurgalılara evrimi, hücreler birbirleriyle iletişim kuramasalardı mümkün olmazdı. Hücre-hücre Hücre-matriks etkileşimini
HÜCRE SĠNYAL OLAYLARI PROF. DR. FATMA SAVRAN OĞUZ Çok hücreli organizmaların kompleks omurgalılara evrimi, hücreler birbirleriyle iletişim kuramasalardı mümkün olmazdı. Hücre-hücre Hücre-matriks etkileşimini
Notlarımıza iyi çalışan kursiyerlerimiz soruların çoğunu rahatlıkla yapılabileceklerdir.
 Biyokimya sınavı orta zorlukta bir sınavdı. 1-2 tane zor soru ve 5-6 tane eski soru soruldu. Soruların; 16 tanesi temel bilgi, 4 tanesi ise detay bilgi ölçmekteydi. 33. soru mikrobiyolojiye daha yakındır.
Biyokimya sınavı orta zorlukta bir sınavdı. 1-2 tane zor soru ve 5-6 tane eski soru soruldu. Soruların; 16 tanesi temel bilgi, 4 tanesi ise detay bilgi ölçmekteydi. 33. soru mikrobiyolojiye daha yakındır.
1. Öğretmen Kılavuzu. 2. Öğrenci Kılavuzu
 1. Öğretmen Kılavuzu a. Konu b. Kullanıcı Kitlesi c. Deney Süresi d. Materyaller e. Güvenlik f. Genel Bilgi g. Deney Öncesi Hazırlık h. Ön Bilgi i. Deneyin Yapılışı (Prosedür) j. Deney Sonuçları k. Öğrenci
1. Öğretmen Kılavuzu a. Konu b. Kullanıcı Kitlesi c. Deney Süresi d. Materyaller e. Güvenlik f. Genel Bilgi g. Deney Öncesi Hazırlık h. Ön Bilgi i. Deneyin Yapılışı (Prosedür) j. Deney Sonuçları k. Öğrenci
Yağ Asitlerinin Metabolizması- I Yağ Asitlerinin Yıkılması (Oksidasyonu)
 Yağ Asitlerinin Metabolizması- I Yağ Asitlerinin Yıkılması (Oksidasyonu) Yrd. Doç. Dr. Bekir Engin Eser Zirve Üniversitesi EBN Tıp Fakültesi Tıbbi Biyokimya A.B.D. Yağ Asitleri Uzun karbon zincirine sahip
Yağ Asitlerinin Metabolizması- I Yağ Asitlerinin Yıkılması (Oksidasyonu) Yrd. Doç. Dr. Bekir Engin Eser Zirve Üniversitesi EBN Tıp Fakültesi Tıbbi Biyokimya A.B.D. Yağ Asitleri Uzun karbon zincirine sahip
Biochemistry Chapter 4: Biomolecules. Hikmet Geçkil, Professor Department of Molecular Biology and Genetics Inonu University
 Biochemistry Chapter 4: Biomolecules, Professor Department of Molecular Biology and Genetics Inonu University Biochemistry/Hikmet Geckil Chapter 4: Biomolecules 2 BİYOMOLEKÜLLER Bilim adamları hücreyi
Biochemistry Chapter 4: Biomolecules, Professor Department of Molecular Biology and Genetics Inonu University Biochemistry/Hikmet Geckil Chapter 4: Biomolecules 2 BİYOMOLEKÜLLER Bilim adamları hücreyi
-- Giriş -- Enzimler ve katalizörler -- Enzimlerin isimlendirilmesi -- Enzimlerin etki mekanizması -- Enzimlerin yapısı -- Enzimler ve prostetik
 -- Giriş -- Enzimler ve katalizörler -- Enzimlerin isimlendirilmesi -- Enzimlerin etki mekanizması -- Enzimlerin yapısı -- Enzimler ve prostetik gruplar -- Enzimlerin sınıflandırılması -- Önemli koenzim
-- Giriş -- Enzimler ve katalizörler -- Enzimlerin isimlendirilmesi -- Enzimlerin etki mekanizması -- Enzimlerin yapısı -- Enzimler ve prostetik gruplar -- Enzimlerin sınıflandırılması -- Önemli koenzim
Canlının yapısında bulunan organik molekül grupları; o Karbonhidratlar o Yağlar o Proteinler o Enzimler o Vitaminler o Nükleik asitler ve o ATP
 Tamamı karbon ( C ) elementi taşıyan moleküllerden oluşan bir gruptur. Doğal organik bileşikler canlı vücudunda sentezlenir. Ancak günümüzde birçok organik bileşik ( vitamin, hormon, antibiyotik vb. )
Tamamı karbon ( C ) elementi taşıyan moleküllerden oluşan bir gruptur. Doğal organik bileşikler canlı vücudunda sentezlenir. Ancak günümüzde birçok organik bileşik ( vitamin, hormon, antibiyotik vb. )
13 HÜCRESEL SOLUNUM LAKTİK ASİT FERMANTASYONU
 13 HÜCRESEL SOLUNUM LAKTİK ASİT FERMANTASYONU Laktik Asit Fermantasyonu Glikozdan oksijen yokluğunda laktik asit üretilmesine LAKTİK ASİT FERMANTASYONU denir. Bütün canlılarda sitoplazmada gerçekleşir.
13 HÜCRESEL SOLUNUM LAKTİK ASİT FERMANTASYONU Laktik Asit Fermantasyonu Glikozdan oksijen yokluğunda laktik asit üretilmesine LAKTİK ASİT FERMANTASYONU denir. Bütün canlılarda sitoplazmada gerçekleşir.
SU VE HÜCRE İLİŞKİSİ
 SU VE HÜCRE İLİŞKİSİ Oluşturacağı her 1 g organik madde için bitkinin 500 g kadar suyu kökleriyle alması ve tepe (uç) noktasına kadar taşıyarak atmosfere aktarması gerekir. Normal su düzeyinde hayvan hücrelerinin
SU VE HÜCRE İLİŞKİSİ Oluşturacağı her 1 g organik madde için bitkinin 500 g kadar suyu kökleriyle alması ve tepe (uç) noktasına kadar taşıyarak atmosfere aktarması gerekir. Normal su düzeyinde hayvan hücrelerinin
ENZİMATİK ANALİZ VE AKTİVİTE TAYİNLERİ
 ENZİMATİK ANALİZ VE AKTİVİTE TAYİNLERİ Enzim Tanımı Sınıflandırma Üç Boyutlu Yapı Etkime Şekli Enzimler biyolojik katalizörlerdir, yani biyokimyasal reaksiyonları hızlandıran biyolojik kökenli maddelerdir.
ENZİMATİK ANALİZ VE AKTİVİTE TAYİNLERİ Enzim Tanımı Sınıflandırma Üç Boyutlu Yapı Etkime Şekli Enzimler biyolojik katalizörlerdir, yani biyokimyasal reaksiyonları hızlandıran biyolojik kökenli maddelerdir.
EGZERSİZ ENERJİ KAYNAKLARI DOÇ.DR.MİTAT KOZ
 EGZERSİZ ENERJİ KAYNAKLARI DOÇ.DR.MİTAT KOZ 3 farklı enerji sistemi Acil enerji sistemi Kısa süreli enerji sistemi Uzun süreli enerji sistemi Acil enerji ATP -------------> ADP Creatine + ADP ------------>
EGZERSİZ ENERJİ KAYNAKLARI DOÇ.DR.MİTAT KOZ 3 farklı enerji sistemi Acil enerji sistemi Kısa süreli enerji sistemi Uzun süreli enerji sistemi Acil enerji ATP -------------> ADP Creatine + ADP ------------>
EGZERSİZ ENERJİ KAYNAKLARI DOÇ.DR.MİTAT KOZ
 EGZERSİZ ENERJİ KAYNAKLARI DOÇ.DR.MİTAT KOZ 3 farklı enerji sistemi Acil enerji sistemi Kısa süreli enerji sistemi Uzun süreli enerji sistemi Acil enerji ATP -------------> ADP Creatine + ADP ------------>
EGZERSİZ ENERJİ KAYNAKLARI DOÇ.DR.MİTAT KOZ 3 farklı enerji sistemi Acil enerji sistemi Kısa süreli enerji sistemi Uzun süreli enerji sistemi Acil enerji ATP -------------> ADP Creatine + ADP ------------>
Dağılımı belirleyen primer parametre plazma proteinlerine bağlanma oranıdır.
 DAĞILIM AŞAMASINI ETKİLEYEN ÖNEMLİ FAKTÖRLER Dağılımı belirleyen primer parametre plazma proteinlerine bağlanma oranıdır. Bu bağlanma en fazla albüminle olur. Bağlanmanın en önemli özelliği nonselektif
DAĞILIM AŞAMASINI ETKİLEYEN ÖNEMLİ FAKTÖRLER Dağılımı belirleyen primer parametre plazma proteinlerine bağlanma oranıdır. Bu bağlanma en fazla albüminle olur. Bağlanmanın en önemli özelliği nonselektif
T. C. İSTANBUL BİLİM ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ BİYOKİMYA ANABİLİM DALI YÜKSEK LİSANS PROGRAMI EĞİTİM-ÖĞRETİM YILI MÜFREDATI
 I. YARIYILI T. C. İSTANBUL BİLİM ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ BİYOKİMYA ANABİLİM DALI YÜKSEK LİSANS PROGRAMI 2016-2017 EĞİTİM-ÖĞRETİM YILI MÜFREDATI B 601 Temel Biyokimya I Zorunlu 3 0 3 4 B
I. YARIYILI T. C. İSTANBUL BİLİM ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ BİYOKİMYA ANABİLİM DALI YÜKSEK LİSANS PROGRAMI 2016-2017 EĞİTİM-ÖĞRETİM YILI MÜFREDATI B 601 Temel Biyokimya I Zorunlu 3 0 3 4 B
BİYOKİMYAYA GİRİŞ: ATOM, MOLEKÜL, ORGANİK BİLEŞİKLER
 BİYOKİMYAYA GİRİŞ: ATOM, MOLEKÜL, ORGANİK BİLEŞİKLER Biyokimyanın tanımı yaşamın temel kimyası ile ilgilenen bilim dalı (Bios, Yunancada yaşam demektir.) canlı sistemin yapısını ve fonksiyonlarını kimyasal
BİYOKİMYAYA GİRİŞ: ATOM, MOLEKÜL, ORGANİK BİLEŞİKLER Biyokimyanın tanımı yaşamın temel kimyası ile ilgilenen bilim dalı (Bios, Yunancada yaşam demektir.) canlı sistemin yapısını ve fonksiyonlarını kimyasal
8. Hafta Amino Asitler, Peptidler ve Proteinler: Prof. Dr. Şule PEKYARDIMCI PEPTİT BAĞI
 8. Hafta Amino Asitler, Peptidler ve Proteinler: Prof. Dr. Şule PEKYARDIMCI PEPTİT BAĞI Bir amino asidin -amino grubu 2. bir amino asidin -karboksil grubuyla reaksiyona girince bir molekül su ayrılarak
8. Hafta Amino Asitler, Peptidler ve Proteinler: Prof. Dr. Şule PEKYARDIMCI PEPTİT BAĞI Bir amino asidin -amino grubu 2. bir amino asidin -karboksil grubuyla reaksiyona girince bir molekül su ayrılarak
Tüm yaşayan organizmalar suya ihtiyaç duyarlar Çoğu hücre suyla çevrilidir ve hücrelerin yaklaşık %70 95 kadarı sudan oluşur. Yerküre içerdiği su ile
 Su Kimyası Tüm yaşayan organizmalar suya ihtiyaç duyarlar Çoğu hücre suyla çevrilidir ve hücrelerin yaklaşık %70 95 kadarı sudan oluşur. Yerküre içerdiği su ile canlılık için gerekli ortamı sunar. Canlıların
Su Kimyası Tüm yaşayan organizmalar suya ihtiyaç duyarlar Çoğu hücre suyla çevrilidir ve hücrelerin yaklaşık %70 95 kadarı sudan oluşur. Yerküre içerdiği su ile canlılık için gerekli ortamı sunar. Canlıların
00220 Gıda Biyokimyası
 00220 Gıda Biyokimyası Hazırlayan: Doç.Gökhan DURMAZ 00220 Gıda Biyokimyası-Şubat 2013 1 Bu notların hazırlanmasında aşağıdaki eserlerden yararlanılmıştır; Biyokimya, Engin Gözükara, Nobel Tip Kitabevi,
00220 Gıda Biyokimyası Hazırlayan: Doç.Gökhan DURMAZ 00220 Gıda Biyokimyası-Şubat 2013 1 Bu notların hazırlanmasında aşağıdaki eserlerden yararlanılmıştır; Biyokimya, Engin Gözükara, Nobel Tip Kitabevi,
Beslenmeden hemen sonra, artan kan glikoz seviyesi ile birlikte insülin hormon seviyesi de artar. Buna zıt olarak glukagon hormon düzeyi azalır.
 Seçmeli Ders: Dokular ve Organlar Arası Metabolik İlişkiler 1.HAFTA Normal metabolizmada aktif olan günlük akış; Yaşamak için gerekli olan enerji akışı, dışardan alınan gıdalardan elde edilir. Kullanılan
Seçmeli Ders: Dokular ve Organlar Arası Metabolik İlişkiler 1.HAFTA Normal metabolizmada aktif olan günlük akış; Yaşamak için gerekli olan enerji akışı, dışardan alınan gıdalardan elde edilir. Kullanılan
Enzimler, reaksiyon hızlarını büyük oranda artıran ve bunu mükemmel bir. seçicilikle yapan proteinlerden oluşan biyolojik katalizörlerdir.
 MIT OpenCourseWare http://ocw.mit.edu 5.60 Thermodinamik ve Kinetik Bahar 2008 Bu malzemelere atıfta bulunmak veya kullanım şartlarını öğrenmek için http://ocw.mit.edu/terms sitesini ziyaret ediniz Okuma
MIT OpenCourseWare http://ocw.mit.edu 5.60 Thermodinamik ve Kinetik Bahar 2008 Bu malzemelere atıfta bulunmak veya kullanım şartlarını öğrenmek için http://ocw.mit.edu/terms sitesini ziyaret ediniz Okuma
I. YARIYIL TEMEL BİYOKİMYA I (B 601 TEORİK 3, 3 KREDİ)
 T.C. İSTANBUL BİLİM ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ BİYOKİMYA ANABİLİM DALI YÜKSEK LİSANS PROGRAMI 2014-2015 EĞİTİM-ÖĞRETİM YILI DERS İÇERİKLERİ I. YARIYIL TEMEL BİYOKİMYA I (B 601 TEORİK 3, 3
T.C. İSTANBUL BİLİM ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ BİYOKİMYA ANABİLİM DALI YÜKSEK LİSANS PROGRAMI 2014-2015 EĞİTİM-ÖĞRETİM YILI DERS İÇERİKLERİ I. YARIYIL TEMEL BİYOKİMYA I (B 601 TEORİK 3, 3
ÖNFORMÜLASYON 5. hafta
 ÖNFORMÜLASYON 5. hafta Partisyon katsayısı (P y/s ): Bir etkin maddenin yağ/su bölümlerindeki dağılımıdır. Lipofilik/hidrofilik özelliklerinin tayin edilmesidir. Oktanol içinde tayin edilir Partisyon katsayısının
ÖNFORMÜLASYON 5. hafta Partisyon katsayısı (P y/s ): Bir etkin maddenin yağ/su bölümlerindeki dağılımıdır. Lipofilik/hidrofilik özelliklerinin tayin edilmesidir. Oktanol içinde tayin edilir Partisyon katsayısının
DÖNEM 2- I. DERS KURULU AMAÇ VE HEDEFLERİ
 DÖNEM 2- I. DERS KURULU AMAÇ VE HEDEFLERİ Kan, kalp, dolaşım ve solunum sistemine ait normal yapı ve fonksiyonların öğrenilmesi 1. Kanın bileşenlerini, fiziksel ve fonksiyonel özelliklerini sayar, plazmanın
DÖNEM 2- I. DERS KURULU AMAÇ VE HEDEFLERİ Kan, kalp, dolaşım ve solunum sistemine ait normal yapı ve fonksiyonların öğrenilmesi 1. Kanın bileşenlerini, fiziksel ve fonksiyonel özelliklerini sayar, plazmanın
LİPİTLERİN ORGANİZMADAKİ GÖREVLERİ SAFRA ASİTLERİ
 8. Hafta: Lipit Metabolizması: Prof. Dr. Şule PEKYARDIMCI LİPİTLERİN ORGANİZMADAKİ GÖREVLERİ 1. Yapısal fonksiyon görevi: Lipitler fosfolipitler başta olmak üzere hücre ve organel zarlarının yapısına girer
8. Hafta: Lipit Metabolizması: Prof. Dr. Şule PEKYARDIMCI LİPİTLERİN ORGANİZMADAKİ GÖREVLERİ 1. Yapısal fonksiyon görevi: Lipitler fosfolipitler başta olmak üzere hücre ve organel zarlarının yapısına girer
AMİNO ASİTLER. COO - H 3 N + C a H R
 AMİNO ASİTLER AMİNO ASİTLER H 3 N + C a H R a-amino Asit (AA) Yapılarında Amino (-NH 3 + ) grubu Karboksil (- ) grubu Yan zincir ( R ) taşıyan organik bileşiklerdir (a-amino karboksilik asitler) Kısa zincirli
AMİNO ASİTLER AMİNO ASİTLER H 3 N + C a H R a-amino Asit (AA) Yapılarında Amino (-NH 3 + ) grubu Karboksil (- ) grubu Yan zincir ( R ) taşıyan organik bileşiklerdir (a-amino karboksilik asitler) Kısa zincirli
Hücre solunumu ve fermentasyon enerji veren katabolik yollardır. (ΔG=-686 kcal/mol)
 hücre solunumu Hücre solunumu ve fermentasyon enerji veren katabolik yollardır. (ΔG=-686 kcal/mol) C 6 H 12 O 6 + 6 O 2 6 CO 2 + 6 H 2 0 + enerji (ATP + ısı) Hücre solunumu karbonhidratlar, yağlar ve protein
hücre solunumu Hücre solunumu ve fermentasyon enerji veren katabolik yollardır. (ΔG=-686 kcal/mol) C 6 H 12 O 6 + 6 O 2 6 CO 2 + 6 H 2 0 + enerji (ATP + ısı) Hücre solunumu karbonhidratlar, yağlar ve protein
Kolesterol Metabolizması. Yrd. Doç. Dr. Bekir Engin Eser Zirve Üniversitesi EBN Tıp Fakültesi Tıbbi Biyokimya A.B.D.
 Kolesterol Metabolizması Yrd. Doç. Dr. Bekir Engin Eser Zirve Üniversitesi EBN Tıp Fakültesi Tıbbi Biyokimya A.B.D. Steroidler Steroidlerin yapı taşı birbirine yapışık 4 halkalı karbon iskelehdir, bu yapı
Kolesterol Metabolizması Yrd. Doç. Dr. Bekir Engin Eser Zirve Üniversitesi EBN Tıp Fakültesi Tıbbi Biyokimya A.B.D. Steroidler Steroidlerin yapı taşı birbirine yapışık 4 halkalı karbon iskelehdir, bu yapı
Akıllı Defter. 9.Sınıf Biyoloji. vitaminler,hormonlar,nükleik asitler. sembole tıklayınca etkinlik açılır. sembole tıklayınca ppt sunumu açılır
 9.Sınıf Biyoloji 1 Akıllı Defter vitaminler,hormonlar,nükleik asitler sembole tıklayınca etkinlik açılır sembole tıklayınca ppt sunumu açılır sembole tıklayınca video açılır 1 VİTAMİNLER ***Vitaminler:
9.Sınıf Biyoloji 1 Akıllı Defter vitaminler,hormonlar,nükleik asitler sembole tıklayınca etkinlik açılır sembole tıklayınca ppt sunumu açılır sembole tıklayınca video açılır 1 VİTAMİNLER ***Vitaminler:
ENDOKRİN BEZ EKZOKRİN BEZ. Tiroid bezi. Deri. Hormon salgısı. Endokrin hücreler Kanal. Kan akımı. Ter bezi. Ekzokrin hücreler
 ENDOKRİN SİSTEM Endokrin sistem, sinir sistemiyle işbirliği içinde çalışarak vücut fonksiyonlarını kontrol eder ve vücudumuzun farklı bölümleri arasında iletişim sağlar. 1 ENDOKRİN BEZ Tiroid bezi EKZOKRİN
ENDOKRİN SİSTEM Endokrin sistem, sinir sistemiyle işbirliği içinde çalışarak vücut fonksiyonlarını kontrol eder ve vücudumuzun farklı bölümleri arasında iletişim sağlar. 1 ENDOKRİN BEZ Tiroid bezi EKZOKRİN
Solunumda organik bileşikler karbondioksite yükseltgenir ve absorbe edilen oksijen ise suya indirgenir.
 Solunum bütün aktif hücrelerde oksijenin absorbe edilmesi ve buna eşdeğer miktarda karbondioksitin salınması şeklinde sürekli olarak devam eden bir prosestir. Solunumda organik bileşikler karbondioksite
Solunum bütün aktif hücrelerde oksijenin absorbe edilmesi ve buna eşdeğer miktarda karbondioksitin salınması şeklinde sürekli olarak devam eden bir prosestir. Solunumda organik bileşikler karbondioksite
BİYOİNORGANİK KİMYA 5. HAFTA
 BİYOİNORGANİK KİMYA 5. HAFTA ESER ELEMENTLER İnsan vücudunda en yüksek oranda bulunan element oksijendir. İkincisi ise karbondur. İnsan vücudunun kütlesinin %99 u sadece 6 elementten meydana gelir. Bunlar:
BİYOİNORGANİK KİMYA 5. HAFTA ESER ELEMENTLER İnsan vücudunda en yüksek oranda bulunan element oksijendir. İkincisi ise karbondur. İnsan vücudunun kütlesinin %99 u sadece 6 elementten meydana gelir. Bunlar:
ĐÇERĐK. Vitamin B6 Formları. LOGO www.themegallery.com. Tarihsel Bakış. Yapısal Formüller. 4 Piridoksin Piridoksal Piridoksamin Piridoksal-fosfat
 LOGO ĐÇERĐK Tarihsel Bakış B6 Vitamininin Genel Özellikleri Kimyasal Ve Biyolojik Fonksiyonları Biyokimyasal Fonksiyonları YRD. DOÇ. DR. BEKİR ÇÖL SUNAN: DUYGU BAHÇE Emilim, Transport ve Metabolizma İmmün
LOGO ĐÇERĐK Tarihsel Bakış B6 Vitamininin Genel Özellikleri Kimyasal Ve Biyolojik Fonksiyonları Biyokimyasal Fonksiyonları YRD. DOÇ. DR. BEKİR ÇÖL SUNAN: DUYGU BAHÇE Emilim, Transport ve Metabolizma İmmün
KARADENİZ ALABALIĞI (Salmo trutta Labrax) BÖBREK, KARACİĞER, SOLUNGAÇ VE KAS DOKULARINDAN KARBONİK ANHİDRAZ ENZİMİNİN SAFLAŞTIRILMASI,
 KARADENİZ ALABALIĞI (Salmo trutta Labrax) BÖBREK, KARACİĞER, SOLUNGAÇ VE KAS DOKULARINDAN KARBONİK ANHİDRAZ ENZİMİNİN SAFLAŞTIRILMASI, KARAKTERİZASYONU VE BAZI METAL İYONLARININ ENZİM AKTİVİTESİ ÜZERİNE
KARADENİZ ALABALIĞI (Salmo trutta Labrax) BÖBREK, KARACİĞER, SOLUNGAÇ VE KAS DOKULARINDAN KARBONİK ANHİDRAZ ENZİMİNİN SAFLAŞTIRILMASI, KARAKTERİZASYONU VE BAZI METAL İYONLARININ ENZİM AKTİVİTESİ ÜZERİNE
Amino Asitler. Amino asitler, yapılarında hem amino grubu ( NH 2 ) hem de karboksil grubu ( COOH) içeren bileşiklerdir.
 Amino Asitler Amino asitler, yapılarında hem amino grubu ( NH 2 ) hem de karboksil grubu ( COOH) içeren bileşiklerdir. 1 Fizyolojik ph da, amino asitlerin amino grubu proton taşır ve pozitif yüklüdür;
Amino Asitler Amino asitler, yapılarında hem amino grubu ( NH 2 ) hem de karboksil grubu ( COOH) içeren bileşiklerdir. 1 Fizyolojik ph da, amino asitlerin amino grubu proton taşır ve pozitif yüklüdür;
Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı
 Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani madde yani bileşik
Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani madde yani bileşik
Yağ Asitlerinin Biyosentezi. Prof. Dr. Fidancı
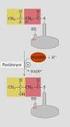 Yağ Asitlerinin Biyosentezi Prof. Dr. Fidancı Yağ asitlerinin sentezi özellikle karaciğer ve yağ dokusu hücrelerinde iki şekilde gerçekleşir. Bu sentez şekillerinden biri yağ asitlerinin, hücrenin sitoplazma
Yağ Asitlerinin Biyosentezi Prof. Dr. Fidancı Yağ asitlerinin sentezi özellikle karaciğer ve yağ dokusu hücrelerinde iki şekilde gerçekleşir. Bu sentez şekillerinden biri yağ asitlerinin, hücrenin sitoplazma
Serbest radikallerin etkileri ve oluşum mekanizmaları
 Serbest radikallerin etkileri ve oluşum mekanizmaları Serbest radikallerin yapısında, çoğunlukla oksijen yer almaktadır. (reaktif oksijen türleri=ros) ROS oksijen içeren, küçük ve oldukça reaktif moleküllerdir.
Serbest radikallerin etkileri ve oluşum mekanizmaları Serbest radikallerin yapısında, çoğunlukla oksijen yer almaktadır. (reaktif oksijen türleri=ros) ROS oksijen içeren, küçük ve oldukça reaktif moleküllerdir.
Paylaşılan elektron ya da elektronlar, her iki çekirdek etrafında dolanacaklar, iki çekirdek arasındaki bölgede daha uzun süre bulundukları için bu
 4.Kimyasal Bağlar Kimyasal Bağlar Aynı ya da farklı cins atomları bir arada tutan kuvvetlere kimyasal bağlar denir. Pek çok madde farklı element atomlarının birleşmesiyle meydana gelmiştir. İyonik bağ
4.Kimyasal Bağlar Kimyasal Bağlar Aynı ya da farklı cins atomları bir arada tutan kuvvetlere kimyasal bağlar denir. Pek çok madde farklı element atomlarının birleşmesiyle meydana gelmiştir. İyonik bağ
Cuma materyallerinden. Le Châtelier İlkesi: Denge halindeki bir sisteme dış etki uygulandığı zaman, denge dış etkiyi şekilde davranır.
 35.1 5.111 Ders 35 Kinetik Konu: Kataliz Bölüm 13 (kısım 13.14-13.15) Cuma materyallerinden Le Châtelier İlkesi: Denge halindeki bir sisteme dış etki uygulandığı zaman, denge dış etkiyi şekilde davranır.
35.1 5.111 Ders 35 Kinetik Konu: Kataliz Bölüm 13 (kısım 13.14-13.15) Cuma materyallerinden Le Châtelier İlkesi: Denge halindeki bir sisteme dış etki uygulandığı zaman, denge dış etkiyi şekilde davranır.
