YÜKSEK LİSANS TEZİ Nihan UYSAL ( ) Doç. Dr. Yaşar YILMAZ. Doç. Dr. Orhan GÜNEY (İ.T.Ü.)
|
|
|
- Gözde Başer
- 6 yıl önce
- İzleme sayısı:
Transkript
1 İSTANBUL TEKNİK ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ AKRİLAMİD POLİMERİZASYON SÜRECİNİN FLORESAN MOLEKÜLLER ARACILIĞI İLE EŞZAMANLI OLARAK TAKİBİ YÜKSEK LİSANS TEZİ Nihan UYSAL ( ) Tezin Enstitüye Verildiği Tarih : 7 Mayıs 2007 Tezin Savunulduğu Tarih : 11 Haziran 2007 Tez Danışmanı : Diğer Jüri Üyeleri Doç. Dr. Yaşar YILMAZ Prof. Dr. Ahmet Togo GİZ (İ.T.Ü.) Doç. Dr. Orhan GÜNEY (İ.T.Ü.) HAZİRAN 2007
2 ÖNSÖZ Lisans eğitimimden itibaren bana her zaman destek olan değerli hocam Doç. Dr. Yaşar YILMAZ a bu tez çalışması vasıtasıyla teşekkür etmek istiyorum. Yorulmak bilmeden, azimle çalışan, başaran, her zaman-her konuda yardımcı olan ve aynı zamanda insanlığı ile de bana örnek olan hocamla umarım daha birçok güzel çalışmalar yapacağız. Ayrıca, MOSpekt Laboratuarında çalışan, emek veren herkese, özellikle Ali Gelir e, deneysel çalışmalarımda yardımlarından dolayı teşekkür ediyorum. Beni yetiştiren, arkamda hep varlıklarını, desteklerini hissettiğim annem, babam ve abim... Bana doğruluğu, çalışmayı öğrettiğiniz için ve hep güzel şeyler yaşattığınız için sizlere çok teşekkürler. Sizlerin bana verdiği huzur ve güven sayesinde umarım daha çok ilerleyeceğim. Bu tez çalışmasında uzaklarda da olsa desteğini, sevgisini hep hissettiren Fuat Onur Kızıldereli ye ve ayrıca bana destek olan bütün arkadaşlarıma teşekkür ediyorum. Haziran 2007, Nihan Uysal ii
3 İÇİNDEKİLER ÖNSÖZ İÇİNDEKİLER KISALTMALAR TABLO LİSTESİ ŞEKİL LİSTESİ SEMBOL LİSTESİ ÖZET SUMMARY 1. GİRİŞ 2. TEORİK ALTYAPI 2.1 Akrilamid 2.2 Floresans 2. Piranin. DENEYLER VE YORUMLAR 4. POLİMERLEŞME SÜRECİNİN TEORİK OLARAK MODELLENMESİ 5. POLİMER TABANLI ph-metre TASARIMI 6. SONUÇLAR KAYNAKLAR ii iii iv v vi viii ix x iii
4 KISALTMALAR APS BIS M mm mm nm POH (POH) * P4 TEMED : Amonyumpersulfat : Bisakrilamid : Molarite : Milimolar : Milimetre : Nanometre : Piranin molekülü : Uyarılmış piranin molekülü : Pirentetrasülfonikasit : Tetrametilendiamin iv
5 TABLO LİSTESİ Tablo.1 : Polimerleşme deneylerinde kullanılan kimyasallar ve bunların çözelti içerisindeki miktarları... 9 Sayfa No v
6 ŞEKİL LİSTESİ Şekil 2.1 Şekil 2.2 Şekil 2. Şekil 2.4 Şekil 2.5 Şekil 2.6 Şekil 2.7 Şekil.1 Şekil.2 Şekil. Şekil.4 Şekil.5 Şekil.6 Şekil.7 Şekil.8 Şekil.9 Şekil 4.1 Şekil 4.2 Şekil 4. Şekil 4.4 Şekil 4.5 : Akrilamidin polimerleşme mekanizması... : Aromatik moleküllere ait enerji diyagramı (Jablonski Diagramı)... : a) Piren molekülü b) Piren molekülünün floresan spektrumu... : Piranin molekülü... : Piranin molekülünün a) uyarılma spektrumu b) soğurma spektrumu... : Piranin molekülünün ışımalı ve ışımasız geçiş şeması... : Piranin molekülünün değişik ph değerlerinde floresans spektrumu... : MOSpekt Laboratuarında kullanılan Floresan Spektrometresi ve Ocean Optics USB2000 Spektrofotometresi... : a) Akrilamid polimerleşmesi sırasında piranin spektrumundaki değişim. b) Polimerleşme süresince değişik akrilamid derişimlerinde kısa dalga boyundaki (406nm den 427nm ye) kayma... : Polimerleşme süresince ph değişimi... : a) Değişik ph larda şişirilmiş 1M akrilamid jelinin spektrumları, b) Jelin şişirildiği sulardan alınan spektrumlar... : a) 0,6M akrilamid jelinin saf su ile şişirilmeden önce ve en son şişmiş halde alınan spektrumları, b) 0,2M lineer akrilamid polimer çözeltisinin seyreltilmeden önceki ve sonraki spektrumları, c) 0,45M lineer akrilamid polimer çözeltisinin metanolle çöktürülmeden önce ve sonraki spektrumları... : a) P4 molekülü b) P4 çözeltisinin floresan spektrumu... : a) 1M akrilamidin P4 varlığında polimerleşmesi sırasında önce ve sonra alınan spektrumlar, b) Aynı jel saf su ile yıkanırken jelden alınan spektrumlar... : a) İçerisinde saf akrilamid jeli bulunan piranin çözeltisinin floresan spektrumları, b) Piranin difüze eden akrilamid jelinin spektrumları... : Akrilamid polimerleşmesi sırasında piranin ile akrilamid arasındaki etkileşmelerin şematik olarak tasviri... : Polimerleşme süresince şiddetlerin zamanla değişimi... : Düzeltilmiş floresan şiddetlerin zamanla değişimi... : Piraninin a) 1-bacaktan, b) 2-bacaktan, c) -bacaktan ve d) 4-bacaktan polimer zincirlerine bağlanma olasılıkları... : Düzeltilmiş floresan şiddetlerle teorik hesapların karşılaştırılması... : Düzeltilmiş floresan şiddet, teorik eğri ve monomer dönüşümünün zamanla değişimi... Sayfa No vi
7 Şekil 5.1 Şekil 5.2 Şekil 5. Şekil 5.4 Şekil 5.5 : a) Piranin difüze edilmiş 1M akrilamid jelinin değişik ph değerlerindeki floresan spektrumu, b) I 445 /I 512 oranının ph a bağlı olarak değişimi... : Değişik ph değerlerine sahip çözeltilere daldırılan jelin I 445 /I 512 oranının zamanla değişimi... : 1M ve 4M jellerin I 445 /I 512 oranının ph ile değişimi... : Farklı kalınlıklara sahip 4M akrilamid jelinin I 445 /I 512 oranının ph ile değişimi... : a) 1M akrilamid jelinin saf suda bekletilmeden önce ve 4 hafta saf suda bekletildikten sonra şiddetlerinin oranının ph ile değişimi, b) 4M akrilamid jelinin saf suda bekletilmeden önce ve 1 hafta saf suda bekletildikten sonra şiddetlerinin oranının ph ile değişimi vii
8 SEMBOL LİSTESİ R S S T 1 1 P 0 PyO : Serbest radikal : Birinci uyarılmış enerji seviyesi : Elektronik temel seviye : Birinci uyarılmış triplet seviye : Radikal hale gelmiş APS ile piraninin karşılaşma olasılığı N Py : Çözeltideki piranin sayısı N APS : Çözeltideki APS sayısı N : Çözeltideki toplam molekül sayısı ε η f p Top : Serbest radikalin piraninle karşılaşması durumunda onunla reaksiyona girme olasılığı : APS nin serbest radikal hale gelme olasılığı : Piranin molekülündeki fonksiyonel grup sayısı : Polimere dönüşmüş monomer sayısının toplam molekül sayısına oranı 1 P n : Piranin molekülünün uzunluğu n olan herhangi bir poliakrilamid zincirinin başında veya sonunda bulunma olasılığı 2 P nk : Herhangi bir uzunluktaki zincirin başına ya da sonuna bağlı olan piraninin k uzunluğunda bir akrilamid zinciri üzerindeki, k monomerden herhangi biri üzerindeki pozitif yüklü amid gruplarıyla SO üzerinden elektrostatik bağ yapma olasılığı P : n uzunlukta bir zincire kimyasal olarak bağlı olan Piraninin üzerindeki üç nkl 4 nkrl SO grubundan biriyle hem k hem l uzunlukta iki zincirle, zincirler üzerindeki herhangi bir monomerle aynı anda SO üzerinden elektrostatik bağ yapma olasılığı P : Bir uçtan kimyasal olarak bağlı bir piraninin hem k hem l hem de r uzunlukta üç zincirle, zincirler üzerindeki herhangi bir monomerle SO üzerinden etkileşme olasılığı N( t ) : t anında reaksiyon kabında bulunan (reaksiyona girmemiş) monomer sayısı N MO : Reaksiyonun başlangıcındaki monomer miktarı φ : Başlangıçtaki monomer sayısının toplam molekül sayısına oranı 0 N ( ) p t : t anında polimere dönüşmüş olan monomer miktarı viii
9 AKRİLAMİD POLİMERİZASYON SÜRECİNİN FLORESAN MOLEKÜLLER ARACILIĞI İLE EŞZAMANLI OLARAK TAKİBİ ÖZET Günümüzde değişik yöntemler olmasına rağmen, bunlardan neredeyse hiçbiri polimerleşme sürecini etkilemeden polimer dönüşümünü büyük bir kesinlikle ve eşzamanlı olarak izlemeye imkân vermemektedir. Bu tez çalışmasında, bu problemin çözümü için aromatik moleküllerin emisyon ve soğurma spektrumları ve uyarılmış durum ömürlerindeki değişimlerin gözlenmesi ve bu yolla içinde bulundukları ortamların özelliklerinin yorumlanmasına dayanan spektroskopik yöntemler denenmiştir. Monomer olarak kullanılan akrilamid çözeltisinin içerisine çok az miktarda piranin izleyici molekülü konup, bu molekülün floresan emisyon spektrumu izlenerek akrilamid polimerleşme reaksiyonunun eşzamanlı olarak incelenebileceği gösterilmiş ve bu yöntemin diğer birçok monomer sistemi için de uygulanabileceği öngörülmüştür. Piranin molekülü üzerinde bulunan OH yan grubu radikal eklenme yoluyla akrilamid polimer zincirlerinin uç gruplarına kimyasal olarak bağlanmakta ve piranin üzerindeki üç adet SO yan grupları ise poliakrilamid zincirleri üzerindeki pozitif yüklenmiş amid grupları ile elektrostatik olarak etkileşmektedir. Kimyasal bağlanma sonucunda piranin spektrumu 515nm den 406nm ye kaymakta, elektrostatik etkileşmeler ise 406nm deki spektrumun reaksiyon boyunca yaklaşık 40nm civarına kaymasına sebep olmaktadır. Floresan ışık şiddetindeki değişim, yaptığımız teorik modellemeler ve monomer dönüşümü deneyleri ile karşılaştırılmış ve floreasan ışık şiddetinin reaksiyon süresince monomer dönüşümü ile orantılı olduğu gösterilmiştir. Yaptığımız teorik model deneysel sonuçlar ile oldukça iyi bir şekilde örtüşmüştür. Tez çalışmasının bir bölümünde ise akrilamid jeli içerisinde tuzaklanmış piraninin floresan spektrumundaki tepelerin ph duyarlılığından faydalanarak 0 5 aralığında sulu çözeltilerin ph ını ölçebilen oldukça hassas bir ph metre tasarlanmıştır. ix
10 REAL-TIME MONITORING OF ACRYLAMIDE POLYMERIZATION VIA FLUORESCENT MOLECULES SUMMARY Nowadays, although there exist many methods for monitoring polymerization almost none of them is able to monitor the polymerization process in real-time with great precision. To solve this problem we have tested, in this thesis, the spectroscopic methods based on the interpretation of the change in the emission and the absorption spectra, and viewing the lifetimes of injected fluoroprobes to monitor the change in their microenvironment. Pyranine fluoroprobe in trace amount was placed in the acrylamide pre-polymer solution and fluorescence spectra of this fluoroprobe were monitored. It was shown that real time monitoring of the free radical polymerization of acrylamide can be performed by this method, and it is anticipated that this method can also be used for many kinds of monomers. Pyranine binds chemically to the functional ends of the growing polymer chains over OH groups via radical addition, and, at the same time, three SO groups on the probe molecule electrostatically interact with the regions of excess positive charges appeared on the amide groups of the polyacrylamide chains due to the protonation effect produced by water. Chemical bonding cause a shift, from 515 to 406nm in maxima of the emission spectra, and the electrostatic interactions cause the shift in the maxima from 406nm to approximately 40nm during the reaction. The change in the fluorescence intensity is compared with our theoretical models and monomer conversion experiment, and it was observed that fluorescence intensity is directly proportional to the monomer conversion measured during the polymerization. Our theoretical model was agreed best with the experimental results. In the one part of this thesis, we have designed a very sensitive ph-meter which is able to work in aqueous media of 0<pH<5, by using the ph sensitivity of the peaks appeared in the fluorescence spectra of the pyranine which was incorporated in polyacrylamide thin slab gels. x
11 1. GİRİŞ Polimerleşme sürecinin eşzamanlı olarak takip edilmesi reaksiyon mekanizmasının anlaşılması ve birçok fiziksel büyüklüğün hesaplanabilmesi açısından son derece önemlidir. Günümüzde ışık saçılması, nötron saçılması, yoğunluk değişimine dayanan dilatometrik ölçüm yöntemleri, diferansiyel kalorimetrik tarama yöntemi (DSC), reaksiyonun farklı aşamalarında durdurulan örneklerin çöktürüldükten sonra polimerik kısmın kütlelerinin ölçülmesi (gravimetrik yöntem veya makroskopik ölçüm yöntemi) gibi yöntemler olmasına rağmen bunlardan neredeyse hiçbiri eşzamanlı ölçümlere imkân verebilecek yöntemlerden değildir. Bu yöntemler ya ancak düşük polimer derişimlerinde ya da reaksiyonun ilk aşamalarında uygun sonuçlar vermekte veya büyük ölçüm hataları içermektedir. Polimer biliminde, 1979 dan itibaren lüminesans deney tekniklerinin geliştirilmesi ile moleküler boyutta etkileşmelerin izlenmesi konusunda büyük ilerlemeler olmuştur. Karbon atomlarının doğası çok sayıda aromatik molekül oluşturulabilmesine izin vermektedir. Aromatik moleküller ilginç spektroskopik özelliklere sahiptir. Bu maddeler uygun dalga boyunda ışıkla uyarıldığında kararlı duruma geçerken "floresan" veya "fosforesan" (lüminesan) ışık yayınlamaktadır. Aromatik moleküllerin emisyon spektrumları ve uyarılmış durum yaşam süreleri moleküllerin içinde bulunduğu ortama bağlı olarak değişmektedir. Spektroskopik özelliklerdeki bu değişimlerden yararlanarak, molekülün içinde bulunduğu ortam hakkında bilgi edinmek mümkün olmaktadır. Lüminesans deney tekniklerdeki gelişmeler polimer çalışmalarını da etkilemiş ve özellikle son yirmi yıl içerisinde bu konuda hem dünya da hem de ülkemizde büyük ilerlemeler kaydedilmiştir. Jellerde şişme [1,2], sol-gel geçişleri [-6], hacim faz geçişleri [7], camsı geçişler [8,9], hetero jellerin çökmüş durum fazları arasındaki geçişler [10], jellerde hafızalandırma işlemleri [11] ve aromatik grup içeren monomerlerin polimerleşmesi [12] ve jelleşmesi gibi çalışmalar floresan özellik gösteren izleyici moleküller aracılığıyla gerçekleştirilmiş ve dünya literatüründeki yerini almıştır. Buna karşın, günümüzde polimerleşme reaksiyonunu eş zamanlı olarak ve polimerleşen sistemi etkilemeden büyük kesinlikle izlemenin yolu henüz bulunmuş 1
12 değildir. Bazı özel durumlar için, mesela, monomerlerin kendisinin floresan özelliğe sahip olduğu bazı sistemler [12] veya ancak sol-gel geçiş noktaları civarındaki bazı çalışmalar [-6] için bu mümkün olsa dahi bu teknik henüz genelleştirilememiştir. Bununla birlikte, çok sayıda ve farklı özelliklerde aromatik molekülün var olması bu tekniğin gelişebilmesi konusundaki ümitleri devam ettirmektedir. Bu tez çalışması sırasında yaptığımız çalışmalarda, molekül yapısı Şekil. 2.4 de gösterilen piranin (8- hydroxypyrene-1,,6-trisulfonic acid, trisodium salt) molekülünün akrilamid serbest radikal polimerleşme ve jelleşme sürecinin izlenmesinde başarıyla kullanılabilecek bir aday molekül olduğu anlaşılmıştır. Akrilamid çözeltisinin içerisine piranin izleyici molekülü konup, bu molekülün floresan emisyon spektrumu izlenerek akrilamidin polimerleşme reaksiyonunun eşzamanlı olarak incelenebileceği gösterilmiş ve bu yöntemin diğer birçok monomer sistemi içinde uygulanabileceği öngörülmüştür. Bu yöntemde piranin molekülü üzerinde bulunan OH yan grubu radikal eklenme yoluyla akrilamid zincirlerinin uç gruplarına kimyasal olarak bağlanmakta ve bunun sonucunda piraninin floresan spektrumu 515nm den 406nm ye kaymaktadır. Aynı zamanda, izleyici molekül (piranin) üzerindeki üç SO yan gurubu, akrilamid zincirleri üzerinde bulunan ve zincirin suyla etkileşmesi sebebiyle pozitif olarak yüklenen amid gruplarıyla elektrostatik olarak etkileşmekte ve bunun sonucunda 406nm deki tepenin polimerleşme süresince adım-adım 40nm civarına kaymasına sebep olmaktadır. Deneylerle ulaştığımız bu sonuçlar yapmış olduğumuz teorik modellemeler ve diğer yöntemlerle de desteklenmektedir. Sonuç olarak floresan ışık şiddetindeki değişim takip edilerek polimerleşme sürecine ait ortalama küme büyüklüğü (veya polimerleşme derecesinin ağırlık ortalaması) [4], reaksiyon hız sabiti gibi bazı fiziksel parametreler reaksiyon süreci boyunca eş zamanlı olarak ölçülebilmektedir. Çalışmanın ilk bölümünde akrilamid ile piranin etkileşimleri anlatılmış ve daha sonra teorik hesaplarla yapılan deneyler karşılaştırılmıştır. Çalışmanın uygulamaya yönelik kısmında ise akrilamid jeli içerisinde tuzaklanmış piranin moleküllerinin ph duyarlılığından faydalanarak 0 5 aralığında çalışan bir ph metre tasarlanmıştır. 2
13 2. TEORİK ALTYAPI Birbirine kimyasal bağlarla bağlanarak büyük moleküller oluşturabilen küçük mol kütleli kimyasal maddeye monomer adı verilir. Monomerlerin birbirine kimyasal bağlarla bağlanarak oluşturdukları uzun zincir şeklindeki yapılar ise polimeri oluşturmaktadır. Lineer (doğrusal) polimerde monomerler düz bir zincir şeklinde bulunurlar, eğer monomerler dallı yapıda bir araya gelmişlerse dallanmış polimer adını alırlar. Ortamda çapraz bağlayıcı olduğunda, çapraz bağlayıcı molekül derişiminin kritik bir değerin üzerinde olması durumunda üç boyutlu bir ağ yapı oluşur. Oluşan bu yapıya polimerik jel ya da kısaca jel denir. Sistemin polimerik bir çözelti durumundan jel durumuna geçişi ise literatürde sol-gel faz geçişi olarak adlandırılmaktadır. [1-16] Polimerleşme süreci farklı yollarla oluşmaktadır. Basamaklı polimerizasyonda (kondensasyon polimerizasyonu) iki monomer etkileşerek ortama yeni bir molekül açığa çıkarırlar. Bir diğer yol ise katılma polimerizasyonudur, burada monomerler polimer zincirlerine birer-birer ve hızla katılırlar. Katılma polimerizasyonunu başlatma yöntemlerinden biri serbest radikallerden (çiftlenmemiş elektronu bulunan bileşikler) faydalanmaktır. Bu yönteme radikalik katılma polimerizasyonu adı verilir. Katılma polimerizasyonu iyonik karakterli aktif merkezlerden de başlayabilir buna ise iyonik katılma polimerizasyonu adı verilir. [17] Bu çalışmada incelenecek olan akrilamid monomeri Şekil 2.1 de gösterildiği gibi radikalik katılma polimerizasyonu ile polimerleşmektedir yani ortamdaki serbest radikaller akrilamid monomerini aktif hale getirip polimerleşme reaksiyonunu gerçekleştirir. Akrilamid monomerinin genel özellikleri aşağıdaki bölümde verilmiştir. 2.1 Akrilamid Yüksek molekül ağırlığı olan akrilamid, beyaz kristal görünüşlü bir katıdır ve suda çözünürlüğü oldukça yüksektir. Molekül yapısındaki çift bağlar sayesinde polimerleşme reaksiyonu verir. Kolay işlenebilmesi ve serbest radikal başlatıcılarla da kolayca polimerleşebilmesi gibi özelliklerinden dolayı bilimsel araştırmalarda tercih edilir.
14 Poliakrilamid, Diş hekimliğinde dolgu maddesi olarak, artık suların temizlenmesinde, kâğıt yapımında katkı maddesi olarak, fotoğraf ve polyester film yapımında ve daha birçok alanda katkı maddesi olarak kullanılır. [18] Akrilamidin polimerleşme mekanizması Şekil 2.1 de verildiği gibi özetlenebilir. Burada, ortamdaki serbest radikaller, R, akrilamidin yapısındaki çift bağı kırarak akrilamidi aktif hale getirirler. Ortamdaki diğer akrilamid monomerleri de aktif hale gelmiş monomerlerle etkileşerek bunlara bağlanır ve böylece akrilamid zinciri oluştururlar. Zincir ortamda tekrar bir radikalle karşılaşırsa sonlanır. [19] Şekil 2.1 Akrilamidin polimerleşme mekanizması Bu çalışmada akrilamid monomerinin serbest radikal polimerleşme sürecini incelemek için piranin aromatik molekülünün floresan özelliklerinden faydalanılacaktır. Bu sebeple aşağıdaki bölümde floresans konusunda kısa bir bilgi verilmektedir. 2.2 Floresans Aromatik bir molekül uyarıldığı zaman enerjisini ışımasız (aldığı enerjiyi titreşim enerji seviyeleri üzerinden ortama ısı olarak aktarmak yoluyla) veya ışımalı geçiş yaparak (ışık yayarak) verir ve temel seviyeye geri döner. Aromatik moleküllerin uygun bir ışıkla uyarılması sonucu temel seviyeye geri dönmesi sırasında yaydıkları ışık floresans ya da fosforesans olarak adlandırılmaktadır. Floresans aynı katlılığa (aynı spin yönelimine) sahip durumlar arasında (S j S i, S j S 0 veya T j T i gibi) olurken, fosforesans farklı spin yönelimine sahip durumlar arasında (genelde T 1 S 0 ) 4
15 meydana gelir. Pratikte genellikle floresansın S 1 S 0 durumu gözlenir. Floresans emisyon spektrumu S 1 den ortaya çıktığından dolayı karakteristiği uyarma dalga boyundan bağımsızdır. Uyarılmış durumdan titreşimle sönmeden kaynaklanan enerji kaybı olduğundan emisyon eksitasyona göre daha düşük enerjiye doğru kayar. [ 20-22] Uyarılmış titreşim düzeyleri Enerji elektronik temel seviye Şekil 2.2 Aromatik moleküllere ait enerji diyagramı (Jablonski Diagramı) 2. Piranin Şekil 2. de görülen piren molekülünün türevi olan piranin (POH, 8-hydroxypyrene- 1,,6-trisulfonic acid, trisodium salt) pirenden farklı olarak üç SO Na ve bir OH grubuna sahip bir moleküldür. Şekil 2.4 de görüldüğü gibi, suda çözündüğünde SO Na gruplarındaki sodyum çözülerek çevre iyonu haline gelmekte ve moleküle bağlı olan SO grubu ise SO iyonu haline gelmektedir Py (a) Floresan şiddet (rastgele birim) 1 0 (b) Dalga boyu (nm) Şekil 2. a) Piren molekülü b) Piren molekülünün floresans spektrumu 5
16 Piranin molekülünün soğurma ve uyarılma spektrumları Şekil 2.5 te verilmektedir. Buradan görüldüğü gibi uyarılma ve soğurma spektrumlarında en yüksek şiddet 400nm dalga boyunda olmaktadır. Yani molekül, bu dalga boyundaki ışığı soğurur ve bu yolla daha yüksek bir enerji düzeyine uyarılır. Şekil 2.4 Piranin molekülü Piranin molekülü OH grubu içermesinden dolayı, molekülün emisyon spektrumu içinde bulunduğu ortamın ph ı hakkında bilgi vermektedir. Piranin molekülü uyarıldığında, (POH) *, Şekil 2.6 da görüldüğü gibi, k r olasılığı ile 445nm de floresan ışığı yayabilir ya da k nr olasılığı ile ışımasız geçiş yaparak taban duruma dönebilir. Bunun yanı sıra (POH) *, H + iyonunu serbest bırakarak (PO - ) * şekline dönüşerek 510nm dalga boyunda floresan ışığı yayınlayabilir. Bu olay ters olarak da gözlenebilir yani (PO - ) * ve H + iyonları birleşip (POH) * oluşabilir.[2] (a) (b) 800 uyarılma spektrumu soğurma spektrumu dalga boyu (nm) dalga boyu (nm) Şekil 2.5 Piranin molekülünün a) uyarılma spektrumu b) soğurma spektrumu 6
17 Piranin molekülünün bu farklı geçiş olasılıkları ortamın ph ının bir fonksiyonudur. Şekil 2.7 den görüldüğü gibi, ph<1 iken piranin molekülü sadece 445nm dalga boyunda maksimumu olan bir emisyon vermektedir. (POH) * (PO - ) * + H + λ em =445nm λ em =510nm k nr k r k nr k r POH PO - + H + λ abs =400nm λ abs =450nm Şekil 2.6 Piranin molekülünün ışımalı ve ışımasız geçiş şeması ph> 5 iken ortamda H + iyonları derişimi (PO - ) * anyonunu yarı ömrü içerisinde tekrar protone etmek için yeterli olmadığından sadece 510nm dalga boyunda tepe görülmektedir. 1<pH<5 iken piranin 400nm lik ışık ile uyarıldığında hem 445nm hem de 510nm dalga boyunda emisyon tepeleri gözlenmektedir. Bu iki tepenin bağıl şiddeti ortamın ph ına ve diğer fiziksel özelliklerine bağlı olmakla birlikte 1<pH<5 aralığında 445nm deki şiddetin 510nm deki şiddete oranı 0,2 yi geçmemektedir. [4,24] Floresan şiddet dalgaboyu(nm) Şekil 2.7 Piranin molekülünün değişik ph değerlerinde floresans spektrumu 7
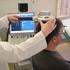
18 . DENEYLER VE YORUMLAR Deneysel çalışmalarda, örneği, seçilen dalga boyuyla uyarmak için Perkin Elmer Floresan Spektrometresi 204 ve örnekten yayılan emisyon ışığını toplayıp bilgisayara aktarmak için ise Ocean Optics USB2000 Spektrofotometresi kullanılmıştır. Bu spektrofotometrenin dalga boyu aralığı nm dir. Bu spektrometrede değişik dalga boylarında sistemi uyarmak mümkün olmakta ve spektrofotometre ile 6 farklı dalga boyundaki emisyon şiddetlerinin zamanla değişimi aynı anda gözlenebilmektedir. Piranin molekülü ile yapılan deneylerde uyarma dalga boyu 400nm olarak seçilmiştir. Şekil.1 MOSpekt Laboratuarında kullanılan Floresan Spektrometresi ve Ocean Optics USB2000 Spektrofotometresi. Yapılan deneylerde monomer olarak akrilamid (CH 2 =CHCONH 2 ), başlatıcı olarak APS (amonyum persulfat (NH 4 ) 2 S 2 O 8 ), çapraz bağlayıcı olarak BIS (N,N'- Methylenebisacrylamide (H 2 C=CHCONH) 2 CH 2 )), hızlandırıcı olarak ise TEMED (Tetramethylethylenediamine, C 6 H 16 N 2 ) kullanılmıştır. 60 o C ve üzerinde yapılan deneylerde ise hızlandırıcı kullanmaya gerek kalmadan polimerleşme gerçekleştiğinden TEMED kullanılmadan, polimerleşme reaksiyonu boyunca deney 60 o C de yapılmıştır. Deneylerde kullanılan örnekler ve içerdikleri kimyasalların miktarları Tablo.1 de verilmektedir. Yapılan deneylerde çözelti hazırlandıktan sonra çözeltiden 10 dakika süreyle azot geçirilmiş ve daha sonra ölçümlere başlanmıştır. 8
19 Tablo.1 Polimerleşme deneylerinde kullanılan kimyasallar ve bunların çözelti içerisindeki miktarları Aromatik molekül Örnek No AAm [M] BIS [mm] APS [mm] 1 5,00 7,0 5,40 2 2,00 29,0 14,10 Piranin (10-4 M) 1,00 14,60 7,10 4 0,60 8,80 4,20 5 0,50 0,00,50 6 0,45 0,00,10 7 0,0 4,40 2,10 8 0,20 0,00 1,40 9 0,10 1,40 0,70 P4 (10-4 M) 10 1,00 14,60 7, ,00 58,70 28,0-12 2,00 29,0 14,10 1 1,00 14,60 7, M piranin içeren 2M akrilamid in (Örnek 2) polimerleşme sürecinde, piraninin emisyon spektrumundaki değişim Şekil.2(a) da gösterilmektedir. Bu deneyde piranin molekülü daha önce belirtildiği gibi 400nm dalga boyunda ışıkla uyarılmakta ve farklı polimerleşme zamanlarında emisyon spektrumu kaydedilmektedir. Şekilden görüldüğü gibi ilk başta sadece 515nm dalga boyunda emisyon tepesi gözlenirken daha sonra 406nm de yeni bir tepe ortaya çıkmaktadır. Polimerleşme süresince 515nm deki tepenin şiddeti azalmakta ve bu kısa dalga boyundaki tepe zamanla hem 427nm ye doğru kaymakta hem de şiddeti artmaktadır. Değişik akrilamid derişimlerindeki örnekler için zamanla bu kısa dalga boyundaki kaymaların nasıl olduğu incelenmiş ve Şekil.2(b) de gösterilmiştir. Buna göre küçük derişimlerde 9
20 doğrusal bir kayma olurken 0,5M üstündeki derişimlerde hızla 40nm civarına kayma görülmektedir. Şekil.2 a) Akrilamid polimerleşmesi sırasında piranin spektrumundaki değişim. b) Polimerleşme süresince değişik akrilamid derişimlerinde kısa dalga boyundaki (406nm den 427nm ye) kayma. Şekil.2(a) daki 515nm den kısa dalga boyuna doğru olan kayma ph etkisinden kaynaklanan bir kayma değildir. Şekil. de görüldüğü gibi polimerleşme süresince ph 4 ün altına inmemektedir[25]. Daha önce anlatıldığı gibi (Şekil 2.7) 445nm ye kayma etkin olarak ancak ph<1 iken görülmektedir. Şekil..2 de gösterilen durumda ise hem ph yeterince yüksek değerde hem de kısa dalga boylu tepe 445nm de değil, nm aralığında çıkmaktadır. Yani, polimerleşme sırasındaki kayma ph etkisinden tamamen farklı bir mekanizma sonucu oluşmaktadır. 10
21 9 8 7 ph Polim erleşm e zamanı (dak) Şekil. Polimerleşme süresince ph değişimi Piranin varlığında sentezlenen jeller yıkandığında piraninlerin jelden çıkıp çıkmadığının anlaşılması için jeller değişik ph lara sahip suda yıkandı ve hem jelden hem de yıkama suyundan spektrum alındı. Şekil.4 de görüldüğü gibi 1M akrilamid jeli (Örnek ) değişik ph değerlerinde suda günlerce bekletilip şişirilmesine rağmen spektrumda bir kayma gözlenmemiştir. Yıkama suyundan alınan spektrumda ise yıkama suyuna az miktarda piranin çıktığı gözlenmektedir. Yıkama suyundan alınan spektrumda şiddet, jelden alınan spektrumdakine oranla çok-çok küçüktür (yaklaşık en fazla %5 civarında). Bu gösteriyor ki, az miktarda piranin içeren küçük kümeler jele bağlanamadan suya çıkmıştır. Bu kümelerin floresan spektrumu daha küçük dalga boyunda (41nm) tepe vermektedir. Fakat defalarca jel yıkanmasına karşın halen daha jelde yaklaşık %95 oranında piranin moleküllerinin var olduğu ve hiç bir şekilde jelden dışarı sızmadığı görülmektedir. [26] Bu deney, piranin moleküllerinin bir şekilde polimer zincirlerine kimyasal olarak bağlandığını ve bu yüzden jelin dışına sızmadığını açıkça göstermektedir. Yıkama deneylerinden sonra, jellerin şişme sürecindeki davranışları incelendi. Örnek olarak, 0,6M lık akrilamid jelinin (Örnek 4) çökmüş ve saf suyla tamamen şişirilmiş durumdaki spektrumları Şekil.5(a) da gösterilmiştir. Şekilden görüldüğü gibi şişmiş jelin emisyon spektrumunda 45nm lerden 410nm civarına bir kayma olmaktadır. Bu kayma polimerleşme sırasındaki uzun dalga boyuna doğru olan kaymanın tam tersine, yani kısa dalga boyuna doğru olmaktadır. 11
22 Şekil.4 a) Değişik ph larda şişirilmiş 1M akrilamid jelinin spektrumları, b) Jelin şişirildiği sulardan alınan spektrumlar. (Grafik üzerindeki sayılar ph değerlerini göstermektedir.) Şişme deneyinde gözlenen kısa dalga boyuna kayma lineer polimerlerin saf suyla seyreltilmesi durumunda da gözlenmektedir. Yine örnek olarak, 0,2M lineer akrilamid (Örnek 8) polimer çözeltisinin saf suyla 10 defa seyreltilmesi durumunda emisyon spektrumunda kayma Şekil.5(b) de gösterilmiştir. Bu şekilden görüldüğü gibi yine 45nm lerden 410nm civarına bir kayma olmaktadır. Jelleşme ve sentezlenmiş jellerin şişmesi ve büzülmesi durumunda emisyon spektrumundaki bu kaymalara suyun etkisini incelemek için 0,45M lineer poliakrilamid (Örnek 6) çözeltisi (çapraz bağlayıcı içermeyen poliakrilamid) metanol içerisinde çöktürülmüştür. Çöktürmeden önce ve sonraki floresan spektrumu Şekil.5(c) de verilmektedir. Buradan görüldüğü gibi 40nm deki emisyon tepesi polimerleşmenin ilk aşamasında görülen, 406nm dalga boyuna kaymıştır. 12
23 Şekil.5 a) 0,6M akrilamid jelinin saf su ile şişirilmesinde önce ve en son şişmiş halde alınan spektrumları, b) 0,2M lineer akrilamid polimer çözeltisinin seyreltilmeden önceki ve sonraki spektrumları, c) 0,45M lineer akrilamid polimer çözeltisinin metanolle çöktürülmeden önce ve sonraki spektrumları. Şişirme, seyreltme ve çöktürme deneyleri piranin üzerindeki SO gruplarının polimer zincirine elektrostatik etkileşmelerle bağlanma, bu bağların kırılması veya bağlanmama durumlarından kaynaklanabileceğini göstermektedir. Bu deneyler, piranin üzerindeki OH grubunun 515nm den 406nm ye olan kaymadan, SO grubunun ise 406nm den 40nm lere ya da 40nm den 406nm lere olan kaymalardan sorumlu olduğu izlenimi ortaya çıkarmaktadır. Jelin şişmesi ya da lineer polimerlerin seyreltilmesi durumunda aşağıdaki paragraflarda da bahsedileceği gibi, SO gruplarıyla akrilamid zincirleri arasındaki elektrostatik bağlar zayıflamakta veya tamamen kopmaktadır. Çöktürme deneyinde ise bu tür bağların 1
24 oluşamadığı düşünülmektedir. Bu öngörülerin doğrulanabilmesi için OH grubu içermeyen, onun yerine sadece SO grupları olan bir deneme molekülü kullanılarak reaksiyon sürecinin incelenmesi ve karşılaştırılması gerekmektedir. Bu sebeple, piraninle yapılan deneylerden sonra, OH grubu içermeyen onun yerine 4 tane SONa içerip ve yine piren türevi olan P4 (1,,6,8-pyrene tetrasulfonic acid tetrasodium salt) şeklinde isimlendirdiğimiz molekül ile deneyler yapıldı. P4 molekülü ile yapılan deneylerde bu molekül 40nm dalga boyu ile uyarılarak (molekülün soğurma spektrumunun maksimum olduğu dalga boyu) emisyon spektrumu incelendi. Şekil.6 da P4 molekülü ve onun emisyon spektrumu görülmektedir. P4 suda çözündüğünde yine piranin gibi SO Na moleküllerindeki sodyum çözülerek moleküle bağlı 4 adet SO iyonu kalmaktadır. P4, OH grubu içermemesinden dolayı ortamdaki ph değişimlerinden etkilenmemektedir, yani emisyon spektrumunda herhangi bir kayma olmamaktadır. (b) Şekil.6 a) P4 molekülü b) P4 çözeltisinin floresan spektrumu 10-4 M P4 molekülü ile sentezlenen 1M akrilamidin (Örnek 10) polimerleşmesi sırasında spektrumundaki değişime baktığımızda Şekil.7(a) da görüldüğü gibi spektrum 404nm dalga boyundan yaklaşık 411nm civarına kaymıştır. Yani spektrumda sadece küçük dalga boyunda kayma gözlenmiştir. Aynı jel saf su ile yıkandığında ise Şekil.7(b) den görüldüğü gibi P4 lerin neredeyse tamamı jelden çıkmaktadır. Bu deneylerden anlaşılacağı gibi küçük dalga boyundaki sağa doğru kayma SO gruplarından kaynaklanan bir kaymadır. Piranin ile yapılan deneylerdeki sağa doğru kaymanın nedeninin SO grupları olduğu anlaşılmıştır. Polimerleşme sırasında, büyük dalga boyundan (515nm) küçük dalga boylarına doğru bir kaymanın 14
25 görülmemesi ise bu kaymanın OH grubu tarafından gerçekleştiğini bize ispatlamaktadır. Jel yıkandığında P4 moleküllerinin tamamen jelden çıkıyor olması ise ortamda kimyasal bir bağ olmadığını göstermektedir. Piranin ile yapılan deneylerde ise piranin moleküllerinin yıkandığında jelden çıkmaması, piranin moleküllerinin OH üzerinden akrilamid zincirleriyle kimyasal bağ yaptığını gösterir. Şekil.7 a) 1M akrilamidin P4 varlığında polimerleşmesi sırasında önce ve sonra alınan spektrumlar, b) Aynı jel saf su ile yıkanırken jelden alınan spektrumlar. Piraninin sadece polimerleşme sırasında mı bağlandığını yoksa polimerleşme gerçekleştikten sonra ortama eklendiğinde de polimere bağlanıp bağlanmayacağını gözlemek için ek deneyler yapıldı. Örnek olarak, saf halde (piranin içermeden saf su ile hazırlanan çözeltide) sentezlenen 2M akrilamid (Örnek 12) jelinin 10-4 M piranin çözeltisi içerisindeki davranışı Şekil.8 de gösterilmektedir. Görüldüğü gibi çözeltideki piranin miktarı zamanla azalmakta ve jeldeki piranin ise zamanla artmaktadır yani piraninler jele difüze etmektedir. Şekilde de görüldüğü gibi hem jelden hem piranin çözeltisinden alınan spektrumda tepe 515nm civarında olup difüzyon sırasında spektrumda hiçbir kayma gözlenmemektedir. 15
26 Buradan anlaşılacağı gibi, saf halde sentezlenmiş jele piraninler sonradan bağlanmamaktadırlar, piranin ile poliakrilamid jeli arasındaki kimyasal bağlanma ancak polimerleşme süresince oluşmaktadır. Şekil.8 a) İçerisinde saf akrilamid jeli bulunan piranin çözeltisinin floresan spektrumları, b) Piranin difüze eden akrilamid jelinin spektrumları. Yapılan deneylerden çıkarılan sonuç göstermektedir ki piranin OH üzerinden akrilamid ile kimyasal bağ yaptığında spektrum 515nm den 406nm ye kaymakta, polimerleşme ilerledikçe piranin molekülündeki SO grupları ve akrilamid üzerindeki amid grupları arasında elektrostatik etkileşimler arttıkça 406nm deki tepe her bir SO etkileşmesi ile yaklaşık 7-8nm sağa doğru kaymaktadır. Yapılan deneyler sonrasında varılan sonuçlarla piranin ve akrilamid arasındaki etkileşmeler ve akrilamidin polimerleşme süreci Şekil.9 da gösterilmiştir. Burada çözeltide bulunan ve başlatıcı olan APS ((NH 4 ) 2 S 2 O 8 ) molekülü, TEMED varlığında serbest radikal hale gelmektedir. Ortamdaki serbest radikaller piranin ile karşılaştığında OH grubundaki H + iyonunu alarak piranini serbest radikal haline getirmektedir. Serbest radikal hale gelmiş piranin molekülü akrilamid monomeri ile karşılaştığında akrilamidin yapısındaki çift bağı kırarak aralarında kimyasal bağ oluşur ve akrilamidi aktif hale getirir (polimerleşmeyi başlatır). Bu kimyasal bağ 16
27 sonucu floresan emisyon spektrumu 515nm den 406nm ye doğru kayar. Aktif haldeki akrilamide ortamdaki diğer akrilamidler de bağlanarak polimer zinciri oluştururlar. Suyun protonasyon etkisinden dolayı monomerdeki oksijen molekülü ortamdaki H + iyonuyla bağlanır ve karbon ile oksijen (C ve O) arasındaki çift bağ kırılır. Bu durumda amid (NH 2 ) grubunda çiftlenmemiş elektrondan dolayı karbon atomuyla çift bağ oluşur ve amid grubu pozitif olarak yüklenir. Piranin üzerindeki SO gruplarıyla radikal hale gelmiş akrilamid üzerindeki pozitif yüklü amid grupları arasında elektrostatik etkileşmeler oldukça 406nm deki tepe 40nm civarına kaymaktadır. [27] TEMED ( NH ) S O 8 2 SO NH 4 O S SO O S SO HO SO SO 4 HSO 4 O SO CH2 CH C O NH2 O S O CH2 CH C NH2 CH 2 n O CH C O NH2 H O S O CH 2 CH CH n 2 C OH NH2 CH C OH NH 2 O S SO O S SO O S O C OH C OH O S SO NH 2 O S SO NH 2 NH 2 C OH NH 2 C OH O SO Şekil.9 Akrilamid polimerleşmesi sırasında piranin ile akrilamid arasındaki etkileşmelerin şematik olarak tasviri. 17
28 4. POLİMERLEŞME SÜRECİNİN TEORİK OLARAK MODELLENMESİ Polimerleşme süresince kısa dalga boyundaki tepenin kaymasının piranin üzerindeki SO grupları ile akrilamid zincirleri üzerindeki amid grupları arasındaki bağ sayısı ile ilgili olduğu önceki bölümde tartışılmıştı. Daha önce bahsedildiği gibi her SO -amid etkileşmesinin dalga boyunda yaklaşık olarak 7-8nm kaymaya sebep olduğu düşünülmektedir. Laboratuarımızda kullanılan Ocean Optics USB2000 Spektrofotometresi 6 ayrı dalga boyuna karşılık gelen floresan ışık şiddetlerinin zamanla değişimini aynı anda ölçebilmektedir. Şekil 4.1 de, örnek olarak 0,5M lineer poliakrilamid (Örnek 5) çözeltisinde, polimerleşme boyunca, 400nm, 406nm, 414nm, 422nm ve 40nm ye karşılık gelen şiddetlerinin zamanla artışı ve 515nm deki şiddetin azalışı gösterilmektedir nm 406nm 414nm 422nm 40nm 515nm normalize floresan şiddet zaman (sn) Şekil 4.1 Polimerleşme süresince şiddetlerin zamanla değişimi Polimerleşme süresince örneğin opaklığının kısmen artması sonucu 90 o de ölçülen floresans şiddet de (saçılma şiddeti) artmaktadır. Bu sebeple ölçülen floresan ışık şiddetlerinin düzeltilmesi, yani saçılma etkisinin göz önüne alınması gerekmektedir. 18
29 Burada saçılma ışığının ölçülen şiddetler üzerine etkisini ve ölçülen şiddetlerin ne şekilde düzeltilmesi gerektiğini tartışmak isteriz. f(t), saçılan ışık şiddetini reaksiyon boyunca sabit bırakacak bir fonksiyon olsun. Yani saçılma ışık şiddeti S(t) nin f(t) ye oranı bir sabit, 1/k, olsun; S( t) / f ( t) = 1/ k. (4.1) Buradan, f ( t) = ks( t) şeklinde olacaktır. f(t) fonksiyonu ölçülen floresan şiddet ile çarpılırsa düzeltilmiş şiddet, I d (t), elde edilecektir. I ( t) = k. I( t). S( t) (4.2) d Bu düzeltme işlemi daha önce yapılan bir çalışmada da kullanılmıştır. [28] Şekil 4.1 de 414nm, 422nm ve 40nm dalga boyundaki şiddet değişimleri denklem (4.2) aracılığıyla düzeltildiğinde Şekil 4.2 deki şiddetler elde edilmektedir. Bu şekilden görüldüğü gibi şiddetler biraz daha artmıştır, yani reaksiyonun özellikle sonraki bölümlerinde opaklaşmanın artması sonucu floresan şiddetlerdeki verim kaybı önlenmiştir nm 422nm 40nm 80 düzeltilmiş floresan şiddet zaman (sn) Şekil 4.2 Düzeltilmiş floresan şiddetlerin zamanla değişimi Şekil.9 dan anlaşılacağı üzere belli olasılıklarla serbest radikal hale gelen piranin molekülleri akrilamid monomerlerini belli olasılıklarla aktif hale getirmekte ve akrilamid zincir reaksiyonu başlatılmaktadır. Şekil.9 dan da görüleceği gibi olayın doğası gereği piranin molekülleri zincirin ya başında ya da sonunda bulunabilmektedir. Zincirin başına ya da sonuna kimyasal olarak bağlanan piranin 19
30 molekülleri akrilamid zincirleri üzerindeki pozitif yüklü amid gruplarıyla piranin üzerindeki negatif yüklü SO iyonları arasında elektrostatik etkileşmeler oluşmaktadır. Zincirler birbirine yeterince yakınken (jel belli ölçüde çökmüş durumda iken) piraninler bir taraftan da diğer zincirlere veya aynı zincir üzerindeki amid gruplarıyla SO iyonları aracılığıyla elektrostatik olarak etkileşmekte bir taraftan da O-C bağlarıyla polimerlere kimyasal olarak bağlanmaktadır. Jel yeterince şişirildiğinde ise SO -amid bağlarının sayısı azalmaktadır. Bu durumu, aşağıdaki kısımda, basit istatistiksel yaklaşımlar kullanarak teorik olarak modelledik. Bu modelde herhangi bir latis (örgü) modeli kullanılmamaktadır. Radikal hale gelmiş APS ile piraninin karşılaşma olasılığı, P PyO ; P PyO 1 N Py 2N APS = ε η f N Top N Top (4.) şeklinde olacaktır, burada ortamdaki piranin sayısı N Py, APS sayısı N APS ve toplam molekül sayısı N Top ile gösterilmektedir. ε: serbest radikalin piraninle karşılaşması durumunda onunla reaksiyona girme (piranini başlatıcı haline getirme) olasılığı, η: APS nin serbest radikal hale gelme olasılığı (bozunma verimi), f ise piranin molekülündeki fonksiyonel grup sayısı olarak tanımlanmaktadır. Piranin elektrostatik ve 1 kimyasal bağ yapma kabiliyetine sahip fonksiyonel gruba sahiptir, yani f=4 tür. Polimere dönüşmüş monomer sayısının toplam molekül sayısına oranını, p, rasgele seçilmiş bir monomerin herhangi bir zincire bağlı olma olasılığına eşit olacaktır. Bu durumda, piranin molekülünün uzunluğu n olan herhangi bir poliakrilamid zincirinin başında veya sonunda bulunma olasılığı, P = P p (1 p) (4.4) 1 n 2 n PyO n = 1 şeklinde olacaktır. Burada, n içerisindeki 2 p n ( 1 p) terimi uzunluğu n olan bir zincir oluşma olasılığıdır. Herhangi bir uzunluktaki zincirin başına ya da sonuna bağlı olan piraninin k uzunluğunda (k değişken bir sayı olmak üzere) bir akrilamid zinciri üzerindeki, k monomerden herhangi biri üzerindeki pozitif yüklü amid gruplarıyla SO üzerinden elektrostatik bağ yapma olasılığı, P, 2 ( 1 ) 2 k P ( 1) (1 ) 2 nk = Pn f k p p (4.5) k= 2 şeklinde yazılabilir. Bağ yapma olasılığı ından, SO 2 nk ve amid gruplarının birbirine dokunacakları veya birbiriyle yeterince kuvvetli bir etkileşme yapabilecekleri bir mesafeye gelmeleri kastedilmektedir. (4.5) ifadesinde toplamın 2 den başlamasının 20
31 nedeni şudur: akrilamid monomeri üzerindeki amid grubunun yük kayması sebebiyle pozitif hale gelmesi bu monomerin ancak bir zincir üzerinde olması durumunda (ve aynı anda çözelti içerisinde negatif iyonların bulunması durumunda) gerçekleşmektedir. [27] En düşük boyutlu zincir 2 monomer içereceğinden toplam 2 den başlatılmıştır. Benzer şekilde, n uzunlukta bir zincire kimyasal olarak bağlı olan piraninin üzerindeki üç SO grubundan biriyle k uzunluğundaki bir zincir üzerindeki bir monomerle, diğer SO grubuyla da l uzunluktaki bir zincir üzerindeki herhangi bir monomerle aynı anda elektrostatik bağ yapma olasılığı, P nkl, ( 1 ) 2 k ( 1) (1 ) 2 ( 2) 2 l P (1 ) 2 nkl = Pn f k p p f l p p k= 2 l= 2 (4.6) şeklinde yazılabilir. Aynı yolla bir uçtan kimyasal olarak bağlı bir piraninin hem k hem l hem de r uzunlukta üç zincirle, zincirler üzerindeki herhangi bir monomerle SO üzerinden etkileşme olasılığı, 4 ( 1 ) 2 k 2 2 l ( 1) (1 ) ( 2) (1 ) 2 ( ) 2 r P (1 ) 2 nklr = Pn f k p p f l p p f r p p k = 2 l= 2 r= 2 (4.7) şeklinde yazılabilir. Burada sabit sayılar başa alınıp, piranin üzerindeki fonksiyonel grup sayısı olan f yerine 4 yazılıp, gerekli matematiksel işlemler yapılırsa, toplam içindeki terimler, N p n p p n= 1 1 p(1 + p) ( 1 p) (4.8a) N 2 s s p p (4.8b) s= 2 şeklinde ifadeler içermektedir. Burada vurgulamak gerekir ki denklem (4.8a) ve (4.8b) eşitlikleri toplamanın üst limiti N nin çok büyük olması durumunda geçerli olacaktır. Bu da reaksiyonun herhangi bir p değerinde veya buna karşılık gelen reaksiyon zamanında, reaksiyon kabında var olan polimerlerin çok büyük bir kısmının yeterince uzun zincirler halinde olmasını gerektirmektedir. Bu yaklaşımın reaksiyonun son aşamaları dışında, başlangıçtan itibaren geçerli olabileceği düşünülebilir. Çünkü serbest radikal polimerizasyonu çok hızlı bir şekilde oluşmakta ve zincirler çok kısa sürede uzayabilmektedir. Bu nedenle, reaksiyon kabında yeterince monomer var oldukça reaksiyondaki ortalama zincir uzunluğu neredeyse zamandan bağımsız olarak belli bir değerde olacaktır (elbette belli bir dağılıma sahip olacak fakat ortalama zincir uzunluğundaki standart sapma çok fazla değişmeyecektir). Ancak reaksiyonun son aşamalarına doğru reaksiyon kabındaki monomer sayısı azalacağından ortalama zincir boyundaki standart sapma 21
32 büyüyebileceği için kısa boylu zincir sayısının etkisi önemsenebilecektir. Bu durumda, son iki ifade geçerliliğini bir ölçüde kaybedebilecektir. Sonuç olarak, (4.8a) ve (4.8b) bağıntılarının reaksiyonun başlangıcından itibaren çok uzun bir süre boyunca geçerli olacağı düşünülmektedir. (4.8a) ve (4.8b) ifadelerinde p (tepkimeye girmiş monomer sayısının reaksiyon kabındaki toplam molekül sayısına oranı) aşağıdaki şekilde ifade edilebilir. p N Mo = (4.9) N N( t) Top Burada N(t); t anında reaksiyon kabında bulunan (reaksiyona girmemiş) monomer sayısını, N M0 ise reaksiyonun başlangıcındaki, t=0 anındaki, monomer miktarını kt göstermektedir. N(t), k reaksiyon hız sabiti olmak üzere, N e M 0 şeklinde tanımlanırsa [8,17,29,0], p olasılığı, p N N e kt = MO MO kt = φ0 φ0e NTop (4.10) şeklinde yazılabilir. Bu denklemde φ 0, başlangıçtaki monomer sayısının toplam molekül sayısına oranıdır, N M 0 φ 0 =. (4.10) ile verilen p olasılığı ( ) N Top denklemlerinde yerine yazılırsa Şekil 4. te şematik olarak gösterilen 1-bacaktan, 2-bacaktan, -bacaktan, ve 4-bacaktan polimer zincirlerine bağlanma olasılıkları sırasıyla: kt kt P = Aφ (1 φ + φ e )(1 e ) (4.11a) 1 n kt kt kt 2 Pnk = Aφ 0 (1 + φ0 φ0e ) (1 φ0 + φ0e ) (1 e ) (4.11b) P nkl 0 kt kt 2 kt 0 0e 0 0e e (1 + φ φ ) (1 φ + φ ) (1 ) = 6Aφ kt (1 φ + φ e ) 0 0 (4.11c) ve kt kt kt 4 (1 + φ φ0e ) (1 φ0 + φ0e ) (1 e ) nklr = 6Aφ 0 kt 2 (1 φ0 + φ0e ) P (4.11d) şeklinde yazılabilmektedir. Bu denklemlerdeki A katsayısı baştaki sabit sayıları εηn APS. NPy temsil etmektedir, burada A = olur. 2 2N Top 22
33 (a) (b) (c) Şekil 4. Piraninin a) 1-bacaktan, b) 2-bacaktan, c) -bacaktan ve d) 4- bacaktan polimer zincirlerine bağlanma durumlarını gösteren temsili resim. (d) Ölçtüğümüz kısa dalga boylu pikin şiddetinin zamanla arttığını ve aynı zamanda 406nm den 40nm civarına doğru kaydığını yukarıda tartışmıştık. 406nm ye tek bacaktan bağlanma, 414nm ye iki bacaktan bağlanma, 422nm ye üç bacaktan bağlanma ve 40nm ye dört bacaktan bağlanma durumları karşılık getirildiğinde bu dalga boylarına karşılık gelen ışık şiddetleri aşağıdaki şekilde hesaplanabilir: i i I = BP N ( t) (4.12) nklr nklr p Burada i P nklr denklem (4.11) de verilen olasılıkları (i=1,2,,4 olmak üzere), N p (t) polimere dönüşmüş olan monomer miktarını, B ise bir orantı katsayısını göstermektedir. Başlangıçtaki reaksiyon kabındaki monomer sayısından t anında reaksiyon kabında bulunan monomer miktarını çıkartırsak, polimere dönüşmüş monomer miktarı N p (t), zamanın fonksiyonu olarak, N ( t) = N N e = N (1 e ) = N. p = N. φ (1 e ) (4.1) kt kt kt p MO MO MO Top Top 0 şeklinde yazılabilir. Böylece, her bir duruma karşılık gelen floresan ışık şiddeti zaman cinsinden, I = A φ (1 φ + φ e )(1 e ) (4.14a) 1 2 kt kt 2 n I = A φ (1 + φ φ e )(1 e ) (4.14b) 2 kt kt nk I (1 + φ φ e ) (1 e ) kt 2 kt nkl = 6A φ0 kt (1 φ0 + φ0e ) (4.14c) 2
34 I (1 + φ φ e ) (1 e ) kt kt nklr = 6A φ0 kt 2 (1 φ0 + φ0e ) (4.14d) şeklinde ifade edilebilecektir. A katsayısı baştaki sabit sayıları temsil etmektedir. Bεη N APS. NPy Burada, A = olur. 2N Top Teorik yaklaşımlarla hesaplanan şiddetler, 0,5M lineer akrilamidin (Örnek 5) polimerleşmesi deneyindeki spektrometre ile zamanla değişimi gözlenen ve düzeltme yapılan şiddetlerle karşılaştırılırsa (Şekil 4.2), Şekil 4.4 de görüldüğü gibi teorik öngörümüzün deneysel sonuçlarla iyi bir uyum gösterdiği anlaşılmaktadır. Özellikle reaksiyonun sonlarına doğru hafif sapmalar olmasının nedeni yukarıdaki paragraflarda, (4.8a) ve (4.8b) yaklaşımları üzerinden tartışılmıştı. Ölçülen ortalama ışık şiddetinin, jelleşme deneyleri için sol-gel geçişleri civarında, polimerleşme derecesinin ağırlık ortalamasıyla veya ortalama polimer küme büyüklüğü ile orantılı olacağı daha önce, kritik nokta civarındaki evrensellik tartışması çalışmalarıyla, gösterilmişti.[4] Bu çalışmada ise ölçülen ortalama ışık şiddetinin % monomer dönüşümüyle orantılı olacağı öngörülmektedir. Çünkü polimere dönüşen monomer miktarıyla orantılı olarak polimer uçlarına bağlı piranin sayısı da artacaktır Düzeltilmiş Floresan Şiddet, Teorik Eğri Zaman (sn) Şekil 4.4 Düzeltilmiş floresan şiddetlerle teorik hesapların karşılaştırılması. (Düz çizgiler teorik eğrilerdir.) 24
35 Bu sebeple, çalışmanın bu aşamasında, polimerleşme sırasında polimere dönüşen monomer miktarı, floresan ölçüm yöntemi dışında, başka yöntemlerle de ölçülüp teoriden ve deneylerden bulunan sonuçlarla karşılaştırıldı. 0,5M lineer akrilamid çözeltisinden çok miktarda örnek hazırlanarak polimerleşme boyunca bu örneklerin belli aralıklarla metanole konup çöktürülmesi sağlanmış, sonradan da her bir örneğin kurutulmuş halde iken polimere dönüşmüş monomer kütleleri terazi ile ölçülmüştür. Şekil 4.5 de bu polimere dönüşen kütlelerin zamanla değişiminin hem floresan şiddetle hem de teorik hesapla uyuştuğu görülmektedir. Teraziyle ölçme yöntemiyle yapılan deneylerde özellikle reaksiyonun baş kısımlarında çok büyük hatalar görülmekte, bunun dışındaki zaman aralığında iyi bir uyum gözlenmektedir. Bu tür kütle ölçümleriyle yapılan deneylerde küçük dönüşümler için bu tür büyük hatalar oldukça olağan karşılanmalıdır. Çünkü dönüşümün çok az olması sebebiyle, havadan kapılacak en ufak bir nem bile büyük hatalara sebep olmaktadır. norm. floresan şiddet, teorik eğri, %monomer dönüşümü zaman (saniye) floresan şiddet monomer dönüşümü teorik eğri monomer dönüşümü(tekrar) Şekil 4.5 Düzeltilmiş floresan şiddet, teorik eğri ve monomer dönüşümünün zamanla değişimi. (Üçgen şeklinde gösterilen veriler aynı molaritede tekrarlanan deneyin verileridir.) 25
36 5. POLİMER TABANLI ph-metre TASARIMI Yapılan deneyler sonucu piranin içermeyen akrilamid jeline sonradan piranin difüze edildiği zaman piranin ile akrilamid zincirleri arasındaki elektrostatik bağların kuvvetli olmasından dolayı jel yıkansa dahi, ph<6 durumunda, piranin moleküllerinin jelden kolayca dışarı çıkmadığı görülmüştür. Ayrıca bu durumda piranin ile akrilamid arasında kimyasal bağ olmamasından dolayı jeldeki piraninler, normal piranin çözeltisi gibi ortamın ph değişimlerinden etkilenecektir. Bu özellikler dikkate alınarak ve piraninin özellikle düşük ph değerlerinde (1<pH<5) spektrumunun çok belirgin değişiyor olmasından faydalanılarak akrilamid jelinden ph-metre tasarlandı. Bunun için 1M ve 4M saf akrilamid jelleri (piranin içermeyen, saf suda) sentezlendi. Bunlardan 1M (Örnek 1) olan jelden 2,2mm ve 4M (Örnek 11) jelden 1,6mm ve 2,5mm kalınlıklarında ince parçalar kesilerek, bu parçalar 10-4 M piranin çözeltisinde uzun süre bekletildi ve jellere piranin difüzyonu sağlandı. Piranin difüzyonu tamamlanan jeller değişik ph değerlerinde çözeltilere daldırılarak jelden floresan spektrumu alındı. Şekil 5.1(a) da değişik ph değerlerine sahip çözeltilerde yeterince bekletilmiş 1M akrilamid jelinin floresan spektrumu görülmektedir. Buradan 445nm ve 512nm dalga boylarındaki şiddetlerin oranları jellerin daldırıldığı suyun ph ına bağlı olarak incelendi. Bu şiddetlerin incelenmesinin nedeni I 445 /I 512 oranının uyarma dalga boyundan bağımsız olup sıvı çözeltinin ph ı ile değişmesidir. Şekil 5.1(b) de bu oranın çözeltinin ph ına bağlı olarak nasıl değiştiği görülmektedir. I 445 /I 512 oranının ne kadar sürede sabit hale geldiğini, yani ph-metrenin ne kadar süre çözeltide bekletilirse çözeltinin ph değeri ile ilgili doğru sonuç vereceğini gözlemek için, 10 ar saniye aralıklarla jel aynı ph değerinde çözeltiye daldırılıp bu oranın zamanla nasıl değiştiğine bakıldı. Aynı işlem değişik ph değerlerinde çözeltiler için tekrarlandı. 26
37 120 (a) normalize floresan spektrumu ph=0,070 ph=5, dalgaboyu (nm) 0,7 0,6 (b) 0,5 I 446 /I 512 0,4 0, 0,2 0,1 0, Şekil 5.1 a) Piranin difüze edilmiş 1M akrilamid jelinin değişik ph değerlerindeki floresan spektrumu, b) I 445 /I 512 oranının ph a bağlı olarak değişimi ph Şekil 5.2 de jelin daldırıldığı değişik ph değerlerindeki çözeltilerde şiddetlerin oranının zamanla nasıl değiştiği birkaç ph değerindeki çözelti örneği için görülmektedir. Bu şekilden anlaşılacağı gibi yaklaşık olarak 50 saniye sonunda I 445 /I 512 oranında belirgin bir değişim olmamaktadır yani ph-metrenin cevap süresi yaklaşık 50 saniyedir. Aynı ölçümler 4M akrilamid jeli için de tekrarlanmıştır. Şekil 5. te 1M ve 4M jellerin ph değişimiyle şiddet oranlarının nasıl değiştiği görülmektedir. Bu grafikte düz çizgi deney verilerine fit edilen en uygun eğriyi göstermektedir. 27
YMN62 SICAKLIĞA DUYARLI YENİ POLİMERLER İLE ÇAPRAZ BAĞLI HİDROJEL MATRİKS SENTEZİ VE KARAKTERİZASYONU
 YMN62 SICAKLIĞA DUYARLI YENİ POLİMERLER İLE ÇAPRAZ BAĞLI HİDROJEL MATRİKS SENTEZİ VE KARAKTERİZASYONU M. Şölener 1, E. Uğuzdoğan 2, Ş.T. Çamlı 3, S. Patır 4, M. Nurbaş 1, O. S. Kabasakal 1, E. B. Denkbaş
YMN62 SICAKLIĞA DUYARLI YENİ POLİMERLER İLE ÇAPRAZ BAĞLI HİDROJEL MATRİKS SENTEZİ VE KARAKTERİZASYONU M. Şölener 1, E. Uğuzdoğan 2, Ş.T. Çamlı 3, S. Patır 4, M. Nurbaş 1, O. S. Kabasakal 1, E. B. Denkbaş
SINAV SÜRESİ 80 DAKİKADIR. BAŞARILAR. Terim Açıklama Örnek
 PLİMER KİMYASI ARA SINAVI 31.07.2015 SRU N 1 2 3 4 5 PUAN Yalnızca 4 soruyu yanıtlayınız. Yanıtlamadığınız sorunun PUAN kısmına çarpı koyunuz. Aksi taktirde 5. Soru değerlendirme dışı kalacaktır. N : AD
PLİMER KİMYASI ARA SINAVI 31.07.2015 SRU N 1 2 3 4 5 PUAN Yalnızca 4 soruyu yanıtlayınız. Yanıtlamadığınız sorunun PUAN kısmına çarpı koyunuz. Aksi taktirde 5. Soru değerlendirme dışı kalacaktır. N : AD
BÖLÜM 7. ENSTRÜMENTAL ANALİZ YÖNTEMLERİ Doç.Dr. Ebru Şenel
 BÖLÜM 7. ENSTRÜMENTAL ANALİZ YÖNTEMLERİ 1. SPEKTROSKOPİ Bir örnekteki atom, molekül veya iyonların bir enerji düzeyinden diğerine geçişleri sırasında absorplanan veya yayılan elektromanyetik ışımanın,
BÖLÜM 7. ENSTRÜMENTAL ANALİZ YÖNTEMLERİ 1. SPEKTROSKOPİ Bir örnekteki atom, molekül veya iyonların bir enerji düzeyinden diğerine geçişleri sırasında absorplanan veya yayılan elektromanyetik ışımanın,
Soygazların bileşik oluşturamamasının sebebi bütün orbitallerinin dolu olmasındandır.
 KİMYASAL BAĞLAR Kimyasal bağ, moleküllerde atomları birarada tutan kuvvettir. Bir bağın oluşabilmesi için atomlar tek başına bulundukları zamankinden daha kararlı (az enerjiye sahip) olmalıdırlar. Genelleme
KİMYASAL BAĞLAR Kimyasal bağ, moleküllerde atomları birarada tutan kuvvettir. Bir bağın oluşabilmesi için atomlar tek başına bulundukları zamankinden daha kararlı (az enerjiye sahip) olmalıdırlar. Genelleme
Doç. Dr. Cengiz ÇETİN, BEK153 Organik Eserlerde Önleyici Koruma Ders Notu DERS 2 2. POLİMERLER
 DERS 2 2. POLİMERLER 2.1. Yardımcı Terimler Bileşik, birden fazla atomun belirli oranlarda kimyasal reaksiyonu sonucu bir araya gelmesiyle oluşan saf maddedir. Bileşiklerin en küçük yapı taşı moleküllerdir.
DERS 2 2. POLİMERLER 2.1. Yardımcı Terimler Bileşik, birden fazla atomun belirli oranlarda kimyasal reaksiyonu sonucu bir araya gelmesiyle oluşan saf maddedir. Bileşiklerin en küçük yapı taşı moleküllerdir.
Bir maddenin başka bir madde içerisinde homojen olarak dağılmasına ÇÖZÜNME denir. Çözelti=Çözücü+Çözünen
 ÇÖZÜCÜ VE ÇÖZÜNEN ETKİLEŞİMLERİ: Çözünme olayı ve Çözelti Oluşumu: Bir maddenin başka bir madde içerisinde homojen olarak dağılmasına ÇÖZÜNME denir. Çözelti=Çözücü+Çözünen Çözünme İyonik Çözünme Moleküler
ÇÖZÜCÜ VE ÇÖZÜNEN ETKİLEŞİMLERİ: Çözünme olayı ve Çözelti Oluşumu: Bir maddenin başka bir madde içerisinde homojen olarak dağılmasına ÇÖZÜNME denir. Çözelti=Çözücü+Çözünen Çözünme İyonik Çözünme Moleküler
TAMPON ÇÖZELTİLER. Prof.Dr.Mustafa DEMİR M.DEMİR 09-TAMPON ÇÖZELTİLER 1
 TAMPON ÇÖZELTİLER Prof.Dr.Mustafa DEMİR M.DEMİR 09-TAMPON ÇÖZELTİLER 1 Tampon çözeltiler Kimyada belli ph larda çözelti hazırlamak ve bunu uzun süre kullanmak çok önemlidir. Ancak bu çözeltilerin saklanması
TAMPON ÇÖZELTİLER Prof.Dr.Mustafa DEMİR M.DEMİR 09-TAMPON ÇÖZELTİLER 1 Tampon çözeltiler Kimyada belli ph larda çözelti hazırlamak ve bunu uzun süre kullanmak çok önemlidir. Ancak bu çözeltilerin saklanması
ALETLİ ANALİZ YÖNTEMLERİ
 ALETLİ ANALİZ YÖNTEMLERİ Spektroskopiye Giriş Yrd. Doç. Dr. Gökçe MEREY SPEKTROSKOPİ Işın-madde etkileşmesini inceleyen bilim dalına spektroskopi denir. Spektroskopi, Bir örnekteki atom, molekül veya iyonların
ALETLİ ANALİZ YÖNTEMLERİ Spektroskopiye Giriş Yrd. Doç. Dr. Gökçe MEREY SPEKTROSKOPİ Işın-madde etkileşmesini inceleyen bilim dalına spektroskopi denir. Spektroskopi, Bir örnekteki atom, molekül veya iyonların
İki ve üç kovalent bağa sahip moleküller doymamış olarak isimlendirilirler.
 İki ve üç kovalent bağa sahip moleküller doymamış olarak isimlendirilirler. Her biri tek kovalent bağa sahip hidrokarbona, doymuş hidrokarbon denir ve mevcut bağlarından biri kopmadan yeni bir atom bağlanamaz.
İki ve üç kovalent bağa sahip moleküller doymamış olarak isimlendirilirler. Her biri tek kovalent bağa sahip hidrokarbona, doymuş hidrokarbon denir ve mevcut bağlarından biri kopmadan yeni bir atom bağlanamaz.
Kuvvetli Asit ve Kuvvetli Baz Titrasyonları
 Kuvvetli Asit ve Kuvvetli Baz Titrasyonları Prof. Dr. Mustafa DEMİR http://web.adu.edu.tr/akademik/mdemir/ M.DEMİR(ADU) 2009-06-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 1 Sulu çözeltilerde [H 3 O ] kaynağı 1)
Kuvvetli Asit ve Kuvvetli Baz Titrasyonları Prof. Dr. Mustafa DEMİR http://web.adu.edu.tr/akademik/mdemir/ M.DEMİR(ADU) 2009-06-KUVVETLİ ASİT VE BAZ TİTRASYONLARI 1 Sulu çözeltilerde [H 3 O ] kaynağı 1)
FARMASÖTİK TEKNOLOJİ I «ÇÖZELTİLER»
 FARMASÖTİK TEKNOLOJİ I «ÇÖZELTİLER» Uygun bir çözücü içerisinde bir ya da birden fazla maddenin çözündüğü veya moleküler düzeyde disperse olduğu tektür (homojen: her tarafta aynı oranda çözünmüş veya dağılmış
FARMASÖTİK TEKNOLOJİ I «ÇÖZELTİLER» Uygun bir çözücü içerisinde bir ya da birden fazla maddenin çözündüğü veya moleküler düzeyde disperse olduğu tektür (homojen: her tarafta aynı oranda çözünmüş veya dağılmış
Atomlar ve Moleküller
 Atomlar ve Moleküller Madde, uzayda yer işgal eden ve kütlesi olan herşeydir. Element, kimyasal tepkimelerle başka bileşiklere parçalanamayan maddedir. -Doğada 92 tane element bulunmaktadır. Bileşik, belli
Atomlar ve Moleküller Madde, uzayda yer işgal eden ve kütlesi olan herşeydir. Element, kimyasal tepkimelerle başka bileşiklere parçalanamayan maddedir. -Doğada 92 tane element bulunmaktadır. Bileşik, belli
Bir katı malzeme ısıtıldığında, sıcaklığının artması, malzemenin bir miktar ısı enerjisini absorbe ettiğini gösterir. Isı kapasitesi, bir malzemenin
 Bir katı malzeme ısıtıldığında, sıcaklığının artması, malzemenin bir miktar ısı enerjisini absorbe ettiğini gösterir. Isı kapasitesi, bir malzemenin dış ortamdan ısı absorblama kabiliyetinin bir göstergesi
Bir katı malzeme ısıtıldığında, sıcaklığının artması, malzemenin bir miktar ısı enerjisini absorbe ettiğini gösterir. Isı kapasitesi, bir malzemenin dış ortamdan ısı absorblama kabiliyetinin bir göstergesi
MADDENİN YAPISI VE ÖZELLİKLERİ ATOM
 MADDENİN YAPISI VE ÖZELLİKLERİ ATOM ATOMUN YAPISI Elementlerin tüm özelliğini gösteren en küçük parçasına atom denir. Atomu oluşturan parçacıklar farklı yüklere sa-hiptir. Atomda bulunan yükler; negatif
MADDENİN YAPISI VE ÖZELLİKLERİ ATOM ATOMUN YAPISI Elementlerin tüm özelliğini gösteren en küçük parçasına atom denir. Atomu oluşturan parçacıklar farklı yüklere sa-hiptir. Atomda bulunan yükler; negatif
Paylaşılan elektron ya da elektronlar, her iki çekirdek etrafında dolanacaklar, iki çekirdek arasındaki bölgede daha uzun süre bulundukları için bu
 4.Kimyasal Bağlar Kimyasal Bağlar Aynı ya da farklı cins atomları bir arada tutan kuvvetlere kimyasal bağlar denir. Pek çok madde farklı element atomlarının birleşmesiyle meydana gelmiştir. İyonik bağ
4.Kimyasal Bağlar Kimyasal Bağlar Aynı ya da farklı cins atomları bir arada tutan kuvvetlere kimyasal bağlar denir. Pek çok madde farklı element atomlarının birleşmesiyle meydana gelmiştir. İyonik bağ
Atomlar birleştiği zaman elektron dağılımındaki değişmelerin bir sonucu olarak kimyasal bağlar meydana gelir. Üç çeşit temel bağ vardır:
 Atomlar birleştiği zaman elektron dağılımındaki değişmelerin bir sonucu olarak kimyasal bağlar meydana gelir. Üç çeşit temel bağ vardır: İyonik bağlar, elektronlar bir atomdan diğerine aktarıldığı zaman
Atomlar birleştiği zaman elektron dağılımındaki değişmelerin bir sonucu olarak kimyasal bağlar meydana gelir. Üç çeşit temel bağ vardır: İyonik bağlar, elektronlar bir atomdan diğerine aktarıldığı zaman
Genel Kimya Prensipleri ve Modern Uygulamaları Petrucci Harwood Herring 8. Baskı. Bölüm 4: Kimyasal Tepkimeler
 Genel Kimya Prensipleri ve Modern Uygulamaları Petrucci Harwood Herring 8. Baskı Bölüm 4: Kimyasal Tepkimeler İçindekiler 4-1 Kimyasal Tepkimeler ve Kimyasal Eşitlikler 4-2 Kimyasal Eşitlik ve Stokiyometri
Genel Kimya Prensipleri ve Modern Uygulamaları Petrucci Harwood Herring 8. Baskı Bölüm 4: Kimyasal Tepkimeler İçindekiler 4-1 Kimyasal Tepkimeler ve Kimyasal Eşitlikler 4-2 Kimyasal Eşitlik ve Stokiyometri
KİMYA-IV. Yrd. Doç. Dr. Yakup Güneş
 KİMYA-IV Yrd. Doç. Dr. Yakup Güneş Organik Kimyaya Giriş Kimyasal bileşikler, eski zamanlarda, elde edildikleri kaynaklara bağlı olarak Anorganik ve Organik olmak üzere, iki sınıf altında toplanmışlardır.
KİMYA-IV Yrd. Doç. Dr. Yakup Güneş Organik Kimyaya Giriş Kimyasal bileşikler, eski zamanlarda, elde edildikleri kaynaklara bağlı olarak Anorganik ve Organik olmak üzere, iki sınıf altında toplanmışlardır.
1. Giriş 2. Yayınma Mekanizmaları 3. Kararlı Karasız Yayınma 4. Yayınmayı etkileyen faktörler 5. Yarı iletkenlerde yayınma 6. Diğer yayınma yolları
 1. Giriş 2. Yayınma Mekanizmaları 3. Kararlı Karasız Yayınma 4. Yayınmayı etkileyen faktörler 5. Yarı iletkenlerde yayınma 6. Diğer yayınma yolları Sol üstte yüzey seftleştirme işlemi uygulanmış bir çelik
1. Giriş 2. Yayınma Mekanizmaları 3. Kararlı Karasız Yayınma 4. Yayınmayı etkileyen faktörler 5. Yarı iletkenlerde yayınma 6. Diğer yayınma yolları Sol üstte yüzey seftleştirme işlemi uygulanmış bir çelik
İYON TEPKİMELERİ. Prof. Dr. Mustafa DEMİR. (Kimyasal tepkimelerin eşitlenmesi) 03-İYON TEPKİMELERİ-KİMYASAL TEPKİMELERİN EŞİTLENMESİ 1 M.
 İYN TEPKİMELERİ (Kimyasal tepkimelerin eşitlenmesi) Prof. Dr. Mustafa DEMİR 0İYN TEPKİMELERİKİMYASAL TEPKİMELERİN EŞİTLENMESİ 1 Bir kimyasal madde ısı, elektrik veya çözücü gibi çeşitli fiziksel veya kimyasal
İYN TEPKİMELERİ (Kimyasal tepkimelerin eşitlenmesi) Prof. Dr. Mustafa DEMİR 0İYN TEPKİMELERİKİMYASAL TEPKİMELERİN EŞİTLENMESİ 1 Bir kimyasal madde ısı, elektrik veya çözücü gibi çeşitli fiziksel veya kimyasal
5) Çözünürlük(Xg/100gsu)
 1) I. Havanın sıvılaştırılması II. abrika bacasından çıkan SO 3 gazının H 2 O ile birleşmesi III. Na metalinin suda çözünmesi Yukardaki olaylardan hangilerinde kimyasal değişme gerçekleşir? 4) Kütle 1
1) I. Havanın sıvılaştırılması II. abrika bacasından çıkan SO 3 gazının H 2 O ile birleşmesi III. Na metalinin suda çözünmesi Yukardaki olaylardan hangilerinde kimyasal değişme gerçekleşir? 4) Kütle 1
Aşağıda verilen özet bilginin ayrıntısını, ders kitabı. olarak önerilen, Erdik ve Sarıkaya nın Temel. Üniversitesi Kimyası" Kitabı ndan okuyunuz.
 KİMYASAL BAĞLAR Aşağıda verilen özet bilginin ayrıntısını, ders kitabı olarak önerilen, Erdik ve Sarıkaya nın Temel Üniversitesi Kimyası" Kitabı ndan okuyunuz. KİMYASAL BAĞLAR İki atom veya atom grubu
KİMYASAL BAĞLAR Aşağıda verilen özet bilginin ayrıntısını, ders kitabı olarak önerilen, Erdik ve Sarıkaya nın Temel Üniversitesi Kimyası" Kitabı ndan okuyunuz. KİMYASAL BAĞLAR İki atom veya atom grubu
ATOMİK YAPI. Elektron Yükü=-1,60x10-19 C Proton Yükü=+1,60x10-19 C Nötron Yükü=0
 ATOMİK YAPI Elektron Yükü=-1,60x10-19 C Proton Yükü=+1,60x10-19 C Nötron Yükü=0 Elektron Kütlesi 9,11x10-31 kg Proton Kütlesi Nötron Kütlesi 1,67x10-27 kg Bir kimyasal elementin atom numarası (Z) çekirdeğindeki
ATOMİK YAPI Elektron Yükü=-1,60x10-19 C Proton Yükü=+1,60x10-19 C Nötron Yükü=0 Elektron Kütlesi 9,11x10-31 kg Proton Kütlesi Nötron Kütlesi 1,67x10-27 kg Bir kimyasal elementin atom numarası (Z) çekirdeğindeki
POLİ(AKRİLAMİD-KO-SODYUM AKRİLAT)/BENTONİT NANOKOMPOZİT HİDROJELLERİN SENTEZİ VE ŞİŞME DAVRANIŞININ İNCELENMESİ
 Özet POLİ(AKRİLAMİD-KO-SODYUM AKRİLAT/BENTONİT NANOKOMPOZİT HİDROJELLERİN SENTEZİ VE ŞİŞME DAVRANIŞININ İNCELENMESİ Gülşah Yaşar a, Selva Çavuş*, İsmail Aydın a a Reoloji Laboratuvarı *İstanbul Üniversitesi,
Özet POLİ(AKRİLAMİD-KO-SODYUM AKRİLAT/BENTONİT NANOKOMPOZİT HİDROJELLERİN SENTEZİ VE ŞİŞME DAVRANIŞININ İNCELENMESİ Gülşah Yaşar a, Selva Çavuş*, İsmail Aydın a a Reoloji Laboratuvarı *İstanbul Üniversitesi,
Fiziksel özellikleri her yerde aynı olan (homojen) karışımlara çözelti denir. Bir çözeltiyi oluşturan her bir maddeye çözeltinin bileşenleri denir.
 GENEL KİMYA 1 LABORATUARI ÇALIŞMA NOTLARI DENEY: 8 ÇÖZELTİLER Dr. Bahadır KESKİN, 2011 @ YTÜ Fiziksel özellikleri her yerde aynı olan (homojen) karışımlara çözelti denir. Bir çözeltiyi oluşturan her bir
GENEL KİMYA 1 LABORATUARI ÇALIŞMA NOTLARI DENEY: 8 ÇÖZELTİLER Dr. Bahadır KESKİN, 2011 @ YTÜ Fiziksel özellikleri her yerde aynı olan (homojen) karışımlara çözelti denir. Bir çözeltiyi oluşturan her bir
UBT Foton Algılayıcıları Ara Sınav Cevap Anahtarı Tarih: 22 Nisan 2015 Süre: 90 dk. İsim:
 UBT 306 - Foton Algılayıcıları Ara Sınav Cevap Anahtarı Tarih: 22 Nisan 2015 Süre: 90 dk. İsim: 1. (a) (5) Radyoaktivite nedir, tanımlayınız? Bir radyoizotopun aktivitesi (A), izotopun birim zamandaki
UBT 306 - Foton Algılayıcıları Ara Sınav Cevap Anahtarı Tarih: 22 Nisan 2015 Süre: 90 dk. İsim: 1. (a) (5) Radyoaktivite nedir, tanımlayınız? Bir radyoizotopun aktivitesi (A), izotopun birim zamandaki
ÇÖZELTILERDE DENGE. Asitler ve Bazlar
 ÇÖZELTILERDE DENGE Asitler ve Bazlar Zayıf Asit ve Bazlar Değişik asitler için verilen ph değerlerinin farklılık gösterdiğini görürüz. Bir önceki konuda ph değerinin [H₃O + ] ile ilgili olduğunu gördük.
ÇÖZELTILERDE DENGE Asitler ve Bazlar Zayıf Asit ve Bazlar Değişik asitler için verilen ph değerlerinin farklılık gösterdiğini görürüz. Bir önceki konuda ph değerinin [H₃O + ] ile ilgili olduğunu gördük.
6.4. Çözünürlük üzerine kompleks oluşumunun etkisi ------------ 6.5. Çözünürlük üzerine hidrolizin etkisi ---------------------------- 6.6.
 iii İÇİNDEKİLER 1. GİRİŞ ------------------------------------------------------------------- 2. TANIMLAR ------------------------------------------------------------ 2.1. Atom-gram -------------------------------------------------------
iii İÇİNDEKİLER 1. GİRİŞ ------------------------------------------------------------------- 2. TANIMLAR ------------------------------------------------------------ 2.1. Atom-gram -------------------------------------------------------
DENEY 6. CH 3 COO - + Na + + H 2 O ve
 DENEY 6 İLETKENLİK TİTRASYONU İLE KUVVETLİ VE ZAYIF ASİTLERİN ANALİZİ Deneyin Yapılışı: Deney için sırasıyla,5 N HCl;,1 N Asetik asit ve ikisinin de bilinmeyen miktarlarda bulunduğu karışımı,1 N NaOH ile
DENEY 6 İLETKENLİK TİTRASYONU İLE KUVVETLİ VE ZAYIF ASİTLERİN ANALİZİ Deneyin Yapılışı: Deney için sırasıyla,5 N HCl;,1 N Asetik asit ve ikisinin de bilinmeyen miktarlarda bulunduğu karışımı,1 N NaOH ile
3.BÖLÜM: TERMODİNAMİĞİN I. YASASI
 3.BÖLÜM: TERMODİNAMİĞİN I. YASASI S (k) + O SO + ısı Reaksiyon sonucunda sistemden ortama verilen ısı, sistemin iç enerjisinin bir kısmının ısı enerjisine dönüşmesi sonucunda ortaya çıkmıştır. Enerji sistemden
3.BÖLÜM: TERMODİNAMİĞİN I. YASASI S (k) + O SO + ısı Reaksiyon sonucunda sistemden ortama verilen ısı, sistemin iç enerjisinin bir kısmının ısı enerjisine dönüşmesi sonucunda ortaya çıkmıştır. Enerji sistemden
Enerji Sistemleri Mühendisliği Bölümü
 YALOVA ÜNİVERSİTESİ MÜHENDİSLİK FAKÜLTESİ Enerji Sistemleri Mühendisliği Bölümü ESM 413 Enerji Sistemleri Laboratuvarı-II RL, RC ve RLC DEVRELERİNİN AC ANALİZİ Puanlandırma Sistemi: Hazırlık Soruları:
YALOVA ÜNİVERSİTESİ MÜHENDİSLİK FAKÜLTESİ Enerji Sistemleri Mühendisliği Bölümü ESM 413 Enerji Sistemleri Laboratuvarı-II RL, RC ve RLC DEVRELERİNİN AC ANALİZİ Puanlandırma Sistemi: Hazırlık Soruları:
ATOMİK YAPI. Elektron Yükü=-1,60x10-19 C Proton Yükü=+1,60x10-19 C Nötron Yükü=0
 ATOMİK YAPI Atom, birkaç türü birleştiğinde çeşitli molekülleri, bir tek türü ise bir kimyasal öğeyi oluşturan parçacıktır. Atom, elementlerin özelliklerini taşıyan en küçük yapı birimi olup çekirdekteki
ATOMİK YAPI Atom, birkaç türü birleştiğinde çeşitli molekülleri, bir tek türü ise bir kimyasal öğeyi oluşturan parçacıktır. Atom, elementlerin özelliklerini taşıyan en küçük yapı birimi olup çekirdekteki
MOL KAVRAMI I. ÖRNEK 2
 MOL KAVRAMI I Maddelerin taneciklerden oluştuğunu biliyoruz. Bu taneciklere atom, molekül ya da iyon denir. Atom : Kimyasal yöntemlerle daha basit taneciklere ayrılmayan ve elementlerin yapıtaşı olan taneciklere
MOL KAVRAMI I Maddelerin taneciklerden oluştuğunu biliyoruz. Bu taneciklere atom, molekül ya da iyon denir. Atom : Kimyasal yöntemlerle daha basit taneciklere ayrılmayan ve elementlerin yapıtaşı olan taneciklere
Nötr (yüksüz) bir için, çekirdekte kaç proton varsa çekirdeğin etrafındaki yörüngelerde de o kadar elektron dolaşır.
 ATOM ve YAPISI Elementin özelliğini taşıyan en küçük parçasına denir. Atom Numarası Bir elementin unda bulunan proton sayısıdır. Protonlar (+) yüklü olduklarından pozitif yük sayısı ya da çekirdek yükü
ATOM ve YAPISI Elementin özelliğini taşıyan en küçük parçasına denir. Atom Numarası Bir elementin unda bulunan proton sayısıdır. Protonlar (+) yüklü olduklarından pozitif yük sayısı ya da çekirdek yükü
Kimya Mühendisliği Bölümü, 2014/2015 Öğretim Yılı, Bahar Yarıyılı 0102-Genel Kimya-II Dersi, Dönem Sonu Sınavı
 Kimya Mühendisliği Bölümü, 2014/2015 Öğretim Yılı, Bahar Yarıyılı 0102-Genel Kimya-II Dersi, Dönem Sonu Sınavı 20.05.2015 Soru (puan) 1 (20 ) 2 (20 ) 3 (20 ) 4 (25) 5 (20 ) 6 (20 ) Toplam Alınan Puan Not:
Kimya Mühendisliği Bölümü, 2014/2015 Öğretim Yılı, Bahar Yarıyılı 0102-Genel Kimya-II Dersi, Dönem Sonu Sınavı 20.05.2015 Soru (puan) 1 (20 ) 2 (20 ) 3 (20 ) 4 (25) 5 (20 ) 6 (20 ) Toplam Alınan Puan Not:
ATOM BİLGİSİ Atom Modelleri
 1. Atom Modelleri BÖLÜM2 Maddenin atom adı verilen bir takım taneciklerden oluştuğu fikri çok eskiye dayanmaktadır. Ancak, bilimsel bir (deneye dayalı) atom modeli ilk defa Dalton tarafından ileri sürülmüştür.
1. Atom Modelleri BÖLÜM2 Maddenin atom adı verilen bir takım taneciklerden oluştuğu fikri çok eskiye dayanmaktadır. Ancak, bilimsel bir (deneye dayalı) atom modeli ilk defa Dalton tarafından ileri sürülmüştür.
Hitit Üniversitesi, Mühendislik Fakültesi, Kimya Mühendisliği Bölümü, 19030,ÇORUM sstilmisbasan@hitit.edu.tr
 ÜÇLÜ POLİ(VİNİL KLORÜR) KARIŞIMLARININ TERMOMEKANİK ÖZELLİKLERİNE MALEİK ANHİDRİT İÇEREN TERPOLİMERLERİN ETKİSİ SATILMIŞ BASAN, ÖZLEM AYDIN, FATMA ŞAHİN Hitit Üniversitesi, Mühendislik Fakültesi, Kimya
ÜÇLÜ POLİ(VİNİL KLORÜR) KARIŞIMLARININ TERMOMEKANİK ÖZELLİKLERİNE MALEİK ANHİDRİT İÇEREN TERPOLİMERLERİN ETKİSİ SATILMIŞ BASAN, ÖZLEM AYDIN, FATMA ŞAHİN Hitit Üniversitesi, Mühendislik Fakültesi, Kimya
GENEL KİMYA. Yrd.Doç.Dr. Tuba YETİM
 GENEL KİMYA ÇÖZELTİLER Homojen karışımlara çözelti denir. Çözelti bileşiminin ve özelliklerinin çözeltinin her yerinde aynı olması sebebiyle çözelti, «homojen» olarak nitelendirilir. Çözeltinin değişen
GENEL KİMYA ÇÖZELTİLER Homojen karışımlara çözelti denir. Çözelti bileşiminin ve özelliklerinin çözeltinin her yerinde aynı olması sebebiyle çözelti, «homojen» olarak nitelendirilir. Çözeltinin değişen
POLİMER KİMYASI -4. Prof. Dr. Saadet K. Pabuccuoğlu
 POLİMER KİMYASI -4 Prof. Dr. Saadet K. Pabuccuoğlu Fiziksel Etkenlerle Başlama Diğer başlama tipleri Plazma polimerizasyonu: Bir gaz halindeki monomer; plazma oluşum şartlarında düşük basınçta bir elektrik
POLİMER KİMYASI -4 Prof. Dr. Saadet K. Pabuccuoğlu Fiziksel Etkenlerle Başlama Diğer başlama tipleri Plazma polimerizasyonu: Bir gaz halindeki monomer; plazma oluşum şartlarında düşük basınçta bir elektrik
BÖLÜM 2 ATOMİK YAPI İÇERİK. Atom yapısı. Bağ tipleri. Chapter 2-1
 BÖLÜM 2 ATOMİK YAPI İÇERİK Atom yapısı Bağ tipleri 1 Atomların Yapıları Atomlar başlıca üç temel atom altı parçacıktan oluşur; Protonlar (+ yüklü) Nötronlar (yüksüz) Elektronlar (-yüklü) Basit bir atom
BÖLÜM 2 ATOMİK YAPI İÇERİK Atom yapısı Bağ tipleri 1 Atomların Yapıları Atomlar başlıca üç temel atom altı parçacıktan oluşur; Protonlar (+ yüklü) Nötronlar (yüksüz) Elektronlar (-yüklü) Basit bir atom
R RAMAN SPEKTROSKOPİSİ CAN EROL
 R RAMAN SPEKTROSKOPİSİ CAN EROL Spektroskopi nedir? x Spektroskopi, çeşitli tipte ışınların madde ile etkileşimini inceleyen bilim dalıdır. Lazer radyasyon ışını örnekten geçer örnekten radyasyon çıkarken
R RAMAN SPEKTROSKOPİSİ CAN EROL Spektroskopi nedir? x Spektroskopi, çeşitli tipte ışınların madde ile etkileşimini inceleyen bilim dalıdır. Lazer radyasyon ışını örnekten geçer örnekten radyasyon çıkarken
Nanomalzemelerin Karakterizasyonu. Yapısal Karakterizasyon Kimyasal Karakterizasyon
 Nanomalzemelerin Karakterizasyonu Yapısal Karakterizasyon Kimyasal Karakterizasyon 1 Nanomalzemlerin Yapısal Karakterizasyonu X ışını difraksiyonu (XRD) Çeşitli elektronik mikroskoplar(sem, TEM) Atomik
Nanomalzemelerin Karakterizasyonu Yapısal Karakterizasyon Kimyasal Karakterizasyon 1 Nanomalzemlerin Yapısal Karakterizasyonu X ışını difraksiyonu (XRD) Çeşitli elektronik mikroskoplar(sem, TEM) Atomik
a. Yükseltgenme potansiyeli büyük olanlar daha aktifdir.
 ELEKTROKİMYA A. AKTİFLİK B. PİLLER C. ELEKTROLİZ A. AKTİFLİK Metallerin elektron verme, ametallerin elektron alma yatkınlıklarına aktiflik denir. Yani bir metal ne kadar kolay elektron veriyorsa bir ametal
ELEKTROKİMYA A. AKTİFLİK B. PİLLER C. ELEKTROLİZ A. AKTİFLİK Metallerin elektron verme, ametallerin elektron alma yatkınlıklarına aktiflik denir. Yani bir metal ne kadar kolay elektron veriyorsa bir ametal
Nötronlar kinetik enerjilerine göre aşağıdaki gibi sınıflandırılırlar
 Nötronlar kinetik enerjilerine göre aşağıdaki gibi sınıflandırılırlar Termal nötronlar (0.025 ev) Orta enerjili nötronlar (0.5-10 kev) Hızlı nötronlar (10 kev-10 MeV) Çok hızlı nötronlar (10 MeV in üzerinde)
Nötronlar kinetik enerjilerine göre aşağıdaki gibi sınıflandırılırlar Termal nötronlar (0.025 ev) Orta enerjili nötronlar (0.5-10 kev) Hızlı nötronlar (10 kev-10 MeV) Çok hızlı nötronlar (10 MeV in üzerinde)
DENEY 0. Bölüm 1 - Ölçme ve Hata Hesabı
 DENEY 0 Bölüm 1 - Ölçme ve Hata Hesabı Amaç: Ölçüm metodu ve cihazına bağlı hata ve belirsizlikleri anlamak, fiziksel bir niceliği ölçüp hata ve belirsizlikleri tespit etmek, nedenlerini açıklamak. Genel
DENEY 0 Bölüm 1 - Ölçme ve Hata Hesabı Amaç: Ölçüm metodu ve cihazına bağlı hata ve belirsizlikleri anlamak, fiziksel bir niceliği ölçüp hata ve belirsizlikleri tespit etmek, nedenlerini açıklamak. Genel
HAZIRLAYAN Mutlu ŞAHİN. Hacettepe Fen Bilgisi Öğretmenliği. DENEY NO: 6 DENEYİN ADI: DOYMUŞ NaCl ÇÖZELTİSİNİN ELEKTROLİZİ
 HAZIRLAYAN Mutlu ŞAHİN Hacettepe Fen Bilgisi Öğretmenliği DENEY NO: 6 DENEYİN ADI: DOYMUŞ NaCl ÇÖZELTİSİNİN ELEKTROLİZİ DENEYİN AMACI: Doymuş NaCl çözeltisinin elektroliz sonucu elementlerine ayrışmasının
HAZIRLAYAN Mutlu ŞAHİN Hacettepe Fen Bilgisi Öğretmenliği DENEY NO: 6 DENEYİN ADI: DOYMUŞ NaCl ÇÖZELTİSİNİN ELEKTROLİZİ DENEYİN AMACI: Doymuş NaCl çözeltisinin elektroliz sonucu elementlerine ayrışmasının
PERİYODİK CETVEL-ÖSS DE ÇIKMIŞ SORULAR
 PERİODİK CETVEL-ÖSS DE ÇIKMIŞ SORULAR 1. Bir elementin periyodik cetveldeki yeri aşağıdakilerden hangisi ile belirlenir? A) Atom ağırlığı B) Değerliği C) Atom numarası D) Kimyasal özellikleri E) Fiziksel
PERİODİK CETVEL-ÖSS DE ÇIKMIŞ SORULAR 1. Bir elementin periyodik cetveldeki yeri aşağıdakilerden hangisi ile belirlenir? A) Atom ağırlığı B) Değerliği C) Atom numarası D) Kimyasal özellikleri E) Fiziksel
MAKRO-MEZO-MİKRO. Deney Yöntemleri. MİKRO Deneyler Zeta Potansiyel Partikül Boyutu. MEZO Deneyler Reolojik Ölçümler Reometre (dinamik) Roww Hücresi
 Kolloidler Bir maddenin kendisi için çözücü olmayan bir ortamda 10-5 -10-7 cm boyutlarında dağılmasıyla oluşan çözeltiye kolloidal çözelti denir. Çimento, su, agrega ve bu sistemin dispersiyonuna etki
Kolloidler Bir maddenin kendisi için çözücü olmayan bir ortamda 10-5 -10-7 cm boyutlarında dağılmasıyla oluşan çözeltiye kolloidal çözelti denir. Çimento, su, agrega ve bu sistemin dispersiyonuna etki
HISTOLOJIDE BOYAMA YÖNTEMLERI. Dr. Yasemin Sezgin. yasemin sezgin
 HISTOLOJIDE BOYAMA YÖNTEMLERI Dr. Yasemin Sezgin yasemin sezgin HÜRESEL BOYAMANIN TEMEL PRENSİPLERİ Hem fiziksel hem kimyasal faktörler hücresel boyamayı etkilemektedir BOYAMA MEKANIZMASı Temelde boyanın
HISTOLOJIDE BOYAMA YÖNTEMLERI Dr. Yasemin Sezgin yasemin sezgin HÜRESEL BOYAMANIN TEMEL PRENSİPLERİ Hem fiziksel hem kimyasal faktörler hücresel boyamayı etkilemektedir BOYAMA MEKANIZMASı Temelde boyanın
3. Kimyasal Bileşikler
 TOBB Ekonomi ve Teknoloji Üniversitesi 3. Kimyasal Bileşikler Mol kavramı ve kimyasal bileşikler Kimyasal Bileşik Formülleri (Kaba vs Molekül Formülü) Yüzde bileşimin hesaplanması Yakma analizi TOBB Ekonomi
TOBB Ekonomi ve Teknoloji Üniversitesi 3. Kimyasal Bileşikler Mol kavramı ve kimyasal bileşikler Kimyasal Bileşik Formülleri (Kaba vs Molekül Formülü) Yüzde bileşimin hesaplanması Yakma analizi TOBB Ekonomi
FZM 220. Malzeme Bilimine Giriş
 FZM 220 Yapı Karakterizasyon Özellikler İşleme Performans Prof. Dr. İlker DİNÇER Fakültesi, Fizik Mühendisliği Bölümü 1 Atomsal Yapı ve Atomlararası Bağ1 Ders Hakkında FZM 220 Dersinin Amacı Bu dersin
FZM 220 Yapı Karakterizasyon Özellikler İşleme Performans Prof. Dr. İlker DİNÇER Fakültesi, Fizik Mühendisliği Bölümü 1 Atomsal Yapı ve Atomlararası Bağ1 Ders Hakkında FZM 220 Dersinin Amacı Bu dersin
GENEL KİMYA 101 ÖDEV 3
 TOBB EKONOMİ VE TEKNOLOJİ ÜNİVERSİTESİ-27 Kasım 2013 Bütün Şubeler GENEL KİMYA 101 ÖDEV 3 ÖNEMLİ! Ödev Teslim Tarihi: 6 Aralık 2013 Soru 1-5 arasında 2 soru Soru 6-10 arasında 2 soru Soru 11-15 arasında
TOBB EKONOMİ VE TEKNOLOJİ ÜNİVERSİTESİ-27 Kasım 2013 Bütün Şubeler GENEL KİMYA 101 ÖDEV 3 ÖNEMLİ! Ödev Teslim Tarihi: 6 Aralık 2013 Soru 1-5 arasında 2 soru Soru 6-10 arasında 2 soru Soru 11-15 arasında
Serüveni 3. ÜNİTE KİMYASAL TÜRLER ARASI ETKİLEŞİM GÜÇLÜ ETKİLEŞİM. o İYONİK BAĞ o KOVALENT BAĞ o METALİK BAĞ
 Serüveni 3. ÜNİTE KİMYASAL TÜRLER ARASI ETKİLEŞİM GÜÇLÜ ETKİLEŞİM o İYONİK BAĞ o KOVALENT BAĞ o METALİK BAĞ KİMYASAL TÜR 1. İYONİK BAĞ - - Ametal.- Kök Kök Kök (+) ve (-) yüklü iyonların çekim kuvvetidir..halde
Serüveni 3. ÜNİTE KİMYASAL TÜRLER ARASI ETKİLEŞİM GÜÇLÜ ETKİLEŞİM o İYONİK BAĞ o KOVALENT BAĞ o METALİK BAĞ KİMYASAL TÜR 1. İYONİK BAĞ - - Ametal.- Kök Kök Kök (+) ve (-) yüklü iyonların çekim kuvvetidir..halde
Tek Boyutlu Potansiyeller: Potansiyel eşiği
 Tek Boyutlu Potansiyeller: Potansiyel eşiği Şekil I: V 0 yüksekliğindeki potansiyel eşiği. Parçacık soldan gelmekte olup, enerjisi E dir. Zamandan bağımsız bir durumu analiz ediyoruz ki burada iyi belirlenmiş
Tek Boyutlu Potansiyeller: Potansiyel eşiği Şekil I: V 0 yüksekliğindeki potansiyel eşiği. Parçacık soldan gelmekte olup, enerjisi E dir. Zamandan bağımsız bir durumu analiz ediyoruz ki burada iyi belirlenmiş
İÇİNDEKİLER -BÖLÜM / 1- -BÖLÜM / 2- -BÖLÜM / 3- GİRİŞ... 1 ÖZEL GÖRELİLİK KUANTUM FİZİĞİ ÖNSÖZ... iii ŞEKİLLERİN LİSTESİ...
 İÇİNDEKİLER ÖNSÖZ... iii ŞEKİLLERİN LİSTESİ... viii -BÖLÜM / 1- GİRİŞ... 1 -BÖLÜM / 2- ÖZEL GÖRELİLİK... 13 2.1. REFERANS SİSTEMLERİ VE GÖRELİLİK... 14 2.2. ÖZEL GÖRELİLİK TEORİSİ... 19 2.2.1. Zaman Ölçümü
İÇİNDEKİLER ÖNSÖZ... iii ŞEKİLLERİN LİSTESİ... viii -BÖLÜM / 1- GİRİŞ... 1 -BÖLÜM / 2- ÖZEL GÖRELİLİK... 13 2.1. REFERANS SİSTEMLERİ VE GÖRELİLİK... 14 2.2. ÖZEL GÖRELİLİK TEORİSİ... 19 2.2.1. Zaman Ölçümü
X-IŞINI FLORESANS SPEKTROSKOPİSİ. X-ışınları spektrometresi ile numunelerin yarı kantitatif olarak içeriğinin belirlenmesi.
 X-IŞINI FLORESANS SPEKTROSKOPİSİ 1. DENEYİN AMACI X-ışınları spektrometresi ile numunelerin yarı kantitatif olarak içeriğinin belirlenmesi. 2. TEORİK BİLGİ X-ışınları, yüksek enerjiye sahip elektronların
X-IŞINI FLORESANS SPEKTROSKOPİSİ 1. DENEYİN AMACI X-ışınları spektrometresi ile numunelerin yarı kantitatif olarak içeriğinin belirlenmesi. 2. TEORİK BİLGİ X-ışınları, yüksek enerjiye sahip elektronların
ÇÖZELTİLERİN KOLİGATİF ÖZELLİKLERİ
 ÇÖZELTİLERİN KOLİGATİF ÖZELLİKLERİ Çözeltilerin sadece derişimine bağlı olarak değişen özelliklerine koligatif özellikler denir. Buhar basıncı düşmesi, Kaynama noktası yükselmesi, Donma noktası azalması
ÇÖZELTİLERİN KOLİGATİF ÖZELLİKLERİ Çözeltilerin sadece derişimine bağlı olarak değişen özelliklerine koligatif özellikler denir. Buhar basıncı düşmesi, Kaynama noktası yükselmesi, Donma noktası azalması
Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı
 Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani madde yani bileşik
Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani madde yani bileşik
Kil Nedir? Kristal yapıları birbirinden farklı birkaç mineralin oluşturduğu bir karışımın genel ismidir
 Nanokompozitlerin sentezi Kil Nedir? Kristal yapıları birbirinden farklı birkaç mineralin oluşturduğu bir karışımın genel ismidir KİL=Ana kil minerali + Diğer kil mineralleri + Eser organik maddeler Yapısında
Nanokompozitlerin sentezi Kil Nedir? Kristal yapıları birbirinden farklı birkaç mineralin oluşturduğu bir karışımın genel ismidir KİL=Ana kil minerali + Diğer kil mineralleri + Eser organik maddeler Yapısında
KİMYASAL ANALİZ KALİTATİF ANALİZ (NİTEL) (NİCEL) KANTİTATİF ANALİZ
 KİMYASAL ANALİZ KALİTATİF ANALİZ (NİTEL) KANTİTATİF ANALİZ (NİCEL) KANTİTATİF ANALİZ Bir numunedeki element veya bileşiğin bağıl miktarını belirlemek için yapılan analizlere denir. 1 ANALİTİK ANALİTİK
KİMYASAL ANALİZ KALİTATİF ANALİZ (NİTEL) KANTİTATİF ANALİZ (NİCEL) KANTİTATİF ANALİZ Bir numunedeki element veya bileşiğin bağıl miktarını belirlemek için yapılan analizlere denir. 1 ANALİTİK ANALİTİK
ONDOKUZ MAYIS ÜNİVERSİTESİ MÜHENDİSLİK FAKÜLTESİ KİMYA MÜHENDİSLİĞİ BÖLÜMÜ ORGANİK KİMYA LABORATUVARI DENEY 8 : YÜZEY GERİLİMİNİN BELİRLENMESİ
 ONDOKUZ MAYIS ÜNİVERSİTESİ MÜHENDİSLİK FAKÜLTESİ KİMYA MÜHENDİSLİĞİ BÖLÜMÜ ORGANİK KİMYA LABORATUVARI DENEY 8 : YÜZEY GERİLİMİNİN BELİRLENMESİ DENEYİN AMACI Gazlarda söz konusu olmayan yüzey gerilimi sıvı
ONDOKUZ MAYIS ÜNİVERSİTESİ MÜHENDİSLİK FAKÜLTESİ KİMYA MÜHENDİSLİĞİ BÖLÜMÜ ORGANİK KİMYA LABORATUVARI DENEY 8 : YÜZEY GERİLİMİNİN BELİRLENMESİ DENEYİN AMACI Gazlarda söz konusu olmayan yüzey gerilimi sıvı
KİNETİK GAZ KURAMI. Doç. Dr. Faruk GÖKMEŞE Kimya Bölümü Hitit Üniversitesi Fen Edebiyat Fakültesi 1
 Kinetik Gaz Kuramının Varsayımları Boyle, Gay-Lussac ve Avagadro deneyleri tüm ideal gazların aynı davrandığını göstermektedir ve bunları açıklamak üzere kinetik gaz kuramı ortaya atılmıştır. 1. Gazlar
Kinetik Gaz Kuramının Varsayımları Boyle, Gay-Lussac ve Avagadro deneyleri tüm ideal gazların aynı davrandığını göstermektedir ve bunları açıklamak üzere kinetik gaz kuramı ortaya atılmıştır. 1. Gazlar
Continuous Spectrum continued
 fftinsaat.com Continuous Spectrum continued Hotter objects Shift toward this end Longer wavelength Shorter wavelength Cooler objects Shift toward this end Discrete Spectrum Absorption Ex: stars, planets
fftinsaat.com Continuous Spectrum continued Hotter objects Shift toward this end Longer wavelength Shorter wavelength Cooler objects Shift toward this end Discrete Spectrum Absorption Ex: stars, planets
Infrared Spektroskopisi ve Kütle Spektrometrisi
 Infrared Spektroskopisi ve Kütle Spektrometrisi 1 Giriş Spektroskopi, yapı tayininde kullanılan analitik bir tekniktir. Nümuneyi hiç bozmaz veya çok az bozar. Nümuneden geçirilen ışımanın dalga boyu değiştirilir
Infrared Spektroskopisi ve Kütle Spektrometrisi 1 Giriş Spektroskopi, yapı tayininde kullanılan analitik bir tekniktir. Nümuneyi hiç bozmaz veya çok az bozar. Nümuneden geçirilen ışımanın dalga boyu değiştirilir
HİDROKARBONLAR ve ALKENLER. Ders Notu
 HİDROKARBONLAR ve ALKENLER Ders Notu HİDROKARBONLAR ve ALKENLER Karbon atomları arası en az bir çift bağ içerdiklerinden doymamış hidrokarbonlardır,. Çift bağdan biri sigma, diğeri pi bağıdır. Çift bağlı
HİDROKARBONLAR ve ALKENLER Ders Notu HİDROKARBONLAR ve ALKENLER Karbon atomları arası en az bir çift bağ içerdiklerinden doymamış hidrokarbonlardır,. Çift bağdan biri sigma, diğeri pi bağıdır. Çift bağlı
BİLEŞİKLER VE FORMÜLLERİ
 BİLEŞİKLER VE FORMÜLLERİ Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur). Bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere
BİLEŞİKLER VE FORMÜLLERİ Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur). Bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere
ELEKTRONLARIN DĠZĠLĠMĠ
 ELEKTRONLARIN DĠZĠLĠMĠ Eğer bu üç elementin birer elektronu daha olsaydı, her birinde yeni bir katman oluşacaktı. Çünkü her üçünün de en dıştaki katmanları tamamen dolu durumdadır. 1.Katmanda en çok 2
ELEKTRONLARIN DĠZĠLĠMĠ Eğer bu üç elementin birer elektronu daha olsaydı, her birinde yeni bir katman oluşacaktı. Çünkü her üçünün de en dıştaki katmanları tamamen dolu durumdadır. 1.Katmanda en çok 2
ERCİYES ÜNİVERSİTESİ MÜHENDİSLİK FAKÜLTESİ ENERJİ SİSTEMLERİ MÜHENDİSLİĞİ BÖLÜMÜ
 ERCİYES ÜNİVERSİTESİ MÜHENDİSLİK FAKÜLTESİ ENERJİ SİSTEMLERİ MÜHENDİSLİĞİ BÖLÜMÜ ENERJİ SİSTEMLERİ LABORATUVARI -II DENEY FÖYÜ DENEY ADI KÜTLE TRANSFERİ DERSİN ÖĞRETİM ÜYESİ DENEYİ YAPTIRAN ÖĞRETİM ELEMANI
ERCİYES ÜNİVERSİTESİ MÜHENDİSLİK FAKÜLTESİ ENERJİ SİSTEMLERİ MÜHENDİSLİĞİ BÖLÜMÜ ENERJİ SİSTEMLERİ LABORATUVARI -II DENEY FÖYÜ DENEY ADI KÜTLE TRANSFERİ DERSİN ÖĞRETİM ÜYESİ DENEYİ YAPTIRAN ÖĞRETİM ELEMANI
Katlı oranlar kanunu. 2H 2 + O 2 H 2 O Sabit Oran ( 4 g 32 g 36 g. 2 g 16 g 18 g. 1 g 8 g 9 g. 8 g 64 g 72 g. N 2 + 3H 2 2NH 3 Sabit Oran (
 Sabit oranlar kanunu Bir bileşiği oluşturan elementlerin kütleleri arasında sabit bir oran vardır. Bu sabit oranın varlığı ilk defa 799 tarihinde Praust tarafından bulunmuş ve sabit oranlar kanunu şeklinde
Sabit oranlar kanunu Bir bileşiği oluşturan elementlerin kütleleri arasında sabit bir oran vardır. Bu sabit oranın varlığı ilk defa 799 tarihinde Praust tarafından bulunmuş ve sabit oranlar kanunu şeklinde
rasgele değişkeninin olasılık yoğunluk fonksiyonu,
 3.6. Bazı Sürekli Dağılımlar 3.6.1 Normal Dağılım Normal dağılım hem uygulamalı hem de teorik istatistikte kullanılan oldukça önemli bir dağılımdır. Normal dağılımın istatistikte önemli bir yerinin olmasının
3.6. Bazı Sürekli Dağılımlar 3.6.1 Normal Dağılım Normal dağılım hem uygulamalı hem de teorik istatistikte kullanılan oldukça önemli bir dağılımdır. Normal dağılımın istatistikte önemli bir yerinin olmasının
KİMYASAL DENGE. AMAÇ Bu deneyin amacı öğrencilerin reaksiyon denge sabitini,k, deneysel olarak bulmalarıdır.
 KİMYASAL DENGE AMAÇ Bu deneyin amacı öğrencilerin reaksiyon denge sabitini,k, deneysel olarak bulmalarıdır. TEORİ Bir kimyasal tepkimenin yönü bazı reaksiyonlar için tek bazıları için ise çift yönlüdür.
KİMYASAL DENGE AMAÇ Bu deneyin amacı öğrencilerin reaksiyon denge sabitini,k, deneysel olarak bulmalarıdır. TEORİ Bir kimyasal tepkimenin yönü bazı reaksiyonlar için tek bazıları için ise çift yönlüdür.
Aktivitesi Kontrol Edilebilen Fotodinamik Terapi Duyarlaştırıcılarına Doğru
 Aktivitesi Kontrol Edilebilen Fotodinamik Terapi Duyarlaştırıcılarına Doğru Engin U. Akkaya Kimya Bölümü, Bilkent Üniversitesi, 06800 Ankara De Silva nın 1993 yılındaki ufuk açan makalesi yayımlandığından
Aktivitesi Kontrol Edilebilen Fotodinamik Terapi Duyarlaştırıcılarına Doğru Engin U. Akkaya Kimya Bölümü, Bilkent Üniversitesi, 06800 Ankara De Silva nın 1993 yılındaki ufuk açan makalesi yayımlandığından
TOPRAKLARIN KİMYASAL ÖZELLİKLERİ
 TOPRAKLARIN KİMYASAL ÖZELLİKLERİ Toprakların kimyasal özellikleri denince, genel olarak toprak reaksiyonu = toprak asitliği ve toprağın besin maddeleri bakımından karakteristikleri anlaşılmaktadır. İyon
TOPRAKLARIN KİMYASAL ÖZELLİKLERİ Toprakların kimyasal özellikleri denince, genel olarak toprak reaksiyonu = toprak asitliği ve toprağın besin maddeleri bakımından karakteristikleri anlaşılmaktadır. İyon
Raman Spektroskopisi
 Raman Spektroskopisi Çalışma İlkesi: Bir numunenin GB veya yakın-ir monokromatik ışından oluşan güçlü bir lazer kaynağıyla ışınlanmasıyla saçılan ışının belirli bir açıdan ölçümüne dayanır. Moleküllerin
Raman Spektroskopisi Çalışma İlkesi: Bir numunenin GB veya yakın-ir monokromatik ışından oluşan güçlü bir lazer kaynağıyla ışınlanmasıyla saçılan ışının belirli bir açıdan ölçümüne dayanır. Moleküllerin
SCHRÖDİNGER: Elektronun yeri (yörüngesi ve orbitali) birer dalga fonksiyonu olan n, l, m l olarak ifade edilen kuantum sayıları ile belirlenir.
 . ATOMUN KUANTUM MODELİ SCHRÖDİNGER: Elektronun yeri (yörüngesi ve orbitali) birer dalga fonksiyonu olan n, l, m l olarak ifade edilen kuantum sayıları ile belirlenir. Orbital: Elektronların çekirdek etrafında
. ATOMUN KUANTUM MODELİ SCHRÖDİNGER: Elektronun yeri (yörüngesi ve orbitali) birer dalga fonksiyonu olan n, l, m l olarak ifade edilen kuantum sayıları ile belirlenir. Orbital: Elektronların çekirdek etrafında
ÇOKLU DENGELER -1. Prof.Dr.Mustafa DEMİR ÇOKLU DENGE PROBLEMİ ÇÖZÜMÜNDE SİSTEMATİK YAKLAŞIM M.DEMİR 08-ÇOKLU DENGELER-1 1
 ÇOKLU DENGELER -1 ÇOKLU DENGE PROBLEMİ ÇÖZÜMÜNDE SİSTEMATİK YAKLAŞIM Prof.Dr.Mustafa DEMİR M.DEMİR 08-ÇOKLU DENGELER-1 1 Kimyasal tepkimelerin bir çoğu, ortamda birden fazla tür olduğu ve bu türler arasında
ÇOKLU DENGELER -1 ÇOKLU DENGE PROBLEMİ ÇÖZÜMÜNDE SİSTEMATİK YAKLAŞIM Prof.Dr.Mustafa DEMİR M.DEMİR 08-ÇOKLU DENGELER-1 1 Kimyasal tepkimelerin bir çoğu, ortamda birden fazla tür olduğu ve bu türler arasında
TERMODİNAMİĞİN BİRİNCİ YASASI
 İç Enerji Fonksiyonu ve C v Isınma Isısı Kimyasal tepkimelerin olmadığı kapalı sistemlerde kütle yanında molar miktar da sabit kalmaktadır. Madde miktarı n mol olan kapalı bir ideal gaz sistemi düşünelim.
İç Enerji Fonksiyonu ve C v Isınma Isısı Kimyasal tepkimelerin olmadığı kapalı sistemlerde kütle yanında molar miktar da sabit kalmaktadır. Madde miktarı n mol olan kapalı bir ideal gaz sistemi düşünelim.
GIDA İŞLEME VE ANALİZ TEKNİKLERİ I
 GIDA İŞLEME VE ANALİZ TEKNİKLERİ I RAPOR NO: 1 GRUP NO: 3 KONU: Bazı gıdalarda dondurma prosesi ve donma noktası alçalmasının tespiti ÖĞRETMENİN ADI SOYADI: Doç. Dr. Nesimi AKTAŞ ÖĞRENCİNİN ADI SOYADI:
GIDA İŞLEME VE ANALİZ TEKNİKLERİ I RAPOR NO: 1 GRUP NO: 3 KONU: Bazı gıdalarda dondurma prosesi ve donma noktası alçalmasının tespiti ÖĞRETMENİN ADI SOYADI: Doç. Dr. Nesimi AKTAŞ ÖĞRENCİNİN ADI SOYADI:
10. Sınıf Kimya Konuları KİMYANIN TEMEL KANUNLARI VE TEPKİME TÜRLERİ Kimyanın Temel Kanunları Kütlenin korunumu, sabit oranlar ve katlı oranlar
 10. Sınıf Kimya Konuları KİMYANIN TEMEL KANUNLARI VE TEPKİME TÜRLERİ Kimyanın Temel Kanunları Kütlenin korunumu, sabit oranlar ve katlı oranlar kanunları Demir (II) sülfür bileşiğinin elde edilmesi Kimyasal
10. Sınıf Kimya Konuları KİMYANIN TEMEL KANUNLARI VE TEPKİME TÜRLERİ Kimyanın Temel Kanunları Kütlenin korunumu, sabit oranlar ve katlı oranlar kanunları Demir (II) sülfür bileşiğinin elde edilmesi Kimyasal
YRD.DOÇ. DR. CABBAR VEYSEL BAYSAL ELEKTRIK & ELEKTRO NIK Y Ü K. M Ü H.
 EM 420 Yüksek Gerilim Tekniği EŞ MERKEZLİ KÜRESEL ELEKTROT SİSTEMİ YRD.DOÇ. DR. CABBAR VEYSEL BAYSAL ELEKTRIK & ELEKTRO NIK Y Ü K. M Ü H. Not: Tüm slaytlar, listelenen ders kaynaklarından alıntı yapılarak
EM 420 Yüksek Gerilim Tekniği EŞ MERKEZLİ KÜRESEL ELEKTROT SİSTEMİ YRD.DOÇ. DR. CABBAR VEYSEL BAYSAL ELEKTRIK & ELEKTRO NIK Y Ü K. M Ü H. Not: Tüm slaytlar, listelenen ders kaynaklarından alıntı yapılarak
5.111 Ders Özeti #21 21.1
 5.111 Ders Özeti #21 21.1 AsitBaz Dengesi Bölüm 10 Okunsun Konular: Asit ve Bazların Sınıflandırılması, Suyun Öziyonlaşması, ph Fonksiyonları, Asit ve Baz Kuvvetleri, Zayıf Asit İçeren Dengeler. Asit ve
5.111 Ders Özeti #21 21.1 AsitBaz Dengesi Bölüm 10 Okunsun Konular: Asit ve Bazların Sınıflandırılması, Suyun Öziyonlaşması, ph Fonksiyonları, Asit ve Baz Kuvvetleri, Zayıf Asit İçeren Dengeler. Asit ve
KİMYASAL BAĞLAR İYONİK BAĞ KOVALANT BAĞ POLAR KOVALENT BAĞ APOLAR KOVALENT BAĞ
 KİMYASAL BAĞLAR İYONİK BAĞ KOVALANT BAĞ POLAR KOVALENT BAĞ APOLAR KOVALENT BAĞ Atomlar bağ yaparken, elektron dizilişlerini soy gazlara benzetmeye çalışırlar. Bir atomun yapabileceği bağ sayısı, sahip
KİMYASAL BAĞLAR İYONİK BAĞ KOVALANT BAĞ POLAR KOVALENT BAĞ APOLAR KOVALENT BAĞ Atomlar bağ yaparken, elektron dizilişlerini soy gazlara benzetmeye çalışırlar. Bir atomun yapabileceği bağ sayısı, sahip
Elementlerin büyük bir kısmı tabiatta saf hâlde bulunmaz. Çoğunlukla başka elementlerle bileşikler oluşturmuş şekilde bulunurlar.
 Elementlerin büyük bir kısmı tabiatta saf hâlde bulunmaz. Çoğunlukla başka elementlerle bileşikler oluşturmuş şekilde bulunurlar. Elementlerin bileşik oluşturma istekleri onların kararlı yapıya ulaşma
Elementlerin büyük bir kısmı tabiatta saf hâlde bulunmaz. Çoğunlukla başka elementlerle bileşikler oluşturmuş şekilde bulunurlar. Elementlerin bileşik oluşturma istekleri onların kararlı yapıya ulaşma
5.111 Ders Özeti #23 23.1
 5.111 Ders Özeti #23 23.1 Asit/Baz Dengeleri (Devam) Konu: Titrasyon Cuma günü ders notlarından Asidik tampon etkisi: Zayıf asit, HA, protonlarını ortamdaki kuvvetli bazın OH iyonlarına aktarır. Zayıf
5.111 Ders Özeti #23 23.1 Asit/Baz Dengeleri (Devam) Konu: Titrasyon Cuma günü ders notlarından Asidik tampon etkisi: Zayıf asit, HA, protonlarını ortamdaki kuvvetli bazın OH iyonlarına aktarır. Zayıf
Bir atomdan diğer bir atoma elektron aktarılmasıyla
 kimyasal bağlar Kimyasal bağ, moleküllerde atomları bir arada tutan kuvvettir. Atomlar daha düşük enerjili duruma erişmek için bir araya gelirler. Bir bağın oluşabilmesi için atomlar tek başına bulundukları
kimyasal bağlar Kimyasal bağ, moleküllerde atomları bir arada tutan kuvvettir. Atomlar daha düşük enerjili duruma erişmek için bir araya gelirler. Bir bağın oluşabilmesi için atomlar tek başına bulundukları
1. BÖLÜM : ANALİTİK KİMYANIN TEMEL KAVRAMLARI
 ANALİTİK KİMYA DERS NOTLARI Yrd.Doç.Dr.. Hüseyin ÇELİKKAN 1. BÖLÜM : ANALİTİK KİMYANIN TEMEL KAVRAMLARI Analitik kimya, bilimin her alanında faydalanılan, maddenin özellikleri hakkında bilgi veren yöntemlerin
ANALİTİK KİMYA DERS NOTLARI Yrd.Doç.Dr.. Hüseyin ÇELİKKAN 1. BÖLÜM : ANALİTİK KİMYANIN TEMEL KAVRAMLARI Analitik kimya, bilimin her alanında faydalanılan, maddenin özellikleri hakkında bilgi veren yöntemlerin
İletkenlik, maddenin elektrik akımını iletebilmesinin ölçüsüdür.
 İletkenlik, maddenin elektrik akımını iletebilmesinin ölçüsüdür. C= 1/R dir. Yani direncin tersidir. Birimi S.m -1 dir. (Siemens birimi Alman bilim insanı ve mucit Werner von Siemens e ithafen verilmiştir)
İletkenlik, maddenin elektrik akımını iletebilmesinin ölçüsüdür. C= 1/R dir. Yani direncin tersidir. Birimi S.m -1 dir. (Siemens birimi Alman bilim insanı ve mucit Werner von Siemens e ithafen verilmiştir)
ÇÖZÜNÜRLÜK (ORTAK İYON ETKİSİ ) (Çöktürme ile Ayırma)
 ÇÖZÜNÜRLÜ (ORTA İYON ETİSİ ) (Çöktürme ile Ayırma) Prof. Dr. ustafa DEİR 08ORTA İYON ETİSİ07B ÇÖZÜNÜRLÜ ÇÖTÜRE İLE AYIRA 1 ORTA İYON ETİSİ 08ORTA İYON ETİSİ07B ÇÖZÜNÜRLÜ ÇÖTÜRE İLE AYIRA ORTA İYON ETİSİ
ÇÖZÜNÜRLÜ (ORTA İYON ETİSİ ) (Çöktürme ile Ayırma) Prof. Dr. ustafa DEİR 08ORTA İYON ETİSİ07B ÇÖZÜNÜRLÜ ÇÖTÜRE İLE AYIRA 1 ORTA İYON ETİSİ 08ORTA İYON ETİSİ07B ÇÖZÜNÜRLÜ ÇÖTÜRE İLE AYIRA ORTA İYON ETİSİ
Paslanmaz Çelik Gövde. Yalıtım Sargısı. Katalizör Yüzey Tabakası. Egzoz Emisyonları: Su Karbondioksit Azot
 Paslanmaz Çelik Gövde Yalıtım Sargısı Egzoz Emisyonları: Su Karbondioksit Azot Katalizör Yüzey Tabakası Egzoz Gazları: Hidrokarbonlar Karbon Monoksit Azot Oksitleri Bu bölüme kadar, açıkça ifade edilmese
Paslanmaz Çelik Gövde Yalıtım Sargısı Egzoz Emisyonları: Su Karbondioksit Azot Katalizör Yüzey Tabakası Egzoz Gazları: Hidrokarbonlar Karbon Monoksit Azot Oksitleri Bu bölüme kadar, açıkça ifade edilmese
DENEY 8 POLİPROTİK ASİTLER: ph TİTRASYON EĞRİLERİ KULLANILARAK pka DEĞERLERİNİN BELİRLENMESİ
 DENEY 8 POLİPROTİK ASİTLER: ph TİTRASYON EĞRİLERİ KULLANILARAK pka DEĞERLERİNİN BELİRLENMESİ 8.1. AMAÇ Bir asidin titrasyonunu yapmak. Poliprotik bir asidin gücünü belirlemek. Bir asidin pka değerlerini
DENEY 8 POLİPROTİK ASİTLER: ph TİTRASYON EĞRİLERİ KULLANILARAK pka DEĞERLERİNİN BELİRLENMESİ 8.1. AMAÇ Bir asidin titrasyonunu yapmak. Poliprotik bir asidin gücünü belirlemek. Bir asidin pka değerlerini
ANADOLU ÜNİVERSİTESİ ECZACILIK FAKÜLTESİ FARMASÖTİK KİMYA ANABİLİMDALI GENEL KİMYA II DERS NOTLARI (ORGANİK KİMYAYA GİRİŞ)
 ANADOLU ÜNİVERSİTESİ ECZACILIK FAKÜLTESİ FARMASÖTİK KİMYA ANABİLİMDALI GENEL KİMYA II DERS NOTLARI (ORGANİK KİMYAYA GİRİŞ) Hazırlayan: Doç. Dr. Yusuf ÖZKAY 1. Organik bileşik kavramının tarihsel gelişimi
ANADOLU ÜNİVERSİTESİ ECZACILIK FAKÜLTESİ FARMASÖTİK KİMYA ANABİLİMDALI GENEL KİMYA II DERS NOTLARI (ORGANİK KİMYAYA GİRİŞ) Hazırlayan: Doç. Dr. Yusuf ÖZKAY 1. Organik bileşik kavramının tarihsel gelişimi
KOROZYON. Teorik Bilgi
 KOROZYON Korozyon, metalik malzemelerin içinde bulundukları ortamla reaksiyona girmeleri sonucu, dışardan enerji vermeye gerek olmadan, doğal olarak meydan gelen olaydır. Metallerin büyük bir kısmı su
KOROZYON Korozyon, metalik malzemelerin içinde bulundukları ortamla reaksiyona girmeleri sonucu, dışardan enerji vermeye gerek olmadan, doğal olarak meydan gelen olaydır. Metallerin büyük bir kısmı su
İTKİLİ MOTORLU UÇAĞIN YATAY UÇUŞ HIZI
 İTKİLİ MOTORLU UÇAĞIN YATAY UÇUŞ HIZI Mustafa Cavcar Anadolu Üniversitesi Havacılık ve Uzay Bilimleri Fakültesi 26470 Eskişehir Yatay uçuş sabit uçuş irtifaında yeryüzüne paralel olarak yapılan uçuştur.
İTKİLİ MOTORLU UÇAĞIN YATAY UÇUŞ HIZI Mustafa Cavcar Anadolu Üniversitesi Havacılık ve Uzay Bilimleri Fakültesi 26470 Eskişehir Yatay uçuş sabit uçuş irtifaında yeryüzüne paralel olarak yapılan uçuştur.
Vakum Teknolojisi * Prof. Dr. Ergun GÜLTEKİN. İstanbul Üniversitesi Fen Fakültesi
 Vakum Teknolojisi * Prof. Dr. Ergun GÜLTEKİN İstanbul Üniversitesi Fen Fakültesi Giriş Bilimsel amaçla veya teknolojide gerekli alanlarda kullanılmak üzere, kapalı bir hacim içindeki gaz moleküllerinin
Vakum Teknolojisi * Prof. Dr. Ergun GÜLTEKİN İstanbul Üniversitesi Fen Fakültesi Giriş Bilimsel amaçla veya teknolojide gerekli alanlarda kullanılmak üzere, kapalı bir hacim içindeki gaz moleküllerinin
2+ 2- Mg SO 4. (NH 4 ) 2 SO 4 (amonyum sülfat) bileşiğini katyon ve anyonlara ayıralım.
 KONU: Kimyasal Tepkimeler Dersin Adı Dersin Konusu İYONİK BİLEŞİKLERİN FORMÜLLERİNİN YAZILMASI İyonik bağlı bileşiklerin formüllerini yazmak için atomların yüklerini bilmek gerekir. Bunu da daha önceki
KONU: Kimyasal Tepkimeler Dersin Adı Dersin Konusu İYONİK BİLEŞİKLERİN FORMÜLLERİNİN YAZILMASI İyonik bağlı bileşiklerin formüllerini yazmak için atomların yüklerini bilmek gerekir. Bunu da daha önceki
Şekil 7.1 Bir tankta sıvı birikimi
 6 7. DİFERENSİYEL DENKLEMLERİN SAYISAL ÇÖZÜMLERİ Diferensiyel denklemlerin sayısal integrasyonunda kullanılabilecek bir çok yöntem vardır. Tecrübeler dördüncü mertebe (Runge-Kutta) yönteminin hemen hemen
6 7. DİFERENSİYEL DENKLEMLERİN SAYISAL ÇÖZÜMLERİ Diferensiyel denklemlerin sayısal integrasyonunda kullanılabilecek bir çok yöntem vardır. Tecrübeler dördüncü mertebe (Runge-Kutta) yönteminin hemen hemen
İÇİNDEKİLER TEMEL KAVRAMLAR - 2. 1. Atomlar, Moleküller, İyonlar...36. 1.2. Atomlar...36. 1.2. Moleküller...37. 1.3. İyonlar...37
 vi TEMEL KAVRAMLAR - 2 1. Atomlar, Moleküller, İyonlar...36 1.2. Atomlar...36 1.2. Moleküller...37 1.3. İyonlar...37 2. Kimyasal Türlerin Adlandırılması...38 2.1. İyonların Adlandırılması...38 2.2. İyonik
vi TEMEL KAVRAMLAR - 2 1. Atomlar, Moleküller, İyonlar...36 1.2. Atomlar...36 1.2. Moleküller...37 1.3. İyonlar...37 2. Kimyasal Türlerin Adlandırılması...38 2.1. İyonların Adlandırılması...38 2.2. İyonik
Anabilim Dalı : Fizik Programı : Fizik Mühendisliği
 İSTANBUL TEKNİK ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ SEÇİLMİŞ HEDEF MOLEKÜLLERE DUYARLI POLİMERİK JEL SENTEZİ VE FİZİKSEL PARAMETRELERİN SEÇİCİLİK ÜZERİNE ETKİSİ DOKTORA TEZİ Ali GELİR Anabilim Dalı :
İSTANBUL TEKNİK ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ SEÇİLMİŞ HEDEF MOLEKÜLLERE DUYARLI POLİMERİK JEL SENTEZİ VE FİZİKSEL PARAMETRELERİN SEÇİCİLİK ÜZERİNE ETKİSİ DOKTORA TEZİ Ali GELİR Anabilim Dalı :
ATOM ve YAPISI Maddelerin gözle görülmeyen (bölünmeyen) en parçasına atom denir. Atom kendinden başka hiçbir fiziksel ya da kimyasal metotlarla
 ATOM ve YAPISI Maddelerin gözle görülmeyen (bölünmeyen) en parçasına atom denir. Atom kendinden başka hiçbir fiziksel ya da kimyasal metotlarla kendinden farklı atomlara dönüşemezler. Atomda (+) yüklü
ATOM ve YAPISI Maddelerin gözle görülmeyen (bölünmeyen) en parçasına atom denir. Atom kendinden başka hiçbir fiziksel ya da kimyasal metotlarla kendinden farklı atomlara dönüşemezler. Atomda (+) yüklü
İYONİK ÇEVRENİN ENZİM-ULTRAFİLTRASYON MEMBRAN ARAYÜZEY ETKİLEŞİMLERİNE ETKİSİ
 İYONİK ÇEVRENİN ENZİM-ULTRAFİLTRASYON MEMBRAN ARAYÜZEY ETKİLEŞİMLERİNE ETKİSİ Sema SALGIN *, Serpil TAKAÇ **, H.Tunçer ÖZDAMAR ** * Cumhuriyet Üniversitesi Mühendislik Fakültesi Kimya Mühendisliği Bölümü
İYONİK ÇEVRENİN ENZİM-ULTRAFİLTRASYON MEMBRAN ARAYÜZEY ETKİLEŞİMLERİNE ETKİSİ Sema SALGIN *, Serpil TAKAÇ **, H.Tunçer ÖZDAMAR ** * Cumhuriyet Üniversitesi Mühendislik Fakültesi Kimya Mühendisliği Bölümü
