KISA ÜRÜN BİLGİSİ. Etkin madde: Her bir kullanıma hazır enjektör 5 ml çözeltide etkin madde olarak 250 mg fulvestrant içerir.
|
|
|
- Elmas Öncel
- 8 yıl önce
- İzleme sayısı:
Transkript
1 1. BEŞERİ TIBBİ ÜRÜNÜN ADI KISA ÜRÜN BİLGİSİ FASLODEX 250 mg/5 ml enjeksiyonluk çözelti 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Her bir kullanıma hazır enjektör 5 ml çözeltide etkin madde olarak 250 mg fulvestrant içerir. Yardımcı maddeler: Etanol % mg/ml Yardımcı maddeler için 6.1 e bakınız. 3. FARMASÖTİK FORM Enjeksiyonluk çözelti Berrak, renksiz ila sarı renkte, viskoz çözelti 4. KLİNİK ÖZELLİKLER 4.1 Terapötik endikasyonlar FASLODEX, doğal ya da yapay postmenopozal kadınlardaki lokal olarak ilerlemiş veya metastaz yapmış ve endokrin tedaviden sonra ilerlemeye devam etmiş hormon reseptör pozitif meme kanserinin tedavisinde endikedir Pozoloji ve uygulama şekli Pozoloji/uygulama sıklığı ve süresi: Erişkin yaştaki kadınlar (yaşlılar dahil): Önerilen doz ayda bir kez iki 5 ml lik enjeksiyon olarak, her iki kalçaya intramuskular enjeksiyonla uygulanan toplam 500 mg ve bir defaya mahsus olarak ilk dozdan iki hafta sonra verilen ilave bir 500 mg dozdur. Enjeksiyonun yavaş uygulanması önerilir (1-2 dakika/enjeksiyon). Uygulama şekli: FASLODEX, ardışık iki 5 ml enjeksiyon şeklinde gluteal bölgeye intramusküler enjeksiyonla yavaşça (1-2 dk/enjeksiyon) uygulanır. Detaylı kullanma talimatı için bkz Özel popülasyonlara ilişkin ek bilgiler Böbrek yetmezliği : Hafif ile orta derecede böbrek yetmezliği (kreatinin klirensi 30 ml/dakika) olan hastalarda doz ayarlanması önerilmez. Şiddetli böbrek yetmezliği (kreatinin klirensi <30 ml/dakika) olan hastalardaki etkinlik ve güvenlilik değerlendirilmemiştir bu nedenle bu hastalarda dikkatle kullanılmalıdır (bkz. Bölüm 4.4). 1/15
2 Karaciğer yetmezliği: Hafif ile orta derecede karaciğer yetmezliği olan hastalarda doz ayarlanması önerilmez. Ancak fulvestrant maruziyeti artabileceğinden, Faslodex bu hastalarda dikkatle kullanılmalıdır. Ciddi derecede karaciğer yetmezliği olan hastalardaki etkinlik ve güvenlilik değerlendirilmemiştir (bkz. Bölüm 4.3,4.4 ve 5.2). Pediatrik popülasyon : 0-18 yaş arası çocuk ve adolesanlarda etkinlik ve güvenlilik değerlendirilmemiştir. Geriyatrik popülasyon: Bu yaş grubu hastalarda normal erişkin doz tavsiyelerine uyulur Kontrendikasyonlar FASLODEX, aşağıdaki durumlarda kontrendikedir: Fulvestrant veya yardımcı maddelerden herhangi birine karşı aşırı duyarlılığı olduğu bilinen hastalarda, Gebelikte ve emzirme döneminde (Bkz. Bölüm 4.6), İleri derecede karaciğer yetmezliğinde (Bkz. Bölüm 4.4 ve Bölüm 5.2) Özel kullanım uyarıları ve önlemleri Fulvestrant, öncelikle karaciğerde metabolize edilir Karaciğer yetmezliği olan hastalarda, klirensin azalması söz konusu olduğundan FASLODEX dikkatli kullanılmalıdır (Bkz. Bölüm 4.2, Bölüm 4.3 ve Bölüm 5.2). FASLODEX ileri derecede böbrek yetmezliği olan hastalarda dikkatle kullanılmalıdır (kreatinin klerensi dakikada 30 ml den düşük). İntramüsküler uygulama yolu nedeniyle FASLODEX, kanamalı diyatezi veya trombositopenisi olan ya da antikoagülan tedavi altındaki hastalar tedavi edilirken dikkatle kullanılmalıdır. Meme kanseri ilerlemiş kadınlarda tromboembolik vakalar yaygın olarak gözlenmekte olup, bu vakalar FASLODEX ile yapılan klinik çalışmalarda da gözlenmiştir (Bkz. Bölüm 4.8). Bu durum risk taşıyan hastalara FASLODEX i reçete ederken göz önünde bulundurulmalıdır. Fulvestrantın kemikler üzerine etkileri hakkında uzun süreli veri mevcut değildir. Fulvestrantın etki mekanizması nedeniyle potansiyel bir osteoporoz riski söz konusudur. FASLODEX te hacmin %10 u kadar etanol (alkol) vardır. (örneğin, her dozda 1000 mg a kadar, her dozda 20 ml biraya eşdeğer, her dozda 8 ml şaraba eşdeğer gibi) Alkol bağımlılığı olanlar için zararlı olabilir. Hamile veya emziren kadınlar, çocuklar ve karaciğer hastalığı ya da epilepsi gibi yüksek risk grubundaki hastalar için dikkate alınmalıdır Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri Fulvestrantın midazolamla (CYP3A4 substratı) birlikte kullanıldığı klinik bir etkileşim çalışması fulvestrantın CYP3A4 ü inhibe etmediğini göstermiştir. Rifampisin (CYP3A4 indükleyicisi) ve ketokonazol (CYP3A4 inhibitörü) ile yapılan klinik etkileşim çalışmaları fulvestrant klerensinde klinik olarak anlamlı bir değişikliği işaret etmemiştir. Bu nedenle 2/11
3 fulvestrant ile CYP 3A4 inhibitörlerini veya indükleyicilerini eşzamanlı kullanan hastalarda doz ayarlaması gerekli değildir Gebelik ve laktasyon Genel tavsiye Gebelik Kategorisi: D Çocuk doğurma potansiyeli bulunan kadınlar/doğum kontrolü (Kontrasepsiyon) FASLODEX in gebelik ve/veya fetüs/yenidoğan üzerinde zararlı farmakolojik etkileri bulunmaktadır. Çocuk doğurma potansiyeli bulunan kadınlara FASLODEX ile tedavi görürken etkili bir doğum kontrol yöntemi kullanmaları tavsiye edilmelidir. Gebelik dönemi FASLODEX gebelik döneminde kontrendikedir (Bkz. Bölüm 4.3). Fulvestrantın sıçan ve tavşanda tek doz intramüsküler uygulama sonrasında plasentayı geçtiği gösterilmiştir. Hasta, FASLODEX kullanırken gebelik oluşması durumunda, fetüs üzerindeki potansiyel zarar ve potansiyel düşük riski hakkında bilgilendirilmelidir. Postmenopozal kadınlar hariç gebelik döneminde kullanılmamalıdır. Laktasyon dönemi Fulvestrantın insan sütüyle atılıp atılmadığı bilinmemektedir. Fulvestrant emzirme dönemindeki sıçanlarda sütle atılmıştır. Emzirilen bebeklerde fulvestranttan kaynaklanabilecek ciddi istenmeyen reaksiyon potansiyeli dikkate alındığında FASLODEX emzirme döneminde kontrendikedir (Bkz. Bölüm 4.3). Üreme yeteneği/fertilite Hayvanlar üzerinde yapılan çalışmalar, fetal anomali ve ölüm insidansında artışı da içeren üreme toksisitesini göstermiştir (Bkz. Bölüm 5.3) Araç ve makine kullanımı üzerindeki etkiler FASLODEX in, hastaların araç veya makine kullanma yeteneği üzerinde etkisi yoktur veya etki ihmal edilebilir düzeydedir. Ancak, FASLODEX tedavisi sırasında yaygın olarak asteni bildirildiğinden, araç veya makine kullanırken bu istenmeyen reaksiyonun görüldüğü hastalara dikkatli olmaları önerilmelidir İstenmeyen etkiler Bu bölüm klinik çalışmalar, pazarlama sonrası çalışmalar veya spontan raporlardan alınan tüm istenmeyen reaksiyonlara dayalı bilgiler sunmaktadır. Asteni, bulantı ve enjeksiyon bölgesi reaksiyonları ve hepatik enzimlerde (ALT, AST, ALP) artış en sık bildirilen istenmeyen ilaç reaksiyonlarıdır. Aşağıda sıklıkları verilen istenmeyen ilaç reaksiyonları, Faslodex 500 mg ile Faslodex 250 mg karşılaştırma çalışmaları olan CONFIRM, FINDER 1, FINDER 2 ve NEWEST çalışmalarında görülmüştür. Aşağıda listelenen istenmeyen ilaç reaksiyonları sıklıklarına ve Sistem Organ Sınıfına (SOC) göre sınıflandırılmıştır. 3/11
4 Şu terimler ve sıklık dereceleri kullanılmıştır: Çok yaygın ( 1/10); yaygın ( 1/100 ila <1/10); yaygın olmayan ( 1/1000 ila <1/100); seyrek ( 1/ ila <1/1000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Her bir sıklık grubu içinde istenmeyen ilaç reaksiyonları azalan ciddiyet sırasıyla listelenmiştir. Enfeksiyonlar ve enfestasyonlar Yaygın: İdrar yolu enfeksiyonları Bağışıklık sistemi hastalıkları Yaygın: Aşırı duyarlılık reaksiyonları Metabolizma ve beslenme hastalıkları Yaygın: Anoreksi a Sinir sistemi hastalıkları Yaygın: Baş ağrısı Vasküler hastalıklar Yaygın: Venöz tromboembolizm a, sıcak basması Gastrointestinal hastalıklar Çok yaygın : Bulantı Yaygın: Kusma, diyare Hepato-bilier hastalıklar Çok yaygın: Karaciğer enzimlerinde artış (ALT,AST,ALP) a Yaygın: Bilirubin seviyelerinde artış a Yaygın olmayan: Karaciğer yetmezliği c, hepatit c, gamma-gt de yükselme Deri ve deri altı dokusu hastalıkları Yaygın: Deri döküntüsü Kas-iskelet bozuklukları, bağ dokusu ve kemik hastalıkları Yaygın: Sırt ağrısı a Üreme sistemi ve meme hastalıkları Yaygın olmayan: Vajinal moniliyazis, lökore, vajinal hemoraji Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar Çok yaygın: Asteni a,enjeksiyon bölgesi ağrısı b Yaygın olmayan: Enjeksiyon bölgesinde kanama ve şişlik a Altta yatan hastalıktan dolayı Faslodex in kesin katkısının ölçülemediği durumlardaki istenmeyen ilaç reaksiyonlarını içerir. b Enjeksiyon bölgesi reaksiyonları, enjeksiyon bölgesinde kanama ve şişliği kapsamaz. c Bu durum majör klinik çalışmalarda gözlenmemiştir (CONFIRM, FINDER 1, FINDER 2, NEWEST). Sıklık, tahmini nokta için %95 güven aralığının üst limiti kullanılarak hesaplanmıştır. Bu 3/563 olarak (563 majör klinik çalışmalardaki hasta sayısıdır) hesaplanmaktadır ve yaygın olmayan sıklık derecesine denk gelmektedir. 4/11
5 Pazarlama sonrası deneyimler FASLODEX in, ilaçla ilgili olduğu bildirilen ve nadiren gözlenen (<%1) diğer istenmeyen reaksiyonlar arasında tromboembolik fenomen, miyalji, vertigo, lökopeni ve anjiyoödem ile ürtikerin dahil olduğu aşırı duyarlılık reaksiyonları yer almaktadır. Nadiren (<%1) ve özellikle kullanmakta olduğu hormon tedavisinden FASLODEX tedavisine geçiş yapan hastalarda, ilk 6 hafta içinde vajinal kanama bildirilmiştir. Kanamanın sürmesi halinde, ayrıntılı değerlendirme yapılması düşünülmelidir Doz aşımı ve tedavisi İnsanlarda doz aşımı deneyimi yoktur. Hayvanlar üzerinde yapılan çalışmalar, yüksek fulvestrant dozlarına, anti-östrojenik aktiviteyle doğrudan ya da dolaylı olarak ilişkili etkiler dışında başka bir etki eşlik etmediği izlenimini vermektedir (Bkz. Bölüm 5.3). Doz aşımının meydana gelmesi durumunda semptomatik destekleyici tedavi önerilmektedir. 5. FARMAKOLOJİK ÖZELLİKLER 5.1. Farmakodinamik özellikler Farmakoterapötik grup: Endokrin terapi, Anti-östrojenler ATC kodu: L02BA03 Etki mekanizması: Fulvestrant, östradiol ile benzer bir afiniteye sahip kompetitif bir östrojen reseptör (ÖR) antagonistidir. Fulvestrant, östrojenlerin tropik etkisini, kendisi kısmi agonist (östrojenbenzeri) aktivite göstermeksizin bloke eder. Etki mekanizması östrojen reseptör proteininin down-regülasyonuna yol açmak şeklindedir. Primer meme kanserli postmenopozal kadınlarda yapılan klinik çalışmalar, fulvestrantın ÖR - pozitif tümörlerde plaseboya kıyasla ÖR proteinini anlamlı bir şekilde azalttığını göstermiştir. Ayrıca, intrinsik östrojen agonist ile etkilerinin olmamasından kaynaklanan progesteron reseptörü ekspresyonunda anlamlı bir azalma olmuştur. Ayrıca postmenapozal neoadjuvan tedavide tümörlerde fulvestrant 500 mg ın ÖR proteinini ve proliferasyon belirleyici Ki67 yi 250 mg dan çok daha iyi derecede azalttığını göstermiştir. İlerlemiş meme kanseri üzerindeki klinik güvenlilik ve etkililik: İlerlemiş meme kanseri olan ve hastalığın, adjuvan tedavi sırasında veya sonrasında nüksettiği ya da ilerlemiş meme kanseri nedeniyle uygulanan endokrin tedavinin ardından ilerlediği toplam 736 postmenapozal kadın üzerinde yapılan bir Faz III klinik çalışması tamamlanmıştır. Çalışma, hastalığı nüksetmiş veya anti-estrojen tedavi (AE altgrup) ile ilerlemiş 423 hasta ve hastalığı nüksetmiş veya aromataz inhibitör terapi ile (AI altgrup) ilerlemiş 313 hasta ile yapılmıştır. Bu çalışmada FASLODEX 500mg(n=362) ile FASLODEX 250 mg(n=374) ın etkinlik ve güvenliliği karşılaştırılmıştır. Primer sonlanım nokta progresyonsuz sağ kalım, ikincil etki noktalar objektif yanıt oranı (OYO) dahil, klinik yarar oranı (KYO) ve genel sağkalımdır (GS). Etki sonuçları için CONFIRM çalışması tablo 2 de özetlenmiştir. 5/11
6 Tablo 2 : CONFIRM çalışması sonuçları Değişken Tip : çalışma Faslodex karşılaştırması 500 mg (N=362) Faslodex 250 mg (N=374) Gruplar arası karşılaştırma (Faslodex 500mg / Faslodex 250mg) Risk oranı %95 GA p-değeri Progresyonsuz sağkalım Kaplan-Meier risk oranı Tüm hastalar , AE altgrup (n=423) , AI alt grup (n=313) a , GS Kaplan-Meier risk oranı Tüm hastalar , AE altgrup (n=423) , AI alt grup (n=313) a , Değişken Tip : çalışma karşılaştırması Faslodex 500 mg (N=362) Faslodex 250 mg (N=374) Gruplar arası karşılaştırma (Faslodex 500mg / Faslodex 250mg) Fark % %95 GA OYO b % hasta OY ile; % fark Tüm hastalar , 6.3 AE altgrup (n=423) , 9.3 AI alt grup (n=313) a , 9.8 KYO c % hasta KY ile Tüm hastalar , 13.3 AE altgrup (n=423) , 16.6 AI alt grup (n=313) a , 15.2 a b c Faslodex hastalığı nüksetmiş veya anti-estrojen tedavi ile ilerlemiş hastalarda endikedir. AI alt grup sonuçlarının etkisi bulunmamaktadır. OYO başlangıçta uygun olan hastaya göre hesaplanmıştır.(başlangıçta ölçülebilir düzeyde olan Faslodex 500 mg için 240, Faslodex 250 mg için 261 hasta) 24 hafta > en iyi yanıtı veren hastalar ile hesaplanmıştır. GA : Güven aralığı; AE : anti-estrogen ; AI : aromataz inhibitörü; GS : Genel sağkalım; OYO :Objektif yanıt oranı ; KYO : Klinik yanıt oranı İlerlemiş meme kanseri olan ve hastalığın, adjuvan endokrin tedavi sırasında veya sonrasında nüksettiği ya da ilerlemiş meme kanseri nedeniyle uygulanan endokrin tedavinin ardından ilerlediği toplam 851 postmenopozal kadın üzerinde yapılan iki Faz III klinik çalışması tamamlanmıştır. 6/11
7 Çalışma popülasyonunun %77 si östrojen reseptörü pozitif meme kanseridir. Bu çalışmalarda ayda bir uygulanan 250 mg fulvestrantın güvenlilik ve etkililiği, günlük 1 mg uygulanan anastrozol (aromataz inhibitörü) ile karşılaştırılmıştır. Genel olarak ayda bir 250 mg dozda uygulanan fulvestrant, hastalık ilerleyinceye kadar geçen süre, objektif yanıt ve ölüme kadar geçen süre açısından en az anastrozol kadar etkili olmuştur. İki tedavi grubu arasında bu sonlanım noktalarının herhangi biri açısından istatistiksel olarak anlamlı bir farklılık tespit edilmemiştir. Primer sonlanım noktası hastalığın ilerlemesine kadar geçen süredir. Her iki çalışmadan birleştirilmiş analizler, anastrozol alan hastaların %85 ine kıyasla fulvestrant alan hastaların %83 ünde ilerleme meydana geldiğini göstermiştir. Hastalığın ilerlemesine kadar geçen süre açısından fulvestrantın anastrozole oranla risk oranı 0.95 tir (%95 GA 0.82 ila 1.10). Objektif yanıt oranı %16.5 olan anastrozole oranla fulvestrant için %19.2 dir. Ölüme kadar geçen medyan süre fulvestrant ile tedavi edilen hastalar için 27.4 ay ve anastrozol ile tedavi edilen hastalar için 27.6 aydır. Ölüme kadar geçen süre açısından fulvestrantın anastrozole oranla risk oranı 1.01 dir (%95 GA 0.86 ila 1.19). Postmenopozal endometrium üzerindeki etkiler: Klinik öncesi veriler fulvestrantın, postmenopozal endometrium üzerinde uyarıcı etkiye sahip olmadığı izlenimini uyandırmaktadır (Bkz. Bölüm 5.3). Sağlıklı postmenopozal gönüllüler üzerinde yapılan iki haftalık bir çalışma, günde 20 mikrogram etinilöstradiol ile tedavi edilen gönüllülerin, 250 mg fulvestrant ile ön tedavilerinin yapılmasının, postmenopozal endometrium üzerindeki uyarıcı etkiyi, endometrium kalınlığının ultrason ile ölçüm ile değerlendirmesinde, plasebo ile ön tedaviye kıyasla anlamlı bir şekilde azalttığını göstermiştir. FASLODEX 500 mg veya 250 mg ile tedavi edilen meme kanseri hastalarında 16 haftaya kadar neoadjuvan tedavinin endometriyal kalınlıkta belirgin değişim ile sonuçlanmaması, agonist etki olmadığını belirtir. Çalışılan meme kanseri hastalarında istenmeyen endometriyal etkilere dair bir kanıt yoktur. Benign jinekolojik hastalığı olan premenopozal hastalarla yapılan iki kısa süreli çalışmada (1 hafta ve 12 hafta) fulvestrant ve plasebo grupları arasında endometriyal kalınlıkta ultrason ölçümü ile anlamlı farklılıklar saptanmamıştır. Kemik üzerindeki etkiler: FASLODEX in kemik üzerine etkilerine dair uzun süreli yapılmış tedavi sonucu bulunmamaktadır. FASLODEX 500 mg veya 250 mg ile tedavi edilen meme kanseri hastalarında 16 haftaya kadar neoadjuvan tedavi, serum kemik döngüsü işaretleyicilerinde klinik anlamda belirgin değişimler ile sonuçlanmıştır. Çalışılan meme kanseri hastalarında istenmeyen kemik etkilerine dair bir kanıt yoktur Farmakokinetik özellikler Genel özellikler Emilim: FASLODEX in uzun etkili intramüsküler enjeksiyonunu takiben, fulvestrant yavaşça absorbe olur ve doruk plazma konsantrasyonlarına (C maks ) yaklaşık 5 gün sonra erişilir. Faslodex 500 mg uygulanması, doz verilmesinden 1 ay içerisinde kararlı durum veya ona yakın, maruziyet düzeylerine erişir (sırasıyla ortalama çapraz validasyon [CV]): EAA 475 (33.4%) ng.gün/ml, C maks 25.1 (35.1%) ng/ml, C min 16.3 (25.9%) ng/ml]. Kararlı durumda fulvestrant plazma 7/11
8 konsantrasyonları doruk ve çukur konsantrasyonlar arasında yaklaşık 3 kat farkla nispeten dar bir aralıkta korunur. Dağılım: Fulvestrant vücutta geniş kapsamlı ve hızla dağılır. Kararlı durumdaki sanal dağılım hacminin (Vd ss ) yüksek olması (yaklaşık 3 ila 5 L/kg), bu bileşiğin dağılımının büyük ölçüde ekstravasküler olduğu izlenimini vermektedir. Fulvestrantın plazma proteinlerine bağlanma oranı yüksektir (%99). Çok düşük yoğunluklu lipoprotein (VLDL), düşük yoğunluklu (LDL) ve yüksek yoğunluklu lipoprotein (HDL) fraksiyonları fulvestrantın bağlandığı başlıca proteinlerdir. Proteinlere kompetitif olarak bağlanmayla ilgili herhangi bir etkileşim çalışması yürütülmemiştir. Cinsiyet hormonu bağlayan globülinin rolü belirlenmemiştir. Biyotransformasyon: Fulvestrantın metabolizması tam anlamıyla değerlendirilmemiştir, ancak endojen steroidlerinkine benzer birkaç olası biyotransformasyon yolunu kapsamaktadır (17-keton, sulfon, 3-sulfat, 3- ve 17-glukuronat metabolitleri dahil) Tanımlanmış olan metabolitleri, antiöstrojenik olarak ya daha az aktiftir veya fulvestranta benzeyen aktivite göstermiştir. İnsan karaciğer preparatlarında ve rekombinan insan enzimleriyle yapılan çalışmalar CYP3A4 ün, fulvestrant oksidasyonunda rol alan tek sitokrom P450 izoformu olduğunu göstermiştir ama sitokrom P450 enzim sisteminin kullanılmadığı metabolik yollar, in vivo daha baskın gözükmektedir. In vitro veriler fulvestrantın CYP450 izoenzimlerini inhibe etmediği yönündedir. Eliminasyon: Fulvestrant başlıca metabolize formda elimine edilir. Majör atılım yolu feçes olup, %1 den azı idrarla atılmaktadır. Fulvestrant 11 ± 1.7 ml/dak/kg değerinde yüksek bir klerense sahip olup, bu durum yüksek hepatik atılım oranına işaret etmektedir. İntramüsküler uygulamadan sonraki terminal yarılanma ömrü (t 1/2 ) absorpsiyon hızı ile yönetilir ve 50 gün olarak tahmin edilmektedir. Doğrusallık/Doğrusal olmayan durum: İntramüsküler uygulama sonrası, 50 mg ila 250 mg doz aralığında maruziyet yaklaşık olarak doz ile orantılıdır. Hastalardaki karakteristik özellikler Faz III çalışmalardan elde edilen verilere ilişkin bir popülasyon farmakokinetiği analizinde fulvestrantın farmakokinetik profilinde yaş (33 ila 89 yıl aralığı), vücut ağırlığı ( kg) veya ırk açısından herhangi bir farklılık tespit edilmemiştir. Böbrek yetmezliği: Hafif ile orta derecede böbrek fonksiyon yetmezliği, fulvestrantın farmakokinetiğini klinik olarak anlamlı derecede etkilememiştir. Karaciğer yetmezliği: Fulvestrantın farmakokinetiği hafif ila orta derecede karaciğer yetmezliği olan (Child-Pugh sınıf A ve B) gönüllülerde yürütülen bir tek-doz klinik çalışmasında değerlendirilmiştir. Yüksek doz olarak daha kısa süreli intramüsküler enjeksiyon formülasyonu kullanılmıştır. Sağlıklı gönüllülerle kıyaslandığında karaciğer yetmezliği olan gönüllülerin EAA larında yaklaşık 2.5 kat artış olmuştur. FASLODEX uygulanan hastalarda, maruziyette bu boyuttaki bir artışın iyi tolere edilmesi beklenmektedir. İleri derecede karaciğer yetmezliği (Child-Pugh sınıf C) olan gönüllüler değerlendirilmemiştir. 8/11
9 5.3. Klinik öncesi güvenlilik verileri Fulvestrantın akut toksisitesi düşüktür. FASLODEX ve diğer fulvestrant formülasyonları, hayvan türleri üzerinde yapılan çalışmalarda iyi tolere edilmiştir. Enjeksiyon bölgesinde miyozit ve granülomatomu dahil lokal reaksiyonlar taşıyıcıya bağlanmış; ancak tavşanlarda miyozitin şiddeti, kontrol olarak uygulanan serum fizyolojiğe kıyasla fulvestrant ile artmıştır. Sıçanlarda ve köpeklerde fulvestrantın çok dozlu intramüsküler uygulamaları ile yapılan toksisite çalışmalarında özellikle dişi üreme sisteminde; ancak aynı zamanda her iki cinsiyetin hormonlara duyarlı diğer organlarında görülen etkilerin çoğundan, fulvestrantın anti-östrojenik aktivitesi sorumlu bulunmuştur. Kronik (12 ay) dozlama sonrası bazı köpeklerde farklı dokularında artirit görülmüştür. Köpekler üzerinde yapılan çalışmalarda oral ve intravenöz uygulamayı takiben kardiyovasküler sistem üzerinde etkiler (EKG de S-T segmentinin hafifçe yükselmesi [oral] ve bir köpekte sinüs arresti [intravenöz]) görülmüştür. Bunlar hastalardakinden daha yüksek (C maks >15), maruziyet düzeylerinde meydana gelmiş olup klinik doz kullanıldığı zaman insanlarda güvenlilik açısından kısıtlı anlama sahiptir. Fulvestrant genotoksik potansiyel göstermemiştir. Klinik doza yakın dozlarda kullanılan fulvestrant, üreme ve embriyo/fetal gelişim üzerinde, anti-östrojenik aktivitesi ile tutarlı etkiler göstermiştir. Sıçanlarda dişi fertilitesinde ve embriyonik sağkalımda geri dönüşümlü bir azalma, distosi ve tarsal fleksür dahil fetal anomalilerin insidansında artış gözlenmiştir. Fulvestrant verilen tavşanlarda gebelik sona ermiştir. Plasenta ağırlığı ve implantasyon sonrası fetüs kaybında artış görülmüştür. Tavşanlarda fetal varyasyonların insidansı artmıştır (pelvik kemerde ters dönme ve 27 presakral vertebra). Sıçanlarda yapılan iki yıllık onkojenisite çalışması (FASLODEX in intramüsküler uygulanması), yüksek dozlarda, 10 mg/sıçan/15 gün, dişi sıçanların overlerindeki benign granüloza hücreli tümör insidansında ve erkek sıçanların testis Leydig hücre tümörleri insidansında artış göstermiştir. İki yıllık bir fare onkojenisite çalışmasında (günlük oral uygulama), 150 ve 500 mg/kg/gün dozlarda over seks kord tümörü (hem benin hem de malin) insidansında artış görülmüştür. Bu bulguların etkisizlik seviyesinde, sistemik maruziyet seviyeleri (EAA); sıçanlarda, insanlarda beklenen maruziyetten dişilerde 1,5 kat ve erkeklerde 0,8 kat fazla ve farelerde insanlara oranla, hem dişi hem de erkekte beklenen maruziyet seviyelerinden yaklaşık 0,8 kat fazladır. Bu gibi tümörlerin indüksiyonu, siklüsü olan hayvanlarda anti-östrojenlerin neden olduğu gonadotropin seviyelerindeki farmakoloji ilişkili endokrin geribildirim değişiklikleri ile tutarlıdır. Bu nedenle bu bulguların ilerlemiş meme kanseri olan postmenopozal kadınlarda, fulvestrant kullanımı ile ilişkili olduğu düşünülmemektedir. 6. FARMASÖTİK ÖZELLİKLER 6.1. Yardımcı maddelerin listesi Etanol %96 Benzil alkol Benzil benzoat Hintyağı 9/11
10 6.2. Geçimsizlikler Geçimlilik çalışmaları yapılmadığından, bu tıbbi ürün başka tıbbi ürünler ile karıştırılmamalıdır Raf ömrü 48 ay 6.4. Saklamaya yönelik özel tedbirler 2ºC-8ºC arasında (buzdolabında) saklayınız. Dondurmayınız. Donmuş ürünleri çözüp kullanmayınız. Işıktan korumak için kullanıma hazır enjektörü orijinal ambalajında saklayınız Ambalajın niteliği ve içeriği Her biri 5 ml FASLODEX enjeksiyonluk çözelti içeren, emniyetli kapağa sahip bir veya iki adet berrak nötral cam (Tip 1) enjektör. Enjektörler, polistirenden yapılmış piston çubukları ve her biri enjektöre iliştirilecek iki güvenli iğne (Safety-Glide ) bir tepsi içinde sunulmaktadır Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj Atıklarının Kontrolü Yönetmelik lerine uygun olarak imha edilmelidir. Kullanma Talimatı Kullanım şekli ve dozu bölümüne bakınız. Uyarı Kullanım öncesinde güvenli iğneyi (BD SafetyGlide Koruyucu Hipodermik İğne) otoklavlamayın. Kullanım ve imha sırasında eller daima iğnenin arkasında durmalıdır. Her iki enjektör için : Cam enjektör gövdesini, tepsiden alın ve hasar görüp görmediğini kontrol edin. Şekil 1 Enjektörün luer bağlantı yeri üzerindeki beyaz plastik kılıfı, ek yerinden kırarak, beraberindeki lastik uç koruyucusuyla birlikte çıkarın (Şekil 1). İğneyi, Luer bağlantı yerine tespit etmek için döndürün. Güvenli iğnenin (Safety-Glide ) dış ambalajını açın. Şekil 2 Güvenli iğneyi Luer-Lok ile birleştirin (Şekil 2 ye bakınız). İğne ile Luer bağlantısını tam olarak oturana kadar döndürün. İğnenin kılıfını, ucuna zarar vermemek için dümdüz çekerek çıkarın. Dolu enjektörü uygulama noktasına getirin. İğnenin üzerindeki koruyucu kılıfı çıkarın. 10/11
11 Parenteral çözeltiler uygulama öncesi partiküler madde ve renk değişimi açısından görsel olarak incelenmelidir. Enjektörün içerisindeki havayı alın. Kalçaya, intramusküler enjeksiyon olarak yavaşça uygulayın (1-2 dakika/enjeksiyon). Kullanıcıya kolaylık sağlanması açısından iğnenin ucu, kesik ağzı yukarıya bakacak şekilde, enjektörün üzerindeki kola sabitlenmiştir (Şekil 3 e bakınız). İğneyi hastadan çeker çekmez, enjektörün üzerindeki kolu tamamen ileriye doğru, iğnenin ucu örtülünceye kadar iterek iğne koruma düzeneğini çalıştırın (Bkz. Şekil 4). NOT: Görsel olarak, plastik kolun tamamen ilerlemiş olduğunu ve iğne ucunun kapandığını doğrulayınız. Bunu gerçekleştiremezseniz, enjektörü hemen, içerisine keskin cisimlerin konulduğu bir kutuya atın. Doldurulmuş şırıngalar yalnızca tek kullanım içindir. Şekil 3 Şekil 4 Becton Dizcinson dan Safety-Glide bilgisi Safety-Glide, Beckon Dickinson and Company adlı firmanın ticari bir markasıdır Yetkili temsilci: Becton Dickinson, Laagstraat 57, B-9140 Tomso Belgium 7. RUHSAT SAHİBİ AstraZeneca İlaç San. ve Tic. Ltd. Şti. Büyükdere Cad. Yapı Kredi Plaza B Blok Kat: 3-4 Levent İstanbul Tel.: (0 212) Faks: (0 212) RUHSAT NUMARASI 118/91 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİ İlk ruhsat tarihi: Ruhsat yenileme tarihi: KÜB ÜN YENİLENME TARİHİ /11
KISA ÜRÜN BİLGİSİ. Etkin madde: Her bir kullanıma hazır enjektör 5 ml çözeltide etkin madde olarak 250 mg fulvestrant içerir.
 KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI FASLODEX 250 mg/5 ml enjeksiyonluk çözelti 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Her bir kullanıma hazır enjektör 5 ml çözeltide etkin madde olarak
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI FASLODEX 250 mg/5 ml enjeksiyonluk çözelti 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Her bir kullanıma hazır enjektör 5 ml çözeltide etkin madde olarak
KISA ÜRÜN BİLGİSİ. 1. BEŞERİ TIBBİ ÜRÜNÜN ADI MEDOTİLİN 1000 mg/4ml İ.M./İ.V. enjeksiyonluk çözelti içeren ampul
 KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI MEDOTİLİN 1000 mg/4ml İ.M./İ.V. enjeksiyonluk çözelti içeren ampul 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin Madde: Her bir ampul 1000 mg Kolin alfoskerat a
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI MEDOTİLİN 1000 mg/4ml İ.M./İ.V. enjeksiyonluk çözelti içeren ampul 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin Madde: Her bir ampul 1000 mg Kolin alfoskerat a
KISA ÜRÜN BİLGİSİ. 3. FARMASÖTİK FORMU Film tablet Beyaz ile beyazımsı renkte, yuvarlak, konkav film tabletlerdir.
 KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI MENOCTYL 40 mg Film Tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Otilonyum bromür 40 mg Yardımcı maddeler: Laktoz monohidrat 28 mg Yardımcı maddeler
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI MENOCTYL 40 mg Film Tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Otilonyum bromür 40 mg Yardımcı maddeler: Laktoz monohidrat 28 mg Yardımcı maddeler
KISA ÜRÜN BİLGİSİ. Günde 1-3 kez, ağrılı bölgedeki cilt üzerine ince bir tabaka halinde sürülür, emilimine yardımcı olmak için hafifçe masaj yapılır.
 KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI FASTJEL %2.5 jel 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: 1 g jel 25 mg ketoprofen içerir. Yardımcı madde(ler): Yardımcı maddeler için bkz. 6.1. 3. FARMASÖTİK
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI FASTJEL %2.5 jel 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: 1 g jel 25 mg ketoprofen içerir. Yardımcı madde(ler): Yardımcı maddeler için bkz. 6.1. 3. FARMASÖTİK
KISA ÜRÜN BİLGİSİ. 4. KLİNİK ÖZELLİKLER 4.1 Terapötik endikasyonlar NIZORAL Ovül, akut ve kronik vulvovajinal kandidozun lokal tedavisinde kullanılır.
 KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI NIZORAL 400 mg Ovül 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Her bir ovül etkin madde olarak 400 mg ketokonazol içerir. Yardımcı maddeler: Bütil hidroksianizol
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI NIZORAL 400 mg Ovül 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Her bir ovül etkin madde olarak 400 mg ketokonazol içerir. Yardımcı maddeler: Bütil hidroksianizol
KISA ÜRÜN BĐLGĐSĐ 1. BEŞERĐ TIBBĐ ÜRÜNÜN ADI. LACDIGEST 2250 u/tab Çiğneme Tableti 2. KALĐTATĐF VE KANTĐTATĐF BĐLEŞĐM
 1. BEŞERĐ TIBBĐ ÜRÜNÜN ADI KISA ÜRÜN BĐLGĐSĐ LACDIGEST 2250 u/tab Çiğneme Tableti 2. KALĐTATĐF VE KANTĐTATĐF BĐLEŞĐM Etkin madde: Her bir çiğneme tableti 2250 ünite tilaktaz içerir. Yardımcı maddeler:
1. BEŞERĐ TIBBĐ ÜRÜNÜN ADI KISA ÜRÜN BĐLGĐSĐ LACDIGEST 2250 u/tab Çiğneme Tableti 2. KALĐTATĐF VE KANTĐTATĐF BĐLEŞĐM Etkin madde: Her bir çiğneme tableti 2250 ünite tilaktaz içerir. Yardımcı maddeler:
KISA ÜRÜN BİLGİLERİ. Tablet. Bir yüzü çentikli beyaz ila beyaza yakın kapsül şeklinde tablet.
 KISA ÜRÜN BİLGİLERİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI AMİNESS-N film tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİMİ Etkin madde: Her tablet; 45 mg L-Histidin, 60 mg L-İzolösin, 90 mg L-Lösin, 96 mg L- Lizin asetat
KISA ÜRÜN BİLGİLERİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI AMİNESS-N film tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİMİ Etkin madde: Her tablet; 45 mg L-Histidin, 60 mg L-İzolösin, 90 mg L-Lösin, 96 mg L- Lizin asetat
KISA ÜRÜN BİLGİSİ. 1. BEŞERİ TIBBİ ÜRÜNÜN ADI OCERAL % 1 deri spreyi
 KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI OCERAL % 1 deri spreyi 2. KALİTATİF VE KANTİTATİF BİLEŞİM 1 ml çözeltide; Etkin madde: Oksikonazol nitrat 11.47 mg (10 mg oksikonazole eşdeğer miktarda) Yardımcı
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI OCERAL % 1 deri spreyi 2. KALİTATİF VE KANTİTATİF BİLEŞİM 1 ml çözeltide; Etkin madde: Oksikonazol nitrat 11.47 mg (10 mg oksikonazole eşdeğer miktarda) Yardımcı
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI. ESANSİYEL AMİNO ASİT ORAL Tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİM
 KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI ESANSİYEL AMİNO ASİT ORAL Tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: 1 tablet içeriği : L-izolösin 59 mg L-lösin 89 mg L-lizin 75 mg = lizin asetat
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI ESANSİYEL AMİNO ASİT ORAL Tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: 1 tablet içeriği : L-izolösin 59 mg L-lösin 89 mg L-lizin 75 mg = lizin asetat
12 yaş ve üzeri ergenlerde ve yetişkinlerde, günde üç defa (sabah, öğlen ve akşam) 1 tablet dozajı uygulanır.
 KISA ÜRÜN BİLGİLERİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI UMCA FİLM TABLET 2. KALİTATİF VE KANTİTATİF BİLEŞİMİ Etkin madde : Bir film-kaplı tablet, kurutulmuş Afrika sardunyası (Pelargonium sidoides) (1 : 8 10) köklerinden
KISA ÜRÜN BİLGİLERİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI UMCA FİLM TABLET 2. KALİTATİF VE KANTİTATİF BİLEŞİMİ Etkin madde : Bir film-kaplı tablet, kurutulmuş Afrika sardunyası (Pelargonium sidoides) (1 : 8 10) köklerinden
KISA ÜRÜN BİLGİSİ. 1. BEŞERİ TIBBİ ÜRÜNÜN ADI HİPOKORT % 0,5 pomad
 1. BEŞERİ TIBBİ ÜRÜNÜN ADI HİPOKORT % 0,5 pomad KISA ÜRÜN BİLGİSİ 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Her 30 g pomad içerisinde: Hidrokortizon asetat 0,15 g Yardımcı maddeler: Her 30 g pomad
1. BEŞERİ TIBBİ ÜRÜNÜN ADI HİPOKORT % 0,5 pomad KISA ÜRÜN BİLGİSİ 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Her 30 g pomad içerisinde: Hidrokortizon asetat 0,15 g Yardımcı maddeler: Her 30 g pomad
KULLANMA TALİMATI. Bu ilacı kullanmaya başlamadan önce bu KULLANMA TALİMATINI dikkatlice okuyunuz, çünkü sizin için önemli bilgiler içermektedir.
 KULLANMA TALİMATI TİSİNON 10 mg kapsül Ağızdan alınır. Her kapsül; Etkin madde: 10 mg nitisinon Yardımcı maddeler: Prejelatinize nişasta ve opak beyaz gövde / opak lacivert kapak No:3 sert jelatin kapsül
KULLANMA TALİMATI TİSİNON 10 mg kapsül Ağızdan alınır. Her kapsül; Etkin madde: 10 mg nitisinon Yardımcı maddeler: Prejelatinize nişasta ve opak beyaz gövde / opak lacivert kapak No:3 sert jelatin kapsül
KISA ÜRÜN BİLGİSİ. 4.1. Terapötik endikasyonlar Kas-iskelet sistemi ile ilişkili akut ağrılı kas spazmlarının semptomatik tedavisinde endikedir.
 KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI MAXTHİO 4 mg/2 ml İM Enjeksiyon İçin Çözelti İçeren Ampul 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Tiyokolşikosid 4 mg Yardımcı maddeler: Sodyum klorür
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI MAXTHİO 4 mg/2 ml İM Enjeksiyon İçin Çözelti İçeren Ampul 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Tiyokolşikosid 4 mg Yardımcı maddeler: Sodyum klorür
KISA ÜRÜN BİLGİSİ. Hiperkalsemiyi önlemek için, dozun, biyokimyasal cevaba göre ayarlanması önemlidir.
 KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI ONE-ALPHA 2 mikrogram / ml i.v. ampul 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde Alfakalsidol Yardımcı maddeler Etanol 2 mikrogram 80 mg Yardımcı maddeler
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI ONE-ALPHA 2 mikrogram / ml i.v. ampul 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde Alfakalsidol Yardımcı maddeler Etanol 2 mikrogram 80 mg Yardımcı maddeler
KISA ÜRÜN BİLGİSİ. 3. FARMASÖTİK FORM Vajinal Ovül Hafif sarı yağlı süspansiyon içeren sarımtırak oval kapsül şeklindedir.
 1. BEŞERİ TIBBİ ÜRÜNÜN ADI KISA ÜRÜN BİLGİSİ MACMIROR COMPLEX 500 mg + 200.000 IU vajinal ovül 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Her bir vajinal ovül Nifuratel 500 mg; Nistatin 200.000 IU
1. BEŞERİ TIBBİ ÜRÜNÜN ADI KISA ÜRÜN BİLGİSİ MACMIROR COMPLEX 500 mg + 200.000 IU vajinal ovül 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Her bir vajinal ovül Nifuratel 500 mg; Nistatin 200.000 IU
KISA ÜRÜN BİLGİSİ. Doktor tarafından başka bir şekilde tavsiye edilmediği takdirde aşağıdaki dozlarda kullanılır.
 KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI GRİZİNC 15 mg/ 5 ml şurup 2. KALİTATİF VE KANTİTATİF BİLEŞİMİ Etkin Madde: Çinko sülfat heptahidrat Yardımcı maddeler: Şeker (sükroz) Gliserin Sunset yellow
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI GRİZİNC 15 mg/ 5 ml şurup 2. KALİTATİF VE KANTİTATİF BİLEŞİMİ Etkin Madde: Çinko sülfat heptahidrat Yardımcı maddeler: Şeker (sükroz) Gliserin Sunset yellow
KISA ÜRÜN BİLGİSİ. Çeşitli nedenlere bağlı kuru öksürüğün (nonprodüktif öksürük) semptomatik tedavisinde endikedir.
 KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI LUNGES 30 mg/5 ml şurup 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Levodropropizin...6 mg / ml Yardımcı maddeler: Sakkaroz...350,00 mg / ml Sodyum hidroksit...3,60
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI LUNGES 30 mg/5 ml şurup 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Levodropropizin...6 mg / ml Yardımcı maddeler: Sakkaroz...350,00 mg / ml Sodyum hidroksit...3,60
KISA ÜRÜN BİLGİLERİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI. DENTİNOX diş jeli 2. KALİTATİF VE KANTİTATİF BİLEŞİM
 KISA ÜRÜN BİLGİLERİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI DENTİNOX diş jeli 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde : Lidokain hidroklorür, 1H 2 O 3.4 mg/g Hidroksipolietoksidodekan 600 3.2 mg/g Kamomil tentürü
KISA ÜRÜN BİLGİLERİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI DENTİNOX diş jeli 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde : Lidokain hidroklorür, 1H 2 O 3.4 mg/g Hidroksipolietoksidodekan 600 3.2 mg/g Kamomil tentürü
KISA ÜRÜN BİLGİLERİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI. ZALAIN 500 mg Vajinal Tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİM
 KISA ÜRÜN BİLGİLERİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI ZALAIN 500 mg Vajinal Tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin Madde Her bir vajinal tablet 500 mg Sertakonazol nitrat içerir. Yardımcı Maddeler Yardımcı
KISA ÜRÜN BİLGİLERİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI ZALAIN 500 mg Vajinal Tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin Madde Her bir vajinal tablet 500 mg Sertakonazol nitrat içerir. Yardımcı Maddeler Yardımcı
RECBUTİN hemoroid krizleri sırasında ağrılı ve kaşıntılı anal semptomların ve fissürlerin semptomatik tedavisinde endikedir.
 KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI RECBUTİN rektal krem 2. KALİTATİF VE KANTİTATİF BİLEŞİM 1 g kremde; Etkin madde: Trimebutin baz Ruskogenin 58.00 mg 5.00 mg Yardımcı maddeler: Setostearil alkol
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI RECBUTİN rektal krem 2. KALİTATİF VE KANTİTATİF BİLEŞİM 1 g kremde; Etkin madde: Trimebutin baz Ruskogenin 58.00 mg 5.00 mg Yardımcı maddeler: Setostearil alkol
KULLANMA TALİMATI FERICOSE
 KULLANMA TALİMATI FERICOSE 100mg/5ml İ.V. Enjeksiyonluk Çözelti İçeren Ampul Damar içine uygulanır. Etkin madde: 5 ml lik her bir ampul, 100 mg (20 mg/ml) elementer demire eşdeğer 2700 mg demir hidroksit
KULLANMA TALİMATI FERICOSE 100mg/5ml İ.V. Enjeksiyonluk Çözelti İçeren Ampul Damar içine uygulanır. Etkin madde: 5 ml lik her bir ampul, 100 mg (20 mg/ml) elementer demire eşdeğer 2700 mg demir hidroksit
1. BEŞERİ TIBBİ ÜRÜNÜN ADI. VERTİN 16 mg Tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİM. Etkin madde: Betahistin dihidroklorür... 16 mg
 KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI VERTİN 16 mg Tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Betahistin dihidroklorür... 16 mg Yardımcı maddeler: Mannitol... 50 mg Yardımcı maddeler
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI VERTİN 16 mg Tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Betahistin dihidroklorür... 16 mg Yardımcı maddeler: Mannitol... 50 mg Yardımcı maddeler
KULLANMA TALİMATI. 35, 50 ve 100 gramlık alüminyum tüplerde, uygulayıcısı ve kullanma talimatı ile birlikte karton kutuda kullanıma sunulmaktadır.
 ESTRIOL Vajinal Krem, 1 mg Vajinal yolla veya haricen uygulanır. KULLANMA TALİMATI Etkin madde: 1 gramında 1 mg östriol bulunur. Yardımcı maddeler: Dekalinyum klorür, Parfüm yağı, Dokusat sodyum, Propilen
ESTRIOL Vajinal Krem, 1 mg Vajinal yolla veya haricen uygulanır. KULLANMA TALİMATI Etkin madde: 1 gramında 1 mg östriol bulunur. Yardımcı maddeler: Dekalinyum klorür, Parfüm yağı, Dokusat sodyum, Propilen
KULLANMA TALİMATI. Bu ilacı kullanmaya başlamadan önce bu KULLANMA TALİMATINI dikkatlice okuyunuz, çünkü sizin için önemli bilgiler içermektedir.
 SPRAMAX 1.5 M.I.U film kaplı tablet Ağızdan alınır. KULLANMA TALİMATI Etkin madde: Her kaplanmış tablet; 1.500.000 IU Spiramisin içerir. Yardımcı maddeler: Hidroksipropil selüloz, Prejelatinize Mısır Nişastası,
SPRAMAX 1.5 M.I.U film kaplı tablet Ağızdan alınır. KULLANMA TALİMATI Etkin madde: Her kaplanmış tablet; 1.500.000 IU Spiramisin içerir. Yardımcı maddeler: Hidroksipropil selüloz, Prejelatinize Mısır Nişastası,
KULLANMA TALİMATI HEKSA DERİ MERHEMİ. Deriye lokal olarak uygulanır. Etkin madde:
 KULLANMA TALİMATI HEKSA DERİ MERHEMİ Deriye lokal olarak uygulanır. Etkin madde: Her 1 gram merhemde 30 mg oksitetrasiklin e eşdeğer oksitetrasiklin hidroklorür ve 10.000 ünite polimiksin B ye eşdeğer
KULLANMA TALİMATI HEKSA DERİ MERHEMİ Deriye lokal olarak uygulanır. Etkin madde: Her 1 gram merhemde 30 mg oksitetrasiklin e eşdeğer oksitetrasiklin hidroklorür ve 10.000 ünite polimiksin B ye eşdeğer
KISA ÜRÜN BĐLGĐSĐ. Kuru göz sendromunun semptomatik tedavisinde kullanılır.
 KISA ÜRÜN BĐLGĐSĐ 1. BEŞERĐ TIBBĐ ÜRÜNÜN ADI EYESTIL 10 ml göz damlası 2. KALĐTATĐF VE KANTĐTATĐF BĐLEŞĐM Etkin madde : 100 ml de : 0.150 g hiyalüronik asit sodyum tuzu içerir. Yardımcı maddeler : Yardımcı
KISA ÜRÜN BĐLGĐSĐ 1. BEŞERĐ TIBBĐ ÜRÜNÜN ADI EYESTIL 10 ml göz damlası 2. KALĐTATĐF VE KANTĐTATĐF BĐLEŞĐM Etkin madde : 100 ml de : 0.150 g hiyalüronik asit sodyum tuzu içerir. Yardımcı maddeler : Yardımcı
KULLANMA TALİMATI. Bu ilacı kullanmaya başlamadan önce bu KULLANMA TALİMATINI dikkatlice okuyunuz, çünkü sizin için önemli bilgiler içermektedir.
 KULLANMA TALİMATI CASODEX 150 mg film tablet Ağız yoluyla alınır. Etkin madde: 150 mg bikalutamid Yardımcı maddeler: Laktoz monohidrat, magnezyum stearat, polividon, sodyum nişasta glikolat, hipromelloz,
KULLANMA TALİMATI CASODEX 150 mg film tablet Ağız yoluyla alınır. Etkin madde: 150 mg bikalutamid Yardımcı maddeler: Laktoz monohidrat, magnezyum stearat, polividon, sodyum nişasta glikolat, hipromelloz,
KULLANMA TALİMATI. Etkin madde: Her saşe1200 mg asetilsistein içerir. Yardımcı maddeler: Beta karoten, aspartam, sorbitol ve portakal aroması içerir.
 KULLANMA TALİMATI ASİST 1200 mg toz içeren saşe Ağızdan alınır. Etkin madde: Her saşe1200 mg asetilsistein içerir. Yardımcı maddeler: Beta karoten, aspartam, sorbitol ve portakal aroması içerir. Bu ilacı
KULLANMA TALİMATI ASİST 1200 mg toz içeren saşe Ağızdan alınır. Etkin madde: Her saşe1200 mg asetilsistein içerir. Yardımcı maddeler: Beta karoten, aspartam, sorbitol ve portakal aroması içerir. Bu ilacı
KULLANMA TALİMATI. Etkin madde: Her bir çiğneme tableti 725 mg (250 mg baza eşdeğer) Pirantel pamoat içerir.
 KULLANMA TALİMATI KONTİL çiğneme tableti Ağızdan alınır. Etkin madde: Her bir çiğneme tableti 725 mg (250 mg baza eşdeğer) Pirantel pamoat içerir. Yardımcı maddeler: Sodyum siklamat, povidon K-30, sukroz,
KULLANMA TALİMATI KONTİL çiğneme tableti Ağızdan alınır. Etkin madde: Her bir çiğneme tableti 725 mg (250 mg baza eşdeğer) Pirantel pamoat içerir. Yardımcı maddeler: Sodyum siklamat, povidon K-30, sukroz,
Bu ilacı kullanmaya başlamadan önce bu KULLANMA TALİMATINI dikkatlice okuyunuz, çünkü sizin için önemli bilgiler içermektedir.
 KULLANMA TALİMATI LUCENTIS 10 mg/ml enjeksiyonluk çözelti içeren flakon Göz içine uygulanır. Etkin madde: Her flakonun 0,3 ml si 3 mg ranibizumab içerir. Yardımcı maddeler: Alfa,alfa-trehaloz dihidrat,
KULLANMA TALİMATI LUCENTIS 10 mg/ml enjeksiyonluk çözelti içeren flakon Göz içine uygulanır. Etkin madde: Her flakonun 0,3 ml si 3 mg ranibizumab içerir. Yardımcı maddeler: Alfa,alfa-trehaloz dihidrat,
KISA ÜRÜN BİLGİSİ. 1. BEŞERİ TIBBİ ÜRÜNÜN ADI BİTAZOL 500 mg vajinal tablet
 KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI BİTAZOL 500 mg vajinal tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Her bir vajinal tablet 500 mg ornidazol içerir. Y ardım cı m addeler: Laktoz 400
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI BİTAZOL 500 mg vajinal tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Her bir vajinal tablet 500 mg ornidazol içerir. Y ardım cı m addeler: Laktoz 400
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI. FENİSTİL Jel 2. KALİTATİF VE KANTİTATİF BİLEŞİM
 KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI FENİSTİL Jel 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: 1 g jel, 1 mg dimetinden maleat içerir. Yardımcı maddeler: Propilen glikol, benzalkonyum klorür
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI FENİSTİL Jel 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: 1 g jel, 1 mg dimetinden maleat içerir. Yardımcı maddeler: Propilen glikol, benzalkonyum klorür
16 yaş altı hastalarda viral grip/ soğuk algınlığı veya suçiçeği durumlarında hekime danışılmadan kullanılmamalıdır.
 1. BEŞERİ TIBBİ ÜRÜNÜN ADI DENCOL Jel Sprey 2. KALİTATİF VE KANTİTATİF BİLEŞİM Her 1 g jel, Etkin madde: Kolin salisilat içerir. Yardımcı maddeler: Sorbitol (%70) Karboksimetil selüloz sodyum 87.1 mg 70.0
1. BEŞERİ TIBBİ ÜRÜNÜN ADI DENCOL Jel Sprey 2. KALİTATİF VE KANTİTATİF BİLEŞİM Her 1 g jel, Etkin madde: Kolin salisilat içerir. Yardımcı maddeler: Sorbitol (%70) Karboksimetil selüloz sodyum 87.1 mg 70.0
KISA ÜRÜN BİLGİSİ. 3. FARMASÖTİK FORM Kullanıma hazır oral süspansiyon. Hafif, krem sarısı, homojen, vişne/nane aromalı opak süspansiyon.
 KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI MIKOSTATIN oral süspansiyon 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Nistatin 100.000 ünite/ml Yardımcı maddeler: Etanol Sukroz 8,07 mg/ml 500 mg/ml
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI MIKOSTATIN oral süspansiyon 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Nistatin 100.000 ünite/ml Yardımcı maddeler: Etanol Sukroz 8,07 mg/ml 500 mg/ml
KISA ÜRÜN BİLGİLERİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI. STİLEX jel 2. KALİTATİF VE KANTİTATİF BİLEŞİMİ
 KISA ÜRÜN BİLGİLERİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI STİLEX jel 2. KALİTATİF VE KANTİTATİF BİLEŞİMİ Etkin madde : 1 g STİLEX, etkin madde olarak 15 mg Mepiramin maleat, 15 mg Lidokain hidroklorür ve 50 mg Dekspantenol
KISA ÜRÜN BİLGİLERİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI STİLEX jel 2. KALİTATİF VE KANTİTATİF BİLEŞİMİ Etkin madde : 1 g STİLEX, etkin madde olarak 15 mg Mepiramin maleat, 15 mg Lidokain hidroklorür ve 50 mg Dekspantenol
KISA ÜRÜN BİLGİSİ. 0.1-0.3 Ünite klostridiopeptidaz A (Majör enzim) ya 0.04 0.75 mg* eşdeğer miktarda üretim fazlası
 1. BEŞERİ TIBBİ ÜRÜNÜN ADI STERİL NOVUXOL Pomad KISA ÜRÜN BİLGİSİ 2. KALİTATİF VE KANTİTATİF BİLEŞİM Bir gram pomatta; Etkin madde: Kollajenaz; (steril, filtre edilmiş) - 1.20 Ünite klostridiopeptidaz
1. BEŞERİ TIBBİ ÜRÜNÜN ADI STERİL NOVUXOL Pomad KISA ÜRÜN BİLGİSİ 2. KALİTATİF VE KANTİTATİF BİLEŞİM Bir gram pomatta; Etkin madde: Kollajenaz; (steril, filtre edilmiş) - 1.20 Ünite klostridiopeptidaz
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI. ORO İHTİYOL % 10 Merhem 2. KALİTATİF VE KANTİTATİF BİLEŞİM. Etkin madde:
 KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI ORO İHTİYOL % 10 Merhem 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: İhtiyol 2.00 g Yardımcı maddeler: Lanolin susuz (koyun) 2,00 g Yardımcı maddeler için
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI ORO İHTİYOL % 10 Merhem 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: İhtiyol 2.00 g Yardımcı maddeler: Lanolin susuz (koyun) 2,00 g Yardımcı maddeler için
EXELDERM KREM KISA ÜRÜN BİLGİLERİ. : % 1 Sulkonazol nitrat
 KISA ÜRÜN BİLGİLERİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI EXELDERM krem 2. KALİTATİF VE KANTİTATİF BİLEŞİMİ Etkin madde : % 1 Sulkonazol nitrat Yardımcı maddeler : Propilen Glikol Stearil alkol Setil alkol 5.000
KISA ÜRÜN BİLGİLERİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI EXELDERM krem 2. KALİTATİF VE KANTİTATİF BİLEŞİMİ Etkin madde : % 1 Sulkonazol nitrat Yardımcı maddeler : Propilen Glikol Stearil alkol Setil alkol 5.000
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI. DEBRİDAT FORT tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİM
 KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI DEBRİDAT FORT tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Her bir tablet 200 mg Trimebutin Maleat içerir. Yardımcı maddeler: Laktoz 175 mg Yardımcı
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI DEBRİDAT FORT tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Her bir tablet 200 mg Trimebutin Maleat içerir. Yardımcı maddeler: Laktoz 175 mg Yardımcı
KULLANMA TALİMATI. ONDAREN 8 mg/4 ml I.V. enjeksiyonluk çözelti içeren ampul Damar içine uygulanır.
 KULLANMA TALİMATI ONDAREN 8 mg/4 ml I.V. enjeksiyonluk çözelti içeren ampul Damar içine uygulanır. Etkin madde: Her bir ml çözelti 2 mg ondansetron baza eşdeğer miktarda ondansetron hidroklorür dihidrat
KULLANMA TALİMATI ONDAREN 8 mg/4 ml I.V. enjeksiyonluk çözelti içeren ampul Damar içine uygulanır. Etkin madde: Her bir ml çözelti 2 mg ondansetron baza eşdeğer miktarda ondansetron hidroklorür dihidrat
PENSA PHARMA İLAÇ TİCARET VE SANAYİ A.Ş. Bonemax 70 mg Tablet Prospektüs
 Bonemax 70 mg Tablet FORMÜLÜ Her bir tablet 70 mg alendronat serbest aside eşdeğer miktarda alendronat monosodyum trihidrat içerir. FARMAKOLOJİK ÖZELLİKLERİ Farmakodinamik özellikler Bifosfonatlar kemikte
Bonemax 70 mg Tablet FORMÜLÜ Her bir tablet 70 mg alendronat serbest aside eşdeğer miktarda alendronat monosodyum trihidrat içerir. FARMAKOLOJİK ÖZELLİKLERİ Farmakodinamik özellikler Bifosfonatlar kemikte
 KULLANMA TALİMATI SOMATOSTATİN EUMEDICA 250 µg i.v. İnfüzyon için Liyofilize Toz içeren Flakon Damardan uygulanır. Etkin madde: Her flakonda etkin madde olarak, 250 µg somatostatine eşdeğer miktarda hidratlanmış
KULLANMA TALİMATI SOMATOSTATİN EUMEDICA 250 µg i.v. İnfüzyon için Liyofilize Toz içeren Flakon Damardan uygulanır. Etkin madde: Her flakonda etkin madde olarak, 250 µg somatostatine eşdeğer miktarda hidratlanmış
KISA ÜRÜN BİLGİSİ. Uygulama şekli: Az miktarda su ile seyreltilerek ya da seyreltilmeden yutulmaksızın gargara yapılır.
 KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI: DİCLORAL gargara 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Her 1 ml 0,74 mg diklofenak (serbest asit şeklinde) içerir. Yardımcı madde(ler): Yardımcı
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI: DİCLORAL gargara 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Her 1 ml 0,74 mg diklofenak (serbest asit şeklinde) içerir. Yardımcı madde(ler): Yardımcı
PROCTOLOG hemoroid krizleri sırasında ağrılı ve kaşıntılı anal semptomların ve fissürlerin semptomatik tedavisinde endikedir.
 KISA ÜRÜN BİLGİLERİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI PROCTOLOG rektal krem 2. KALİTATİF VE KANTİTATİF BİLEŞİM 100 g. kremde, Etkin madde: Ruskogenin Trimebutin Yardımcı maddeler: Setostearil alkol Propilen glikol
KISA ÜRÜN BİLGİLERİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI PROCTOLOG rektal krem 2. KALİTATİF VE KANTİTATİF BİLEŞİM 100 g. kremde, Etkin madde: Ruskogenin Trimebutin Yardımcı maddeler: Setostearil alkol Propilen glikol
KULLANMA TALİMATI. PROCTO-GLYVENOL krem Rektal yoldan uygulanır.
 KULLANMA TALİMATI PROCTO-GLYVENOL krem Rektal yoldan uygulanır. Etkin madde: 100 g krem 5 g tribenosid ve 2 g lidokain hidroklorür içerir. Yardımcı maddeler: Makrogol setosteril eter, setil alkol, izopropil
KULLANMA TALİMATI PROCTO-GLYVENOL krem Rektal yoldan uygulanır. Etkin madde: 100 g krem 5 g tribenosid ve 2 g lidokain hidroklorür içerir. Yardımcı maddeler: Makrogol setosteril eter, setil alkol, izopropil
OVITRELLE KULLANIMA HAZIR ŞIRINGADA ENJEKSİYONLUK ÇÖZELTİ 250 mikrogram/0.5 ml
 OVITRELLE KULLANIMA HAZIR ŞIRINGADA ENJEKSİYONLUK ÇÖZELTİ 250 mikrogram/0.5 ml FORMÜLÜ 1 kullanıma hazır şırınga etken madde olarak 250 mikrogram koriogonadotropin alfa (6500 İnternasyonal Üniteye eşdeğer)
OVITRELLE KULLANIMA HAZIR ŞIRINGADA ENJEKSİYONLUK ÇÖZELTİ 250 mikrogram/0.5 ml FORMÜLÜ 1 kullanıma hazır şırınga etken madde olarak 250 mikrogram koriogonadotropin alfa (6500 İnternasyonal Üniteye eşdeğer)
KISA ÜRÜN BİLGİSİ. 1. BEŞERİ TIBBİ ÜRÜNÜN ADI DROPLEKS kulak damlası. 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin maddeler: Her 1 ml de;
 KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI DROPLEKS kulak damlası 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin maddeler: Her 1 ml de; Fenazon 45.52 mg Lidokain hidroklorür 11.38 mg Yardımcı maddeler: Yardımcı
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI DROPLEKS kulak damlası 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin maddeler: Her 1 ml de; Fenazon 45.52 mg Lidokain hidroklorür 11.38 mg Yardımcı maddeler: Yardımcı
Tabletler çiğnenmeden yeterli miktarda sıvı, örneğin bir bardak su ile yutulmalıdır.
 KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI DEBRİDAT tablet 100 mg 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Her bir tablet 100 mg Trimebutin Maleat içerir. Yardımcı maddeler: Laktoz monohidrat
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI DEBRİDAT tablet 100 mg 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Her bir tablet 100 mg Trimebutin Maleat içerir. Yardımcı maddeler: Laktoz monohidrat
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI. PROCTO-GLYVENOL Supozituvar
 1. BEŞERİ TIBBİ ÜRÜNÜN ADI PROCTO-GLYVENOL Supozituvar KISA ÜRÜN BİLGİSİ 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Her bir supozituvar (2 g), 400 mg tribenosid ve 40 mg lidokain içerir. Yardımcı
1. BEŞERİ TIBBİ ÜRÜNÜN ADI PROCTO-GLYVENOL Supozituvar KISA ÜRÜN BİLGİSİ 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Her bir supozituvar (2 g), 400 mg tribenosid ve 40 mg lidokain içerir. Yardımcı
BEBEK VE ÇOCUK ÖLÜMLÜLÜĞÜ 9
 BEBEK VE ÇOCUK ÖLÜMLÜLÜĞÜ 9 Attila Hancıoğlu ve İlknur Yüksel Alyanak Sağlık programlarının izlenmesi, değerlendirilmesi ve ileriye yönelik politikaların belirlenmesi açısından neonatal, post-neonatal
BEBEK VE ÇOCUK ÖLÜMLÜLÜĞÜ 9 Attila Hancıoğlu ve İlknur Yüksel Alyanak Sağlık programlarının izlenmesi, değerlendirilmesi ve ileriye yönelik politikaların belirlenmesi açısından neonatal, post-neonatal
KULLANMA TALİMATI FASLODEX
 KULLANMA TALİMATI FASLODEX 250 mg/5 ml enjeksiyonluk çözelti Kas içine uygulanır. Etkin madde: Her bir kullanıma hazır enjektör 5 ml çözeltide etkin madde olarak 250 mg fulvestrant içerir. Yardımcı maddeler:
KULLANMA TALİMATI FASLODEX 250 mg/5 ml enjeksiyonluk çözelti Kas içine uygulanır. Etkin madde: Her bir kullanıma hazır enjektör 5 ml çözeltide etkin madde olarak 250 mg fulvestrant içerir. Yardımcı maddeler:
15 Mart 2006 ve 17 Temmuz 2006 tarihli Bakanlık talepleri/ Haziran 2005 tarihli PDR / 16 Kasım 2005 tarihli CD referans alınmıştır.
 1. BEŞERİ TIBBİ ÜRÜNÜN ADI GYNO-TROSYD 100 mg vajinal tablet KISA ÜRÜN BİLGİSİ 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Tiokonazol 100 mg Yardımcı maddeler: Yardımcı maddeler için 6.1 e bakınız.
1. BEŞERİ TIBBİ ÜRÜNÜN ADI GYNO-TROSYD 100 mg vajinal tablet KISA ÜRÜN BİLGİSİ 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Tiokonazol 100 mg Yardımcı maddeler: Yardımcı maddeler için 6.1 e bakınız.
KISA ÜRÜN BİLGİSİ. Her kapsülde, Saw palmetto (cüce palmiye) meyve sıvı ekstresi 160 mg (10-14,3:1) (ekstraksiyon ajanı: etanol %90 a/a) içerir.
 1. BEŞERİ TIBBİ ÜRÜNÜN ADI PROSTAGOOD MONO Kapsül KISA ÜRÜN BİLGİSİ 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Her kapsülde, Saw palmetto (cüce palmiye) meyve sıvı ekstresi 160 mg (10-14,3:1) (ekstraksiyon
1. BEŞERİ TIBBİ ÜRÜNÜN ADI PROSTAGOOD MONO Kapsül KISA ÜRÜN BİLGİSİ 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Her kapsülde, Saw palmetto (cüce palmiye) meyve sıvı ekstresi 160 mg (10-14,3:1) (ekstraksiyon
KULLANMA TALİMATI. - Yardımcı maddeler: Poli(laktik-ko-glikolik asit) 1:1
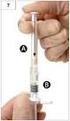 KULLANMA TALİMATI Lectrum 3,6 mg İmplant Deri altına uygulanır. Steril, apirojen - Etkin madde: 3.78 mg leuprorelin asetat - Yardımcı maddeler: Poli(laktik-ko-glikolik asit) 1:1 Bu ilacı kullanmaya başlamadan
KULLANMA TALİMATI Lectrum 3,6 mg İmplant Deri altına uygulanır. Steril, apirojen - Etkin madde: 3.78 mg leuprorelin asetat - Yardımcı maddeler: Poli(laktik-ko-glikolik asit) 1:1 Bu ilacı kullanmaya başlamadan
KISA ÜRÜN BİLGİSİ. 1. BEŞERİ TIBBİ ÜRÜNÜN ADI TUSSİR 30 mg / 5ml şurup. 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde:
 KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI TUSSİR 30 mg / 5ml şurup 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Levodropropizin Yardımcı maddeler: 30 mg / 5 ml Sukroz...2.5 g/ 5 ml Gliserol.0.5 g/
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI TUSSİR 30 mg / 5ml şurup 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Levodropropizin Yardımcı maddeler: 30 mg / 5 ml Sukroz...2.5 g/ 5 ml Gliserol.0.5 g/
KISA ÜRÜN BİLGİSİ. 1. BEŞERİ TIBBİ ÜRÜNÜN ADI Droser Burun Damlası. 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde:
 1. BEŞERİ TIBBİ ÜRÜNÜN ADI Droser Burun Damlası KISA ÜRÜN BİLGİSİ 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Sodyum klorür % 0.9 (a/h) Yardımcı maddeler: Yardımcı maddeler için Bölüm 6.1 e bakınız.
1. BEŞERİ TIBBİ ÜRÜNÜN ADI Droser Burun Damlası KISA ÜRÜN BİLGİSİ 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Sodyum klorür % 0.9 (a/h) Yardımcı maddeler: Yardımcı maddeler için Bölüm 6.1 e bakınız.
KULLANMA TALĐMATI. CALCIUM PICKEN %10 Ampul Damar ve kas içine uygulanır.
 KULLANMA TALĐMATI CALCIUM PICKEN %10 Ampul Damar ve kas içine uygulanır. Etkin madde: Her bir ampul 225 mg kalsiyum glukonat monohidrat ve 572 mg kalsiyum levülinat dihidrat içerir. Yardımcı madde (ler):
KULLANMA TALĐMATI CALCIUM PICKEN %10 Ampul Damar ve kas içine uygulanır. Etkin madde: Her bir ampul 225 mg kalsiyum glukonat monohidrat ve 572 mg kalsiyum levülinat dihidrat içerir. Yardımcı madde (ler):
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI. NICORETTE INVISI 15 mg Nikotin Bandı 2. KALİTATİF VE KANTİTATİF BİLEŞİM.
 KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI NICORETTE INVISI 15 mg Nikotin Bandı 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: 13.5 cm 2 lik her bir bant cm 2 de 1.75 mg nikotin içerir. NICORETTE INVISI
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI NICORETTE INVISI 15 mg Nikotin Bandı 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: 13.5 cm 2 lik her bir bant cm 2 de 1.75 mg nikotin içerir. NICORETTE INVISI
KULLANMA TALİMATI. Bu ilacı kullanmaya başlamadan önce bu KULLANMA TALİMATINI dikkatlice okuyunuz, çünkü sizin için önemli bilgiler içermektedir.
 KULLANMA TALİMATI Lectrum 5,0 mg İmplant Deri altına uygulanır. Steril, apirojen - Etkin madde: 5.25 mg leuprorelin asetat - Yardımcı maddeler: Polilaktik asit Bu ilacı kullanmaya başlamadan önce bu KULLANMA
KULLANMA TALİMATI Lectrum 5,0 mg İmplant Deri altına uygulanır. Steril, apirojen - Etkin madde: 5.25 mg leuprorelin asetat - Yardımcı maddeler: Polilaktik asit Bu ilacı kullanmaya başlamadan önce bu KULLANMA
Doktor tarafından başka şekilde tavsiye edilmediği takdirde;
 KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI ZADİTEN SRO 2 mg film tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Ketotifen hidrojen fumarat 2.750 mg (2 mg ketotifene eşdeğer bazda) Yardımcı maddeler:
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI ZADİTEN SRO 2 mg film tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Ketotifen hidrojen fumarat 2.750 mg (2 mg ketotifene eşdeğer bazda) Yardımcı maddeler:
KISA ÜRÜN BĐLGĐSĐ. 1. BEŞERĐ TIBBĐ ÜRÜNÜN ADI TEARON % 0.05 Oftalmik Emülsiyon Đçeren Tek Dozluk Flakon
 KISA ÜRÜN BĐLGĐSĐ 1. BEŞERĐ TIBBĐ ÜRÜNÜN ADI TEARON % 0.05 Oftalmik Emülsiyon Đçeren Tek Dozluk Flakon 2. KALĐTATĐF VE KANTĐTATĐF BĐLEŞĐM Etkin madde: Her 1 ml de etkin madde olarak 0.5 (%0.05) mg siklosporin
KISA ÜRÜN BĐLGĐSĐ 1. BEŞERĐ TIBBĐ ÜRÜNÜN ADI TEARON % 0.05 Oftalmik Emülsiyon Đçeren Tek Dozluk Flakon 2. KALĐTATĐF VE KANTĐTATĐF BĐLEŞĐM Etkin madde: Her 1 ml de etkin madde olarak 0.5 (%0.05) mg siklosporin
KISA ÜRÜN BİLGİSİ. DEBRİDAT 24 mg/ 5 ml oral süspansiyon hazırlamak için granül
 1. BEŞERİ TIBBİ ÜRÜNÜN ADI KISA ÜRÜN BİLGİSİ DEBRİDAT 24 mg/ 5 ml oral süspansiyon hazırlamak için granül 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Sulandırılmadan önce; her 100 gram granül, 787
1. BEŞERİ TIBBİ ÜRÜNÜN ADI KISA ÜRÜN BİLGİSİ DEBRİDAT 24 mg/ 5 ml oral süspansiyon hazırlamak için granül 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Sulandırılmadan önce; her 100 gram granül, 787
KISA ÜRÜN BİLGİSİ. 3. FARMASÖTİK FORM Film Tablet AERIUS Film Tablet, açık mavi, yüzeyleri düz, yuvarlak bir tablettir. Bir yüzünde SP yazılıdır.
 1. BEŞERİ TIBBİ ÜRÜNÜN ADI AERIUS Film Tablet KISA ÜRÜN BİLGİSİ 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Desloratadin... 5 mg Yardımcı madde(ler): Laktoz...5.8 mg Yardımcı maddeler için bölüm 6.1
1. BEŞERİ TIBBİ ÜRÜNÜN ADI AERIUS Film Tablet KISA ÜRÜN BİLGİSİ 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Desloratadin... 5 mg Yardımcı madde(ler): Laktoz...5.8 mg Yardımcı maddeler için bölüm 6.1
HAMETAN KREM KISA ÜRÜN BİLGİSİ. HAMETAN kullanımı ile ilgili herhangi bir süre kısıtlaması yoktur.
 KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI HAMETAN krem 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Hamamelis virginiana distilatı 5.35 g / 100 g Yardımcı maddeler: Setil alkol Sorbik asit 5.00 g
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI HAMETAN krem 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Hamamelis virginiana distilatı 5.35 g / 100 g Yardımcı maddeler: Setil alkol Sorbik asit 5.00 g
KULLANMA TALİMATI. ZALAIN 300 mg Vajinal Supozituvar Hazne (vajina) içine uygulanır.
 KULLANMA TALİMATI ZALAIN 300 mg Vajinal Supozituvar Hazne (vajina) içine uygulanır. - Etkin Madde: Her bir vajinal supozituvar (ovül) 300 mg sertakonazol nitrat içerir. - Yardımcı Maddeler: Katı, yarı
KULLANMA TALİMATI ZALAIN 300 mg Vajinal Supozituvar Hazne (vajina) içine uygulanır. - Etkin Madde: Her bir vajinal supozituvar (ovül) 300 mg sertakonazol nitrat içerir. - Yardımcı Maddeler: Katı, yarı
KISA ÜRÜN BİLGİSİ. 1. Ürünün İsmi. EUCARBON tablet. 2. Kalitatif ve Kantitatif Bileşimi. Etkin maddeler:
 KISA ÜRÜN BİLGİSİ 1. Ürünün İsmi EUCARBON tablet 2. Kalitatif ve Kantitatif Bileşimi Etkin maddeler: Bir tablette; 180,0 mg bitkisel kömür, 50,0 mg kükürt, 105,0 mg senne (sinameki) yaprağı tozu ve 25,0
KISA ÜRÜN BİLGİSİ 1. Ürünün İsmi EUCARBON tablet 2. Kalitatif ve Kantitatif Bileşimi Etkin maddeler: Bir tablette; 180,0 mg bitkisel kömür, 50,0 mg kükürt, 105,0 mg senne (sinameki) yaprağı tozu ve 25,0
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI. APROKAM 50 mg İntrakameral Enjeksiyonluk çözelti tozu 2. KALİTATİF VE KANTİTATİF BİLEŞİM
 1. BEŞERİ TIBBİ ÜRÜNÜN ADI KISA ÜRÜN BİLGİSİ APROKAM 50 mg İntrakameral Enjeksiyonluk çözelti tozu 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Her flakon 50 mg sefuroksim içerir (52,6 mg sefuroksim
1. BEŞERİ TIBBİ ÜRÜNÜN ADI KISA ÜRÜN BİLGİSİ APROKAM 50 mg İntrakameral Enjeksiyonluk çözelti tozu 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Her flakon 50 mg sefuroksim içerir (52,6 mg sefuroksim
Veri Toplama Yöntemleri. Prof.Dr.Besti Üstün
 Veri Toplama Yöntemleri Prof.Dr.Besti Üstün 1 VERİ (DATA) Belirli amaçlar için toplanan bilgilere veri denir. Araştırmacının belirlediği probleme en uygun çözümü bulabilmesi uygun veri toplama yöntemi
Veri Toplama Yöntemleri Prof.Dr.Besti Üstün 1 VERİ (DATA) Belirli amaçlar için toplanan bilgilere veri denir. Araştırmacının belirlediği probleme en uygun çözümü bulabilmesi uygun veri toplama yöntemi
KISA ÜRÜN BİLGİSİ. İlgili uyarılar için, 4.4 Özel kullanım uyarıları ve önlemleri bölümüne bakınız. Yardımcı maddeler için, bölüm 6.1 e bakınız.
 KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI KETODERM Krem % 2 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: KETODERM Krem % 2 her bir gramında 20 mg ketokonazol içerir. Yardımcı maddeler: 1 gram krem;
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI KETODERM Krem % 2 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: KETODERM Krem % 2 her bir gramında 20 mg ketokonazol içerir. Yardımcı maddeler: 1 gram krem;
KISA ÜRÜN BİLGİSİ. 3.FARMASÖTİK FORM Krem Beyaz, homojen, hemen,hemen kokusuz krem (yağ içinde su emülsiyonu).
 KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI NUTRAPLUS KREM %10 2.KALİTATİF ve KANTİTATİF BİLEŞİM Etkin madde: Her 1g krem içerisinde: Üre 100 mg Yardımcı maddeler: Metil parahidroksibenzoat (E218) 1.8
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI NUTRAPLUS KREM %10 2.KALİTATİF ve KANTİTATİF BİLEŞİM Etkin madde: Her 1g krem içerisinde: Üre 100 mg Yardımcı maddeler: Metil parahidroksibenzoat (E218) 1.8
KULLANMA TALİMATI. Bu ilacı kullanmaya başlamadan önce bu KULLANMA TALİMATINI dikkatlice okuyunuz, çünkü sizin için önemli bilgiler içermektedir.
 KULLANMA TALİMATI AMBREKS PEDİATRİK şurup Ağızdan alınır. Etkin madde: 5 ml (1 ölçek) şurup solüsyonu, 15 mg ambroksol HCl içerir. Yardımcı maddeler: Sorbitol % 70 solüsyonu, metil paraben, propil paraben,
KULLANMA TALİMATI AMBREKS PEDİATRİK şurup Ağızdan alınır. Etkin madde: 5 ml (1 ölçek) şurup solüsyonu, 15 mg ambroksol HCl içerir. Yardımcı maddeler: Sorbitol % 70 solüsyonu, metil paraben, propil paraben,
KULLANMA TALİMATI. Bu ilacı kullanmaya başlamadan önce bu KULLANMA TALİMATINI dikkatlice okuyunuz. Çünkü sizin için önemli bilgiler içermektedir.
 KULLANMA TALİMATI DROPOLEV 60 mg/ml ORAL DAMLA, 30 ml Ağız yolu ile kullanılır. Etkin madde: Her 1 ml çözelti 60 mg levodropropizin içerir. Yardımcı maddeler: Metil paraben sodyum, propilen glikol, sukroz,
KULLANMA TALİMATI DROPOLEV 60 mg/ml ORAL DAMLA, 30 ml Ağız yolu ile kullanılır. Etkin madde: Her 1 ml çözelti 60 mg levodropropizin içerir. Yardımcı maddeler: Metil paraben sodyum, propilen glikol, sukroz,
KISA ÜRÜN BİLGİSİ. 1. BEŞERİ TIBBİ ÜRÜNÜN ADI BUTAMCOD 7.5 mg/5 ml Şurup
 1. BEŞERİ TIBBİ ÜRÜNÜN ADI BUTAMCOD 7.5 mg/5 ml Şurup KISA ÜRÜN BİLGİSİ 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Butamirat sitrat Yardımcı maddeler: Sorbitol % 70 Etanol Sakarin sodyum Benzoik asit
1. BEŞERİ TIBBİ ÜRÜNÜN ADI BUTAMCOD 7.5 mg/5 ml Şurup KISA ÜRÜN BİLGİSİ 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Butamirat sitrat Yardımcı maddeler: Sorbitol % 70 Etanol Sakarin sodyum Benzoik asit
KISA ÜRÜN BİLGİSİ. 1. BEŞERİ TIBBİ ÜRÜNÜN ADI HEPA-MERZ İnfüzyon Konsantresi
 1. BEŞERİ TIBBİ ÜRÜNÜN ADI HEPA-MERZ İnfüzyon Konsantresi KISA ÜRÜN BİLGİSİ 2. KALİTATİF VE KANTİTATİF BİLEŞİMİ Etkin madde: 1 ampul (10 ml), 5,0 g L-ornitin L-aspartat içermektedir. Yardımcı maddeler:
1. BEŞERİ TIBBİ ÜRÜNÜN ADI HEPA-MERZ İnfüzyon Konsantresi KISA ÜRÜN BİLGİSİ 2. KALİTATİF VE KANTİTATİF BİLEŞİMİ Etkin madde: 1 ampul (10 ml), 5,0 g L-ornitin L-aspartat içermektedir. Yardımcı maddeler:
KISA ÜRÜN BİLGİSİ. 3. FARMASÖTİK FORM Film Tablet Açık sarı renkli, her iki yüzü düz, oblong, bikonveks film kaplı tabletler.
 KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI OSTEOFLEX Film Tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin Maddeler: Glukozamin Sülfat Bunda: Serbest Glukozamin (kabuklu deniz hayvanından elde edilen)
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI OSTEOFLEX Film Tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin Maddeler: Glukozamin Sülfat Bunda: Serbest Glukozamin (kabuklu deniz hayvanından elde edilen)
KISA ÜRÜN BĐLGĐSĐ. 67 mg. 101 mg. 68 mg. 86 mg. 59 mg. 105 mg
 KISA ÜRÜN BĐLGĐSĐ 1. BEŞERĐ TIBBĐ ÜRÜNÜN ADI KETOSTERĐL Film tablet 2. KALĐTATĐF VE KANTĐTATĐF BĐLEŞĐM Etkin madde: (RS)-3-metil-2-okso-valerat (DL-Đzolösin α-ketoanaloğu) kalsiyum tuzu 4-metil-2-okso-valerik
KISA ÜRÜN BĐLGĐSĐ 1. BEŞERĐ TIBBĐ ÜRÜNÜN ADI KETOSTERĐL Film tablet 2. KALĐTATĐF VE KANTĐTATĐF BĐLEŞĐM Etkin madde: (RS)-3-metil-2-okso-valerat (DL-Đzolösin α-ketoanaloğu) kalsiyum tuzu 4-metil-2-okso-valerik
KISA ÜRÜN BİLGİSİ. Yardımcı maddeler: Polietilen glikol g Polietilen glikol g. Setil alkol g.
 KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI DERİVERİN Merhem 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: 25 gram kremde; Aluminyum hidroksid jel (kuru)...2.50 g. Çinko oksid...1.25 g. Borik asid...1.25
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI DERİVERİN Merhem 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: 25 gram kremde; Aluminyum hidroksid jel (kuru)...2.50 g. Çinko oksid...1.25 g. Borik asid...1.25
KISA ÜRÜN BİLGİSİ. 1. BEŞERİ TIBBİ ÜRÜNÜN ADI VENDİOS 600 mg Tablet
 KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI VENDİOS 600 mg Tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Her tablette; Diosmin 600 mg Yardımcı maddeler: Yardımcı maddeler için bölüm 6.1. e bakınız.
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI VENDİOS 600 mg Tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Her tablette; Diosmin 600 mg Yardımcı maddeler: Yardımcı maddeler için bölüm 6.1. e bakınız.
KuLLANMA TALİMATI. ROVAMYCINE 3 MIU film kaplı tablet Oral yoldan kullanılır.
 KuLLANMA TALİMATI ROVAMYCINE 3 MIU film kaplı tablet Oral yoldan kullanılır. Etkin madde: Her bir tablet 3 000 000 IU spiramisin içerir. Yardımcı maddeler: Snowflake 12019 Maizena, Hidroksipropil Selüloz,
KuLLANMA TALİMATI ROVAMYCINE 3 MIU film kaplı tablet Oral yoldan kullanılır. Etkin madde: Her bir tablet 3 000 000 IU spiramisin içerir. Yardımcı maddeler: Snowflake 12019 Maizena, Hidroksipropil Selüloz,
SOMAVERT 10 mg Enjeksiyonluk Çözelti İçin Toz İçeren Flakon ve Çözücü
 FORMÜLÜ: SOMAVERT 10 mg Enjeksiyonluk Çözelti İçin Toz İçeren Flakon ve Çözücü Etken madde olarak 10 mg pegvisomant ve yardımcı maddeler olarak 1.36 mg glisin, 36.0 mg mannitol, 1.04 mg sodyum fosfat dibazik
FORMÜLÜ: SOMAVERT 10 mg Enjeksiyonluk Çözelti İçin Toz İçeren Flakon ve Çözücü Etken madde olarak 10 mg pegvisomant ve yardımcı maddeler olarak 1.36 mg glisin, 36.0 mg mannitol, 1.04 mg sodyum fosfat dibazik
KULLANMA TALĐMATI. Bu ilacı kullanmaya başlamadan önce bu KULLANMA TALĐMATINI dikkatlice okuyunuz, çünkü sizin için önemli bilgiler içermektedir.
 KULLANMA TALĐMATI TERBĐSĐL %1 sprey Cilt üzerine uygulanır. Etkin madde: 30 ml çözeltide 300 mg terbinafin hidroklorür bulunur. Yardımcı maddeler: Setomakragol 1000, propilen glikol, etanol (%96), deiyonize
KULLANMA TALĐMATI TERBĐSĐL %1 sprey Cilt üzerine uygulanır. Etkin madde: 30 ml çözeltide 300 mg terbinafin hidroklorür bulunur. Yardımcı maddeler: Setomakragol 1000, propilen glikol, etanol (%96), deiyonize
08.11.2008 VİTAMİN D VE İMMÜN SİSTEM VİTAMİN D
 VİTAMİN D VE İMMÜN SİSTEM VİTAMİN D Vitamin D ve İmmün Sistem İnsülin Sekresyonuna Etkisi Besinlerde D Vitamini Makaleler Vitamin D, normal bir kemik gelişimi ve kalsiyum-fosfor homeostazisi için elzem
VİTAMİN D VE İMMÜN SİSTEM VİTAMİN D Vitamin D ve İmmün Sistem İnsülin Sekresyonuna Etkisi Besinlerde D Vitamini Makaleler Vitamin D, normal bir kemik gelişimi ve kalsiyum-fosfor homeostazisi için elzem
Kurutulmuş Hedera helix folium (Duvar sarmaşığı yaprağı) ekstresi 0.7 gram (5-7.5:1) Ekstraksiyon solvanı (Etanol)
 KISA ÜRÜN BİLGİLERİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI PROSPAN Şurup 2. KALİTATİF VE KANTİTATİF BİLEŞİMİ Etkin madde : 100 ml şurup aşağıdakileri içerir: Kurutulmuş Hedera helix folium (Duvar sarmaşığı yaprağı)
KISA ÜRÜN BİLGİLERİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI PROSPAN Şurup 2. KALİTATİF VE KANTİTATİF BİLEŞİMİ Etkin madde : 100 ml şurup aşağıdakileri içerir: Kurutulmuş Hedera helix folium (Duvar sarmaşığı yaprağı)
ÜRÜN BİLGİSİ. CARDOVOL 5 mg/5 ml İ.V. Enjeksiyonluk Çözelti İçeren Ampul
 1. ÜRÜN ADI ÜRÜN BİLGİSİ CARDOVOL 5 mg/5 ml İ.V. Enjeksiyonluk Çözelti İçeren Ampul 2. BİLEŞİM Etkin madde: Metoprolol tartarat 5 mg 3. TERAPÖTİK ENDİKASYONLAR Supraventriküler taşiaritmiler. Şüphelenilen
1. ÜRÜN ADI ÜRÜN BİLGİSİ CARDOVOL 5 mg/5 ml İ.V. Enjeksiyonluk Çözelti İçeren Ampul 2. BİLEŞİM Etkin madde: Metoprolol tartarat 5 mg 3. TERAPÖTİK ENDİKASYONLAR Supraventriküler taşiaritmiler. Şüphelenilen
KISA ÜRÜN BİLGİSİ. Her iki yüzünde de ELLA kodu kazınmış bulunan, beyaz renkte, yuvarlak, tablet.
 KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI ELLA 30mg Tablet. 2. KALİTATİF VE KANTİTATİF BİLEŞİMİ Etkin madde: Ulipristal asetat Yardımcı maddeler: Laktoz monohidrat Kroskarmeloz sodyum 30 mg 237 mg 15
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI ELLA 30mg Tablet. 2. KALİTATİF VE KANTİTATİF BİLEŞİMİ Etkin madde: Ulipristal asetat Yardımcı maddeler: Laktoz monohidrat Kroskarmeloz sodyum 30 mg 237 mg 15
KISA ÜRÜN BİLGİSİ. Uygulama şekli: Tabletler çiğnenmeden yeterli miktarda sıvı, örneğin bir bardak su ile, yutulmalıdır.
 KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI TİREBRANT FORT 200 mg Tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Her bir tablet 200 mg Trimebutin Maleat içerir. Yardımcı maddeler: Laktoz monohidrat
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI TİREBRANT FORT 200 mg Tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Her bir tablet 200 mg Trimebutin Maleat içerir. Yardımcı maddeler: Laktoz monohidrat
KISA ÜRÜN BİLGİSİ. 1. BEŞERİ TIBBİ ÜRÜNÜN ADI TANTUM VERDE gargara
 1. BEŞERİ TIBBİ ÜRÜNÜN ADI TANTUM VERDE gargara KISA ÜRÜN BİLGİSİ 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: 120 ml gargara içinde 180 mg benzidamin HCl bulunur. Yardımcı madde(ler): 120 ml de, Metil
1. BEŞERİ TIBBİ ÜRÜNÜN ADI TANTUM VERDE gargara KISA ÜRÜN BİLGİSİ 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: 120 ml gargara içinde 180 mg benzidamin HCl bulunur. Yardımcı madde(ler): 120 ml de, Metil
Kısa Ürün Bilgisi. 1. BEŞERİ TIBBİ ÜRÜNÜN ADI NİMELİD 100 mg TABLET
 Kısa Ürün Bilgisi 1. BEŞERİ TIBBİ ÜRÜNÜN ADI NİMELİD 100 mg TABLET 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Her bir tablet 100 mg Nimesulide (mikronize) içermektedir. Yardımcı madde(ler): Laktoz
Kısa Ürün Bilgisi 1. BEŞERİ TIBBİ ÜRÜNÜN ADI NİMELİD 100 mg TABLET 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Her bir tablet 100 mg Nimesulide (mikronize) içermektedir. Yardımcı madde(ler): Laktoz
KISA ÜRÜN BİLGİLERİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI. BATTICON Pomad. 2. KALİTATİF VE KANTİTATİF BİLEŞİM 100 g da: Etkin Madde Povidon iyot 30/06
 KISA ÜRÜN BİLGİLERİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI BATTICON Pomad 2. KALİTATİF VE KANTİTATİF BİLEŞİM 100 g da: Etkin Madde Povidon iyot 30/06 10.00 g Yardımcı Maddeler Yardımcı maddeler için 6.1 e bakınız.
KISA ÜRÜN BİLGİLERİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI BATTICON Pomad 2. KALİTATİF VE KANTİTATİF BİLEŞİM 100 g da: Etkin Madde Povidon iyot 30/06 10.00 g Yardımcı Maddeler Yardımcı maddeler için 6.1 e bakınız.
4.3. Kontrendikasyonlar Bileşenlerden herhangi birine karşı önceden oluşmuş aşırı duyarlılık durumlarında kontrendikedir.
 KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI GİSMOTAL 200 mg FORT tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Her bir tablet 200 mg trimebutin maleat içerir. Yardımcı maddeler: Laktoz monohidrat
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI GİSMOTAL 200 mg FORT tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Her bir tablet 200 mg trimebutin maleat içerir. Yardımcı maddeler: Laktoz monohidrat
KISA ÜRÜN BİLGİSİ. 1 uygulama (ağız kısmından çıkan doz): Siklesonid.80 mikrogram
 KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI ALVESCO 80 mikrogram çözelti içeren inhalasyon aerosolü 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: 1 uygulama (ağız kısmından çıkan doz): Siklesonid.80
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI ALVESCO 80 mikrogram çözelti içeren inhalasyon aerosolü 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: 1 uygulama (ağız kısmından çıkan doz): Siklesonid.80
KISA ÜRÜN BĐLGĐSĐ. 4.1. Terapötik endikasyonlar Çeşitli nedenlere bağlı kuru öksürüğün (nonprodüktif öksürük) semptomatik tedavisinde endikedir.
 KISA ÜRÜN BĐLGĐSĐ 1. BEŞERĐ TIBBĐ ÜRÜNÜN ADI PULMOREST 30mg/5ml şurup 2. KALĐTATĐF VE KANTĐTATĐF BĐLEŞĐM Etkin madde: 1 ml şurup için: Levodropropizin 6,0 mg Yardımcı maddeler: Sakkaroz Metil paraben (E218)
KISA ÜRÜN BĐLGĐSĐ 1. BEŞERĐ TIBBĐ ÜRÜNÜN ADI PULMOREST 30mg/5ml şurup 2. KALĐTATĐF VE KANTĐTATĐF BĐLEŞĐM Etkin madde: 1 ml şurup için: Levodropropizin 6,0 mg Yardımcı maddeler: Sakkaroz Metil paraben (E218)
KORELASYON VE REGRESYON ANALİZİ
 KORELASON VE REGRESON ANALİZİ rd. Doç. Dr. S. Kenan KÖSE İki ya da daha çok değişken arasında ilişki olup olmadığını, ilişki varsa yönünü ve gücünü inceleyen korelasyon analizi ile değişkenlerden birisi
KORELASON VE REGRESON ANALİZİ rd. Doç. Dr. S. Kenan KÖSE İki ya da daha çok değişken arasında ilişki olup olmadığını, ilişki varsa yönünü ve gücünü inceleyen korelasyon analizi ile değişkenlerden birisi
RHEOMACRODEX damar içi yoldan uygulanan berrak, renksiz bir çözeltidir.
 KULLANMA TALİMATI RHEOMACRODEX %10 - İzotonik sodyum klorür solüsyonunda (Cam şişede) Damar yolundan kullanılır Etkin maddeler: Yardımcı maddeler: Her bir litre çözelti 9 gram sodyum klorür ve 10 gram
KULLANMA TALİMATI RHEOMACRODEX %10 - İzotonik sodyum klorür solüsyonunda (Cam şişede) Damar yolundan kullanılır Etkin maddeler: Yardımcı maddeler: Her bir litre çözelti 9 gram sodyum klorür ve 10 gram
KULLANMA TALİMATI. Bu ilacı kullanmaya başlamadan önce bu KULLANMA TALİMATINI dikkatlice okuyunuz, çünkü sizin için önemli bilgiler içermektedir.
 PATANOL S %0.2 steril oftalmik çözelti Göze damlatılarak uygulanır. KULLANMA TALİMATI Etkin madde: 2 mg/ml olopatadin e eşdeğer 2.22 mg/ml olopatadin hidroklorür Yardımcı maddeler: Benzalkonyum klorür,
PATANOL S %0.2 steril oftalmik çözelti Göze damlatılarak uygulanır. KULLANMA TALİMATI Etkin madde: 2 mg/ml olopatadin e eşdeğer 2.22 mg/ml olopatadin hidroklorür Yardımcı maddeler: Benzalkonyum klorür,
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI. SINECOD şurup 2. KALİTATİF VE KANTİTATİF BİLEŞİM
 KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI SINECOD şurup 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Her 5 ml şurup, 7,5 mg butamirat sitrat (1.5 mg/ml) içerir. Yardımcı maddeler: Sorbitol, gliserol,
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI SINECOD şurup 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Her 5 ml şurup, 7,5 mg butamirat sitrat (1.5 mg/ml) içerir. Yardımcı maddeler: Sorbitol, gliserol,
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI. JODID 200 mikrogram Tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİM
 KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI JODID 200 mikrogram Tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Her bir tablet 200 mikrogram iyodüre eşdeğer 261.6 mikrogram potasyum iyodür içerir.
KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI JODID 200 mikrogram Tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Her bir tablet 200 mikrogram iyodüre eşdeğer 261.6 mikrogram potasyum iyodür içerir.
KULLANMA TALİMATI. Bu ilacı kullanmaya başlamadan önce bu KULLANMA TALİMATINI dikkatlice okuyunuz, çünkü sizin için önemli bilgiler içermektedir.
 SABRİL 500 mg saşe Ağızdan alınır. KULLANMA TALİMATI Etkin madde: Bir saşede 500 mg vigabatrin Yardımcı madde(ler): Povidon Bu ilacı kullanmaya başlamadan önce bu KULLANMA TALİMATINI dikkatlice okuyunuz,
SABRİL 500 mg saşe Ağızdan alınır. KULLANMA TALİMATI Etkin madde: Bir saşede 500 mg vigabatrin Yardımcı madde(ler): Povidon Bu ilacı kullanmaya başlamadan önce bu KULLANMA TALİMATINI dikkatlice okuyunuz,
BEBEK FORMÜLLERİ TEBLİĞİ
 Amaç BEBEK FORMÜLLERİ TEBLİĞİ Yetki Kanunu: Türk Gıda Kodeksi Yönetmeliği Yayımlandığı R.Gazete :04.09.2008-26987 Tebliğ No: 2008/52 Bebek Formülleri Tebliğinde Değişiklik Yapılması Hakkında Tebliğ Yayımlandığı
Amaç BEBEK FORMÜLLERİ TEBLİĞİ Yetki Kanunu: Türk Gıda Kodeksi Yönetmeliği Yayımlandığı R.Gazete :04.09.2008-26987 Tebliğ No: 2008/52 Bebek Formülleri Tebliğinde Değişiklik Yapılması Hakkında Tebliğ Yayımlandığı
Türkiye Ekonomi Politikaları Araştırma Vakfı Değerlendirme Notu Sayfa1
 Sağlık Reformunun Sonuçları İtibariyle Değerlendirilmesi 26-03 - 2009 Tuncay TEKSÖZ Dr. Yalçın KAYA Kerem HELVACIOĞLU Türkiye Ekonomi Politikaları Araştırma Vakfı Türkiye 2004 yılından itibaren sağlık
Sağlık Reformunun Sonuçları İtibariyle Değerlendirilmesi 26-03 - 2009 Tuncay TEKSÖZ Dr. Yalçın KAYA Kerem HELVACIOĞLU Türkiye Ekonomi Politikaları Araştırma Vakfı Türkiye 2004 yılından itibaren sağlık
