4. ATOM VE MOLEKÜL TAYFLARI (Devamı) ÇİZELGELER İki elektronlu atomların L değerleri ve terimleri.
|
|
|
- Oz Sevim
- 5 yıl önce
- İzleme sayısı:
Transkript
1 ÇİZELGELER İki elektronlu atomların L değerleri ve terimleri. Elektronlar L Terimler ss 0 S sp P pp 0,, 2 S, P, D pd, 2, 3 P, D, F dd 0,, 2, 3, 4 S, P, D, F, G df, 2, 3, 4, 5 P, D, F, G, H ff 0,, 2, 3, 4, 5, 6 S, P, D, F, G, H, I
2 Eşdeğer elektronlardan ortaya çıkan terimler. Elektronlar s 2 p 2 p 3 d 2 f 2 S Terimler S, D, 3 P 2 P, 2 D, 4 S S, D, G, 3 P, 3 F S, D, G, I, 3 P, 3 F, 3 H
3 Eşdeğer olmayan elektronlardan ortaya çıkan terimler. Elektronlar ss sp sd pp pd dd Terimler S, 3 P P, 3 P D, 3 D S, P, D, 3 S, 3 P, 3 D P, D, F, 3 P, 3 D, 3 F S, P, D, F, G, 3 S, 3 P, 3 D, 3 F, 3 G
4 Toplam S değeri ve çokluluk. Elektron Sayısı S Çokluluk /2 ikili 2 0, tekli, üçlü 3 /2, 3/2 ikili, dörtlüler 4 0,,2 tekli, üçlü, beşli 5 /2, 3/2, 5/2 ikili, dörtlü, altılı 6 0,, 2, 3 tekli, üçlü, beşli, yedili
5 J Değerleri Terim Tekli İkili Üçlü Dörtlü Beşli Altılı S 0 /2 3/2 2 5/2 P /2, 3/2 0,,2 /2, 3/2, 5/2, 2, 3 3/2, 5/2, 7/2 D 2 3/2, 5/2,2,3 /2, 3/2, 5/2, 7/2 0,,2,3,4 /2, 3/2, 5/2, 7/2, 9/2 F 3 5/2, 7/2 2,3,4 G 4 7/2, 9/2 3,4,5
6 Atomik Terimlerin Soyu: Eğer bir optik tayfa 2 den fazla elektron katılıyorsa, terimlerin sayılarına dikkat edilmelidir. İyonize olmuş bir kükürt atomunu dikkate alalım. Temel konfigürasyon olan 3s 2 3p 3 ün terimleri; 4 S(L=0, S=3/2), 2 D(L=2, S=/2), 2 P(L=, S=/2) dir. Bir 4p elektronu daha ekliyelim (l=, s=/2) ve SI in 3s 2 3p 3 4p sinin terimlerini hesaplayalım. Özgün terimlerin L ve S değerlerine, 4p elektronunun l ve s vektörlerini ekleyiniz. Sonuç olarak; S II 3 P 4 S 2 D 2 P + p S I 3p 3 4p 5p3p 3 P, 3 D, 3 F, P, D, F 3 S, 3 P, 3 D, S, P, D Soylar, ( 4 S) 5 P, ( 2 D) 3 F...v.b olarak gösteririz. Farklı erkelere karşılık gelen ve farklı soylara dayanan 3 ayrı 3 P teriminin, 2 farklı 3 D teriminin ve bir de D teriminin varlığına dikkat ediniz.
7 8) Işınım İçin Seçim Kuralları: Her ne kadar bütün tayf çizgileri belirli düzey arasındaki geçişleri gösteriyorsa da, düzeylerin bütün olası kombinasyonları, gözlenen çizgileri vermezler. Belirli seçim kuralları sağlamalıdır. Dipol ışınımı için bu kuralların en önemlileri Laporte Parite Kuralı ve J üzerindeki sınırlamalardır. Tüm geçiş olasılıkları tüm geçişlerin çizgilerini vermemektedir. Çizgi sayısı, terimler arasındaki geçiş olasılıklarından daha azdır. ) Laporte Parite Kuralı: Parite, her zaman değişmelidir. Parite değişiminden çizgi (geçiş) olur. ΔL=± gibi farklı konfigürasyonlar arasında geçişler olur (ΔL=± kuralı). Buna göre 2p 3 e giren düzeyler, 2p3d ya da 2p3s deki düzeylerle bir araya gelebilir (yani 2p 3 düzeyinden 2p3d ve 2p3s düzeylerine geçiş sözkonusudur), fakat 2p3f ya da 2p3p deki düzeylerle bir araya gelemezler (2p 3 2p3f,2p3p geçişleri yok), çünkü bunlarda ΔL=± kuralı sağlanmamaktadır.(bkz Şekil 52)
8 Şekil 52. Laporte parite kuralına göre yasak geçişe bir örnek
9 2) J deki değişim ± ya da 0 olabilir, fakat J=0 dan J=0 a hiç bir zaman geçiş olamaz. Tüm atomlar (elementler) için bu iki kural genel olarak vardır. Bundan sonraki kurallar ise LS kuplajı gösteren (hafif elementler için) atomlar içindir. Sıkı, LS kuplajı koşulları altında ise; 3) L deki değişim L± e değişebilir ya da değişmez. 4) S değişmemelidir, değişmez. Yani çoklular değişmez. Tekli-Tekli İkili-İkili gecisleri vardir Üçlüden tekliye gibi geçiş yoktur. 3 ve 4 seçim kuralları, oksijen gibi hafif atomların alçak düzeyleri için oldukça geçerlidir; fakat bunlar demir ve titanyum gibi ağır atomlarda geçerli değildirler. Çünkü bunlarda L ve S artık iyi birer kuantum sayısı değildirler. ve 2 seçim kuralları çiğnendiğinde, ışınımın yasaklanmış olduğu söylenir.
10 9) Tayf Çizgilerinin Belirlenmesi, terim Diyagramları: Enerji düzeylerinin saptanarak bir tayfın çözümlenmesi çoğu kez zordur. Bunun için değişik ipuçları kullanılır: Alçak (düşük) sıcaklıklarda yalnızca alçak düzeylere karşılık gelen çizgiler kuvvetli olduklarından sıcaklıkla tayfın görünümünün değişmesi yararlı olabilir ya da Zeeman şekilleri ilgilenilen terimlerin L, S ve J değerlerine bağlı olduğundan, tayf çizgilerinin bir manyetik alandaki yarılmaları (Zeeman olayı) belirlenecek terimin cinsini verebilir. Farklı S değerli terimler arasındaki geçişlerden çıkan interkombinasyon çizgileri de üçlü ve teklilerin yerini belirlemeye yardımcı olur. Her ne kadar bazı metal iyonlarının yüksek düzey çizgileri tayin edilmişse de, bütün önemli elementlerin nötr ve bir kez iyonlaşmış olanların tayfları çözümlenmiştir. S den daha ağır elementlerin bir kaç izinli çizgisi ve ikinci iyonizasyon durumundan daha yüksek iyonizasyon durumlarına ilişkin soğurma çizgileri yıldız tayflarında gözlenmiştir.
11 Enerji diyagramları çoğu kez yıldız ve bulutsulardaki uyartılma mekanizmalarını canlandırabilmemize yardım eder. Böylesi bir diyagram yapabilmek için terim tabloları kullanılır. Oksijen (O III) İçin Terim Diyagramı: O III : s 2 2s 2 2p 2 Şekil 53 : O III için böylesi bir diyagramın bir parçasını vermektedir. En üstteki yatay çizgi 54,7 ev luk iyonizasyon potansiyelini göstermektedir. S, D düzeyleri Metastable düzeylerdir. ( S, D, 3 P S D, D 3 P).
12 Şekil 53. OIII için terim diyagramı
13 3d den 3p ye ve 3s den 3p ye geçişler, O yıldızlarında (O tayf türünden yıldızlarda) gözlenen çizgileri temsil ederler. Bu yıldızlarda sıcaklık O IV çizgilerini uyaracak kadar yüksektir. 3 P temel terimi herhangi bir yolla 2p3s veya 2p3d düzeyine uyartılırsa, temel düzeye düşme, önce S 0 düzeyine olur ve burada uzun süre kalır, ardından D 2 düzeyine ve sonunda 3 P temel düzeye gelir. Ancak bu geçişlerden oluşan çizgiler laboratuarda elde edilememektedir. Dolayısıyla bu geçişler yasaklanmıştır (laboratuardaki basınç şartlarından dolayı geçiş olmaz). Ne var ki bu çizgiler, bulutsularda görülmektedir. Bulutsularda gaz çok seyrek, basınç az olduğundan düzeyde kalma uzun sürelidir (ömür uzun) bulutsularda yoğunluk az dolayısıyla yasak geçişler bulutsularda mümkün olmaktadır. S D S 3 P Yasak gecisler (Laboratuvarda S D Yasak geçişi [ 5007 O ] ile gösterilir. mümkün olmuyor)
14 0) Yasaklanmış Geçişler: 2p 2 temel konfigürasyonu 3 P, D ve S terimlerini kapsar ve 3p3s ya da 2p3p lik uyartılmış düzeylerin çok altında yer alır. S den D ye ya da D den 3 P ye geçişlerde (2p 2 konfigürasyonunda) Laporte kuralı ihlal edilir (l=±) ve bunlara yasaklanmış çizgiler denir. OIII deki D ve S düzeyleri (2,48 ve 5,3 voltluk) kararsız düzeyler olarak adlandırılırlar. 2p3s 3 P gibi olağan bir yüksek düzeyde bulunan bir atom, 0-8 sn gibi kısa bir sürede kademeli olarak aşağıya inecektir. Eğer bu atom alçak düzeyli kararsız düzeylerden birinde kendini bulursa, salma yaparak daha düşük bir düzeye geçmeden önce orada bir saniye kadar kalabilir. Şekil 54 : Yasaklanmış çizgiler için geçiş şeması. Menzel, Payne ve Boyce, yasaklanmış çizgiler için aşağıdaki gösterimleri önermişlerdir: p 2, p 4 için S D geçişi : Auroral Geçiş D 3 P geçişi : Nebular Geçiş S 3 P geçişi : Transauroral Geçiş
15
16 Bir p 2 ya da p 4 konfigürasyonunda S ve D arasındaki geçişler auroral geçişler olarak adlandırılırlar. Çünkü geceleri kutup ışımasında görülen 5577 çizgisi bu türdür. Oksijenin uyartılması ve eski duruma geçişleri sonucu oluşan yeşilimtrak ışınımdır. S D geçişi kutuplarda, belli açılarda yeryüzüne gelen evren ışınımlarıdır. Gaz bulutsularındaki en kuvvetli çizgiler D 3 P geçişlerinden ortaya çıkar; bu nedenle bunlara nebular geçişler denir. Nebular geçişler özellikle bulutsulardaki yeşil rengi veren geçişlerdir. S 3 P geçişi gözlenmemiştir. En zayıf, olasılığı en düşük olan geçiştir. Transauroral çizgi S 3 P geçişini belirler ve genellikle zayıftır. 2p 3 OII için; 2 P 2 D geçişi Auroral Geçiş 2 D 4 S geçişi Nebular Geçiş 2 P 4 S geçişi Transauroral Geçiş tir.
17 Edlen tarafından Güneş in renk küresinde belirlenen çizgiler, genellikle temel terimli düzeyler arasındaki geçişleri temsil ederler. [ ] işareti yasaklanmış çizgileri göstermek için kullanılır. Yasaklanmış çizgilerden çok az bir kısmı deneylerle elde edilebilir. Genellikle bunlar, tayfın çözümlenmesinden sonra tahmin edilebilirler. Eğer çözümleme kararsız düzeylerin yerlerini belirleyebilecek kadar tamam değilse, bir eş-elektronik dizisindeki erke düzeylerinin ekstrapolasyonu kullanılabilir.
18 Tayf Çizgilerini Genişleten Etkiler:. Atomun ince yapısından dolayı genişleme 2. Zeeman olayından dolayı genişleme: H manyetik alandan dolayı tayf çizgisinin yeniden başka çizgilere yarılmasıdır. Bu da çizginin genişlemesine etken olur. 3. Elektriksel alandan ileri gelen çizgi genişlemesi (Paschen-Back olayı) olmaktadır.
19 Burada x-ışınları tayfı ve ince yapı konularını incelemeyeceğiz. Zeeman ve Paschen-Back etkileri tayfların incelenmesinde önemlidir. Bir çizginin bileşenlerinin sayı ve konumları, alt ve üst düzeylerin L, S ve J değerlerine bağlıdır. Bundan başka bu bileşenler belirgin uçlaşma ve yeğinlik bağıntısı gösterirler. Zeeman etkisinin astrofiziksel uygulamaları güneş lekelerinin tayflarının ve A-Pec yıldızlarının açıklamalarında yatmaktadır. Tayf çizgileri manyetik alanlarla olduğu gibi elektriksel alanlarla da genişlemeye, hatta yarılmaya uğrayabilirler. Yıldız atmosferlerinde büyük elektriksel alanlar yoktur, fakat yüklü parçacıların hızla hareketi bir ışınım yapan atomun yanında kuvvetli mikroskopik elektriksel alanlar yaratabilir. Bu alanlarla hidrojen ve helyum çizgileri genişlerler.
4. ATOM VE MOLEKÜL TAYFLARI (Devamı)
 n = 1, 2, 3, 4, 5, 6, 7,... Kabuk : K, L, M, N, O, P, Q,... l=0 l=1 l=2 Bu kabuklar, x-ışınlarıyla kesin olarak saptanmıştır. Yani, elektronların böyle kabuklar üzerindeki dağılımları röntgen spektrumlarından
n = 1, 2, 3, 4, 5, 6, 7,... Kabuk : K, L, M, N, O, P, Q,... l=0 l=1 l=2 Bu kabuklar, x-ışınlarıyla kesin olarak saptanmıştır. Yani, elektronların böyle kabuklar üzerindeki dağılımları röntgen spektrumlarından
4. ATOM VE MOLEKÜL TAYFLARI
 4. ATOM VE MOLEKÜL TAYFLARI 4.1 Giriş Modern kuantum kuramı gelişmeden önce, tayfların açıklanması ancak temel düzeyin altında gelişti. Güneş benzeri yıldızların tayflarında görülen çoğu çizgilerin kimyasal
4. ATOM VE MOLEKÜL TAYFLARI 4.1 Giriş Modern kuantum kuramı gelişmeden önce, tayfların açıklanması ancak temel düzeyin altında gelişti. Güneş benzeri yıldızların tayflarında görülen çoğu çizgilerin kimyasal
ASTRONOMİ II 8. KONU: Tayfsal Sınıflama
 ASTRONOMİ II 8. KONU: Tayfsal Sınıflama Hazırlayan: Doç. Dr. Tolgahan KILIÇOĞLU Dikkat: Bu ders notu dersin tamamını içermez! 8.3 Boltzmann ve Saha Kanunları 8.3.1 Boltzmann Kanunu Boltzmann kanunu bir
ASTRONOMİ II 8. KONU: Tayfsal Sınıflama Hazırlayan: Doç. Dr. Tolgahan KILIÇOĞLU Dikkat: Bu ders notu dersin tamamını içermez! 8.3 Boltzmann ve Saha Kanunları 8.3.1 Boltzmann Kanunu Boltzmann kanunu bir
tayf kara cisim ışınımına
 13. ÇİZGİ OLUŞUMU Yıldızın iç kısımlarından atmosfere doğru akan ışınım, dalga boyunun yaklaşık olarak sürekli bir fonksiyonudur. Çünkü iç bölgede sıcaklık gradyenti (eğimi) küçüktür ve madde ile ışınım
13. ÇİZGİ OLUŞUMU Yıldızın iç kısımlarından atmosfere doğru akan ışınım, dalga boyunun yaklaşık olarak sürekli bir fonksiyonudur. Çünkü iç bölgede sıcaklık gradyenti (eğimi) küçüktür ve madde ile ışınım
ATOMİK YAPI. Elektron Yükü=-1,60x10-19 C Proton Yükü=+1,60x10-19 C Nötron Yükü=0
 ATOMİK YAPI Atom, birkaç türü birleştiğinde çeşitli molekülleri, bir tek türü ise bir kimyasal öğeyi oluşturan parçacıktır. Atom, elementlerin özelliklerini taşıyan en küçük yapı birimi olup çekirdekteki
ATOMİK YAPI Atom, birkaç türü birleştiğinde çeşitli molekülleri, bir tek türü ise bir kimyasal öğeyi oluşturan parçacıktır. Atom, elementlerin özelliklerini taşıyan en küçük yapı birimi olup çekirdekteki
AST404 GÖZLEMSEL ASTRONOMİ HAFTALIK UYGULAMA DÖKÜMANI
 AST404 GÖZLEMSEL ASTRONOMİ HAFTALIK UYGULAMA DÖKÜMANI Öğrenci Numarası: I. / II. Öğretim: Adı Soyadı: İmza: HAFTA 08 1. KONU: TAYFSAL GÖZLEM 1 2. İÇERİK Doppler Etkisi Kirchhoff Yasaları Karacisim Işınımı
AST404 GÖZLEMSEL ASTRONOMİ HAFTALIK UYGULAMA DÖKÜMANI Öğrenci Numarası: I. / II. Öğretim: Adı Soyadı: İmza: HAFTA 08 1. KONU: TAYFSAL GÖZLEM 1 2. İÇERİK Doppler Etkisi Kirchhoff Yasaları Karacisim Işınımı
ATOMİK YAPI. Elektron Yükü=-1,60x10-19 C Proton Yükü=+1,60x10-19 C Nötron Yükü=0
 ATOMİK YAPI Elektron Yükü=-1,60x10-19 C Proton Yükü=+1,60x10-19 C Nötron Yükü=0 Elektron Kütlesi 9,11x10-31 kg Proton Kütlesi Nötron Kütlesi 1,67x10-27 kg Bir kimyasal elementin atom numarası (Z) çekirdeğindeki
ATOMİK YAPI Elektron Yükü=-1,60x10-19 C Proton Yükü=+1,60x10-19 C Nötron Yükü=0 Elektron Kütlesi 9,11x10-31 kg Proton Kütlesi Nötron Kütlesi 1,67x10-27 kg Bir kimyasal elementin atom numarası (Z) çekirdeğindeki
6. UYARTILMA, İYONLAŞMA VE AYRIŞMA
 6. UYARTILMA, İYONLAŞMA VE AYRIŞMA Astrofizik, 1500 2000 dereceden milyonlarca dereceye kadar sıcaklıktaki maddelerin özellikleri ile ilgilenir. İlk yaklaşım olarak ilgi, durgun durum koşullarında toplanmıştır.
6. UYARTILMA, İYONLAŞMA VE AYRIŞMA Astrofizik, 1500 2000 dereceden milyonlarca dereceye kadar sıcaklıktaki maddelerin özellikleri ile ilgilenir. İlk yaklaşım olarak ilgi, durgun durum koşullarında toplanmıştır.
İNSTAGRAM:kimyaci_glcn_hoca
 MODERN ATOM TEORİSİ ATOMUN KUANTUM MODELİ Bohr atom modeli 1 H, 2 He +, 3Li 2+ vb. gibi tek elektronlu atom ve iyonların çizgi spektrumlarını başarıyla açıklamıştır.ancak çok elektronlu atomların çizgi
MODERN ATOM TEORİSİ ATOMUN KUANTUM MODELİ Bohr atom modeli 1 H, 2 He +, 3Li 2+ vb. gibi tek elektronlu atom ve iyonların çizgi spektrumlarını başarıyla açıklamıştır.ancak çok elektronlu atomların çizgi
Yrd. Doç. Dr. H. Hasan YOLCU. hasanyolcu.wordpress.com
 Yrd. Doç. Dr. H. Hasan YOLCU hasanyolcu.wordpress.com En az iki atomun belli bir düzenlemeyle kimyasal bağ oluşturmak suretiyle bir araya gelmesidir. Aynı atomda olabilir farklı atomlarda olabilir. H 2,
Yrd. Doç. Dr. H. Hasan YOLCU hasanyolcu.wordpress.com En az iki atomun belli bir düzenlemeyle kimyasal bağ oluşturmak suretiyle bir araya gelmesidir. Aynı atomda olabilir farklı atomlarda olabilir. H 2,
SCHRÖDİNGER: Elektronun yeri (yörüngesi ve orbitali) birer dalga fonksiyonu olan n, l, m l olarak ifade edilen kuantum sayıları ile belirlenir.
 . ATOMUN KUANTUM MODELİ SCHRÖDİNGER: Elektronun yeri (yörüngesi ve orbitali) birer dalga fonksiyonu olan n, l, m l olarak ifade edilen kuantum sayıları ile belirlenir. Orbital: Elektronların çekirdek etrafında
. ATOMUN KUANTUM MODELİ SCHRÖDİNGER: Elektronun yeri (yörüngesi ve orbitali) birer dalga fonksiyonu olan n, l, m l olarak ifade edilen kuantum sayıları ile belirlenir. Orbital: Elektronların çekirdek etrafında
Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı
 Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani madde yani bileşik
Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani madde yani bileşik
ELEMETLER VE BİLEŞİKLER ELEMENTLER VE SEMBOLLERİ
 ELEMENTLER VE SEMBOLLERİ Elementler Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere element denir. Elementler çok sayıda
ELEMENTLER VE SEMBOLLERİ Elementler Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere element denir. Elementler çok sayıda
Bazı atomlarda proton sayısı aynı olduğu halde nötron sayısı değişiktir. Bunlara izotop denir. Şekil II.1. Bir atomun parçaları
 8 II. MİNERALLER II.1. Element ve Atom Elementlerin en ufak parçasına atom denir. Atomlar, proton, nötron ve elektron gibi taneciklerden oluşur (Şekil II.1). Elektron negatif, proton pozitif elektrik yüküne
8 II. MİNERALLER II.1. Element ve Atom Elementlerin en ufak parçasına atom denir. Atomlar, proton, nötron ve elektron gibi taneciklerden oluşur (Şekil II.1). Elektron negatif, proton pozitif elektrik yüküne
MADDENİN YAPISI VE ÖZELLİKLERİ ATOM
 MADDENİN YAPISI VE ÖZELLİKLERİ ATOM ATOMUN YAPISI Elementlerin tüm özelliğini gösteren en küçük parçasına atom denir. Atomu oluşturan parçacıklar farklı yüklere sa-hiptir. Atomda bulunan yükler; negatif
MADDENİN YAPISI VE ÖZELLİKLERİ ATOM ATOMUN YAPISI Elementlerin tüm özelliğini gösteren en küçük parçasına atom denir. Atomu oluşturan parçacıklar farklı yüklere sa-hiptir. Atomda bulunan yükler; negatif
AST404 GÖZLEMSEL ASTRONOMİ HAFTALIK UYGULAMA DÖKÜMANI
 AST404 GÖZLEMSEL ASTRONOMİ HAFTALIK UYGULAMA DÖKÜMANI Öğrenci Numarası: I. / II. Öğretim: Adı Soyadı: İmza: HAFTA 09 1. KONU: Tayfsal Analiz II 2. İÇERİK Kirchhoff Kanunları Çizgi Analizi ile Element Tespiti
AST404 GÖZLEMSEL ASTRONOMİ HAFTALIK UYGULAMA DÖKÜMANI Öğrenci Numarası: I. / II. Öğretim: Adı Soyadı: İmza: HAFTA 09 1. KONU: Tayfsal Analiz II 2. İÇERİK Kirchhoff Kanunları Çizgi Analizi ile Element Tespiti
İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA
 İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA İNCELENİR Her tarafında aynı özelliği gösteren, tek bir madde
İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA İNCELENİR Her tarafında aynı özelliği gösteren, tek bir madde
İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA İNCELENİR
 KARIŞIMLAR İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA İNCELENİR Her tarafında aynı özelliği gösteren, tek
KARIŞIMLAR İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA İNCELENİR Her tarafında aynı özelliği gösteren, tek
ATOMLAR ARASI BAĞLAR Doç. Dr. Ramazan YILMAZ
 ATOMLAR ARASI BAĞLAR Doç. Dr. Ramazan YILMAZ Sakarya Üniversitesi, Teknoloji Fakültesi, Metalurji ve Malzeme Mühendisliği Bölümü Esentepe Kampüsü, 54187, SAKARYA Atomlar Arası Bağlar 1 İyonik Bağ 2 Kovalent
ATOMLAR ARASI BAĞLAR Doç. Dr. Ramazan YILMAZ Sakarya Üniversitesi, Teknoloji Fakültesi, Metalurji ve Malzeme Mühendisliği Bölümü Esentepe Kampüsü, 54187, SAKARYA Atomlar Arası Bağlar 1 İyonik Bağ 2 Kovalent
Elektronların Dizilişi ve Kimyasal Özellikleri
 Elektronların Dizilişi ve Kimyasal Özellikleri ELEKTRON ALIŞVERİŞİ VE SONUÇLARI: Helyum (2), neon (10), argon (18)in elektron dağılımları incelendiğinde Eğer bu üç elementin birer elektronu daha olsaydı,
Elektronların Dizilişi ve Kimyasal Özellikleri ELEKTRON ALIŞVERİŞİ VE SONUÇLARI: Helyum (2), neon (10), argon (18)in elektron dağılımları incelendiğinde Eğer bu üç elementin birer elektronu daha olsaydı,
PERİYODİK SİSTEM VE ELEKTRON DİZİLİMLERİ#6
 PERİYODİK SİSTEM VE ELEKTRON DİZİLİMLERİ#6 Periyodik sistemde yatay sıralara Düşey sütunlara.. adı verilir. 1.periyotta element, 2 ve 3. periyotlarda..element, 4 ve 5.periyotlarda.element 6 ve 7. periyotlarda
PERİYODİK SİSTEM VE ELEKTRON DİZİLİMLERİ#6 Periyodik sistemde yatay sıralara Düşey sütunlara.. adı verilir. 1.periyotta element, 2 ve 3. periyotlarda..element, 4 ve 5.periyotlarda.element 6 ve 7. periyotlarda
Elektronların Dağılımı ve Kimyasal Özellikleri
 Elektronların Dağılımı ve Kimyasal Özellikleri Helyum (2), neon (10), argon (18)in elektron dağılımları incelendiğinde Eğer bu üç elementin birer elektronu daha olsaydı, her birinde yeni bir katman oluşacaktı.
Elektronların Dağılımı ve Kimyasal Özellikleri Helyum (2), neon (10), argon (18)in elektron dağılımları incelendiğinde Eğer bu üç elementin birer elektronu daha olsaydı, her birinde yeni bir katman oluşacaktı.
BİLEŞİKLER VE FORMÜLLERİ
 BİLEŞİKLER VE FORMÜLLERİ Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur). Bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere
BİLEŞİKLER VE FORMÜLLERİ Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur). Bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere
BÖLÜM 2 ATOMİK YAPI İÇERİK. Atom yapısı. Bağ tipleri. Chapter 2-1
 BÖLÜM 2 ATOMİK YAPI İÇERİK Atom yapısı Bağ tipleri 1 Atomların Yapıları Atomlar başlıca üç temel atom altı parçacıktan oluşur; Protonlar (+ yüklü) Nötronlar (yüksüz) Elektronlar (-yüklü) Basit bir atom
BÖLÜM 2 ATOMİK YAPI İÇERİK Atom yapısı Bağ tipleri 1 Atomların Yapıları Atomlar başlıca üç temel atom altı parçacıktan oluşur; Protonlar (+ yüklü) Nötronlar (yüksüz) Elektronlar (-yüklü) Basit bir atom
Element ve Bileşikler
 Element ve Bileşikler Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere element denir. Bir elementi oluşturan bütün atomların
Element ve Bileşikler Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere element denir. Bir elementi oluşturan bütün atomların
ATOMUN YAPISI ATOMUN ÖZELLİKLERİ
 ATOM Elementlerin özelliğini taşıyan, en küçük yapı taşına, atom diyoruz. veya, fiziksel ve kimyasal yöntemlerle daha basit birimlerine ayrıştırılamayan, maddenin en küçük birimine atom denir. Helyum un
ATOM Elementlerin özelliğini taşıyan, en küçük yapı taşına, atom diyoruz. veya, fiziksel ve kimyasal yöntemlerle daha basit birimlerine ayrıştırılamayan, maddenin en küçük birimine atom denir. Helyum un
ELEMENTLER VE SEMBOLLERİ
 ELEMENTLER VE SEMBOLLERİ MADDE SAF MADDE ELEMENT BİLEŞİK KARIŞIM HOMOJEN KARIŞIM HETEROJEN KARIŞIM SAF MADDE: Kendisinden başka madde bulundur-mayan maddelere denir. ELEMENT: İçerisinde tek cins atom bulunduran
ELEMENTLER VE SEMBOLLERİ MADDE SAF MADDE ELEMENT BİLEŞİK KARIŞIM HOMOJEN KARIŞIM HETEROJEN KARIŞIM SAF MADDE: Kendisinden başka madde bulundur-mayan maddelere denir. ELEMENT: İçerisinde tek cins atom bulunduran
ELEMENTLER VE BİLEŞİKLER
 ELEMENTLER VE BİLEŞİKLER 1- Elementler ve Elementlerin Özellikleri a) ELEMENTLER Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere
ELEMENTLER VE BİLEŞİKLER 1- Elementler ve Elementlerin Özellikleri a) ELEMENTLER Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere
SU Lise Yaz Okulu 2. Ders, biraz (baya) fizik. Dalgalar Elektromanyetik Dalgalar Kuantum mekaniği Tayf Karacisim ışıması
 SU Lise Yaz Okulu 2. Ders, biraz (baya) fizik Dalgalar Elektromanyetik Dalgalar Kuantum mekaniği Tayf Karacisim ışıması Dalga Nedir Enerji taşıyan bir değişimin bir yöne doğru taşınmasına dalga denir.
SU Lise Yaz Okulu 2. Ders, biraz (baya) fizik Dalgalar Elektromanyetik Dalgalar Kuantum mekaniği Tayf Karacisim ışıması Dalga Nedir Enerji taşıyan bir değişimin bir yöne doğru taşınmasına dalga denir.
Radyoaktif elementin tek başına bulunması, bileşik içinde bulunması, katı, sıvı, gaz, iyon halinde bulunması radyoaktif özelliğini etkilemez.
 RADYOAKTİFLİK Kendiliğinden ışıma yapabilen maddelere radyoaktif maddeler denir. Radyoaktiflik çekirdek yapısıyla ilişkilidir. Radyoaktif bir atom hangi bileşiğin yapısına girerse o bileşiği radyoaktif
RADYOAKTİFLİK Kendiliğinden ışıma yapabilen maddelere radyoaktif maddeler denir. Radyoaktiflik çekirdek yapısıyla ilişkilidir. Radyoaktif bir atom hangi bileşiğin yapısına girerse o bileşiği radyoaktif
MOL KAVRAMI I. ÖRNEK 2
 MOL KAVRAMI I Maddelerin taneciklerden oluştuğunu biliyoruz. Bu taneciklere atom, molekül ya da iyon denir. Atom : Kimyasal yöntemlerle daha basit taneciklere ayrılmayan ve elementlerin yapıtaşı olan taneciklere
MOL KAVRAMI I Maddelerin taneciklerden oluştuğunu biliyoruz. Bu taneciklere atom, molekül ya da iyon denir. Atom : Kimyasal yöntemlerle daha basit taneciklere ayrılmayan ve elementlerin yapıtaşı olan taneciklere
ELEKTRONLARIN DİZİLİMİ, KİMYASAL ÖZELLİKLERİ VE
 ELEKTRONLARIN DİZİLİMİ, KİMYASAL ÖZELLİKLERİ VE ELEMENTLER ELEMENTLER METALLER AMETALLER SOYGAZLAR Hiçbir kimyasal ayırma yöntemi ile kendinden daha basit maddelere ayrıştırılamayan saf maddelere element
ELEKTRONLARIN DİZİLİMİ, KİMYASAL ÖZELLİKLERİ VE ELEMENTLER ELEMENTLER METALLER AMETALLER SOYGAZLAR Hiçbir kimyasal ayırma yöntemi ile kendinden daha basit maddelere ayrıştırılamayan saf maddelere element
ELEMENT VE BİLEŞİKLER
 ELEMENT VE BİLEŞİKLER 1- Elementler ve Elementlerin Özellikleri: a) Elementler: Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere
ELEMENT VE BİLEŞİKLER 1- Elementler ve Elementlerin Özellikleri: a) Elementler: Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere
Yrd.Doç.Dr. Emre YALAMAÇ. Yrd.Doç.Dr. Emre YALAMAÇ İÇERİK
 İÇERİK Elementlere, Bileşiklere ve Karışımlara atomik boyutta bakış Dalton Atom Modeli Atom Fiziğinde Buluşlar - Elektronların Keşfi - Atom Çekirdeği Keşfi Günümüz Atom Modeli Kimyasal Elementler Periyodik
İÇERİK Elementlere, Bileşiklere ve Karışımlara atomik boyutta bakış Dalton Atom Modeli Atom Fiziğinde Buluşlar - Elektronların Keşfi - Atom Çekirdeği Keşfi Günümüz Atom Modeli Kimyasal Elementler Periyodik
Moleküllerarası Etkileşimler, Sıvılar ve Katılar - 11
 Moleküllerarası Etkileşimler, Chemistry, The Central Science, 10th edition Theodore L. Brown; H. Eugene LeMay, Jr.; and Bruce E. Bursten Sıvılar ve Katılar - 11 Maddenin Halleri Maddenin halleri arasındaki
Moleküllerarası Etkileşimler, Chemistry, The Central Science, 10th edition Theodore L. Brown; H. Eugene LeMay, Jr.; and Bruce E. Bursten Sıvılar ve Katılar - 11 Maddenin Halleri Maddenin halleri arasındaki
Yıldızların: Farklı renkleri vardır. Bu, onların farklı sıcaklıklarda olduklarını gösterir. Daha sıcak yıldızlar, ömürlerini daha hızlı tüketirler.
 Yıldızların Hayatı Yıldızların: Farklı renkleri vardır Bu, onların farklı sıcaklıklarda olduklarını gösterir Daha sıcak yıldızlar, ömürlerini daha hızlı tüketirler. Yıldız Oluşum Bölgeleri Evren, yıldız
Yıldızların Hayatı Yıldızların: Farklı renkleri vardır Bu, onların farklı sıcaklıklarda olduklarını gösterir Daha sıcak yıldızlar, ömürlerini daha hızlı tüketirler. Yıldız Oluşum Bölgeleri Evren, yıldız
MALZEME BİLGİSİ DERS 4 DR. FATİH AY.
 MALZEME BİLGİSİ DERS 4 DR. FATİH AY www.fatihay.net fatihay@fatihay.net GEÇEN HAFTA TEMEL KAVRAMLAR ATOMLARDA ELEKTRONLAR PERİYODİK TABLO BÖLÜM II ATOM YAPISI VE ATOMLARARASı BAĞLAR BAĞ KUVVETLERİ VE ENERJİLERİ
MALZEME BİLGİSİ DERS 4 DR. FATİH AY www.fatihay.net fatihay@fatihay.net GEÇEN HAFTA TEMEL KAVRAMLAR ATOMLARDA ELEKTRONLAR PERİYODİK TABLO BÖLÜM II ATOM YAPISI VE ATOMLARARASı BAĞLAR BAĞ KUVVETLERİ VE ENERJİLERİ
Atomlar birleştiği zaman elektron dağılımındaki değişmelerin bir sonucu olarak kimyasal bağlar meydana gelir. Üç çeşit temel bağ vardır:
 Atomlar birleştiği zaman elektron dağılımındaki değişmelerin bir sonucu olarak kimyasal bağlar meydana gelir. Üç çeşit temel bağ vardır: İyonik bağlar, elektronlar bir atomdan diğerine aktarıldığı zaman
Atomlar birleştiği zaman elektron dağılımındaki değişmelerin bir sonucu olarak kimyasal bağlar meydana gelir. Üç çeşit temel bağ vardır: İyonik bağlar, elektronlar bir atomdan diğerine aktarıldığı zaman
ATOM BİLGİSİ Atom Modelleri
 1. Atom Modelleri BÖLÜM2 Maddenin atom adı verilen bir takım taneciklerden oluştuğu fikri çok eskiye dayanmaktadır. Ancak, bilimsel bir (deneye dayalı) atom modeli ilk defa Dalton tarafından ileri sürülmüştür.
1. Atom Modelleri BÖLÜM2 Maddenin atom adı verilen bir takım taneciklerden oluştuğu fikri çok eskiye dayanmaktadır. Ancak, bilimsel bir (deneye dayalı) atom modeli ilk defa Dalton tarafından ileri sürülmüştür.
H-R DİYAGRAMI. Bir yıldızın Hertzsprung-Russell diyagramındaki yeri biliniyorsa, o yıldızın;
 H-R DİYAGRAMI Bir yıldızın Hertzsprung-Russell diyagramındaki yeri biliniyorsa, o yıldızın; Etkin Sıcaklığı Renk ölçeği Tayf Türü Işınım sınıfı Toplam ışınım gücü Mutlak parlaklığı Yüzey çekim ivmesi Uzaklığı
H-R DİYAGRAMI Bir yıldızın Hertzsprung-Russell diyagramındaki yeri biliniyorsa, o yıldızın; Etkin Sıcaklığı Renk ölçeği Tayf Türü Işınım sınıfı Toplam ışınım gücü Mutlak parlaklığı Yüzey çekim ivmesi Uzaklığı
KĠMYASAL ÖZELLĠKLER VE KĠMYASAL BAĞ
 Elektronların Dizilimi ve Kimyasal Özellikler Atomların katmanlarında belirli sayılarda elektron bulunmaktadır. Ancak bir atom, tek katmanlıysa ve bu katmanda iki elektronu varsa kararlıdır. Atomun iki
Elektronların Dizilimi ve Kimyasal Özellikler Atomların katmanlarında belirli sayılarda elektron bulunmaktadır. Ancak bir atom, tek katmanlıysa ve bu katmanda iki elektronu varsa kararlıdır. Atomun iki
ELEKTRON DİZİLİMİ PAULİ DIŞLAMA İLKESİ:
 ELEKTRON DİZİLİMİ PAULİ DIŞLAMA İLKESİ: Bir atomdaki herhangi iki elektronun dört kuantum sayısı aynı olamaz. Bir atomun n,l,ml, kuant sayıları aynı olsa bile m s spin kuantum sayıları farklı olacaktır.
ELEKTRON DİZİLİMİ PAULİ DIŞLAMA İLKESİ: Bir atomdaki herhangi iki elektronun dört kuantum sayısı aynı olamaz. Bir atomun n,l,ml, kuant sayıları aynı olsa bile m s spin kuantum sayıları farklı olacaktır.
Örnek : 3- Bileşiklerin Özellikleri :
 Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani
Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani
Elementlerin büyük bir kısmı tabiatta saf hâlde bulunmaz. Çoğunlukla başka elementlerle bileşikler oluşturmuş şekilde bulunurlar.
 Elementlerin büyük bir kısmı tabiatta saf hâlde bulunmaz. Çoğunlukla başka elementlerle bileşikler oluşturmuş şekilde bulunurlar. Elementlerin bileşik oluşturma istekleri onların kararlı yapıya ulaşma
Elementlerin büyük bir kısmı tabiatta saf hâlde bulunmaz. Çoğunlukla başka elementlerle bileşikler oluşturmuş şekilde bulunurlar. Elementlerin bileşik oluşturma istekleri onların kararlı yapıya ulaşma
BMM 205 Malzeme Biliminin Temelleri
 BMM 205 Malzeme Biliminin Temelleri Atom Yapısı ve Atomlar Arası Bağlar Dr. Ersin Emre Ören Biyomedikal Mühendisliği Bölümü Malzeme Bilimi ve Nanoteknoloji Mühendisliği Bölümü TOBB Ekonomi ve Teknoloji
BMM 205 Malzeme Biliminin Temelleri Atom Yapısı ve Atomlar Arası Bağlar Dr. Ersin Emre Ören Biyomedikal Mühendisliği Bölümü Malzeme Bilimi ve Nanoteknoloji Mühendisliği Bölümü TOBB Ekonomi ve Teknoloji
GÜNEŞİN ELEKTROMANYETİK SPEKTRUMU
 GÜNEŞİN ELEKTROMANYETİK SPEKTRUMU Güneş ışınımı değişik dalga boylarında yayılır. Yayılan bu dalga boylarının sıralı görünümü de güneş spektrumu olarak isimlendirilir. Tam olarak ifade edilecek olursa;
GÜNEŞİN ELEKTROMANYETİK SPEKTRUMU Güneş ışınımı değişik dalga boylarında yayılır. Yayılan bu dalga boylarının sıralı görünümü de güneş spektrumu olarak isimlendirilir. Tam olarak ifade edilecek olursa;
KİMYA-IV. Yrd. Doç. Dr. Yakup Güneş
 KİMYA-IV Yrd. Doç. Dr. Yakup Güneş Organik Kimyaya Giriş Kimyasal bileşikler, eski zamanlarda, elde edildikleri kaynaklara bağlı olarak Anorganik ve Organik olmak üzere, iki sınıf altında toplanmışlardır.
KİMYA-IV Yrd. Doç. Dr. Yakup Güneş Organik Kimyaya Giriş Kimyasal bileşikler, eski zamanlarda, elde edildikleri kaynaklara bağlı olarak Anorganik ve Organik olmak üzere, iki sınıf altında toplanmışlardır.
KİM-117 TEMEL KİMYA Prof. Dr. Zeliha HAYVALI Ankara Üniversitesi Kimya Bölümü
 KİM-117 TEMEL KİMYA Prof. Dr. Zeliha HAYVALI Ankara Üniversitesi Kimya Bölümü Bu slaytlarda anlatılanlar sadece özet olup ayrıntılı bilgiler ve örnek çözümleri derste verilecektir. BÖLÜM 4 PERİYODİK SİSTEM
KİM-117 TEMEL KİMYA Prof. Dr. Zeliha HAYVALI Ankara Üniversitesi Kimya Bölümü Bu slaytlarda anlatılanlar sadece özet olup ayrıntılı bilgiler ve örnek çözümleri derste verilecektir. BÖLÜM 4 PERİYODİK SİSTEM
Elektrik Yük ve Elektrik Alan
 Bölüm 1 Elektrik Yük ve Elektrik Alan Bölüm 1 Hedef Öğretiler Elektrik yükler ve bunların iletken ve yalıtkanlar daki davranışları. Coulomb s Yasası hesaplaması Test yük kavramı ve elektrik alan tanımı.
Bölüm 1 Elektrik Yük ve Elektrik Alan Bölüm 1 Hedef Öğretiler Elektrik yükler ve bunların iletken ve yalıtkanlar daki davranışları. Coulomb s Yasası hesaplaması Test yük kavramı ve elektrik alan tanımı.
NORMAL ÖĞRETİM DERS PROGRAMI
 NORMAL ÖĞRETİM DERS PROGRAMI 1. Yarıyıl 1. Hafta ( 19.09.2011-23.09.2011 ) Nükleer reaktör türleri ve çalışma prensipleri Atomik boyuttaki parçacıkların yapısı Temel kavramlar Elektrostatiğin Temelleri,
NORMAL ÖĞRETİM DERS PROGRAMI 1. Yarıyıl 1. Hafta ( 19.09.2011-23.09.2011 ) Nükleer reaktör türleri ve çalışma prensipleri Atomik boyuttaki parçacıkların yapısı Temel kavramlar Elektrostatiğin Temelleri,
1. ÜNİTE: MODERN ATOM TEORİSİ
 . ÜNİTE: MODERN ATOM TEORİSİ.4. Elektron Dizilimi ve Periyodik Sisteme Yerleşim Atomun Kuantum Modeli oluşturulduktan sonra Bohr, yaptığı çalışmalarda periyodik cetvel ile kuantum teorisi arasında bir
. ÜNİTE: MODERN ATOM TEORİSİ.4. Elektron Dizilimi ve Periyodik Sisteme Yerleşim Atomun Kuantum Modeli oluşturulduktan sonra Bohr, yaptığı çalışmalarda periyodik cetvel ile kuantum teorisi arasında bir
2- Bileşim 3- Güneş İç Yapısı a) Çekirdek
 GÜNEŞ 1- Büyüklük Güneş, güneş sisteminin en uzak ve en büyük yıldızıdır. Dünya ya uzaklığı yaklaşık 150 milyon kilometre, çapı ise 1.392.000 kilometredir. Bu çap, Yeryüzünün 109 katı, Jüpiter in de 10
GÜNEŞ 1- Büyüklük Güneş, güneş sisteminin en uzak ve en büyük yıldızıdır. Dünya ya uzaklığı yaklaşık 150 milyon kilometre, çapı ise 1.392.000 kilometredir. Bu çap, Yeryüzünün 109 katı, Jüpiter in de 10
MADDENİN YAPISI VE ÖZELLİKLERİ
 MADDENİN YAPISI VE ÖZELLİKLERİ 1. Atomun Yapısı KONULAR 2.Element ve Sembolleri 3. Elektronların Dizilimi ve Kimyasal Özellikler 4. Kimyasal Bağ 5. Bileşikler ve Formülleri 6. Karışımlar 1.Atomun Yapısı
MADDENİN YAPISI VE ÖZELLİKLERİ 1. Atomun Yapısı KONULAR 2.Element ve Sembolleri 3. Elektronların Dizilimi ve Kimyasal Özellikler 4. Kimyasal Bağ 5. Bileşikler ve Formülleri 6. Karışımlar 1.Atomun Yapısı
ATOMİK YAPI VE ATOMLAR ARASI BAĞLAR. Aytekin Hitit
 ATOMİK YAPI VE ATOMLAR ARASI BAĞLAR Aytekin Hitit Malzemeler neden farklı özellikler gösterirler? Özellikler Fiziksel Kimyasal Bahsi geçen yapısal etkenlerden elektron düzeni değiştirilemez. Ancak diğer
ATOMİK YAPI VE ATOMLAR ARASI BAĞLAR Aytekin Hitit Malzemeler neden farklı özellikler gösterirler? Özellikler Fiziksel Kimyasal Bahsi geçen yapısal etkenlerden elektron düzeni değiştirilemez. Ancak diğer
Element atomlarının atom ve kütle numaraları element sembolleri üzerinde gösterilebilir. Element atom numarası sembolün sol alt köşesine yazılır.
 Atom üç temel tanecikten oluşur. Bunlar proton, nötron ve elektrondur. Proton atomun çekirdeğinde bulunan pozitif yüklü taneciktir. Nötron atomun çekirdeğin bulunan yüksüz taneciktir. ise çekirdek etrafında
Atom üç temel tanecikten oluşur. Bunlar proton, nötron ve elektrondur. Proton atomun çekirdeğinde bulunan pozitif yüklü taneciktir. Nötron atomun çekirdeğin bulunan yüksüz taneciktir. ise çekirdek etrafında
PERİYODİK CETVEL-ÖSS DE ÇIKMIŞ SORULAR
 PERİODİK CETVEL-ÖSS DE ÇIKMIŞ SORULAR 1. Bir elementin periyodik cetveldeki yeri aşağıdakilerden hangisi ile belirlenir? A) Atom ağırlığı B) Değerliği C) Atom numarası D) Kimyasal özellikleri E) Fiziksel
PERİODİK CETVEL-ÖSS DE ÇIKMIŞ SORULAR 1. Bir elementin periyodik cetveldeki yeri aşağıdakilerden hangisi ile belirlenir? A) Atom ağırlığı B) Değerliği C) Atom numarası D) Kimyasal özellikleri E) Fiziksel
METALİK MALZEMELERİN GENEL KARAKTERİSTİKLERİ BAHAR 2010
 METALİK MALZEMELERİN GENEL KARAKTERİSTİKLERİ BAHAR 2010 WEBSİTE www2.aku.edu.tr/~hitit Dersler İÇERİK Metalik Malzemelerin Genel Karakteristiklerİ Denge diyagramları Ergitme ve döküm Dökme demir ve çelikler
METALİK MALZEMELERİN GENEL KARAKTERİSTİKLERİ BAHAR 2010 WEBSİTE www2.aku.edu.tr/~hitit Dersler İÇERİK Metalik Malzemelerin Genel Karakteristiklerİ Denge diyagramları Ergitme ve döküm Dökme demir ve çelikler
Soygazların bileşik oluşturamamasının sebebi bütün orbitallerinin dolu olmasındandır.
 KİMYASAL BAĞLAR Kimyasal bağ, moleküllerde atomları birarada tutan kuvvettir. Bir bağın oluşabilmesi için atomlar tek başına bulundukları zamankinden daha kararlı (az enerjiye sahip) olmalıdırlar. Genelleme
KİMYASAL BAĞLAR Kimyasal bağ, moleküllerde atomları birarada tutan kuvvettir. Bir bağın oluşabilmesi için atomlar tek başına bulundukları zamankinden daha kararlı (az enerjiye sahip) olmalıdırlar. Genelleme
GENEL KİMYA. 4. Konu: Kimyasal türler, Kimyasal türler arasındaki etkileşimler, Kimyasal Bağlar
 GENEL KİMYA 4. Konu: Kimyasal türler, Kimyasal türler arasındaki etkileşimler, Kimyasal Bağlar Kimyasal Türler Doğada bulunan bütün maddeler tanecikli yapıdadır. Maddenin özelliğini gösteren küçük yapı
GENEL KİMYA 4. Konu: Kimyasal türler, Kimyasal türler arasındaki etkileşimler, Kimyasal Bağlar Kimyasal Türler Doğada bulunan bütün maddeler tanecikli yapıdadır. Maddenin özelliğini gösteren küçük yapı
Bölüm 8: Atomun Elektron Yapısı
 Bölüm 8: Atomun Elektron Yapısı 1. Elektromanyetik Işıma: Elektrik ve manyetik alanın dalgalar şeklinde taşınmasıdır. Her dalganın frekansı ve dalga boyu vardır. Dalga boyu (ʎ) : İki dalga tepeciği arasındaki
Bölüm 8: Atomun Elektron Yapısı 1. Elektromanyetik Işıma: Elektrik ve manyetik alanın dalgalar şeklinde taşınmasıdır. Her dalganın frekansı ve dalga boyu vardır. Dalga boyu (ʎ) : İki dalga tepeciği arasındaki
GENEL KİMYA. 4. Konu: Kimyasal türler, Kimyasal türler arasındaki etkileşimler, Kimyasal Bağlar
 GENEL KİMYA 4. Konu: Kimyasal türler, Kimyasal türler arasındaki etkileşimler, Kimyasal Bağlar Kimyasal Türler Doğada bulunan bütün maddeler tanecikli yapıdadır. Maddenin özelliğini gösteren küçük yapı
GENEL KİMYA 4. Konu: Kimyasal türler, Kimyasal türler arasındaki etkileşimler, Kimyasal Bağlar Kimyasal Türler Doğada bulunan bütün maddeler tanecikli yapıdadır. Maddenin özelliğini gösteren küçük yapı
Maddenin Mekanik Özellikleri
 Gaz Sıvı Katı Bölüm 1 Maddenin Mekanik Özellikleri Prof. Dr. Bahadır BOYACIOĞLU Maddenin Mekanik Özellikleri Maddenin Halleri Katı Sıvı Gaz Plazma Yoğunluk ve Özgül Ağırlık Hooke Kanunu Zor ve Zorlama
Gaz Sıvı Katı Bölüm 1 Maddenin Mekanik Özellikleri Prof. Dr. Bahadır BOYACIOĞLU Maddenin Mekanik Özellikleri Maddenin Halleri Katı Sıvı Gaz Plazma Yoğunluk ve Özgül Ağırlık Hooke Kanunu Zor ve Zorlama
Elektrot Potansiyeli. (k) (k) (k) Tepkime vermez
 Elektrot Potansiyeli Uzun metal parçası, M, elektrokimyasal çalışmalarda kullanıldığında elektrot adını alır. M n+ metal iyonları içeren bir çözeltiye daldırılan bir elektrot bir yarı-hücre oluşturur.
Elektrot Potansiyeli Uzun metal parçası, M, elektrokimyasal çalışmalarda kullanıldığında elektrot adını alır. M n+ metal iyonları içeren bir çözeltiye daldırılan bir elektrot bir yarı-hücre oluşturur.
Büyük Patlama ve Evrenin Oluşumu. Test 1 in Çözümleri
 7 Büyük Patlama ve Evrenin Oluşumu 225 Test 1 in Çözümleri 1. Elektrikçe yüksüz parçacıklar olan fotonların kütleleri yoktur. Işık hızıyla hareket ettikleri için atom içerisinde bulunamazlar. Fotonlar
7 Büyük Patlama ve Evrenin Oluşumu 225 Test 1 in Çözümleri 1. Elektrikçe yüksüz parçacıklar olan fotonların kütleleri yoktur. Işık hızıyla hareket ettikleri için atom içerisinde bulunamazlar. Fotonlar
KUTUP IŞINIMI AURORA. www.astrofotograf.com
 KUTUP IŞINIMI AURORA www.astrofotograf.com Kutup ışıkları, ya da aurora, genellikle kutup bölgelerinde görülen bir gece ışımasıdır. Aurora, gökyüzündeki doğal ışık görüntüleridir. Genelde gece görülen
KUTUP IŞINIMI AURORA www.astrofotograf.com Kutup ışıkları, ya da aurora, genellikle kutup bölgelerinde görülen bir gece ışımasıdır. Aurora, gökyüzündeki doğal ışık görüntüleridir. Genelde gece görülen
ELEKTRONLARIN DĠZĠLĠMĠ
 ELEKTRONLARIN DĠZĠLĠMĠ Eğer bu üç elementin birer elektronu daha olsaydı, her birinde yeni bir katman oluşacaktı. Çünkü her üçünün de en dıştaki katmanları tamamen dolu durumdadır. 1.Katmanda en çok 2
ELEKTRONLARIN DĠZĠLĠMĠ Eğer bu üç elementin birer elektronu daha olsaydı, her birinde yeni bir katman oluşacaktı. Çünkü her üçünün de en dıştaki katmanları tamamen dolu durumdadır. 1.Katmanda en çok 2
FZM 220. Malzeme Bilimine Giriş
 FZM 220 Yapı Karakterizasyon Özellikler İşleme Performans Prof. Dr. İlker DİNÇER Fakültesi, Fizik Mühendisliği Bölümü 1 Ders Hakkında FZM 220 Dersinin Amacı Bu dersin amacı, fizik mühendisliği öğrencilerine,
FZM 220 Yapı Karakterizasyon Özellikler İşleme Performans Prof. Dr. İlker DİNÇER Fakültesi, Fizik Mühendisliği Bölümü 1 Ders Hakkında FZM 220 Dersinin Amacı Bu dersin amacı, fizik mühendisliği öğrencilerine,
ATOM BİLGİSİ I ÖRNEK 1
 ATOM BİLGİSİ I Elementlerin özelliklerini ta ıyan en küçük yapıta ı atomdur. Son çözümlemede, bütün maddelerin atomlar toplulu u oldu unu söyleyebiliriz. Elementler, aynı tür atomlardan, bile ik ve karı
ATOM BİLGİSİ I Elementlerin özelliklerini ta ıyan en küçük yapıta ı atomdur. Son çözümlemede, bütün maddelerin atomlar toplulu u oldu unu söyleyebiliriz. Elementler, aynı tür atomlardan, bile ik ve karı
Kütlesel çekim kuvveti nedeniyle cisimler bir araya gelme eğilimi gösterirler, birbirlerine
 Türkçe Özet Doğayı araştırmamız çevremizde gördüklerimizle başlar. Onların yapı taşlarını merak ederiz ve biyoloji ile kimyada olduğu gibi mümkün olduğunca küçük ölçeklere inmeye çalışırız. Ancak bu araştırmanın
Türkçe Özet Doğayı araştırmamız çevremizde gördüklerimizle başlar. Onların yapı taşlarını merak ederiz ve biyoloji ile kimyada olduğu gibi mümkün olduğunca küçük ölçeklere inmeye çalışırız. Ancak bu araştırmanın
BİYOLOJİK MOLEKÜLLERDEKİ
 BİYOLOJİK MOLEKÜLLERDEKİ KİMYASALBAĞLAR BAĞLAR KİMYASAL VE HÜCRESEL REAKSİYONLAR Yrd. Doç.Dr. Funda BULMUŞ Atomun Yapısı Maddenin en küçük yapı taşı olan atom elektron, proton ve nötrondan oluşmuştur.
BİYOLOJİK MOLEKÜLLERDEKİ KİMYASALBAĞLAR BAĞLAR KİMYASAL VE HÜCRESEL REAKSİYONLAR Yrd. Doç.Dr. Funda BULMUŞ Atomun Yapısı Maddenin en küçük yapı taşı olan atom elektron, proton ve nötrondan oluşmuştur.
BÖLÜM 2 ATOMİK YAPI İÇERİK. Atom yapısı. Bağ tipleri. Chapter 2-1
 BÖLÜM 2 ATOMİK YAPI İÇERİK Atom yapısı Bağ tipleri 1 Atomların Yapıları Atomlar başlıca üç temel atom altı parçacıktan oluşur; Protonlar (+ yüklü) Nötronlar (yüksüz) Elektronlar (-yüklü) Basit bir atom
BÖLÜM 2 ATOMİK YAPI İÇERİK Atom yapısı Bağ tipleri 1 Atomların Yapıları Atomlar başlıca üç temel atom altı parçacıktan oluşur; Protonlar (+ yüklü) Nötronlar (yüksüz) Elektronlar (-yüklü) Basit bir atom
Serüveni 3. ÜNİTE KİMYASAL TÜRLER ARASI ETKİLEŞİM GÜÇLÜ ETKİLEŞİM. o İYONİK BAĞ o KOVALENT BAĞ o METALİK BAĞ
 Serüveni 3. ÜNİTE KİMYASAL TÜRLER ARASI ETKİLEŞİM GÜÇLÜ ETKİLEŞİM o İYONİK BAĞ o KOVALENT BAĞ o METALİK BAĞ KİMYASAL TÜR 1. İYONİK BAĞ - - Ametal.- Kök Kök Kök (+) ve (-) yüklü iyonların çekim kuvvetidir..halde
Serüveni 3. ÜNİTE KİMYASAL TÜRLER ARASI ETKİLEŞİM GÜÇLÜ ETKİLEŞİM o İYONİK BAĞ o KOVALENT BAĞ o METALİK BAĞ KİMYASAL TÜR 1. İYONİK BAĞ - - Ametal.- Kök Kök Kök (+) ve (-) yüklü iyonların çekim kuvvetidir..halde
Kimya EğitimiE. Ders Sorumlusu Prof. Dr. Đnci MORGĐL
 Kimya EğitimiE Ders Sorumlusu Prof. Dr. Đnci MORGĐL Konu:Metallerin Reaksiyonları Süre: 4 ders saati Metallerin Su Đle Reaksiyonları Hedef : Metallerin su ile verdikleri reaksiyonları kavratabilmek. Davranışlar:
Kimya EğitimiE Ders Sorumlusu Prof. Dr. Đnci MORGĐL Konu:Metallerin Reaksiyonları Süre: 4 ders saati Metallerin Su Đle Reaksiyonları Hedef : Metallerin su ile verdikleri reaksiyonları kavratabilmek. Davranışlar:
3- KİMYASAL ELEMENTLER VE FONKSİYONLARI
 3- KİMYASAL ELEMENTLER VE FONKSİYONLARI Doğada 103 elementin olduğu bilinmektedir. Bunlardan 84 metal elementlerdir. Metal elementler toksik olan ve toksik olmayan elementler olarak ikiye ayrılmaktadır.
3- KİMYASAL ELEMENTLER VE FONKSİYONLARI Doğada 103 elementin olduğu bilinmektedir. Bunlardan 84 metal elementlerdir. Metal elementler toksik olan ve toksik olmayan elementler olarak ikiye ayrılmaktadır.
ALETLİ ANALİZ YÖNTEMLERİ
 ALETLİ ANALİZ YÖNTEMLERİ Spektroskopiye Giriş Yrd. Doç. Dr. Gökçe MEREY SPEKTROSKOPİ Işın-madde etkileşmesini inceleyen bilim dalına spektroskopi denir. Spektroskopi, Bir örnekteki atom, molekül veya iyonların
ALETLİ ANALİZ YÖNTEMLERİ Spektroskopiye Giriş Yrd. Doç. Dr. Gökçe MEREY SPEKTROSKOPİ Işın-madde etkileşmesini inceleyen bilim dalına spektroskopi denir. Spektroskopi, Bir örnekteki atom, molekül veya iyonların
PERİYODİK CETVEL. Yanıt : D. www.kimyahocam.com. 3 Li : 1s2 2s 1 2. periyot 1A grubu. 16 S : 1s2 2s 2 2p 6 3s 2 3p 4 3.
 PERİODİK CETVEL Periyodik cetvel, elementlerin atom numaraları temel alınarak düzenlenmiş bir sistemdir. Periyodik cetvelde, nötr atomlarının elektron içeren temel enerji düzeyi sayısı aynı olan elementler
PERİODİK CETVEL Periyodik cetvel, elementlerin atom numaraları temel alınarak düzenlenmiş bir sistemdir. Periyodik cetvelde, nötr atomlarının elektron içeren temel enerji düzeyi sayısı aynı olan elementler
Aşağıda verilen özet bilginin ayrıntısını, ders kitabı. olarak önerilen, Erdik ve Sarıkaya nın Temel. Üniversitesi Kimyası" Kitabı ndan okuyunuz.
 KİMYASAL BAĞLAR Aşağıda verilen özet bilginin ayrıntısını, ders kitabı olarak önerilen, Erdik ve Sarıkaya nın Temel Üniversitesi Kimyası" Kitabı ndan okuyunuz. KİMYASAL BAĞLAR İki atom veya atom grubu
KİMYASAL BAĞLAR Aşağıda verilen özet bilginin ayrıntısını, ders kitabı olarak önerilen, Erdik ve Sarıkaya nın Temel Üniversitesi Kimyası" Kitabı ndan okuyunuz. KİMYASAL BAĞLAR İki atom veya atom grubu
1. ÜNİTE: MODERN ATOM TEORİSİ İyon Yükleri ve Yükseltgenme Basamakları
 1. ÜNİTE: MODERN ATOM TEORİSİ 1.7. İyon Yükleri ve Yükseltgenme Basamakları Yüksüz bir atomun yapısındaki pozitif (+) yüklü protonlarla negatif () yüklü elektronların sayıları birbirine eşittir. Yüksüz
1. ÜNİTE: MODERN ATOM TEORİSİ 1.7. İyon Yükleri ve Yükseltgenme Basamakları Yüksüz bir atomun yapısındaki pozitif (+) yüklü protonlarla negatif () yüklü elektronların sayıları birbirine eşittir. Yüksüz
Paslanmaz Çelik Gövde. Yalıtım Sargısı. Katalizör Yüzey Tabakası. Egzoz Emisyonları: Su Karbondioksit Azot
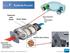 Paslanmaz Çelik Gövde Yalıtım Sargısı Egzoz Emisyonları: Su Karbondioksit Azot Katalizör Yüzey Tabakası Egzoz Gazları: Hidrokarbonlar Karbon Monoksit Azot Oksitleri Bu bölüme kadar, açıkça ifade edilmese
Paslanmaz Çelik Gövde Yalıtım Sargısı Egzoz Emisyonları: Su Karbondioksit Azot Katalizör Yüzey Tabakası Egzoz Gazları: Hidrokarbonlar Karbon Monoksit Azot Oksitleri Bu bölüme kadar, açıkça ifade edilmese
CALLİSTER - SERAMİKLER
 CALLİSTER - SERAMİKLER Atomik bağı ağırlıklı olarak iyonik olan seramik malzemeler için, kristal yapılarının atomların yerine elektrikle yüklü iyonlardan oluştuğu düşünülebilir. Metal iyonları veya katyonlar
CALLİSTER - SERAMİKLER Atomik bağı ağırlıklı olarak iyonik olan seramik malzemeler için, kristal yapılarının atomların yerine elektrikle yüklü iyonlardan oluştuğu düşünülebilir. Metal iyonları veya katyonlar
Elektronların Dizilimi ve Kimyasal Bağlar
 Elektronların Dizilimi ve Kimyasal Bağlar Elektronların Dizilimi Elektronlar çekirdek çevresindeki yörüngelerde dönerek hareket ederler. Çekirdeğe en yakın yörünge 1 olmak üzere dışa doğru 2, 3,4... olarak
Elektronların Dizilimi ve Kimyasal Bağlar Elektronların Dizilimi Elektronlar çekirdek çevresindeki yörüngelerde dönerek hareket ederler. Çekirdeğe en yakın yörünge 1 olmak üzere dışa doğru 2, 3,4... olarak
12. SINIF KONU ANLATIMLI
 12. SINIF KONU ANLATIMLI 3. ÜNİTE: DALGA MEKANİĞİ 2. Konu ELEKTROMANYETİK DALGA ETKİNLİK VE TEST ÇÖZÜMLERİ 2 Elektromanyetik Dalga Testin 1 in Çözümleri 1. B manyetik alanı sabit v hızıyla hareket ederken,
12. SINIF KONU ANLATIMLI 3. ÜNİTE: DALGA MEKANİĞİ 2. Konu ELEKTROMANYETİK DALGA ETKİNLİK VE TEST ÇÖZÜMLERİ 2 Elektromanyetik Dalga Testin 1 in Çözümleri 1. B manyetik alanı sabit v hızıyla hareket ederken,
GENEL KİMYA. Yrd.Doç.Dr. Tuba YETİM
 GENEL KİMYA MOLEKÜLLER ARASI KUVVETLER Moleküller Arası Kuvvetler Yüksek basınç ve düşük sıcaklıklarda moleküller arası kuvvetler gazları ideallikten saptırır. Moleküller arası kuvvetler molekülde kalıcı
GENEL KİMYA MOLEKÜLLER ARASI KUVVETLER Moleküller Arası Kuvvetler Yüksek basınç ve düşük sıcaklıklarda moleküller arası kuvvetler gazları ideallikten saptırır. Moleküller arası kuvvetler molekülde kalıcı
I. FOTOELEKTRON SPEKTROSKOPĠSĠ (PES) PES orbital enerjilerini doğrudan tayin edebilir. (Fotoelektrik etkisine benzer!)
 5.111 Ders Özeti #9 Bugün için okuma: Bölüm 1.14 (3.Baskıda, 1.13) Elektronik Yapı ve Periyodik Çizelge, Bölüm 1.15, 1.16, 1.17, 1.18, ve 1.20 (3.Baskıda, 1.14, 1.15, 1.16, 1.17, ve 1.19) Atom Özelliklerinde
5.111 Ders Özeti #9 Bugün için okuma: Bölüm 1.14 (3.Baskıda, 1.13) Elektronik Yapı ve Periyodik Çizelge, Bölüm 1.15, 1.16, 1.17, 1.18, ve 1.20 (3.Baskıda, 1.14, 1.15, 1.16, 1.17, ve 1.19) Atom Özelliklerinde
Paylaşılan elektron ya da elektronlar, her iki çekirdek etrafında dolanacaklar, iki çekirdek arasındaki bölgede daha uzun süre bulundukları için bu
 4.Kimyasal Bağlar Kimyasal Bağlar Aynı ya da farklı cins atomları bir arada tutan kuvvetlere kimyasal bağlar denir. Pek çok madde farklı element atomlarının birleşmesiyle meydana gelmiştir. İyonik bağ
4.Kimyasal Bağlar Kimyasal Bağlar Aynı ya da farklı cins atomları bir arada tutan kuvvetlere kimyasal bağlar denir. Pek çok madde farklı element atomlarının birleşmesiyle meydana gelmiştir. İyonik bağ
Bohr Atom Modeli. ( I eylemsizlik momen ) Her iki tarafı mv ye bölelim.
 Bohr Atom Modeli Niels Hendrik Bohr, Rutherford un atom modelini temel alarak 1913 yılında bir atom modeli ileri sürdü. Bohr teorisini ortaya koyarak atomların çizgi spektrumlarının açıklanabilmesi için
Bohr Atom Modeli Niels Hendrik Bohr, Rutherford un atom modelini temel alarak 1913 yılında bir atom modeli ileri sürdü. Bohr teorisini ortaya koyarak atomların çizgi spektrumlarının açıklanabilmesi için
GENEL KİMYA. Yrd.Doç.Dr. Tuba YETİM
 GENEL KİMYA ATOMUN ELEKTRON YAPISI Bohr atom modelinde elektronun bulunduğu yer için yörünge tanımlaması kullanılırken, kuantum mekaniğinde bunun yerine orbital tanımlaması kullanılır. Orbital, elektronun
GENEL KİMYA ATOMUN ELEKTRON YAPISI Bohr atom modelinde elektronun bulunduğu yer için yörünge tanımlaması kullanılırken, kuantum mekaniğinde bunun yerine orbital tanımlaması kullanılır. Orbital, elektronun
2.3 Asimptotik Devler Kolu
 2.3 Asimptotik Devler Kolu 2.3.1 Erken Asimptotik dev kolu 2.3.2 Termal pulsasyon yapan Asimptotik dev kolu 2.3.3 Üçüncü karışım ve Karbon yıldızları 2.3.4 s-süreci nükleosentezi 2.3.5 Kütle kaybı ve AGB
2.3 Asimptotik Devler Kolu 2.3.1 Erken Asimptotik dev kolu 2.3.2 Termal pulsasyon yapan Asimptotik dev kolu 2.3.3 Üçüncü karışım ve Karbon yıldızları 2.3.4 s-süreci nükleosentezi 2.3.5 Kütle kaybı ve AGB
Lewis Nokta Yapıları ve VSEPR
 6 DENEY Lewis Nokta Yapıları ve VSEPR 1. Giriş Bu deneyde moleküllerin Lewis Nokta yapıları belirlenecek ve VSEPR kuralları ile molekülün geometrisi ve polaritesi tayin edilecektir. 2. Lewis Nokta Yapıları
6 DENEY Lewis Nokta Yapıları ve VSEPR 1. Giriş Bu deneyde moleküllerin Lewis Nokta yapıları belirlenecek ve VSEPR kuralları ile molekülün geometrisi ve polaritesi tayin edilecektir. 2. Lewis Nokta Yapıları
BÖLÜM 3: (6,67x10 Nm kg )(1,67x10 kg)»10 36 F (9x10 Nm C )(1,6x10 C) NÜKLEONLAR ARASI KUVVET- NÜKLEER KUVVET
 BÖLÜM : NÜKLEONLAR ARASI KUVVET- NÜKLEER KUVVET Atomdaki elektronların hareketini kontrol eden kuvvetler elektromanyetik kuvvettir. Elektromanyetik kuvvet atomları ve molekülleri bir arada tutar. Çekirdekteki
BÖLÜM : NÜKLEONLAR ARASI KUVVET- NÜKLEER KUVVET Atomdaki elektronların hareketini kontrol eden kuvvetler elektromanyetik kuvvettir. Elektromanyetik kuvvet atomları ve molekülleri bir arada tutar. Çekirdekteki
İstatistiksel Mekanik I
 MIT Açık Ders Malzemeleri http://ocw.mit.edu 8.333 İstatistiksel Mekanik I: Parçacıkların İstatistiksel Mekaniği 2007 Güz Bu materyallerden alıntı yapmak veya Kullanım Şartları hakkında bilgi almak için
MIT Açık Ders Malzemeleri http://ocw.mit.edu 8.333 İstatistiksel Mekanik I: Parçacıkların İstatistiksel Mekaniği 2007 Güz Bu materyallerden alıntı yapmak veya Kullanım Şartları hakkında bilgi almak için
MADDE VE ENDüSTRi ünite 4
 Johann Wolfgang öbereiner PERİOİK SİSTEMİN TARİHSEL GELİŞİMİ Johann Wolfgang öbereiner Elementleri belirli bir düzene koymak için ilk çalışmayı yaptı. Alman kimyacı benzer fiziksel ve kimyasal özelliklere
Johann Wolfgang öbereiner PERİOİK SİSTEMİN TARİHSEL GELİŞİMİ Johann Wolfgang öbereiner Elementleri belirli bir düzene koymak için ilk çalışmayı yaptı. Alman kimyacı benzer fiziksel ve kimyasal özelliklere
Dalton atom modelinde henüz keşfedilmedikleri için atomun temel tanecikleri olan proton nötron ve elektrondan bahsedilmez.
 MODERN ATOM TEORİSİ ÖNCESİ KEŞİFLER Dalton Atom Modeli - Elementler atom adı verilen çok küçük ve bölünemeyen taneciklerden oluşurlar. - Atomlar içi dolu küreler şeklindedir. - Bir elementin bütün atomları
MODERN ATOM TEORİSİ ÖNCESİ KEŞİFLER Dalton Atom Modeli - Elementler atom adı verilen çok küçük ve bölünemeyen taneciklerden oluşurlar. - Atomlar içi dolu küreler şeklindedir. - Bir elementin bütün atomları
Malzemeler elektrik yükünü iletebilme yeteneklerine göre 3 e ayrılırlar. İletkenler Yarı-iletkenler Yalıtkanlar
 Malzemeler elektrik yükünü iletebilme yeteneklerine göre 3 e ayrılırlar. İletkenler Yarı-iletkenler Yalıtkanlar : iletkenlik katsayısı (S/m) Malzemelerin iletkenlikleri sıcaklık ve frekansla değişir. >>
Malzemeler elektrik yükünü iletebilme yeteneklerine göre 3 e ayrılırlar. İletkenler Yarı-iletkenler Yalıtkanlar : iletkenlik katsayısı (S/m) Malzemelerin iletkenlikleri sıcaklık ve frekansla değişir. >>
Periyodik Tablo(sistem)
 Periyodik Tablo(sistem) Geçmişten Günümüze Periyodik Tablo Bilim adamları elementlerin sayısı arttıkça bunları benzer özelliklerine göre sıralamaya çalışmışlardır.(bunu süpermarketlerdeki ürünlerin dizilişlerine
Periyodik Tablo(sistem) Geçmişten Günümüze Periyodik Tablo Bilim adamları elementlerin sayısı arttıkça bunları benzer özelliklerine göre sıralamaya çalışmışlardır.(bunu süpermarketlerdeki ürünlerin dizilişlerine
kitabı olarak önerilen, Erdik ve Sarıkaya nın
 PERİYODİK CETVEL Aşağıda verilen özet bilginin ayrıntısını, ders kitabı olarak önerilen, Erdik ve Sarıkaya nın Temel Üniversitesi Kimyası" Kitabı ndan okuyunuz. Modern periyotlu dizge, elementleri artan
PERİYODİK CETVEL Aşağıda verilen özet bilginin ayrıntısını, ders kitabı olarak önerilen, Erdik ve Sarıkaya nın Temel Üniversitesi Kimyası" Kitabı ndan okuyunuz. Modern periyotlu dizge, elementleri artan
2.ÜNİTE:ATOM VE PERİYODİK SİSTEM ATOM ALTI TANECİKLER
 2.ÜNİTE:ATOM VE PERİYODİK SİSTEM ATOM ALTI TANECİKLER ATOM ALTI TANECİKLER: Atom numarası=proton sayısı=çekirdek yükü Kütle numarası (Nükleon sayısı)=proton sayısı+ nötron sayısı Kütle No iyon yükü Atom
2.ÜNİTE:ATOM VE PERİYODİK SİSTEM ATOM ALTI TANECİKLER ATOM ALTI TANECİKLER: Atom numarası=proton sayısı=çekirdek yükü Kütle numarası (Nükleon sayısı)=proton sayısı+ nötron sayısı Kütle No iyon yükü Atom
1 mol = 6, tane tanecik. Maddelerde tanecik olarak atom, molekül ve iyonlar olduğunda dolayı mol ü aşağıdaki şekillerde tanımlamak mümkündür.
 1 GENEL KİMYA Mol Kavramı 1 Mol Kavramı Günlük hayatta kolaylık olsun diye, çok küçük taneli olan maddeler tane yerine birimlerle ifade edilir. Örneğin pirinç alınırken iki milyon tane pirinç yerine ~
1 GENEL KİMYA Mol Kavramı 1 Mol Kavramı Günlük hayatta kolaylık olsun diye, çok küçük taneli olan maddeler tane yerine birimlerle ifade edilir. Örneğin pirinç alınırken iki milyon tane pirinç yerine ~
POTANSİYEL - ph diyagramları
 POTANSİYEL - ph diyagramları Metallerin çoğu su ve hava gibi çevresel şartlar altında korozyon eğilimi gösterirler. Çevreleri ile beraber bu metaller enerji vererek, oksit veya hidroksitler şeklinde kimyasal
POTANSİYEL - ph diyagramları Metallerin çoğu su ve hava gibi çevresel şartlar altında korozyon eğilimi gösterirler. Çevreleri ile beraber bu metaller enerji vererek, oksit veya hidroksitler şeklinde kimyasal
