ANTİKORLAR VE KULLANIM ALANLARI
|
|
|
- Ece Baybaşin
- 7 yıl önce
- İzleme sayısı:
Transkript
1 T. C. HALİÇ ÜNİVERSİTESİ FEN EDEBİYAT FAKÜLTESİ MOLEKÜLER BİYOLOJİ VE GENETİK BÖLÜMÜ ANTİKORLAR VE KULLANIM ALANLARI BEYZA SERVET GÖNCÜ Bitirme Projesi Danışman: Yard. Doç. Dr. Demet AKTEN AKDOĞAN İSTANBUL Haziran 2007
2 İÇİNDEKİLER I. 1. TARİHÇE...5 I Kronoloji...6 BÖLÜM II...8 II. 1. ANTİJENLER (İMMÜNOJENLER)...8 II Yabancılık...8 II Molekül büyüklüğü...9 II Kimyasal Karmaşıklık...9 II Molekülün Yapısal Sertliği...9 II Çözünebilirlik ve Metabolize Edilebilme...10 II Emilim ve Atılım Hızı...10 II Elektrik Yükü...10 II Canlıların Genetik Yapısı...10 II Antijen Miktarı (Dozu)...10 II Antijenin Organizmaya Giriş veya Veriliş Yolu...11 II Adjuvan Madde Varlığı...11 II. 2. ANTİJEN ÇEŞİTLERİ VE HAPTEN...11 II Kimyasal Bileşiklerin Antijenik Özellikleri...12 II Adjuvan Maddeler...12 II Canlıların Evrimsel Yakınlığına Göre Antijenler...13 II Heteroantijen...13 II İzoantijen (= Alloantijen)...13 II Otoantijen...13 II Heterofil Antijen...13 II Çeşitli Antijen Örnekleri...14 II Mikrop Antijenleri...14 II Virüs Antijenleri...14 II Bakteri Antijenleri
3 II Kan Grubu Antijenleri...15 II Doku Uygunluk Antijenleri...16 II Epitop...16 II Hapten...18 BÖLÜM III...19 III. 1. ANTİKORLAR (İMMÜNOGLOBÜLİNLER)...19 III. 2. ANTİKORLARIN SENTEZLENME SÜREÇLERİ...21 III Yan Zincirler Teorisi...23 III Kalıp Teorisi (= Direktif Teori)...23 III Öğretici Teori (Instructive Theory)...23 III Klonal Seçilim Teorisi (Selektif Teori, Clonal Selection Theory)...24 III Somatik Rekombinasyon...26 III Alternatif Kırpılma...28 III. 3. ANTİKORLARIN MOLEKÜLER YAPISI...29 III Değişken Bölgenin Özellikleri...35 III Sabit Bölgenin Özellikleri...36 III. 4. İMMÜNOGLOBÜLİN KATLANMASI...36 III. 5. ANTİJEN ANTİKOR BAĞLANMA BÖLGELERİ...37 III. 6. HAFİF ZİNCİR SENTEZİ...42 III. 7. AĞIR ZİNCİR SENTEZİ...45 III J ve D Genlerinin Antikor Çeşitliliğindeki Rolü...48 III V(D)J Katılması...49 III. 8. AĞIR ZİNCİRDE İZOTİP DÖNÜŞÜMÜ (SWİTCH)...49 III. 8. ANTİKORLARIN SINIFLANDIRILMASI...51 III IgG...51 III IgD...52 III IgA...53 III Sekretuar Komponent ve J Zinciri...55 III IgM
4 BÖLÜM VI...59 IV. 1. MONOKLONAL ANTİKORLAR...59 IV. 2. POLİKLONAL ANTİKORLAR...62 IV. 3. MONOKLONAL ANTİKORLARIN KULLANIM ALANLARI...63 IV Monoklonal Yöntemler...66 IV Kimerik Antikor Oluşumları...69 IV "Humanized" Antikor Oluşumları...69 IV. 4. NANOBODİES...70 Kaynaklar
5 BÖLÜM I I. 1. TARİHÇE İmmünoloji bilimi, immün sistemin fonksiyonlarını ve yapılarını anlamaya yarar. İmmünolojik hastalıkların erken ölümlere neden olması ile tıp bilimi bu konuda çalışmalara kaymıştır. Milattan önce 430 larda Atina da görülen veba salgını ile ilk kez immünoloji teriminden bahsedildi. Thucydides in (Şekil I.1.) notlarında hastalığın evrelerinde belli bir nöbet geçirdiklerinden bahsetmiş. Bu inceleme Louis Pasteur' ün aşılama ve germ-teorisi ile gösterilen gelişime büyük bir kazanç sağladı. O zamana kadar Robert Koch 1981 de kanıtladığı enfeksiyon hastalıklarında mikroorganizmaların rolü ile 1905 de Nobel ödülüne layık görüldü de Walter Reed virüslerin de insanlarda patojen özellik gösterdiğini ispatladı. 19.yüzyılın sonlarında hücresel ve humoral immünite çalışmaları ile immünoloji bilimi büyük bir aşama kaydetti. Özellikle Paul Ehrlich in ileri sürdüğü yan zincir teorisi sayesinde açıklanan antijen-antikor reaksiyonları, spesifiteleri ve humoral immüniteyi anlamaya yönelik yazdığı makalelerle immünolojiye büyük katkılar sağlandı de bu çalışmaları ile Nobel ödülüne layık görüldü (Şekil I.2). Onunla birlikte aynı zamanda hücresel immünolojiyi keşfeden Elie Metchnikoff da Nobel e layık görüldü (Şekil I.3.). Şekil I.1.Thucydides Tahminî M.Ö. 460 M.Ö.400, Antik Yunan tarihçisi Şekil I.2. Paul Ehrlich Şekil I.3. Elie Metchnikoff 5
6 I Kronoloji 1862 Fagositoz (Ernst Haeckel) 1877 Mast hücresi (Paul Ehrlich) 1879 Kuduz aşısı (Louis Pasteur) 1883 Aşıların hücresel teorisi (Elie Metchnikoff) Kuduz aşısı ilk kez bir insana (Joseph Meister) uygulandı 1888 Bakteriyel toksinlerin keşfi (Pierre Roux ve Alexandre Yersin) 1894 Bakteriyolizis (Richard Pfeiffer) Antikor oluşum teorisi (Paul Ehrlich) 1901 Kan grupları (Karl Landsteiner) 1906 Alerji (Clemens von Pirquet) 1910 Viral immünoloji teorisi (Peyton Rous) 1917 Haptenlerin keşfi (Karl Landsteiner) 1938 Antijen-antikor bağlanma hipotezi (John Marrack) Adjuvantlar (Jules Freund ve Katherine McDermott) 1948 B hücrelerinde antikor üretimi 1949 İmmünolojik tolerans hipotezi Klonal seçilim teorisi (Frank Macfarlane Burnet) İnterferon keşfi İnsan lökosit antijenleri Antikor yapısının aydınlatılması 1959 Lenfosit sirkülâsyonunun keşfi (James Gowans) Timüsün hücresel immünite elemanlarını içerdiğinin keşfi İmmün cevapta T ve B hücrelerinin koordinasyonu 1967 IgE nin tanımlanması (Kimishige Ishizaka) 6
7 1972 Antikorların moleküler yapısı MHC ve T hücre sınırlanması (Rolf Zinkernagel ve Peter Doherty) Genetik analizlerde monoklonal antikor kullanımı İmmünoglobülin genlerinde somatik rekombinasyonun tanımlanması (Susumu Tonegawa) HIV in keşfi T hücre reseptör genlerinin tanımlanması 1986 Hepatit B aşısının genetik mühendisliği ile üretilmesi 1986 T yardımcı hücrelerinin (Th1 ve Th2) fonksiyonları (Timothy Mosmann) SCID için gen terapisi İmmünolojik tolerans modeli (Polly Matzinger) T hücrelerinde düzenleme (Shimon Sakaguchi) Toll-like reseptörlerin tanımlanması FOXP3 geninin, düzenleyici T hücrelerinin gelişimindeki rolü İnsan papilloma virüs aşısının keşfi (Ian Frazer) 7
8 BÖLÜM II II. 1. ANTİJENLER (İMMÜNOJENLER) Organizmaya girdiğinde, kendisine karşı bir bağışık yanıt oluşmasına yol açan ve bu cevap sonucunda oluşan ürün ile özgül olarak birleşebilen maddelere antijen denir. İmmünojen sözcüğü de antijen ile eş anlamlı olarak kullanılır. Bir maddenin antijen özelliği gösterebilmesi için bazı özelliklere sahip olması gerekir. Bu özellikler aşağıdaki gibi özetlenmiştir. II Yabancılık Bir madde, girdiği organizmanın yapısına yabancı ise antijenik özellik gösterebilir. Kimyasal bir bileşiğin yabancılığından söz edilirken, molekülün üç boyutlu yapısı kastedilmektedir. Çünkü her canlı yaşamını ve neslini sürdürebilmek için kendi vücut maddelerini sentezler ve bu maddeler hemen her canlıda protein, yağ, karbonhidrat, nükleik asit dediğimiz aynı temel maddelerden oluşmuştur. Bu temel maddelerin ince yapısı ise her canlıda aynıdır. Örneğin protein her canlıda aminoasit dizilerinden oluşur, lipitler yağ asitleri zincirlerinden oluşur. Ancak bu temel maddelerin üç boyutlu molekül yapıları canlı türleri arasında önemli farklılıklar gösterir. Bunu bir örnekle açıklayalım: Kobay ve tavşanda çeşitli proteinler sentezlenir. Her ikisi de protein olmasına rağmen, kobay proteini tavşan için yabancı bir maddedir ve tavşana verilecek olursa kobay proteinine karşı özgül bir bağışık yanıt meydana gelir. Burada iki türe ait proteinler arasındaki fark; proteinleri oluşturan aminoasitlerin dizilişleri, üç boyutlu olarak duruşları ve elektron yükleri bakımından gösterdikleri farklılıktan ileri gelmektedir. Diğer bir örnek olarak hemoglobin molekülünü verebiliriz. Hemoglobin bir proteindir ve tüm memelilerde işlevi aynıdır. Fakat aminoasit dizilişindeki farklılık nedeniyle bir türe ait hemoglobin başka bir tür canlı için yabancıdır ve antijenik özellik göstermektedir. İki canlı evrimsel akrabalık yönünden birbirinden ne kadar uzaksa, yapı maddeleri birbirine o kadar yabancıdır ve o kadar iyi antijen özelliği gösterirler. Akrabalık ne kadar yakınsa antijen özelliği o kadar zayıflar ve hatta kaybolabilir. Ancak bağışıklık mekanizması bozulursa canlıda, kendine karşı da bağışık yanıt oluşur, ve hastalıkla sonuçlanır (= otoimmün hastalıklar). İmmün sistem normalde immünojenik olan yabancı molekülleri kendinden olan ve olmayan (self ve non-self) şeklinde ayrılabilmektedir. Böylelikle tavşan serumundan izole 8
9 edilen ve aynen veya bir başka tavşana enjekte edilen albümin antikor oluşumuna yol açmaktadır. Bununla beraber diğer omurgalı hayvanlara enjekte edilen aynı protein, antijen dozu veriliş şekli ve enjeksiyon sıklığına bağlı olarak belli miktarlarda antikor oluşumuna sebep olabilir. II Molekül büyüklüğü Aminoasitler veya monosakkaritler gibi çok küçük moleküller antijenik değildir. Genel olarak belirli molekül çapı antijen özelliği gösterebilmek için gerekli olarak kabul edilir. Bununla beraber bütün maddelerin inaktif veya aktif olduğu spesifik alt veya üst eşik değeri yoktur. Bir maddenin iyi bir antijen olabilmesi için molekül ağırlığının büyük olması gerekir. Genellikle molekül ağırlığı ve daha büyük olan maddeler iyi antijendirler. Çok nadir olarak molekül ağırlığı 1000 den düşük olan maddeler antijen olabilir. Ancak genel kural olarak molekül ağırlığı den daha küçük moleküller zayıf antijendir. Ancak bu kurala uymayan maddeler de vardır. Örneğin; glukagon isimli bir kimyasal madde molekül ağırlığında olmasına rağmen oldukça iyi bir antijenite gösterir. Diğer taraftan molekül ağırlığı olan dextran iyi antijen özelliği göstermez. II Kimyasal Karmaşıklık Bir molekülün; antijen özelliği gösterebilmesi için belirli bir dereceye kadar kimyasal kompleksiteye izin verilmelidir. Buradaki prensip sentetik polipeptidlerle açık olarak örneklenmiştir. Aynı aminoasitlerden oluşan homopolimerler molekül büyüklüğüne bakılmaksızın zayıf antijendirler, hâlbuki iki hatta üç aminoasit kopolimerleri daha etkili antijen olabilirler. Özetle belirtilirse moleküllerin antijenitesi için kesin bir eşik değeri koymak zordur. Genel kural olarak moleküler yapının kompleks olması ile antijenite artmaktadır. Aromatik aminoasitler, non-aromatik aminoasitlere göre antijenik uyarıma daha az katkıda bulunur. Bu sebeple tirozin içeren adipolipeptidler, tirozin içermeyen aynı polimerlere göre daha antijeniktir. Antijenite molekülün tirozin içeriğiyle orantılıdır. Böylece kötü bir aromatik aminoasit olan zayıf immünojen jelatin e, tirozin halkalarının eklenmesi bu maddenin antijenitesini belirgin olarak arttırır. II Molekülün Yapısal Sertliği Bir maddenin lenfositler tarafından antijen olarak tanınabilmesi için değişmez bir yapı göstermesi gerekir. Lipit, jelâtin gibi belirli bir sertliği olmayan moleküller bu nedenle iyi antijenite gösteremezler. 9
10 II Çözünebilirlik ve Metabolize Edilebilme Antijenik maddenin, girdiği organizmada çözünebilmesi ve metabolize edilebilmesi antijenik gücünü etkiler. Örneğin, keratin gibi hidrolitik enzimlere dayanıklı olup metabolize edilemeyen, parçalanamayan maddeler antijenik değildirler. Benzer şekilde naylon, teflon, polistren, poliakrilamid gibi maddeler makromolekül olmasına karşın metabolize edilemezler ve antijenite göstermezler. Bunlara karşı bağışık yanıt oluşmaz. Bu nedenle doku içine yerleştirilen protezlerin çoğu bu maddelerden yapılmıştır. II Emilim ve Atılım Hızı Antijenik maddenin immün sistemi uyarabilecek bir süre organizmada kalabilmesi antijenitesini etkiler. Genellikle yavaş emilen ve organizmadan yavaş atılan maddelerin immün sistemle etkileşimi daha iyi olduğundan antijeniteleri de daha güçlüdür. Hızlı emilip, hızla vücuttan atılanlar iyi antijen değildir. II Elektrik Yükü İyi bir antijenik madde elektrik yükü taşımalıdır. Molekülün tümü yerine epitopun çevresindeki elektrik yükü daha önemlidir. Çünkü elektrik yüklü gruplar moleküle, sulu ortamda eriyebilirlik kazandırarak çevre ile daha iyi temas etmelerini, dolayısıyla immün sistem hücrelerine daha kolay girmelerini sağlayan hidrofilik nitelik kazandırırlar. Ancak çok kuvvetli pozitif (+) veya negatif (-) yüklü olanlar başka bileşikler tarafından hızla tutulup örtüldüğünden iyi antijen değildirler. II Canlıların Genetik Yapısı Belirli bir antijene cevap verebilme immün cevabın genetik kontrolünde olan bir işlemdir. Saf polisakkaritlerin; fare ve insanlarda antijenik özellikler gösterebilmekte fakat buna karşılık Gine domuzlarında antijenik özellik göstermediği bilinmektedir. Canlılarda immün cevap otozomal dominant geçiş şeklinde olmaktadır. II Antijen Miktarı (Dozu) Antijenik maddenin miktarı antijeniteyi, dolayısıyla bağışık yanıtın gücünü etkiler. Genel olarak bağışık yanıtın gücü antijenin artan dozuna paralel olarak artış gösterir. Ancak miktar çok az olursa immün sistem uyarılamaz ve bağışık yanıt oluşmaz, miktar çok fazla olursa yine immün sistem felç olur ve iyi bir bağışık yanıt oluşamaz. 10
11 II Antijenin Organizmaya Giriş veya Veriliş Yolu Enjeksiyon ile giriş antijeniteyi arttırır. Fakat ağız yoluyla veya deri mukoza yolu ile girerek iyi antijenite gösteren maddeler de vardır. Giriş veya veriliş yolu bağışık yanıtın gücünü ve çeşidini etkiler. İyi bir bağışık yanıt almak istediğimizde antijenin uygun dozda, uygun yolla ve uygun zaman aralıkları ile verilmesi gerekir. Bu konu, aşı uygulamalarında çok önemlidir. II Adjuvan Madde Varlığı Adjuvan maddeler, birlikte enjekte edildiği antijene karşı oluşan bağışık yanıtı arttırırlar. Fosfat ve alüminyum hidroksit gibi mineral tuzları, ölü mikobakteri içeren madensel yağlar (=Tam freund adjuvanı) bu amaçla kullanılırlar. II. 2. ANTİJEN ÇEŞİTLERİ VE HAPTEN Değişik yollardan organizmaya giren antijenlerin, antijen sunucu hücreleri uyarması ve bu hücreler tarafından T lenfositlere sunulması ve T lenfositleri aracılığı ile T/B lenfositlerinin uyarılması veya T lenfositlerinin yardımı olmaksızın doğrudan B lenfositlerinin uyarılması immün yanıtı oluşturur. Antijen sunucu hücrelerde, antijen işlem gördükten sonra bu hücreler tarafından lenfositlere sunulması ve lenfositleri aktive etmesi bakımından antijenler iki gruba ayrılırlar; 1. Timus a Bağlı Antijenler: T ev B lenfositleri tarafından tanınan antijenlere denir. Bu tip antijenler immün yanıt oluşumunda T lenfositlerine gereksinim duyarlar ve genellikle protein yapısındadırlar. 2. Timus dan Bağımsız Antijenler: Doğrudan B lenfositlerini uyarırlar. Bu tip antijenler aynı epitopların tekrarlandığı büyük polimerik moleküllerdir. IgM sınıfından antikor yanıtına neden olurlar ve hafıza hücrelerine dönüşme etkinlikleri oldukça yavaştır. 11
12 II Kimyasal Bileşiklerin Antijenik Özellikleri Proteinler; en iyi antijen özelliği gösteren kimyasal bileşiklerdir. Büyük molekül ağırlığı olan bazı karbonhidrat molekülleri (polisakkaritler) antijen özelliğindedir. Saf polisakkarit antijenlere karşı IgM sınıfı antikorlar sentezlenir. Monosakkarit ve disakkarit gibi küçük karbonhidrat molekülleri antijenik değildir, ancak hapten özelliği gösterirler. Yağlar; saf halde iken antijenik özellikleri yoktur. Ancak protein ve polisakkaritlerle birleştiklerinde (lipoprotein ve lipopolisakkarit halinde) antijen özelliği kazanabilirler. Nükleik asitler ; iyi antijen özelliği göstermezler. Ancak parçalandıklarında veya proteinlerle birleştiklerinde (= nükleoprotein) antijenik özellik kazanabilirler. İlaçlar ve çeşitli kimyasal bileşikler; küçük molekül ağırlıklı ve basit kimyasal yapıda olmalarına rağmen bağışık yanıt oluşabilmektedir. Çünkü bu maddeler, girdikleri canlının proteinleri veya bazı kan hücrelerinin yüzeyine yapışarak antijenite kazanabilirler. İlaçlara karşı alerjik reaksiyonların çoğu da bu mekanizmayla gelişmektedir. II Adjuvan Maddeler Birlikte verildiği antijenlere karşı bağışık yanıtı güçlendiren ve daha uzun süreli bağışık yanıt oluşmasını sağlayan maddelerdir. Adjuvantların fonksiyonları aşağıdakilerden bir ya da bir kaçını içerir: 1) İmmünojen olarak kalma süresini arttırır. 2) Etkili olan hacmi arttırır. 3) Makrofaj ve/veya lenfosit popülasyonlarının birikimini arttırır. Bir kısım adjuvantlar deney hayvanlarında kullanılmaktadır. Bunlara örnek; Çok güçlü olan Freud un komplet adjuvanıdır (KFA). KFA öldürülmüş mikobakterileri içeren yağ-su emülsiyonudur. KFA nın makrofajları ve bazı lenfositleri uyardığı ve immünojenler için bir depo oluşturduğu sanılmaktadır. Ancak insanlarda çok güçlü inflematuar etkisi sebebiyle kullanılmamaktadır. Boğmaca mikrobu (BCG), Bazı bakteri ürünleri (endotoksin, nükleik asit yıkım ürünleri) gibi. 12
13 Adjuvan madde, antijen ile birlikte karıştırılarak verilirse etkisini gösterir. Önce veya sonra verilirse bir yararı olmaz. II Canlıların Evrimsel Yakınlığına Göre Antijenler II Heteroantijen Evrimsel gelişme yönünden yakınlığı olmayan canlıların, karşılıklı antijen özelliği gösteren maddeleridir. Örneğin mikrop antijenleri insan için heteroantijendir. II İzoantijen (= Alloantijen) Evrimsel yönden birbirine yakın, hatta aynı türe ait canlılardaki bireysel farklılık gösteren antijenlerdir. Örneğin insandaki kan grubu antijenleri: Bazı kişilerde A grubu antijenleri varken, bazı kişilerde ise B grubu antijenleri bulunur. Bu da bireysel farklılıktır. II Otoantijen Normalde canlılar kendi antijenik yapılarına karşı bağışık yanıt oluşturmazlar. Ancak bazı hastalık durumlarında canlının kendi antijenik yapılarında değişmeler olabilir, başkalaşabilir ve bunun sonucunda da bağışık yanıt oluşmasına neden olabilirler. Bunlara otoantijen denir. II Heterofil Antijen Evrimsel yakınlığı ve akrabalığı olmayan ve birbirine hiç benzemeyen türlerde, ortak epitoplara sahip olan antijenlerdir. Kısaca farklı antijen moleküllerinde tesadüfen birbirine uyan, benzeyen epitopların bulunmasıdır. Örneğin; streptokok bakterisi ile memelilerin kalp dokusunda birbirine çok benzer antijenler gösterilmiştir. Doğal olarak birine karşı oluşan antikor benzer antijen ile de çapraz reaksiyon verecektir. 13
14 II Çeşitli Antijen Örnekleri II Mikrop Antijenleri Tüm canlılarda olduğu gibi mikroplarda da birçok antijenik yapı bulunur. Mikroplar organizmaya girdiklerinde, tüm bu antijenik maddelerine karşı bağışık yanıt meydana gelir. Oluşan bağışık yanıt sonucunda da organizma mikrobu etkisiz hale getirerek hastalıktan korunmuş olur. Ayrıca laboratuarlarda mikropları tanımak için veya mikrobun yaptığı hastalığın tanısını koymak için mikrop antijenleri ve bunlara karşı oluşan özgül antikorlardan yararlanılır. Yine aşı hazırlanması yönüyle de mikrop antijenlerinin bilinmesi önemlidir. Mikropların antijenik yapılarından bazıları şunlardır: II Virüs Antijenleri Virüsler temel olarak Nükleik asitten ibaret bir çekirdek ile bunu çevreleyen protein yapısındaki kılıf (kapsid) ve bazılarında bulunabilen zarftan ibarettir. Organizmaya giren virüslerin değişik antijenlere karşı değişik sayıda antikor oluşur. Bu antikorlar doğrudan virüs ün kendi maddelerine karşı olduğu gibi virüsün üremesi sırasında oluşan bazı enzimlere ve virüsten ayrılarak ortama yayılan alt birim yapılarına karşı da oluşabilir. Virüsleri oluşturan kısımlar içinde en iyi antijen özelliği gösteren bölüm kapsid dir. Bu ve bunu oluşturan kapsomerler virüse antijen özgüllüğü veren antijenleri içerir. Virüse ait nükleik asitler iyi antijen özelliği göstermezler. Şekil II. 1. virüs antijenleri 14
15 II Bakteri Antijenleri Bilinen hastalandırıcı bakterilerin çoğunda kesin ve iyi bir antijen yapısı olmasına karşın bazı bakteri antijenleri immünolojik olarak önem taşımaz. Genel olarak bakterilerde bulunan antijen çeşitleri; Şekil II. 2. Bakteri antijenleri. Kapsül Antijenleri; Kapsüllü bakterilerde bulunur ve polisakkarit yapısındadır. Hücre Çeperi Antijenleri; Genellikle bakterilerin esas hücresel antijenleri hücre çeperi yapısında bulunur. Polisakkarit yapısında (streptokok) veya lipopolisakkarit yapısında (gram negatif bakteri çeperlerinde) olabilir. Lipopolisakkarit antijenlerinin; lipit yapıları toksik (endotoksin), polisakkarit yapıları antijenik özellik gösterir. II Kan Grubu Antijenleri İnsanların eritrositlerinin yüzeyinde bulunan antijenlerdir ve kişilere göre farklılık gösterebilirler. Pratikte en çok önem taşıyan kan grubu antijenleri ABO ve Rh sistemleridir. Daha farklı, fakat sadece araştırmalarda kullanılan başka kan grubu antijen sistemleri de vardır. ABO kan grubu sisteminde eritrosit yüzeylerinde A ve B olmak üzere iki tip antijen, serumda ise bu antijenlere karşı antikorlar bulunur. 15
16 II Doku Uygunluk Antijenleri Deney hayvanlarında yapılan doku ve organ nakli araştırmalarında, aynı türün bireyleri arasında farklı doku antijenleri olduğu gösterilmiştir. Nakledilen doku ve organların reddine (= atılmasına) neden olan bu antijenlere doku uygunluk veya transplantasyon (=doku-organ nakli) antijenleri adı verilmiştir. Doku antijenleri vücudun tüm hücrelerinde bulunur, sadece eritrosit ve yağ dokusu hücrelerinde bulunmaz. Bu antijenlerin yapımı genetik kontrol altındadır. İnsanda 6. kromozomda bulunan bu gen bölgesine "Büyük doku uygunluk kompleksi gen bölgesi = Major Histocompatibility Complex = MHC" adı verilir. Doku uygunluk antijenlerine MHC antijenleri veya ilk kez Lökositlerde gösterildiği için "İnsan Lökosit Antijenleri = Human Leukocyte Antigens = HLA" adı da verilmektedir. İnsanda; HLA-A, HLA-B, HLA-C, HLA-D, HLA-DR, HLA- DP, HLA-DQ olmak üzere yedi ana grup vardır. Doku ve organ nakillerinde HLA antijenlerine bakılarak aynı veya birbirine benzerlik gösterenler tercih edilir. Bu antijenler Mendel kurallarına göre soydan soya geçiş gösterirler. Akrabalık derecesi ne kadar yakınsa HLA antijenleri de o derece birbirine benzerdir. Tek yumurta ikizlerinde HLA antijenleri özdeştir (tamamen aynıdır). II Epitop Kuvvetli antijenler büyük moleküllerdir, bu maddelerin yalnızca belirli bir bölgesi antikor ile birleşir. Bu bölgeler antijen-antikor reaksiyonlarının özgüllüğünü sağlar ve Epitop olarak adlandırılır. Bir antijen üzerinde bulunan farklı determinantların sayısı moleküler hacim ve kimyasal kompleksivite ile ilişkilidir. Bir antijendeki epitop sayısı, her antijene bağlı olan antikor sayısı ile saptanır. Bu tür ölçümlerin değeri tüm alanların antikorla bağlanmasından dolayı azdır. Bu durum bir antijenik molekülde tüm epitoplar için özel antikorların belirli bir serum içerisinde bulunamayacağını anlatır. 16
17 Şekil II. 3. Epitop a (yeşil) bağlı antijen (turuncu). Antikor cevabı antijenik molekülün belirli kısımlarına karşıdır. Şekerler veya çok halkalı polimer protein bileşikleri ile yapılan çalışmalarda bir epitop yapısının 4-6 aminoasit veya şeker rezidüeleri şeklinde olduğu görülmüştür. Proteinlerin yüzey kısmından başka iç kısmı da antijenik olabilir. Bu sebeple büyük proteinler birçok güçlü epitoplar taşımaktadır. Polisakkaritlerin terminal yan zincirleri çok güçlü epitop bölgeleridir. Çok zincirli polipeptidlerin dış kenarında alanin, orta kısımda ise tirozinglutamik asit bulunur veya tersi durum (dış kısmında tirozin-glutamik asit, orta kısmında alanin) söz konusudur. İlk durumda antikorlar alanine spesifik iken, diğer durumda tirozinglutamik asit zincirlerine karşı spesifiktir. (Şekil II. 3. ) 3 tip epitop bulunur: 1. Lineer Epitop (sequental epitop): Epitopun aminoasitleri veya şeker rezidüelerinin hepsi yerleşim olarak antijenin lineer bir şekilde yer alır. Bu rezidüvler birbirlerine kovalent olarak bağlıdır. Bu tip epitoplar ısı ile denatürasyondan veya proteinin üçlü yapısını değiştiren işlemlerden etkilenmez. 2. Konformasyonel Epitop: Epitoplar üç boyutlu bir konformasyonda polipeptid veya polisakkarit bir zincir ile birleştirilerek bir arada tutulurlar ve denatürasyondan etkilenirler. 17
18 3. Neoantijenik Epitop: Proteinler kovalent modifikasyonlara tabi tutulursa (fosforilasyon, spesifik proteoliz gibi) kovalent yapı değişir ve yeni antijenik epitoplar oluşur. Bu yeni oluşan Antijenik epitoplara da neoantijenik epitop denir. II Hapten Düşük molekül ağırlıklı, basit kimyasal yapıda bazı maddeler gerçekte antijen olmadıkları halde, bir taşıyıcı proteine bağlandıkları zaman antijen niteliği kazanırlar. Kendilerine karşı antikor sentezlettirirler ve bu antikorla özgül olarak birleşebilirler. Bu maddeler Yunanca da bağlamak anlamına gelen Hapten olarak adlandırılır. Haptenler antijen molekülündeki epitop gibi davranırlar (Şekil II. 4.). Burada özgül uyaran hapten molekülüdür ve antikorlar, taşıyıcı proteine değil, haptene karşı meydana gelirler. Oluşan özgül antikorlar, taşıyıcı molekül olmadığı zaman da, sadece hapten ile birleşebilirler. Bazı basit yapılı kimyasal maddeler ve ilaçlar da organizmaya girdiklerinde, hapten gibi davranarak taşıyıcı bir moleküle tutunur ve antijenik uyarıma neden olabilirler. Bu tip maddelere karşı bazı alerjik reaksiyonlar bu mekanizma ile meydana gelirler. Şekil II. 4. Fab fragmanına bağlı Hapten (sarı). 18
19 BÖLÜM III III. 1. ANTİKORLAR (İMMÜNOGLOBÜLİNLER) Antikorlar, vücuda giren yabancı hücreler için üretilen glikoprotein yapısında moleküllerdir. Bu moleküller, savunma sisteminin askerlerinden biri olan B hücreleri tarafından üretilirler. Antikorlar istilacıları etkisiz hale getirirler. Başlıca iki görevleri vardır: Birincisi, vücuda giren düşman hücreye (antijene) bağlanmak. İkincisi, bağlanma gerçekleştikten sonra antijenin biyolojik yapısını bozmak ve antijeni yok etmek. Kanda ve hücre dışı sıvıda bulunan antikorlar, hastalıklara yol açabilen bakterilere veya virüslere bağlanırlar. Bağlandıkları yabancı molekülleri, bedenin savaşçı hücreleri için işaretleyip etkisiz hale getirmiş olurlar. Antikor bağlanacağı düşmana (antijene), üç boyutlu bir yapıda, tıpkı bir anahtarla kilit arasındaki uyum gibi tam olarak oturur. Vücut karşılaştığı hemen hemen her düşmana uygun bir antikor üretebilir. Üstelik üretilen antikorlar, tek bir tip değildir. Her düşman için onun yapısına uygun, onunla başa çıkabilecek bir antikor hazırlanır. Çünkü bir hastalık için üretilen antikor, başka bir hastalık için etkisizdir. Her patojene uygun özel bir antikor üretilebilmesi için, B hücrelerinin karşılaştıkları her antijeni çok iyi tanımaları ve yapılarını çok iyi bilmeleri gerekir. Yaklaşık olarak yüz milyon civarında değişik antikor meydana getirilebileceği tahmin edilmektedir. Bu kadar çeşitli antikor yapabilmenin sırrı immünoglobülin genlerinin düzenlenmesi ile değişik kombinasyonlar yapabilmesinde saklıdır. Evrende çok çeşitli antijenler bulunduğu için buna karşı meydana gelen antikorlarda çok çeşitli olacaktır. Bu nedenle antikorlar heterojendir. Bu heterojenitesi, seroloji ve elektroforez gibi çeşitli metotlarla gösterilebilir. İmmünoglobülinlerin moleküler seviyedeki incelenmesinde enzim ve bazı indirgeyici ajanlarla immünoglobülin moleküllerini küçük parçalara ayırdığının gösterilmesi önemlidir. Diğer taraftan myelomalı hastaların kanlarında saf immünoglobülin tespitide incelemeleri kolaylaştırmıştır (Şekil III. 1.). 19
20 Şekil III. 1. :multiple myeloma, [plazma hücreleri tarafından anormal sayıda, tek tip antikor üretimi sonucu oluşan bir hastalık]. Her bir immünoglobülin ikisi hafif ikisi de ağır olmak üzere dört tane zincirden meydana gelmiştir. 25 kd luk hafif zincir ve 50 kd luk ağır zincir yapıları birbirlerine disülfid bağı ile bağlanırlar, her bir ağır zincirde kendi aralarında disülfid bağı ile birbirlerine tutunarak, immünoglobulinin iskeletini taşırlar (Şekil III. 2.). Şekil III. 2. : İmmünoglobülin iskeletinin temel yapısı. 20
21 III. 2. ANTİKORLARIN SENTEZLENME SÜREÇLERİ İmmün sistemin temel hücresi lenfositlerdir. Lenfositlerde kalıtsal olarak immün cevap ile ilgili ürünleri sentezleme yeteneği vardır. Nasıl çeşitli hormon ve enzimleri yapan ve salgılayan özel hücreler varsa, lenfositler de antijenle uyarıldıklarında immünoglobülin (= antikor) ve diğer immün cevap maddelerini sentezlerler. Ig'ler antijenle uyarılan B- lenfositlerin değişimi ile oluşan plazma hücrelerince sentezlenirler. Hayvanlar yabancı kimyasal gruplara karşı spesifik antikorlar oluşturabilirler. Buna örnek olarak; Dinitrofenil grubu (DNP) na belirgin bir şekilde cevap oluşur ve antikorlar oluşturulur. DNP için oluşturulan spesifik antikor yani anti-dnp antikoru oluşumunda şu yollar izlenir; i. DNP grubu BSA (bovine serum albümin) antijeni ile birlikte kovalent olarak etkileşime girer. DNP, BSA üzerindeki nükleofilik bağlanma bölgelerine bağlanır. (Şekil III. 3.) Şekil III. 3. : Dinitrofenil bovin serum albumin (DNP-BSA) bir çeşit antijen 21
22 ii. DNP-BSA antijeni tavşana enjekte edilir. 1 2 gün içerisinde tavşan serumunda anti-dnp antikoru oluşumu belirlenmiştir. Bu erken gelen antikor moleküllerinin ise immünoglobülin M sınıfına (IgM) ait olduğunu saptanmıştır. IgM yaklaşık 1000 kd ağırlığındadır. (Şekil III.4.) Şekil III. 4. : immün cevap oluşumunda IgM ve IgG miktarlarının haftalara göre değişimi iii. iv. Antijen enjeksiyonundan yaklaşık olarak 10 gün sonra IgM seviyesinde düşüş gözlenmiş. Bu düşüş esnasında başka bir çeşit anti-dnp antikoru seviyesinde artış meydana gelmiştir. Diğer oluşan antikor ise IgG dir. IgG nin moleküler ağırlığı 150 kd civarındadır. IgG miktarı enjeksiyondan 3 hafta geçmesine rağmen değişmeden kalıyor. Bu devrede yeniden DNP-BSA antijeni enjekte edildiğinde IgG miktarının yeniden arttığı gözleniyor. v. Tavşandan alınan kandan, serum hazırlanıyor. Bu hazırlanan seruma antiserum deniliyor. Antiserum içerisinde büyük çoğunluğu IgG olan ~1mg/ml anti-dnp antikoru mevcuttur. vi. Anti-DNP antikoru serumdaki diğer proteinlerden kromatografi yöntemiyle ayrılıyor (örneğin; DNP kolonlu afinite kromatografisi). 22
23 İmmün cevap oluşumunda halen çözümlenemeyen konu Ig'lerin çok sayıda farklı antijene özgül olacak şekilde nasıl sentezlendiğidir. Ayrıca immün sistem doğada bulunabilecek tüm antijenik maddeleri tanıyabilme ve immün cevap oluşturabilme yeteneğinde iken kendi vücut yapısındaki antijenik maddelere karşı immün cevap oluşturmaz ve sessiz kalır. Bu karışık olayların oluş mekanizmalarını anlamak araştırmacıları uzun yıllardan beri meşgul etmektedir. Antikorların nasıl sentezlendiği konusunda bugüne kadar ileri sürülen hipotezler (varsayımlar) şunlardır; III Yan Zincirler Teorisi 1897'de P.Ehrlich tarafından ileri sürülmüştür. Ancak geçerliliği kalmamış olup, sadece tarihi değeri vardır. Bu teoriye göre hücrelerde besin maddelerini yakalayabilmek için her besin maddesine uyan almaçlar (reseptörler) vardır. Antijenler, hücrelerdeki bu reseptörlere rastlantı olarak benzer yapıda ise onlarla birleşirler. Ancak bu birleşme reseptörün görevini bozar. Hücrenin beslenmesi bozulur ve hücre yaşamını sürdürebilmek için çok sayıda reseptör yapmaya başlar, bunların fazlası dolaşıma geçer. Bunlar da antikor molekülleri denilmekteydi. III Kalıp Teorisi (= Direktif Teori) 1930'da F. Haurowitz tarafından ileri sürülmüştür. Bu teoriye göre, organizmaya giren antijenler Ig sentezlemekte olan hücrelere göç ederler ve Ig molekülleri antijeni bir kalıp gibi kullanarak ona uyacak şekilde aminoasit dizilişlerini şekillendirirler. Antijene uygun Ig sentezinin sürekli olması için de antijenin kısımları hücrede kalır ve böylece özgül antikorlar sentezlenmiş olur. Ancak son yıllarda yapılan çok duyarlı deneylere karşın Ig sentezleyen hücreler de antijene rastlanmamıştır. Ayrıca immünoglobülinler protein yapısında olduklarına göre bir kez sentezlendikten sonra yapılarının değişmesinin mümkün olmadığı bugün bilinmektedir. Bu nedenlerle teori desteğini kaybetmiştir. III Öğretici Teori (Instructive Theory) Enzimler sahip oldukları spesifik özellikleri, milyonlarca yıl evrimleşerek kazanmışlardır. Antikorlar yabancı antijenlere karşı çok kısa süre de, yalnızca hayvan serumu içerisinde, antijene spesifik bir şekilde sentezlenebiliyorlar. Bu kadar kısa sürede spesifik bir şekilde üretilmelerini öğretici teori ile açıklayabiliriz. Antikorlar antijene özgü üç boyutlu yapılarını ve dolayısıyla işlevlerini, antijeni şablon olarak kullanarak kazanıyorlar (anahtar = antikor; antijen = kilit). Bu model de, bir çok farklı 23
24 kombinasyonlar bir araya gelerek, farklı aminoasit dizilimleri sayesinde spesifik antikor moleküllerini oluşturur. Öğretici teoride; eğer ortamda antijen yoksa ve antikoru denatüre edip açılmasını sağladıktan sonra tekrar katlanmasına izin verilirse, antikorun eski yapısına ve dolayısıyla işlevine kavuşamayacağı kabul ediliyor. Christian Anfinsen ise ribonükleaz ın yapısı açılıp kapansa da, antijen varlığında yeniden eski haline gelebildiğini ispatlamıştır. Bu deneysel sonuçta öğretici teorinin geçersizliğinin bir göstergesidir (Şekil III. 5.) Şekil III. 5. : Antikorların denatüre olduktan sonra yeniden üç boyutlu yapısına dönmesi. III Klonal Seçilim Teorisi (Selektif Teori, Clonal Selection Theory) 1955'te Jerne, 1957'de Burnet tarafından ileri sürülmüştür. Günümüzde de destek görmektedir. Bu teoriye göre; immün cevap verme yeteneğindeki hücrelerden biri veya bir grubu, tek bir antijen veya benzer yapıdaki bir grup antijen determinantı ile birleşebilme ve cevap verebilme yeteneğindedir. Böylece canlılarda, her biri bir antijene yanıt verebilecek yetenekte, birbirinden farklı, çok sayıda lenfosit bulunduğu kabul edilmektedir. Organizmaya giren antijen kendisine uyan hücreyi (B-lenfositi) bulur, bağlanır ve onu uyarır. Sadece onu seçmiş olur. Uyarım sonucu lenfositler hızla çoğalmaya başlar. Böylece belli bir antijene karşı özgül antikor sentezleyebilen bir hücre kolonisi (= klonu) meydana gelmiş olur. Ancak lenfosit yüzeyindeki Ig reseptör farklılığının nasıl oluştuğu bu teori ile açıklanamamaktadır (Şekil III. 6.). 24
25 Şekil III. 6. : Klonal seçilim teorisi (Clonal Selection Theory). 25
26 III Somatik Rekombinasyon Antikor sentezi için bulunan az sayıda genin antijenik uyarım sonrası mutasyona uğraması ile antikor farklılığının sağlandığını ileri süren "somatik mutasyon teorisi" vardı. Ancak antijenlerle bu kadar çok mutasyonun gerçekleşebileceği inandırıcı bulunmadığı için bu teori geçerliliğini kaybetmiştir. Daha sonraları, Somatik Rekombinasyon Teorisi, ileri sürülmüştür. Bu gerçeğe en yakın teori olarak kabul edilmiştir. 1976'da Tonegawa'nın çalışmaları (Şekil III. 7.) ile fare embriyo hücrelerinde, antikorun değişken (V) ve sabit (C) bölgelerine ait genler birbirinden uzakta iken, antikor sentezleyen plazma hücrelerinde bu genlerin bir arada bulunduğu saptanmıştır. Ayrıca immünoglobülin (Ig) molekülünün antijenle bağlanan ve değişken olan (V) bölgesi için çok fazla sayıda, sabit (C) bölgeleri için ise bir veya birkaç gen bölgesi bulunmuştur. B lenfositlerin gelişme sürecinde değişken bölge (V) genlerinden bir kısmı yer değiştirmekte ve DNA zincirinde yeniden düzenlenme olmaktadır. Ayrıca değişken bölge (V) genlerinde yüksek sıklıkta mutasyon olduğu da gösterilmiştir. Böylece antijenik uyarım sonucu B lenfositleri çoğalırken, genlerdeki rekombinasyona ek olarak, değişken bölge (V) genlerinde mutasyonlar oluşur ve antijene en iyi uyum sağlayan antikor çeşitleri sentezlenmiş olur (Şekil III. 8. ). Şekil III. 7. : Susumu Tonegawa 26
27 Şekil III. 8. :Somatik Rekombinasyon ve RNA kırpılması ile çeşitli proteinlerin sentezi. [Susumu Tonegawa, Somatic Generation Of Immune Diversity Center for Cancer Research and Department of Biology, Massachusetts Institute of Technology, Cambridge, Massachusetts, U.S.A., Nobel lecture, December 8, 1987]. 27
28 III Alternatif Kırpılma Pre-mRNA işlemesinde kesip-ekleme işleminin merkezi rol oynaması, gen ekspresyonu düzenlemesinin, kesip-ekleme düzeneğinin kontrolünde olma olasılığını gündeme getirdi. Çoğu pre mrna, birçok intron içerdiğinden, aynı genin 5 ve 3 kesim bölgelerinin farklı kombinasyonları ile farklı mrna lar üretilebilir. Ekzonları çeşitli kombinasyonlarda birleştirme olasılığı, pre-mrna dan çok sayıda mrna meydana getirerek (ve bu yüzden birçok protein), gen ekspresyonunun kontrolünde yeni, bir yol sağlar. Alternatif kesip-ekleme adı verilen bu olay, kompleks ökaryotların genlerinde sık görülür. Örneğin, alternatif kesip-eklemenin ortalama memeli geninden, üç veya daha fazla mrna üretimi ile sonuçlanacağı tahmin edilmekte ve bu durum, memeli genomlarındaki tahmini gen ile kodlanabilecek proteinlerin çeşitliliğini önemli ölçüde arttırmaktadır. Alternatif kesip-ekleme modelleri farklı dokularda değişebileceğinden, alternatif kesip-ekleme gen ekspresyonunun doku spesifik ve gelişimsel düzenlemeleri için önemli bir mekanizma oluşturur. Doku spesifik alternatif kesip-ekleme için iyi çalışılmış bir örnek; aynı premrna nın alternatif kesip-eklenmesinin, sineğin erkek veya dişi olmasını belirlediği, Drosophilia da cinsiyet belirlenmesidir (Şekil III. 9.). Transformer adı verilen bir genin pre-mrna sının alternatif kesilip-eklenmesi, sadece dişi sineklerde eksprese olan bir protein (SXL) ile kontrol edilir. Transformer premrna üç ekzona sahiptir. Fakat iki farklı cinste, alternatif 3 kesim bölgelerinin kullanılması sonucunda mrna ya farklı bir ikinci ekzon katılır. Erkeklerde, ekzon1, U2AF kesip-ekleme faktörünün ekzon2 deki dizilere bağlanmasıyla belirlenen, 3 kesim bölgelerinin oldukça yukarısına bağlanır. Dişilerde SXL proteini ekzon2 deki bu bölgeye bağlanarak, U2AF nin bağlanmasını engeller. Sonuç olarak, dişilerde yukarıdaki 3 kesim bölgesi atlanır ve bunun yerine ekzon1, daha aşağıdaki bir alternatif 3 kesim bölgesine bağlanır. Erkek transformer mrna sında bulunan ekzon 2 dizileri, proteine çevrimi sonlandırıcı kodon içerirler ve böylece hiç protein üretilmez. Bu sonlandırıcı kodon, dişi mrna sında bulunmaz ve dişi sinekler, cinsiyet belirlemesinden anahtar düzenleyici olarak davranan, fonksiyonel Transformer proteinini eksprese ederler. Transformer ın alternatif kesilip eklenmesi, bir kesip-ekleme faktörünün (U2AF) bağlanmasını bloke ederek fonksiyon gösteren represörün (SXL proteinin) etkisini açıklamaktadır. Diğer durumlarda alternatif kesip-ekleme başka şekilde tanınmayacak 28
29 kesim bölgelerini kesip-ekleme faktörlerinin bağlayan aktivatörlerle kontrol edilir. Böylece alternatif kesip-eklemeyi birçok mekanizma denetleyebilir. Alternatif kesip-ekleme çeşitliliği, gelişim ve farklılaşma sürecinde sentezlenmesi gereken proteinlerin çeşitliliğine büyük bir katkı sağlar. Şekil III. 9. : Drosophilia da cinsiyet belirlenmesinde alternatif kesip ekleme 29
30 III. 3. ANTİKORLARIN MOLEKÜLER YAPISI İmmünoglobülinler glikoprotein yapısında olup %82 ila %92 si polipeptid ve %4-18 i ise karbonhidratlardan meydana gelmiştir. Karbonhidratlar basit veya kompleks yan zincirler halinde, daha çok oligosakkarit şeklindedir. Oligosakkaritler N-asetil glukozamin uçları ile polipeptid zincirindeki bir asparjine N-glikozidik bağı ile bağlanır. Oligosakkarit dallar galaktoz ile sonlanır ve N-asetil nörominik asit bu galaktoza tutunur. Antikorlar bifonksiyonel moleküllerdir. Bir yandan antijene bağlanma özelliği gösterirlerken bir diğer yandan Efektör fonksiyonu gösterir ve mast hücrelerinden histamin salınımı gibi fonksiyonu vardır. Efektör fonksiyon immünoglobülinin hedef dokuya veya immün sistem hücrelerine bağlanmasını ve kompleman aktivasyonunu içerir. Aynı zamanda fagositozu kolaylaştırır ve transplasental olarak geçer. Her bir immünoglobülin de iki tür polipeptid zinciri bulunur. İki uzun H zinciri ve iki kısa L zinciri şeklinde birbirlerine disülfid bağları ile bağlı şekildedirler (Şekil III.10.). Şekil III İmmünglobülin molekülündeki L ve H zinciri ile disülfit bağlarının gösterimi. İlk tamamlanan aminoasit frekansı myeloma L zinciridir. Bu zincirin 214 aminoasitten oluştuğu 1965 yılında belirlendi. Yapılan çalışmada L zincirinin dimerli bir yapıya sahip ve farklı hastalardan izole edildiğinde (ilk izolasyon 1847 de Henry Bence- Jones tarafından gerçekleştirildi, bu sebeple L zincirine Bence-Jones proteini de denilmektedir) farklı aminoasit dizilimine sahip olduğu görüldü. En çarpıcı gerçek ise, 30
31 farklı aminoasit dizilimlerinin, polipeptid zincirinin amino terminal ucundaki aminoasit diziliminde olmasıdır. Her bir Bence-Jones proteininin (L zinciri) aminoasit frekansının 1 ila 108. aminoasitler arasında değişiklik gösterdiği kanıtlanmıştır. Bu farklılık birçok farklı aminoasit dizilimlerinde 109. pozisyondan sonra görülmemiştir. Böylece; L zincirinde, değişken bölge (1 ila 108. aminoasit rezidüelerinde) ve sabit bölge (109 ila 214. aminoasit rezidüelerinde) bulunduğu kabul edilmiştir (Şekil III. 11.). H zinciri 446 aminoasit içermektedir ve L zincirinden iki kat daha uzundur. H zinciri analiz edildiğinde farklı myeloma immünoglobülinlerinde, farklılık gösteren kısmın amino terminal uçta bulunduğu ve 109. aminoasit pozisyonundan sonra değişkenlik görülmediği belirlenmiştir. Böylelikle H zinciri, tıpkı L zinciri gibi değişken ve sabit bölgelerden oluşmuştur. H zincirindeki değişken bölge, L zincirindeki değişken bölge ile aynı uzunlukta fakat sabit bölge ise L zincirine göre üç kat daha uzundur (Şekil III.11.). Şekil III.11. İmmünoglobülin yapısındaki L zinciri, H zinciri ile değişken bölgeler (yeşil), ve sabit bölgeler (sarı) olarak görülmektedir. Hipervariable bölgeler (CDRs) ise kırmızı renkte görülmektedir L ve H zinciri 3 segmentten oluşurlar. Bu segmentlerden biri diğer değişken bölgelerden çok daha fazla değişkenlik gösteren hipervariable bölgelerdir (Şekil III.11.) de Elvin Kabat antijen bağlanma bölgesinde bulunan ve antikor spesifitesini 31
32 sağlayan, aşırı değişken aminoasit rezidüeleri olan hipervariable bölgelerin bulunabileceğini öne sürdü. X-ray kristalografi çalışmaları ile kısa süren tartışmalar sonunda da bu fikir kabul edildi. Hipervariable bölgeler aynı zamanda tamamlayıcı bağlanma bölgeleri (CDRs-complementarity-determining regions) de denir çünkü antikor spesifitesini bu bölgeler sağlar. Hipervariable bölgeler 10 aminoasit uzunluğundadır. İmmünoglobülinler homolog domainlerden oluşurlar. İmmünoglobülin molekülünün aminoasit dizilimi 1968 de Gerald Edelman tarafından tamamlandı. Aminoasit dizilimindeki bazı özellikler şunlardır; 1. Değişken bölgedeki L zinciri (V L ) ile sabit bölgedeki L zinciri (V H ) benzer aminoasit dizilimlerine sahiptirler. 2. Ağır zincirin sabit bölgesi (C H ), üç eşit uzunlukta ve benzer dizilimde bölgelerden oluşur (C H 1, C H 2, C H 3) (Şekil III. 12.). 3. Ayrıca sabit bölgenin L zinciri (C L ), sabit bölgenin ağır zincirine en yakın bölgedir (Şekil III. 12.). 4. L ve H zincirlerinin her ikisinin de zincir içi disülfid bağları birbirlerine benzer noktalarda görülmektedir. (Şekil III. 12.) Şekil III. 12. İmmünoglobülin domainlerinin yapısı. [G.M. Edelman, The structure and function of antibodies, Copyright 1970 [by Scientific American, Inc. All rights reserved]. Bu benzerlikler immünoglobülinlerin sıkıca katlanmış ve her birinini birbirinden ayıran moleküler fonksiyonlara sahip domainler olduğunu gösterir. Böylelikle benzer 32
33 domainler tersiyer yapıda bulunurlar. Bu yapıda bulundukları x-ray kristalografisi çalışmaları ile görülmüştür. Bu üç boyutlu yapıda bulunan Fab fragmenti insan immünoglobülinlerinde 2,0 Ǻ rezolüsyonda görülmüştür. Bu parça dört globüler alt birimden oluşmuş (V L, V H, C L, ve C H 1) ve tetrahedral bir yapıda düzenlenmiştir (Şekil III.13 III. 14.). Şekil III. 13. Antikor molekülünün Fab unitesinin yapısı. L zinciri (mavi), H zinciri (kırmızı). Sağda şematik diyagramı, solda space-filling model. [Drawn from 1fve.pdb. C. Eigenbrot, M.Randal, L. Presta, P. Carter and A. A. Kossiakoff. J. Mol. Biol. 229 (1993):969.] 33
34 Şekil III.14. Fab parçasının anti paralel β tabakalı yapısı. Fc ünitesi Efektör fonksiyona sahiptir (komplement fiksasyonu, plasental geçiş gibi). İki C H 2 ve iki C H 3 domaininden oluşur (Şekil III: 15.). İmmünoglobülinlerin biyolojik özellikleri bu bölgedeki aminoasit dizisi ile tanınır. Bu bölge hücre yüzeylerinde bulunan Fc reseptörleri tarafından tanınır. Ayrıca Fc ünitesi, papain veya pepsin muamelesi sonucu immünoglobülin yapısındaki C H 3 bölgesindeki aminoasit rezidüelerinden ayrılması ile oluşur. 34
35 Şekil III. 15. Antikor molekülünün Fc ünitesi yapısı. H zinciri (kırmızı ve sarı), karbonhidrat üniteleri (yeşil ve mavi). Sağda şematik diyagram, solda atomik model. [drawn from 1fc1.pdb. J. Deisenhofer. Biochemistry 20 (1981):2361.] III Değişken Bölgenin Özellikleri Her iki zincirin amino terminal ucunda bulunan değişken bölge antijen tanıma ve bağlanmadan sorumludur. Değişken olarak isimlendirilmesinin nedeni; aminoasit dizindeki çeşitliliktir. Aminoasit dizisindeki değişiklik bir B lenfositinin ürettiği klon tarafından üretilen antikorun, diğer klonda üretilenden farklı olmasına neden olur. Çeşitli spesifitelerde de antikor oluşması içinse, molekülün değişken kısmının farklı ve çeşitli olması gerekir. Variable kısmını şifre eden genler, germ formunda, sabit bir bölgede olmayıp, kromozom boyunca dağılmış küçük gen segmentleri şeklinde bulunurlar. B hücresinin gelişip, immünoglobülin sentezlemesi için, bu gen segmentlerinin bir araya gelip, fonksiyonel bir gen teşkil etmesi gerekir. Bu gen segmentlerinin bir araya gelebilmesi için, DNA segmentlerini kesme, yeniden dizme ve yan yana getirme gibi oldukça çeşitli işlemlere gerek vardır. Bu işlemleri meydana getirecek enzimler yalnız gelişmekte olan lenfositlerde tespit edilmiştir. 35
36 III Sabit Bölgenin Özellikleri Her iki zincirinde karboksil ucunda sabit yani constant bölge bulunur. constant bölge antikorların etki görevlerinden sorumludur. Üç ya da dört Ig domaini bulunur. Constant bölge diğer etki molekülleri ve hücrelerin bir birleriyle reaksiyona sokarak antikorların görevlerini yerine getirmesini sağlar. Ağır zincirin karboksi terminal bölgesi B lenfositlerin yüzeylerine bağlanmasını sağlar. Diğer taraftan Ig ağır zincirinin C (constant-sabit) parçası, her immünoglobülin molekülünde, immünoglobülin cinsine bağlı olarak, γ, α, ε, μ, δ şeklindedir; ancak antijen spesifitesini belirlemez. III. 4. İMMÜNOGLOBÜLİN KATLANMASI Tüm antikorlarda üç boyutlu yapı, β-tabakalı yapıdan oluşur. Hidrofobik zincirler β- tabakalı yapıyı disülfid bağlarıyla birbirine sıkıca paketlemiştir. Bu sıkı paketlenmiş yapıya immünoglobülin katlanması (immunoglobulin fold) denir (Şekil III. 16.). Şekil III. 16..(A) İmmünoglobülin domainlerini oluşturan β tabakalı yapı (mavi ve sarı)ve disülfid bağları ile paketlenmiş formu (immünoglobülin fold). (B) CDR1, CDR2, CDR3 yapılarının β tabakalı yapıları birbirine bağladığı bölgeler. [C. Branden ve J. Tooze. Intraduction to Protein Structure (Garland, 1991) p.185] 36
37 Tamamlayıcı tutunma yapan bölgeler (CDRs) V L ve V H yapıları arasında görülür. X-ray kristalografi analizleri ile hipervariable bölgelerin (CDR1, CDR2, CDR3), antijenlerin bağlandığı uçtaki düğüm bölgesinde bulunduğu görülmüştür (Şekil III.16. B ). CDR 1 2 ve 3 numaralı β tabakalı yapılar arasında ortaya çıkar. CDR3 ise 6 ve 7 numaralı β tabakalı yapılar arasında ortaya çıkar (Şekil III. 16.). değişken bölge domainleri immünoglobülin katlanmasında ekstradan iki β tabakalı yapı oluşturur ve bu iki ayrı tabakayı ise CDR2 bir arada tutar (Şekil III. 16.). III. 5. ANTİJEN ANTİKOR BAĞLANMA BÖLGELERİ İmmünoglobulin G, serumda bulunan en önemli antikordur yaklaşık 150kd ağırlığındadır. Bu büyük proteinin aktivitesini yitirmeden fragmentlere ayırarak yapısını incelemek için 1959 da Rodney Porter bir çalışma yapmıştır. İmmünoglobülin G yi papain ile muamele etmiş ve proteolitik yıkımla 50 kd luk üç fragmente ayırmıştır (Şekil III.17.) IgG Papain 2 F ab + F c (150 kd) (her biri 50 kd) (50kd) Şekil III. 17. : Papain muamelesi sonucu üç parçaya ayrılan IgG molekülü. Bu iki fragment antijene bağlanır. Bu fragmentlere F ab (F=fragment, ab=antijene bağlanan) denir. Her bir F ab, antijenler veya haptenler için bağlanma bölgeleri içerir ve 37
38 bütün moleküller için aynı bağlanma afinitesine yani ilgisine sahiptirler. Bununla birlikte, F ab moleküllerinin kolları çok esnektir bu esneklik sayesinde çoklu bağlanma bölgeleri içeren antijene kolayca bağlanabilir. İmmünoglobülin G iki benzer antijen bağlanma bölgesi içerir (Şekil III. 19). Şekil III. 18. İmmünoglobülin G yapısı üzerine antijen bağlanma bölgeleri [U.S. national library of medicine sitesinden alınmıştır]. Şekil III. 19. IgG-antijen bağlanma modelleri. Diğer 50 kd luk fragment olan F c (F=fragment, c=kristalize) kolaylıkla kristalize olur, antijene bağlanmayan bölgedir fakat bütün biyolojik aktiviteler burada meydana gelir. F c bölgesinin koruyucu cevap oluşumunda efektör fonksiyonu na arabuluculuk görevi vardır (komplement fiksasyonu, plasental transfer gibi). İmmünoglobülinler diğer hücrelerde bulunan Fc reseptörü ile tanınır. Antijen antikor kompleksi makrofaj yüzeyindeki uygun F c reseptörüne bağlanarak, makrofaj tarafından içeri alınır. Çoklu bağlanma bölgeleri içeren antijenler F c reseptörüne bağlı antikorlara karşılıklı bağlanarak fagositozun başlamasını sağlarlar. Oluşan kompleks içeri alınır ve lizozom enzimleri ile sindirilir. F c fragmentleri aynı zamanda membran transportunda görevlidir. Örneğin; fetüse plasenta yoluyla antikor taşınması. Elektron mikroskobu ile yapılan çalışmalarda görüldü ki; IgG Y harfi şeklinde ve monomer yapıdadır. Bundan başka bir F c ve 2 F ab fragmentleri içerir ve fragmentlerin birleştiği ortak noktaya Hinge bölgesi denir. Hinge bölgesi, F ab ve F c ünitelerini bir arada tutan menteşe bölgesidir. Hinge bölgesi moleküle esneklik katar ve iki Fab kolunun 38
39 serbestçe hareket etmesine olanak sağlar Fab kolları arasındaki açı derece arasında değişir (Şekil III. 21.). Antijen bağlayıcı yüzeyin büyüklüğü 8 12 aminoasit veya 3 6 glikoz molekülünü kapsayacak şekildedir (Şekil III. 20.). Şekil III. 20. : Fab, Fc ve Hinge bölgesi. Şekil III. 21. : Hinge bölgesinin esnek yapısı. (A) kollar arasındaki açı 0 (B) kollar arasındaki açı 90 (C) kollar arasındaki açı 60. X-ray kristalografi çalışmaları ile Fab molekülünün yapısal avantajının 14 ten fazla hapten ve antijeni bağlayarak, antikor spesifitesine katkı sağladığı görülmüştür. Antijen antikor bağlanma modeli tıpkı enzim substrat bağlanmasına benzer. Örneğin; Fosforilkolinin, antikor bağlanma oyuğunda bulunan ikisi hafif (L), üçü ağır (H) zincirde bulunan beş CDRs molekülüne bağlanması (Şekil III.22.). Fosforilkolin yüzeyindeki pozitif gruplar, antikorun Fab bölgesindeki, negatif grup olan glutamat ile elektrostatik 39
40 etkileşime girerek bağlanır. Negatif gruplar, Fab bölgesindeki pozitif grup olan arjinin ile elektrostatik etkileşime girerek bağlanır. Fosforilkolin yüzeyindeki fosfat grupları ise, oyukta bulunan tirozin aminoasit indeki hidroksil grubuna, hidrojen bağları ile bağlanır (Şekil III. 23.). Bu kompleksin stabilize olmasını (sabit kalmasını) triptofan aminoasiti tarafından oluşturulan bir çok van der waals etkileşimi sağlar. Şekil III. 23. : Antikor bağlanma bölgesindeki Fosforilkolin (yeşil) bağlanma modeli. [E.A. Paldan, D.R. Davies, S. Rudikoff ve M. Potter. Immunochemistry (13 (1976): 945. ] Fosforilkolin bağlanması antikor yapısında önemli ölçüde bir değişiklik meydana getirmez. Buna karşılık diğer haptenler, önemli ölçüde konformasyonel değişiklik oluşturmaktalar. Çok sayıda zayıf elektrostatik etkileşimler, hidrojen bağları ve van der Waals etkileşimleri, hidrofobik etkileşimlerle birleşerek kuvvetli ve özgül bağlar oluşturuyor. Antikor, antijene bağlanırken bağlanma bölgesi enzimdeki katalitik bölge gibi yapısal değişime uğruyor. Bu değişim en elverişli bağlanmayı mümkün kılıyor. Böylelikle antikorun bağlanabileceği farklı türde antijen sayısı artırılmış oluyor. İmmünoglobülin molekülünde ağır ve hafif zincirin değişken parçalarının yan yana gelmesiyle immünojen spesifitesi sağlanmış olur. Çeşitli spesifitelerde de antikor oluşması için, molekülün değişken kısmının farklı ve çeşitli olması gerekir. Diğer taraftan Ig ağır zincirinin C (constant-değişmez) parçası, her immünoglobülin molekülünde, 40
41 immünoglobülin cinsine bağlı olarak, γ, α, ε, μ, δ şeklindedir; ancak antijen spesifitesini belirlemez. İmmünoglobülin genleri, germ hücreleri ve non-lenfositik hücrelerde, intakt ve fonksiyonel genler şeklinde bulunmazlar. Zira bu immünoglobülinlerin V parçasını şifre eden genler, germ formunda, intakt olmayıp, kromozom boyunca dağılmış küçük gen segmentleri şeklinde bulunurlar. B hücresinin gelişip, immünoglobülin sentezlemesi için, bu gen segmentlerinin bir araya gelip, fonksiyonel bir gen teşkil etmesi gerekir. Bu gen segmentlerinin bir araya gelebilmesi için, DNA segmentlerini kesme, yeniden dizme ve yan yana getirme gibi oldukça çeşitli işlemlere gerek vardır. Bu işlemleri meydana getirecek enzimler yalnız gelişmekte olan lenfositlerde tespit edilmiştir. 41
42 III. 6. HAFİF ZİNCİR SENTEZİ Hafif zincir molekül ağırlığı takriben kda kadardır. Hafif zincirin sabit kısmının (constant) özelliğine göre κ ve λ olmak üzere ikiye ayrılır. κ \ λ oranı insanlarda ikidir. Bir immünoglobülin de iki zincir bir arada olmaz. κ zincirinin oluşması, daha basit bir mekanizma ile olmaktadır. κ zincirini yapacak tüm gen segmentleri ikinci kromozomda mevcuttur (Şekil III. 24.). κ hafif zincirinin sabit (constant) kısmı ikinci kromozom üzerinde bulunan Cκ ekzonu tarafından yapılmaktadır. Kromozom üzerinde de yalnız bir tane Cκ ekzonu vardır. V bölgesi V ve J genleri tarafından kodlanır. κ geninin değişken (Variable) kısmını yapacak olan genler kromozom üzerinde iki bölgede bulunurlar. Bunlar variable (Vκ) ve joining (Jκ) segmentleri denir. V geninin bir bölümü koparak ayrılıyor ve bu parçalardan J adlı dört tane yepyeni bir gen dizisi oluşuyor. J genleri CDR3 hipervariable bölgeyi kodladıklarından antikor çeşitliliğinde son derece önemli rol oynamaktadırlar. V ve J bölgeleri farklı noktalarda birleşebiliyorlar; 95. aminoasite ait kodonun yakınlarında, V ve J nin farklı şekilde rekombinasyonu ile ~3000 farklı kısa zincir meydana gelebilmektedir. Şekil III. 24. kromozom 2 Vκ, değişken bölgede bulunan ilk 95 amino asidi yapar. Daha kısa olan J segmenti ise 96 ila 108 arası aminoasitleri yapar. Ck geni ise 109 ila 214 arası aminoasitleri yapmaktadır. Bir tane Ck geni bulunmasına karşın; Vk ve Jk genleri ise yapıları farklı ve birden fazla gen segmenti şeklinde bulunur (Şekil III. 25.). Şekil III. 25. : κ ve λ hafif zincir genleri. 42
43 J gen segmenti sabit (Constant) kısmına yakın olarak bulunduğu halde, değişken (Variable) gen segmenti yaygın olarak bulunmaktadır (tüm ikinci kromozomun %1 ini teşkil eder). J segmenti beş adet olmasına karşılık, yüzden fazla değişik şekillerde Vκ segmenti bulunur. Non-lenfoid hücrelerde Vκ ve Jκ segmenti, bu şekilde geniş aralıklarla ayrılmış halde bulunur. Öncül hematopoetik hücre, B hücresi meydana getirmek üzere yönlendiğinde; hücre, bir tane Vκ ve bir tane de Jκ segmentini de seçerek onları birleştirir. Böylece tek bir devamlı ekzon meydana gelir. Bir çok durumda birleşme, iki segmenti ayıran DNA parçasının spesifik enzimlerde delesyonu sonucu meydana gelir. Bu birleşme olduktan sonra transkripsiyon başlar. Vκ, Jκ, Cκ yı içine alacak şekilde gelişir. Böylece meydana gelen RNA da κ proteini sentezi için tüm bilgiler mevcuttur. Meydana gelen κ hafif zincirlerinde değişik Vκ ve Jκ zincirleri bulunacağı için, çok değişik antijen spesifitesinde olacaklardır (Şekil III ). λ; zinciri de aynı şekilde meydana gelmektedir. Ancak λ zincirinde 6 9 tane değişik Jλ ekzonları bulunur. Herhangi bir J gen segmenti ile birleşir. Meydana gelen Vλ / Jλ ekzonu Cλ segmentlerinden birisiyle beraber kopya edilir. Böylece Cα spesifitesini de taşıyan λ hafif zinciri meydana gelir. 43
44 Şekil III. 26. κ hafif zincir sentezi. [Elsevier Abbas & Lichtman, Cellular and Molecular Immunology]. Şekil III. 27.: Hafif zincir sentezi. [Janeway, Travers, Immunobiology 6th edition] 44
45 III. 7. AĞIR ZİNCİR SENTEZİ Tüm ağır zincirler 14.kromozom üzerinde bulunan genler tarafından şifrelenirler (Şekil III. 28.). Ağır zincirlerin sabit bölgeleri belirli ekzon kümeleri tarafından kodlanır. 9 ağır zincir türünü şifreleyen gen segmentleri 14. kromozom üzerinde arka arkaya dizilmiştir. Bu sıra şöyledir: CH, C-δ, Cγ3, Cγ1, Cα1, Cγ2, Cγ4, Cε, Cα2. Her birinden yalnız bir kopya vardır. JH ın sayısı 6 tanedir. Buna karşılık V H gen segmentlerinin kaç tane olduğu tam anlamıyla bilinmemektedir. Ancak birkaç yüz tane olduğu tahmin edilmektedir. Hafif zincirden farklı olarak ağır zincirde, üçüncü bir gen segmenti de olaya katılır. Buna D (diversty) gen segmenti denir. D gen segmenti V H ile J H arasında bulunur (Şekil III. 29.). D gen segmentinin Şekil III. 28.: sayısı en az 15 dir. Her bir D segmenti iki ila üç aminoasiti şifre eder. kromozom 14 Ağır zincir (Heavy chain) geni oluşması için iki tane düzenlenmeye gereksinim vardır. Önce D H ile J H segmenti düzenlenir. Meydana gelen D H -J H segmenti daha sonra V H segmenti ile birleşir. Bu şekilde V/D/J birleşmesi meydana gelmiş olur. Böylece çok çeşitli antikor spesifitesi gösteren ağır zincirler oluşur (Şekil III ). Örneğin; 200 V H, 10 D H ve 6 J H segmenti olduğu düşünülürse; (200x10x6) = değişik türde H zinciri meydana gelebilecektir. Bu da 500 değişik κ hafif zinciri ile birleştiğinde; x 500 = değişik antijeni bağlama kapasitesinde antikorlar oluşturabilecektir. Şekil III. 29. : Ağır zincir gen bölgesi 45
46 Şekil III. 30.: Ağır zincir sentezi [Janeway, Travers, Immunobiology 6th edition] 46
47 Şekil III. 31. Ağır zincir sentezi Her bir hafif zincir ağır zincirle eşleşirken, iki ağır zincir birbiri ile eşleşir. Hem ağır hem hafif zincir birbirleri ile Kovalent Etkileşim; disülfid bağları zincir içi ve zincirler arasında bulunur. Hafif zincirde iki, ağır zincirde dört adet zincir içi disülfid bağı bulunur. Zincirler arası disülfid bağları hafif zincirin sabit kısmı ile ağır zincirin C H 1 domaini arasında bulunur. Non-kovalent Etkileşim; hafif (V L ) ve ağır zincirin değişken (V C ) kısımları arasındaki ve hafif zincirin sabit kısmı ile (C L ) ağır zincirin C H 1 domaini arasındaki hidrofobik etkileşimler. En yoğun non-kovalent etkileşimler C H 3 domaini arasındadır. 47
48 III J ve D Genlerinin Antikor Çeşitliliğindeki Rolü V ve C genleri arasında baz uzunluğunda J genleri bulunur (Şekil III. 32.). İmmünoglobülin ağır zincirinde J genlerine ek olarak D genleri bulunur. İmmünoglobülin ağır zincirinde C gen kümelerinin 5 bölgesinde J gen kümesi (6 J segment) ve 20 den fazla D gen kümesi içeren, D genleri bulunur (Şekil III. 33.). Şekil III. 32. J genleri ve C genlerinin lokalizasyonu. Şekil III. 33. : Değişken bölgeyi kodlayan ağır zincir genleri D ve J gen segmentleri V bölgesinin karboksi ucunu kodlar. Ig hafif zincirde V bölgesi V ve J genleri tarafından kodlanır Ig ağır zincirde V bölgesi V, D ve J gen segmentleri tarafından kodlanır 48
49 III V(D)J Katılması V(D)J genlerinin düzenlenmesi için, gen kümeleri, 12 bp, diğeri ise 23 bp lik diziler ile ayrılmıştır. Bu düzenleme, için gerekli olan Rekombinasyon sinyali, yüksek derecede korunmuş olan heptamer ve oktamer dizilerden oluşur. Rekombinasyon oluşması bp lik dizinin varlığına bağlıdır. Rekombinasyonu gerçekleştirilen V(D)J genleri için 12 ve 23 bp lik korunmuş DNA dizilerinin lokasyonu ile sinyal dizisi doğru genlerin birleştirileceğini belirler (Şekil III. 34.). Şekil III. 34. : V(D)J rekombinasyonu. (12-23 rules) III. 8. AĞIR ZİNCİRDE İZOTİP DÖNÜŞÜMÜ (SWİTCH) V/D/J ekzonları birleştikten sonra yanındaki Cμ ekzonu ile kaynaşır IgM nin μ ağır zinciri oluşur. diğer C ağır zincir genleri yazılamaz. Diğer C ağır zincir genlerinin yazılması için molekülde izotip switch dönüşümünün olması gerekir. Bu durumda yeni bir C ağır zincir geni, V/D/J segmenti ile birleşir. Bunun olması için, yeni kullanılacak ağır zincirle, V/D/J segmenti arasında kalan DNA kısmının delesyona uğraması gerekir. Dönüşüm V/D/J rekombinasyon yeteneğinin artık kaybolduğu hücrelerde meydana gelir. Böylece ağır zinciri yapmak için birleşen V/D/J kısımları, herhangi bir C ağır zincir 49
50 gen segmenti ile birleşerek, değişik izotipte immünoglobülinler yapılmış olur. Dönüşüm hadisesi, delesyonla meydana geldiğinden geri dönüşümü olmayan bir mekanizmadır. Genel kaide olarak V/D/J birleşiminin, yanındaki C H zinciri eksprese olur. Bunun istisnası Cδ zinciri geni. Cμ genine çok yakın olarak bulunur ve genel olarak Cμ ekzonu ile beraber kopyalanır. Meydana gelen RNA daha sonra işleme uygulayarak μ veya δ mrna sını meydana getirir. Böylece IgM ve IgD molekülleri meydana gelir. IgM ve IgD nin beraber hücre yüzeyinde olması B lenfositlerinde sıklıkla görülen bir durumdur (Şekil III. 35.). IgA prosedürü IgG prosedürü Şekil III. 35. :izotip dönüşümü 50
51 III. 8. ANTİKORLARIN SINIFLANDIRILMASI III IgG IgG, normal insan serumundaki immünoglobülinlerin % 75'ini oluşturur. IgG molekülü Y harfi şeklinde, monomer yapıda ve kDa molekül ağırlığındadır. Erişkinde 100 ml. serumda 1000 mgr IgG bulunur. IgG molekülünde bulunan 2 tane Fab parçasına iki antijen bağlanabilir (Şekil III. 35.). Bu nedenle IgG iki değerlidir. Şekil III. 35.: IgG molekülünün yapısı. IgG'nin kan ve dokulardaki yoğunluğu eşittir. IgG plasenta yoluyla anneden fetüse geçebilen tek Ig'dir. Hamileliğin üçüncü ve dördüncü ayında IgG'ler anneden bebeğe geçmeye başlar ve bu geçiş doğuma kadar giderek artan oranlarda devam eder. Yeni doğan bir bebeğin kanında anneden geçen IgG'ler dolaşır. Böylece anneden bebeğe geçen IgG sınıfı özgül antikorlar doğumdan sonraki ilk aylarda bebeği, annenin dirençli olduğu çeşitli enfeksiyonlara karşı korumuş olur. Bebeğin kendi IgG sentezi ise doğumdan itibaren başlar ve 2 yaşında erişkin düzeye ulaşır. 40 yaşından sonra IgG düzeyinin tekrar azalmaya başladığı görülür. Kanda bulunan IgG, transüdasyon (sızma) ile external sıvılara da geçebilir. Annelerin ilk emzirdiği süt olan kolostrumda serumdan sızan IgG'ler vardır ve bebeğin bağırsak mukozasından geçerek, yeni doğan bebeğin bağışıklığını güçlendirirler. 51
52 IgG moleküllerinde antijenik ve menteşe gölgesinde iki ağır zincir arasındaki disülfid bağının sayısı açısından farklılık gösteren dört alt grup saptanmıştır. IgG 1 'de 2, IgG 2 'de 4,IgG 3 'de 15 ve IgG 4 'te 2 disülfid bağı bulunur. Tüm IgG'lerin %65'i IgG 1 'dir. IgG 2 %23'ünü, IgG 3 %8'ini, IgG 4 ise %4'ünü oluşturur. IgG 3 >IgG 1 >IgG 2 >IgG 4 III IgD Molekül ağırlığı kda olan, monomer yapıda bir immünoglobülindir. Serumdaki immünoglobülinlerin %0.2 kadarını oluşturur. Erişkinde 100 ml serumda 3 mgr bulunur. Isı ve proteolitik enzimlerle kolayca parçalanır ve kısa ömürlüdür. IgD'nin antikor aktivitesi olduğu kanıtlanamamıştır ve asıl işlevinin ne olduğu da tam anlaşılamamıştır. IgD, IgM ile birlikte, B-lenfositlerin yüzeylerinde bulunur. IgD muhtemelen B-lenfositlerin farklılaşmasında rol oynar (Şekil III. 36.). Şekil III. 36. IgD molekülünün ekspresyonu 52
53 III IgA Genel olarak yapısı IgG'e benzer. Ancak IgA molekülleri hem IgG gibi monomer halde (bir temel birim), hem de iki veya daha fazla monomerin J bağlayıcı polipeptid zinciri ile bağlanması sonucu dimer (iki temel birimli) veya trimer (üç temel birimli) halde bulunabilmektedir. Molekül ağırlığı monomer için kda, dimer için kda dur. IgA, insan serumundaki Ig'lerin %15'ini oluşturur. Erişkinde 100 ml. serumda 200 mgr IgA bulunur. Serumdaki IgA'ların %80'i monomer yapıdadır. IgA salgılarda bulunan temel Ig'dir. Solunum, sindirim ve genital sistem salgıları ile gözyaşı, tükrük, ve sütte IgA bulunur. Salgılardaki IgA molekülleri çoğunlukla dimer, çok az da polimer yapıdadır. Salgısal IgA molekülleri siga şeklinde gösterilirler. Salgısal IgA, serum IgA'sından farklılık gösterir. Bu farklılık, yukarıda da sözü edildiği gibi hem monomer ve dimer yapı farklılığı göstermeleri, hem de siga'da ek olarak salgısal parça (= Transport parça) bulunmasından ileri gelmektedir. siga genellikle sekretuvar dokularda, mukoza altındaki plazma hücrelerince sentezlenir ve epitel hücrelerinden geçerken salgısal parça ile birleşerek salgılanır (Şekil III. 37). Şekil III. 37. IgA fonksiyonu 53
54 Salgısal parça bir β (beta) globülindir. siga'lar serum IgA'sından farklı olarak proteolitik enzimlere dayanıklıdır. siga'ların oluşmasında sistemik enfeksiyonlardan çok yerel enfeksiyonların veya yerel antijenik uyarımların rolü vardır. siga dışarıdan giren mikroorganizmaların mukoza hücrelerine bağlanmalarına, burada yerleşmelerine ve enfeksiyon oluşturmalarına engel olur. Ayrıca besinlerle alınarak bağırsağa ulaşan, zararlı olabilecek makromoleküllerle birleşerek onların emilimini önler ve tahrip edilmelerini kolaylaştırır. IgA, çeşitli mikroorganizmalar tarafından oluşturulan toksik veya litik enzimleri de etkisiz hale getirir. Bu özellikleri nedeniyle siga, vücut savunmasında çok önemli rolü olan bir Ig'dir. IgA'nın, antijenik farklılık gösteren ve IgA1ve IgA2 olarak ifade edilen iki alt sınıfı bulunmuştur. IgA1 serumdaki IgA'nın %90'ını, IgA2 ise %10'unu oluşturur. Salgılarda ise IgA1 ve IgA2 oranı yarı yarıyadır. IgA, doğumdan itibaren 2. ayda sentezlenmeye başlar, yavaş yavaş yükselerek buluğ çağında erişkin düzeye ulaşır. 54
55 III Sekretuar Komponent ve J Zinciri IgA üniteleri polimerize olduklarında, disülfid bağlı polimerler meydana gelir. Sekresyonlarda bulunan IgA ise iki tane dört zincirli yapı ile beraber, sekretuar komponent ve J zincirini taşırlar. J zinciri polimer yapan tüm Ig moleküllerinde olduğu halde sekretuar komponent yalnız IgA da mevcuttur (Şekil III. 38.). IgA nın sekretuar veya J zinciri ile birleşmesi polimerizasyonu tahrik eder. Sekretuar parça genel olarak ya serbest halde veya non-kovalent şeklinde bağlarla bağlanır. Az bir kısım vakada, kovalent disülfid bağları mevcut olabilir. Sekretuar komponent gezici olmayan epitel hücreleri tarafından yapılır. IgA nın mukozal hücrelerden sekresyona geçmesini sağlar. Şekil III. 38. Sekretuar komponent mol ağırlığı olan tek bir zincirden meydana gelir. Karbonhidrat muhtevası yüksektir. Yapısal olarak immünoglobülin moleküllerine benzemez. J zinciri küçük asidik bir polipeptid olup, plazma hücreleri tarafından yapılır. J zinciri α ve J zincirlerinin sistein kısmına kovalent olarak bağlanır. Polimerizasyon için J zincirinin gerekip gerekmediği hususu açıklığa kavuşmamıştır. Hayvan incelemelerinden J 55
56 zincirinin polimerizasyon için şart olmadığı ancak mevcudiyetinde polimerizasyonunun kolaylaştığı anlaşılmıştır. III IgE Molekül ağırlığı olan monomer yapıda bir Ig'dir. Normalde serumda çok az bulunur ve Ig'lerin %0.004'ünü oluşturur. Erişkinde 100 ml serumdaki miktarı 0.05 mgr'dır. IgE, Fc parçası ile mast hücresi ve bazofil lökositlere bağlanabilme özelliğindedir. Bağlandığı zaman bu hücreleri duyarlı hale getirirler. IgE, helmint dediğimiz parazitlere karşı aktif bağışıklıkla, astım, saman nezlesi, ürtiker gibi çabuk tipteki aşırı duyarlılık reaksiyonlarında önemlidir. Hücrelere bağlı haldeki IgE'nin ömrü, serbest IgE'ye göre daha uzundur ve proteolitik enzimlere de daha dayanıklıdır. IgE komplemanı aktive etmez. Diğer Ig'lere göre ısıya daha duyarlıdır. IgE sentezleyen plazma hücreleri daha çok salgısal yüzeylerde (solunum, sindirim vb.) bulunur. Helmint enfeksiyonları ve alerjik durumlarda bu mukozaların salgılarında IgE miktarında artış olur. Şekil III. 39. IgE domainleri. 56
57 Şekil III. 40. IgE Fab bölgesi ve IgE reseptörü Mast hücreleri ve bazofillere Fc uçlarından bağlı haldeki IgE'ler özgül antijenleri ile (yani alerjenle) karşılaşıp onlarla birleşecek olursa bu hücreler uyarılır ve sitoplazmalarındaki granülleri boşaltırlar. Açığa çıkan maddeler ise çabuk tipteki alerjik reaksiyonları ortaya çıkarırlar. IgE alerjik reaksiyonlarda ve parazit enfeksiyonlarında rol oynar.bir antijenik uyarıma karşı özgül antikor sentezinin nasıl gerçekleştiği konusunda birçok görüş ileri sürülmüştür. Bunlardan en çok destek göreni doğal klon seçimi ve genetik temele dayanan görüşlerdir. III IgM IgM, normal insan serumundaki immünoglobülinlerin %10'unu oluşturur. En büyük Ig'dir ve makroglobulin de denir. Molekül ağırlığı olan ve 5 temel birimden oluşan bir pentamerdir. Şekil olarak IgG molekülüne benzeyen 5 tane monomerin disülfid bağlarıyla bağlanmasından oluşan yıldız şeklinde bir Ig'dir. Antijen uyarımında ilk sentezlenir, kısa ömürlüdür. IgM molekülünde ayrıca, beş tane monomeri birbirine bağlayan J bağlayıcı polipeptidi bulunur. IgM moleküllerinin büyük bir kısmı dolaşan kandadır (%80'i). Dokulardaki yoğunluğu daha azdır. IgM molekülleri plasentadan geçemezler. Ancak yeni doğan bir bebeğin serumunda IgM molekülleri gösterilirse, bu 57
58 bebeğin intrauterin dönemde bir enfeksiyon geçirdiği veya bir antijenle karşılaştığı söylenebilir. Bu nedenle pek çok sağlık merkezinde kordon kanında rutin olarak IgM tayinleri yapılarak enfeksiyon araştırılmaktadır. Normal koşullarda IgM doğumdan itibaren sentezlenmeye başlar ve 6-9. aylarda erişkin düzeye ulaşır. IgM'nin erişkin düzeyi 100 ml. serumda 100 mgr kadardır. Şekil III. 41. IgM pentamer yapısı IgM nin diğer önemli bir özelliği her türlü antijenik uyarımda (enfeksiyon, aşı, v.b) ilk ve en erken sentezlenen Ig olmasıdır. Enfeksiyon hastalıklarının akut döneminde IgM serum düzeyinde önemli artış görülür. Fakat IgM kısa ömürlü bir antikor olduğundan, serum düzeyi kısa bir süre sonra azalarak, yerini uzun süre koruyucu etkinlik gösteren IgG sınıfı antikorlara bırakırlar. Bu nedenle bir serum örneğinde IgG'ye göre daha yüksek miktarlarda özgül IgM saptanması akut (henüz geçirilmekte olan veya çok yeni geçirilmiş) bir enfeksiyonu düşündürür. IgM, antijen bağlama kapasitesi yanında, kompleman bağlama gücü de en yüksek olan Ig'dir. Fagositozu kolaylaştırır. İnsanda, serumdaki kan gruplarına ait izoantikorlar (anti-a ve anti-b) IgM sınıfı antikorlardır. Ayrıca B lenfosit yüzeyindeki Ig reseptörler de monomer IgM yapısındadır. 58
59 BÖLÜM VI IV. 1. MONOKLONAL ANTİKORLAR Hastalıklara yol açan bakteri, virüs ve diğer enfektif ajanlar gibi vücuda yabancı olan maddeler, antijen olarak bilinirler ve vücudun bağışıklık sistemi tarafından "istilacılar" olarak tanımlanırlar. Bu enfektif ajanlara karşı vücudun doğal savunma ajanlarıysa, antijenleri bulan ve yok eden bir protein çeşidi olan antikorlardır. Antikorların oldukça önemli iki özelliği, çeşitli hastalıklarla savaşımda onları son derece etkin kılar; 1) Her bir antikorun sadece tek bir antijene bağlanma özgüllüğü göstermesi 2) Bazı antijenlerin bağışıklık sistemini bir kez uyarmaları sonrasında o hastalık için ömür boyu dayanıklılık sağlaması (Örneğin; kızamık ve suçiçeği gibi çocuk hastalıklarına karşı vücudun ürettiği antikorlar, hayat boyu bu hastalıklara karşı vücutta direnç oluşmasını sağlar) Antikorların bu ikinci özelliğinden yararlanılarak, aşılar geliştirilmiş bulunuyor. Etkisiz hale getirilmiş ya da etkileri azaltılmış bakteri ya da virüslerin ya da yüzeylerindeki bu proteinden hazırlanan aşı, içeriğindeki antijenlere karşı vücutta antikor oluşumunu sağlar. Genel olarak, vücut tarafından sağlıklı dokuları hedef alan antikorlar üretilmez. Üretildiğinde vücudun bağışıklık sistemi bunlara saldırır. Yani "otoimmün" cevap oluşur. Ancak ilaç formunda vücuda alınan bu tip antikorlar, belirli düzensizliklerin düzeltilmesine yardımcı olur. Hastalıklarla savaşım sağlayan antikorların büyük miktarlarda ve saf olarak elde edilmesi, uzun süredir bilim insanlarını peşinden koşturan bir hedef. Kullanılan klasik yöntem; laboratuar hayvanlarına antijen verilmesi sonrasında oluşan antikorların toplanması. Ancak, bu yöntemde iki önemli sorunla karşı karşıya kalınır: elde edilen antiserum içerisinde istenmeyen birçok maddenin bulunması ve bu nedenle de elde edilen kullanılabilir antikor miktarının oldukça düşük olması. Monoklonal antikor teknolojisi İle antikorların saf halde ve oldukça büyük miktarlarda üretilmesi olanaklı hale gelmiş bulunuyor. Bu amaç için kullanılan yöntem, basitçe şöyle: Öncelikle, istenen antikorları doğal olarak üreten hücreler elde edilir. Daha sonraysa bu hücrelere sonsuz bölünme yeteneği kazandırılır ve kültür ortamında, İstenen antikoru üretecek hibrid (melez) hücreler 59
60 geliştirilir. Bu şekilde doğal hücreler, kültür ortamında birer antikor fabrikasına dönüştürülmüş olur. Örneğin, myeloma, kemik iliğinde oluşan ve hücre kültüründe üretilmeye uygun olan bir tümör tipi. Myeloma hücreleri, antikor üretme yeteneğine sahip olan dalak hücreleri ile kaynaştırdıklarında, oluşan hibrit (melez) hücreler büyük miktarlarda monoklonal antikor üretebilir. Bu şekilde, iki farklı hücre tipinin istenen özellikleri birleştirilmiş olur (sürekli olarak bölünme yeteneği ve büyük miktarlarda saf antikor üretebilme yeteneği). Bu teknolojide, sonsuz bölünme yeteneğine sahip tümör hücreleriyle antikor üretebilen memeli hücreleri kaynaştırılarak, sürekli olarak antikor üreten "hibridoma" adı verilen hücreler elde edilir. Bu hücreler tek bir tip hibrit hücreden türedikleri için de "monoklonal hücreler" olarak adlandırılırlar. Geleneksel yöntemlerle üretilen antikorlarsa, birçok hücreden elde edildikleri için, "poliklonal" olarak adlandırılırlar. Örneğin, kültür ortamında üretilen fare hibridoma hücreleri gibi. Monoklonal tekniğinde, seçilen hibrit hücreler tek bir tip spesifik antikor üretirler. Bu nedenle de hastalıklarla savaşımda, klasik tekniklerle üretilen poliklonal antikorlardan potansiyel olarak çok daha etkili olurlar. Çünkü ilaçlar, yabancı maddenin yanı sıra, vücudun kendi hücrelerine de etki ederek mide bulantısı ve alerjik reaksiyonlar gibi istenmeyen yan etkilere yol açabilirler. Radyoaktif kimyasal ya da toksin ile işaretlenmiş olan monoklonal antikorlarsa yalnızca hedef moleküle yönelmeleri nedeniyle, oldukça az bir yan etkiye neden olurlar. Monoklonal antikorlar, tıp alanındaki araştırmalarda geniş çapta kullanılmaktadır. Bu alandaki çalışmaların çoğuysa, oldukça yeni. Farelerden elde edilen monoklonal antikorlar, insan bağışıklık sistemiyle daha fazla uyum gösterebilmeleri için çoğunlukla "İnsanlaştırılmış" hücreler yapılıyor li yıllarda monoklonal antikor tekniğinin bulunuşuyla ilgili haberlerin basına yansımasından sonra, dizginlenemeyen bir iyimserlik baş göstermişti. Bu antikorlar; kanser, otoimmün rahatsızlıklar (kendi bağışıklık sistemimizin kendi hücre ve dokularımıza karşı harekete geçmesi), sepsis ve akut enflamasyonlar (yangı) gibi zayıflatıcı ya da ölümcül hastalıklara yakalanmış milyonlarca hastaya umut vermişti. Bulaşıcı hastalıklar da monoklonal antikorlar ile tedavi edilebilecekti. Ancak işler beklenildiği gibi yürümedi. Tedavi amacıyla monoklonal antikor uygulanan hastalarda, bu yabancı antikorlara karşı vücudun kendi antikorlarının oluştuğu ve sonuçta hastaların tam 60
61 olarak açıklanamayan bir nedenden dolayı daha da hasta hale geldikleri görüldü. Beklenmedik bir başka sonuç ise, monoklonal antikorların hedeflerine ulaşamadan önce yok edilmeleri oldu. Bu seri başarısızlıkların sonucunda klinik deneyler alt üst oldu ve tüm stoklar üreticilerin ellerinde kaldı. Kaybolan milyonlarca doların arkasındaysa, sadece hayal kırıklığı kaldı. Şans eseri, tüm bu olumsuzluklara karşın araştırmadan vazgeçmeyen bilim adamları, yeni bir teknik kullanarak monoklonal antikorları yeniden geliştirmeyi başardılar. Amerikan Gıda ve İlaç İdaresi (FDA) tarafından değerlendirip onaylanmış olan monoklonal antikor bazlı birçok efektif ilaç, piyasaya sürülmek için sıra bekliyor. Görünüşe göre, yeniden geliştirilen monoklonal antikorlar, içinde bulunduğumuz yıllara damgasını vurmak üzere. Şimdiden 10 adet monoklonal bazlı İlaç piyasaya sürülmüş ve 3 tanesi de FDA'dan onay bekler durumdadır. Bunların dışında, yaklaşık 100 adet antikor da, hayvan deneylerinde umut verici görüldüğü için insanlarda deneme aşamasına geçirilmiştir. Monoklonal araştırmaları ve üretimi yapan firmalardan Genentech, geçen Temmuz ayında FDA'nın isteği üzerine alerji ve astım tedavisi için piyasaya sürmeye hazırlandığı Xolair isimli monoklonal antikorun uzun dönemli güvenilirliğinin kanıtlanabilmesi için, klinik deneyler hakkında daha ayrıntılı bilgi vermek zorunda kalmıştı. FDA tarafından yayınlanan bu mesaj, tüm hızıyla yürümekte olan monoklonal çalışmalarına biraz olsun endişe düşürmüştür. Herşeye karşın, monoklonal antikorların avantajlarını görmezden gelmek oldukça zordur. Medarex firmasının yöneticisi Donald L. Drakeman, bu antikorların normal ilaçlardan daha kolay ve ucuza üretildiğini belirtiyor. Monoklonal antikorlar büyük moleküller olmaları nedeniyle her hastalık için uygun olmayabiliyor. Ancak, küçük inorganik moleküllerden bir ilacın üretilmesi 5 yıla yakın bir zaman alabilirken, aynı hastalık için monoklonal antikor bazlı bir ilacın üretimi bir ya da iki yıl gibi çok kısa bir sürede tamamlanabiliyor. Bu da, inorganik kökenli bir ilacın üretimi için 20 milyon dolar harcamak yerine, aynı işlemi monoklonal antikor bazlı bir ilaç üretimi için sadece 2 milyon dolar harcayarak halletmek anlamına geliyor. Monoklonallerin bir diğer avantajı da, neredeyse hiç toksik etki göstermemeleri. Bu da, çeşitli sendromlara yol açabilecek toksinleri içeren, ya da vücutta birikim sonucu 61
62 zehirlenmelere yol açabilen çoğu ilacın yanında, monoklonalleri oldukça güvenli bir hale getiriyor. IV. 2. POLİKLONAL ANTİKORLAR Organizmanın aynı anda birçok farklı antijene karşı antikor üretmesi sonucu vücut sıvıları ve serumda poliklonal antikorlar oluşur. Şekil IV. 1. : Poliklonal antikor İstenilen özelliklere sahip bir antikorun laboratuar koşullarında istenildiği miktarda elde edilebilmesi için, ilgili antikoru sentezleyen B hücresinin ölümsüzleştirilmesi gerekmektedir. B lenfositleri in-vitro koşullarda 4 5 günden uzun süre yaşatılamazlar. Bu nedenle monoklonal antikor üretim çalışmalarında başlangıçta B lenfositleri Epstein Barr Virüsü (EBV) gibi onkogenik virüslerle transforme edilerek ölümsüzleştirilmişlerdir. Bu yolla elde edilen antikor miktarının az olması ve kullanılacak antijen miktarının kısıtlı olması nedeniyle yaygın olarak kullanılamamıştır yılında Cesar Milstein, Cotton ve Secher adlı araştırmacılar ile çalışırken in vitro şartlarda fare myeloma hücre kültüründen spontan mutasyon yapmayı başarmışlardır. Daha sonra Milstein ve Köhler, ilk kez mutant fare myeloma hücresini bir antijen ile immünize edilmiş dalak hücresini birleştirerek monoklonal antikor sentezleyen Hibridoma tekniğini tanımlamışlardır. Böylece B lenfositlerinin özgül antikor yapıcı özelliklerini myeloma hücrelerinin ise ölümsüz olma özelliğini kazanan hibrit hücreler özel 62
63 şartlarda üretildikleri zaman tek bir antijenik determinanta karşı çok yüksek özgüllükte, sonsuz miktarda ve monoklonal tipte antikor sentezleyebileceklerini göstermişlerdir. Hibridoma teknolojisinin ortaya çıkması ile poliklonal antikorların yarattığı problemler azaldığı gibi miktar ve duyarlılık yönünden daha verimli olan bu teknoloji immünoloji, biyoloji, tıp, veterinerlik sahalarındaki araştırmalara yeni bir boyut kazandırmaktadır. Poliklonal antikorlar, vücutta B hücrelerinin yabancı bir antijenle uyarımları sonucu meydana gelen ve değişik aktivitelere sahip olan IgG, IgM ve IgA antikor izotipleri içeren hetorojenik özelliklerinden dolayı spesifiteleri zayıftır. Monoklonal antikorlar ise antijenin değişik determinantlarından belli bir epitopa özgül olarak bağlanabilen ve tek tip immünoglobülin yapısı gösteren moleküllerdir. Monoklonal antikorun epitopa özgüllüğü, poliklonal antikor ile tanımlanması mümkün olmayan antijenlerin tanımlanması sağlanır. Poliklonal antikor kesimleri çapraz tepkime, düşük özgünlük gibi istenmeyen özelliklere sahiptir. Elde edilişlerinde bir süreklilik olmaması ile birlikte bir canlıdan diğerine farklı özelliklerde poliklonal antikor karışımlarının oluşması pratik açıdan uygunluk göstermemektedir. Monoklonal antikor üreten hibridomalar sıvı nitrojende uzun süre muhafaza edilerek istenilen zamanda üretim yapılıp kullanılabilirler. Hücre kültür sistemine alındıklarında bir fabrika gibi sürekli antikor üretimlerini sürdürürler. Poliklonal antikorlar uzun immünizasyon periyodundan sonra bir kez elde edilirken, antikor aktivitelerini de uzun süre muhafaza edemezler. IV. 3. MONOKLONAL ANTİKORLARIN KULLANIM ALANLARI Hastalıkların Teşhisinde; Enfeksiyonların ve bunlara bağlı olarak meydana gelen hastalıklarda etkenin (bakteri, virüs, parazit vb.) veya antikorların saptanmasında monoklonal antikor lar büyük yararlar sağlamaktadır. Hastalık etkeninin çok çabuk ve güvenilir biçimde yapılması hastalığın etrafa yayılmadan, tedavisi mümkün olmaktadır. Monoklonal antikorlar aynı zamanda hastalık odaklarının, kanser hücrelerinin, tümör belirteçlerinin ve metastazların teşhisinde, ayrıca süt, idrar, doku sıvıları vb. sıvılardaki hormon, enzim, ilaç, eriyebilir protein, metabolit gibi bazı kimyasal maddelerin tespitinde de kullanılmaktadır. 63
64 Tümör antijenlerine karşı geliştirilen monoklonal antikorlar ile tümör dokusunun yerinin saptanması ve bu antikorlara radyoaktif madde veya toksin bağlanarak tümör hücrelerinin özgül olarak yok edilmesi yönünde çalışmalar yapılmıştır. Kanserli hastaların kendi tümör antijenlerine karşı hazırlanmış monoklonal antikor lar ile immünosintigrafik tarama yapılabilmektedir (antikorlar I 123, Yttrium 90 ve Indium 111 ile işaretlenerek) Tümör hücresi üzerinde sitotoksik etki ile tümör dokusunun yok edilmesi konusunda da aminopterin, difteri toksini, risin gibi sitotoksik moleküllerle yapılan çalışmalar olumlu sonuç vermektedir. Fare monoklonal antikorları ile kronik lenfoblastik lösemi (CLL), kolorektal kanser, akciğer adenokarsinomu, akut lenfoblastik lösemi (ALL) gibi insan kanserlerinde monoklonal antikorlarla tedavinin mümkün olabildiği kanıtlanmıştır. Karşılaşılan güçlük, fare antikorlarına karşı gelişen immün reaksiyonlar sonucu toksin ve radyoaktif yan ürünlerin vücutta birikme sorunudur. Bu amaçla insan antikorları geliştirme çalışmaları hız kazanmıştır. Monoklonal antikorun bir toksine bağlanmadan da tümöre karşı etki gösterdiği belirlenmiştir. Hepatoma tanı ve takibinde alfa-feto protein (AFP) ve kolon kanserinde karsino-embriyonik antijen (CEA) tayini için özgül monoklonal antikorlar geliştirilmiştir. Yine myeloma hücre yüzeylerinde bulunan yüksek molekül ağırlıklı glikoproteinlere karşı geliştirilen antikorlar ile hedef antijenlere yönelik tedaviler uygulamak mümkündür. Hastalıkların Tedavisinde; Özellikle kanserin tedavisinde, kanserli hücrelerin yüzey antijenlerine karşı geliştirilen monoklonal antikorlarla gerek direk olarak, gerekse antikorlara çeşitli toksinler veya kemoterapötik ajanlar konjuge edilerek tedavi çalışmaları yapılmıştır. Veya antikorlara radyoizotoplar bağlanarak radyo immünoterapi yapılmıştır. Bu amaçla yarı ömürleri kısa olan İodine 131 (Yarı ömrü 8 gün), Astadine 211 (yarı ömrü 7,2 saat) gibi radyoizotoplar kullanılmıştır 1. Adım: Tümör hücresinde bulunan spesifik bir tümör antijenine karşı hazırlanan monoklonal antikor toksin veya izotop ile birleştirilir 2. Adım: Toksin veya izotop bağlı monoklonal antikor doğrudan tümör hücresine bağlanır (normal hücreye değil). 3. Adım: Sitotoksik ilaç veya radyoaktif izotop tümör hücresini öldürür. Hastalıklardan Korunmada; Koruyucu amaçla, çeşitli enfeksiyonlara karşı geliştirilmiş monoklonal antikorlar pasif bağışıklık sağlamak amacı ile kullanılmıştır. 64
65 Aşıların Hazırlanmasında; Antikorlar, antijenik epitoplara karşı gelişmektedir. Antijene spesifik bölgeler olan idiotipik (antikor) yapılara karşı tekrar antikor geliştirildiğinde yani anti-idiotipik antikor geliştirildiğinde, bu yapılar antijenle aynı internal imaja sahip olmaları nedeni ile aşı olarak kullanılabilirler. Şekil IV. 2. : Monoklonal antikorlar kanser tedavisi için; ADEPT (antibody directed enzyme prodrug therapy), ADCC (antibody dependent cel mediated cytotoxicity), CDC (complement dependent cytotoxicity), MAb (monoklonal antibody), scfv (single chain Fv fragment), teknikleri etkili bir şekilde temel kanser tedavilerinde denenmektedir. Monoklonal Antikorların Diğer Kullanım Alanları: Birçok temel bilimsel çalışmalarda ve araştırmalarda monoklonal antikorlardan yararlanılmaktadır. Yeni bir bakteri veya virüsün, antijenik yapısını belirleme çalışmasında, antijenlerin saflaştırılmasında, tanı kitlerinin hazırlanmasında monoklonal antikorlardan yararlanılır. Günümüzde Monoklonal Antikorların ilaç Amaçlı Kullanımları: Fare kökenli monoklonal antikorlar, çoğunlukla tanı amaçlı kullanılmaktadır. İnsanlara tedavi edici amaçla uygulandıkları zaman, HAMA cevabı denilen insanda anti fare antikorlarının oluşumuna bağlı olarak alerjik reaksiyonlar oluşmakta ve fare antikoru aşılanan hastalarda genellikle eklem bölgelerinde şişlik ve kızarıklık oluşmaktadır. HAMA böbrek 65
66 yetmezliğine neden olarak yaşamsal tehlike de oluşturabilmektedir. Ayrıca monoklonal antikorların hedeflerine ulaşamadan yok edildikleri de gözlenmiştir. Bu nedenle hem HAMA cevabının oluşmasını hem de fare antikorlarının bağışıklık sistemi tarafından vakitsiz bir şekilde etkisizleştirilmesini önlemek amacıyla, fare antikorlarının insanlaştırılması için çeşitli teknikler geliştirilmiştir. IV Monoklonal Yöntemler Monoklonallerin daha önce başarısız olmalarının nedeni, üretim yönteminin eksikliği olmuştu. Bu klasik üretim yöntemi, 1975 yılında Georges J. F. Köhler ve Cesar Milstein İsimli iki immünolog tarafından keşfedilmişti. İngiltere'deki Cambridge Tıbbi Araştırmalar Konseyi Moleküler Biyoloji Laboratuarı nda çalışan bu iki bilim adamı, bu buluşlarıyla 1984 Fizyoloji-Tıp Nobel ödülüne layık görülmüşlerdi. Temel süreç, bir fareye antijen enjekte edilmesi yoluyla, farenin antikor üretici hücreleri olan B lenfositlerin, verilen antijene karşı antikor üretmelerini sağlama esasına dayanır. Şekil IV. 3. : Monoklonal hücre hattı elde edilmesi. 66
67 1. Fareye antijen verilmesinden sonra, antikor üreten B lenfositler dalaktan toplanır. 2. Fareden alınan B lenfosit hücreleri, sonsuz üreme potansiyeline sahip hücrelerle (örneğin; myeloma hücreleri) kaynaştırılır. 3. Kültür ortamında hibridoma adı verilen hücreler elde edilir. Kaynaşamayan hücreler, bu aşamada ölür. 4. Hibridomalar ayrı ayrı kültür ortamına alınır ve bölünerek çoğalmaları sağlanır. 5. Orijinal antijene bağlanma özelliğine sahip antikoru üreten hibridoma kültürü seçilir. 6. Seçilen hibridomalar, laboratuar koşullarında ya da farenin vücudu içerisinde çoğaltılır. 7. En son işlem olarak, antikorlar saflaştırılır. Ancak bu özel hibridomalar, insan bağışıklık sistemi tarafından "yabancı" (antijen) olarak algılanan fare kökenli antikorların oluşumuna neden olurlar. Fare antikoru aşılanan hastalarda genellikle, eklem bölgelerinde şişlik ve kızarıklıklarla kendini gösteren HAMA cevabı (insanda anti-fare antikorlarının oluşumu) görülür. Böbrek yetmezliğine de neden olan HAMA, yaşamsal tehlike oluşturmasının yanı sıra, verilen antikorların vücut tarafından yok edilmesine de yol açar. Bu nedenle, hem HAMA cevabının oluşmasını hem de fare antikorlarının bağışıklık sistemi tarafından vakitsiz bir şekilde etkisizleştirilmesini önlemek amacıyla, fare antikorlarının "insanlaştırılması" için çeşitli teknikler geliştirilmiş bulunuyor. Fare monoklonal antikorlarının insanlaştırılması ve tamamen insansı olan monoklonal antikorların geliştirilmesi, immün cevap oluşturmamaları nedeniyle önemli. Bu nedenle ticari firmaların neredeyse tamamınca üretilen antikorların insanlaştırılması ya da tamamen insansı hale getirilmesi üzerinde yoğunlaşılmaktadır. "Y" şeklinde moleküller olan antikorlar, kol uzantılarında bulunan F ab (Antijen Bağlayıcı Bölge) ile antijenlere bağlanırlar. "Y"nin boyun kısmında bulunan Fc almaç bölgesiyse, immün sistemin hücreleriyle etkileşir. F ab bölgesiyle bakteriye bağlanan antikor, F c bölgesiyle mikrop yok edici hücreleri kendilerine çekerek, bakterinin parçalanmasını sağlar. 67
68 Bir diğer yaklaşım, fare monoklonallerinin, antikor bağlayıcı bölgesi dışındaki tüm bölgelerinin insana ait parçalarla yer değiştirilmesidir. Amerika'da piyasaya sürülmüş olan monoklonal bazlı ilaçların dört tanesi, bu tip kimerik (yarı insan yarı fare) antikorlar. Bunların arasında, Malvern'de bulunan Centocor firmasının ürünlerin den biri olan ReoPro da bulunuyor. Balon anjioplastisi ile temizlenen arterlerin sonradan tıkanmasını engelleyen bu ilacın, 2000 yılı içindeki satışı 418 milyon dolara ulaştı. ReoPro, onay alarak piyasaya sürülen ilk monoklonal ilaç. Bilim adamlarınca kabul gören bir başka strateji olan "insanlaştırma" yöntemidir. Genentech tarafından üretilen ve göğüs kanseri tedavisinde kullanılan Herceptin isimli ilacı da içeren toplam 5 ürün, bu teknikle üretilmiş. Bu teknikte, fare monoklonallerinin tüm bölgeleri, gen mühendisliği teknikleri yardımıyla insan proteinleriyle seçici olarak değiştirilir. Bu yolla üretilen ilk "insanlaştırılmış" antikor, Cambridge'de bulunan Millenium Pharmaceutics tarafından üretilen Campath isimli İlaç. Diğer tedavilerin işe yaramadığı B hücresi kronik lenfatik lösemi hastalarında kullanılmak üzere, 2000 yılı Mayıs ayında FDA'dan onay almış bulunuyor. Bu ilaç, hem normal hücrelerin, hem de kanserli hücrelerin çoğunda bulunan bir almaca bağlanır. Ancak hastalarda, tedavinin tamamlanmasından sonra normal hücrelerin sayısında bir artış görülmüş. Piyasadaki diğer monoklonaller ise, tümüyle saf fare antikorlarından oluşur. Medarex ve Fremont firmaları, farelere tümüyle "insansı" antikorlar ürettirmenin çeşitli yollarını bulmuşlar. Bu firmalarca gen değişimi gerçekleştirilen fareler, insan antikor genleri taşır hale getirildikten sonra, vücutlarında her yönüyle "insansı" antikorlar üretmeye başlamış. Abgenix İsimli bir başka ilaç firmasınca, Interleukin-8'e (IL 8) karşı üretilmiş olan, tümüyle insanlaştırılmış bir antikorun klinik testleri yürütülmekte. Vücutça çok fazla IL 8 üretildiğinde, romatoid artrit ya da psoriasis gibi yangı ve şişkinliğe yol açan otoimmün hastalıklar ortaya çıkabilir. Bir grup araştırmacı, fareleri kullanmaksızın seri monoklonal üretimi üzerinde çalışmakta. İngiltere'deki Cambridge Antikor Teknolojisi ve Münich'teki MorphoSys AG tarafından kullanılan "phage (faj) display" tekniği, tam olarak bunu gerçekleştirmeye dayanır. Bu teknik ayrıca, tek bir antijene karşı en yüksek özgüllüğü gösteren monoklonallerin bulunmasına da yardımcı olur. Faj display tekniğinde, "ipliksi faj" adı verilen ve bakterileri enfekte etme özelliği taşıyan, uzun ve ipliksi bir virüsten yararlanılır. Araştırıcılar, insan B-lenfosit hücrelerinden yalıttıkları DNA'yı bir bakteri virüsü'nün (faj) 68
69 değişikliğe uğratılmış genetik yapısına (genomuna) (ör. Escherichia coli) ekleyerek, bakterinin ipliksi fajlarca enfekte edilmesini sağlamış bulunuyorlar. 1. B lenfositin antijen bağlayıcı antikor parçasının genleri eklenen bakteri, fajlarca enfekte edilir. 2. Enfekte olan bakteride kendini kopyalayan faj, B lenfositin antikor genlerince kodlanan proteinleri de otomatik olarak sentezleyerek, her birinin ucunda farklı antikor parçası bulunan yeni fajlar oluşturur. 3. İstenen hedef antijene (örneğin; kanser hücrelerinin yüzeyindeki almaçlara) özgül olarak bağlanabilen antikor parçalarını taşıyan fajlar toplanır. 4. İşlem birkaç kez tekrarlanarak, seçilen fajların genleri bakteriye yeniden eklenir ve spesifik antikor parçaları çoğaltılır. IV Kimerik Antikor Oluşumları Yarı insan yarı fare olan antikorlardır. Bu antikorları oluştururken, fare antikorunun değişken bölgesi ile insan antikorunun sabit bölgesi birleştirilmekte, yada antijen tanınmasından sorumlu CDR bölgeleri fareye aitken diğer kısımlar insan antikor özelliğine sahip antikorlardır. Bu yapıdaki antikor moleküllerine karşı immünolojik yanıt hemen hemen yok gibidir. IV "Humanized" Antikor Oluşumları Antikor moleküllerinin variable bölgesindeki hypervariable bölgeler (CDR) gerçekte antijen tanınmasından sorumlu bölgelerdir. Kimerik antikor molekülünün oluşturulmasında sadece CDR için kodlama yapan DNA bölgeleri ( fare ya da rodent kaynaklı) insan immünoglobülinin ağır zincir değişken domaini için kodlama yapan DNA bölgesi ile birleştirilmiş, böylece oluşan yeni molekül daha fazla oranda insan IgG özelliğini taşımaktadır. 69
70 Şekil IV. 4. Monoklonal Antikor yöntemleriyle üretilen antikor çeşitleri IV. 4. NANOBODİES Antikor türü proteinlerdir. Kendilerine özgü yapı ve işlevleri vardır. Ortaya çıkışları, bir okulda yapılan projede develerin parazitlerle nasıl savaştığını anlamaya çalışırken antikor testlerinde bir hata oluşmasıyla fark edildi. Dört zincirli antikorların dışında, bir çift ağır zincirden oluşan antikorlara rastlanıyor. Nature dergisinde 1993 yılında bu konu yayınlanıyor. Asya develeri, Güney Amerika lamalarında, kandaki antikorların yarsının bu şekilde olduğu görülüyor. Bu yeni bulunan proteinler, daha sonra sadece antijenin bağlandığı V H bölgeleri kalacak şekilde kesiliyor. Normal bir antikorun 10 da 1 kadar küçük olmalarına rağmen, onlar kadar güçlü bir bağlanma özelliği gösteriyorlar. Bu küçük antikorlar, kimyasal açıdan daha hareketli, antikorların giremeyeceği dar bölgelere (örneğin enzimin aktif bölgesi, membran yüzeyindeki belirli bölgelere) rahatça bağlanabiliyorlar (Şekil IV. 5.) 70
71 Şekil IV. 5. antikor yapısı ve nanobody yapısı. Belçika da bulunan Ablynx adlı firma nanobody leri üretmeye başlıyor. Şekil IV. 6. Bilinen antikor, develerde bulunan antikor ve Ablynx firmasının ürettiği nanobody yapısı. Nanobodylerin avantajlarına baktığımızda; sıcağa, ph a ve proteaz aktivitesine karşı dayanıklı oldukları, aktivitelerini kaybetmedikleri gözlemlenmiş (farelerin bağırsak sisteminde). Bu da bağırsak kanseri gibi bağırsakla ilgili hastalıkların tedavisinde kullanabilirliğini gösteriyor (Şekil IV. 7.). 71
72 Kimyasal bileşenleri ve şekli daha basit olduklarından, mikroplar tarafından sentezlenmeleri daha kolaydır. Daha az gen tarafından kodlanıyorlar ve çok sayıda sentezlenebiliyorlar. Ablynx firması 1lt maya kültüründen ~1 gr sentezlenebiliyor ve oda sıcaklığındaki raf ömrü daha uzun olmaktadır. Kandaki yarı ömürlerini arttırmak amacıyla, anti-albümin nanobody ler, esas hedef antijene özgü nanobody lere bağlanarak IgM yapısı gibi multivalent grupları oluşturulmuş. Nanobody ler iki farklı antijeni tanıyacak şekilde de dizayn edilebiliyorlar, Bispesifik Nanobody ler çok daha dayanıklılar, küçük ilaç molekülleri gibi enzimleri inhibe edebiliyorlar, antikorlar gibi yüksek çeşitliliğe ve düşük toksisiteye sahipler. Yarı ömürleri en az 45 dakika veya en yüksek iki hafta olacak şekilde dizayn edilmeleri mümkün. Şekil IV. 7. kanser tedavisinde kullanılan yöntemlerin günlere ve tümör sayısına bağlı olarak değişimi 72
ANTİJENLER VE YAPILARI
 ANTİJENLER VE YAPILARI IMMUNOJEN VE ANTIJEN nedir? Immun cevap oluşturan yabancı maddeler antijen veya immunojen olabilir. Immunojen; İmmun yanıt meydana getirme kabiliyetindeki herhangi bir madde Antijen
ANTİJENLER VE YAPILARI IMMUNOJEN VE ANTIJEN nedir? Immun cevap oluşturan yabancı maddeler antijen veya immunojen olabilir. Immunojen; İmmun yanıt meydana getirme kabiliyetindeki herhangi bir madde Antijen
ÜNİTE 9. İmmünolojiye Giriş ve Antijen. Amaçlar. İçindekiler. Öneriler. Bu üniteyi çalıştıktan sonra,
 ÜNİTE 9 İmmünolojiye Giriş ve Antijen Bu üniteyi çalıştıktan sonra, Amaçlar İmmünoloji = Bağışıklık biliminin tanımını ve tarihsel gelişmesini, Antijenin ne olduğunu, bir maddenin antijenik özellik gösterebilmesi
ÜNİTE 9 İmmünolojiye Giriş ve Antijen Bu üniteyi çalıştıktan sonra, Amaçlar İmmünoloji = Bağışıklık biliminin tanımını ve tarihsel gelişmesini, Antijenin ne olduğunu, bir maddenin antijenik özellik gösterebilmesi
Hümoral İmmün Yanıt ve Antikorlar
 Hümoral İmmün Yanıt ve Antikorlar H. Barbaros ORAL Uludağ Üniversitesi Tıp Fakültesi İmmünoloji Anabilim Dalı Edinsel immün sistemin antijenleri bağlamak için kullandığı 3 molekül sınıfı: I.Antikorlar,
Hümoral İmmün Yanıt ve Antikorlar H. Barbaros ORAL Uludağ Üniversitesi Tıp Fakültesi İmmünoloji Anabilim Dalı Edinsel immün sistemin antijenleri bağlamak için kullandığı 3 molekül sınıfı: I.Antikorlar,
Antikorlar, üretimlerini sağlayan antijen ile özgün tepkime veren globülin yapısında proteinlerdir. immunoglobülinler
 Antikorlar, üretimlerini sağlayan antijen ile özgün tepkime veren globülin yapısında proteinlerdir immunoglobülinler Kan plazmasındaki proteinlerin %12-19 u Antikorlar gamaglobülinlerdir Tisselius 1937
Antikorlar, üretimlerini sağlayan antijen ile özgün tepkime veren globülin yapısında proteinlerdir immunoglobülinler Kan plazmasındaki proteinlerin %12-19 u Antikorlar gamaglobülinlerdir Tisselius 1937
İMMUNİZASYON. Bir bireye bağışıklık kazandırma! Bireyin yaşı? İmmunolojik olarak erişkin mi? Maternal antikor? Konak antijene duyarlı mı? Sağlıklı mı?
 İMMUNİZASYON Bir bireye bağışıklık kazandırma! Bireyin yaşı? İmmunolojik olarak erişkin mi? Maternal antikor? Konak antijene duyarlı mı? Sağlıklı mı? Canlıya antijen verdikten belli bir süre sonra, o canlıda
İMMUNİZASYON Bir bireye bağışıklık kazandırma! Bireyin yaşı? İmmunolojik olarak erişkin mi? Maternal antikor? Konak antijene duyarlı mı? Sağlıklı mı? Canlıya antijen verdikten belli bir süre sonra, o canlıda
7. PROKARYOTLARDA GEN İFADESİNİN DÜZENLENMESİ
 7. PROKARYOTLARDA GEN İFADESİNİN DÜZENLENMESİ Başlıklar 1. Prokaryotlar gen ifadesini çevre koşullarına göre düzenler 2. E. Coli de laktoz metabolizması 3. Lac operonu negatif kontrol 4. CAP pozitif kontrol
7. PROKARYOTLARDA GEN İFADESİNİN DÜZENLENMESİ Başlıklar 1. Prokaryotlar gen ifadesini çevre koşullarına göre düzenler 2. E. Coli de laktoz metabolizması 3. Lac operonu negatif kontrol 4. CAP pozitif kontrol
7. PROKARYOTLARDA GEN İFADESİNİN DÜZENLENMESİ
 7. PROKARYOTLARDA GEN İFADESİNİN DÜZENLENMESİ Başlıklar 1. Prokaryotlar gen ifadesini çevre koşullarına göre düzenler 2. E. Coli de laktoz metabolizması 3. Lac operonu negatif kontrol 4. CAP pozitif kontrol
7. PROKARYOTLARDA GEN İFADESİNİN DÜZENLENMESİ Başlıklar 1. Prokaryotlar gen ifadesini çevre koşullarına göre düzenler 2. E. Coli de laktoz metabolizması 3. Lac operonu negatif kontrol 4. CAP pozitif kontrol
III-Hayatın Oluşturan Kimyasal Birimler
 III-Hayatın Oluşturan Kimyasal Birimler MBG 111 BİYOLOJİ I 3.1.Karbon:Biyolojik Moleküllerin İskeleti *Karbon bütün biyolojik moleküllerin omurgasıdır, çünkü dört kovalent bağ yapabilir ve uzun zincirler
III-Hayatın Oluşturan Kimyasal Birimler MBG 111 BİYOLOJİ I 3.1.Karbon:Biyolojik Moleküllerin İskeleti *Karbon bütün biyolojik moleküllerin omurgasıdır, çünkü dört kovalent bağ yapabilir ve uzun zincirler
ADIM ADIM YGS LYS Adım DOLAŞIM SİSTEMİ 5 İNSANDA BAĞIŞIKLIK VE VÜCUDUN SAVUNULMASI
 ADIM ADIM YGS LYS 177. Adım DOLAŞIM SİSTEMİ 5 İNSANDA BAĞIŞIKLIK VE VÜCUDUN SAVUNULMASI İNSANDA BAĞIŞIKLIK VE VÜCUDUN SAVUNULMASI Hastalık yapıcı organizmalara karşı vücudun gösterdiği dirence bağışıklık
ADIM ADIM YGS LYS 177. Adım DOLAŞIM SİSTEMİ 5 İNSANDA BAĞIŞIKLIK VE VÜCUDUN SAVUNULMASI İNSANDA BAĞIŞIKLIK VE VÜCUDUN SAVUNULMASI Hastalık yapıcı organizmalara karşı vücudun gösterdiği dirence bağışıklık
ORGANİZMALARDA BAĞIŞIKLIK MEKANİZMALARI
 ORGANİZMALARDA BAĞIŞIKLIK MEKANİZMALARI Organizmalarda daha öncede belirtildiği gibi hücresel ve humoral bağışıklık bağışıklık reaksiyonları vardır. Bunlara ilave olarak immünoljik tolerans adı verilen
ORGANİZMALARDA BAĞIŞIKLIK MEKANİZMALARI Organizmalarda daha öncede belirtildiği gibi hücresel ve humoral bağışıklık bağışıklık reaksiyonları vardır. Bunlara ilave olarak immünoljik tolerans adı verilen
Canlıların yapısına en fazla oranda katılan organik molekül çeşididir. Deri, saç, tırnak, boynuz gibi oluşumların temel maddesi proteinlerdir.
 Canlıların yapısına en fazla oranda katılan organik molekül çeşididir. Deri, saç, tırnak, boynuz gibi oluşumların temel maddesi proteinlerdir. Proteinlerin yapısında; Karbon ( C ) Hidrojen ( H ) Oksijen
Canlıların yapısına en fazla oranda katılan organik molekül çeşididir. Deri, saç, tırnak, boynuz gibi oluşumların temel maddesi proteinlerdir. Proteinlerin yapısında; Karbon ( C ) Hidrojen ( H ) Oksijen
VİROLOJİ -I Antiviral İmmunite
 VİROLOJİ -I Antiviral İmmunite Prof.Dr. Yılmaz Akça Prof.Dr. Feray Alkan Prof.Dr. Aykut Özkul Prof. Dr. Seval Bilge-Dağalp Prof.Dr. M. Taner Karaoğlu Prof.Dr. Tuba Çiğdem Oğuzoğlu DOĞAL SAVUNMA HATLARI-DOĞAL
VİROLOJİ -I Antiviral İmmunite Prof.Dr. Yılmaz Akça Prof.Dr. Feray Alkan Prof.Dr. Aykut Özkul Prof. Dr. Seval Bilge-Dağalp Prof.Dr. M. Taner Karaoğlu Prof.Dr. Tuba Çiğdem Oğuzoğlu DOĞAL SAVUNMA HATLARI-DOĞAL
ADIM ADIM YGS-LYS 55. ADIM CANLILARIN SINIFLANDIRILMASI-15 VİRÜSLER
 ADIM ADIM YGS-LYS 55. ADIM CANLILARIN SINIFLANDIRILMASI-15 VİRÜSLER Virüsler Hücresel yapı da dahil olmak üzere canlıların ortak özelliklerini göstermeyen canlılardır. Prokaryotlardan daha küçüklerdir.
ADIM ADIM YGS-LYS 55. ADIM CANLILARIN SINIFLANDIRILMASI-15 VİRÜSLER Virüsler Hücresel yapı da dahil olmak üzere canlıların ortak özelliklerini göstermeyen canlılardır. Prokaryotlardan daha küçüklerdir.
ÜNİTE 11. İmmünglobulinler (Antikorlar) Amaçlar. İçindekiler. Öneriler. Bu üniteyi çalıştıktan sonra;
 ÜNİTE 11 İmmünglobulinler (Antikorlar) Bu üniteyi çalıştıktan sonra; Amaçlar Vücut savunmasında önemli rolleri olan immünglobulinlerin (= antikorların) yapısını, İmmünglobulinlerin çeşitlerini ve bunların
ÜNİTE 11 İmmünglobulinler (Antikorlar) Bu üniteyi çalıştıktan sonra; Amaçlar Vücut savunmasında önemli rolleri olan immünglobulinlerin (= antikorların) yapısını, İmmünglobulinlerin çeşitlerini ve bunların
Replikasyon, Transkripsiyon ve Translasyon. Yrd. Doç. Dr. Osman İBİŞ
 Replikasyon, Transkripsiyon ve Translasyon Yrd. Doç. Dr. Osman İBİŞ DNA replikasyonu DNA nın replikasyonu, DNA molekülünün, sakladığı genetik bilgilerin sonraki nesillere aktarılması için kendi kopyasını
Replikasyon, Transkripsiyon ve Translasyon Yrd. Doç. Dr. Osman İBİŞ DNA replikasyonu DNA nın replikasyonu, DNA molekülünün, sakladığı genetik bilgilerin sonraki nesillere aktarılması için kendi kopyasını
Yapay Bağışık Sistemler ve Klonal Seçim. Bmü-579 Meta Sezgisel Yöntemler Yrd. Doç. Dr. İlhan AYDIN
 Yapay Bağışık Sistemler ve Klonal Seçim Bmü-579 Meta Sezgisel Yöntemler Yrd. Doç. Dr. İlhan AYDIN Bağışık Sistemler Bağışıklık sistemi insan vücudunun hastalıklara karşı savunma mekanizmasını oluşturan
Yapay Bağışık Sistemler ve Klonal Seçim Bmü-579 Meta Sezgisel Yöntemler Yrd. Doç. Dr. İlhan AYDIN Bağışık Sistemler Bağışıklık sistemi insan vücudunun hastalıklara karşı savunma mekanizmasını oluşturan
Biochemistry Chapter 4: Biomolecules. Hikmet Geçkil, Professor Department of Molecular Biology and Genetics Inonu University
 Biochemistry Chapter 4: Biomolecules, Professor Department of Molecular Biology and Genetics Inonu University Biochemistry/Hikmet Geckil Chapter 4: Biomolecules 2 BİYOMOLEKÜLLER Bilim adamları hücreyi
Biochemistry Chapter 4: Biomolecules, Professor Department of Molecular Biology and Genetics Inonu University Biochemistry/Hikmet Geckil Chapter 4: Biomolecules 2 BİYOMOLEKÜLLER Bilim adamları hücreyi
TRANSLASYON ve PROTEİNLER
 TRANSLASYON ve PROTEİNLER Prof. Dr. Sacide PEHLİVAN 13 Aralık 2016 mrna daki baz sırasının kullanılarak amino asitlerin doğru sıra ile proteini oluşturmasını kapsayan olayların tümüne Translasyon veya
TRANSLASYON ve PROTEİNLER Prof. Dr. Sacide PEHLİVAN 13 Aralık 2016 mrna daki baz sırasının kullanılarak amino asitlerin doğru sıra ile proteini oluşturmasını kapsayan olayların tümüne Translasyon veya
BİYOLOJİ DERS NOTLARI YGS-LGS YÖNETİCİ MOLEKÜLLER
 www.benimdershanem.esy.es Bilgi paylaştıkça çoğalır. BİYOLOJİ DERS NOTLARI YGS-LGS YÖNETİCİ MOLEKÜLLER NÜKLEİK ASİTLER Nükleik asitler, bütün canlı hücrelerde ve virüslerde bulunan, nükleotid birimlerden
www.benimdershanem.esy.es Bilgi paylaştıkça çoğalır. BİYOLOJİ DERS NOTLARI YGS-LGS YÖNETİCİ MOLEKÜLLER NÜKLEİK ASİTLER Nükleik asitler, bütün canlı hücrelerde ve virüslerde bulunan, nükleotid birimlerden
T Lenfositleri. Dr. Göksal Keskin
 T Lenfositleri Dr. Göksal Keskin Lenfositlerin ortak özellikleri-1 Kazanılmış bağışıklık sisteminin en önemli elemanlarıdır Spesifite özellikleri var Bellekleri var Primer lenfoid organlarda üretilirler
T Lenfositleri Dr. Göksal Keskin Lenfositlerin ortak özellikleri-1 Kazanılmış bağışıklık sisteminin en önemli elemanlarıdır Spesifite özellikleri var Bellekleri var Primer lenfoid organlarda üretilirler
RNA Yapısı ve Katlanması, Hücrede Bulunan RNA Çeşitleri
 RNA Yapısı ve Katlanması, Hücrede Bulunan RNA Çeşitleri RNA (Ribonükleik Asit) Nükleik asitler, Friedrich Miescher tara2ndan 1869'da keşfedildi. İl=haplı bandajlardan izole edilen bu maddeye nüklein adını
RNA Yapısı ve Katlanması, Hücrede Bulunan RNA Çeşitleri RNA (Ribonükleik Asit) Nükleik asitler, Friedrich Miescher tara2ndan 1869'da keşfedildi. İl=haplı bandajlardan izole edilen bu maddeye nüklein adını
ÇEKİRDEK EĞİTİM PROGRAMI
 ÇEKİRDEK EĞİTİM PROGRAMI Tıp Fakülteleri Mezuniyet Öncesi İmmünoloji Eğitim Programı Önerisi in hücre ve dokuları ilgi hücrelerini isim ve işlevleri ile bilir. Kemik iliği, lenf nodu, ve dalağın anatomisi,
ÇEKİRDEK EĞİTİM PROGRAMI Tıp Fakülteleri Mezuniyet Öncesi İmmünoloji Eğitim Programı Önerisi in hücre ve dokuları ilgi hücrelerini isim ve işlevleri ile bilir. Kemik iliği, lenf nodu, ve dalağın anatomisi,
Organik Bileşikler. Karbonhidratlar. Organik Bileşikler YGS Biyoloji 1
 Organik Bileşikler YGS Biyoloji 1 Hazırladığımız bu yazıda; organik bileşikler ve organik bileşiklerin yapısını, canlılarda bulunan organik bileşikleri ve bunların görevlerini, kullanım alanlarını, canlılar
Organik Bileşikler YGS Biyoloji 1 Hazırladığımız bu yazıda; organik bileşikler ve organik bileşiklerin yapısını, canlılarda bulunan organik bileşikleri ve bunların görevlerini, kullanım alanlarını, canlılar
İMMÜNOBİYOLOJİ. Prof. Dr. Nursel GÜL. Ankara Üniversitesi Fen Fakültesi Biyoloji Bölümü
 İMMÜNOBİYOLOJİ Prof. Dr. Nursel GÜL Ankara Üniversitesi Fen Fakültesi Biyoloji Bölümü GİRİŞ İmmünoloji, organizmaların dışarıdan gelen mikroorganizmalara, parazitlere vb. birçok yabancı ajana karşı veya
İMMÜNOBİYOLOJİ Prof. Dr. Nursel GÜL Ankara Üniversitesi Fen Fakültesi Biyoloji Bölümü GİRİŞ İmmünoloji, organizmaların dışarıdan gelen mikroorganizmalara, parazitlere vb. birçok yabancı ajana karşı veya
Canlının yapısında bulunan organik molekül grupları; o Karbonhidratlar o Yağlar o Proteinler o Enzimler o Vitaminler o Nükleik asitler ve o ATP
 Tamamı karbon ( C ) elementi taşıyan moleküllerden oluşan bir gruptur. Doğal organik bileşikler canlı vücudunda sentezlenir. Ancak günümüzde birçok organik bileşik ( vitamin, hormon, antibiyotik vb. )
Tamamı karbon ( C ) elementi taşıyan moleküllerden oluşan bir gruptur. Doğal organik bileşikler canlı vücudunda sentezlenir. Ancak günümüzde birçok organik bileşik ( vitamin, hormon, antibiyotik vb. )
I- Doğal-doğuştan (innate)var olan bağışıklık
 I- Doğal-doğuştan (innate)var olan bağışıklık Fagositik hücreler (makrofajlar, mast hücreleri) Kompleman sistemi(direkt bakteri hücre membranı parçalayarak diğer immün sistem hücrelerin bunlara atak yapmasına
I- Doğal-doğuştan (innate)var olan bağışıklık Fagositik hücreler (makrofajlar, mast hücreleri) Kompleman sistemi(direkt bakteri hücre membranı parçalayarak diğer immün sistem hücrelerin bunlara atak yapmasına
Hücrelerde gerçekleşen yapım, yıkım ve dönüşüm olaylarının bütününe metabolizma denir.
 METABOLİZMA ve ENZİMLER METABOLİZMA Hücrelerde gerçekleşen yapım, yıkım ve dönüşüm olaylarının bütününe metabolizma denir. A. ÖZÜMLEME (ANABOLİZMA) Metabolizmanın yapım reaksiyonlarıdır. Bu tür olaylara
METABOLİZMA ve ENZİMLER METABOLİZMA Hücrelerde gerçekleşen yapım, yıkım ve dönüşüm olaylarının bütününe metabolizma denir. A. ÖZÜMLEME (ANABOLİZMA) Metabolizmanın yapım reaksiyonlarıdır. Bu tür olaylara
15- RADYASYONUN NÜKLEİK ASİTLER VE PROTEİNLERE ETKİLERİ
 15- RADYASYONUN NÜKLEİK ASİTLER VE PROTEİNLERE ETKİLERİ İyonlaştırıcı radyasyonların biyomoleküllere örneğin nükleik asitler ve proteinlere olan etkisi hakkında yeterli bilgi yoktur. Ancak, nükleik asitlerden
15- RADYASYONUN NÜKLEİK ASİTLER VE PROTEİNLERE ETKİLERİ İyonlaştırıcı radyasyonların biyomoleküllere örneğin nükleik asitler ve proteinlere olan etkisi hakkında yeterli bilgi yoktur. Ancak, nükleik asitlerden
OKSİJENLİ SOLUNUM
 1 ----------------------- OKSİJENLİ SOLUNUM ----------------------- **Oksijenli solunum (aerobik): Besinlerin, oksijen yardımıyla parçalanarak, ATP sentezlenmesine oksijenli solunum denir. Enzim C 6 H
1 ----------------------- OKSİJENLİ SOLUNUM ----------------------- **Oksijenli solunum (aerobik): Besinlerin, oksijen yardımıyla parçalanarak, ATP sentezlenmesine oksijenli solunum denir. Enzim C 6 H
İ. Ü İstanbul Tıp Fakültesi Tıbbi Biyoloji Anabilim Dalı Prof. Dr. Filiz Aydın
 İ. Ü İstanbul Tıp Fakültesi Tıbbi Biyoloji Anabilim Dalı Prof. Dr. Filiz Aydın Hücre iletişimi Tüm canlılar bulundukları çevreden sinyal alırlar ve yanıt verirler Bakteriler glukoz ve amino asit gibi besinlerin
İ. Ü İstanbul Tıp Fakültesi Tıbbi Biyoloji Anabilim Dalı Prof. Dr. Filiz Aydın Hücre iletişimi Tüm canlılar bulundukları çevreden sinyal alırlar ve yanıt verirler Bakteriler glukoz ve amino asit gibi besinlerin
HUMORAL İMMUN YANIT 1
 HUMORAL İMMUN YANIT 1 Antijen B lenfosit... HUMORAL İMMUN YANIT Antikor üretimi 2 Antijenini işlenmesi ve sunulması Yardımcı T-lenfosit aktivasyonu Yardımcı T hücre- B hücre ilişkisi B hücre aktivasyonu
HUMORAL İMMUN YANIT 1 Antijen B lenfosit... HUMORAL İMMUN YANIT Antikor üretimi 2 Antijenini işlenmesi ve sunulması Yardımcı T-lenfosit aktivasyonu Yardımcı T hücre- B hücre ilişkisi B hücre aktivasyonu
AŞI ve SERUMLAR. Dr. Sibel AK
 AŞI ve SERUMLAR Dr. Sibel AK Bugün; Ak#f İmmünizasyon Bakteriyel Aşılar Viral Aşılar Aşı Takvimi Pasif İmmünizasyon Aşı Etkileşimleri Tanımlar İmmünite (Bağışıklık): Konağın, kendisinden farklı yapıya
AŞI ve SERUMLAR Dr. Sibel AK Bugün; Ak#f İmmünizasyon Bakteriyel Aşılar Viral Aşılar Aşı Takvimi Pasif İmmünizasyon Aşı Etkileşimleri Tanımlar İmmünite (Bağışıklık): Konağın, kendisinden farklı yapıya
İMMÜN YANITIN EFEKTÖR GRUPLARI VE YANITIN DÜZENLENMESİ. Güher Saruhan- Direskeneli İTF Fizyoloji AD
 İMMÜN YANITIN EFEKTÖR GRUPLARI VE YANITIN DÜZENLENMESİ Güher Saruhan- Direskeneli İTF Fizyoloji AD HÜCRE İÇİ MİKROBA YANIT Veziküle alınmış mikroplu fagosit Sitoplazmasında mikroplu hücre CD4 + efektör
İMMÜN YANITIN EFEKTÖR GRUPLARI VE YANITIN DÜZENLENMESİ Güher Saruhan- Direskeneli İTF Fizyoloji AD HÜCRE İÇİ MİKROBA YANIT Veziküle alınmış mikroplu fagosit Sitoplazmasında mikroplu hücre CD4 + efektör
Gram (+)Bakterilerde Duvar Yapısı Gram (-) Bakterilerde Duvar Yapısı Lipopolisakkaritin Önemi
 Gram (+)Bakterilerde Duvar Yapısı Çoğunluğu peptidoglikan yapıdır. Bunun yanında teikoik asitte içerirler. Bu yapı gliserol veya Ribitolün PO4 gruplarına bağlanmasıyla oluşur. Teikoik asitler peptidoglikan
Gram (+)Bakterilerde Duvar Yapısı Çoğunluğu peptidoglikan yapıdır. Bunun yanında teikoik asitte içerirler. Bu yapı gliserol veya Ribitolün PO4 gruplarına bağlanmasıyla oluşur. Teikoik asitler peptidoglikan
MOLEKÜLER BİYOLOJİ DOÇ. DR. MEHMET KARACA (5. BÖLÜM)
 MOLEKÜLER BİYOLOJİ DOÇ. DR. MEHMET KARACA (5. BÖLÜM) TRANSKRİPSİYONU (ÖKARYOTİK) STOPLAZMA DNA Transkripsiyon hnrna RNA nın işlenmesi mrna G AAA Eksport G AAA NÜKLEUS TRANSKRİPSİYONU (PROKARYOTİK) Stoplazma
MOLEKÜLER BİYOLOJİ DOÇ. DR. MEHMET KARACA (5. BÖLÜM) TRANSKRİPSİYONU (ÖKARYOTİK) STOPLAZMA DNA Transkripsiyon hnrna RNA nın işlenmesi mrna G AAA Eksport G AAA NÜKLEUS TRANSKRİPSİYONU (PROKARYOTİK) Stoplazma
TRANSLASYON VE DÜZENLENMESİ
 TRANSLASYON VE DÜZENLENMESİ TRANSLASYON Translasyonda nükleik asit kullanılır fakat son ürün bir nükleik asit değil proteindir. Translasyon mekanizması 4 ana bileşenden oluşmaktadır: 1. mrnalar 2. trnalar
TRANSLASYON VE DÜZENLENMESİ TRANSLASYON Translasyonda nükleik asit kullanılır fakat son ürün bir nükleik asit değil proteindir. Translasyon mekanizması 4 ana bileşenden oluşmaktadır: 1. mrnalar 2. trnalar
CANLILARIN YAPISINDA BULUNAN TEMEL BİLEŞENLER
 CANLILARIN YAPISINDA BULUNAN TEMEL BİLEŞENLER Canlıların yapısında bulunan moleküller yapısına göre 2 ye ayrılır: I. İnorganik Bileşikler: Bir canlı vücudunda sentezlenemeyen, dışardan hazır olarak aldığı
CANLILARIN YAPISINDA BULUNAN TEMEL BİLEŞENLER Canlıların yapısında bulunan moleküller yapısına göre 2 ye ayrılır: I. İnorganik Bileşikler: Bir canlı vücudunda sentezlenemeyen, dışardan hazır olarak aldığı
YGS YE HAZIRLIK DENEMESi #16
 YGS YE HAZIRLIK DENEMESi #16 1) Topraktaki azotlu bileşik miktarını, I. Denitrifikasyon bakteri sayısındaki artış II. Saprofit bakterilerce gerçekleşen çürüme III. Şimşek ve yıldırım olaylarındaki artış
YGS YE HAZIRLIK DENEMESi #16 1) Topraktaki azotlu bileşik miktarını, I. Denitrifikasyon bakteri sayısındaki artış II. Saprofit bakterilerce gerçekleşen çürüme III. Şimşek ve yıldırım olaylarındaki artış
DİCLE ÜNİVERSİTESİ TIP FAKÜLTESİ DÖNEM II. KAN-DOLAŞIM ve SOLUNUM DERS KURULU
 DİCLE ÜNİVERSİTESİ TIP FAKÜLTESİ DÖNEM II KAN-DOLAŞIM ve SOLUNUM DERS KURULU Doç.Dr. Engin DEVECİ İMMÜN SİSTEM TİPLERİ I- Doğal-doğuştan (innate)var olan bağışıklık Fagositik hücreler (makrofajlar, mast
DİCLE ÜNİVERSİTESİ TIP FAKÜLTESİ DÖNEM II KAN-DOLAŞIM ve SOLUNUM DERS KURULU Doç.Dr. Engin DEVECİ İMMÜN SİSTEM TİPLERİ I- Doğal-doğuştan (innate)var olan bağışıklık Fagositik hücreler (makrofajlar, mast
Bağışıklık sistemi nasıl çalışır?
 On5yirmi5.com Bağışıklık sistemi nasıl çalışır? İnsanda bağışıklık sistemi, özellik ve görevleri nelerdir? Kaç çeşit bağışıklık sistemi vardır? Yayın Tarihi : 23 Ekim 2012 Salı (oluşturma : 10/3/2017)
On5yirmi5.com Bağışıklık sistemi nasıl çalışır? İnsanda bağışıklık sistemi, özellik ve görevleri nelerdir? Kaç çeşit bağışıklık sistemi vardır? Yayın Tarihi : 23 Ekim 2012 Salı (oluşturma : 10/3/2017)
BAKTERİLERİN GENETİK KARAKTERLERİ
 BAKTERİLERİN GENETİK KARAKTERLERİ GENETİK MATERYALLER VE YAPILARI HER HÜCREDE Genetik bilgilerin kodlandığı bir DNA genomu bulunur Bu genetik bilgiler mrna ve ribozomlar aracılığı ile proteinlere dönüştürülür
BAKTERİLERİN GENETİK KARAKTERLERİ GENETİK MATERYALLER VE YAPILARI HER HÜCREDE Genetik bilgilerin kodlandığı bir DNA genomu bulunur Bu genetik bilgiler mrna ve ribozomlar aracılığı ile proteinlere dönüştürülür
Organik bileşikler; karbonhidratlar, lipidler, proteinler, vitaminler ve nükleik asitler olmak üzere beş gruba ayrılır.
 ORGANİK BİLEŞİKLER **Organik bileşikler: Canlılar tarafından sentezlenirler. Yapılarında C, H, atomlarını bulundururlar. Organik bileşikler; karbonhidratlar, lipidler, proteinler, vitaminler ve nükleik
ORGANİK BİLEŞİKLER **Organik bileşikler: Canlılar tarafından sentezlenirler. Yapılarında C, H, atomlarını bulundururlar. Organik bileşikler; karbonhidratlar, lipidler, proteinler, vitaminler ve nükleik
PROKARYOTLARDA GEN EKSPRESYONU. ve REGÜLASYONU. (Genlerin Gen Ürünlerine Dönüşümünü Kontrol Eden Süreçler)
 PROKARYOTLARDA GEN EKSPRESYONU ve REGÜLASYONU (Genlerin Gen Ürünlerine Dönüşümünü Kontrol Eden Süreçler) Nihal EYVAZ (050559015) Şerife OKAY (050559025) Prof. Dr. Figen ERKOÇ Gazi Eğitim Fakültesi Gen
PROKARYOTLARDA GEN EKSPRESYONU ve REGÜLASYONU (Genlerin Gen Ürünlerine Dönüşümünü Kontrol Eden Süreçler) Nihal EYVAZ (050559015) Şerife OKAY (050559025) Prof. Dr. Figen ERKOÇ Gazi Eğitim Fakültesi Gen
İ. Ü İstanbul Tıp Fakültesi Tıbbi Biyoloji Anabilim Dalı Prof. Dr. Filiz Aydın
 İ. Ü İstanbul Tıp Fakültesi Tıbbi Biyoloji Anabilim Dalı Prof. Dr. Filiz Aydın Canlının en küçük birimi Hücre 1665 yılında ilk olarak İngiliz bilim adamı Robert Hooke şişe mantarından kesit alıp mikroskopta
İ. Ü İstanbul Tıp Fakültesi Tıbbi Biyoloji Anabilim Dalı Prof. Dr. Filiz Aydın Canlının en küçük birimi Hücre 1665 yılında ilk olarak İngiliz bilim adamı Robert Hooke şişe mantarından kesit alıp mikroskopta
LYS ANAHTAR SORULAR #4. Nükleik Asitler ve Protein Sentezi
 LYS ANAHTAR SORULAR #4 Nükleik Asitler ve Protein Sentezi 1) İncelenen bir nükleotidin DNA ya mı yoksa RNA ya mı ait olduğu; I. Bağ çeşidi II. Pürin bazı çeşidi III. Pirimidin bazı çeşidi IV. Şeker çeşidi
LYS ANAHTAR SORULAR #4 Nükleik Asitler ve Protein Sentezi 1) İncelenen bir nükleotidin DNA ya mı yoksa RNA ya mı ait olduğu; I. Bağ çeşidi II. Pürin bazı çeşidi III. Pirimidin bazı çeşidi IV. Şeker çeşidi
3. Sınıf Klinik İmmünoloji Vize Sınav Soruları (Kasım 2011)
 3. Sınıf Klinik İmmünoloji Vize Sınav Soruları (Kasım 2011) 1- Virgin B lenfositleri ile ilişkili aşağıda yer alan ifadelerden ikisi yanlıştır. Yanlış ifadelerin ikisini de birlikte içeren seçeneği işaretleyiniz.
3. Sınıf Klinik İmmünoloji Vize Sınav Soruları (Kasım 2011) 1- Virgin B lenfositleri ile ilişkili aşağıda yer alan ifadelerden ikisi yanlıştır. Yanlış ifadelerin ikisini de birlikte içeren seçeneği işaretleyiniz.
Genetik Bilgi: DNA Yapısı, Fonksiyonu ve Replikasyonu. Dr. Mahmut Çerkez Ergören
 Genetik Bilgi: DNA Yapısı, Fonksiyonu ve Replikasyonu Dr. Mahmut Çerkez Ergören Genetik materyal; Kendini çoğaltır. Bilgi depolar. Bilgiyi ifade eder. Mutasyonla varyasyonlara izin verir. Genetik Tarihçe
Genetik Bilgi: DNA Yapısı, Fonksiyonu ve Replikasyonu Dr. Mahmut Çerkez Ergören Genetik materyal; Kendini çoğaltır. Bilgi depolar. Bilgiyi ifade eder. Mutasyonla varyasyonlara izin verir. Genetik Tarihçe
Edinsel İmmün Yanıt Güher Saruhan- Direskeneli
 Edinsel İmmün Yanıt Güher Saruhan- Direskeneli İTF Fizyoloji AD Doğal bağışıklık Edinsel bağışıklık Hızlı yanıt (saatler) Sabit R yapıları Sınırlı çeşidi tanıma Yanıt sırasında değişmez Yavaş yanıt (Gün-hafta)
Edinsel İmmün Yanıt Güher Saruhan- Direskeneli İTF Fizyoloji AD Doğal bağışıklık Edinsel bağışıklık Hızlı yanıt (saatler) Sabit R yapıları Sınırlı çeşidi tanıma Yanıt sırasında değişmez Yavaş yanıt (Gün-hafta)
Sınıf ; Çalışma yaprağı 3
 Öğrencinin Adı ve soyadı ; Sınıf ; Çalışma yaprağı 3 F.8.2. DNA ve Genetik Kod / Canlılar ve Yaşam Bu ünitede öğrencilerin; DNA ve genetik kod ile ilişkili kavramları açıklamaları ve aralarındaki ilişkileri
Öğrencinin Adı ve soyadı ; Sınıf ; Çalışma yaprağı 3 F.8.2. DNA ve Genetik Kod / Canlılar ve Yaşam Bu ünitede öğrencilerin; DNA ve genetik kod ile ilişkili kavramları açıklamaları ve aralarındaki ilişkileri
Hücre. 1 µm = 0,001 mm (1000 µm = 1 mm)!
 HÜCRE FİZYOLOJİSİ Hücre Hücre: Tüm canlıların en küçük yapısal ve fonksiyonel ünitesi İnsan vücudunda trilyonlarca hücre bulunur Fare, insan veya filin hücreleri yaklaşık aynı büyüklükte Vücudun büyüklüğü
HÜCRE FİZYOLOJİSİ Hücre Hücre: Tüm canlıların en küçük yapısal ve fonksiyonel ünitesi İnsan vücudunda trilyonlarca hücre bulunur Fare, insan veya filin hücreleri yaklaşık aynı büyüklükte Vücudun büyüklüğü
YGS YE HAZIRLIK DENEMESi #22
 YGS YE HAZIRLIK DENEMESi #22 1) Zigottan başlayıp yeni bir bireyin meydana gelmesiyle sonlanan olayların hepsine birden gelişme denir. Embriyonun gelişimi sırasında, I. Morula II. Gastrula III. Blastula
YGS YE HAZIRLIK DENEMESi #22 1) Zigottan başlayıp yeni bir bireyin meydana gelmesiyle sonlanan olayların hepsine birden gelişme denir. Embriyonun gelişimi sırasında, I. Morula II. Gastrula III. Blastula
Sonradan Kazandırılan Bağışıklık
 Sonradan Kazandırılan Bağışıklık 1 Çocukların Ölüm Nedenleri Arasında Aşı İle Önlenebilir Hastalıklar İlk Sırada Bulunur Boğmaca 11% Tetanoz 8% Diğerleri 1% Pnömokok 28% Hib 15% Rotavirus 16% Kızamık 21%
Sonradan Kazandırılan Bağışıklık 1 Çocukların Ölüm Nedenleri Arasında Aşı İle Önlenebilir Hastalıklar İlk Sırada Bulunur Boğmaca 11% Tetanoz 8% Diğerleri 1% Pnömokok 28% Hib 15% Rotavirus 16% Kızamık 21%
VİRUS HASTALIKLARINDA TANI YÖNTEMLERİ
 VİRUS HASTALIKLARINDA TANI YÖNTEMLERİ Doç. Dr. Koray Ergünay MD PhD Hacettepe Üniversitesi Tıp Fakültesi Mikrobiyoloji ve Klinik Mikrobiyoloji Anabilim Dalı, Viroloji Ünitesi Viral Enfeksiyonlar... Klinik
VİRUS HASTALIKLARINDA TANI YÖNTEMLERİ Doç. Dr. Koray Ergünay MD PhD Hacettepe Üniversitesi Tıp Fakültesi Mikrobiyoloji ve Klinik Mikrobiyoloji Anabilim Dalı, Viroloji Ünitesi Viral Enfeksiyonlar... Klinik
8. KONU: VİRAL KOMPONENTLERİN BİYOLOJİK FONKSİYONU Kodlama: Her virüs kendine özgü proteini oluşturmakla birlikte, proteinde nükleik asidi için
 8. KONU: VİRAL KOMPONENTLERİN BİYOLOJİK FONKSİYONU Kodlama: Her virüs kendine özgü proteini oluşturmakla birlikte, proteinde nükleik asidi için koruyucu kalkan görevi görmektedir. Protein kendi kendine
8. KONU: VİRAL KOMPONENTLERİN BİYOLOJİK FONKSİYONU Kodlama: Her virüs kendine özgü proteini oluşturmakla birlikte, proteinde nükleik asidi için koruyucu kalkan görevi görmektedir. Protein kendi kendine
2. Histon olmayan kromozomal proteinler
 12. Hafta: Nükleik Asitler: Nükleik asitlerin yapısal üniteleri, nükleozitler, nükleotidler, inorganik fosfat, nükleotidlerin fonksiyonları, nükleik asitler, polinükleotidler, DNA nın primer ve sekonder
12. Hafta: Nükleik Asitler: Nükleik asitlerin yapısal üniteleri, nükleozitler, nükleotidler, inorganik fosfat, nükleotidlerin fonksiyonları, nükleik asitler, polinükleotidler, DNA nın primer ve sekonder
YAZILIYA HAZIRLIK SORULARI. 9. Sınıf
 YAZILIYA HAZIRLIK SORULARI 9. Sınıf DOĞRU YANLIŞ SORULARI Nitel gözlemlerin güvenilirliği nicel gözlemlerden fazladır. Ökaryot hücrelerde kalıtım materyali çekirdek içinde bulunur. Ototrof beslenen canlılar
YAZILIYA HAZIRLIK SORULARI 9. Sınıf DOĞRU YANLIŞ SORULARI Nitel gözlemlerin güvenilirliği nicel gözlemlerden fazladır. Ökaryot hücrelerde kalıtım materyali çekirdek içinde bulunur. Ototrof beslenen canlılar
YGS YE HAZIRLIK DENEMESi #18
 YGS YE HAZIRLIK DENEMESi #18 1) Bakterilerin gerçekleştirdiği, I. Kimyasal enerji sayesinde besin sentezleme II. Işık enerjisini kimyasal bağ enerjisine dönüştürme III. Kimyasal bağ enerjisini ATP enerjisine
YGS YE HAZIRLIK DENEMESi #18 1) Bakterilerin gerçekleştirdiği, I. Kimyasal enerji sayesinde besin sentezleme II. Işık enerjisini kimyasal bağ enerjisine dönüştürme III. Kimyasal bağ enerjisini ATP enerjisine
KİMYA-IV. Yrd. Doç. Dr. Yakup Güneş
 KİMYA-IV Yrd. Doç. Dr. Yakup Güneş Organik Kimyaya Giriş Kimyasal bileşikler, eski zamanlarda, elde edildikleri kaynaklara bağlı olarak Anorganik ve Organik olmak üzere, iki sınıf altında toplanmışlardır.
KİMYA-IV Yrd. Doç. Dr. Yakup Güneş Organik Kimyaya Giriş Kimyasal bileşikler, eski zamanlarda, elde edildikleri kaynaklara bağlı olarak Anorganik ve Organik olmak üzere, iki sınıf altında toplanmışlardır.
İnfeksiyon tanısında yeni yaklaşımlar Biyosensörler. Barış OTLU İnönü Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Malatya.
 İnfeksiyon tanısında yeni yaklaşımlar Biyosensörler Barış OTLU İnönü Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Malatya. Bakterilerin tanımlanması Bakterilerin tanımlanması Bakterilerin
İnfeksiyon tanısında yeni yaklaşımlar Biyosensörler Barış OTLU İnönü Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Malatya. Bakterilerin tanımlanması Bakterilerin tanımlanması Bakterilerin
ayxmaz/biyoloji Adı: 1.Aşağıda verilen atomların bağ yapma sayılarını (H) ekleyerek gösterin. C N O H
 Adı: 1.Aşağıda verilen atomların bağ yapma sayılarını (H) ekleyerek gösterin. C N O H 2.Radyoaktif izotoplar biyologları için önemlidir? Aşağıda radyoakif maddelerin kullanıldığı alanlar sıralanmıştır.bunlarla
Adı: 1.Aşağıda verilen atomların bağ yapma sayılarını (H) ekleyerek gösterin. C N O H 2.Radyoaktif izotoplar biyologları için önemlidir? Aşağıda radyoakif maddelerin kullanıldığı alanlar sıralanmıştır.bunlarla
KALITSAL MOLEKÜLÜN BİÇİMİ ve ORGANİZASYONU PROF. DR. SERKAN YILMAZ
 KALITSAL MOLEKÜLÜN BİÇİMİ ve ORGANİZASYONU PROF. DR. SERKAN YILMAZ Değişik canlı gruplarında kalıtsal molekülün çeşidi, sayısı, biçimi ve organizasyonu bakımından farklılıklar bulunur. Ortak özellik: nükleik
KALITSAL MOLEKÜLÜN BİÇİMİ ve ORGANİZASYONU PROF. DR. SERKAN YILMAZ Değişik canlı gruplarında kalıtsal molekülün çeşidi, sayısı, biçimi ve organizasyonu bakımından farklılıklar bulunur. Ortak özellik: nükleik
KALITSAL MADDE PROF. DR. SERKAN YILMAZ
 KALITSAL MADDE PROF. DR. SERKAN YILMAZ Kalıtsal madde (kalıtsal molekül, genetik materyal) (1) canlının yapı ve işlevlerinin belirlenmesinden, (2) canlının kendine benzer bir canlıyı meydana getirmesinden,
KALITSAL MADDE PROF. DR. SERKAN YILMAZ Kalıtsal madde (kalıtsal molekül, genetik materyal) (1) canlının yapı ve işlevlerinin belirlenmesinden, (2) canlının kendine benzer bir canlıyı meydana getirmesinden,
YGS YE HAZIRLIK DENEMESi #21
 YGS YE HAZIRLIK DENEMESi #21 1) Aşağıda bazı dönüşüm tepkimeleri gösterilmiştir. a 2) Enzimlerin çalışma hızına etki eden faktörlerle ilgili; RH RH ADP + Pi ATP I II b Buna göre a ve b yönlerindeki değişimlerle
YGS YE HAZIRLIK DENEMESi #21 1) Aşağıda bazı dönüşüm tepkimeleri gösterilmiştir. a 2) Enzimlerin çalışma hızına etki eden faktörlerle ilgili; RH RH ADP + Pi ATP I II b Buna göre a ve b yönlerindeki değişimlerle
ÇANAKKALE ONSEKİZ MART ÜNİVERSİTESİ TIP FAKÜLTESİ Eğitim Yılı
 Dönem I. 2. Ders Kurulu II. HÜCRE BİLİMLERİ-I Eğitim Programı Eğitim Başkoordinatörü: Dönem Koordinatörü: Koordinatör Yardımcısı: Doç. Dr. Erkan Melih ŞAHİN Prof. Dr. Alirıza ERDOĞAN Yrd. Doç. Ders Kurulu
Dönem I. 2. Ders Kurulu II. HÜCRE BİLİMLERİ-I Eğitim Programı Eğitim Başkoordinatörü: Dönem Koordinatörü: Koordinatör Yardımcısı: Doç. Dr. Erkan Melih ŞAHİN Prof. Dr. Alirıza ERDOĞAN Yrd. Doç. Ders Kurulu
Kan Bankacılığı ve Transfüzyon Tıbbında HLA Sisteminin Önemi
 Kan Bankacılığı ve Transfüzyon Tıbbında HLA Sisteminin Önemi 1 HLA TAŞIYAN HÜCRELER VE TRANSFÜZYONDA ÖNEMİ Dr. İshak Özel TEKİN Bülent Ecevit Üniversitesi Tıp Fakültesi İmmünoloji A.D. 2 3 Baruj Benacerraf
Kan Bankacılığı ve Transfüzyon Tıbbında HLA Sisteminin Önemi 1 HLA TAŞIYAN HÜCRELER VE TRANSFÜZYONDA ÖNEMİ Dr. İshak Özel TEKİN Bülent Ecevit Üniversitesi Tıp Fakültesi İmmünoloji A.D. 2 3 Baruj Benacerraf
ETKİN İLAÇ KULLANIMINDA GENETİK FAKTÖRLER. İlaç Kullanımında Bireyler Arasındaki Genetik Farklılığın Mekanizması
 ETKİN İLAÇ KULLANIMINDA GENETİK FAKTÖRLER İlaç Kullanımında Bireyler Arasındaki Genetik Farklılığın Mekanizması Absorbsiyon İlaç hedefleri Dağılım Hastalıkla ilgili Metabolizma yolaklar Atılım Farmakokinetik
ETKİN İLAÇ KULLANIMINDA GENETİK FAKTÖRLER İlaç Kullanımında Bireyler Arasındaki Genetik Farklılığın Mekanizması Absorbsiyon İlaç hedefleri Dağılım Hastalıkla ilgili Metabolizma yolaklar Atılım Farmakokinetik
Kanın fonksiyonel olarak üstlendiği görevler
 EGZERSİZ VE KAN Kanın fonksiyonel olarak üstlendiği görevler Akciğerden dokulara O2 taşınımı, Dokudan akciğere CO2 taşınımı, Sindirim organlarından hücrelere besin maddeleri taşınımı, Hücreden atık maddelerin
EGZERSİZ VE KAN Kanın fonksiyonel olarak üstlendiği görevler Akciğerden dokulara O2 taşınımı, Dokudan akciğere CO2 taşınımı, Sindirim organlarından hücrelere besin maddeleri taşınımı, Hücreden atık maddelerin
A. DNA NIN KEŞFİ VE ÖNEMİ
 DNA nın Yapısı ve Replikasyonu Biyoloji Ders Notları A. DNA NIN KEŞFİ VE ÖNEMİ İlk olarak Friedrich Miescher (1869) akyuvar hücreleri ve balık sperminde yönetici molekülleri tespit etmiştir. Çekirdekte
DNA nın Yapısı ve Replikasyonu Biyoloji Ders Notları A. DNA NIN KEŞFİ VE ÖNEMİ İlk olarak Friedrich Miescher (1869) akyuvar hücreleri ve balık sperminde yönetici molekülleri tespit etmiştir. Çekirdekte
Akıllı Defter. 9.Sınıf Biyoloji. vitaminler,hormonlar,nükleik asitler. sembole tıklayınca etkinlik açılır. sembole tıklayınca ppt sunumu açılır
 9.Sınıf Biyoloji 1 Akıllı Defter vitaminler,hormonlar,nükleik asitler sembole tıklayınca etkinlik açılır sembole tıklayınca ppt sunumu açılır sembole tıklayınca video açılır 1 VİTAMİNLER ***Vitaminler:
9.Sınıf Biyoloji 1 Akıllı Defter vitaminler,hormonlar,nükleik asitler sembole tıklayınca etkinlik açılır sembole tıklayınca ppt sunumu açılır sembole tıklayınca video açılır 1 VİTAMİNLER ***Vitaminler:
Kloroform, eter ve benzen gibi organik çözücülerde çözünen bunun yanı sıra suda çözünmeyen veya çok az çözünen organik molekül grubudur.
 Kloroform, eter ve benzen gibi organik çözücülerde çözünen bunun yanı sıra suda çözünmeyen veya çok az çözünen organik molekül grubudur. Yağların suda çözünmemesi canlılığın devamı içi önemlidir. Çünkü
Kloroform, eter ve benzen gibi organik çözücülerde çözünen bunun yanı sıra suda çözünmeyen veya çok az çözünen organik molekül grubudur. Yağların suda çözünmemesi canlılığın devamı içi önemlidir. Çünkü
HLA MOLEKÜLLERİ VE KLİNİK ÖNEMİ. Prof. Dr. Göksal Keskin
 HLA MOLEKÜLLERİ VE KLİNİK ÖNEMİ Prof. Dr. Göksal Keskin 2017-18 1 HLA Human LÖKOSİT Antijen human MHC Hücre yüzey proteinleri Self ve nonself ayırımında önemli T lenfositlerine peptid yapıda antijenleri
HLA MOLEKÜLLERİ VE KLİNİK ÖNEMİ Prof. Dr. Göksal Keskin 2017-18 1 HLA Human LÖKOSİT Antijen human MHC Hücre yüzey proteinleri Self ve nonself ayırımında önemli T lenfositlerine peptid yapıda antijenleri
Prediktör Testler ve Sıradışı Serolojik Profiller. Dr. Dilara İnan Isparta
 Prediktör Testler ve Sıradışı Serolojik Profiller Dr. Dilara İnan 04.06.2016 Isparta Hepatit B yüzey antijeni (HBsAg) HBV yüzeyinde bulunan bir proteindir; RIA veya EIA ile saptanır Akut ve kronik HBV
Prediktör Testler ve Sıradışı Serolojik Profiller Dr. Dilara İnan 04.06.2016 Isparta Hepatit B yüzey antijeni (HBsAg) HBV yüzeyinde bulunan bir proteindir; RIA veya EIA ile saptanır Akut ve kronik HBV
HAYVANSAL HÜCRELER VE İŞLEVLERİ. YRD. DOÇ. DR. ASLI SADE MEMİŞOĞLU RESİM İŞ ZEMİN KAT ODA: 111
 HAYVANSAL HÜCRELER VE İŞLEVLERİ YRD. DOÇ. DR. ASLI SADE MEMİŞOĞLU RESİM İŞ ZEMİN KAT ODA: 111 asli.memisoglu@deu.edu.tr KONULAR HAYVAN HÜCRESİ HAYVAN, BİTKİ, MANTAR, BAKTERİ HÜCRE FARKLARI HÜCRE ORGANELLERİ
HAYVANSAL HÜCRELER VE İŞLEVLERİ YRD. DOÇ. DR. ASLI SADE MEMİŞOĞLU RESİM İŞ ZEMİN KAT ODA: 111 asli.memisoglu@deu.edu.tr KONULAR HAYVAN HÜCRESİ HAYVAN, BİTKİ, MANTAR, BAKTERİ HÜCRE FARKLARI HÜCRE ORGANELLERİ
Populasyon Genetiği. Populasyonlardaki alel ve gen frekanslarının değişmesine neden olan süreçleri araştıran evrimsel bilim dalı.
 Bu dersin içeriği, Populasyonun tanımı, Alel ve genotip frekansı, Gen havuzu, Gen frekansı, Gerçek/Doğal populasyonlar ve ideal populasyonlar, Populasyon genetiğinin çalışma alanları, HW kanunu -giriş,
Bu dersin içeriği, Populasyonun tanımı, Alel ve genotip frekansı, Gen havuzu, Gen frekansı, Gerçek/Doğal populasyonlar ve ideal populasyonlar, Populasyon genetiğinin çalışma alanları, HW kanunu -giriş,
TEST 1. Hücre Solunumu. 4. Aşağıda verilen moleküllerden hangisi oksijenli solunumda substrat olarak kullanılamaz? A) Glikoz B) Mineral C) Yağ asidi
 1. Termometre Çimlenen bezelye tohumlar Termos Çimlenen bezelye tohumları oksijenli solunum yaptığına göre yukarıdaki düzenekle ilgili, I. Termostaki oksijen miktarı azalır. II. Termometredeki sıcaklık
1. Termometre Çimlenen bezelye tohumlar Termos Çimlenen bezelye tohumları oksijenli solunum yaptığına göre yukarıdaki düzenekle ilgili, I. Termostaki oksijen miktarı azalır. II. Termometredeki sıcaklık
YGS YE HAZIRLIK DENEMESi #13
 YGS YE HAZIRLIK DENEMESi #13 1) Canlılarda özelliklerin genlerle kontrol edildiği ve her genin en az bir özellikten sorumlu olduğu bilindiğine göre, I. Diploid canlılarda her özellik için iki gen bulunması
YGS YE HAZIRLIK DENEMESi #13 1) Canlılarda özelliklerin genlerle kontrol edildiği ve her genin en az bir özellikten sorumlu olduğu bilindiğine göre, I. Diploid canlılarda her özellik için iki gen bulunması
YGS YE HAZIRLIK DENEMESi #6
 YGS YE HAZIRLIK DENEMESi #6 1) Canlılar soylarının devam ettirebilmek için üreyerek yeni bireyler meydana getirir. Bu üreme olaylarıyla ilgili olarak; I. Bakterinin ikiye bölünerek kendine benzer yeni
YGS YE HAZIRLIK DENEMESi #6 1) Canlılar soylarının devam ettirebilmek için üreyerek yeni bireyler meydana getirir. Bu üreme olaylarıyla ilgili olarak; I. Bakterinin ikiye bölünerek kendine benzer yeni
HÜCRE SĠNYAL OLAYLARI PROF. DR. FATMA SAVRAN OĞUZ
 HÜCRE SĠNYAL OLAYLARI PROF. DR. FATMA SAVRAN OĞUZ Çok hücreli organizmaların kompleks omurgalılara evrimi, hücreler birbirleriyle iletişim kuramasalardı mümkün olmazdı. Hücre-hücre Hücre-matriks etkileşimini
HÜCRE SĠNYAL OLAYLARI PROF. DR. FATMA SAVRAN OĞUZ Çok hücreli organizmaların kompleks omurgalılara evrimi, hücreler birbirleriyle iletişim kuramasalardı mümkün olmazdı. Hücre-hücre Hücre-matriks etkileşimini
DOKU UYUŞUM SİSTEMİ. Doku Uyuşum Kompleksi-MHC (Major Histocompatibility Complex) Doku Uyuşum Molekülleri (Dokum Uyuşum Antijenleri)
 DOKU UYUŞUM SİSTEMİ Doku Uyuşum Kompleksi-MHC (Major Histocompatibility Complex) Doku Uyuşum Molekülleri (Dokum Uyuşum Antijenleri) DOKU UYUŞUM SİSTEMİ DLA HLA (Human Leucocyte Antigen) FLA BoLA OLA CLA
DOKU UYUŞUM SİSTEMİ Doku Uyuşum Kompleksi-MHC (Major Histocompatibility Complex) Doku Uyuşum Molekülleri (Dokum Uyuşum Antijenleri) DOKU UYUŞUM SİSTEMİ DLA HLA (Human Leucocyte Antigen) FLA BoLA OLA CLA
Transkripsiyon ve Transkripsiyonun Düzenlenmesi
 MBG 505 BAKTERİ GENETİĞİ Transkripsiyon ve Transkripsiyonun Düzenlenmesi Emrah ÖZÇELİK Ribonükleik asit (RNA) 3 tip RNA Mesajcı RNA (mrna) (genetik seviyede) Transfer RNA (trna) Ribozomal RNA (rrna) (fonksiyonel
MBG 505 BAKTERİ GENETİĞİ Transkripsiyon ve Transkripsiyonun Düzenlenmesi Emrah ÖZÇELİK Ribonükleik asit (RNA) 3 tip RNA Mesajcı RNA (mrna) (genetik seviyede) Transfer RNA (trna) Ribozomal RNA (rrna) (fonksiyonel
3.1. Karbonhidratların Tanımı 3.2. Karbonhidratların Sınıflandırılması 3.3. Monosakkaritler ve Monosakkarit Türevleri Monosakkaritler
 3.1. Karbonhidratların Tanımı 3.2. Karbonhidratların Sınıflandırılması 3.3. Monosakkaritler ve Monosakkarit Türevleri 3.3.1. Monosakkaritler 3.3.1.1. Monosakkaritlerin isimlendirilmesi 3.3.2. Monosakkaritlerin
3.1. Karbonhidratların Tanımı 3.2. Karbonhidratların Sınıflandırılması 3.3. Monosakkaritler ve Monosakkarit Türevleri 3.3.1. Monosakkaritler 3.3.1.1. Monosakkaritlerin isimlendirilmesi 3.3.2. Monosakkaritlerin
Hücresel İmmünite Dicle Güç
 Hücresel İmmünite Dicle Güç dguc@hacettepe.edu.tr kekik imus Kalbe yakınlığı ve Esrarengiz hale Ruhun oturduğu yer Ruh cesaret yiğitlik Yunanlı Hekim MS 1.yy Kalp, pankreas, timus imus yaşla küçülür (timik
Hücresel İmmünite Dicle Güç dguc@hacettepe.edu.tr kekik imus Kalbe yakınlığı ve Esrarengiz hale Ruhun oturduğu yer Ruh cesaret yiğitlik Yunanlı Hekim MS 1.yy Kalp, pankreas, timus imus yaşla küçülür (timik
BİYOLOJİK MOLEKÜLLERDEKİ
 BİYOLOJİK MOLEKÜLLERDEKİ KİMYASALBAĞLAR BAĞLAR KİMYASAL VE HÜCRESEL REAKSİYONLAR Yrd. Doç.Dr. Funda BULMUŞ Atomun Yapısı Maddenin en küçük yapı taşı olan atom elektron, proton ve nötrondan oluşmuştur.
BİYOLOJİK MOLEKÜLLERDEKİ KİMYASALBAĞLAR BAĞLAR KİMYASAL VE HÜCRESEL REAKSİYONLAR Yrd. Doç.Dr. Funda BULMUŞ Atomun Yapısı Maddenin en küçük yapı taşı olan atom elektron, proton ve nötrondan oluşmuştur.
M. (arpa şekeri) +su S (çay şekeri) + su L.. (süt şekeri)+ su
 KARBONHİDRATLAR Karbonhidratlar yapılarında.. (C),.. (H) ve. (O) atomu bulunduran organik bileşiklerdir. Karbonhidratların formülü ( ) ile gösterilir. Nükleik asitlerin, ATP nin, hücre, bitkilerde yapısına
KARBONHİDRATLAR Karbonhidratlar yapılarında.. (C),.. (H) ve. (O) atomu bulunduran organik bileşiklerdir. Karbonhidratların formülü ( ) ile gösterilir. Nükleik asitlerin, ATP nin, hücre, bitkilerde yapısına
ADIM ADIM YGS-LYS 37. ADIM HÜCRE 14- ÇEKİRDEK
 ADIM ADIM YGS-LYS 37. ADIM HÜCRE 14- ÇEKİRDEK 3) Çekirdek Ökaryot yapılı hücrelerde genetik maddeyi taşıyan hücre kısmıdır. Prokaryot hücreli canlılarda bulunmaz. GÖREVLERİ: 1) Genetik maddeyi taşıdığından
ADIM ADIM YGS-LYS 37. ADIM HÜCRE 14- ÇEKİRDEK 3) Çekirdek Ökaryot yapılı hücrelerde genetik maddeyi taşıyan hücre kısmıdır. Prokaryot hücreli canlılarda bulunmaz. GÖREVLERİ: 1) Genetik maddeyi taşıdığından
KAS DOKUSU. Prof.Dr. Ümit TÜRKOĞLU
 KAS DOKUSU Prof.Dr. Ümit TÜRKOĞLU 1 Kas dokusu, kimyasal enerjiyi mekanik enerjiye dönüştürerek hareketi sağlayan bir dokudur. Toplam vücut ağırlığının Yenidoğanda % 25 Genç erişkin dönemde % 40 ve yaşlılık
KAS DOKUSU Prof.Dr. Ümit TÜRKOĞLU 1 Kas dokusu, kimyasal enerjiyi mekanik enerjiye dönüştürerek hareketi sağlayan bir dokudur. Toplam vücut ağırlığının Yenidoğanda % 25 Genç erişkin dönemde % 40 ve yaşlılık
EĞİTİM - ÖĞRETİM YILI DÖNEM I V. KURUL DERS PROGRAMI HEMOPOETİK VE İMMÜN SİSTEM. (1 Mayıs Haziran 2017 )
 Dekan V. Baş Koordinatör Dönem I Koordinatörü Dönem I Koordinatör Yardımcısı Dönem I Koordinatör Yardımcısı Kurulun amacı: 2016 2017 EĞİTİM - ÖĞRETİM YILI DÖNEM I V. KURUL DERS PROGRAMI HEMOPOETİK VE İMMÜN
Dekan V. Baş Koordinatör Dönem I Koordinatörü Dönem I Koordinatör Yardımcısı Dönem I Koordinatör Yardımcısı Kurulun amacı: 2016 2017 EĞİTİM - ÖĞRETİM YILI DÖNEM I V. KURUL DERS PROGRAMI HEMOPOETİK VE İMMÜN
Hücre çeperi (Hücre duvarı)
 Hücre çeperi (Hücre duvarı) Mycoplasmalar dışındaki tüm prokaryotlarda vardır. Görevleri: Bakteriyi kendi iç basıncına karşı korur(hücre içi ozmotik basıncı % 10-20 sakkaroz çözeltisi yoğunluğuna eşittir).
Hücre çeperi (Hücre duvarı) Mycoplasmalar dışındaki tüm prokaryotlarda vardır. Görevleri: Bakteriyi kendi iç basıncına karşı korur(hücre içi ozmotik basıncı % 10-20 sakkaroz çözeltisi yoğunluğuna eşittir).
DÖNEM 1- A, 3. DERS KURULU (2015-2016)
 DÖNEM 1- A, 3. DERS KURULU (2015-2016) DERS SAATİ DERS ADI DERS KONUSU DERSİ VEREN ÖĞRETİM ÜYESİ 4. DK 1. Hafta 07 Aralık Pazartesi Mikrobiyoloji Mikrobiyolojinin tarihçesi ve mikroorganizmalara genel
DÖNEM 1- A, 3. DERS KURULU (2015-2016) DERS SAATİ DERS ADI DERS KONUSU DERSİ VEREN ÖĞRETİM ÜYESİ 4. DK 1. Hafta 07 Aralık Pazartesi Mikrobiyoloji Mikrobiyolojinin tarihçesi ve mikroorganizmalara genel
Adaptif İmmünoterapi. Prof.Dr.Ender Terzioğlu Akdeniz Üniversitesi Antalya
 Adaptif İmmünoterapi Prof.Dr.Ender Terzioğlu Akdeniz Üniversitesi Antalya Adaptif immünoterapi İmmün Sistemin kanser oluşumunda koruyucu rolü daha iyi anlaşılmıştır. Monoklonal antikor teknolojisi, Tümör
Adaptif İmmünoterapi Prof.Dr.Ender Terzioğlu Akdeniz Üniversitesi Antalya Adaptif immünoterapi İmmün Sistemin kanser oluşumunda koruyucu rolü daha iyi anlaşılmıştır. Monoklonal antikor teknolojisi, Tümör
MİKROBİYOLOJİ SORU KAMPI 2015
 Canlıların prokaryot ve ökoaryot olma özelliğini hücre komponentlerinden hangisi belirler? MİKROBİYOLOJİ SORU KAMPI 2015 B. Stoplazmik membran C. Golgi membranı D. Nükleer membran E. Endoplazmik retikulum
Canlıların prokaryot ve ökoaryot olma özelliğini hücre komponentlerinden hangisi belirler? MİKROBİYOLOJİ SORU KAMPI 2015 B. Stoplazmik membran C. Golgi membranı D. Nükleer membran E. Endoplazmik retikulum
ADIM ADIM YGS LYS Adım EVRİM
 ADIM ADIM YGS LYS 191. Adım EVRİM EVRİM İLE İLGİLİ GÖRÜŞLER Evrim, geçmiş ile gelecekteki canlıların ve olayların yorumlanmasını sağlayarak, bugün dünyada yaşayan canlılar arasındaki akrabalık derecesini
ADIM ADIM YGS LYS 191. Adım EVRİM EVRİM İLE İLGİLİ GÖRÜŞLER Evrim, geçmiş ile gelecekteki canlıların ve olayların yorumlanmasını sağlayarak, bugün dünyada yaşayan canlılar arasındaki akrabalık derecesini
YAZILIYA HAZIRLIK SORULARI. 12. Sınıf 1 GENDEN PROTEİNE
 YAZILIYA HAZIRLIK SORULARI 12. Sınıf 1 GENDEN PROTEİNE Protein sentezini tüm canlılar gerçekleştirir. Bir mrna molekülünde en fazla 64 çeşit kodon bulunur. DOĞRU YANLIŞ SORULARI Canlıların heterotrof beslenenleri
YAZILIYA HAZIRLIK SORULARI 12. Sınıf 1 GENDEN PROTEİNE Protein sentezini tüm canlılar gerçekleştirir. Bir mrna molekülünde en fazla 64 çeşit kodon bulunur. DOĞRU YANLIŞ SORULARI Canlıların heterotrof beslenenleri
VİRAL ENFEKSİYONLAR VE KORUNMA. Yrd. Doç. Dr. Banu KAŞKATEPE
 VİRAL ENFEKSİYONLAR VE KORUNMA Yrd. Doç. Dr. Banu KAŞKATEPE VİRAL HASTALIKLARDA İMMÜNİTE Virüsler konak hücreye girdikten sonra çoğalır ve viral çoğalma belirli bir düzeye ulaştığında hastalık semptomları
VİRAL ENFEKSİYONLAR VE KORUNMA Yrd. Doç. Dr. Banu KAŞKATEPE VİRAL HASTALIKLARDA İMMÜNİTE Virüsler konak hücreye girdikten sonra çoğalır ve viral çoğalma belirli bir düzeye ulaştığında hastalık semptomları
Mikroorganizmalar gözle görülmezler, bu yüzden mikroskopla incelenirler.
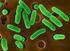 10. Sınıf Enfeksiyondan Korunma 2.Hafta ( 22-26 / 09 / 2014 ) ENFEKSİYON ETKENLERİNİN SINIFLANDIRILMASI 1.) BAKTERİLER 2.) VİRÜSLER Slayt No : 2 Mikroorganizmaların Sınıflandırılması ; a.) Sayısal Yöntem,
10. Sınıf Enfeksiyondan Korunma 2.Hafta ( 22-26 / 09 / 2014 ) ENFEKSİYON ETKENLERİNİN SINIFLANDIRILMASI 1.) BAKTERİLER 2.) VİRÜSLER Slayt No : 2 Mikroorganizmaların Sınıflandırılması ; a.) Sayısal Yöntem,
2003 ÖSS BİYOLOJİ SORULARI VE CEVAPLARI
 2003 ÖSS BİYOLOJİ SORULARI VE CEVAPLARI 1. Bir hücrede oksijenli solunum, protein sentezi, fotosentez olaylarının tümünün gerçekleşebilmesi için, bu hücrede; I. ribozom, II. kloroplast, III. mitokondri,
2003 ÖSS BİYOLOJİ SORULARI VE CEVAPLARI 1. Bir hücrede oksijenli solunum, protein sentezi, fotosentez olaylarının tümünün gerçekleşebilmesi için, bu hücrede; I. ribozom, II. kloroplast, III. mitokondri,
T.C. MUSTAFA KEMAL ÜNİVERSİTESİ TAYFUR ATA SÖKMEN TIP FAKÜLTESİ EĞİTİM & ÖĞRETİM YILI DÖNEM II
 T.C. MUSTAFA KEMAL ÜNİVERSİTESİ TAYFUR ATA SÖKMEN TIP FAKÜLTESİ 2017 2018 EĞİTİM & ÖĞRETİM YILI DÖNEM II VI. DERS KURULU (4 HAFTA) 1901206HASTALIKLARIN BİYOLOJİK TEMELİ DERS KURULU-I DEKAN DEKAN YRD. BAŞKORDİNATÖR
T.C. MUSTAFA KEMAL ÜNİVERSİTESİ TAYFUR ATA SÖKMEN TIP FAKÜLTESİ 2017 2018 EĞİTİM & ÖĞRETİM YILI DÖNEM II VI. DERS KURULU (4 HAFTA) 1901206HASTALIKLARIN BİYOLOJİK TEMELİ DERS KURULU-I DEKAN DEKAN YRD. BAŞKORDİNATÖR
İ. Ü İstanbul Tıp Fakültesi Tıbbi Biyoloji Anabilim Dalı Prof. Dr. Filiz Aydın
 İ. Ü İstanbul Tıp Fakültesi Tıbbi Biyoloji Anabilim Dalı Prof. Dr. Filiz Aydın Genetik nedir? Biyolojinin kalıtım ve varyasyonlarla (çeşitlilikle) ilgilenen bilim dalıdır. Genetik yaşayan tüm organizmalarda
İ. Ü İstanbul Tıp Fakültesi Tıbbi Biyoloji Anabilim Dalı Prof. Dr. Filiz Aydın Genetik nedir? Biyolojinin kalıtım ve varyasyonlarla (çeşitlilikle) ilgilenen bilim dalıdır. Genetik yaşayan tüm organizmalarda
İMMUNOLOJİK TANI YÖNTEMLERİ
 İMMUNOLOJİK TANI YÖNTEMLERİ Presipitasyon G)İMMUNOASSAY TESTLER İşaretli antikorların kullanılmasıyla 1942 de; FA Fluoresan Antikor (Fluorokromlar) 1954 de; IFA (İndirekt Fluoresan Antikor) 1960 da; RIA
İMMUNOLOJİK TANI YÖNTEMLERİ Presipitasyon G)İMMUNOASSAY TESTLER İşaretli antikorların kullanılmasıyla 1942 de; FA Fluoresan Antikor (Fluorokromlar) 1954 de; IFA (İndirekt Fluoresan Antikor) 1960 da; RIA
MOLEKÜLER BİYOLOJİ LABORATUVARI
 MOLEKÜLER 2014-2015 BİYOLOJİ LABORATUVARI GÜZ DÖNEMİ MOLEKÜLER BİYOLOJİ LABORATUVARI 7.HAFTA DERS NOTLARI GAZİ ÜNİVERSİTESİ FEN FAKÜLTESİ BİYOLOJİ BÖLÜMÜ Sayfa 1 / 6 1. RFLP (RESTRİKSİYON PARÇA UZUNLUK
MOLEKÜLER 2014-2015 BİYOLOJİ LABORATUVARI GÜZ DÖNEMİ MOLEKÜLER BİYOLOJİ LABORATUVARI 7.HAFTA DERS NOTLARI GAZİ ÜNİVERSİTESİ FEN FAKÜLTESİ BİYOLOJİ BÖLÜMÜ Sayfa 1 / 6 1. RFLP (RESTRİKSİYON PARÇA UZUNLUK
