DENİZ SUYUNDAKİ HİDROJEN SÜLFÜRÜN (H 2 S), FARKLI METAL ELEKTROTLAR KULLANILARAK ELEKTRO-OKSİDASYONUNUN İNCELENMESİ. Orhan YILMAZ
|
|
|
- Belgin Engin
- 6 yıl önce
- İzleme sayısı:
Transkript
1 DENİZ SUYUNDAKİ HİDROJEN SÜLFÜRÜN (H 2 S), FARKLI METAL ELEKTROTLAR KULLANILARAK ELEKTRO-OKSİDASYONUNUN İNCELENMESİ Orhan YILMAZ YÜKSEK LİSANS TEZİ KİMYA GAZİ ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ EYLÜL 2012 ANKARA
2 i Orhan YILMAZ tarafından hazırlanan DENİZ SUYUNDAKİ HİDROJEN SÜLFÜRÜN (H 2 S), FARKLI METAL ELEKTROTLAR KULLANILARAK ELEKTRO-OKSİDASYONUNUN İNCELENMESİ adlı bu tezin Yüksek Lisans tezi olarak uygun olduğunu onaylarım. Yrd. Doç. Dr. Aylin AYTAÇ Tez Danışmanı Kimya Anabilim Dalı. Yrd. Doç. Dr. Ayşe Elif SANLI Tez Danışmanı Kimya Mühendisliği Anabilim Dalı. Bu çalışma, jürimiz tarafından oy birliği ile Kimya Anabilim Dalında Yüksek Lisans tezi olarak kabul edilmiştir. Prof. Dr. Semra BİLGİÇ Kimya Anabilim Dalı, A.Ü.. Prof. Dr. Senay TAŞÇIOĞLU Kimya Anabilim Dalı, G.Ü... Prof. Dr. Mehlika PULAT Kimya Anabilim Dalı, G.Ü.. Tarih: 27/09/2012 Bu tez ile G.Ü. Fen Bilimleri Enstitüsü Yönetim Kurulu Yüksek Lisans derecesini onamıştır. Prof. Dr. Şeref SAĞIROĞLU Fen Bilimleri Enstitüsü Müdürü.
3 ii TEZ BİLDİRİMİ Tez içindeki bütün bilgilerin etik davranış ve akademik kurallar çerçevesinde elde edilerek sunulduğunu, ayrıca tez yazım kurallarına uygun olarak hazırlanan bu çalışmada orijinal olmayan her türlü kaynağa eksiksiz atıf yapıldığını bildiririm. Orhan YILMAZ
4 iv DENİZ SUYUNDAKİ HİDROJEN SÜLFÜRÜN (H 2 S), FARKLI METAL ELEKTROTLAR KULLANILARAK ELEKTRO-OKSİDASYONUNUN İNCELENMESİ (Yüksek Lisans Tezi) Orhan YILMAZ GAZİ ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ Eylül 2012 ÖZET Bu çalışmada, deniz suyundaki hidrojen sülfürün (H 2 S), nikel, bakır, gümüş, paslanmaz çelik (304), çinko ve vanadyum elektrotlar kullanılarak elektrooksidasyonu açık devre potansiyeli, döngüsel voltametri ve empedans ölçümleri ile incelendi. ph 14 de 600 mv potansiyelde 0,021 M. hidrojen sülfür konsantrasyonunda Nikel en yüksek elektrokatalitik aktiviteyi gösterdi. Nikel anot kullanılarak hazırlanan H 2 S/H 2 O 2 yakıt hücresinde hidrojen sülfürün oksidasyon mekanizması, oksidan olarak asidik peroksit ve yakıt olarak ise bazik hidrojen sülfür kullanılarak araştırıldı. Yakıt hücresinin hücre potansiyeli 25 ºC de 850 mv olarak ölçüldü. Bilim Kodu : Anahtar Kelimeler : Deniz suyu, hidrojen sülfür, elektro-oksidasyon Sayfa Adedi : 115 Tez Yöneticileri : Yrd. Doç. Dr. Aylin AYTAÇ Yrd. Doç. Dr. Ayşe Elif SANLI
5 v INVESTIGATION OF THE ELECTRO-OXIDATION OF SEA WATER CONTAINING HYDROGEN SULPHIDE USING THE DIFFERENT METAL ELECTRODES (M.Sc. Thesis) GAZİ UNIVERSITY INSTITUTE OF SCIENCE AND TECHNOLOGY September 2012 ABSTRACT In this study, the oxidation mechanism of hydrogen sulfide (H 2 S) in the sea water using nickel, copper, silver, stainless steel (304), zinc and vanadium was investigated by open circuit potential, cyclic voltammetry and impedance analysis. Nickel showed the highest electro-catalytic activity at 14 ph, 0.6 V potential and M H 2 S concentration. The oxidation mechanism of hydrogen sulfide was investigated, and a fuel cell operating with acidic peroxide as oxidant and basic hydrogen sulfide as fuel was constructed. A stable solid state solid H 2 S/H 2 O 2 fuel cell has been developed 298 K. When the acidic hydrogen peroxide was used as the oxidant, the cell potential increased to 0.85 V at 298 K. Science Code : Key Words : Sea water, hydrogen sulphide, electro-oxidation Number of Pages : 115 Thesis Advisors : Asist. Prof. Dr. Aylin AYTAÇ Asist. Prof. Dr. Ayşe Elif SANLI
6 vi TEŞEKKÜR Çalışmalarım boyunca değerli yardım ve katkılarıyla beni yönlendiren ve kıymetli tecrübelerinden faydalandığım saygıdeğer hocalarım Yrd. Doç. Dr. Aylin AYTAÇ ve Yrd. Doç. Dr. Ayşe Elif SANLI ya ve çalışmalarım boyunca her zaman yanımda olan ve desteğini benden esirgemeyen eşim Ebru YILMAZ a teşekkürü bir borç bilirim.
7 vii İÇİNDEKİLER Sayfa ÖZET... iv ABSTRACT... v TEŞEKKÜR... vi İÇİNDEKİLER... vii ÇİZELGELERİN LİSTESİ....x ŞEKİLLERİN LİSTESİ... xi RESİMLERİN LİSTESİ... xvi SİMGELER VE KISALTMALAR... xvii 1. GİRİŞ GENEL BİLGİLER Hidrojen sülfür Hidrojen sülfür kaynakları Yanma gazları ve hidrojen sülfür Denizlerde anaerobik olarak oluşan hidrojen sülfür Hidrojen sülfürün kimyasal ve elektrokimyasal proseslerinin incelenmesi Hidrojen sülfürün parçalanma reaksiyonları Claus prosesi Katı oksit yakıt pilleri Sülfür birikiminin engellenmesi Enerji kaynağı olarak Karadeniz suyu Karadeniz suyunun H 2 S ve enerji içeriğinin incelenmesi...16
8 viii Sayfa 2.8. Deniz suyunun elektrolizi Hidrojen üretimi Klor gazı üretimi Elektrik enerjisi üretimi Deniz suyu içinde bazı metallerin elektrokimyasal davranışları H 2 S yakıt hücreleri DENEYSEL ÇALIŞMAR Kullanılan Kimyasallar Yapay deniz suyunun hazırlanması Analizde Kullanılan Yöntemler ve Cihazlar Dönüşümlü voltametri tekniği (CV) Elektrokimyasal Empedans Spektroskopisi Yöntemi (EIS) Tafel Ekstrapolasyonu Yöntemi Elektrotların Hazırlanması Elektrokimyasal Ölçümler Elektrotların derişim, ph ve sıcaklığa bağlı olarak etkisinin incelenmesi Yakıt Pili Testleri Yakıt pilinin hazırlanması ve performans testleri Empedans çalışması BULGULAR VE TARTIŞMA Deniz suyu ve Na 2 S içeren çözelti içinde metallerin elektrokimyasal davranışları....45
9 ix Sayfa Elektrolit çözeltisinin ph'sının ve Na 2 S konsantrasyonunun etkisi Metal elektrotlar ile yapılan çalışmalar Nikel elektrot Bakır elektrot Gümüş elektrot Paslanmaz çelik (304) elektrot Çinko elektrot V 2 O 5 elektrot Yakıt pili çalışmaları Yakıt pili performansı Yüzey empedans çalışması SONUÇLAR ÖNERİLER.110 KAYNAKLAR ÖZGEÇMİŞ
10 x ÇİZELGELERİN LİSTESİ Çizelge Sayfa Çizelge 2.1. Karadeniz de Hidrojen Sülfür Potansiyeli.. 18 Çizelge 3.2. Yapay deniz suyundaki tuz miktarları Çizelge 4.1. Pt/C anot yüzeyine ait empedans parametreleri Çizelge 4.3. Ni anot yüzeyine ait empedans parametreleri.. 108
11 xi ŞEKİLLERİN LİSTESİ Şekil Sayfa Şekil 2.1. CO, CO 2, H 2 ve H 2 S ün sudaki çözünürlükleri.. 7 Şekil 2.2. Atık su içinde H 2 S, HS - ve S -2 ph a bağlı olarak değişimi...8 Şekil 2.3. Basitleştirilmiş Claus prosesi düzeneği.11 Şekil 2.4. Yakıt pilinin basitleştirilmiş şeması ve yakıt pili çeşitleri Şekil 2.5. H 2 S//Hava SOFC nin temel çalışma prensibi Şekil 2.6. Karadeniz de H 2 S dağılımı...17 Şekil Karadeniz de çalışmanın yapıldığı bölge (5) ve derinlikle sudaki H 2 S, O 2, CH 4, NH 4 -, NO 2 - değişimlerini gösteren grafikler. 20 Şekil 2.8. Karadeniz de 4 farklı noktadan alınan numunelerin oksijen içeriği, tuzluluk, H 2 S içeriği ve sıcaklık profilleri Şekil 2.9. Hidrojen sülfürün etkileri ve hidrojenle olan ilişkisi..22 Şekil Hidrojen potansiyelinin Karadeniz suyunun derinliğine bağlı olarak değişmesi...23 Şekil Global su kaynakları 25 Şekil Mevcut elektroliz teknikleri.24 Şekil Mevcut elektroliz teknikleri ve tuzluluğun karşılaştırılması Şekil Suyun N.Ş.A. da elektrolizi Şekil Hidrojen sülfürün N.Ş.A. da elektrolizi.27 Şekil 3.1. Nyguist grafiği...39 Şekil 3.2. Bode grafiği...41 Şekil 3.3. Tafel eğirisi Şekil 3.4. Yakıt test hücresi...44
12 xii Şekil Sayfa Şekil 4.1. Ni-S-H 2 O sistemine ait Pourbaix diyagramı...48 Şekil 4.2. Ni elektrodun ph=14 de deniz suyu + Na 2 S içeren çözelti içinde açık devre potansiyeli Şekil 4.3. Ni elektrodun deniz suyu içerisinde farklı sıcaklıklardaki döngüsel voltamogramları.. 50 Şekil 4.4. Ni elektrodun deniz suyu ve Na 2 S ilave edilen çözelti içinde farklı ph lardaki döngüsel voltamogramları.51 Şekil 4.5. Ni elektrodun ph=14 de deniz suyu ve Na 2 S ilave edilen çözelti içinde alınan çoklu tarama döngüsel voltamagramları...52 Şekil 4.6. Deniz suyu ve Na 2 S ilave edilen çözelti içinde farklı konsantrasyonlarında alınan döngüsel voltamogramları Şekil 4.7. Ni elektrodun ph=14 te farklı sıcaklıklarda alınan döngüsel voltamogramları 54 Şekil 4.8. Nikel elektrodun Deniz suyu + Na 2 S içinde Nyquist eğrileri.55 Şekil 4.9. Cu-S-H 2 O Sistemi için Pourbaix diyagramı 56 Şekil Cu elektrotun deniz suyu ve Na 2 S ilave edilen çözelti içinde ph=14 te alınan açık devre potansiyeli.57 Şekil Cu elektrotun deniz suyu ve Na 2 S ilave edilen çözelti içinde farklı ph larda alınan döngüsel voltamogramları Şekil Cu elektrodun deniz suyu ve Na 2 S ilave edilen çözelti içinde ph=10 da alınan çoklu tarama döngüsel voltamogramları 60 Şekil Cu elektrodun deniz suyu içerisinde farklı sıcaklıklarda alınan döngüsel voltamogramları..61 Şekil Cu elektrodun deniz suyu ve Na 2 S ilave edilen çözelti içinde ph=10 da farklı Na 2 S konsantrasyonlarında alınan döngüsel voltamogramları Şekil Cu elektrodun deniz suyu ve Na 2 S ilave edilen çözelti içinde ph=12 de farklı Na 2 S konsantrasyonlarında alınan döngüsel voltamogramları.63
13 xiii Şekil Sayfa Şekil Cu elektrodun deniz suyu ve Na 2 S ilave edilen çözeltide ph=10 de farklı sıcaklıklarda alınan döngüsel voltamogramları.64 Şekil Cu elektrodun deniz suyu ve Na 2 S ilave edilen çözeltide ph=12 de farklı sıcaklıklarda alınan döngüsel voltamogramları.65 Şekil Cu elektrodun deniz suyu ve Na 2 S ilave edilen çözeltide farklı ph larda alınan Nyquist diyagramları...66 Şekil Ag elektrodun H 2 S içeren ve içermeyen ortamlarda alınan döngüsel voltamogramları 68 Şekil Ag-S-H 2 O sistemine ait Pourbaix diyagramı...69 Şekil Ag elektrodun deniz suyu ve Na 2 S içeren çözelti içinde ph=14 te açık devre potansiyeli..70 Şekil Ag elektrodun deniz suyu ve Na 2 S ilave edilen çözelti içinde farklı ph larda alınan döngüsel voltamogramları Şekil Ag elektrodun deniz suyu içerisinde farklı sıcaklıklarda alınan döngüsel voltamogramları...72 Şekil Ag elektrodun deniz suyu ve Na 2 S ilave edilen çözeltide ph=14 te farklı konsantrasyonlarda alınan döngüsel voltamogramları...73 Şekil Ag elektrodun deniz suyu ve Na 2 S ilave edilen çözeltide farklı ph larda alınan Nyquist diyagramları...74 Şekil Paslanmaz çelik (304), (326) ve (630) elektrot için deniz suyu içinde alınan açık devre potansiyelleri...77 Şekil Paslanmaz çelik (304) elektrot Fe-S-H 2 O sistemine ait Pourbaix diyagramı.78 Şekil Paslanmaz çelik (304) elektrodunun deniz suyu ve Na 2 S ilave edilen çözelti içinde alınan açık devre potansiyeli.79 Şekil Paslanmaz çelik (304) elektrodunun deniz suyu ve Na 2 S ilave edilen çözeltide farklı ph larda alınan Tafel eğrileri..80 Şekil Paslanmaz çelik (304) elektrodunun deniz suyu içinde ph=8 de alınan çoklu tarama döngüsel voltamogramları.81
14 xiv Şekil Sayfa Şekil Paslanmaz çelik (304) elektrodunun deniz suyu ve Na 2 S ilave edilen çözeltide farklı ph larda alınan döngüsel voltamogramları..82 Şekil Paslanmaz çelik (304) elektrodunun deniz suyu ve Na 2 S ilave edilen çözelti içinde ph=12 de alınan döngüsel voltamogramları...84 Şekil Paslanmaz çelik (304) elektrodunun deniz suyu ve Na 2 S ilave edilen çözelti içinde farklı konsantrasyonlarda ph=14 de alınan döngüsel voltamogramları Şekil Paslanmaz çelik (304) elektrodunun Nyquist diyagramı...86 Şekil Zn-H 2 O sistemine ait Pourbaix Diyagramı..88 Şekil Zn elektrodun deniz suyu ve Na 2 S ilave edilen çözelti içinde farklı ph larda alınan Tafel eğrileri...89 Şekil Zn elektrodun deniz suyu ve Na 2 S ilave edilen çözelti içinde farklı ph larda alınan döngüsel voltamogramları...90 Şekil Zn elektrodun deniz suyu ve Na 2 S ilave edilen çözelti içinde farklı konsantrasyonlarda ph=14 te alınan döngüsel voltamogramları...91 Şekil Sülfatın ph=10.28 de V 2 O 5 ile modifiye edilmiş GCE elektrot yüzeyinde oksidasyonu...94 Şekil V 2 O 5 elektrodunun deniz suyu ve Na 2 S ilave edilen çözelti içinde 48 saatte alınan açık devre potansiyeli...96 Şekil V 2 O 5 elektrodunun deniz suyu içinde alınan döngüsel voltamogramları97 Şekil 4.42.V 2 O 5 elektrodunun deniz suyu ve Na 2 S ilave edilen çözelti içinde farklı ph larda alınan döngüsel voltamogramları...98 Şekil V 2 O 5 elektrodunun deniz suyu ve Na 2 S ilave edilen çözeltide farklı konsatrasyonlarda ph=14 te alınan döngüsel voltamogramları Şekil V 2 O 5 elektrodunun deniz suyu ve Na 2 S ilave edilen çözeltide ph=14 de farklı sıcaklıklarda alınan döngüsel voltamogramları Şekil V 2 O 5 elektrodunun deniz suyu ve Na 2 S ilave edilen çözelti içinde alınan Nyquist diyagramları Şekil M KOH çözeltisine 1 ml Na 2 S ilavesinin hücre potansiyelini artırması (Pt/C anot yakıt hücresi)...104
15 xv Şekil Sayfa Şekil M KOH çözeltisine 1 ml Na 2 S ilave edilerek alınan V-t eğrisi (Ni anot yakıt hücresi) Şekil Pt/C anot yakıt hücresinin polarizasyon eğrisi Şekil 4.49 Ni anot yakıt hücresinin polarizasyon eğrisi Şekil Pt/C ve Ni yakıt hücrelerine ait potansiyel-zaman eğrileri 106 Şekil Pt/C anot yakıt hücresine ait Nyquist Diyagramı ve eşdeğer devre analizi Şekil Ni anot yakıt hücresine ait Nyquist Diyagramı ve eşdeğer devre analizi Şekil 5.1. Karadeniz Dip Suları Hidrojen Sülfür Hidrojen İlişkisi...110
16 xvi RESİMLERİN LİSTESİ Resim Sayfa Resim 3.1. Referans 3000 Potentiostat/Galvanostat/ZRA marka cihaz 34 Resim 3.2. Üçlü elektrot sistemi.35
17 xvii SİMGELER VE KISALTMALAR Bu çalışmada kullanılmış bazı simgeler ve kısaltmalar, açıklamaları ile birlikte aşağıda sunulmuştur. Simgeler Açıklama Ni Nikel Cu Bakır Ag Gümüş Zn Çinko S Kükürt C Derece celsius V Volt A Amper ma Mili amper ml Mili litre Kısaltmalar Açıklama H 2 S Hidrojen sülfür Na 2 S Sodyum sülfür KOH Potasyum hidroksit NaOH Sodyum hidroksit H 2 O 2 Hidrojen peroksit V 2 O 5 Vanadyum (V) oksit Pas. Çel. Paslanmaz Çelik (304) DS Deniz Suyu NŞA Normal Şartlar Altında SOFC - KOYP Katı oksit yakıt hücresi GR Yeşil Pas
18 xviii Kısaltmalar Açıklama kwh MW GWh GW OCP CV EIS HER MET GC Kilowatt-saat Megawatt Gigawatt-saat Gigawatt Açık Devre Potansiyeli Dönüşümlü Voltametri Elektrokimyasal Empedans Spektrometresi Hidrojen Üretim Reaksiyonu Membran Elektrot Takımı Camsı Karbon
19 1 1. GİRİŞ Enerji ve teknoloji bir toplumun gelişiminde büyük rol oynayan, birbirine bağımlı iki etkendir. Teknolojinin hızla gelişmeye devam etmesiyle beraber enerjiye duyulan gereksinim de sürekli artış göstermektedir. Teknoloji çağı olarak adlandırılan içinde bulunduğumuz dönemde enerji teknolojileri ile ilgili stratejiler ülkelerin gelişmişlik ve kalkınma düzeylerini etkileyen en önemli faktörlerden biridir. Dünya nüfusundaki artış ve daha konforlu yaşam talebine bağlı olarak kişi başına düşen enerji ihtiyacı da sürekli artmaktadır. Günümüzde Dünya toplam elektrik enerjisi gereksinimi 20 trilyon kwh düzeyindedir. Bu gereksinimin % 26,5 i kömür, %34 ü petrol, %24 ü doğal gaz, %6 sı nükleer enerji gibi fosil yakıtlardan, %5,9 u hidrolik ve %3,5 i ise rüzgar, güneş, jeotermal enerji gibi yenilenebilir kaynaklardan karşılanmaktadır yılı itibari ile Dünyada bilinen petrol rezervi milyar varil, kömür rezervi 847,5 milyar ton ve doğalgaz rezervi ise 177,36 trilyon m 3 tür. Günümüzde dünya petrol tüketimi varil/gün dür. Dünya petrol rezervi ise milyon varildir. Buna göre; enerji tüketim trendinin bugünkü seviyesiyle, bilinen petrol rezervlerinin ömrü 43 yıl, doğal gazın 62 yıl, kömürün ise yıl olarak tahmin edilmektedir. İnsanlığın daha konforlu yaşam talebindeki artışla bu ömrün çok daha kısıtlı olacağı açıktır. Bu aşamada daha yeni bir kaynak devreye konulmaz ise Dünya nın 21. Yüzyıldaki en önemli ve güvenilir enerji kaynağı yine kömür olmaktadır. Türkiye deki yaklaşık MW lık kurulu gücün MW ını fosil yakıtlı termik santrallar (bunlara doğal gaz santralları da dahil) MW ını ise hidrolik santrallar oluşturmaktadır. Fosil yakıtlı santralların MW ını doğal gaz yakan kombine çevrim santralları ve kojenerasyon tesisleri oluşturmaktadır. 72 milyon nüfuslu Türkiye de kişi başına düşen net elektrik tüketimi 2010 yılında 2871 kwh olmuştur. Bu rakam AB ülkeleri ortalaması olarak 7000 kwh, OECD ülkelerinde 8024 kwh, Rusya a 6000 kwh, İspanya da 5970 kwh ve komşumuz Yunanistan da 5142 kwh tır. Dünya elektrik tüketimi ortalaması ise 2456 kwh tir. Gelişmiş ülkelerle karşılaştırdığımızda kişi başına düşen elektrik tüketimimizin düşük olduğu göze çarpmaktadır.
20 2 Öte yandan ülkemiz, tükettiği genel enerjinin % 28 ini yerli kaynaklardan sağlayan bir ülkedir. Geri kalan %72 lik gibi çok büyük bir yüzdesini ise ithal etmektedir. Bu da enerji konusunda ülkemizin dışa bağımlı olduğunun çok açık bir göstergesidir. İthal ettiğimiz enerjinin çok pahalı olması ülke ekonomisini olumsuz yönde etkilemektedir. Türkiye de, kurulu durumdaki enerji santrallerinde 2009 yılında 194 GWh civarında elektrik enerjisi üretilmiştir. Ülkemizdeki hızlı sanayileşme nedeni ile yıllık enerji ihtiyacımız 40 GW a kadar yükselmiştir. Sadece bu rakamlar bile ülkemizde enerji kapasitesinin alternatifli olarak geliştirilmesini ve enerjinin tasarruflu kullanılmasının önemini açıkça ortaya koymaktadır. Bununla birlikte enerji güvenliği, dünya enerji piyasalarındaki arz gelişmeleri ve ekonomikliği göz önüne alınarak enerji ihtiyacımızın karşılanmasında yerli kaynaklara ağırlık verilmesi şarttır. Etüt ve arama çalışmalarına yeterli kaynak ayrılmadığı hususu bir yana bırakılacak olursa petrol ve doğal gaz rezervlerimizin yok denecek kadar az olduğu ifade edilmektedir. Sahip olduğumuz birincil enerji kaynaklarımızın % 50 sini çok düşük ısıl değerli ve yüksek küllü linyitler oluşturmaktadır. Bunun yanı sıra MW lık ekonomik hidrolik enerji kapasitemiz bulunmaktadır. Bir ülkenin gelişmişliğinin en önemli göstergelerinden biri enerji stratejileridir. Gelişmiş ülkelere baktığımızda mevcut enerji sistemlerinin çevreye uyumlu teknolojilere dönüştürülmesi sırasında yerel, çevreye zarar vermeyen, verimli enerji kaynaklarının kurulumu ve kullanımına önem verdiklerini görmekteyiz. Güneş, rüzgar, hidrojen ve jeotermal enerji gibi alternatif enerji kaynakları yerel, çevre dostu ve verimli enerji kaynakları olarak önem arz eden teknolojilerdir. Türkiye alternatif enerji kaynakları açısından zengin bir ülkedir. Türkiye nin ortalama yıllık toplam güneşlenme süresi saat (günlük toplam 7,2 saat), ortalama toplam ışınım şiddeti kwh/m²-yıl (günlük toplam 3,6 kwh/m²) dır. Isı üretim amaçlı kullanımı giderek yaygınlaşmasına rağmen Güneş enerjisi, yüksek ilk yatırım maliyeti nedeniyle, Türkiye de henüz elektrik üretim amaçlı kullanıma başlanmış bir enerji kaynağı değildir. Gerekli altyapı çalışmalarının tamamlanması durumunda güneş enerjisinden kwh/m2 lik enerji elde edilebilecektir. Hem güneş pillerinde hem de yoğunlaştırılmış güneş enerjisi sistemlerinde ulaşılan
21 3 teknoloji ile günümüzde güneş enerjisinden daha verimli bir şekilde faydalanmak mümkün olmaktadır. Rüzgar enerjisi henüz emekleme aşamasında olmasına rağmen ümit vermektedir. Türkiye nin karasal alanlarında 400 milyar kwh/yıl brüt potansiyel, 120 milyar kwh/yıl teknik potansiyel ve 50 milyar kwh/yıl ekonomik potansiyeli bulunmaktadır. Brüt potansiyel ise MW, teknik potansiyel MW rüzgar, ekonomik potansiyel ise MW kurulu gücüne eşdeğerdir. Türkiye kıyı sahalarında ise MW kurulu gücünde potansiyel bulunmaktadır. Alternatif bir enerji kaynağı olan hidrojen; temiz, taşınabilir, yenilenebilir, dönüşebilir, alevli ve katalitik yanmaya, elektrokimyasal dönüşüme uygun olması bakımından fosil yakıtlara göre büyük üstünlükler göstermektedir. Hidrojenin saf oksijenle yanmasından sadece su buharı ortaya çıkması çevre kirliliğini önlemek açısından hidrojen kullanımına eğilimi de beraberinde getirmiştir. Tüm bu özellikleri sebebiyle hidrojen, geleceğin enerjisi olmaya en büyük adaydır. Hidrojen çevresel açıdan bakıldığında en temiz yakıttır. Ayrıca depolanabilir, taşınabilir, nakledilebilir olması ve hammaddesinin çeşitli olması hidrojeni geleceğin enerjisi yapabilecek özelliklerindendir. Hidrojen doğada serbest halde bulunmaz. Genellikle diğer elementlerle bileşik halinde bulunur. Örneğin su hidrojenin ve oksijenin kombinasyonundan meydana gelir. Fosil yakıtlar da hidrojen kaynağı olarak kabul edilebilir. Hidrojen fosil yakıtların kullanıldığı her yerde yakıt olarak kullanılabilmektedir. Ulaşımda, ısıtmada, elektrik üretiminde hidrojen yakıtından yararlanılabilir. Hidrojen, alevli yanmaya, katalitik yanmaya, kimyasal dönüşüme, yakıt hücresinde kullanılarak elektrik üretimine uygun bir yakıttır. Fosil yakıtlar ise yalnızca alevli yanmaya uygundur. Hidrojen kullanımına baktığımızda ilk olarak karşımıza yakıt hücreleri çıkmaktadır. Yakıt hücreleri dizüstü bilgisayarlardan otomobillere kadar birçok alanda enerji ihtiyacını karşılayacak şekilde tasarlanmıştır. Yakıt hücrelerinde hidrojen kullanımı ile %60 a kadar enerji dönüşüm verimi elde edilebilmektedir. Bu da geleneksel motorların iki katı kadar fazla verimli olduğunu göstermektedir. Yakıt hücresi
22 4 kullanımı ile enerjiyi taşınabilir hale getirebiliyor olmamız da bu teknolojiyi daha cazip hale getirmektedir. Önümüzdeki yıllarda hidrojen enerjisi ve yakıt hücresi kullanımı büyük oranda yaygınlaşacaktır. Türkiye nin hidrojen üretim kapasitesine baktığımızda ilk göze çarpan veri Karadeniz deki hidrojen sülfür oluşumudur. Karadeniz, hem düşük oksijen, hem de yüksek hidrojen sülfür konsantrasyonuna sahip bir geçiş bölgesi bulunduran, bir iç denizdir. Karadeniz in hidrojen sülfürce zengin bölgesi yaklaşık 50 m kalınlığında bir katmandır. Bu katman, deniz yüzeyinde başlayıp 200 m derinliğe ulaşan oksijenlenmiş bölge ile anoksit bölge arasında yer alır. 200 m derinlikten sonra oksijenin yerini hidrojen sülfür almaktadır. Hidrojen sülfür, dünyanın en zehirli maddesi olmakla birlikte, hidrojen üretimi için kullanıldığında geniş çapta enerji kaynağı olabilecek bir maddedir. Hidrojen ve sülfür elde etmek için Karadeniz deki bu doğal oluşumdan faydalanmak, büyük miktardaki deniz suyunu hidrojen sülfürden arındıracağı gibi büyük oranda hidrojen eldesi sağlayacaktır. Günümüzde teknolojinin ilerlemesi ve enerji kullanımındaki artış beraberinde çevre kirliliğini getirmektedir. Dünyada kullanılan enerji kaynakları genel olarak kömür, doğal gaz, nükleer enerji, petrol ve hidroelektriktir. Enerji üretiminde kullanılan yakıtların çoğu kirlilik yapıcı özelliğe sahiptir. Kirlilikler hava kirliliği, su kirliliği, kara kirliliği olarak sınıflandırılsa da tabiatta kirliliğin bir döngü şeklinde oluştuğu bilinmektedir. Yanma sonucunda oluşan ve kirliliğe sebep olan baca gazları atmosfere atılarak hava kirliliğine sebep olurken, havadaki konsantrasyonları artan bu moleküller, havada bulunan başka moleküllerle reaksiyona girerek farklı yapılara dönüşerek, katı partiküller halinde toprağa veya suya çökebildikleri gibi yağmurun ve nemin etkisiyle asit yağmurları şeklinde de yeryüzüne inerek su ve toprak kirliliğine neden olmaktadırlar. Kükürt bu döngüde önemli yeri olan bir kimyasaldır. Yanma sonucu baca gazında oluşmaktadır. Baca gazlarında üretilen kükürt tabiattaki sülfür çevrimine katılarak, havanın oksijeni ile SO 2 ve H 2SO e 2 SO 3 oluşturmakta, su buharıyla ise 4
23 5 dönüşmektedir. Deniz dipleri gibi havasız ortamlarda biriken SO 2 ise anaerobik bakteriler tarafından parçalanarak H 2 S gazı üretmektedir. Ülkemizde Karadeniz ve Haliç in derin sularında çözünmüş halde bol miktarda hidrojen sülfür bulunmaktadır. Karadeniz dip sularında bulunan ve yaklaşık olarak 1469 milyon ton olduğu tahmin edilen hidrojen sülfürün %100 ayrıştırılması halinde 268,823x 10 6 ton hidrojen elde edilmesinin mümkündür. Bir evin yıllık enerji ihtiyacı yaklaşık 3600 kwh olduğu kabul edilecek olursa ve Karadeniz bölgesinde yaklaşık 10 milyon ailenin yaşadığı düşünülürse, bu kitlenin yıllık enerji ihtiyacı toplamı 3,6x kwh olacaktır. Bu enerji ihtiyacının tamamının sadece Karadeniz dip sularından elde edilecek hidrojen yakıtından karşılanması durumunda bölgenin yaklaşık olarak 250 yıllık enerji ihtiyacı karşılanabilecektir [1]. Ancak bu proseste maliyeti etkileyen en önemli kısım Karadeniz in dip sularının çıkarılması aşamasıdır ki, dünyada bu işi sadece birkaç firma yapabilmektedir. Elde edilen hidrojenin depolanması, kullanım yerlerine taşınması gibi bazı diğer bazı problemlerde mevcut dezavantajlardır. Bu çalışmada, hidrojen üretimine alternatif bir çözüm olarak H 2 S içeren deniz suyundan elektro-oksidasyon mekanizması ile yerinde doğrudan elektrik enerjisi üretilmesi önerilmektedir.
24 6 2. GENEL BİLGİLER 2.1. Hidrojen Sülfür Hidrojen sülfür normal şartlar altında renksiz ve kötü kokusu olan bir gazdır. Çok zehirli, uçucu ve yanıcı bir maddedir. Hidrojen sülfür gazı havadan % 20 daha ağır olmasından dolayı yeterli havalandırmanın olmadığı kuşatılmış yerlerde ve zemindeki çukurlarda birikerek dibe çökmekte ve tehlike yaratmaktadır. Ortamdaki hidrojen sülfür konsantrasyonu % % 46 ulaştığında ise patlamaya neden olmaktadır. 20 o C sıcaklıkta saf sudaki çözünürlüğü 2.7 L olan hidrojen sülfürün sudaki çözünürlüğü su sıcaklığının bir derece artmasıyla % 2.5 azalmaktadır. Diğer bazı gazlarla kıyaslandığı zaman, sudaki çözünürlüğünün oldukça yüksektir Sıvılaştırılmış hidrojen sülfür elektriği iletmez. Kaynama noktası -60,75 C, erime noktası ise -83,70 C'dir. Havadan 1.19 defâ daha ağırdır. Kaynama noktasında yoğunluğu 0,993'tür. Suda ve alkolde oldukça çözünür. Yanıcıdır. % 4,5-45,5 oranında hidrojen sülfür içeren hava patlayıcıdır. Hidrojen sülfür az miktarda petrolde, kaplıcalarda ve tabiî gaz kuyularında bulunur. Elementlerinden de elde edilen hidrojen sülfür laboratuvarlarda demir sülfür üzerine hidrojen klorür etki ettirmekle elde edilir. Saf hidrojen sülfür elde etmek için kalsiyum veya baryum, sülfür reaksiyona sokularak oluşturulur. H 2 S in sudaki çözünürlüğünün CO, CO 2 ve H 2 ile kıyaslandığı zaman oldukça yüksek olduğu Şekil 2.1 de görülmektedir.
25 7 Şekil 2.1. CO, CO 2, H 2 ve H 2 S ün sudaki çözünürlükleri H 2 S suda iki adımda çözünür: H 2 S HS - + H + (2.1) HS - S -2 + H + (2.2) Havasız şartlarda arıtmada ph nın 8 den küçük olması hallerinde hemen hemen hiç S -2 ye rastlanmadığı için ikinci safha ihmal edilebilir. Sıvı fazdaki HS - konsantrasyonu ph ya baglıdır. ph nın 7 den küçük olması halinde toplam sülfürün %50 si H 2 S iken ph 7.5 ise bu deger %20 ye düşer. Bu yüzden ph= aralığında ortamdaki iyonize olmamış H 2 S konsantrasyonunda ani azalma gözlenir. Çözünmüş H 2 S in bir kısmı sıvı fazdan gaz faza geçer ve bu olayda etkili esas faktör sıvı
26 8 üzerindeki gaz fazı H 2 S kısmi basıncının değeridir. Dolayısı ile havasız reaktörlerdeki H 2 S transferi, Gaz: H 2 S Sıvı: H 2 S HS - + H + (2.3) şeklinde gösterilebilir. H 2 S sıvı fazdan gaz faza transfer olduğunda reaksiyonun yönü sola döner ve daha fazla serbest H 2 S teşekkül eder. Sülfür, ortamın ph sına ve sıcaklığa bağlı olarak H 2 S, HS - ve S -2 halinde bulunur. Şekil 2.2 de görüldüğü gibi düşük ph değerlerinde sülfür hidrojen sülfür halinde bulunmaktadır. Hidrojen sülfür ve oksijen, nemli ortamda bakteriler yardımı ile reaksiyona girerek çok kuvvetli asit olan sülfürik asit oluşur. H 2 S + 2O 2 Bakteri + H 2 SO 4 (2.4) Şekil 2.2. Atık su içinde H 2 S, HS - ve S -2 ph ya bağlı olarak değişimi
27 Hidrojen Sülfür Kaynakları Yanma gazları ve hidrojen sülfür Hidrojen sülfür, bahsedildiği gibi istenmeyen, zararlı ancak pek çok enerji üretim prosesleri sonucunda ortaya çıkması kaçınılmaz olan bir gazdır. Dolayısıyla kömür, doğal gaz gibi fosil yakıtlarda kükürdün giderilmesi için pek çok proses geliştirilmiştir. Bazı prosesler yanma öncesinde yakıtların temizlenmesi amacı taşırken, Clause prosesi gibi bazı prosesler ise yanma sonucunda oluşan baca gazında H 2 S in tutulmasına yönelik olarak uygulama alanı bulmaktadır Denizlerde anaerobik olarak oluşan hidrojen sülfür İnsanoğlu yakın zamanlara kadar okyanusun güneş ışığı almayan derin sularında canlı yaşamının olmadığını düşünmekteydi. Ancak günümüzde bu bölgelerde de bazı mantar türü canlıların yaşadığı tespit edilmiştir. Bu canlıların yaşamlarını sürdürmek için güneş ışığı yerine farklı bir enerji kaynağı kullanmakta oldukları yapılan araştırmalar sonucunda anlaşılmıştır. Bu canlılar deniz diplerinde H 2 S çıkışı olan volkanik bölgelerde bulunmakta ve H 2 S ü oksijenle yakarak su ve çeşitli sülfatlar üretmektedirler. Dolayısıyla H 2 S ün yakıt olarak tabiatın kendi çevrimi içinde kullanılabilen bir madde olduğu anlaşılmaktadır. Hidrojen sülfür + Oksijen Su + Sülfatlar (2.5) S H + H 2 S (2.6) Bununla beraber kirliliğin olduğu deniz dibi gibi oksijensiz ortamlarda da bol olarak -2 bulunan SO 4 anaerobik bakteriler yardımıyla H 2 S e dönüştürülmektedir. Karadeniz in suyunun % 90 ı anaerobiktir ve suda bol miktarda H 2 S bulunmaktadır. Deniz seviyesinin 100 metre derine inildiği zaman oksijen miktarı azalarak sıfıra -2 düşer ve bakteriler besin sağlamak için parçalama işlemini ortamdaki SO 4 iyonlarını kullanarak gerçekleştirirler. Bu beslenme zinciri sonucunda ortama bol miktarda H 2 S gazı verilmektedir.
28 Hidrojen Sülfürün Kimyasal ve Elektrokimyasal Proseslerinin İncelenmesi Hidrojen sülfürün parçalanma reaksiyonları Ağır yağların hidrodesülfirizasyonu, zift ve kömür gazlaştırılması, fosil yakıtların rafine edilmesi sırasında üretilen gaz akımlarında istenmeyen yan ürün olarak hidrojen sülfür bulunur. Hidrojen sülfür renksiz, korozif ve oldukça zehirli bir maddedir. Doğal gaz içerisinde birkaç ppm den %50 ye varan konsantrasyon oranlarında ya da daha fazla bulunur. Son birkaç yılda bu gazin endüstrideki varlığı ve zehirliliği üstüne pek çok makale yayınlanmıştır [2]. Her yıl yalnızca Amerika Birleşik Devletleri tek başına, çoğunlukla fosil yakıtın rafine edilmesiyle ortaya çıkan yan ürün olarak, yirmi milyon tondan fazla hidrojen sülfür (H 2 S) üretmektedir [3]. Karadeniz dip sularında 2,5-3 milyon ton hidrojen sülfür (H 2 S) bulunmaktadır. Bu çok özel denizdeki dengeler korunmazsa ve iyileştirme çabaları hemen hayata geçirilmezse büyük felaketlerin yaşanması veya onarılamaz çevre kirliliklerinin ortaya çıkması mümkün olabilecektir. Çevre açısından son derece tehlikeli olan H 2 S gazi ticari olarak da kullanılmamaktadır. Bu yüzden H 2 S gazının elementel kükürde dönüştürülmesi en sağlıklı yöntemdir. H 2 S in hemen hemen tamamı, havayla kısmi oksidasyon neticesinde saf kükürt ve suyun ortaya çıktığı Claus Prosesi yle kükürde dönüştürülür [4] Claus prosesi Claus prosesinin ilk aşamasında, H 2 S bakımından zengin olan gaz ve hava (O 2 ) alev bekine yollanır. Daha sonra, birleştirilmiş besleme akımı ısısal reaksiyon odasına girer ve hızlı yanma reaksiyonlarının dengeye ulaşmasına yetecek kadar bekleme zamanı sağlanır. Bu bölüm karışımı sağlamak ve reaksiyona girmemiş gazı yakma kanalından gelen buhardan korumak için odacıklara ayrılabilir. Basitleştirilmiş Claus prosesine ait bir düzenek Şekil 2.3 de gösterilmektedir.
29 11 Proses gazı daha sonra yüksek basınçlı buhar üretilerek sıcaklığın 640 K e düştüğü atık ısı geri kazanım kazanına girer. Soğumuş gaz akımı, sıcaklığın 500 K in bile altına düştüğü kükürt kondansatörüne girer. Element halindeki kükürt buharı, sıvı faza yoğunlaşır ve bir toplama kabında toplanır. Şekil 2.3. Basitleştirilmiş Claus prosesi düzeneği. 1/3 H 2 S + O 2 1/3 SO 2 + 1/3 H 2 O (2.7) 2/3 H 2 S + 1/3 SO 2 S + 2/3 H 2 O (2.8) H 2 S + ½ O 2 S + H 2 O + Q (2.9) Birinci kondansatörden çıkan maddeler katalitik yatağa girmeden önce kükürdün bir dahaki aşamada yoğunlaşmasını engellemek için tekrar 640 K e ısıtılır. Bu aşamada Al 2 O 3 bazlı katalizör H 2 S ile SO 2 nin reaksiyona girerek elementel kükürt ve su oluşmasını teşvik eder. Kükürt oranını maksimuma çıkarmak için katalitik reaktör dizisine giren beslemede beslemenin H 2 S:SO 2 oranının 2 olması istenir. Birinci reaktörden ayrılan gazlar buhar oluşturulması ile 500 K e soğutuldukları ikinci bir kükürt kondansatörüne girerler. Elementel kükürt buharı yoğunlaşır ve toplama kabına akar. Ünitenin toplam kükürt geri kazanımını arttırmak için iki veya daha fazla ilave ısıtıcı/katalizör/kondansatör dizilimi kullanmak yaygın bir uygulamadır. Bu değer genellikle beslemedeki kükürdün % i kadarla sınırlıdır. Tüm kükürt kondansatörlerinde ve atık ısı kazanlarında buhar oluşumu ile ısı kazanımı proses boyunca uygulanır. Prosesin son aşamasında gazlar, atık içindeki
30 12 H 2 S konsantrasyonunu %1 in altında sınırlı tutmak için 873 K (bulunan gazların çeşidine bağlı olarak sıcaklık değişir) civarında çalışan yakma fırınına beslenir. Gaz akımları içerisindeki H 2 S, amonyak kullanılarak yıkanır ve toplanır. Genellikle amonyak içerisinden ayrılmış olan H 2 S Claus prosesine gönderilir ve geri kazanılan sulu amonyak daha fazla muamele görmeden yakılır. H 2 S in ayrılması tamamen gerçekleştirilmediğinde, geri kazanılan sulu amonyak çözeltisi yaklaşık %2 oranında H 2 S içerir ve H 2 S in yakılması boyunca SOx emisyonlarının oluşmasına sebep olur Katı Oksit Yakıt Pilleri Yakıt pilleri reaksiyonlardan gelen kimyasal enerjiyi elektrik enerjisine dönüştüren elektrokimyasal aletlerdir. Yakıt pil sisteminin temel bileşeni her bir yüzeyinde gözenekli elektrotlar olan bir elektrolit membrandır. Temel yakıt pili sisteminin basitleştirilmiş şematik görünümü ve yakıt pili çeşitleri Şekil 2.4. te görülmektedir. Elektrolit membrandan geçen iyon difüzyonunun tipi yakıt pillerini sınıflandırmada en önemli etkendir. Bir yakıt akışı (genellikle H 2 ) ve bir oksitleyici akış (hava) pile elektrokimyasal reaksiyonların oluştuğu anot ve katot elektrotlarından sürekli beslenir. Elektrolit membran iki elektrotu da yakıt ve hava geçirmez olacak şekilde ayırır, fakat iyonik parçacıkların pilin her iki tarafına geçişlerine izin verir [5]. Katı oksit yakıt pillerinde (KOYP) elektrolit membran yerine seramik bazlı oksit iyon iletkenleri kullanılır. Bu pillerde havadan gelen oksijen pil katodunda oksit anyonları oluşturarak indirgenir. Bu negatif yüklenmiş parçacıklar membran elektrolitten difüze olur ve pilin anot kısmında yakıt ile tepkimeye girer. Bu difüzyon işlemi sıcaklık yardımıyla gerçekleşir ve gerçekleşmesi için işlem sıcaklığının 900 K in üzerinde olması gerekir. Bunun yanında bu yüksek işlem sıcaklığı umulanın aksine düşük sıcaklıklara göre daha ucuz ve değersiz metal katalizörlerin pil elektrotu olarak kullanılmasına olanak tanır.
31 13 Şekil 2.4. Yakıt pilinin basitleştirilmiş şeması ve yakıt pili çeşitleri [5]. Claus Prosesinde düşük dereceli termal enerjinin geri kazanımı mümkün olmakla birlikte, bu maddeyi bir yakıt pili içinde elektrokimyasal olarak okside etmek çok daha tercih edilir bir seçenektir. Bu proses konseptinde, Claus Prosesindeki yakma fırınının yerini bir H 2 S//Hava KOYP (Katı Oksit Yakıt Pili) alır ve denge reaktörü dizisine dokunulmaz. H 2 S//Hava KOYP nin temel çalışma prensibi Şekil 2.5 te gösterilmektedir. Bu elektrokimyasal dönüşüm cihazları, eşzamanlı olarak elektrik, yüksek sıcaklıkta buhar ve konsantre kükürt ya da kükürt dioksit üretirler. Yapılan araştırmalar göstermiştir ki, özellikle yüksek derecelerdeki yakıt kullanımında temel oksidasyon ürünü kükürt dioksittir. KOYP nin yükseltilmiş çalışma sıcaklığında, H 2 S ısıl parçalanmaya maruz kalır ve elementel kükürt ve hidrojene ayrışır. Fakat bir H 2 S//Hava KOYP nin başlıca teknik zorluklarından biri, H 2 S açısından zengin ortamlara maruz kaldıklarında katalitik olarak aktif, iletken, kimyasal ve elektrokimyasal olarak stabil olan anot maddeleri tanımlamak ve geliştirmektir.
32 14 Şekil 2.5. H 2 S//Hava KOYP nin temel çalışma prensibi Sülfür Birikiminin Engellenmesi Sülfür çözücü olarak pek çok malzeme kullanılabilir. Ancak çalışma şartlarında buharlaşabilen bir malzemenin olması tercih edilmektedir. Benzen ve toluen gibi aromatikler, siklopentan ve siklohegzan gibi sikloparafinler ve bunların daha düşük alkil türevleri gibi kaynama noktası düşük siklik hidrokarbonlar uygun çözücülerdir. Diğer uygun çözücüler olarak karbon disülfid, amonyak, amonyağın sulu ya da alkolik çözeltileri sayılabilmektedir. Çözelti hücre çalışma sıcaklığının biraz altında buharlaşan bir çözelti olmalıdır. Mesela 85 0 C de çalışan bir hücre için 79 0 C de buharlaşan benzen uygun olduğu gibi, 50 0 C deki hücrede 46,3 0 C de buharlaşan karbon disülfit, oda sıcaklığındaki hücre için amonyum sülfitin kullanılması uygundur. Sonuç olarak, çözelti ile periyodik olarak veya sürekli yıkanan anot yüzeyi temiz ve aktif durumda tutulur. Hücreden elektrik üretilmesi ve diğer kıymetli maddelerin elde edilmesi daha sonra gerçekleşmektedir. Oluşan serbest sülfürün, anodun gözeneklerinde çok ince bir yapıda çökerek anot polarizasyonunun ve anot-elektrolit ara yüzey direncini artırması, bu birikmenin
33 15 önlenmesi ile mümkün olmaktadır. Benzen gibi bir çözücünün buharı elektrolitin içinde anodun gözeneklerinden geçirilir. Anot yüzeyine en azından benzenin buharlaşma sıcaklığını sağlayacak bir ısıtıcı yerleştirilir. Böylece anodun dışından buhar halde benzen akışı sağlanarak anotta sülfür birikmesi engellenir. Bir çözücü içinde çözülen H 2 S gazı çözelti buharlaştırılarak elektrokimyasal olarak yükseltgenir. Sülfür ise elektrolitte çözünmüş olarak veya çökelti halinde anotta oluşabilir. Çözelti tabi gazlardan yoğunlaştırılarak uzaklaştırılır ve tekrar sisteme ileri sülfür bileşiklerini uzaklaştırmak için beslenir. Diğer bir uygun çözücü amonyum çözeltisidir. Sülfür, amonyum çözeltisi içinde amonyum polisülfitler şekline dönüşmektedir. Amonyum polisülfitler konsantre sulu amonyum çözeltisi içinde yüksek çözünürlüğe sahiptir ve oluşan NH 4 HS in yüksek buhar basıncına sahip olması avantaj sağlamaktadır. Amonyum hem ucuz, hem uçucu hem de yüksek ph da hidrosülfit çözeltisi oluşturma kapasitesine sahip olduğu için tercih edilir bir çözücüdür. Daha da fazlası elektroliz esnasında parçalanmamaktadır. Çalışmalarda %50 lik amonyum çözeltisinin kullanılması tercih edilmektedir. Amonyum çözeltisi H 2 S ile doyurulmaktadır. Çalışma sonucunda hücrede oluşan amonyum polisülfit çözeltisi içindeki sülfür, amonyak çözeltisinin buharlaştırılması sonucunda distile edilerek ayrılmakta veya polisüliftler içeren çözelti asit ile reaksiyona sokularak çökelen sülfür geri kazanılmaktadır. Distilasyon C aralığında tutularak gerçekleştirilmektedir [6] Enerji Kaynağı Olarak Karadeniz Suyu Karadeniz'in flora ve faunası evsel ve endüstriyel kirlenme nedeniyle her geçen gün fakirleşmektedir. Karadeniz; Bulgaristan, Gürcistan, Romanya, Rusya, Türkiye ve Ukrayna gibi ülkelerden gelen akarsularla beslenmektedir. Büyük beş ırmak Karadeniz'e dökülür: Dinyeper, Dinyester, Don Irmağı, Kuban Irmağı, bütün doğu ve orta Avrupa yı kapsayan Tuna. Tuna tek başına her yıl 203 kilometre küp tatlı suyu Karadeniz e taşır. Bu miktar Kuzey Denizi ne akan bütün tatlı sulardan fazladır. Türkiye'den ise belli başlı dört ırmak Karadeniz'de sonlanır: Sakarya, Kızılırmak, Yeşilırmak ve Çoruh (sonuncusunun büyük bölümü Türkiye'de olmasına karşın
34 16 Gürcistan'da Batum'dan denize dökülür). Bu denize dökülen Avrupa ve Asya akarsularıyla birlikte Karadeniz havzasının alanı denizin kendisinden 5 kat daha geniştir ve yaklaşık 2.2 milyon km 2 'dir. Dolayısıyla geniş bir bölgenin tüm kirlenme etkileri Karadeniz e taşınmaktadır. Özellikle Tuna Nehri tüm Orta ve Doğu Avrupa ile Balkanlar'ın endüstri ve evsel atık sularının boşaltıldığı bir yüzeysel su olup, doğal yaşam için ölümcül miktarda organik ve inorganik maddeyi Karadeniz'e getirmekte kirlilik oradan Boğazlar yoluyla da Marmara Denizi'ne taşınmaktadır. Karadeniz, diğer denizlerden izole edilmiş ve sadece Marmara Denizi vasıtasıyla Ege Denizine açılmaktadır. Karadeniz de su sirkülasyonunun olmaması yaklaşık metre derinliğin altında oksijensiz bir tabakanın oluşmasına neden olmuştur. Yıllardan beri bölge insanları için geçim kaynağı, dinlenme alanı ve hatta atıkların boşaltıldığı bir bölge olan Karadeniz deki bu kirletici etkiler aşağıdaki gibi sıralanabilir: Yerleşim sonucu evsel atıklarla, Sanayiden kaynaklanan atık su deşarjlarıyla, Yağış sonucu yıkanma ve üzülmeyle, Tarımsal faaliyetler sonucuyla, Liman faaliyetleri ve deniz trafiğiyle, Denize ulaşan nehir ve akarsular vasıflarıyla, ulaşırlar 2.7. Karadeniz Suyunun H 2 S ve Enerji İçeriğinin İncelenmesi Karadeniz in % 90 anaerobik ortama sahiptir ve aneorobik sülfür indirgen bakteriler (SİB) tarafından bol miktarda H 2 S üretilmesi sonucunda yüksek hidrojen sülfür içeriğine sahiptir. Aerobik ve anaerobik ara yüzey Karadeniz de 140 m derinliği ve 250 m kıyı boyunca uzanan bölgedir. H 2 S içeriği 1000 m de 8 ml/l deniz suyundan, 2000 m de 8.5 ml/l deniz suyuna çıkmaktadır. Tabanda ise H 2 S içeriği 13.5 ml/l deniz suyu değerine kadar ulaşmaktadır. Şekil 2.6. H 2 S dağılımını göstermektedir. Bu dağılım Çizelge 2.1. de rakamsal olarak verilmektedir.
35 17 Şekil 2.6. Karadeniz de H 2 S dağılımı Çizelge 2.1. Karadeniz de Hidrojen Sülfür Potansiyeli Derinlik (m) H 2 S (µmol/l) H 2 S (mol/m 2 ) a 2, , , , , , b 40,7 Toplam 519,2 a m. b m. Hidrojenin önemli rezervlerinden biri de hidrojen sülfür (H 2 S) içermesi nedeniyle Karadeniz in dip sularıdır. Buradan hidrojen üretilmesi amacıyla şuan kapsamlı bir çalışma yoktur. Ancak bu sulardaki hidrojen sülfür varlığı ve potansiyeli konusunda çeşitli inceleme ve araştırmalar yapılmıştır. Karadeniz in kirletilmesi sonucu
36 18 yaklaşık km 2 lik bir alan hidrojen sülfür ihtiva etmektedir. Bu alan oksijensiz olup canlı yaşamı da söz konusu değildir. Karadeniz dip sularının durgun olmasından dolayı, burada bulunan hidrojen sülfür kendiliğinden deniz yüzeyine çıkmamaktadır. Karadeniz in orta bölgelerinde su yüzeyinden yaklaşık 100 m derinliğe inildiğinde Hidrojen Sülfür tabakasına rastlanacaktır. Kıyı kesimlerde H 2 S e ulaşım derinliği minimum 170 m dir. Karadeniz ortalarına kurulacak olan platformlar sayesinde H 2 S in yüzeye çıkarılma maliyeti azaltılmış olacaktır. Zonguldak, Samsun, Sinop, Giresun açıklarında H 2 S e ulaşmak daha kolaydır. Karadeniz dip sularında bulunan hidrojen sülfür 150 metre derinlikten itibaren başlar ve dibe doğru lineer olarak artar metre derinlikte 8 ml/l deniz suyu, 2000 metrede 8.5 ml/l deniz suyu ve tabana yakın kısımlarda 13.5 ml/l deniz suyu oranlarıyla Karadeniz in toplam 4857 milyar ton hidrojen sülfür ihtiva ettiği tahmin edilmektedir. Hidrojen sülfür potansiyeline bağlı olarak toplam hidrojen potansiyelinin en yüksek olduğu tabaka metre derinlikler arasıdır. Hidrojen sülfürden hidrojenin ayrıştırılması da elektroliz yöntemiyle gerçekleştirilir. Fakat hidrojen sülfürün elektrolizinde kullanılan enerji suya göre kat daha azdır. Yani suyun elektrolizi yöntemiyle hidrojen elde etmek için kullanılan enerji kwh iken, hidrojen sülfürün elektrolizi ile hidrojen elde etmek için gerekli enerji kwh tir. Karadeniz de oksijenli ve oksijensiz fotosentez yaparak biyolojik aktivite gösteren çoklu katmanlar mevcuttur. Bu organizmaların dağılımı ve varlığı O 2 /H 2 S redoks dönüşümü hatlarına bağlılık göstermektedir. Şekil 2.7 de, Karadeniz de (5) numaralı noktada yapılan hidrografik ve kimyasal karakteri görülmektedir. Deniz suyunun oksijen içeriği yüzeyde 5-6 m3/l deniz suyu iken, m ye inildiğinde bu değer 8.64 m3/l deniz suyuna yükselmektedir m de ise bu değer sıfıra düşmektedir. 150 m den sonra suda hidrojen sülfür içeriği tespit edilmektedir. Dip sularda bu içerik artmaktadır.
37 19 Şekil 2.7.b deki grafikten sülfit bölgesinde ise oksijen konsantrasyonunun ve oksijen gradyentinin azaldığı görülmektedir. İlk sülfit 94 m de bulunmaktadır. Organik maddelerin nitrifikasyonu sonucunda oluşan nitrat ise 60 m civarındaki mesafedeyken, iki nitrit piki 40 ve 77 m de bulunmuştur. Amonyum ilk olarak 75 m de bulunmaktadır. NH 4 ve H 2 S tabanda 100 ve 400 μm a ulaşmaktadır. Metan ise dipte 12 μm dır. Floresans 30 m de maksimum 60 m de minimum hesaplanmıştır [7]. Karadeniz üzerindeki 4 farklı istasyondan alınan deniz suyu numenlerinin oksijen içeriği, tuzluluk, H 2 S içeriği ve sıcaklık profilleri Şekil 2.8 de verilmiştir. Sıcaklık başlangıçta azaldığı halde sonradan sülfür miktarında dik düşüşle birlikte H 2 S oluşumu başlamakta ve sıcaklıkta da bir miktar yükselme gözlenmektedir. Ki bu durum gereksiz oksidasyon reaksiyonlarının gerçekleştiğini göstermektedir [8].
38 20 (a) (b) Şekil Karadeniz de çalışmanın yapıldığı bölge (5) ve derinlikle sudaki H 2 S, O 2, CH 4, NH 4 +, NO 2 - değişimlerini gösteren grafikler
39 21 Şekil 2.8. Karadeniz de 4 farklı noktadan alınan numunelerin oksijen içeriği, tuzluluk, H 2 S içeriği ve sıcaklık profilleri [8].
40 22 Karadeniz kıyılarında m derinlikteki H 2 S tabakasından uygun teknolojiler ve rüzgar ve/veya hidrolik enerji gibi yenilenebilir enerji kaynakları kullanılarak yaklaşık olarak 1.3 milyon ton hidrojen gazı üretmek mümkündür. Üretilen hidrojen miktarı deniz suyu derinliğine karşı Neretin ve Dimitrov tarafından hesaplanmıştır [9]. H 2 S in %100 dönüşümü kabul edilerek elde edilebilecek hidrojen miktarları, iki araştırmacının sonuçlarına göre karşılaştırmalı olarak verilmektedir. Ancak maksimum hidrojen potansiyeli m deki tabakada 1469 milyon ton H 2 S den milyon ton hidrojen potansiyelidir. Toplam hidrojen potansiyeli tüm Karadeniz su tabakası ele alındığında 270 milyon ton olarak hesaplanmıştır. Karadeniz in dip sularındaki H 2 S in parçalanması ve ekstrakt edilmesinde yenilenebilir kaynaklar kullanılırsa hidrojen üretim maliyeti düşürülebilecektir. Sonuç olarak Karadeniz pek çok Avrupa ülkesinde olduğu gibi bölge ülkelerinin enerji ihtiyacını karşılayabilecek büyük bir enerji potansiyeline sahiptir [10]. Anaerobik Alan Bakteriyel Bozunma KARADENİZ ANODİK HAVZA Anaerobik Bakteriyel Topluluk Karadeniz dibinde H 2 S oluşumu Zararlı Etkiler Karadeniz dibinde Sağlık Yenilenebilir H 2 S birikimi problemleri enerji kaynakları Çevre Sülfür H 2 S ayrılması kirliliği Hava Hidrojen kirliliği Yerel ve endüstriyel Isı ve elektrik Yakıt pili destekli uygulamalar üretimi enerji teknolojileri Şekil 2.9. Hidrojen sülfürün etkileri ve hidrojenle olan ilişkisi Su kirliliği Ekolojik problemler
41 23 Şekil (a) Hidrojen potansiyelinin Karadeniz suyunun derinliğine bağlı olarak değişmesi, (b) Hidrojen potansiyelinin Karadeniz deki H 2 S potansiyeline bağlı olarak değişmesi Deniz Suyunun Elektrolizi Deniz suyundan hidrojen üretmek için elektroliz yöntemi 3 yöntemle gerçekleştirilebilir: 1. Elektroliz; H 2, O 2 ve alkalilerin eldesi 2. Elektroliz; H 2, O 2, Cl 2 ve alkalilerin eldesi 3. Elektroliz; H 2 ve sodyum hipoklorit (NaClO) eldesi Yeryüzünün %75 i sudan oluşmuştur. Ancak bunun çoğu tuzlu sudur ve hidrojen üretimi için önce tuz giderimi yapılmalıdır. İnsanlığın ulaşabileceği su kaynakları Şekil.2.11 de gösterilmiştir. Böylece tuzlu suyun taze suyu yerine elektroliz kaynağı olarak kullanılması ciddi bir avantaj sağlayacağı düşünülmektedir [11].
42 24 Şekil Global su kaynakları Sistemde elde edilmesi beklenen temel ürün hidrojendir. Bununla beraber, kostik soda ve klor ana ürün iken, hidrojen de yan üründür. Taze su elektroliz hücresi H 2 /O 2 hücresi olarak bilinir. Doymuş tuzlu su elektroliz hücresi ise H 2 /Cl 2 hücresi olarak bilinir ve kostik soda üretir. Hidrojen/oksijen 2:1 oranında ana hücrede üretilirken, hidrojen/klor 1:1 oranında ikinci hücrede üretilmektedir. (Şekil.2.12)
43 25 Şekil Mevcut elektroliz teknolojileri Şekil Mevcut elektroliz teknolojileri ve tuzluluğun karşılaştırılması Alkali suyun elektrolizi; yüksek miktarda hidrojen üretmek için pratikte mevcut olarak kullanılan bir teknolojidir. Ancak düşük verim ve düşük akım yoğunluğu ve gibi problemler mevcuttur. Hücre verimi ve akım yoğunluğunu artırmak için çalışmalar devam etmektedir.
44 26 Alkali su elektrolizi için düşük tuz içerikli taze su kullanılır ve ön işlem ve tuz giderme sistemleri hidrojen üretim maliyetini artırır. Şekil 2.13 de farklı elektrolitlerle, alkali su elektrolizi ve okyanus suyu, gerçekleştirilen elektrolizler için mevcut teknolojiler gösterilmiştir. Hidrojen üretimi için tuzlu su kullanmak ve H 2 /O 2 hücresinde elektrolizi avantaj sağlamaktadır. Ancak normal şartlar altında deniz suyunun elektrolizinde kütle transfer sınırlamaları ve reaksiyon kinetikleri sonucunda H 2 /Cl 2 üretimi gerçekleşmektedir Hidrojen üretimi Hidrojen üretilmesi elektrokimyasal sistemler ile mümkün olmaktadır. Termodinamik olarak H 2 S in elektroliz edilerek hidrojen üretilmesi, suyun elektrolizinden daha az enerji ile gerçekleşmektedir. Deniz suyunun elektroliz potansiyeli (yaklaşık 0.13 V) suyun elektroliz potansiyelinden (1.23 V) daha düşük değerlerde olması basit bir elektroliz sistemi ile düşük maliyetle hidrojen eldesine imkân vermektedir. Termodinamik olarak suyun ve H 2 S ün elektroliz potansiyelleri aşağıdaki gibi verilebilir: H 2 O H 2 + ½ O 2 E 0 =1.23 V (2.10) H 2 S H 2 + ½ S 2 E 0 =0.17 V (2.11) Normal şartlar altında (N.Ş.A.) suyun elektrolizi için gerekli enerji miktarı 237,1 kj/mol iken H 2 S in N.Ş.A da elektrolizi için gerekli enerji miktarı 73,28 kj/mol dür. Görüldüğü gibi hidrojen sülfürden hidrojen eldesi suya göre 3,235 kat daha kârlıdır. Bununla birlikte bir mol hidrojen üretimi için, yenilenebilir enerji kaynaklarını kullanarak elde edilen elektrik enerjisinde 0,066 KWh lık kısmının kullanılması gerekmektedir. H 2 S den 1 mol enerji üretimi için harcanacak enerji 0,0203 KWh olmaktadır. H 2 S ve H 2 O nun elektrolizi sırasındaki enerji farklılıkları Şekil 2.14 ve Şekil 2.15 de daha açık bir biçimde görülmektedir.
45 27 Şekil Suyun N.Ş.A. da elektrolizi Şekil Hidrojen sülfürün N.Ş.A. da elektrolizi
46 Klor gazı üretimi Klorür içeren tuzlu suyun elektrolizinde temel anot ürünü klordur. Aşağıdaki reaksiyonların sonucunda klor gazı oluşur: (2.12) (2.13) (2.14) Tuzlu suyun elektrolizi esnasında klor oluşumunda, gaz fazdaki klor gazı, sıvı fazdaki klor gazı ve toplam klor arasında fark olmaktadır. Deniz suyu ile yapılan elektroliz çalışmalarında sistemde oksijen yerine ana ürün olarak klor gazının oluşmasına katkıda bulunan iki ama faktör aşağıdaki gibidir: 1. Deniz suyu gibi tamponlanmamış çözeltiler; hidrojen üreterek hem oksijen hem de klor oluşumu sağlarlar: (2.15) Anotta üretilen klor gazı derhal hidrolize uğrayarak H + üretir: (2.16) (2.17) (2.18) Anot daha asidik olduğu için, oksijen oluşumunun termodinamik voltajı daha anodik olur. Baskın olan klor oluşumu ise ph dan bağımsızdır. Güç ilk anoda uygulandığı için, oksijen oluşumu için teorik voltaj aşağıdaki eşitliğe göre daha anodik olacaktır: (2.19)
47 29 2. Oksijen oluşumunu engelleyen ikinci faktör ise; pratik akım yoğunluğunda yüksek aşırı potansiyel olarak bilinen etkidir. Elektroliz için anot ph sı 1-2 değerlerinde olmalıdır. Dahası etkin anot ph sı çok düşük olursa, oksijen oluşumu termodinamik olarak klor oluşumuna tercih edilir. Çünkü oksijen oluşumunun eşdeğer potansiyeli klorun eşdeğer potansiyelinden yaklaşık olarak 200 mv daha düşüktür [12] Elektrik enerjisi üretimi Karadeniz de bulunan toplam 1469 milyon ton H 2 S potansiyelinden elde edilen 270 milyon ton toplam hidrojen potansiyeli kullanılarak 38.3 milyon TJ lik termal enerji veya 8.87 milyon GWh elektrik enerjisi elde edilmesi mümkündür. Bu hidrojen miktarı 808 milyon ton benzin, 766 milyon ton doğal gaz, 841 milyon ton fueloil, 851 milyon ton doğal petrole eşittir. Sonuç olarak bu değerler, Türkiye, Bulgaristan, Ukrayna, Rusya, Gürcistan ve Romanya gibi bölge ülkelerini Karadeniz in dip sularından hidrojen enerjisi üretmek için cesaretlendirmekte ve yatırıma yönlendirmektedir. Bu şekilde bölge ülkelerinin enerji ihtiyacının kısmi olarak giderilmesi ve hidrojenin Avrupa ülkelerine taşınması mümkündür. Bu çalışmada Karadeniz suyunda bulunan H 2 S ün yakıt hücrelerinde doğrudan elektrik üretiminde kullanılması önerilmektedir Deniz Suyu İçinde Bazı Metallerin Elektrokimyasal Davranışları Deniz ortamında kullanılan metallerin yüksek korozyon direncine sahip olması istenmektedir. Bakteri, deniz suyu ve malzeme arasındaki etkileşimler yüzeyde meydana gelen pasif tabakanın ve biofilm tabakasının özelliklerini etkilemektedir. Bakteri ortamında yüzeylerinde bakteriler tarafından biofilmler ve denizin iyonik ortamından dolayı pasif, yarı-pasif tabakalar oluşmaktadır. Bu pasif film tabakasının özellikleri n- veya p-tipi olmalarına göre değişmektedir. N-tipi film katodik reaksiyon akımını artırır. P-tipi pasif film ise elektron sağlayarak katodik reaksiyonları artırmaktadır [13].
48 30 Paslanmaz çelik, nikel temelli alaşımlar, titanyum, pirinç (Cu+Zn alaşımı) ve platin deniz suyu ile yapılan çalışmalarda yaygın olarak kullanılan başlıca malzemelerdir [14]. Paslanmaz çelik korozyon direnci yüksek bir malzemedir. Pasifleşebilen Nitemelli alaşımlar korozyona karşı direnç göstermektedirler. Cu ve Zn dan oluşan (pirinç) iyi bir ısıl ve elektriksel geçirgenlik gösterir ve istenen korozyon direncine sahiptir. Ni ve Krom un bir diğer özellikleri paslanmaz çelik ve Ni-temelli alaşımların hazırlanmasında temel ilave elementleri olmalarıdır. Biofilm kaplanmış katodik malzemeler, deniz suyu kullanılan Mikrobial yakıt pillerinde anodik malzemeler olarak kullanılmaktadırlar. Mesela, paslanmaz çelik yüzeyinde katodik oksijen indirgenmesi ile oluşan biofilm, hidrojen yükseltgenmesinde anodik davranış göstermektedir. Bu proje çalışmasında H 2 S içeren deniz suyunun elektro-oksidasyonu ile elektrik enerjisi üretilmesi amaçlanmaktadır. Mevcut araştırmalar bu çözelti ortamında hidrojen üretimi üzerine yoğunlaşmıştır. Bu çalışmada hidroliz yerine doğrudan oksidasyonun araştırılması orijinal ve farklı bir yaklaşım olması açısından dikkat çekicidir. Bu alanda yapılan bir çalışmanın ilk çalışmalardan olduğu literatürün incelemesi sonucunda görülebilecektir. Bu çalışmada temel bazı metallerin elektro-oksidasyon mekanizması incelenecektir. Seçilen katalizörler deniz suyu içinde korozyon direnci yüksek olan veya H 2 S e karşı yükseltgen davranış gösteren metallerdir. Bu metaller Ni, Cu, Ag, Paslanmaz Çelik (304), Ag ve V 2 O 5 dır. Çalışmalarda dönüşümlü voltametri tekniği kullanılarak elektrokimyasal davranışlar incelenmiştir. Uygun görülen metal katalizör anot malzemesi olarak kullanılarak hazırlanan yakıt hücresinin performans testleri gerçekleştirilecektir H 2 S Yakıt Hücreleri Bir yakıt hücresinde H 2 S yakıt olarak kullanılarak elektrik enerjisi üretilebilmektedir. Bu hücreler o C gibi yüksek sıcaklıklarda çalışan yakıt hücresi tipleridir. Bu
49 31 hücrelerde H 2 S ün yükseltgenmesi Platin katalizörler kullanılarak gerçekleşmektedir. 22 o C de H 2 S(g)/O 2 yakıt hücrelerinde maksimum 300 mv hücre potansiyeline ulaşılırken, o C civarındaki sıcaklıklarda 850 mv hücre voltajına kadar çıkılabilmektedir [15]. Düşük çalışma sıcaklıklarında potansiyeli yükseltmenin diğer bir yolu O 2 yerine oksidan olarak asidik H 2 O 2 çözeltisi kullanılmasıdır [16]. %35 lik H 2 O 2 çözeltisi hem güvenli, hem kararlıdır, zehirli değildir ve suya yükseltgenir. H 2 S (bazik,sıvı) / H 2 O 2(asidik,sıvı) yakıt hücresi düşük sıcaklıklarda H 2 S (g) / O 2 yakıt hücresinden daha yüksek güç çıktısı sağlayacaktır. Böyle bir yakıt hücresi konfigürasyonu aşağıdaki gibi önerilmektedir: H 2 S + NaOH anot Nafion membran katot H 2 O 2 +H 2 SO 4 Anot, katot ve toplam hücre reaksiyonları ise aşağıda verildiği gibidir: Anot: H 2 S S 2H 2e (2.20) Katot: - H2O2 2H 2e 2H 2O (2.21) Toplam: H S H O S 2H O (2.22) H 2 S yakıt hücreleri için yapılan elektrokimyasal çalışmalarda düşük sıcaklıklarda Ni elektrodun katalitik davranış gösterdiği anlaşılmaktadır [17].
50 32 3. DENEYSEL ÇALIŞMA Sunulan tez kapsamında, yakıt hücrelerinde kullanılmak üzere, metal elektrotlar hazırlanmış ve karakterizasyonları gerçekleştirilmiştir. Bu amaçla nikel, bakır, gümüş, paslanmaz çelik (304), çinko, vanadyum metallerinin deniz suyu içinde ve deniz suyu + Na 2 S ilave edilen çözelti içinde elektrokimyasal davranışları incelenmiştir Kullanılan Kimyasallar Potasyum hidroksit ( KOH) (Merck) Sodyum hidroksit (NaOH) (Merck) %99.9 luk İzopropanol(CH 3 ) 2 CHOH) (Merck) Sodyum Sülfür (Na 2 S) (Merck) Hidrojen peroksit (2 M H 2 O 2 ) (Merck) Nafion çözeltisi (Merck) 15 mg cm-2 Pt/C (% 10) (Alfa aiser) 15 mg cm-2 Ni toz (% 10) (Alfa aiser) Deiyonize su (18 Ω) Yapay Deniz suyu Ortamın ph ını ayarlamak için derişik potasyum hidroksit çözeltisi kullanılmıştır. Dönüşümlü voltametri analizleri ölçümleri, deniz suyu üzerine 0, M Na 2 S eklenmek suretiyle yapılmıştır. Çözeltilerin hazırlanmasında ve cam malzemelerin yıkanmasında deiyonize su kullanılmıştır Yapay deniz suyunun hazırlanması Çalışmalarda yapay deniz suyu kullanılmıştır. Bu su çizelge 3.1 deki tuzları içermektedir. (NaCl, MgCl 2, Na 2 SO 4, CaCl 2, KCl, SrCl 2, NaHCO 3, KBr, NaF). Çözeltinin ph sı 0,1 N NaOH çözeltisi ile ayarlanmıştır. Mineral tuzların içerikleri çizelge 3.1 de verilmiştir [18].
51 33 Çizelge 3.1. % 35 lik 1 kg yapay deniz suyundaki tuz miktarları GRAVİMETRİK TUZLAR Tuz Moleküler ağırlık g mol -1 g kg -1 çözelti Sodyum klorür (NaCl) 58,44 23,926 Sodyum sülfat (Na 2 SO 4 ) 142,04 4,008 Potasyum klorür (KCl) 74,56 0,667 Sodyum bikarbonat (NaHCO 3 ) 84,00 0,196 Potasyum bromür (KBr) 119,01 0,098 Borik asit (H 3 BO 3 ) 61,83 0,026 Sodyum florür (NaF) 41,99 0,003 VOLUMETRİK TUZLAR Tuz Moleküler ağırlık g mol -1 mol kg -1 çözelti Magnezyum klorür (MgCl 2.6H 2 O) 203,33 0,05327 Kalsiyum klorür (CaCl 2.2H 2 O) 147,03 0,01033 Stronsiyum klorür (SrCl 2.6H 2 O) 266,64 0, Analizde Kullanılan Yöntemler ve Cihazlar Sülfürlü ortamda çalışmanın en önemli zorluğu elektrot yüzeyinde sülfürün çökerek elektrotun zehirlenmesine neden olmasıdır. Bu sebeple elektrot yüzeyinde birikme olup olmadığı empedans analizleri yapılarak (EIS) incelenmiştir. Hazırlanan katalizörlerin;
52 34 i. Deniz suyu içinde ii. HS - konsantrasyonu artırılmış deniz suyu ortamında iii. Farklı sıcaklıklarda iv. Farklı ph larda v. Farklı tarama hızlarında Elektrokimyasal davranışları incelenmiş ve sonuçlar sunulmuştur Dönüşümlü voltametri tekniği (CV) Dönüşümlü voltametri potansiyodinamik elektrokimyasal bir ölçüm tekniğidir. Bu amaçla potansiyostatlar kullanılır. Bu çalışmada Gamry Referans 3000 marka potansiyostat kullanılmıştır. (Resim 3.1.) İndirgenme ve yükseltgenmenin olduğu reaksiyon ortamları için dönüşümlü voltametri tekniği ile analiz yapmak ve voltagram oluşturmak mümkündür. Denemenin temeli elektroaktif formların çözelti içinde bulunmasına dayanmaktadır. Resim 3.1.Referans 3000 Potentiostat/Galvanostat/ZRA marka cihaz
53 35 Çalışmamızda klasik üç elektrotlu sistem kullanılmıştır. (Resim 3.2.) Çalışma elektrodu, Ni, Cu, Ag, Paslanmaz Çelik (304), Zn ve Vanadyum metalleridir. Referans elektrot sistemde potansiyeli pek değişmeyen elektrottur. Bu çalışmada referans hidrojen elektrotuna nazaran potansiyelini nispeten koruduğu ve kimyasal direnci iyi olduğu için doymuş kalomel elektrot seçilmiştir. Karşıt elektrot ise bir nevi kaynak görevi üstlenmektedir. Elektronları alır ve böylece akım dış devreden hücreye doğru akar. Döngüsel voltamogram eğrilerinde karşıt elektrot olarak platin tel kullanılmıştır. Hazırlamış olduğumuz katalizörler, bir camsı karbon üzerine yerleştirilerek elektrot haline getirilmiştir. Çünkü karbon kağıt destekle, camsı karbon aynı iletkenlik değerine sahiptir. Karbon destekli katalizörümüzün camsı karbon yüzeyine sıkıca yapışabilmesi için çalışma elektrotumuz, teflon malzeme ile özel olarak dizayn edilmiştir. Resim 3.2.Üçlü elektrot sistemi Analiz esnasında çalışma elektrotu, referans elektrot ve karşıt elektrot bir potansiyometreye bağlanmıştır. Potansiyometre aracılığıyla elektrokimyasal hücrede dönüşümlü voltamogramlar elde edilmiştir. Döngü yaklaşık olarak referans elektrota göre -1.2 V ile 2.5 V değerleri arasında yapılmıştır. Yapılan analiz sonucunda zamana karşı potansiyel ölçümü referans ile çalışma elektrotu arasında yapılırken,
54 36 akım ise çalışma elektrotu ile karşıt elektrot arasında ölçülmektedir. Elde edilen voltamogramlarda akım i, potansiyel ise E harfi ile ifade edilmektedir. Hazırlanan farklı metal elektrotlara ait dönüşümlü voltamogramlar 50 mvs -1 tarama hızında, deniz suyu ve deniz suyu + sodyum sülfür içerisinde oda sıcaklığında, ayrıca farklı sıcaklık ve ph değerlerinde gerçekleştirilmiştir. Analizlerde, hazırlanan farklı metal elektrotlar çalışma elektrotu olarak kullanılmış ve anot katalizörü olarak test edilmiştir Elektrokimyasal empedans spektroskopisi yöntemi Alternatif akım elektrokimyasal empedans spektroskopisi (EIS), özellikle kaplama yapılmış elektrokimyasal korozyon sistemlerinin kinetiğini aydınlatmada kullanılan bir araçtır. Korozyon kinetiği, korozyon mekanizması ve önemli fiziksel parametrelerin belirlenmesinde birçok yöntem uygulanmaktadır. EIS metal ile elektrolit ara fazının karakterizasyonunda kullanılır. EIS elektrokimyasal sistem içerisinde gerçekleşen kaplamanın aydınlatılmasında yardımcı olur. Potansiyostat, elektrolit içerisindeki örneğe hem doğru akım potansiyeli hem de buna ek olarak alternatif akım potansiyeli uygular [19]. Elektrokimyasal empedans spektroskopisinden, kaplamanın değerlendirilmesinde, elektrokimyasal sistem içerisindeki yük taşınım unsurlarının aydınlatılmasında, korozyon mekanizması ve korozyon hızının belirlenmesinde faydalanılır. Elektrokimyasal empedans spektroskopi (EIS) yöntemi ile korozyon, yarı iletkenler, piller, elektrolizli kaplama ve elektroorganik sentezlerle çalışılabilir. EIS ölçümleri, elektrot kapasitansı ve yük transfer kinetiği hakkında bilgi verir. Elektrokimyasal reaksiyon elektrot arayüzeyinde geçer. Empedans ölçümlerinde, elektrokimyasal reaksiyon resistör (rezistans) ve kapasitörün spesifik bileşimini içeren bir elektronik devreye benzetilir. Bir ya da daha fazla eşdeğer devreyle elektrokimyasal sistem arasında ilişki kurarak empedans eğrileri elde edilir.
55 37 Seri resistans R 0 (ohmik direnç) elektrolit direncini temsil eder. Yüzeydeki filmler ve teller hücreyle birleştirilir. Bu şekilde sistem ölçülür. Paralel direnç R t ile gösterilir. Yük transfer direncidir ve korozyon reaksiyon derecesini belirler. C dl çift tabaka kapasitansı, elektrot elektrolit ara yüzeyinde bulunur. Elektrot yüzeyi, elektrolit içindeki zıt yükteki maddelere eşit değerde yüklenir. Denge kurulur. Ara yüzeyin dayanıklı bölgelerinde yükler sırayla dağılır. İyon transfer derecesi tespit edilir. Yüksek frekanslarda, kapasitans (C dl ) kolayca ayrılanları sadece seri dirence (R 0 ) yöneltir. Frekans azaldıkça kapasitans iletimi azalır ve R t nin yanıtı artar. Frekans sıfıra yaklaştığında kapasitör iletimi durur ve hücrenin empedansı R t ve R 0 dan ölçülür. Eklenen element Warburg empedansdan bulunur. Bu empedans frekansın kareköküyle orantılıdır ( 1/ (ω) 1/2 ). Bu oran yüksek ve düşük frekanslarda geçerlidir. Difüzyon ise sadece düşük Frekanslar da bu orantıya uyar. Difüzyon tabaka etkisi düşük frekanslarda eksenin gerçek bölümün de empedansın bükülmesine sebep olur. Çift yarım daire verir. Elektrokimyasal hücre elektronik modeli temsil eder. Elektronik devre eşdeğer devre olarak da bilinir. Doğru akım teoride direnç ohm kuralıyla tanımlanır. Doğru akım teorisinde; E= I x R (3.1) Doğru akım potansiyeli (E) devreye uygulanabilir. Son akım ölçülür ve direnç hesaplanır. Potansiyelin birimi volt (V), akımın birimi amper (A), ve direncin birimi ohm (Ω) dur. Alternatif akım teorisinde; E= I x Z (3.2) Potansiyel E, akım I ve empedans Z ile gösterilir. Akım ve potansiyel dalgalı biçimde olan genliktir. Sinüs akım dalgası şu şekilde tanımlanır; I= A x sin(ωt +Φ)
56 38 I= ani akım ω= frekans= 2πƒ A= maksimum genlik Φ= değişen faz Vektör analizi, genlik ve fazın dalgalı formunu tanımlamaya yardımcı olduğu için kullanışlı bir metotdur. Akım dalgalı form vektörü üç farklı yolla gösterilir. Birinci gösterimde vektörün bittiği noktada x ve y koordinatlarının değeri verilir. İkinci yaklaşımda vektör kesinlikle bir açı (θ) ve I büyüklüğüyle belirtilir. Üçüncü yaklaşımda açılar gerçek I' ve hayali I'' ile belirtilir. I'' koordinat değeri j ile çarpılır. j= (-1) 1/2 (3.3) I toplam = I' ve I''j Benzer şekilde ac gerilim vektörü şu şekilde gösterilir; E toplam = E' ve E''j Ac empedansın gösterimi ise; Z toplam = Z' + Z''j Elektrokimyasal sistem eşdeğer elektriksel devrenin terimleriyle gösterilebilir. Bu sistemde R 0 kararsız (dengesiz) direnç, çalışma elektrodu ve referans elektrot arasındaki dirençtir. R p polarizasyon direnci elektrot/ çözelti ara yüzeyindedir. R p elektrokimyasal reaksiyonun derecesinden hesaplanır. Kapasitans ölçümleri adsorpsiyon ve desorpsiyon reaksiyonları hakkında bilgi verir (elektrot yüzeyinde film oluşumu ve organik kaplamanın tamamlılığı). Difüzyon-kontrol elektrokimyasal reaksiyonları polarizasyon direncinden çok yük transfer direncine bağlıdır. Ac empedans ölçümlerinin amacı elektrokimyasal sistemi doğrulamak, elektrokimyasal sisteme uygun eşdeğer devre modelini kurmaktır. Bu sistem için karakteristik frekans 0, Hz aralığındadır. Ac empedans ölçümlerinin deneysel verileri çeşitli frekanslardadır. E' ve E'' gerçek ve hayali gerilimin komponentleri ve I' ve I'' gerçek ve hayali akımın komponentleri olarak gösterilir.
57 39 Gerçek empedans Z' ve hayali empedans Z'' olarak gösterilir. Verilerden uygulanan her frekans için değişen faz ve toplam empedans hesaplanabilir. Sadece elde edilen eğrinin biçimine bakarak kimyasal sistemin doğru davranışı bulunabilir. Nyquist grafiğinde Z'' ne karşı Z' çizilir. Bu grafik bir devreye uygun gelmektedir. Bu grafikten; ω θmax = 1/CR P [(1+R P )/R 0 ] 1/2 (3.4) ω θmax = 2πƒ θmax (3.5) kullanılarak R 0, R p ve C d l hesaplanabilir. Şekil 3.1. Nyquist grafiği Bode grafiği avantajı Nyquist grafiğinden daha fazladır. Bode grafiğinde ölçümler uzun zaman almaz, düşük frekanslarda R p belirlenebilir. Nyquist grafiği Şekil 3.1. yüksek frekanslarda verilerin ekstrapolasyonunda daha etkilidir. Veriler dağınık olduğu zaman Bode grafiği, tam yarım daire şeklindeyse Nyquist grafiği tercih edilir. Frekans elektrokimyasal sistemin davranışına bağlıdır. Elektrokimyasal sistem Bode grafiğiyle Nyquist gafiğine nazaran daha iyi
58 40 belirlenebilir. Bazı elektrokimyasal reaksiyonlar, bir derece belirleme basamağından daha fazla olabilir. Her bir basamak sistem-empedans bileşenini temsil eder ve tam sabit dereceyi verir. Ac empedans verileri tek basamağı ayırabilir ve tek reaksiyon derecesi ya da bekleme zamanı hakkında bilgi verir. Bode grafiğinin Nyquist grafiğinden üstün avantajları vardır. Grafikte frekansın logaritması kullanılır. Grafik çok geniş frekans aralığında verilir. Bode grafiğinde frekans logaritmik olarak aksisde verilir. Böylelikle geniş empedans alanı bu aksise yerleştirilir. Bu durum Bode grafiğinin bir avantajıdır. Empedans kuvvetle frekansa bağlıdır. log Z ve log ω eğrileri R p ve R 0 değerleridir. Yüksek frekanslarda, omik direnç empedansdan üstündür ve log (R 0 ) yüksek frekanstaki horizontal eğriden okunur. Düşük frekanslarda, polarizasyon direnci log (R 0 + R p ) yi verir. Bu değer düşük frekanstaki horizontal yaydan okunabilir. Orta frekanslarda, grafik düz çizgi şeklindedir ve eğimi -1 dir. Bu çizginin log Z ekstrapolasyonunda aksis ω= 1 (log ω= 0, ƒ= 0,16 Hz ) C dl ile ilişkisi şu şekildedir; Z = 1/C dl ω ω=2πƒ (3.6) Çift tabaka kapasitansı C dl su eşitlikle hesaplanır; ωθmax= [( 1/C dl R p )(1+R p /R 0 )] 1/2 (3.7)
59 41 Şekil 3.2. Bode grafiği Bode grafiği (Şekil 3.2.) Nyquist grafiğine göre daha kullanışlı bir metottur. Ölçüm zamanı kısadır. Veriler dağınık olduğu zaman Bode grafiği daha uygundur. Bazı elektrokimyasal reaksiyonlar bir derece basamağından daha fazladır. Her bir basamak sistem empedans komponentlerini temsil eder ve tam reaksiyon derece sabitini verir. Elektrokimyasal empedans deneyleri bu basamakları ayırt eder ve takip eden basamak dereceleri ya da bekleme zamanları hakkında bilgi verir. Bode grafiğinin dezavantajı ise eğer devrenin değeri değişirse eğrinin biçimi de değişir [20] Tafel Ekstrapolasyonu Yöntemi Tafel ekstrapolasyonu yönteminde, korozyona uğrayan metal için anodik ve katodik Tafel eğrileri deneysel olarak belirlenir ve bunların çizgisel olan kısımları uzatılarak kesim noktalarından o sistem için korozyon akımı I kor ve korozyon potansiyeli E kor belirlenir. Asitli bir ortama daldırılan M metali hidrojen çıkararak korozyona uğruyorsa, yüksek dirençli bir voltmetre kullanılarak korozyon potansiyeli E kor ölçülebilir. Bu potansiyelden başlayarak metale anodik akım verilirse M metalinin yükseltgenmesini karşılayan (M M e - ) artı eğilimli anodik Tafel eğrisi elde
60 42 edilir. Korozyon potansiyelinden başlayarak katodik akım verilirse eksi eğimle gösterilen ve tam çizilen doğru kesimi bölgesi (Katodik Tafel Eğrisi, Şekil 3.3. elde edilir [21]. Şekil 3.3. Tafel eğrisi 3.3. Elektrotların Hazırlanması Ni, Cu, Ag, Zn ve Paslanmaz Çelik metal elektrotlardan kesilen 1 cm x 1 cm ebatlarında numuneler bakır tel ile lehimlenerek hücre içinde elektrot olarak kullanılacak hale getirildi. V 2 O 5 elektrot ise toz malzemeden hazırlandı. 1 mg malzeme tartılarak izopropil alkol ve Nafion çözeltisi ile karıştırıldı. Yüzeyi parlatılan camsı karbon (GC) elektrot üzerine, hazırlanan katalizör mürekkebi damlatılarak oda sıcaklığında kurutuldu ve deneylerde kullanıldı.
61 Elektrokimyasal Ölçümler Elektrotların derişim, ph ve sıcaklığa bağlı olarak etkisinin incelenmesi Hazırlanan elektrotların elektrokimyasal denemelerinde ölçüm alma koşullarını yani çalışma şartlarını tespit etmek gerekir. Bunun için hazırlanan elektrotların deniz suyu çözeltisi ve deniz suyu + sodyum sülfür çözeltisi içinde oda sıcaklığında, farklı ph değerlerinde sodyum sülfür derişimine bağlı dönüşümlü voltamogramları incelenmiştir. Aynı zamanda sıcaklığın akım - potansiyel eğrilerine etkisini görebilmek amacıyla 40 o C, 60 o C, 70 o C ve 80 o C ler de elektrotların deniz suyu çözeltisi ve deniz suyu + sodyum sülfür çözeltisi içinde döngüsel voltamogramları incelenmiştir Yakıt Pili Testleri Yakıt pilinin hazırlanması ve performans testleri Yakıt hücresi testleri için iki hücre hazırlandı. Hücrenin birinde Pt/C anot, diğerinde ise Ni anot kullanıldı. Her hücrede de katotta toz Pt/C kullanılmıştır. Anot olarak 15 mg cm -2 Pt/C (%10 Alfa Aiser) ve 15 mg cm -2 Ni tozları (Alfa Aiser), katotta ise 15 mg cm -2 Pt/C (%10 Alfa Aiser) kullanıldı. Metal tozları, Nafion çözeltisi ve izopropil alkol ile karıştırılarak ultrasonik banyo içinde 15 dakika bekletilerek katalizör mürekkepleri hazırlandı. Katalizör mürekkepleri karbon kağıtlar üzerine uygulanarak 60 o C de kurutuldu. Anot ve katot Nafion-117 membran üzerine 1.2 psi basınç ve 150 o C de sıcak presle baskılanarak Membran-Elektrot-Takımı (MET) hazırlandı. MET ler yakıt hücresinin içine yerleştirildi. Deneylerde kullanılan test hücresi Şekil 3.4 de verilmiştir. Her iki hücre 6 ml oksidan ve 6 ml yakıt depoları içermektedir. Sistemde yakıt ve oksidan akışı bulunmamaktadır. Hücrede anolit olarak 0.1 M Na 2 S + 1 M NaOH ve katolit olarak 2 M asidik H 2 O 2 çözeltileri kullanılmıştır.
62 44 Şekil 3.4. Yakıt Test Hücresi Empedans çalışması ve performans testleri Elektrokimyasal İmpedans spektroskopi (EIS) çalışmaları elektrot yüzeyinin karakteristiğini belirlemek için Gamry Instrument Reference-3000 ile gerçekleştirilmiştir. 100 khz ve 10 mhz frekans aralığında çalışılmıştır. 10 mv luk bir AC sinyali potansiyostatik olarak uygulanmıştır. Sonuçlar Nyquist diyagramları olarak verilmiştir. Eşdeğer devreler Gamry Instrument software programı kullanılarak simule edilmiştir.
63 45 4. BULGULAR VE TARTIŞMA 4.1. Deniz Suyu + Na 2 S İçeren Çözelti İçinde Ni, Cu, Ag, Paslanmaz Çelik (304), Çinko ve Vanadyum Metallerinin Elektrokimyasal Davranışları Deniz suyu içine Na 2 S ilave edilerek hidrojen sülfürlü deniz suyu ortamı simule edilemeye çalışılmıştır. H 2 S in oksidasyonun elektrokimyasal davranışı çalışma elektrotunun yüzey morfolojisinden ve çözeltinin bileşiminden (konsantrasyon, ph ve redoks arabulucuları olarak bilinen çözünmüş katalitik türlerin varlığı) ciddi ölçüde etkilenmektedir. Ancak ortamın ph sı, Na 2 S konsantrasyonu ve sıcaklık gibi faktörler metallerin elektrokimyasal davranışlarını önemli ölçüde değiştirmektedir Elektrolit çözeltisinin ph sının ve Na 2 S konsantrasyonunun etkisi Anotta kullanılan elektrolit çözeltisinin ph sı oluşacak yan ürünlerin belirlenmesi açısından çok önemli bir parametredir. ph 7 veya daha düşük değerlerde tutulursa H 2 S beslenen anotta serbest sülfür, hidrojen iyonları ve elektronlar oluşur [22]. H 0 2 S S 2H 2e (4.1) Sülfür hücrenin altındaki çıkıştan hücre dışına alınır. ph 7 ve daha düşük değerlerde ise katotta oluşan hidrojen gazı dışarı alınır: 2H 2e H (4.2) 2 Elektrolit ph sı 7 den daha yüksek olduğunda ise katotta suyun elektrolizi sonucunda hidrojen gazı oluşmaktadır: 2H2O 2e H2 2 OH (4.3)
64 46 Daha önemlisi, ph 7.5 dan büyük olduğunda anotta oluşan ürün ph 7 den küçük olduğunda oluşan üründen oldukça farklıdır. Bu durumda H 2 S bazik çözelti ile bisülfit iyonları ve hidrojen iyonları oluşturmak üzere reaksiyon vermektedir: H 2 S HS H (4.4) Bisülfit iyonları elektrolitik olarak serbest sülfür ve H 2 S oluşturmaktadırlar: 0 2HS S H2S 2 e (4.5) Serbest sülfür, sodyum sülfit ile reaksiyon vermektedir: 0 S Na S Na S Na S S 2 Na S 0 Na S S Na S (4.6) (4.7) (4.8) η; 2 ile 8 arasında bir tam sayıyı göstermektedir. Burada polisülfitler Na 2 S 4 ve daha ileri reaksiyonları vererek ilerlemektedir. Reaksiyonların daha yüksek sülfürleri içeren polisülfitlerin oluşmasını sınırlandırmak için kontrol edilmesi gerekmektedir. Bu durum özel bir anot seçimi veya kullanılan elektrolit ve elektrolit sıcaklığının kontrol edilmesiyle başarılabilir [22]. Deneylerde kullanılan elektrolitin ph sı oluşacak yan ürünlerin belirlenmesi açısından çok önemlidir. Bu sistemde kullanılabilecek uygun bazik elektrolitler; sodyum sülfür, sodyum karbonat, sodyum fosfat, sodyum hidroksit, sodyum mono-, di-hidrojen fosfat, sodyum bi karbonat, sodyum bisülfit gibi, komponentlerin sulu çözeltileridir. Hücrede sodyum bileşikleri gibi amonyum ve potasyum bileşikleri de kullanılabilmektedir. Diğer başka pek çok bazik sulu veya susuz çözeltiler de kullanılmakla beraber, genellikle bu katyonların polisülfürlerinin oluşması istendiği için, sodyum, potasyum ve amonyum iyonlarını oluşturan elektrolitlerin kullanılması tercih edilmektedir.
65 Metal Elektrotlar İle Yapılan Çalışmalar Nikel elektrot Ni elektrot hem yüksek aktivitesinden hem de düşük fiyatından dolayı elektrokimyasal proseslerde katalizör olarak ümit vaat edici bir metaldir. Ni-temelli katalizörler hidrojen üretim reaksiyonu (HER) için yüksek katalitik aktivite ve tek başına nikelinkinden daha iyi katalitik kapasite göstermektedirler [23]. Ni-Fe elektroliz ile hidrojen üretim reaksiyonu (HER) için en dikkat çekici katalizördür. Ni-Fe-C ise HER için çok daha iyi katalitik aktivite ve kararlılık göstermektedir. %9-12 Al ve %6 Fe ve Ni içeren Ni-Al bronz alaşımlar okyanus şartlarında çok iyi korozyon direnci göstermektedirler. Alaşımda Nikel varlığı korozyon direncini ve dayanıklılık verimini artırmakta ve mikro yapılı kararlı hale getirici gibi davranmaktadır [24]. Korozyon direnci, mekanik yumuşaklık, çok iyi elektriksel ve ısıl geçirgenliği gibi özelliklerinden dolayı, Ni-Al bronz alaşımlar ve Cu-Ni alaşımlar, boru hatlarında, yapısal malzemelerde ve deniz ortamındaki gemi teknelerinde en yaygın kullanılan malzemelerdir. Cu-Ni alaşımın iyi korozyon direncinin sebebi bakır yüzeyinde oluşan Cu 2 O dır. Ni veya Fe atomlarının bakır kafesi içinde olması kusur sayısını azaltmakta korozyon tabakasının pasifleştirici gücünü artırmaktadır. Bununla beraber, Cu-Ni alaşımı H 2 S içeren deniz suyu ile temas edince hızlı bir korozyona maruz kalmaktadırlar.
66 48 Şekil 4.1 de Nikel-S-H 2 O sistemine ait Pourbaix diyagramı görülmektedir [25]. Şekil 4.1. Ni-S-H 2 O sistemine ait Pourbaix diyagramı
67 49 Şekil 4.2 de Nikel elektrodun ph=14 de deniz suyu + Na 2 S içeren çözelti içinde açık devre potansiyeli görülmektedir. Şekil 4.2. Nikel elektrodun ph=14 de deniz suyu + Na 2 S içeren çözelti içinde açık Devre potansiyeli (25 o C) Şekil 4.2 de Ni elektrodun -100 mv lar civarında dengeye geldiği görülmektedir. Pourbaix diyagramlarından bu potansiyelin NiS oluşum bölgesine denk geldiği anlaşılmaktadır.
68 50 Şekil 4.3 de Nikel elektrodun deniz suyu içerisinde farklı sıcaklıklardaki döngüsel voltamogramları görülmektedir. Şekil 4.3. Ni elektrodun deniz suyu içerisinde 30 o C, 40 o C, 50 o C, 60 o C ve 80 o C deki döngüsel voltamogramları Şekil 4.3 de Nikel elektrodun deniz suyu içinde 0 V civarında bir pik verdiği ve sıcaklıkla bu pik şiddetinin arttığı gözlenmektedir. Bu bölgede NiCl 2 oluşur. Ortam şartlarında H 2 oluşumu ve Cl 2 gazı oluşumu da gözlenmemektedir.
69 51 Şekil 4.4 de Ni elektrodun deniz suyu ve Na 2 S ilave edilen çözelti içinde farklı ph lardaki döngüsel voltamogramları görülmektedir. Şekil 4.4. Ni elektrodun deniz suyu + Na 2 S içerisinde ph=12, ph=13 ve ph=14 deki döngüsel voltamogramları Şekil 4.4 de ph>12 şartlarında pozitif potansiyellerde oksidasyon piklerinin oluştuğu görülmektedir. ph=12 ve 14 te yaklaşık mv potansiyellerde yüzeyde oluşan tabaka katalitik davranış göstermektedir.
70 52 Şekil 4.5 de Ni elektrodun ph=14 de deniz suyu ve Na 2 S ilave edilen çözelti içinde alınan çoklu tarama döngüsel voltamogramları görülmektedir. Şekil 4.5. Ni elektrodun ph=14 de deniz suyu + Na 2 S çözeltisi içinde alınan çoklu tarama döngüsel voltamogramları (10 tarama) Şekil 4.5 de Nikelin Na 2 S içeren deniz suyu içinde alınan çoklu taramasında elektrot yüzeyinin kararlı bir davranış gösterdiği anlaşılmaktadır. Nikel için ph=14 optimum çalışma şartı olarak kabul edilebilir. Nikelin alkali çözelti içinde anodik davranışı Ni/Ni(OH) 2 ve Ni(OH) 2 /NiOOH redox reaksiyonlarına bağlıdır. Alkali çözeltilerde metal çözünür ve Ni(OH) 2 oluşarak metal yüzeyinde aşağıdaki mekanizmaya göre adsorplanır [26].
71 53 Ni (metal)t + H 2 O (NiOH) ads + H + + e - (4.9) Şekil. 4.6 da Nikel elektrodun deniz suyu ve Na 2 S ilave edilen çözelti içinde farklı konsantrasyonlarında alınan döngüsel voltamogramlar görülmektedir. Şekil 4.6. Nikel elektrodun deniz suyu + Na 2 S ilave edilmiş çözelti içinde farklı konsantrasyonlarda ph=14 deki döngüsel voltamogramlar Şekil. 4.6 da 600 mv civarındaki pikin akım yoğunluğu HS - konsantrasyonu ile artmakta ve potansiyel pozitife doğru kayma göstermektedir. Bu potansiyelde HS -, alkali ortamda oluşan ve yüzeyde adsorplanan Ni(OH) 2 üzerinde yükseltgenmektedir. Ni(OH) 2 tabakası ise NiO(OH) e dönüşmektedir. NiO(OH) in tekrar Ni(OH) 2 e dönüşmesi ise geri taramada 300 mv civarında gözlenmektedir.
72 54 Şekil 4.7 de Ni elektrodun ph=14 te farklı sıcaklıklarda alınan döngüsel voltamogramları görülmektedir. Şekil 4.7. Ni elektrodun deniz suyu içerisinde ph=14 + 0, M 0,2 ml Na 2 S içerisinde 40 o C, 50 o C, 60 o C, ve 70 o C deki döngüsel voltamogramları Şekil 4.7 de Nikel elektrodun ph=14 te alınan döngüsel voltamogramlarında, sıcaklık arttıkça pik akımlarında artış olduğu görülmektedir. 60 o C'nin üstüne çıkıldığı zaman oksidasyon potansiyeli 600 mv dan -50 mv civarına kaymaktadır.
73 55 Nikel Elektrot Yüzeyinin Empedans Analizi Şekil 4.8 de Nikel elektrodun deniz suyu (mavi hat) + Na 2 S içinde Nyquist eğrileri görülmektedir. Şekil 4.8. Nikel elektrodun deniz suyu + Na 2 S içinde Nyquist eğrileri Şekil 4.8 de deniz suyuna sülfür ilave edildikten sonra empedansın ciddi olarak küçüldüğü ve ph arttıkça yüzeyde empedans küçülürken mekanizmanında değiştiği görülmektedir. Yüzeyde NiS oluşumu ile empedansın küçülmesi yüzeyde oluşan tabakanın reaksiyona girdiğini göstermektedir. Dolayısıyla oluşan tabakanın HS - in yükseltgenmesinde katalitik etki gösterdiği anlaşılmaktadır. Ayrıca artan ph ile yüzeyde Warburg empedansı gözlenmektedir. Bu da yüzeyde difüzyonun arttığını mekanizmasının difüzyona doğru kaydığını göstermektedir. Empedans çalışmasında loplardaki küçülme ve Warburg empedansının ortaya çıkması, Nikel katalizörünün
74 56 H 2 S içeren deniz suyu içinde katalitik davranış gösterdiğini açık bir şekilde göstermektedir Bakır Elektrot Şekil 4.9 de Cu-S-H 2 O Sistemine ait Pourbaix diyagramı görülmektedir [27]. Şekil 4.9. Cu-S-H 2 O Sistemi için Pourbaix diyagramı Şekil 4.9 de -230 mv dan -210 mv a düşüp bu potansiyelde sabit kaldığı Pourbaix diyagramından da görülmektedir. Yüksek ph da yaklaşık -400 mv lar civarında yüzeyde Cu 2 S oluşması beklenmektedir. Cu 2 S ın yüzeyi kapladıktan sonra kararlı bir film tabakası oluşturduğu bilinmektedir. Yüzeyde oksit tabaklarının oluşmasını engellemektedir. Dolayısıyla Na 2 S li ortamda uygun ph ayarlaması yapılarak, Na 2 S ün oksidasyonu Cu 2 S üzerinden yürüyen bir mekanizma ile gerçekleştirilebilir.
75 57 Şekil 4.10 da Bakır elektrodun deniz suyu ve Na 2 S ilave edilen çözelti içinde ph=14 te alınan açık devre potansiyeli (OCP) görülmektedir. Şekil Bakır elektrotun deniz suyu + 1 mmol Na 2 S ilave edilmiş çözelti içinde ph=14 te Açık Devre Potansiyeli (OCP) Şekil 4.10 da yaklaşık -210 mv da elektrot denge potansiyeline ulaşmaktadır. Bakırın sülfür içeren ortamdaki mekanizması bir seri reaksiyonla aşağıda verildiği gibidir. 1. Adım elektrolitin katodik indirgenmesidir. Çözünmüş oksijen olması durumunda katodik reaksiyon hidrojen oluşumudur: (4.10) Havalı ortamda ise çözünmüş oksijenin indirgenmesi meydana gelir: O 2 + 2H 2 O 4OH - (4.11) Sülfit iyonları yüksek ph da hidrojene olur: S 2- + H 2 O HS - + OH - pk=14.9 (4.12)
76 58 HS - metalik bakır ile oksidasyon reaksiyonun adsorblanmış ara ürünlerini oluşturur: Cu + HS - Cu(HS - ) ads (4.13) Bakırın anodik çözünmesi aşağıdaki gibi olur: Cu(HS - ) Cu(HS) + e - (4.14) Bunu çözünme ve tekrar birleşme prosesleri takip eder: 2Cu + + HS - + OH - Cu 2 S + H 2 O (4.15) Toplam reaksiyon aşağıdaki gibidir: 4Cu + 2S 2- + O 2 + 2H 2 O 2Cu 2 S + 4OH - (4.16) Paralel bir reaksiyon olan bakır oksit oluşumu benzer bir prosesle yürür. 4Cu + O 2 2Cu 2 O (4.17) Ancak Cu 2 S in bulunması Cu 2 O filminin oluşmasını engellemektedir. Adsorplanan HS - elektrot yüzeyinde negatif bir şarja sebep olarak hidrojen oluşum reaksiyonunu katalizler: HS - +e - H ads + S 2- (4.18) H ads +H ads H 2 (4.19)
77 59 Şekil 4.11 de bakır elektrodun deniz suyu ve Na 2 S ilave edilen çözelti içinde farklı ph larda alınan döngüsel voltamogramları görülmektedir. Şekil Cu elektrodun deniz suyu ve Na 2 S ilave edilen çözelti içinde farklı ph larda alınan döngüsel voltamogramları Şekil 4.11 da ph < 10 olduğunda yüzeyde deniz suyu ortamında ve Na 2 S ilavesinden sonra döngüsel voltamogramda değişiklik olmamaktadır. Çözelti ph sı 10 a ayarlanınca ortamda artan HS - konsantrasyonuyla birlikte pik akımları büyümektedir. ph=14 te ise hem anodik hem de katodik pik akımlarıı düşmektedir. Bu durum ortam ph sının Cu ın katalitik aktivitesinde önemli olduğunu göstermektedir. Pourbaix diyagramlarından ve yukarıda verilen reaksiyon mekanizmalarından bu çalışma şartlarında yüzeyde Cu 2 S oluşumu beklenmektedir. 300 mv civarı bakır
78 60 oksitlerin oluştuğu potansiyeldir. Ancak sülfür varlığı, oksit oluşumunu engellemektedir. Şekil de bakır elektrodun deniz suyu ve Na 2 S ilave edilen çözelti içinde ph=10 da alınan çoklu tarama (50 mvsn -1 ) döngüsel voltamogramları görülmektedir. Şekil Cu elektrodun deniz suyu+ Na 2 S içinde ph=10 da çoklu tarama (50 mvsn -1 ) döngüsel voltamogramları Şekil 4.12 de ph=10 da Na 2 S içeren çözelti içinde bakır elektrot ile alınan çoklu taramada, elektrot bu çalışma şartlarında kararlı bir davranış göstermektedir. Tarama sayısı artınca 0.7 V da gözlenen oksidasyon piki yükselmektedir.
79 61 Bakır elektrot deniz suyu içinde oksit kaplanarak (CuO) korozyona karşı direnç gösterebilen bir metaldir. Bakıra ait çoklu tarama Şekil.4.12 de pik akımlarında yüzeyin kararlı olduğu görülmektedir. Şekil 4.13 de bakır elektrodun deniz suyu içerisinde farklı sıcaklıklarda alınan döngüsel voltamogramları görülmektedir. Şekil Cu elektrodun deniz suyu içerisinde 22 o C, 30 o C, 40 o C, 50 o C, 60 o C ve 70 o C deki döngüsel voltamogramları Şekil 4.13 de bakır elektrotun farklı sıcaklıklarda alınan döngüsel voltamogramlarında, 445 mv da gözlenen pik sıcaklık arttıkça artmakta ve geri taramada -310 mv civarından tersinir olarak indirgenmektedir.
80 62 Na 2 S konsantrasyonundaki artışın etkisinin anlayabilmek amacıyla Şekil 4.14 de bakır elektrodun deniz suyu ve Na 2 S ilave edilen çözelti içinde ph=10 da farklı Na 2 S konsantrasyonlarında alınan döngüsel voltamogramları görülmektedir. Şekil Cu elektrodun deniz suyu ve Na 2 S içinde ph=10 da değişen Na 2 S konsantrasyonlarında alınan döngüsel voltamogramları Şekil 4.14 de 370 mv ve 680 mv larda iki anodik pik gözlenmektedir. Artan Na 2 S konsantrasyonuyla beraber 370 mv daki pik kaybolmakta, 680 mv daki pik akımı ise artmaktadır. Bu piklerden biri adsorpsiyon piki diğeri ise oksidasyon pikidir. Eğer yüzeyde HS - adsorpsiyonu artarsa bu durumun hidrojen oluşumunu katalizlemesi beklenir. Ancak katodik bölgedeki piklere bakılırsa yaklaşık V daki piklerin
81 63 şiddetlerinde bir değişiklik görülmemektedir. Dolayısıyla yüzeyde HS - adsorpsiyonundan kaynaklanan bir hidrojen oluşum reaksiyonu yoktur. Dolayısıyla 370 mv civarındaki pikin adsorpsiyon piki, 680 mv civarındaki pikin ise oksidasyon piki olduğu söylenebilir. Şekil.4.15 de bakır elektrodun deniz suyu ve Na 2 S ilave edilen çözeltide ph=12 de farklı Na 2 S konsantrasyonlarında alınan döngüsel voltamogramları görülmektedir. Şekil Cu elektrodun deniz suyu +Na 2 S çözeltisinde ph=12 de farklı Na 2 S konsantrasyonlarında alınan döngüsel voltamogramları Şekil 4.15 te ph=12 de farklı konsantrasyonlarda alınan döngüsel voltamogramlarda, sistemin yaklaşık olarak 180 mv daki adsorpsiyon piki üzerinden yürüdüğü açıkça görülmektedir. Yüzeyde artan pik şiddeti adsorpsiyonun Na 2 S konsantrasyonu ile
82 64 birlikte arttığını göstermektedir. Katodik bölgedeki davranış incelendiği zaman ise düşük konsantrasyonlarda V da gözlenen indirgenme piki konsantrasyon arttıkça daha negatif potansiyellere doğru kaymaktadır. Yüzeyde artan HS - adsorpsiyonu ile birlikte hidrojen oluşumunun da arttığı -1.2 V daki pikteki artıştan gözlenmektedir. Şekil 4.16 da bakır elektrodun deniz suyu ve Na 2 S ilave edilen çözeltide ph=10 da farklı sıcaklıklarda alınan döngüsel voltamogramlar görülmektedir. Şekil Cu elektrodun deniz suyu + Na 2 S içeren çözeltide ph=10 da farklı sıcaklıklarda alınan döngüsel voltamogramları
83 65 Şekil 4.17 de bakır elektrodun deniz suyu ve Na 2 S ilave edilen çözeltide ph=12 de farklı sıcaklıklarda alınan döngüsel voltamogramlar görülmektedir. Şekil Cu elektrodun deniz suyu + Na 2 S içeren çözeltide ph=12 de farklı sıcaklıklarda alınan döngüsel voltamogramları Şekil 4.16 ve Şekil 4.17 deki döngüsel voltamogramlar incelendiği zaman deniz suyu ve farklı ph daki Na 2 S li çözeltilerin sıcaklıkla benzer davranış gösterdikleri anlaşılmaktadır. Sıcaklıkla anodik bölgedeki pikler de farklı değişiklikler olmaktadır. Yaklaşık olarak 0.22 V daki adsorpsiyon piki sıcaklıkla artmaktadır V daki oksidasyon piki ise Na 2 S li çözeltilerde gözlenmekle beraber tüm ph değerlerinde bu pikin azalmakta hatta sıcaklık artışı ile birlikte yok olmaktadır. Bu durum sıcaklıkla yüzeyde adsorpsiyonun arttığını göstermektedir. Ancak yüzeyde adsorplanan HS -
84 66 iyonları olmadığı aşikardır. Çünkü bu pik hem Na 2 S olmayan çözeltilerde hem de HS - adsorpsiyonunun hızlandırdığı hidrojen oluşumu hiçbir döngüsel voltamogramda gözlenmemektedir. Aksine indirgenme potansiyeli -400 mv'dan daha pozitif değerlere doğru kaymaktadır. Bakır Elektrot Yüzeyinin Empedans Analizi Şekil 4.18 da bakır elektrodun deniz suyu ve Na 2 S ilave edilen çözeltide farklı ph larda alınan Nyquist diyagramları görülmektedir. Şekil Cu elektrodun deniz suyu ve Na 2 S ilave edilen çözeltiler içinde ph=8 (kırmızı hat), ph=10 ve ph=12 deki Nyquist diyagramları
85 67 Şekil 4.18 de sülfür ilavesiyle yüzeyde oluşan film tabakası yüzeyin transfer direncini artırmaktadır. Ancak ph=10 olduğu zaman R ct düşmekte ph=12 olduğunda ise R ct daha da düşmekte ve yüzeyde Warburg empedansı gözlenmektedir. Transfer direncinde gözlenen düşme Na 2 S konsantrasyonunun oksidasyon hızını artırdığını göstermektedir. Warburg empedansının oluşması yüzeyde oluşan tabakanın reaktivitelerinin arttığını göstermektedir. Bu durumda yüzeyde toplanan oksidasyon ürünleri elektriksel şarj dengesi oluşturmaktadır Gümüş elektrot Şekil 4.19 deki akım-potansiyel eğrisinden Ag ün katalitik aktivitesinin ph ya sıkı bir şekilde bağlı olduğu görülmektedir. Ag(II) katalizörü kullanarak asidik ortamda H 2 S ün tutulması için Muthuraman ve arkadaşlarının yaptığı çalışmalardan H 2 S ün doğrudan okside olmadığı anlaşılmaktadır. H 2 S bulunan asidik bir çözelti içine Ag(II) tuzları eklenmeden ve eklenerek döngüsel voltamogramlar alınmıştır M Ag(II) bulunan ve bulunmayan ortamda alınan döngüsel voltamogramlardan Ag(II) bulunan ortamda yaklaşık 1.82 V civarında pik akımında artış olduğu görülmektedir. Ag(II) ara ürününden kaynaklanan pik akımındaki artış, ara ürün üzerinden yürüyen elektrokatalitik oksidasyonu göstermektedir. Bu çalışma şartlarında asidik ortamda H 2 S in doğrudan oksidasyonunun gerçekleşmediği anlaşılmaktadır [28].
86 68 Şekil 4.19 da Ag elektrodun HNO 3 çözeltisi içinde H 2 S içeren ve içermeyen ortamlarda alınan döngüsel voltamogramları görülmektedir. Şekil Ag elektrodun 6M HNO 3 Çözeltisi içinde H 2 S içeren ve içermeyen ortamlarda alınan döngüsel voltamogramları (Pt çalışma elektrodu, Ag(I) konsantrasyonu; 0.005M, tarama hızı; 100 mvs -1 ) [28].
87 69 Şekil 4.20 de Ag-S-H 2 O sistemine ait Pourbaix diyagramı görülmektedir. Şekil Ag-S-H 2 O sistemine ait Pourbaix diyagramı
88 70 Şekil 4.21 de Ag elektrodun açık devre potansiyeli görülmektedir. Şekil Ag elektrodun deniz suyu ve Na 2 S içeren çözelti içinde ph=14 te açık devre potansiyeli Şekil 4.20 de verilen Pourbaix diyagramından Ag yüzeyinde Na 2 S ilave edilmesi durumunda Ag 2 S oluşması beklenmektedir. Şekil 4.21 de verilen Ag ün açık devre potansiyeli grafiğinden ise Ag ün açık devre potansiyeli V olarak bulunmuştur. Bu potansiyelin Ag 2 S oluşum potansiyeli olduğu görülmektedir. Asidik çözeltide reaksiyon mekanizması aşağıdaki gibi önerilmektedir. Düşük ph larda sülfat (SO 2-4 ) oluşuma sebep olmaktadır. Ag(I) Ag(II) + e - (4.20) 8Ag(II) + H 2 S + 4H 2 O 8Ag(I) + SO H + (4.21)
89 71 Şekil 4.22 de gümüş elektrodun deniz suyu ve Na 2 S ilave edilen çözelti içinde farklı ph larda alınan döngüsel voltamogramları görülmektedir. Şekil Ag elektrodun deniz suyu ve Na 2 S içinde farklı ph larda alınan döngüsel Voltamogramları Şekil 4.22 de yüksek ph larda (ph=10, 12, 14) alınan döngüsel voltamogramlarda 1 V un üstündeki potansiyellerde oksidasyon pikleri gözlenmektedir. Bu durum elektroliz potansiyelini göstermektedir. Geri taramada ise -1.1 V da indirgenme reaksiyonu meydana gelmekte ve Ag yüzeyinde oluşan Ag 2 S geri taramada aşağıdaki reaksiyon mekanizmaları ile tekrar Ag e indirgenmektedir. Ag 2 S + 2 e - 2 Ag + S 2- (4.22) Ag 2 S + 2 H e - 2 Ag + H 2 S (4.23)
90 72 Şekil 4.23 de gümüş elektrodun deniz suyu içerisinde farklı sıcaklıklarda alınan döngüsel voltamogramları görülmektedir. Şekil Ag elektrodun deniz suyu içerisinde 22 o C, 30 o C, 40 o C, 50 o C ve 60 o C de alınan döngüsel voltamogramları Şekil 4.23 de gümüş elektrodun farklı sıcaklıklarda alınan döngüsel voltamogramlarında, sıcaklık arttıkça pik akımlarında artış olduğu görülmektedir.
91 73 Şekil 4.24 de gümüş elektrodun deniz suyu ve Na 2 S ilave edilen çözeltide ph=14 te farklı konsantrasyonlarda alınan döngüsel voltamogramları görülmektedir. Şekil Ag elektrodun deniz suyu ve Na 2 S ilave edilen (0.08e-3 M 0.2 ml, 0.4 ml, 0.8 ml, 1 ml) çözeltide ph=14 te alınan döngüsel voltamogramları Şekil 4.24 de artan Na 2 S konsantrasyonuna karşı pik akımında belirgin bir artış gözlenmemektedir. Reaksiyon mekanizmasının ve yüzeyde meydana gelen mekanizmaların konsantrasyona bağlı olmadığı görülmektedir. Ag elektrot ile yapılan çalışmada reaksiyon mekanizması Ag elektrodun aktif yüzey alanına bağlı olarak yürümektedir. Yüzeyde oluşan sülfür tabakasının HS - ün oksidasyonunda katalitik etkisi yoktur. Tersine hidrolizin meydana gelmesine yardımcı olmaktadır.
92 74 Gümüş Elektrot Yüzeyinin Empedans Analizi Şekil 4.25 de gümüş elektrodun deniz suyu ve Na 2 S ilave edilen çözeltide farklı ph larda alınan Nyquist diyagramları görülmektedir. Şekil Ag elektrodun deniz suyu ve deniz suyu + Na 2 S ilave edilmiş ortamda farklı ph larda (ph=10, 12, 14) alınan Nyquist diyagramları Ag elektrodun sülfüre karşı duyarlılığı ph ya bağlıdır. ph=10 da ortama ilave edilen 0.2 ml Na 2 S ile yüzeyde Ag 2 S oluşmaktadır. Ancak ph >10 olduğu zaman döngüsel voltamogramlardan görüldüğü gibi yüzeyde Ag 2 S ün indirgenmesinden dolayı aktif alanlar artmakta ve yüzey empedansı küçülmektedir. Yükselen ph ile artan HS - konsantrasyonu Ag yüzeyinde reaksiyona girebilmektedir. Farklı ph larda ilave
93 75 edilerek alınan empedanslarda ph ya bağlı olarak meydana gelen yüzey değişimi açıkça görülmektedir. Reaksiyon Ag ün aktif yüzey alanına bağlı olarak meydana gelmektedir. Ag elektrot yaklaşık 600 mv civarında bir oksidasyon piki vermektedir. Bu pik -800 mv da indirgenmektedir. Pik şiddeti sıcaklıkla artmaktadır. İndirgenme piki hidrojen oluşumu bölgesine yakındır. Ancak elektroliz bölgesinde herhangi bir pik gözlenmemektedir Paslanmaz Çelik (304) Elektrot Çeliğin deniz suyu korozyonunda Fe (II-III) hidroksisülfat oluşumu yeşil pas (Green rusts:gr) olarak adlandırılır. Yeşil paslar (GR) deniz suyunda bulunan en temel anyonlardır. Bunlar GR(Cl - ), GR(CO 2-3 ) ve GR(SO 2-4 ) lardır. Örnek olarak GR(SO 2 4 ) negatif bir ara tabaka yerine pozitif hidroksit tabakası oluşturmak üzerine yapılanmaktadır. Çözeltide [Cl - ]/(SO 2-4 ] molar oranı yüksek bile olsa GR(Cl - ) yerine çift valanslı anyonlarla kuvvetli bir bağlanma eğilimine sahip olan GR(SO - 4 ) oluşumu gözlenmektedir [29]. GR çözünmüş oksijen tarafından FeOOH bileşiğine yükseltgenir. Prosesin başında deniz suyu içindeki çeliğin yüzeyinde oluşan GR tabakası dışta Fe(III) oksihidroksitler içte tabakada ise GR(SO 2-4 ) oluştururlar. Bu tabaka 6-12 ay içinde FeS ile birleşir. SRB lerin metabolik aktivitelerinden dolayı deniz suyu içinde çelik yüzeyinde FeS oluşur. Çözünmüş oksijenin mikro-organizmaların solunumu ve GR(SO 2-4 ) ile reaksiyonları sonucunda tüketilmesi Fe(III) oksihidroksitlerin oluşmasına yol açar. Bundan sonra artık korozyon reaksiyonu oksijen transferi ile kontrol edilemez. Bundan sonra reaksiyon mekanizmasını sınırlayan basamak mikroorganizmaların beslenme ihtiyacı olacaktır. Çelik yüzeyine bir anodik polarizasyon uygulandığı zaman Fe(II) ve Fe(III) elektrokimyasal olarak meydana gelerek, aşağıdaki anodik reaksiyon ile metalden GR oluşumuna neden olur.
94 76 6Fe + SO H 2 O Fe ıı 4Fe ııı 2(OH) 12 SO 4.8H 2 O + 12H e - (4.24) Anodik şartlarda çeliğin korozyonu esnasında bu reaksiyon suyun indirgenmesi ile birlikte yürür: 2H + + 2e - H 2 (4.25) Fe ve GR(SO 4 2- ) arasındaki denge şartları aşağıdaki gibi verilmektedir: E eq (GR SO4 /Fe) = ph log(a SO4 ) ph=7 de denge potansiyeli E eq (GR SO4 ) = V/SHE değeridir. Bu yaklaşımlar sonucunda GR nin ana yapısı GR(SO 2-4 ), FeS ve Fe 3 O 4 olmak üzere üç fazdan oluşmaktadır. Fe(II-III) karışımı içeren bileşik magnetit olarak bilinir. Magnetit de GR(SO 2-4 ) gibi çeliğin çözülmesine neden olur. Fe 3 O 4 ve GR(SO 2-4 ) oluşumu, Fe ve SO 4 ara yüzey konsantrasyonlarına ve ph ya bağlıdır. Düşük sülfat konsantrasyonu, yüksek magnetit oluşumuna yol açar. Benzer şekilde yüksek ph değerlerinde ve düşük çözünmüş Fe(II) konsantrasyonlarında magnetit oluşumu baskındır. Paslanmaz çelik 304 yüksek korozyon direnci ve termal direncinden dolayı en çok kullanılan malzemedir. Diğer paslanmaz çeliklerle kıyaslayınca (316, 630), deniz suyu içinde Cl - iyonları tarafından oluşturulan pasifleştirici filmden dolayı bozulmaktadır ve korozyona uğramaktadır. Paslanmaz Çelik (316) deniz suyunda harika bir korozyon direnci gösterirken, Paslanmaz Çelik (630) e bakır ilave edilerek dayanıklılığı artırılmakta ve korozyona direnci yükselmektedir [30].
95 77 Şekil 4.26 da paslanmaz çelik (304), (326) ve (630) elektrot için deniz suyu içinde açık devre potansiyelleri (OCP) görülmektedir Şekil Paslanmaz Çelik (304, 316, 630) elektrot için deniz suyunda ph=8 de alınan açık devre potansiyelleri (OCP) [29].
96 78 Şekil 4.27 de paslanmaz çelik (304) elektrot Fe-S-H 2 O sistemine ait Pourbaix diyagramı görülmektedir. Şekil Fe-S-H 2 O sistemine ait Pourbaix diyagramı
97 79 Şekil 4.28 de paslanmaz çelik (304) elektrodun deniz suyu ve Na 2 S ilave edilen çözelti içinde alınan açık devre potansiyeli (OCP) görülmektedir. Şekil Paslanmaz çelik elektrodun deniz suyu ve Na 2 S ilave edilen çözelti içinde ph=14 te alınan açık devre potansiyeli (OCP)
98 80 Şekil 4.29 da paslanmaz çelik (304) elektrodun deniz suyu ve Na 2 S ilave edilen çözeltide farklı ph larda alınan Tafel eğrileri görülmektedir. Şekil Paslanmaz çelik (304) elektrodun deniz suyu ve Na 2 S ilave edilen (1.4 ml, 8e-5 M) çözeltide farklı ph larda alınan Tafel eğrileri
99 81 Şekil 4.30 da paslanmaz çelik (304) elektrodunun deniz suyu içinde ph=8 de alınan çoklu tarama döngüsel voltamogramları görülmektedir. Şekil Paslanmaz çelik (304) elektrodunun deniz suyu içinde ph=8 de çoklu tarama döngüsel voltamogramları (10 tarama) Şekil 4.30 da 1.4 V da gözlenen oksidasyon piki suyun elektrolizi potansiyelinden daha pozitif potansiyelde oksijen oluşumu ile meydana gelmekte olan bir reaksiyondur. Beklendiği gibi Fe(III) bileşiğinin oluşumu gözlenmektedir. Katodik taramada yaklaşık 700 mv da gözlenen ikinci oksidasyon piki ise Fe 3+ /Fe 2+ dönüşümünden kaynaklanmaktadır. Paslanmaz çelik ile deniz suyu içinde 30 o C nin üstündeki sıcaklıklara çıkıldığı zaman çözünme hızlanmakta ve yeşil pas (GR) hızla çökelmektedir. Bu sıcaklıktan yüksek değerlere çıkıldığı zaman paslanmaz çelik elektrodun uygun olmadığı görülmektedir.
100 82 Şekil 4.31 de paslanmaz çelik (304) elektrodunun deniz suyu ve Na 2 S ilave edilen çözeltide farklı ph larda alınan döngüsel voltamogramları, iç şekilde ise deniz suyu (lacivert hat) ve Na 2 S ilave edilen deniz suyu (kırmızı hat) içinde alınan döngüsel voltamogramlar görülmektedir. Şekil Paslanmaz çelik (304) elektrodunun deniz suyu ve Na 2 S ilave edilen (1.4 ml, 8e-5 M) çözeltide farklı ph larda alınan döngüsel voltamogramları (içteki şekil: deniz suyuna Na 2 S ilavesi ph=8 de alınan döngüsel voltamogramı), Şekil 4.31 daki iç şekilde deniz suyu içinde 1.4 V da Fe(III) bileşenleri oluştuğu, 0.9 V da ise Fe(II) ye indirgenme pikleri görülmektedir. Na 2 S ilavesi ile 1.4 V daki pik akımı düşmekte ve buna bağlı olarak 0.9 V daki pik yok olmaktadır. Sülfür Fe oksitlerle birleşik yaparak çözünmeye sebep olmaktadır. Ortam ph sı 14 e doğru arttıkça artan HS - konsantrasyona bağlı olarak 1.4 V daki pik akımı yükselme göstermektedir. Bu durum yüzeyde daha kararlı olan FeS oluşumunu ve HS - ün yükseltgenme aktivitesinin arttığını göstermektedir.
101 83 Bu durum Fe(III) oksitlerin HS - ün oksidasyonunu hızlandırdıklarını göstermektedir. Fe(III) türlerinin Fe(II) türlerinden daha reaktif oldukşarı bilinmektedir. Bu durum toplam hız eşitliğinde aşağıdaki gibi verilebilir. -d[h 2 S] T / dt= k[h 2 S] a T [Fe(OH) 3 (s)] b a ve b H 2 S ve Fe(OH) 3 reaksiyonları için reaksiyon mertebeleri, k hız sabitidir. Sülfat iyonu eklenen deniz suyu çözeltisi içinde elektrot yüzeyinin daha büyük olan sülfit iyonları tarafından kompleks oluşturulması sonucunda Cl - iyonlarının reaksiyon hızı azalacaktır. H 2 S in Fe(OH) 3 üzerinde oksidasyon hızı çözelti ph sına sıkı bir şekilde bağlıdır. ph=7 de yüzeyde Fe-oksihidroksit yoğunluğu (αfeooh, βfeooh ve γfeooh) maksimumdur. Çözelti ph sı H 2 S ün kimyasal kompozisyonunu ve yüzey oksitlerinin bölgelerini (surface sites on the oxidas) dğiştirmektedir. H 2 S ve Fe oksitler arasındaki reaksiyon mekanizmaları aşağıdaki gibi önerilmektedir [31]. i. Yüzeyde kompleks oluşumu: FeOH + HS - FeS - + H 2 O (4.26) ii. Elektron transferi FeS - Fe II S (4.27) iii. Oksitlenmiş ürünün bırakılması ve Fe(II) nin ayrılması Fe II OH 2 + yeni aktif bölgeler + Fe +2 (4.28) H 2 S ün Fe(OH) 3 tarafından yükseltgenmesi için muhtemel reaksiyonlar aşağıdaki gibidir: FeOH + HS - FeS - + H 2 O (4.29) FeO - + HS - FeOHS 2- (4.30) FeOH HS - FeH 2 S + H 2 O (4.31)
102 84 Şekil 4.32 da paslanmaz çelik (304) elektrodunun deniz suyu ve Na 2 S ilave edilen çözelti içinde ph=12 de alınan döngüsel voltamogramları görülmektedir. Şekil Paslanmaz çelik (304) elektrodunun deniz suyu ve Na 2 S ilave edilen çözelti içinde ph=12 de alınan döngüsel voltamogramları Şekil 4.32 de ph=12 de artan konsantrasyonlarda HS - in oksidiyonunun akım şiddeti artan Na 2 S konsantrasyonu ile azalmaktadır. Bu azalma muhtemel elektrodun çözünmesinden kaynaklanmaktadır.
103 85 Şekil 4.33 de paslanmaz çelik (304) elektrodunun deniz suyu ve Na 2 S ilave edilen çözelti içinde farklı konsantrasyonlarda ph=14 de alınan döngüsel voltamogramları görülmektedir. Şekil Paslanmaz çelik elektrodunun deniz suyu ve NaS ilave edilen çözelti içinde farklı konsantrasyonlarda ph=14 te alınan döngüsel voltamogramları Şekil 4.33 te ph=14 te artan HS - şiddetinin arttığı görülmektedir. konsantrasyonu ile oksidasyon pik akımının Şekil 4.32 ve Şekil 4.33 ph nın elektrot yüzeyinin elektrokimyasal davranışı üzerindeki etkisini göstermektedir. Yüksek ph da elektrot yüzeyinde koruyucu bir tabaka oluşmaktadır.
104 86 Paslanmaz Çelik (304) Elektrot Yüzeyinin Empedans Analizi Şekil 4.34 te paslanmaz çelik (304) elektrotun Nyquist diyagramı görülmektedir. Şekil Paslanmaz Çelik (304) elektrodunun Nyquist diyagramı Şekil 4.34 te deniz suyu içinde oksit yapıları Na 2 S ilavesi ile çözünmektedir ve buna bağlı olarak empedans küçülmektedir. ph=8 de oldukça düşen transfer direnci, ph=10 da biraz artmıştır. ph=12 de maksimum değerine ulaşmıştır. Bu durum yüzeyde artan FeS tabakasını göstermektedir. ph=14 te ise reaksiyon mekanizması değişmekte Warburg empedansı başlamaktadır. Bu sistemde difüzyon mekanizmasının meydana geldiğini ve yüzeyde HS - iyonlarının reaktivitesinin arttığını göstermektedir.
105 Çinko elektrot Zn yüksek kapasitesi (0.82 Ah/g), yüksek deşarj verimi ve yüksek güvenlik özelliklerinden dolayı birincil bataryalarda anot olarak kullanılan metaldir. Zn/MnO 2 alkali bataryaların ve çinko-hava bataryalarının anodu olarak kullanılmaktadır. Çinkonun alkali ortamda korozyonunun indirgeme yeteneğine sahiptir. Çinkonun alkali ortamdaki korozyonu suyun katodik indirgenmesi ile kontrol edilmektedir. Bu prosesin en önemli ürünü hidrojen gaz üretimidir [32]. Zn elektrot H 2 S içeren jeotermal sularında ise H 2 S ün çökeltilmesi ve oksidasyonu için kullanılmaktadır. H 2 S, ZnS olarak çöker ve H 2 S sülfata veya elementel sülfüre okside olabilir. ZnS fotokatalitik hidrojen üretiminde kullanılan bir katalizördür. Yükseltgenme ve indirgenme basamakları ile hidrojen üretimi aşağıdaki yarı reaksiyonlar ile şu şekilde yazılabilir: 2ZnCl + 2H 2 O 2ZnO + Cl 2 + 2H 2 (yükseltgenme) (4.32) ZnS + H 2 O ZnO + S + H 2 (yükseltgenme) (4.33) ZnS + H 2 Zn + H 2 S (indirgenme) (4.34)
106 88 Şekil 4.35 de Zn-H 2 O sistemine ait Pourbaix Diyagramı görülmektedir. Şekil Zn-H 2 O sistemine ait Pourbaix Diyagramı
107 89 Şekil 4.36 da çinko elektrodun deniz suyu ve Na 2 S ilave edilen çözelti içinde farklı ph larda alınan Tafel eğrileri görülmektedir. Şekil Zn elektrodun deniz suyu + 0, M Na 2 S içerisinde ph=8, ph=11, ph=12 ve ph=14 deki Tafel eğrileri Çinko elektrodun Na 2 S içeren ph<14 çözelti ortamında çinkonun hiçbir anodik davranış göstermediği anlaşılmaktadır. Hidrojen oluşum potansiyelinde pik vermesi hidroliz katalizörü olduğunu göstermektedir. ph=14 değerinde ise H 2 S gazı üretmektedir.
BARTIN ÜNİVERSİTESİ MÜHENDİSLİK FAKÜLTESİ METALURJİ VE MALZEME MÜHENDİSLİĞİ MALZEME LABORATUARI II DERSİ AKIMLI VE AKIMSIZ KAPLAMALAR DENEY FÖYÜ
 BARTIN ÜNİVERSİTESİ MÜHENDİSLİK FAKÜLTESİ METALURJİ VE MALZEME MÜHENDİSLİĞİ MALZEME LABORATUARI II DERSİ AKIMLI VE AKIMSIZ KAPLAMALAR DENEY FÖYÜ Gelişen teknoloji ile beraber birçok endüstri alanında kullanılabilecek
BARTIN ÜNİVERSİTESİ MÜHENDİSLİK FAKÜLTESİ METALURJİ VE MALZEME MÜHENDİSLİĞİ MALZEME LABORATUARI II DERSİ AKIMLI VE AKIMSIZ KAPLAMALAR DENEY FÖYÜ Gelişen teknoloji ile beraber birçok endüstri alanında kullanılabilecek
VIA GRUBU ELEMENTLERİ
 Bölüm 8 VIA GRUBU ELEMENTLERİ Bu slaytlarda anlatılanlar sadece özet olup ayrıntılı bilgiler derste verilecektir. O, S, Se, Te, Po O ve S: Ametal Se ve Te: Yarı metal Po: Metal *Oksijen genellikle bileşiklerinde
Bölüm 8 VIA GRUBU ELEMENTLERİ Bu slaytlarda anlatılanlar sadece özet olup ayrıntılı bilgiler derste verilecektir. O, S, Se, Te, Po O ve S: Ametal Se ve Te: Yarı metal Po: Metal *Oksijen genellikle bileşiklerinde
Bölüm 2. Bu slaytlarda anlatılanlar sadece özet olup ayrıntılı bilgiler derste verilecektir.
 Bölüm 2 Bu slaytlarda anlatılanlar sadece özet olup ayrıntılı bilgiler derste verilecektir. *Hidrojen evrende en bol bulunan elementtir (%70). Dünyada ise oksijendir. Tüm yıldızlar ve birçok gezegen çok
Bölüm 2 Bu slaytlarda anlatılanlar sadece özet olup ayrıntılı bilgiler derste verilecektir. *Hidrojen evrende en bol bulunan elementtir (%70). Dünyada ise oksijendir. Tüm yıldızlar ve birçok gezegen çok
MEMM4043 metallerin yeniden kazanımı
 metallerin yeniden kazanımı 2016-2017 güz yy. Prof. Dr. Gökhan Orhan MF212 katot - + Cu + H 2+ SO 2-4 OH- Anot Reaksiyonu Cu - 2e - Cu 2+ E 0 = + 0,334 Anot Reaksiyonu 2H 2 O O 2 + 4H + + 4e - E 0 = 1,229-0,0591pH
metallerin yeniden kazanımı 2016-2017 güz yy. Prof. Dr. Gökhan Orhan MF212 katot - + Cu + H 2+ SO 2-4 OH- Anot Reaksiyonu Cu - 2e - Cu 2+ E 0 = + 0,334 Anot Reaksiyonu 2H 2 O O 2 + 4H + + 4e - E 0 = 1,229-0,0591pH
HİDROJEN ÜRETİMİ BUĞRA DOĞUKAN CANPOLAT
 1 HİDROJEN ÜRETİMİ BUĞRA DOĞUKAN CANPOLAT 16360018 2 HİDROJEN ÜRETİMİ HİDROJEN KAYNAĞI HİDROKARBONLARIN BUHARLA İYİLEŞTİRİMESİ KISMİ OKSİDASYON DOĞAL GAZ İÇİN TERMAL KRAKİNG KÖMÜR GAZLAŞTIRMA BİYOKÜTLE
1 HİDROJEN ÜRETİMİ BUĞRA DOĞUKAN CANPOLAT 16360018 2 HİDROJEN ÜRETİMİ HİDROJEN KAYNAĞI HİDROKARBONLARIN BUHARLA İYİLEŞTİRİMESİ KISMİ OKSİDASYON DOĞAL GAZ İÇİN TERMAL KRAKİNG KÖMÜR GAZLAŞTIRMA BİYOKÜTLE
KANALİZASYONLARDA HİDROJEN SÜLFÜR GAZI OLUŞUMU SAĞLIK ÜZERİNE ETKİLERİ
 KANALİZASYONLARDA HİDROJEN SÜLFÜR GAZI OLUŞUMU SAĞLIK ÜZERİNE ETKİLERİ Bu Çalışma Çevre Orman Bakanlığı Müsteşar Yardımcısı Sayın Prof. Dr. Mustafa Öztürk tarafından 2006 yılında yapılmıştır. Orijinal
KANALİZASYONLARDA HİDROJEN SÜLFÜR GAZI OLUŞUMU SAĞLIK ÜZERİNE ETKİLERİ Bu Çalışma Çevre Orman Bakanlığı Müsteşar Yardımcısı Sayın Prof. Dr. Mustafa Öztürk tarafından 2006 yılında yapılmıştır. Orijinal
YAKIT PİLLERİ. Cihat DEMİREL
 YAKIT PİLLERİ Cihat DEMİREL 16360030 İçindekiler Yakıt pilleri nasıl çalışır? Yakıt Pili Çalışma Prensibi Yakıt pilleri avantaj ve dezavantajları nelerdir? 2 Yakıt Pilleri Nasıl Çalışır? Tükenmez ve hiç
YAKIT PİLLERİ Cihat DEMİREL 16360030 İçindekiler Yakıt pilleri nasıl çalışır? Yakıt Pili Çalışma Prensibi Yakıt pilleri avantaj ve dezavantajları nelerdir? 2 Yakıt Pilleri Nasıl Çalışır? Tükenmez ve hiç
Biyogaz Temel Eğitimi
 Biyogaz Temel Eğitimi Sunanlar: Dursun AYDÖNER Proje Müdürü Rasim ÜNER Is Gelistime ve Pazarlama Müdürü Biyogaz Temel Eğitimi 1.Biyogaz Nedir? 2.Biyogaz Nasıl Oluşur? 3.Biyogaz Tesisi - Biyogaz Tesis Çeşitleri
Biyogaz Temel Eğitimi Sunanlar: Dursun AYDÖNER Proje Müdürü Rasim ÜNER Is Gelistime ve Pazarlama Müdürü Biyogaz Temel Eğitimi 1.Biyogaz Nedir? 2.Biyogaz Nasıl Oluşur? 3.Biyogaz Tesisi - Biyogaz Tesis Çeşitleri
HAZIRLAYAN Mutlu ŞAHİN. Hacettepe Fen Bilgisi Öğretmenliği. DENEY NO: 6 DENEYİN ADI: DOYMUŞ NaCl ÇÖZELTİSİNİN ELEKTROLİZİ
 HAZIRLAYAN Mutlu ŞAHİN Hacettepe Fen Bilgisi Öğretmenliği DENEY NO: 6 DENEYİN ADI: DOYMUŞ NaCl ÇÖZELTİSİNİN ELEKTROLİZİ DENEYİN AMACI: Doymuş NaCl çözeltisinin elektroliz sonucu elementlerine ayrışmasının
HAZIRLAYAN Mutlu ŞAHİN Hacettepe Fen Bilgisi Öğretmenliği DENEY NO: 6 DENEYİN ADI: DOYMUŞ NaCl ÇÖZELTİSİNİN ELEKTROLİZİ DENEYİN AMACI: Doymuş NaCl çözeltisinin elektroliz sonucu elementlerine ayrışmasının
20.11.2014. Sülfirik Asit. Kükürtten Geri kazanım Pirit H2S
 Sülfirik Asit Kükürtten Geri kazanım Pirit H2S Kükürt, limon sarısında ametal, yalın katı cisimdir. Kükürt doğada yaygın olarak bulunan bir elementtir (yer kürenin % 0,06'sını oluşturur). Özellikle en
Sülfirik Asit Kükürtten Geri kazanım Pirit H2S Kükürt, limon sarısında ametal, yalın katı cisimdir. Kükürt doğada yaygın olarak bulunan bir elementtir (yer kürenin % 0,06'sını oluşturur). Özellikle en
MEMM4043 metallerin yeniden kazanımı
 metallerin yeniden kazanımı Endüstriyel Atık Sulardan Metal Geri Kazanım Yöntemleri 2016-2017 güz yy. Prof. Dr. Gökhan Orhan MF212 Atıksularda Ağır Metal Konsantrasyonu Mekanik Temizleme Kimyasal Temizleme
metallerin yeniden kazanımı Endüstriyel Atık Sulardan Metal Geri Kazanım Yöntemleri 2016-2017 güz yy. Prof. Dr. Gökhan Orhan MF212 Atıksularda Ağır Metal Konsantrasyonu Mekanik Temizleme Kimyasal Temizleme
Ayxmaz/biyoloji. Azot döngüsü. Azot kaynakları 1. Atmosfer 2. Su 3. Kara 4. Canlılar. Azot döngüsü
 Azot döngüsü Azot kaynakları 1. Atmosfer 2. Su 3. Kara 4. Canlılar Azot döngüsü 1. Azot bitkiler tarafından organik moleküllerin (A.asit,organik baz vb.)yapısına katılır. 2. Bitkiler azotu sadece NO3-
Azot döngüsü Azot kaynakları 1. Atmosfer 2. Su 3. Kara 4. Canlılar Azot döngüsü 1. Azot bitkiler tarafından organik moleküllerin (A.asit,organik baz vb.)yapısına katılır. 2. Bitkiler azotu sadece NO3-
1.10.2015. Kömür ve Doğalgaz. Öğr. Gör. Onur BATTAL
 Kömür ve Doğalgaz Öğr. Gör. Onur BATTAL 1 2 Kömür yanabilen sedimanter organik bir kayadır. Kömür başlıca karbon, hidrojen ve oksijen gibi elementlerin bileşiminden oluşmuş, diğer kaya tabakalarının arasında
Kömür ve Doğalgaz Öğr. Gör. Onur BATTAL 1 2 Kömür yanabilen sedimanter organik bir kayadır. Kömür başlıca karbon, hidrojen ve oksijen gibi elementlerin bileşiminden oluşmuş, diğer kaya tabakalarının arasında
Türkiye nin Elektrik Üretimi ve Tüketimi
 Türkiye nin Elektrik Üretimi ve Tüketimi -Çimento Sanayinde Enerji Geri Kazanımı Prof. Dr. İsmail Hakkı TAVMAN Dokuz Eylül Üniversitesi Makine Mühendisliği Bölümü Enerji Kaynakları Kullanışlarına Göre
Türkiye nin Elektrik Üretimi ve Tüketimi -Çimento Sanayinde Enerji Geri Kazanımı Prof. Dr. İsmail Hakkı TAVMAN Dokuz Eylül Üniversitesi Makine Mühendisliği Bölümü Enerji Kaynakları Kullanışlarına Göre
Ekosistem ve Özellikleri
 Ekosistem ve Özellikleri Öğr. Gör. Özgür ZEYDAN http://cevre.beun.edu.tr/zeydan/ Ekosistem Belirli bir bölgede yaşayan ve birbirleriyle sürekli etkileşim halindeki canlılar (biyotik faktörler) ve cansız
Ekosistem ve Özellikleri Öğr. Gör. Özgür ZEYDAN http://cevre.beun.edu.tr/zeydan/ Ekosistem Belirli bir bölgede yaşayan ve birbirleriyle sürekli etkileşim halindeki canlılar (biyotik faktörler) ve cansız
FOSİL YAKITLARIN YANMASI
 Kömür, sıvı yakıtlar ve doğal gazın yakılması sırasında açığa çıkan bazı gazların zehirleyici etkileri ve çevre için zararları vardır. Kükürtdioksit (SO 2 ) ve (NO x ) ler bu zararlı gazların miktar ve
Kömür, sıvı yakıtlar ve doğal gazın yakılması sırasında açığa çıkan bazı gazların zehirleyici etkileri ve çevre için zararları vardır. Kükürtdioksit (SO 2 ) ve (NO x ) ler bu zararlı gazların miktar ve
İÇİNDEKİLER 2
 Özgür Deniz KOÇ 1 İÇİNDEKİLER 2 3 4 5 6 Elektrotlar Katalizörler Elektrolit Çalışma Sıcaklığı Karbon Nikel, Ag, Metal oksit, Soy Metaller KOH(potasyum hidroksit) Çözeltisi 60-90 C (pot. 20-250 C) Verimlilik
Özgür Deniz KOÇ 1 İÇİNDEKİLER 2 3 4 5 6 Elektrotlar Katalizörler Elektrolit Çalışma Sıcaklığı Karbon Nikel, Ag, Metal oksit, Soy Metaller KOH(potasyum hidroksit) Çözeltisi 60-90 C (pot. 20-250 C) Verimlilik
Akvaryum veya küçük havuzlarda amonyağın daha az zehirli olan nitrit ve nitrata dönüştürülmesi için gerekli olan bakteri populasyonunu (nitrifikasyon
 Azotlu bileşikler Ticari balık havuzlarında iyonize olmuş veya iyonize olmamış amonyağın konsantrasyonlarını azaltmak için pratik bir yöntem yoktur. Balık havuzlarında stoklama ve yemleme oranlarının azaltılması
Azotlu bileşikler Ticari balık havuzlarında iyonize olmuş veya iyonize olmamış amonyağın konsantrasyonlarını azaltmak için pratik bir yöntem yoktur. Balık havuzlarında stoklama ve yemleme oranlarının azaltılması
Sülfirik Asit. Kükürtten Geri kazanım Pirit H2S
 Sülfirik Asit Kükürtten Geri kazanım Pirit H2S Kükürt, limon sarısında ametal, yalın katı cisimdir. Kükürt doğada yaygın olarak bulunan bir elementtir (yer kürenin % 0,06'sını oluşturur). Özellikle en
Sülfirik Asit Kükürtten Geri kazanım Pirit H2S Kükürt, limon sarısında ametal, yalın katı cisimdir. Kükürt doğada yaygın olarak bulunan bir elementtir (yer kürenin % 0,06'sını oluşturur). Özellikle en
İÇERİK. Amaç Yanma Dizel motorlardan kaynaklanan emisyonlar Dizel motor kaynaklı emisyonların insan ve çevre sağlığına etkileri Sonuç
 SAKARYA 2011 İÇERİK Amaç Yanma Dizel motorlardan kaynaklanan emisyonlar Dizel motor kaynaklı emisyonların insan ve çevre sağlığına etkileri Sonuç Yanma prosesinin incelenmesi ve temel yanma ürünleri Sıkıştırmalı
SAKARYA 2011 İÇERİK Amaç Yanma Dizel motorlardan kaynaklanan emisyonlar Dizel motor kaynaklı emisyonların insan ve çevre sağlığına etkileri Sonuç Yanma prosesinin incelenmesi ve temel yanma ürünleri Sıkıştırmalı
Enerji Kaynakları ENERJİ 1) YENİLENEMEZ ENERJİ KAYNAKLARI 2) YENİLENEBİLİR ENERJİ KAYNAKLARI
 ENERJİ Enerji, iş yapabilme kabiliyetidir. Bir sistemin enerjisi, o sistemin yapabileceği azami iştir Enerji Kaynakları 1) YENİLENEMEZ ENERJİ KAYNAKLARI 2) YENİLENEBİLİR ENERJİ KAYNAKLARI YENİLENEMEZ ENERJİ
ENERJİ Enerji, iş yapabilme kabiliyetidir. Bir sistemin enerjisi, o sistemin yapabileceği azami iştir Enerji Kaynakları 1) YENİLENEMEZ ENERJİ KAYNAKLARI 2) YENİLENEBİLİR ENERJİ KAYNAKLARI YENİLENEMEZ ENERJİ
SORULAR. 2- Termik santrallerden kaynaklanan atıklar nelerdir? 4- Zehirli gazların insanlar üzerindeki etkileri oranlara göre nasıl değişir?
 SORULAR 1- Termik enerji nedir? 2- Termik santrallerden kaynaklanan atıklar nelerdir? 3- Gaz atıklar nelerdir? 4- Zehirli gazların insanlar üzerindeki etkileri oranlara göre nasıl değişir? 5- Bir termik
SORULAR 1- Termik enerji nedir? 2- Termik santrallerden kaynaklanan atıklar nelerdir? 3- Gaz atıklar nelerdir? 4- Zehirli gazların insanlar üzerindeki etkileri oranlara göre nasıl değişir? 5- Bir termik
Şekilde görüldüğü gibi Gerilim/akım yoğunluğu karakteristik eğrisi dört nedenden dolayi meydana gelir.
 Bir fuel cell in teorik açık devre gerilimi: Formülüne göre 100 oc altinda yaklaşık 1.2 V dur. Fakat gerçekte bu değere hiçbir zaman ulaşılamaz. Şekil 3.1 de normal hava basıncında ve yaklaşık 70 oc da
Bir fuel cell in teorik açık devre gerilimi: Formülüne göre 100 oc altinda yaklaşık 1.2 V dur. Fakat gerçekte bu değere hiçbir zaman ulaşılamaz. Şekil 3.1 de normal hava basıncında ve yaklaşık 70 oc da
ELEKTROLİTİK TOZ ÜRETİM TEKNİKLERİ. Prof.Dr.Muzaffer ZEREN
 Prof.Dr.Muzaffer ZEREN Bir çok metal (yaklaşık 60) elektroliz ile toz haline getirilebilir. Elektroliz kapalı devre çalışan ve çevre kirliliğine duyarlı bir yöntemdir. Kurulum maliyeti ve uygulama maliyeti
Prof.Dr.Muzaffer ZEREN Bir çok metal (yaklaşık 60) elektroliz ile toz haline getirilebilir. Elektroliz kapalı devre çalışan ve çevre kirliliğine duyarlı bir yöntemdir. Kurulum maliyeti ve uygulama maliyeti
Yanma Kaynaklı Kirleticiler
 Dokuz Eylül Üniversitesi, Mühendislik Fakültesi, Çevre Mühendisliği Bölümü, Buca/İZMİR Yanma Kaynaklı Kirleticiler Prof.Dr. Abdurrahman BAYRAM Telefon: 0232 3017113-3017080 Faks: 0232 4530922 E-Mail: abayram@deu.edu.tr
Dokuz Eylül Üniversitesi, Mühendislik Fakültesi, Çevre Mühendisliği Bölümü, Buca/İZMİR Yanma Kaynaklı Kirleticiler Prof.Dr. Abdurrahman BAYRAM Telefon: 0232 3017113-3017080 Faks: 0232 4530922 E-Mail: abayram@deu.edu.tr
Öğretim Üyeleri İçin Ön Söz Öğrenciler İçin Ön Söz Teşekkürler Yazar Hakkında Çevirenler Çeviri Editöründen
 Öğretim Üyeleri İçin Ön Söz Öğrenciler İçin Ön Söz Teşekkürler Yazar Hakkında Çevirenler Çeviri Editöründen ix xiii xv xvii xix xxi 1. Çevre Kimyasına Giriş 3 1.1. Çevre Kimyasına Genel Bakış ve Önemi
Öğretim Üyeleri İçin Ön Söz Öğrenciler İçin Ön Söz Teşekkürler Yazar Hakkında Çevirenler Çeviri Editöründen ix xiii xv xvii xix xxi 1. Çevre Kimyasına Giriş 3 1.1. Çevre Kimyasına Genel Bakış ve Önemi
a. Yükseltgenme potansiyeli büyük olanlar daha aktifdir.
 ELEKTROKİMYA A. AKTİFLİK B. PİLLER C. ELEKTROLİZ A. AKTİFLİK Metallerin elektron verme, ametallerin elektron alma yatkınlıklarına aktiflik denir. Yani bir metal ne kadar kolay elektron veriyorsa bir ametal
ELEKTROKİMYA A. AKTİFLİK B. PİLLER C. ELEKTROLİZ A. AKTİFLİK Metallerin elektron verme, ametallerin elektron alma yatkınlıklarına aktiflik denir. Yani bir metal ne kadar kolay elektron veriyorsa bir ametal
TOPRAK TOPRAK TEKSTÜRÜ (BÜNYESİ)
 TOPRAK Toprak esas itibarı ile uzun yılların ürünü olan, kayaların ve organik maddelerin türlü çaptaki ayrışma ürünlerinden meydana gelen, içinde geniş bir canlılar âlemini barındırarak bitkilere durak
TOPRAK Toprak esas itibarı ile uzun yılların ürünü olan, kayaların ve organik maddelerin türlü çaptaki ayrışma ürünlerinden meydana gelen, içinde geniş bir canlılar âlemini barındırarak bitkilere durak
KİMYA II DERS NOTLARI
 KİMYA II DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN Genel anlamda elektrokimya elektrik enerjisi üreten veya harcayan redoks reaksiyonlarını inceler. Elektrokimya pratikte büyük öneme sahip bir konudur. Piller,
KİMYA II DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN Genel anlamda elektrokimya elektrik enerjisi üreten veya harcayan redoks reaksiyonlarını inceler. Elektrokimya pratikte büyük öneme sahip bir konudur. Piller,
Kırılma Noktası Klorlaması
 Kırılma Noktası Klorlaması AMAÇ Farklı oranlarda klor ile amonyağın reaksiyon vermesi sonucu oluşan kalıntı klor ölçümünün yapılması ve verilerin grafiğe aktarılarak kırılma noktasının belirlenmesi. ÖN
Kırılma Noktası Klorlaması AMAÇ Farklı oranlarda klor ile amonyağın reaksiyon vermesi sonucu oluşan kalıntı klor ölçümünün yapılması ve verilerin grafiğe aktarılarak kırılma noktasının belirlenmesi. ÖN
ÇEVRE MÜHENDĠSLĠĞĠ BÖLÜMÜ 0010020036 KODLU TEMEL ĠġLEMLER-1 LABORATUVAR DERSĠ DENEY FÖYÜ
 DENEY NO: 5 HAVAANDIRMA ÇEVRE MÜHENDĠSĠĞĠ BÖÜMÜ Çevre Mühendisi atmosfer şartlarında suda çözünmüş oksijen ile yakından ilgilidir. Çözünmüş oksijen (Ç.O) su içinde çözünmüş halde bulunan oksijen konsantrasyonu
DENEY NO: 5 HAVAANDIRMA ÇEVRE MÜHENDĠSĠĞĠ BÖÜMÜ Çevre Mühendisi atmosfer şartlarında suda çözünmüş oksijen ile yakından ilgilidir. Çözünmüş oksijen (Ç.O) su içinde çözünmüş halde bulunan oksijen konsantrasyonu
SU ÜRÜNLERİNDE MEKANİZASYON-2
 SU ÜRÜNLERİNDE MEKANİZASYON-2 Yrd.Doç.Dr. Mehmet Ali Dayıoğlu Ankara Üniversitesi Ziraat Fakültesi Tarım Makinaları & Teknolojileri Mühendisliği Bölümü Kaynak: YENİLENEBİLİR ENERJİ KAYNAKLARI VE TEKNOLOJİLERİ
SU ÜRÜNLERİNDE MEKANİZASYON-2 Yrd.Doç.Dr. Mehmet Ali Dayıoğlu Ankara Üniversitesi Ziraat Fakültesi Tarım Makinaları & Teknolojileri Mühendisliği Bölümü Kaynak: YENİLENEBİLİR ENERJİ KAYNAKLARI VE TEKNOLOJİLERİ
Kimyasal Toprak Sorunları ve Toprak Bozunumu-I
 Kimyasal Toprak Sorunları ve Toprak Bozunumu-I asitleşme-alkalileşme (tuzluluk-alkalilik) ve düşük toprak verimliliği Doç. Dr. Oğuz Can TURGAY ZTO321 Toprak İyileştirme Yöntemleri Toprak Kimyasal Özellikleri
Kimyasal Toprak Sorunları ve Toprak Bozunumu-I asitleşme-alkalileşme (tuzluluk-alkalilik) ve düşük toprak verimliliği Doç. Dr. Oğuz Can TURGAY ZTO321 Toprak İyileştirme Yöntemleri Toprak Kimyasal Özellikleri
Elektrot Potansiyeli. (k) (k) (k) Tepkime vermez
 Elektrot Potansiyeli Uzun metal parçası, M, elektrokimyasal çalışmalarda kullanıldığında elektrot adını alır. M n+ metal iyonları içeren bir çözeltiye daldırılan bir elektrot bir yarı-hücre oluşturur.
Elektrot Potansiyeli Uzun metal parçası, M, elektrokimyasal çalışmalarda kullanıldığında elektrot adını alır. M n+ metal iyonları içeren bir çözeltiye daldırılan bir elektrot bir yarı-hücre oluşturur.
ÇEV416 ENDÜSTRİYEL ATIKSULARIN ARITILMASI
 ÇEV416 ENDÜSTRİYEL ATIKSULARIN ARITILMASI 6.Endüstriyel Kirlenme Kontrolü - Nötralizasyon Yrd. Doç. Dr. Kadir GEDİK Birçok endüstrinin atıksuyu asidik veya bazik olduğundan alıcı ortama veya kimyasal ve/veya
ÇEV416 ENDÜSTRİYEL ATIKSULARIN ARITILMASI 6.Endüstriyel Kirlenme Kontrolü - Nötralizasyon Yrd. Doç. Dr. Kadir GEDİK Birçok endüstrinin atıksuyu asidik veya bazik olduğundan alıcı ortama veya kimyasal ve/veya
İÇ SU BALIKLARI YETİŞTİRİCİLİĞİNDE SU KALİTESİ
 İÇ SU BALIKLARI YETİŞTİRİCİLİĞİNDE SU KALİTESİ Karada bir su ürünleri işletmesi kurulacaksa, su kaynağı olarak kaynak suyu, dere, ırmak, akarsu, göl, baraj suları veya yeraltı suları kullanılabilir. Yetiştiriciliğin
İÇ SU BALIKLARI YETİŞTİRİCİLİĞİNDE SU KALİTESİ Karada bir su ürünleri işletmesi kurulacaksa, su kaynağı olarak kaynak suyu, dere, ırmak, akarsu, göl, baraj suları veya yeraltı suları kullanılabilir. Yetiştiriciliğin
HİDROJEN SÜLFÜR GİDERİM YÖNTEMLERİ ve ÇEVRE AÇISINDAN DEĞERLENDİRİLMESİ
 Hava Kirliliği ve Kontrolü Ulusal Sempozyumu 2008, 22 25 Ekim 2008, HATAY HİDROJEN SÜLFÜR GİDERİM YÖNTEMLERİ ve ÇEVRE AÇISINDAN DEĞERLENDİRİLMESİ Berceste BEYRİBEY (*), Zehra ALTIN, Burcu ÇORBACIOĞLU,
Hava Kirliliği ve Kontrolü Ulusal Sempozyumu 2008, 22 25 Ekim 2008, HATAY HİDROJEN SÜLFÜR GİDERİM YÖNTEMLERİ ve ÇEVRE AÇISINDAN DEĞERLENDİRİLMESİ Berceste BEYRİBEY (*), Zehra ALTIN, Burcu ÇORBACIOĞLU,
1) Biyokütleye Uygulanan Fiziksel Prosesler
 1) Biyokütleye Uygulanan Fiziksel Prosesler 1. Su giderme 2. Kurutma 3. Boyut küçültme 4. Yoğunlaştırma 5. Ayırma Su giderme işleminde nem, sıvı fazda gideriliyor. Kurutma işleminde nem, buhar fazda gideriliyor.
1) Biyokütleye Uygulanan Fiziksel Prosesler 1. Su giderme 2. Kurutma 3. Boyut küçültme 4. Yoğunlaştırma 5. Ayırma Su giderme işleminde nem, sıvı fazda gideriliyor. Kurutma işleminde nem, buhar fazda gideriliyor.
ÇEV416 ENDÜSTRİYEL ATIKSULARIN ARITILMASI
 ÇEV416 ENDÜSTRİYEL ATIKSULARIN ARITILMASI 9.Çözünmüş İnorganik ve Organik Katıların Giderimi Yrd. Doç. Dr. Kadir GEDİK İnorganiklerin Giderimi Çözünmüş maddelerin çapları
ÇEV416 ENDÜSTRİYEL ATIKSULARIN ARITILMASI 9.Çözünmüş İnorganik ve Organik Katıların Giderimi Yrd. Doç. Dr. Kadir GEDİK İnorganiklerin Giderimi Çözünmüş maddelerin çapları
ENERJİ YÖNETİMİ VE POLİTİKALARI
 ENERJİ YÖNETİMİ VE POLİTİKALARI KAZANLARDA ENERJİ VERİMLİLİĞİ ÖĞRENCİNİN ADI:KUBİLAY SOY ADI:KOÇ NUMARASI:15360038 KAZANLAR Yakıtın kimyasal enerjisini yanma yoluyla ısı enerjisine dönüştüren ve bu ısı
ENERJİ YÖNETİMİ VE POLİTİKALARI KAZANLARDA ENERJİ VERİMLİLİĞİ ÖĞRENCİNİN ADI:KUBİLAY SOY ADI:KOÇ NUMARASI:15360038 KAZANLAR Yakıtın kimyasal enerjisini yanma yoluyla ısı enerjisine dönüştüren ve bu ısı
Biyogaz Yakıtlı Kojenerasyon Uygulamaları
 Biyogaz Yakıtlı Kojenerasyon Uygulamaları Sedat Akar Turkoted Yönetim Kurulu Üyesi Biyogaz Nedir? Biyogaz, mikrobiyolojik floranın etkisi altındaki organik maddelerin oksijensiz bir ortamda çürütülmesi
Biyogaz Yakıtlı Kojenerasyon Uygulamaları Sedat Akar Turkoted Yönetim Kurulu Üyesi Biyogaz Nedir? Biyogaz, mikrobiyolojik floranın etkisi altındaki organik maddelerin oksijensiz bir ortamda çürütülmesi
Çizelge 2.6. Farklı ph ve su sıcaklığı değerlerinde amonyak düzeyi (toplam amonyağın yüzdesi olarak) (Boyd 2008a)
 - Azotlu bileşikler Su ürünleri yetiştiricilik sistemlerinde oksijen gereksinimi karşılandığı takdirde üretimi sınırlayan ikinci faktör azotlu bileşiklerin birikimidir. Ana azotlu bileşikler; azot gazı
- Azotlu bileşikler Su ürünleri yetiştiricilik sistemlerinde oksijen gereksinimi karşılandığı takdirde üretimi sınırlayan ikinci faktör azotlu bileşiklerin birikimidir. Ana azotlu bileşikler; azot gazı
Çevre Biyolojisi
 Çevre Biyolojisi 115-02 Bölüm 03-02 Temel Ekolojik Kavramlar ve Süreçler Çağatay Tavşanoğlu 2017-2018 Güz Biyojeokimyasal döngüler ve madde geri kazanımı Ekosistem boyunca enerji akışı tek yönlü bir süreçtir
Çevre Biyolojisi 115-02 Bölüm 03-02 Temel Ekolojik Kavramlar ve Süreçler Çağatay Tavşanoğlu 2017-2018 Güz Biyojeokimyasal döngüler ve madde geri kazanımı Ekosistem boyunca enerji akışı tek yönlü bir süreçtir
Doğal Rb elementinin atom kütlesi 85,47 g/mol dür ve atom kütleleri 84,91 g/mol olan 86 Rb ile 86,92 olan 87
 Doğal Rb elementinin atom kütlesi 85,47 g/mol dür ve atom kütleleri 84,91 g/mol olan 86 Rb ile 86,92 olan 87 Rb izotoplarından oluşmuştur. İzotopların doğada bulunma yüzdelerini hesaplayınız. Bir bileşik
Doğal Rb elementinin atom kütlesi 85,47 g/mol dür ve atom kütleleri 84,91 g/mol olan 86 Rb ile 86,92 olan 87 Rb izotoplarından oluşmuştur. İzotopların doğada bulunma yüzdelerini hesaplayınız. Bir bileşik
I.6. METEOROLOJİ VE HAVA KİRLİLİĞİ
 I.6. METEOROLOJİ VE HAVA KİRLİLİĞİ Meteorolojik şartlar, hava kirliliğinin sadece can sıkıcı bir durum veya insan sağlığı için ciddi bir tehdit olduğunu belirler. Fotokimyasal dumanın negatif etkileri
I.6. METEOROLOJİ VE HAVA KİRLİLİĞİ Meteorolojik şartlar, hava kirliliğinin sadece can sıkıcı bir durum veya insan sağlığı için ciddi bir tehdit olduğunu belirler. Fotokimyasal dumanın negatif etkileri
Malzeme Bilimi Ve Laboratuvarı KOROZYON. Sakarya Üniversitesi Teknoloji Fakültesi
 Malzeme Bilimi Ve Laboratuvarı KOROZYON Sakarya Üniversitesi Teknoloji Fakültesi Korozyon Tabiatta hemen hemen tamamı bileşik halde bulunan metallerin tabii hallerine dönüş çabasına korozyon denilebilir.
Malzeme Bilimi Ve Laboratuvarı KOROZYON Sakarya Üniversitesi Teknoloji Fakültesi Korozyon Tabiatta hemen hemen tamamı bileşik halde bulunan metallerin tabii hallerine dönüş çabasına korozyon denilebilir.
TÜRKIYE NİN MEVCUT ENERJİ DURUMU
 TÜRKIYE NİN MEVCUT ENERJİ DURUMU Zinnur YILMAZ* *Cumhuriyet Üniversitesi, Mühendislik Fakültesi, Çevre Mühendisliği Bölümü, SİVAS E-mail: zinnuryilmaz@cumhuriyet.edu.tr, Tel: 0346 219 1010/2476 Özet Yüzyıllardan
TÜRKIYE NİN MEVCUT ENERJİ DURUMU Zinnur YILMAZ* *Cumhuriyet Üniversitesi, Mühendislik Fakültesi, Çevre Mühendisliği Bölümü, SİVAS E-mail: zinnuryilmaz@cumhuriyet.edu.tr, Tel: 0346 219 1010/2476 Özet Yüzyıllardan
KATI ATIKLARDAN ENERJİ ELDE EDİLMESİ
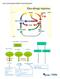 KATI ATIKLARDAN ENERJİ ELDE EDİLMESİ Atıktan enerji elde edilmesi, atıkların fazla oksijen varlığında yüksek sıcaklıkta yakılması prosesidir. Yanma ürünleri, ısı enerjisi, inert gaz ve kül şeklinde sayılabilir.
KATI ATIKLARDAN ENERJİ ELDE EDİLMESİ Atıktan enerji elde edilmesi, atıkların fazla oksijen varlığında yüksek sıcaklıkta yakılması prosesidir. Yanma ürünleri, ısı enerjisi, inert gaz ve kül şeklinde sayılabilir.
BÖLÜM. Elektrotlar ve Elektrokimyasal Hücreler 1. ÜNİTE İÇERİK Elektrot ve Elektrolit Yarı Hücre ve Hücre
 1. 2 1. İÇERİK 1.2.1 Elektrot ve Elektrolit 1.2.2 Yarı Hücre ve Hücre Elektrotlar ve Elektrokimyasal Hücreler Bitkilerin fotosentez yapması, metallerin arıtılması, yakıt hücrelerinin görev yapması gibi
1. 2 1. İÇERİK 1.2.1 Elektrot ve Elektrolit 1.2.2 Yarı Hücre ve Hücre Elektrotlar ve Elektrokimyasal Hücreler Bitkilerin fotosentez yapması, metallerin arıtılması, yakıt hücrelerinin görev yapması gibi
ATIKTAN ENERJİYE: MUZ KABUĞUNUN ALTERNATİF ENERJİ KAYNAĞI OLARAK YAKIT PİLLERİNDE DEĞERLENDİRİLMESİ
 ATIKTAN ENERJİYE: MUZ KABUĞUNUN ALTERNATİF ENERJİ KAYNAĞI OLARAK YAKIT PİLLERİNDE DEĞERLENDİRİLMESİ Hazırlayan Öğrenciler Oğuzhan YILDIRIM 8-C Gökhan ÇETİN 8-C Danışman Öğretmen Melike TURAN İZMİR, 2014
ATIKTAN ENERJİYE: MUZ KABUĞUNUN ALTERNATİF ENERJİ KAYNAĞI OLARAK YAKIT PİLLERİNDE DEĞERLENDİRİLMESİ Hazırlayan Öğrenciler Oğuzhan YILDIRIM 8-C Gökhan ÇETİN 8-C Danışman Öğretmen Melike TURAN İZMİR, 2014
MODERN ENERJİ DEPOLAMA SİSTEMLERİ VE KULLANİM ALANLARİ
 MODERN ENERJİ DEPOLAMA SİSTEMLERİ VE KULLANİM ALANLARİ Muhammed Aydın ARSLAN 16360007 İÇERİK Hidrojen Depolama Sistemleri Batarya Volan Süper Kapasitörler Süper İletken Manyetik Enerji Depolama HİDROJEN
MODERN ENERJİ DEPOLAMA SİSTEMLERİ VE KULLANİM ALANLARİ Muhammed Aydın ARSLAN 16360007 İÇERİK Hidrojen Depolama Sistemleri Batarya Volan Süper Kapasitörler Süper İletken Manyetik Enerji Depolama HİDROJEN
Korozyon Hızı Ölçüm Metotları. Abdurrahman Asan
 Korozyon Hızı Ölçüm Metotları Abdurrahman Asan 1 Giriş Son zamanlara değin, korozyon hızının ölçülmesi, başlıca ağırlık azalması yöntemine dayanıyordu. Bu yöntemle, korozyon hızının duyarlı olarak belirlenmesi
Korozyon Hızı Ölçüm Metotları Abdurrahman Asan 1 Giriş Son zamanlara değin, korozyon hızının ölçülmesi, başlıca ağırlık azalması yöntemine dayanıyordu. Bu yöntemle, korozyon hızının duyarlı olarak belirlenmesi
ALTERNATİF ENERJİ KAYNAKLARI
 ALTERNATİF ENERJİ KAYNAKLARI KONULAR 1-Güneş Enerjisi i 2-Rüzgar Enerjisi 4-Jeotermal Enerji 3-Hidrolik Enerji 4-Biyokütle Enerjisi 5-Biyogaz Enerjisi 6-Biyodizel Enerjisi 7-Deniz Kökenli Enerji 8-Hidrojen
ALTERNATİF ENERJİ KAYNAKLARI KONULAR 1-Güneş Enerjisi i 2-Rüzgar Enerjisi 4-Jeotermal Enerji 3-Hidrolik Enerji 4-Biyokütle Enerjisi 5-Biyogaz Enerjisi 6-Biyodizel Enerjisi 7-Deniz Kökenli Enerji 8-Hidrojen
TAMGA ENDÜSTRİYEL KONTROL SİSTEMLERİ LTD.ŞTİ., ENERJİ YÖNETİMİNDE SINIRSIZ ÇÖZÜMLER SUNAR. HOŞGELDİNİZ
 TAMGA ENDÜSTRİYEL KONTROL SİSTEMLERİ LTD.ŞTİ., ENERJİ YÖNETİMİNDE SINIRSIZ ÇÖZÜMLER SUNAR. HOŞGELDİNİZ TAMGA TRİO YANMA VERİMİ Yakma ekipmanları tarafından yakıtın içerdiği enerjinin, ısı enerjisine dönüştürülme
TAMGA ENDÜSTRİYEL KONTROL SİSTEMLERİ LTD.ŞTİ., ENERJİ YÖNETİMİNDE SINIRSIZ ÇÖZÜMLER SUNAR. HOŞGELDİNİZ TAMGA TRİO YANMA VERİMİ Yakma ekipmanları tarafından yakıtın içerdiği enerjinin, ısı enerjisine dönüştürülme
HİDROJEN ENERJİSİ VE TÜRKİYE DEKİ HİDROJEN POTANSİYELİ
 HİDROJEN ENERJİSİ VE TÜRKİYE DEKİ HİDROJEN POTANSİYELİ Nihat ÖZTÜRK Mehmet BİLGİÇ Cemali ARSLAN Gazi Üniversitesi Teknik Eğitim Fakültesi Elektrik Eğitimi Bölümü 06500 Beşevler/ANKARA ozturk@gazi.edu.tr
HİDROJEN ENERJİSİ VE TÜRKİYE DEKİ HİDROJEN POTANSİYELİ Nihat ÖZTÜRK Mehmet BİLGİÇ Cemali ARSLAN Gazi Üniversitesi Teknik Eğitim Fakültesi Elektrik Eğitimi Bölümü 06500 Beşevler/ANKARA ozturk@gazi.edu.tr
Kimyasal Metalürji (II) (MET312)
 KARADENİZ TEKNİK ÜNİVERSİTESİ Metalürji ve Malzeme Mühendisliği Bölümü Kimyasal Metalürji (II) (MET312) Dersin Sorumlusu: Yrd. Doç. Dr. Saeid Pournaderi 2016 2017 Eğitim Yılı Bahar Dönemi Flaş-Fırın Mat
KARADENİZ TEKNİK ÜNİVERSİTESİ Metalürji ve Malzeme Mühendisliği Bölümü Kimyasal Metalürji (II) (MET312) Dersin Sorumlusu: Yrd. Doç. Dr. Saeid Pournaderi 2016 2017 Eğitim Yılı Bahar Dönemi Flaş-Fırın Mat
ENERJİ ÜRETİMİ VE ÇEVRESEL ETKİLERİ
 ENERJİ ÜRETİMİ VE ÇEVRESEL ETKİLERİ Prof. Dr. Ferruh Ertürk Doç. Dr. Atilla Akkoyunlu Çevre Yük. Müh. Kamil B. Varınca 31 Mart 2006 İstanbul İçindekiler İÇİNDEKİLER...İ ÇİZELGELER LİSTESİ...İİİ ŞEKİLLER
ENERJİ ÜRETİMİ VE ÇEVRESEL ETKİLERİ Prof. Dr. Ferruh Ertürk Doç. Dr. Atilla Akkoyunlu Çevre Yük. Müh. Kamil B. Varınca 31 Mart 2006 İstanbul İçindekiler İÇİNDEKİLER...İ ÇİZELGELER LİSTESİ...İİİ ŞEKİLLER
- Türkiye Denizlerinde Kirlenme Durumu
 - Türkiye Denizlerinde Kirlenme Durumu Marmara Denizi: Yaklaşık 11.352 km 2 'lik bir alan kaplayan Marmara Denizi hidrografik yapısı açısından tipik haliç özelliğine sahiptir. Karadeniz den yüzey akıntıları
- Türkiye Denizlerinde Kirlenme Durumu Marmara Denizi: Yaklaşık 11.352 km 2 'lik bir alan kaplayan Marmara Denizi hidrografik yapısı açısından tipik haliç özelliğine sahiptir. Karadeniz den yüzey akıntıları
HAZIRLAYAN Mutlu ŞAHİN. Hacettepe Fen Bilgisi Öğretmenliği
 HAZIRLAYAN Mutlu ŞAHİN Hacettepe Fen Bilgisi Öğretmenliği DENEY NO: 8 DENEYİN ADI: PİL VE AKÜ DENEYİN AMACI: PİL VE AKÜLERİN ÇALIŞMA SİSTEMİNİN VE KİMYASAL ENERJİNİN ELEKTRİK ENERJİSİNE DÖNÜŞÜMÜNÜN ANLAŞILMASI
HAZIRLAYAN Mutlu ŞAHİN Hacettepe Fen Bilgisi Öğretmenliği DENEY NO: 8 DENEYİN ADI: PİL VE AKÜ DENEYİN AMACI: PİL VE AKÜLERİN ÇALIŞMA SİSTEMİNİN VE KİMYASAL ENERJİNİN ELEKTRİK ENERJİSİNE DÖNÜŞÜMÜNÜN ANLAŞILMASI
KÜKÜRT DİOKSİT GAZI İLE ÜLEKSİT TEN BORİK ASİT ÜRETİMİ
 KÜKÜRT DİOKSİT GAZI İLE ÜLEKSİT TEN BORİK ASİT ÜRETİMİ İbrahim Hakkı Karakaş a*,mehmet Çopur b, M. Muhtar Kocakerim c, Zeynep Karcıoğlu Karakaş d a Bayburt Üniversitesi, Bayburt Meslek Yüksek Okulu, Bayburt
KÜKÜRT DİOKSİT GAZI İLE ÜLEKSİT TEN BORİK ASİT ÜRETİMİ İbrahim Hakkı Karakaş a*,mehmet Çopur b, M. Muhtar Kocakerim c, Zeynep Karcıoğlu Karakaş d a Bayburt Üniversitesi, Bayburt Meslek Yüksek Okulu, Bayburt
ÖMRÜNÜ TAMAMLAMIŞ LASTİKLERİN GERİ KAZANIMINDA PİROLİZ YÖNTEMİ
 ÖMRÜNÜ TAMAMLAMIŞ LASTİKLERİN GERİ KAZANIMINDA PİROLİZ YÖNTEMİ Onursal Yakaboylu Aslı İşler Filiz Karaosmanoğlu 1 Onursal Yakaboylu - Atık Sempozyumu / Antalya 19/04/2011 İÇERİK Lastik Atık lastik Atık
ÖMRÜNÜ TAMAMLAMIŞ LASTİKLERİN GERİ KAZANIMINDA PİROLİZ YÖNTEMİ Onursal Yakaboylu Aslı İşler Filiz Karaosmanoğlu 1 Onursal Yakaboylu - Atık Sempozyumu / Antalya 19/04/2011 İÇERİK Lastik Atık lastik Atık
3) Oksijenin pek çok bileşiğindeki yükseltgenme sayısı -2 dir. Ancak, H 2. gibi peroksit bileşiklerinde oksijenin yükseltgenme sayısı -1 dir.
 5.111 Ders Özeti #25 Yükseltgenme/İndirgenme Ders 2 Konular: Elektrokimyasal Piller, Faraday Yasaları, Gibbs Serbest Enerjisi ile Pil-Potansiyelleri Arasındaki İlişkiler Bölüm 12 YÜKSELTGENME/İNDİRGENME
5.111 Ders Özeti #25 Yükseltgenme/İndirgenme Ders 2 Konular: Elektrokimyasal Piller, Faraday Yasaları, Gibbs Serbest Enerjisi ile Pil-Potansiyelleri Arasındaki İlişkiler Bölüm 12 YÜKSELTGENME/İNDİRGENME
TEHLİKELİ ATIK ÖN İŞLEM TESİSLERİ
 TEHLİKELİ ATIK ÖN İŞLEM TESİSLERİ i. Elleçleme (Handling) Tesisi Elleçleme tesisi, uygun tehlikeli ve tehlikesiz endüstriyel atıkların, parçalanması ve termal bertaraf tesislerinin istediği fiziksel şartları
TEHLİKELİ ATIK ÖN İŞLEM TESİSLERİ i. Elleçleme (Handling) Tesisi Elleçleme tesisi, uygun tehlikeli ve tehlikesiz endüstriyel atıkların, parçalanması ve termal bertaraf tesislerinin istediği fiziksel şartları
ÇÖZÜNMÜŞ OKSİJEN TAYİNİ
 ÇEVRE KİMYASI LABORATUVARI ÇÖZÜNMÜŞ OKSİJEN TAYİNİ 1. GENEL BİLGİLER Doğal sular ve atıksulardaki çözünmüş oksijen (ÇO) seviyeleri su ortamındaki fiziksel, kimyasal ve biyokimyasal aktivitelere bağımlıdır.
ÇEVRE KİMYASI LABORATUVARI ÇÖZÜNMÜŞ OKSİJEN TAYİNİ 1. GENEL BİLGİLER Doğal sular ve atıksulardaki çözünmüş oksijen (ÇO) seviyeleri su ortamındaki fiziksel, kimyasal ve biyokimyasal aktivitelere bağımlıdır.
HİDROJENLİ ENERJİ ÜRETEÇLERİ MESUT EROĞLU
 HİDROJENLİ ENERJİ ÜRETEÇLERİ MESUT EROĞLU 15360027 HİDROJEN Hidrojen bilinen tüm yaķıtlar içerisinde birim kütle başına en yüksek enerji içeriğine sahiptir. Üst ısıl değeri 140.9 Mj / kg, alt ısıl değeri
HİDROJENLİ ENERJİ ÜRETEÇLERİ MESUT EROĞLU 15360027 HİDROJEN Hidrojen bilinen tüm yaķıtlar içerisinde birim kütle başına en yüksek enerji içeriğine sahiptir. Üst ısıl değeri 140.9 Mj / kg, alt ısıl değeri
ALUMİNYUMUN YÜZEYİNDEKİ OKSİT TABAKASININ SÜLFÜRİK ASİT ANODIZING YÖNTEMİYLE GELİŞTİRİLMESİ*
 ALUMİNYUMUN YÜZEYİNDEKİ OKSİT TABAKASININ SÜLFÜRİK ASİT ANODIZING YÖNTEMİYLE GELİŞTİRİLMESİ* The Development of Alumina Formed on Aluminium Using Sulphuric Acid Anodizing Technique Suzan KONUKLU Kimya
ALUMİNYUMUN YÜZEYİNDEKİ OKSİT TABAKASININ SÜLFÜRİK ASİT ANODIZING YÖNTEMİYLE GELİŞTİRİLMESİ* The Development of Alumina Formed on Aluminium Using Sulphuric Acid Anodizing Technique Suzan KONUKLU Kimya
Dokuz Eylül Üniversitesi, Mühendislik Fakültesi, Çevre Mühendisliği Bölümü, Buca/İZMİR. Yanma. Prof.Dr. Abdurrahman BAYRAM
 Dokuz Eylül Üniversitesi, Mühendislik Fakültesi, Çevre Mühendisliği Bölümü, Buca/İZMİR Yanma Prof.Dr. Abdurrahman BAYRAM Telefon: 0232 3017494 Faks: 0232 3017498 E-Mail: abayram@deu.edu.tr ÇEV 3016 Hava
Dokuz Eylül Üniversitesi, Mühendislik Fakültesi, Çevre Mühendisliği Bölümü, Buca/İZMİR Yanma Prof.Dr. Abdurrahman BAYRAM Telefon: 0232 3017494 Faks: 0232 3017498 E-Mail: abayram@deu.edu.tr ÇEV 3016 Hava
Elektrik Enerjisi Üretimi. Dr. Öğr. Üyesi Emrah ÇETİN
 Elektrik Enerjisi Üretimi Dr. Öğr. Üyesi Emrah ÇETİN ELEKTRİK PİYASALARI İŞLETME A.Ş. Doğalgaz Yenilenemez (Fosil) Kaynaklı Kömür Elektrik Enerjisi Üretim Çeşitleri Nükleer Petrol türevleri
Elektrik Enerjisi Üretimi Dr. Öğr. Üyesi Emrah ÇETİN ELEKTRİK PİYASALARI İŞLETME A.Ş. Doğalgaz Yenilenemez (Fosil) Kaynaklı Kömür Elektrik Enerjisi Üretim Çeşitleri Nükleer Petrol türevleri
Katı Atık Yönetiminde Arıtma Çamuru. Enes KELEŞ Kasım / 2014
 Katı Atık Yönetiminde Arıtma Çamuru Enes KELEŞ Kasım / 2014 İÇİNDEKİLER Arıtma Çamuru Nedir? Arıtma Çamuru Nerede Oluşur? Arıtma Çamuru Çeşitleri Arıtma Çamuru Nerelerde Değerlendirilebilir? 1. Açık Alanda
Katı Atık Yönetiminde Arıtma Çamuru Enes KELEŞ Kasım / 2014 İÇİNDEKİLER Arıtma Çamuru Nedir? Arıtma Çamuru Nerede Oluşur? Arıtma Çamuru Çeşitleri Arıtma Çamuru Nerelerde Değerlendirilebilir? 1. Açık Alanda
Meteoroloji. IX. Hafta: Buharlaşma
 Meteoroloji IX. Hafta: Buharlaşma Hidrolojik döngünün önemli bir unsurunu oluşturan buharlaşma, yeryüzünde sıvı ve katı halde farklı şekil ve şartlarda bulunan suyun meteorolojik faktörlerin etkisiyle
Meteoroloji IX. Hafta: Buharlaşma Hidrolojik döngünün önemli bir unsurunu oluşturan buharlaşma, yeryüzünde sıvı ve katı halde farklı şekil ve şartlarda bulunan suyun meteorolojik faktörlerin etkisiyle
Fiziksel özellikleri her yerde aynı olan (homojen) karışımlara çözelti denir. Bir çözeltiyi oluşturan her bir maddeye çözeltinin bileşenleri denir.
 GENEL KİMYA 1 LABORATUARI ÇALIŞMA NOTLARI DENEY: 8 ÇÖZELTİLER Dr. Bahadır KESKİN, 2011 @ YTÜ Fiziksel özellikleri her yerde aynı olan (homojen) karışımlara çözelti denir. Bir çözeltiyi oluşturan her bir
GENEL KİMYA 1 LABORATUARI ÇALIŞMA NOTLARI DENEY: 8 ÇÖZELTİLER Dr. Bahadır KESKİN, 2011 @ YTÜ Fiziksel özellikleri her yerde aynı olan (homojen) karışımlara çözelti denir. Bir çözeltiyi oluşturan her bir
ÖLÇME, DEĞERLENDİRME VE SINAV HİZMETLERİ GENEL MÜDÜRLÜĞÜ
 AY EKİM 06-07 EĞİTİM - ÖĞRETİM YILI. SINIF VE MEZUN GRUP KİMYA HAFTA DERS SAATİ. Kimya nedir?. Kimya ne işe yarar?. Kimyanın sembolik dili Element-sembol Bileşik-formül. Güvenliğimiz ve Kimya KONU ADI
AY EKİM 06-07 EĞİTİM - ÖĞRETİM YILI. SINIF VE MEZUN GRUP KİMYA HAFTA DERS SAATİ. Kimya nedir?. Kimya ne işe yarar?. Kimyanın sembolik dili Element-sembol Bileşik-formül. Güvenliğimiz ve Kimya KONU ADI
BİTKİ BESİN MADDELERİ (BBM)
 BİTKİ BESİN MADDELERİ (BBM) Toprak Bilgisi Dersi Prof. Dr. Günay Erpul erpul@ankara.edu.tr Işık Enerjisinin Kimyasal Enerjiye Dönüştürülmesi Fotosentez, karbon (C), oksijen (O) ve hidrojen (H) atomlarını
BİTKİ BESİN MADDELERİ (BBM) Toprak Bilgisi Dersi Prof. Dr. Günay Erpul erpul@ankara.edu.tr Işık Enerjisinin Kimyasal Enerjiye Dönüştürülmesi Fotosentez, karbon (C), oksijen (O) ve hidrojen (H) atomlarını
KİMYA II DERS NOTLARI
 KİMYA II DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN Sulu Çözeltilerin Doğası Elektrolitler Metallerde elektronların hareketiyle elektrik yükü taşınır. Saf su Suda çözünmüş Oksijen gazı Çözeltideki moleküllerin
KİMYA II DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN Sulu Çözeltilerin Doğası Elektrolitler Metallerde elektronların hareketiyle elektrik yükü taşınır. Saf su Suda çözünmüş Oksijen gazı Çözeltideki moleküllerin
YENİLENEBİLİR ENERJİ KAYNAKLARI VE DALGA ENERJİSİ. O.Okan YEŞİLYURT Gökhan IŞIK
 YENİLENEBİLİR ENERJİ KAYNAKLARI VE DALGA ENERJİSİ O.Okan YEŞİLYURT Gökhan IŞIK NEDİR BU ENERJİ? İş Yapabilme Yeteneğidir. Canlı Tüm Organizmalar Enerjiye İhtiyaç Duyar. İnsanlık Enerjiye Bağımlıdır. Yaşam
YENİLENEBİLİR ENERJİ KAYNAKLARI VE DALGA ENERJİSİ O.Okan YEŞİLYURT Gökhan IŞIK NEDİR BU ENERJİ? İş Yapabilme Yeteneğidir. Canlı Tüm Organizmalar Enerjiye İhtiyaç Duyar. İnsanlık Enerjiye Bağımlıdır. Yaşam
KOROZYON. Teorik Bilgi
 KOROZYON Korozyon, metalik malzemelerin içinde bulundukları ortamla reaksiyona girmeleri sonucu, dışardan enerji vermeye gerek olmadan, doğal olarak meydan gelen olaydır. Metallerin büyük bir kısmı su
KOROZYON Korozyon, metalik malzemelerin içinde bulundukları ortamla reaksiyona girmeleri sonucu, dışardan enerji vermeye gerek olmadan, doğal olarak meydan gelen olaydır. Metallerin büyük bir kısmı su
KÖMÜRÜN GAZLAŞTIRILMASI YOLUYLA ELDE EDİLEN SENTEZ GAZINDAN METANOL ÜRETİMİ
 Ek 2 ULUSAL ÖĞRENCİ TASARIM YARIŞMASI PROBLEM TANIMI KÖMÜRÜN GAZLAŞTIRILMASI YOLUYLA ELDE EDİLEN SENTEZ GAZINDAN METANOL ÜRETİMİ 1. Giriş Türk kömür rezervlerinden metanol üretimi Kömürden metanol üretimi,
Ek 2 ULUSAL ÖĞRENCİ TASARIM YARIŞMASI PROBLEM TANIMI KÖMÜRÜN GAZLAŞTIRILMASI YOLUYLA ELDE EDİLEN SENTEZ GAZINDAN METANOL ÜRETİMİ 1. Giriş Türk kömür rezervlerinden metanol üretimi Kömürden metanol üretimi,
Katoda varan pozitif iyonlar buradan kendilerini nötrleyecek kadar elektron alırlar.
 ELEKTROLİZ Şekilde verilen kapta saf su var iken, anahtar kapatıldığında lamba yanmaz. Saf suyun içine H 2 SO 4, NaCI, NaOH gibi suda iyonlarına ayrışan maddelerden herhangi biri katıldığında lamba ışık
ELEKTROLİZ Şekilde verilen kapta saf su var iken, anahtar kapatıldığında lamba yanmaz. Saf suyun içine H 2 SO 4, NaCI, NaOH gibi suda iyonlarına ayrışan maddelerden herhangi biri katıldığında lamba ışık
MM548 Yakıt Pillerinin Prensibi ve Uygulaması. Yrd.Doç.Dr. Muhittin Bilgili
 MM548 Yakıt Pillerinin Prensibi ve Uygulaması Yrd.Doç.Dr. Muhittin Bilgili MM548 Ders içeriği 1) Yakıt pillerine giriş 2) Yakıt pillerinin çalışma prensibi: - Elektro-Kimyasal Prosesler ve Elektrik Üretimi
MM548 Yakıt Pillerinin Prensibi ve Uygulaması Yrd.Doç.Dr. Muhittin Bilgili MM548 Ders içeriği 1) Yakıt pillerine giriş 2) Yakıt pillerinin çalışma prensibi: - Elektro-Kimyasal Prosesler ve Elektrik Üretimi
Proje Adı ASİT YAĞMURLARININ BİTKİ YAPRAKLARI ÜZERİNE ETKİSİ. Proje Grubu KARINCA. Emrah AVCI Abdullah Bayram GÜRDAL
 Y.İ.B.O. ÖĞRETMENLERİ (FEN VE TEKNOLOJİ, FİZİK, KİMYA, BİYOLOJİ VE MATEMATİK) PROJE DANIŞMANLIĞI Proje Adı ASİT YAĞMURLARININ BİTKİ YAPRAKLARI ÜZERİNE ETKİSİ Proje Grubu KARINCA Grubu Üyeleri Asıl alt
Y.İ.B.O. ÖĞRETMENLERİ (FEN VE TEKNOLOJİ, FİZİK, KİMYA, BİYOLOJİ VE MATEMATİK) PROJE DANIŞMANLIĞI Proje Adı ASİT YAĞMURLARININ BİTKİ YAPRAKLARI ÜZERİNE ETKİSİ Proje Grubu KARINCA Grubu Üyeleri Asıl alt
Örnek : 3- Bileşiklerin Özellikleri :
 Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani
Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani
YENİLENEBİLİR ENERJİ KAYNAKLARI
 YENİLENEBİLİR ENERJİ KAYNAKLARI ENERJİ Artan nüfus ile birlikte insanların rahat ve konforlu şartlarda yaşama arzuları enerji talebini sürekli olarak artırmaktadır. Artan enerji talebini, rezervleri sınırlı
YENİLENEBİLİR ENERJİ KAYNAKLARI ENERJİ Artan nüfus ile birlikte insanların rahat ve konforlu şartlarda yaşama arzuları enerji talebini sürekli olarak artırmaktadır. Artan enerji talebini, rezervleri sınırlı
Akreditasyon Sertifikası Eki (Sayfa 1/9) Akreditasyon Kapsamı
 Akreditasyon Sertifikası Eki (Sayfa 1/9) Deney Laboratuvarı Adresi : Kazımiye Mah. Dadaloğlu Cad. No:32 /A Çorlu/Tekirdağ 59850 TEKİRDAĞ / TÜRKİYE Tel : 0 282 652 40 55 Faks : 0 282 652 04 56 E-Posta :
Akreditasyon Sertifikası Eki (Sayfa 1/9) Deney Laboratuvarı Adresi : Kazımiye Mah. Dadaloğlu Cad. No:32 /A Çorlu/Tekirdağ 59850 TEKİRDAĞ / TÜRKİYE Tel : 0 282 652 40 55 Faks : 0 282 652 04 56 E-Posta :
YENİLENEBİLİR ENERJİ KAYNAKLARI VE ÇEVRE MEVZUATI
 YENİLENEBİLİR ENERJİ KAYNAKLARI VE ÇEVRE MEVZUATI Dr. Gülnur GENÇLER ABEŞ Çevre Yönetimi ve Denetimi Şube Müdürü Çevre ve Şehircilik İl Müdürlüğü 06/02/2016 YENİLENEBİLİR ENERJİ NEDİR? Sürekli devam eden
YENİLENEBİLİR ENERJİ KAYNAKLARI VE ÇEVRE MEVZUATI Dr. Gülnur GENÇLER ABEŞ Çevre Yönetimi ve Denetimi Şube Müdürü Çevre ve Şehircilik İl Müdürlüğü 06/02/2016 YENİLENEBİLİR ENERJİ NEDİR? Sürekli devam eden
MADDE DÖNGÜLERİ SU, KARBON VE AZOT DÖNGÜSÜ SELİN HOCA
 MADDE DÖNGÜLERİ SU, KARBON VE AZOT DÖNGÜSÜ SELİN HOCA Ekosistemde kimyasal elementler sınırlı sayıda bulunur. Bu nedenle bu kimyasal elementeler organik ve inorganik formlarda devir halindedir. Bu devre,
MADDE DÖNGÜLERİ SU, KARBON VE AZOT DÖNGÜSÜ SELİN HOCA Ekosistemde kimyasal elementler sınırlı sayıda bulunur. Bu nedenle bu kimyasal elementeler organik ve inorganik formlarda devir halindedir. Bu devre,
MAKİNE VE TEÇHİZAT İŞLERİNDE İSG
 MAKİNE VE TEÇHİZAT İŞLERİNDE İSG 3.HAFTA Hazırlayan: Öğr. Gör. Tuğberk ÖNAL MALATYA 2017 YAKITLAR -YANMA Enerji birçok ülke için günümüzün en önemli sorunlarının başında gelmektedir. Özellikle ülkemiz
MAKİNE VE TEÇHİZAT İŞLERİNDE İSG 3.HAFTA Hazırlayan: Öğr. Gör. Tuğberk ÖNAL MALATYA 2017 YAKITLAR -YANMA Enerji birçok ülke için günümüzün en önemli sorunlarının başında gelmektedir. Özellikle ülkemiz
ÇALIŞMA YAPRAĞI KONU ANLATIMI
 ÇALIŞMA YAPRAĞI KONU ANLATIMI HATUN ÖZTÜRK 20338647 Küresel Isınma Küresel ısınma, dünya atmosferi ve okyanuslarının ortalama sıcaklıklarında belirlenen artış için kullanılan bir terimdir. Fosil yakıtların
ÇALIŞMA YAPRAĞI KONU ANLATIMI HATUN ÖZTÜRK 20338647 Küresel Isınma Küresel ısınma, dünya atmosferi ve okyanuslarının ortalama sıcaklıklarında belirlenen artış için kullanılan bir terimdir. Fosil yakıtların
HACETTEPE ÜNĐVERSĐTESĐ EĞĐTĐM FAKÜLTESĐ ÖĞRETĐM TEKNOLOJĐLERĐ VE MATERYAL GELĐŞTĐRME
 HACETTEPE ÜNĐVERSĐTESĐ EĞĐTĐM FAKÜLTESĐ KĐMYA ÖĞRETMENLĐĞĐ ÖĞRETĐM TEKNOLOJĐLERĐ VE MATERYAL GELĐŞTĐRME 8. SINIF FEN VE TEKNOLOJĐ DERSĐ 3. ÜNĐTE: MADDENĐN YAPISI VE ÖZELLĐKLERĐ KONU: BAZLAR ÇALIŞMA YAPRAĞI
HACETTEPE ÜNĐVERSĐTESĐ EĞĐTĐM FAKÜLTESĐ KĐMYA ÖĞRETMENLĐĞĐ ÖĞRETĐM TEKNOLOJĐLERĐ VE MATERYAL GELĐŞTĐRME 8. SINIF FEN VE TEKNOLOJĐ DERSĐ 3. ÜNĐTE: MADDENĐN YAPISI VE ÖZELLĐKLERĐ KONU: BAZLAR ÇALIŞMA YAPRAĞI
Tablo : Türkiye Su Kaynakları potansiyeli. Ortalama (aritmetik) Yıllık yağış 642,6 mm Ortalama yıllık yağış miktarı 501,0 km3
 Dünyadaki toplam su miktarı 1,4 milyar km3 tür. Bu suyun % 97'si denizlerde ve okyanuslardaki tuzlu sulardan oluşmaktadır. Geriye kalan yalnızca % 2'si tatlı su kaynağı olup çeşitli amaçlar için kullanılabilir
Dünyadaki toplam su miktarı 1,4 milyar km3 tür. Bu suyun % 97'si denizlerde ve okyanuslardaki tuzlu sulardan oluşmaktadır. Geriye kalan yalnızca % 2'si tatlı su kaynağı olup çeşitli amaçlar için kullanılabilir
MM548 Yakıt Pillerinin Prensibi ve Uygulaması
 MM548 Yakıt Pillerinin Prensibi ve Uygulaması 2015 Güz Dönemi Yrd.Doç.Dr. Muhittin Bilgili Ders içeriği 1) Yakıt pillerine giriş 2) Yakıt pillerinin çalışma prensibi: - Elektro-Kimyasal Prosesler ve Elektrik
MM548 Yakıt Pillerinin Prensibi ve Uygulaması 2015 Güz Dönemi Yrd.Doç.Dr. Muhittin Bilgili Ders içeriği 1) Yakıt pillerine giriş 2) Yakıt pillerinin çalışma prensibi: - Elektro-Kimyasal Prosesler ve Elektrik
KAZANLARDA ENERJİ VERİMLİLİĞİ
 KAZANLARDA ENERJİ VERİMLİLİĞİ BİRSEN BAKIR ELEKTRİK MÜH. ENERJİ YÖNETİCİSİ EVD ENERJİ YÖNETİMİ -1- Kazanlar Yakıtın kimyasal enerjisini yanma yoluyla ısı enerjisine dönüştüren ve bu ısı enerjisini taşıyıcı
KAZANLARDA ENERJİ VERİMLİLİĞİ BİRSEN BAKIR ELEKTRİK MÜH. ENERJİ YÖNETİCİSİ EVD ENERJİ YÖNETİMİ -1- Kazanlar Yakıtın kimyasal enerjisini yanma yoluyla ısı enerjisine dönüştüren ve bu ısı enerjisini taşıyıcı
SÜRDÜRÜLEBİLİR ENERJİ VE HİDROJEN ZEYNEP KEŞKEK ALTERNATİF ENERJİ KAYNAKLARI TEKNOLOJİSİ
 SÜRDÜRÜLEBİLİR ENERJİ VE HİDROJEN ZEYNEP KEŞKEK ALTERNATİF ENERJİ KAYNAKLARI TEKNOLOJİSİ HİDROJENİN DEPOLANMASI ÇÖZÜM BEKLEYEN SORUNLAR Hidrojenin en önemli özelliklerinden biri depolanabilir olmasıdır.
SÜRDÜRÜLEBİLİR ENERJİ VE HİDROJEN ZEYNEP KEŞKEK ALTERNATİF ENERJİ KAYNAKLARI TEKNOLOJİSİ HİDROJENİN DEPOLANMASI ÇÖZÜM BEKLEYEN SORUNLAR Hidrojenin en önemli özelliklerinden biri depolanabilir olmasıdır.
ÖLÇÜM VE /VEYA ANALİZ İLE İLGİLİ; Kapsam Parametre Metot Adı Metot Numarası ph Elektrometrik metot TS EN ISO 10523
 Çevresel Etki Değerlendirmesi İzin ve Denetim lüğü EK LİSTE-1/8 ph Elektrometrik metot TS EN ISO 10523 SU, ATIK SU 1,2 İletkenlik Elektrot Metodu TS 9748 EN 27888 Sıcaklık Laboratuvar ve Saha Metodu SM
Çevresel Etki Değerlendirmesi İzin ve Denetim lüğü EK LİSTE-1/8 ph Elektrometrik metot TS EN ISO 10523 SU, ATIK SU 1,2 İletkenlik Elektrot Metodu TS 9748 EN 27888 Sıcaklık Laboratuvar ve Saha Metodu SM
Atmosfer Kimyası Neden Önemli?
 ÇEV 715 Atmosfer Kimyası Özgür ZEYDAN (PhD.) http://cevre.beun.edu.tr/zeydan/ Atmosfer Kimyası Neden Önemli? Atmosfere salınan antropojenik ve doğal emisyonların atmosferin fiziksel ve kimyasal yapısını
ÇEV 715 Atmosfer Kimyası Özgür ZEYDAN (PhD.) http://cevre.beun.edu.tr/zeydan/ Atmosfer Kimyası Neden Önemli? Atmosfere salınan antropojenik ve doğal emisyonların atmosferin fiziksel ve kimyasal yapısını
KÖMÜR JEOLOJİSİ. Kömürün Kullanım Alanları ve Teknolojisi
 KÖMÜR JEOLOJİSİ Kömür, siyah, koyu gri veya kahverengi-siyah renkli, parlak veya mat bir katı fosil yakıt ve aynı zamanda sedimanter bir kayadır (Şekil 1). Şekil1. Tabakalı bir kömür mostrasının genel
KÖMÜR JEOLOJİSİ Kömür, siyah, koyu gri veya kahverengi-siyah renkli, parlak veya mat bir katı fosil yakıt ve aynı zamanda sedimanter bir kayadır (Şekil 1). Şekil1. Tabakalı bir kömür mostrasının genel
KOROZYON DERS NOTU. Doç. Dr. A. Fatih YETİM 2015
 KOROZYON DERS NOTU Doç. Dr. A. Fatih YETİM 2015 v Korozyon nedir? v Korozyon nasıl oluşur? v Korozyon çeşitleri nelerdir? v Korozyona sebep olan etkenler nelerdir? v Korozyon nasıl önlenebilir? Korozyon
KOROZYON DERS NOTU Doç. Dr. A. Fatih YETİM 2015 v Korozyon nedir? v Korozyon nasıl oluşur? v Korozyon çeşitleri nelerdir? v Korozyona sebep olan etkenler nelerdir? v Korozyon nasıl önlenebilir? Korozyon
Yrd. Doç. Dr. H. Hasan YOLCU. hasanyolcu.wordpress.com
 Yrd. Doç. Dr. H. Hasan YOLCU hasanyolcu.wordpress.com En az iki atomun belli bir düzenlemeyle kimyasal bağ oluşturmak suretiyle bir araya gelmesidir. Aynı atomda olabilir farklı atomlarda olabilir. H 2,
Yrd. Doç. Dr. H. Hasan YOLCU hasanyolcu.wordpress.com En az iki atomun belli bir düzenlemeyle kimyasal bağ oluşturmak suretiyle bir araya gelmesidir. Aynı atomda olabilir farklı atomlarda olabilir. H 2,
T.C. Ölçme, Seçme ve Yerleştirme Merkezi
 T.C. Ölçme, Seçme ve Yerleştirme Merkezi LİSANS YERLEŞTİRME SINAVI-2 KİMYA TESTİ 25 HAZİRAN 2016 CUMARTESİ Bu testlerin her hakkı saklıdır. Hangi amaçla olursa olsun, testlerin tamamının veya bir kısmının
T.C. Ölçme, Seçme ve Yerleştirme Merkezi LİSANS YERLEŞTİRME SINAVI-2 KİMYA TESTİ 25 HAZİRAN 2016 CUMARTESİ Bu testlerin her hakkı saklıdır. Hangi amaçla olursa olsun, testlerin tamamının veya bir kısmının
On-line Oksijen Tüketiminin Ölçülmesiyle Havalandırma Prosesinde Enerji Optimizasyonu
 On-line Oksijen Tüketiminin Ölçülmesiyle Havalandırma Prosesinde Enerji Optimizasyonu Speaker: Ercan Basaran, Uwe Späth LAR Process Analysers AG 1 Genel İçerik 1. Giriş 2. Proses optimizasyonu 3. İki optimizasyon
On-line Oksijen Tüketiminin Ölçülmesiyle Havalandırma Prosesinde Enerji Optimizasyonu Speaker: Ercan Basaran, Uwe Späth LAR Process Analysers AG 1 Genel İçerik 1. Giriş 2. Proses optimizasyonu 3. İki optimizasyon
POTANSİYEL - ph diyagramları
 POTANSİYEL - ph diyagramları Metallerin çoğu su ve hava gibi çevresel şartlar altında korozyon eğilimi gösterirler. Çevreleri ile beraber bu metaller enerji vererek, oksit veya hidroksitler şeklinde kimyasal
POTANSİYEL - ph diyagramları Metallerin çoğu su ve hava gibi çevresel şartlar altında korozyon eğilimi gösterirler. Çevreleri ile beraber bu metaller enerji vererek, oksit veya hidroksitler şeklinde kimyasal
