BĠYOKĠMYA DOÇ. DR. MEHMET KARACA
|
|
|
- Deniz Göllü
- 10 yıl önce
- İzleme sayısı:
Transkript
1 BĠYOKĠMYA DOÇ. DR. MEHMET KARACA
2 ÇÖZÜNÜRLÜK Çözünürlük, belli bir miktar çözünenin, belirli Ģartlar altında, spesifik bir çözücü içinde çözünmesini tanımlar. Çözücü solvent olarak ve çözünen solut olarak adlandırılır ve SOLVENT + SOLUT birlikte çözeltiyi oluģtururlar. Çözümlendirme iģlemide çözücü su olduğu zaman HİDRASYON olarak adlandırılır. Suyun uzaklaģtırlamsına DEHĠDRASYON, katı maddelerin susuz olduğunu belirmek için is ANHĠDROUS kavramı kullanılmaktadır.
3 DOYMUġ ÇÖZELTĠ Daha fazla çözünen alamayan çözeltiye, DOYMUġ ÇÖZELTĠ adı verilir. Çözeltinin denge durumu etkileyen faktörler: 1) Sıcaklık 2) Çözücü içinde çözünebilecek maksimum çözünen madde miktarına 3) Çözücü ile çözünen arasındaki intermoleküler kuvvetler 4) Diğer maddelerin varlığı ve miktarları 5) Basınç
4 ÇÖZEN (SOLVENT) ÇÖZÜCÜ VE ÇÖZÜNENĠN DURUMLARI ÇÖZÜLEN (SOLUT) SIVI SIVI ALKOLLÜ SU SIVI KATI TUZLU SU ÖRNEK SIVI GAZ AMONYAKLI SU KATI SIVI GÜMÜŞLÜ-CİVA KATI KATI BAKIRLI-ÇİNKO ( Pirinç ) KATI GAZ PALLADYUMDA HİDROJEN GAZ GAZ AZOTTA OKSİJEN DOÇ. DR. MEHMET KARACA
5 ÇÖZÜNME Çözücü ve çözünenin birbiri içinde homojen olarak karıģması ile çözünme olayı gerçekleģir. Bir çözücünün bir maddeyi çözebilmesi için; çözücü ile çözünenin molekülleri arasındaki çekim kuvvetlerinin, çözücü ve çözünenin kendi molekülleri arasındaki çekim kuvvetinden daha büyük olması gerekir. ġeker, suda iyonlarına ayrıģmadan moleküler halde çözünür. Diğer taraftan NaCl tuzunun çözülmesinde iyonlarına ayrıģma görülür.
6 ÇÖZÜNME Genellikle çözünme olayı, çözücü ile çözünenin benzer yapıda olmaları ile gerçekleģir. Bu durum benzer benzeri çözer Ģeklinde ifade edilebilir. Suya göre polaritesi daha az olan kloroform, (CHCl 3 ), suda çözünmez. Çünkü su molekülleri birbirlerini, kloroform moleküllerine göre daha fazla çekerler. Polar bir bileģik, örneğin metanol, su molekülleri tarafından çekilerek suda çözünür. Benzen gibi polar olmayan çoğu organik bileģikler suda çözünmezler.
7 SOLVATĠZE ĠYONLAR Ġyonik bileģikler polar sıvılarda çok iyi çözünürler. Çünkü polar çözücü molekülleri, bileģikteki zıt yüklü iyonları iyon-dipol çekim kuvvetleri ile çekerek iyonun etrafını çözücü molekülleri ile sararlar. Bu tür iyonlara "solvatize iyonlar" denir. Solvatize iyonlar sıvı faza geçerek çözünme olayını sağlarlar. Çözücü olarak su kullanılırsa, çözücü ile sarılmıģ iyonlara "hidratize iyonlar" denir.
8 BUHARLAġMA - YOĞUNLAġMA - KAYNAMA Çözeltilerdeki moleküllerin bazılarının sıvı yüzeyinden ayrılarak gaz haline geçmesi "buharlaģma" olarak tanımlanır. Bitki ve toprak yüzeyindeki buharlaģma Buhar halindeki moleküllerin bazılarının tekrar sıvıya dönmeleri olay da "yoğunlaģma olarak bilinir. Buharlaşma hızı ile yoğunlaşma hızının birbirine eşit olduğu buharın basıncına o sıvının o sıcaklıktaki buhar basıncı denir. Sıvının buhar basıncının, dıģbasınca eģit olduğu sıcaklığa, o maddenin "kaynama noktası" denir. Suyun 100 C de dinamik denge halinde iken buhar basıncı 760 mm Hg dır, eğer atmosfer basıncı da 760 mm Hg ise kaynama olayı gözlenir.
9 Raoult Yasası ve Tarım Çözeltilerin buhar basınçları ile, konsantrasyonu arasındaki bağıntı ilk kez François-Marie Raoult tarafından araştırılmıştır ve bu bağıntı "Raoult Yasası" olarak bilinmektedir. Raoult Yasasına göre, bir çözeltinin buhar basıncı, çözücünün saf haldeki buhar basıncı ile onun mol kesrinin çarpımına eģittir. BUHAR BASINCI BUHAR BASINCI SADECE ÇÖZÜCÜ ÇÖZÜCÜ + ÇÖZÜNEN
10 ÇÖZELTĠLERĠN KOLĠGATĠF ÖZELLĠKLERĠ Koligatif özellikler çözeltideki çözünen parçacıklarının sayısına bağlı olan özelliklerdir. Çözeltide bulunan çözünen parçacıkları (atomlar, iyonlar, moleküller) çözeltinin buhar basıncının, saf çözücüye göre daha düşük olmasına neden olurlar. Çünkü çözünen parçacıkları; çözeltinin yüzeyinden daha az sayıda çözücü moleküllerinin ayrılmasına sebep olurlar. Buna karģın sıvıya dönen buhar moleküllerinin sayısı değiģmez.
11 ÇÖZELTĠLERĠN KOLĠGATĠF ÖZELLĠKLERĠ Konsantre çözeltiler, saf çözücüden daha yavaş buharlaşırlar. Buhar basıncının azalması, koligatif özelliğe bir örnektir. Bir çözünen etkisi ile buhar basıncı düģürülen bir çözeltinin, buhar basıncını atmosferik basınca eģit yapabilmek için daha yüksek sıcaklığa gereksinimi vardır. Bu etki çözeltilerde kaynama noktası yükselmesi Ģeklinde ortaya çıkar.
12 ÇÖZELTĠLERĠN KOLĠGATĠF ÖZELLĠKLERĠ Ozmotik basınç da diğer bir koligatif özelliktir. Ozmoz olayı, çözünen parçacıklarının geçemediği yarı geçirgen bir zardan çözücü moleküllerinin difüzyonudur. Yarı geçirgen zarın iki tarafında farklı konsantrasyonlu çözeltiler yer aldığında, çözücü daha seyreltik çözeltiden (daha fazla çözücü içerir) daha derişik çözeltiye (daha az çözücü içerir) hareket eder. Ozmoz olayı, derişik çözelti yeteri kadar seyreltik olana kadar diğer bir deyişle, çözücü molekülleri zardan zıt yönlerde eşit hızda geçişleri sağlanana kadar devam eder.
13 Ozmotik basınç Ozmotik basınç ozmoz sırasında daha konsantre çözeltiden, çözücü akıģını durdurmak için gereken basınçtır. Ozmotik basınç da sadece çözünenin parçacıklarının sayısına (sabit sıcaklıkta, hacimde) bağlı olup koligatif bir özelliktir. Ozmotik basınç canlı sistemlerde çok önemlidir. İnsan plazmasının 37 C'de 7.65 atmosferlik bir basıncı olduğu bulunmuştur. Bitki köklerinde ise 50 atm veya daha fazla olabilmektedir.
14 İZOTONİK ORTAM: hücrenin sitoplazmik konsantrasyonu dış ortamla aynıdır, hücre içi ile dış ortam konsantrasyon dengesi sağlanmış olup osmoz gerçekleşmez. HİPERTONİK ORTAM: Hücre sitoplazmik konsantrasyonundan daha yüksek bir ortama konulduğunda, hücre içinden ortama su geçer, osmoz gerçekleşir, su kaybından dolayı hücrelerin hacimleri küçülür ve büzülürler.
15 HİPOTONİK ORTAM: hücre sitoplazmik konsantrasyonundan daha düşük bir ortama konulduğunda, ortamdan hücre içine su geçişi gerçekleşir, bir başka deyişle osmoz gerçekleşir. Bu durum bitki hücrelerinde turgor yaratır. Plazmoliz (Plasmolysis): Hücrenin suyunun hücre dışına çıkması ile su kaybı olup plazmoliz bir ozmotik durumdur.
16 ÇÖZÜNÜRLÜĞE ETKĠ EDEN FAKTÖRLER Çözünürlük dengesine ve dolayısıyla çözünürlüğe etki eden bu faktörler 1) ortak iyon etkisi, 2) yabancı iyon etkisi, 3) hidrojen iyon-deriģiminin etkisi (ph), 4) kompleksleģmenin etkisi Ģeklinde sıralanabilir. 1- Ortak Ġyon Etkisi: Az çözünen iyonik bir bileşiğin çözeltisine bu bileşik ile ortak iyona (anyon veya katyon) sahip başka bir tuz katılırsa, ortak iyon çözünürlüğü azaltıcı yönde etki eder.
17 2- Yabancı Ġyon Etkisi: Çözünürlük dengesinde yer almayan iyonlar "yabancı iyonlar" veya "ortak olmayan iyonlar" olarak bilinirler. Örneğin AgCl'ün doygun çözeltisine katılan KNO 3, NaNO 3 gibi elektrolitlerin iyonları yabancı iyon durumundadırlar. Bu iyonlar çözeltinin toplam iyon deriģimini artırırlar. Yabancı iyonlar ile toplam deriģim arttığında, iyonlar arası çekimler önemli duruma gelir. Yabancı iyonlar az çözünen bileģenin çözünürlüğünü artırırlar. Bu nedenle çöktürme iģlemlerinde yabancı iyonlardan kaçınmak gerekir.
18 3- Hidrojen Ġyonu DeriĢiminin Etkisi (ph Etkisi): Az çözünen bir bileşiğin iyonları asidik veya bazik özellikte ise, çözeltinin hidrojen iyonu deriģiminin değiģimi, çözünürlük dengesinin değiģmesine neden olur, bazik anyon veren bileģiklerin çözünürlüğünü artırmak hatta tamamen çözmek için hidrojen iyonu deriģimini artırmak gerekir.
19 4-KompleksleĢmenin Etkisi: Kompleks iyon oluģumu, suda çözünmeyen bazı bileģikleri suda çözünür hale getirir. Diğer bir deyişle az çözünen bir bileģiğin iyonlarından biri çözeltiye katılan diğer bileģiklerle kompleksleģebiliyorsa çözünürlük artar. 5. Sıcaklık, 6. Basınç, 7. Enzimler (Biyomoleküllerin parçalanmasında).
20 ELEKTROLĠTLER Çözünme olayı ile çözeltide yüklü iyonik parçacıklar veya yüksüz moleküler parçacıklar oluşabilir. Bazı maddeler suda iyonlarına ayrışmadan, moleküler yapısını koruyarak çözünebilir. Örneğin aseton (CH 3 COCH 3 ) suda yüklü parçacıklara ayrışmaz. Bu şekilde çözeltisinde yüklü parçacıklar bulunmayan bir çözeltinin elektriği iletmesi beklenemez. Bu tür elektriği iletmeyen çözeltiler oluşturan çözünen maddeler "elektrolit olmayanlar" olarak adlandırılırlar.
21 Çözünen madde, sodyum klorür gibi iyonik bir bileşik ise suda artı ve eksi NaCl (k) + su Na+ (suda) + Cl- (suda) yüklü iyonik parçacıklar oluştururlar. Bu şekilde çözeltide (+) ve (-) yüklü parçacıklar oluşturarak çözeltisinin elektriği iletmesini sağlayan maddeler "elektrolitler" olarak adlandırılırlar
22
23 Kuvvetli bir elektrolit, çözücü içerisinde çözünerek tamamen iyonlarına ayrıģır. Örneğin hidroklorik asit suda çözündüğünde, HCl(g) + su H+ (suda) + Cl- (suda) tamamen iyonlarına ayrıģır ve çözeltisi elektriği iyi iletir. Zayıf bir elektrolit ise çözeltide kısmen iyonlarına ayrıģır. Örneğin asetik asit, CH3COOH, moleküllerinin büyük bir kısmı (%98.7) iyonlarına ayrıģmadan çözeltide kalabilir. CH3COOH (s) + Su CH3 COO-(suda) + H+ (suda)
24 KUVVETLİ VE ZAYIF ELEKTROLİTLER Asetik asit gibi suda çözünerek az miktarda (%1.3) iyonlar verebilen zayıf elektrolitler elektriği pek iyi iletmezler. Kuvvetli elektrolitlere; Nitrik asit (HNO3), Hidroklorik asit (HCl), sodyum hidroksil (NaOH), potasyum hidroksil (KOH), kalsiyum hidroksil (Ca(OH)2), sodyum klorür (NaCl) gibi maddeler, Zayıf elektrolitlere ise; karbonik asit (H 2 CO3), fosforik asit (H3PO4), hidrojen sülfür (H2S), asetik asit (CH3COOH), civa klorür (HgCl2), hidrojen siyanür (HCN), amonyak (NH3) gibi maddeler örnek olarak verilebilir.
25 BASĠT HESAPLAMALAR Kimyasal hesaplamalarda bileşiğin en küçük birimi baz olarak alınır. Bir bileşiğin tüm özelliklerini taşıyan en küçük birimine kovalent bileşiklerde, "molekül", iyonik bileşiklerde ise "formül birim" denir. Temel birim ağırlık; molekül ağırlığı, formül ağırlığı ve atom ağırlığı alınır. Bir molekül veya formül ağırlığı içerdikleri atom veya iyonların ağırlıklarının toplamına eşittir.
26 Tek molekül veya tek formül ağırlığını bulmak için laboratuvarda kullanılan hassas teraziler yetersiz kalmaktadır. Çünkü laboratuvarda kullanılan hassas terazilerin ölçebileceği en küçük birim miligram düzeyindedir. Mol, herhangi bir maddenin Avagadro sayısı kadar birim 6.02x10 23 sayısı miktarıdır.
27
28 Molarite Molarite, bir litre (1000 ml) çözeltide çözünenin mol sayısıdır. Molarite M; çözünenin mol sayısı n ve çözeltinin hacmi V, olmak üzere,
29 Mol Kesri Çözeltideki bir bileģenin mol sayısının, toplam mol sayısına oranı, o bileģenin mol kesri olarak tanımlanır ve X ile gösterilir.
30 Eklivalen ağırlık sayısı; çözünenin ağırlığının ekivalen ağırlığına bölünmesiyle bulunur. Ekivalen ağırlık ise maddenin gireceği reaksiyondaki iģlevine göre değiģir. NötralleĢme reaksiyonlarında; ekivalen ağırlık, formül ağırlığının asitlerde aktarılan H+ iyonu sayısına, bazlarda aktarılan OH- iyonu sayısına bölünmesiyle bulunur.
31 Yükseltgenme-indirgenme reaksiyonlarında ise ekivalen ağırlık, formül ağırlığının reaksiyonda aktarılan elektron sayısına bölünmesiyle bulunur. Tuz oluģturan reaksiyonlarda ekivalen ağırlık, formül ağırlığının tuzun bir cins iyonunun toplam yük sayısına bölünmesiyle bulunur. Yükseltgenme-indirgenme reaksiyonlarında ise ekivalen ağırlık, formül ağırlığının reaksiyonda aktarılan elektron sayısına bölünmesiyle bulunur. Tuz oluģturan reaksiyonlarda ekivalen ağırlık, formül ağırlığının tuzun bir cins iyonunun toplam yük sayısına
32 Normalite Normalite bir litre çözeltide çözünenin ekivalen (veya eģdeğer) ağırlık sayısıdır. Normalite, "N"; çözünenin ekivalen ağırlık sayısı "ek" ve çözeltinin hacmi "V", olmak üzere
33 HCl, HNO 3, CH 3 COOH gibi tek H+ iyonu içeren asitlerle NaOH, KOH gibi tek OH- iyonu içeren bazlarda, ekivalen ağırlık formül ağırlığına eģittir. NaCl, AgNO 3 gibi tuzlarda ekivalen ağırlık formül ağırlığına eģittir. BaCl 2, MgSO 4 gibi tuzlarda ise, ekivalen ağırlık formül ağırlığının yarısına eģittir.
34 Molalite Molalite, 1 kg (veya 1000 g) çözücüde (çözeltide değil) çözünenin mol sayısıdır. Molalite veya molal deriģim, "m" ile gösterilir. Örneğin 5.0 molal NaCl çözeltisi demek, 1 kg suda 5.0 mol NaCl bulunuyor demektir.
35 Yüzde DeriĢim veya Yüzde Konsantrasyon Ağırlık-hacim yüzdesi esasına göre verilen yüzde çözeltiler: 100 hacim birimi çözeltide kaç ağırlık birimi çözünen olduğunu gösterir. Örneğin %20'lik NaCl çözeltisi demek 100 hacim birimi çözeltide 20 ağırlık birimi NaCl var demektir. Böyle bir çözelti 20 g NaCl tarılarak hacim su ile 100 ml tamamlanır. Burada örneğin gram cinsinden bir solut, ml hacim cinsinden bir sıvıda çözülmüģtür: Gösterimi % agırlık/hacim veya % (w/v) Ģeklindedir
36 Hacim esasına göre verilen yüzde çözeltiler: 100 Hacim birimi (ml, L, m3, vb. olabilir) çözeltide kaç hacim birimi çözünen olduğunu gösterir. Örneğin 30 ml hacmindeki alkole, 70 ml su eklenecek Ģekilde final hacimin 100 ml tamamlanması ile %30'luk bir alkol çözeltisi hazırlanmıģ olur. Gösterimi % (h/h) veya % (v/v)
37 Ağırlık esasına göre verilen yüzde çözeltiler: 100 Ağırlık birimi çözeltide kaç ağırlık birimi çözünen olduğunu gösterir. Gösterimi % Ağırlık/Ağırlık, % g/g, %w/w
38 Çözeltilerin Seyreltilmesi Çözeltiler genellikle konsantrasyonu bilinen stok çözeltilerinden hazırlanır. Bazı durumlarda serisel seyreltmeler yapılarak çok seyreltik çözeltiler hazırlanır.
39 STOK SOLÜSYONLAR Seyreltme hesapları, stok çözeltiden alınan çözünen mol sayısı ile seyreltik çözeltideki çözünenin mol sayısının aynı olması esasına dayanır ve : (stok derişimi) (stok hacmi) = (istenen derişim) (istenen hacim) şeklinde ifade edilebilir. Burada eşitliğin her iki tarafında derişim ve hacim birimlerinin aynı olmasına dikkat edilmelidir. Çoğu derişimler molarite ve normalite ile ifade edildiğinden kısaca M1V1 = M2V2 veya N1V1 = N2V2, şeklinde yazılabilir. N1, M1, V1 normalite, molarite ve hacmin ilk değerleri, N2, M2, V2 ise normalite, molarite ve hacmin son değerleridir.
40 ppm & ppb Bazen çok hassas analizlerde derişimler o kadar küçük olur ki derişim birimi olarak "ppm veya "ppb" kullanılır. ppm, milyonda parça anlamında (ppm, Ġngilizce parts per million v kelimelerinin kısaltılmış şekli) bir derişim birimidir Çok küçük derişimler için diğer bir derişim birimi ppb (Ġngilizce parts per billion kelimelerinin kısaltılmışı) kullanılır. Milyarda parça anlamına gelen ppb için litre çözücüde çözünen miktarı mikrogram cinsinden ifade edilir.
41 KĠMYASAL REAKSĠYONLAR Bir kimyasal reaksiyon, "kimyasal değiģme süreci" olarak tanımlanabilir. Kimyasal değiģmeler, maddenin özelliklerinin ve bileģiminin değiģmesine neden olan değiģmelerdir. Kimyasal dönüģüme uğrayacak reaktantlar kısaca tanecik" olarak adlandırdığımız atomlar, iyonlar veya moleküllerden oluģurlar. Maddeleri oluģturan tanecikler sürekli hareket halindedirler. Bu hareketlilik maddenin katı, sıvı ya da gaz halinde oluģuna bağlı olduğu gibi, sıcaklığa da bağlıdır.
42 Ġki (veya daha fazla) madde belirli bir ortamda karıģtırıldığında bunları oluģturan tanecikler birbiriyle çarpıģacaktır. ĠĢte bu çarpıģmaların bir kısmı mevcut bağların kırılarak yeni bağlar oluģmasını ve böylece değiģik maddelerin meydana gelmesini sağlayacaklardır. iki atom arasında bir reaksiyonun gerçekleģmesi bunlara ait değerlik orbitallerinin etkileģmesi koģuluna bağlıdır. Bu nedenle de bir reaksiyon oluģabilmesi için bu iki atomun değerlik orbitallerinin etkileģmesine elverecek kadar birbirlerine yaklaģmaları gerekir.
43 Böylesi bir yaklaģma da ancak, iki ayrı atoma ait iki çekirdeği çevreleyen elektronların arasındaki itme kuvvetlerini yenecek düzeyde enerjiye sahip bir çarpıģma ile mümkündür. Böyle bir çarpıģma için gerekli enerji miktarına da "aktivasyon enerjisi (E a ) "denir.
44 Aktif komplekste atomlar arasında, ürünleri meydana getirecek yeni bağlar oluşmaya başlamış iken, eski bağlar zayıflamıģ durumdadır.
45 EKZOTERMĠK & ENDOTERMĠK REAKSĠYONLAR Ekzotermik reaksiyonlar kimyasal dönüģüm sonucunda çevreye enerji salan reaksiyonlardır ve bu reaksiyonlarda ürünlerin potansiyel enerjisi reaktantlarınkinden daha düģük bir düzeye ine
46 Endotermik Reaksiyonlar Yürütülebilmesi için belirli bir enerjinin verilmesini gerektiren reaksiyonlara "endotermik reaksiyonlar" denir ve bu reaksiyonlarda ürünlerin potansiyel enerjisi reaktantlarınkinden daha yüksektir. Endotermik reaksiyonlarda da, reaksiyonun baģlatılabilmesi için en azından aktivasyon enerjisi engelini aģmaya yetecek kadar bir enerjinin verilmesi ön koģuldur.
47 Bir endotermik reaksiyon olan fotosentez ve potansiyel enerji diyagramı.
48 REAKSĠYON HIZINI ETKĠLEYEN FAKTÖRLER 1-Reaktantların Yapısı: Kimyasal değişme boyunca gerçekleşecek bağ kırılma ve oluşmalarının hızı, bu bağların ve bunların oluşturduğu moleküllerin yapısına göre değişir. Karbohidrat veya lipit 2-Reaktantların Konsantrasyonu: Reaksiyon ortamında daha çok sayıda reaktant taneciği bulunması, daha fazla sayıda çarpışmanın gerçekleşmesine neden olur. 3-Katı Reaktantın Yüzey Alanı: Katı haldeki bir reaktantın yüzey alanı ne ölçüde büyük olursa, reaksiyon da o ölçüde hızlı gerçekleģir.
49 REAKSĠYON HIZINI ETKĠLEYEN FAKTÖRLER 4-Sıcaklık Reaktantların sıcaklığını yükseltmek, taneciklerin kinetik enerjilerini ve dolayısıyla hızlarını artırır. Bu ise hem reaksiyona neden olabilecek (etkin) çarpıģma sayısını artırır, hem de çarpışan taneciklere aktivasyon enerjisi engelini aģmaya yetecek kadar enerji kazandırır. 5- Katalizörler: Kendileri tüketilmediği halde reaksiyonların hızlanmasını sağlayan bu tür maddelere "katalizör" adı verilir. katalizörler bir reaksiyonu aktivasyon enerjisini düģürerek hızlandırırlar.
50
Genel Kimya. Bölüm 7: ÇÖZELTİLER VE ÇÖZÜNÜRLÜK. Yrd. Doç. Dr. Mustafa SERTÇELİK Kafkas Üniversitesi Kimya Mühendisliği Bölümü
 Genel Kimya Bölüm 7: ÇÖZELTİLER VE ÇÖZÜNÜRLÜK Yrd. Doç. Dr. Mustafa SERTÇELİK Kafkas Üniversitesi Kimya Mühendisliği Bölümü ÇÖZELTİ VE TÜRLERİ Eğer bir madde diğer bir madde içinde molekül, atom veya iyonları
Genel Kimya Bölüm 7: ÇÖZELTİLER VE ÇÖZÜNÜRLÜK Yrd. Doç. Dr. Mustafa SERTÇELİK Kafkas Üniversitesi Kimya Mühendisliği Bölümü ÇÖZELTİ VE TÜRLERİ Eğer bir madde diğer bir madde içinde molekül, atom veya iyonları
ÜNİTE 9. Çözeltiler. Amaçlar. İçindekiler. Öneriler
 ÜNİTE 9 Çözeltiler Amaçlar Bu üniteyi çalıştıktan sonra, Çözelti ve çözelti türlerini tanımlayabilecek, Çözünme olgusunu ve çözünürlüğü kavrayacak, Elektrolitleri ve çeşitlerini tanımlayabilecek, Çözelti
ÜNİTE 9 Çözeltiler Amaçlar Bu üniteyi çalıştıktan sonra, Çözelti ve çözelti türlerini tanımlayabilecek, Çözünme olgusunu ve çözünürlüğü kavrayacak, Elektrolitleri ve çeşitlerini tanımlayabilecek, Çözelti
Çözelti iki veya daha fazla maddenin birbiri içerisinde homojen. olarak dağılmasından oluşan sistemlere denir.
 3. ÇÖZELTİLER VE ÇÖZELTİ KONSANTRASYONLARI Çözelti: Homojen karışımlardır. Çözelti iki veya daha fazla maddenin birbiri içerisinde homojen olarak dağılmasından oluşan sistemlere denir. Çözelti derişimi
3. ÇÖZELTİLER VE ÇÖZELTİ KONSANTRASYONLARI Çözelti: Homojen karışımlardır. Çözelti iki veya daha fazla maddenin birbiri içerisinde homojen olarak dağılmasından oluşan sistemlere denir. Çözelti derişimi
ÇÖZELTİLERİN KOLİGATİF ÖZELLİKLERİ
 ÇÖZELTİLERİN KOLİGATİF ÖZELLİKLERİ Çözeltilerin sadece derişimine bağlı olarak değişen özelliklerine koligatif özellikler denir. Buhar basıncı düşmesi, Kaynama noktası yükselmesi, Donma noktası azalması
ÇÖZELTİLERİN KOLİGATİF ÖZELLİKLERİ Çözeltilerin sadece derişimine bağlı olarak değişen özelliklerine koligatif özellikler denir. Buhar basıncı düşmesi, Kaynama noktası yükselmesi, Donma noktası azalması
Çözeltiler. MÜHENDİSLİK KİMYASI DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN. Yrd. Doç. Dr. Atilla EVCİN Afyonkarahisar Kocatepe Üniversitesi 2006
 Çözeltiler Çözelti, iki veya daha fazla maddenin homojen bir karışımı olup, en az iki bileşenden oluşur. Bileşenlerden biri çözücü, diğeri ise çözünendir. MÜHENDİSLİK KİMYASI DERS NOTLARI Yrd. Doç. Dr.
Çözeltiler Çözelti, iki veya daha fazla maddenin homojen bir karışımı olup, en az iki bileşenden oluşur. Bileşenlerden biri çözücü, diğeri ise çözünendir. MÜHENDİSLİK KİMYASI DERS NOTLARI Yrd. Doç. Dr.
Fiziksel özellikleri her yerde aynı olan (homojen) karışımlara çözelti denir. Bir çözeltiyi oluşturan her bir maddeye çözeltinin bileşenleri denir.
 GENEL KİMYA 1 LABORATUARI ÇALIŞMA NOTLARI DENEY: 8 ÇÖZELTİLER Dr. Bahadır KESKİN, 2011 @ YTÜ Fiziksel özellikleri her yerde aynı olan (homojen) karışımlara çözelti denir. Bir çözeltiyi oluşturan her bir
GENEL KİMYA 1 LABORATUARI ÇALIŞMA NOTLARI DENEY: 8 ÇÖZELTİLER Dr. Bahadır KESKİN, 2011 @ YTÜ Fiziksel özellikleri her yerde aynı olan (homojen) karışımlara çözelti denir. Bir çözeltiyi oluşturan her bir
ÇÖZELTİLER VE ÇÖZELTİ KONSANTRASYONLARI 3.1. Çözeltiler için kullanılan temel kavramlar
 1.10.2015. ÇÖZELTİLER VE ÇÖZELTİ KONSANTRASYONLARI.1. Çözeltiler için kullanılan temel kavramlar Homojen karışımlardır. Çözelti iki veya daha fazla maddenin birbiri içerisinde homojen olarak dağılmasından
1.10.2015. ÇÖZELTİLER VE ÇÖZELTİ KONSANTRASYONLARI.1. Çözeltiler için kullanılan temel kavramlar Homojen karışımlardır. Çözelti iki veya daha fazla maddenin birbiri içerisinde homojen olarak dağılmasından
GENEL KİMYA. Yrd.Doç.Dr. Tuba YETİM
 GENEL KİMYA ÇÖZELTİLER Homojen karışımlara çözelti denir. Çözelti bileşiminin ve özelliklerinin çözeltinin her yerinde aynı olması sebebiyle çözelti, «homojen» olarak nitelendirilir. Çözeltinin değişen
GENEL KİMYA ÇÖZELTİLER Homojen karışımlara çözelti denir. Çözelti bileşiminin ve özelliklerinin çözeltinin her yerinde aynı olması sebebiyle çözelti, «homojen» olarak nitelendirilir. Çözeltinin değişen
FARMASÖTİK TEKNOLOJİ I «ÇÖZELTİLER»
 FARMASÖTİK TEKNOLOJİ I «ÇÖZELTİLER» Uygun bir çözücü içerisinde bir ya da birden fazla maddenin çözündüğü veya moleküler düzeyde disperse olduğu tektür (homojen: her tarafta aynı oranda çözünmüş veya dağılmış
FARMASÖTİK TEKNOLOJİ I «ÇÖZELTİLER» Uygun bir çözücü içerisinde bir ya da birden fazla maddenin çözündüğü veya moleküler düzeyde disperse olduğu tektür (homojen: her tarafta aynı oranda çözünmüş veya dağılmış
Kimyafull Gülçin Hoca
 KOLLİGATİF ÖZELLİKLER Kimyafull Gülçin Hoca Buhar basıncının düşmesi Kaynama sıcaklığının yükselmesi Donma sıcaklığının düşmesi Ozmotik basınç A) BUHAR BASINCI DÜŞMESİ RAOULT yasası: Bir çözeltiyi oluşturan
KOLLİGATİF ÖZELLİKLER Kimyafull Gülçin Hoca Buhar basıncının düşmesi Kaynama sıcaklığının yükselmesi Donma sıcaklığının düşmesi Ozmotik basınç A) BUHAR BASINCI DÜŞMESİ RAOULT yasası: Bir çözeltiyi oluşturan
BİYOKİMYASAL ÇÖZELTİLER
 2. HAFTA BİYOKİMYASAL ÇÖZELTİLER Çözelti hazırlanması % Çözeltiler, molar çözeltiler, normal çözeltiler, osmolar çözeltiler, izotonik çözeltiler, molal çözeltiler, ppm çözeltiler BİYOKİMYASAL ÇÖZELTİLER
2. HAFTA BİYOKİMYASAL ÇÖZELTİLER Çözelti hazırlanması % Çözeltiler, molar çözeltiler, normal çözeltiler, osmolar çözeltiler, izotonik çözeltiler, molal çözeltiler, ppm çözeltiler BİYOKİMYASAL ÇÖZELTİLER
HEDEF VE DAVRANIŞLAR:
 HEDEF VE DAVRANIŞLAR: 1) Çözünürlük konusuna giriş yapılır ve günlük hayattan örnekler vererek anlaşılmasının sağlanır. 2) Çözünürlüğe etki eden faktörlerin anlatılır ve örneklerle pekiştirilir. 3) Çözünürlüğe
HEDEF VE DAVRANIŞLAR: 1) Çözünürlük konusuna giriş yapılır ve günlük hayattan örnekler vererek anlaşılmasının sağlanır. 2) Çözünürlüğe etki eden faktörlerin anlatılır ve örneklerle pekiştirilir. 3) Çözünürlüğe
Suda çözündüğünde hidrojen iyonu verebilen maddeler asit, hidroksil iyonu verebilenler baz olarak tanımlanmıştır.
 7. ASİTLER VE BAZLAR Arrhenius AsitBaz Tanımı (1884) (Svante Arrhenius) Suda çözündüğünde hidrojen iyonu verebilen maddeler asit, hidroksil iyonu verebilenler baz olarak tanımlanmıştır. HCl H + + Cl NaOH
7. ASİTLER VE BAZLAR Arrhenius AsitBaz Tanımı (1884) (Svante Arrhenius) Suda çözündüğünde hidrojen iyonu verebilen maddeler asit, hidroksil iyonu verebilenler baz olarak tanımlanmıştır. HCl H + + Cl NaOH
Aeresol. Süspansiyon. Heterojen Emülsiyon. Karışım. Kolloidal. Çözelti < 10-9 m Süspansiyon > 10-6 m Kolloid 10-9 m m
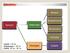 Aeresol Süspansiyon Karışım Heterojen Emülsiyon Kolloidal Çözelti < 10-9 m Süspansiyon > 10-6 m Kolloid 10-9 m - 10-6 m Homojen Çözelti Dağılan Faz Dağılma Fazı Kolloid Tipi katı katı,sıvı,gaz sol katı
Aeresol Süspansiyon Karışım Heterojen Emülsiyon Kolloidal Çözelti < 10-9 m Süspansiyon > 10-6 m Kolloid 10-9 m - 10-6 m Homojen Çözelti Dağılan Faz Dağılma Fazı Kolloid Tipi katı katı,sıvı,gaz sol katı
 1. 250 ml 0,20 M CuSO 4 (aq) çözeltisi hazırlamak için gerekli olan CuSO 4.5H 2 O kütlesini bulunuz. Bu çözeltiden 100 ml 0,10 M CuSO 4 (aq) çözeltisini nasıl hazırlarsınız?( Cu: 63,5; S:32; O:16; H:1)
1. 250 ml 0,20 M CuSO 4 (aq) çözeltisi hazırlamak için gerekli olan CuSO 4.5H 2 O kütlesini bulunuz. Bu çözeltiden 100 ml 0,10 M CuSO 4 (aq) çözeltisini nasıl hazırlarsınız?( Cu: 63,5; S:32; O:16; H:1)
TURUNCU RENGĐN DANSI NASIL OLUR?
 KĐMYA EĞĐE ĞĐTĐM M SEMĐNER NERĐ PROF. DR. ĐNCĐ MORGĐL TURUNCU RENGĐN DANSI NASIL OLUR? HAZIRLAYAN: GÜLÇĐN YALLI KONU: ÇÖZELTĐLER KONU BAŞLIĞI: TURUNCU RENGĐN DANSI NASIL OLUR? ÇÖZELTĐLER Fiziksel özellikleri
KĐMYA EĞĐE ĞĐTĐM M SEMĐNER NERĐ PROF. DR. ĐNCĐ MORGĐL TURUNCU RENGĐN DANSI NASIL OLUR? HAZIRLAYAN: GÜLÇĐN YALLI KONU: ÇÖZELTĐLER KONU BAŞLIĞI: TURUNCU RENGĐN DANSI NASIL OLUR? ÇÖZELTĐLER Fiziksel özellikleri
6.PPB (milyarda bir kısım) Kaynakça Tablo A-1: Çözelti Örnekleri... 5 Tablo B-1:Kolloidal Tanecikler... 8
 İçindekiler A. ÇÖZELTİLER... 2 1.Çözünme... 2 2.Homojenlik... 4 3.Çözelti... 5 4.Çözünürlük... 5 Çözünürlüğe Sıcaklık Ve Basınç Etkisi... 6 B. KARIŞIMLAR... 7 1.Çözeltiler... 7 2.Kolloidal Karışımlar...
İçindekiler A. ÇÖZELTİLER... 2 1.Çözünme... 2 2.Homojenlik... 4 3.Çözelti... 5 4.Çözünürlük... 5 Çözünürlüğe Sıcaklık Ve Basınç Etkisi... 6 B. KARIŞIMLAR... 7 1.Çözeltiler... 7 2.Kolloidal Karışımlar...
GIDALARIN BAZI FİZİKSEL NİTELİKLERİ
 GIDALARIN BAZI FİZİKSEL NİTELİKLERİ 1 Gıdaların bazı fiziksel özellikleri: Yoğunluk Özgül ısı Viskozite Gıdaların kimyasal bileşimi ve fiziksel yapılarına bağlı olarak BELLİ SINIRLARDA DEĞİŞİR!!! Kimyasal
GIDALARIN BAZI FİZİKSEL NİTELİKLERİ 1 Gıdaların bazı fiziksel özellikleri: Yoğunluk Özgül ısı Viskozite Gıdaların kimyasal bileşimi ve fiziksel yapılarına bağlı olarak BELLİ SINIRLARDA DEĞİŞİR!!! Kimyasal
Bir maddenin başka bir madde içerisinde homojen olarak dağılmasına ÇÖZÜNME denir. Çözelti=Çözücü+Çözünen
 ÇÖZÜCÜ VE ÇÖZÜNEN ETKİLEŞİMLERİ: Çözünme olayı ve Çözelti Oluşumu: Bir maddenin başka bir madde içerisinde homojen olarak dağılmasına ÇÖZÜNME denir. Çözelti=Çözücü+Çözünen Çözünme İyonik Çözünme Moleküler
ÇÖZÜCÜ VE ÇÖZÜNEN ETKİLEŞİMLERİ: Çözünme olayı ve Çözelti Oluşumu: Bir maddenin başka bir madde içerisinde homojen olarak dağılmasına ÇÖZÜNME denir. Çözelti=Çözücü+Çözünen Çözünme İyonik Çözünme Moleküler
Çözelti konsantrasyonları. Bir çözeltinin konsantrasyonu, çözeltinin belirli bir hacmi içinde çözünmüş olan madde miktarıdır.
 Çözelti konsantrasyonları Bir çözeltinin konsantrasyonu, çözeltinin belirli bir hacmi içinde çözünmüş olan madde miktarıdır. 1 -Yüzde ( % ) -Molarite (M) -Molalite (m) -Normalite (N) çözelti konsantrasyonlarını
Çözelti konsantrasyonları Bir çözeltinin konsantrasyonu, çözeltinin belirli bir hacmi içinde çözünmüş olan madde miktarıdır. 1 -Yüzde ( % ) -Molarite (M) -Molalite (m) -Normalite (N) çözelti konsantrasyonlarını
ÇÖZÜNME ve ÇÖZÜNÜRLÜK
 ÇÖZÜNME ve ÇÖZÜNÜRLÜK Prof. Dr. Mustafa DEMİR M.DEMİR 05-ÇÖZÜNME VE ÇÖZÜNÜRLÜK 1 Çözünme Olayı Analitik kimyada çözücü olarak genellikle su kullanılır. Su molekülleri, bir oksijen atomuna bağlı iki hidrojen
ÇÖZÜNME ve ÇÖZÜNÜRLÜK Prof. Dr. Mustafa DEMİR M.DEMİR 05-ÇÖZÜNME VE ÇÖZÜNÜRLÜK 1 Çözünme Olayı Analitik kimyada çözücü olarak genellikle su kullanılır. Su molekülleri, bir oksijen atomuna bağlı iki hidrojen
5) Çözünürlük(Xg/100gsu)
 1) I. Havanın sıvılaştırılması II. abrika bacasından çıkan SO 3 gazının H 2 O ile birleşmesi III. Na metalinin suda çözünmesi Yukardaki olaylardan hangilerinde kimyasal değişme gerçekleşir? 4) Kütle 1
1) I. Havanın sıvılaştırılması II. abrika bacasından çıkan SO 3 gazının H 2 O ile birleşmesi III. Na metalinin suda çözünmesi Yukardaki olaylardan hangilerinde kimyasal değişme gerçekleşir? 4) Kütle 1
ÇÖZÜNÜRLÜK ÇÖZÜNÜRLÜĞE ETKİ EDEN FAKTÖRLER
 ÇÖZÜNÜRLÜK ÇÖZÜNÜRLÜĞE ETKİ EDEN FAKTÖRLER ÇÖZÜNÜRLÜK Belirli sıcaklık ve basınçta genelde 100 g suda çözünen maksimum madde miktarına çözünürlük denir. Çözünürlük t C de X gr / 100 gr su olarak ifade
ÇÖZÜNÜRLÜK ÇÖZÜNÜRLÜĞE ETKİ EDEN FAKTÖRLER ÇÖZÜNÜRLÜK Belirli sıcaklık ve basınçta genelde 100 g suda çözünen maksimum madde miktarına çözünürlük denir. Çözünürlük t C de X gr / 100 gr su olarak ifade
ÇÖZÜNÜRLÜĞE ETKİ EDEN FAKTÖRLER
 ÇÖZÜNÜRLÜĞE ETKİ EDEN FAKTÖRLER 1- SICAKLIK 2- ORTAK İYON ETKİSİ 3- ÇÖZÜCÜ ÇÖZÜNEN CİNSİ 4- BASINCIN ETKİSİ 1- SICAKLIK ETKİSİ Sıcaklık etkisi Le Chatelier prensibine bağlı olarak yorumlanır. ENDOTERMİK
ÇÖZÜNÜRLÜĞE ETKİ EDEN FAKTÖRLER 1- SICAKLIK 2- ORTAK İYON ETKİSİ 3- ÇÖZÜCÜ ÇÖZÜNEN CİNSİ 4- BASINCIN ETKİSİ 1- SICAKLIK ETKİSİ Sıcaklık etkisi Le Chatelier prensibine bağlı olarak yorumlanır. ENDOTERMİK
HACETTEPE ÜNĐVERSĐTESĐ ÖĞRETĐM TEKNOLOJĐLERĐ VE MATERYAL GELĐŞTĐRME KONU ANLATIMI. Hazırlayan: Hale Sümerkan. Dersin Sorumlusu: Prof. Dr.
 HACETTEPE ÜNĐVERSĐTESĐ ÖĞRETĐM TEKNOLOJĐLERĐ VE MATERYAL GELĐŞTĐRME KONU ANLATIMI Hazırlayan: Hale Sümerkan Dersin Sorumlusu: Prof. Dr.Đnci Morgil ANKARA 2008 ÇÖZELTĐLER Çözeltiler, iki ya da daha fazla
HACETTEPE ÜNĐVERSĐTESĐ ÖĞRETĐM TEKNOLOJĐLERĐ VE MATERYAL GELĐŞTĐRME KONU ANLATIMI Hazırlayan: Hale Sümerkan Dersin Sorumlusu: Prof. Dr.Đnci Morgil ANKARA 2008 ÇÖZELTĐLER Çözeltiler, iki ya da daha fazla
İLK ANYONLAR , PO 4. Cl -, SO 4 , CO 3 , NO 3
 İLK ANYONLAR Cl -, SO -, CO -, PO -, NO - İLK ANYONLAR Anyonlar negatif yüklü iyonlardır. Kalitatif analitik kimya analizlerine ilk anyonlar olarak adlandırılan Cl -, SO -, CO -, PO -, NO - analizi ile
İLK ANYONLAR Cl -, SO -, CO -, PO -, NO - İLK ANYONLAR Anyonlar negatif yüklü iyonlardır. Kalitatif analitik kimya analizlerine ilk anyonlar olarak adlandırılan Cl -, SO -, CO -, PO -, NO - analizi ile
İnstagram:kimyaci_glcn_hoca SIVI ÇÖZELTİLER VE ÇÖZÜNÜRLÜK. kimyaci_glcn_hoca
 SIVI ÇÖZELTİLER VE ÇÖZÜNÜRLÜK SIVI ÇÖZELTİLER H 2 O, CH 3 CI, HF, H 2 S gibi moleküller; *Sıvılar ise polardır. * Bu tür maddeler dipol dipol etkileşimi oluşturur *Birbiri içerisinde *Çözelti:Çözünen +
SIVI ÇÖZELTİLER VE ÇÖZÜNÜRLÜK SIVI ÇÖZELTİLER H 2 O, CH 3 CI, HF, H 2 S gibi moleküller; *Sıvılar ise polardır. * Bu tür maddeler dipol dipol etkileşimi oluşturur *Birbiri içerisinde *Çözelti:Çözünen +
KİMYA II DERS NOTLARI
 KİMYA II DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN Sulu Çözeltilerin Doğası Elektrolitler Metallerde elektronların hareketiyle elektrik yükü taşınır. Saf su Suda çözünmüş Oksijen gazı Çözeltideki moleküllerin
KİMYA II DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN Sulu Çözeltilerin Doğası Elektrolitler Metallerde elektronların hareketiyle elektrik yükü taşınır. Saf su Suda çözünmüş Oksijen gazı Çözeltideki moleküllerin
Her madde atomlardan oluşur
 2 Yaşamın kimyası Figure 2.1 Helyum Atomu Çekirdek Her madde atomlardan oluşur 2.1 Atom yapısı - madde özelliği Elektron göz ardı edilebilir kütle; eksi yük Çekirdek: Protonlar kütlesi var; artı yük Nötronlar
2 Yaşamın kimyası Figure 2.1 Helyum Atomu Çekirdek Her madde atomlardan oluşur 2.1 Atom yapısı - madde özelliği Elektron göz ardı edilebilir kütle; eksi yük Çekirdek: Protonlar kütlesi var; artı yük Nötronlar
BİLEŞİKLER ve FORMÜLLERİ
 BİLEŞİKLER ve FORMÜLLERİ Bileşikler ve Formülleri Bilinen yaklaşık 120 çeşit element vardır. Bu elementlerin yaklaşık % 90 ı tabiatta bulunur. Ancak bugün bilinen yaklaşık 30 milyon bileşik vardır. Buna
BİLEŞİKLER ve FORMÜLLERİ Bileşikler ve Formülleri Bilinen yaklaşık 120 çeşit element vardır. Bu elementlerin yaklaşık % 90 ı tabiatta bulunur. Ancak bugün bilinen yaklaşık 30 milyon bileşik vardır. Buna
Paylaşılan elektron ya da elektronlar, her iki çekirdek etrafında dolanacaklar, iki çekirdek arasındaki bölgede daha uzun süre bulundukları için bu
 4.Kimyasal Bağlar Kimyasal Bağlar Aynı ya da farklı cins atomları bir arada tutan kuvvetlere kimyasal bağlar denir. Pek çok madde farklı element atomlarının birleşmesiyle meydana gelmiştir. İyonik bağ
4.Kimyasal Bağlar Kimyasal Bağlar Aynı ya da farklı cins atomları bir arada tutan kuvvetlere kimyasal bağlar denir. Pek çok madde farklı element atomlarının birleşmesiyle meydana gelmiştir. İyonik bağ
ÇÖZELTİLERDE YÜZDELİK İFADELER. Ağırlıkça yüzde (% w/w)
 ÇÖZELTİ HAZIRLAMA İki veya daha çok maddenin çıplak gözle veya optik araçlarla yan yana fark edilememesi ve mekanik yollarla ayrılamaması sonucu oluşturdukları karışıma çözelti adı verilir. Anorganik kimyada,
ÇÖZELTİ HAZIRLAMA İki veya daha çok maddenin çıplak gözle veya optik araçlarla yan yana fark edilememesi ve mekanik yollarla ayrılamaması sonucu oluşturdukları karışıma çözelti adı verilir. Anorganik kimyada,
YouTube:Kimyafull Gülçin Hoca Serüveni DERİŞİM BİRİMLERİ Ppm-ppb SORU ÇÖZÜMLERİ
 Serüveni DERİŞİM BİRİMLERİ Ppm-ppb SORU ÇÖZÜMLERİ ppm Toplam madde miktarının milyonda 1 birimlik maddesine denir. NOT: 1 kg su = 1 Litre ppm =. 10 6 1 kg çözeltide çözünen maddenin mg olarak kütlesine
Serüveni DERİŞİM BİRİMLERİ Ppm-ppb SORU ÇÖZÜMLERİ ppm Toplam madde miktarının milyonda 1 birimlik maddesine denir. NOT: 1 kg su = 1 Litre ppm =. 10 6 1 kg çözeltide çözünen maddenin mg olarak kütlesine
Serüveni 3. ÜNİTE KİMYASAL TÜRLER ARASI ETKİLEŞİM GÜÇLÜ ETKİLEŞİM. o İYONİK BAĞ o KOVALENT BAĞ o METALİK BAĞ
 Serüveni 3. ÜNİTE KİMYASAL TÜRLER ARASI ETKİLEŞİM GÜÇLÜ ETKİLEŞİM o İYONİK BAĞ o KOVALENT BAĞ o METALİK BAĞ KİMYASAL TÜR 1. İYONİK BAĞ - - Ametal.- Kök Kök Kök (+) ve (-) yüklü iyonların çekim kuvvetidir..halde
Serüveni 3. ÜNİTE KİMYASAL TÜRLER ARASI ETKİLEŞİM GÜÇLÜ ETKİLEŞİM o İYONİK BAĞ o KOVALENT BAĞ o METALİK BAĞ KİMYASAL TÜR 1. İYONİK BAĞ - - Ametal.- Kök Kök Kök (+) ve (-) yüklü iyonların çekim kuvvetidir..halde
KOLLİGATİF ÖZELLİKLER SORU ÇÖZÜMÜ
 KOLLİGATİF ÖZELLİKLER SORU ÇÖZÜMÜ KOLLİGATİF ÖZELLİKLER Çözeltinin derişimine bağlı özelliklerine KOLİGATİF ÖZELLİK denir. Kaynama noktası Buhar basıncı Donma noktası Osmotik Basınç Çözünen Madde çözündüğünde:
KOLLİGATİF ÖZELLİKLER SORU ÇÖZÜMÜ KOLLİGATİF ÖZELLİKLER Çözeltinin derişimine bağlı özelliklerine KOLİGATİF ÖZELLİK denir. Kaynama noktası Buhar basıncı Donma noktası Osmotik Basınç Çözünen Madde çözündüğünde:
Sulu Çözeltiler ve Kimyasal Denge
 Sulu Çözeltiler ve Kimyasal Denge Sulu Çözeltiler Çözelti: iki veya daha fazla maddenin meydana getirdiği homojen karışımdır. çözücü, Kütlece fazla olan (veya çözme işlemini yapan) bileşene çözücü denir.
Sulu Çözeltiler ve Kimyasal Denge Sulu Çözeltiler Çözelti: iki veya daha fazla maddenin meydana getirdiği homojen karışımdır. çözücü, Kütlece fazla olan (veya çözme işlemini yapan) bileşene çözücü denir.
DENEY I ÇÖZELTİ KONSANTRASYONLARI. Genel Bilgi
 DENEY I ÇÖZELTİ KONSANTRASYONLARI Genel Bilgi 1. Çözelti İki ya da daha fazla maddenin herhangi bir oranda bir araya gelerek oluşturdukları homojen karışıma çözelti denir. Diğer bir deyişle, bir maddenin
DENEY I ÇÖZELTİ KONSANTRASYONLARI Genel Bilgi 1. Çözelti İki ya da daha fazla maddenin herhangi bir oranda bir araya gelerek oluşturdukları homojen karışıma çözelti denir. Diğer bir deyişle, bir maddenin
ASİTLER- BAZLAR. Suyun kendi kendine iyonlaşmasına Suyun Otonizasyonu - Otoprotoliz adı verilir. Suda oluşan H + sadece protondur.
 ASİTLER- BAZLAR SUYUN OTONİZASYONU: Suyun kendi kendine iyonlaşmasına Suyun Otonizasyonu - Otoprotoliz adı verilir. Suda oluşan H + sadece protondur. H 2 O (S) H + (suda) + OH - (Suda) H 2 O (S) + H +
ASİTLER- BAZLAR SUYUN OTONİZASYONU: Suyun kendi kendine iyonlaşmasına Suyun Otonizasyonu - Otoprotoliz adı verilir. Suda oluşan H + sadece protondur. H 2 O (S) H + (suda) + OH - (Suda) H 2 O (S) + H +
ÇÖZELTİ HAZIRLAMA. Kimyasal analizin temel kavramlarından olan çözeltinin anlamı, hazırlanışı ve kullanılışının öğrenilmesidir.
 1. DENEYİN AMACI ÇÖZELTİ HAZIRLAMA Kimyasal analizin temel kavramlarından olan çözeltinin anlamı, hazırlanışı ve kullanılışının öğrenilmesidir. 2. DENEYİN ANLAM VE ÖNEMİ Bir kimyasal bileşikte veya karışımda
1. DENEYİN AMACI ÇÖZELTİ HAZIRLAMA Kimyasal analizin temel kavramlarından olan çözeltinin anlamı, hazırlanışı ve kullanılışının öğrenilmesidir. 2. DENEYİN ANLAM VE ÖNEMİ Bir kimyasal bileşikte veya karışımda
SU VE HÜCRE İLİŞKİSİ
 SU VE HÜCRE İLİŞKİSİ Oluşturacağı her 1 g organik madde için bitkinin 500 g kadar suyu kökleriyle alması ve tepe (uç) noktasına kadar taşıyarak atmosfere aktarması gerekir. Normal su düzeyinde hayvan hücrelerinin
SU VE HÜCRE İLİŞKİSİ Oluşturacağı her 1 g organik madde için bitkinin 500 g kadar suyu kökleriyle alması ve tepe (uç) noktasına kadar taşıyarak atmosfere aktarması gerekir. Normal su düzeyinde hayvan hücrelerinin
ÖĞRETĐM TEKNOLOJĐSĐ VE MATERYAL GELĐŞTĐRME ÇÖZELTĐLER
 ÖĞRETĐM TEKNOLOJĐSĐ VE MATERYAL GELĐŞTĐRME ÇÖZELTĐLER Ders Sorumlusu: Prof. Dr. Đnci MORGĐL HAZIRLAYAN: NAZLI KIRCI ANKARA,2008 KONU ANLATIMI ÇÖZELTĐLER Đki ya da daha fazla kimyasal maddenin herhangi
ÖĞRETĐM TEKNOLOJĐSĐ VE MATERYAL GELĐŞTĐRME ÇÖZELTĐLER Ders Sorumlusu: Prof. Dr. Đnci MORGĐL HAZIRLAYAN: NAZLI KIRCI ANKARA,2008 KONU ANLATIMI ÇÖZELTĐLER Đki ya da daha fazla kimyasal maddenin herhangi
Çözünürlük kuralları
 Çözünürlük kuralları Bütün amonyum, bileşikleri suda çok çözünürler. Alkali metal (Grup IA) bileşikleri suda çok çözünürler. Klorür (Cl ), bromür (Br ) ve iyodür (I ) bileşikleri suda çok çözünürler, ancak
Çözünürlük kuralları Bütün amonyum, bileşikleri suda çok çözünürler. Alkali metal (Grup IA) bileşikleri suda çok çözünürler. Klorür (Cl ), bromür (Br ) ve iyodür (I ) bileşikleri suda çok çözünürler, ancak
ÇÖZELTİ/MİX HAZIRLAMA ZENGİNLEŞTİRME (SPIKE) YAPMA
 T.C. GIDA TARIM VE HAYVANCILIK BAKANLIĞI ULUSAL GIDA REFERANS LABORATUVARI EĞİTİM NOTU ÇÖZELTİ/MİX HAZIRLAMA ZENGİNLEŞTİRME (SPIKE) YAPMA Hazırlayan: Dr.Özge ÇETİNKAYA AÇAR T.C. GIDA TARIM VE HAYVANCILIK
T.C. GIDA TARIM VE HAYVANCILIK BAKANLIĞI ULUSAL GIDA REFERANS LABORATUVARI EĞİTİM NOTU ÇÖZELTİ/MİX HAZIRLAMA ZENGİNLEŞTİRME (SPIKE) YAPMA Hazırlayan: Dr.Özge ÇETİNKAYA AÇAR T.C. GIDA TARIM VE HAYVANCILIK
Su ve çevrenin canlılar için uygunluğu
 Su ve çevrenin canlılar için uygunluğu Su ve çevrenin canlılar için uygunluğu Yeryüzündeki yaşam su içinde ortaya çıkmış ve canlıların karalar üzerine yayılışından önceki 3 milyar yıl boyunca su içinde
Su ve çevrenin canlılar için uygunluğu Su ve çevrenin canlılar için uygunluğu Yeryüzündeki yaşam su içinde ortaya çıkmış ve canlıların karalar üzerine yayılışından önceki 3 milyar yıl boyunca su içinde
GENEL KİMYA 101 ÖDEV 3
 TOBB EKONOMİ VE TEKNOLOJİ ÜNİVERSİTESİ-27 Kasım 2013 Bütün Şubeler GENEL KİMYA 101 ÖDEV 3 ÖNEMLİ! Ödev Teslim Tarihi: 6 Aralık 2013 Soru 1-5 arasında 2 soru Soru 6-10 arasında 2 soru Soru 11-15 arasında
TOBB EKONOMİ VE TEKNOLOJİ ÜNİVERSİTESİ-27 Kasım 2013 Bütün Şubeler GENEL KİMYA 101 ÖDEV 3 ÖNEMLİ! Ödev Teslim Tarihi: 6 Aralık 2013 Soru 1-5 arasında 2 soru Soru 6-10 arasında 2 soru Soru 11-15 arasında
HAZIRLAYAN Mutlu ġahġn. Hacettepe Fen Bilgisi Öğretmenliği DENEY NO: 3 DENEYĠN ADI: ASĠT, BAZ VE TUZLARIN ĠLETKENLĠĞĠ
 HAZIRLAYAN Mutlu ġahġn Hacettepe Fen Bilgisi Öğretmenliği DENEY NO: 3 DENEYĠN ADI: ASĠT, BAZ VE TUZLARIN ĠLETKENLĠĞĠ DENEYĠN AMACI: ASĠT, BAZ VE TUZLARIN SULU ÇÖZELTĠLERĠNDE ĠYONLARINA AYRIġARAK ELEKTRĠK
HAZIRLAYAN Mutlu ġahġn Hacettepe Fen Bilgisi Öğretmenliği DENEY NO: 3 DENEYĠN ADI: ASĠT, BAZ VE TUZLARIN ĠLETKENLĠĞĠ DENEYĠN AMACI: ASĠT, BAZ VE TUZLARIN SULU ÇÖZELTĠLERĠNDE ĠYONLARINA AYRIġARAK ELEKTRĠK
Fizyoloji. Vücut Sıvı Bölmeleri ve Özellikleri. Dr. Deniz Balcı.
 Fizyoloji Vücut Sıvı Bölmeleri ve Özellikleri Dr. Deniz Balcı [email protected] Ders İçeriği 1 Vücut Sıvı Bölmeleri ve Hacimleri 2 Vücut Sıvı Bileşenleri 3 Sıvıların Bölmeler Arasındaki HarekeF Okuma
Fizyoloji Vücut Sıvı Bölmeleri ve Özellikleri Dr. Deniz Balcı [email protected] Ders İçeriği 1 Vücut Sıvı Bölmeleri ve Hacimleri 2 Vücut Sıvı Bileşenleri 3 Sıvıların Bölmeler Arasındaki HarekeF Okuma
Atomlar ve Moleküller
 Atomlar ve Moleküller Madde, uzayda yer işgal eden ve kütlesi olan herşeydir. Element, kimyasal tepkimelerle başka bileşiklere parçalanamayan maddedir. -Doğada 92 tane element bulunmaktadır. Bileşik, belli
Atomlar ve Moleküller Madde, uzayda yer işgal eden ve kütlesi olan herşeydir. Element, kimyasal tepkimelerle başka bileşiklere parçalanamayan maddedir. -Doğada 92 tane element bulunmaktadır. Bileşik, belli
ÇÖZELTILERDE DENGE. Asitler ve Bazlar
 ÇÖZELTILERDE DENGE Asitler ve Bazlar Zayıf Asit ve Bazlar Değişik asitler için verilen ph değerlerinin farklılık gösterdiğini görürüz. Bir önceki konuda ph değerinin [H₃O + ] ile ilgili olduğunu gördük.
ÇÖZELTILERDE DENGE Asitler ve Bazlar Zayıf Asit ve Bazlar Değişik asitler için verilen ph değerlerinin farklılık gösterdiğini görürüz. Bir önceki konuda ph değerinin [H₃O + ] ile ilgili olduğunu gördük.
BİLEŞİKLER VE FORMÜLLERİ
 BİLEŞİKLER VE FORMÜLLERİ Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur). Bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere
BİLEŞİKLER VE FORMÜLLERİ Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur). Bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere
KĐMYA EĞĐTĐMĐ DERSĐ PROF.DR.ĐNCĐ MORGĐL
 KĐMYA EĞĐE ĞĐTĐMĐ DERSĐ PROF.DR.ĐNC NCĐ MORGĐL SINIF:11 DERS SAATĐ:4 KĐMYASAL REAKSĐYONLAR Sulu çözeltilerde olan reaksiyonlar Sulu çözeltilerde çökelme ve çözünme ile ilgili kurallar Gaz çıkışıışı olan
KĐMYA EĞĐE ĞĐTĐMĐ DERSĐ PROF.DR.ĐNC NCĐ MORGĐL SINIF:11 DERS SAATĐ:4 KĐMYASAL REAKSĐYONLAR Sulu çözeltilerde olan reaksiyonlar Sulu çözeltilerde çökelme ve çözünme ile ilgili kurallar Gaz çıkışıışı olan
ASİTLER, BAZLAR ve TUZLAR
 ASİTLER, BAZLAR ve TUZLAR 1. ASİTLER Sulu çözeltilerine Hidrojen İyonu veren maddelere asit denir. Ör 1 HCl : Hidroklorik asit HCl H + + Cl - Ör 2 H 2 SO 4 : Sülfürik asit H 2 SO 4 2H + + SO 4-2 Ör 3 Nitrik
ASİTLER, BAZLAR ve TUZLAR 1. ASİTLER Sulu çözeltilerine Hidrojen İyonu veren maddelere asit denir. Ör 1 HCl : Hidroklorik asit HCl H + + Cl - Ör 2 H 2 SO 4 : Sülfürik asit H 2 SO 4 2H + + SO 4-2 Ör 3 Nitrik
İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA
 İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA İNCELENİR Her tarafında aynı özelliği gösteren, tek bir madde
İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA İNCELENİR Her tarafında aynı özelliği gösteren, tek bir madde
İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA İNCELENİR
 KARIŞIMLAR İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA İNCELENİR Her tarafında aynı özelliği gösteren, tek
KARIŞIMLAR İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA İNCELENİR Her tarafında aynı özelliği gösteren, tek
KARIŞIMLARIN SINIFLANDIRILMASI
 IN SINIFLANDIRILMASI Doğadaki maddelerin çoğu saf halde bulunmaz. Çevremizde gördüğümüz maddeler genellikle karışım halindedir. Soluduğumuz hava, yediğimiz çikolata, kek, içtiğimiz meyve suyu, süt hatta
IN SINIFLANDIRILMASI Doğadaki maddelerin çoğu saf halde bulunmaz. Çevremizde gördüğümüz maddeler genellikle karışım halindedir. Soluduğumuz hava, yediğimiz çikolata, kek, içtiğimiz meyve suyu, süt hatta
Örnek : 3- Bileşiklerin Özellikleri :
 Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani
Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani
4. ÇÖZÜNÜRLÜK. Çözünürlük Çarpımı Kçç. NaCl Na+ + Cl- (%100 iyonlaşma) AgCl(k) Ag + (ç) + Cl - (ç) (Kimyasal dengeye göre iyonlaşma) K = [AgCl(k)]
![4. ÇÖZÜNÜRLÜK. Çözünürlük Çarpımı Kçç. NaCl Na+ + Cl- (%100 iyonlaşma) AgCl(k) Ag + (ç) + Cl - (ç) (Kimyasal dengeye göre iyonlaşma) K = [AgCl(k)] 4. ÇÖZÜNÜRLÜK. Çözünürlük Çarpımı Kçç. NaCl Na+ + Cl- (%100 iyonlaşma) AgCl(k) Ag + (ç) + Cl - (ç) (Kimyasal dengeye göre iyonlaşma) K = [AgCl(k)]](/thumbs/69/61024076.jpg) 4. ÇÖZÜNÜRLÜK Çözünürlük Çarpımı NaCl Na+ + Cl- (%100 iyonlaşma) AgCl(k) Ag + (ç) + Cl - (ç) (Kimyasal dengeye göre iyonlaşma) + - [Ag ][Cl ] K = [AgCl(k)] K [AgCl(k)] = [Ag + ] [Cl - ] = [Ag + ] [Cl -
4. ÇÖZÜNÜRLÜK Çözünürlük Çarpımı NaCl Na+ + Cl- (%100 iyonlaşma) AgCl(k) Ag + (ç) + Cl - (ç) (Kimyasal dengeye göre iyonlaşma) + - [Ag ][Cl ] K = [AgCl(k)] K [AgCl(k)] = [Ag + ] [Cl - ] = [Ag + ] [Cl -
ASİT-BAZ VE ph. MÜHENDİSLİK KİMYASI DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN. Yrd. Doç. Dr. Atilla Evcin Afyonkarahisar Kocatepe Üniversitesi 2006
 ASİT-BAZ VE ph MÜHENDİSLİK KİMYASI DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN Asitler ve bazlar günlük yaşantımızda sıkça karşılaştığımız kavramlardan biridir.insanlar, her nekadar asetil salisilik asit ve
ASİT-BAZ VE ph MÜHENDİSLİK KİMYASI DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN Asitler ve bazlar günlük yaşantımızda sıkça karşılaştığımız kavramlardan biridir.insanlar, her nekadar asetil salisilik asit ve
10. Sınıf Kimya Konuları KİMYANIN TEMEL KANUNLARI VE TEPKİME TÜRLERİ Kimyanın Temel Kanunları Kütlenin korunumu, sabit oranlar ve katlı oranlar
 10. Sınıf Kimya Konuları KİMYANIN TEMEL KANUNLARI VE TEPKİME TÜRLERİ Kimyanın Temel Kanunları Kütlenin korunumu, sabit oranlar ve katlı oranlar kanunları Demir (II) sülfür bileşiğinin elde edilmesi Kimyasal
10. Sınıf Kimya Konuları KİMYANIN TEMEL KANUNLARI VE TEPKİME TÜRLERİ Kimyanın Temel Kanunları Kütlenin korunumu, sabit oranlar ve katlı oranlar kanunları Demir (II) sülfür bileşiğinin elde edilmesi Kimyasal
Bileşikteki atomların cinsini ve oranını belirten formüldür. Kaba formül ile bileşiğin molekül ağırlığı hesaplanamaz.
 BİLEŞİKLER Birden fazla elementin belirli oranlarda kimyasal yollarla bir araya gelerek, kendi özelligini kaybedip oluşturdukları yeni saf maddeye bileşik denir. Bileşikteki atomların cins ve sayısını
BİLEŞİKLER Birden fazla elementin belirli oranlarda kimyasal yollarla bir araya gelerek, kendi özelligini kaybedip oluşturdukları yeni saf maddeye bileşik denir. Bileşikteki atomların cins ve sayısını
Doğal Rb elementinin atom kütlesi 85,47 g/mol dür ve atom kütleleri 84,91 g/mol olan 86 Rb ile 86,92 olan 87
 Doğal Rb elementinin atom kütlesi 85,47 g/mol dür ve atom kütleleri 84,91 g/mol olan 86 Rb ile 86,92 olan 87 Rb izotoplarından oluşmuştur. İzotopların doğada bulunma yüzdelerini hesaplayınız. Bir bileşik
Doğal Rb elementinin atom kütlesi 85,47 g/mol dür ve atom kütleleri 84,91 g/mol olan 86 Rb ile 86,92 olan 87 Rb izotoplarından oluşmuştur. İzotopların doğada bulunma yüzdelerini hesaplayınız. Bir bileşik
SU Dr. Fatih Büyükserin
 SU Dr. Fatih Büyükserin SU Organizma ağırlığının yüzde % 70 ini oluşturur Su molekülleri arasındaki çekim kuvvetleri ve suyun az da olsa iyonlaşma eğilimi Biyomoleküllerin yapı ve görevlerinin oluşmasında
SU Dr. Fatih Büyükserin SU Organizma ağırlığının yüzde % 70 ini oluşturur Su molekülleri arasındaki çekim kuvvetleri ve suyun az da olsa iyonlaşma eğilimi Biyomoleküllerin yapı ve görevlerinin oluşmasında
HAZIRLAYAN Mutlu ŞAHİN. Hacettepe Fen Bilgisi Öğretmenliği
 HAZIRLAYAN Mutlu ŞAHİN Hacettepe Fen Bilgisi Öğretmenliği DENEY NO: 1 DENEYİN ADI: ÇÖZELTİLER DENEYİN AMACI: FARKLI DERİŞİMLERDE ÇÖZELTİ HAZIRLAYABİLME TEORİK BİLGİ: Katı, sıvı ve gazların birbirleri içerisinde
HAZIRLAYAN Mutlu ŞAHİN Hacettepe Fen Bilgisi Öğretmenliği DENEY NO: 1 DENEYİN ADI: ÇÖZELTİLER DENEYİN AMACI: FARKLI DERİŞİMLERDE ÇÖZELTİ HAZIRLAYABİLME TEORİK BİLGİ: Katı, sıvı ve gazların birbirleri içerisinde
Suyun Fizikokimyasal Özellikleri
 Suyun Fizikokimyasal Özellikleri Su bitkinin yaşamında yaşamsal bir rol oynar. Bitki tarafından yapılan her gram başına organik madde için kökler tarafından 500 gr su alınır. Bu su, bitkinin bir ucundan
Suyun Fizikokimyasal Özellikleri Su bitkinin yaşamında yaşamsal bir rol oynar. Bitki tarafından yapılan her gram başına organik madde için kökler tarafından 500 gr su alınır. Bu su, bitkinin bir ucundan
Moleküllerarası Etkileşimler, Sıvılar ve Katılar - 11
 Moleküllerarası Etkileşimler, Chemistry, The Central Science, 10th edition Theodore L. Brown; H. Eugene LeMay, Jr.; and Bruce E. Bursten Sıvılar ve Katılar - 11 Maddenin Halleri Maddenin halleri arasındaki
Moleküllerarası Etkileşimler, Chemistry, The Central Science, 10th edition Theodore L. Brown; H. Eugene LeMay, Jr.; and Bruce E. Bursten Sıvılar ve Katılar - 11 Maddenin Halleri Maddenin halleri arasındaki
İÇERİK. Suyun Doğası Sulu Çözeltilerin Doğası
 İÇERİK Suyun Doğası Sulu Çözeltilerin Doğası Su içinde İyonik Bileşikler Su içinde Kovalent Bileşikler Çökelme Tepkimesi Asit-Baz Tepkimeleri (Nötürleşme) Yükseltgenme-İndirgenme Tepkimeleri Önemli Tip
İÇERİK Suyun Doğası Sulu Çözeltilerin Doğası Su içinde İyonik Bileşikler Su içinde Kovalent Bileşikler Çökelme Tepkimesi Asit-Baz Tepkimeleri (Nötürleşme) Yükseltgenme-İndirgenme Tepkimeleri Önemli Tip
ÇÖZELTİLERDE DENGE (Asit-Baz)
 ÇÖZELTİLERDE DENGE (AsitBaz) SUYUN OTOİYONİZASYONU Saf suyun elektrik akımını iletmediği bilinir, ancak çok hassas ölçü aletleriyle yapılan deneyler sonucunda suyun çok zayıf da olsa iletken olduğu tespit
ÇÖZELTİLERDE DENGE (AsitBaz) SUYUN OTOİYONİZASYONU Saf suyun elektrik akımını iletmediği bilinir, ancak çok hassas ölçü aletleriyle yapılan deneyler sonucunda suyun çok zayıf da olsa iletken olduğu tespit
SU ve ÇEVRENİN CANLILAR İÇİN UYGUNLUĞU
 SU ve ÇEVRENİN CANLILAR İÇİN UYGUNLUĞU Suyun polaritesinin etkileri Su molekülünün polar olması hidrojen bağlarının oluşmasına neden olur. 2 Su molekülü Oldukça basit yapılıdır. Tekli bağla bağlı olup
SU ve ÇEVRENİN CANLILAR İÇİN UYGUNLUĞU Suyun polaritesinin etkileri Su molekülünün polar olması hidrojen bağlarının oluşmasına neden olur. 2 Su molekülü Oldukça basit yapılıdır. Tekli bağla bağlı olup
MEMM4043 metallerin yeniden kazanımı
 metallerin yeniden kazanımı Endüstriyel Atık Sulardan Metal Geri Kazanım Yöntemleri 2016-2017 güz yy. Prof. Dr. Gökhan Orhan MF212 Atıksularda Ağır Metal Konsantrasyonu Mekanik Temizleme Kimyasal Temizleme
metallerin yeniden kazanımı Endüstriyel Atık Sulardan Metal Geri Kazanım Yöntemleri 2016-2017 güz yy. Prof. Dr. Gökhan Orhan MF212 Atıksularda Ağır Metal Konsantrasyonu Mekanik Temizleme Kimyasal Temizleme
Soygazların bileşik oluşturamamasının sebebi bütün orbitallerinin dolu olmasındandır.
 KİMYASAL BAĞLAR Kimyasal bağ, moleküllerde atomları birarada tutan kuvvettir. Bir bağın oluşabilmesi için atomlar tek başına bulundukları zamankinden daha kararlı (az enerjiye sahip) olmalıdırlar. Genelleme
KİMYASAL BAĞLAR Kimyasal bağ, moleküllerde atomları birarada tutan kuvvettir. Bir bağın oluşabilmesi için atomlar tek başına bulundukları zamankinden daha kararlı (az enerjiye sahip) olmalıdırlar. Genelleme
ÇÖZÜNME OLGUSU VE ÇÖZELTĐLER SÜRE : 2 DERS SAATĐ
 ÇÖZÜNME OLGUSU VE ÇÖZELTĐLER SÜRE : 2 DERS SAATĐ HAZIRLAYANLAR: NAZLI KIRCI ESRA N.ÇECE SUPHĐ SEVDĐ HEDEF VE DAVRANIŞLAR. HEDEF 1 : ÇÖZELTĐ VE ÖZELLĐKLERĐNĐ KAVRAYABĐLME DAVRANIŞLAR : 1. Çözünme kavramını
ÇÖZÜNME OLGUSU VE ÇÖZELTĐLER SÜRE : 2 DERS SAATĐ HAZIRLAYANLAR: NAZLI KIRCI ESRA N.ÇECE SUPHĐ SEVDĐ HEDEF VE DAVRANIŞLAR. HEDEF 1 : ÇÖZELTĐ VE ÖZELLĐKLERĐNĐ KAVRAYABĐLME DAVRANIŞLAR : 1. Çözünme kavramını
1. BÖLÜM : ANALİTİK KİMYANIN TEMEL KAVRAMLARI
 ANALİTİK KİMYA DERS NOTLARI Yrd.Doç.Dr.. Hüseyin ÇELİKKAN 1. BÖLÜM : ANALİTİK KİMYANIN TEMEL KAVRAMLARI Analitik kimya, bilimin her alanında faydalanılan, maddenin özellikleri hakkında bilgi veren yöntemlerin
ANALİTİK KİMYA DERS NOTLARI Yrd.Doç.Dr.. Hüseyin ÇELİKKAN 1. BÖLÜM : ANALİTİK KİMYANIN TEMEL KAVRAMLARI Analitik kimya, bilimin her alanında faydalanılan, maddenin özellikleri hakkında bilgi veren yöntemlerin
KONU: MOLEKÜLER BİYOLOJİDE TEMEL TEKNİKLER; Çözeltiler ve Tamponlar
 KONU: MOLEKÜLER BİYOLOJİDE TEMEL TEKNİKLER; Çözeltiler ve Tamponlar AMAÇ: - Moleküler Biyoloji laboratuvarında kullanılan çözeltileri ve hazırlanışlarını öğrenmek. - Biyolojik tamponların kullanım amaçlarını,
KONU: MOLEKÜLER BİYOLOJİDE TEMEL TEKNİKLER; Çözeltiler ve Tamponlar AMAÇ: - Moleküler Biyoloji laboratuvarında kullanılan çözeltileri ve hazırlanışlarını öğrenmek. - Biyolojik tamponların kullanım amaçlarını,
Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı
 Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani madde yani bileşik
Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani madde yani bileşik
KARIŞIMLAR HOMOJEN KARŞIMLAR 1.ÇÖZÜCÜLER VE ÇÖZELTİLER:
 KARIŞIMLAR HOMOJEN KARŞIMLAR 1.ÇÖZÜCÜLER VE ÇÖZELTİLER: Kimyasal tepkimeler arasında, çözelti ve çözelti tepkimeleri önemli yer tutmaktadır. Bir maddenin başka bir madde içinde, gözle görülemeyecek kadar
KARIŞIMLAR HOMOJEN KARŞIMLAR 1.ÇÖZÜCÜLER VE ÇÖZELTİLER: Kimyasal tepkimeler arasında, çözelti ve çözelti tepkimeleri önemli yer tutmaktadır. Bir maddenin başka bir madde içinde, gözle görülemeyecek kadar
Sıvılardan ekstraksiyon:
 Sıvılardan ekstraksiyon: Sıvı haldeki bir karışımdan bir maddenin, bu maddenin içinde bulunduğu çözücü ile karışmayan ve bu maddeyi çözen bir başka çözücü ile çalkalanarak ilgili maddenin ikinci çözücüye
Sıvılardan ekstraksiyon: Sıvı haldeki bir karışımdan bir maddenin, bu maddenin içinde bulunduğu çözücü ile karışmayan ve bu maddeyi çözen bir başka çözücü ile çalkalanarak ilgili maddenin ikinci çözücüye
ÖLÇME, DEĞERLENDİRME VE SINAV HİZMETLERİ GENEL MÜDÜRLÜĞÜ
 AY EKİM 06-07 EĞİTİM - ÖĞRETİM YILI. SINIF VE MEZUN GRUP KİMYA HAFTA DERS SAATİ. Kimya nedir?. Kimya ne işe yarar?. Kimyanın sembolik dili Element-sembol Bileşik-formül. Güvenliğimiz ve Kimya KONU ADI
AY EKİM 06-07 EĞİTİM - ÖĞRETİM YILI. SINIF VE MEZUN GRUP KİMYA HAFTA DERS SAATİ. Kimya nedir?. Kimya ne işe yarar?. Kimyanın sembolik dili Element-sembol Bileşik-formül. Güvenliğimiz ve Kimya KONU ADI
5. ÇÖZÜNÜRLÜK DENGESİ
 5. ÇÖZÜNÜRLÜK DENGESİ Birçok tuz suda çok az çözünür. Tuzların sudaki çözünürlüğünden faydalanarak çökelek oluşumu kontrol edilebilir ve çökme olayı karışımları ayırmak için kullanılabilir. Çözünürlük
5. ÇÖZÜNÜRLÜK DENGESİ Birçok tuz suda çok az çözünür. Tuzların sudaki çözünürlüğünden faydalanarak çökelek oluşumu kontrol edilebilir ve çökme olayı karışımları ayırmak için kullanılabilir. Çözünürlük
ÇÖZÜNÜRLÜK (ORTAK İYON ETKİSİ ) (Çöktürme ile Ayırma)
 ÇÖZÜNÜRLÜ (ORTA İYON ETİSİ ) (Çöktürme ile Ayırma) Prof. Dr. ustafa DEİR 08ORTA İYON ETİSİ07B ÇÖZÜNÜRLÜ ÇÖTÜRE İLE AYIRA 1 ORTA İYON ETİSİ 08ORTA İYON ETİSİ07B ÇÖZÜNÜRLÜ ÇÖTÜRE İLE AYIRA ORTA İYON ETİSİ
ÇÖZÜNÜRLÜ (ORTA İYON ETİSİ ) (Çöktürme ile Ayırma) Prof. Dr. ustafa DEİR 08ORTA İYON ETİSİ07B ÇÖZÜNÜRLÜ ÇÖTÜRE İLE AYIRA 1 ORTA İYON ETİSİ 08ORTA İYON ETİSİ07B ÇÖZÜNÜRLÜ ÇÖTÜRE İLE AYIRA ORTA İYON ETİSİ
EYVAH ŞEKERĐM KAYBOLDU!!!!! 9. SINIF 4. ÜNĐTE KARIŞIMLAR
 EYVAH ŞEKERĐM KAYBOLDU!!!!! 9. SINIF 4. ÜNĐTE KARIŞIMLAR KĐMYA ĐLE ĐLĐŞKĐSĐ ve GÜNLÜK HAYATLA ĐLĐŞKĐSĐ ŞEKERĐN ÇAYDA YA DA BAŞKA BĐR SIVIDA KARIŞTIRILDIĞINDA KAYBOLMASI, KĐMYADA ÇÖZÜNME OLGUSUYLA AÇIKLANABĐLĐR.
EYVAH ŞEKERĐM KAYBOLDU!!!!! 9. SINIF 4. ÜNĐTE KARIŞIMLAR KĐMYA ĐLE ĐLĐŞKĐSĐ ve GÜNLÜK HAYATLA ĐLĐŞKĐSĐ ŞEKERĐN ÇAYDA YA DA BAŞKA BĐR SIVIDA KARIŞTIRILDIĞINDA KAYBOLMASI, KĐMYADA ÇÖZÜNME OLGUSUYLA AÇIKLANABĐLĐR.
ÇÖZÜNÜRLÜK DENGESİ (Kçç)
 ÇÖZÜNÜRLÜK DENGESİ (Kçç) ÇÖZELTİLERDE ÇÖZÜNME VE ÇÖKELME OLAYLARI Çözeltiler doymuşluklarına göre üçe ayrılırlar: 1- Doymamış çözeltiler: Belirli bir sıcaklıkta ve basınçta çözebileceğinden daha az miktarda
ÇÖZÜNÜRLÜK DENGESİ (Kçç) ÇÖZELTİLERDE ÇÖZÜNME VE ÇÖKELME OLAYLARI Çözeltiler doymuşluklarına göre üçe ayrılırlar: 1- Doymamış çözeltiler: Belirli bir sıcaklıkta ve basınçta çözebileceğinden daha az miktarda
ASİTLER VE BAZLAR ASİT VE BAZ KAVRAMLARI M.DEMİR ASİT VE BAZ KAVRAMLARI 1
 ASİTLER VE BAZLAR ASİT VE BAZ KAVRAMLARI M.DEMİR ASİT VE BAZ KAVRAMLARI 1 Asit ve baz, değişik zamanlarda değişik şekillerde tanımlanmıştır. Bugün bu tanımların hepsi de kullanılmaktadır. Hangi tanımın
ASİTLER VE BAZLAR ASİT VE BAZ KAVRAMLARI M.DEMİR ASİT VE BAZ KAVRAMLARI 1 Asit ve baz, değişik zamanlarda değişik şekillerde tanımlanmıştır. Bugün bu tanımların hepsi de kullanılmaktadır. Hangi tanımın
Diffüzyonun özel bir halini ortaya koyan ve osmozis adı verilen bu olgu, bitkilerin yaşamında büyük öneme sahip bulunmaktadır.
 3. Osmozis Ayrımlı geçirgen (yarı geçirgen) bir zarla ayrılmış ortamda suyun, su potansiyelinin (su yoğunluğunun) yüksek olduğu yönden daha düşük olduğu yöne geçişi Osmozis olarak bilinmektedir. Osmozis,
3. Osmozis Ayrımlı geçirgen (yarı geçirgen) bir zarla ayrılmış ortamda suyun, su potansiyelinin (su yoğunluğunun) yüksek olduğu yönden daha düşük olduğu yöne geçişi Osmozis olarak bilinmektedir. Osmozis,
T.C. Ölçme, Seçme ve Yerleştirme Merkezi
 T.C. Ölçme, Seçme ve Yerleştirme Merkezi LİSANS YERLEŞTİRME SINAVI-2 KİMYA TESTİ 17 HAZİRAN 2017 CUMARTESİ Bu testlerin her hakkı saklıdır. Hangi amaçla olursa olsun, testlerin tamamının veya bir kısmının
T.C. Ölçme, Seçme ve Yerleştirme Merkezi LİSANS YERLEŞTİRME SINAVI-2 KİMYA TESTİ 17 HAZİRAN 2017 CUMARTESİ Bu testlerin her hakkı saklıdır. Hangi amaçla olursa olsun, testlerin tamamının veya bir kısmının
Erciyes Üniversitesi Gıda Mühendisliği Bölümü Gıda Analizleri ve Teknolojisi Laboratuvar Föyü Sayfa 1
 LABORATUVAR KURALLARI VE ÇÖZELTİ HAZIRLAMA LABORATUVAR KURALLARI 1. Laboratuvar çalışmaları sırasında elbiselerin özellikle yakıcı ve tehlikeli maddelerden korunması için laboratuara önlükle gelinmelidir.
LABORATUVAR KURALLARI VE ÇÖZELTİ HAZIRLAMA LABORATUVAR KURALLARI 1. Laboratuvar çalışmaları sırasında elbiselerin özellikle yakıcı ve tehlikeli maddelerden korunması için laboratuara önlükle gelinmelidir.
GENEL KİMYA. 7. Konu: Kimyasal reaksiyonlar, Kimyasal eşitlikler, Kimyasal tepkime türleri, Kimyasal Hesaplamalar
 GENEL KİMYA 7. Konu: Kimyasal reaksiyonlar, Kimyasal eşitlikler, Kimyasal tepkime türleri, Kimyasal Hesaplamalar Kimyasal Reaksiyonlar Kimyasal reaksiyon (tepkime), kimyasal maddelerdeki kimyasal değişme
GENEL KİMYA 7. Konu: Kimyasal reaksiyonlar, Kimyasal eşitlikler, Kimyasal tepkime türleri, Kimyasal Hesaplamalar Kimyasal Reaksiyonlar Kimyasal reaksiyon (tepkime), kimyasal maddelerdeki kimyasal değişme
00213 ANALİTİK KİMYA-I SINAV VE ÇALIŞMA SORULARI
 00213 ANALİTİK KİMYA-I SINAV VE ÇALIŞMA SORULARI A) TANIMLAR, KAVRAMLAR ve TEMEL HESAPLAMALAR: 1. Aşağıdaki kavramları birer cümle ile tanımlayınız. Analitik kimya, Sistematik analiz, ph, Tesir değerliği,
00213 ANALİTİK KİMYA-I SINAV VE ÇALIŞMA SORULARI A) TANIMLAR, KAVRAMLAR ve TEMEL HESAPLAMALAR: 1. Aşağıdaki kavramları birer cümle ile tanımlayınız. Analitik kimya, Sistematik analiz, ph, Tesir değerliği,
ASİTLER VE BAZLAR ASİT VE BAZ KAVRAMLARI
 ASİTLER VE BAZLAR ASİT VE BAZ KAVRAMLARI Prof. Dr. Mustafa DEMİR M.DEMİR 0ASİT VE BAZ KAVRAMLARI Asit ve baz, değişik zamanlarda değişik şekillerde tanımlanmıştır. Bugün bu tanımların hepsi de kullanılmaktadır.
ASİTLER VE BAZLAR ASİT VE BAZ KAVRAMLARI Prof. Dr. Mustafa DEMİR M.DEMİR 0ASİT VE BAZ KAVRAMLARI Asit ve baz, değişik zamanlarda değişik şekillerde tanımlanmıştır. Bugün bu tanımların hepsi de kullanılmaktadır.
Hidroklorik asit ve sodyum hidroksitin reaksiyonundan yemek tuzu ve su meydana gelir. Bu kimyasal olayın denklemi
 KİMYASAL DENKLEMLER İki ya da daha fazla maddenin birbirleri ile etkileşerek kendi özelliklerini kaybedip yeni özelliklerde bir takım ürünler meydana getirmesine kimyasal olay, bunların formüllerle gösterilmesine
KİMYASAL DENKLEMLER İki ya da daha fazla maddenin birbirleri ile etkileşerek kendi özelliklerini kaybedip yeni özelliklerde bir takım ürünler meydana getirmesine kimyasal olay, bunların formüllerle gösterilmesine
DENEY 3. MADDENİN ÜÇ HALİ: NİTEL VE NİCEL GÖZLEMLER Sıcaklık ilişkileri
 DENEY 3 MADDENİN ÜÇ HALİ: NİTEL VE NİCEL GÖZLEMLER Sıcaklık ilişkileri AMAÇ: Maddelerin üç halinin nitel ve nicel gözlemlerle incelenerek maddenin sıcaklık ile davranımını incelemek. TEORİ Hal değişimi,
DENEY 3 MADDENİN ÜÇ HALİ: NİTEL VE NİCEL GÖZLEMLER Sıcaklık ilişkileri AMAÇ: Maddelerin üç halinin nitel ve nicel gözlemlerle incelenerek maddenin sıcaklık ile davranımını incelemek. TEORİ Hal değişimi,
Birden çok maddenin kimyasal bağ oluşturmadan bir arada bulunmasıyla meydana gelen maddelere karışım denir.
 Anahtar Kavramlar Çözelti çözücü çözünen homojen hetorojen derişik seyreltik Birden çok maddenin kimyasal bağ oluşturmadan bir arada bulunmasıyla meydana gelen maddelere karışım denir. Solduğumuz hava;
Anahtar Kavramlar Çözelti çözücü çözünen homojen hetorojen derişik seyreltik Birden çok maddenin kimyasal bağ oluşturmadan bir arada bulunmasıyla meydana gelen maddelere karışım denir. Solduğumuz hava;
KARIŞIMLAR. Çözünme: En az iki maddenin birbiri içinde homojen bir şekilde dağılmasına çözünme denir.
 ÇÖZÜCÜLER VE ÇÖZELTİLER KARIŞIMLAR Çözünme: En az iki maddenin birbiri içinde homojen bir şekilde dağılmasına çözünme denir. Çözelti: Boyutu 10 nanometreden küçük olacak şekilde dağılmış maddelerin oluşturduğu
ÇÖZÜCÜLER VE ÇÖZELTİLER KARIŞIMLAR Çözünme: En az iki maddenin birbiri içinde homojen bir şekilde dağılmasına çözünme denir. Çözelti: Boyutu 10 nanometreden küçük olacak şekilde dağılmış maddelerin oluşturduğu
SU VE KİMYASAL BAĞLAR. Yrd. Doç. Dr. Osman İBİŞ
 SU VE KİMYASAL BAĞLAR Yrd. Doç. Dr. Osman İBİŞ Kimyasal Bağlar ve Çeşitleri Nelerdir? Kimyasal bağ, çekirdekteki atomları bir arada tutan kuvvettir. İki ya da daha fazla atom arasında elektron alışverişi
SU VE KİMYASAL BAĞLAR Yrd. Doç. Dr. Osman İBİŞ Kimyasal Bağlar ve Çeşitleri Nelerdir? Kimyasal bağ, çekirdekteki atomları bir arada tutan kuvvettir. İki ya da daha fazla atom arasında elektron alışverişi
Kimya Mühendisliği Bölümü, 2014/2015 Öğretim Yılı, Bahar Yarıyılı 0102-Genel Kimya-II Dersi, Dönem Sonu Sınavı
 Kimya Mühendisliği Bölümü, 2014/2015 Öğretim Yılı, Bahar Yarıyılı 0102-Genel Kimya-II Dersi, Dönem Sonu Sınavı 20.05.2015 Soru (puan) 1 (20 ) 2 (20 ) 3 (20 ) 4 (25) 5 (20 ) 6 (20 ) Toplam Alınan Puan Not:
Kimya Mühendisliği Bölümü, 2014/2015 Öğretim Yılı, Bahar Yarıyılı 0102-Genel Kimya-II Dersi, Dönem Sonu Sınavı 20.05.2015 Soru (puan) 1 (20 ) 2 (20 ) 3 (20 ) 4 (25) 5 (20 ) 6 (20 ) Toplam Alınan Puan Not:
ATOMLAR ARASI BAĞLAR Doç. Dr. Ramazan YILMAZ
 ATOMLAR ARASI BAĞLAR Doç. Dr. Ramazan YILMAZ Sakarya Üniversitesi, Teknoloji Fakültesi, Metalurji ve Malzeme Mühendisliği Bölümü Esentepe Kampüsü, 54187, SAKARYA Atomlar Arası Bağlar 1 İyonik Bağ 2 Kovalent
ATOMLAR ARASI BAĞLAR Doç. Dr. Ramazan YILMAZ Sakarya Üniversitesi, Teknoloji Fakültesi, Metalurji ve Malzeme Mühendisliği Bölümü Esentepe Kampüsü, 54187, SAKARYA Atomlar Arası Bağlar 1 İyonik Bağ 2 Kovalent
ÖĞRETĐM TEKNOLOJĐLERĐ VE MATERYAL GELĐŞĐMĐ ÇALIŞMA YAPRAĞI
 ÖĞRETĐM TEKNOLOJĐLERĐ VE MATERYAL GELĐŞĐMĐ ÇALIŞMA YAPRAĞI REAKSĐYON HIZINA ETKĐ EDEN FAKTÖRLER YASEMĐN KONMAZ 20338575 Çalışma Yaprağı Ders Anlatımı: REAKSĐYON HIZINA ETKĐ EDEN FAKTÖRLER: 1.Reaktif Maddelerin
ÖĞRETĐM TEKNOLOJĐLERĐ VE MATERYAL GELĐŞĐMĐ ÇALIŞMA YAPRAĞI REAKSĐYON HIZINA ETKĐ EDEN FAKTÖRLER YASEMĐN KONMAZ 20338575 Çalışma Yaprağı Ders Anlatımı: REAKSĐYON HIZINA ETKĐ EDEN FAKTÖRLER: 1.Reaktif Maddelerin
kimyasal değişimin sembol ve formüllerle ifade edilmesidir.
 myasal reaksiyon Bir (veya birden fazla ) madde nin etkileşim sonucu yeni madde(lere) dönüşmesi işlemidir. ziksel değişim - renk değişimi - çökelek oluşumu - gaz çıkışı - ısı değişimi imyasal denklem aktif
myasal reaksiyon Bir (veya birden fazla ) madde nin etkileşim sonucu yeni madde(lere) dönüşmesi işlemidir. ziksel değişim - renk değişimi - çökelek oluşumu - gaz çıkışı - ısı değişimi imyasal denklem aktif
4. Açısal momentum kuantum sayısı (,) 2 olan bir orbital türü ile ilgili, 5. Orbitaller Maksimum elektron sayısı
 Kuantum Sayıları Ve rbitaller 1. Başkuantum sayısı (n) belirtilen temel enerji düzeylerinden hangisinde bulunabilecek maksimum orbital sayısı yanlış verilmiştir? Başkuantum sayısı (n) Maksimum orbital
Kuantum Sayıları Ve rbitaller 1. Başkuantum sayısı (n) belirtilen temel enerji düzeylerinden hangisinde bulunabilecek maksimum orbital sayısı yanlış verilmiştir? Başkuantum sayısı (n) Maksimum orbital
Genel Kimya 101-Lab (4.Hafta) Asit Baz Teorisi Suyun İyonlaşması ve ph Asit Baz İndikatörleri Asit Baz Titrasyonu Deneysel Kısım
 Genel Kimya 101-Lab (4.Hafta) Asit Baz Teorisi Suyun İyonlaşması ve ph Asit Baz İndikatörleri Asit Baz Titrasyonu Deneysel Kısım Asit Baz Teorisi Arrhenius Teorisi: Sulu çözeltlerine OH - iyonu bırakan
Genel Kimya 101-Lab (4.Hafta) Asit Baz Teorisi Suyun İyonlaşması ve ph Asit Baz İndikatörleri Asit Baz Titrasyonu Deneysel Kısım Asit Baz Teorisi Arrhenius Teorisi: Sulu çözeltlerine OH - iyonu bırakan
VÜCUT SIVILARI. Yrd.Doç.Dr. Önder AYTEKİN. Copyright 2004 Pearson Education, Inc., publishing as Benjamin Cummings
 VÜCUT SIVILARI Yrd.Doç.Dr. Önder AYTEKİN Su Dengesi Vücudumuzun önemli bir bölümü sudan oluşur ve su dengesi vücudun en önemli sorunlarından birisidir. Günlük olarak alınan ve vücuttan atılan su miktarı
VÜCUT SIVILARI Yrd.Doç.Dr. Önder AYTEKİN Su Dengesi Vücudumuzun önemli bir bölümü sudan oluşur ve su dengesi vücudun en önemli sorunlarından birisidir. Günlük olarak alınan ve vücuttan atılan su miktarı
