Enerji ve madde arasındaki iliģkiyi inceler
|
|
|
- Serkan Pamuk
- 7 yıl önce
- İzleme sayısı:
Transkript
1 TERMODİNAMİK
2 Enerji ve madde arasındaki iliģkiyi inceler
3 Termodinamikte bir organizma, bir hücre veya birbiri ile reaksiyona giren iki madde, sistem olarak tanımlanır. Bir sistem, bir çevre içinde yer almaktadır. Sistem ve çevrenin ikisi birlikte de evren i oluģtururlar. Çevre sistem Evren
4 Sistem; termodinamikte, fiziksel ve kimyasal olayların gerçekleģmekte olduğu belirli sınırlar içindeki madde topluluğuna denir. Çevre; sistemin durumu üzerine etki yapabilen,sistemle temas halinde bulunan ve sistemi çevreleyen ortamdır.
5 Sistemler; YalıtılmıĢ sistem; hacim, kütle ve enerji değiģmez madde enerji Çevre
6 Sistemler; Kapalı sistem; Çevre ile yalnızca enerji alıģ-veriģi yapar madde enerji Çevre
7 Sistemler; Açık sistem; madde ve enerji alıģ-veriģi yapabilirler. madde enerji Çevre
8 Süreç-1 Süreç; sistemde oluģan ve herhangi bir değiģime neden olan olaydır. Sistemle çevre arasındaki enerji alıģ-veriģi son bulduğunda süreç dengeye ulaģmıģ demektir. Sistem termodinamik durumunu termodinamik değiģkenlerinin bir/birkaç ının değiģmesiyle değiģtirebilir.
9 Süreç-2 Bu değiģimler; DönüĢümlü süreçler ve DönüĢümsüz süreçler olarak 2 ye ayrılırlar.
10 Süreç-3 DönüĢümlü süreç(daima dengede kalır) Buz Su (0 0 C) (0 0 C) DönüĢümsüz süreç Canlının doğup, büyümesi ve sonunda ölmesi, Tersi mümkün değil.
11 Termodinamik Ġlgi alanları Ġlgi alanına girmeyenler - Basınç - Hacim - Isı - Kimyasal BileĢim - Zaman - Reaksiyon mekanizması - Reaksiyonun nasıl oluģtuğu
12 Termodinamik çözümlemede, sistemin toplam enerjisini oluģturan değiģik enerji biçimlerini makroskopik ve mikroskopik olarak iki gurupta ele almak yararlı olur.
13 Makroskopik enerji, sistemin tümünün bir dıģ referans noktasına göre sahip olduğu enerjidir, kinetik ve potansiyel enerji gibi. Mikroskopik enerji ise, sistemin molekül yapısı ve molekül hareketliliğiyle ilgilidir ve dıģ referans noktalarından bağımsızdır.
14 ISI KAPASİTESİ Isı kapasitesi C birim kütle baģına ısı miktarının (Q) sıcaklık değiģimi T ye bölümü olarak adlandırılır. Ģeklindedir. C Q m T
15 C v T m Isı m Yalıtım Sabit hacimde ısı kapasitesi
16 Sabit hacimde tutulan bir malzemeye (katı, sıvı veya gaz) ısı verilmektedir. Bu durumda ısı kapasitesi Cv adını alır. Verilen ısı malzemenin iç enerjisinin, E artmasına neden olur. (Sisteme verilen enerji, sistemin iç enerjisinin artmasında kullanılır) Bu durumda denklem; Q E mc v T
17 Sistem elemanlarının sahip olduğu kinetik enerjinin toplamı Ġç Enerji olarak adlandırılır.(e)
18 C p T m Isı m Sabit basınçta ısı kapasitesi
19 Sabit basınçta tutulan bir malzemeye (katı, sıvı veya gaz) ısı verilsin. Bu durumda ölçülen ısıl kapasite Cp olarak adlandırılır. Verilen ısı malzemenin iç enerjisinin artmasının yanı sıra ağırlığın kaldırılmasını da sağlar. Dolayısıyla PV iģi de yapılmıģ olur. Bu durumda: Q E P V mc p T
20 Termodinamiğin Birinci Yasası Termodinamiğin birinci kanunu veya diğer adıyla enerjinin korunumu ilkesi enerjinin değiģik biçimleri arasındaki iliģkileri ve genel olarak enerji etkileģimlerini incelemek için sağlam bir temel oluģturur.
21 Kapalı sistem olarak tanımlanan, belirli sınırlar içinde bulunan sabit bir kütle için termodinamiğin birinci yasası veya enerjinin korunumu ilkesi aģağıdaki gibi ifadelendirilebilir: Q W E Q, sistem sınırlarından net ısı geçiģini; W, değiģik biçimleri kapsayan net iģi; E, sistemdeki toplam enerji değiģimini ifade eder.
22 Termodinamiğin birinci yasası deneysel gözlemlere dayanarak, enerjinin var veya yok edilemeyeceğini, ancak bir biçimden diğerine dönüģebileceğini vurgular.
23 Q E W Q; Sistemin çevreden aldığı veya verdiği enerji kcal, kjoule E; Sistemdeki iç enerji değiģikliği E=E 2 -E 1 W; Sistemin yaptığı iģ Bir sisteme dıģarıdan Q kadar ısı enerjisi verdiğimizde bunun bir kısmı iç enerjisini arttırırken bir kısmı da sisteme iģ yaptırır.
24 Q E W Biyokimyasal reaksiyonlarda (P sbt) W=P. V V= V 2 V 1 Q= E + P. V H=E+P.V(entalpi)
25 ENTALPĠ Entalpi (H), enerji ile iliģkili bir durum fonksiyonudur. Durum fonksiyonu; Herhangi bir termodinamik sistemin enerji değiģikliği sistemim ilk ve son durumuna bağlıdır. Sistemin son durumuna hangi hızla ve nasıl geldiğinin bir önemi yoktur.
26 Entalpi değişikliği ( H), Sistemin volüm artıģı veya volüm azalmasından baģka iģ yapılmazsa Entalpi değişikliği ( H), çevreden alınan veya çevreye verilen ısı miktarıdır.
27 1- Çevreden ısı alarak gerçekleģen olaylar ENDOTERMĠK reaksiyonlar 2- Çevreye ısı vererek gerçekleģen olaylar ise EKZOTERMĠK reaksiyonlardır
28 Entalpi değiģiminin belirlenmesi 1- Bomba kalorimetreleri ile ölçülebilirler, 2-Standart entalpi değiģikliklerinden hesaplanabilirler.
29 Bomba Kalorimetresi-1
30 Bomba Kalorimetresi-2 Vücudumuzda kullanılan besin maddeleri oksitlendiklerinde enerji açığa çıkarırlar. Besin maddelerinin oksitlenme entalpileri bomba kalorimetreleri ile ölçülebilir. Karbonhidratların ve yağların O 2 le yakılması kalorimetre ile ölçülebilecek değerler elde edilir.
31 Hess Yasası Bir reaksiyon birden fazla basamakta gerçekleģiyorsa reaksiyonun entalpi değiģimi, her basamaktaki entalpi değiģiminin toplamına eģittir. Bu olay HESS yasası olarak bilinir. Entalpi değiģikliklerinin toplanabilme özelliğidir. H= H(ürünler)- H(reaktanlar)
32 H= H(ürünler)- H(reaktanlar) H<0 sistem ısı kaybeder(ekzotermik reak.) H>0 sistem ısı kazanır(endotermik reak.)
33 Termodinamiğin ikinci yasası
34 Entropi Reaksiyonlar oluģurken bazılarının endotermik, bazılarının ise ekzotermik olduğunu tespit ettik. Reaksiyonlardan bazılarının oluģması için uyarı gerekirken, bazılarının baģlaması için uyarıya gerek yoktur yani kendiliğindendir. Örneğin 1-0 o C daki buzun oda sıcaklığında erimesi için herhangi bir uyarıya gerek yok, H>0 2- NötürleĢme reaksiyonları H<0 3- Ġdeal gazın balonlar arası geçiģi H=0
35 3- H=0
36 Bir yönde kendiliğinden (spontan) olan olaylar diğer yönde spontan değildirler. Doğada kendiliğinden olan olaylar genelde enerji kaybıyla sonuçlanırlar. Spontanlık sistemlerin düzenleri ile ilgilidir.
37 Termodinamiğin ikinci yasası Kendiliğinden gerçekleşen herhangi bir süreçte sistem ve çevrenin total entropisi artar. Evren kaçınılmaz olarak düzenli durumdan daha düzensiz duruma gider.
38 S- Entropi; Madde ve enerjinin düzensizlik halinin bir ölçüsüdür. Doğada kendi halinde bırakılan her Ģeyin entropisi artar.
39 Entropi GeliĢigüzellik/Dağınıklık entropi ile ifade edilir. ΔS = S(son) - S(ilk) Bir maddenin Sıvı hali, katı haline göre daha yüksek entropiye sahiptir. Bir maddenin gaz hali, sıvı haline göre daha yüksek entropiye sahiptir. Sıcaklık yükseldikçe maddenin entropisi yükselir. Bir kimyasal reaksiyonda gaz moleküllerin sayısı artıkça entropi artar.
40 Entropi Entropi değiģimi enerji boyutuna sahiptir S, entropideki değiģme miktarı, Q; ısı enerjisindeki değiģme, T; mutlak sıcaklık S Q T
41 Entropi; Bir termodinamik durumun düzensizliğinin ölçüsü olan termodinamik değiģkendir. Sistemin her termodinamik durumunun bir durumunun bir entropisi vardır. Birden fazla alt birimden oluģan bir sistemin entropisi, basit olarak alt sistemlerin entropilerinin toplamıdır. S(evren)= S(sistem) + S(çevre) Entropi değiģimi sürecin niteliği hakkında bilgi verir.
42 Entropi Entropi değiģimi sürecin niteliği hakkında bilgi verir. S = 0 dönüģümlü, S> 0 dönüģümsüz, S <0 olanaksız.
43 SERBEST ENERJĠ Q p v Termodinamiğin 1. yasası Q T S Termodinamiğin 2. yasası p v T S p v T S 0 T S G SERBEST ENERJĠ-(Gibbs Enerjisi)
44 SERBEST ENERJĠ Bir kimyasal reaksiyonun yönü ve ne kadar devam edeceği, reaksiyon sırasında iki faktörün ne derece değiģeceğine bağlıdır. Bunlar, entalpi ( H, reaksiyona girenlerin ve ürünlerin ısı içeriklerindeki değiģimlerin ölçüsüdür) ve entropi ( S, reaksiyona girenlerin ve ürünlerin geliģigüzelliği ve düzensizliğindeki değiģimin ölçüsüdür. Bu termodinamik birimlerin hiçbirisi kendi baģına bir kimyasal reaksiyonun yazıldığı yönde spontan olarak ilerleyip ilerlemeyeceğini saptamak için yeterli değildir. Ancak, matematiksel olarak birleģtirildiklerinde entalpi ve entropi üçüncü bir birimi, serbest reaksiyonunun spontan olarak ilerleyeceği yönü tahmin eden serbest enerjiyi tanımlamak için kullanılabilir.
45 SERBEST ENERJĠ DEĞĠġĠMĠ Serbest enerjideki değiģim 2 Ģekilde olabilir. 1- G (Serbest Enerji DeğiĢimi) Daha geneldir., çünkü serbest enerjideki değiģimi ve böylece ürünlerin ve reaktanların belirli konsantrasyonlarında reaksiyonun yönünü tahmin eder. 2- Gº (Standart Serbest Enerji DeğiĢimi) Ürünler ve reaktanlar 1 mol/l iken olan enerji değiģimidir. [Standart durumda reaktanlar veya ürünlerin konsantrasyonu 1 mol/l olmasına rağmen, protonların konsantrasyonunun 10-7 mol/l olduğu -ki bu ph= 7 dirkabul edilir].
46 G işareti reaksiyonun yönünü tahmin eder Serbest enerjideki değiģim, G, sabit bir ısı ve basınçta reaksiyonun yönünün tahmini için kullanılabilir. A B
47 Eğer G negatif bir sayı ise, net bir enerji kaybı vardır ve reaksiyon spontan olarak yazıldığı yönde ilerler yani A, B'ye çevrilir. Reaksiyonun ekzergonik olduğu söylenir.
48 Eğer G pozitif bir sayı ise, net bir enerji kazancı vardır ve reaksiyon spontan olarak B'den A'ya ilerlemez. Reaksiyonun endergonik olduğu söylenir ve reaksiyonun B'den A'ya ilerleyebilmesi için sisteme mutlaka enerji eklemek gerekir.
49 G= O ise, reaktanlar denge halindedir. Bir reaksiyon, spontan olarak ilerliyorsa yani serbest enerji kaybediliyorsa reaksiyon, G sıfıra ulaģıncaya ve denge kuruluncaya kadar devam eder.
50 SERBEST ENERJĠ Tepkimenin yönünü yada gerçekleģebilirliğini belirleyen ve iģ için değerlendirilebilen enerji Ģeklidir. G=0 Denge durumu G<0 Serbest enerjide azalma Kendiliğinden gerçekleģebilirliği G>0 Olayın oluģması için sayısal değer olarak serbest enerjiye ihtiyacı olduğunu gösterir.
51 1. H<0, S>0, G<0 olduğunda reaksiyon bütün sıcaklıklarda kendiliğinden oluģur. 2. H>0, S<0, G>0 Reaksiyon hiçbir sıcaklıkta kendiliğinden oluģmaz, 3. H<0, S<0, G<0 reaksiyon düģük sıcaklıklarda kendiğinden oluģur, yüksek sıcaklıklarda pozitif ve ters yönde spontan 4. H>0, S>0, G<0 yüksek sıcaklıklarda negatif ve yazıldığı yönde spontan.
52 A A Serbest Enerji ve Denge Katsayısı B B K K>1 ise B maddesi tepkime ürünü olarak gerçekleģebilir. K=1 ise A=B olur. A maddesinin yarısı B maddesine döner. K<1 ise yeterince A maddesinden B dönüģümü olmaz. G negatif ( ) ise reaksiyon ürünlere doğru (sağa doğru) spontan olarak gerçekleģir. B A
53 K Denge katsayısı, tıpkı serbest enerji değiģimi ( G) gibi tepkimenin gerçekleģebilirliğinin göstergesidir. Bir tepkimenin G ile K arasındaki iliģki G= G 0 + RT lnk G 0 =- RT ln K G 0 =- 2,3RT log K
54 K>1 G<0; negatif ( ) ise reaksiyon ürünlere doğru (sağa doğru) spontan olarak gerçekleģir, reaksiyon ekzergonik tir K=1 G=0; Reaksiyon dengededir. K<1 G>0, pozitiftir, reaksiyon yazıldığı Ģekilde soldan sağa doğru kendiliğinden ilerlemez ( G>0) ve reaksiyon endergonik tir.
55 Termodinamiğin biyolojik süreçlerdeki önemi 1- Birçok biyolojik enerji dönüģümü, kimyasal reaksiyonları izleyen moleküller arasında yeniden bir enerji dağılımı sonucu oluģur. 2- Biyolojik fonksiyon, organizasyonu oluģturmak için kullanılan enerjiyle iliģkilidir. 3-Termodinamiğe göre; kendi haline bırakılan bir sistem maksimum bir entropi durumuna doğru yol alır. Canlı, oldukça karmaģık ve düzenli bir duruma doğru geliģir. Doğal termodinamik gidiģ yönüne ters yönde etki eden, sisteme eģdeğer enerjinin girmesidir.(güneģ enerjisi)
56 BĠYOENERJETĠK Canlı sistemde; enerji iletilmelerini, enerji akımlarını ve enerjinin oluģturduğu süreçleri inceleyen bilim dalına biyoenerjetik adı verilir.
57 BĠYOENERJETĠK Bütün canlılar varlıklarını sürdürebilmek için 3 tip iģ yapmak zorundadırlar ve bunun için enerjiye ihtiyaçları vardır. 1- Biyosentez, 2- Ozmotik iģ, 3- Mekanik iģ
58 Biyolojik enerji akımları Besinlerin oksitlenmesi sonucu ortaya çıkan enerjiden iģ yapmak için yararlanırız. Bu enerjinin ne kadarının doğrudan iģe dönüģtürüleceği söz konusu metabolik yolun verimliliğine bağlıdır. Spontan Olaylar; Serbest enerji değiģikliği iģ yapmakta kullanılabilecek enerji miktarının teorik maksimum değerini belirtir, Spontan Olmayan Olaylar; ĠĢ yapmak için sisteme dıģarıdan sağlanması gereken minimum enerji miktarıdır.
59 Biyosentezi amacı, canlının ihtiyacı olan kendine özgü karmaģık moleküllerin yapılmasıdır. CO 2, NH 4 ve su gibi basit moleküllerden karmaģık molekülleri sentezleyebilen canlılar, ototrof canlılar dır.
60 FOTOSENTEZĠN TERMODĠNAMĠK ÖZELLĠKLERĠ Fotosentez de enerji güneģten elde edilir ve enerji glikoza yüklenir. 6CO2 6H 2O C6H12O6 6O2 G=686 kcal/mol (Yüksek serbest en. ) H=673 kcal/mol S=-43,6 kcal/mol (entropi ) (1mol glikoz için 686 kcal güneģ enerjisinden harcanıyor)
61 Heterotrofik Canlılar, besleyici moleküllerin yıkılması vasıtasıyla bir kimyasal formdan serbest enerji elde ederler ve besin moleküllerinin yakılma süreci solunum olarak adlandırılır.
62 Solunum C6H12O6 6O2 6CO2 6H 2O G=-686 kcal/mol H= -673 kcal/mol S=+43,6 kcal/mol
63 Biyolojik Enerji Akımı
64 Biyolojik Enerji Akımı BaĢlıca 3 aģamada gerçekleģir; 1-GüneĢ Enerjisi, 2- ATP moleküllerinin oluģumunda 3- ATP içeriğinin çeģitli biyolojik iģlerde kullanılmasında
65 ADP ile Pi tan oluşturulan ATP, daha sonra kimyasal enerjisinin bir kısmını -metabolik ara maddeler ve küçük ön maddelerden makromoleküllerin sentezi, -konsantrasyon gradientine karşı membranların bir tarafından diğer tarafına maddelerin taşınması -mekanik hareket gibi endergonik süreçler için kullanır.
66 Canlı hücredeki reaksiyonlar Canlı hücredeki reaksiyonların çoğu, beş genel kategoriden birine uyar: Fonksiyonel grup transferi Oksidasyon-redüksiyon Bir veya daha fazla karbon atomu çevresindeki bağ yapısının yeniden düzenlenmesi C C bağlarını oluşturan veya yıkan reaksiyonlar Bir molekül su çıkışıyla iki molekülün kondensasyonu reaksiyonları
67 Canlı hücrede ph=7 dolaylarında ATP molekülündeki her fosfat grubu(-) yüklüdür. ATP 4(-) yüke sahiptir. Bu nedenle canlı hücrede anyon Ģeklinde çok az bulunur ve genel olarak Mg ile kompleks yapar.
68
69
70 ATP hücrelere enerji veren reaksiyonlarla, enerji harcayan reaksiyonları bağlayan ortak ara bileģiktir.
71 ATP nin negatifliğinin nedenleri ve önemi 1- Hücrede suyun nötral ancak polar ortamında ATP molekülünün 3 fosfat grubu proton ayrıģmasıyla 4(-) yük taģır. Elektronegatiflik nitelik- ATP hidrolizinin enerjetiğini belirler. Hidroliz sonucu oluģan ürünler elektronegatif yükleri nedeniyle birleģme eğilimi göstermezler.
72 2- ATP hidrolizinin G nin yüksek negatif değerinin önemli bir nedeni ise tepkime ürünlerinin ADP ve fosfatın olanaklı olan en düģük enerji seviyesinde olmasındandır.
73 Bu bağlara yüksek enerjili fosfat bağları denmesinin nedeni????? G=-7,3 kcal/mol Tepkimeye giren fosfat türevinin hidrolizi sonucu kimyasal iģ gücündeki değiģmedir.
74 Oksijenli Solunum 3 Kademede GerçekleĢir Glikoliz Evresi Krebs Devri Oksidatif Fosforilasyon Evresi (ETS)
75 sitoplazma Mitekondri matriksi Mitekondri zarı
76 Elektron Transport Zinciri Q
77
78 Elektromotif güç Her elektron vericisinin bir elektron verme gücü yada eğilimi, alıcısınında elektronlara yönelik bir ilginliği vardır. Bir elektron vericisinin elektron verme gücü, elektromotif güç yada redoks potansiyeli denir.
79 Elektronların iletimi enerji salan bir olaydır. Bu süreçte serbest enerjideki değiģme redoks potansiyeli ile doğrudan orantılıdır. G n.f. E 0 - Elektron taģıyıcıları arasındaki redoks pot n- aktarılan elektron sayısı F- Faraday katsayısı
80 Bir glikoz molekülünün oksitlenmesi sonucu 12 e- çifti solunum zinciri yolu ile O 2 ne aktarılır ve 624 kcal/mol enerji elde edilir.
81
82
83 Elektron transport zinciri mitokondri iç zarındadır ve vücutta farklı yakıtlardan elde edilen elektronların oksijene iletilmelerindeki son ortak yoldur. Elektron trasportu ve oksidatif fosforilasyon ile ATP sentezi vücudun mitokondri taşıyan tüm hücrelerinde sürekli oluşur.
84 Elektron transport zincirinin komponentleri iç zarda yerleşmiştir. Dış zar birçok iyonun ve küçük molekülün serbestçe geçişini sağlayan porlar (gözenekler) taşımasına rağmen, mitokondri iç zarı H+, Na+, K+ da dahil olmak üzere küçük iyonların çoğuna, ATP, ADP, pirüvat gibi küçük moleküllere ve mitokondri fonksiyonu için önemli olan diğer metabolitlere geçirgen olmayan özelleşmiş bir yapıdır.
85 ATP sentetaz kompleksleri Bu protein kompleksleri iç membran partikülleri olarak adlandırılırlar ve mitokondri iç zarının iç yüzeyine bağlanmıģlardır. Mitokondri matriksine doğru uzanan küreler Ģeklinde görülürler.
86
87
88 Elektron taģıyıcılar ; NAD, FAD, sitokromlar, kinonlar ve flavoproteinlerdir.. NAD, FAD, kinonlar Hem elektron, hem proton (H + ) taģırlar Sitokromlar Sadece elektron taģıyıcısıdırlar. Aktarım sırasında protonlar hücre dıģına çıkar, OH - lar hücre içinde kalır. Böylece membranın dıģı kısmen pozitif içi ise kısmen negatif yüklü olur. Burada bir membranda bir iyon gradienti oluģur. Bu bir enerji oluģumu sağlar. Tıpkı bir pil gibi artı ve eksi iyonların zıt kutuplardaki etkileģimi sonucu membran enerjili bir hal alır ve bu enerjili hal ATP sentezi için kullanılır.
89 Protonların membran dıģına çıkması ve membranın bu iyon gradienti sonucu enerjili bir hal alması olayına PMG(proton motif güç) denir.
90 Hücre dıģındaki protonların tekrar hücre içine girmesi gerekir. Protonlar yüklü olduğu için özel taģıma proteinleriyle hücre içine alınırlar. Bu özel protein ATPase enzimi ve bu enzimin F0 F1 komponentleridir. ATPase enzimleri hücre membranına gömülü durumdadır..
91 PROTON MOTIVE GÜÇ İLE ENERJİ ELDESİ NADH + H + gibi Hidrojen taģıyıcıları hidrojen atomları 2e- ve 2H+ ayrılır. e- ETS ile taģınır. H+ (protonlar) hücre dıģına pompalanır. Böylece hafif asidik bir hücre membranı yüzeyi oluģur. ETS de taģınan e- lar son e- alıcısına ( O 2 solunumda O 2 ) aktarılır. Eğer O 2 H 2 O indirgenecekse,reaksiyonu tamamlamak için sitoplazmadan H+ ihtiyacı vardır. Bu protonlar suyun hidrolizinde sağlanır. ( H2O H + + OH - )
92 PROTON MOTIVE GÜÇ İLE ENERJİ ELDESİ H+ in O2 indirgenmede kullanılması ve H+ nın ETS ile dıģarı atılması sitoplazmik zarın iç tarafında OH- birikimine neden olur. Küçük olmalarına karģın H+ ve OH- yüklü olmaları nedeniyle membandan kolayca geçemez. Sonuçta denge kendiliğinden oluģamaz.
93 Sonuçta sitoplazmik membranın iki tarafı arasında bir PH GRADĠENTĠ ve membrana karģı bir ELEKTROKĠMYASAL POTANSĠYEL oluģur. Sitoplazmik membranın iç tarafı ( - ) negatif alkali sitoplazmik membranın dıģ tarafı ( + ) pozitif asidik olur. Bu ph gradienti ve elektrokimyasal potansiyel bir pil gibi enerji barındırmaktadır. Bu elektriksel enerji ise hücre tarafından kullanılır ve depolanır. Pildeki enerjitik durum elektromotive güç membranda ise proton motive güç olarak ifade edilir.
94
95 Canlıların ATP Hidrolizine bağımlı olarak 1- Biyosentez, 2- Ozmotik iģ, 3- Mekanik iģ, yaparlar.
96 Biyosentezin Termodinamik Özellikleri 1- Küçük ve basit bileģiklerden, büyük ve karmaģık makromoleküllerin sentez edildiği biyosentez reaksiyonlarında entropi azalır. 2-Biyosentez reaksiyonlarında yeralan reaktantlar standart konsantrasyonlarında değil seyreltik çözeltileri halinde bulunurlar. Ters yönde gerçekleģme eğilimindedirler. Ortak ara bileģik kullanımı ilkesine uyarlar.
97 Enerjetik açıdan partiküller membranı 2 farklı biçimde geçebilir, 1- Pasif iletim, 2- Aktif iletim.
98 Biyoenerjetik ilkeleri ile iletim Maddenin 2 bölme arasında yoğunluk farkını ortadan kaldırması ve olayın kendiliğinden oluģması beklenir. S E G Pasif iletimin oluģması
99 Bölmeler arasında bir yoğunluk farkının oluģumuna yol açacak bir iletim S E G Aktif iletim
OKSİJENLİ SOLUNUM
 1 ----------------------- OKSİJENLİ SOLUNUM ----------------------- **Oksijenli solunum (aerobik): Besinlerin, oksijen yardımıyla parçalanarak, ATP sentezlenmesine oksijenli solunum denir. Enzim C 6 H
1 ----------------------- OKSİJENLİ SOLUNUM ----------------------- **Oksijenli solunum (aerobik): Besinlerin, oksijen yardımıyla parçalanarak, ATP sentezlenmesine oksijenli solunum denir. Enzim C 6 H
Doç. Dr. Meltem ERCAN
 578 ĐÇĐNDEKĐLER 1- Termodinamik kavramlar 2- Termodinamik Yasalar 3- Biyoenerjetik 4- Biyomoleküler Sistemlerde Enerji Aktarımları 5- Canlıların Atp Hidrolizine Bağımlı Olarak Gerçekleştirdikleri Đşler
578 ĐÇĐNDEKĐLER 1- Termodinamik kavramlar 2- Termodinamik Yasalar 3- Biyoenerjetik 4- Biyomoleküler Sistemlerde Enerji Aktarımları 5- Canlıların Atp Hidrolizine Bağımlı Olarak Gerçekleştirdikleri Đşler
2. Kanun- Enerji dönüşümü sırasında bir miktar kullanılabilir kullanılamayan enerji ısı olarak kaybolur.
 Enerji Dönüşümleri Enerji Enerji; bir maddeyi taşıma veya değiştirme kapasitesi anlamına gelir. Enerji : Enerji bir formdan diğerine dönüştürülebilir. Kimyasal enerji ;moleküllerinin kimyasal bağlarının
Enerji Dönüşümleri Enerji Enerji; bir maddeyi taşıma veya değiştirme kapasitesi anlamına gelir. Enerji : Enerji bir formdan diğerine dönüştürülebilir. Kimyasal enerji ;moleküllerinin kimyasal bağlarının
KİMYASAL TERMODİNAMİK VE BİYOENERJETİKLER
 KİMYASAL TERMODİNAMİK VE BİYOENERJETİKLER Biyokimyasal olarak önemli reaksiyon türleri Canlı hücredeki reaksiyonların çoğu, beş genel kategoriden birine uyar: 1) Fonksiyonel grup transferi 2) Oksidasyon
KİMYASAL TERMODİNAMİK VE BİYOENERJETİKLER Biyokimyasal olarak önemli reaksiyon türleri Canlı hücredeki reaksiyonların çoğu, beş genel kategoriden birine uyar: 1) Fonksiyonel grup transferi 2) Oksidasyon
Redoks Kimyasını Gözden Geçirme
 Redoks Kimyasını Gözden Geçirme I. Yükseltgenme Durumu ya da Sayısı Bir bileşiğin yükseltgenme durumu ya da sayısı, ne derece yükseltgenmiş (elektronca fakir) ya da indirgenmiş (elektronca zengin) bir
Redoks Kimyasını Gözden Geçirme I. Yükseltgenme Durumu ya da Sayısı Bir bileşiğin yükseltgenme durumu ya da sayısı, ne derece yükseltgenmiş (elektronca fakir) ya da indirgenmiş (elektronca zengin) bir
TEST 1. Hücre Solunumu. 4. Aşağıda verilen moleküllerden hangisi oksijenli solunumda substrat olarak kullanılamaz? A) Glikoz B) Mineral C) Yağ asidi
 1. Termometre Çimlenen bezelye tohumlar Termos Çimlenen bezelye tohumları oksijenli solunum yaptığına göre yukarıdaki düzenekle ilgili, I. Termostaki oksijen miktarı azalır. II. Termometredeki sıcaklık
1. Termometre Çimlenen bezelye tohumlar Termos Çimlenen bezelye tohumları oksijenli solunum yaptığına göre yukarıdaki düzenekle ilgili, I. Termostaki oksijen miktarı azalır. II. Termometredeki sıcaklık
11. SINIF KONU ANLATIMI 2 ATP-2
 11. SINIF KONU ANLATIMI 2 ATP-2 Fotosentez ve kemosentez reaksiyonları hem endergonik hem ekzergonik reaksiyonlardır. ATP molekülü ile hücrenin endergonik ve ekzergonik reaksiyonları arasında enerji transferini
11. SINIF KONU ANLATIMI 2 ATP-2 Fotosentez ve kemosentez reaksiyonları hem endergonik hem ekzergonik reaksiyonlardır. ATP molekülü ile hücrenin endergonik ve ekzergonik reaksiyonları arasında enerji transferini
Doğadaki Enerji Akışı
 Doğadaki Enerji Akışı Güneş enerjisi Kimyasal enerjisi ATP Fotosentez olayı ile enerjisi Hareket enerjisi Isı enerjisi ATP Enerjinin Temel Molekülü ATP + H 2 O ADP + H 2 O ADP + Pi + 7300 kalori AMP +
Doğadaki Enerji Akışı Güneş enerjisi Kimyasal enerjisi ATP Fotosentez olayı ile enerjisi Hareket enerjisi Isı enerjisi ATP Enerjinin Temel Molekülü ATP + H 2 O ADP + H 2 O ADP + Pi + 7300 kalori AMP +
BİY 315 BİYOKİMYA GİRİŞ. Yrd. Doç. Dr. Ebru SAATÇİ Güz Yarı Dönemi
 BİY 315 BİYOKİMYA GİRİŞ Yrd. Doç. Dr. Ebru SAATÇİ 2008-2009 Güz Yarı Dönemi 1 Anlatım Planı 1. Makromoleküller ve Su 2. Amino asitler ve Peptidler 3. Proteinler 4. Enzimler 5. Karbohidratlar 6. Nükleik
BİY 315 BİYOKİMYA GİRİŞ Yrd. Doç. Dr. Ebru SAATÇİ 2008-2009 Güz Yarı Dönemi 1 Anlatım Planı 1. Makromoleküller ve Su 2. Amino asitler ve Peptidler 3. Proteinler 4. Enzimler 5. Karbohidratlar 6. Nükleik
Hücre solunumu ve fermentasyon enerji veren katabolik yollardır. (ΔG=-686 kcal/mol)
 hücre solunumu Hücre solunumu ve fermentasyon enerji veren katabolik yollardır. (ΔG=-686 kcal/mol) C 6 H 12 O 6 + 6 O 2 6 CO 2 + 6 H 2 0 + enerji (ATP + ısı) Hücre solunumu karbonhidratlar, yağlar ve protein
hücre solunumu Hücre solunumu ve fermentasyon enerji veren katabolik yollardır. (ΔG=-686 kcal/mol) C 6 H 12 O 6 + 6 O 2 6 CO 2 + 6 H 2 0 + enerji (ATP + ısı) Hücre solunumu karbonhidratlar, yağlar ve protein
REAKSİYON KİNETİĞİ, REAKSİYONLARLA İLGİLİ TEMEL KAVRAMLAR VE METABOLİZMA. Doç.Dr. Mustafa ALTINIŞIK ADÜTF Biyokimya AD 2004
 REAKSİYON KİNETİĞİ, REAKSİYONLARLA İLGİLİ TEMEL KAVRAMLAR VE METABOLİZMA Doç.Dr. Mustafa ALTINIŞIK ADÜTF Biyokimya AD 2004 1 Reaksiyon (tepkime) türleri 1 Gerçekte tüm organik tepkimeler dört sınıftan
REAKSİYON KİNETİĞİ, REAKSİYONLARLA İLGİLİ TEMEL KAVRAMLAR VE METABOLİZMA Doç.Dr. Mustafa ALTINIŞIK ADÜTF Biyokimya AD 2004 1 Reaksiyon (tepkime) türleri 1 Gerçekte tüm organik tepkimeler dört sınıftan
Metabolizma. Metabolizmaya giriş. Metabolizmaya giriş. Metabolizmayı tanımlayacak olursak
 Metabolizma Yaşamak için beslenmek zorundayız. Çünkü; Besinlerden enerji elde ederiz ve bu enerji; Hücresel faaliyetleri sürdürmemiz, Hareket etmemiz, Taşınım olaylarını gerçekleştirebilmemiz, Vücut sıcaklığını
Metabolizma Yaşamak için beslenmek zorundayız. Çünkü; Besinlerden enerji elde ederiz ve bu enerji; Hücresel faaliyetleri sürdürmemiz, Hareket etmemiz, Taşınım olaylarını gerçekleştirebilmemiz, Vücut sıcaklığını
Hücre Solunumu: Kimyasal Enerji Eldesi
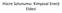 Hücre Solunumu: Kimyasal Enerji Eldesi Hücre solunumu ve fermentasyon enerji veren katabolik yollardır. Organik moleküllerin atomları enerji depolamaya müsaittir. Hücreler enzimler aracılığı ile organik
Hücre Solunumu: Kimyasal Enerji Eldesi Hücre solunumu ve fermentasyon enerji veren katabolik yollardır. Organik moleküllerin atomları enerji depolamaya müsaittir. Hücreler enzimler aracılığı ile organik
Canlılarda Enerjitik Olaylar, Fotosentez ve Kemosentez, Aerobik Solunum ve Fermantasyon
 Canlılarda Enerjitik Olaylar, Fotosentez ve Kemosentez, Aerobik Solunum ve Fermantasyon SOLUNUM İki çeşit solunum vardır HÜCRE DIŞI SOLUNUM: Canlıların dış ortamdan O 2 alıp, dış ortama
Canlılarda Enerjitik Olaylar, Fotosentez ve Kemosentez, Aerobik Solunum ve Fermantasyon SOLUNUM İki çeşit solunum vardır HÜCRE DIŞI SOLUNUM: Canlıların dış ortamdan O 2 alıp, dış ortama
hesaplama (Ders #16 dan devam) II. İstemli değişim ve serbest enerji III. Entropi IV. Oluşum serbest enerjisi
 5.111 Ders Özeti #17 Bugün için okuma: Bölüm 7.1 İstemli değişme, Bölümler 7.2 ve 7.8 -Entropi, Bölümler 7.12, 7.13, ve 7.15 Serbest Enerji. Ders #18 için okuma: Bölüm 7.16 Biyolojik Sistemlerde Serbest-Enerji
5.111 Ders Özeti #17 Bugün için okuma: Bölüm 7.1 İstemli değişme, Bölümler 7.2 ve 7.8 -Entropi, Bölümler 7.12, 7.13, ve 7.15 Serbest Enerji. Ders #18 için okuma: Bölüm 7.16 Biyolojik Sistemlerde Serbest-Enerji
3.BÖLÜM: TERMODİNAMİĞİN I. YASASI
 3.BÖLÜM: TERMODİNAMİĞİN I. YASASI S (k) + O SO + ısı Reaksiyon sonucunda sistemden ortama verilen ısı, sistemin iç enerjisinin bir kısmının ısı enerjisine dönüşmesi sonucunda ortaya çıkmıştır. Enerji sistemden
3.BÖLÜM: TERMODİNAMİĞİN I. YASASI S (k) + O SO + ısı Reaksiyon sonucunda sistemden ortama verilen ısı, sistemin iç enerjisinin bir kısmının ısı enerjisine dönüşmesi sonucunda ortaya çıkmıştır. Enerji sistemden
BÖLÜM 19 KİMYASAL TERMODİNAMİK ENTROPİ VE SERBEST ENERJİ Öğrenme Hedefleri ve Anahtar Kavramlar: Kendiliğinden, tersinir, tersinmez ve izotermal
 BÖLÜM 19 KİMYASAL TERMODİNAMİK ENTROPİ VE SERBEST ENERJİ Öğrenme Hedefleri ve Anahtar Kavramlar: Kendiliğinden, tersinir, tersinmez ve izotermal tepkime kavramlarının anlaşılması Termodinamiğin II. yasasının
BÖLÜM 19 KİMYASAL TERMODİNAMİK ENTROPİ VE SERBEST ENERJİ Öğrenme Hedefleri ve Anahtar Kavramlar: Kendiliğinden, tersinir, tersinmez ve izotermal tepkime kavramlarının anlaşılması Termodinamiğin II. yasasının
Enerji iş yapabilme kapasitesidir. Kimyacı işi bir süreçten kaynaklanan enerji deyişimi olarak tanımlar.
 Kinetik ve Potansiyel Enerji Enerji iş yapabilme kapasitesidir. Kimyacı işi bir süreçten kaynaklanan enerji deyişimi olarak tanımlar. Işıma veya Güneş Enerjisi Isı Enerjisi Kimyasal Enerji Nükleer Enerji
Kinetik ve Potansiyel Enerji Enerji iş yapabilme kapasitesidir. Kimyacı işi bir süreçten kaynaklanan enerji deyişimi olarak tanımlar. Işıma veya Güneş Enerjisi Isı Enerjisi Kimyasal Enerji Nükleer Enerji
YAZILIYA HAZIRLIK TEST SORULARI. 11. Sınıf
 YAZILIYA HAZIRLIK TEST SORULARI 11. Sınıf 1) Oksijenli solunumda, oksijen molekülleri, I. Oksidatif fosforilasyon II. Glikoliz II. Krebs Evrelerinden hangilerinde kullanılır? A) Yalnız I B) Yalnız II C)
YAZILIYA HAZIRLIK TEST SORULARI 11. Sınıf 1) Oksijenli solunumda, oksijen molekülleri, I. Oksidatif fosforilasyon II. Glikoliz II. Krebs Evrelerinden hangilerinde kullanılır? A) Yalnız I B) Yalnız II C)
HÜCRE SOLUNUMU: KİMYASAL ENERJİ ELDESİ
 HÜCRE SOLUNUMU: KİMYASAL ENERJİ ELDESİ Güneş: Temel enerji kaynağı!!! Güneş ışığı bitkiler ve diğer organizmalar için temel enerji kaynağıdır. 2 Katabolik yollar Hücreler, enzimler aracılığı ile, potansiyel
HÜCRE SOLUNUMU: KİMYASAL ENERJİ ELDESİ Güneş: Temel enerji kaynağı!!! Güneş ışığı bitkiler ve diğer organizmalar için temel enerji kaynağıdır. 2 Katabolik yollar Hücreler, enzimler aracılığı ile, potansiyel
Hücrelerde gerçekleşen yapım, yıkım ve dönüşüm olaylarının bütününe metabolizma denir.
 METABOLİZMA ve ENZİMLER METABOLİZMA Hücrelerde gerçekleşen yapım, yıkım ve dönüşüm olaylarının bütününe metabolizma denir. A. ÖZÜMLEME (ANABOLİZMA) Metabolizmanın yapım reaksiyonlarıdır. Bu tür olaylara
METABOLİZMA ve ENZİMLER METABOLİZMA Hücrelerde gerçekleşen yapım, yıkım ve dönüşüm olaylarının bütününe metabolizma denir. A. ÖZÜMLEME (ANABOLİZMA) Metabolizmanın yapım reaksiyonlarıdır. Bu tür olaylara
Atomlar ve Moleküller
 Atomlar ve Moleküller Madde, uzayda yer işgal eden ve kütlesi olan herşeydir. Element, kimyasal tepkimelerle başka bileşiklere parçalanamayan maddedir. -Doğada 92 tane element bulunmaktadır. Bileşik, belli
Atomlar ve Moleküller Madde, uzayda yer işgal eden ve kütlesi olan herşeydir. Element, kimyasal tepkimelerle başka bileşiklere parçalanamayan maddedir. -Doğada 92 tane element bulunmaktadır. Bileşik, belli
Sıcaklık (Temperature):
 Sıcaklık (Temperature): Sıcaklık tanım olarak bir maddenin yapısındaki molekül veya atomların ortalama kinetik enerjilerinin ölçüm değeridir. Sıcaklık t veya T ile gösterilir. Termometre kullanılarak ölçülür.
Sıcaklık (Temperature): Sıcaklık tanım olarak bir maddenin yapısındaki molekül veya atomların ortalama kinetik enerjilerinin ölçüm değeridir. Sıcaklık t veya T ile gösterilir. Termometre kullanılarak ölçülür.
6. glikolizde enerji kazanım hesaplamalarında; Substrat düzeyinde -ATP üretimi yaklaşık yüzde kaç hesaplanır? a. % 0 b. % 2 c. % 10 d. % 38 e.
 www.lisebiyoloji.com ayxmaz/biyoloji Test Çoktan Seçmeli 1. Hangi terim moleküllerin parçalanması ile açığa çıkan enerjinin depolandığı metabolik yolları ifade eder? a. anabolik yollar b. Katabolik yollar
www.lisebiyoloji.com ayxmaz/biyoloji Test Çoktan Seçmeli 1. Hangi terim moleküllerin parçalanması ile açığa çıkan enerjinin depolandığı metabolik yolları ifade eder? a. anabolik yollar b. Katabolik yollar
Biyokimyasal reaksiyonlarda enerji değişikliklerini inceler. Bazı reaksiyonlar olurken bazıları neden olmaz?
 Biyokimyasal reaksiyonlarda enerji değişikliklerini inceler Bazı reaksiyonlar olurken bazıları neden olmaz? Sistemler arasındaki fark? Biyolojik olmayan sistemler ısı enj kullanılır Biyolojik sistemler
Biyokimyasal reaksiyonlarda enerji değişikliklerini inceler Bazı reaksiyonlar olurken bazıları neden olmaz? Sistemler arasındaki fark? Biyolojik olmayan sistemler ısı enj kullanılır Biyolojik sistemler
Biyoloji Canlılarda Solunum Enerjinin Açığa Çıkışı
 Biyoloji Canlılarda Solunum Enerjinin Açığa Çıkışı Canlılarda Enerji Dönüşümleri Canlılarda Solunum: Enerjinin Açığa Çıkışı Canlı hücrede gerçekleşen tüm metabolik olaylar enerji gerektirir. Hayvanlar
Biyoloji Canlılarda Solunum Enerjinin Açığa Çıkışı Canlılarda Enerji Dönüşümleri Canlılarda Solunum: Enerjinin Açığa Çıkışı Canlı hücrede gerçekleşen tüm metabolik olaylar enerji gerektirir. Hayvanlar
ÜNİTE 7:HÜCRESEL SOLUNUM
 ÜNİTE 7:HÜCRESEL SOLUNUM Hücreler iş yapabilmek için enerjiye gereksinim duyarlar. Enerji ekosisteme güneş enerjisi yoluyla gelir ve ototrof canlılar sayesinde güneş enerjisi besinlerdeki kimyasal bağ
ÜNİTE 7:HÜCRESEL SOLUNUM Hücreler iş yapabilmek için enerjiye gereksinim duyarlar. Enerji ekosisteme güneş enerjisi yoluyla gelir ve ototrof canlılar sayesinde güneş enerjisi besinlerdeki kimyasal bağ
ΔH bir sistem ile çevresi arasındaki ısı transferiyle alakalı. Bir reaksiyonun ΔH ını hesaplayabiliyoruz. Hess yasası,
 TERMOKİMYA Termodinamiğin 1. kuralı, iç enerjinin (U) nasıl değiştiğiyle alakalı U U çevre U evren ΔU değişimleri ΔH ile alakalı U PV H ΔH bir ile çevresi arasındaki ısı transferiyle alakalı (@ sabit P)
TERMOKİMYA Termodinamiğin 1. kuralı, iç enerjinin (U) nasıl değiştiğiyle alakalı U U çevre U evren ΔU değişimleri ΔH ile alakalı U PV H ΔH bir ile çevresi arasındaki ısı transferiyle alakalı (@ sabit P)
7. Bölüm: Termokimya
 7. Bölüm: Termokimya Termokimya: Fiziksel ve kimyasal değişimler sürecindeki enerji (ısı ve iş) değişimlerini inceler. sistem + çevre evren Enerji: İş yapabilme kapasitesi. İş(w): Bir kuvvetin bir cismi
7. Bölüm: Termokimya Termokimya: Fiziksel ve kimyasal değişimler sürecindeki enerji (ısı ve iş) değişimlerini inceler. sistem + çevre evren Enerji: İş yapabilme kapasitesi. İş(w): Bir kuvvetin bir cismi
Solunumda organik bileşikler karbondioksite yükseltgenir ve absorbe edilen oksijen ise suya indirgenir.
 Solunum bütün aktif hücrelerde oksijenin absorbe edilmesi ve buna eşdeğer miktarda karbondioksitin salınması şeklinde sürekli olarak devam eden bir prosestir. Solunumda organik bileşikler karbondioksite
Solunum bütün aktif hücrelerde oksijenin absorbe edilmesi ve buna eşdeğer miktarda karbondioksitin salınması şeklinde sürekli olarak devam eden bir prosestir. Solunumda organik bileşikler karbondioksite
ayxmaz/lisebiyoloji.com
 Adı/Soyadı: Sınıf/No: / Fotosentez İnceleme Çalışma 1. Verilen terimleri kullanarak aşağıdaki ifadeleri tamamlayın. A.Terimler: Klorofil, Kloroplast, Mavi ve kırmızı ışık dalgalarının,yeşil ışık dalgalarının,
Adı/Soyadı: Sınıf/No: / Fotosentez İnceleme Çalışma 1. Verilen terimleri kullanarak aşağıdaki ifadeleri tamamlayın. A.Terimler: Klorofil, Kloroplast, Mavi ve kırmızı ışık dalgalarının,yeşil ışık dalgalarının,
Solunum. Solunum ve odunsu bitkilerin büyümesi arasında yüksek bir korelasyon bulunmaktadır (Kozlowski ve Pallardy, 1997).
 SOLUNUM Solunum Solunum, canlı hücrelerdeki organik maddelerin oksidasyonuyla, enerjinin açığa çıkarılması olayı olarak tanımlanır. Açığa çıkan enerji, kimyasal enerji (ATP) olarak depolanır. Solunum ürünleri,
SOLUNUM Solunum Solunum, canlı hücrelerdeki organik maddelerin oksidasyonuyla, enerjinin açığa çıkarılması olayı olarak tanımlanır. Açığa çıkan enerji, kimyasal enerji (ATP) olarak depolanır. Solunum ürünleri,
Kendiliğinden Oluşan Olaylar ISTEMLI DEĞIŞIM: ENTROPI VE SERBEST ENERJI. Entropi. Şelale her zaman aşağı akar, yukarı aktığı görülmemiştir.
 Şelale her zaman aşağı akar, yukarı aktığı görülmemiştir. ISTEMLI DEĞIŞIM: ENTROPI VE SERBEST ENERJI Bir fincan çay içerisine atılan bir küp şeker çözünür ama hiçbir zaman çözünmüş şeker çayın içinde kendiliğinden
Şelale her zaman aşağı akar, yukarı aktığı görülmemiştir. ISTEMLI DEĞIŞIM: ENTROPI VE SERBEST ENERJI Bir fincan çay içerisine atılan bir küp şeker çözünür ama hiçbir zaman çözünmüş şeker çayın içinde kendiliğinden
İal-biyoloji METABOLİZMA/SOLUNUM. 1.Metabolizma ölçümünde dikkate edilecek koşullar nelerdir?
 METABOLİZMA/SOLUNUM 1.Metabolizma ölçümünde dikkate edilecek koşullar nelerdir? 2.Solunum evrelerinde elektron vericiler (giren madde) ve elektron alıcıları (son) yazınız Evreler Elektron vericiler Elektron
METABOLİZMA/SOLUNUM 1.Metabolizma ölçümünde dikkate edilecek koşullar nelerdir? 2.Solunum evrelerinde elektron vericiler (giren madde) ve elektron alıcıları (son) yazınız Evreler Elektron vericiler Elektron
HÜCRESEL SOLUNUM OKSİJENSİZ SOLUNUM
 1 HÜCRESEL SOLUNUM *Hücresel solunum: Besinlerin parçalanarak ATP sentezlenmesine, hücresel solunum denir. ----------------------- OKSİJENSİZ SOLUNUM ----------------------- (ANAEROBİK SOLUNUM = FERMANTASYON)
1 HÜCRESEL SOLUNUM *Hücresel solunum: Besinlerin parçalanarak ATP sentezlenmesine, hücresel solunum denir. ----------------------- OKSİJENSİZ SOLUNUM ----------------------- (ANAEROBİK SOLUNUM = FERMANTASYON)
ÜNİTE 7 : HÜCRESEL SOLUNUM
 ÜNİTE 7 : HÜCRESEL SOLUNUM Yaşam için gerekli enerjinin tümü güneşten gelir.güneşte hidrojen füzyonla helyuma dönüşür ve ışık üretilir.yeşil bitkiler güneş ışığının enerjisini fotosentezle glukozdaki kimyasal
ÜNİTE 7 : HÜCRESEL SOLUNUM Yaşam için gerekli enerjinin tümü güneşten gelir.güneşte hidrojen füzyonla helyuma dönüşür ve ışık üretilir.yeşil bitkiler güneş ışığının enerjisini fotosentezle glukozdaki kimyasal
OKSİDATİF FOSFORİLASYON. Prof. Dr. Yeşim ÖZKAN
 OKSİDATİF FOSFORİLASYON Prof. Dr. Yeşim ÖZKAN Canlı organizmalarda; Biyosentez Aktif Transport Hareket gibi süreçlerde enerjiye ihtiyaç vardır. Bu enerji tüketilen yiyeceklerden sağlanmaktadır. Enerji
OKSİDATİF FOSFORİLASYON Prof. Dr. Yeşim ÖZKAN Canlı organizmalarda; Biyosentez Aktif Transport Hareket gibi süreçlerde enerjiye ihtiyaç vardır. Bu enerji tüketilen yiyeceklerden sağlanmaktadır. Enerji
6. glikolizde enerji kazanım hesaplamalarında; Substrat düzeyinde -ATP üretimi yaklaşık yüzde kaç hesaplanır? a. % 0 b. % 2 c. % 10 d. % 38 e.
 www.lisebiyoloji.com ayxmaz/biyoloji Test Çoktan Seçmeli 1. Hangi terim moleküllerin parçalanması ile açığa çıkan enerjinin depolandığı metabolik yolları ifade eder? a. anabolik yollar b. Katabolik yollar
www.lisebiyoloji.com ayxmaz/biyoloji Test Çoktan Seçmeli 1. Hangi terim moleküllerin parçalanması ile açığa çıkan enerjinin depolandığı metabolik yolları ifade eder? a. anabolik yollar b. Katabolik yollar
Biyolojik Oksidasyon. Yrd.Doç.Dr.Filiz Bakar Ateş
 Biyolojik Oksidasyon Yrd.Doç.Dr.Filiz Bakar Ateş Canlı hücreler, dışarıdan aldıkları kimyasal veya fiziksel enerjiyi, geliştirdiği bir sistemle, ATP ile taşınan biyolojik enerjiye çevirirler; ATP yi kullanarak
Biyolojik Oksidasyon Yrd.Doç.Dr.Filiz Bakar Ateş Canlı hücreler, dışarıdan aldıkları kimyasal veya fiziksel enerjiyi, geliştirdiği bir sistemle, ATP ile taşınan biyolojik enerjiye çevirirler; ATP yi kullanarak
Termal Genleşme İdeal Gazlar Isı Termodinamiğin 1. Yasası Entropi ve Termodinamiğin 2. Yasası
 Termal Genleşme İdeal Gazlar Isı Termodinamiğin 1. Yasası Entropi ve Termodinamiğin 2. Yasası Sıcaklık, bir gaz molekülünün kütle merkezi hareketinin ortalama kinetic enerjisinin bir ölçüsüdür. Sıcaklık,
Termal Genleşme İdeal Gazlar Isı Termodinamiğin 1. Yasası Entropi ve Termodinamiğin 2. Yasası Sıcaklık, bir gaz molekülünün kütle merkezi hareketinin ortalama kinetic enerjisinin bir ölçüsüdür. Sıcaklık,
3) Oksijenin pek çok bileşiğindeki yükseltgenme sayısı -2 dir. Ancak, H 2. gibi peroksit bileşiklerinde oksijenin yükseltgenme sayısı -1 dir.
 5.111 Ders Özeti #25 Yükseltgenme/İndirgenme Ders 2 Konular: Elektrokimyasal Piller, Faraday Yasaları, Gibbs Serbest Enerjisi ile Pil-Potansiyelleri Arasındaki İlişkiler Bölüm 12 YÜKSELTGENME/İNDİRGENME
5.111 Ders Özeti #25 Yükseltgenme/İndirgenme Ders 2 Konular: Elektrokimyasal Piller, Faraday Yasaları, Gibbs Serbest Enerjisi ile Pil-Potansiyelleri Arasındaki İlişkiler Bölüm 12 YÜKSELTGENME/İNDİRGENME
SU VE HÜCRE İLİŞKİSİ
 SU VE HÜCRE İLİŞKİSİ Oluşturacağı her 1 g organik madde için bitkinin 500 g kadar suyu kökleriyle alması ve tepe (uç) noktasına kadar taşıyarak atmosfere aktarması gerekir. Normal su düzeyinde hayvan hücrelerinin
SU VE HÜCRE İLİŞKİSİ Oluşturacağı her 1 g organik madde için bitkinin 500 g kadar suyu kökleriyle alması ve tepe (uç) noktasına kadar taşıyarak atmosfere aktarması gerekir. Normal su düzeyinde hayvan hücrelerinin
METABOLİZMA REAKSİYONLARI. Hazırlayanlar Prof. Dr. Ayşe CAN Prof.Dr. Nuriye AKEV
 METABOLİZMA REAKSİYONLARI Hazırlayanlar Prof. Dr. Ayşe CAN Prof.Dr. Nuriye AKEV METABOLİZMA Canlı sistemde maddelerin uğradığı kimyasal değişikliklerin hepsine birden metabolizma, bu değişiklikleri meydana
METABOLİZMA REAKSİYONLARI Hazırlayanlar Prof. Dr. Ayşe CAN Prof.Dr. Nuriye AKEV METABOLİZMA Canlı sistemde maddelerin uğradığı kimyasal değişikliklerin hepsine birden metabolizma, bu değişiklikleri meydana
TERMODİNAMİĞİN TEMEL EŞİTLİKLERİ
 Serbest İç Enerji (Helmholtz Enerjisi) Ve Serbest Entalpi (Gibbs Enerjisi) Fonksiyonları İç enerji ve entalpi fonksiyonları yalnızca termodinamiğin birinci yasasından tanımlanır. Entropi fonksiyonu yalnızca
Serbest İç Enerji (Helmholtz Enerjisi) Ve Serbest Entalpi (Gibbs Enerjisi) Fonksiyonları İç enerji ve entalpi fonksiyonları yalnızca termodinamiğin birinci yasasından tanımlanır. Entropi fonksiyonu yalnızca
5.111 Ders Özeti #18 Bugün için okuma: Bölüm 7.16 Biyolojik Sistemlerde Serbest-Enerji Değişimi. Sınav #2 geliyor. (Ders #17 den devam)
 5.111 Ders Özeti #18 Bugün için okuma: Bölüm 7.16 Biyolojik Sistemlerde Serbest-Enerji Değişimi. Sınav #2 geliyor. Konular: Termodinamik I. Oluşum serbest enerjisi II. Ġstemlilik üzerine sıcaklığın etkisi
5.111 Ders Özeti #18 Bugün için okuma: Bölüm 7.16 Biyolojik Sistemlerde Serbest-Enerji Değişimi. Sınav #2 geliyor. Konular: Termodinamik I. Oluşum serbest enerjisi II. Ġstemlilik üzerine sıcaklığın etkisi
1. HAFTA Giriş ve Temel Kavramlar
 1. HAFTA Giriş ve Temel Kavramlar TERMODİNAMİK VE ISI TRANSFERİ Isı: Sıcaklık farkının bir sonucu olarak bir sistemden diğerine transfer edilebilen bir enerji türüdür. Termodinamik: Bir sistem bir denge
1. HAFTA Giriş ve Temel Kavramlar TERMODİNAMİK VE ISI TRANSFERİ Isı: Sıcaklık farkının bir sonucu olarak bir sistemden diğerine transfer edilebilen bir enerji türüdür. Termodinamik: Bir sistem bir denge
Öğr. Gör. Dr. İlker BÜYÜK (Botanik, 10. Hafta): Fotosentez FOTOSENTEZ
 FOTOSENTEZ Elektron Koparılması ve Floresans Enerjisi Elektronlar negatif (e - ) ve protonlar pozitif (p + ) yüklüdür. Bu nedenle protonlar elektronları çekerler. Elektronlar ise, belli bir enerjiye sahiptir
FOTOSENTEZ Elektron Koparılması ve Floresans Enerjisi Elektronlar negatif (e - ) ve protonlar pozitif (p + ) yüklüdür. Bu nedenle protonlar elektronları çekerler. Elektronlar ise, belli bir enerjiye sahiptir
E.T.S. tam olarak nedir? Ne işe yarar?
 E.T.S. tam olarak nedir? Ne işe yarar? Elektron Taşıma Sistemi(E.T.S.) fotosentez,oksijenli solunum ve kemosentez yapan canlılarda görülen molekül gruplarıdır.bu moleküller canlıda canlıya değişse de,
E.T.S. tam olarak nedir? Ne işe yarar? Elektron Taşıma Sistemi(E.T.S.) fotosentez,oksijenli solunum ve kemosentez yapan canlılarda görülen molekül gruplarıdır.bu moleküller canlıda canlıya değişse de,
BİYOKİMYA II EK NOT. Ortak biyokimyasal tepkimeler
 BİYOKİMYA II EK NOT Dr. NaĢit ĠĞCĠ Ortak biyokimyasal tepkimeler Ġndirgenme-yükseltgenme (redüksiyon-oksidasyon, redoks) tepkimeleri de biyokimya açısından çok önemli tepkimelerdir. Basitçe, elektron kaybı
BİYOKİMYA II EK NOT Dr. NaĢit ĠĞCĠ Ortak biyokimyasal tepkimeler Ġndirgenme-yükseltgenme (redüksiyon-oksidasyon, redoks) tepkimeleri de biyokimya açısından çok önemli tepkimelerdir. Basitçe, elektron kaybı
4.BÖLÜM: ENTROPİ 1.İSTEMLİ VE İSTEMSİZ DEĞİŞMELER
 4.BÖLÜM: ENROPİ 1.İSEMLİ VE İSEMSİZ DEĞİŞMELER Doğal bir olayın termodinamikteki anlamı istemli değişmedir. İSEMLİ DEĞİŞMELER, bir dış etki tarafından yönlendirmeye ihtiyaç olmaksızın kendiliğinden meydana
4.BÖLÜM: ENROPİ 1.İSEMLİ VE İSEMSİZ DEĞİŞMELER Doğal bir olayın termodinamikteki anlamı istemli değişmedir. İSEMLİ DEĞİŞMELER, bir dış etki tarafından yönlendirmeye ihtiyaç olmaksızın kendiliğinden meydana
Elektrot Potansiyeli. (k) (k) (k) Tepkime vermez
 Elektrot Potansiyeli Uzun metal parçası, M, elektrokimyasal çalışmalarda kullanıldığında elektrot adını alır. M n+ metal iyonları içeren bir çözeltiye daldırılan bir elektrot bir yarı-hücre oluşturur.
Elektrot Potansiyeli Uzun metal parçası, M, elektrokimyasal çalışmalarda kullanıldığında elektrot adını alır. M n+ metal iyonları içeren bir çözeltiye daldırılan bir elektrot bir yarı-hücre oluşturur.
PERİYODİK CETVEL-ÖSS DE ÇIKMIŞ SORULAR
 PERİODİK CETVEL-ÖSS DE ÇIKMIŞ SORULAR 1. Bir elementin periyodik cetveldeki yeri aşağıdakilerden hangisi ile belirlenir? A) Atom ağırlığı B) Değerliği C) Atom numarası D) Kimyasal özellikleri E) Fiziksel
PERİODİK CETVEL-ÖSS DE ÇIKMIŞ SORULAR 1. Bir elementin periyodik cetveldeki yeri aşağıdakilerden hangisi ile belirlenir? A) Atom ağırlığı B) Değerliği C) Atom numarası D) Kimyasal özellikleri E) Fiziksel
Sunum ve Sistematik 1. ÜNİTE: CANLILARDA ENERJİ DÖNÜŞÜMÜ KONU ÖZETİ
 Sunum ve Sistematik 1. ÜNİTE: CANLILARDA ENERJİ DÖNÜŞÜMÜ KONU ÖZETİ Bu başlık altında, ünitenin en can alıcı bilgileri, kazanım sırasına göre en alt başlıklara ayrılarak hap bilgi niteliğinde konu özeti
Sunum ve Sistematik 1. ÜNİTE: CANLILARDA ENERJİ DÖNÜŞÜMÜ KONU ÖZETİ Bu başlık altında, ünitenin en can alıcı bilgileri, kazanım sırasına göre en alt başlıklara ayrılarak hap bilgi niteliğinde konu özeti
MEMM4043 metallerin yeniden kazanımı
 metallerin yeniden kazanımı 2016-2017 güz yy. Prof. Dr. Gökhan Orhan MF212 katot - + Cu + H 2+ SO 2-4 OH- Anot Reaksiyonu Cu - 2e - Cu 2+ E 0 = + 0,334 Anot Reaksiyonu 2H 2 O O 2 + 4H + + 4e - E 0 = 1,229-0,0591pH
metallerin yeniden kazanımı 2016-2017 güz yy. Prof. Dr. Gökhan Orhan MF212 katot - + Cu + H 2+ SO 2-4 OH- Anot Reaksiyonu Cu - 2e - Cu 2+ E 0 = + 0,334 Anot Reaksiyonu 2H 2 O O 2 + 4H + + 4e - E 0 = 1,229-0,0591pH
Fizik 203. Ders 6 Kütle Çekimi-Isı, Sıcaklık ve Termodinamiğe Giriş Ali Övgün
 Fizik 203 Ders 6 Kütle Çekimi-Isı, Sıcaklık ve Termodinamiğe Giriş Ali Övgün Ofis: AS242 Fen ve Edebiyat Fakültesi Tel: 0392-630-1379 ali.ovgun@emu.edu.tr www.aovgun.com Kepler Yasaları Güneş sistemindeki
Fizik 203 Ders 6 Kütle Çekimi-Isı, Sıcaklık ve Termodinamiğe Giriş Ali Övgün Ofis: AS242 Fen ve Edebiyat Fakültesi Tel: 0392-630-1379 ali.ovgun@emu.edu.tr www.aovgun.com Kepler Yasaları Güneş sistemindeki
HÜCRE MEMBRANINDAN MADDELERİN TAŞINMASI. Dr. Vedat Evren
 HÜCRE MEMBRANINDAN MADDELERİN TAŞINMASI Dr. Vedat Evren Vücuttaki Sıvı Kompartmanları Vücut sıvıları değişik kompartmanlarda dağılmış Vücuttaki Sıvı Kompartmanları Bu kompartmanlarda iyonlar ve diğer çözünmüş
HÜCRE MEMBRANINDAN MADDELERİN TAŞINMASI Dr. Vedat Evren Vücuttaki Sıvı Kompartmanları Vücut sıvıları değişik kompartmanlarda dağılmış Vücuttaki Sıvı Kompartmanları Bu kompartmanlarda iyonlar ve diğer çözünmüş
Yağ Asitlerinin Metabolizması- I Yağ Asitlerinin Yıkılması (Oksidasyonu)
 Yağ Asitlerinin Metabolizması- I Yağ Asitlerinin Yıkılması (Oksidasyonu) Yrd. Doç. Dr. Bekir Engin Eser Zirve Üniversitesi EBN Tıp Fakültesi Tıbbi Biyokimya A.B.D. Yağ Asitleri Uzun karbon zincirine sahip
Yağ Asitlerinin Metabolizması- I Yağ Asitlerinin Yıkılması (Oksidasyonu) Yrd. Doç. Dr. Bekir Engin Eser Zirve Üniversitesi EBN Tıp Fakültesi Tıbbi Biyokimya A.B.D. Yağ Asitleri Uzun karbon zincirine sahip
Şekilde görüldüğü gibi Gerilim/akım yoğunluğu karakteristik eğrisi dört nedenden dolayi meydana gelir.
 Bir fuel cell in teorik açık devre gerilimi: Formülüne göre 100 oc altinda yaklaşık 1.2 V dur. Fakat gerçekte bu değere hiçbir zaman ulaşılamaz. Şekil 3.1 de normal hava basıncında ve yaklaşık 70 oc da
Bir fuel cell in teorik açık devre gerilimi: Formülüne göre 100 oc altinda yaklaşık 1.2 V dur. Fakat gerçekte bu değere hiçbir zaman ulaşılamaz. Şekil 3.1 de normal hava basıncında ve yaklaşık 70 oc da
Bölüm 3. Maddenin Isıl Özellikleri ve TERMODİNAMİK. Prof. Dr. Bahadır BOYACIOĞLU
 Bölüm 3 Maddenin Isıl Özellikleri ve TERMODİNAMİK Prof. Dr. Bahadır BOYACIOĞLU Termodinamik Yasaları Termodinamiğin 0. Yasası Termodinamiğin I. Yasası Termodinamiğin II. Yasası Termodinamiğin III. Yasası
Bölüm 3 Maddenin Isıl Özellikleri ve TERMODİNAMİK Prof. Dr. Bahadır BOYACIOĞLU Termodinamik Yasaları Termodinamiğin 0. Yasası Termodinamiğin I. Yasası Termodinamiğin II. Yasası Termodinamiğin III. Yasası
Bölüm 7 ENTROPİ. Bölüm 7: Entropi
 Bölüm 7 ENTROPİ 1 Amaçlar Termodinamiğin ikinci kanununu hal değişimlerine uygulamak. İkinci yasa verimini ölçmek için entropi olarak adlandırılan özelliği tanımlamak. Entropinin artış ilkesinin ne olduğunu
Bölüm 7 ENTROPİ 1 Amaçlar Termodinamiğin ikinci kanununu hal değişimlerine uygulamak. İkinci yasa verimini ölçmek için entropi olarak adlandırılan özelliği tanımlamak. Entropinin artış ilkesinin ne olduğunu
13 HÜCRESEL SOLUNUM LAKTİK ASİT FERMANTASYONU
 13 HÜCRESEL SOLUNUM LAKTİK ASİT FERMANTASYONU Laktik Asit Fermantasyonu Glikozdan oksijen yokluğunda laktik asit üretilmesine LAKTİK ASİT FERMANTASYONU denir. Bütün canlılarda sitoplazmada gerçekleşir.
13 HÜCRESEL SOLUNUM LAKTİK ASİT FERMANTASYONU Laktik Asit Fermantasyonu Glikozdan oksijen yokluğunda laktik asit üretilmesine LAKTİK ASİT FERMANTASYONU denir. Bütün canlılarda sitoplazmada gerçekleşir.
ELEKTROKİMYA II. www.kimyahocam.com
 ELEKTROKİMYA II ELEKTROKİMYASAL PİLLER Kendiliğinden gerçekleşen redoks tepkimelerinde elektron alışverişinden yararlanılarak, kimyasal bağ enerjisi elektrik enerjisine dönüştürülebilir. Kimyasal enerjiyi,
ELEKTROKİMYA II ELEKTROKİMYASAL PİLLER Kendiliğinden gerçekleşen redoks tepkimelerinde elektron alışverişinden yararlanılarak, kimyasal bağ enerjisi elektrik enerjisine dönüştürülebilir. Kimyasal enerjiyi,
HAZIRLAYAN Mutlu ŞAHİN. Hacettepe Fen Bilgisi Öğretmenliği. DENEY NO: 6 DENEYİN ADI: DOYMUŞ NaCl ÇÖZELTİSİNİN ELEKTROLİZİ
 HAZIRLAYAN Mutlu ŞAHİN Hacettepe Fen Bilgisi Öğretmenliği DENEY NO: 6 DENEYİN ADI: DOYMUŞ NaCl ÇÖZELTİSİNİN ELEKTROLİZİ DENEYİN AMACI: Doymuş NaCl çözeltisinin elektroliz sonucu elementlerine ayrışmasının
HAZIRLAYAN Mutlu ŞAHİN Hacettepe Fen Bilgisi Öğretmenliği DENEY NO: 6 DENEYİN ADI: DOYMUŞ NaCl ÇÖZELTİSİNİN ELEKTROLİZİ DENEYİN AMACI: Doymuş NaCl çözeltisinin elektroliz sonucu elementlerine ayrışmasının
FOTOSENTEZ. 1. Fotosentez, güneş enerjisini, besin içindeki saklı kimyasal bağ enerjisine çeviren olaydır.
 1 FOTOSENTEZ *Fotosentez: Klorofilli canlıların, ışık enerjisini kullanarak; inorganik maddelerden organik besin sentezlemesine fotosentez denir. 1. Fotosentez, güneş enerjisini, besin içindeki saklı kimyasal
1 FOTOSENTEZ *Fotosentez: Klorofilli canlıların, ışık enerjisini kullanarak; inorganik maddelerden organik besin sentezlemesine fotosentez denir. 1. Fotosentez, güneş enerjisini, besin içindeki saklı kimyasal
Yrd. Doç. Dr. H. Hasan YOLCU. hasanyolcu.wordpress.com
 Yrd. Doç. Dr. H. Hasan YOLCU hasanyolcu.wordpress.com En az iki atomun belli bir düzenlemeyle kimyasal bağ oluşturmak suretiyle bir araya gelmesidir. Aynı atomda olabilir farklı atomlarda olabilir. H 2,
Yrd. Doç. Dr. H. Hasan YOLCU hasanyolcu.wordpress.com En az iki atomun belli bir düzenlemeyle kimyasal bağ oluşturmak suretiyle bir araya gelmesidir. Aynı atomda olabilir farklı atomlarda olabilir. H 2,
HÜCRE ZARINDA TAŞINIM
 HÜCRE ZARINDA TAŞINIM Yrd. Doç. Dr. Aslı AYKAÇ YDÜ TIP FAKÜLTESİ BİYOFİZİK AD Küçük moleküllerin zardan geçişi Lipid çift tabaka Polar moleküller için geçirgen olmayan bir bariyerdir Hücre içindeki suda
HÜCRE ZARINDA TAŞINIM Yrd. Doç. Dr. Aslı AYKAÇ YDÜ TIP FAKÜLTESİ BİYOFİZİK AD Küçük moleküllerin zardan geçişi Lipid çift tabaka Polar moleküller için geçirgen olmayan bir bariyerdir Hücre içindeki suda
Kimya.12 3.Ünite Konu Özeti
 Kimya.12 3.Ünite Konu Özeti 1. ORGANĠK REDOKS TEPKĠMELERĠ 2. YER DEĞĠġTĠRME (SÜBSTĠTÜSYON) TEPKĠMELERĠ 3. KATILMA TEPKĠMELERĠ 4. AYRILMA (ELĠMĠNASYON) TEPKĠMELERĠ 5. KONDENZASYON TEPKĠMELERĠ Hazırlayan
Kimya.12 3.Ünite Konu Özeti 1. ORGANĠK REDOKS TEPKĠMELERĠ 2. YER DEĞĠġTĠRME (SÜBSTĠTÜSYON) TEPKĠMELERĠ 3. KATILMA TEPKĠMELERĠ 4. AYRILMA (ELĠMĠNASYON) TEPKĠMELERĠ 5. KONDENZASYON TEPKĠMELERĠ Hazırlayan
METABOLİZMA. Dr. Serkan SAYINER
 METABOLİZMA Dr. Serkan SAYINER serkan.sayiner@neu.edu.tr Genel Bakış Canlı organizmalar, kendilerini yenilemek, gelişmek ve üremek için kimyasal maddelere gereksinim duyarlar. Çünkü organizmanın tamamı
METABOLİZMA Dr. Serkan SAYINER serkan.sayiner@neu.edu.tr Genel Bakış Canlı organizmalar, kendilerini yenilemek, gelişmek ve üremek için kimyasal maddelere gereksinim duyarlar. Çünkü organizmanın tamamı
ÖLÇME, DEĞERLENDİRME VE SINAV HİZMETLERİ GENEL MÜDÜRLÜĞÜ
 AY EKİM 06-07 EĞİTİM - ÖĞRETİM YILI. SINIF VE MEZUN GRUP KİMYA HAFTA DERS SAATİ. Kimya nedir?. Kimya ne işe yarar?. Kimyanın sembolik dili Element-sembol Bileşik-formül. Güvenliğimiz ve Kimya KONU ADI
AY EKİM 06-07 EĞİTİM - ÖĞRETİM YILI. SINIF VE MEZUN GRUP KİMYA HAFTA DERS SAATİ. Kimya nedir?. Kimya ne işe yarar?. Kimyanın sembolik dili Element-sembol Bileşik-formül. Güvenliğimiz ve Kimya KONU ADI
BileĢiklerin formülleri atom sayıları oranını yansıtan en basit formüldür.
 KATILAR KRĠSTAL KATI Sert SıkıĢtırılmayan Tanecikleri belirli geometrik Ģekle sahiptir. ĠYONĠK KRĠSTAL Anyon- katyonlar arasında elektrostatik çekim kuvveti sonucu oluģur (iyonik bağ içerir). Sert-sağlam-
KATILAR KRĠSTAL KATI Sert SıkıĢtırılmayan Tanecikleri belirli geometrik Ģekle sahiptir. ĠYONĠK KRĠSTAL Anyon- katyonlar arasında elektrostatik çekim kuvveti sonucu oluģur (iyonik bağ içerir). Sert-sağlam-
E = U + KE + KP = (kj) U = iç enerji, KE = kinetik enerji, KP = potansiyel enerji, m = kütle, V = hız, g = yerçekimi ivmesi, z = yükseklik
 Enerji (Energy) Enerji, iş yapabilme kabiliyetidir. Bir sistemin enerjisi, o sistemin yapabileceği azami iştir. İş, bir cisme, bir kuvvetin tesiri ile yol aldırma, yerini değiştirme şeklinde tarif edilir.
Enerji (Energy) Enerji, iş yapabilme kabiliyetidir. Bir sistemin enerjisi, o sistemin yapabileceği azami iştir. İş, bir cisme, bir kuvvetin tesiri ile yol aldırma, yerini değiştirme şeklinde tarif edilir.
Her madde atomlardan oluşur
 2 Yaşamın kimyası Figure 2.1 Helyum Atomu Çekirdek Her madde atomlardan oluşur 2.1 Atom yapısı - madde özelliği Elektron göz ardı edilebilir kütle; eksi yük Çekirdek: Protonlar kütlesi var; artı yük Nötronlar
2 Yaşamın kimyası Figure 2.1 Helyum Atomu Çekirdek Her madde atomlardan oluşur 2.1 Atom yapısı - madde özelliği Elektron göz ardı edilebilir kütle; eksi yük Çekirdek: Protonlar kütlesi var; artı yük Nötronlar
Serüveni 3. ÜNİTE KİMYASAL TÜRLER ARASI ETKİLEŞİM GÜÇLÜ ETKİLEŞİM. o İYONİK BAĞ o KOVALENT BAĞ o METALİK BAĞ
 Serüveni 3. ÜNİTE KİMYASAL TÜRLER ARASI ETKİLEŞİM GÜÇLÜ ETKİLEŞİM o İYONİK BAĞ o KOVALENT BAĞ o METALİK BAĞ KİMYASAL TÜR 1. İYONİK BAĞ - - Ametal.- Kök Kök Kök (+) ve (-) yüklü iyonların çekim kuvvetidir..halde
Serüveni 3. ÜNİTE KİMYASAL TÜRLER ARASI ETKİLEŞİM GÜÇLÜ ETKİLEŞİM o İYONİK BAĞ o KOVALENT BAĞ o METALİK BAĞ KİMYASAL TÜR 1. İYONİK BAĞ - - Ametal.- Kök Kök Kök (+) ve (-) yüklü iyonların çekim kuvvetidir..halde
ayxmaz/biyoloji Adı: 1.Aşağıda verilen atomların bağ yapma sayılarını (H) ekleyerek gösterin. C N O H
 Adı: 1.Aşağıda verilen atomların bağ yapma sayılarını (H) ekleyerek gösterin. C N O H 2.Radyoaktif izotoplar biyologları için önemlidir? Aşağıda radyoakif maddelerin kullanıldığı alanlar sıralanmıştır.bunlarla
Adı: 1.Aşağıda verilen atomların bağ yapma sayılarını (H) ekleyerek gösterin. C N O H 2.Radyoaktif izotoplar biyologları için önemlidir? Aşağıda radyoakif maddelerin kullanıldığı alanlar sıralanmıştır.bunlarla
ADIM ADIM YGS-LYS 27. ADIM HÜCRE 4- HÜCRE ZARINDAN MADDE GEÇİŞLERİ
 ADIM ADIM YGS-LYS 27. ADIM HÜCRE 4- HÜCRE ZARINDAN MADDE GEÇİŞLERİ Hücre zarı canlıdır ve seçici-geçirgendir. Bu özelliği nedeniyle bazı maddeler hücre zarından geçebilirken bazı maddeler geçemez. Hücre
ADIM ADIM YGS-LYS 27. ADIM HÜCRE 4- HÜCRE ZARINDAN MADDE GEÇİŞLERİ Hücre zarı canlıdır ve seçici-geçirgendir. Bu özelliği nedeniyle bazı maddeler hücre zarından geçebilirken bazı maddeler geçemez. Hücre
Aktif ve pasif iyon alımı
 Aktif ve pasif iyon alımı Moleküllerin membranı geçerek taşınmaları için aktif proses her zaman gerekli değildir. Moleküllerin bir kısmı dış ortamdan membran içine konsantrasyon farkına bağlı olarak çok
Aktif ve pasif iyon alımı Moleküllerin membranı geçerek taşınmaları için aktif proses her zaman gerekli değildir. Moleküllerin bir kısmı dış ortamdan membran içine konsantrasyon farkına bağlı olarak çok
FİZYOLOJİ LABORATUVAR BİLGİSİ VEYSEL TAHİROĞLU
 FİZYOLOJİ LABORATUVAR BİLGİSİ VEYSEL TAHİROĞLU Fizyolojiye Giriş Temel Kavramlar Fizyolojiye Giriş Canlıda meydana gelen fiziksel ve kimyasal değişikliklerin tümüne birden yaşam denir. İşte canlı organizmadaki
FİZYOLOJİ LABORATUVAR BİLGİSİ VEYSEL TAHİROĞLU Fizyolojiye Giriş Temel Kavramlar Fizyolojiye Giriş Canlıda meydana gelen fiziksel ve kimyasal değişikliklerin tümüne birden yaşam denir. İşte canlı organizmadaki
FOTOSENTEZ C 6 H 12 O 6 + 6 O 2. Fotosentez yapan canlılar: - Bitkiler - Mavi yeşil algler - Bazı bakteriler - Bazı protistalar. Glikoz IŞIK KLOROFİL
 Fotosentez FOTOSENTEZ Işık enerjisinin kullanılarak organik bileşiklerin üretilmesidir. Yeşil yapraklı bitkilerin inorganik maddelerden (H 2 O, CO 2 ), ışık enerjisi ve klorofil yardımı ile organik besin
Fotosentez FOTOSENTEZ Işık enerjisinin kullanılarak organik bileşiklerin üretilmesidir. Yeşil yapraklı bitkilerin inorganik maddelerden (H 2 O, CO 2 ), ışık enerjisi ve klorofil yardımı ile organik besin
HÜCRE SOLUNUMU ve FERMENTASYON
 HÜCRE SOLUNUMU ve FERMENTASYON 1 Bakteriler yoğurt, peynir, pizza üretimi gibi mayalanma olaylarını gerçekleştirirler. Kaslarınız çok çalışırsa, oksijen yokluğundan dolayı kasılamazlar. Yediğiniz bütün
HÜCRE SOLUNUMU ve FERMENTASYON 1 Bakteriler yoğurt, peynir, pizza üretimi gibi mayalanma olaylarını gerçekleştirirler. Kaslarınız çok çalışırsa, oksijen yokluğundan dolayı kasılamazlar. Yediğiniz bütün
YGS ANAHTAR SORULAR #5
 YGS ANAHTAR SORULAR #5 1) 2) Yağ + Lipaz %30 Nişasta + %40 Aminoasit + Su %20 Aminoasit + %5 İyot + %5 Amilaz + Su İçinde yağ ve yağı sindiren enzim bulunan bir bağırsak parçası saf suyla dolu olan cam
YGS ANAHTAR SORULAR #5 1) 2) Yağ + Lipaz %30 Nişasta + %40 Aminoasit + Su %20 Aminoasit + %5 İyot + %5 Amilaz + Su İçinde yağ ve yağı sindiren enzim bulunan bir bağırsak parçası saf suyla dolu olan cam
BİYOLOJİK MOLEKÜLLERDEKİ
 BİYOLOJİK MOLEKÜLLERDEKİ KİMYASALBAĞLAR BAĞLAR KİMYASAL VE HÜCRESEL REAKSİYONLAR Yrd. Doç.Dr. Funda BULMUŞ Atomun Yapısı Maddenin en küçük yapı taşı olan atom elektron, proton ve nötrondan oluşmuştur.
BİYOLOJİK MOLEKÜLLERDEKİ KİMYASALBAĞLAR BAĞLAR KİMYASAL VE HÜCRESEL REAKSİYONLAR Yrd. Doç.Dr. Funda BULMUŞ Atomun Yapısı Maddenin en küçük yapı taşı olan atom elektron, proton ve nötrondan oluşmuştur.
FARMASÖTİK TEKNOLOJİ I «ÇÖZELTİLER»
 FARMASÖTİK TEKNOLOJİ I «ÇÖZELTİLER» Uygun bir çözücü içerisinde bir ya da birden fazla maddenin çözündüğü veya moleküler düzeyde disperse olduğu tektür (homojen: her tarafta aynı oranda çözünmüş veya dağılmış
FARMASÖTİK TEKNOLOJİ I «ÇÖZELTİLER» Uygun bir çözücü içerisinde bir ya da birden fazla maddenin çözündüğü veya moleküler düzeyde disperse olduğu tektür (homojen: her tarafta aynı oranda çözünmüş veya dağılmış
KİMYASAL ENERJİ ve HAYAT ÜN TE 1
 ÜN TE (Adenozin Trifosfat) Hücrenin enerji kaynağıdır. Yapısında bulunan elementler; C, H, O, N ve P dir. Yapı taşları: P P ¾ 3 tane fosforik (H3 4 ) P tane 5C lu şeker (Riboz) tane Azotlu organik baz
ÜN TE (Adenozin Trifosfat) Hücrenin enerji kaynağıdır. Yapısında bulunan elementler; C, H, O, N ve P dir. Yapı taşları: P P ¾ 3 tane fosforik (H3 4 ) P tane 5C lu şeker (Riboz) tane Azotlu organik baz
Hidroklorik asit ve sodyum hidroksitin reaksiyonundan yemek tuzu ve su meydana gelir. Bu kimyasal olayın denklemi
 KİMYASAL DENKLEMLER İki ya da daha fazla maddenin birbirleri ile etkileşerek kendi özelliklerini kaybedip yeni özelliklerde bir takım ürünler meydana getirmesine kimyasal olay, bunların formüllerle gösterilmesine
KİMYASAL DENKLEMLER İki ya da daha fazla maddenin birbirleri ile etkileşerek kendi özelliklerini kaybedip yeni özelliklerde bir takım ürünler meydana getirmesine kimyasal olay, bunların formüllerle gösterilmesine
ürünler ve reaktiflerin standart hallerinde olduğu pil potansiyeli (pil voltajı). E nin birimi volttur.
 26.1 5.111 Ders Özeti #26 Yükseltgenme/Ġndirgenme Ders 3 Konular: Yarı Hücre Tepkimelerini Toplama ve Çıkarma, ve Nernst EĢitliği Bölüm 12 Cuma Günü materyallerinden Standart Haller ve Pil Potansiyelleri
26.1 5.111 Ders Özeti #26 Yükseltgenme/Ġndirgenme Ders 3 Konular: Yarı Hücre Tepkimelerini Toplama ve Çıkarma, ve Nernst EĢitliği Bölüm 12 Cuma Günü materyallerinden Standart Haller ve Pil Potansiyelleri
CANLILARIN YAPISINDA BULUNAN TEMEL BİLEŞENLER
 CANLILARIN YAPISINDA BULUNAN TEMEL BİLEŞENLER Canlıların yapısında bulunan moleküller yapısına göre 2 ye ayrılır: I. İnorganik Bileşikler: Bir canlı vücudunda sentezlenemeyen, dışardan hazır olarak aldığı
CANLILARIN YAPISINDA BULUNAN TEMEL BİLEŞENLER Canlıların yapısında bulunan moleküller yapısına göre 2 ye ayrılır: I. İnorganik Bileşikler: Bir canlı vücudunda sentezlenemeyen, dışardan hazır olarak aldığı
Atomlar birleştiği zaman elektron dağılımındaki değişmelerin bir sonucu olarak kimyasal bağlar meydana gelir. Üç çeşit temel bağ vardır:
 Atomlar birleştiği zaman elektron dağılımındaki değişmelerin bir sonucu olarak kimyasal bağlar meydana gelir. Üç çeşit temel bağ vardır: İyonik bağlar, elektronlar bir atomdan diğerine aktarıldığı zaman
Atomlar birleştiği zaman elektron dağılımındaki değişmelerin bir sonucu olarak kimyasal bağlar meydana gelir. Üç çeşit temel bağ vardır: İyonik bağlar, elektronlar bir atomdan diğerine aktarıldığı zaman
www.demiraylisesi.com
 YÖNETİCİ MOLEKÜLLER C, H, O, N, P atomlarından meydana gelir. Hücrenin en büyük yapılı molekülüdür. Yönetici moleküller hücreye ait genetik bilgiyi taşır, hayatsal faaliyetleri yönetir, genetik bilginin
YÖNETİCİ MOLEKÜLLER C, H, O, N, P atomlarından meydana gelir. Hücrenin en büyük yapılı molekülüdür. Yönetici moleküller hücreye ait genetik bilgiyi taşır, hayatsal faaliyetleri yönetir, genetik bilginin
Kimya ve Enerji. 1. Sistem ve Çevre. 2. Isı, Mekanik İş ve İç Enerji. YKS Fasikülleri. Yakup Demir. a. Sistemlerin
 Bu notlara Youtube dan Kimya Elbistan kanalında ilgili videolarının açıklamalar kısmında ki linkten ücretsiz bir şekilde ulaşabilirsiniz. Fiziksel ve kimyasal değişimlerde meydana gelen ısı değişimini
Bu notlara Youtube dan Kimya Elbistan kanalında ilgili videolarının açıklamalar kısmında ki linkten ücretsiz bir şekilde ulaşabilirsiniz. Fiziksel ve kimyasal değişimlerde meydana gelen ısı değişimini
Konular: I. Değerlik bağı teorisi ve melezleģme (Ders #15 den devam) Karmaşık moleküllerde melezleşme tayini
 5.111 Ders Özeti #16 Bugün için okuma: Bölümler 6.13, 6.15, 6.16, 6.17, 6.18, ve 6.20 (3. Baskıda Bölümler 6.14, 6.16, 6.17, 6.18, 6.19 ve 6.21) Kimyasal Değişim Entalpisi. Ders #17 için okuma: Bölüm 7.1
5.111 Ders Özeti #16 Bugün için okuma: Bölümler 6.13, 6.15, 6.16, 6.17, 6.18, ve 6.20 (3. Baskıda Bölümler 6.14, 6.16, 6.17, 6.18, 6.19 ve 6.21) Kimyasal Değişim Entalpisi. Ders #17 için okuma: Bölüm 7.1
CANLILARDA TAMPONLAMA
 CANLILARDA TAMPONLAMA ph= -log [H + ] / Sorensen, H potansiyeli örnekler Hücreler ve organizmalar özgül ve sabit bir sitozol ve hücre dışı sıvı ph sını korurlar Böylece biyomoleküllerin en uygun iyonik
CANLILARDA TAMPONLAMA ph= -log [H + ] / Sorensen, H potansiyeli örnekler Hücreler ve organizmalar özgül ve sabit bir sitozol ve hücre dışı sıvı ph sını korurlar Böylece biyomoleküllerin en uygun iyonik
BÖLÜM 2 ATOMİK YAPI İÇERİK. Atom yapısı. Bağ tipleri. Chapter 2-1
 BÖLÜM 2 ATOMİK YAPI İÇERİK Atom yapısı Bağ tipleri 1 Atomların Yapıları Atomlar başlıca üç temel atom altı parçacıktan oluşur; Protonlar (+ yüklü) Nötronlar (yüksüz) Elektronlar (-yüklü) Basit bir atom
BÖLÜM 2 ATOMİK YAPI İÇERİK Atom yapısı Bağ tipleri 1 Atomların Yapıları Atomlar başlıca üç temel atom altı parçacıktan oluşur; Protonlar (+ yüklü) Nötronlar (yüksüz) Elektronlar (-yüklü) Basit bir atom
İstanbul Tıp Fakültesi Tıbbi Biyoloji ABD Prof. Dr. Filiz Aydın
 İstanbul Tıp Fakültesi Tıbbi Biyoloji ABD Prof. Dr. Filiz Aydın Mitokondri, ökaryotik organizmanın farklı bir organeli Şekilleri küremsi veya uzun silindirik Çapları 0.5-1 μm uzunlukları 2-6 μm Sayıları
İstanbul Tıp Fakültesi Tıbbi Biyoloji ABD Prof. Dr. Filiz Aydın Mitokondri, ökaryotik organizmanın farklı bir organeli Şekilleri küremsi veya uzun silindirik Çapları 0.5-1 μm uzunlukları 2-6 μm Sayıları
SU ve ÇEVRENİN CANLILAR İÇİN UYGUNLUĞU
 SU ve ÇEVRENİN CANLILAR İÇİN UYGUNLUĞU Suyun polaritesinin etkileri Su molekülünün polar olması hidrojen bağlarının oluşmasına neden olur. 2 Su molekülü Oldukça basit yapılıdır. Tekli bağla bağlı olup
SU ve ÇEVRENİN CANLILAR İÇİN UYGUNLUĞU Suyun polaritesinin etkileri Su molekülünün polar olması hidrojen bağlarının oluşmasına neden olur. 2 Su molekülü Oldukça basit yapılıdır. Tekli bağla bağlı olup
 AEROBİK SOLUNUM (OKSİJENLİ SOLUNUM) 1. SINIF ÜNİTE, KONU, KAZANIM VE AÇIKLAMALARI 1..4. Hücresel Solunum Anahtar Kavramlar fermantasyon, glikoliz, mitokondri, oksijenli solunum, hücresel solunum, krebs
AEROBİK SOLUNUM (OKSİJENLİ SOLUNUM) 1. SINIF ÜNİTE, KONU, KAZANIM VE AÇIKLAMALARI 1..4. Hücresel Solunum Anahtar Kavramlar fermantasyon, glikoliz, mitokondri, oksijenli solunum, hücresel solunum, krebs
Kimya Mühendisliği Bölümü, 2014/2015 Öğretim Yılı, Bahar Yarıyılı 0102-Genel Kimya-II Dersi, Dönem Sonu Sınavı
 Kimya Mühendisliği Bölümü, 2014/2015 Öğretim Yılı, Bahar Yarıyılı 0102-Genel Kimya-II Dersi, Dönem Sonu Sınavı 20.05.2015 Soru (puan) 1 (20 ) 2 (20 ) 3 (20 ) 4 (25) 5 (20 ) 6 (20 ) Toplam Alınan Puan Not:
Kimya Mühendisliği Bölümü, 2014/2015 Öğretim Yılı, Bahar Yarıyılı 0102-Genel Kimya-II Dersi, Dönem Sonu Sınavı 20.05.2015 Soru (puan) 1 (20 ) 2 (20 ) 3 (20 ) 4 (25) 5 (20 ) 6 (20 ) Toplam Alınan Puan Not:
Tüm yaşayan organizmalar suya ihtiyaç duyarlar Çoğu hücre suyla çevrilidir ve hücrelerin yaklaşık %70 95 kadarı sudan oluşur. Yerküre içerdiği su ile
 Su Kimyası Tüm yaşayan organizmalar suya ihtiyaç duyarlar Çoğu hücre suyla çevrilidir ve hücrelerin yaklaşık %70 95 kadarı sudan oluşur. Yerküre içerdiği su ile canlılık için gerekli ortamı sunar. Canlıların
Su Kimyası Tüm yaşayan organizmalar suya ihtiyaç duyarlar Çoğu hücre suyla çevrilidir ve hücrelerin yaklaşık %70 95 kadarı sudan oluşur. Yerküre içerdiği su ile canlılık için gerekli ortamı sunar. Canlıların
BİTKİLERDE SOLUNUM REAKSİYONLARI. Prof. Dr. Necmi İŞLER Tarla Bitkileri Bölümü Öğretim Üyesi
 BİTKİLERDE SOLUNUM REAKSİYONLARI Prof. Dr. Necmi İŞLER Tarla Bitkileri Bölümü Öğretim Üyesi Havanın serbest O2 kullanarak bitki hücrelerinde şekerlerin, yağların ya da diğer organik moleküllerin oksitlenmesi
BİTKİLERDE SOLUNUM REAKSİYONLARI Prof. Dr. Necmi İŞLER Tarla Bitkileri Bölümü Öğretim Üyesi Havanın serbest O2 kullanarak bitki hücrelerinde şekerlerin, yağların ya da diğer organik moleküllerin oksitlenmesi
KİMYASAL REAKSİYONLARDA DENGE
 KİMYASAL REAKSİYONLARDA DENGE KİMYASAL REAKSİYONLARDA DENGE Kimyasal reaksiyonlar koşullar uygun olduğunda hem ileri hem de geri yönde gerçekleşirler. Böyle tepkimelere tersinir ya da denge tepkimeleri
KİMYASAL REAKSİYONLARDA DENGE KİMYASAL REAKSİYONLARDA DENGE Kimyasal reaksiyonlar koşullar uygun olduğunda hem ileri hem de geri yönde gerçekleşirler. Böyle tepkimelere tersinir ya da denge tepkimeleri
6. BÖLÜM MİKROBİYAL METABOLİZMA
 6. BÖLÜM MİKROBİYAL METABOLİZMA 1 METABOLİZMA Hücrede meydana gelen tüm reaksiyonlara denir Anabolizma: Basit moleküllerden kompleks moleküllerin sentezlendiği enerji gerektiren reaksiyonlardır X+Y+ENERJİ
6. BÖLÜM MİKROBİYAL METABOLİZMA 1 METABOLİZMA Hücrede meydana gelen tüm reaksiyonlara denir Anabolizma: Basit moleküllerden kompleks moleküllerin sentezlendiği enerji gerektiren reaksiyonlardır X+Y+ENERJİ
