3- KATILAR FİZİKSEL KİMYA 3- KATILAR
|
|
|
- Eser Berker
- 7 yıl önce
- İzleme sayısı:
Transkript
1 3- KATILAR Katılar genel olarak iki sınıfa ayrılabilirler: Kristalin ve amorf. Buz uzun aralıklı ve değişmez bir düzene sahip olan kristalin bir katıdır; atomları, molekülleri ya da iyonları belirli pozisyonlar kaplar. Kristalin bir katıdaki bu tür tanecik düzeni, net çekim kuvvetlerinin maksimum düzeyde olması demektir. Bir kristalin kararlılığından sorumlu olan kuvvetler iyonik kuvvetler, kovalent bağlar, Van der Waals kuvvetleri, hidrojen bağları ya da bu kuvvetlerin bileşimi olabilir. am gibi amorf katılar ise iyi tanımlanmış bir düzenleme ve uzun aralıklı moleküler yapıdan yoksundurlar. Bu bölümde ağırlıklı olarak kristalin katıların yapıları üzerinde durulacaktır. Bir birim hücre, kristalin bir katının tekrarlanan temel yapısal birimidir. Şekil 3.1, bir birim hücreyi ve onun üç boyuttaki genişlemesini gösterir. Her küre bir atomu, iyonu ya da molekülü temsil eder ve örgü noktası olarak adlandırılır. Birçok kristalde örgü noktası gerçekte böyle bir tanecik içermez. Daha doğrusu, her bir örgü noktasının etrafında özdeş biçimde düzenlenmiş birkaç atom, iyon ya da molekül olabilir. Bununla birlikte, basitlik için her bir örgü noktasının bir atom tarafından işgal edildiği varsayılabilir. Bu, metallerin çoğunda rastlanan bir durumdur. Şekil 3.1 (a) Bir birim hücre ve (b) birim hücrenin üç boyutta genişlemesi. Siyah küreler atomları, iyonları ya da molekülleri temsil eder. Yrd. Doç. Dr. Ayşe Engin KURTOĞLU 1
2 Her kristalin katı aşağıdaki şekilde görülen yedi tip birim hücreden biri olarak tanımlanabilir. Tüm kenarları ve tüm açıları eşit olduğundan, kübik birim hücrenin geometrisi özellikle basittir. Birim hücrelerin herhangi biri üç boyutlu uzayda tekrarlandığında kristalin bir katının tipik örgü yapısı oluşur. Şekil 3.2 Yedi çeşit birim hücre vardır. açısı b ve c kenarları ile, β açısı a ve c kenarları ile ve açısı a ve b kenarları ile belirlenir. Kürelerin İstiflenmesi Birkaç eşdeğer kürenin üç boyutlu düzenli bir yapı oluşturmak için farklı şekillerde istiflenmesi göz önünde bulundurularak, kristal oluşumu için genel geometrik koşullar anlaşılabilir. Kürelerin katmanlar halinde düzenlenme şekli, ne tip birim hücreye sahip olunduğunu belirler. Kürelerin oluşturduğu bir katman, en basit durumda Şekil 3.3 (a) da görüldüğü gibi düzenlenebilir. Şekil 3.3 Basit kübik hücredeki eşdeğer kürelerin düzenlenmesi. (a) Bir katmanın üstten görünüşü. (b) Basit kübik hücrenin tanımı. (c) Her küre sekiz birim hücre tarafından paylaşıldığından ve bir küpte sekiz köşe olduğundan, basit bir kübik birim hücrede bir tam kürenin eşdeğeri bulunur. Yrd. Doç. Dr. Ayşe Engin KURTOĞLU 2
3 Koordinasyon sayısı, bir kristal örgüdeki bir atomun (ya da iyonun) etrafındaki atomların (ya da iyonların) sayısı olarak tanımlanır. Onun değeri bize kürelerin ne kadar sıkı istiflendiğinin ölçüsünü verir ve daha büyük koordinasyon sayısı birbirine daha yakın küreler demektir. Diğer kübik hücre tipleri gövde merkezli kübik hücre (gmk) ve yüzey merkezli kübik hücredir (ymk) (Şekil 3.4). İkinci katmandaki kürelerin ilk katmanın çukurlarına ve üçüncü katmanın, ikinci katmanın çukurlarına yerleştiği gövde merkezli kübik düzen basit bir küpten farklıdır (Şekil 3.5). Bu yapıdaki her kürenin koordinasyon sayısı 8 dir (Her küre üst katmandaki dört küre ve alt katmandaki dört küre ile temastadır). Yüzey merkezli kübik hücrede, sekiz köşedeki kürelere ek olarak küpün altı yüzünün her birinin merkezinde de küreler vardır. Şekil 3.4 Üç tip kübik hücre. Gerçekte atomları, iyonları ya da molekülleri temsil eden küreler bu kübik hücrelerde birbirleriyle temas halindedirler. Şekil 3.5 Bir gövde merkezli kübikteki eşdeğer kürelerin düzeni. (a) Üstten görünüş. (b) Gövde merkezli kübik birim hücrenin tanımı. (c) Gövde merkezli kübik birim hücrede iki tam kürenin eşdeğeri bulunur. Kristalin bir katıdaki her birim hücre, diğer birim hücrelere bitişik olduğundan, bir hücrenin atomlarının çoğu komşu hücrelerle paylaşılır. Örneğin tüm kübik hücre tiplerindeki her köşe atomu sekiz birim hücreye aittir (Şekil 3.6 a). Yüzey merkezli bir atom iki birim hücre tarafından paylaşılır (Şekil 3.6 b). Yrd. Doç. Dr. Ayşe Engin KURTOĞLU 3
4 Şekil 3.6 (a) Herhangi bir hücredeki köşe atomu sekiz birim hücre tarafından paylaşılır. (b) Bir kübik hücredeki yüzey merkezli atom iki birim hücre tarafından paylaşılır. Basit kübik ve gövde merkezli kübik hücrelerde yüzey merkezli kübik hücredekinden daha fazla boşluk vardır. Kürelerin en etkili düzenlenmesi, en sıkı istiflenme, A katmanı olarak adlandırılan, Şekil 3.7 de görülen yapı ile başlar. Şekil 3.7 (a) Sıkı istiflenmiş bir katmandaki her küre, diğer altı küre ile temas halindedir. (b) İkinci katmandaki küreler, ilk katmandaki küreler arasındaki çukurlara yerleşirler. (c) Sıkı istiflenmiş hekzagonal yapıdaki üçüncü katman kürelerinin her biri birinci katman kürelerinin üzerine yerleşirler. (d) Sıkı istiflenmiş kübik yapıdaki üçüncü katman kürelerinin her biri, birinci katmandaki çukurların üzerine karşılık gelen çukurlara yerleşirler. Yrd. Doç. Dr. Ayşe Engin KURTOĞLU 4
5 Kristallerden X Işını Kırınımı Kristal yapı hakkında tüm bilinenler, X ışını kırınım çalışmalarından öğrenilir. X ışını kırınımı, X ışınlarının kristalin bir katı biriminden saçılması ile ilgilidir. Katı şebekedeki taneciklerin düzenini anlamak için saçılma ya da kırılma ile oluşturulmuş modeller kullanılır. Alman fizikçi Max ve Laue, X ışınlarının dalga uzunluğu kristaldeki örgü noktaları arasındaki uzaklıklarla kıyaslanabilecek büyüklükte olduğundan, şebekenin X ışınlarını kırabildiğini gösterdi. Bir X ışını kırınım modeli, X ışınlarına dalgaların eşlik etmesinin sonucudur. Şekil 3.8, tipik bir X ışını kırınım düzeneğini gösterir. Bir X ışınları demeti bir yüzeye sabitlenmiş kristale yönlendirilir. Kristaldeki atomlar gelen radyasyonun bir kısmını absorplar ve daha sonra yeniden yayınlar, bu işlem X ışınlarının saçılması olarak adlandırılır. Şekil 3.8 Bir kristalin X ışını kırınımını elde etmek için oluşturulmuş düzenek. Kalkan, kırılmamış X ışınlarının fotoğraf plağına zarar vermesini önler. Bir kırınım modelinin nasıl oluşturulabildiğini anlamak için, X ışınlarının iki paralel düzlemdeki atomlar tarafından saçılmasını düşünelim (Şekil 3.9). Başlangıçta, iki gelen ışık birbiri ile aynı fazdadır (maksimumları ve minimumları aynı pozisyonlarda bulunur). Daha aşağıdaki dalga ikinci katmandaki bir atom tarafından saçılırken daha yukarıdaki dalga birinci katmandaki bir atom tarafından saçılır ya da yansıtılır. Saçılmış iki dalganın yeniden aynı fazda olabilmesi için, daha aşağıdaki dalga tarafından kat edilmiş ek uzaklık, X ışınının dalga boyunun ( ) tam katı olmalıdır. Yani, B+D = 2.d.Sin = n. n=1, 2, 3, (3.1) : X ışınları ile kristal düzlem arasındaki açı d: Bitişik düzlemler arasındaki uzaklık Yrd. Doç. Dr. Ayşe Engin KURTOĞLU 5
6 Şekil 3.9 X ışınlarının iki atom katmanından yansıtılması. Aşağıdaki dalga yukarıdakinden 2.d.Sin kadar daha uzun bir yol kat eder. İki dalganın kırılma sonrasında yeniden aynı fazda olması için 2.d.Sin =n. olmalıdır. (n=1, 2, 3, ) ise, X ışınının dalga boyudur. Şekildeki noktalar yalnız kristal yüzlerce paralel katman içerirse gözlenir. X ışını kırınım tekniği, katı haldeki moleküllerdeki bağ uzunluklarını ve bağ açılarını bulmak için en duyarlı yöntemi sunar. Elektron yoğunluğu düzey haritası, bir molekülün çeşitli yerlerindeki bağıl elektron yoğunlukları ile ilgili bilgi verir. Örnek 3.1 0,154 nm dalga boylu X ışınları bir kristalden 14,17 o lik bir açı yaparak kırılırlar. n=1 olduğunu varsayarak, kristaldeki katmanlar arası uzaklığı (pm) cinsinden hesaplayınız. Yanıt: 1 nm=1000 pm n. =2.d.Sin (3.1) eşitliğinden, 1000 pm 1.0,154 nm. n. 1 nm d 348,8 pm 2.Sin 2.Sin14,17 Amorf Katılar Kristal yapıdaki katılar son derece kararlıdırlar. Ancak, bir katı hızla oluşturulursa (örneğin, bir sıvı hızla soğutulursa) atomları ve molekülleri sıralanacak zamanı bulamazlar ve düzenli bir kristalinkinden farklı pozisyonlarda bulunabilirler. Oluşan katıya amorf adı verilir. Amorf katılar belli bir sıcaklık aralığında gitgide yumuşarlar ve akıcılık kazanırlar. Yumuşamanın başladığı bu noktaya camsı geçiş sıcaklığı denir. am gibi amorf katıların atomları üç boyutlu düzenden yoksundurlar. am genellikle, kristallenmeksizin katı halde soğutulmuş olan, inorganik malzemelerin optikçe saydam bir eritme ürününü temsil eder. Eritme ürünüyle, cam sodyum oksit (Na 2 O), bor oksit (B 2 O 3 ) ve renk ve diğer özellikler için, bazı geçiş metal oksitleri gibi bileşikler ile temel bileşeni olan eritilmiş silisyum dioksitin karıştırılması ile oluşur. Bazı konularda cam bir katıdan çok bir sıvı gibi davranır. X ışını kırınım araştırmaları camda uzun aralıklı periyodik düzenin bulunmadığını gösterir. Bugün genel kullanımda bulunan, yaklaşık 800 farklı cam çeşidi vardır. Tablo 3.2 kuvars, pyreks ve soda kireç camının bileşimini ve özelliklerini gösterir. Yrd. Doç. Dr. Ayşe Engin KURTOĞLU 6
7 Tablo 3.2 Üç Çeşit amın Bileşimi ve Özellikleri. ADI BİLEŞİMİ ÖZELLİKLERİ VE KULLANIM ALANLARI Saf kuvars camı % 100 SiO 2 Düşük termal genleşme, geniş bir dalga boyu aralığında saydam. Optik Pyrex cam SiO 2, % B 2 O 3, % Al 2 O 3, az miktarda Soda-kireç camı SiO 2, % 75 Na 2 O, % 15 ao, % 10 araştırmada kullanılır. Düşük termal genleşme, görünür ve kızılötesine saydam, ancak UV radyasyona değil. Laboratuvarda ve mutfaktaki ateşe dayanıklı cam eşya yapımında kullanılır. Kimyasal maddeler tarafından kolayca tahrip edilen ve termal değişimlere duyarlı. Görünür ışığı geçirir, ancak UV radyasyonu absorbe eder. Başlıca pencere camlarının ve şişelerin yapımında kullanılır. amın rengi, büyük ölçüde metal iyonlarının (oksitleri halinde) varlığından kaynaklanır. Örneğin, yeşil cam, demir (III) oksit (Fe 2 O 3 ) ya da bakır (II) oksit (uo) içerir, sarı cam, uranyum (IV) oksit (UO 2 ) içerir, mavi cam, kobalt (II) oksit (oo) ve bakır (II) oksit (uo) içerir ve kırmızı cam, küçük altın ve bakır parçacıkları içerir. Burada bahsedilen metal iyonlarının çoğu geçiş metalleridir. Katıların Atomik Isıları Özgül (spesifik) ısının, bir maddenin 1 gramının sıcaklığını 1 o arttırmak için gerekli olan ısı miktarı olduğunu Sıvılar konusunu işlerken tanımlamıştık. Basit katı bir maddede bulunabilen en küçük parçalar, gazlardaki moleküller yerine genel olarak atomlar olarak düşünüldüğünden burada atomik ısılar göz önüne alınır. Sabit hacim ve basınçtaki atomik ısılar arasındaki fark, birkaç onda bir kadardır. Bütün katı elementlerin atomik ısıları, yani atom kütleleriyle özgül (spesifik) ısıları çarpımı cal cinsinden yaklaşık olarak 6,3 e eşittir. Dulong-Petit Yasası denilen bu yasa atom kütleleri 30 dan yüksek olan çoğu elementler halinde doğrudur. Atom kütleleri küçük ve güç eriyebilen elementler için (, Si, B gibi) yasanın doğru olmadığı görülür. Ancak sıcaklık arttırıldığında atomik ısılar normal değere yaklaşır (Şekil 3.13). Örneğin (elmas) için atomik ısı 11 o de 1,36 iken 606 o de 5,26 dır. Ayrıca hiçbir sıcaklıkta katı elementlerin atomik ısıları birbirine eşit değildir, sıcaklık arttığında özgül (spesifik) ısılar da artar, örneğin tungsten için 1300 o de 8,2 dir. Mutlak sıfırda bütün basit katı maddelerin özgül (spesifik) ısıları sıfır olur. Bu durum kuantum kuramıyla açıklanabilir. Yrd. Doç. Dr. Ayşe Engin KURTOĞLU 7
8 Katılardaki atomlar titreşim hareketlerinde bulunurlar. O halde, katılardaki atomik ısı yalnız titreşim enerjisinden ileri gelir. Her yönde titreşebilen atomda üç serbestlik derecesi olduğuna göre, atomik ısı v =3.R=5,95 olur. Bu ise 6,3 e yakındır. Aradaki fark 6,3 ün p ye ait olmasındandır. Tablo 3.3 Oda Sıcaklığında p (Katılar İçin). ELEMENT p ELEMENT p Hidrojen 2,5 Fosfor 5,5 Lityum 5,5 Kükürt 5,5 Bor 2,7 Klor 6,2 Elmas 1,5 Potasyum 6,9 Grafit 2,0 Kalsiyum 6,2 Oksijen 4,0 Demir 5,9 Flor 5,0 Nikel 6,2 Sodyum 6,8 Gümüş 6,0 Magnezyum 6,0 Kadmiyum 6,7 Alüminyum 5,8 Altın 6,1 Silisyum 4,9 Kurşun 6,1 Şekil 3.13 Katı elementlerin atomik ısıları. Örnek 3.2 Kalsiyum (a) ve oksijenin (O) atomik ısıları 6,2 ve 4,0 cal.g -1. o -1 olarak ölçüldüğüne göre, kalsiyum oksidin (ao) özgül (spesifik) ısısını hesaplayınız. (a: 40 g.mol -1, O: 16 g.mol -1 ) Yanıt: ao için, Atomik ısı = 1.6,2+1.4,0 = 10,2 cal.mol -1. o -1 Dulong-Petit Yasası na göre, c Atomik ısı Atom / Molekül kütlesi 10, ,2 56 0,182 cal.g o. Yrd. Doç. Dr. Ayşe Engin KURTOĞLU 8
9 Örnek 3.3 Atom kütlesi 40 olan kalsiyumun (a) özgül (spesifik) ısısını hesaplayınız. Yanıt: Dulong-Petit Yasası na göre, c Atomik ısı kütlesi Atom / Molekül 6,2 40 0,155 cal.g Örnek 3.4 Oda sıcaklığında demirin (Fe) özgül (spesifik) ısısı 0,107 cal.g -1. o -1 olarak ölçülmüştür. Demirin atom kütlesini hesaplayınız. Gerçek atom kütlesi 55,8 olduğuna göre yapılan hata ne kadardır? Yanıt: Dulong-Petit Yasası na göre, c Atomik ısı Atom / Molekül kütlesi 0,107 55,8 55,14 % Hata.100 % 1,2 55,8 Katı Bileşiklerin Molar Isıları 5,9 M o. M 55,14 g.mol Katı bir bileşiğin molar ısısı, yani 1 molgramının sıcaklığını 1 o arttırmak için gerekli olan ısı miktarı, molekülü oluşturan atomların atomik ısılarının toplamına eşittir. Neumann-Kopp Yasası denilen yasa yardımıyla katı bileşiklerin yaklaşık molar ısıları hesaplanabilir. Bunun için Tablo 3.3 teki değerlerden yararlanılır. al 2 durumunda atom sayısı 3 tür, o halde molar ısısı= 3.6,2=18,6 cal.mol -1. o dir. Oysa deneysel değer 19,3 cal.mol -1. o (80,75 J.mol -1. o ) dir. ao 3 durumunda ise ayrı ayrı atomların ısılarını toplamak gerekir: 1.6, , ,0 = 20,2 cal.mol -1. o = 84,52 J.mol -1. o bulunur. Sıvılarda özgül (spesifik) ısılar daha büyüktür. Aşağıdaki değerlerden yararlanarak sıvıların molar ısıları hesaplanabilir: Tablo 3.4 Oda Sıcaklığında p (Sıvılar İçin). Element p Element p Hidojen 5,0 Oksijen 6,0 Bor 4,8 Flor 7,0 Karbon 3,0 Diğer elementler 8,0 Örneğin sülfat asidinin H 2 SO 4 in molar ısısı için, 2.5, , ,0 = 42 cal.mol -1. o =175,73 J.mol -1. o bulunur. Katıların Özgül (Spesifik) Isılarının Sıcaklıkla Değişmesi Katı maddelerin özgül (spesifik) ısıları mutlak sıfır yakınlarında sıfırdır. Klasik kuramın açıklayamadığı bu sorunun ilk açıklaması Einstein (1907) tarafından yapılmıştır. Einstein, bir kristaldeki bütün atomların bir ortalama denge durumlarına göre harmonik titreşim hareketleri yapan osilatörler (elektriksel salınımları üreten devre) olarak düşünülebileceğini varsaymıştır. Einstein, her maddenin sabit ve ayırt edici bir titreşim Yrd. Doç. Dr. Ayşe Engin KURTOĞLU 9
10 frekansının ( ) bulunduğunu ve osilatörler tarafından absorplanan enerjinin sürekli olmayıp Planck Kuramı na göre süreksiz bir biçimde olduğunu düşünmüştür. Planck Kuramı na göre osilatörün ortalama enerjisi, h. E (3.2) h. / k. T e eşitliği ile verilmiştir. Katıda her osilatör atomu üç serbestlik derecesine sahip olduğundan, 1 atomgram gazın enerjisi yukarıdaki eşitliğin 3.N ile çarpılmasıyla elde edilir., atomun üç serbestlik derecesine sahip olduğu ayırt edici sıcaklıksa, R. =N.h. alınarak enerji için, 3.R. E / T e (3.3) Molar ısı için, ya da, v de dt h. e 3.k.N.. k.t (e 2 2 h. / k.t h. / k.t ) 2 (3.4) / T.e T v 3.R. (3.5) / T 2 (e ) ya da, v 3.R.E. (3.6) T bulunur ki, katıların molar ısıları için Einstein eşitliğidir. E. ye Einstein Fonksiyonu T denir. Düşük sıcaklıklarda T büyüktür, paydada 2 / T e yanında 1 ihmal edilebilir. O halde, T v 3.R..e 0 (3.7) t 0 T v 3.R. 3.R (3.8) t Yüksek T olur. Bu sonuçlara göre, mutlak sıfır yakınında katı maddelerin özgül (spesifik) ısıları sıfır olmakla birlikte, oldukça yüksek sıcaklıklarda ise v =3.R=5,96 cal ye eşit olur. Einstein eşitliği elmas halinde gerçekleştirilmiştir. v nin 331,3 K de deneysel sonucu alınıp buradan frekansı ( =2, s -1 ) bulunmuş ve bu değer eşitliğin diğer sıcaklıklarda uygulanması için kullanılmıştır. Örneğin 331,3 K de v (Deneysel)=1,838, v (Hesaplanan)=1,752, 1258,3 K de v (Deneysel)=5,507, v (Hesaplanan)=5,442 dir. Debye Eşitliği Einstein Eşitliği birçok durumda (örneğin elmas durumunda olduğu gibi) deneysel ölçülerle uyarlıkta olmakla birlikte, bazı durumlarda (örneğin u, Kl gibi) uyarlık tam değildir. Daha başarılı bir kuram P. Debye tarafından önerilmiştir. Einstein Kuramı nda katıdaki bütün atomların aynı titreşim frekansına sahip oldukları varsayılmıştır. Oysa her atom, çevresindeki diğer atomların devamlı etkisinde kalır. O halde tek frekans yerine sıfır frekansla bir m üst sınır frekansı arasında değişen bir frekanslar spektrumu düşünmek gerekir. Debye (1913) bu düşünceden hareket ederek deneysel olgularla uyarlıkta olan bir eşitlik vermiştir., atomun üç serbestlik derecesine sahip olduğu ayırt edici sıcaklık ise, Yrd. Doç. Dr. Ayşe Engin KURTOĞLU 10
11 h. m (3.9) k R dır. Burada h Planck sabiti, k Boltzmann sabiti k, m de düşünülen katıda N A maksimum titreşim sayısıdır. Yüksek sıcaklıklarda v =3.R, düşük sıcaklıklarda ise, 3 3 T T v 77,94.3.R. 464,6. (3.10) olur ki, mutlak sıfırda v gerçekten sıfır olur. Her madde için ayırt edici sıcaklık sabit olduğundan, düşük sıcaklıklarda katı bir maddenin atomik ısısı mutlak sıcaklığın üçüncü kuvvetiyle orantılıdır (Şekil 3.14). Şekil 3.14 Düşük sıcaklıkta v nin T ile değişimi. Yrd. Doç. Dr. Ayşe Engin KURTOĞLU 11
1. Amaç Kristallerin üç boyutlu yapısı incelenecektir. Ön bilgi için İnorganik Kimya, Miessler ve Tarr, Bölüm 7 okunmalıdır.
 14 DENEY KATI HAL 1. Amaç Kristallerin üç boyutlu yapısı incelenecektir. Ön bilgi için İnorganik Kimya, Miessler ve Tarr, Bölüm 7 okunmalıdır. 2. Giriş Atomlar arası (veya moleküller arası) çekim kuvvetleri
14 DENEY KATI HAL 1. Amaç Kristallerin üç boyutlu yapısı incelenecektir. Ön bilgi için İnorganik Kimya, Miessler ve Tarr, Bölüm 7 okunmalıdır. 2. Giriş Atomlar arası (veya moleküller arası) çekim kuvvetleri
Katılar & Kristal Yapı
 Katılar & Kristal Yapı Katılar Kristal katılar Amorf katılar Belli bir geometrik şekle sahip olan katılardır, tanecikleri belli bir düzene göre istiflenir. Belli bir geometrik şekli olmayan katılardır,
Katılar & Kristal Yapı Katılar Kristal katılar Amorf katılar Belli bir geometrik şekle sahip olan katılardır, tanecikleri belli bir düzene göre istiflenir. Belli bir geometrik şekli olmayan katılardır,
Katılar. MÜHENDİSLİK KİMYASI DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN. Yrd. Doç. Dr. Atilla EVCİN Afyonkarahisar Kocatepe Üniversitesi 2006
 Katılar Tüm maddeler, yeteri kadar soğutulduğunda katıları oluştururlar. MÜHENDİSLİK KİMYASI DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN Oluşan katıların doğası atom, iyon veya molekülleri birarada tutan kuvvetlere
Katılar Tüm maddeler, yeteri kadar soğutulduğunda katıları oluştururlar. MÜHENDİSLİK KİMYASI DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN Oluşan katıların doğası atom, iyon veya molekülleri birarada tutan kuvvetlere
KATILARIN ATOMİK DÜZENİ KRİSTAL YAPILAR
 KATILARIN ATOMİK DÜZENİ KRİSTAL YAPILAR KRİSTAL YAPILAR Mühendislik açısından önemli olan katı malzemelerin fiziksel özelikleri; katı malzemeleri meydana getiren atom, iyon veya moleküllerin dizilişine
KATILARIN ATOMİK DÜZENİ KRİSTAL YAPILAR KRİSTAL YAPILAR Mühendislik açısından önemli olan katı malzemelerin fiziksel özelikleri; katı malzemeleri meydana getiren atom, iyon veya moleküllerin dizilişine
ELEMETLER VE BİLEŞİKLER ELEMENTLER VE SEMBOLLERİ
 ELEMENTLER VE SEMBOLLERİ Elementler Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere element denir. Elementler çok sayıda
ELEMENTLER VE SEMBOLLERİ Elementler Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere element denir. Elementler çok sayıda
Bir kristal malzemede uzun-aralıkta düzen mevcu4ur.
 Bir kristal malzemede uzun-aralıkta düzen mevcu4ur. Kristal ka8ların bazı özellikleri, malzemelerin kristal yapılarına, yani atomların, iyonların ya da moleküllerin üç boyutlu olarak meydana ge@rdikleri
Bir kristal malzemede uzun-aralıkta düzen mevcu4ur. Kristal ka8ların bazı özellikleri, malzemelerin kristal yapılarına, yani atomların, iyonların ya da moleküllerin üç boyutlu olarak meydana ge@rdikleri
Gelin bugün bu yazıda ilkokul sıralarından beri bize öğretilen bilgilerden yeni bir şey keşfedelim, ya da ne demek istediğini daha iyi anlayalım.
 Kristal Yapılar Gelin bugün bu yazıda ilkokul sıralarından beri bize öğretilen bilgilerden yeni bir şey keşfedelim, ya da ne demek istediğini daha iyi anlayalım. Evrende, kimyasal özellik barındıran maddelerin
Kristal Yapılar Gelin bugün bu yazıda ilkokul sıralarından beri bize öğretilen bilgilerden yeni bir şey keşfedelim, ya da ne demek istediğini daha iyi anlayalım. Evrende, kimyasal özellik barındıran maddelerin
Bölüm 3 - Kristal Yapılar
 Bölüm 3 - Kristal Yapılar Katı malzemeler, atomların veya iyonların oluşturdukları düzene göre sınıflandırılır. Kristal malzemede uzun-aralıkta atomsal ölçekte tekrarlayan bir düzen mevcuttur. Katılaşma
Bölüm 3 - Kristal Yapılar Katı malzemeler, atomların veya iyonların oluşturdukları düzene göre sınıflandırılır. Kristal malzemede uzun-aralıkta atomsal ölçekte tekrarlayan bir düzen mevcuttur. Katılaşma
ATOMLAR ARASI BAĞLAR
 MALZEME 2. HAFTA 1 ATOMSAL BAĞ ATOMLAR ARASI BAĞLAR Atomlar, atomlar arası bağ kuvvetleri ile bir araya gelirler. Malzemenin en küçük yapı taşı olan atomları bağ kuvvetleri bir arada tutar. Atomsal bağların
MALZEME 2. HAFTA 1 ATOMSAL BAĞ ATOMLAR ARASI BAĞLAR Atomlar, atomlar arası bağ kuvvetleri ile bir araya gelirler. Malzemenin en küçük yapı taşı olan atomları bağ kuvvetleri bir arada tutar. Atomsal bağların
MOL KAVRAMI I. ÖRNEK 2
 MOL KAVRAMI I Maddelerin taneciklerden oluştuğunu biliyoruz. Bu taneciklere atom, molekül ya da iyon denir. Atom : Kimyasal yöntemlerle daha basit taneciklere ayrılmayan ve elementlerin yapıtaşı olan taneciklere
MOL KAVRAMI I Maddelerin taneciklerden oluştuğunu biliyoruz. Bu taneciklere atom, molekül ya da iyon denir. Atom : Kimyasal yöntemlerle daha basit taneciklere ayrılmayan ve elementlerin yapıtaşı olan taneciklere
BİLEŞİKLER VE FORMÜLLERİ
 BİLEŞİKLER VE FORMÜLLERİ Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur). Bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere
BİLEŞİKLER VE FORMÜLLERİ Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur). Bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere
Bazı atomlarda proton sayısı aynı olduğu halde nötron sayısı değişiktir. Bunlara izotop denir. Şekil II.1. Bir atomun parçaları
 8 II. MİNERALLER II.1. Element ve Atom Elementlerin en ufak parçasına atom denir. Atomlar, proton, nötron ve elektron gibi taneciklerden oluşur (Şekil II.1). Elektron negatif, proton pozitif elektrik yüküne
8 II. MİNERALLER II.1. Element ve Atom Elementlerin en ufak parçasına atom denir. Atomlar, proton, nötron ve elektron gibi taneciklerden oluşur (Şekil II.1). Elektron negatif, proton pozitif elektrik yüküne
Elektronların Dağılımı ve Kimyasal Özellikleri
 Elektronların Dağılımı ve Kimyasal Özellikleri Helyum (2), neon (10), argon (18)in elektron dağılımları incelendiğinde Eğer bu üç elementin birer elektronu daha olsaydı, her birinde yeni bir katman oluşacaktı.
Elektronların Dağılımı ve Kimyasal Özellikleri Helyum (2), neon (10), argon (18)in elektron dağılımları incelendiğinde Eğer bu üç elementin birer elektronu daha olsaydı, her birinde yeni bir katman oluşacaktı.
BÖLÜM 2 ATOMİK YAPI İÇERİK. Atom yapısı. Bağ tipleri. Chapter 2-1
 BÖLÜM 2 ATOMİK YAPI İÇERİK Atom yapısı Bağ tipleri 1 Atomların Yapıları Atomlar başlıca üç temel atom altı parçacıktan oluşur; Protonlar (+ yüklü) Nötronlar (yüksüz) Elektronlar (-yüklü) Basit bir atom
BÖLÜM 2 ATOMİK YAPI İÇERİK Atom yapısı Bağ tipleri 1 Atomların Yapıları Atomlar başlıca üç temel atom altı parçacıktan oluşur; Protonlar (+ yüklü) Nötronlar (yüksüz) Elektronlar (-yüklü) Basit bir atom
Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı
 Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani madde yani bileşik
Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani madde yani bileşik
ATOMİK YAPI. Elektron Yükü=-1,60x10-19 C Proton Yükü=+1,60x10-19 C Nötron Yükü=0
 ATOMİK YAPI Elektron Yükü=-1,60x10-19 C Proton Yükü=+1,60x10-19 C Nötron Yükü=0 Elektron Kütlesi 9,11x10-31 kg Proton Kütlesi Nötron Kütlesi 1,67x10-27 kg Bir kimyasal elementin atom numarası (Z) çekirdeğindeki
ATOMİK YAPI Elektron Yükü=-1,60x10-19 C Proton Yükü=+1,60x10-19 C Nötron Yükü=0 Elektron Kütlesi 9,11x10-31 kg Proton Kütlesi Nötron Kütlesi 1,67x10-27 kg Bir kimyasal elementin atom numarası (Z) çekirdeğindeki
FZM 220. Malzeme Bilimine Giriş
 FZM 220 Yapı Karakterizasyon Özellikler İşleme Performans Prof. Dr. İlker DİNÇER Fakültesi, Fizik Mühendisliği Bölümü 1 Ders Hakkında FZM 220 Dersinin Amacı Bu dersin amacı, fizik mühendisliği öğrencilerine,
FZM 220 Yapı Karakterizasyon Özellikler İşleme Performans Prof. Dr. İlker DİNÇER Fakültesi, Fizik Mühendisliği Bölümü 1 Ders Hakkında FZM 220 Dersinin Amacı Bu dersin amacı, fizik mühendisliği öğrencilerine,
ATOMUN YAPISI. Özhan ÇALIŞ. Bilgi İletişim ve Teknolojileri
 ATOMUN YAPISI ATOMLAR Atom, elementlerin en küçük kimyasal yapıtaşıdır. Atom çekirdeği: genel olarak nükleon olarak adlandırılan proton ve nötronlardan meydana gelmiştir. Elektronlar: çekirdeğin etrafında
ATOMUN YAPISI ATOMLAR Atom, elementlerin en küçük kimyasal yapıtaşıdır. Atom çekirdeği: genel olarak nükleon olarak adlandırılan proton ve nötronlardan meydana gelmiştir. Elektronlar: çekirdeğin etrafında
Örnek : 3- Bileşiklerin Özellikleri :
 Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani
Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani
ATOMİK YAPI. Elektron Yükü=-1,60x10-19 C Proton Yükü=+1,60x10-19 C Nötron Yükü=0
 ATOMİK YAPI Atom, birkaç türü birleştiğinde çeşitli molekülleri, bir tek türü ise bir kimyasal öğeyi oluşturan parçacıktır. Atom, elementlerin özelliklerini taşıyan en küçük yapı birimi olup çekirdekteki
ATOMİK YAPI Atom, birkaç türü birleştiğinde çeşitli molekülleri, bir tek türü ise bir kimyasal öğeyi oluşturan parçacıktır. Atom, elementlerin özelliklerini taşıyan en küçük yapı birimi olup çekirdekteki
ELEMENTLER VE BİLEŞİKLER
 ELEMENTLER VE BİLEŞİKLER 1- Elementler ve Elementlerin Özellikleri a) ELEMENTLER Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere
ELEMENTLER VE BİLEŞİKLER 1- Elementler ve Elementlerin Özellikleri a) ELEMENTLER Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere
ELEMENTLERİN SEMBOLLERİ VE ATOM
 ELEMENT VE SEMBOLLERİ SAF MADDE: Kendisinden başka madde bulundurmayan maddelere denir. ELEMENT: İçerisinde tek cins atom bulunduran maddelere denir. Yani elementlerin yapı yaşı atomlardır. BİLEŞİK: En
ELEMENT VE SEMBOLLERİ SAF MADDE: Kendisinden başka madde bulundurmayan maddelere denir. ELEMENT: İçerisinde tek cins atom bulunduran maddelere denir. Yani elementlerin yapı yaşı atomlardır. BİLEŞİK: En
MALZEME BİLGİSİ DERS 5 DR. FATİH AY. www.fatihay.net fatihay@fatihay.net
 MALZEME BİLGİSİ DERS 5 DR. FATİH AY www.fatihay.net fatihay@fatihay.net GEÇEN HAFTA BAĞ KUVVETLERİ VE ENERJİLERİ ATOMLARARASI BİRİNCİL BAĞLAR İKİNCİL VEYA VAN DER WAALS BAĞLARI MOLEKÜLLER BÖLÜM III KATILARDA
MALZEME BİLGİSİ DERS 5 DR. FATİH AY www.fatihay.net fatihay@fatihay.net GEÇEN HAFTA BAĞ KUVVETLERİ VE ENERJİLERİ ATOMLARARASI BİRİNCİL BAĞLAR İKİNCİL VEYA VAN DER WAALS BAĞLARI MOLEKÜLLER BÖLÜM III KATILARDA
Yrd. Doç. Dr. H. Hasan YOLCU. hasanyolcu.wordpress.com
 Yrd. Doç. Dr. H. Hasan YOLCU hasanyolcu.wordpress.com En az iki atomun belli bir düzenlemeyle kimyasal bağ oluşturmak suretiyle bir araya gelmesidir. Aynı atomda olabilir farklı atomlarda olabilir. H 2,
Yrd. Doç. Dr. H. Hasan YOLCU hasanyolcu.wordpress.com En az iki atomun belli bir düzenlemeyle kimyasal bağ oluşturmak suretiyle bir araya gelmesidir. Aynı atomda olabilir farklı atomlarda olabilir. H 2,
Element ve Bileşikler
 Element ve Bileşikler Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere element denir. Bir elementi oluşturan bütün atomların
Element ve Bileşikler Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere element denir. Bir elementi oluşturan bütün atomların
Yrd.Doç.Dr. Emre YALAMAÇ. Yrd.Doç.Dr. Emre YALAMAÇ İÇERİK
 İÇERİK Elementlere, Bileşiklere ve Karışımlara atomik boyutta bakış Dalton Atom Modeli Atom Fiziğinde Buluşlar - Elektronların Keşfi - Atom Çekirdeği Keşfi Günümüz Atom Modeli Kimyasal Elementler Periyodik
İÇERİK Elementlere, Bileşiklere ve Karışımlara atomik boyutta bakış Dalton Atom Modeli Atom Fiziğinde Buluşlar - Elektronların Keşfi - Atom Çekirdeği Keşfi Günümüz Atom Modeli Kimyasal Elementler Periyodik
ELEMENT VE BİLEŞİKLER
 ELEMENT VE BİLEŞİKLER 1- Elementler ve Elementlerin Özellikleri: a) Elementler: Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere
ELEMENT VE BİLEŞİKLER 1- Elementler ve Elementlerin Özellikleri: a) Elementler: Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere
BİYOKİMYAYA GİRİŞ: ATOM, MOLEKÜL, ORGANİK BİLEŞİKLER
 BİYOKİMYAYA GİRİŞ: ATOM, MOLEKÜL, ORGANİK BİLEŞİKLER Biyokimyanın tanımı yaşamın temel kimyası ile ilgilenen bilim dalı (Bios, Yunancada yaşam demektir.) canlı sistemin yapısını ve fonksiyonlarını kimyasal
BİYOKİMYAYA GİRİŞ: ATOM, MOLEKÜL, ORGANİK BİLEŞİKLER Biyokimyanın tanımı yaşamın temel kimyası ile ilgilenen bilim dalı (Bios, Yunancada yaşam demektir.) canlı sistemin yapısını ve fonksiyonlarını kimyasal
BÖLÜM 2 ATOMİK YAPI İÇERİK. Atom yapısı. Bağ tipleri. Chapter 2-1
 BÖLÜM 2 ATOMİK YAPI İÇERİK Atom yapısı Bağ tipleri 1 Atomların Yapıları Atomlar başlıca üç temel atom altı parçacıktan oluşur; Protonlar (+ yüklü) Nötronlar (yüksüz) Elektronlar (-yüklü) Basit bir atom
BÖLÜM 2 ATOMİK YAPI İÇERİK Atom yapısı Bağ tipleri 1 Atomların Yapıları Atomlar başlıca üç temel atom altı parçacıktan oluşur; Protonlar (+ yüklü) Nötronlar (yüksüz) Elektronlar (-yüklü) Basit bir atom
Malzeme Bilimi I Metalurji ve Malzeme Mühendisliği
 I Metalurji ve Malzeme Mühendisliği Doç. Dr. Rıdvan YAMANOĞLU 2017-2018 Metaller katılaşırken kendilerine has, elektron düzenlerinin neden olduğu belli bir kafes sisteminde kristalleşirler. Aluminyum,
I Metalurji ve Malzeme Mühendisliği Doç. Dr. Rıdvan YAMANOĞLU 2017-2018 Metaller katılaşırken kendilerine has, elektron düzenlerinin neden olduğu belli bir kafes sisteminde kristalleşirler. Aluminyum,
MADDE NEDİR? Çevremize baktığımızda gördüğümüz her şey örneğin, dağlar, denizler, ağaçlar, bitkiler, hayvanlar ve hava birer maddedir.
 MADDE NEDİR? Çevremize baktığımızda gördüğümüz her şey örneğin, dağlar, denizler, ağaçlar, bitkiler, hayvanlar ve hava birer maddedir. Her maddenin bir kütlesi vardır ve bu tartılarak bulunur. Ayrıca her
MADDE NEDİR? Çevremize baktığımızda gördüğümüz her şey örneğin, dağlar, denizler, ağaçlar, bitkiler, hayvanlar ve hava birer maddedir. Her maddenin bir kütlesi vardır ve bu tartılarak bulunur. Ayrıca her
7. Sınıf Fen ve Teknoloji Dersi 4. Ünite: Madde ve Yapısı Konu: Elementler ve Sembolleri
 ÖĞRETĐM TEKNOLOJĐLERĐ VE MATERYAL GELĐŞĐMĐ 7. Sınıf Fen ve Teknoloji Dersi 4. Ünite: Madde ve Yapısı Konu: Elementler ve Sembolleri Çalışma Yaprağı Konu Anlatımı-Değerlendirme çalışma Yaprağı- Çözümlü
ÖĞRETĐM TEKNOLOJĐLERĐ VE MATERYAL GELĐŞĐMĐ 7. Sınıf Fen ve Teknoloji Dersi 4. Ünite: Madde ve Yapısı Konu: Elementler ve Sembolleri Çalışma Yaprağı Konu Anlatımı-Değerlendirme çalışma Yaprağı- Çözümlü
METALİK MALZEMELERİN GENEL KARAKTERİSTİKLERİ BAHAR 2010
 METALİK MALZEMELERİN GENEL KARAKTERİSTİKLERİ BAHAR 2010 WEBSİTE www2.aku.edu.tr/~hitit Dersler İÇERİK Metalik Malzemelerin Genel Karakteristiklerİ Denge diyagramları Ergitme ve döküm Dökme demir ve çelikler
METALİK MALZEMELERİN GENEL KARAKTERİSTİKLERİ BAHAR 2010 WEBSİTE www2.aku.edu.tr/~hitit Dersler İÇERİK Metalik Malzemelerin Genel Karakteristiklerİ Denge diyagramları Ergitme ve döküm Dökme demir ve çelikler
Elementlerin büyük bir kısmı tabiatta saf hâlde bulunmaz. Çoğunlukla başka elementlerle bileşikler oluşturmuş şekilde bulunurlar.
 Elementlerin büyük bir kısmı tabiatta saf hâlde bulunmaz. Çoğunlukla başka elementlerle bileşikler oluşturmuş şekilde bulunurlar. Elementlerin bileşik oluşturma istekleri onların kararlı yapıya ulaşma
Elementlerin büyük bir kısmı tabiatta saf hâlde bulunmaz. Çoğunlukla başka elementlerle bileşikler oluşturmuş şekilde bulunurlar. Elementlerin bileşik oluşturma istekleri onların kararlı yapıya ulaşma
ALETLİ ANALİZ YÖNTEMLERİ
 ALETLİ ANALİZ YÖNTEMLERİ Spektroskopiye Giriş Yrd. Doç. Dr. Gökçe MEREY SPEKTROSKOPİ Işın-madde etkileşmesini inceleyen bilim dalına spektroskopi denir. Spektroskopi, Bir örnekteki atom, molekül veya iyonların
ALETLİ ANALİZ YÖNTEMLERİ Spektroskopiye Giriş Yrd. Doç. Dr. Gökçe MEREY SPEKTROSKOPİ Işın-madde etkileşmesini inceleyen bilim dalına spektroskopi denir. Spektroskopi, Bir örnekteki atom, molekül veya iyonların
MALZEME BİLGİSİ. Kristal Yapılar ve Kristal Geometrisi
 MALZEME BİLGİSİ Dr.- Ing. Rahmi ÜNAL Konu: Kristal Yapılar ve Kristal Geometrisi 1 KRİSTAL YAPILAR Malzemelerin iç yapısı atomların diziliş biçimine bağlıdır. Kristal yapı Kristal yapılarda atomlar düzenli
MALZEME BİLGİSİ Dr.- Ing. Rahmi ÜNAL Konu: Kristal Yapılar ve Kristal Geometrisi 1 KRİSTAL YAPILAR Malzemelerin iç yapısı atomların diziliş biçimine bağlıdır. Kristal yapı Kristal yapılarda atomlar düzenli
MIT Açık Ders Malzemeleri http://ocw.mit.edu. 5.62 Fizikokimya II. 2008 Bahar
 MIT Açık Ders Malzemeleri http://ocw.mit.edu 5.62 Fizikokimya II 2008 Bahar Bu materyallerden alıntı yapmak veya Kullanım Şartları hakkında bilgi almak için http://ocw.mit.edu/terms ve http://tuba.acikders.org.tr
MIT Açık Ders Malzemeleri http://ocw.mit.edu 5.62 Fizikokimya II 2008 Bahar Bu materyallerden alıntı yapmak veya Kullanım Şartları hakkında bilgi almak için http://ocw.mit.edu/terms ve http://tuba.acikders.org.tr
BileĢiklerin formülleri atom sayıları oranını yansıtan en basit formüldür.
 KATILAR KRĠSTAL KATI Sert SıkıĢtırılmayan Tanecikleri belirli geometrik Ģekle sahiptir. ĠYONĠK KRĠSTAL Anyon- katyonlar arasında elektrostatik çekim kuvveti sonucu oluģur (iyonik bağ içerir). Sert-sağlam-
KATILAR KRĠSTAL KATI Sert SıkıĢtırılmayan Tanecikleri belirli geometrik Ģekle sahiptir. ĠYONĠK KRĠSTAL Anyon- katyonlar arasında elektrostatik çekim kuvveti sonucu oluģur (iyonik bağ içerir). Sert-sağlam-
maddelere saf maddeler denir
 Madde :Kütlesi olan her şeye madde denir. Saf madde: Aynı cins atom veya moleküllerden oluşan maddeye denir. Fiziksel yollarla kendisinden başka maddelere ayrışmayan maddelere saf maddeler denir Element:
Madde :Kütlesi olan her şeye madde denir. Saf madde: Aynı cins atom veya moleküllerden oluşan maddeye denir. Fiziksel yollarla kendisinden başka maddelere ayrışmayan maddelere saf maddeler denir Element:
MADDE NEDİR? Çevremize baktığımızda gördüğümüz her şey örneğin, dağlar, denizler, ağaçlar, bitkiler, hayvanlar ve hava birer maddedir.
 MADDE NEDİR? Çevremize baktığımızda gördüğümüz her şey örneğin, dağlar, denizler, ağaçlar, bitkiler, hayvanlar ve hava birer maddedir. Her maddenin bir kütlesi vardır ve bu tartılarak bulunur. Ayrıca her
MADDE NEDİR? Çevremize baktığımızda gördüğümüz her şey örneğin, dağlar, denizler, ağaçlar, bitkiler, hayvanlar ve hava birer maddedir. Her maddenin bir kütlesi vardır ve bu tartılarak bulunur. Ayrıca her
Kimyanın Temel Kanunları
 Kimyanın Temel Kanunları A. Kütlenin Korunumu Kanunu Lavoiser miktarı belli olan kalay (Sn) parçasını içinde bir miktar hava bulunan bir fanusa koyarak tartmış.daha sonra fanusu içindekilerle birlikte
Kimyanın Temel Kanunları A. Kütlenin Korunumu Kanunu Lavoiser miktarı belli olan kalay (Sn) parçasını içinde bir miktar hava bulunan bir fanusa koyarak tartmış.daha sonra fanusu içindekilerle birlikte
KİMYASAL BİLEŞİKLER İÇERİK
 KİMYASAL BİLEŞİKLER İÇERİK Mol, Molar Kütle Kimyasal Formülden Yüzde Bileşiminin Hesaplanması Bir Bileşiğin Yüzde Bileşiminden Kimyasal Formülünün Hesaplanması Organik Bileşiklerin Kimyasal Bileşiminin
KİMYASAL BİLEŞİKLER İÇERİK Mol, Molar Kütle Kimyasal Formülden Yüzde Bileşiminin Hesaplanması Bir Bileşiğin Yüzde Bileşiminden Kimyasal Formülünün Hesaplanması Organik Bileşiklerin Kimyasal Bileşiminin
MADDENİN YAPISI VE ÖZELLİKLERİ ATOM
 MADDENİN YAPISI VE ÖZELLİKLERİ ATOM ATOMUN YAPISI Elementlerin tüm özelliğini gösteren en küçük parçasına atom denir. Atomu oluşturan parçacıklar farklı yüklere sa-hiptir. Atomda bulunan yükler; negatif
MADDENİN YAPISI VE ÖZELLİKLERİ ATOM ATOMUN YAPISI Elementlerin tüm özelliğini gösteren en küçük parçasına atom denir. Atomu oluşturan parçacıklar farklı yüklere sa-hiptir. Atomda bulunan yükler; negatif
Atomlar ve Moleküller
 Atomlar ve Moleküller Madde, uzayda yer işgal eden ve kütlesi olan herşeydir. Element, kimyasal tepkimelerle başka bileşiklere parçalanamayan maddedir. -Doğada 92 tane element bulunmaktadır. Bileşik, belli
Atomlar ve Moleküller Madde, uzayda yer işgal eden ve kütlesi olan herşeydir. Element, kimyasal tepkimelerle başka bileşiklere parçalanamayan maddedir. -Doğada 92 tane element bulunmaktadır. Bileşik, belli
KATILARDA KRİSTAL YAPI. Hekzagonal a b c 90 o, 120. Tetragonal a b c 90 o. Rombohedral (Trigonal) Ortorombik a b c 90 o. Monoklinik a b c 90 o
 KATILARDA KRİSTAL YAPI Kristal yapı atomun bir üst seviyesinde incelenen ve atomların katı halde oluşturduğu düzeni ifade eden birim hücre (kafes) geometrik parametreleri ve atom dizilimi ile tarif edilen
KATILARDA KRİSTAL YAPI Kristal yapı atomun bir üst seviyesinde incelenen ve atomların katı halde oluşturduğu düzeni ifade eden birim hücre (kafes) geometrik parametreleri ve atom dizilimi ile tarif edilen
BMM 205 Malzeme Biliminin Temelleri
 BMM 205 Malzeme Biliminin Temelleri Atom Yapısı ve Atomlar Arası Bağlar Dr. Ersin Emre Ören Biyomedikal Mühendisliği Bölümü Malzeme Bilimi ve Nanoteknoloji Mühendisliği Bölümü TOBB Ekonomi ve Teknoloji
BMM 205 Malzeme Biliminin Temelleri Atom Yapısı ve Atomlar Arası Bağlar Dr. Ersin Emre Ören Biyomedikal Mühendisliği Bölümü Malzeme Bilimi ve Nanoteknoloji Mühendisliği Bölümü TOBB Ekonomi ve Teknoloji
Atomlar birleştiği zaman elektron dağılımındaki değişmelerin bir sonucu olarak kimyasal bağlar meydana gelir. Üç çeşit temel bağ vardır:
 Atomlar birleştiği zaman elektron dağılımındaki değişmelerin bir sonucu olarak kimyasal bağlar meydana gelir. Üç çeşit temel bağ vardır: İyonik bağlar, elektronlar bir atomdan diğerine aktarıldığı zaman
Atomlar birleştiği zaman elektron dağılımındaki değişmelerin bir sonucu olarak kimyasal bağlar meydana gelir. Üç çeşit temel bağ vardır: İyonik bağlar, elektronlar bir atomdan diğerine aktarıldığı zaman
İstatistiksel Mekanik I
 MIT Açık Ders Malzemeleri http://ocw.mit.edu 8.333 İstatistiksel Mekanik I: Parçacıkların İstatistiksel Mekaniği 2007 Güz Bu materyallerden alıntı yapmak veya Kullanım Şartları hakkında bilgi almak için
MIT Açık Ders Malzemeleri http://ocw.mit.edu 8.333 İstatistiksel Mekanik I: Parçacıkların İstatistiksel Mekaniği 2007 Güz Bu materyallerden alıntı yapmak veya Kullanım Şartları hakkında bilgi almak için
ATOMLAR ARASI BAĞLAR Doç. Dr. Ramazan YILMAZ
 ATOMLAR ARASI BAĞLAR Doç. Dr. Ramazan YILMAZ Sakarya Üniversitesi, Teknoloji Fakültesi, Metalurji ve Malzeme Mühendisliği Bölümü Esentepe Kampüsü, 54187, SAKARYA Atomlar Arası Bağlar 1 İyonik Bağ 2 Kovalent
ATOMLAR ARASI BAĞLAR Doç. Dr. Ramazan YILMAZ Sakarya Üniversitesi, Teknoloji Fakültesi, Metalurji ve Malzeme Mühendisliği Bölümü Esentepe Kampüsü, 54187, SAKARYA Atomlar Arası Bağlar 1 İyonik Bağ 2 Kovalent
KATIHAL FİZİĞİ DERS 2. Tipik Kristal Yapılar Kuasi-kristaller Doluluk Oranı
 KATIHAL FİZİĞİ DERS 2 Tipik Kristal Yapılar Kuasi-kristaller Doluluk Oranı Tipik Kristal Yapılar Yüzey Merkezli Kübik Kristal Yapı (Face centered Cubic (fcc)) Yüzey merkezleri ve köşelerde atomlar vardır.
KATIHAL FİZİĞİ DERS 2 Tipik Kristal Yapılar Kuasi-kristaller Doluluk Oranı Tipik Kristal Yapılar Yüzey Merkezli Kübik Kristal Yapı (Face centered Cubic (fcc)) Yüzey merkezleri ve köşelerde atomlar vardır.
Elektronların Dizilişi ve Kimyasal Özellikleri
 Elektronların Dizilişi ve Kimyasal Özellikleri ELEKTRON ALIŞVERİŞİ VE SONUÇLARI: Helyum (2), neon (10), argon (18)in elektron dağılımları incelendiğinde Eğer bu üç elementin birer elektronu daha olsaydı,
Elektronların Dizilişi ve Kimyasal Özellikleri ELEKTRON ALIŞVERİŞİ VE SONUÇLARI: Helyum (2), neon (10), argon (18)in elektron dağılımları incelendiğinde Eğer bu üç elementin birer elektronu daha olsaydı,
Paylaşılan elektron ya da elektronlar, her iki çekirdek etrafında dolanacaklar, iki çekirdek arasındaki bölgede daha uzun süre bulundukları için bu
 4.Kimyasal Bağlar Kimyasal Bağlar Aynı ya da farklı cins atomları bir arada tutan kuvvetlere kimyasal bağlar denir. Pek çok madde farklı element atomlarının birleşmesiyle meydana gelmiştir. İyonik bağ
4.Kimyasal Bağlar Kimyasal Bağlar Aynı ya da farklı cins atomları bir arada tutan kuvvetlere kimyasal bağlar denir. Pek çok madde farklı element atomlarının birleşmesiyle meydana gelmiştir. İyonik bağ
MALZEME BİLGİSİ DERS 4 DR. FATİH AY.
 MALZEME BİLGİSİ DERS 4 DR. FATİH AY www.fatihay.net fatihay@fatihay.net GEÇEN HAFTA TEMEL KAVRAMLAR ATOMLARDA ELEKTRONLAR PERİYODİK TABLO BÖLÜM II ATOM YAPISI VE ATOMLARARASı BAĞLAR BAĞ KUVVETLERİ VE ENERJİLERİ
MALZEME BİLGİSİ DERS 4 DR. FATİH AY www.fatihay.net fatihay@fatihay.net GEÇEN HAFTA TEMEL KAVRAMLAR ATOMLARDA ELEKTRONLAR PERİYODİK TABLO BÖLÜM II ATOM YAPISI VE ATOMLARARASı BAĞLAR BAĞ KUVVETLERİ VE ENERJİLERİ
KRİSTAL KAFES SİSTEMLERİ
 KRİSTAL KAFES SİSTEMLERİ Doç. Dr. Ramazan YILMAZ Sakarya Üniversitesi, Teknoloji Fakültesi, Metalurji ve Malzeme Mühendisliği Bölümü Esentepe Kampüsü, 54187, SAKARYA 1 Giriş 2 Kristal Yapısı ve Birim Hücreler
KRİSTAL KAFES SİSTEMLERİ Doç. Dr. Ramazan YILMAZ Sakarya Üniversitesi, Teknoloji Fakültesi, Metalurji ve Malzeme Mühendisliği Bölümü Esentepe Kampüsü, 54187, SAKARYA 1 Giriş 2 Kristal Yapısı ve Birim Hücreler
KRİSTAL KUSURLARI BÖLÜM 3. Bağlar + Kristal yapısı + Kusurlar. Özellikler. Kusurlar malzeme özelliğini önemli ölçüde etkiler.
 KRİSTAL KUSURLARI Bağlar + Kristal yapısı + Kusurlar Özellikler Kusurlar malzeme özelliğini önemli ölçüde etkiler. 2 1 Yarıiletken alttaş üretiminde kullanılan silikon kristalleri neden belli ölçüde fosfor
KRİSTAL KUSURLARI Bağlar + Kristal yapısı + Kusurlar Özellikler Kusurlar malzeme özelliğini önemli ölçüde etkiler. 2 1 Yarıiletken alttaş üretiminde kullanılan silikon kristalleri neden belli ölçüde fosfor
Moleküllerarası Etkileşimler, Sıvılar ve Katılar - 11
 Moleküllerarası Etkileşimler, Chemistry, The Central Science, 10th edition Theodore L. Brown; H. Eugene LeMay, Jr.; and Bruce E. Bursten Sıvılar ve Katılar - 11 Maddenin Halleri Maddenin halleri arasındaki
Moleküllerarası Etkileşimler, Chemistry, The Central Science, 10th edition Theodore L. Brown; H. Eugene LeMay, Jr.; and Bruce E. Bursten Sıvılar ve Katılar - 11 Maddenin Halleri Maddenin halleri arasındaki
Seramik malzemelerin kristal yapıları
 Seramik malzemelerin kristal yapıları Kararlı ve kararsız anyon-katyon görünümü. Kırmızı daireler anyonları, mavi daireler katyonları temsil eder. Bazı seramik malzemelerin atomlararası bağlarının iyonik
Seramik malzemelerin kristal yapıları Kararlı ve kararsız anyon-katyon görünümü. Kırmızı daireler anyonları, mavi daireler katyonları temsil eder. Bazı seramik malzemelerin atomlararası bağlarının iyonik
1 mol = 6, tane tanecik. Maddelerde tanecik olarak atom, molekül ve iyonlar olduğunda dolayı mol ü aşağıdaki şekillerde tanımlamak mümkündür.
 1 GENEL KİMYA Mol Kavramı 1 Mol Kavramı Günlük hayatta kolaylık olsun diye, çok küçük taneli olan maddeler tane yerine birimlerle ifade edilir. Örneğin pirinç alınırken iki milyon tane pirinç yerine ~
1 GENEL KİMYA Mol Kavramı 1 Mol Kavramı Günlük hayatta kolaylık olsun diye, çok küçük taneli olan maddeler tane yerine birimlerle ifade edilir. Örneğin pirinç alınırken iki milyon tane pirinç yerine ~
KRİSTAL YAPISI VE KRİSTAL SİSTEMLERİ
 KRİSTAL YAPISI VE KRİSTAL SİSTEMLERİ Kristal Yapı: Atomların, üç boyutlu uzayda düzenli (kendini tekrar eden) bir şekilde dizilmesiyle oluşan yapıya kristal yapı denir. Bir kristal yapı birim hücresiyle
KRİSTAL YAPISI VE KRİSTAL SİSTEMLERİ Kristal Yapı: Atomların, üç boyutlu uzayda düzenli (kendini tekrar eden) bir şekilde dizilmesiyle oluşan yapıya kristal yapı denir. Bir kristal yapı birim hücresiyle
BÖLÜM 2. Kristal Yapılar ve Kusurlar
 BÖLÜM 2 Kristal Yapılar ve Kusurlar 1- ATOMİK VE İYONİK DÜZENLER Kısa Mesafeli Düzenler-Uzun Mesafeli Düzenler Kısa Mesafeli Düzenler (SRO): Kısa mesafede atomların tahmin edilebilir düzenlilikleridir.
BÖLÜM 2 Kristal Yapılar ve Kusurlar 1- ATOMİK VE İYONİK DÜZENLER Kısa Mesafeli Düzenler-Uzun Mesafeli Düzenler Kısa Mesafeli Düzenler (SRO): Kısa mesafede atomların tahmin edilebilir düzenlilikleridir.
GENEL KİMYA. 6. Konu: Mol Kavramı ve Avagadro Sayısı
 GENEL KİMYA 6. Konu: Mol Kavramı ve Avagadro Sayısı Avagadro Sayısı ve Mol Kavramı Gündelik hayatta bazen maddeleri teker teker ifade etmek yerine toplu halde belirtmeyi tercih ederiz. Örneğin; 30 tane
GENEL KİMYA 6. Konu: Mol Kavramı ve Avagadro Sayısı Avagadro Sayısı ve Mol Kavramı Gündelik hayatta bazen maddeleri teker teker ifade etmek yerine toplu halde belirtmeyi tercih ederiz. Örneğin; 30 tane
FİZ 427 KRİSTAL FİZİĞİ
 FİZ 427 KRİSTAL FİZİĞİ 1. Madde nedir? Kaça ayrılır? Fiziksel Özellikler Kimyasal Özellikler Ortak ve Ayırtedici özellikler 2. Katı nedir? Katı maddenin özellikleri Katı cisimler kaça ayrılır? 3. Mükemmel
FİZ 427 KRİSTAL FİZİĞİ 1. Madde nedir? Kaça ayrılır? Fiziksel Özellikler Kimyasal Özellikler Ortak ve Ayırtedici özellikler 2. Katı nedir? Katı maddenin özellikleri Katı cisimler kaça ayrılır? 3. Mükemmel
Element ve Bileşikler
 Element ve Bileşikler Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere element denir. Bir elementi oluşturan bütün atomların
Element ve Bileşikler Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere element denir. Bir elementi oluşturan bütün atomların
MALZEMENİN İÇ YAPISI: Katılarda Atomsal Bağ
 MALZEMENİN İÇ YAPISI: Katılarda Atomsal Bağ Bölüm İçeriği Bağ Enerjisi ve Kuvveti Atomlar arası mesafe, Kuvvet ve Enerji İlişkisi Atomlar arası Mesafeyi Etkileyen Faktörler. Sıcaklık, Iyonsallik derecesi,
MALZEMENİN İÇ YAPISI: Katılarda Atomsal Bağ Bölüm İçeriği Bağ Enerjisi ve Kuvveti Atomlar arası mesafe, Kuvvet ve Enerji İlişkisi Atomlar arası Mesafeyi Etkileyen Faktörler. Sıcaklık, Iyonsallik derecesi,
ATOM BİLGİSİ Atom Modelleri
 1. Atom Modelleri BÖLÜM2 Maddenin atom adı verilen bir takım taneciklerden oluştuğu fikri çok eskiye dayanmaktadır. Ancak, bilimsel bir (deneye dayalı) atom modeli ilk defa Dalton tarafından ileri sürülmüştür.
1. Atom Modelleri BÖLÜM2 Maddenin atom adı verilen bir takım taneciklerden oluştuğu fikri çok eskiye dayanmaktadır. Ancak, bilimsel bir (deneye dayalı) atom modeli ilk defa Dalton tarafından ileri sürülmüştür.
Sıcaklık (Temperature):
 Sıcaklık (Temperature): Sıcaklık tanım olarak bir maddenin yapısındaki molekül veya atomların ortalama kinetik enerjilerinin ölçüm değeridir. Sıcaklık t veya T ile gösterilir. Termometre kullanılarak ölçülür.
Sıcaklık (Temperature): Sıcaklık tanım olarak bir maddenin yapısındaki molekül veya atomların ortalama kinetik enerjilerinin ölçüm değeridir. Sıcaklık t veya T ile gösterilir. Termometre kullanılarak ölçülür.
Malzeme I Katılarda Kristal Yapılar
 Malzeme I Katılarda Kristal Yapılar 1 2 Atomik Yapılarda Düzen a) Düzensiz yapı: Atomların dağılımında herhangi bir düzen yoktur. Asal gazlarda görülür. b-c) Kısa aralıklı düzen: Atomların dağılımında
Malzeme I Katılarda Kristal Yapılar 1 2 Atomik Yapılarda Düzen a) Düzensiz yapı: Atomların dağılımında herhangi bir düzen yoktur. Asal gazlarda görülür. b-c) Kısa aralıklı düzen: Atomların dağılımında
STOKİYOMETRİ. Kimyasal Tepkimelerde Kütle İlişkisi
 STOKİYOMETRİ Kimyasal Tepkimelerde Kütle İlişkisi Sülfür oksijen içerisinde yanarak kükürt dioksit oluşturur. Modeller elementel sülfürü (S8), oksijeni ve kükürt dioksit moleküllerini göstermektedir. Her
STOKİYOMETRİ Kimyasal Tepkimelerde Kütle İlişkisi Sülfür oksijen içerisinde yanarak kükürt dioksit oluşturur. Modeller elementel sülfürü (S8), oksijeni ve kükürt dioksit moleküllerini göstermektedir. Her
IVA GRUBU ELEMENTLERİ
 Bölüm 6 IVA GRUBU ELEMENTLERİ Bu slaytlarda anlatılanlar sadece özet olup ayrıntılı bilgiler derste verilecektir. C, Si, Ge, Sn, Pb C: Ametal Si ve Ge: Yarı metal Sn ve Pb: Metal C: +4 ile -4 arası Si
Bölüm 6 IVA GRUBU ELEMENTLERİ Bu slaytlarda anlatılanlar sadece özet olup ayrıntılı bilgiler derste verilecektir. C, Si, Ge, Sn, Pb C: Ametal Si ve Ge: Yarı metal Sn ve Pb: Metal C: +4 ile -4 arası Si
h 7.1 p dalgaboyuna sahip bir dalga karakteri de taşır. De Broglie nin varsayımı fotonlar için,
 DENEY NO : 7 DENEYİN ADI : ELEKTRONLARIN KIRINIMI DENEYİN AMACI : Grafit içinden kırınıma uğrayan parçacıkların dalga benzeri davranışlarının gözlemlenmesi. TEORİK BİLGİ : 0. yüzyılın başlarında Max Planck
DENEY NO : 7 DENEYİN ADI : ELEKTRONLARIN KIRINIMI DENEYİN AMACI : Grafit içinden kırınıma uğrayan parçacıkların dalga benzeri davranışlarının gözlemlenmesi. TEORİK BİLGİ : 0. yüzyılın başlarında Max Planck
Elektromanyetik Işıma Electromagnetic Radiation (EMR)
 Elektromanyetik Işıma Electromagnetic Radiation (EMR) Elektromanyetik ışıma (ışık) bir enerji şeklidir. Işık, Elektrik (E) ve manyetik (H) alan bileşenlerine sahiptir. Light is a wave, made up of oscillating
Elektromanyetik Işıma Electromagnetic Radiation (EMR) Elektromanyetik ışıma (ışık) bir enerji şeklidir. Işık, Elektrik (E) ve manyetik (H) alan bileşenlerine sahiptir. Light is a wave, made up of oscillating
MMM291 MALZEME BİLİMİ
 MMM291 MALZEME BİLİMİ Ofis Saatleri: Perşembe 14:00 16:00 ayse.kalemtas@btu.edu.tr, akalemtas@gmail.com Bursa Teknik Üniversitesi, Doğa Bilimleri, Mimarlık ve Mühendislik Fakültesi, Metalurji ve Malzeme
MMM291 MALZEME BİLİMİ Ofis Saatleri: Perşembe 14:00 16:00 ayse.kalemtas@btu.edu.tr, akalemtas@gmail.com Bursa Teknik Üniversitesi, Doğa Bilimleri, Mimarlık ve Mühendislik Fakültesi, Metalurji ve Malzeme
İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA
 İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA İNCELENİR Her tarafında aynı özelliği gösteren, tek bir madde
İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA İNCELENİR Her tarafında aynı özelliği gösteren, tek bir madde
İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA İNCELENİR
 KARIŞIMLAR İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA İNCELENİR Her tarafında aynı özelliği gösteren, tek
KARIŞIMLAR İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA İNCELENİR Her tarafında aynı özelliği gösteren, tek
ENERJİ DENKLİKLERİ 1
 ENERJİ DENKLİKLERİ 1 Enerji ilk kez Newton tarafından ortaya konmuştur. Newton, kinetik ve potansiyel enerjileri tanımlamıştır. 2 Enerji; Potansiyel, Kinetik, Kimyasal, Mekaniki, Elektrik enerjisi gibi
ENERJİ DENKLİKLERİ 1 Enerji ilk kez Newton tarafından ortaya konmuştur. Newton, kinetik ve potansiyel enerjileri tanımlamıştır. 2 Enerji; Potansiyel, Kinetik, Kimyasal, Mekaniki, Elektrik enerjisi gibi
7. Sınıf Fen ve Teknoloji
 KONU: Atomun Yapısı Saçlarımızın elektriklenmesi, araba kapısına çarpan parmak uçlarımızın elektriksel yük boşalmasından dolayı karıncalanması, cam çubuğun kumaşa sürtüldükten sonra kâğıdı çekmesi, kazağımızı
KONU: Atomun Yapısı Saçlarımızın elektriklenmesi, araba kapısına çarpan parmak uçlarımızın elektriksel yük boşalmasından dolayı karıncalanması, cam çubuğun kumaşa sürtüldükten sonra kâğıdı çekmesi, kazağımızı
KONU 11: TAŞIN HAMMADDE OLARAK KULLANIMI: MİNERALLER. Taşın Hammadde Olarak Kullanımı
 KONU 11: TAŞIN HAMMADDE OLARAK KULLANIMI: MİNERALLER Taşın Hammadde Olarak Kullanımı Odun ve kemik gibi, taş da insanın varlığının ilk evrelerinden bu yana elinin altında bulunan ve doğanın ona verdiği
KONU 11: TAŞIN HAMMADDE OLARAK KULLANIMI: MİNERALLER Taşın Hammadde Olarak Kullanımı Odun ve kemik gibi, taş da insanın varlığının ilk evrelerinden bu yana elinin altında bulunan ve doğanın ona verdiği
Serüveni 2.ÜNİTE:ATOM VE PERİYODİK SİSTEM. Elementlerin periyodik sistemdeki yerlerine göre sınıflandırılması
 Serüveni 2.ÜNİTE:ATOM VE PERİYODİK SİSTEM Elementlerin periyodik sistemdeki yerlerine göre sınıflandırılması METALLER Metaller doğada..atomlu halde ya da bileşikleri halinde bulunur. Oda sıcaklığında..hariç
Serüveni 2.ÜNİTE:ATOM VE PERİYODİK SİSTEM Elementlerin periyodik sistemdeki yerlerine göre sınıflandırılması METALLER Metaller doğada..atomlu halde ya da bileşikleri halinde bulunur. Oda sıcaklığında..hariç
GENEL KİMYA. 4. Konu: Kimyasal türler, Kimyasal türler arasındaki etkileşimler, Kimyasal Bağlar
 GENEL KİMYA 4. Konu: Kimyasal türler, Kimyasal türler arasındaki etkileşimler, Kimyasal Bağlar Kimyasal Türler Doğada bulunan bütün maddeler tanecikli yapıdadır. Maddenin özelliğini gösteren küçük yapı
GENEL KİMYA 4. Konu: Kimyasal türler, Kimyasal türler arasındaki etkileşimler, Kimyasal Bağlar Kimyasal Türler Doğada bulunan bütün maddeler tanecikli yapıdadır. Maddenin özelliğini gösteren küçük yapı
MADDENİN YAPISI VE ÖZELLİKLERİ
 MADDENİN YAPISI VE ÖZELLİKLERİ 1. Atomun Yapısı KONULAR 2.Element ve Sembolleri 3. Elektronların Dizilimi ve Kimyasal Özellikler 4. Kimyasal Bağ 5. Bileşikler ve Formülleri 6. Karışımlar 1.Atomun Yapısı
MADDENİN YAPISI VE ÖZELLİKLERİ 1. Atomun Yapısı KONULAR 2.Element ve Sembolleri 3. Elektronların Dizilimi ve Kimyasal Özellikler 4. Kimyasal Bağ 5. Bileşikler ve Formülleri 6. Karışımlar 1.Atomun Yapısı
Bir atomdan diğer bir atoma elektron aktarılmasıyla
 kimyasal bağlar Kimyasal bağ, moleküllerde atomları bir arada tutan kuvvettir. Atomlar daha düşük enerjili duruma erişmek için bir araya gelirler. Bir bağın oluşabilmesi için atomlar tek başına bulundukları
kimyasal bağlar Kimyasal bağ, moleküllerde atomları bir arada tutan kuvvettir. Atomlar daha düşük enerjili duruma erişmek için bir araya gelirler. Bir bağın oluşabilmesi için atomlar tek başına bulundukları
YERKABUĞUNU OLUŞTURAN MİNERALLER İNM 102: İNŞAAT MÜHENDİSLERİ İÇİN JEOLOJİ. Yerkabuğunun Yapısı. Yerkürenin Yapısı. Dr.
 İNM 102: İNŞAAT MÜHENDİSLERİ İÇİN JEOLOJİ 17.03.2015 YERKABUĞUNU OLUŞTURAN MİNERALLER Dr. Dilek OKUYUCU Yerkürenin Yapısı Yerkabuğunun Yapısı 1 Yerkabuğunun Yapısı ~100 km ~10 km Yerkabuğunun Yapısı Yerkabuğunu
İNM 102: İNŞAAT MÜHENDİSLERİ İÇİN JEOLOJİ 17.03.2015 YERKABUĞUNU OLUŞTURAN MİNERALLER Dr. Dilek OKUYUCU Yerkürenin Yapısı Yerkabuğunun Yapısı 1 Yerkabuğunun Yapısı ~100 km ~10 km Yerkabuğunun Yapısı Yerkabuğunu
8.333 İstatistiksel Mekanik I: Parçacıkların İstatistiksel Mekaniği
 MIT Açık Ders Malzemeleri http://ocw.mit.edu 8.333 İstatistiksel Mekanik I: Parçacıkların İstatistiksel Mekaniği 2007 Güz Bu materyallerden alıntı yapmak veya Kullanım Şartları hakkında bilgi almak için
MIT Açık Ders Malzemeleri http://ocw.mit.edu 8.333 İstatistiksel Mekanik I: Parçacıkların İstatistiksel Mekaniği 2007 Güz Bu materyallerden alıntı yapmak veya Kullanım Şartları hakkında bilgi almak için
Paslanmaz Çelik Gövde. Yalıtım Sargısı. Katalizör Yüzey Tabakası. Egzoz Emisyonları: Su Karbondioksit Azot
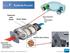 Paslanmaz Çelik Gövde Yalıtım Sargısı Egzoz Emisyonları: Su Karbondioksit Azot Katalizör Yüzey Tabakası Egzoz Gazları: Hidrokarbonlar Karbon Monoksit Azot Oksitleri Bu bölüme kadar, açıkça ifade edilmese
Paslanmaz Çelik Gövde Yalıtım Sargısı Egzoz Emisyonları: Su Karbondioksit Azot Katalizör Yüzey Tabakası Egzoz Gazları: Hidrokarbonlar Karbon Monoksit Azot Oksitleri Bu bölüme kadar, açıkça ifade edilmese
FZM 220. Malzeme Bilimine Giriş
 FZM 220 Yapı Karakterizasyon Özellikler İşleme Performans Prof. Dr. İlker DİNÇER Fakültesi, Fizik Mühendisliği Bölümü 1 Atomsal Yapı ve Atomlararası Bağ1 Ders Hakkında FZM 220 Dersinin Amacı Bu dersin
FZM 220 Yapı Karakterizasyon Özellikler İşleme Performans Prof. Dr. İlker DİNÇER Fakültesi, Fizik Mühendisliği Bölümü 1 Atomsal Yapı ve Atomlararası Bağ1 Ders Hakkında FZM 220 Dersinin Amacı Bu dersin
Malzeme Bilgisi. Madde ve Özellikleri
 Malzeme Bilgisi Madde: Boşlukta yer kaplayan, kütlesi ve hacmi olan katı, sıvı veya gaz şeklinde bulunan her şeye madde denir. Ayırt edici özellikler: Bir maddenin diğer maddelerden farklılık gösterenyanları,
Malzeme Bilgisi Madde: Boşlukta yer kaplayan, kütlesi ve hacmi olan katı, sıvı veya gaz şeklinde bulunan her şeye madde denir. Ayırt edici özellikler: Bir maddenin diğer maddelerden farklılık gösterenyanları,
GENEL KİMYA. 4. Konu: Kimyasal türler, Kimyasal türler arasındaki etkileşimler, Kimyasal Bağlar
 GENEL KİMYA 4. Konu: Kimyasal türler, Kimyasal türler arasındaki etkileşimler, Kimyasal Bağlar Kimyasal Türler Doğada bulunan bütün maddeler tanecikli yapıdadır. Maddenin özelliğini gösteren küçük yapı
GENEL KİMYA 4. Konu: Kimyasal türler, Kimyasal türler arasındaki etkileşimler, Kimyasal Bağlar Kimyasal Türler Doğada bulunan bütün maddeler tanecikli yapıdadır. Maddenin özelliğini gösteren küçük yapı
ATOMİK YAPI VE ATOMLAR ARASI BAĞLAR. Aytekin Hitit
 ATOMİK YAPI VE ATOMLAR ARASI BAĞLAR Aytekin Hitit Malzemeler neden farklı özellikler gösterirler? Özellikler Fiziksel Kimyasal Bahsi geçen yapısal etkenlerden elektron düzeni değiştirilemez. Ancak diğer
ATOMİK YAPI VE ATOMLAR ARASI BAĞLAR Aytekin Hitit Malzemeler neden farklı özellikler gösterirler? Özellikler Fiziksel Kimyasal Bahsi geçen yapısal etkenlerden elektron düzeni değiştirilemez. Ancak diğer
Sıvılar ve Katılar. Maddenin Halleri. Sıvıların Özellikleri. MÜHENDİSLİK KİMYASI DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN
 Sıvılar ve Katılar MÜHENDİSLİK KİMYASI DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN Sıcaklık düşürülürse gaz moleküllerinin kinetik enerjileri azalır. Bu nedenle, bir gaz yeteri kadar soğutulursa moleküllerarası
Sıvılar ve Katılar MÜHENDİSLİK KİMYASI DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN Sıcaklık düşürülürse gaz moleküllerinin kinetik enerjileri azalır. Bu nedenle, bir gaz yeteri kadar soğutulursa moleküllerarası
GENEL KİMYA. Yrd.Doç.Dr. Tuba YETİM
 GENEL KİMYA MOLEKÜLLER ARASI KUVVETLER Moleküller Arası Kuvvetler Yüksek basınç ve düşük sıcaklıklarda moleküller arası kuvvetler gazları ideallikten saptırır. Moleküller arası kuvvetler molekülde kalıcı
GENEL KİMYA MOLEKÜLLER ARASI KUVVETLER Moleküller Arası Kuvvetler Yüksek basınç ve düşük sıcaklıklarda moleküller arası kuvvetler gazları ideallikten saptırır. Moleküller arası kuvvetler molekülde kalıcı
Kristallerdeki yüzeyler, simetri ve simetri elemanları 2 boyutta nasıl gösterilir?
 13/17 EKİM 2014 Kristallerdeki yüzeyler, simetri ve simetri elemanları 2 boyutta nasıl gösterilir? Küresel projeksiyon ile stereografik projeksiyonun farkı? Stereo-net (Wullf-net) Nokta grubu ne demek?
13/17 EKİM 2014 Kristallerdeki yüzeyler, simetri ve simetri elemanları 2 boyutta nasıl gösterilir? Küresel projeksiyon ile stereografik projeksiyonun farkı? Stereo-net (Wullf-net) Nokta grubu ne demek?
Termodinamik İdeal Gazlar Isı ve Termodinamiğin 1. Yasası
 İdeal Gazlar Isı ve Termodinamiğin 1. Yasası İdeal Gazlar P basıncında, V hacmindeki bir kaba konulan kütlesi m ve sıcaklığı T olan bir gazın özellikleri ele alınacaktır. Bu kavramların birbirleriyle nasıl
İdeal Gazlar Isı ve Termodinamiğin 1. Yasası İdeal Gazlar P basıncında, V hacmindeki bir kaba konulan kütlesi m ve sıcaklığı T olan bir gazın özellikleri ele alınacaktır. Bu kavramların birbirleriyle nasıl
Serüveni 4.ÜNİTE MADDENİN HALLERİ ORTAK VE AYIRDEDİCİ ÖZELLİKLER
 Serüveni 4.ÜNİTE MADDENİN HALLERİ ORTAK VE AYIRDEDİCİ ÖZELLİKLER MADDENİN HALLERİ MADDE MİKTARINA BAĞLI ÖZELLİKLER:(ORTAK ÖZELLİKLER) :Madde miktarının ölçüsüdür. :Maddenin boşlukta kapladığı yerdir Eylemsizlik:Maddenin
Serüveni 4.ÜNİTE MADDENİN HALLERİ ORTAK VE AYIRDEDİCİ ÖZELLİKLER MADDENİN HALLERİ MADDE MİKTARINA BAĞLI ÖZELLİKLER:(ORTAK ÖZELLİKLER) :Madde miktarının ölçüsüdür. :Maddenin boşlukta kapladığı yerdir Eylemsizlik:Maddenin
KİNETİK GAZ KURAMI. Doç. Dr. Faruk GÖKMEŞE Kimya Bölümü Hitit Üniversitesi Fen Edebiyat Fakültesi 1
 Kinetik Gaz Kuramının Varsayımları Boyle, Gay-Lussac ve Avagadro deneyleri tüm ideal gazların aynı davrandığını göstermektedir ve bunları açıklamak üzere kinetik gaz kuramı ortaya atılmıştır. 1. Gazlar
Kinetik Gaz Kuramının Varsayımları Boyle, Gay-Lussac ve Avagadro deneyleri tüm ideal gazların aynı davrandığını göstermektedir ve bunları açıklamak üzere kinetik gaz kuramı ortaya atılmıştır. 1. Gazlar
bir atomun/iyonun bulunduğu kafes içindeki en yakın komşu atomlarının/iyonlarının sayısıdır.
 Koordinasyon sayısı; bir atomun/iyonun bulunduğu kafes içindeki en yakın komşu atomlarının/iyonlarının sayısıdır. Arayer boşlukları Kristal yapılarda kafes noktalarında bulunan atomlar arasındaki boşluklara
Koordinasyon sayısı; bir atomun/iyonun bulunduğu kafes içindeki en yakın komşu atomlarının/iyonlarının sayısıdır. Arayer boşlukları Kristal yapılarda kafes noktalarında bulunan atomlar arasındaki boşluklara
1. Düzensiz yapı : Atom veya moleküllerin rastgele dizilmesi. Argon gibi asal gazlarda görülür.
 Malzemeler atomların bir araya gelmesi ile oluşur. Bu yapı içerisinde atomları bir arada tutan kuvvete atomlar arası bağ denir. Yapı içerisinde bir arada bulunan atomlar farklı düzenlerde bulunabilir.
Malzemeler atomların bir araya gelmesi ile oluşur. Bu yapı içerisinde atomları bir arada tutan kuvvete atomlar arası bağ denir. Yapı içerisinde bir arada bulunan atomlar farklı düzenlerde bulunabilir.
MİNERALLER. Tek mineralden oluşan kayaçlar. Kireçtaşı (Kalsit). Kaya tuzu (Halit). Buzul
 Kayaçlar minerallerden oluşan Yer materyalidir. Çoğu kayaçlar birden fazla mineralden oluşmaktadır. Örnek: Granit Potasyum feldspat. Plajioklas (Feldspat). Kuvars. Hornblende. Biyotit MİNERALLER Tek mineralden
Kayaçlar minerallerden oluşan Yer materyalidir. Çoğu kayaçlar birden fazla mineralden oluşmaktadır. Örnek: Granit Potasyum feldspat. Plajioklas (Feldspat). Kuvars. Hornblende. Biyotit MİNERALLER Tek mineralden
FEN ve TEKNOLOJİ DERSİ / PERİYODİK SİSTEM. Metaller, Ametaller ve Yarı metaller
 Metaller, Ametaller ve Yarı metaller 1 Elementler gösterdikleri benzer özelliklere göre metaller, yarı metaller ve ametaller olarak sınıflandırılabilirler. Periyodik tabloda metal, ametal ve yarı metallerin
Metaller, Ametaller ve Yarı metaller 1 Elementler gösterdikleri benzer özelliklere göre metaller, yarı metaller ve ametaller olarak sınıflandırılabilirler. Periyodik tabloda metal, ametal ve yarı metallerin
KİMYASAL BAĞLAR İYONİK BAĞ KOVALANT BAĞ POLAR KOVALENT BAĞ APOLAR KOVALENT BAĞ
 KİMYASAL BAĞLAR İYONİK BAĞ KOVALANT BAĞ POLAR KOVALENT BAĞ APOLAR KOVALENT BAĞ Atomlar bağ yaparken, elektron dizilişlerini soy gazlara benzetmeye çalışırlar. Bir atomun yapabileceği bağ sayısı, sahip
KİMYASAL BAĞLAR İYONİK BAĞ KOVALANT BAĞ POLAR KOVALENT BAĞ APOLAR KOVALENT BAĞ Atomlar bağ yaparken, elektron dizilişlerini soy gazlara benzetmeye çalışırlar. Bir atomun yapabileceği bağ sayısı, sahip
2- Bileşim 3- Güneş İç Yapısı a) Çekirdek
 GÜNEŞ 1- Büyüklük Güneş, güneş sisteminin en uzak ve en büyük yıldızıdır. Dünya ya uzaklığı yaklaşık 150 milyon kilometre, çapı ise 1.392.000 kilometredir. Bu çap, Yeryüzünün 109 katı, Jüpiter in de 10
GÜNEŞ 1- Büyüklük Güneş, güneş sisteminin en uzak ve en büyük yıldızıdır. Dünya ya uzaklığı yaklaşık 150 milyon kilometre, çapı ise 1.392.000 kilometredir. Bu çap, Yeryüzünün 109 katı, Jüpiter in de 10
