DEZENFEKTANLARIN FUNGİSİDAL/ FUNGİSTATİK AKTİVİTELERİNİN VE OLASI DİRENÇ MEKANİZMALARININ CANDIDA ALBICANS MODELİ ÜZERİNDE İNCELENMESİ
|
|
|
- Engin Açık
- 6 yıl önce
- İzleme sayısı:
Transkript
1
2 DEZENFEKTANLARIN FUNGİSİDAL/ FUNGİSTATİK AKTİVİTELERİNİN VE OLASI DİRENÇ MEKANİZMALARININ CANDIDA ALBICANS MODELİ ÜZERİNDE İNCELENMESİ Ali Adil Fouad FOUAD DOKTORA TEZİ TIBBİ MİKROBİYOLOJİ ANABİLİM DALI GAZİ ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ MART 2016
3
4
5 DEZENFEKTANLARIN FUNGİSİDAL/ FUNGİSTATİK AKTİVİTELERİNİN VE OLASI DİRENÇ MEKANİZMALARININ CANDIDA ALBICANS MODELİ ÜZERİNDE İNCELENMESİ (Doktora Tezi) Ali Adil Fouad FOUAD iv GAZİ ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ Mart 2016 ÖZET Dezenfektan maddeler mantar hücresinde fungisidal veya fungistatik etki gösterebilir. Antifungal etkinin mekanizması ile bakterilerde görülen antibakteriyel etki arasında benzerlikler bulunduğu düşünülmektedir. Bu çalışmanın amacı Candida albicans modeli üzerinde çalışarak dezenfektan maddelerin mantar hücresine nasıl etki ettiklerinin incelenmesi ve direnç mekanizmalarının açıklanmasıdır. Duyarlı ve dirençli fenotiplerin ayrılması için 417 klinik Candida albicans kökeni ve referans kökenler taranmıştır. Tarama sonucunda Minimum İnhibitor Konsantrasyon (MİK) ve Minimum Fungisidal Konsantrasyon (MFK) değerleri elde edilmiştir. MİK vemfk değerleri kullanılarak biyosidler için Epidemiyolojik Sınır Değerler (ECOFF) belirlenmiştir. Biyosid dirençli ve duyarlı kökenlerde membran geçirgenliğinin incelenmesi için kristal viyole deneyi yapılmıştır. Seçilen kökenler arasında membran geçirgenliği açısından fark bulunmuştur. Efluks pompalarını kodlayan genlerin artmış ekspresyonunu göstermek için rodamin 6G (R6G) kullanılmıştır. Biyosid direncinin atım pompaları ile ilişkili olduğu sonucuna varılmıştır. Biyosid duyarlı ve dirençli kökenlerde atım pompalarındaki ekspresyon değişikliklerini göstermek için CDR ve ERG genlerini hedefleyen PZR yöntemi kullanılmıştır. Çalışmada virülans ile direncin arasında ilişki olup olmadığı Galleria mellonella larvalarında araştırılmıştır. Biyosid direncinin kökenlerin virülansını etkilemediği gösterilmiştir. Bilim Kodu : Anahtar Kelimeler : Candida albicans, biyosid, direnç, Galleria mellonella Sayfa Adedi : 112 Danışman : Prof. Dr. Ayşe KALKANCI
6 v FUNGICIDAL/ FUNGISTATIC ACTIVITIES AND THE POSSIBLE MECHANISMS OF RESISTANCE OF DISINFECTANTS EVALUATED ON A CANDIDA ALBICANS MODEL (Ph. D. Thesis) Ali Adil Fouad FOUAD GAZI UNIVERSITY INSTITUTE OF HEALTH SCIENCES March 2016 ABSTRACT Disinfectants may have fungicidal or fungistatic effects on a fungal cell. Biocides may have similar effects on fungal cell when compared with bacterial cells. The aim of this study is to evaluate the mechanisms of action of disinfectants against fungi and the mechanisms of fungal resistance in a Candida albicans model. Clinical Candida strains (n:417) and reference strains were subjected to screening step. Minimum inhibitory concentrations (MICs) and minimum fungicidal concentrations (MFCs) of biocides were obtained from microdilution assay. Epidemiological cut off values (ECOFF) were calculated based on the MICs and MFCs of the population. Membrane permeability was investigated by crystal violet assay. Biocide susceptible and resistance strains showed remarkable difference in terms of membrane permeability. Rhodamine uptake assay was performed for the demonstration of the increased expression of genes encoding efflux pumps. The results suggested that biocide resistance associated with efflux pumps. Overexpression of the efflux pump genes was analyzed in the resistant phenotypes by molecular assays such as polymerase chain reaction targeting CDR and ERG efflux pumps. The relationship between virulence and biocide resistance was evaluated in Galleria mellonella larvae. Biocide resistance did not affect the virulence of the strains. Science Code : Key Words : Candida albicans, biocide, resistance, Galleria mellonella Page Number : 112 Advisor : Prof. Dr. Ayşe KALKANCI
7 vi TEŞEKKÜR Doktora eğitimim süresince ve tez çalışmamın her aşamasında yakın ilgi ve desteğini gördüğüm; çalışmalarımın yönlendirilmesi ve sonuçlandırılmasında büyük emeği geçen tez danışmanım sayın Prof. Dr. Ayşe KALKANCI ya, Tıbbi Mikrobiyoloji Anabilim Dalımızın değerli ve seçkin öğretim üyelerine ve çalışanlarına, Birlikte çalışmaktan mutluluk duyduğum bütün asistan, yüksek lisans, doktora öğrencileri ve laboratuvar çalışanlarına, Bu tez çalışması SBAG 113S383 kodlu proje kapsamında gerçekleştirildiğinden dolayı TÜBİTAK a Eğitimim boyunca desteklerinden dolayı Yurtdışı Türkler ve Akraba Topluluklar Başkanlığı na Tüm hayatım boyunca sevgisini ve dualarını esirgemeyen, büyük emeklerle yetiştirip beni bugünlere getiren canım annem ve babama, Sevgisi, desteği, anlayışı ve sabrı ile her daim yanımda olan sevgili eşim Merve Nur FOUAD a Sonsuz teşekkür ederim.
8 vii İÇİNDEKİLER ÖZET... iv Sayfa ABSTRACT... v TEŞEKKÜR... vi İÇİNDEKİLER... vii ÇİZELGELERİN LİSTESİ... xi ŞEKİLLERİN LİSTESİ... xiii RESİMLERİN LİSTESİ... xv SİMGELER VE KISALTMALAR... xvi 1. GİRİŞ GENEL BİLGİLER Dezenfeksiyon Dezenfektan Dezenfektanların Sınıflandırılması Etki seviyelerine göre Temel içeriklerine göre Dezenfeksiyonu Etkileyen Faktörler Dezenfektan Kullanımında Dikkat Edilmesi Gereken Hususlar Biyosidlerin Etki Mekanizmaları Proteinler ve nükleik asit üzerine etki edenler Hücre membranına (zar) etki edenler Enzimlerin fonksiyonunu bozarak veya değiştirerek etki edenler Bakteri sporlarına etki edenler Virüslere etki edenler Biyosidlere Karşı Gelişen Direnç Mekanizmalar... 10
9 viii Sayfa 2.8. Mikroorganizmaların Biyosidlere Karşı Direnç Gelişimi Intrinsik direnç Kazanılmış direnç Mantarlarda Biyosid Direncinin Mekanizmaları Dezenfektan Direncinin Önemi Çalışmada Kullanılan Biyosidlerin Kimyasal ve Farmakolojik Özellikleri Klorheksidin Sodyum hipoklorit Benzalkonyum klorür Triklosan Mantarlarda Virülans Deneysel Model olarak Galleria mellonella In vitro Virülans Çalışmada Yapılan Virülans Deneyleri Galleria mellonella deneyi In vitro virülans faktörleri GEREÇ VE YÖNTEM Örneklerin Toplanması Kullanılan Araç ve Gereçler Kullanılan cihazlar Kullanılan Besiyerleri Kullanılan Kimyasal Maddeler Kullanılan kitler Kullanılan primerler ve enzimler Yöntemler Besiyerlerinin hazırlanması Mikrodilüsyon yöntemi ile biyositlerin minimal inhibisyon konsantrasyonunun (MİK) Belirlenmesi Biyosidlerin aktivite deneyi... 31
10 ix Sayfa Membran geçirgenlik deneyi Atım pompalarının biyosid metabolizmasında rolünün anlaşılması için rodamin geri alım çalışması Atım pompası genlerinde CDR ekspresyon artışının ters transkriptaz (reverse transkriptaz) PZR ile gösterilmesi Polimeraz zincir reaksiyonu (PZR) Elektroforez için kullanılan solüsyonlar Virülans deneyleri Mini enfeksiyon modeli olarak Galleria mellonella deneyi BULGULAR Mikrodilisyon Sonuçları Benzalkonyum klorür için MİK değerleri Benzalkonyum klorür için MFK değerleri Klorhekzidin diglukonat için MİK değerleri Klorhekzidin diglukonat için MFK değerleri Triklosan için MİK değerleri Triklosan için MFK değerleri Sodyum hipoklorit için MİK değerleri Sodyum hipoklorit için MFK değerleri Biyosidlerin Aktivite Deney Sonuçları Kontrol deneylerin sonuçları Kantitatif süspansiyon testinin sonuçları Kantitatif taşıyıcı testinin sonuçları Membran Geçirgenlik Deneyinin Sonuçları Rodamin 6G Efluks (atım) Deneyinin Sonuçları Ters Transkriptaz (Reverse Transkriptaz) PZR Sonuçları In Vitro Virülans Deneylerin Sonuçları Salgısal asit proteinaz (SAP) deneyinin sonuçları Fosfolipaz deneyinin sonuçları Esteraz aktivite deneyinin sonuçları Hemolitik aktivite deneyinin sonuçları Slaym üretimi deneyinin sonuçları In Vivo Virülans (G. mellonella modeli) Deneyinin Sonuçları... 74
11 Sayfa 5. TARTIŞMA SONUÇ KAYNAKLAR EKLER EK-1. Etik Kurul toplantı kararları sayfası EK-2. Gazi Üniversitesi (girişimsel olmayan) klinik araştırmalar Etik Kurulu değerlendirme formu x ÖZGEÇMİŞ
12 xi ÇİZELGELERİN LİSTESİ Çizelge Sayfa Çizelge 2.1. EPA (Environmental Protection Agency) ürün sınıflaması ve bu ürünler için CDC nin belirlediği dezenfeksiyon düzeyleri... 5 Çizelge 3.1. PZR Reaksiyon Karışımı (1. Tur) (1X için) Çizelge 3.2. PZR Reaksiyon Karışımı (2. Tur) (1X için) Çizelge 3.3. Çalışmada kullanılan primer dizisi Çizelge 3.4. Amplifikasyon karışımı (1X için) Çizelge 3.5. CDR1 gen böleglerinin amplifikasyonu için reaksiyon şartları Çizelge 3.6. ERG11 gen böleglerinin amplifikasyonu için reaksiyon şartları Çizelge 4.1. Kullanılan biyosidler için yapılan kontrol deneylerin sonuçları Çizelge 4.2. Benzalkonyum klorür için kantitatif süspansiyon testi sonuçları Çizelge 4.3. Klorhekzidin diglukonat için kantitatif süspansiyon testi sonuçları Çizelge 4.4. Triklosan için kantitatif süspansiyon testi sonuçları Çizelge 4.5. Sodyum hipoklorit için kantitatif süspansiyon testi sonuçları Çizelge 4.6. Benzalkonyum klörür için kantitatif taşıyıcı testi sonuçları Çizelge 4.7. Klorhekzidin diglukonat için kantitatif taşıyıcı testi sonuçları Çizelge 4.8. Sodyum hipoklorit için kantitatif taşıyıcı testi sonuçları Çizelge 4.9. Biyosid dirençli kökenin kristal viyole geri alım (Up take) yüzdesi Çizelge Biyosid duyarlı kökenin kristal viyole geri alım (Up take) yüzdesi Çizelge R6G nin farklı konsantrasyonlarda optik densite değerleri.. 65 Çizelge Biyosid duyarlı ve dirençli kökenlerin R6G geri alım değerleri Çizelge İzolatlardan elde edilen RNA miktarları Çizelge Ters transkriptz ile elde edilen cdna miktarları Çizelge İn vitro virülans deneylerinin toplu sonuçları... 74
13 Çizelge Biyosid dirençli ve virülans faktörleri pozitif köken ile oluşturulan enfeksiyon modeli, deney saatlerine göre canlı kalan larva sayısı ve xii Sayfa mortalite oranları 75 Çizelge Biyosid dirençli ve virülans faktörleri negatif köken ile oluşturulan enfeksiyon modeli, deney saatlerine göre canlı kalan larva sayısı ve mortalite oranları 75 Çizelge Biyosid duyarlı ve virülans faktörleri negatif köken ile oluşturulan enfeksiyon modeli, deney saatlerine göre canlı kalan larva sayısı ve mortalite oranları 76
14 xiii ŞEKİLLERİN LİSTESİ Şekil Sayfa Şekil 2.1. G. mellonella nın yaşam döngüsü Şekil 3.1. Test süspansiyonun hazırlanışı Şekil 3.2. Kantitatif test yönteminin uygulanışı Şekil 3.3. Taşıyıcı inokülasyonunun hazırlaması Şekil 3.4. Kantitatif taşıyıcı test yönteminin uygulanışı Şekil 3.5. Rhodamin 6G (R6G) uygulaması Şekil 3.6. G. mellonella deney protokolü Şekil 4.1. BNZ nin MİK ve MFK Değerlerinin Dağılımı, ECOFF= 4mg/L Şekil 4.2. CHX nin MİK ve MFK değerlerinin dağılımı, ECOFF=2 mg/l Şekil 4.3. TRC nin MİK ve MFK değerlerinin dağılımı, ECOFF=1mg/L Şekil 4.4. SHC nin MİK ve MFK değerlerinin dağılımı, ECOFF=4096 mg/l Şekil 4.5. R6G nin farklı konsantrasyonlardaki OD değerleri Şekil 4.6. Biyosid duyarlı ve dirençli kökenlerin R6G nin geri alım değerleri Şekil 4.7. SAP pozitif, biyosid dirençli köken ile enfekte edilen larvaların yaşam eğrileri Şekil 4.8. SAP negatif, biyosid dirençli köken ile enfekte edilen larvaların yaşam eğrileri Şekil 4.9. SAP negatif, biyosid duyarlı köken ile enfekte edilen larvaların yaşam eğrileri Şekil Fosfolipaz pozitif, biyosid dirençli köken ile enfekte edilen larvaların yaşam eğrileri Şekil Fosfolipaz negatif, biyosid dirençli köken ile enfekte edilen larvaların yaşam eğrileri Şekil Fosfolipaz negatif, biyosid duyarlı köken ile enfekte edilen larvaların yaşam eğrileri... 78
15 xiv Şekil Sayfa Şekil Esteraz pozitif, biyosid dirençli köken ile enfekte edilen larvaların yaşam eğrileri Şekil Esteraz negatif, biyosid dirençli köken ile enfekte edilen larvaların yaşam eğrileri Şekil Esteraz negatif, biyosid duyarlı köken ile enfekte edilen larvaların yaşam eğrileri Şekil Slaym pozitif, biyosid dirençli köken ile enfekte edilen larvaların yaşam eğrileri Şekil Slaym negatif, biyosid dirençli köken ile enfekte edilen larvaların yaşam eğrileri Şekil Slaym negatif, biyosid duyarlı köken ile enfekte edilen larvaların yaşam eğrileri... 80
16 xv RESİMLERİN LİSTESİ Resim Sayfa Resim 3.1. G. mellonella nın cam kavanozlarda üretilmesi Resim 3.2. G. mellonella larvalarının canlı ve ölü görüntüsü...54 Resim numaralı duyarlı kökenin RNA sına ait NanoDrop analiz ekranı görüntüsü Resim numaralı dirençli kökenin DNA sına ait NanoDrop analiz ekranı görüntüsü Resim , 34 ve 80 numaralı kökenlerin CDR1 primer çifti ile yapılan PZR sonrası jel elektroforez görüntüsü Resim , 34 ve 80 numaralı kökenlerin ERG11 primer çifti ile yapılan PZR sonrası jel elektroforez görüntüsü Resim 4.5. SAP negatif biyosid duyarlı ve SAP pozitif dirençli kökenler Resim 4.6. SAP pozitif C. albicans (ATCC 10231) ve SAP negatif dirençli kökenler Resim 4.7. Fosfolipaz aktivitesi pozitif biyosid dirençli kökenler Resim 4.8. Fosfolipaz aktivitesi pozitif C. albicans (ATCC 10231) ve fosfolipaz aktivitesi negatif biyosid duyarlı köken Resim 4.9. Esteraz aktivitesi pozitif C. albicans (ATCC 10231) ve esteraz aktivitesi pozitif biyosid dirençli köken Resim Esteraz aktivitesi negatif biyosid duyarlı (solda) ve dirençli (sağda) kökenler Resim Hemoliz negatif kökenler ve pozitif kontrol köken Resim numara C. parapsilosis pozitif kontrol, 2 numara slaym üretimi negatif ve 3 numara slaym üretimi pozitif kökenler... 73
17 xvi SİMGELER VE KISALTMALAR Bu çalışmada kullanılmış simgeler ve kısaltmalar, açıklamaları ile birlikte aşağıda sunulmuştur. Simgeler Açıklamalar C Santigrat μl Mikrolitre ml Mililitre μg/ml Mikrogram/Mililitre Kısaltmalar Açıklamalar CDC CFU/ml CLSI cdna EDTA CDR ERG11 MDR MİK MFK PZR TRİS ECOFF ABC MFS MATE SMR RND Central of Disease Control and Prevention Colony Formation Unit (Koloni Oluşturan Birim)/mililitre Clinical and Laboratory Standards Institute Komplementer Deoksiribonükleik Asit Etilen Diamin Tetra Asetik Asit Candida Drug Resistance Genleri 14α-demethylase Geni Multidrug Efflux Genleri Minimum İnhibisyon Konsantrasyonu Minimum Fungisidal Konsantrasyonu Polimeraz Zincir Reaksiyonu Hydroxymethyl Aminometan Epidemiyolojik Sınır Değerler Adenosine Triphosphate Binding Cassette süperailesi Major Facilitator Süperailesi Multidrug And Toxic Compound Extrusion ailesi Small Multidrug Resistance ailesi Resistance-Nodulation-Division ailesi
18 1 1. GİRİŞ Dezenfektanlar veya daha genel adı ile biyosidler, hastane ortamında yüzeylerin veya endüstride ürünlerin kontaminasyondan korunmasında kullanılan antimikrobiyal etkili kimyasallardır. Dezenfektan maddeler mantar hücresinde fungisidal veya fungistatik etki gösterebilir. Antifungal etkinin mekanizması ile bakterilerde görülen antibakteriyel etki arasında benzerlikler bulunduğu düşünülmektedir. Biyosidler için mikrobiyal hücrelerde birden fazla hedef bulunmaktadır. Bu nedenle biyosidlere karşı bakteriyel direnci ya hedef bölgede ya da metabolik aktivitelerinde bir modifikasyon sonucu ortaya çıkmaktadır. Biyosidlere karşı bakteriyel direnç ya intrensek ya da kazanılmış direnç olarak gelişmektedir [1]. İntrensek direnci geliştiren birden fazla mekanizma bulunmaktadır. Bunların arasında; hücre zarının geçirgenliğinin değişime uğraması sayılabilir. Bu geçirgenlik bariyer olarak ifade edilir. Örneğin, gram negatif bakterilerdeki lipopolisakarit tabakası bir geçirgenlik bariyer olarak bilinir ve aynı zamanda hücre duvarındaki protein, yağ asitleri ve fosfolipitlerin değişmesi sonucu biyosidlerin etkinliğinin azalmasına yol açmaktadır [1]. Biyosidlere dirençli olan mikroorganizmaların bir başka özelliği, hücre duvarında oluşan değişiklilik ve atım pompaların etkisi sonucu gelişen biyosidlerin inaktivasyonudur. Aynı zamanda mikroorganizmaları dirençli kılan ve genomdaki mutasyon sonucu ortaya çıkan hedef değişikliği ya da modifikasyonudur [2]. Bir başka intrensek direnç mekanizması olarak aktif atım pompaları (Effluks) sayılabilir. Effluks pompaları biyosidler olmak üzere, hücre içi toksik bileşiklerin azaltmasında rol oynamaktadır. Bakterilerde aktif ilaç pompa sistemleri (Effluks) ABC, MFS, MATE, SMR, ve RND olmak üzere beş protein süper ailesinin olduğunu bildirilmiştir [1]. Biyosidlere karşı kazanılmış direnç ise ya mutasyon ya da direnç genlerin kazanılması sonucu ortaya çıkmaktadır. Genetik belirleyicilerin transferi ve biyosidlerin üzerine etkisi konusunda çok az bilgi bulunmaktadır.
19 2 Bakteriler hariç diğer mikroorganizmalardaki direnç mekanizmaları ile ilgili kısıtlı bilgiler bulunmaktadır ve bu nedenle daha fazla çalışma yapılması gerektiği bildirilmektedir. Etki ve direnç mekanizmalarının araştırılması hem akademik anlamda yaralı olcak hem de ajanların klinik olarak daha etkili bir şekilde kullanılmasına, yeni ve daha etkili bileşikler geliştirilmesine olanak sağlayacaktır. Mantarların biyosid direnci ile ilgili iki teorik başlık doğal (intrensek) mekanizmalar ve kazanılmış direnç mekanizmalarıdır. Membran geçirgenliğinin azalması, atım pompaları doğal direnç mekanizmaları olarak sayılabilir. Mantar hücresinde fungistatik veya fungisitik etki gösteren maddelere direnç ile ilişkili olabilecek plazmid gibi aktarılabilir genetik elemanların varlığı kanıtlanmamıştır. Mantar hücresinde biyosidlerin hedefi olabilecek yapılar olan hücre membranı, ribozomlar, proteinler, nükleik asitler sıralanmıştır. Gluteraldehidin hücre duvarına, kuarterner amonyum bileşiklerinin hücre membranına, alkilleyici ajanların proteinlere, ağır metallerin fungal enzimlere etki ettikleri belirtilmiştir [3]. Biyosidlerin mantarlar üzerinde etki ettikleri hücresel hedefler ve biyosidlere hangi mekanizmalar ile direnç geliştiği konusundaki bilgilerimiz kısıtlı olup ülkemizde bu konu ile yapılmış bir çalışma bulunmamaktadır. Bu çalışmada, Gazi Üniversitesi Tıp Fakültesi Mikrobiyoloji laboratuvarında, kültür koleksiyonunda bulunan Candida albicans kökenleri üzerinde çalışarak, dezenfektan ve koruyucu olarak kullanılan bazı biyosidlerin mantar hücresindeki etkilerinin gösterilmesi, biyosid direncinin varlığının ve mekanizmalarının araştırılması ve vahşi kökenlerin oluşturacağı enfeksiyonlar ile biyosid dirençli kökenlerin oluşturacağı enfeksiyonların Galleria mellonella larvası modeli üzerinde karşılaştırılması amaçlanmıştır.
20 3 2. GENEL BİLGİLER 2.1. Dezenfeksiyon Cansız nesnelerin üzerinden patojenik mikroorganizmaların yok eden veya üremesini inhibe eden ve endosporlara etki etmeyen, hastanelerde sıklıkla dezenfektan adı verilen kimyasal maddelerle, bazen de mekanik temizlik ve ısı uygulamaları ile gerçekleştirilen bir işlemdir [4]. Dezenfeksiyon geniş spektrumlu bir işlem ve amacı mikroorganizmaların hepsini öldürmek yerine, onların ortamdaki miktarını en az seviyeye düşürmektir [5] Dezenfektan Dezenfektanların belirli konsantrasyonları ile kısa süre temastan (30 dakika) sonra, bakteri sporları hariç tüm mikroorganizmaları öldürebilmektedir. Bu ürünlerin benzer konsantrasyonlarda kullanıldığında bakteriyel ve fungal sporlar dahil tüm formlarına 6-10 saatlik uygulamadan sonra zarar vermektedir [4]. Dezenfektanlar 5 dakika üzerinde ancak 10 dakikadan daha az bir süre içinde patojen mikroorganizmaların sayısı % oranında düşüren kimyasal maddelerin kullanılması anlamına gelmemektedir [6]. Su ile temizlik de bir dezenfeksiyonun işlemidir [5]. Biyosid terimi antiseptik, dezenfektan ya da bazı durumlarda koruyucu aktiviteye sahip bileşikleri tarif etmek için kullanılmıştır. Bir bileşiği kullanmak için kapasite gibi sadece tek bir ya da iki veya kullanılan tüm özelliklere sahip olması gerekmektedir [7]. Hastane enfeksiyonlarının önlenmesinde en önemli önlem etkin ve doğru antiseptik ve dezenfektanın kullanılmasıdır. Mikroorganizmaların dezenfektanlara karşı duyarlılıkları hücre yapısındaki özelliklerine bağlı olarak değişmektedir [8] Dezenfektanların Sınıflandırılması Etki seviyelerine göre Patojen mikroorganizmalara karşı kullanımı önerilen dezenfektanlar etki seviyelerine göre üç grupta toplamışlardır. Bunlar yüksek, orta ve düşük seviyeli dezenfektanlardır [4,9].
21 4 Yüksek seviyeli dezenfektanlar Yüksek seviyeli dezenfektanlar, uzun süreli kullanımla bakteri sporlarını inaktive ederek sterilizan etkili olabilmektedir. Aynı zamanda kısa süreli kullanımla da bakteri sporlarının pek çoğunu öldürerek yüksek seviyeli dezenfeksiyon etki gösterirler. Sterilizan olarak formüle edilen kimyasal dezenfektanlar alet sterilizasyonunda hemen hemen hiç kullanılmamaktadır. Bu daha çok germisidler yüksek seviyeli dezenfeksiyon için tercih edilmektedirler [10,11]. Gluteraldehid, hidrojen peroksid, perasetik asit kimyasal sterilizan ve yüksek düzey dezenfektanlarda yer alırken, sodyum hipoklorid ise yüksek düzey dezenfektanlarda yer alırlar [12]. Orta seviyeli dezenfektanlar Bakteri sporlarını öldürmeyebilir; fakat mikobakterleri ve özellikle Mycobacterium tuberculosis i inaktive ederler. Bu dezenfektanlar aynı zamanda mantarlara (aseksüel sporlar dahil ve seksüel sporlar genellikle hariç), zarflı ve zarfsız virüslere karşı etkilidir [13]. Orta seviyeli dezenfektanlar arasında izopropil alkol, glukoprotamin, fenoller ve iyodoforlar sayılabilir [12]. Düşük seviyeli dezenfektanlar Düşük seviyeli dezenfektanlar, bakteri sporları, mikobakterileri, tüm mantarları ve zarfsız virüsleri öldüremeyebilmektedir. Bu dezenfektanlar rutin uygulamalarında uygundur, çünkü vejetatif bakteri formlarını ve çoğu mantarı, aynı zamanda zarflı virüsleri hızla öldürmektedirler [13,14]. Fenoller, iyodoforlar, sodyum hipoklorit ve izopropil bu grupta yer alırlar. Çizelge 2.1. de yüksek, orta ve düşük seviyeli dezenfektanlar düzeyleri özetlenmiştir [15,16].
22 5 Çizelge 2.1. EPA (Environmental Protection Agency) ürün sınıflaması ve bu ürünler için CDC nin belirlediği dezenfeksiyon düzeyleri [15,16]. Yüksek düzey dezenfeksiyon Orta düzey dezenfeksiyon Düşük düzey dezenfeksiyon Dezenfektanlar Ölen mikroorganizmalar Canlı kalan veya inaktive olmayanlar Dirençli olanlar dışında -Dirençli bakteri sporları tüm mikroorganizmalar -Gluteraldehit %2 -Sodyum hipoklorit ppm -Etil / izopropil alkol % İyodoforlar ppm serbest iyot -Fenol ve fenol bileş. % Sodyum hipoklorit ppm -Etil / izopropil alkol < %50 -Fenol ve fenol bileş.% İyodoforlar ppm serbest iyot -Sodyum hipoklorit 100 ppm -Kuaterner amonyum bileşikleri % Vejetatif bakteriler - M. tuberculosis - Hepatit B virüsü (HBV) ve diğer virüsler - Çoğu mantarlar -Çoğu vejetatif bakteriler -Bazı virüsler -Bazı mantarlar - M. avium intracellulare - Bakteri sporları - Prion - M. tuberculosis - Bakteri sporları - HBV - Prion Temel içeriklerine göre Dezenfektanların temel içeriklerine göre farklı çeşitleri bulunmaktadır. Bunlardan bir kısmı cihazlar, aletler ve yüzeyler içi, bir kısmı da insan veya hayvan cildine uygulanan nispeten daha az toksik ve canlılar için zararlı etkileri az olan dezenfektanlardır. Bu tür dezenfektanların sınıflandırılması aşağıdaki gibi yapılabilir. Alkaliler :- Hidroksitler Biguanidler :- Klorhekzidin Katyonik surfektanlar :- Kuaterner amonyum bileşikleri Halojenler ve halojen içerikliler :- a. İyot bazlı:- İyodoforlar b. Klorin ve klor salan bileşikler:- Sodyum hipoklorit Oksitleyici ajanlar :- Peroksitler, peroksijen komponentleri Fenoller :- Fenol tuzları ve bileşikleri, sentetik fenoller (triklosan) Alkilleyici ajanlar :- Aldehitler yukardaki tüm dezenfektanlar bütün mikroorganizmalara etkili değildirler. Bazılarına duyarlı bazılarına ise dirençli olabilirler [6].
23 6 Bir dezenfektanın etkili olabilmesi için bazı kriterleri bulundurması gerekmektedir Bunlardan; Geniş bir etki spektruma sahip olması, Temas süresince canlı hücrelerin redüksiyonunun belirlenebilir olması, Geniş bir ph ve ısı aralığında etkili olabilmesi, Organik artıkların (idrar, dışkı ve kan) varlığında dahi etkinliğini göstermesi, Antimikrobiyal aktivite süresinin yeterli olması, Açık yaraya uygulandığında doğal direnci etkilememesi, Renksiz ve kokusuz olması, Dezenfekte edilecek malzemeye zarar vermemesi, Raf ömrünün uzun olması, Minimum yoğunlukta maksimum etkiye sahip olması, Ucuz ve kullanımı kolay olması, Suda ve organik sıvılarda eriyebilmesi, İrritan olmaması, toksik etkisi bulunmaması, Temizlik maddeleriyle geçimsiz olmaması [6,17] Dezenfeksiyonu Etkileyen Faktörler Mikroorganizma sayısı ve türü Mikroorganizma sayısının ve türün öneminden ziyade mikroorganizmanın yaşam döngüsüde önemlidir. Örneğin 100 bakteri sporunu yok etmek, 10 6 virüs veya bakteriyi öldürmekten daha zordur [18-21].
24 7 Organik madde miktarı Organik maddeler dezenfektanları nötralize edebilir. Organik maddelerin uzaklaştırılmasıyla olumsuz durum ortadan kalkar [18-21]. Dezenfektan konsantrasyonu Dezenfektan veya antiseptik ajanların etkisi konsantrasyonu ile doğru orantılıdır. Birçok kimyasal maddeler konsantrasonuna bağlı olarak yani yüksek konsantrasyonda germisidal etkiye sahip iken, daha düşük konsantrasyonlarda mikrobiyostatik etki göstermektedir. Ancak konsantrasyonun artmasıyla dezenfektanın etkisinin artışı aynı oranda değil ve belli bir konsantrasyon sonra etki düzeyi değişmez. O nedenle her dezenfektanın bir optimum konsantrasyon vardır ve bu konsantrasyonlarda kullanılmaları tavsiye edilir [18-21]. Dezenfeksiyon süresi Bir kimyasal ajanın mikroorganizmalar üzerine gereken etkiyi yapabilmesi için belli bir temas süresine ihtiyaç duyulur. Temas süreyle doğru orantılı olarak etki artar. Ancak düşük etkili dezenfektanların bazılarında başlangıçta mikroorganizma sayısını azaltmakla birlikte zaman uzadıkça özellikle Gram-negatif bakterilerin üreyip çoğalmalarına sebep olabilir [18-21]. Isı Sıcaklıkla doğru orantılı dezenfektanın iyonlaşma derecesi, dolayısıyla etki belirgin biçimde artar. Bu dezenfektanın ve etkilenecek olan mikroorganizmanın türüne göre değişmektedir [18-21]. ph derecesi Her dezenfektanın optimal etkili olduğu bir ph değeri vardır. Pek çok dezenfektan madde için optimal ph nötr ortamlardır. Bu ph dan ne kadar uzaklaşılırsa etkinlik o kadar azalır [18-21].
25 8 Yüzey gerilimini azaltıcı maddelerin bulunması Dezenfektanın mikroorganizmalara daha kolay ve doğrudan etki etmesi için ıslatma ve yayılma yeteneğini artırarak sağlanmaktadır. Deterjanlar klorlu dezenfektanlarda olduğu gibi bazı dezenfektanların etkisini azaltabilir [18-21] Dezenfektan Kullanımında Dikkat Edilmesi Gereken Hususlar Kullanılmadan önce uygun oranda sulandırılmalıdır, Dezenfekte edilecek maddenin temizliği yapılmalı ve ayrılabilir parçalarını dezenfektana konulmalıdır, Dezenfekte edilecek malzeme ıslak olarak dezenfektana atılmamalıdır, Dezenfektanların etki süreleri bilinmeli ve önerilen temas süresine uyulmalıdır, Hazırlanan dezenfektan solüsyonun üzerine hazırlandığı tarih yazılmalıdır, Dezenfektan solüsyon azaldıkça üstüne ilave yapılmaması, Dezenfektan solüsyonların saklandıkları kapların kapakları mantar içermemeli, Solüsyon güneş ışığından uzak tutulmalı ve havayla uzun süre temas etmemelidir, Dezenfekte edilecek madde tamamen dezenfektana batırılmalıdır, Kullanılan solüsyonlardan ara sıra örnek alınarak etkinlikleri test edilmelidir, Dezenfektan kullanan kişiler mutlaka eldiven ve maske kullanmalıdır, Dezenfektan kullanımı ile ilgili eğitimler verilmeli ve denetimler yapılmalıdır [22] Biyosidlerin Etki Mekanizmaları Antiseptik, dezenfektan ve koruyucu maddeler, hücrede özgül bir hedefi bulunan antibiyotiklerden daha geniş bir etki spektrumuna sahiptir. Çünkü bunların mikroorganizmalar üzerinde daha çok hedefi bulunmaktadır. Byosidler değişik mekanizmalarla mikrobiyostatik veya mikrobisidal etki gösterir. Bunların özellikle bakteriler üzerine etki mekanizmaları diğer mikroorganizmalara (virüs, protozoon) göre daha iyi belirlenmiştir. Aynı madde bir veya daha fazla mekanizma ile etki edebilir. Biyosidler, hücre duvarını bozma, sitoplazma zarını bozma, protoplazmayı pıhtılaştırma, hücre içi bileşenlerinin dışarıya sızmasına neden olma, hücre homeostazini bozma, mikropların enzim, diğer protein yapılarını bozma gibi mekanizmalarla etki etmektedir [23,24].
26 Proteinler ve nükleik asit üzerine etki edenler Alkol, aseton ve organik çözücüler bazı dezenfektan maddeler, protein yapısındaki maddeleri ve enzimleri koagule ve denatüre ederek normal yapılarının bozulmasına neden olur ve buna bağlı olarak da hücreler ölür. Ağır metaller (civa, bakır, çinko), alkilleyici ajanlar (formalin, etilen oksit) ve oksitleyici ajanlar gibi bazı dezenfektanlar mikroorganizma DNA'sı ile birleşerek nükleik asidin replikasyonuna ve protein sentezine engel olur. Buna bağlı olarak bakterinin ölümüne yol açar [25] Hücre membranına (zar) etki edenler Fenol ve fenol bileşikleri, deterjanlar ve organik çözücüler gibi Dezenfektanlar yüzey gerilimini azaltarak ve ozmotik basıncı yükselterek hücre zarının yarı geçirgenlik özelliğini kaybettirir. Buna bağlı olarak hücrenin dehidratasyona uğrar. Metabolizma bozulur ve bakteri hücresinin ölümüne neden olur. Bazı dezenfektanlar bakteri membranında etki ederek bakterinin aktif ve pasif transportunu bozarken, bazıları da hücre duvarına tamamen zarar verir [25]. Fenol ve fenol bileşikleri Sitoplazma zarındaki oksidaz ve dehidrogenazlarla geri dönüşümsüz olarak bağlanarak hücre içi bileşiklerin dışarı çıkmasına neden olur ve bakteriyi öldürür [25]. Organik çözücüler Hücre zarının lipid yapısını bozarak ve hücre proteinini denatüre ederek etki ederler. Kloroform, alkoller ve tolüen bu grupta yer alırlar [25] Enzimlerin fonksiyonunu bozarak veya değiştirerek etki edenler Ağır metaller, tuzlar, oksidan maddeler, alkalin maddeler ve deterjanlar gibi dezenfektanlar, mikroorganizma enzimlerine bağlanarak enzimlerin kimyasal yapısını ve aktivitesini bozarak etki ederler. Böylece hücre metabolizması bozulur ve ölümüne yol açar [25].
27 Bakteri sporlarına etki edenler Dezenfeksiyon maddeleri ile sporlu bakterilerin vegetatif şekilleri öldürülerek bunların tekrar spor yapmaları önlenir. Kuarterner amonyum bileşenleri germinasyon aşamasında etkilidir. Fenol spor oluşuma aşamasını etkiler. Gluteraldehid, formaldehid, hipoklorit, iyot, hidrojen peroksit ve etilen oksit olgun spor aşamasında etkilidir [25] Virüslere etki edenler Virüsler çok hücreli mikroorganizmalar gibi enfeksiyona yol açmaktadırlar. Virüslerin kontrolü onların inaktive edilerek hücre içinde üremeyi ve bulaştırmayı sürekli elverişsiz kılmaktır. Biyosidler inaktivasyon ile ya virüslerin nükleik asitlerini ya da onların yapısındaki proteinlere zarar vererek etkili olabilir [26]. Etilen oksit, nitrik asit, hidroksilamin gibi alkilleştirilmiş ajanlar mutajenler gibi etki edeler, yani DNA ve RNA yı başkalaştırırlar. Eğer başkalaşma yeni viral parçacıkların direkt sentezinden dolayı DNA ve RNA ya engelse, alkali ajanlar etkili inaktivatör olarak adlandırırlar. Deterjanlar, alkoller ve diğer ajanlar aynı yolla virüs ve bakterilere etki ederek proteinleri denatüre ederler [27]. Virüsler bazen proteinleri denatüre olmasına rağmen enfeksiyonu sürdürürler. Bu yüzden bakteriye karşı kullanılan dezenfeksiyon yöntemleri, bulaşıcı virüslere o kadar etkili olmayabilirler. Ayrıca bir ajanın kullanılması virüsleri inaktivite etmez, laboratuvardan elde edilen enfeksiyonlarla sonuçlanabilir [26] Biyosidlere Karşı Gelişen Direnç Mekanizmalar Dezenfektanın bakteri hücresindeki hedefinin değişime uğraması Antibiyotiklerin tersine dezenfektanların hücrede çoklu hedefleri bulunur. Buna bir istisna olarak Escherichia coli lerdeki triklosan direnci gösterilmektedir. Bu dirençte enoyl redüktaz enzimini kodlayan gende bir mutasyon vardır. Ancak sonrada yapılan çalışmalarda triklosanın E. coli hücresinde bundan başka hedefleri de bulunduğu bildirilmiştir [28].
28 11 Membran geçirgenliğin bozulması (impermabilite) Hücre içerisinde dezenfektan madde birikmesinin engellenmesi sonucu dezenfektan direncine yol açar. Membran geçirgenliğin azalması sonucu gram-negatif bakterilerdeki kazanılmış dezenfektan direncine yol açmaktadır. Hücre yüzeyinin hidrofobik yapısındaki, dış membran yapısındaki, dış membrandaki protein ve yağ asidin değişikliklere uğraması sonucu permeabilite değişikliklerine sebep olmaktadır. Ancak henüz sorumlu olan genetik defekt veya spesifik membran/permeabilite defekti aydınlatılamamıştır. Buna karşın, dış membranın dezenfektan direncinde önemli bir yeri olduğu açıktır [28]. Gram-negatif bakterilerin hücre duvarlarında fazla lipid olması gram-pozitif bakterilerden dezenfektanlara daha dirençlidir. Dış membranın harabiyete uğratılmasında dezenfektanlara karşı duyarlılık artar. Aynı zamanda bazı mikroorganizmalar tarafından oluşturulan biyofilm impermeabiliteye yol açan bir diğer mekanizmadır. Biyofilm içerisinde üreyen bakterilerde dezenfektanlara direnç gözlenmesi, muhtemelen biyofilm tabakasının dezenfektan madde permeabilitesine karşı bir engel oluşturmasına bağlıdır [29]. Hücre dışına atım (Efflux) pompaları Bakterilerde bulunan bazı efflux sistemleri geniş spektrumlu olup, yapısal olarak birbiri ile ilişkisiz olan birçok dezenfektan maddeyi hücre dışına atabilmektedir. Dezenfektan direncinde rol oynayan efflux pompaları multidrug efflux (MDR) sistemleri olarak bilinmektedir. Bu efflux sisteminden sorumlu genler genellikle plazmidler tarafından kodlanmaktadır [28] Mikroorganizmaların Biyosidlere Karşı Direnç Gelişimi Mikroorganizmaların dezenfektanlara karşı direncinin kökeni iki türdür: Doğal (intrinsik) direnç:- dezenfektanlarla temas olmadan mikroorganizmanın dezenfektana karşı doğal direnci vardır. Kazanılmış direnç:- kromozomlardaki mutasyon, plazmid ya da transpozonlar aracılığı ile gelişen bir direnç mekanizmasıdır [14,30].
29 Doğal (intrinsik) direnç İntrinsik direnç, gram negatif bakterilerde, mantarlarda, parazit kistlerinde, mikobakterilerde ve sporlarda görülür [14]. Gram negatif bakteriler intrinsik olarak birçok dezenfektana gram-pozitif bakterilerden daha dirençlidir. İntrinsik direnç, genellikle dezenfektan maddenin hücre içine alımının azalması ile ilişkilidir [28] Kazanılmış direnç Plazmid aracılı antiseptik ve dezenfektan direnci ilk olarak Pseudomonas aeruginosa da tanımlanmakla birlikte daha sonra Staphylococcus aureus, koagülaz negatif stafilokoklar, Pseudomonas türleri ve Enterobacteriaceae üyelerinde rapor edilmiştir [31]. Kazanılmış direnç mutasyonla genetik materyalin (plazmid, transpozon) bir başka hücreden kazanılması ile ortaya çıkar. Mutasyona bağlı kazanılmış direnç, artan dezenfektan konsantrasyonlarına maruz kalınmasıyla açıklanabilir. Enterobacteriaceae ailesinde, plazmidler antibiyotiklerin yanı sıra bazı dezenfektanlara karşı özgül direnç genleri taşıyabilmektedir. Ciddi yanık enfeksiyonlarını önlemede tipik olarak kullanılan gümüş nitrat ve gümüş sülfadiazin gibi gümüş tuzlarına plazmid aracılığıyla ile gelişen direnç, hastane ortamın da özel bir önem taşır. S. marcescens le gözlenen plazmide bağlı formaldehid direncinin aldehid parçalanması ile ilişkili olduğu düşünülmektedir [4]. Birçok dezenfektana karşı direnç gelişimi bilinmektedir. Mikroorganizmalarda antiseptik ve dezenfektanlara karşı direnç durumu aşağıda gösterilmektedir. (duyarlılık yukardan aşağı artmaktadır) [30,32].
30 13 Dirençli Duyarlı Prionlar Coccidia (Cryptosporidium) Sporlar (Bacillus, Clostridium difficile) Mikobakteriler (M. tuberculosis, M. avium-intracellulare) Kistler (Giardia) Küçük zarfsız virüsler (Polio virüs) Trofozoitler (Acanthamoeba) Gram negatif bakteriler (Pseudomonas, Providencia) Mantarlar (Candida, Aspergillus) Büyük zarfsız virüsler (Enterovirüs, Adenovirüs) Gram pozitif bakteriler (S. aureus, Enterococcus) Lipid zarflı virüsler (HIV, HBV) Biyosidlere karşı direnç daha çok bakteri sporlarında görülür. Sporu çevrileyen manto biyosidlerin geçişini engeller. Dezenfektanlara direnç, ikinci sıklıkta mikobakterilerde görülür. Endoskopları dezenfekte etmekte kullanılan dezenfektanlara dirençli mikobakteriler ile oluşan enfeksiyonlar bildirilmiştir. Stafilokoklar gibi gram pozitif bakterilerin hücre duvar yapısından dolayı dezenfektanlara karşı etkili bir engel oluşturmaz. Ancak mukoid ve/veya slaym faktörü taşıyan stafilokoklar birçok dezenfektanlara (kloroksilenol, setrimid ve klorhekzidine) daha dirençlidir. Slaym faktörü uzaklaştırıldığı zaman dirençli stafilokoklar daha duyarlı hale gelmektedirler [14] Mantarlarda Biyosid Direncinin Mekanizmaları Mantarlardaki biyosid direnç bakteri ile karşılaştırıldığında çok az sayıda çalışma bulunmaktadır. Mantarlarda biyosit direnci iki yolla gelişmektedir: Intrinsik direnç (dışarı atma, enzimatik inaktivasyon, fenotipik modülasyon), Kazanılmış direnç (mutasyon, indüklenen atım pompaları). Mantarlarda kazanılmış dirençte plazmidlerin rolü hakkında veri bulunmamaktadır [30]. Mantarlarda biyoside karşı duyarlılıkları hücre duvarı bileşimi (glukan, mannan), hücre duvarı kalınlığı ve plazma membranı ile ilişkilidir. Mantarların duvar yapısındaki glukan ve mannoproteinler klorhekzidin alımı ve sonuçta aktivitesini etkiler. Örneğin Candida albicans, Saccharomyces cerevisiae ya göre klorhekzidine daha dirençlidir. Linoleik
31 14 asitten zengin plazma membranına sahip olan maya hücreleri, oleik asitten zengin plazma membranı olanlara göre etanole daha dirençlidir. Küfler mayalara göre biyositlere daha dirençlidir. Küfler için gereken öldürücü biyosit konsantrasyonu mayaların gerektirdiği konsantrasyondan kat kadar fazladır. Küflerin direnci duvar yapısı ile ilişkilidir. Küf sporlarının bakteri sporlarından daha duyarlı olduğu belirtilmektedir [30] Dezenfektan Direncinin Önemi Biyosidlere yüksek oranda dirençli kökenlerin ortaya çıkması nedeniyle; biyosidlere karşı duyarlılık giderek azalmaktadır. Bu nedenle günümüzde biyosidlere dirençli suşların giderek artabileceği düşünülmektedir. Şu ana kadar gözlenmekle birlikte, bu durum dezenfekta kullanımının giderek yaygınlaşması nedeniyle gelecek yıllarda bu sorunla karşılanabileceği söylenebilir [31]. Dezenfektanlar antibiyotiklerin aksine birden çok hedefe yönelik aktivite gösterir. Düşük konsantrasyonlarda ise antibiyotikler gibi bir ya da iki hedefi etkileyebilir. Düşük seviyede dezenfektana maruz kalmanın dezenfektan duyarlılığında azalmaya yol açtığını bildiren yayınlar olmakla birlikte pratik uygulamada dezenfektanlar çok yüksek konsantrasyonlarda kullanıldığı için duyarlılıkta azalma klinik uygulamalarda pratik etki oluşturmayacak boyuttadır. Bazı durumlarda ise dezenfektanın yoğun kullanıldığı yerlerden izole edilen kökenlerde o dezenfektanın kullanım konsantrasyonuna karşı direnç saptanmış, bu direncin intrensek dirence sahip suşların seçilmesiyle ilişkili olduğu belirtilmiştir [31]. Dezenfektanlara karşı direnç MİK ile belirlenmektedir. Çoklu antibiyotik direnci ve qac direnç geni taşıyan bakterilerin dezenfektanlara karşı MİK düzeyi artabilir. Bununla birlikte MİK değerlerindeki küçük artışlar dezenfektanların klinik kullanımdaki konsantrasyonlarının çok altındadır. Bu direnç genlerinin varlığı bu nedenle dezenfeksiyona gerçek, etkin bir direnci göstermez. Kullanım konsantrasyonlarındaki dezenfektanlar antibiyotik direnci ile ilişkili olma hususunda pek probleme yol açmazlar. Hastanelerde çevresel ortamda bulunan dezenfektan kalıntıları ile antibiyotik direnci arasında korelasyonu araştıran sınırlı sayıda çalışmada, bu durumun antibiyotiklere dirençli bakterilerin seçilmesine yol açmadığı şeklindedir. Dezenfektanlara karşı gelişen direnç ile başa çıkabilmek için dezenfektanların sadece gerekli hallerde ve etkin konsantrasyonlarda ve doğru uygulamalarla kullanılması gerekmektedir [31].
32 Çalışmada Kullanılan Biyosidlerin Kimyasal ve Farmakolojik Özellikleri Klorheksidin Klorheksidin diglukonat (CHX) kuaterner amonyum yapılı, bis-biguanid bileşiğidir. İlk kez 1954 yılında bir antimikrobiyal ajan olarak tanımlanmıştır. Asetat (diasetat), glukonat ve hidroklorür tuzları olarak bulunmaktadır. Antiseptik amaçlı en yaygın kullanılan biyosidlerden biri olmuştur [33, 34]. El yıkama, oral ürünler ve bir koruyucu madde olarak kullanılmaktadır. Klorheksidin diglukonat düşük cilt tahrişi ve geniş spektrumlu aktivitesi ile bakterisidal bir ajandır. Hem bakteriler hem de mayalarda alımı hızlıdır ancak düşük ph ve konsantrasyonda aktivitesi azalmaktadır [35]. Pozitif yüklü olmasından dolayı katyonik özellik taşır ve bakteri hücre duvarı, ekstrasellüler polisakkaritler, hidroksiapatit, pelikıl, tükürük müsinleri ve oral mukoza gibi negatif yüklü yüzeylere afinite gösterir. Klorheksidin diglukonat; bağlandığı bu dokulardan yavaşça salınarak uzun süreli etki gösterir. Düşük konsantrasyonda bakteriyostatik, yüksek konsantrasyonda ise hücresel içeriğini irreversible olarak çökelttiğinden bakterisittir. Klorheksidin diglukonat gram pozitif bakterilerde fosfat gruplarına, gram negative bakterilerde yüzeydeki lipopolisakkaritlere bağlanır. Bu bağlantı bakteri yüzeyinin bütünlüğünün bozulmasına neden olur. Sitoplazmik membran zarar gördüğünde ilk gözlenen madde potasyum iyonudur. Sitoplazmik membranın geçirgenliğinin değişmesi, sitoplazmik proteinlerin çökelmesini arttırır, hücresel ozmotik dengeyi değiştirir, metabolizmayı, hücre büyüme ve bölünmesini zarara uğratır [33]. Klorhekzidinin maya hücre duvarında morfolojik modifikasyon, sitoplazmik bileşiklerinin sızması, yüksek konsantrasyonda nükleoproteinin koagüle etmesi ve intrasellüler bileşikler ile etkileşim yaparak etki yapmaktadır [2].
33 Sodyum hipoklorit Sodyum hipoklorit (SHC), en yaygın kullanılan klor içeren dezenfektandır. Çamaşır suyu %5,25 oranında sodyum hipoklorit içerir ve içinde 50,000 ppm serbest klor bulunur. Dezenfektanın biosidal aktivitesi, solüsyonun içerdiği serbest klor miktarı ile ölçülür. ph:8 olan musluk suyu ile taze hazırlanan ve kapalı opak şişelerde saklanan NaOCl stabilitesini bir ay korumaktadır. Ancak bir ay içerisinde sık sık ağzı açılırsa aktif klor konsantrasyonu azalmaktadır. Dezenfekte edilecek yüzeylerdeki organik madde miktarına bağlı olarak 1/10-1/100 e kadar sulandırılır. Sodyum hipokloritin %5,25 lik stok çözeltisinin 1/10 luk dilüsyonu yaklaşık 5000 ppm serbest klora eşdeğer gelmektedir. Bu çözelti Central of Disease Control and Prevention (CDC) tarafından yere dökülen, etrafa sıçrayan kanların dezenfeksiyonu için önerilmektedir. Temiz yüzeyler için 1000 ppm aktif klor yeterlidir. Düşük konsantrasyonlar (2-500 ppm) vejetatif bakterilere, mantarlara ve çoğu virüse karşı etkilidir. Sporosidal aktivite 2500 ppm civarında sağlanabilir. Ancak bu konsantrasyon oldukça korozif etkilidir ve sınırlı kullanılmalıdır. Yüksek konsantrasyonlar, mukoz membranlarda, gözlerde ve ciltte irritasyona yol açar. Klor bileşikleri güneş ışığı ve bazı metaller ile inaktive olurlar. Bu nedenle daima taze solüsyonları kullanılmalıdır. Hipokloritler kesinlikle asitler veya amonyak ile karıştırılmamalıdır. Bu toksik klor gazı çıkışına neden olabilir [36,37] Benzalkonyum klorür Benzalkonyum klorür (BNZ) 1935 yılından beri klinik kullanımda olan bir kuaterner amonyum bileşiğidir [38]. Kuaterner amonyum bileşiklerinin CDC tarafından antiseptik değil de dezenfektan olarak kritik olmayan yüzeylerde (zemin, mobilya, duvar gibi) kullanımı önerilmektedir [4]. Benzalkonyum klorür gıda endüstrisinde, gıda işleme hatları ve yüzeylerinin sanitasyonunda dezenfektan ve katyonik yüzey aktif ajan olarak yaygın kullanılan geniş spektrumlu bir antimikrobiyal ajandır. Sağlık kuruluşlarında, evlerde dezenfektan ve antiseptik olarak ayrıca düşük konsantrasyonda ilaçlarda antimikrobiyal koruyucu olarak kulanılmaktadır. Benzalkonyum klorür, benzil klorür ile alkildimetilamin arasında bir nükleofilik yer değiştirme reaksiyonu ürünüdür [39, 40].
34 17 Benzalkonyum klorür genel membran geçirgenliğine etki etmektedir. Düşük konsantrasyonlarda sitoplazmik maddelerin sitolitik sızıntısıyla birlikte dış membrane hasarına neden olur ve böylece hücre içine alımını ve girişini sağlamaktadır. Yüksek konsantrasyonlarda, karboksilik grupları hedef almakta ve bakteriyel sitoplazmada genel pıhtılaşmaya neden olmaktadır [41, 42]. Bakteri hücrelerinin en dış yüzeyi genellikle iki değerli katyonların varlığı ile stabilize edilmiş negatif yük taşımaktadır. Bu negatif yük gram pozitif bakterilerde teikoik asit ve polisakkarit elemanlar ile ilişkili iken, gram negatif bakterilerde lipopolisakkarit ve stoplazmik membran ile ilişkilidir. Birçok antimikrobiyal ajan katyoniktir ve bu nedenle bakteri hücrelerine yüksek bağlanma afinitesine sahiptir. Genellikle, katyonik antimikrobiyallerin hücre yüzeyi ile etkileşime girebilmeleri ve sitoplazmik membran ile bütünleşebilmeleri için hidrofobik bölgeyle birlikte bir kuvvetli pozitif yük gerekmektedir [43]. Bir antiseptik ajanın uygunluğunu değerlendirmek ve biyouyumlu antibakteriyel ajanı seçmek için hem mikrobisidal aktivite hem de sitotoksik etkisi dikkate alınmalıdır [44]. Benzalkonyum klorür bazlı dezenfektanlar toksik olmayan, bozulmaya yol açmayan ve kullanılan dilüsyonlarda kokusuz, noniyonik ve amfolitik yüzey aktif ajanlardır. Sağlık hizmetleri kaynaklı enfeksiyonların en yaygın nedenlerinden biri çalışanların elleri ile kişiden kişi bulaşmasıdır [43]. Benzalkonyum klorür el dezenfektanı normal el yıkama için en popüler durulanmayan el dezenfektanı formülüdür. Ayrıca koruyucu olarak BNZ içeren intranasal ürünlerin uzun ve kısa vadeli klinik kullanımda güvenli olduğu ve iyi tolare edildiği görülmektedir [40] Triklosan Triklosan (2,2,4 trikloro-2 -hidroksidifenileter); sentetik, iyonize olmayan, geniş spektrumlu, 40 yıldan fazla süredir kullanımda olan antimikrobik bir ajandır. Sağlık ürünleri içinde ilk olarak diş plaklarını azaltmak için dental ürünlerin içinde ve cerrahi alan boyamasında kullanılmıştır [45,46]. Triklosan (TRC) bugün el sabunları, cerrahi alan temizliği, duş jeli, deodorant, sağlık bakım personeli el temizliği, el losyonu, el kremleri ve diş macunları içinde bulunmaktadır [47,48].
35 18 Triklosan bakterinin sitoplazmik membran, RNA, lipid ve protein sentezini engelleyerek etki eder. Gram-pozitif ve gram-negatif bakteriler üzerinde bakteriyostatik etki göstermektedir. Bunun yanı sıra antifungal ve antiviral özelliklerinin de olduğu bilinmektedir. Triklosan mikroorganizmaya ait ENR (enoyl-acyl redüktaz) enzimini bloke ederek lipid sentezini inhibe etmektedir. Böylece mikroorganizmanı gelişmesini ve bölünerek çoğalmasını engellemektedir [49] Mantarlarda Virülans Mikroorganizmaların hastalık oluşturma özellikleri, esasen aralarında kesin bir sınır olmayan iki terimle açıklanmaktadır; bunlar hastalık yapıcı "patojen" mikroorganizmalar ve hastalık oluşturma özelliği bulunmayan "apatojen" olanlar. Patojen mikroorganizmaların hastalık yapma dereceleri virülansları olarak isimlendirilir. Virülans faktörleri, konakta patojenlerin nasıl hasara neden olduklarını açıklar. Bu faktörler bazı patojenler için gerekli, bazıları için de yardımcıdır. Patojen mantarlar konak dokuya saldırmada yardımcı olacak virülans faktörlerine sahiptirler. Mantarların virülans faktörleri, patogenezde rol oynayan faktörlerdir [50] Deneysel Model olarak Galleria mellonella 19. yüzyıldan beri mikroorganizmaların patojeniteleri ve virülansları daha iyi anlaşılması için hayvan modelleri kullanılmaktadır. Deney hayvaları ile yapılan çalışmalarda daha çok fare, rat ve tavşan gibi memeliler kullanılır. Ancak enfeksiyonların deneysel hayvan modellerinde çalışılabilmesi için bazı şartların bulunması gerekmektedir. Etik ilkelerin gözetilmesi şattır. Memeli hayvanların yerine omurgasız modellerin kullanımı gündeme gelmiştir. Galleria mellonella larvaları virülans çalışmaları için iyi bir fizyolojik model oluşturmakta laboratuvar şartlarında kolayca yetiştirilmektedir. Larva modeli ucuz ve daha az zahmetli olması, etik kurul onayı gerektirmemesi nedeni ile son yıllarda ilgi çekmeye başlamıştır [51] In vitro Virülans C. albicans virülans faktörlerine sahip olup konak savunma sistemleri tarafından elemine edilmelerini önlemek için kullanırlar. Virülans faktörleri yardımıyla C. albicans mikrobiyal flora ile rekabet ederek konağın farklı bölgelerinde enfeksiyonlara neden
36 19 olabilmektedir. Patojenite kriterleri denilen bu faktörler C. albicans ve diğer Candida türlerinin virülansını belirler. Virülans faktörlerinin önemi en iyi C. albicans türünde gösterilmiştir [52]. Bu çalışmada biyosid duyarlı ve dirençli C. albicans kökenlerin in vitro virülans deneyleri için hemolitik aktivite, proteinaz, fosfolipaz, esteraz, slaym faktör oluşturma özellikleri araştırılmıştır Çalışmada Yapılan Virülans Deneyleri Galleria mellonella deneyi Büyük mum güvesi Galleria mellonella Lepidoptera takımı, Pyralidae familyası içinde yer almaktadır. Bal peteklerine zarar vererek önemli miktarda ekonomik kayıplara yol açmaktadır. G. mellonella larvaları laboratuvarda kolay bir şekilde yetiştirilebilmektedir. Bu nedenle araştırmalarda tercih edilen bir organizmadır [53]. Büyük mum güvesi yaşam döngüsü, yumurta, larva, pupa ve ergin olmak üzere 4 evreden oluşmaktadır. Bu yaşam döngüsü sadece sıcaklık çok düşük olduğunda veya besin yetersizliği olduğu durumlarda etkilenmektedir. Bu nedenden dolayı mum güvesinin yaşam döngüsü sıcaklık ve besine bağlı olarak 6 haftadan 6 aya kadar değişebilmektedir [54]. Şekil 2.1. G. mellonella nın yaşam döngüsü [55].
37 20 Dişiler yumurtalarını bal peteğinde bulunan yarık ve deliklere yumurtlarlar. Yumurtalar pembemsi krem veya beyaz renktedir. Normal koşullarda (oda ısısında) bu yumurtalardan 5-8 gün içerisinde larvalar çıkar. Yumurtadan çıkan larvalar ipeksi bir tünel oluşturarak peteğin taban kısmına doğru ilerlemeye başlar. Larvalar ideal şartlar (sıcaklık, besin ve nem) bulunduğunda 1-2 ay arasında gelişmelerini tamamlar. Bu dönem sonunda larvanın boyu yaklaşık 28 mm ye kadar ulaşır. İlk 10 gün içerisinde larvaların ağırlıkları her gün iki katı artar. Larvalar sadece balmumu ile beslenerek gelişmelerini tamamlayamazlar. Larvanın gelişmesi için en ideal sıcaklık C olup, 15 C nin altındaki sıcaklıkta ise beslenme ve gelişmeleri görünmez. Larva döneminin sonunda larvanın ördüğü yapı çok dayanıklı bir yapı halini alır. Gömlek içinde larva pupaya, daha sonra da ergin güveye doğru değişime başlar. Bu değişim süreci 1-9 haftada sona erer. Ergin güvenin büyüklüğü ve rengi çok değişken bir yapıda olup bu durum larval evredeki besinin yapısı ve çeşitli gelişim devrelerindeki süreye bağlı olarak değişmektedir. Dişi güveler erkek güvelerden daha geniş yapılıdırlar. Mum güveleri genellikle geceleri uçarlar. Gündüz saatlerinde karanlık yerlerde dinlenirler. Dişi güveler gömlekten çıkıştan 4-10 gün içerisinde yumurtlamaya başlarlar [53,56] In vitro virülans faktörleri Biyofilm (Slaym) Candida türleri kateter, yapay eklem, protez kalp kapağı gibi tıbbi cihazların yüzeylerine yapışıp biyofilm üreterek kolonizasyon ve enfeksiyon oluşturabilirler. Oluşan biyofilmde hem mikroorganizmaya hem de konağa ait faktörler rol oynamaktadır. Bu yapışma ve kolonizasyon için mantarın slaym faktörünün, konağın da fibrin ve fibronektinlerinin karşılıklı etkileşiminin gerekli olduğu bildirilmektedir. Biyofilmlerdeki hücrelerin planktonik hücrelerden tamamen farklı fenotipik özellikler gösterdikleri, klinikte kullanılan antifungallere daha dirençli oldukları ve enfeksiyon için bir kaynak oluşturdukları belirtilmektedir. Biyofilm oluşturabilme yeteneği ile virülans derecesi arasında pozitif bir ilişki olduğu belirlenmiştir [57,58-61]. Biyofilm, ince bazal bir maya tabakası, üzerinde kalın bir hif tabakası ve bu yapıyı çevreleyen hücre dışı matriksden oluşmaktadır. Serbest maya hücreleri önce katı bir yüzeye yapışır, daha sonra morfogeneze uğrar ve salgısal hücre duvar polimeri β 1,3 -
38 21 glukanca zengin ekstrasellüler bir matriks içerisine gömülü karışık morfolojide hücrelerden oluşan yoğun bir tabaka ortaya çıkar. Matriks karbonhidrat, protein, fosfor ve hekzoaminazlardan meydana gelir. Besin, ph, oksijen gibi çevre koşullarının yanı sıra etkenin türü de matriks kompozisyonunu etkiler [61-63]. Biyofilm oluşumunda rol alan çok sayıda gen tanımlanmıştır. Bunlardan bazıları hif oluşumu için gerekli transkripsiyon faktörü Efg1 ve kinaz Yak1 dir. Ayrıca, transkripsiyon faktörü Zap1 in matriksin polisakkarit bileşenlerinin üretimini, diğer bir transkripsiyon faktörü Bcr1 in ise hücrelerin yüzeylere yapışmasını sağlayan adhezinlerin oluşumunu düzenlediği bildirilmektedir. Bir grup alkol dehidrogenaz ise hücreler arası haberleşme (quorum sensing) moleküllerinin seviyesini düzenlemektedir [64]. Candida türleri arasında biyofilm üretimi en sık olarak C. albicans ta görülmektedir. Kateter kaynaklı enfeksiyonlarda yüksek oranda rol oynayan C. parapsilosis için biyofilm üretiminin önemli bir virülans faktörü olduğu; ayrıca C. tropicalis, C. glabrata ve C. kefyr in de biyofilm ürettiği saptanmıştır [62,65]. Proteinaz Enzimi C. albicans tarafından en sık üretilen hidrolitik enzim salgısal aspartic asid proteinazdır. Bu enzimleri kodlayan SAP gen ailesinde birbirinden farklı 10 kadar gen mevcuttur. SAP1, SAP2, SAP3 genleri yalnızca maya hücrelerinde, SAP4, SAP5, SAP6 ise hif yapılarında bulunmaktadır. SAP9, SAP10 hem maya hem hif yapılarında bulunup fungal hücre duvarına bağlıdır [66]. Salgısal aspartik proteinazlar kollojen, laminin, fibronektin, müsin, salgısal laktoferrin, α2- makroglobulin, immünglobulinlerin tamamına yakını, interlökin-1β, laktoperoksidaz, katepsin D, kompleman, çeşitli kan koagulasyon öncüllerini hidrolize eder. Bu özellikler mantarın virülansını ve dokulara invazyonunu sağlar [66].
39 22 Fosfolipaz Enzimi C. albicans başta olmak üzere diğer Candida türleri, Cryptococcus neoformans, Aspergillus fumigatus gibi fungal patojenlerde fosfolipaz aktivitesi saptanmıştır. Candida türlerinin fosfolipaz aktivitesi ile virülansı arasında ciddi bir korilasyon bulunmuştur [54,59,63,66]. Fosfolipaz aktivitesinin mantarın doku invazyonunda önemli bir rolü olduğu bildirilmiştir. Bu enzimler hücre membran yapısında bulunan gliserofosfolipitlerin ester bağlarını hidrolize ederek doku invazyonuna yol açar. C. albicans larda fosfolipaz aktivitesi nonalbicans lara göre çok daha yüksektir. C. albicans ta fosfolipaz A, B1, B2, C ve D tanımlanmıştır [68]. Fosfolipaz B, lizofosfolipaz-transaçilaz ve hidrolaz aktiviteleri aktiviteleri nedeni ile C. albicans ın virülansında çok önemlidir [66]. Esteraz Enzimi Esteraz enzimi de lipazlar gibi triaçilgliserollerin ester bağlarını hidrolize etmektedir. Lipazlardan farkı suda çözünebilen, uzun zincirleri yağ asidi içeren substratlara etki göstermesidir [69]. Bazı Candida türlerinin, fosfolipazın yanı sıra esteraz gibi enzimleri salgılayarak, lipolitik aktivite gösterdiği belirtilmiştir. Candida türlerinde esteraz aktivitesini, tween 80 içeren katı besiyerinde opasite testi ile gösterilmiştir [70]. Ekstrasellüler esteraz enzimi ısıya duyarlı bir enzimdir. Maksimum esteraz aktivitesi, tek karbon kaynağı olarak Tween 80 içeren besiyerinde, ph 5.5 de görülmektedir. Ayrıca bir lipaz aktivatörü olan sodyum taurokolat eklenmesiyle esteraz aktivitesinin de stimüle ettiğini belirtilmiştir [69-71]. Esteraz enziminin substratları arasında yer alan ve insan derisinin stratum korneum tabakasında yüksek oranda bulunan triaçilgliserol ve mono açilgliserol substratları lipolitik
40 enzimlerinin aktivitesi sonucunda parçalanmakta ve bunun neticesinde mikroorganızmanın invazyonu ve kolonizasyonu kolaylaştırmaktadır [72]. 23 Hemolitik Aktivite Hemolitik aktivite, patojen mikroorganizmaların demir kaynağı olarak konağın demir bağlı proteinlerini kullanarak konak içinde yaşamalarını sağlayan önemli bir virülans faktörüdür. Hemoglobin bu mikroorganizmalar için önemli bir demir kaynağıdır. Hemolizinler ise patojen mikroorganizmaların elementer demiri kullanmak için hemi parçamalarını sağlayan enzimlerdir ve özellikle sterptokok ve satfilokokların oluşturduğu enfeksiyonların patogenezinde rol alan önemli virülans faktörleri olarak bilinirler. Streptococcus gordonii deki alfa-hemolitik faktör olan hidrojen peroksitin C. albicans ta varlığı gösterilmiştir. Bununla birlikte Candida larda hemolizin mekanizması tam olarak bilinmemektedir. C. albicans ın indüklediği komplemana bağlı hemoliz ilk olarak 1994 yılında Manns ve ark. tarafından glikozla zenginleştirilmiş kanlı agar besiyerinde basit plak analiz yöntemi ile gözterilmiştir yılında yapılan bir başka çalışmada bu metodu çeşitli klinik örneklerden elde edilen farklı Candida türlerinin hemolitik aktivitelerini değerlendirmek ve hemolizin üretiminde türlerin spesifik farklılıklarını karşılaştırmak amacıyla modifiye edilmiştir. Araştırıcılar bu çalışmalarında, Candida türlerinde 24 saatlik sürede alfa hemoliz yaptığı 48 saat sonra ise C.albicans, C. glabrata, C. kefyr, C. tropicalis ve C. krusei suşlarının beta hemolize neden olabildiklerini gözlemişlerdir [73-75]. Bu çalışmada, biyosidlere duyarlı ve dirençli olan C. albicans kökenleri kullanılarak; in vitro direnç özellikleri ve direnç ile virülans ilişkisini ortaya koyulmaya çalışılacaktır.
41 24
42 25 3. GEREÇ VE YÖNTEM 3.1. Örneklerin Toplanması Çalışmaya Gazi Üniversitesi Tıp Fakültesi Hastanesi Mikoloji Laboratuvarında tarihleri arasında çeşitli klinik örneklerinden izole edilen ve hastane enfeksiyon etkeni olduğu belirlenen 417 Candida albicans suşu ve bir ATCC standart suşu (C.albicans 10231) dahil edilmiştir. Laboratuvara gelen klinik örneklerin ekimleri Sabouraud Dekstroz Agar a (SDA) yapılmış ve 37 C de saatlik inkübasyonun ardından üreyen koloniler değerlendirmeye alınmıştır. Elde edilen suşların tür düzeyinde tanımlanması çimlenme borusu testi kullanılarak ve doğrulanması için ID32 C (biomerieux, Fransa) kiti kullanılarak yapılmıştır. Kesin tanısı konulan suşların saklama tüplerine (mikrobank) konularak çalışmaların yapılacağı güne kadar -80 C de muhafaza edilmiştir Kullanılan Araç ve Gereçler Kullanılan cihazlar Etüv ( elektro-mag, Türkiye) Otoklav ( Sanyo, Japonya) Nanodrop cihazı (Thermo Scientific, ABD) LightCycler 2.0 ( Roche, Almanya) Buzdolabı (Arçelik, Türkiye) Derin dondurucu -20 C (Uğur, Türkiye) Derin dondurucu -80 C (Sanyo, Japonya) Sınıf 2 biyogüvenlik kabini (Metis biyoteknoloji, Türkiye) Santrifüj cihazı (BOECO, Almanya) Mikrosantrifüj ( Beckman Coulter, Almanya) Kuru blok ( Bio TDB-100, Almanya) Cam eşyalar, özeler, bistüriler, kapillerler, enjektör Mikropipetler ve uçları (Beta pette TM, ABD) U tabanlı mikroplak (LP italiana, İtalya)
43 26 Pastör fırını Çalkalayıcı (vortex) ph metre Otomatik pipet seti (Labmate, Türkiye) McFarland bulanıklılık ayarı turbidite ölçen cihazı (Dade Behring MicroScan Turbidity Mater) Kullanılan Besiyerleri Sabouraud Dekstroz Agar (SDA) Besiyeri (Fluka Biochemica, Isviçre) Mueller Hinton Agar (MHA) Besiyeri ( Himedia, Italya) Mueller Hinton Brot (MHB) Besiyeri ( Himedia, Italya) Malt Ekstrakt Agar (MEA) Besiyeri ( Himedia, Italya) Kullanılan Kimyasal Maddeler Bovine albümin (Merck, Almanya) Tripton (Fluka, İsviçre) NaCl (Fluka, İsviçre) Tween-80 (Fluka, İsviçre) Saponin (Fluka, İsviçre) L-histidine (Merck, Almanya) Lesitin soya %30 (Himedia, Hindistan) Sodyum tiyosülfat (Fluka, İsviçre) Magnezyum klorür (Panreac, İspanya) Kalsiyum klorür (Riedel- de Haen, Almanya) Sodyum bikarbonat (Sigma, ABD) 0,45 μm çaplı filtre (Corning, Almanya) Benzalkonyum klorür (Sigma, Danimarka) Klorheksidin diglukonat solüsyon (Sigma, İspanya) Irgasan (Sigma, Hindistan) Sodyum hipoklorit (Sigma, ABD) Tris-Hidroklorür (Amresco, Kanada)
44 27 Borik Asit (Applichem, Almanya) Etilen Diamin Tetra Asetik Asit (EDTA) (J.T. Baker, Hollanda) Agaroz (Sigma, ABD) Etidyum Bromid (Sigma, ABD) Primerler (metabion, Almanya) dntp (Thermo scientific, Almanya) 10 X buffer (Biolabs, İngiltere) Taq Polimeraz (Biolabs, İngiltere) DNase, RNase Free Su MgCl2 (Fermentas, Litvanya) Agar ( Himedia, Hindistan) Kullanılan kitler RNA izolasyon kiti ( Biological industries, İsrail) cdna kiti (Roche, Almanya) Heliosis kiti ( Metis, Türkiye) Kullanılan primerler ve enzimler Atım pompası primerleri (Alpha DNA, UK) Mutasyon primerleri (Alpha DNA, UK) LightCycler FastStart DNA Master HybProbe (Roche, Almanya)
45 Yöntemler Besiyerlerinin hazırlanması Sabouraud Dekstroz Agar ın (SDA) Hazırlanması Besiyerinin içeriği: Pepton 10g/L D (+) Glukoz 20 g/l Agar 17g/L ph 5.6 Toz besiyerinden 47 g tartılmış ve üzerine 1 L ye tamamlayacak şekilde distile su eklenerek otoklavda 121ºC de 15 dakika 1 atm basınçta sterilize edilmiştir. Steril petri kaplarına kalınlığı 4 mm olacak şekilde 25 er ml dökülerek katılaşıncaya kadar bekletildi ve kullanılıncaya kadar +4ºC de buzdolabında saklanmıştır. Mueller Hinton Agar ın hazırlanması Besiyerinin içeriği: Sığır infüzyonu 300 g/l Kazein asit hidrolizat 17,50 g/l Nişasta 1,50 g/l Agar 17,00 g/l ph 7,3±0,2 Toz besiyerinden 38 g tartılmış ve üzerine 1 L ye tamamlayacak şekilde distile su eklenerek otoklavda 121ºC de 15 dakika 1 atm basınçta sterilize edilmiştir. Steril petri kaplarına kalınlığı 4 mm olacak şekilde 25 er ml dökülerek katılaşıncaya kadar bekletildi ve kullanılıncaya kadar +4ºC de buzdolabında saklanmıştır.
46 29 Mueller Hinton Broth ın hazırlanması Besiyerinin içeriği: Sığır infüzyonu 2 g/l Nişasta 1,5 g/l Kazein hidrolizat 17,5 g/l ph 7,4±0,2 Toz besiyerinden 23 g tartılmış ve üzerine 1 L ye tamamlayacak şekilde distile su eklenerek otoklavda 121ºC de 15 dakika 1 atm basınçta sterilize edilmiştir ve kullanılıncaya kadar +4ºC de buzdolabında saklanmıştır. Malt Ekstrakt Agar ın hazırlanması Besiyerinin içeriği: Malt ekstrakt 48g Soya pepton 3g Agar 15g PH 6,5 Toz besiyerinden 48 g tartılmış ve üzerine 1 L ye tamamlayacak şekilde distile su eklenerek otoklavda 121ºC de 15 dakika 1 atm basınçta sterilize edilmiştir ve kullanılıncaya kadar +4ºC de buzdolabında saklanmıştır Mikrodilüsyon yöntemi ile biyositlerin minimal inhibisyon konsantrasyonunun (MİK) Belirlenmesi Klinik C. albicans kökenleri seçilen biyosidlere duyarlılıkları açısından Clinical and Laboratory Standards Institute (CLSI) tarafından mayalar için standardize edilen mikrodilüsyon yöntemi M27 A3 esas alınarak taranmıştır. 417 C. albicans kökeninin sodyum hipoklorit (SHC), benzalkonyum klorür (BNZ), triklosan (TRC) ve klorhekzidinin (CHX) için ayrı ayrı olmak üzere minimum inhibitör konsantrasyon (MİK) değerleri, minimum fungisidal konsantrasyon (MFK) değerleri elde edilmiştir. Bu değerler grafik üzerinde yerleştirilerek kökenlerin çoğunluğunun toplandığı Epidemiyolojik Sınır Değeri (Epidemiologic cut off value=ecoff) belirlenmiştir. Bu deneyde biyosid çalışmalarını düzenleyen CEN tarafından kalite kontrol kökeni olarak önerilen Candida albicans ATCC kullanılmıştır.
47 30 Mikrodilüsyon yönteminde, Mueller Hinton sıvı besiyeri (Himedia, Hindistan) kullanılmıştır. Mueller-Hinton sıvı besiyeri üretici firmanın önerileri doğrultusunda hassas terazide tartılmış, distile su içinde çözüldükten sonra otoklavda steril edilmiştir. Toz hammadde olarak sağlanan benzalkonium klorürün (Sigma, Danimarka) 256 miligram/litre (mg/l) stok konsantrasyonlarının hazırlanması için 0,0128 gr BNZ tartılmış ve 50 mililitre distile suda çözerek stok solüsyonlar elde edilmiştir. Stok solüsyonlar kullanılıncaya kadar +4 o C de saklanmıştır. 96 kuyucuklu U-tabanlı plağın bütün kuyucuklarına 100 er μl Muel ler Hinton sıvı besiyeri eklenmiştir. Daha sonra 256 mg/l stok BNZ solüsyonlarından 0, mg/l seri sulandırımı yapılmıştır. 0,5 Mc Farland bulanıklığındaki maya süspansiyonu hazırlandıktan sonra negatif kontrol kuyucukları hariç 10 er μl bütün kuyucuklara eklenmiştir. Mikroplaklar 37 C de 24 saat inkübe edilmiştir. Gözle üreme saptanmayan en düşük dezenfektan konsantrasyonu MİK olarak belirlenmiştir. Sıvı halde bulunan CHX çözeltisinden (1,06 gr/ml, Sigma-İspanya), 64 mg/l konsantrasyonunun hazırlanması için 0,0015 ml alınarak, distile su ile 50 mililitreye tamamlanmıştır. Daha sonra 96 kuyucuklu U-tabanlı plağın bütün kuyucuklarına 100 er μl Mueller Hinton sıvı besiyeri eklenmiştir. CHX 0, mg/l seri sulandırımı yapıldı. 0,5 Mc Farland bulanıklığındaki maya süspansiyonu hazırlanmıştır. Daha sonra maya süspansiyonundan negatif kontrol kuyucukları hariç 10 er μl ütün b kuyucuklara eklenmiştir. Gözle üreme saptanmayan en düşük dezenfektan konsantrasyonu MİK olarak belirlenmiştir. Solüsyon halindeki sodyum hipoklorit in %10-15 (Sigma-ABD) mg/l stok konsantrasyonlarının hazırlanması için 9 ml alıp distile su ile 50 ml ye tamamlanmıştır. Daha sonra 96 kuyucuklu U-tabanlı plağın bütün kuyucuklarına 100 er μl Muel ler Hinton sıvı besiyeri eklenmiştir. SHC mg/l seri sulandırımı yapılmıştır. 0,5 Mc Farland bulanıklığındaki maya süspansiyonu hazırlanmıştır. Daha sonra maya süspansiyonundan negatif kontrol kuyucukları hariç 10 er μl bütün kuyucuklara eklenmiştir. Gözle üreme saptanmayan en düşük dezenfektan konsantrasyonu MİK olarak belirlenmiştir. Toz olarak bulunan triklosan (Sigma-Hindistan) 16mg/L stok konsantrasyonlarının hazırlanması için 0,0016 gr tartıp 100 ml DMSO da çözülmüştür. Daha sonra 96 kuyucuklu U-tabanlı plağın bütün kuyucuklarına 100 er μl Muel ler Hinton sıvı besiyeri
48 31 eklenmiştir. TRC 0, mg/l seri sulandırımı yapılmıştır. 0,5 Mc Farland bulanıklığındaki maya süspansiyonu hazırlanmıştır. Daha sonra maya süspansiyonundan negatif kontrol kuyucukları hariç 10 er μl bütün kuyucuklara eklenmiştir. Gözle üreme saptanmayan en düşük dezenfektan konsantrasyonu MİK olarak belirlenmiştir Biyosidlerin aktivite deneyi Test edilen biyosidin MİK değeri ECOFF değerinin üzerinde olduğunda o köken duyarlılık azalmış veya dirençli köken olarak ayrıldı. Bu fenotipteki kökenlere Comité Européen de Normalisation (CEN) tarafından mantarlar için standardize edilen kantitatif süspansiyon testi (UNI EN 13624) ve kantitatif taşıyıcı testi (EN 14562) uygulanmıştır. Mikrodilüsyon testi sonuçlarına göre biyosid duyarlılığının azalmış olduğu belirlenen kökenlere karşı biyosidlerin aktivitelerinin değişip değişmediği belirlenmiştir. Bu deneyde biyosid duyarlılığı iyi bilinen referans köken Candida albicans ATCC kullanılmıştır. Kantitatif süspansiyon testi Kantitatif süspansiyon test yönteminde, maya süspansiyonu hazırlanır ve kirletici madde ile karıştırıldıktan sonra sert su içerisinde dilüe edilmiş dezenfektanla muamele edilmiştir. Belirli temas sürelerinin ardından bu karışımdan belli miktarda alınır ve dezenfektan etkisini durdurmak için nötralizör içine konulmuştur. Farklı konsantrasyondaki (MİK değeri, bir altı ve bir üstü) dezenfektanlarla muamele edilen maya süspansiyonları temas sürelerinin sonunda pasajlanarak inkübasyona bırakılmıştır saat sonra oluşan koloniler sayılımıştır. Örnekte canlı kalan maya sayısı belirlenerek logaritmik azalma hesaplanmıştır. Yüzey dezenfeksiyonunda, dezenfektanın etkili kabul edilmesi için canlı maya sayısında en az 5 log azalma olması gerekmektedir. Kantitatif süspansiyon testinde kullanılan solüsyonlar: Dilüentin hazırlaması -Tripton -Sodyum klorür -Distile Su Otoklavda sterilize edilmiştir. 1,0 g 8,5 g 1000 ml
49 32 Nötralizörün hazırlaması -Tween g -Saponin 30 g -L-histidin 1 g -Lesitin 3 g -Sodyum Tiyosülfat 5 g 1000 ml dilüent veya 0,0025 mol/l fosfat tamponu içinde hazırlanmıştır. Sert suyun hazırlaması Solüsyon A -MgCl2 19,84 g -CaCl2 46,24 g -Distile su 1000 ml Otoklavda sterilize edilir, buzdolabında en fazla 1 ay saklanarak kullanılmıştır. Solüsyon B -NaHCO3 35,02 g -Distile su 1000 ml Filtrasyon ile sterilize edilir, buzdolabında en fazla 1 hafta saklanarak kullanılmıştır. Sert su çalışma solüsyonu - Solüsyon A 6 ml -Solüsyon B 8 ml -Distile su 1000 ml ph 7 olmalıdır. Her çalışma öncesi aseptik koşullarda taze olarak hazırlanmış ve 12 saat içinde kullanılmıştır. Deneylerde kullanılan kirletici maddenin hazırlanması Temiz koşullar için 0,3 gr sığır albümini 100 ml dilüent içerisinde çözülerek hazırlanmıştır. Membran filtrasyonu ile sterilize edilmiştir. Test kirli koşullarda yapılacaksa 3 gr sığır albümini 97 ml dilüent içinde hazırlanmış ve 3 ml yıkanmış insan eritrosit süspansiyonu ile karıştırılmıştır. Bu karışım filtre edilerek buzdolabında 1 ay saklanabilmektedir.
50 33 Yıkanmış insan eritrositi elde etmek için 8 ml insan eritrositi süspansiyonu 800 g de 10 dk çevrilir ve 3 kez dilüent ile yıkanarak hazırlanır. Bundan 3 ml alınarak 97 ml sığır albümin solüsyonu ile karıştırılır ve %3 lük süspansiyonu elde edilir. Maya süspansiyonları Kökenler malt ekstrakt agar plaklarına pasajlanarak stok kültürleri yapılmıştır. Bu stok kültürden tekrar MEA plaklarına pasaj yapılarak ikinci subkültürler elde edilmiştir. Çalışmada ikinci veya üçüncü subkültürler kullanılmıştır. Çalışma için her bir kökenden iki farklı maya süspansiyonu hazırlanmıştır: Test süspansiyonu; dezenfektan duyarlılık testlerini yürütmede kullanılan maya süspansiyonudur. Validasyon süspansiyonu; kontrol deneylerinde kullanılan maya süspansiyonudur. Test süspansiyonunun hazırlanması (N) : Malt ekstrakt plaklarında üreyen maya kolonilerinden öze ile birkaç koloni alınarak cam tüp içerisindeki dilüent içinde süspanse edilmiş ve mekanik karıştırıcı ile karıştırılarak homojen maya süspansiyonu elde edilmiştir. Bu süspansiyondaki maya sayısı 1,5x10 7 5,0x10 7 koloni oluşturan birim/mililitre (CFU/ml) arasında olmalıdır. Çalışmada test süspansiyonundaki canlı maya sayısını belirlemek için 2 ml dilüent içinde hazırlanan test süspansiyonundan 100 mikrolitre (μl) alınarak 4900 μl dilüent içine konmuş (1/50 dilüsyon), buradan 100 μl al ınarak 4900 μl dilüent içine aktarılmış (tekrar 1/50 dilüsyon), buradan da 100 μl alınarak y ine 4900 μl dilüent içine konmuş (tekrar 1/50 dilüsyon). Son dilüsyondan 100 μl alınıp MEA plaklarına ekimi yapılmıştır saatlik inkübasyondan sonra oluşan maya kolonileri sayılmıştır. Çıkan sayı 1,25x10 6 ile çarpıldığında test süspansiyonunda bulunan canlı maya sayısı hesaplanmıştır.
51 34 Şekil 3.1. Test süspansiyonun hazırlanışı Validasyon süspansiyonunun hazırlanması (Nv) Kontrol deneylerinde kullanılan maya süspansiyonudur. Test süspansiyonunun (N) seyreltilmesi ile hazırlanmıştır. Bunun için test süspansiyonundan 100 μl alınıp 4900 μl dilüent içeren tüpe konmuş, bu tüpten 50 μl alınmış ve 4950 μl dilüent içeren bir başka tüpe konulmuştur. (1/5000 dilüsyon). Validasyon süspansiyonundaki maya sayısı 2.4x10 3 8x10 3 CFU/ml arasında olmalıdır. Validasyon süspansiyonunda bulunan canlı maya sayısını hesaplamak için Nv tüpünden 100 μl alınır ve 900 μl dilüent içine konmuştur. Buradan 100 μl alınarak MEA plaklarına yayılmıştır. İnkübasyonun ardından plaklarda sayılan maya koloni sayısı 100 ile çarpılır ve Nv değeri bulunur. Kontrol deneyleri Dezenfektan duyarlılık testlerinde kullanılan sert su, kirletici madde ve nötralizörün etkilerini kontrol etmek için uygulanan deneylerdir.
52 35 Deneysel Şartların Kontrolü A Deneyde kullanılan ürün ve dezenfektan dışındaki koşulların (kirletici madde, sert su) C. albicans üzerine öldürücü etkisinin olup olmadığının gösterilmesi için yapılmıştır. Deney için bir tüpe 100 μl validasyon süspansiyonu (Nv) ve 100 μl kirletici madde konulmuştur. 2 dakika beklendikten sonra üzerine 800 μl sert su eklenmiştir. 5 dakika sonra bu tüpten 100 μl alınarak MEA plaklarına ekim yapılmıştır. İnkübasyon süresinin sonunda oluşan koloni sayısı hesaplanmış ve çıkan sayı 100 ile çarpılmıştır. Kontrol deneyi A sonunda canlı maya sayısında azalma olmaması beklenmektedir. Nötralizörün Kontrolü B Nötralizasyonda kullanılan maddelerin mikroorganizmalar üzerine toksik etkisinin olup olmadığının gösterilmesi için yapılan kontrol deneyidir. Kontrol deneyi B de kullanılan maya süspansiyonuna N VB denir. N VB nin değeri 2,4x10 4 ile 8x10 4 hücre/ml arasında olmalıdır. N VB nin hazırlanması için test süspansiyonundan (N) 100 μl alınmış içinde 4900 μl dilüent bulunan tüpe konmuştur. Bu tüpten de 100 μl sıvı alarak içinde 900 μl dilüent bulunan bir başka tüpe aktarılmıştır. Son tüpteki süspansiyon N VB dir. N VB süspansiyonundaki maya sayısının belirlenmesi için bu süspansiyondan 100 μl alarak 900 μl dilüent ile karıştırılmış, bu tüpten 50 μl alınıp 450 μl dilüent içine konmuş, bu tüpten de 50 μl alınıp 450 μ l dilüent içeren tüpe aktarılmış ve son tüpteki sıvıdan 100 μl alınarak MEA plaklarına ekimi yapılmıştır saatlik inkübasyondan sonra koloni sayımı yapılarak elde edilen sayı yapılan dilüsyon miktarı olan 10 4 ile çarpılmış ve böylelikle N VB de bulunan maya sayısı hesaplanmıştır. Kontrol deney B için N VB süspansiyonundan 100 μl alınıp 900 μl nötralizör içeren tüpe konmuştur. Bu tüpten 50 μl alınıp 450 μl nötralizör içeren tüpe konmuştur. Bu tüpten de 50 μl alınıp yine 450 μl nötralizör içeren bir başka tüpe konmuştur. Son tüpteki sıvıdan 100 μl alınıp TSA plaklarına ekim yapılmış ve 24 saatlik inkübasyonun ardından koloni sayımı yapılmıştır. Çıkan sayı yapılan dilüsyon oranı olan 10 4 ile çarpılmıştır.
53 36 Nötralizörün Kontrolü C Deneylerde kullanılan nötralizör maddelerin dezenfektanın etkisini gerçekten sona erdirip erdirmediğinin gösterilmesi için yapılan kontrol deneyidir. Bu deney için bir tüp içine 100 μl kirletic i madde ve 100 μl dilüent konmuştur. 2 dakika beklendikten sonra tüpe 800 μl dezenfektan eklenmiş ve 5 dakika beklenmiştir. 5. dakikadan sonra bu tüpten 100 μl sıvı alınarak içinde 800 μl nötralizör bulunan tüpe aktarılmış ve tekrar 5 dakika bekletilmiştir. Daha sonra bu tüpün üzerine 100 μl Nv süspansiyonundan eklenerek 30 dakika inkübasyona bırakılmıştır. Sürenin sonunda son tüpten 50 μl alınarak MEA plaklarına ekim yapılmış ve 24 saatlik inkübasyona bırakılmıştır. Koloni sayımı yapılmış ve çıkan sayı 200 ile çarpılmıştır. Elde edilen bu sayının 0,5x Nv ye eşit veya büyük olması gerekmektedir. Kantitatif süspansiyon test yönteminin uygulanması Test süspansiyonundan (N) 100μl alınmış ve içinde 100 μl kirletici madde bulunan tüpe konularak 2 dakika beklenmiştir. Daha sonra üzerine 800 μl dezenfektan solüsyonu eklenmiştir. Bu tüpten 1, 5 ve 30. dakikalarda olmak üzere üç kez 100 er μl alınarak içinde 800 μl nötralizör ve 100 μl sert su bulunan tüplere aktarılmıştır. 5 dakika beklendikten sonra bu tüplerden 100 er μl alın arak MEA plaklarına ekim yapılmış ve inkübasyon süresi sonunda koloni sayımı yapılmıştır. Koloni sayısı yapılan dilüsyon miktarı olan 100 ile çarpılmıştır. Çıkan sayı 1,5 x x 10 2 hücre/ml arasında olmalıdır. Şekil 3.2. Kantitatif test yönteminin uygulanışı
54 37 Testin değerlendirilmesi Test yönteminde maya süspansiyonu (N) 1,5x10 7-5x10 7 hücre/ml olarak hesaplanmış ve bu süspansiyon deneylerde kullanılmıştır. Test prosedürüne göre maya süspansiyonundan alınan 100 μl, 100 μl kirletici madde ve 800 μl dezenfektan ile muamele edilmektedir. Bu aşamada süspansiyonda bulunan maya miktarı dilüsyon nedeniyle 10 kat azalmakta ve çalışma süspansiyonunda bulunan CFU sayısı 1,5x10 6-5x10 6 arasında olmaktadır. Bu dezenfektanla karşılaşan maya süspansiyonudur. Bu karışımdan 100 μl alınıp 800 μl nötralizör ve 100 μl sert su içine konulduğunda 10 kat daha dilüsyon yapılmış olmaktadır. Bu son dilüsyondan 100 μl alınıp plaklara ekildiği için 10 kat dilüsyon yapılmıştır. Plaklarda üreyen koloni sayıldığında dilüsyon oranı olan 100 ile çarpılmıştır. Çalışma süspansiyonundaki sayı (1,5x10 6-5x10 6 ) ile elde edilen sayı arasındaki farkın 10 5 ten daha düşük olması dezenfektanın mikroorganizma üzerine etkili olmadığını göstermektedir. CFU sayısında 5 log veya daha fazla düşüş olması dezenfektanın etkili olduğunu göstermektedir. Kantitatif taşıyıcı testi: Kantitatif taşıyıcı test yönteminde ise, maya test süspansiyonu kirletici madde içinde hazırlanmış ve taşıyıcı cam lama yayılmıştır. Taşıyıcı kuruduktan sonra dezenfektan içine daldırılmıştır. Taşıyıcı ürün içinde toplam 60 dakika inkübe edilmiştir. Bu temas süresi sonunda taşıyıcı cam boncuk içeren nötralizan içine aktarılmıştır. Sallanarak maya hücrelerinin yüzeyden ayrılması sağlanmıştır. Canlı kalmış hücreler sayılımıştır. Canlı kalmış hücreler belirlendikten sonra redüksiyon miktarı saptanmıştır. Koloni sayılarında dezenfektan ile muamele edildikten sonra 4 log veya daha fazla azalma bulunursa, kökenin dezenfektana karşı duyarlı olarak kabul edilmiştir. Kantitatif taşıyıcı testinde kullanılan solüsyonlar: Dilüentın hazırlaması -Tripton -Sodyum Klorür -Distile Su Otoklavda sterilize edilmiştir. 1,0 g 8,5 g 1000 ml
55 38 Nötralizörün hazırlaması -Tween g -Saponin 30 g -L-histidin 1 g -Lesitin 3 g -Sodyum tiyosülfat 5 g 1000 ml dilüent veya 0,0025 mol/l fosfat tamponu içinde hazırlanmıştır. Sert suyun hazırlaması Solüsyon A -MgCl2 19,84 g -CaCl2 46,24 g -Distile su 1000 ml Otoklavda sterilize edilmiş, buzdolabında en fazla 1 ay saklanarak kullanılmıştır. Solüsyon B -NaHCO3 35,02 g -Distile su 1000 ml Filtrasyon ile sterilize edilmiş, buzdolabında en fazla 1 hafta saklanarak kullanılmıştır. Sert su çalışma solüsyonu - Solüsyon A 6 ml -Solüsyon B 8 ml -Distile su 1000 ml ph 7 olmalıdır. Her çalışma öncesi aseptik koşullarda taze olarak hazırlanmış ve 12 saat içinde kullanılmıştır. Deneylerde kullanılan kirletici maddenin hazırlanması Temiz koşullar için 0,3 gr sığır albümini 100 ml dilüent içerisinde çözülerek hazırlanmıştır. Membran filtrasyonu ile sterilize edilmiştir. Test kirli koşullarda yapılacaksa 3 gr sığır albümini 97 ml dilüent içinde hazırlanmış ve 3 ml yıkanmış insan eritrosit süspansiyonu ile karıştırılmıştır. Bu karışım filtre edilerek buzdolabında 1 ay saklanabilmektedir.
56 39 Yıkanmış insan eritrositi elde etmek için 8 ml insan eritrositi süspansiyonu 800 g de 10 dk çevrilir ve 3 kez dilüent ile yıkanarak hazırlanır. Bundan 3 ml alınarak 97 ml sığır albümin solüsyonu ile karıştırılır ve %3 lük süspansiyonu elde edilir. Cam malzemeler: - Petri plaklar 9-10 cm - Cam boncuklar 0,25-0,5 mm - Bir tarafı buzlu lam 1,5 x 6 cm Cam malzemeler Pastör fırınında sterilize edilmiştir. Test süspansiyonunun hazırlanması (N) 5 ml dilüent 2,5 gr cam boncuk içeren 50 ml lik bir cam flask içine konmuştur. Bir öze dolusu maya kültüründen alınmış dilüent içinede süspanse edilmiştir. Flask 3 dakika mekanik karıştırıcıda çalkalanmıştır. Daha sonra süspansiyonu aspire edilerek bir tüpe aktarılmıştır. Süspansiyondaki hücre sayısı dilüent ile 1,5x10 8 5,0x10 8 CFU/ ml arasında ayarlanmıştır. Taşıyıcıların inokülasyonu 1 ml kirletici maddeden bir tüpe konmuştur. Üzerine 9 ml. test süspansiyonu (N) eklenmiştir. Karışımdan 50 µl alıp taşıyıcıdaki inokülasyon alanına yayılmıştır. Taşıyıcı C de kurutulmuştur. Kurutma sonrası hemen kullanılmıştır.
57 40 Şekil 3.3. Taşıyıcı inokülasyonunun hazırlanması Kantitatif taşıyıcı test yönteminin uygulanması 20 ml dezenfektandan bir tüpe konmuştur. İnoküle edilmiş olan taşıyıcı lam tüpe daldırılmıştır. İnokülasyon karesinin dezenfektan ile tamamen kaplandığından emin olunmuştur. Ardından temas süreleri ( 1 dk, 5 dk ve 30 dk) hesaplanmaya başlanmıştır. Temas süresi sonunda taşıyıcı lam 20 ml nötralizan ve 2 ml cam boncuğu içeren başka bir tüpe aktarılmış ve 5 dakika bekletilmiştir. İnkübasyondan sonra örnekten 1 ml alınmış ve MEA besiyerine ekim yapılmıştır. Şekil 3.4. Kantitatif taşıyıcı test yönteminin uygulanışı
58 41 Hesaplamalar Vc değerinin hesaplanması: Agar plaklarındaki maya kolonilerin normal sayım limitleri dür. Her bir 1 ml örnek için birden fazla MEA plak kullanıldı ise, her plakta üreyen kolonilerin sayısı belirlenip toplayarak Vc değeri hesaplanmıştır. Nw değeri, temas süresi sonunda nötralizasyon öncesinde test karışımının ml sindeki hücre sayısını gösterir, Nw değeri şu formülle hesaplanır: Nw = Vc değerlerin toplamı (c) x 10. Na değeri temas süresi sonunda ve nötralizan eklenmesinden önceki test karışımının 1 ml sindeki hücre sayısını gösterir. Na değerinin hesaplanması şu formülle hesaplanır: Vc değerlerin toplamı (c) x 10/ petri sayısı (n). Yukardaki değerler belirlendikten sonra redüksiyon miktarı şu formülle hesaplanır: R= Nw /Na.
59 Membran geçirgenlik deneyi Fenotipik olarak duyarlı ya da dirençli olarak ayrılan kökenlerin membran geçirgenliğinin araştırılması için kristal viyole deneyi yapılmıştır [76]. Sabouraud dekstroz sıvı besiyerinde bir gecelik inkübasyon ile üretilen C. albicans kültüründen %0,9 luk NaCl ün mililitresinde 10 6 koloni oluşturan ünite (CFU/ml) hücre içerecek şekilde süspansiyonlar hazırlanmıştır. Her biyosid için MİK değeri kadar, MİK değerinin iki altında ve iki üstündeki dilüsyon değeri kadar olmak üzere toplam beş ayrı dilüsyon test edilmiştir. Her biyosidin beş ayrı dilüsyonu 10 6 CFU/ml maya içeren tüp içine eklenmiştir. Biyosid ve mayanın serum fizyolojik içindeki karışımı bir gece 37 C de inkübe edilmiştir. Biyosid eklenmemiş hücre süspansiyonları negatif kontrol olarak, hücre membranına etkili antifungal olan nistatin eklenmiş maya süspansiyonları da pozitif kontrol olarak kullanılmıştır. İnkübasyon sonrasında süspansiyon içeren tüpler 9,300 xg devirde 5 dakika santrifüj edilmiştir. Oluşan çökelek üzerine % 0,9 NaCl içinde eritilmiş 10 µg/ml kristal viyole eklenmiştir. Bu boyalı karışım 37 C de 10 dakika inkübasyondan sonra tekrar 13,000 xg devirde 15 dakika santrifüj edilmiştir. Üst sıvılar 96 kuyucuklu plağa alınmıştır. Kuyucukların optik dansiteleri 590 dalga boyunda okunmuştur. Sadece kristal viyole içeren kuyucuk %100 olarak kabul edilerek aşağıdaki formüle göre her bir örnek için kristal viyole alım (up take) yüzdesi hesaplanmıştır. Alım yüzdesi = (Örneğe ait OD / kristal viyole solüsyonunun OD değeri) X Atım pompalarının biyosid metabolizmasında rolünün anlaşılması için rodamin geri alım çalışması Mantar hücresinde kimyasalların ve ilaçların hücre dışına atımından (efflux) sorumlu iki tip atım pompası tanımlanmıştır. Bunlar C.albicans Cdr1p ve Cdr2p pompalarının bulunduğu ABC taşıyıcı ailesi ve C.albicans Mdr1p pompasının bulunduğu major kolaylaştırıcı protein MFC ailesidir. Maesaki ve ark. tarafından 1999 yılında tanımlanmış eski ama klasik bir yöntem olan rodamin 6G (R6G) protokolüne göre, maya yüzeyinde bulunan atım pompalarının enerjiye bağımlı atım süreçleri kantitatif olarak incelenmiştir. R6G kullanılarak sadece ABC taşıyıcı ailesi üyesi CDR1 ve CDR2 genlerinin artmış ekspresyonu gösterilebilmektedir. Bu floresan madde Mdr1p proteini ile bağlanmaz. Enerji kaynağı olarak glukoz kullanıldığında atımın nasıl değiştiği spektrofotometrik olarak
60 43 ölçülmüştür. Bu yöntem için, bir gecelik inkübasyon ile sıvı besiyerinde üretilmiş olan biyosid dirençli ve duyarlı C. albicans kültüründen alınan hücreler ayrı ayrı sayılarak 10 ml taze SDB sıvı besiyeri içinde 10 6 hücre olacak şekilde sayılmıştır. Hücreler 5 saat boyunca çalkalayarak 37 C de inkübe edilmiştir. İnkübasyon sonrasında 3000 xg devirde 5 dk santrifüj edilmiştir. Çökelek PBS (Phosphate Buffered Saline) ile iki kere yıkanmıştır. Hücreler PBS içinde tekrar süspanse edilmiş, 10 ml PBS içinde 10 6 hücre olacak şekilde konsantrasyon düzenlenmiştir. Çalkalayarak 1 saat 37 C de inkübe edilmiştir. Hücrelerin üzerine 10 µl R6G solüsyonundan (son konsantrasyon 0,5 M) eklenmiştir. Bir kere daha 37 C de 30 dk süre ile inkübe edilmiştir. Karışımdan 1 ml santrifüj tüpüne aktarılmıştır. Kalan 9 ml hücre süspansiyonu iki ayrı 15 ml lik santrifüj tüpüne paylaştırılmıştır. Kontrol tüpü olacak bir tanesine 500 µl PBS, deney tüpü olacak diğerine 500 µl glukoz solüsyonu (son kansantrasyon 10 mm) eklenmiştir. Karışımlar 37 C de 30 dk süre ile inkübe edilmiştir. Her 15 ml lik tüpten 1 ml alarak mikrosantrifüj tüpüne aktarılmıştır. Mikrosantrifüj tüpleri 10,000 xg devirde 1 dk süre ile santrifüj edilmiştir. Üst sıvılar hemen temiz mikroplaklara aktarılmıştır. Kuyucuk içindeki sıvılar OD 527 nm de okunmuştur. R6G nin 0 ile 5 M arasındaki konsantrasyonlarının OD değerleri ölçülerek bir standart eğri oluşturulmuştur. Bilinmeyen R6G miktarı bu standart eğriye göre hesaplanmıştır. Glukoz eklenmeden önceki R6G tutulumu ile eklendikten sonraki tutulum karşılaştırılmıştır [77]. C.albicans 1x10 8 hücre/10 ml 37 o C de 1 saat inkübasyon 10 µl of R6G (10 µm) 37 o C de 30 dk inkübasyon 1 ml Glukoz PBS Glukoz / PBS Kontrol 1 ml 1 ml R6G geri alımı OD 527 nm R6G effux OD 527 nm Şekil 3.5. Rhodamin 6G (R6G) uygulaması
61 Atım pompası genlerinde CDR ekspresyon artışının ters transkriptaz (reverse transkriptaz) PZR ile gösterilmesi Polimeraz zincir reaksiyonu (PZR) Total RNA nın eldesi Örneklerinden RNA elde edilmesi için EZ-RNA Total RNA izolasyon kiti kullanılmıştır. Üretici firma önerilerine uygun olarak, 100 μl örnek ile çalışılmıştır. Kit içeriğinde bulunan DNaz ile örneklerdeki olası bulaşı engellenmiştir. Elde edilen total RNA miktarları RNA ölçüm cihazında (NanoDrop, ABD) ölçülerek RNA varlığı kayıt edilmiştir. Testin uygulanışı 1. Örnekler 0.5 ml denatürasyon solüsyonu içinde süspanse edilmiştir. 2. Homojenatlar 5 dakika oda ısısında bekletilmiş ve ependorfa konulmuştur. 3. Üzerine 0.5 ml ekstraksiyon solüsyonu eklenmiş ve 15 saniye hafifçe çalkalanmıştır. 4. Oda ısısında 10 dakika bekletilmiş ve 15 dakika, 4 C ve 12,000 xg de santrifüj edilmiştir. 5. Yeni ependorfa üst fazı alınmıştır. 6. Protokolün 3., 4. ve 5. basamakları tekrarlanmıştır. 7. Üzerine 0,5 ml izopropanol eklenip, karıştırılmış ve oda ısısında 10 dakika bekletilmiştir. 8. Sekiz dakika, 4 C ve xg de santrifüj edilmiştir. 9. Örnekler -20 C de 30 dakika bekletilmiştir. 10. Süpernatant tek seferde hızlı bir şekilde dökülmüştür. 11. Pellet kısmı 1ml % 75 lik alkol ile yıkanmıştır. 12. Beş dakika, 4 C de ve 7500 xg de santrifüj edilmiştir. 13. Pipetle süpernatant atılmıştır. 14. Pellet 5 dakika havada kurutulmuştur. 15. Pellet üzerine 100 μl, 0,1 mm EDTA lı serum fizyolojik solüsyonu eklenmiştir. 16. On beş dakika, 55 C de kuru blokta inkübe edilmiştir.
62 Tüm RNA örnekleri çoğaltma işlemine kadar -80 C de bekletilmiştir. Ters transkriptaz PZR (RT-PZR) ile cdna eldesi Total RNA dan komplementer DNA (cdna) elde edilmesi için Transcriptor First Strand cdna Synthesis Kit for RT-PZR (Roche, Almanya) kullanılmıştır. Birinci karışım (1X) için: Çizelge 3.1. PZR Reaksiyon Karışımı (1. Tur) (1X için) Bileşen Miktar RNA 2 µl Anchored primer 1 µl Su 8.4 µl Total hacim 11.4 µl Çizelge 3.2. PZR Reaksiyon Karışımı (2. Tur) (1X için) Bileşen Miktar Transkriptör ters transkriptaz reaksiyon tamponu (5X) 4 µl RNAaz inhibitörü 0.5 µl Deoksinükleotid karışımı (10mM) 2 µl DTT 1 µl Transkriptör ters transkriptaz 1.1 µl Son Hacim 20 µl Testin uygulanışı 1. Ependorflara, hazırlanan ilk reaksiyon karışımından 13 er μl dağıtılmıştır. Nazikçe santrifüj yapılmıştır. 2. Ependorf içerisindeki 1. Reaksiyon karışımı, kuru blokta C de 6510 dk inkübe edilmiştir. Örnekler santrifüj edilmiştir. 3. Ependorflar hızlı bir şekilde buza yerleştirilmiştir ve buz üzerinde ependorflara 2. Reaksiyon karışımından 7 şer μl eklenmiştir. Örnekler santrifüj edilmiştir. 4. Ependorf içerisindeki reaksiyon karışımı, kuru blokta 55 C de 30 dk inkübe edilmiştir.
63 46 5. Örnekler kuru blokta 55 C'den sonra 85 C de 5 dk inkübe edilmiş ve buz üzerine konmuştur. 6. Elde edilen cdna'lar spin santrifüj edilmiş ve Nanodrop ND 1000 UV-Vis (Thermo Scientific, ABD) cihazı ile miktarlarının belirlenmesi amacıyla ölçülmüştür. 7. Daha sonra kullanılmak üzere -20 C' de saklanmıştır. Atım pompalarının ekspresyon artışının PZR ile gösterilmesi Elde edilen cdna lar konvansiyonel PZR ile çoğaltılmıştır. Çoğaltma işleminde CDR1 ve ERG11 ayrı ayrı hedeflenmiştir. Çalışmada kullanılan primer dizileri çizelge 3.3 te verilmiştir. Çizlge 3.3. Çalışmada kullanılan primer dizisi Primeler CDR1 Forward CDR1 Revers ERG11 Forward ERG11 Revers 5-3 yönünde dizi TGTGTACTATCCATCAACCATCAGC CACCAAAATAAGCCGTTCTACCA TTTGGTGGTGGTAGACATA GAACTATAATCAGGGTCAGG PZR reaksiyon karışımı Her bir örnek için numaralandırılmış steril 0,2 ml lik PZR tüplerine, DNA örneğinden 5 μl eklendikten sonra hazırlanan PZR reaksiyon karışımı 20 μl dağıtılmış ve spin santrifüj yapıldıktan sonra ısı döngü cihazına yerleştirilmiştir. Çizelge 3.4. Amplifikasyon karışımı (1X için) 10X PZR tamponu 2µl MgCl 2 (2.5mM) 2,5 µl dntp (10mM) 0,1 µl Primer Forward(100pmol) 0,1 µl Primer Rrvers (100pmol) 0,1 µl Taq polimeraz 0,2 µl su 15 µl cdna 5 µl
64 47 Amplifikasyon şartları Çalışmada CDR1 ve ERG11 kodlayan bölgelerin amplifikasyonu için kullanılan PZR amplifikasyon şartları çizelge 3.5 ve da verilmiştir. Çizelge 3.5. CDR1 gen böleglerinin amplifikasyonu için reaksiyon şartları Reaksiyon aşaması Sıcaklık Süre Döngü sayısı Ön ısıtma 95 C 5 dakika Denetürasyon 94 C 30 saniye Primer bağlanması 55 C 45 saniye 45 Uzama 72 C 1 dakika Son uzama 72 C 7 dakika Saklama 4 C - Çizelge 3.6. ERG11 gen böleglerinin amplifikasyonu için reaksiyon şartları Reaksiyon aşaması Sıcaklık Süre Döngü sayısı Ön ısıtma 95 C 5 dakika Denetürasyon 94 C 30 saniye Primer bağlanması 58 C 45 saniye 45 Uzama 72 C 1 dakika Son uzama 72 C 7 dakika Saklama 4 C - Isı döngü cihazında çoğaltılmış olan PZR ürünleri %2 lik agaroz jelde yürütülerek amplifikasyonun başarılı olup olmadığı kontrol edilmiştir. PZR ürünlerinden 9 er μl alınarak 3 μl yükleme tamponuyla karıştırılarak yüklenmiştir. Jelin ilk kuyucuğuna moleküler ağırlık standardı yüklenmiştir. Elektroforez yürütme tamponu olarak 1X TBE (Tris-Borik asit-edta) kullanılmıştır. Elektroforez işlemi sonrasında jel 0,5 μg/ml etidyum bromür içeren 1X TBE çözeltisinde 30 dakika boyandıktan sonra UV translimunatör üzerine aktarılan jel UV ile görüntülenmiştir. Görüntüler kamera kullanılarak kaydedilmiştir (Syngene Bio Imaging, Ingenius, İngiltere). Elde edilen sonuçlar DNA moleküler ağırlık standardı ile karşılaştırıldığında 93 veya 134 baz çifti ağırlığında bant görülen kökenler CDR1 veya ERG11 pozitif olarak değerlendirilmiştir.
65 Elektroforez için kullanılan solüsyonlar 5X Tris-Borik asit-edta (TBE) tamponunun hazırlanışı Tris-Base Borik Asit EDTA (0,5 M, ph: 8,0) 54 g 27,5 g 20 ml Kimyasallar çözündükten sonra distile su ile 1L ye tamamlanmıştır. ph 8,0 e ayarlanarak oda ısısında saklanmıştır. Elektroforez yürütme tamponu (1X TBE) 5X TBE stok tampon solüsyonundan alınan bir hacim, dört hacim distile su ile karıştırılmıştır. Böylece agaroz jel hazırlanmasında ve elektroforez işleminde gerekli olan 1X TBE tamponu hazırlanmıştır. Etidyum bromid (Et-Br) çözeltisi hazırlanışı 10 mg etidyum bromid 1 ml distile suda çözülerek hazırlanmış ve +4 ºC de saklanmıştır. Agaroz jel hazırlanışı (% 2) Elektroforez için %2 lik agaroz jelin hazırlanmasında, 2 g agaroz tartılarak 1X TBE tamponu ile 100 ml ye tamamlanmıştır ve mikrodalga fırında homojen bir şekilde şeffaf hale gelinceye kadar ısıtılmıştır. Jel tarağı yerleştirilerek jel tepsisine dikkatlice döküldükten sonra yaklaşık 30 dakika oda ısısında beklenerek jelin katılaşarak donması sağlanmıştır. Daha sonra jel içerisinden tarak çıkartılarak elektroforez tankına yerleştirilmiştir.
66 Virülans deneyleri Biyosid duyarlı ve dirençli kökenlerin hemolitik aktivite, salgısal asit proteinaz, fosfolipaz, esteraz, slaym faktör oluşturma özellikleri araştırılmıştır. Klasik virülans deneyleri için besiyerleri kullanılarak virülans faktörlerinin varlığı veya yokluğu not edilmiştir. Salgısal Asit Proteinaz ( SAP) Deneyi Deneyde salgısal asit proteinaz varlığının gösterilmesi için, sığır serum albumin agar (SSAA) besiyeri kullanılmıştır. 100 ml lik besiyerinin hazırlanışı; - Glukoz 2 gr - KH 2 PO gr - MgSO 4 7H 2 O Agar 2 gr - Distile su 100 ml Besiyeri karışımı otoklavda 121 C de 15 dakika sterilize edilmiştir. Besiyerinin ph sı 5,0 e ayarlanmıştır. Ayrıca temel besiyerine eklenecek olan protein çözeltisi hazırlanmıştır. Protein çözeltinin hazırlanışı; - Sığır serum albumin (Fraksiyon V) 1 gr - Distile su 100 ml Protein çözeltisini hazırladıktan sonra 0,2 µm çapındaki membran filtre ile steril edilmiştir. Otoklavdan çıkan besiyeri C ye kadar soğutulmuş ve % 20 oranında protein çözeltisini ekleyerek 9 cm lik petri kaplarına 25 er ml dökülmüştür. Triklorasetik asit kullanımlı SAP deneyinin yapılışı Test edilen C. albicans kökenleri SDA besiyerine pasajlanarak 37 C de 24 saat inkübe edilmiştir. Üreyen C. albicans kökenleri, steril distile su ile 0,5Mc Farland (10 8 maya/ ml)
67 50 olacak şekilde ayarlanmıştır. Bundan sonra Sığır serum albumin agar (SSAA) besiyerine 10 µl maya süspansiyonundan akıtılmış ve 37 C de 10 gün bekletilmiştir. İnkübasyondan sonra, besiyerinin üzerini örtecek şekilde % 20 triklorasetik asit eklenmiş ve 20 dakika bekletildikten sonra dökülmüştür. Plaklar PBS ile yıkanmıştır. Plaklar yıkandıktan sonra % 0.06 amidoblack boyası ile 10 dakika boyanmıştır. Daha sonra çözücü (45:10:45 oranlarında metanol, asetik asit, distile su) ile yıkanarak amidoblack boyası çıkarılmıştır. Plaklar PBS ile tekrar yıkanmış ve kurumaya bırakılmıştır. Koloni etrafında şeffaf zonu olmayanlar negatif ve etrafında şeffaf zon olan koloniler ise pozitif olarak değerlendirilmiştir [78]. Fosfolipaz Deneyi Fosfolipaz enziminin saptanması için, yumurta sarılı agar (YSA) besiyeri kullanılmıştır. 100 ml lik besiyerinin hazırlanışı: - NaCl 5.84 gr - CaCl gr - SDA 6.5 gr - Distile su 100 ml Besiyeri karışımı otoklavda 121 C de 15 dakika sterilize edilmiştir. Besiyerinin ph sı 5,0 e ayarlanmıştır. Besiyerine eklenecek olan yumurta sarısı 1000 xg de dakika santrifüj edilmiştir. Üsteki sıvı atılmış ve çökeltiye distile su eklenerek ilk hacmine getirilmiştir. 50 C ye kadar soğutulmuş temel besiyerine % 8 steril yumurta sarısı eklenmiştir. Eşit miktarda sitrik asit ve disodyum hidrojen tamponu eklenerek, besiyeri ile karıştırılmıştır. ph 4,3 e ayarlanmıştır. Hazırlanan YSA besiyeri steril plaklara dökülmüştür. Fosfolipaz deneyin yapılışı SDA ya pasajlanarak 37 C de 24 saat inkübe edilen kökenlerin distile su ile 0,5 Mc Farland süspansiyonları hazırlanmıştır. Bu süspansiyonların 10 µl si her plağa 2 örnek olacak şekilde ekimler yapılmıştır. Plaklar 37 C de nemli ortamda 4 gün bekletilmiştir.
68 Kolonilerin etrafında, bu süre sonunda meydana gelen belirgin halka şeklindeki presipitasyon zonu ölçümleri yapılmıştır [79]. 51 Esteraz deneyi Esteraz üretiminin gözlenmesi için Tween 80 agar kullanılmıştır. 100 ml lik besiyerinin hazırlanışı: - NaCl 0.5 gr - CaCl gr - Pepton 1 gr - Agar 1,5 gr - Distile su 100 ml hazırlanan besiyeri otoklavda 121 ºC de 15 dak süre ile sterilize edilmiştir. Sterilizasyon sonrasında besiyeri 50 ºC ye soğutulunca içerisine % 0.5 oranında steril Tween 80 (Sigma, ABD) eklenmiştir. Esteraz deneyinin yapılışı SDA da üreyen kökenlerden steril eküvyon çubuğu ile alınarak 1 santimetre (cm) çapında ekilmiştir. Besiyerleri 37ºC de 10 gün inkübe edilmiştir. İnkubasyon süresi içinde ekim etrafında Tween 80 in hidrolizi ile açığa çıkan yağ asidinin kalsiyum ile birleşerek opak kristaller halinde çökmesi; pozitif esteraz aktivitesi olarak değerlendirilmiştir [80]. Hemolitik Aktivite Kökenlerin hemolitik aktivitelerinin gösterilmesi için, % 5 koyun kanlı SDA besiyeri kullanılmıştır. Deneyin yapılışı: SDA da üreyen 24 saatlik kökenlerden % 0,5 lik serum fizyolojik (SF) kullanarak Mc Farland 0,5 e göre süspansiyonları hazırlanmıştır. Her süspansiyondan 10 µl. alınarak
69 52 besiyerine 5 mm çap oluşturacak şekilde ekim yapılmıştır. Plaklar 37 ºC de, % 5 CO 2 li etüvde 48 saat inkübe edilmiştir. Kolonilerin etrafında oluşan saydam halkalar hemoliz zonu olarak değerlendirilmiştir [81]. Biyofilm (slaym) üretimi Slaym faktör üretimini saptamak üzere Christensen yöntemi uygulanmıştır. Test edilecek kökenler SDA besiyerine pasajlayarak 24 saatlik taze kültürleri elde edilmiştir. Her kültürden bir öze dolusu alınarak içinde % 8 glukoz bulunan Sabouraud dekstroz broth (SDB) besiyeri tüplerine ekim yapılmıştır. Etüvde 37 C de 48 saat inkübasyondan sonra tüp içerikleri boşaltılmıştır. İki kez distile su ile yıkanarak tüplerin iç yüzeyi %1 lik safranin ile boyanmıştır. Tüpler ters çevrilerek süzdürülmüştür. İç yan yüzeyinde kırmızı pembe renkli film tabakası oluşması slaym pozitif; tüp duvarında herhangi bir film tabakası oluşmaması negatif olarak değerlendirilmiştir [82] Mini enfeksiyon modeli olarak Galleria mellonella deneyi G.mellonella Larvalarının Elde Edilmesi G. mellonella larvaları, cam kavanozlarda, yarı sentetik besinler kullanılarak 28 C± 2 C, % 60 ± 5 bağıl neme sahip karanlık laboratuvar ortamında yetiştirilmiştir. Stok kültürün devamlılığı G.mellonella ergin dişi ve erkek böceklerin çiftleşmeleri sonucu, besin konulan kavanozlara dişilerin bıraktığı yumurtaların açılması sonucu sağlanmıştır. Resim 3.1. G. mellonella nın cam kavanozlarda üretilmesi
70 53 Deney Besinlerinin Hazırlanması Deneylerde kullanılan G. mellonella larvalarının beslenmesi için yarı sentetik bir ortam hazırlanmıştır. Bu amaçla besin bileşenlerinden kepek, gliserin, bal ve su bir kap içine konulmuş ve iyice homojen bir hale gelinceye kadar karıştırılmıştır. Daha sonra bu karışıma balmumu ilave edilerek karışım homojenliği sağlanmıştır. G. mellonella nın 100 gram yarı sentetik besiyerinin hazırlanışı: Buğday unu Buğday kepeği Süt tozu Ekmek mayası Balmumu Gliserin Bal 22 g 22 g 11 g 5,5 g 17,5 g 11 ml 11 ml Duyarlı, vahşi kökenlerin oluşturacağı enfeksiyonlar ile dirençli kökenlerin oluşturacağı enfeksiyonların model üzerinde karşılaştırılması yapılmıştır. Çalışmada büyük canlı modeller yerine, daha ucuz olan ve model uygulaması kolay olan larva modeli tercih edilmiştir. Galleria mellonella larvası Candida enfeksiyonlarına duyarlı bir mikro canlıdır. Biyosid dirençli ve duyarlı kökenlerin in vitro virülans deneyleri yapıldıktan sonra ayrı ayrı G. mellonella larvasına enjekte edilmiştir. Deney için rastgele seçilmiş ağırlıkları 300 mg civarında olan 10 adet larva kullanılmıştır. Her larvanın arka sol bacak içine Hamilton iğnesi kullanılarak 10 µl maya içeren sıvı doğrudan uygulanmıştır. Enfekte edilen larvalar 30ºC de inkübe edilerek ertesi gün ölü larva sayısı belirlenmiştir (Resim 3.2). Bütün deney en az iki kez tekrar edilmiş canlı larva sayılar ile Kaplan-Meier eğrileri çizilmiştir [83].
71 54 Resim 3.2. Canlı larvalar (solda), enfekte larvalar (sağda) Şekil 3.6. G. mellonella deney protokolü [55].
72 55 4. BULGULAR 4.1. Mikrodilüsyon Sonuçları C. albicans için Epidemiyolojik Sınır Değerin (ECOFF) belirlenmesi için BNZ CHX, TRC ve SHC için ayrı ayrı olmak üzere Minimum İnhibitör Konsantrasyon (MİK) değerleri ve Minimum Fungisidal Konsantrasyon (MFK) değerleri hesaplanmıştır Benzalkonyum klorür için MİK değerleri Çalışmaya dahil edilen toplam 417 C. albicans kökeninin MİK değerleri 1 tanesinde (% 0,23) 0,25 mg/l, 4 tanesinde (% 0,95) 0,5 mg/l, 20 tanesinde (% 4.8) 1 mg/l, 170 tanesinde (% 40,7) 2 mg/l, 205 tanesinde (%49,16) 4 mg/l ve 17 tanesinde ise (% 4) 8 mg/l olarak belirlenmiştir. BNZ için MİK değerlerinin dağılımı şekil 4.1 de gösterilmiştir. BNZ için ECOFF değeri 4 mg/l olarak bulunmuştur Benzalkonyum klorür için MFK değerleri BNZ için MFK değerleri 417 kökeninin 2 tanesinde (% 0,47) 1 mg/l, 46 tanesinde (% 11) 2 mg/l, 154 tanesinde (% 36,9) 4 mg/l, 164 tanesinde (% 39,3) 8 mg/l, 49 tanesinde (%11,7) 16 mg/l ve 2 tanesinde ise (% 0,47) olarak belirlenmiştir. BNZ için MFK değerlerinin dağılımı şekil 4.1 de gösterilmiştir.
73 İzolat sayısı MİK mg/l MİK MFK Şekil 4.1. BNZ nin MİK ve MFK değerlerinin dağılımı, ECOFF= 4mg/L Klorhekzidin diglukonat için MİK değerleri MİK değerlerinin 417 kökenin 3 ünde (% 0,71) 0,25 mg/l, 13 ünde (% 3.11) 0,5 mg/l, 79 unda (%18,9) 1 mg/l, 239 kökende (% 57,3) 2 mg/l, 72 kökende (% 17,2) 4 mg/l ve 11 kökende ise (% 2,6) 8 mg/l olarak belirlenmiştir. CHX için MİK değerlerinin dağılımı şekil 4.2 de gösterilmiştir. CHX için ECOFF değeri 2 mg/l olarak bulunmuştur Klorhekzidin diglukonat için MFK değerleri CHX için MFK değerleri 417 kökenin 5 tanesinde (% 1,1) 0,5 mg/l, 14 tanesinde (% 3,35) 1 mg/l, 157 tanesinde (% 37,6) 2 mg/l, 145 tanesinde (% 34,77) 4 mg/l, 84 tanesinde (% 20,14) 8 mg/l ve 12 tanesinde ise (% 2,87) 16 mg/l olarak belirlenmiştir. CHX için MFK değerlerinin dağılımı şekil 4.2 de gösterilmiştir.
74 57 Şekil 4.2. CHX nin MİK ve MFK değerlerinin dağılımı, ECOFF=2 mg/l Triklosan için MİK değerleri TRC için MİK değerleri 417 kökenin 1 inde (% 0,23) 0,06 mg/l, 21 inde (% 5) 0,125 mg/l, 47 sinde (% 11,2) 0,25 mg/l, 28 inde (% 6,7) 0,5 mg/l, 163 ünde (% 39) 1 mg/l, 99 unda (% 23,7) 2 mg/l ve 33 ünde ise (% 7,9) 4 mg/l olarak belirlenmiştir. TRC için MİK değerlerinin dağılımı şekil 4.3 de gösterilmiştir. TRC için ECOFF değeri 1 mg/l olarak bulunmuştur Triklosan için MFK değerleri TRC için MFK değerleri kökenlerin 3 ünde (% 0,71) 0,125 mg/l, 24 ünde (% 5,7) 0,25 mg/l, 46 nda (% 11) 0,5 mg/l, 30 unda (% 7,19) 1 mg/l, 154 ünde (% 36,93) 2 mg/l, 99 unda (% 23,7) 4 mg/l, 30 unda (%7,19) 8 mg/l ve 5 inde ise (% 1,19) 16 mg/l olarak belirlenmiştir. TRC için MFK değerlerinin dağılımı şekil 4.3 de gösterilmiştir.
75 58 İzolat sayısı ,03 0,06 0,125 0,25 0, MİK mg/l MİK MFK Şekil 4.3. TRC nin MİK ve MFK değerlerinin dağılımı, ECOFF=1mg/L Sodyum hipoklorit için MİK değerleri MİK değerlerinin 417 kökenin 2 sinde (% 0,47) 256 mg/l, 5 inde (% 1,19) 512 mg/l, 96 sında (%23) 1024 mg/l, 127 sinde (% 30,45) 2048 mg/l, 155 inde (%37,1) 4096 mg/l, 31 inde (% 7,43) 8192 mg/l ve 1 tanesinde ise (% 0,23) mg/l olarak belirlenmiştir. SHC için MİK değerlerinin dağılımı şekil 4.4 de gösterilmiştir. SHC için ECOFF değeri 4096 mg/l olarak bulunmuştur Sodyum hipoklorit için MFK değerleri SHC için belirlenen MFK değerlerinin 2 kökende (%0,47) 256 mg/l, 38 kökende (%9,11) 1024 mg/l, 98 kökende (% 23,5) 2048 mg/l, 131 kökende (%31,4) 4096 mg/l, 114 tanesinde (% 27,33) 8192 mg/l, 33 kökende (% 7,9) 16,384 mg/l ve 1 kökende ise (% 0,23) mg/l olarak belirlenmiştir. SHC için MFK değerlerinin dağılımı şekil 4.4 de gösterilmiştir.
76 59 Şekil 4.4. SHC nin MİK ve MFK değerlerinin dağılımı, ECOFF=4096 mg/l 4.2. Biyosidlerin Aktivite Deneylerinin Sonuçları Kontrol deneylerinin sonuçları Dezenfektan duyarlılık testlerinin uygulanmasından önce deneylerde kullanılacak olan sert su, nötralizör, dilüent gibi maddelerin maya üzerindeki etkilerinin kontrol edilmesi amacıyla yapılan kontrol deneylerinin sonuçları aşağıda verilmiştir. Kontrol deneylerinde zorunlu olarak C. albicans ATCC kullanılmıştır. Çizelge 4.1. Kullanılan biyosidler için yapılan kontrol deneylerinin sonuçları Kontrol Deneyi A : Biyosid Standart köken Validasyon Kontrol A süspansiyonu( Nv) BNZ 4, , CHX C.albicans ATCC , , TRC 6, , SHC 1, , Çalışmada kullanılan biyosidler için yapılan kontrol A deneyi sonrasında zorunlu test mikroorganizması ile elde edilen CFU/ml sayısı validasyon süspansiyonunda bulunan CFU/ml sayısının yarısından (0,5 Nv) büyük olduğu için deneyin standartlar içinde
77 60 olduğu gösterilmiştir. Bu deneyle kirletici madde ve sert suyun çalışmada kullanılan C. albicans üzerine öldürücü etkilerinin olmadığı gösterilmiştir. Nötralizatör kontrolü B Biyosid Standart köken Validasyon Kontrol B süspansiyonu(n vb ) BNZ 2, , CHX C.albicans ATCC , , TRC 4, , SHC , Çalışmada kullanılan biyosidler için yapılan kontrol B deneyi sonrasında zorunlu test mikroorganizması ile elde edilen CFU/ml sayısı validasyon süspansiyonunda bulunan CFU/ml sayısının yarısından (0,5 Nv) büyük olduğu için deney koşullarının standartlar içinde olduğu gösterilmiştir. Bu deneyle nötralizörün C. albicans üzerine öldürücü etkisinin olmadığı gösterilmiştir. Nötralizatör kontrolü C Biyosid Standart köken Validasyon Kontrol C süspansiyonu(n vb ) BNZ , CHX C.albicans ATCC , , TRC 5, SHC , Çalışmada kullanılan biyosidler için yapılan kontrol C deneyi sonrasında zorunlu test mikroorganizması ile elde edilen CFU/ml sayısı validasyon süspansiyonunda bulunan CFU/ml sayısının yarısının (0,5 Nv) üzerinde bulunduğu için deney koşullarının standartlar içinde olduğu gösterilmiştir. Deneyde kullanılan nötralizörün biyosidleri nötralize ettiği kanıtlanmıştır Kantitatif süspansiyon testinin sonuçları ECOFF değerinin sınırında ve üzerinde olan biyosid dirençli olarak belirlenmiş örnekler için kantitatif süspansiyon testi sonuçları çizelge 4.2., 4.3., 4.4. ve 4.5. te verilmiştir. Seçilen örneklerden hazırlanan maya test süspansiyonlarında bulunan CFU/ml sayısı hesaplanarak kaydedilmiştir. Çalışmada kullanılan dezenfektanlar ECOFF sınırı ve ECOFF
78 61 üzerindeki (>ECOFF) konstantrasyonları için de maya süspansiyonu dezenfektanla muamele edildikten sonraki 1., 5. ve 30. dakikalarda alınan örnekler nötralizör içeren tüplere aktarılmış ve daha sonra MEA besiyerine ekimleri yapılmıştır saatlik inkübasyonun ardından plaklardaki koloni sayıları hesaplanmıştır. Test protokolüne göre başlangıç süspansiyonundaki maya sayısı ile dezenfektanla muameleden sonraki üreyen maya sayısı arasında 5 log luk (10-5 ) azalma bulunursa bu izolatın dezenfektana karşı duyarlı olarak kabul edilmiştir. Benzalkonyum klorürün 4 mg/l, 8 mg/l ve 16 mg/l konsantrasyonları için 1., 5. ve 30. dakika temas sonrası bu izolatta 5 log luk (10-5 ) azalma bulunmamasından dolayı izolatın bu konsantrasyonda BNZ e karşı duyarlı olmadığı kabul edilmiştir. Klorhekzidin diglukonatın 2 mg/l, 4 mg/l ve 8 mg/l konsantrasyonları için 1., 5. ve 30. dakika temas sonrası bu izolatta 5 log luk (10-5 ) azalma bulunmamasından dolayı izolatın bu konsantrasyonda CHX a karşı duyarlı olmadığı kabul edilmiştir. Triklosanın 1 mg/l, 2 mg/l ve 4 mg/l konsantrasyonları için 1., 5. ve 30. dakika temas sonrası bu izolatta 5 log luk (10-5 ) azalma bulunmamasından dolayı izolatın bu konsantrasyonda TRC a karşı duyarlı olmadığı kabul edilmiştir. Sodyum hipokloritin 4096 mg/l konsantrasyonu için 1., 5. ve 30. dakika temas sonrası 5 log azalma olduğundan, 8192 mg/l ve mg/l konsantrasyonlarında ise 5. ve 30. dakikalarda hiç üreme olmamasından dolayı izolatın bu konsantrasyonda dezenfektana duyarlı olduğu bulunmuştur. Çizelge 4.2. Benzalkonyum klorür için kantitatif süspansiyon testi sonuçları BNZ 4 mg/l (ECOFF) 8 mg/l (>ECOFF sınırı) 16 mg/l (>ECOFF) Başlangıç 1.dk 5.dk 30.dk 1.dk 5.dk 30.dk 1.dk 5.dk 30.dk konsantrasyonu 2 x x x x x x x x x x10 2 Çizelge 4.3. Klorhekzidin diglukonat için kantitatif süspansiyon testi sonuçları CHX 2 mg/l (ECOFF) 4 mg/l (>ECOFF sınırı) 8 mg/l (>ECOFF) Başlangıç 1.dk 5.dk 30.dk 1.dk 5.dk 30.dk 1.dk 5.dk 30.dk konsantrasyonu 2,5 x x x x x x x x x x10 2
79 62 Çizelge 4.4. Triklosan için kantitatif süspansiyon testi sonuçları TRC 1 mg/l (ECOFF) 2 mg/l (>ECOFF sınırı) 4 mg/l (>ECOFF) Başlangıç 1.dk 5.dk 30.dk 1.dk 5.dk 30.dk 1.dk 5.dk 30.dk konsantrasyonu 3x x x x x x x x x x10 2 Çizelge 4.5. Sodyum hipoklorit için kantitatif süspansiyon testi sonuçları SHC 4096 mg/l (ECOFF) 8192 mg/l (>ECOFF sınırı) mg/l (>ECOFF) Başlangıç 1.dk 5.dk 30.dk 1.dk 5.dk 30.dk 1.dk 5.dk 30.dk konsantrasyonu 4,5x x10 2 7x10 2 4x x10 2 O O O O O O: Üreme yok Kantitatif taşıyıcı testinin sonuçları Kantitatif süspansiyon yönteminde test edilen kökenler, kantitatif taşıyıcı testinde de kullanılmıştır. Testte sadece BNZ, CHX ve SHC kullanılmıştır. TRC ile kontrol deneyleri standartlar içinde bulunmadığı için dışarıda bırakılmıştır. Çalışmada kullanılan dezenfektanlar ECOFF değeri ve ECOFF değerinin üzerindeki konsantrasyonları için maya süspansiyonu ile çalışılmıştır. Cam taşıyıcı üzerine yayılan maya süspansiyonları dezenfektan ile 1, 5 ve 30 dakika karşılaştıktan sonra nötralizör ve cam boncuk içeren steril kaplara aktarılmıştır. 5 dakika bekletildikten sonra buradan 1 ml alınarak MEA besiyerine ekim yapılmıştır. İnkübasyondan sonra oluşan koloniler sayılmıştır. Çalışmanın sonucunda, BNZ için 4 mg/l, 8 mg/l ve 16 mg/l ile 1 ve 5 dakika temas sonrasında üreyen koloni sayıları normal sınırlar arasında ( koloni) olduğu için köken duyarlı kabul edilmiştir. 16 mg/l konsantrasyonu ile 30 ve 5 dakika temas sonrasında hiç üreme olmadığı için dezenfektan fungisidal etkili bulunmuştur (Çizelge 4.6). Çizelge 4.6. Benzalkonyum klörür için kantitatif taşıyıcı testi sonuçları 4 mg/l (ECOFF) 8 mg/l (>ECOFF) 16 mg/l (>ECOFF) Örnek no. 1.dk 5.dk 30.dk 1.dk 5.dk 30.dk 1.dk 5.dk 30.dk O O 74 O O O: Üreme yok
80 63 Klorhekzidin diglukonat ın 4 mg/l, 8 mg/l ve 16 mg/l konsantrasyonları ile 1, 5 ve 30 dakika temas sonrası oluşan koloni sayıları normal sınırlar arası ve altında olduğundan köken duyarlı kabul edilmiştir (Çizelge 4.7). Çizelge 4.7. Klorhekzidin diglukonat için kantitatif taşıyıcı testi sonuçları 4 mg/l ( ECOFF) 8 mg/l (>ECOFF) 16 mg/l (>ECOFF) Örnek no. 1.dk 5.dk 30.dk 1.dk 5.dk 30.dk 1.dk 5.dk 30.dk O O O O: Üreme yok Sodyum hipoklorit in 4096 mg/l konsantrasyonu ile 1 ve 5 dakika temas sonrası üreyen koloni sayıları normal sınırlar arasında bulunurken, 30 dakika için ise sınırın altında bulunmuştur mg/l ve mg/l konsantrasyonları için elde edilen koloni sayıları normal sınırların altında bulunmuştur. Elde edilen sonuçlara göre test edilen köken duyarlı kabul edilmiştir. Çizelge 4.8. Sodyum hipoklorit için kantitatif taşıyıcı testi sonuçları 4096 mg/l (ECOFF) 8192 mg/l (>ECOFF) mg/l (>ECOFF) Örnek no. 1.dk 5.dk 30.dk 1.dk 5.dk 30.dk 1.dk 5.dk 30.dk O 2 O O O: Üreme yok Taşıyıcı deneyinde elde edilen sonuçlara göre, test edilen dezenfektanların etkisinde başlangıca göre 5 log dan fazla azalma olduğu için kökenler duyarlı olarak kabul edilmiştir Membran Geçirgenlik Deneyinin Sonuçları İzolatların membran geçirgenliklerinin incelenmesi kristal viyole deneyi ile yapılmıştır. Yüksek MİK ve düşük MİK elde edilen kökenler seçilmiştir. Yüksek MİK elde edilen 4 köken ile 1 duyarlı köken deneye dahil edilmiştir. Deney 96 kuyucuklu mikroplarda yapılmıştır. Seçilen izolatların toplam 5 farklı biyosid konsantrasyonu için kristal viyole
81 64 alım (up take) yüzdeleri belirlenmiştir. Deneyde nistatin (4 mg/l) ve amfoterisin B (16 mg/l) ilaçları pozitif kontrol (PK) ve ilaçsız bir izolat negatif kontrol olarak (NK) kullanılmıştır. Çizelge 4.9. Biyosid dirençli kökenin kristal viyole alım (up take) yüzdeleri Geri alım (up take) yüzdesi Biyosid +2 MİK +1 MİK MİK -1 MİK -2 MİK BNZ 79,2 78,8 76,7 55,9 47,1 CHX 64 70,4 54,5 32,7 33 TRC 64,4 65,8 48,5 37,6 33,4 SHC 69 66,1 64,7 35,2 40,9 Amfoterisin B 66,9 65, ,9 36,6 Nistatin 33,4 34,8 35,5 23,2 21,4 NK MİK: MİK değerinin bir kat üstü, +2 MİK: MİK değerinin iki kat üstü, -1 MİK: MİK değerinin bir kat altı, -2 MİK: MİK değerinin iki kat altı, NK: negatif kontrol Çizelge Biyosid duyarlı kökenin kristal viyole alım (up take) yüzdeleri Geri alım (up take) yüzdesi Biyosid +2 MİK +1 MİK MİK -1 MİK -2 MİK BNZ 57,6 56,5 52, ,8 CHX 43 42, ,5 27,6 TRC 49,3 26,7 45,5 29,3 30,9 SHC 49,3 50, ,3 32,7 Amfoterisin B 52, ,6 33,4 34,6 Nistatin 52,7 54,1 49,7 35,8 35 NK MİK: MİK değerinin bir kat üstü, +2 MİK: MİK değerinin iki kat üstü, -1 MİK: MİK değerinin bir kat altı, -2 MİK: MİK değerinin iki kat altı, NK: negatif kontrol Deneyin sonucunda biyosidlere duyarlı kökende kristal viyole alım düzeyleri % 26,5-57,6 arasında bulunurken, dirençli kökenlerde % 79,2 ye kadar yükselmiştir. Biyosid miktarı MİK düzeyinin üzerine çıktıkça, kristal viyole alım yüzdeleri artmıştır. Bu deney bize, biyosidlerin membrandan hücre içine alındığını ve alımın biyosid miktarı ile ilişkili olduğunu göstermiştir. Biyosid duyarlı ve dirençli kökenler arasında, membranın geçirgenliği açısından fark bulunmuştur. Dirençli kökenlerde membranın daha geçirgen olduğu çünkü, alım yüzdelerinin arttığı görülmüştür.
82 Rodamin 6G Efluks (atım) Deneyinin Sonuçları Efluks (atım) pompalarının sayıca artışını göstermek için floresan bir boya olan R6G kullanılmıştır. Bu çalışma için biyosidlere duyarlı ve dirençli birer adet köken seçilerek R6G nin geri alımı belirlenmiştir. Glukoz, pompaları uyaran bir faktör olarak deneye eklenmiştir. Deneyin sonucunda, R6G nin 1 Mve 5 M arasındaki konsantrasyonlarının optik dansite (OD) değerleri ölçülmüştür. R6G nin konsantrasyonu artıkça OD değeri artmıştır (Şekil 4.5). Biyoside dirençli olan kökenin R6G geri alım değerinin, duyarlı olandan yüksek olduğu belirlenmiştir. Glukoz eklenen koşullarda biyosid dirençli kökenin R6G geri alım değerinin, duyarlı kökenden yüksek bulunmuştur ( Şekil 4.6). Çizelge R6G nin farklı konsantrasyonlarda optik densite değerleri R6G Konsantrasyonu OD 527 nm 0,098 0,867 1,814 2,153 2,217 Çizelge Biyosid duyarlı ve dirençli kökenlerin R6G geri alım değerleri PBS+R6G Glukoz+ R6G Kontrol Duyarlı köken 0,085 0,08 0,076 Dirençli köken 0,09 0,1 0,077 PBS: Phosphate Buffered Saline
83 66 Şekil 4.5. R6G nin farklı konsantrasyonlardaki OD değerleri Şekil 4.6. Biyosid duyarlı ve dirençli kökenlerin R6G geri alım değerleri Yukardaki sonuçlara göre biyosid direncinin atım pompaları ile ilişkili olduğu sonucuna varılmıştır.
84 Ters Transkriptaz (Reverse Transkriptaz) PZR Sonuçları Klinik C. albicans izolatları arasından seçilen biyosid duyarlı ve dirençli kökenlerde atım pompalarındaki ekspresyon değişikliklerini göstermek için RT-PZR uygulanmıştır. Genomik RNA izole edilerek spektrofotometrik olarak (NanoDrop, Thermo Scientific, ABD) ölçülmüştür. Çizelge Kökenlerden elde edilen RNA miktarları Örnek no. Özelik RNA miktarı (ng/µl) 333 Biyosid duyarlı 348,4 34 Biyosid dirençli 310,2 70 Biyosid dirençli 152,4 80 Biyosid dirençli 243,6 Resim numaralı duyarlı kökenin RNA sına ait NanoDrop analiz ekranı görüntüsü Daha sonra elde edilen RNA lar ters transkriptaz (RT-PZR) ile önce komplimenter DNA ya (cdna) dönüştürülmüştür. Elde edilen cdna lar tekrar spektrofotometrik olarak ölçülmüştür. Çizelge Ters transkriptaz PZR ile elde edilen cdna miktarları Örnek no. cdna miktarı (ng/µl) , , ,8
85 68 Resim numaralı dirençli kökenin DNA sına ait NanoDrop analiz ekranı görüntüsü Oluşan cdna lar CDR1 ve ERG11 genleri ayrı ayrı hedeflenerek yapılan PZR sonrası agaroz jel elektroforezde görüntülenmiştir. M PK NK Resim , 34 ve 80 numaralı kökenlerin CDR1 primer çifti ile yapılan PZR sonrası jel elektroforez görüntüsü. 1, 2, 3: CDR1 pozitif kökenler, M: moleküler ağırlık standartı (Marker), PK: pozitif kontrol, NK: negatif kontrol
86 69 M NK PK Resim , 34 ve 80 numaralı kökenlerin ERG11 primer çifti ile yapılan PZR sonrası jel elektroforez görüntüsü. 2: ERG11 pozitif köken, M: moleküler ağırlık standartı (Marker), PK: pozitif kontrol, NK: negatif kontrol 4.6. In Vitro Virülans Deneylerinin Sonuçları Virülans deneyleri için çalışmada kullanılan tüm biyosidlere duyarlı 1 ve 3 dirençli köken olmak üzere toplam 4 köken seçilmiştir. Seçilen kökenlerde; salgısal asit proteinaz, fosfolipaz, esteraz, hemolitik aktivite ve slaym faktör üretimi araştırılmıştır. Deneylerde C. albicans ATCC kalite kontrol kökeni olarak kullanılmıştır. Tüm virülans deney sonuçları tablo 4.12 de gösterilmiştir Salgısal asit proteinaz (SAP) deneyinin sonuçları Deneye dahil edilen bir adet biyoside duyarlı ve 3 adet biyosid dirençli toplam 4 kökende SAP araştırılmıştır. Üç dirençli kökenin ikisinde (% 66,66) SAP enzimine rastlanırken, duyarlı kökende ise SAP enzimi saptanmamıştır. Köken sayısının az olması nedeniyle, elde edilen sonuçlar SAP varlığı ile biyosid direnci arasında ilişkiye dair kesin hükümler elde edilmesi için yeterli değildir.
87 Resim numara SAP negatif biyosid duyarlı köken, 2 numara SAP pozitif dirençli köken. 1 2 Resim numara SAP pozitif C. albicans (ATCC 10231), 2 numara SAP negatif dirençli köken Fosfolipaz deneyinin sonuçları Bu çalışmada yumurta sarılı agar (YSA) besiyeri kullanılarak fosfolipaz enzim aktivitesi araştırılmıştır. Biyosid dirençli 3 kökenden 2 tanesinde (%66,66) fosfolipaz aktivitesi belirlenmiştir. Biyosid duyarlı köken ve dirençli diğer kökende ise fosfolipaz enziminin bulunmadığı görülmüştür.
88 71 Resim 4.7. Fosfolipaz aktivitesi pozitif biyosid dirençli kökenler 1 2 Resim numara fosfolipaz aktivitesi pozitif C. albicans (ATCC 10231), 2 numara fosfolipaz aktivitesi negatif biyosid duyarlı köken Esteraz aktivite deneyinin sonuçları Çalışmaya alınan biyosid dirençli kökenlerin bir tanesinin (% 33,33) esteraz enzimi ürettiği saptanırken, geri kalan kökenlerde ise esteraz saptanmamıştır. C. albicans ATCC pozitif kontrol olarak deneyde kullanılmıştır.
89 Resim numara esteraz aktivitesi pozitif C. albicans (ATCC 10231), 2 numara esteraz aktivitesi pozitif biyosid dirençli köken Resim Esteraz aktivitesi negatif, biyosid duyarlı (solda) ve dirençli (sağda) kökenler Hemolitik aktivite deneyinin sonuçları Çalışmaya alınan 4 C. albicans kökeninden hiç birinde (% 0) hemolitik aktivite gözlenmemiştir. Deneyde C.albicans ATCC pozitif kontrol olarak kullanılmıştır.
90 Resim , 2 ve 3 numara hemoliz negatif kökenler, 4 numara ise pozitif kontrol Slaym üretimi deneyinin sonuçları Deney için seçilen biyosid dirençli üç kökenin ikisinde (% 66,66) slaym faktör üretimi gösterilmiştir. Biyosid duyarlı köken ve dirençli diğer kökende ise slaym faktör üretimi negatif bulunmuştur. Deneyde pozitif kontrol olarak Candida parapsilosis kökeni kullanılmıştır Resim numara C. parapsilosis pozitif kontrol, 2 numara slaym üretimi negatif ve 3 numara slaym üretimi pozitif kökenler
91 74 Çizelge İn vitro virülans deneylerinin toplu sonuçları Pozitif köken sayısı/ negatif köken sayısı Köken SAP Fosfolipaz Esteraz Hemoliz Slaym faktör Biyosid dirençli 2/1 2/1 1/2 0/3 2/1 Biyosid duyarlı 0/1 0/1 0/1 0/1 0/1 İn vitro virülans deneylerinde kullanılan köken sayısının az olması nedeniyle biyosid direnci ile virülans faktörleri arasındaki ilişki kesin kanıtlar eşliğinde değerlendirilmemiştir. Her grupta en az 30 kökenin bulunduğu in vitro virülans deneyleri ile değerlenmesi gerekmektedir. Elde ettiğimiz sonuçlar, in vitro virülans faktörlerinin, biyosidlere duyarlı ve dirençli kökenlerde pozitif veya negatif olabildiğini gösteren öncü sonuçlardır In Vivo Virülans (G. mellonella modeli) Deneyinin Sonuçları In vitro virülans deney sonuçlarını elde ettikten sonra, biyoside duyarlı ve dirençli kökenler ile G. mellonella larvalarında enfeksiyon modeli oluşturulmuştur. Enfeksiyon modelleri, kökenlerin hem pozitif hem de negatif virülans özelliklerine göre ayrı ayrı oluşturulmuştur. Enfeksiyonun varlığı larvalardan alınan hemolenf sıvısının kültürü ile doğrulanmıştır. Bütün gruplarda 12. saatte başlangıçtaki 10 larva canlı kalmıştır. Ölümler 48. saatten itibaren başlamış ve 240. saatte (10. gün) en yüksek düzeye ulaşmıştır. Seçilen kökenlerle enfekte edilen ve deneyin son gününe kadar (10.gün) canlı kalan larvaların sayısı ile Kaplan-Meier eğrileri oluşturulmuştur. Elde edilen eğrilerde her köken için ayrı ayrı olmak üzere enfekte larvalar, SF enjekte edilen larvalar ile ellenmeden bırakılan kontrol grubu larvalara ait sayılar sırasıyla şekil 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17 ve 18 de yer almaktadır.
92 Çizelge Biyoside dirençli ve virülans faktörleri pozitif kökenler ile oluşturulan enfeksiyon modeli, deney saatlerine göre canlı kalan larva sayısı ve mortalite oranları Deney saati SAP (+) Canlı kalan larva sayısı (Mortalite oranı %)* Fosfolipaz Esteraz Slaym faktör SF (+) (+) (+) Ellenmemiş (0) 10 (0) 10 (0) 10 (0) 10 (0) 10 (0) (0) 10 (0) 10 (0) 10 (0) 10 (0) 10 (0) (0) 8 (20) 10 (0) 10 (0) 10 (0) 10 (0) 72 9 (10) 7 (30) 10 (0) 7 (30) 10 (0) 10 (0) 96 9 (10) 6 (40) 9 (10) 6 (40) 10 (0) 10 (0) (10) 4 (60) 4 (60) 4 (60) 10 (0) 10 (0) (40) 3 (70) 4 (60) 4 (60) 10 (0) 10 (0) (40) 3 (70) 4 (60) 4 (60) 7 (30) 10 (0) (60) 3 (70) 3 (70) 2 (80) 5 (50) 10 (0) (70) 1 (90) 3 (70) 2 (80) 4 (60) 10 (0) (100) 0 (100) 1(90) 0 (100) 4 (60) 10 (0) 75 Deneyde ilk ölümler fosfolipaz (+) grupta 48. saatte başlamıştır. 96. saatte fosfolipaz (+) ve slaym (+) gruplarda canlı larva sayısı 6 ya inmiştir. Bu sonuçlara göre larvalarda fosfolipaz, esteraz, SAP ve slaym üretiminin mortaliteyi arttırdığını söylenebilir. Çizelge Biyoside dirençli ve virülans faktörleri negatif köken ile oluşturulan enfeksiyon modeli, deney saatlerine göre canlı kalan larva sayısı ve mortalite oranları Deney saati SAP (-) Canlı kalan larva sayısı (Mortalite oranı %)* Fosfolipaz Esteraz Slaym faktör SF (-) (-) (-) Ellenmemiş (0) 10 (0) 10 (0) 10 (0) 10 (0) 10 (0) (0) 10 (0) 10 (0) 10 (0) 10 (0) 10 (0) (0) 10 (0) 10 (0) 10 (0) 10 (0) 10 (0) (0) 10 (0) 10 (0) 9 (10) 10 (0) 10 (0) (0) 10 (0) 10 (0) 8 (20) 10 (0) 10 (0) (0) 10 (0) 10 (0) 5 (50) 10 (0) 10 (0) (30) 5 (50) 8 (20) 4 (60) 10 (0) 10 (0) (50) 4 (60) 6 (40) 4 (60) 7 (30) 10 (0) (50) 2 (80) 4 (60) 3 (70) 5 (50) 10 (0) (70) 1 (90) 1 (90) 3 (70) 4 (60) 10 (0) (70) 1 (90) 1(90) 3 (70) 4 (60) 10 (0)
93 76 Biyoside dirençli ve virülans faktörleri negatif olan köken ile enfekte edilen larvaların ilk ölümleri 72. saatte başlamış ve slaym faktör negatif grupta görülmüştür. Diğer gruplardaki larvaların sayısı 144. saatte azalmaya başlamıştır. Çizelge Biyoside duyarlı ve virülans faktörleri negatif köken ile oluşturulan enfeksiyon modeli, deney saatlerine göre canlı kalan larva sayısı ve mortalite oranları Deney saati SAP (-) Canlı kalan larva sayısı (Mortalite oranı %)* Fosfolipaz Esteraz Slaym faktör SF (-) (-) (-) Ellenmemiş (0) 10 (0) 10 (0) 10 (0) 10 (0) 10 (0) (0) 10 (0) 10 (0) 10 (0) 10 (0) 10 (0) (0) 10 (0) 10 (0) 10 (0) 10 (0) 10 (0) (0) 10 (0) 10 (0) 9 (10) 10 (0) 10 (0) (0) 10 (0) 10 (0) 8 (20) 10 (0) 10 (0) (0) 10 (0) 10 (0) 5 (50) 10 (0) 10 (0) (30) 4 (60) 8 (20) 4 (60) 10 (0) 10 (0) (50) 4 (60) 4 (60) 4 (60) 7 (30) 10 (0) (50) 2 (80) 3 (70) 2 (80) 5 (50) 10 (0) (70) 1 (90) 2 (80) 2 (80) 4 (60) 10 (0) (70) 1 (90) 1(90) 2 (80) 4 (60) 10 (0) Biyoside duyarlı ve virülans faktörleri negatif köken enjekte edilen larvaların ilk ölümleri 72. saatte başlamış ve slaym faktör negatif grupta görülmüştür. Diğer gruplardaki larvaların sayısı 144. saatte azalmaya başlamıştır. Yukarıdaki sonuçlara bakıldığında larvaların 240. saatteki mortalite oranı fosfolipaz ve esteraz negatif gruplarında yüksek (% 90) bulunmuştur. Hemolitik aktivite hem biyosid duyarlı ve dirençli kökenlerde bulunmamasından dolayı G. mellonella larva deneyine dahil edilmemiştir.
94 77 Şekil 4.7. SAP pozitif, biyosid dirençli köken ile enfekte edilen larvaların yaşam eğrileri Şekil 4.8. SAP negatif, biyosid dirençli köken ile enfekte edilen larvaların yaşam eğrileri Şekil 4.9. SAP negatif, biyosid duyarlı köken ile enfekte edilen larvaların yaşam eğrileri
95 78 Şekil Fosfolipaz pozitif, biyosid dirençli köken ile enfekte edilen larvaların yaşam eğrileri Şekil Fosfolipaz negatif, biyosid dirençli köken ile enfekte edilen larvaların yaşam eğrileri Şekil Fosfolipaz negatif, biyosid duyarlı köken ile enfekte edilen larvaların yaşam eğrileri
96 79 Şekil Esteraz pozitif, biyosid dirençli köken ile enfekte edilen larvaların yaşam eğrileri Şekil Esteraz negatif, biyosid dirençli köken ile enfekte edilen larvaların yaşam eğrileri Şekil Esteraz negatif, biyosid duyarlı köken ile enfekte edilen larvaların yaşam eğrileri
97 80 Şekil Slaym pozitif, biyosid dirençli köken ile enfekte edilen larvaların yaşam eğrileri Şekil Slaym negatif, biyosid dirençli köken ile enfekte edilen larvaların yaşam eğrileri Şekil Slaym negatif, biyosid duyarlı köken ile enfekte edilen larvaların yaşam eğrileri
98 81 Biyosid direnci ile virülans arasındaki ilişki mortalite oranlarına bakılarak değerlendirilmiştir. SAP, fosfolipaz ve slaym üretim pozitif dirençli köken ile oluşturulan enfeksiyonun 240. saatte mortalite oranları %100 bulunurken; SAP, fosfolipaz ve slaym üretimi negatif dirençli ve duyarlı kökenler ile oluşturulan enfeksiyonun mortalite oranları % 70-%90 arasında bulunmuştur. Esteraz pozitif ve negatif dirençli ve duyarlı kökenler ile oluşturulan enfeksiyonlara bakıldığında, larvaların mortalite oranları sırasıyla % 90 ve % 10 bulunmuştur. Virülans deneylerinin sonuçları topluca değerlendirildiğinde, in vitro virülans ile in vivo virülans deneylerinin sonuçları uyumlu olduğu görülmüştür. Virülansı yüksek kökenler ile mortalitesi yüksek enfeksiyonlar oluşmuştur. Biyosid direncinin virülans faktörlerinden bağımsız olduğu görülmüştür. Biyosid dirençli kökenler ile oluşan enfeksiyonların mortalitesi, biyosid duyarlı kökenden farklı bulunmamıştır. Biyosid direncinin virülansı ve mortaliteyi etkilemediği anlaşılmıştır.
99 82 5. TARTIŞMA Mikroorganizmalar üzerine mikrobisidal veya mikrobiyostatik etkili antiseptik ve dezenfektan maddeler yaygın şekilde kullanılmaktadır. Hastane enfeksiyonlarının önlenmesi ve kontrolünde dezenfeksiyonun etkin bir şekilde uygulanması ayrı bir yer tutmaktadır. Ancak hastane enfeksiyonu etkeni mikroorganizmalarda görülebilen dezenfektan direnci, dezenfeksiyon uygulamalarında karşılaşılan sorunlardan biridir. Bu yüzden dezenfektan maddelere olan direncin ve bu direncin kaynağının belirlenmesi önem taşımaktadır. Dezenfektan ya da koruyucu olarak kullanılan sodyum hipoklorit (SHC), benzalkonyum klorit (BNZ), triklosan (TRC) ve klorhekzidin (CHX) isimli biyosidler bu çalışma için seçilmiştir. Bu biyosidlerin seçilmesinin nedeni gıdalarda, temizlik maddelerinde yaygın olarak kullanılmalarıdır. Bu nedenle Candida cinsi mantarlar ile uzun süre düşük dozda karşılaşmaktadırlar. Bu biyosidlerin Candida hücresindeki etkileri, varsa direnç mekanizmaları ve düşük dozdaki bu uzun süreli karşılaşmanın sonuçları bilinmemektedir. Mikroorganizmaların dezenfektanlara karşı duyarlılıkları yapısal özelliklerine bağlı olarak değişmektedir. Doğal direnç, genellikle dezenfektan maddenin hücre içine alımının azalması sonucu ortaya çıkarken; kazanılmış direnç kromozomal mutasyonlar ve plazmidler aracılığıyla gelişmektedir [4,84]. Dezenfektanların yaygın ve bazen de hatalı kullanılmalarının, antibiyotik direncine yol açıp açmadığı sorusu gündeme gelmiş ve direnç konusu önem kazanmıştır [85]. Biyosidlerin hem bakteri hem de mantar hücreleri üzerine benzer etki gösterdikleri düşünülmektedir. Bakteri konusunda çok sayıda çalışma bulunmakla birlikte, mantarlar ile yapılan çalışmaların sayısı kısıtlıdır. Mikroorganizmaların antimikrobiyal ajanlara duyarlıklarının tarandığı çalışmalarda Minimum İnhibitör Konsantrasyon (MİK) değerlerini bulmak üzere dilüsyon temelli testler uygulanmıştır. Aynı testler çok sayıda etken kullanılarak uygulandığında MİK değerlerinden daha güvenilir olan Epidemiyolojik Sınır Değerler (ECOFF) hesaplanabilir. ECOFF değeri test edilen kökenler arasında, MİK dağılımından elde edilen bir değerdir.
100 Test edilen gruba özgül olarak, dirençli veya duyarlı denmeksizin, bir duyarlılık yoklamasını göstermektedir. 83 Çalışmamızda 417 C. albicans kökeninin seçilen biyosidlere duyarlılığı araştırılmıştır. BNZ, CHX, TRC ve SHC nin MİK ve MFK değerleri grafik üzerinde dizilerek ECOFF değerleri belirlenmiştir. ECOFF değerleri BNZ için 4 mg/l, CHX için 2 mg/l, TRC için 1 mg/l ve SHC için 4096 mg/l olarak belirlenmiştir. Biyosidler için ECOFF değerlerinin kullanılması geniş çalışma grupları için söz konusu olabilir. Belirlenmiş MİK değerleri bulunmadığı için, ECOFF değerleri azalmış duyarlılığı göstermek konusunda yol göstericidir. Bu nedenle çalışmamızda, duyarlılık sınır değer olarak ECOFF değerleri kullanılmıştır. Ian Morrissey ve ark. (2014) yaptıkları çalışmada 3319 klinik örneğin MİK, MFK/MBK değerlerini belirlemişlerdir. Bu örnekler içinde yer alan 200 C. albicans kökeni için BNZ, CHX, TRC ve SHC ECOFF değerleri sırasıyla 16 mg/l, 16 mg/l, 16 mg/l ve 8292 mg/l olarak belirlenmiştir. Kökenlerin her bir biyoside farklı düzeyde duyarlı olduğu, özgül direnç mekanizmalarının rol alabileceği belirtilmiştir [86]. Bizim çalışmamız ve öncesinde yapılan Morrisey ve ark. nın çalışması dışında Candida kökenlerinin biyosidlere duyarlılığın değerlendirildiği ECOFF belirlenmesine yönelik bir başka çalışma bulunmamaktadır. Bu nedenle sonuçlarımız, sadece bu öncü çalışma ile karşılaştırılabilmiştir. Bizim çalışmamız sonucunda elde edilen ECOFF değerleri, Morrisey ve ark. nın sonuçlarından daha düşük bulunmuştur. Morrisey ve ark. nın 200 köken ile, bizim ise 417 köken ile çalışmış olmamız nedeniyle, bizim ECOFF değerlerimizin daha geniş bir köken sayısından elde edildiği ve daha doğru olduğu sonucu çıkarılabilir. ECOFF değerlerinin belirlenmediği ancak C. albicans ların biyosidlere duyarlılığının araştırıldığı başka çalışmalar bulunmaktadır. Gupta ve ark. (2015) yaptıkları bir çalışmada dişlerde kanal tedavisinde kullanılan CHX ve kalsiyum hidroksit in C. albicans ve Enterokok lar üzerine etkili olduğunu saptamışlardır. Ancak bir etki sınır değeri belirlememişlerdir [87].
101 84 Singh ve Kosat (2015) yaptıkları bir başka çalışmada ise, diş kanal tedavisinde kullanılan %3 lük SHC, % 17 lik EDTA ve % 2 lik CHX kombinasyonunun C. albicans koloni sayısını azalttığını bildirmişlerdir [88]. Kuaterner amonyum bileşiklerine direnç ile ilişkilendirilen qac proteini ilk olarak S. aureus ve KNS suşlarında tanımlanmış; ardından yiyecek ve yiyecek üretim ortamlarından izole edilen stafilokok türlerinde de QAC A/B ve SMR direnç genleri saptanmıştır. Hastane ortamında kullanılan çoğu dezenfektan ve antiseptik preparatta CHX gibi katyonik bileşikler ile BNZ gibi kuaterner amonyum bileşiklerine sıkça rastlanmaktadır. Bu ajanlara dirençle ilişkilendirilen, plazmid ile kodlanan antiseptik direnç genleri tanımlanmıştır. Özellikle çoğul ilaç direncini kodlayan plazmidlerin bakteriler arasında aktarımı ile aynı anda hem antiseptik, dezenfektan preparatlara hem de antibiyotiklere dirençli suşların yaygınlaşması olasılığı endişe verici bir durumdur. Plazmid aracılı biyosit direnci ile ilgili çalışmalar, enfeksiyonlardaki önemi göz önüne alınarak daha çok S. aureus suşları üzerinde yoğunlaşmıştır [89,90]. He ve ark. (2014) çevreden izole edilen stafilokok izolatlarında BNZ direncinin saptanması çalışmalarında toplam 653 farklı stafilokok kökeninin MİK değerlerini belirlemiştir. 63 izolat BNZ e dirençli kökenler olarak belirlenmiştir. 63 dirençli kökenin 41 inde qaca/b, 30 unda qacc, 25 inde qacg, 16 sında qach ve 8 inde qacj saptanmıştır. Elde edilen verilere göre BNZ uygulanması stafilokoklarda antibiyotik direnci ile ilişkili bulunmuştur [91]. Dezenfektan ve antiseptik maddelerin her alanda yaygın olarak kullanılmalarının bakteri türleri arasında direnç oluşmasına neden olabileceği, ayrıca ortamda bulunan kalıntılarının biyosid ve antibiyotik dirençli bakteri türlerinin seçilmesine yol açtığı düşünülmektedir [92]. Mayer ve arkadaşları, yılları arasında Avrupa nın farklı yerlerinden topladıkları 297 adet MRSA, ve 200 adet MSSA toplam 497 S. aureus kökeninde dezenfektan direnç genlerinin dağılımını incelemiştir. MRSA ların % 63 ünde, MSSA ların ise % 12 sinde qac A/B direnç genleri tespit edilmiştir. qaca/b genlerinin prevalansının yüksek bulunması, enfeksiyon önleyici ajanların hastanelerde yaygın kullanılmasının seçici etkisi olarak yorumlanmıştır [93].
102 85 Biyosidlerin mantarlara karşı etkinliği sınırlı sayıda çalışmada değerlendirilmiştir. Fungisidal veya fungisitatik etki mekanizmaları ise tam olarak bilinmemektedir. Küf mantarları, mayalardan daha dirençli bulunmuştur [32]. Kalkancı ve ark. nın 2015 yılında yayınlanan makalesinde gıda ve çevre kaynaklı veya klinik köken olarak izole edilmiş 77 adet küf mantarının SHC, CHX, BNZ ve TRC duyarlılıkları incelenmiştir. Klinik kökenler ile gıda-çevre kaynaklı kökenlerin duyarlılıklarının farklı olduğu bulunmuştur. Çalışmanın sonucunda, kökenlerin % 75 i CHX ye (MİK 1mg/L), % 90 ı BNZ ye (MİK 2mg/L) ve % 89 u TRC ye karşı duyarlı olarak belirlenmiştir. SHC için ise tüm kökenlerden geniş bir MİK dağılımı (MİK < 2048 mg/l) gösterdiği anlaşılmıştır [94]. Klorhekzidin dental ürünlerde bulunmaktadır. Bu nedenle özellikle ağızdan izole edilen kökenler ile çalışmalar yapılmıştır. Bazı çalışmalar, CHX için etkili, bazı çalışmalar azalmış etkili olduğu yönünde tartışmalı sonuçlar sunmuştur. [95,96]. CHX in C. albicans tarafından 30 sn içinde hızla hücre içine alındığı gözlenmiştir. Bu nedenle CHX in hücre duvar veya membranına etkili olabileceği bildirilmiştir. Biyosidlerin mantar hücresine girişi ile ilgili bilgilerimiz azdır. Biyosidlerin hücre membranı yanında duvarındaki glukan ve mannan üzerine de etkili olduğu düşünülmektedir [97]. Yaptığımız çalışmada, kristal viyole kullanılarak membrandan biyosid geçişinin düzeyi araştırılmıştır. Biyosid duyarlığı azalmış, ECOFF üzerinde MİK değeri elde edilen kökenlerde, o biyosidin kristal viyole alımının yükselmesine neden olduğu gözlenmiştir. Alım miktarı veya değeri, dirençli kökenlerde yüksek, duyarlı kökenlerde düşük bulunmuştur. Biyosidler atım pompaları ile hücre dışına atılırlar. Antifungal ilaçlar ve mantar hücresine giren bütün kimyasal maddeler hücre dışına atım pompaları ile atılmaktadır. Biyosidler için de bu mekanizmadan bahsedilmektedir. Ancak duyarlı kökenlerde ve dirençli kökenlerde atım pompaları ayrıntılı olarak incelenmemiştir. Çalışmamızda atım pompalarının incelenmesinde floresan boya olan R6G kullanılmıştır. Dirençli ve duyarlı kökenlerin R6G geri alımı incelenmiştir. Biyosid dirençli kökende R6G geri alım değeri yüksek bulunmuştur. Elde edilen sonuçlardan yola çıkarak, biyosid direnci ile CDR
103 86 tipindeki atım pompaları arasında ilişki olduğu düşünülmüştür. R6G nin MDR tipindeki pompalara bağlanmadığı bilinmektedir. Yan Liu ve arkadaşları (2015) Şanghay ve Çin de izole edilen klinik C. albicans izolatlarında azollere direnç mekanizmalarının değerlendirilmesini amaçlamıştır. Çalışmada toplam 30 C. albicans izolatında R6G kullanarak atım pompaları incelenmiştir. Azol dirençli 12 kökende R6G nin geri alımı duyarlı kökenlerden yüksek bulunmuştur. R6G geri alımının glukoz varlığında arttığı gözlemlenmiştir [98]. Bizim çalışmamızda da biyosid direnci ile atım pompalarının artışının ile ilişkili olduğunu düşündürecek benzer sonuçlar elde edilmiştir. Biyosid direncinin C. albicans atım pompaları ile ilişkili olduğunu gösteren çalışmamız, literatürde özgün bir değere sahip olacaktır. Antifungal ilaçların etki mekanizmaları ve gelişen direnç, biyosid direnci ile karşılaştırıldığında daha iyi araştırılmış konulardır. Antifungal ilaçların etki mekanizmalarının ve direncin değerlendirildiği bütün makaleler biyosid araştırmalarında kaynak olarak kullanılabilir. Çünkü, antifungal etki ve direnç gelişimi benzer mekanizmaları içermektedir. Zira antifungal ilaçlara direnç gelişmesinin temel mekanizmalarından biri atım pompalarını kodlayan genlerdeki değişikliklere bağlı, artmış atım pompa sayısıdır [99]. Çalışmamızda biyosid dirençli kökenlerde atım pompalarından cdr proteinlerinin varlığı, CDR1 gen ifadesindeki artış yoluyla araştırılmıştır. Dirençli kökenlerde CDR1 gen ifadesinde artış bulunması, biyosid direncinin artmış atım pompalarını işaret ettiğini kanıtlamaktadır. Dezenfektanların etkinliğinin belirlenmesinde birden fazla in vitro test bulunmakla birlikte bunların arasında süspansiyon testleri standart yöntem olarak kabul edilmektedir. Süspansiyon testleri dezenfektanın belli konsantrasyonlarda mikroorganizmalara karşı etkinliğini ölçmek için elverişli testlerdir [100,101]. İrikli ve arkadaşları yaptıkları bir çalışmada, % 4 CHX in MRSAve MSSA kökenleri üzerine farklı konsantrasyonlarda (1/10-1/100-1/1000 sulandırım) ve temas sürelerinde
104 87 (1, 2, 5, 10, 30 dk) kalitatif süspansiyon test yöntemi ile etkilerini araştırmışlardır. % 4 CHX tüm konsantrasyonlarda ve temas sürelerinde hem MRSA hem de MSSA kökenlerinde etkili bulunmuştur. Değişik hastane ortamlarından izole edilen bakterilerin duyarlılıkları farklı olabileceğinden ve sık kullanılan dezenfektanlara karşı direnç gelişimi fazla olabileceği için hastane enfeksiyonlarının kontrolünde her hastanenin mevcut mikroorganizmalarına karşı etkili dezenfektanları saptayarak malzeme seçimi yapmasının yararlı olacağı bildirilmiştir [102]. Anabilim dalımızda, Shahab ın yaptığı tez çalışmasında % 4 CHX ve % 1 BNZ çözeltisinin 1/1, 1/10 ve 1/100 lük konsantrasyonlarının KNS ler üzerinde 1, 5 ve 30 dakika temas sonrası bakterisidal etkinliğini incelenmiştir. Her iki dezenfektanın 1/1 lik konsantrasyonlarının tüm bakteri kökenlerinde bakterisidal etkili olduğu bulunmuştur. CHX nin 1/10 luk konsantrasyonunun 1 dakika temas sonrası 29 (% 58), 5 dakika temas sonrasında 46 (% 92) ve 30 dakika temas sonrası ise izolatların 49 (% 98) tanesinde bakterisidal etkili olduğu bulunmuştur. CHX nin 1/100 lük konsantrasyonun 1 dakika temas sonrası bakterisidal etkili bulunmazken, 5 dakika temas sonrası 5 (% 10) ve 30 dakika temas sonrası ise izolatların 22 (% 44) tanesinde bakterisidal etkili bulunmuştur. Benzalkonyum klorürün 1/10 luk konsantrasyonunun 1 dakika temas sonrası kökenlerin 49 (% 98) tanesinde bakterisidal etkili bulunurken, 5 ve 30 dakika temas sonrası, tüm KNS kökenlerinde bakterisidal etkili bulunmuştur. Benzalkonyum klorürün 1/100 lük konsantrasyonunun 1 dakika temas sonrası 29 (% 58), 5 dakika temas sonrası 40 (% 80) ve 30 dakika temas sonrası ise izolatların 44 (% 88) tanesinde bakterisidal etkili olduğu bulunmuştur [103]. Çalışmamızda mikrodilüsyon testi sonuçlarına göre biyosid duyarlılığının azalmış olduğu belirlenen kökenlerle kantitatif süspansiyon ve kantitatif taşıyıcı testleri kullanarak biyosid aktiviteleri incelenmiştir. BNZ ECOFF değeri bizim çalışmamızda 4 mg/l olarak belirlenmiştir. BNZ ECOFF değeri 4 iken MİK değeri 4 mg/l bulunan köken ile kantitatif süspansiyon testi uygulanmıştır. BNZ 8 mg/l ve 16 mg/l konsantrasyonları kullanılarak, 1, 5 ve 30 dk temas sonrasında üremenin azalmadığı belirlenmiştir. BNZ aktivitesinin MİK değerinin üzerinde başlayacağı sonucuna ulaşılmıştır.
105 88 CHX için ECOFF değeri bizim çalışmamızda 2 mg/l olarak belirlenmiştir. CHX MİK değeri 2 mg/l olan köken ile CHX nin 4 mg/l ve 8 mg/l konsantrasyonları için kantitatif süspansiyon testi uygulanmıştır. Benzer şekilde TRC için 1 mg/l, 2 mg/l ve 4 mg/l konsantrasyonlarda aktivitesi araştırılmıştır. CHX ve TRC için de, BNZ gibi, MİK değerlerinin çok üzerinde bir değerde aktiviteleri başladığı sonucuna ulaşılmıştır. Bu sonuçlar bize MİK düzeyinde aktivitenin başlamadığı, yani MİK belirlemesini ancak öncül bir tarama olabileceğini, gerçek direncin aktivite testlerine göre yapılması gerektiğini göstermiştir. SHC için ise MİK değerlerinde aktivitenin başladığı, çünkü MİK değerleri ile yapılan süspansiyon ve taşıyıcı testlerinde 5 log azalma oluştuğu görülmüştür. Kantitatif taşıyıcı testinde ise, süspansiyon testinde aktivitenin olmadığı biyosid konsantrasyonlarında 5 log azalma bulunmuştur. Süspansiyon testi ve taşıyıcı testi, sonuçları bize biyosid duyarlılığının aktivite testleri kullanılarak incelense bile, tartışmalı sonuçlar verebileceğini düşündürmüştür. Çalışmamızda direnç kavramının virülans kavramından farklı olduğu değerlendirilmiştir. Biyosid dirençli Candida kökenlerinin virülansı ile duyarlı kökenlerin virülansı arasında fark olmadığı, bizim çalışmamızda ilk kez ortaya koyulmuştur. Bakterilerin virülansının biyosid direnci ile ilişkisinin araştırıldığı başka çalışmalar bulunmaktadır. Ancak mantarlarda bu çalışmalar yapılmamıştır. Bakteriler için yapılan çalışmalarda elde edilen sonuçlar da çelişkilidir [104,105]. Patojen bakterilerin konak hücrelerinde adaptasyonlarını sağlamak için virülans mekanizmaları modifikasyona uğrar. Antimikrobiyal direnç ve virülans farklı zamanda gelişirler. Virülans, patojen bakterileri konak immün yanıtından korumak içindir [106]. Virülans ve direnç mekanizmaları bakterilerin olumsuz koşullarda kalabilmeleri için gereklidir. Virülans konak savunma mekanizmalarının üstesinden gelmek için gerekli bir patojen savunma mekanizmasıdır. Patojen bakterilerin antimikrobiyal terapinin üstesinden
106 89 gelmek ve zorlu ortamlarda adaptasyon sağlamak için antimikrobiyal ajanlara direnç geliştirebilmektedirler. Türler veya cinsler arasında gerçekleşen gen transferleri virülans ve direnç faktörlerini belirlemektedir. Virülans ve direnç genlerinin varlığı ve yayılmasında türler arası DNA fragmanlarının transferi ve adaptif mutasyonları rol oynamaktadır [106]. Birden fazla mikroorganizma tarafından üretilen biyofilm tabakası ile ilaçlara direnç arasında ilişki gösterilmiştir. Ancak, bunun karşılığında biyofilm üreten S. aureus, P. aeruginosa ve C. albicans ın antimikrobiyal ajanlara duyarlı olduğu bildirilmiştir [107]. Bizim çalışmamızda slaym faktör üretimi ile biyosid direnci arasında sınırlı bir ilişki gösterilmiştir. Biyosid dirençli köken sayısının az olması nedeniyle daha kesin bir sonuca ulaşılamamıştır. Nett ve arkadaşları (2008) C. albicans tarafından oluşturulan biyofilmde, biyosid duyarlılığının azalması adlı çalışmalarında, biyosidlerin planktonik hücrelerin üzerine düşük konsantrasyonda etki ettiklerini, ancak C. albicans, C. parapsilosis ve C. glabrata tarafından üretilen biyofilme karşı daha yüksek konsantrasyonlarda etkili olduklarını kanıtlamışlardır [108]. Biyofilm ve biyosid direnci ile ilgili başka bir çalışmada da Leung ve arkadaşları (2012) Candida ve E. coli tarafından üretilen biyofilmlerin biyoside karşı direncin yüksek antioksidatif kapasite ile ilişkili olduğunu öne sürmüşlerdir. Çalışmada planktonik fazda olan Candida spp. ve E. coli nin SHC, hidrojen peroksit ve iodin solüsyonuna karşı önerilen konsantrasyonlarda duyarlı oldukları gözlemlenmiştir. Ancak biyofilm fazında olduklarında kullanılan biyosidlere karşı duyarlılığın azaldığı görülmüştür. Mikrobiyal biyofilmin biyosidlere karşı direncin yüksek antioksidatif kapasitenin sorumlusu olduğunu öne sürmüşlerdir [109]. Antifungallerin C. albicans virülansına etkisini araştıran birçok çalışma vardır. Benzer çalışmalar bazı biyosidler için de yapılmıştır. CHX e 1 dk süre ile maruz bırakılan yanak epitel hücrelerine C. albicans adezyonunun azaldığı gösterilmiştir [110]. Ellepola ve ark. (2013) C. albicans virülans faktörü olan germ tüp oluşumu ve hücre yüzey hidrofobisitesinin CHX tarafından durdurulduğunu rapor etmişlerdir [111].
107 90 Can ve ark. (2015) tarafından yapılan çalışmada 20 C. albicans kökeni 4 farklı konsantrasyonda CHX, hekzetidin ve TRC a maruz bırakılmıştır. Kökenler daha sonra virülans faktörlerinden fosfolipaz ve proteinaz açısından incelenmiştir. Fosfolipaz aktivitesinin her antiseptik tarafından etkilendiği, azaldığı gösterilmiştir. Proteinaz aktivitesinin ise, CHX ve hekzetidin in 1/150 ve 1/200 lik konsantrasyonlarına maruz kaldıktan sonra değiştiği görülmüştür. TRC nın ise hem fosfolipaz hem de proteinaz aktivitesini engellediği görülmüştür [96]. Çalışmamızda, biyosidlere dirençli olduğu kabul edilen kökenlerin virülans faktörleri incelenmiştir. Çalışmamızda SAP aktivitesi dirençli kökenlerde belirgin bulunurken, esteraz ve hemoliz özellikleri bakımından fark gösterilememiştir. Slaym üretimi ve fosfolipaz üretimi ise kısmen farklı bulunmuştur. Dirençli C. albicans kökenlerinde in vitro virülansın kısmen değiştiği, ancak dirençli köken sayının kısıtlı olması nedeniyle kesin yargılara varılamadığı sonucuna ulaşılmıştır. ECOFF sınırı üzerinde MİK değeri olduğu için dirençli kabul edilen kökenler ile in vivo virülans deneyleri gerçekleştirilmiştir. İn vitro deneylerde olduğu gibi in vivo virülans ile biyosid direnci arasında ilişkilerin araştırıldığı mikolojik araştırma bulunmamaktadır. Çalışmamız bu nedenle literatürde bir öncü çalışmadır. Memeli hayvanlar yerine, etik kurallar ve maliyet gözetilerek mini modellerden Galleria mellonella larvaları tercih edilmiştir. Oggioni ve ark. (2012) klinik S. aureus izolatlarının TRC a karşı duyarlığının azalması ile virülansın azalması arasında kanıt eksikliği adlı makalelerinde, 1385 klinik kökenin TRC a karşı duyarlılıkları taranmıştır. Seri pasajlarla oluşturulan mutant kökenin fabi proteininin TRC a karşı duyarlılığın azalmasına yol açtığı bildirilmiş ve virülansla ilişkisi olmadığı ileri sürülmüştür. Çalışmada vahşi ve mutant kökenleri ayrı ayrı G. mellonella larvalarına enjekte ederek canlı kalım yüzdeleri karşılaştırılmıştır. Virülans açısından duyarlı ve dirençli mutant arasında fark olmadığı sonucuna ulaşılmıştır [104]. Wand ve ark. (2015) kolistin ve biyosid dirençli A. baumanii kökenlerinde virülansı G. mellonella larvalarında araştırmıştır. Çalışmada 6 hafta süreyle kolistine maruz bırakılan ve PMR, IPX genlerinde mutasyon oluşan kökenlerin virülansı ile duyarlı vahşi kökenlerin virülansı arasında bir fark tespit edilmemiştir. [112].
108 91 Latimer ve ark. (2012) yaptıkları çalışmalarında subinhibitör konsantrasyonda TRC ile karşılaştırılan S. aureus kökenlerinde seri pasajlar ile elde ettikleri dirençli mutantların zayıf hemolitik aktivite gösterdiğini, geç koagülaz enzimi salgıladığını, biyofilm oluşumunun da bozuk olduğunu görmüşlerdir. Yani biyosid direncinin virülansı azalttığını bildirmişlerdir [105]. Kalkancı ve ark. nın (2015) yılında yaptıkları çalışmada, antibiyotiklere dirençli ve duyarlı bakteri ve mantar kökenleri ile larva modelleri oluşturulmuştur. Çalışma sonucunda antibiyotik ve antifungal direncinin larvalardaki enfeksiyonun mortalitesini değiştirmediği sonucuna ulaşılmıştır [55]. Bizim çalışmamızda biyosid dirençli kökenlerden virülans faktörleri pozitif veya negatif olanlar ile oluşturulan enfeksiyonların, biyosid duyarlı kökenlerden farklı olmadığı sonucun elde edilmiştir. larvalarda mortalitenin biyosid duyarlığı ile değil, virülans ile ilişkili olduğu bulunmuştur. Wand ve ark. ile Latimer ve ark. bakteriler ile çalışmış oldukları için, bizim çalışmamız başka çalışmalar ile karşılaştırılana kadar, özgünlüğünü koruyacaktır. Çalışmamızın bütün sonuçları bir arada değerlendirildiğinde, BNZ, CHX, TRC ve SHC nin C. albicans üzerindeki etkisine ait özgün sonuçlar elde edildiği görülmektedir. Dirençli kökenlerde atım pompalarının artmış olduğu, membran geçirgenliğinin değiştiği gösterilmiştir.
109 92
110 93 6. SONUÇ Çalışmamızın ilk basamağında geniş bir duyarlılık taraması yapılmıştır. Anabilim Dalımız kültür koleksiyonunda bulunan klinik Candida albicans kökenleri etik kurul onayı ile kullanılmıştır. Biyosidlere duyarlılıkları açısından Clinical and Laboratory Standards Institute (CLSI) tarafından mayalar için standardize edilen mikrodilüsyon yöntemi kullanılarak taranmıştır. 417 C. albicans kökeninin BNZ, CHX, TRC ve SHC için Minimum İnhibitör Konsantrasyon (MİK) değerleri, Minimum Fungisidal Konsantrasyon (MFK) değerleri elde edilmiştir. Bu değerler grafik üzerinde yerleştirilerek kökenlerin çoğunluğunun toplandığı sınır duyarlılık değeri belirlenmiş ve buna Epidemiyolojik Sınır Değer (Epidemiological Cut Off ECOFF) olarak bildirilmiştir. Epidemiyolojik sınır değerleri BNZ, CHX, TRC ve SHC için sırasıyla 4 mg/l, 2 mg/l, 1 mg/l ve 4096 mg/l olarak belirlenmiştir. Test edilen biyosidlerin MİK değeri ECOFF değeri üzerinde olduğunda o köken duyarlılık azalmış veya dirençli köken olarak ayrılmıştır. Bu fenotipteki kökenlere Comité Européen de Normalisation (CEN) tarafından mantarlar için standardize edilen kantitatif süspansiyon testi ve kantitatif taşıyıcı testi uygulanmıştır. BNZ, CHX ve TRC nin MİK değerleri üzerindeki konsantrasyonlarda yapılan aktivite testlerinde 5 log azalma elde edilememiştir. Bu nedenle MİK düzeyinin çok üzerinde aktivite başlayacağı düşünülmüştür. SHC için ise, aksine MİK düzeylerinde yapılan aktivite testlerinde 5 log azalma gösterilmiştir. Kantitatif taşıyıcı testinde ise, MİK sonuçları ile uyumlu değerler elde edilmiştir. Kantitatif taşıyıcı testi sonucuna göre biyosid aktivitesinin MİK düzeyinde başladığı düşünülmüştür. Fenotipik olarak duyarlı ya da dirençli olarak ayrılan kökenlerin membran geçirgenliğinin araştırılması için kristal viyole deneyi yapılmıştır. Deneyin sonucunda, toplam 5 farklı biyosid konsantrasyonunun kristal viyole alım yüzdesi, duyarlı kökende % 26,5-% 57,6 arasında bulunurken, dirençli kökenlerede ise %33- %79,2 arasında bulunmuştur. Biyosid duyarlı ve dirençli kökenler arasında membran geçirgenliği açısından fark bulunmuştur.
111 94 Biyosid direncinin atım pompaları ile ilişkili olup olmadığını araştırmak için atım pompa proteinlerine bağlanan floresan bir boya olan R6G kullanılmıştır. Biyosidlere duyarlı ve dirençli birer adet izolatın R6G nin geri alımı spektrofotometre cihazı ile ölçülerek optik dansite (OD) değerleri belirlenmiştir. Glukoz uyarıcı bir faktör olarak eklenmiştir. Biyoside dirençli olan kökenin R6G geri alım değerinin, duyarlı olandan daha yüksek olduğu belirlenmiştir. Glukoz eklenen koşullarda biyosid dirençli kökenin R6G geri alım değeri, duyarlı kökenden daha yüksek bulunmuştur. Biyosid duyarlı ve dirençli kökenlerde atım pompalarındaki ekspresyon değişikliklerini göstermek için genomik RNA izole edilerek spektrofotometrik NanoDrop cihazı ile kayıt edilmiştir. RNA lardan oluşturulan cdna lar CDR1 ve ERG11 genleri hedeflenerek ayrı ayrı PZR ile çoğaltılmıştır. Biyosid duyarlı ve dirençli kökenlerin virülans özellikleri in vitro olarak incelenmiştir. Deneyde salgısal asit proteinaz, fosfolipaz, esteraz, hemolitik aktivite ve slaym faktör üretimi araştırılmıştır. Virülans deneylerinin sonucunda, biyosid duyarlı ve dirençli kökenlerin virülans özelliklerine bakıldığında, bazı özellikleri pozitif, bazılarının negatif olduğu gösterilmiştir. Direnç ve virülansın arasındaki ilişkiyi göstermek için G. mellonella larvası kullanılarak enfeksiyon modeli oluşturulmuştur. Deneyin sonuçlarına bakıldığında, biyosid direnci ile kökenlerin virülans özellikleri arasında tam bir ilişki bulunmamıştır. Pozitif virülans faktörleri olan biyosid dirençli kökenin oluşturduğu yüksek mortalite oranının direnç değil, virulans faktörlerine bağlı olduğu düşünülmüştür. Çalışmamız sonucunda, başlangıçta oluşturduğumuz hipotezlere cevaplar bulunmuştur. Hipotez 1; C. albicans türü içinde SHC, BNZ, CHX ve TRC e dirençli kökenlerin bulunduğu ileri sürülmüştür. Çalışmamızın sonucunda 417 köken içinde dirençli kökenler olduğu belirlenmiştir. Hipotez 2; biyosidlerin mantar hücresi dışına atım pompaları ile atıldığı ileri sürülmüştür. Çalışmamız, biyosidlerin giriş ve çıkışının hücre membranındaki atım pompaları ile ilişkili olduğunu hem fenotipik hem de genotipik olarak göstermiştir.
112 95 Hipotez 3; biyosid dirençli kökenlerin virülansı ile duyarlı kökenlerin virülansı arasında fark olmadığı öne sürülmüştür. Çalışmamızın sonucunda in vitro virülans faktörlerinden bazılarının direnç ile arttığı, bazılarının ise hiç değişmediği gösterilmiştir. In vivo virülans çalışmasında ise virülansı yüksek olan kökenler; biyosid direncinden bağımsız olarak G. mellonella larva modelinde mortalitesi yüksek enfeksiyonlar oluşturmuştur. Bu nedenle mortaliteyi belirleyen temel faktör virülanstır. Direnç kavramı burada virülansı etkilememiştir.
113 96
114 97 KAYNAKLAR 1. Scientific Committee on Emerging and Newly Identified Health Risks (2009). Effects of biocides on Antibiotic resistance. Scientific Committes Reviews, Gnanadhas, D. P., Marathe, S. A., Chakravortty, D. (2013). Biocides - resistance, cross-resistance mechanisms and assessment: Expert Opinion on Investigational Drugs Reviews, 22(2): Russell, A.D., Furr, J.R. (1996). Biocides: mechanisms of antifungal action and fungal resistance. Science Progress, 79(1): Özyurt, M. (2000). Dezenfeksiyon ve Sterilizasyon Yöntemleri. Klimik Dergisi, 13: Saniç, A. (2002). Tıbbi cihaz ve aletlerin sterilizasyon ve dezenfeksiyonunda genel prensipler., M. Günaydın, Ş. Esen, A. Saniç, H. Leblebicioğlu. (Editörler). Sterilizasyon, Dezenfeksiyon ve Hastane İnfeksiyonları. Samsun. Simad Yayınları, s Gürler, B. (2003, Ekim). Dezenfektan Seçimi ve Dezenfektanların Kullanımı Konusunda Güncel Rehberler. 3. Sterilizasyon Dezenfeksiyon Kongresinde sunuldu, Samsun. 7. Russell, A. D. (2002). Mechanisms of antimicrobial action of antiseptics and disinfectants: an increasingly important area of investigation. Journal of Antimicrobial Chemotherapy, 49(4): İnan, A., Açay, S.Ş., Özyürek, S.Ç., Tekin, S. Z., Erdoğmuş, P., Erdem, İ., Derya, Ö. E., Ceran, N., Göktaş, P. (2009). Hastane kökenli patojenlere karşı çeşitli dezenfektan ve antiseptiklerin etkinliği. Türk Mikrobiyoloji Cemiyeti, 39(3-4): Özer, M. (2003, Ekim). Diş Hekimliğinde Farklı Anabilim Dallarında Dezenfeksiyon ve Sterilizasyon. 3. Sterilizasyon, Dezenfeksiyon Kongresinde sunuldu, Samsun. 10. Gürler, B. (2002). Dezenfektan Gerekli mi? Ne Zaman? Hangi Dezenfektan?, M. Günaydın, Ş. Esen, A. Saniç, H. Leblebicioğlu. (Editörler). Sterilizasyon Dezenfeksiyon ve Hastane İnfeksiyonları. Samsun. simad Yayınları, s Özyurt, M. (2005). Aldehit, Peroksijen ve Perasetik Asit ile Klor Verici Ajan İçermeyen ve Alet Dezenfektanı Olarak Önerilen Diğer Dezenfektanlar, Genel Kullanım Alanları ve Antimikrobiyal Etkinlikleri., M. Günaydın, Ş. Esen, A. Saniç, H. Leblebicioğlu. (Editörler). Sterilizasyon Dezenfeksiyon ve Hastane İnfeksiyonları. Samsun. Simad Yayınları, s Saniç, A. (2003, Ekim). Aldehitler ve Sterilizan Etkili Dezenfektanlar. 3. Sterilizasyon Dezenfeksiyon Kongresinde sunuldu, Samsun. 13. Töreci, K. (2003, Ekim). Dünden Bugüne Sterilizasyon, Dezenfeksiyon, Antisepsi. 3. Sterilizasyon Dezenfeksiyon Kongresinde sunuldu, Samsun.
115 Şencan, İ. (2003, Ekim) Dezenfektanlara Direnç Sorunu ve Pratikte Önemi. 3. Sterilizasyon Dezenfeksiyon Kongresinde sunuldu, Samsun. 15. Rutala, W. A., and Weber, D.J. (2004). Disinfection and Sterilization in Health Care Facilities: What Clinicians Need to Know. Clinical Infectious Diseases, 39 (1): Kohn, W. G., Collins, A. S., Cleveland, J. L.; Harte, J. A., Eklund, K. J. and Malvitz, D. M. (2003). Guidelines for Infection Control in Dental Health-Care Settings Morbidity and Mortality Weekly Report, 52(17): Boyd, F.R. (1995). Basic Medical Microbiology. Fifth edition. USA: Little, Brown, Eryılmaz, M., Akın, A. (2008). Dezenfeksiyon ve antisepsi. Ankara Eczacılık Fakültesi Dergisi, 37(4): Alıcı, Ö. (2007, 4-8 Nisan). Dezenfeksiyonu Etkileyen Faktörler. 5. Ulusal Sterilizasyon Dezenfeksiyon Kongresinde sunuldu, Antalya. 20. Bektaş, T. (2003, Ekim). Ameliyathanede Sterilizasyon ve Dezenfeksiyon Deneyimleri. 3. Sterilizasyon, Dezenfeksiyon Kongresinde sunuldu, Samsun. 21. Berkman, M. (1990). Hastane Ortamının, Alet ve Gereçlerin Dezenfeksiyonu. Ankem Dergisi, 4(3): Güven, R. (2003, 2-4 Ekim). Sterilizasyon Dezenfeksinyon Konusunda Deneyimler: Klinik ve Poliklinikler. 3. Sterilizasyon, Dezenfeksiyon Kongresinde sunuldu, Samsun. 23. Russell, A.D. (1991). Principles of Antimicrobial Activity. In S.S. Block (ed.), Disinfection, Sterilization, and Preservation. Fourth edition. Philadelphia, Lea&Febiger, Chambers, H.F., Hadley W.K., (1998). Miscellaneous Antimicrobial Agents; Disinfectants, Antiseptics & Sterilants. In B.G. Katzung (ed), Basic & Clinical Pharmacology. Seventh edition. Connecticut, Appleton& Lange, Abbasoğlu, U. (2009, 1-5 Nisan). Dezenfektanlar: Sınıflama ve Amaca Uygun Kullanım Alanları. 6. Ulusal Sterilizasyon Dezenfeksiyon Kongresinde sunuldu, Antalya. 26. Black, J.G. (1996). Microbiology: Principles and Applications. Thirdth edition. USA: Prentice Hall, Denyer, S., Russell, A D. (2008.) Non-antibiotic antibacterial agents: mode of action and resistance. İn: S. P. Denyer, Norman, A. H., Sean, P. G. (Eds), Hugo and Russell s Pharmaceutical Microbiology. Seventh edition. Blackwell, Scientific Publications, Oxford, Çağlar, K. (2005, Nisan) Dezenfektanlara Direnç Gelişim Mekanizmaları? Dezenfeksiyon İşlemini Ne Kadar Tehdit Etmektedir? 4. Ulusal Sterilizasyon Dezenfeksiyon Kongresinde sunuldu, Samsun. 29. Russell, A. D. (2002). Bacterial resistance to disinfectants. British Journal of Infection Control, 3(3):
116 30. Öztürk, R. (2004). Antiseptik ve Dezenfektan Maddelere Karşı Direnç Sorunu., M. Günaydın, Ş. Esen, A. Saniç, H. Leblebicioğlu. (Editörler). Sterilizasyon Dezenfeksiyon ve Hastane İnfeksiyonları. Samsun. 31. Kartal, E. D. (2007, 4-8 Nisan). Bakteriler ve Dezenfektanlara Direnç. 5. Ulusal Sterilizasyon Dezenfeksiyon Kongresinde sunuldu, Antalya. 32. McDonnell G., Russell, A. D. (1999). Antiseptics and Disinfectants: Activity, Action and Resistance. Clinical Microbiology Reviews, 12(1): Dinç, G. (2012). Kavite dezenfektanlarının antibakteriyel özellikleri, bağlanma dayanımı ve mikrosızıntı üzerine etkileri (derleme). Atatürk Üniversitesi Diş Hekimliği Fakültesi Dergisi, 6, Kampf, G., Kramer, A. (2004). Epidemiologic background of hand hygiene and evaluation of the most important agents for scrubs and rubs. Clinical Microbiology Reviews, (4): Karami, N., Alsterholm, M., and Faergemann, J. (2009). In vitro Activity of Chlorhexidine and Pentane-1,5-diol and their Combination on Candida albicans, Staphylococcus aureus and Propionibacterium acnes. Acta Dermato Venereologica, 89(5): Dvorak, G. (2008). Disinfection 101. Center for Food Security and Public Health. Iowa State University, USA, Özbakkaloğlu, B. (2003). Hastane Ortamında Kullanılacak Yüzey Dezenfektanları. M. Günaydın, M. Sünbül. (Editörler). 3. Sterilizasyon, Dezenfeksiyon Kongresi. Bilimsel Tıp Yayınevi, Ankara, s Marple, B., Roland, P., and Benninger, M. (2004). Safety review of benzalkonium chloride used as a preservative in intranasal solutions: an overview of conflicting data and opinions. Otolaryngology Head and Neck Surgery, 130(1): Osman, M., El hendawy, H. H., Hassan, A., Abdel-All, S. M., and Mahmoud, D. E. (2012). Efficacy of combination of glutaraldehyde and benzalkonium chloride against multidrug-resistant gram negative bacteria isolated from hospitals. Journal of Applied Sciences Research, 8(6): Fazlara, A., Ekhtelat, M. (2012). The disinfectant effects of benzalkonium chloride on some important foodborne pathogens. American-Eurasian Journal of Agricultural & Environmental Sciences, 12(1): To, M. S., Favrin, S., Romanova, N., and Griffiths, M. W. (2002). Postadaptational resistance to benzalkonium chloride and subsequent physicochemical modifications of Listeria monocytogenes. Applied and Environmental, Microbiology, 68(11): Russell, A. D. (2002). Antibiotic and biocide resistance in bacteria: comments and conclusions. Journal of Applied Microbiology Symposium Supplement, 92(1): Gilbert, P., Moore, L. E. (2005). Cationic antiseptics: diversity of action under a common epithet. Journal of Applied Microbiology, 99(4):
117 Muller, G., Kramer, A. (2008). Biocompatibility index of antiseptic agents by parallel assessment of antimicrobial activity and cellular cytotoxicity. Journal of Antimicrobial Chemotherapy, 61(6): Cao, C., Sha, Y., Meng, H., Kang, J., Yeh, C. H., Chyon, H. Y., and Winston, J. L. (2001). A four-day study to evaluatethe anti-plaque efficacy of an experimental triclosan-containing dentifrice. The Journal of clinical dentistry, 12(4): Jones, R., Jampani, H., and Newman, J. (2000). Triclosan: a review of effectiveness and safety in health care settings. American Journal of Infection Control, 28(2): Bhargava, H. N., Leonard, P. A. (1996). Triclosan: applications and safety. American Journal of Infection Control, 24(3): Desalva, SJ., Kong, BM., and Lin, YJ. (1989). Triclosan: a safety profile. American Journal of Dentistry, 2: Can, C. (2013). Tekstil endüstrisinde triklosan kullanımına farklı bir bakış. Tekstil Teknolojileri Elektronik Dergisi, 7(1): Feldmesser, M. (2004). Virulence factors that protect the fungus from elimination. In: R. A. Calderone, G. S. Blas (Eds.), Pathogenic fungi; host interactions and emerging strategies for control. First edition. England: Caister Academic Press, Kavanagh, K., Fakkon, P.J. (2010). Galleria mellonella larvae as models for studying fungal virulence. Fungal biology reviews, 24(1-2): Abacı, Ö., Haliki, A. (2004). Candida albicans ın virulans faktörleri. Orlab On-Line Mikrobiyoloji Dergisi, 2(9): Taşkın, D. (2010). Besinin Galleria mellonella (L.) (Lepidoptera: Pyralidae) puplarının toplam lipit ve toplam yağ asidi yüzdelerine etkisi. Balıkesir Üniversitesi Fen Bilimleri Enstitüsü dergisi, 12(2): Charriere, J. D., Imdorf, A. (1999). Protection of honey combs from wax moth damage. American Bee Journal, 28, Kalkancı, A., Fouad, A. A., Erdoğan, M., Altay, A., Aliyeva, Z., Bozdayı, G., Çağlar, K. (2015). Bazı bakteri ve mantarların virülansının araştırılmasında Galleria mellonella nın in vivo model olarak kullanılması. Mikrobiyoloji Bülteni, 49(3): Akyol, E. (2013). Mum Güvesi (Galleria mellonella) zararı ve kontrol yöntemleri. Teknik Arıcılık Dergisi, 5(9): Yang, Y. L. (2003). Virulence factors of Candida species. Journal of Microbiology, Immunology and Infection, 36: Mavor, A. L., Thewes, S., and Hube, B. (2005). Systemic fungal infections caused by Candida species: epidemiology, infection process and virulence attributes. Current Drug Targets, 6(8):
118 59. Douglas, L. J. (2003). Candida biofilm and their role in infection. Trends in Microbiology, 11(1): Nett, J., Andes, D. (2006). Candida albicans biofilm development, modeling a hostpathogen interaction. Current Opinion Microbiology, 9(4): Sardi, J. C., Scorzoni L., Bernardi T., Fusco-Almeida A. M, and Mendes Giannini M. J.S. (2013). Candida species: current epidemiology, pathogenicity, biofilm formation, natural antifungal products and new therapeutic options. Journal of Medical Microbiology, 62(1): Kumamoto, C. A. (2002). Candida biofilms. Current Opinion Microbiology, 5(8): Ramage, G., Martinez, J.P., and Lopez-Ribot, J.L. (2006). Candida biofilms on implanted biomaterials: a clinically significant problem. FEMS Yeast Research, 6(7): Kim, J., Sudbery, P. (2011). Candida albicans, a major human fungal pathogen. The Journal of Microbiology, 49(2): Silva, S., Henriques, M., Martins, A., Oliveira, R., Williams, D., and Azeredo, J. (2009). Biofilms of non-candida albicans Candida species: quantification, structure and matrix composition. Medical Mycology, 47(7): Kuleta, J. K., Kozik, M. R., and Kozik, A. (2009). Fungi pathogenic to humans: molecular bases of virulence of Candida albicans, Cryptococcus neoformans and Aspergillus fumigatus. Acta Biochimica Polonica, 56(2): Kadir, T., Gumru, B., and Can, B.U. (2007). Phospholipase activity of Candida albicans isolates from patients with denture stomatitis: The influence of chlorhexidine gluconate on phospholipase production. Archives of Oral Biology, 52(7): Samaranayake, Y. H., Dassanayake, R.S., Cheung, B. P. K., Jayatılake, J. A. M. S., Yeung, K. W. S., Yau, J. Y. Y., and Samaranayake, L. P. (2006). Differential phospholipase gene expression by Candida albicans in artificial media and cultured human oral epithelium. Acta Pathologica, Microbiologica et Immunologica Scandinavica, 114(12): Yücesoy, M., Marol, S. (2003). Candida türlerinin esteraz aktivitesinin belirlenmesi. Mikrobiyoloji Bülteni, 37(1): Yücesoy, M., Karaman, M. (2003). Oral kandidozlu ve sağlıklı bireylerden soyutlanan Candida albicans türlerinde fosfolipaz ve esteraz aktivitesinin incelenmesi. İnfeksiyon Dergisi, 17(4): Keçeli, S., Budak, F. (2004). Candida türlerinde esteraz aktivitesi. Mikrobiyoloji Bülteni, 38(1-2): Hube, B., Stehr, F., Bossenz, M., Mazur, A., Kretschmar, M., and Schafer, W. (2000). Secreted lipase of Candida albicans: cloning, characterisation and expression analysis of a new gene family with at least ten members. Archives of Microbiology, 174(5):
119 Yiğit, N., Aktaş, E. (2008). Candida türlerinde hemolitik aktivite araştırılması. İnfeksiyon Dergisi, 22(2): Luo, G. (2001). Candida species exhibit differential in vitro hemolytic activity. Journal of Clinical Microbiology, 39(8): Yenişehirli, G., Bulut, Y., Tunçoğlu, E. (2010). Klinik örneklerden izole edilen Candida albicans suşlarının fosfolipaz, proteinaz ve hemolitik aktiviteleri. Mikrobiyoloji Bülteni, 44(1): Li, N., Luo, M., Zu, Y.G., Wang, W., Zhang, W., and Yao, L. P. (2013). Effect of corilagin on membrane permeabiity of Escherichia coli, Staphylooccus aureus and Candida albicans. Phytotherapy Research, 27(10): Morgan, G. P., Pinjon, E., Coleman, D. C., Sullivan, D. J. (2007). Analysis of drug resistance in pathogenic fungi. In: Kavanagh, K. ( Ed.), Medical Mycology: Cellular and Molecular Techniques. First edition. Wiley, Ozkan, S., Kaynak, F., Kalkanci, A., Abbasoglu, U., and Kustimur, S. (2005). Slime production and proteinase activity of Candida species isolated from blood samples and the comparison of these activities with minimum inhibitory concentration values of antifungal agents. Memórias do Instituto Oswaldo Cruz, 100(3): Yıldırım, M., Mumcuoğlu, İ., Kurşun, Ş., Koldaş, K., Yetener, V., Balban, N. (2009). İnfeksiyon etkeni olarak izole edilen Candida albicans ve non-albicans Candida suşlarındaki bazı virulans faktörlerinin karşılaştırılması. Türk Mikrobiyoloji Cemiyeti Dergisi, 39 (3-4): Fatahinia, M., Poormohamadi, F., and Mahmoudabadi, A. Z. (2015). Comparative study of esterase and hemolytic activities in clinically important Candida Species, isolated from oral cavity of diabetic and non-diabetic individuals. Jundishapur Journal of Microbiology, 8(3): Demir, F., Kuştimur, S. (2014). Trichosporon spp. suşlarında bazı virülans faktörlerin araştırılması. Mikrobiyoloji Bülteni, 48(4): Satılmış, Ö. K., Akkaya, Y., Ergin, Ç., Kaleli, İ. (2011). Çeşitli klinik örneklerden izole edilen Candida sp kökenlerinde slime faktör üretimi. Pamukkale Tıp Dergisi, 4(1): Fuchs, B. B., Eby, J., Nobile, C. J., El Khoury, J. B., Mitchell, A. P., and Mylonakis, E. (2010). Role of filamentation in Galleria mellonella killing by Candida albicans. Microbes and Infection, 12(6): Rutala, A.W., Weber, D.J. (2005). Disinfection, Sterilization, and Control of Hospital Waste. In: G.L. Mandell, J.E. Bennett, R. Dolin (Eds.), Principles and Practice of Infectious Diseases. Sixth edition. Philadelphia: Elsevier, Gnanadhas, P. D., Marathe, S. A., Chakravortty, D. (2013). Biocides resistance, cross resistance mechanisms and assessment. Expert Opinion on Investigational Drugs, 22(2):
120 86. Morrissey, I., Oggioni, M. R., Knight, D., Curiao, T., Coque, T., Kalkanci, A., Martinez, J., L. (2014). Evaluation of epidemiological cut-off values indicates that biocide resistant subpopulations are uncommon in natural isolates of clinicallyrelevant microorganisms. Plos One, 9 (1): Gupta, P. S., Bhati, M., Jhajharia, K., Patel, H., Paliwal, A., Franklin, S. (2015). Evaluation of antimicrobial and antifungal efficacy of inter appointment intracanal medicaments against Enterococcus and Candida albicans: an in vitro study. Journal of International Oral Health, 7(6): Singh, M., Kasat, O., V. (2015). Efficacy of various combination of irrigants and medicaments on Candida albicans: An in vitro study. Journal of International Society of Preventive and Community, 5(3): Nakipoğlu, Y., İğnak, S., Gürler, N., ve Gürler, B. (2012). Klinik Staphylococcus aureus suşlarında antiseptik direnç genlerinin (qaca/b ve smr) ve antibiyotik maddelere direnç prevalansının araştırılması. Mikrobiyoloji Bülteni, 46(2): Gerba, C. P. (2015). Quaternary Ammonium Biocides: Efficacy in Application. Applied and Environmental Microbiology, 81 (2): He, G.X., Landry, M., Chen, H., Thorpe, C., Walsh, D., Varela, M., F., Pan H. (2014). Detection of benzalkonium chloride resistance in community environmental isolates of Staphylococci. Journal of Medical Microbiology, 63(5): Harbarth, S., Soh S. T., Horner, C., Wilcox, M.H. (2014). Is reduced susceptibility to disinfectants and antiseptics a risk in healthcare settings? A point/ counterpoint review. Journal of Hospital Infection, 87(1) Mayer, S., Boos, M., Beyer, A., Fluit, A. C., Schmitz, F. J. (2001). Distribution of the antiseptic resistance genes qaca, qacb and qacc in 497 methicillin-resistant and susceptible european isolates of Staphylococcus aureus. Journal of Antimicrobial Chemotherapy, 47(6): Kalkancı, A., Elli, M., Fouad, A. A., Yesilyurt, E., Khalil, I. J. (2015). Assessment of susceptibility of mould isolates towards biocides. Journal de Mycologie Médicale, 25(4): Thein, Z. M., Samaranayake, Y. H., Samaranayake, L. P. (2007). Dietary sugars, serum and the biocide chlorhexidine digluconate modify the population and structural dynamics of mixed Candida albicans and Escherichia coli biofilms. Acta Pathologica Microbiologica et Immunologica Scandinavica, 115(2): Maillard, J.Y. (2004). Antifungal activity of disinfectants. In: A. P. Fraise, P. A. Lambert, J.Y. Maillard (Eds), Principles and practice of disinfection, preservation and sterilization. fourth edition. USA: Blackwell Publishing, Can, B. U., Kadir, T., Gumru, B. (2016). Effect of oral antiseptic agents on phospholipase and proteinase enzymes of Candida albicans. Archives of Oral Biology, 62(10): Liu, J. Y., Shi, C., Wang, Y., Li, J. W., Zhao, Y., Xiang, J. M. (2015). Mechanisms of azole resistance in Candida albicans clinical isolates from Shanghai, China. Research in Microbiology, 166 (3):
121 Pfaller, M. A., (2012). Antifungal drug resistance: mechanisms, epidemiology and consequences for treatment. American Journal of Medicine, 125(1): The European Standard EN (2013). Chemical disinfectants and antiseptics. Quantitative suspension test for the evaluation of fungicidal or yeasticidal activity in the medical area. Test method and requirements (phase 2, step 1), British Standards Institution, The European Standard EN (2006). Chemical disinfectants and antiseptics. Quantitative carrier test for the evaluation of fungicidal or yeasticidal activity for instruments used in the medical area. Test method and requirements (phase 2, step 2). British Standards Institution, İrikli, S., Otkun, M. T. (2007). Bazı antiseptik ve dezenfektanların in vitro antimikrobik aktivitelerinin araştırılması. İnfeksiyon Dergisi, 21(1): Shahab, W. S. (2014). Koagülaz Negatif Stafilokoklarda Dezenfetan Direnç Genlerinin Sıklığının Tespiti ve Fenotipik Direnç ile İlişkisinin Araştırılması. Doktora Tezi, Gazi Üniversitesi Sağlık Bilimleri Enstitüsü, Ankara, Oggioni, M. R. Ciusa, M. L., Furi, L., Baldassarri, L., Orefici, G., Cirasola, D., Martinez, J. L., Morrissey, I., Borghi. E. (2012). Lack of evidence for reduced fitness of clinical Staphylococcus aureus isolates with reduced susceptibility to triclosan. Antimicrobial Agents and Chemotherapy, 56 (11): Latimer, J., Forbes, S., McBain, A. J. (2012). Attenuated virulence and biofilm formation in Staphylococcus aureus following sublethal xposure to Triclosan. Antimicrobial Agents and Chemotherapy, 56(6): Beceiro, A., Tomas, M., Bou, G. (2013). Antimicrobial resistance and virulence: a successful or deleterious association in the bacterial world?. Clinical Microbiology Reviews, 26(1): Vizuete, P. S., Orgaz, B., Aymerich, S., Coq, D. L., Briandet, D. (2015). Pathogens protection against the action of disinfectants in multispecies biofilms. Frontiers in Microbiology, 6(705): Nett, J. E., Guite, K. M., Ringeisen, A., Holoyda, K. A., Andes, D. R. (2008). Reduced biocide susceptibility in Candida albicans biofilms. Antimicrobial Agents and Chemotherapy, 52(9): Leung, C.Y., Chan, Y.C., Samaranayake, L.P., Seneviratne C.J. (2012). Biocide resistance of Candida and Escherichia coli biofilms is associated with higher antioxidative capacities. Journal of Hospital Infection, 81(2): Darwazeh, A. M., Lamey, P. J., MacFarlane, T. W., McCuish, A. C. (1994). The effect of exposure to chlorhexidine gluconate in vitro and in vivo on in vitro adhesion of Candida albicans to buccal epithelial cells from diabetic and non-diabetic subjects. Journal of Oral Pathology & Medicine, 23(3): Ellepola, A. N., Joseph, B. K., Khan, Z. U. (2013). Changes in the cell surface hydrophobicity of oral Candida albicans from smokers, diabetics, asthmatics, and healthy individuals following limited exposure to chlorhexidine gluconate. Medical Principles and Practice, 22(3):
122 112. Wand, M. E., Bock, L. J., Bonney, L. C., Sutton J. M. (2015). Retention of virulence following adaptation to colistin in Acinetobacter baumannii reflects the mechanism of resistance. Journal of Antimicrobial Chemotherapy, 70(8):
123 106
124 EKLER 107
125 EK-1. Etik Kurul toplantı kararları sayfası 108
126 EK-2. Gazi Üniversitesi (girişimsel olmayan) klinik araştırmalar Etik Kurulu değerlendirme formu 109
127 EK-2. (devam) Gazi Üniversitesi (girişimsel olmayan) klinik araştırmalar Etik Kurulu değerlendirme formu 110
128 111 ÖZGEÇMİŞ Kişisel Bilgiler Soyadı, adı : Ali Adil Fouad FOUAD Uyruğu : Irak Doğum tarihi ve yeri : 18/10/1981 Diyala Medeni hali : Evli Telefon : ali_fouad81@hotmail.com Eğitim Derece Eğitim Birimi Mezuniyet tarihi Doktora Gazi Üniversitesi/Tıbbi Mikrobiyoloji AD Devam ediyor Yüksek Lisans Gazi Üniversitesi/Tıbbi Mikrobiyoloji AD 2010 Lisans Bağdat Üniversitesi/ Biyoloji Bölümü 2006 Lise Elvelid Erkek Lisesi 2001 İş Deneyimi Yıl Yer Görev Gazi Üniversitesi/ Tbbi Mikrobiyoloji Araştırma görevlisi Yabancı Dil Arapça, İngilizce Yayınlar 1. Kalkancı, A., Fouad, A. A., Erdoğan, M., Altay, A., Aliyeva, Z., Bozdayı, G., Çağlar, K. (2015). Bazı bakteri ve mantarların virülansının araştırılmasında Galleria mellonella nın in vivo model olarak kullanılması. Mikrobiyoloji Bülteni, 49(3), Kalkancı, A., Elli, M., Fouad, A. A., Yesilyurt, E., Khalil, I. J. (2015). Assessment of susceptibility of mould isolates towards biocides. Journal de Mycologie Médicale, 25(4): 1-7.
129 Fouad AA, Kalkancı A. Deneysel enfeksiyon oluşturulmış tavşanların kan ve doku örneklerinde bakteriyel ve fungal DNA nın gösterilmesinde PCR nın yeterliliği. Mikrobiyoloji Bülteni 2012; 46(4): Ozan Deveoglu, Ahmed Muhammed, Ali Fouad, et al. Chromatographic Analysis of Natural Pigments Produced from Datisca cannabina L. and Quercus infectoria Oliv. Plants and their Antimicrobial Activity. J.Chem.Soc.Pak., 34(4), Ali Adil Fouad, Ayşe Kalkancı. Deneysel enfeksiyon oluşturulmuş tavşanların kan ve doku örneklerinde bakteriyel ve fungal DNA nın gösterilmesinde PCR nın yeterliliği. S.4.6, XXXV. Türk Mikrobiyoloji Kongresi, 3-7 Kasım 2012, Kuşadası, Aydın. 6. Ali Adil Fouad, Ayşe Kalkancı, Kenan Hızel, Nilgün Çerikçioğlu, Işın Akyar, Rukiye Berkem, Zayre Erturan, Semra Kuştimur. Klinik Candida lusitaniae kökenlerinin amfoterisin B ye in vitro duyarlılığı: çok merkezli çalışma. XXXV. Türk Mikrobiyoloji Kongresi. 3-7 Kasım Kuşadası, Aydın. 7. Emine Yeşilyurt, Ali Adil Fouad, Ayşe Kalkancı, Murat Dizbay. Hastanemiz yataklı servislerinde kullanılan glukoz ölçüm cihazı ve strip yüzeylerinin hastane enfeksiyonu etkeni mikroorganizmaların varlığı açısından incelenmesi. P152, XXXV. Türk Mikrobiyoloji Kongresi, 3-7 Kasım 2012, Kuşadası, Aydın. 8. Ayşe Kalkancı, Ali Adil Fouad, Merve Erdogan, Nevin Keskin. Mini model of Scedosporium infection. Diversity and Barcoding of Medical Fungi: Novel Achievements and Masterclass. A meeting of the ISHAM Working Groups on Barcoding and Scedosporium Nisan 2014, Holland. 9. Ayse Kalkanci, Marina Elli, Ali Adil Fouad, Emine Yesilyurt, Israa Jabban Khalil. Assessment of susceptibility of moulds isolates towards biocides. II. International Conference on Antimicrobial Research - ICAR2012, Lisbon (Portugal) November 2012.abstractcode:163. Hobiler Futbol, Masa tenisi, Yüzme, Balık tutma, Kitap okuma
130 GAZİ GELECEKTİR...
Sağlık Kuruluşlarında Dezenfektanlarda Direnç Gelişimi
 Türkiye Halk Sağlığı Halk Genel Genel Sağlığı Müdürlüğü Kurumu Sağlık Kuruluşlarında Dezenfektanlarda Direnç Gelişimi Doç. Dr. Serap SÜZÜK YILDIZ Mikrobiyoloji Referans Laboratuvarı ve Biyolojik Ürünler
Türkiye Halk Sağlığı Halk Genel Genel Sağlığı Müdürlüğü Kurumu Sağlık Kuruluşlarında Dezenfektanlarda Direnç Gelişimi Doç. Dr. Serap SÜZÜK YILDIZ Mikrobiyoloji Referans Laboratuvarı ve Biyolojik Ürünler
ANTİSEPTİKLERİN KULLANIM YERLERİ
 ANTİSEPTİKLER 1 Kavramlar: Antiseptik: Canlılar üzerinde (cilde ve dışarı açılan boşlukların mukozasına) dıştan uygulanmak suretiyle kullanılan antimikrobik ilaçlardır. Dezenfektan: Cansız cisimler (cerrahi
ANTİSEPTİKLER 1 Kavramlar: Antiseptik: Canlılar üzerinde (cilde ve dışarı açılan boşlukların mukozasına) dıştan uygulanmak suretiyle kullanılan antimikrobik ilaçlardır. Dezenfektan: Cansız cisimler (cerrahi
Dezenfeksiyonu Etkileyen Faktörler
 Dezenfeksiyon Dezenfeksiyonu Etkileyen Faktörler Yrd. Doç. Dr Özlem ALICI Fatih Üniversitesi Tıp Fakültesi Klinik Mikrobiyoloji ve İnfeksiyon Hastalıkları Anabilim Dalı Cansız yüzeylerdeki patojen mikroorganizmaların
Dezenfeksiyon Dezenfeksiyonu Etkileyen Faktörler Yrd. Doç. Dr Özlem ALICI Fatih Üniversitesi Tıp Fakültesi Klinik Mikrobiyoloji ve İnfeksiyon Hastalıkları Anabilim Dalı Cansız yüzeylerdeki patojen mikroorganizmaların
STERİLİZASYON DERSİ 4. HAFTA DERS NOTLARI YRD. DOÇ. DR. KADRİ KULUALP
 STERİLİZASYON DERSİ 4. HAFTA DERS NOTLARI YRD. DOÇ. DR. KADRİ KULUALP STERİLİZASYON YÖNTEMLERİ SÜZME YÖNTEMİ FİLTRASYON İLE STERİLİZASYON Süzme mekanizmalarına göre; a) Absorbsiyonla mikroorganizmaları
STERİLİZASYON DERSİ 4. HAFTA DERS NOTLARI YRD. DOÇ. DR. KADRİ KULUALP STERİLİZASYON YÖNTEMLERİ SÜZME YÖNTEMİ FİLTRASYON İLE STERİLİZASYON Süzme mekanizmalarına göre; a) Absorbsiyonla mikroorganizmaları
ANTİSEPTİK VE DEZENFEKTANLAR. Prof. Dr. Ayhan Filazi Ankara Üni. Veteriner Fak. Farmakoloji ve Toksikoloji Anabilim Dalı
 ANTİSEPTİK VE DEZENFEKTANLAR Prof. Dr. Ayhan Filazi Ankara Üni. Veteriner Fak. Farmakoloji ve Toksikoloji Anabilim Dalı DEZENFEKTAN (JERMİSİD) Mikroorganizmaları öldürerek etkiyen ve genellikle cansız
ANTİSEPTİK VE DEZENFEKTANLAR Prof. Dr. Ayhan Filazi Ankara Üni. Veteriner Fak. Farmakoloji ve Toksikoloji Anabilim Dalı DEZENFEKTAN (JERMİSİD) Mikroorganizmaları öldürerek etkiyen ve genellikle cansız
DEZENFEKTANLARA DİRENÇ TANIMLAR TANIMLAR STERİLİZASYON YAPMADAN TEMİZLİK YAPABİLİRSİNİZ TEMİZLİK YAPMADAN STERİLİZASYON YAPAMAZSINIZ DEZENFEKSİYON:
 Hidrojen peroksit sterilizasyon DEZENFEKSİYON EL ANTİSEPSİSİ iyod formaldehit gluteraldehit Perasetik asit fenol Çamaşır suyu Etilen oksit klor zefiran alkol ozon ppm Dr. Melda SINIRTAŞ TANIMLAR Hipokrat
Hidrojen peroksit sterilizasyon DEZENFEKSİYON EL ANTİSEPSİSİ iyod formaldehit gluteraldehit Perasetik asit fenol Çamaşır suyu Etilen oksit klor zefiran alkol ozon ppm Dr. Melda SINIRTAŞ TANIMLAR Hipokrat
1. Hekim, hemşire ve diğer sağlık personelinin kontamine. elleri. 2. Hastalara bakım veren kişilerin giysilerinin kontamine
 SORUN MİKROORGANİZMALAR VE DAS YÖNTEMİ Nezahat GÜRLER İstanbul Tıp Fakültesi. Mikrobiyoloji ve Klinik Mikrobiyoloji Anabilim Dalı Çapa- İSTANBUL Metisilin dirençli S.aureus Vankomisin dirençli enterokoklar
SORUN MİKROORGANİZMALAR VE DAS YÖNTEMİ Nezahat GÜRLER İstanbul Tıp Fakültesi. Mikrobiyoloji ve Klinik Mikrobiyoloji Anabilim Dalı Çapa- İSTANBUL Metisilin dirençli S.aureus Vankomisin dirençli enterokoklar
Temizlik: Mikroorganizmaların çoğalması ve yayılmasını önlemek için, yüzeylerin kir ve organik maddelerden fiziksel olarak uzaklaştırılmasıdır.
 DOKÜMAN NO: STR-TL-09 YAYIN TARİHİ : AĞUSTOS 2014 REVİZYON TARİHİ : 00 REVİZYON NO:00 SAYFA 1 / 5 1-Amaç: Ç.Ü Diş Hekimliği Fakültesi klinik ortamından kaynaklanabilecek enfeksiyonları önlemek için hasta,
DOKÜMAN NO: STR-TL-09 YAYIN TARİHİ : AĞUSTOS 2014 REVİZYON TARİHİ : 00 REVİZYON NO:00 SAYFA 1 / 5 1-Amaç: Ç.Ü Diş Hekimliği Fakültesi klinik ortamından kaynaklanabilecek enfeksiyonları önlemek için hasta,
HASTANE ENFEKSİYONLARININ EPİDEMİYOLOJİSİ. Yrd. Doç. Dr. Müjde ERYILMAZ
 HASTANE ENFEKSİYONLARININ EPİDEMİYOLOJİSİ Yrd. Doç. Dr. Müjde ERYILMAZ MİKROORGANİZMA GRUPLARININ DİRENÇLİDEN DUYARLIYA DOĞRU SIRALANMASI DİRENÇLİ DUYARLI Prionlar Bakteri sporları Mikobakteriler Protozoa
HASTANE ENFEKSİYONLARININ EPİDEMİYOLOJİSİ Yrd. Doç. Dr. Müjde ERYILMAZ MİKROORGANİZMA GRUPLARININ DİRENÇLİDEN DUYARLIYA DOĞRU SIRALANMASI DİRENÇLİ DUYARLI Prionlar Bakteri sporları Mikobakteriler Protozoa
2)Subatomik parçacıklardan oluşan radyasyon. α, β ışınları
 B) RADYASYON UYGULAMALARI Radyasyon = enerji yayılması 1)Elektromanyetik radyasyon. UV, X ve γ ışınları 2)Subatomik parçacıklardan oluşan radyasyon. α, β ışınları İyonizan ışınların canlı hücreler üzerine
B) RADYASYON UYGULAMALARI Radyasyon = enerji yayılması 1)Elektromanyetik radyasyon. UV, X ve γ ışınları 2)Subatomik parçacıklardan oluşan radyasyon. α, β ışınları İyonizan ışınların canlı hücreler üzerine
STERİLİZASYON DERSİ 5. HAFTA DERS NOTLARI. Yrd. Doç. Dr. Kadri KULUALP
 STERİLİZASYON DERSİ 5. HAFTA DERS NOTLARI Yrd. Doç. Dr. Kadri KULUALP Kimyasal Maddelerle 1) ETİLEN OKSİT (EO) Sterilizasyon 2) HİDROJEN PEROKSİT 3) PERASETİK ASİT 4) OZON 5) KLORİN DİOKSİT (ClO2) 6) DÜŞÜK
STERİLİZASYON DERSİ 5. HAFTA DERS NOTLARI Yrd. Doç. Dr. Kadri KULUALP Kimyasal Maddelerle 1) ETİLEN OKSİT (EO) Sterilizasyon 2) HİDROJEN PEROKSİT 3) PERASETİK ASİT 4) OZON 5) KLORİN DİOKSİT (ClO2) 6) DÜŞÜK
TIBBĠ BĠLĠMLERE GĠRĠġ DĠLĠMĠ MĠKROBĠYOLOJĠ ANABĠLĠM DALI
 TIBBĠ BĠLĠMLERE GĠRĠġ DĠLĠMĠ MĠKROBĠYOLOJĠ ANABĠLĠM DALI ÖĞRETĠM ÜYESĠ : Prof. Dr. O. ġadi Yenen Ders: VĠROLOJĠYE GĠRĠġ, TARĠHÇE ve EVRĠM 1. Virusların tanımlanması ve rolüne ilişkin önemli tarihsel gelişmelerin
TIBBĠ BĠLĠMLERE GĠRĠġ DĠLĠMĠ MĠKROBĠYOLOJĠ ANABĠLĠM DALI ÖĞRETĠM ÜYESĠ : Prof. Dr. O. ġadi Yenen Ders: VĠROLOJĠYE GĠRĠġ, TARĠHÇE ve EVRĠM 1. Virusların tanımlanması ve rolüne ilişkin önemli tarihsel gelişmelerin
Çocuk ve Yetişkin Üriner Escherichia coli İzolatlarında Plazmidik Kinolon Direnç Genlerinin Araştırılması
 Çocuk ve Yetişkin Üriner Escherichia coli İzolatlarında Plazmidik Kinolon Direnç Genlerinin Araştırılması Melisa Akgöz 1, İrem Akman 1, Asuman Begüm Ateş 1, Cem Çelik 1, Betül Keskin 1, Büşra Betül Özmen
Çocuk ve Yetişkin Üriner Escherichia coli İzolatlarında Plazmidik Kinolon Direnç Genlerinin Araştırılması Melisa Akgöz 1, İrem Akman 1, Asuman Begüm Ateş 1, Cem Çelik 1, Betül Keskin 1, Büşra Betül Özmen
DOMUZ GRİBİYLE MÜCADELE. Halk Sağlığı Projesi
 DOMUZ GRİBİYLE MÜCADELE Halk Sağlığı Projesi Neden Salgınlarla Mücadele Etmeliyiz Kentler nüfus yoğunluğu nedeniyle bulaşıcı hastalık ve salgınlar için uygun ortamlar olması. (Kişiden kişiye, su-gıda,vektör,yüzey,hava
DOMUZ GRİBİYLE MÜCADELE Halk Sağlığı Projesi Neden Salgınlarla Mücadele Etmeliyiz Kentler nüfus yoğunluğu nedeniyle bulaşıcı hastalık ve salgınlar için uygun ortamlar olması. (Kişiden kişiye, su-gıda,vektör,yüzey,hava
İÇME SULARININ DEZENFEKSİYONUNDA NANOMATEYALLERİN KULLANIMI
 İÇME SULARININ DEZENFEKSİYONUNDA NANOMATEYALLERİN KULLANIMI Behzat Balcı, F. Elçin Erkurt, E. Su Turan Çukurova Üniversitesi Mühendislik Fakültesi Çevre Mühendisliği Bölümü Giriş İçme sularında dezenfeksiyon,
İÇME SULARININ DEZENFEKSİYONUNDA NANOMATEYALLERİN KULLANIMI Behzat Balcı, F. Elçin Erkurt, E. Su Turan Çukurova Üniversitesi Mühendislik Fakültesi Çevre Mühendisliği Bölümü Giriş İçme sularında dezenfeksiyon,
İçme Sularının Dezenfeksiyonunda Çinko Oksit Nanomateryalinin Kullanımı
 İçme Sularının Dezenfeksiyonunda Çinko Oksit Nanomateryalinin Kullanımı F. Elçin Erkurt, Behzat Balcı, E. Su Turan Çukurova Üniversitesi Çevre Mühendisliği Bölümü Giriş Su, tüm canlılar için en önemli
İçme Sularının Dezenfeksiyonunda Çinko Oksit Nanomateryalinin Kullanımı F. Elçin Erkurt, Behzat Balcı, E. Su Turan Çukurova Üniversitesi Çevre Mühendisliği Bölümü Giriş Su, tüm canlılar için en önemli
Mikrobiyal Gelişim. Jenerasyon süresi. Bakterilerde üreme eğrisi. Örneğin; (optimum koşullar altında) 10/5/2015
 Mikrobiyal Gelişim Tek hücreli organizmalarda sayı artışı Bakterilerde en çok görülen üreme şekli ikiye bölünmedir (mikroorganizma sayısı) Çok hücreli organizmalarda kütle artışı Genelde funguslarda görülen
Mikrobiyal Gelişim Tek hücreli organizmalarda sayı artışı Bakterilerde en çok görülen üreme şekli ikiye bölünmedir (mikroorganizma sayısı) Çok hücreli organizmalarda kütle artışı Genelde funguslarda görülen
8. BÖLÜM MİKROORGANİZMALARIN FİZİKSEL VE KİMYASAL YÖNTEMLERLE KONTROLÜ
 8. BÖLÜM MİKROORGANİZMALARIN FİZİKSEL VE KİMYASAL YÖNTEMLERLE KONTROLÜ 1 Mikroorganizmaların kontrolünün amacı Hastalıkların engellenerek halk sağlığının korunması Bulaşmış konakçıyı mikroorganizmalardan
8. BÖLÜM MİKROORGANİZMALARIN FİZİKSEL VE KİMYASAL YÖNTEMLERLE KONTROLÜ 1 Mikroorganizmaların kontrolünün amacı Hastalıkların engellenerek halk sağlığının korunması Bulaşmış konakçıyı mikroorganizmalardan
Listeria monocytogenes in Asit Dirençli Türlerinin Benzalkonyum Klorür Direnci ve Biyofilm Oluşumu. Emel ÜNAL TURHAN, Karin Metselaar, Tjakko Abee
 Listeria monocytogenes in Asit Dirençli Türlerinin Benzalkonyum Klorür Direnci ve Biyofilm Oluşumu Emel ÜNAL TURHAN, Karin Metselaar, Tjakko Abee Çalışmanın İçeriği L. monocytogenes ve asit dirençli türler,
Listeria monocytogenes in Asit Dirençli Türlerinin Benzalkonyum Klorür Direnci ve Biyofilm Oluşumu Emel ÜNAL TURHAN, Karin Metselaar, Tjakko Abee Çalışmanın İçeriği L. monocytogenes ve asit dirençli türler,
KALİTELİ SÜT NASIL ELDE EDİLİR?
 KALİTELİ SÜT NASIL ELDE EDİLİR? Prof. Dr. METİN ATAMER Dr. EBRU ŞENEL ANKARA ÜNİVERSİTESİ ZİRAAT FAKÜLTESİ SÜT TEKNOLOJİSİ BÖLÜMÜ Kaliteli süt üretimi için sağlanması gereken koşullar; Sağlıklı inek Özenli
KALİTELİ SÜT NASIL ELDE EDİLİR? Prof. Dr. METİN ATAMER Dr. EBRU ŞENEL ANKARA ÜNİVERSİTESİ ZİRAAT FAKÜLTESİ SÜT TEKNOLOJİSİ BÖLÜMÜ Kaliteli süt üretimi için sağlanması gereken koşullar; Sağlıklı inek Özenli
7. BÖLÜM MİKROBİYAL GELİŞİM
 7. BÖLÜM MİKROBİYAL GELİŞİM 1 Gelişim Tek hücreli organizmalarda sayı artışı Bakterilerde en çok görülen üreme şekli ikiye bölünmedir (mikroorganizma sayısı) Çok hücreli organizmalarda kütle artışı Genelde
7. BÖLÜM MİKROBİYAL GELİŞİM 1 Gelişim Tek hücreli organizmalarda sayı artışı Bakterilerde en çok görülen üreme şekli ikiye bölünmedir (mikroorganizma sayısı) Çok hücreli organizmalarda kütle artışı Genelde
Sıkça kullanılan terimler
 MİKROORGANİZMALARIN FİZİKSEL VE KİMYASAL YÖNTEMLERLE KONTROLÜ Mikroorganizmaların kontrolünün amacı Gıdaları mikrobiyal bozulmaya karşı korumak Bulaşmış konakçıyı mikroorganizmalardan arındırmak Hastalıkların
MİKROORGANİZMALARIN FİZİKSEL VE KİMYASAL YÖNTEMLERLE KONTROLÜ Mikroorganizmaların kontrolünün amacı Gıdaları mikrobiyal bozulmaya karşı korumak Bulaşmış konakçıyı mikroorganizmalardan arındırmak Hastalıkların
Dezenfeksiyon Sterilizasyon
 Dezenfeksiyon Sterilizasyon Dr. Recep ÖZTÜRK İ.Ü. Cerrahpaşa Tıp Fakültesi İnfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Anabilim Dalı ozturkrecep@superonline.com Sterilizasyon Bakteri sporları, mikobakteri,
Dezenfeksiyon Sterilizasyon Dr. Recep ÖZTÜRK İ.Ü. Cerrahpaşa Tıp Fakültesi İnfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Anabilim Dalı ozturkrecep@superonline.com Sterilizasyon Bakteri sporları, mikobakteri,
Biyofilmler; mikroorganizmaların, biyotik veya abiyotik yüzeylere adhezyonu sonrasında oluşturdukları glikokaliks olarak da adlandırılan
 Biyofilmler; mikroorganizmaların, biyotik veya abiyotik yüzeylere adhezyonu sonrasında oluşturdukları glikokaliks olarak da adlandırılan ekstraselluler matriks içinde, birbirlerine yapışarak meydana getirdikleri
Biyofilmler; mikroorganizmaların, biyotik veya abiyotik yüzeylere adhezyonu sonrasında oluşturdukları glikokaliks olarak da adlandırılan ekstraselluler matriks içinde, birbirlerine yapışarak meydana getirdikleri
DÖNEM 1- A, 3. DERS KURULU (2015-2016)
 DÖNEM 1- A, 3. DERS KURULU (2015-2016) DERS SAATİ DERS ADI DERS KONUSU DERSİ VEREN ÖĞRETİM ÜYESİ 4. DK 1. Hafta 07 Aralık Pazartesi Mikrobiyoloji Mikrobiyolojinin tarihçesi ve mikroorganizmalara genel
DÖNEM 1- A, 3. DERS KURULU (2015-2016) DERS SAATİ DERS ADI DERS KONUSU DERSİ VEREN ÖĞRETİM ÜYESİ 4. DK 1. Hafta 07 Aralık Pazartesi Mikrobiyoloji Mikrobiyolojinin tarihçesi ve mikroorganizmalara genel
Mycobacterium tuberculosis te Dışa Atım Pompaları
 Mycobacterium tuberculosis te Dışa Atım Pompaları 1 Dışa atım (efflux)..transporter Geniş substrat özgüllüğü (polispesifik) Doğal fonksiyonları 2 3 ABC (ATP-binding cassette) Sekonder MFS (major facilitator
Mycobacterium tuberculosis te Dışa Atım Pompaları 1 Dışa atım (efflux)..transporter Geniş substrat özgüllüğü (polispesifik) Doğal fonksiyonları 2 3 ABC (ATP-binding cassette) Sekonder MFS (major facilitator
Hemş.Dilek ZENCİROĞLU. Dr.Erhan KABASAKAL
 Dr.Erhan KABASAKAL Sağlık Hizmetleri Genel Müdürlüğü Sağlık Hizmet Standartları Daire Başkanlığı Hastane Enfeksiyonları Sorumlusu erhan.kabasakal@saglik.gov.tr Hemş.Dilek ZENCİROĞLU Dezenfeksiyon Antisepsi
Dr.Erhan KABASAKAL Sağlık Hizmetleri Genel Müdürlüğü Sağlık Hizmet Standartları Daire Başkanlığı Hastane Enfeksiyonları Sorumlusu erhan.kabasakal@saglik.gov.tr Hemş.Dilek ZENCİROĞLU Dezenfeksiyon Antisepsi
Kırılma Noktası Klorlaması
 Kırılma Noktası Klorlaması AMAÇ Farklı oranlarda klor ile amonyağın reaksiyon vermesi sonucu oluşan kalıntı klor ölçümünün yapılması ve verilerin grafiğe aktarılarak kırılma noktasının belirlenmesi. ÖN
Kırılma Noktası Klorlaması AMAÇ Farklı oranlarda klor ile amonyağın reaksiyon vermesi sonucu oluşan kalıntı klor ölçümünün yapılması ve verilerin grafiğe aktarılarak kırılma noktasının belirlenmesi. ÖN
Öğr. Gör. Nurhan BİNGÖL
 Öğr. Gör. Nurhan BİNGÖL Canlı yüzeylere ve canlılara dıştan uygulanan antimikrobial ilaçlara antiseptikler denir. Cansız yüzey, cerrahi malzeme, hasta eşyaları ve hasta çıkartıları (gaita, idrar, balgam
Öğr. Gör. Nurhan BİNGÖL Canlı yüzeylere ve canlılara dıştan uygulanan antimikrobial ilaçlara antiseptikler denir. Cansız yüzey, cerrahi malzeme, hasta eşyaları ve hasta çıkartıları (gaita, idrar, balgam
İÇİNDEKİLER BÖLÜM 1: MİKROBİYOLOJİYE GİRİŞ...1 BÖLÜM 2: MİKROORGANİZMALARIN MORFOLOJİLERİ.13 BÖLÜM 3: MİKROORGANİZMALARIN HÜCRE YAPILARI...
 İÇİNDEKİLER BÖLÜM 1: MİKROBİYOLOJİYE GİRİŞ...1 1.1. Tanım ve Kapsam...1 1.2. Mikrobiyoloji Biliminin Gelişmesi...2 1.3. Mikroorganizmaların Hayatımızdaki Önemi...5 1.3.1. Mikroorganizmaların Yararları...5
İÇİNDEKİLER BÖLÜM 1: MİKROBİYOLOJİYE GİRİŞ...1 1.1. Tanım ve Kapsam...1 1.2. Mikrobiyoloji Biliminin Gelişmesi...2 1.3. Mikroorganizmaların Hayatımızdaki Önemi...5 1.3.1. Mikroorganizmaların Yararları...5
DEZENFEKSİYON TALİMATI
 Hazırlayan Kontrol eden Onaylayan Enfeksiyon Kontrol Komitesi Kalite Yönetim Direktörü Hastane Yöneticisi 1.AMAÇ Hastanedeki tüm birimlerde sterilizasyon ve uygulamaları için yöntemlerin ve dezenfektan
Hazırlayan Kontrol eden Onaylayan Enfeksiyon Kontrol Komitesi Kalite Yönetim Direktörü Hastane Yöneticisi 1.AMAÇ Hastanedeki tüm birimlerde sterilizasyon ve uygulamaları için yöntemlerin ve dezenfektan
DİRENÇLİ BAKTERİ ENFEKSİYONLARINA KARŞI KULLANILAN ANTİBİYOTİKLER
 DİRENÇLİ BAKTERİ ENFEKSİYONLARINA KARŞI KULLANILAN ANTİBİYOTİKLER 1. Vankomisin Vankomisin, Nocardia Orientalis in (eskiden Streptomyces orientalis olarak bilinen) belli suşlarından elde edilen amfoterik
DİRENÇLİ BAKTERİ ENFEKSİYONLARINA KARŞI KULLANILAN ANTİBİYOTİKLER 1. Vankomisin Vankomisin, Nocardia Orientalis in (eskiden Streptomyces orientalis olarak bilinen) belli suşlarından elde edilen amfoterik
Enfeksiyon Kontrol Hekimi Kalite Direktörü Başhekim
 1. AMAÇ Hastane genelindeki sterilizasyon/dezenfeksiyon uygulamaları için sterilizasyon yöntemlerini, dezenfektan seçimi ve dezenfektanların kullanım ilkelerini belirlemektir. 2. KAPSAM Hastanede uygulanan
1. AMAÇ Hastane genelindeki sterilizasyon/dezenfeksiyon uygulamaları için sterilizasyon yöntemlerini, dezenfektan seçimi ve dezenfektanların kullanım ilkelerini belirlemektir. 2. KAPSAM Hastanede uygulanan
EN ÇOK KULLANDIĞIMIZ TIBBİ ALET
 EL HİJYENİ EN ÇOK KULLANDIĞIMIZ TIBBİ ALET GÜNÜMÜZDE NOZOKOMĐAL ENFEKSĐYONLARIN ÖNLENMESĐNDE EN ÖNEMLĐ TEK PROSEDÜR EL YIKAMADIR* EL YIKAMA El Florasi Kalici flora (koagülaz negatif stafilokok, difteroid,
EL HİJYENİ EN ÇOK KULLANDIĞIMIZ TIBBİ ALET GÜNÜMÜZDE NOZOKOMĐAL ENFEKSĐYONLARIN ÖNLENMESĐNDE EN ÖNEMLĐ TEK PROSEDÜR EL YIKAMADIR* EL YIKAMA El Florasi Kalici flora (koagülaz negatif stafilokok, difteroid,
Yoğun Bakımlarda İnfeksiyon Kontrolü: Haricen Klorheksidin Uygulanmalı mı?
 Yoğun Bakımlarda İnfeksiyon Kontrolü: Haricen Klorheksidin Uygulanmalı mı? Dr. Funda YETKİN İnönü Üniversitesi Tıp Fakültesi İnfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Anabilim Dalı Sunum Planı Klorheksidin
Yoğun Bakımlarda İnfeksiyon Kontrolü: Haricen Klorheksidin Uygulanmalı mı? Dr. Funda YETKİN İnönü Üniversitesi Tıp Fakültesi İnfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Anabilim Dalı Sunum Planı Klorheksidin
STERİLİZASYON DERSİ 2. HAFTA DERS NOTLARI. Yrd. Doç. Dr. Kadri KULUALP
 STERİLİZASYON DERSİ 2. HAFTA DERS NOTLARI Yrd. Doç. Dr. Kadri KULUALP KİMYASAL MADDELERİN MİKROORGANİZMALAR ÜZERİNE ETKİLERİ Dezenfeksiyon ve antisepsi daha çok kimyasal maddelerle yapılır. Kimyasal maddelerin
STERİLİZASYON DERSİ 2. HAFTA DERS NOTLARI Yrd. Doç. Dr. Kadri KULUALP KİMYASAL MADDELERİN MİKROORGANİZMALAR ÜZERİNE ETKİLERİ Dezenfeksiyon ve antisepsi daha çok kimyasal maddelerle yapılır. Kimyasal maddelerin
ANTİFUNGAL DİRENÇ MEKANİZMALARI ve DUYARLILIK TESTLERİ. Nilgün ÇERİKÇİOĞLU 2014 MARMARA ÜNİVERSİTESİ TIP FAKÜLTESİ TIBBİ MİKROBİYOLOJİ AD
 ANTİFUNGAL DİRENÇ MEKANİZMALARI ve DUYARLILIK TESTLERİ Nilgün ÇERİKÇİOĞLU 2014 MARMARA ÜNİVERSİTESİ TIP FAKÜLTESİ TIBBİ MİKROBİYOLOJİ AD İn Vitro Duyarlılık Test Sonuçları Duyarlı (MİK) Doza bağımlı duyarlı
ANTİFUNGAL DİRENÇ MEKANİZMALARI ve DUYARLILIK TESTLERİ Nilgün ÇERİKÇİOĞLU 2014 MARMARA ÜNİVERSİTESİ TIP FAKÜLTESİ TIBBİ MİKROBİYOLOJİ AD İn Vitro Duyarlılık Test Sonuçları Duyarlı (MİK) Doza bağımlı duyarlı
Hastane Yer/ Yüzey Dezenfektan Uygulamaları
 Hastane Yer/ Yüzey Dezenfektan Uygulamaları Doç. Dr. Zeliha KOÇAK TUFAN Yıldırım Beyazıt Üniversitesi Ankara Atatürk Eğitim ve Araştırma Hastanesi Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Kliniği
Hastane Yer/ Yüzey Dezenfektan Uygulamaları Doç. Dr. Zeliha KOÇAK TUFAN Yıldırım Beyazıt Üniversitesi Ankara Atatürk Eğitim ve Araştırma Hastanesi Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Kliniği
STERİLİZASYON. Sterilizasyon Yöntemleri. Sterilizasyonu Etkileyen Faktörler
 STERİLİZASYON Tüm canlı mikroorganizmaların tam olarak uzaklaştırılması veya öldürülmesi işlemidir. Türk Gıda Kodeksi Çiğ Süt ve Isıl İşlem Görmüş Sütleri Tebliği ne göre sterilizasyon; oda sıcaklığında
STERİLİZASYON Tüm canlı mikroorganizmaların tam olarak uzaklaştırılması veya öldürülmesi işlemidir. Türk Gıda Kodeksi Çiğ Süt ve Isıl İşlem Görmüş Sütleri Tebliği ne göre sterilizasyon; oda sıcaklığında
Deneysel Hayvan Modelinde Candida Tropicalis Peritonitinin Tedavisinde Kaspofungin ve Amfoterisin B Etkinliğinin Karşılaştırılması
 Deneysel Hayvan Modelinde Candida Tropicalis Peritonitinin Tedavisinde Kaspofungin ve Amfoterisin B Etkinliğinin Karşılaştırılması Melis Demirci, Özlem Tünger, Kenan Değerli, Şebnem Şenol, Çiğdem Banu
Deneysel Hayvan Modelinde Candida Tropicalis Peritonitinin Tedavisinde Kaspofungin ve Amfoterisin B Etkinliğinin Karşılaştırılması Melis Demirci, Özlem Tünger, Kenan Değerli, Şebnem Şenol, Çiğdem Banu
Mikrobiyolojide Moleküler Tanı Yöntemleri. Dr.Tuncer ÖZEKİNCİ Dicle Üniversitesi Tıp Fakültesi Tıbbi Mikrobiyoloji A.D
 Mikrobiyolojide Moleküler Tanı Yöntemleri Dr.Tuncer ÖZEKİNCİ Dicle Üniversitesi Tıp Fakültesi Tıbbi Mikrobiyoloji A.D 1 Enfeksiyonun Özgül Laboratuvar Tanısı Mikroorganizmanın üretilmesi Mikroorganizmaya
Mikrobiyolojide Moleküler Tanı Yöntemleri Dr.Tuncer ÖZEKİNCİ Dicle Üniversitesi Tıp Fakültesi Tıbbi Mikrobiyoloji A.D 1 Enfeksiyonun Özgül Laboratuvar Tanısı Mikroorganizmanın üretilmesi Mikroorganizmaya
TIBBİ MİKROBİYOLOJİ ANABİLİM DALI MEZUNİYET SONRASI (UZMANLIK) EĞİTİMİ DERS MÜFREDATI
 TIBBİ MİKROBİYOLOJİ ANABİLİM DALI MEZUNİYET SONRASI (UZMANLIK) EĞİTİMİ DERS MÜFREDATI DERS KODU MİK 0001 MİK 0002 MİK 0003 MİK 0004 MİK 0005 MİK 0006 MİK 0007 MİK 1000 MİK 4000 MİK 5000 KONU ADI Vaka Değerlendirme
TIBBİ MİKROBİYOLOJİ ANABİLİM DALI MEZUNİYET SONRASI (UZMANLIK) EĞİTİMİ DERS MÜFREDATI DERS KODU MİK 0001 MİK 0002 MİK 0003 MİK 0004 MİK 0005 MİK 0006 MİK 0007 MİK 1000 MİK 4000 MİK 5000 KONU ADI Vaka Değerlendirme
Sterilizasyon ve Dezenfeksiyon. Prof. Dr. Saim DAYAN
 Sterilizasyon ve Dezenfeksiyon Prof. Dr. Saim DAYAN 1 Hastanede Enfeksiyon Kontrolü Dezenfeksiyon Sterilizasyon El hijyeni Sürveyans-izolasyon önlemleri 2 Giriş Mikroorganizmaları etkisiz hale getirmek
Sterilizasyon ve Dezenfeksiyon Prof. Dr. Saim DAYAN 1 Hastanede Enfeksiyon Kontrolü Dezenfeksiyon Sterilizasyon El hijyeni Sürveyans-izolasyon önlemleri 2 Giriş Mikroorganizmaları etkisiz hale getirmek
STERİLİZASYON DERSİ 1. HAFTA DERS NOTLARI. Yrd. Doç. Dr. Kadri KULUALP
 STERİLİZASYON DERSİ 1. HAFTA DERS NOTLARI Yrd. Doç. Dr. Kadri KULUALP HASTANE ENFEKSİYONU NEDİR? 11.08.2005 tarihli Resmî Gazete de yayımlanarak yürürlüğe giren Yataklı Tedavi Kurumları Enfeksiyon Kontrol
STERİLİZASYON DERSİ 1. HAFTA DERS NOTLARI Yrd. Doç. Dr. Kadri KULUALP HASTANE ENFEKSİYONU NEDİR? 11.08.2005 tarihli Resmî Gazete de yayımlanarak yürürlüğe giren Yataklı Tedavi Kurumları Enfeksiyon Kontrol
MİKROBİYOLOJİ SORU KAMPI 2015
 Canlıların prokaryot ve ökoaryot olma özelliğini hücre komponentlerinden hangisi belirler? MİKROBİYOLOJİ SORU KAMPI 2015 B. Stoplazmik membran C. Golgi membranı D. Nükleer membran E. Endoplazmik retikulum
Canlıların prokaryot ve ökoaryot olma özelliğini hücre komponentlerinden hangisi belirler? MİKROBİYOLOJİ SORU KAMPI 2015 B. Stoplazmik membran C. Golgi membranı D. Nükleer membran E. Endoplazmik retikulum
Dezenfeksiyonu Etkileyen Faktörler. Fatih Üniversitesi Tıp Fakültesi, İnfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Anabilim Dalı, ANKARA
 Yrd. Doç. Dr. Özlem ALICI Fatih Üniversitesi Tıp Fakültesi, İnfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Anabilim Dalı, ANKARA Dezenfeksiyon; bir aletin, kullanım amacına bağlı olarak, tekrar kullanılması
Yrd. Doç. Dr. Özlem ALICI Fatih Üniversitesi Tıp Fakültesi, İnfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Anabilim Dalı, ANKARA Dezenfeksiyon; bir aletin, kullanım amacına bağlı olarak, tekrar kullanılması
İmza. İmza. İmza. İmza. İmza
 Sayfa: 1/7 Revizyonun Açıklaması Madde No Yeni yayınlandı. KAPSAM: Tıbbi birimler, Sterilizasyon, Temizlik hizmetleri Hazırlayan Kıymet Çelebi Enfeksiyon Hemşiresi Kontrol Funda BATMAZOĞLU Kalite Koordinatörü
Sayfa: 1/7 Revizyonun Açıklaması Madde No Yeni yayınlandı. KAPSAM: Tıbbi birimler, Sterilizasyon, Temizlik hizmetleri Hazırlayan Kıymet Çelebi Enfeksiyon Hemşiresi Kontrol Funda BATMAZOĞLU Kalite Koordinatörü
Sanitasyon ET HİJYENİ, MUAYENESİ VE TEKNOLOJİSİ DERS NOTLARI (5) PROF.DR.T.HALÛK ÇELİK
 ET HİJYENİ, MUAYENESİ VE TEKNOLOJİSİ DERS NOTLARI (5) PROF.DR.T.HALÛK ÇELİK Sanitasyon Ankara Üniversitesi Veteriner Fakültesi Gıda Hijyeni ve Teknolojisi Bölümü Giriş Dezenfeksiyon; belirli, arzu edilmeyen
ET HİJYENİ, MUAYENESİ VE TEKNOLOJİSİ DERS NOTLARI (5) PROF.DR.T.HALÛK ÇELİK Sanitasyon Ankara Üniversitesi Veteriner Fakültesi Gıda Hijyeni ve Teknolojisi Bölümü Giriş Dezenfeksiyon; belirli, arzu edilmeyen
DEZENFEKSİYON TALİMATI
 Sayfa No 1 / 6 Hazırlayan İnceleyen Onaylayan Enfeksiyon Kontrol Komitesi Kalite Yönetim Temsilcisi Başhekim 1.AMAÇ Hastanedeki tüm birimlerde sterilizasyon ve uygulamaları için yöntemlerin ve dezenfektan
Sayfa No 1 / 6 Hazırlayan İnceleyen Onaylayan Enfeksiyon Kontrol Komitesi Kalite Yönetim Temsilcisi Başhekim 1.AMAÇ Hastanedeki tüm birimlerde sterilizasyon ve uygulamaları için yöntemlerin ve dezenfektan
Enzimlerinin Saptanmasında
 Gram Negatif Bakterilerde Karbapenemaz Enzimlerinin Saptanmasında OXA-48 K-Se T, Blue-Carba Test ve PCR Testlerinin Etkinliğinin Karşılaştırılması Ayham Abulaila, Fatma Erdem, Zerrin Aktaş, Oral Öncül
Gram Negatif Bakterilerde Karbapenemaz Enzimlerinin Saptanmasında OXA-48 K-Se T, Blue-Carba Test ve PCR Testlerinin Etkinliğinin Karşılaştırılması Ayham Abulaila, Fatma Erdem, Zerrin Aktaş, Oral Öncül
STERİLİZASYON / DEZENFEKSİYON TALİMATI
 KOD:TL.50 YAY.TAR:10.10.2011 REV.TAR:01.03.2013 REV.NO:01 SAYFA :1/5 1. AMAÇ: Hastane genelindeki sterilizasyon/dezenfeksiyon uygulamaları için sterilizasyon yöntemlerini, dezenfektan seçimi ve dezenfektanların
KOD:TL.50 YAY.TAR:10.10.2011 REV.TAR:01.03.2013 REV.NO:01 SAYFA :1/5 1. AMAÇ: Hastane genelindeki sterilizasyon/dezenfeksiyon uygulamaları için sterilizasyon yöntemlerini, dezenfektan seçimi ve dezenfektanların
Etkin Madde Klorheksidin glukonat (%1)tır. Yardımcı madde olarak; Kuş üzümü aroması, Kiraz aroması ve Nane esansı içerir.
 KULLANIM KILAVUZU KLORHEX ORAL JEL Birim Formülü Etkin Madde Klorheksidin glukonat (%1)tır. Yardımcı madde olarak; Kuş üzümü aroması, Kiraz aroması ve Nane esansı içerir. Tıbbi Özellikleri Klorheksidin
KULLANIM KILAVUZU KLORHEX ORAL JEL Birim Formülü Etkin Madde Klorheksidin glukonat (%1)tır. Yardımcı madde olarak; Kuş üzümü aroması, Kiraz aroması ve Nane esansı içerir. Tıbbi Özellikleri Klorheksidin
Yer, yüzey ve alet dezenfektanları. Prof Dr Ayşe Kalkancı Gazi Üniversitesi Tıp Fakültesi Tıbbi Mikrobiyoloji Anabilim Dalı
 Yer, yüzey ve alet dezenfektanları Prof Dr Ayşe Kalkancı Gazi Üniversitesi Tıp Fakültesi Tıbbi Mikrobiyoloji Anabilim Dalı 1 Dezenfeksiyon ve dezenfektan nedir? Cansız ortamlarda bulunan mikroorganizmaların
Yer, yüzey ve alet dezenfektanları Prof Dr Ayşe Kalkancı Gazi Üniversitesi Tıp Fakültesi Tıbbi Mikrobiyoloji Anabilim Dalı 1 Dezenfeksiyon ve dezenfektan nedir? Cansız ortamlarda bulunan mikroorganizmaların
BALIK HASTALIKLARININ KONTROLÜ
 BALIK HASTALIKLARININ KONTROLÜ Hastalığın Çıkışını Engelleyici Önlemler Hastalıklardan korunma ile ilgili öncelikli emniyet tedbirleri, sağlıklı canlılarla, sağlıklı yumurtalarla uygun oranlarda stoklama
BALIK HASTALIKLARININ KONTROLÜ Hastalığın Çıkışını Engelleyici Önlemler Hastalıklardan korunma ile ilgili öncelikli emniyet tedbirleri, sağlıklı canlılarla, sağlıklı yumurtalarla uygun oranlarda stoklama
1-Tanım: Mikrop dünyası ve mikroorganizmaların sınıflandırılmasının öğretilmesi.
 MİKROBİYOLOJİ I-DERS TANIMLARI 1-Tanım: Mikrop dünyası ve mikroorganizmaların sınıflandırılmasının öğretilmesi. b. Amaç: Mikrobiyoloji bilimi ve çalıştığı alanlar ile ilgili genel bilgi öğretilmesi amaçlanmıştır.
MİKROBİYOLOJİ I-DERS TANIMLARI 1-Tanım: Mikrop dünyası ve mikroorganizmaların sınıflandırılmasının öğretilmesi. b. Amaç: Mikrobiyoloji bilimi ve çalıştığı alanlar ile ilgili genel bilgi öğretilmesi amaçlanmıştır.
MYCOBACTERIUM TUBERCULOSIS KOMPLEKS KLİNİK İZOLATLARINDA İZONİAZİD DİRENCİNE NEDEN OLAN DIŞA ATIM POMPALARININ SAPTANMASI
 MYCOBACTERIUM TUBERCULOSIS KOMPLEKS KLİNİK İZOLATLARINDA İZONİAZİD DİRENCİNE NEDEN OLAN DIŞA ATIM POMPALARININ SAPTANMASI Özlem Tuncer¹, Orhan Kaya Köksalan², Zeynep Sarıbaş¹ ¹Hacettepe Üniversitesi Tıp
MYCOBACTERIUM TUBERCULOSIS KOMPLEKS KLİNİK İZOLATLARINDA İZONİAZİD DİRENCİNE NEDEN OLAN DIŞA ATIM POMPALARININ SAPTANMASI Özlem Tuncer¹, Orhan Kaya Köksalan², Zeynep Sarıbaş¹ ¹Hacettepe Üniversitesi Tıp
Dr. Murat Günaydın. Ondokuz Mayıs Üniversitesi, Tıp Fakültesi Tıbbi Mikrobiyoloji AD. Samsun. murat@omu.edu.tr
 DEZENFEKSİYON ve DEZENFEKTAN Dr. Murat Günaydın Ondokuz Mayıs Üniversitesi, Tıp Fakültesi Tıbbi Mikrobiyoloji AD. Samsun murat@omu.edu.tr Uygun olmayan dezenfeksiyon İnfeksiyon bulaşı Gastrointestinal
DEZENFEKSİYON ve DEZENFEKTAN Dr. Murat Günaydın Ondokuz Mayıs Üniversitesi, Tıp Fakültesi Tıbbi Mikrobiyoloji AD. Samsun murat@omu.edu.tr Uygun olmayan dezenfeksiyon İnfeksiyon bulaşı Gastrointestinal
TIP 103 HÜCRE DERS KURULU 3.KURUL 1. HAFTA. 13 Şubat 2019 Çarşamba
 09:5 0:5 0:30 :5 :30 2:5 2:30 4:5 5:5 Şubat 209 TIP 03 HÜCRE DERS KURULU 2 Şubat 208 3.KURUL. HAFTA 3 Şubat 209 S D III Moleküllerin Membrandan Difüzyonu I Moleküllerin Membrandan Difüzyonu II Membran
09:5 0:5 0:30 :5 :30 2:5 2:30 4:5 5:5 Şubat 209 TIP 03 HÜCRE DERS KURULU 2 Şubat 208 3.KURUL. HAFTA 3 Şubat 209 S D III Moleküllerin Membrandan Difüzyonu I Moleküllerin Membrandan Difüzyonu II Membran
EL YIKAMA. Acıbadem Kadıköy Hastanesi Enfeksiyon Kontrol Hemşiresi Funda Peker
 EL YIKAMA Acıbadem Kadıköy Hastanesi Enfeksiyon Kontrol Hemşiresi Funda Peker El Yıkama-tarihçesi Tıp tarihi incelendiğinde, el yıkama ile infeksiyon hastalıklarının önlenebildiğine dair veriler XIX. yüzyıla
EL YIKAMA Acıbadem Kadıköy Hastanesi Enfeksiyon Kontrol Hemşiresi Funda Peker El Yıkama-tarihçesi Tıp tarihi incelendiğinde, el yıkama ile infeksiyon hastalıklarının önlenebildiğine dair veriler XIX. yüzyıla
BAL ÜRETİM SÜRECİNDE KRİTİK KONTROL NOKTALARININ BELİRLENMESİ, SEKONDER KONTAMİNASYON KAYNAKLARININ
 BAL ÜRETİM SÜRECİNDE KRİTİK KONTROL NOKTALARININ BELİRLENMESİ, SEKONDER KONTAMİNASYON KAYNAKLARININ ve TEHLİKELERİN TANIMLANMASI, RİSK FAKTÖRLERİNİN VE KORELASYON İLİŞKİLERİNİN ORTAYA KONMASI Hayrettin
BAL ÜRETİM SÜRECİNDE KRİTİK KONTROL NOKTALARININ BELİRLENMESİ, SEKONDER KONTAMİNASYON KAYNAKLARININ ve TEHLİKELERİN TANIMLANMASI, RİSK FAKTÖRLERİNİN VE KORELASYON İLİŞKİLERİNİN ORTAYA KONMASI Hayrettin
Tıbbi Cihaz Dezenfektanları. Prof. Dr. Cüneyt ÖZAKIN Uludağ Üniversitesi Tıp Fakültesi Tıbbi Mikrobiyoloji AD. BURSA
 Tıbbi Cihaz Dezenfektanları Prof. Dr. Cüneyt ÖZAKIN Uludağ Üniversitesi Tıp Fakültesi Tıbbi Mikrobiyoloji AD. BURSA Enfeksiyonların önlenmesinde, temizlik ve el yıkama gibi basit fakat çok etkili olan
Tıbbi Cihaz Dezenfektanları Prof. Dr. Cüneyt ÖZAKIN Uludağ Üniversitesi Tıp Fakültesi Tıbbi Mikrobiyoloji AD. BURSA Enfeksiyonların önlenmesinde, temizlik ve el yıkama gibi basit fakat çok etkili olan
Gebelikte vulvavagina kandidozu:
 Gebelikte vulvavagina kandidozu: Borik asit ile 13 farklı antifungal ilacın CLSI M27-A3 protokolüne göre duyarlılık sonuçları ve dört virulans faktörünün incelenmesi Ayşe Kalkancı 1, Ahmet Barış Güzel
Gebelikte vulvavagina kandidozu: Borik asit ile 13 farklı antifungal ilacın CLSI M27-A3 protokolüne göre duyarlılık sonuçları ve dört virulans faktörünün incelenmesi Ayşe Kalkancı 1, Ahmet Barış Güzel
OXA-48 in Saptanmasına Yönelik İzotermal Rekombinaz Polimeraz Amplifikasyon Yöntemine Dayalı Bir Hızlı Moleküler Test Formatının Geliştirilmesi
 OXA-48 in Saptanmasına Yönelik İzotermal Rekombinaz Polimeraz Amplifikasyon Yöntemine Dayalı Bir Hızlı Moleküler Test Formatının Geliştirilmesi Mert Ahmet Kuşkucu, Gökhan Aygün, Asiye Karakullukçu, Nergiz
OXA-48 in Saptanmasına Yönelik İzotermal Rekombinaz Polimeraz Amplifikasyon Yöntemine Dayalı Bir Hızlı Moleküler Test Formatının Geliştirilmesi Mert Ahmet Kuşkucu, Gökhan Aygün, Asiye Karakullukçu, Nergiz
YÜKSEK LİSANS TEZİ T.C. GAZİ ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ TIBBİ MİKROBİYOLOJİ ANABİLİM DALI MERVE ERDOĞAN
 MERVE ERDOĞAN TIBBİ MİKROBİYOLOJİ ANABİLİM DALI T.C. GAZİ ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ YÜKSEK LİSANS TEZİ SODYUM HİPOKLORİT, BENZALKONYUM KLORİT VE KLORHEKZİDİN İLE KARŞILAŞMIŞ CANDIDA ALBICANS
MERVE ERDOĞAN TIBBİ MİKROBİYOLOJİ ANABİLİM DALI T.C. GAZİ ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ YÜKSEK LİSANS TEZİ SODYUM HİPOKLORİT, BENZALKONYUM KLORİT VE KLORHEKZİDİN İLE KARŞILAŞMIŞ CANDIDA ALBICANS
ÖZEL YALOVA HASTANESİ STERİLİZASYON DEZENFEKSİYON TALİMATI
 Döküman Kodu:EN.TL.25 Yayın Tarihi:01/08/11 Revizyon No:02 Revizyon Tarihi:11/11/15 Sayfa No:7 1.AMAÇ:Hastane genelindeki sterilizasyon/dezenfeksiyon uygulamaları için sterilizasyon yöntemlerini, dezenfektan
Döküman Kodu:EN.TL.25 Yayın Tarihi:01/08/11 Revizyon No:02 Revizyon Tarihi:11/11/15 Sayfa No:7 1.AMAÇ:Hastane genelindeki sterilizasyon/dezenfeksiyon uygulamaları için sterilizasyon yöntemlerini, dezenfektan
'nosocomial' Yunanca iki kelimeden oluşur
 'nosocomial' Yunanca iki kelimeden oluşur 'nosus' hastalık 'komeion' icabına bakmak 'nosocomial' tıbbi tedavi altında iken hastanın edindiği herhangi bir hastalık Tanım Enfeksiyon Hastaneye yatırıldığında
'nosocomial' Yunanca iki kelimeden oluşur 'nosus' hastalık 'komeion' icabına bakmak 'nosocomial' tıbbi tedavi altında iken hastanın edindiği herhangi bir hastalık Tanım Enfeksiyon Hastaneye yatırıldığında
GRUP BAKTERİYOFAJ ANTİ-BAKTERİYEL BOYAR KAPLAMAÇÖZELTİSİ HAZIRLANMASI
 TÜBİTAK-BİDEB KİMYAGERLİK, KİMYA ÖĞRETMENLİĞİ VE KİMYA MÜHENDİSLİĞİ KİMYA LİSANS ÖĞRENCİLERİ ARAŞTIRMA PROJESİ EĞİTİMİ ÇALIŞTAYI (KİMYA-2 ÇALIŞTAY 2011 ANTİ-BAKTERİYEL BOYAR KAPLAMAÇÖZELTİSİ HAZIRLANMASI
TÜBİTAK-BİDEB KİMYAGERLİK, KİMYA ÖĞRETMENLİĞİ VE KİMYA MÜHENDİSLİĞİ KİMYA LİSANS ÖĞRENCİLERİ ARAŞTIRMA PROJESİ EĞİTİMİ ÇALIŞTAYI (KİMYA-2 ÇALIŞTAY 2011 ANTİ-BAKTERİYEL BOYAR KAPLAMAÇÖZELTİSİ HAZIRLANMASI
Mikroorganizmalar gözle görülmezler, bu yüzden mikroskopla incelenirler.
 10. Sınıf Enfeksiyondan Korunma 2.Hafta ( 22-26 / 09 / 2014 ) ENFEKSİYON ETKENLERİNİN SINIFLANDIRILMASI 1.) BAKTERİLER 2.) VİRÜSLER Slayt No : 2 Mikroorganizmaların Sınıflandırılması ; a.) Sayısal Yöntem,
10. Sınıf Enfeksiyondan Korunma 2.Hafta ( 22-26 / 09 / 2014 ) ENFEKSİYON ETKENLERİNİN SINIFLANDIRILMASI 1.) BAKTERİLER 2.) VİRÜSLER Slayt No : 2 Mikroorganizmaların Sınıflandırılması ; a.) Sayısal Yöntem,
BAKTERİLERDE EKSTRAKROMOZAL GENETİK ELEMENTLER
 BAKTERİLERDE EKSTRAKROMOZAL GENETİK ELEMENTLER Plazmid ve Epizomlar Bakterilerin kendi kromozomlarının yanı sıra, kromozom dışı bazı genetik parçacıklar bulunmaktadır Bakteri kromozomundan daha küçük yapıda
BAKTERİLERDE EKSTRAKROMOZAL GENETİK ELEMENTLER Plazmid ve Epizomlar Bakterilerin kendi kromozomlarının yanı sıra, kromozom dışı bazı genetik parçacıklar bulunmaktadır Bakteri kromozomundan daha küçük yapıda
Sitoplazmik membran periferal integral
 İÇ YAPILAR Sitoplazmik membran Hücre duvarının altında, ince ve bakterilerde genellikle aynı yapıda İki katmandan oluşur Periplasmik boşluk ve sitoplazmaya bakan yüzeyde, protein ve fosfolipid İç bölgede,
İÇ YAPILAR Sitoplazmik membran Hücre duvarının altında, ince ve bakterilerde genellikle aynı yapıda İki katmandan oluşur Periplasmik boşluk ve sitoplazmaya bakan yüzeyde, protein ve fosfolipid İç bölgede,
YGS YE HAZIRLIK DENEMESi #13
 YGS YE HAZIRLIK DENEMESi #13 1) Canlılarda özelliklerin genlerle kontrol edildiği ve her genin en az bir özellikten sorumlu olduğu bilindiğine göre, I. Diploid canlılarda her özellik için iki gen bulunması
YGS YE HAZIRLIK DENEMESi #13 1) Canlılarda özelliklerin genlerle kontrol edildiği ve her genin en az bir özellikten sorumlu olduğu bilindiğine göre, I. Diploid canlılarda her özellik için iki gen bulunması
El Hijyeni. Prof. Dr. Murat Günaydın Ondokuz Mayıs Üniversitesi Tıp Fakültesi Mikrobiyoloji ve Klinik Mikrobiyoloji Anabilimdalı / Samsun
 El Hijyeni Prof. Dr. Murat Günaydın Ondokuz Mayıs Üniversitesi Tıp Fakültesi Mikrobiyoloji ve Klinik Mikrobiyoloji Anabilimdalı / Samsun Deri ve Flora Derimiz yaklaşık olarak 1.5 metre kare alana sahip
El Hijyeni Prof. Dr. Murat Günaydın Ondokuz Mayıs Üniversitesi Tıp Fakültesi Mikrobiyoloji ve Klinik Mikrobiyoloji Anabilimdalı / Samsun Deri ve Flora Derimiz yaklaşık olarak 1.5 metre kare alana sahip
Biyosid Hastane ve diğer sağlık kuruluşları. Mikrobisid. Mikrobiostatik. Hazır gıda ve kozmetik sektörü. Sınıflama. Antiseptikler.
 1 Dezenfektan direnci nedir? BAKTERİLER VE DEZENFEKTANLARA DİRENÇ 2 3 Direnç nasıl oluşur? Antibiyotik direnci ilişki? Yard.Doç.Dr Elif DOYUK KARTAL Eskişehir Osmangazi Üniversitesi Tıp Fakültesi Klinik
1 Dezenfektan direnci nedir? BAKTERİLER VE DEZENFEKTANLARA DİRENÇ 2 3 Direnç nasıl oluşur? Antibiyotik direnci ilişki? Yard.Doç.Dr Elif DOYUK KARTAL Eskişehir Osmangazi Üniversitesi Tıp Fakültesi Klinik
Hücre Transfeksiyonu
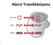 1 Hücre Transfeksiyonu Tanımlar Transformasyon: Bakteri ve bitkilere gene/k materyal aktarılması işlemidir. Transdüksiyon: Ökaryo/k hücrelere gene/k materyallerin viral yöntemlerle aktarılması işlemidir.
1 Hücre Transfeksiyonu Tanımlar Transformasyon: Bakteri ve bitkilere gene/k materyal aktarılması işlemidir. Transdüksiyon: Ökaryo/k hücrelere gene/k materyallerin viral yöntemlerle aktarılması işlemidir.
Gram (+)Bakterilerde Duvar Yapısı Gram (-) Bakterilerde Duvar Yapısı Lipopolisakkaritin Önemi
 Gram (+)Bakterilerde Duvar Yapısı Çoğunluğu peptidoglikan yapıdır. Bunun yanında teikoik asitte içerirler. Bu yapı gliserol veya Ribitolün PO4 gruplarına bağlanmasıyla oluşur. Teikoik asitler peptidoglikan
Gram (+)Bakterilerde Duvar Yapısı Çoğunluğu peptidoglikan yapıdır. Bunun yanında teikoik asitte içerirler. Bu yapı gliserol veya Ribitolün PO4 gruplarına bağlanmasıyla oluşur. Teikoik asitler peptidoglikan
Komplike deri ve yumuşak doku enfeksiyonu etkeni çoklu dirençli patojenlerin bakteriyofaj duyarlılıklarının araştırılması
 Komplike deri ve yumuşak doku enfeksiyonu etkeni çoklu dirençli patojenlerin bakteriyofaj duyarlılıklarının araştırılması Aycan Gundogdu, Ph.D. Erciyes Üniversitesi Tıp Fakültesi Tıbbi Mikrobiyoloji Anabilim
Komplike deri ve yumuşak doku enfeksiyonu etkeni çoklu dirençli patojenlerin bakteriyofaj duyarlılıklarının araştırılması Aycan Gundogdu, Ph.D. Erciyes Üniversitesi Tıp Fakültesi Tıbbi Mikrobiyoloji Anabilim
SIVI SABUNLARIN ANTİBAKTERİYEL ÖZELLİKLERİNİN KARŞILAŞTIRILMASI
 KİMYA BİLİM DANIŞMANLIĞI ÇALIŞTAYI 29 AĞUSTOS 09 EYLÜL 2007 ÇANAKKALE BİYOKİMYA GRUBU SIVI SABUNLARIN ANTİBAKTERİYEL ÖZELLİKLERİNİN KARŞILAŞTIRILMASI PROJE EKİBİ DANIŞMANLAR: Doç. Dr. Cahit AKGÜL ÇOMÜ
KİMYA BİLİM DANIŞMANLIĞI ÇALIŞTAYI 29 AĞUSTOS 09 EYLÜL 2007 ÇANAKKALE BİYOKİMYA GRUBU SIVI SABUNLARIN ANTİBAKTERİYEL ÖZELLİKLERİNİN KARŞILAŞTIRILMASI PROJE EKİBİ DANIŞMANLAR: Doç. Dr. Cahit AKGÜL ÇOMÜ
KISITLI ANTİBİYOTİK BİLDİRİMİ
 KISITLI ANTİBİYOTİK BİLDİRİMİ YAYIN TARİHİ 01/07/2011 REVİZYON TAR.-NO 00 BÖLÜM NO 04 STANDART NO 11 DEĞERLENDİRME ÖLÇÜTÜ 00 Kısıtlı Bildirim : Duyarlılık test sonuçları klinikteki geniş spektrumlu antimikrobik
KISITLI ANTİBİYOTİK BİLDİRİMİ YAYIN TARİHİ 01/07/2011 REVİZYON TAR.-NO 00 BÖLÜM NO 04 STANDART NO 11 DEĞERLENDİRME ÖLÇÜTÜ 00 Kısıtlı Bildirim : Duyarlılık test sonuçları klinikteki geniş spektrumlu antimikrobik
STERİLİZASYON DEZENFEKSİYON PROSEDÜRÜ
 Sayfa No 5/1 Hazırlayan İnceleyen Onaylayan Enfeksiyon Kontrol Komitesi Kalite Yönetim Direktörü Başhekim 1. AMAÇ Çevre Hastanesi dezenfeksiyon ve sterilizasyonun daha etkin sağlanması kuralları belirlemektir.
Sayfa No 5/1 Hazırlayan İnceleyen Onaylayan Enfeksiyon Kontrol Komitesi Kalite Yönetim Direktörü Başhekim 1. AMAÇ Çevre Hastanesi dezenfeksiyon ve sterilizasyonun daha etkin sağlanması kuralları belirlemektir.
Asidik suyun özellikleri. Alkali suyun özellikleri. ph > 11 ORP < -800mV Cl içermez. ph < 2,7 ORP < 1100mV Cl derişimi: 10-80 ppm
 Et Endüstrisinde Elektrolize Yükseltgen Su Uygulaması Cem Okan ÖZER, Birol KILIÇ SÜLEYMAN DEMİREL ÜNİVERSİTESİ GIDA MÜHENDİSLİĞİ Elektrolize yükseltgen su Kontaminasyon=problem Bakteriler otostopçudur.
Et Endüstrisinde Elektrolize Yükseltgen Su Uygulaması Cem Okan ÖZER, Birol KILIÇ SÜLEYMAN DEMİREL ÜNİVERSİTESİ GIDA MÜHENDİSLİĞİ Elektrolize yükseltgen su Kontaminasyon=problem Bakteriler otostopçudur.
Dr. Aysun YALÇI Gülhane Eğitim Araştırma Hastanesi , ANKARA
 Dr. Aysun YALÇI Gülhane Eğitim Araştırma Hastanesi 29.03.2017, ANKARA Sunum Planı Giriş Antimikrobiyal direnci önleme Direncin önlenmesinde WHO, İDSA,CDC önerileri El hijyeni Temas izolasyonu önlemleri
Dr. Aysun YALÇI Gülhane Eğitim Araştırma Hastanesi 29.03.2017, ANKARA Sunum Planı Giriş Antimikrobiyal direnci önleme Direncin önlenmesinde WHO, İDSA,CDC önerileri El hijyeni Temas izolasyonu önlemleri
ANTİFUNGAL DİRENÇ ve ANTİFUNGAL DUYARLILIK TESTLERİ
 ANTİFUNGAL DİRENÇ ve ANTİFUNGAL DUYARLILIK TESTLERİ STANDART DUYARLILIK YÖNTEMLERİ ve ANTİFUNGAL DUYARLILIK TESTLERİNDE NEYİ, NASIL ve NE ZAMAN UYGULAMALIYIZ? Mine Doluca Dereli Dokuz Eylül Üniversitesi
ANTİFUNGAL DİRENÇ ve ANTİFUNGAL DUYARLILIK TESTLERİ STANDART DUYARLILIK YÖNTEMLERİ ve ANTİFUNGAL DUYARLILIK TESTLERİNDE NEYİ, NASIL ve NE ZAMAN UYGULAMALIYIZ? Mine Doluca Dereli Dokuz Eylül Üniversitesi
Çizelge 2.6. Farklı ph ve su sıcaklığı değerlerinde amonyak düzeyi (toplam amonyağın yüzdesi olarak) (Boyd 2008a)
 - Azotlu bileşikler Su ürünleri yetiştiricilik sistemlerinde oksijen gereksinimi karşılandığı takdirde üretimi sınırlayan ikinci faktör azotlu bileşiklerin birikimidir. Ana azotlu bileşikler; azot gazı
- Azotlu bileşikler Su ürünleri yetiştiricilik sistemlerinde oksijen gereksinimi karşılandığı takdirde üretimi sınırlayan ikinci faktör azotlu bileşiklerin birikimidir. Ana azotlu bileşikler; azot gazı
STERİLİZASYON DEZENFEKSİYON VE ANTİSEPSİ TALİMATI
 Dok No:ENF.TL.07 Yayın tarihi:nisan 2013 Rev.Tar/no:-/0 Sayfa No: 1 / 7 1.0 AMAÇ:Hastanedeki tüm birimlerde sterilizasyon, antisepsi ve dezenfeksiyon uygulamaları için yöntemlerin ve dezenfektan kullanım
Dok No:ENF.TL.07 Yayın tarihi:nisan 2013 Rev.Tar/no:-/0 Sayfa No: 1 / 7 1.0 AMAÇ:Hastanedeki tüm birimlerde sterilizasyon, antisepsi ve dezenfeksiyon uygulamaları için yöntemlerin ve dezenfektan kullanım
ÖZEL EGE LİSESİ BAKTERİLERE KARŞI BİTKİSEL DEZENFEKTANLAR
 ÖZEL EGE LİSESİ BAKTERİLERE KARŞI BİTKİSEL DEZENFEKTANLAR HAZIRLAYAN ÖĞRENCİ: Sude SÜMBÜL DANIŞMAN ÖĞRETMEN: Melike GÜZEL İZMİR 2016 İÇİNDEKİLER 1.Proje özeti...2 2.Projenin amacı...2-3 3. Giriş...3-4-5
ÖZEL EGE LİSESİ BAKTERİLERE KARŞI BİTKİSEL DEZENFEKTANLAR HAZIRLAYAN ÖĞRENCİ: Sude SÜMBÜL DANIŞMAN ÖĞRETMEN: Melike GÜZEL İZMİR 2016 İÇİNDEKİLER 1.Proje özeti...2 2.Projenin amacı...2-3 3. Giriş...3-4-5
Yrd. Doç. Dr. Seda SABAH Teknolojisi (Tartışma) 11:30 12:15 Tıbbi Biyoloji ve Genetik: DNA. Yrd. Doç. Dr. Seda SABAH Teknolojisi (Tartışma)
 HÜCRE BİLİMLERİ DERS KURULU III KURUL SORUMLUSU: DOÇ. DR. A.YEŞİM GÖÇMEN KURUL SORUMLUSU YARDIMCISI: YRD. DOÇ. DR. TEKİN YILDIRIM TIP103 HÜCRE BİLİMLERİ DERS KURULU III I. HAFTA 06.02.2017 (Pazartesi)
HÜCRE BİLİMLERİ DERS KURULU III KURUL SORUMLUSU: DOÇ. DR. A.YEŞİM GÖÇMEN KURUL SORUMLUSU YARDIMCISI: YRD. DOÇ. DR. TEKİN YILDIRIM TIP103 HÜCRE BİLİMLERİ DERS KURULU III I. HAFTA 06.02.2017 (Pazartesi)
T. C. İSTANBUL BİLİM ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ BİYOKİMYA ANABİLİM DALI YÜKSEK LİSANS PROGRAMI EĞİTİM-ÖĞRETİM YILI MÜFREDATI
 I. YARIYILI T. C. İSTANBUL BİLİM ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ BİYOKİMYA ANABİLİM DALI YÜKSEK LİSANS PROGRAMI 2016-2017 EĞİTİM-ÖĞRETİM YILI MÜFREDATI B 601 Temel Biyokimya I Zorunlu 3 0 3 4 B
I. YARIYILI T. C. İSTANBUL BİLİM ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ BİYOKİMYA ANABİLİM DALI YÜKSEK LİSANS PROGRAMI 2016-2017 EĞİTİM-ÖĞRETİM YILI MÜFREDATI B 601 Temel Biyokimya I Zorunlu 3 0 3 4 B
CANDİDA İLE UYARILMIŞ VAJİNAL VE BUKKAL EPİTEL HÜCRELERİNİN SİTOKİN ÜRETİMİ
 CANDİDA İLE UYARILMIŞ VAJİNAL VE BUKKAL EPİTEL HÜCRELERİNİN SİTOKİN ÜRETİMİ Emine Yeşilyurt, Sevgi Özyeğen Aslan, Ayşe Kalkancı, Işıl Fidan, Semra Kuştimur Gazi Üniversitesi Tıp Fakültesi Tıbbi Mikrobiyoloji
CANDİDA İLE UYARILMIŞ VAJİNAL VE BUKKAL EPİTEL HÜCRELERİNİN SİTOKİN ÜRETİMİ Emine Yeşilyurt, Sevgi Özyeğen Aslan, Ayşe Kalkancı, Işıl Fidan, Semra Kuştimur Gazi Üniversitesi Tıp Fakültesi Tıbbi Mikrobiyoloji
Biyolojik Risk Etmenleri
 Biyolojik Risk Etmenleri Mesleki tehlikeler Biyolojik, Biyomekanik, Kimyasal, Fiziksel (+radyolojik) Psikososyal TANIMLAMA Çalışma yaşamında biyolojik risk etkenleri denildiğinde akla, herhangi bir enfeksiyona,
Biyolojik Risk Etmenleri Mesleki tehlikeler Biyolojik, Biyomekanik, Kimyasal, Fiziksel (+radyolojik) Psikososyal TANIMLAMA Çalışma yaşamında biyolojik risk etkenleri denildiğinde akla, herhangi bir enfeksiyona,
ANTİPERSPİRANTLAR, DEODORANTLAR ve ANTİMİKROBİYAL AJANLAR
 ANTİPERSPİRANTLAR, DEODORANTLAR ve ANTİMİKROBİYAL AJANLAR Deodorantlar ve antiperspirantlar en fazla kullanılan kozmetik ürünlerindendir. Her gün milyonlarca kişi tarafında koltuk altına uygulanmaktadırlar.
ANTİPERSPİRANTLAR, DEODORANTLAR ve ANTİMİKROBİYAL AJANLAR Deodorantlar ve antiperspirantlar en fazla kullanılan kozmetik ürünlerindendir. Her gün milyonlarca kişi tarafında koltuk altına uygulanmaktadırlar.
DETERJAN VE DEZENFEKTANLAR. Fırat ÖZEL, Gıda Mühendisi 2006
 DETERJAN VE DEZENFEKTANLAR Fırat ÖZEL, Gıda Mühendisi 2006 ÖNEMLİ! Gıdaları insanların sağlıklarını çok ciddi şekilde etkiler. Bu nedenle, gıda üreten kişilerin temizlik kurallarına uyması çok önemlidir.
DETERJAN VE DEZENFEKTANLAR Fırat ÖZEL, Gıda Mühendisi 2006 ÖNEMLİ! Gıdaları insanların sağlıklarını çok ciddi şekilde etkiler. Bu nedenle, gıda üreten kişilerin temizlik kurallarına uyması çok önemlidir.
ADIM ADIM YGS-LYS 55. ADIM CANLILARIN SINIFLANDIRILMASI-15 VİRÜSLER
 ADIM ADIM YGS-LYS 55. ADIM CANLILARIN SINIFLANDIRILMASI-15 VİRÜSLER Virüsler Hücresel yapı da dahil olmak üzere canlıların ortak özelliklerini göstermeyen canlılardır. Prokaryotlardan daha küçüklerdir.
ADIM ADIM YGS-LYS 55. ADIM CANLILARIN SINIFLANDIRILMASI-15 VİRÜSLER Virüsler Hücresel yapı da dahil olmak üzere canlıların ortak özelliklerini göstermeyen canlılardır. Prokaryotlardan daha küçüklerdir.
Su Şartlandırma Ürünleri
 Su Şartlandırma Ürünleri M801 Stabilizatörlü %56 lık Hızlı Çözülen Granül Klor M802 Stabilizatörlü %90 lık Yavaş Çözülen Granül/Tablet Klor Hızlı çözülen ve siyanürik asit içeren %56 lık organik klor
Su Şartlandırma Ürünleri M801 Stabilizatörlü %56 lık Hızlı Çözülen Granül Klor M802 Stabilizatörlü %90 lık Yavaş Çözülen Granül/Tablet Klor Hızlı çözülen ve siyanürik asit içeren %56 lık organik klor
GIDA KAYNAKLI HASTALIKLAR. Gıda orijinli hastalıklar gıda zehirlenmesi gıda enfeksiyonu olarak 2 ana gruba ayrılır.
 GIDA KAYNAKLI HASTALIKLAR Gıda orijinli hastalıklar gıda zehirlenmesi gıda enfeksiyonu olarak 2 ana gruba ayrılır. Gıda Enfeksiyonu: Patojen bir m.o ile kontamine olmuş bir gıdanın yenmesi sonucu oluşan
GIDA KAYNAKLI HASTALIKLAR Gıda orijinli hastalıklar gıda zehirlenmesi gıda enfeksiyonu olarak 2 ana gruba ayrılır. Gıda Enfeksiyonu: Patojen bir m.o ile kontamine olmuş bir gıdanın yenmesi sonucu oluşan
TIBBİ MİKROBİYOLOJİ ANABİLİM DALI Tıbbi Mikrobiyoloji Programı
 TIBBİ MİKROBİYOLOJİ ANABİLİM DALI Tıbbi Mikrobiyoloji Programı Programa Kabul Koşulları: Yüksek Lisans: Fen, Eczacılık ve Mühendislik Fakültelerinin Biyoloji, Gıda, Çevre ve Kimya ile ilgili bölümlerinden
TIBBİ MİKROBİYOLOJİ ANABİLİM DALI Tıbbi Mikrobiyoloji Programı Programa Kabul Koşulları: Yüksek Lisans: Fen, Eczacılık ve Mühendislik Fakültelerinin Biyoloji, Gıda, Çevre ve Kimya ile ilgili bölümlerinden
Sterilizasyon/Dezenfeksiyon Talimatı
 GOÜ Araştırma ve Uygulama Merkezi Enfeksiyon Kontrol Komitesi Sterilizasyon/Dezenfeksiyon Talimatı Talimat No :8 Düzenleme Tarihi :01.01.2005 Revizyon Tarihi:19.07.2012 1. AMAÇ Hastane genelindeki sterilizasyon/dezenfeksiyon
GOÜ Araştırma ve Uygulama Merkezi Enfeksiyon Kontrol Komitesi Sterilizasyon/Dezenfeksiyon Talimatı Talimat No :8 Düzenleme Tarihi :01.01.2005 Revizyon Tarihi:19.07.2012 1. AMAÇ Hastane genelindeki sterilizasyon/dezenfeksiyon
Sorunlu Mikroorganizmalar, Sorunlu Antibiyotikler ve E Test. Prof.Dr.Güner Söyletir Marmara Üniversitesi, İstanbul
 Sorunlu Mikroorganizmalar, Sorunlu Antibiyotikler ve E Test Prof.Dr.Güner Söyletir Marmara Üniversitesi, İstanbul Sorunlu Mikroorganizmalar Nonfermentatif bakteriler Acinetobacter sp. Stenotrophomonas
Sorunlu Mikroorganizmalar, Sorunlu Antibiyotikler ve E Test Prof.Dr.Güner Söyletir Marmara Üniversitesi, İstanbul Sorunlu Mikroorganizmalar Nonfermentatif bakteriler Acinetobacter sp. Stenotrophomonas
12.Hafta YARI KATI İLAÇ ŞEKİLLERİ
 12.Hafta YARI KATI İLAÇ ŞEKİLLERİ Deriden geçişin artırılması 1- Fiziksel yöntemler Sonoforez / Fonoforez (Sonophoresis / Phonophoresis) İyontoforez (Iontophoresis) Elektrodelme (Electroporation) Mikro
12.Hafta YARI KATI İLAÇ ŞEKİLLERİ Deriden geçişin artırılması 1- Fiziksel yöntemler Sonoforez / Fonoforez (Sonophoresis / Phonophoresis) İyontoforez (Iontophoresis) Elektrodelme (Electroporation) Mikro
I. YARIYIL TEMEL BİYOKİMYA I (B 601 TEORİK 3, 3 KREDİ)
 T.C. İSTANBUL BİLİM ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ BİYOKİMYA ANABİLİM DALI YÜKSEK LİSANS PROGRAMI 2014-2015 EĞİTİM-ÖĞRETİM YILI DERS İÇERİKLERİ I. YARIYIL TEMEL BİYOKİMYA I (B 601 TEORİK 3, 3
T.C. İSTANBUL BİLİM ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ BİYOKİMYA ANABİLİM DALI YÜKSEK LİSANS PROGRAMI 2014-2015 EĞİTİM-ÖĞRETİM YILI DERS İÇERİKLERİ I. YARIYIL TEMEL BİYOKİMYA I (B 601 TEORİK 3, 3
ADIM ADIM YGS LYS Adım DOLAŞIM SİSTEMİ 5 İNSANDA BAĞIŞIKLIK VE VÜCUDUN SAVUNULMASI
 ADIM ADIM YGS LYS 177. Adım DOLAŞIM SİSTEMİ 5 İNSANDA BAĞIŞIKLIK VE VÜCUDUN SAVUNULMASI İNSANDA BAĞIŞIKLIK VE VÜCUDUN SAVUNULMASI Hastalık yapıcı organizmalara karşı vücudun gösterdiği dirence bağışıklık
ADIM ADIM YGS LYS 177. Adım DOLAŞIM SİSTEMİ 5 İNSANDA BAĞIŞIKLIK VE VÜCUDUN SAVUNULMASI İNSANDA BAĞIŞIKLIK VE VÜCUDUN SAVUNULMASI Hastalık yapıcı organizmalara karşı vücudun gösterdiği dirence bağışıklık
