FEN BİLGİSİ ÖĞRETMENLİĞİ
|
|
|
- Coskun Çağlayan
- 7 yıl önce
- İzleme sayısı:
Transkript
1 T.C. ANADOLU ÜNİVERSİTESİ YAYINLARI NO: 1080 AÇIKÖĞRETİM FAKÜLTESİ YAYINLARI NO: 598 FEN BİLGİSİ ÖĞRETMENLİĞİ Kimya Yazarlar: Doç.Dr. Ayşe Eren PÜTÜN Yrd.Doç.Dr. Alâattin GÜVEN Yrd.Doç.Dr. Nevin KANIŞKAN Yrd.Doç.Dr. Hüseyin BERBER Yrd.Doç.Dr. Hayrettin TÜRK Editör: Prof.Dr. D.Lâle ZOR
2 Bu kitabın basım, yayım ve satış hakları Anadolu Üniversitesine aittir. "Uzaktan öğretim" tekniğine uygun olarak hazırlanan bu kitabın bütün hakları saklıdır. İlgili kuruluştan izin almadan kitabın tümü ya da bölümleri mekanik, elektronik, fotokopi, manyetik kayıt veya başka şekillerde çoğaltılamaz, basılamaz ve dağıtılamaz. Copyright 1999 by Anadolu University All rights reserved No part of this book may be reproduced or stored in a retrieval system, or transmitted in any form or by any means mechanical, electronic, photocopy, magnetic tape or otherwise, without permission in writing from the University. Tasarım: Yrd.Doç.Dr. Kazım SEZGİN ISBN
3 Başlarken İnsanoğlu var olmaya başladığı ilk günden günümüze dek sürekli olarak, doğayı ve çevresinde gerçekleşen olayları yorumlama ve bilinmeyeni aydınlatma çabası gütmüştür. Bu çabaları ve uğraşların (çalışmaların) ortaya çıkardığı düzenli bilgi toplamı ise, bilim veya fen olarak adlandırılır. Bilimin en temel hedeflerinden biri, ulaşılan birikim ve bilgi düzeyi ile yetinmek yerine, onu basamak yaparak yepyeni ufuklara doğru uzanmaktır. Zira bilimsel aydınlanma sonsuz basamaklı bir merdivende durmadan tırmakmak gibi sınırsız bir süreçtir. Bilgi çağı olarak da betimlenen çağımızın en belirleyici özelliği, bilimsel ve teknolojik açılardan gösterdiği olağanüstü gelişmelerdir. Teknoloji ve bilgi birikimindeki bu tempolu ilerlemeler, eğitim sürecinde etkin görev alan kişi ve kurumlara paralel ek sorumluluklar yüklemektedir. Bunlardan en önemlisi, geleceğimizin ümidi olan gençlerimizin güncel ve çağdaş bilgilerle eğitilmeleri olarak özetlenebilir. Gençlerin eğitim ve bilgilendirilme sürecinde iki belirleyici faktör baş roldedir. Tartışmasız bu faktörlerden ilki ve en önemlisi, gençlerimizi aydınlatmak ve eğitmek gibi yüce bir görevi üstlenen öğretmenlerimizdir. İkincisi ise, bilime katkıda bulunan bilim adamları ile bilgi birikimine ulaşma çabası güden kitleler arasında iletişim aracı olan kitaplar ve diğer görsel ve basılı malzemelerdir. İlköğretim Fen Bilgisi Öğretmenliği Lisans Tamamlama Programı çerçevesinde hazırlanan bu kitapla, sözkonusu faktörlerin her ikisine de hizmet edebilmek amaçlanmıştır. Bu amaç doğrultusunda öncelikle kitap aracılığı ile siz sevgili öğretmenlere ve sizlerin yardımı ve gayretleri aracılığı ile de, modern ve çağdaş bilginin gençlere aktarımı hedeflenmiştir. Kitabın hazırlanışına yönelik bir ikinci ana hedefimiz ise, sizlere Lisans Tamamlama sürecinde gereken bilgileri sunmanın yanısıra, meslek yaşamınızda bir başvuru kaynağı olarak kullanabileceğiniz nitelikte olmasını sağlamaktır. Bu nedenle kitapta kimyanın temelini oluşturan tüm temel kavramlar irdelenmiş ve kitabın kapsamı içinde bir bütün olmasına özen gösterilmiştir. Editör Prof.Dr. D.Lâle ZOR ANADOLU ÜNİ VERSİ TESİ
4
5 Temel Kavramlar Yazar Yrd.Doç.Dr. Alâattin GÜVEN ÜNİTE 1 Amaçlar Bu üniteyi çalıştıktan sonra; kimyanın içeriğini, madde kavramını, maddenin hallerini maddenin özelliklerini, madde ve enerji arasındaki ilişkiyi, kimyasal denklemleri öğreneceksiniz. İçindekiler Giriş 3 Madde ve Maddenin Halleri 3 Maddenin Bileşimi ve Sınıflara Ayrılması 4 Maddenin Fiziksel ve Kimyasal Özellikleri 6 Kimyasal Denklemler 6 Kimyasal Reaksiyonlarda Enerji 7 Özet 8 Değerlendirme Soruları 8
6 Çalışma Önerileri Bu üniteyi çalışırken periyodik cetveli yanınızda bulundurunuz. Ünitede geçen kimyasal formülleri en az bir kere de siz yazınız. ANADOLU ÜNİ VERSİ TESİ
7 TEMEL KAVRAMLAR 3 1. Giriş Kimyanın öz bir tanımı şöyle yapılabilir: Kimya, maddenin atomik ve moleküler sistemlerin bileşimini, yapısını, özelliklerini ve reaksiyonlarını inceleyen bir bilim dalıdır. Madde ile enerji arasındaki etkileşim, maddelerin yapılarında ve davranışlarında değişimler meydana getirir. Kimyacının ana amacı ise, maddelerin yapılarını, davranışlarını, etkileşimlerini ve değişmelerini yorumlamaktır. Yani maddeler arasındaki etkileşimin türünü ve gerekçesini yorumlayabilmek için, kimyanın temel kavramlarının bilinmesi şarttır. Bu ünitenin amacı, kimyanın temel kavramlarını öz olarak vermek ve okuyucuyu bundan sonraki ünitelere hazırlıklı kılmaktır. 2. Madde ve Maddenin Halleri Element, bileşik veya karışım olabilen ve etrafımızda algıladığımız her şeyi oluşturan "madde", ağırlık, hacim, renk, yoğunluk, kaynama noktası vs. gibi belirli özelliklerin toplamı ile karakterize edilir. Bu özellikler, biri hariç, maddenin içinde bulunduğu koşullara göre değişir. Koşulların değiştiremediği maddenin tek özelliği kütlesi'dir. Kütle madde miktarını gösterir. Kütlesi olan ve uzayda yer kaplayan her şey madde olarak tanımlanır. Kütle, madde miktarının bir ölçüsüdür ve herhangi bir cismin kütlesi o cismin uzaydaki konumuna göre değişmez. Paris yakınlarında Sevres'deki uluslararası ölçü ve tartılar müzesinde bulunan %90 platin ve %10 iridyumdan yapılmış olan bir silindirin kütlesi 1 kilogram olarak kabul edilmiştir. 1 Litre ise +4 C ve 760 mmhg basıncındaki 1 kilogram saf suyun hacmidir. 1 Litre 1000 ml ve 1000,027 cm 3 'tür. Veya 1 ml = 1, cm 3 'tür. Madde, katı, sıvı ve gaz olmak üzere üç halde bulunabilir. Bir maddenin bulunduğu hal büyük ölçüde sıcaklık ve basınca bağlıdır. Örneğin, su çeşitli etkenlere bağlı olarak katı, sıvı ve gaz (buhar) halinde bulunabilir. Maddenin hallerine ilişkin aşağıdaki genellemeler yapılabilir: Katılar belirli bir biçime sahip olmalarına karşılık sıvıların ve gazların belirli biçimleri yoktur. Sıvı ve gazlara "akışkanlar" denir. Sıvıların serbest yüzeyleri, içinde bulundukları kaba tâbi değildir. Gaz halindeki maddeler her taraftan kaba bağlı, serbest yüzeyleri olmayan akışkanlardır. Katı, sıvı ve gazların belirli bir kütlesi vardır. Gazlar uygun basınç ve sıcaklıkta sıkıştırılabilirler. Buna karşın katı ve sıvılar sıkıştırılamazlar. AÇIKÖĞ RETİ M FAKÜLTESİ
8 4 TEMEL KAVRAMLAR Enerji aldıkları taktirde, gazlara ilişkin genleşme oranı katı ve sıvılara kıyasla çok fazladır. Maddelerin kimyasal özelliklerini ve bileşimini korumak koşuluyla gerçekleştirebileceği değişikliklere "fiziksel değişimler" denir. 3. Maddenin Bileşimi ve Sınıflara Ayrılması? Maddeler çok küçük parçacık olan atomlardan oluşmuştur. Atomun yapısının aydınlatılması için bilim adamları uzun yıllardan beri çalışmaktadırlar. Son yıllarda, iki özel tip elektron mikroskopunun geliştirilmesiyle, atomların görüntüleri elde edilebilmiştir. Alan emisyon mikroskopu, çok ince metal iğnelerin uçlarındaki molekül veya büyük atomların görülebilmelerini sağlamıştır. Elektron tarama mikroskobu, 5Å büyüklüğündeki atom veya moleküllerin görülebilmelerini sağlamaktadır. Yüksek voltaj elektron mikroskopları ile 2 Å veya daha küçüklerin görülmesi başarılmış ve kristal içindeki bu büyüklükte atom veya moleküllerin görüntüleri elde edilmiştir. Maddeler element, bileşik veya karışım olarak bulunabilmektedirler. Element nedir? Atomla elementin ilişkisi nedir? Sıradan kimyasal işlemler ile kendinden farklı iki veya daha fazla sayıda maddeye ayrılamayan saf maddelere "element" denir. Örneğin, bakır, altın ve oksijen birer elementtirler. Bakır atomu, altın atomu ve oksijen atomu ise bu elementlere ait en küçük birimlerdir. Elementlerin özelliklerini taşıyan en küçük birimlere "atom" denir. Günümüzde bilinen element sayısı 109 olmakla birlikte bunların bir kısmı doğada bulunmamaktadır. Doğada olmayanlar laboratuvarlarda suni şekilde elde edilmektedirler. İki veya daha fazla sayıda atom kimyasal yollar ile bir araya geldiğinde "molekül" denen birimler oluşurlar. Moleküller özdeş veya farklı atomların bağlanması ile oluşabilirler. Örneğin, Neon ve kripton gibi bazı elementler doğada atomlar halinde bulunmalarına karşın, azot ve iyot gibi elementler moleküler yapıda bulunurlar. Bileşikler, atomların kimyasal olarak bir araya gelmeleri sonucu oluşmuşlardır ve bugüne kadar, yaklaşık 17 milyon bileşik kayıt edilmiştir. ANADOLU ÜNİ VERSİ TESİ
9 TEMEL KAVRAMLAR 5 İki veya daha fazla elementin belirli ağırlık oranları dahilinde kimyasal bağlar ile oluşturdukları saf maddelere "bileşikler" denir. Örneğin, hidrojen ve oksijen atomları 2'ye 1 oranında birleşerek H 2 O (su) veya 2'ye 2 oranında birleşerek H 2 O 2 (hidrojen peroksit) meydana getirirler. Element veya bileşikler kesin bileşimlere ve kendilerine özgü özelliklere sahip maddelerdir. Örneğin su bir bileşiktir. Su saf yapıda her zaman 1/9 hidrojen 8/9 oksijen oranlarında bir bileşime sahiptir. Bunun dışında bir yapıda bulunamaz. Bileşikler kendilerini oluşturan elementlerden tamamen farklı özellikler gösterirler. Örneğin, H 2 ile O 2 gazlarının reaksiyonundan oluşan H 2 O (su) moleküllerinin tüm özellikleri kendini oluşturan hidrojen ve oksijen elementlerinin özelliklerinden tamamen farklıdır. Sıcaklık, yoğunluk, derişim, kaynama noktası, vizkosite, elektrik iletkenliği gibi madde özelliklerinin aynı olduğu sistem bölgelerine "faz" adı verilir. Karışımlar fiziksel olarak birbirlerinden tamamen ayrılabilen iki veya daha fazla maddeden meydana gelir. Karışımlarda her madde kendi özelliğini korur. Karışımlar tek bir faz oluşturuyorsa, "homojen karışımlar"; birden fazla faz oluşturuyorlarsa "heterojen karışımlar" olarak adlandırılırlar. Homojen karışımlara "çözeltiler" de denir. Kolalı tüm içkiler ve meyve suları çok bileşenli homojen karışımlara, bir kaşık şekerin bir bardak suda çözünmesiyle elde edilen karışım iki bileşenli homojen karışımlara örnektirler. Bir kaya parçası çok bileşenli heterojen karışımlara örnektir. Metallerin katı çözeltileri "alaşım" olarak adlandırılır ve alaşımların özel önemleri vardır. Alaşımlarda bileşenlerin özelliklerine göre değişik ürünler meydana gelir. Örneğin, bronz alaşımı ağırlık yüzdesi olarak %90 bakır, %10 kalaydan meydana gelmiştir. Aynı şekilde, pirinç %67 bakır ile %33 çinko ve çelik %99 demir ve %1 karbondan oluşmuştur. Madde Saf Maddeler Karışımlar Elementler Bileşikler Homojen karışımlar Heterojen karışımlar Şekil 1.1: Maddelerin Sınıflandırılması AÇIKÖĞ RETİ M FAKÜLTESİ
10 6 TEMEL KAVRAMLAR 4. Maddelerin Fiziksel ve Kimyasal Özellikleri Saf maddeleri tanımlamak için kullanılan özellikler arasında kesin bir sınıflama yapılamazken, donma noktası, kaynama noktası ve spektroskopik özellikler gibi fiziksel özellikler her madde için farklıdır. Daha önce de belirtildiği gibi, bir maddenin yapısının değişmesine karşılık kimyasal yapısında herhangi bir değişiklik olmuyor ise bu değişikliğe "fiziksel değişiklik" denir. Örneğin, su katı, sıvı ve gaz hallerinde kimyasal olarak aynı özelliktedir. Değişiklik suyun sadece fiziksel özelliğindedir. Bazı önemli fiziksel özellikler şunlardır: Erime veya donma noktası: Bu terimlerin her ikisi de, maddenin katı ve sıvı fazlarının birlikte oldukları sıcaklığa karşılık gelir. Örneğin, katı haldeki suyun (buz) erime noktası 0 C'dir. Yine aynı şekilde saf suyun donma noktası da 0 C'dir. Kaynama noktası: Bir sıvının buhar basıncının dış basınca eşit olduğu sıcaklığa "kaynama noktası" denir. Örneğin, suyun 100 C'deki deniz kenarındaki buhar basıncı oradaki atmosfer basıncı olan (dış basınç) 760 mmhg'ye eşittir. Dolayısıyla suyun deniz kenarındaki kaynama noktası 100 C'dir. Deniz seviyesinden yukarılara çıkıldıkça suyun kaynama noktasının düşeceği tanımdan kolaylıkla anlaşılabilir. Yoğunluk ve özgül ağırlık: Yoğunluk, birim hacim basınca düşen ağırlık miktarıdır. Örneğin, +4 C'de saf suyun yoğunluğu 1.00 gram/cm 3 'tür. Yoğunluk maddenin hacmi ile orantılı ve hacim de sıcaklık ile orantılı olduğu için yoğunluk aynı zamanda maddenin bulunduğu ortama göre de değişir. Özgül ağırlık ise, bilinen ve referans olarak alınan bir maddeyle olan yoğunluk oranıdır. Referans madde, gazlar için "hava", katı ve sıvılar için "sudur". Örneğin, civanın özgül ağırlığı 13.6 demek, civa sudan 13.6 kez daha yoğun bir madde demektir. Çözünürlük: Verilen bir sıcaklıkta, belli bir miktar çözücü içinde saf bir maddenin çözünebilen en fazla miktarıdır. Örneğin, 100 C 'de 100 gram suda 39.1 gram NaCl çözünür. 5. Kimyasal Denklemler Bir kimyasal reaksiyon sırasında reaksiyona giren maddeler ile reaksiyon sonucu meydana gelen yeni maddeleri daha anlaşılır şekilde görmek için "kimyasal denklem" denen ifadeler kullanılır. Örneğin, propan gazının oksijen ile olan reaksiyonunu inceleyelim: C 3 H 8 (g) + 5O 2 (g) Giren maddeler (Reaktantlar) 3CO 2 (g) + 4H 2 O (g) + Isı Çıkan maddeler (Ürünler) ANADOLU ÜNİ VERSİ TESİ
11 TEMEL KAVRAMLAR 7 Kimyasal denklemde en önemli özelliklerden birisi, reaksiyona giren maddelerdeki atomların sayısının reaksiyon sonucu meydana gelen ürünlerdeki atomların sayısına eşit olmasıdır. Reaktantlar Ürünler C sayısı 3 C sayısı 3 H " 8 H " 8 O " 10 O " 10 Kimyasal reaksiyonlar ve işlemlerin denklemlerini yazmak için kimyacılar tarafından tüm dünyada genel olarak belirlenen standartlar şunlardır: Reaksiyona girenler okun soluna, ürünler sağ tarafına yazılır. Reaksiyon sırasında sadece değişime uğrayan atom ve moleküller denklemde yer alırlar. Herbir elementin atom sayısı denklemin her iki tarafında aynı olmalıdır. Maddenin hali, kimyasal formülden sonra parantez içinde gösterilmelidir. Katı hali (k), gaz hali (g), sıvı hal (s) sembolleri ile gösterilir. Kimyasal denklemlerin nasıl eşitlendiği ilerideki bölümlerde ayrıntılı olarak ele alınacaktır. 6. Kimyasal Reaksiyonlarda Enerji Bilim adamları enerjiyi "iş yapabilme kapasitesi" olarak tanımlamışlardır. Her bir kimyasal reaksiyona bir enerji değişmesi eşlik eder. Kimyasal reaksiyonlara eşlik eden enerji değişmelerinin incelenmesi termokimyanın konusunu meydana getirir. Bu enerji değişmesi ısı, ışık ya da elektrik şeklinde olabilir. Kimyasal reaksiyonlardaki ürünün enerjisi başlangıç maddelerinden az ise enerji dışarı verilmiştir, böyle reaksiyonlar "ekzotermik" reaksiyonlardır. Eğer ürün başlangıç maddelerininkinden daha yüksek enerji içeriyorsa reaksiyon dışarıdan enerji almıştır, böyle reaksiyonlara "endotermik" reaksiyonlar denir. Kimyasal bir reaksiyona eşlik eden enerji çoğu kez ısı şeklinde kendini gösterir. Bundan dolayı, kimyada enerji birimi olarak kalori veya bunun bin katı olan kilokalori gibi birimler yaygın şekilde kullanılmaktadır. Uluslararası Birim Sistemi (SI) enerji birimini "Joule" olarak belirlemiştir. Ancak kimyacılar hala tercihen "kalori" ve "kilokalori" birimlerini kullanmaktadırlar. 1 kilokalori = 1000 kalori 1 kalori = Joule şeklindedir. AÇIKÖĞ RETİ M FAKÜLTESİ
12 8 TEMEL KAVRAMLAR Karbon elementi içeren maddelerin oksijen gazı ile reaksiyonları ekzotermik reaksiyonlardır. Metan (CH 4 ) gazı ile oksijenin reaksiyonu buna örnektir. CH 4 + 2O 2 CO 2 + 2H 2 O + ısı Buna karşılık kireç taşının (CaCO 3 ) kireç ve karbon dioksite ayrışması reaksiyonu endotermik bir reaksiyondur. CaCO 3 + ısı CaO + CO 2 Özet Kimya, maddenin bileşimini, yapısını, özelliklerini ve değişimini inceleyen bir bilim dalıdır. Etrafımızda gördüğümüz uzayda yer kaplayan ve kütlesi olan her şey "madde" olarak tanımlanır. Maddenin özellikleri, fiziksel ve kimyasal olmak üzere ikiye ayrılır. Fiziksel değişimler, hal değişimlerine, kimyasal değişimler ise, maddenin bileşiminin ve özelliklerinin değişimine neden olur. Değerlendirme Soruları 1. Aşağıdaki ifadelerin hangisi yanlıştır? A. Maddelerin kaynama noktaları dış basınç arttıkça artar. B. Bir bileşikdeki elementlerin kütleleri belirli bir oran gösterir. C. Bir karışımdaki karışanların kütleleri belirli bir oran gösterir. D. Sülfürik asit (H 2 SO 4 ), sodyum hidrojenkarbonat (NaHCO 3 ) ve hidrojen peroksit (H 2 O 2 ), bileşiklere örnektirler. E. Potasyum, arsenik, alüminyum ve nikel birer elementtirler. 2. Aşağıdaki ifadelerin hangisi yanlıştır? A. Madde, katı, sıvı ve gaz olmak üzere üç halde bulunabilir. B. Maddeler gaz halinde belirli bir kütleye sahip değildir. C. Suyun erime ve donma noktası 0 C dir. D. Gazlar sıvı ve katılara kıyasla daha kolay genleşir. E. Bir maddenin dünyadaki ve uzaydaki kütleleri arasında bir fark yoktur. 3. Aşağıdaki ifadelerin hangisi yanlıştır? A. Uluslararası Birim Sistemine (SI) göre kütlenin birimi kilogramdır. B. Gazların bir kütlesi yoktur. C. Kütle, madde miktarının bir ölçüsüdür. D. Madde, kütlesi olan ve uzayda yer işgal eden herşeydir. E. Bir cismin dünyadaki kütlesi ile uzaydaki kütlesi aynıdır. ANADOLU ÜNİ VERSİ TESİ
13 TEMEL KAVRAMLAR 9 4. Aşağıdaki ifadelerin hangisi yanlıştır? A. Suyun sıcaklığının değişimi suyun fiziksel değişimi ile ilgilidir. B. -25 C de 1 gram buzun buhar haline gelebilmesi bir kimyasal değişiklik gerektirir. C. Bir maddenin katı halden sıvı hale geçişi fiziksel olaydır. D. Maddelerin kaynama noktaları maddenin bulunduğu ortamın basıncına bağlıdır. E. Maddenin kimyasal değişimi, maddenin kimyasal yapısında değişiklik gerektirir. 5. Aşağıdaki kimyasal denklemde x, y, z değerlerini bulunuz. A. x = 2 y = 2 z = 1 B. x = 2 y = 1 z = 2 C. x = 1 y = 2 z = 2 D. x = 1 y = 1 z = 2 E. x = 2 y = 1 z = 1 Ca 3 (PO 4 ) 2 + xh 2 SO 4 ycaso 4 + zca(h 2 PO 4 ) kalori kaç joule eder? A B C D E Aşağıdaki ifadelerin hangisi yanlıştır? A. Alkolün yanma işlemi kimyasal bir olaydır. B. Oksijen ve hidrojenin suyu oluşturması kimyasal bir reaksiyondur. C. Mumun yanması fiziksel bir olaydır. D. Reaktantların toplam kütlesi ürünlerin toplam kütlesine eşittir. E. Kimyasal denklemde reaksiyona giren maddeler belirli oranlarda birleşip, yeni ürünler oluştururlar. AÇIKÖĞ RETİ M FAKÜLTESİ
14 10 TEMEL KAVRAMLAR 8. Aşağıdaki ifadelerden hangisi yanlıştır? A. Kalsiyum (Ca) bir elementtir. B. Silisyum dioksit (SiO 2 ) bir bileşiktir. C. Bakır (Cu) bir elementtir. D. Karbon dioksit (CO 2 ) bir bileşiktir. E. Azot gazı (N 2 ) bir elementtir. 9. Aşağıdaki ifadelerden hangisi doğrudur? A. Metan (CH 4 ) gazının yanması endotermik bir reaksiyona örnektir. B. Metan (CH 4 ) gazının yanması ekzotermik bir reaksiyona örnektir. C. Metan (CH 4 ) gazının yanması sırasında bir enerji değişikliği olmaz. D. Metan gazının yanması sırasında metan gazının sadece fiziksel özelliği değişir. E. Hiçbiri Joule kaç kalori eder? A. 10 B. 5 C. 25 D. 50 E. 100 Değerlendirme Sorularının Yanıtları 1. C 2. B 3. B 4. B 5. A 6. D 7. C 8. E 9. B 10. D ANADOLU ÜNİ VERSİ TESİ
MADDE NEDİR? Çevremize baktığımızda gördüğümüz her şey örneğin, dağlar, denizler, ağaçlar, bitkiler, hayvanlar ve hava birer maddedir.
 MADDE NEDİR? Çevremize baktığımızda gördüğümüz her şey örneğin, dağlar, denizler, ağaçlar, bitkiler, hayvanlar ve hava birer maddedir. Her maddenin bir kütlesi vardır ve bu tartılarak bulunur. Ayrıca her
MADDE NEDİR? Çevremize baktığımızda gördüğümüz her şey örneğin, dağlar, denizler, ağaçlar, bitkiler, hayvanlar ve hava birer maddedir. Her maddenin bir kütlesi vardır ve bu tartılarak bulunur. Ayrıca her
ELEMENT VE BİLEŞİKLER
 ELEMENT VE BİLEŞİKLER 1- Elementler ve Elementlerin Özellikleri: a) Elementler: Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere
ELEMENT VE BİLEŞİKLER 1- Elementler ve Elementlerin Özellikleri: a) Elementler: Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere
ELEMENTLER VE BİLEŞİKLER
 ELEMENTLER VE BİLEŞİKLER 1- Elementler ve Elementlerin Özellikleri a) ELEMENTLER Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere
ELEMENTLER VE BİLEŞİKLER 1- Elementler ve Elementlerin Özellikleri a) ELEMENTLER Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere
Malzeme Bilgisi. Madde ve Özellikleri
 Malzeme Bilgisi Madde: Boşlukta yer kaplayan, kütlesi ve hacmi olan katı, sıvı veya gaz şeklinde bulunan her şeye madde denir. Ayırt edici özellikler: Bir maddenin diğer maddelerden farklılık gösterenyanları,
Malzeme Bilgisi Madde: Boşlukta yer kaplayan, kütlesi ve hacmi olan katı, sıvı veya gaz şeklinde bulunan her şeye madde denir. Ayırt edici özellikler: Bir maddenin diğer maddelerden farklılık gösterenyanları,
ELEMETLER VE BİLEŞİKLER ELEMENTLER VE SEMBOLLERİ
 ELEMENTLER VE SEMBOLLERİ Elementler Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere element denir. Elementler çok sayıda
ELEMENTLER VE SEMBOLLERİ Elementler Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere element denir. Elementler çok sayıda
Paylaşılan elektron ya da elektronlar, her iki çekirdek etrafında dolanacaklar, iki çekirdek arasındaki bölgede daha uzun süre bulundukları için bu
 4.Kimyasal Bağlar Kimyasal Bağlar Aynı ya da farklı cins atomları bir arada tutan kuvvetlere kimyasal bağlar denir. Pek çok madde farklı element atomlarının birleşmesiyle meydana gelmiştir. İyonik bağ
4.Kimyasal Bağlar Kimyasal Bağlar Aynı ya da farklı cins atomları bir arada tutan kuvvetlere kimyasal bağlar denir. Pek çok madde farklı element atomlarının birleşmesiyle meydana gelmiştir. İyonik bağ
MADDENİN SINIFLANDIRILMASI
 MADDENİN SINIFLANDIRILMASI MADDE Saf madde Karışımlar Element Bileşik Homojen Karışımlar Heterojen Karışımlar ELEMENT Tek cins atomlardan oluşmuş saf maddeye element denir. ELEMENTLERİN ÖZELLİKLERİ Elementler
MADDENİN SINIFLANDIRILMASI MADDE Saf madde Karışımlar Element Bileşik Homojen Karışımlar Heterojen Karışımlar ELEMENT Tek cins atomlardan oluşmuş saf maddeye element denir. ELEMENTLERİN ÖZELLİKLERİ Elementler
ANADOLU ÜNİVERSİTESİ AÇIKÖĞRETİM FAKÜLTESİ İLKÖĞRETİM ÖĞRETMENLİĞİ LİSANS TAMAMLAMA PROGRAMI. Lineer. Cebir. Ünite 6. 7. 8. 9. 10
 ANADOLU ÜNİVERSİTESİ AÇIKÖĞRETİM FAKÜLTESİ İLKÖĞRETİM ÖĞRETMENLİĞİ LİSANS TAMAMLAMA PROGRAMI Lineer Cebir Ünite 6. 7. 8. 9. 10 T.C. ANADOLU ÜNİVERSİTESİ YAYINLARI NO: 1074 AÇIKÖĞRETİM FAKÜLTESİ YAYINLARI
ANADOLU ÜNİVERSİTESİ AÇIKÖĞRETİM FAKÜLTESİ İLKÖĞRETİM ÖĞRETMENLİĞİ LİSANS TAMAMLAMA PROGRAMI Lineer Cebir Ünite 6. 7. 8. 9. 10 T.C. ANADOLU ÜNİVERSİTESİ YAYINLARI NO: 1074 AÇIKÖĞRETİM FAKÜLTESİ YAYINLARI
maddelere saf maddeler denir
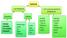 Madde :Kütlesi olan her şeye madde denir. Saf madde: Aynı cins atom veya moleküllerden oluşan maddeye denir. Fiziksel yollarla kendisinden başka maddelere ayrışmayan maddelere saf maddeler denir Element:
Madde :Kütlesi olan her şeye madde denir. Saf madde: Aynı cins atom veya moleküllerden oluşan maddeye denir. Fiziksel yollarla kendisinden başka maddelere ayrışmayan maddelere saf maddeler denir Element:
Kütlesi,hacmi,eylemsizliği olan,tanecikli yapıdaki her şeye madde denir. Yer yüzünde gözümüzle görebildiğimiz her şey maddedir.
 Madde Tanımı Kütlesi,hacmi,eylemsizliği olan,tanecikli yapıdaki her şeye madde denir. Yer yüzünde gözümüzle görebildiğimiz her şey maddedir. MADDENİN MADDENİN HALLERİ HALLERİ maddenin haller i MADDENİN
Madde Tanımı Kütlesi,hacmi,eylemsizliği olan,tanecikli yapıdaki her şeye madde denir. Yer yüzünde gözümüzle görebildiğimiz her şey maddedir. MADDENİN MADDENİN HALLERİ HALLERİ maddenin haller i MADDENİN
Maddelerin ortak özellikleri
 On5yirmi5.com Maddelerin ortak özellikleri Maddelerin ortak özellikleri, ayırt edici özelliklerinin incelenip hallerine göre sınıflandırılmasının yapılması... Yayın Tarihi : 30 Ekim 2012 Salı (oluşturma
On5yirmi5.com Maddelerin ortak özellikleri Maddelerin ortak özellikleri, ayırt edici özelliklerinin incelenip hallerine göre sınıflandırılmasının yapılması... Yayın Tarihi : 30 Ekim 2012 Salı (oluşturma
ÖĞRETĐM TEKNOLOJĐSĐ VE MATERYAL GELĐŞTĐRME
 ÖĞRETĐM TEKNOLOJĐSĐ VE MATERYAL GELĐŞTĐRME KONU: MADDE VE ÖZELLĐKLERĐ (Konu Anlatımı) Hazırlayan: Pınar ÖZCAN Ders Sorumlusu: Prof. Dr. Đnci MORGĐL ANKARA,2008 MADDE VE ÖZELLĐKLERĐ MADDE Kütlesi, hacmi
ÖĞRETĐM TEKNOLOJĐSĐ VE MATERYAL GELĐŞTĐRME KONU: MADDE VE ÖZELLĐKLERĐ (Konu Anlatımı) Hazırlayan: Pınar ÖZCAN Ders Sorumlusu: Prof. Dr. Đnci MORGĐL ANKARA,2008 MADDE VE ÖZELLĐKLERĐ MADDE Kütlesi, hacmi
Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı
 Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani madde yani bileşik
Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani madde yani bileşik
7. Sınıf Fen ve Teknoloji Dersi 4. Ünite: Madde ve Yapısı Konu: Elementler ve Sembolleri
 ÖĞRETĐM TEKNOLOJĐLERĐ VE MATERYAL GELĐŞĐMĐ 7. Sınıf Fen ve Teknoloji Dersi 4. Ünite: Madde ve Yapısı Konu: Elementler ve Sembolleri Çalışma Yaprağı Konu Anlatımı-Değerlendirme çalışma Yaprağı- Çözümlü
ÖĞRETĐM TEKNOLOJĐLERĐ VE MATERYAL GELĐŞĐMĐ 7. Sınıf Fen ve Teknoloji Dersi 4. Ünite: Madde ve Yapısı Konu: Elementler ve Sembolleri Çalışma Yaprağı Konu Anlatımı-Değerlendirme çalışma Yaprağı- Çözümlü
Örnek : 3- Bileşiklerin Özellikleri :
 Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani
Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani
Bir maddenin başka bir madde içerisinde homojen olarak dağılmasına ÇÖZÜNME denir. Çözelti=Çözücü+Çözünen
 ÇÖZÜCÜ VE ÇÖZÜNEN ETKİLEŞİMLERİ: Çözünme olayı ve Çözelti Oluşumu: Bir maddenin başka bir madde içerisinde homojen olarak dağılmasına ÇÖZÜNME denir. Çözelti=Çözücü+Çözünen Çözünme İyonik Çözünme Moleküler
ÇÖZÜCÜ VE ÇÖZÜNEN ETKİLEŞİMLERİ: Çözünme olayı ve Çözelti Oluşumu: Bir maddenin başka bir madde içerisinde homojen olarak dağılmasına ÇÖZÜNME denir. Çözelti=Çözücü+Çözünen Çözünme İyonik Çözünme Moleküler
SEZEN DEMİR MADDE DOĞADA KARIŞIK HALDE BULUNUR
 Kütlesi, hacmi ve eylemsizliği olan her şey maddedir. Buna göre kütle hacim ve eylemsizlik maddenin ortak özelliklerindendir. Çevremizde gördüğümüz, hava, su, toprak v.s gibi her şey maddedir. Maddeler
Kütlesi, hacmi ve eylemsizliği olan her şey maddedir. Buna göre kütle hacim ve eylemsizlik maddenin ortak özelliklerindendir. Çevremizde gördüğümüz, hava, su, toprak v.s gibi her şey maddedir. Maddeler
STOKİYOMETRİ. Kimyasal Tepkimelerde Kütle İlişkisi
 STOKİYOMETRİ Kimyasal Tepkimelerde Kütle İlişkisi Sülfür oksijen içerisinde yanarak kükürt dioksit oluşturur. Modeller elementel sülfürü (S8), oksijeni ve kükürt dioksit moleküllerini göstermektedir. Her
STOKİYOMETRİ Kimyasal Tepkimelerde Kütle İlişkisi Sülfür oksijen içerisinde yanarak kükürt dioksit oluşturur. Modeller elementel sülfürü (S8), oksijeni ve kükürt dioksit moleküllerini göstermektedir. Her
MADDE NEDİR? Çevremize baktığımızda gördüğümüz her şey örneğin, dağlar, denizler, ağaçlar, bitkiler, hayvanlar ve hava birer maddedir.
 MADDE NEDİR? Çevremize baktığımızda gördüğümüz her şey örneğin, dağlar, denizler, ağaçlar, bitkiler, hayvanlar ve hava birer maddedir. Her maddenin bir kütlesi vardır ve bu tartılarak bulunur. Ayrıca her
MADDE NEDİR? Çevremize baktığımızda gördüğümüz her şey örneğin, dağlar, denizler, ağaçlar, bitkiler, hayvanlar ve hava birer maddedir. Her maddenin bir kütlesi vardır ve bu tartılarak bulunur. Ayrıca her
KİMYASAL BİLEŞİKLER İÇERİK
 KİMYASAL BİLEŞİKLER İÇERİK Mol, Molar Kütle Kimyasal Formülden Yüzde Bileşiminin Hesaplanması Bir Bileşiğin Yüzde Bileşiminden Kimyasal Formülünün Hesaplanması Organik Bileşiklerin Kimyasal Bileşiminin
KİMYASAL BİLEŞİKLER İÇERİK Mol, Molar Kütle Kimyasal Formülden Yüzde Bileşiminin Hesaplanması Bir Bileşiğin Yüzde Bileşiminden Kimyasal Formülünün Hesaplanması Organik Bileşiklerin Kimyasal Bileşiminin
Fiziksel özellikleri her yerde aynı olan (homojen) karışımlara çözelti denir. Bir çözeltiyi oluşturan her bir maddeye çözeltinin bileşenleri denir.
 GENEL KİMYA 1 LABORATUARI ÇALIŞMA NOTLARI DENEY: 8 ÇÖZELTİLER Dr. Bahadır KESKİN, 2011 @ YTÜ Fiziksel özellikleri her yerde aynı olan (homojen) karışımlara çözelti denir. Bir çözeltiyi oluşturan her bir
GENEL KİMYA 1 LABORATUARI ÇALIŞMA NOTLARI DENEY: 8 ÇÖZELTİLER Dr. Bahadır KESKİN, 2011 @ YTÜ Fiziksel özellikleri her yerde aynı olan (homojen) karışımlara çözelti denir. Bir çözeltiyi oluşturan her bir
BİLEŞİKLER VE FORMÜLLERİ
 BİLEŞİKLER VE FORMÜLLERİ Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur). Bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere
BİLEŞİKLER VE FORMÜLLERİ Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur). Bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere
Örneğin; İki hidrojen (H) uyla, bir oksijen (O) u birleşerek hidrojen ve oksijenden tamamen farklı olan su (H 2
 On5yirmi5.com Madde ve özellikleri Kütlesi, hacmi ve eylemsizliği olan herşey maddedir. Yayın Tarihi : 21 Ocak 2014 Salı (oluşturma : 2/9/2016) Kütle hacim ve eylemsizlik maddenin ortak özelliklerindendir.çevremizde
On5yirmi5.com Madde ve özellikleri Kütlesi, hacmi ve eylemsizliği olan herşey maddedir. Yayın Tarihi : 21 Ocak 2014 Salı (oluşturma : 2/9/2016) Kütle hacim ve eylemsizlik maddenin ortak özelliklerindendir.çevremizde
ÖĞRENME ALANI : FİZİKSEL OLAYLAR ÜNİTE 2 : KUVVET VE HAREKET
 ÖĞRENME ALANI : FİZİKSEL OLAYLAR ÜNİTE 2 : KUVVET VE HAREKET A BASINÇ VE BASINÇ BİRİMLERİ (5 SAAT) Madde ve Özellikleri 2 Kütle 3 Eylemsizlik 4 Tanecikli Yapı 5 Hacim 6 Öz Kütle (Yoğunluk) 7 Ağırlık 8
ÖĞRENME ALANI : FİZİKSEL OLAYLAR ÜNİTE 2 : KUVVET VE HAREKET A BASINÇ VE BASINÇ BİRİMLERİ (5 SAAT) Madde ve Özellikleri 2 Kütle 3 Eylemsizlik 4 Tanecikli Yapı 5 Hacim 6 Öz Kütle (Yoğunluk) 7 Ağırlık 8
FEN BİLİMLERİ FEN ve TEKNOLOJİ
 KPSS 2017 önce biz sorduk 50 Soruda 32 soru ÖABT FEN BİLİMLERİ FEN ve TEKNOLOJİ TAMAMI ÇÖZÜMLÜ SORU BANKASI KİMYA Eğitimde 30. yıl KOMİSYON ÖABT Fen Bilimleri/ Fen ve Teknoloji Öğretmenliği Soru Bankası
KPSS 2017 önce biz sorduk 50 Soruda 32 soru ÖABT FEN BİLİMLERİ FEN ve TEKNOLOJİ TAMAMI ÇÖZÜMLÜ SORU BANKASI KİMYA Eğitimde 30. yıl KOMİSYON ÖABT Fen Bilimleri/ Fen ve Teknoloji Öğretmenliği Soru Bankası
MADDENİN HALLERİ VE TANECİKLİ YAPI
 MADDENİN HALLERİ VE TANECİKLİ YAPI MADDE BİLGİSİ Kütlesi hacmi ve eylemsizliği olan her şeye madde denir. Maddenin şekil almış haline cisim denir. Cam bir madde iken cam bardak bir cisimdir. Maddeler doğada
MADDENİN HALLERİ VE TANECİKLİ YAPI MADDE BİLGİSİ Kütlesi hacmi ve eylemsizliği olan her şeye madde denir. Maddenin şekil almış haline cisim denir. Cam bir madde iken cam bardak bir cisimdir. Maddeler doğada
GENEL KİMYA. Yrd.Doç.Dr. Tuba YETİM
 GENEL KİMYA ÇÖZELTİLER Homojen karışımlara çözelti denir. Çözelti bileşiminin ve özelliklerinin çözeltinin her yerinde aynı olması sebebiyle çözelti, «homojen» olarak nitelendirilir. Çözeltinin değişen
GENEL KİMYA ÇÖZELTİLER Homojen karışımlara çözelti denir. Çözelti bileşiminin ve özelliklerinin çözeltinin her yerinde aynı olması sebebiyle çözelti, «homojen» olarak nitelendirilir. Çözeltinin değişen
FARMASÖTİK TEKNOLOJİ I «ÇÖZELTİLER»
 FARMASÖTİK TEKNOLOJİ I «ÇÖZELTİLER» Uygun bir çözücü içerisinde bir ya da birden fazla maddenin çözündüğü veya moleküler düzeyde disperse olduğu tektür (homojen: her tarafta aynı oranda çözünmüş veya dağılmış
FARMASÖTİK TEKNOLOJİ I «ÇÖZELTİLER» Uygun bir çözücü içerisinde bir ya da birden fazla maddenin çözündüğü veya moleküler düzeyde disperse olduğu tektür (homojen: her tarafta aynı oranda çözünmüş veya dağılmış
1 mol = 6, tane tanecik. Maddelerde tanecik olarak atom, molekül ve iyonlar olduğunda dolayı mol ü aşağıdaki şekillerde tanımlamak mümkündür.
 1 GENEL KİMYA Mol Kavramı 1 Mol Kavramı Günlük hayatta kolaylık olsun diye, çok küçük taneli olan maddeler tane yerine birimlerle ifade edilir. Örneğin pirinç alınırken iki milyon tane pirinç yerine ~
1 GENEL KİMYA Mol Kavramı 1 Mol Kavramı Günlük hayatta kolaylık olsun diye, çok küçük taneli olan maddeler tane yerine birimlerle ifade edilir. Örneğin pirinç alınırken iki milyon tane pirinç yerine ~
MADDE VE ÖZELLİKLERİ. Kimya Konu Tarama Testi-2
 MADDE VE ÖZELLİKLERİ Kimya Konu Tarama Testi-2 SORU 1: I. Renk, koku, tat ve uçuculuk tüm maddelerin ortak özelliğidir. II. Özkütle, esneklik katsayısı ve kaynama noktası tüm maddelerin ayırt edici özelliğidir.
MADDE VE ÖZELLİKLERİ Kimya Konu Tarama Testi-2 SORU 1: I. Renk, koku, tat ve uçuculuk tüm maddelerin ortak özelliğidir. II. Özkütle, esneklik katsayısı ve kaynama noktası tüm maddelerin ayırt edici özelliğidir.
Bilgi İletişim ve Teknoloji
 MADDENİN HALLERİ Genel olarak madde ya katı ya sıvı ya da gaz hâlinde bulunur. İstenildiğinde ortam şartları elverişli hâle getirilerek bir hâlden diğerine dönüştürülebilir. Maddenin katı, sıvı ve gaz
MADDENİN HALLERİ Genel olarak madde ya katı ya sıvı ya da gaz hâlinde bulunur. İstenildiğinde ortam şartları elverişli hâle getirilerek bir hâlden diğerine dönüştürülebilir. Maddenin katı, sıvı ve gaz
5) Çözünürlük(Xg/100gsu)
 1) I. Havanın sıvılaştırılması II. abrika bacasından çıkan SO 3 gazının H 2 O ile birleşmesi III. Na metalinin suda çözünmesi Yukardaki olaylardan hangilerinde kimyasal değişme gerçekleşir? 4) Kütle 1
1) I. Havanın sıvılaştırılması II. abrika bacasından çıkan SO 3 gazının H 2 O ile birleşmesi III. Na metalinin suda çözünmesi Yukardaki olaylardan hangilerinde kimyasal değişme gerçekleşir? 4) Kütle 1
MOL KAVRAMI I. ÖRNEK 2
 MOL KAVRAMI I Maddelerin taneciklerden oluştuğunu biliyoruz. Bu taneciklere atom, molekül ya da iyon denir. Atom : Kimyasal yöntemlerle daha basit taneciklere ayrılmayan ve elementlerin yapıtaşı olan taneciklere
MOL KAVRAMI I Maddelerin taneciklerden oluştuğunu biliyoruz. Bu taneciklere atom, molekül ya da iyon denir. Atom : Kimyasal yöntemlerle daha basit taneciklere ayrılmayan ve elementlerin yapıtaşı olan taneciklere
Genel Kimya Prensipleri ve Modern Uygulamaları Petrucci Harwood Herring 8. Baskı. Bölüm 4: Kimyasal Tepkimeler
 Genel Kimya Prensipleri ve Modern Uygulamaları Petrucci Harwood Herring 8. Baskı Bölüm 4: Kimyasal Tepkimeler İçindekiler 4-1 Kimyasal Tepkimeler ve Kimyasal Eşitlikler 4-2 Kimyasal Eşitlik ve Stokiyometri
Genel Kimya Prensipleri ve Modern Uygulamaları Petrucci Harwood Herring 8. Baskı Bölüm 4: Kimyasal Tepkimeler İçindekiler 4-1 Kimyasal Tepkimeler ve Kimyasal Eşitlikler 4-2 Kimyasal Eşitlik ve Stokiyometri
kpss Önce biz sorduk 50 Soruda 34 SORU Güncellenmiş Yeni Baskı ÖABT SINIF ÖĞRETMENLİĞİ KİMYA
 Önce biz sorduk kpss 2 0 1 8 50 Soruda 34 SORU Güncellenmiş Yeni Baskı ÖABT SINIF ÖĞRETMENLİĞİ KİMYA Komisyon ÖABT SINIF ÖĞRETMENLİĞİ KİMYA KONU ANLATIMLI ISBN 978-605-318-922-0 Kitapta yer alan bölümlerin
Önce biz sorduk kpss 2 0 1 8 50 Soruda 34 SORU Güncellenmiş Yeni Baskı ÖABT SINIF ÖĞRETMENLİĞİ KİMYA Komisyon ÖABT SINIF ÖĞRETMENLİĞİ KİMYA KONU ANLATIMLI ISBN 978-605-318-922-0 Kitapta yer alan bölümlerin
Maddenin Fiziksel Özellikleri
 ÜNİTE 5 Maddenin Fiziksel Özellikleri Amaçlar Bu üniteyi çalıştıktan sonra, maddeyi yakından tanıyacak, maddenin hallerini bilecek, maddenin fiziksel özelliklerini öğrenecek, fiziksel değişmeleri kavrayacaksınız.
ÜNİTE 5 Maddenin Fiziksel Özellikleri Amaçlar Bu üniteyi çalıştıktan sonra, maddeyi yakından tanıyacak, maddenin hallerini bilecek, maddenin fiziksel özelliklerini öğrenecek, fiziksel değişmeleri kavrayacaksınız.
Maddeyi Oluşturan Tanecikler-Madde Hallerinin Tanecikli Yapısı. Maddeyi Oluşturan Tanecikler- Madde Hallerinin Tanecikli Yapısı
 Maddeyi Oluşturan Tanecikler- Madde Hallerinin Tanecikli Yapısı a) Saf Madde Kendine özgü fiziksel ve kimyasal özellikleri olan, ayırt edici özellikleri bulunan ve bu ayırt edici özellikleri sabit olan
Maddeyi Oluşturan Tanecikler- Madde Hallerinin Tanecikli Yapısı a) Saf Madde Kendine özgü fiziksel ve kimyasal özellikleri olan, ayırt edici özellikleri bulunan ve bu ayırt edici özellikleri sabit olan
E = U + KE + KP = (kj) U = iç enerji, KE = kinetik enerji, KP = potansiyel enerji, m = kütle, V = hız, g = yerçekimi ivmesi, z = yükseklik
 Enerji (Energy) Enerji, iş yapabilme kabiliyetidir. Bir sistemin enerjisi, o sistemin yapabileceği azami iştir. İş, bir cisme, bir kuvvetin tesiri ile yol aldırma, yerini değiştirme şeklinde tarif edilir.
Enerji (Energy) Enerji, iş yapabilme kabiliyetidir. Bir sistemin enerjisi, o sistemin yapabileceği azami iştir. İş, bir cisme, bir kuvvetin tesiri ile yol aldırma, yerini değiştirme şeklinde tarif edilir.
kpss Önce biz sorduk 50 Soruda SORU Güncellenmiş Yeni Baskı ÖABT KİMYA Tamamı Çözümlü SORU BANKASI
 Önce biz sorduk kpss 2 0 1 8 50 Soruda 35 SORU Güncellenmiş Yeni Baskı ÖABT KİMYA Tamamı Çözümlü SORU BANKASI KOMİSYON ÖABT Kimya Soru Bankası ISBN 978-605-318-910-7 Kitapta yer alan bölümlerin tüm sorumluluğu
Önce biz sorduk kpss 2 0 1 8 50 Soruda 35 SORU Güncellenmiş Yeni Baskı ÖABT KİMYA Tamamı Çözümlü SORU BANKASI KOMİSYON ÖABT Kimya Soru Bankası ISBN 978-605-318-910-7 Kitapta yer alan bölümlerin tüm sorumluluğu
MALZEME BİLGİSİ DERS 7 DR. FATİH AY.
 MALZEME BİLGİSİ DERS 7 DR. FATİH AY www.fatihay.net fatihay@fatihay.net GEÇEN HAFTA KIRILMANIN TEMELLERİ KIRILMA ÇEŞİTLERİ KIRILMA TOKLUĞU YORULMA S-N EĞRİSİ SÜRÜNME GİRİŞ Basınç (atm) Katı Sıvı Buhar
MALZEME BİLGİSİ DERS 7 DR. FATİH AY www.fatihay.net fatihay@fatihay.net GEÇEN HAFTA KIRILMANIN TEMELLERİ KIRILMA ÇEŞİTLERİ KIRILMA TOKLUĞU YORULMA S-N EĞRİSİ SÜRÜNME GİRİŞ Basınç (atm) Katı Sıvı Buhar
MADDENİN AYIRT EDİCİ ÖZELLİKLERİ. Nazife ALTIN Bayburt Üniversitesi, Eğitim Fakültesi
 MADDENİN AYIRT EDİCİ ÖZELLİKLERİ Bayburt Üniversitesi, Eğitim Fakültesi www.nazifealtin.wordpress.com MADDENİN AYIRT EDİCİ ÖZELLİKLERİ Bir maddeyi diğerlerinden ayırmamıza ve ayırdığımız maddeyi tanımamıza
MADDENİN AYIRT EDİCİ ÖZELLİKLERİ Bayburt Üniversitesi, Eğitim Fakültesi www.nazifealtin.wordpress.com MADDENİN AYIRT EDİCİ ÖZELLİKLERİ Bir maddeyi diğerlerinden ayırmamıza ve ayırdığımız maddeyi tanımamıza
DERSĐN SORUMLUSU : PROF.DR ĐNCĐ MORGĐL
 DERSĐN SORUMLUSU : PROF.DR ĐNCĐ MORGĐL HAZIRLAYAN : HALE ÜNAL KĐMYASAL REAKSĐYONLARA GĐRĐŞ -Değişmeler ve Tepkime Türleri- Yeryüzünde bulunan tüm maddeler değişim ve etkileşim içerisinde bulunur. Maddelerdeki
DERSĐN SORUMLUSU : PROF.DR ĐNCĐ MORGĐL HAZIRLAYAN : HALE ÜNAL KĐMYASAL REAKSĐYONLARA GĐRĐŞ -Değişmeler ve Tepkime Türleri- Yeryüzünde bulunan tüm maddeler değişim ve etkileşim içerisinde bulunur. Maddelerdeki
Birden çok maddenin kimyasal bağ oluşturmadan bir arada bulunmasıyla meydana gelen maddelere karışım denir.
 Anahtar Kavramlar Çözelti çözücü çözünen homojen hetorojen derişik seyreltik Birden çok maddenin kimyasal bağ oluşturmadan bir arada bulunmasıyla meydana gelen maddelere karışım denir. Solduğumuz hava;
Anahtar Kavramlar Çözelti çözücü çözünen homojen hetorojen derişik seyreltik Birden çok maddenin kimyasal bağ oluşturmadan bir arada bulunmasıyla meydana gelen maddelere karışım denir. Solduğumuz hava;
Serüveni 4.ÜNİTE MADDENİN HALLERİ ORTAK VE AYIRDEDİCİ ÖZELLİKLER
 Serüveni 4.ÜNİTE MADDENİN HALLERİ ORTAK VE AYIRDEDİCİ ÖZELLİKLER MADDENİN HALLERİ MADDE MİKTARINA BAĞLI ÖZELLİKLER:(ORTAK ÖZELLİKLER) :Madde miktarının ölçüsüdür. :Maddenin boşlukta kapladığı yerdir Eylemsizlik:Maddenin
Serüveni 4.ÜNİTE MADDENİN HALLERİ ORTAK VE AYIRDEDİCİ ÖZELLİKLER MADDENİN HALLERİ MADDE MİKTARINA BAĞLI ÖZELLİKLER:(ORTAK ÖZELLİKLER) :Madde miktarının ölçüsüdür. :Maddenin boşlukta kapladığı yerdir Eylemsizlik:Maddenin
3.BÖLÜM: TERMODİNAMİĞİN I. YASASI
 3.BÖLÜM: TERMODİNAMİĞİN I. YASASI S (k) + O SO + ısı Reaksiyon sonucunda sistemden ortama verilen ısı, sistemin iç enerjisinin bir kısmının ısı enerjisine dönüşmesi sonucunda ortaya çıkmıştır. Enerji sistemden
3.BÖLÜM: TERMODİNAMİĞİN I. YASASI S (k) + O SO + ısı Reaksiyon sonucunda sistemden ortama verilen ısı, sistemin iç enerjisinin bir kısmının ısı enerjisine dönüşmesi sonucunda ortaya çıkmıştır. Enerji sistemden
Gaz hali genel olarak molekül ve atomların birbirinden uzak olduğu ve çok hızlı hareket ettiği bir haldir.
 GAZLAR Maddeler tabiatta katı, sıvı ve gaz olmak üzere üç halde bulunurlar. Gaz hali genel olarak molekül ve atomların birbirinden uzak olduğu ve çok hızlı hareket ettiği bir haldir. Gaz molekülleri birbirine
GAZLAR Maddeler tabiatta katı, sıvı ve gaz olmak üzere üç halde bulunurlar. Gaz hali genel olarak molekül ve atomların birbirinden uzak olduğu ve çok hızlı hareket ettiği bir haldir. Gaz molekülleri birbirine
Giriş Maddeyi Oluşturan Tanecikler Element Ve Bileşikler Fiziksel Ve Kimyasal Değişim Maddenin Hallerinin Tanecikli Yapısı
 Giriş Maddeyi Oluşturan Tanecikler Element Ve Bileşikler Fiziksel Ve Kimyasal Değişim Maddenin Hallerinin Tanecikli Yapısı 1.MADDENİN YAPI TAŞLARI-ATOMLAR Atom:Maddeyi oluşturan en küçük yapı taşıdır.
Giriş Maddeyi Oluşturan Tanecikler Element Ve Bileşikler Fiziksel Ve Kimyasal Değişim Maddenin Hallerinin Tanecikli Yapısı 1.MADDENİN YAPI TAŞLARI-ATOMLAR Atom:Maddeyi oluşturan en küçük yapı taşıdır.
GENEL KİMYA. Dr. Öğr. Üyesi Yakup Güneş Temel Eğitim Bölümü Sınıf Eğitimi Anabilim Dalı Öğretim Üyesi
 GENEL KİMYA Dr. Öğr. Üyesi Yakup Güneş Temel Eğitim Bölümü Sınıf Eğitimi Anabilim Dalı Öğretim Üyesi Kimya Nedir? Kimya, evrendeki bütün maddelerin doğasını ve davranışını inceleyen ve böylelikle elde
GENEL KİMYA Dr. Öğr. Üyesi Yakup Güneş Temel Eğitim Bölümü Sınıf Eğitimi Anabilim Dalı Öğretim Üyesi Kimya Nedir? Kimya, evrendeki bütün maddelerin doğasını ve davranışını inceleyen ve böylelikle elde
GENEL KİMYA. Yrd.Doç.Dr. Tuba YETİM
 GENEL KİMYA KİMYASAL REAKSİYONLAR Kimyasal Tepkime Kimyasal tepkime, Bir ya da birkaç maddenin (tepkenler) yeni bir bileşik grubuna (ürünler) dönüştürülmesi işlemidir. Tepkenler Ürünler NO + 1/2 O 2 NO
GENEL KİMYA KİMYASAL REAKSİYONLAR Kimyasal Tepkime Kimyasal tepkime, Bir ya da birkaç maddenin (tepkenler) yeni bir bileşik grubuna (ürünler) dönüştürülmesi işlemidir. Tepkenler Ürünler NO + 1/2 O 2 NO
Element ve Bileşikler
 Element ve Bileşikler Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere element denir. Bir elementi oluşturan bütün atomların
Element ve Bileşikler Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere element denir. Bir elementi oluşturan bütün atomların
HACETTEPE ÜNĐVERSĐTESĐ ÖĞRETĐM TEKNOLOJĐLERĐ VE MATERYAL GELĐŞTĐRME KONU ANLATIMI. Hazırlayan: Hale Sümerkan. Dersin Sorumlusu: Prof. Dr.
 HACETTEPE ÜNĐVERSĐTESĐ ÖĞRETĐM TEKNOLOJĐLERĐ VE MATERYAL GELĐŞTĐRME KONU ANLATIMI Hazırlayan: Hale Sümerkan Dersin Sorumlusu: Prof. Dr.Đnci Morgil ANKARA 2008 ÇÖZELTĐLER Çözeltiler, iki ya da daha fazla
HACETTEPE ÜNĐVERSĐTESĐ ÖĞRETĐM TEKNOLOJĐLERĐ VE MATERYAL GELĐŞTĐRME KONU ANLATIMI Hazırlayan: Hale Sümerkan Dersin Sorumlusu: Prof. Dr.Đnci Morgil ANKARA 2008 ÇÖZELTĐLER Çözeltiler, iki ya da daha fazla
ÖĞRETĐM TEKNĐKLERĐ VE MATERYAL GELĐŞTĐRME
 ÖĞRETĐM TEKNĐKLERĐ VE MATERYAL GELĐŞTĐRME DERS SORUMLUSU: PROF. DR. ĐNCĐ MORGĐL ÖĞRENME ALANI: MADDE VE ÖZELLĐKLERĐ HAZIRLAYAN: Gökçegül DUYGUN 2008 ANKARA KONU ANLATIMI MADDE ve ÖZELLĐKLERĐ MADDE Kütlesi,
ÖĞRETĐM TEKNĐKLERĐ VE MATERYAL GELĐŞTĐRME DERS SORUMLUSU: PROF. DR. ĐNCĐ MORGĐL ÖĞRENME ALANI: MADDE VE ÖZELLĐKLERĐ HAZIRLAYAN: Gökçegül DUYGUN 2008 ANKARA KONU ANLATIMI MADDE ve ÖZELLĐKLERĐ MADDE Kütlesi,
Maddeyi Oluşturan Tanecikler
 Maddeyi Oluşturan Tanecikler a) Saf Madde : Kendine özgü fiziksel ve kimyasal özellikleri olan, ayırt edici özellikleri bulunan ve bu ayırt edici özellikleri sabit olan maddelere saf madde denir. Elementler
Maddeyi Oluşturan Tanecikler a) Saf Madde : Kendine özgü fiziksel ve kimyasal özellikleri olan, ayırt edici özellikleri bulunan ve bu ayırt edici özellikleri sabit olan maddelere saf madde denir. Elementler
Sıcaklık (Temperature):
 Sıcaklık (Temperature): Sıcaklık tanım olarak bir maddenin yapısındaki molekül veya atomların ortalama kinetik enerjilerinin ölçüm değeridir. Sıcaklık t veya T ile gösterilir. Termometre kullanılarak ölçülür.
Sıcaklık (Temperature): Sıcaklık tanım olarak bir maddenin yapısındaki molekül veya atomların ortalama kinetik enerjilerinin ölçüm değeridir. Sıcaklık t veya T ile gösterilir. Termometre kullanılarak ölçülür.
PERİYODİK CETVEL Mendeleev Henry Moseley Glenn Seaborg
 PERİYODİK CETVEL Periyodik cetvel elementleri sınıflandırmak için hazırlanmıştır. İlkperiyodik cetvel Mendeleev tarafından yapılmıştır. Mendeleev elementleri artan kütle numaralarına göre sıralamış ve
PERİYODİK CETVEL Periyodik cetvel elementleri sınıflandırmak için hazırlanmıştır. İlkperiyodik cetvel Mendeleev tarafından yapılmıştır. Mendeleev elementleri artan kütle numaralarına göre sıralamış ve
Serüveni. 1.ÜNİTE: KİMYA BİLİMİ Kimyanın Sembolik Dili #3
 Serüveni 1.ÜNİTE: KİMYA BİLİMİ Kimyanın Sembolik Dili #3 MADDE SAF MADDE SAF OLMAYAN MADDE(KARIŞIM) ELEMENT BİLEŞİK HOMOJEN KARIŞIM HETEROJEN KARIŞIM METAL İYONİK BİLEŞİKLER SÜSPANSİYON AMETAL KOVALENT
Serüveni 1.ÜNİTE: KİMYA BİLİMİ Kimyanın Sembolik Dili #3 MADDE SAF MADDE SAF OLMAYAN MADDE(KARIŞIM) ELEMENT BİLEŞİK HOMOJEN KARIŞIM HETEROJEN KARIŞIM METAL İYONİK BİLEŞİKLER SÜSPANSİYON AMETAL KOVALENT
GAZLAR GAZ KARIŞIMLARI
 DALTON KISMİ BASINÇLAR YASASI Aynı Kaplarda Gazların Karıştırılması Birbiri ile tepkimeye girmeyen gaz karışımlarının davranışı genellikle ilgi çekicidir. Böyle bir karışımdaki bir bileşenin basıncı, aynı
DALTON KISMİ BASINÇLAR YASASI Aynı Kaplarda Gazların Karıştırılması Birbiri ile tepkimeye girmeyen gaz karışımlarının davranışı genellikle ilgi çekicidir. Böyle bir karışımdaki bir bileşenin basıncı, aynı
TY T Temel Yeterlilik Testi
 Ortaöğretim lanı MF - 01 TY T Temel Yeterlilik Testi Kimya Ders Föyü Mol Mol: Maddeyi oluşturan tanecikleri saymayı kolaylaştıran bir paketleme sistemidir. 1. 3 S atomu için verilen; I. 1 mol S atomu 3
Ortaöğretim lanı MF - 01 TY T Temel Yeterlilik Testi Kimya Ders Föyü Mol Mol: Maddeyi oluşturan tanecikleri saymayı kolaylaştıran bir paketleme sistemidir. 1. 3 S atomu için verilen; I. 1 mol S atomu 3
6.PPB (milyarda bir kısım) Kaynakça Tablo A-1: Çözelti Örnekleri... 5 Tablo B-1:Kolloidal Tanecikler... 8
 İçindekiler A. ÇÖZELTİLER... 2 1.Çözünme... 2 2.Homojenlik... 4 3.Çözelti... 5 4.Çözünürlük... 5 Çözünürlüğe Sıcaklık Ve Basınç Etkisi... 6 B. KARIŞIMLAR... 7 1.Çözeltiler... 7 2.Kolloidal Karışımlar...
İçindekiler A. ÇÖZELTİLER... 2 1.Çözünme... 2 2.Homojenlik... 4 3.Çözelti... 5 4.Çözünürlük... 5 Çözünürlüğe Sıcaklık Ve Basınç Etkisi... 6 B. KARIŞIMLAR... 7 1.Çözeltiler... 7 2.Kolloidal Karışımlar...
Yrd.Doç.Dr. Emre YALAMAÇ. Yrd.Doç.Dr. Emre YALAMAÇ İÇERİK
 İÇERİK Elementlere, Bileşiklere ve Karışımlara atomik boyutta bakış Dalton Atom Modeli Atom Fiziğinde Buluşlar - Elektronların Keşfi - Atom Çekirdeği Keşfi Günümüz Atom Modeli Kimyasal Elementler Periyodik
İÇERİK Elementlere, Bileşiklere ve Karışımlara atomik boyutta bakış Dalton Atom Modeli Atom Fiziğinde Buluşlar - Elektronların Keşfi - Atom Çekirdeği Keşfi Günümüz Atom Modeli Kimyasal Elementler Periyodik
GENEL KİMYA. 6. Konu: Mol Kavramı ve Avagadro Sayısı
 GENEL KİMYA 6. Konu: Mol Kavramı ve Avagadro Sayısı Avagadro Sayısı ve Mol Kavramı Gündelik hayatta bazen maddeleri teker teker ifade etmek yerine toplu halde belirtmeyi tercih ederiz. Örneğin; 30 tane
GENEL KİMYA 6. Konu: Mol Kavramı ve Avagadro Sayısı Avagadro Sayısı ve Mol Kavramı Gündelik hayatta bazen maddeleri teker teker ifade etmek yerine toplu halde belirtmeyi tercih ederiz. Örneğin; 30 tane
Atomlar ve Moleküller
 Atomlar ve Moleküller Madde, uzayda yer işgal eden ve kütlesi olan herşeydir. Element, kimyasal tepkimelerle başka bileşiklere parçalanamayan maddedir. -Doğada 92 tane element bulunmaktadır. Bileşik, belli
Atomlar ve Moleküller Madde, uzayda yer işgal eden ve kütlesi olan herşeydir. Element, kimyasal tepkimelerle başka bileşiklere parçalanamayan maddedir. -Doğada 92 tane element bulunmaktadır. Bileşik, belli
KARIŞIMLAR. Birden çok maddenin kimyasal bağ oluşturmadan bir arada bulunmasıyla meydana gelen mad-delere karışım denir.
 KARIŞIMLAR Birden çok maddenin kimyasal bağ oluşturmadan bir arada bulunmasıyla meydana gelen mad-delere karışım denir. 1-HETEROJEN KARIŞIMLAR (ADİ KARIŞIMLAR) Karışımı oluşturan maddeler karışımın her
KARIŞIMLAR Birden çok maddenin kimyasal bağ oluşturmadan bir arada bulunmasıyla meydana gelen mad-delere karışım denir. 1-HETEROJEN KARIŞIMLAR (ADİ KARIŞIMLAR) Karışımı oluşturan maddeler karışımın her
Kimyanın Temel Kanunları
 Kimyanın Temel Kanunları A. Kütlenin Korunumu Kanunu Lavoiser miktarı belli olan kalay (Sn) parçasını içinde bir miktar hava bulunan bir fanusa koyarak tartmış.daha sonra fanusu içindekilerle birlikte
Kimyanın Temel Kanunları A. Kütlenin Korunumu Kanunu Lavoiser miktarı belli olan kalay (Sn) parçasını içinde bir miktar hava bulunan bir fanusa koyarak tartmış.daha sonra fanusu içindekilerle birlikte
ISI VE SICAKLIK. 1 cal = 4,18 j
 ISI VE SICAKLIK ISI Isı ve sıcaklık farklı şeylerdir. Bir maddeyi oluşturan bütün taneciklerin sahip olduğu kinetik enerjilerin toplamına ISI denir. Isı bir enerji türüdür. Isı birimleri joule ( j ) ve
ISI VE SICAKLIK ISI Isı ve sıcaklık farklı şeylerdir. Bir maddeyi oluşturan bütün taneciklerin sahip olduğu kinetik enerjilerin toplamına ISI denir. Isı bir enerji türüdür. Isı birimleri joule ( j ) ve
STOKĐYOMETRĐ. Yrd.Doç.Dr. İbrahim İsmet ÖZTÜRK
 STOKĐYOMETRĐ Yrd.Doç.Dr. İbrahim İsmet ÖZTÜRK 3. Stokiyometri 3.1. Atom Kütlesi 3.1.1.Ortalama Atom Kütlesi 3.2. Avagadro Sayısı ve Elementlerin Mol Kütleleri 3.3. Molekül Kütlesi 3.4. Kütle Spektrometresi
STOKĐYOMETRĐ Yrd.Doç.Dr. İbrahim İsmet ÖZTÜRK 3. Stokiyometri 3.1. Atom Kütlesi 3.1.1.Ortalama Atom Kütlesi 3.2. Avagadro Sayısı ve Elementlerin Mol Kütleleri 3.3. Molekül Kütlesi 3.4. Kütle Spektrometresi
GENEL KİMYA. Yrd. Doç. Dr. Yakup Güneş İlköğretim Bölümü Sınıf Eğitimi Anabilim Dalı Öğretim Üyesi
 GENEL KİMYA Yrd. Doç. Dr. Yakup Güneş İlköğretim Bölümü Sınıf Eğitimi Anabilim Dalı Öğretim Üyesi Kimya Nedir? Kimya, evrendeki bütün maddelerin doğasını ve davranışını inceleyen ve böylelikle elde edilen
GENEL KİMYA Yrd. Doç. Dr. Yakup Güneş İlköğretim Bölümü Sınıf Eğitimi Anabilim Dalı Öğretim Üyesi Kimya Nedir? Kimya, evrendeki bütün maddelerin doğasını ve davranışını inceleyen ve böylelikle elde edilen
2+ 2- Mg SO 4. (NH 4 ) 2 SO 4 (amonyum sülfat) bileşiğini katyon ve anyonlara ayıralım.
 KONU: Kimyasal Tepkimeler Dersin Adı Dersin Konusu İYONİK BİLEŞİKLERİN FORMÜLLERİNİN YAZILMASI İyonik bağlı bileşiklerin formüllerini yazmak için atomların yüklerini bilmek gerekir. Bunu da daha önceki
KONU: Kimyasal Tepkimeler Dersin Adı Dersin Konusu İYONİK BİLEŞİKLERİN FORMÜLLERİNİN YAZILMASI İyonik bağlı bileşiklerin formüllerini yazmak için atomların yüklerini bilmek gerekir. Bunu da daha önceki
KİMYA ÖABT. SORU BANKASI Tamamı Çözümlü KPSS Eğitimde
 ÖABT KİMYA KPSS 2016 Pegem Akademi Sınav Komisyonu; 2015 KPSS ye Pegem Yayınları ile hazırlanan adayların, 40'ın üzerinde soruyu kolaylıkla çözebildiğini açıkladı. SORU BANKASI Tamamı Çözümlü Eğitimde
ÖABT KİMYA KPSS 2016 Pegem Akademi Sınav Komisyonu; 2015 KPSS ye Pegem Yayınları ile hazırlanan adayların, 40'ın üzerinde soruyu kolaylıkla çözebildiğini açıkladı. SORU BANKASI Tamamı Çözümlü Eğitimde
İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA
 İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA İNCELENİR Her tarafında aynı özelliği gösteren, tek bir madde
İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA İNCELENİR Her tarafında aynı özelliği gösteren, tek bir madde
İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA İNCELENİR
 KARIŞIMLAR İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA İNCELENİR Her tarafında aynı özelliği gösteren, tek
KARIŞIMLAR İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA İNCELENİR Her tarafında aynı özelliği gösteren, tek
Katlı oranlar kanunu. 2H 2 + O 2 H 2 O Sabit Oran ( 4 g 32 g 36 g. 2 g 16 g 18 g. 1 g 8 g 9 g. 8 g 64 g 72 g. N 2 + 3H 2 2NH 3 Sabit Oran (
 Sabit oranlar kanunu Bir bileşiği oluşturan elementlerin kütleleri arasında sabit bir oran vardır. Bu sabit oranın varlığı ilk defa 799 tarihinde Praust tarafından bulunmuş ve sabit oranlar kanunu şeklinde
Sabit oranlar kanunu Bir bileşiği oluşturan elementlerin kütleleri arasında sabit bir oran vardır. Bu sabit oranın varlığı ilk defa 799 tarihinde Praust tarafından bulunmuş ve sabit oranlar kanunu şeklinde
Çözeltiler. MÜHENDİSLİK KİMYASI DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN. Yrd. Doç. Dr. Atilla EVCİN Afyonkarahisar Kocatepe Üniversitesi 2006
 Çözeltiler Çözelti, iki veya daha fazla maddenin homojen bir karışımı olup, en az iki bileşenden oluşur. Bileşenlerden biri çözücü, diğeri ise çözünendir. MÜHENDİSLİK KİMYASI DERS NOTLARI Yrd. Doç. Dr.
Çözeltiler Çözelti, iki veya daha fazla maddenin homojen bir karışımı olup, en az iki bileşenden oluşur. Bileşenlerden biri çözücü, diğeri ise çözünendir. MÜHENDİSLİK KİMYASI DERS NOTLARI Yrd. Doç. Dr.
GENEL KİMYA. Yrd.Doç.Dr. Tuba YETİM
 GENEL KİMYA MOLEKÜLLER ARASI KUVVETLER Moleküller Arası Kuvvetler Yüksek basınç ve düşük sıcaklıklarda moleküller arası kuvvetler gazları ideallikten saptırır. Moleküller arası kuvvetler molekülde kalıcı
GENEL KİMYA MOLEKÜLLER ARASI KUVVETLER Moleküller Arası Kuvvetler Yüksek basınç ve düşük sıcaklıklarda moleküller arası kuvvetler gazları ideallikten saptırır. Moleküller arası kuvvetler molekülde kalıcı
GENEL KĐMYA I. Yrd.Doç.Dr. İbrahim İsmet ÖZTÜRK
 GENEL KĐMYA I Yrd.Doç.Dr. İbrahim İsmet ÖZTÜRK GENEL KĐMYA 1 Đlkeler ve Modern Uygulamalar Petrucci Harwood - Herring Çeviri Editörleri Tahsin Uyar - Serpil Aksoy MODERN ÜNĐVERSĐTE KĐMYASI C.E.MORTIMER
GENEL KĐMYA I Yrd.Doç.Dr. İbrahim İsmet ÖZTÜRK GENEL KĐMYA 1 Đlkeler ve Modern Uygulamalar Petrucci Harwood - Herring Çeviri Editörleri Tahsin Uyar - Serpil Aksoy MODERN ÜNĐVERSĐTE KĐMYASI C.E.MORTIMER
KİM-117 TEMEL KİMYA Prof. Dr. Zeliha HAYVALI Ankara Üniversitesi Kimya Bölümü
 KİM-117 TEMEL KİMYA Prof. Dr. Zeliha HAYVALI Ankara Üniversitesi Kimya Bölümü Bu slaytlarda anlatılanlar sadece özet olup ayrıntılı bilgiler ve örnek çözümleri derste verilecektir. HAFTALARA GÖRE KONU
KİM-117 TEMEL KİMYA Prof. Dr. Zeliha HAYVALI Ankara Üniversitesi Kimya Bölümü Bu slaytlarda anlatılanlar sadece özet olup ayrıntılı bilgiler ve örnek çözümleri derste verilecektir. HAFTALARA GÖRE KONU
4. SINIF KİMYA KONU ANLATIMI MADDE NEDİR?
 4. SINIF KİMYA KONU ANLATIMI MADDE NEDİR? Kütlesi, hacmi ve eylemsizliği olan herşey maddedir. Buna göre kütle hacim ve eylemsizlik maddenin ortak özelliklerindendir. Çevremizde gördüğümüz, hava, su, toprak
4. SINIF KİMYA KONU ANLATIMI MADDE NEDİR? Kütlesi, hacmi ve eylemsizliği olan herşey maddedir. Buna göre kütle hacim ve eylemsizlik maddenin ortak özelliklerindendir. Çevremizde gördüğümüz, hava, su, toprak
Enerji iş yapabilme kapasitesidir. Kimyacı işi bir süreçten kaynaklanan enerji deyişimi olarak tanımlar.
 Kinetik ve Potansiyel Enerji Enerji iş yapabilme kapasitesidir. Kimyacı işi bir süreçten kaynaklanan enerji deyişimi olarak tanımlar. Işıma veya Güneş Enerjisi Isı Enerjisi Kimyasal Enerji Nükleer Enerji
Kinetik ve Potansiyel Enerji Enerji iş yapabilme kapasitesidir. Kimyacı işi bir süreçten kaynaklanan enerji deyişimi olarak tanımlar. Işıma veya Güneş Enerjisi Isı Enerjisi Kimyasal Enerji Nükleer Enerji
GENEL KİMYA. 7. Konu: Kimyasal reaksiyonlar, Kimyasal eşitlikler, Kimyasal tepkime türleri, Kimyasal Hesaplamalar
 GENEL KİMYA 7. Konu: Kimyasal reaksiyonlar, Kimyasal eşitlikler, Kimyasal tepkime türleri, Kimyasal Hesaplamalar Kimyasal Reaksiyonlar Kimyasal reaksiyon (tepkime), kimyasal maddelerdeki kimyasal değişme
GENEL KİMYA 7. Konu: Kimyasal reaksiyonlar, Kimyasal eşitlikler, Kimyasal tepkime türleri, Kimyasal Hesaplamalar Kimyasal Reaksiyonlar Kimyasal reaksiyon (tepkime), kimyasal maddelerdeki kimyasal değişme
Genel Kimya. Bölüm 7: ÇÖZELTİLER VE ÇÖZÜNÜRLÜK. Yrd. Doç. Dr. Mustafa SERTÇELİK Kafkas Üniversitesi Kimya Mühendisliği Bölümü
 Genel Kimya Bölüm 7: ÇÖZELTİLER VE ÇÖZÜNÜRLÜK Yrd. Doç. Dr. Mustafa SERTÇELİK Kafkas Üniversitesi Kimya Mühendisliği Bölümü ÇÖZELTİ VE TÜRLERİ Eğer bir madde diğer bir madde içinde molekül, atom veya iyonları
Genel Kimya Bölüm 7: ÇÖZELTİLER VE ÇÖZÜNÜRLÜK Yrd. Doç. Dr. Mustafa SERTÇELİK Kafkas Üniversitesi Kimya Mühendisliği Bölümü ÇÖZELTİ VE TÜRLERİ Eğer bir madde diğer bir madde içinde molekül, atom veya iyonları
ÇÖZELTİLERİN KOLİGATİF ÖZELLİKLERİ
 ÇÖZELTİLERİN KOLİGATİF ÖZELLİKLERİ Çözeltilerin sadece derişimine bağlı olarak değişen özelliklerine koligatif özellikler denir. Buhar basıncı düşmesi, Kaynama noktası yükselmesi, Donma noktası azalması
ÇÖZELTİLERİN KOLİGATİF ÖZELLİKLERİ Çözeltilerin sadece derişimine bağlı olarak değişen özelliklerine koligatif özellikler denir. Buhar basıncı düşmesi, Kaynama noktası yükselmesi, Donma noktası azalması
KARIŞIMLARIN SINIFLANDIRILMASI HAZIRLAYAN FEHMİ GÜR
 IN SINIFLANDIRILMASI HAZIRLAYAN FEHMİ GÜR IN SINIFLANDIRILMASI Karışımlar hangi özelliklerine göre sınıflandırılır? Karışımların sınıflandırılmasında belirleyici olan faktörler nelerdir? Farklı maddelerin
IN SINIFLANDIRILMASI HAZIRLAYAN FEHMİ GÜR IN SINIFLANDIRILMASI Karışımlar hangi özelliklerine göre sınıflandırılır? Karışımların sınıflandırılmasında belirleyici olan faktörler nelerdir? Farklı maddelerin
ÇÖZÜNME ve ÇÖZÜNÜRLÜK
 ÇÖZÜNME ve ÇÖZÜNÜRLÜK Prof. Dr. Mustafa DEMİR M.DEMİR 05-ÇÖZÜNME VE ÇÖZÜNÜRLÜK 1 Çözünme Olayı Analitik kimyada çözücü olarak genellikle su kullanılır. Su molekülleri, bir oksijen atomuna bağlı iki hidrojen
ÇÖZÜNME ve ÇÖZÜNÜRLÜK Prof. Dr. Mustafa DEMİR M.DEMİR 05-ÇÖZÜNME VE ÇÖZÜNÜRLÜK 1 Çözünme Olayı Analitik kimyada çözücü olarak genellikle su kullanılır. Su molekülleri, bir oksijen atomuna bağlı iki hidrojen
T.C. ANADOLU ÜNİVERSİTESİ YAYINI NO: 3275 AÇIKÖĞRETİM FAKÜLTESİ YAYINI NO: 2138 HAVACILIK EMNİYETİ
 T.C. ANADOLU ÜNİVERSİTESİ YAYINI NO: 3275 AÇIKÖĞRETİM FAKÜLTESİ YAYINI NO: 2138 HAVACILIK EMNİYETİ Yazarlar Doç.Dr. Ender GEREDE (Ünite 1, 5, 7, 8) Yrd.Doç.Dr. Uğur TURHAN (Ünite 2) Dr. Eyüp Bayram ŞEKERLİ
T.C. ANADOLU ÜNİVERSİTESİ YAYINI NO: 3275 AÇIKÖĞRETİM FAKÜLTESİ YAYINI NO: 2138 HAVACILIK EMNİYETİ Yazarlar Doç.Dr. Ender GEREDE (Ünite 1, 5, 7, 8) Yrd.Doç.Dr. Uğur TURHAN (Ünite 2) Dr. Eyüp Bayram ŞEKERLİ
SU VE HÜCRE İLİŞKİSİ
 SU VE HÜCRE İLİŞKİSİ Oluşturacağı her 1 g organik madde için bitkinin 500 g kadar suyu kökleriyle alması ve tepe (uç) noktasına kadar taşıyarak atmosfere aktarması gerekir. Normal su düzeyinde hayvan hücrelerinin
SU VE HÜCRE İLİŞKİSİ Oluşturacağı her 1 g organik madde için bitkinin 500 g kadar suyu kökleriyle alması ve tepe (uç) noktasına kadar taşıyarak atmosfere aktarması gerekir. Normal su düzeyinde hayvan hücrelerinin
Element ve Bileşikler
 Element ve Bileşikler Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere element denir. Bir elementi oluşturan bütün atomların
Element ve Bileşikler Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere element denir. Bir elementi oluşturan bütün atomların
T.C. Ölçme, Seçme ve Yerleştirme Merkezi
 T.C. Ölçme, Seçme ve Yerleştirme Merkezi LİSANS YERLEŞTİRME SINAVI-2 KİMYA TESTİ 25 HAZİRAN 2016 CUMARTESİ Bu testlerin her hakkı saklıdır. Hangi amaçla olursa olsun, testlerin tamamının veya bir kısmının
T.C. Ölçme, Seçme ve Yerleştirme Merkezi LİSANS YERLEŞTİRME SINAVI-2 KİMYA TESTİ 25 HAZİRAN 2016 CUMARTESİ Bu testlerin her hakkı saklıdır. Hangi amaçla olursa olsun, testlerin tamamının veya bir kısmının
GENEL KİMYA 101 ÖDEV 3
 TOBB EKONOMİ VE TEKNOLOJİ ÜNİVERSİTESİ-27 Kasım 2013 Bütün Şubeler GENEL KİMYA 101 ÖDEV 3 ÖNEMLİ! Ödev Teslim Tarihi: 6 Aralık 2013 Soru 1-5 arasında 2 soru Soru 6-10 arasında 2 soru Soru 11-15 arasında
TOBB EKONOMİ VE TEKNOLOJİ ÜNİVERSİTESİ-27 Kasım 2013 Bütün Şubeler GENEL KİMYA 101 ÖDEV 3 ÖNEMLİ! Ödev Teslim Tarihi: 6 Aralık 2013 Soru 1-5 arasında 2 soru Soru 6-10 arasında 2 soru Soru 11-15 arasında
SICAKLIK NEDİR? Sıcaklık termometre
 SICAKLIK NEDİR? Sıcaklık maddedeki moleküllerin hareket hızları ile ilgilidir. Bu maddeler için aynı veya farklı olabilir. Yani; Sıcaklık ortalama hızda hareket eden bir molekülün hareket (kinetik) enerjisidir.
SICAKLIK NEDİR? Sıcaklık maddedeki moleküllerin hareket hızları ile ilgilidir. Bu maddeler için aynı veya farklı olabilir. Yani; Sıcaklık ortalama hızda hareket eden bir molekülün hareket (kinetik) enerjisidir.
ATOM ve YAPISI Maddelerin gözle görülmeyen (bölünmeyen) en parçasına atom denir. Atom kendinden başka hiçbir fiziksel ya da kimyasal metotlarla
 ATOM ve YAPISI Maddelerin gözle görülmeyen (bölünmeyen) en parçasına atom denir. Atom kendinden başka hiçbir fiziksel ya da kimyasal metotlarla kendinden farklı atomlara dönüşemezler. Atomda (+) yüklü
ATOM ve YAPISI Maddelerin gözle görülmeyen (bölünmeyen) en parçasına atom denir. Atom kendinden başka hiçbir fiziksel ya da kimyasal metotlarla kendinden farklı atomlara dönüşemezler. Atomda (+) yüklü
şeklinde, katı ( ) fazın ağırlık oranı ise; şeklinde hesaplanır.
 FAZ DİYAGRAMLARI Malzeme özellikleri görmüş oldukları termomekanik işlemlerin sonucunda oluşan içyapılarına bağlıdır. Faz diyagramları mühendislerin içyapı değişikliği için uygulayacakları ısıl işlemin
FAZ DİYAGRAMLARI Malzeme özellikleri görmüş oldukları termomekanik işlemlerin sonucunda oluşan içyapılarına bağlıdır. Faz diyagramları mühendislerin içyapı değişikliği için uygulayacakları ısıl işlemin
ÖLÇME, DEĞERLENDİRME VE SINAV HİZMETLERİ GENEL MÜDÜRLÜĞÜ
 AY EKİM 06-07 EĞİTİM - ÖĞRETİM YILI. SINIF VE MEZUN GRUP KİMYA HAFTA DERS SAATİ. Kimya nedir?. Kimya ne işe yarar?. Kimyanın sembolik dili Element-sembol Bileşik-formül. Güvenliğimiz ve Kimya KONU ADI
AY EKİM 06-07 EĞİTİM - ÖĞRETİM YILI. SINIF VE MEZUN GRUP KİMYA HAFTA DERS SAATİ. Kimya nedir?. Kimya ne işe yarar?. Kimyanın sembolik dili Element-sembol Bileşik-formül. Güvenliğimiz ve Kimya KONU ADI
Maddenin Tanecikli Yapısı
 Maddenin Tanecikli Yapısı MADDENİN TANIMI MADDENİN HALLERİ MADDENİN EN KÜÇÜK BİRİMİ MADDENİN DEĞİŞİMİ YAPISI Maddenin Tanımı Kütlesi olan ve boşlukta yer kaplayan her şeye madde denir. Cisim nedir? Maddenin
Maddenin Tanecikli Yapısı MADDENİN TANIMI MADDENİN HALLERİ MADDENİN EN KÜÇÜK BİRİMİ MADDENİN DEĞİŞİMİ YAPISI Maddenin Tanımı Kütlesi olan ve boşlukta yer kaplayan her şeye madde denir. Cisim nedir? Maddenin
Maddeye dışarıdan ısı verilir yada alınırsa maddenin sıcaklığı değişir. Dışarıdan ısı alan maddenin Kinetik Enerjisi dolayısıyla taneciklerinin
 Maddeye dışarıdan ısı verilir yada alınırsa maddenin sıcaklığı değişir. Dışarıdan ısı alan maddenin Kinetik Enerjisi dolayısıyla taneciklerinin titreşim hızı artar. Tanecikleri bir arada tutan kuvvetler
Maddeye dışarıdan ısı verilir yada alınırsa maddenin sıcaklığı değişir. Dışarıdan ısı alan maddenin Kinetik Enerjisi dolayısıyla taneciklerinin titreşim hızı artar. Tanecikleri bir arada tutan kuvvetler
Termodinamik İdeal Gazlar Isı ve Termodinamiğin 1. Yasası
 İdeal Gazlar Isı ve Termodinamiğin 1. Yasası İdeal Gazlar P basıncında, V hacmindeki bir kaba konulan kütlesi m ve sıcaklığı T olan bir gazın özellikleri ele alınacaktır. Bu kavramların birbirleriyle nasıl
İdeal Gazlar Isı ve Termodinamiğin 1. Yasası İdeal Gazlar P basıncında, V hacmindeki bir kaba konulan kütlesi m ve sıcaklığı T olan bir gazın özellikleri ele alınacaktır. Bu kavramların birbirleriyle nasıl
Elektronların Dağılımı ve Kimyasal Özellikleri
 Elektronların Dağılımı ve Kimyasal Özellikleri Helyum (2), neon (10), argon (18)in elektron dağılımları incelendiğinde Eğer bu üç elementin birer elektronu daha olsaydı, her birinde yeni bir katman oluşacaktı.
Elektronların Dağılımı ve Kimyasal Özellikleri Helyum (2), neon (10), argon (18)in elektron dağılımları incelendiğinde Eğer bu üç elementin birer elektronu daha olsaydı, her birinde yeni bir katman oluşacaktı.
EYVAH ŞEKERĐM KAYBOLDU!!!!! 9. SINIF 4. ÜNĐTE KARIŞIMLAR
 EYVAH ŞEKERĐM KAYBOLDU!!!!! 9. SINIF 4. ÜNĐTE KARIŞIMLAR KĐMYA ĐLE ĐLĐŞKĐSĐ ve GÜNLÜK HAYATLA ĐLĐŞKĐSĐ ŞEKERĐN ÇAYDA YA DA BAŞKA BĐR SIVIDA KARIŞTIRILDIĞINDA KAYBOLMASI, KĐMYADA ÇÖZÜNME OLGUSUYLA AÇIKLANABĐLĐR.
EYVAH ŞEKERĐM KAYBOLDU!!!!! 9. SINIF 4. ÜNĐTE KARIŞIMLAR KĐMYA ĐLE ĐLĐŞKĐSĐ ve GÜNLÜK HAYATLA ĐLĐŞKĐSĐ ŞEKERĐN ÇAYDA YA DA BAŞKA BĐR SIVIDA KARIŞTIRILDIĞINDA KAYBOLMASI, KĐMYADA ÇÖZÜNME OLGUSUYLA AÇIKLANABĐLĐR.
ANADOLU ÜNİVERSİTESİ AÇIKÖĞRETİM FAKÜLTESİ İLKÖĞRETİM ÖĞRETMENLİĞİ LİSANS TAMAMLAMA PROGRAMI. Analiz. Cilt 2. Ünite 8-14
 ANADOLU ÜNİVERSİTESİ AÇIKÖĞRETİM FAKÜLTESİ İLKÖĞRETİM ÖĞRETMENLİĞİ LİSANS TAMAMLAMA PROGRAMI Analiz Cilt 2 Ünite 8-14 T.C. ANADOLU ÜNİVERSİTESİ YAYINLARI NO: 1082 AÇIKÖĞRETİM FAKÜLTESİ YAYINLARI NO: 600
ANADOLU ÜNİVERSİTESİ AÇIKÖĞRETİM FAKÜLTESİ İLKÖĞRETİM ÖĞRETMENLİĞİ LİSANS TAMAMLAMA PROGRAMI Analiz Cilt 2 Ünite 8-14 T.C. ANADOLU ÜNİVERSİTESİ YAYINLARI NO: 1082 AÇIKÖĞRETİM FAKÜLTESİ YAYINLARI NO: 600
Burada a, b, c ve d katsayılar olup genelde birer tamsayıdır. Benzer şekilde 25 o C de hidrojen ve oksijen gazlarından suyun oluşumu; H 2 O (s)
 1 Kimyasal Tepkimeler Kimyasal olaylar elementlerin birbirleriyle etkileşip elektron alışverişi yapmaları sonucu oluşan olaylardır. Bu olaylar neticesinde bir bileşikteki atomların sayısı, dizilişi, bağ
1 Kimyasal Tepkimeler Kimyasal olaylar elementlerin birbirleriyle etkileşip elektron alışverişi yapmaları sonucu oluşan olaylardır. Bu olaylar neticesinde bir bileşikteki atomların sayısı, dizilişi, bağ
4. Açısal momentum kuantum sayısı (,) 2 olan bir orbital türü ile ilgili, 5. Orbitaller Maksimum elektron sayısı
 Kuantum Sayıları Ve rbitaller 1. Başkuantum sayısı (n) belirtilen temel enerji düzeylerinden hangisinde bulunabilecek maksimum orbital sayısı yanlış verilmiştir? Başkuantum sayısı (n) Maksimum orbital
Kuantum Sayıları Ve rbitaller 1. Başkuantum sayısı (n) belirtilen temel enerji düzeylerinden hangisinde bulunabilecek maksimum orbital sayısı yanlış verilmiştir? Başkuantum sayısı (n) Maksimum orbital
