T.C. ĐSTA BUL Ü ĐVERSĐTESĐ SAĞLIK BĐLĐMLERĐ E STĐTÜSÜ ( YÜKSEK LĐSA S TEZĐ )
|
|
|
- Koray Gözübüyük
- 5 yıl önce
- İzleme sayısı:
Transkript
1 T.C. ĐSTA BUL Ü ĐVERSĐTESĐ SAĞLIK BĐLĐMLERĐ E STĐTÜSÜ ( YÜKSEK LĐSA S TEZĐ ) C POLĐ (ADP-RĐBOZ) POLĐMERAZI Đ FERTĐL Đ SA EJAKULAT SPERMĐ DE Đ CELE MESĐ: SPERM A OMALĐLERĐ ĐLE OLA ĐLĐŞKĐSĐ SELE BĐRDAL DA IŞMA PROF.DR. FARUK ALKA HĐSTOLOJĐ VE EMBRĐYOLOJĐ A ABĐLĐM DALI HĐSTOLOJĐ VE EMBRĐYOLOJĐ PROGRAMI ĐSTA BUL-2010
2 ii BEYA Bu tez çalışmasının kendi çalışmam olduğunu, tezin planlanmasından yazımına kadar bütün safhalarda etik dışı davranışımın olmadığını, bu tezdeki bütün bilgileri akademik ve etik kurallar içinde elde ettiğimi, bu tez çalışmasıyla elde edilmeyen bütün bilgi ve yorumlara kaynak gösterdiğimi ve bu kaynakları da kaynaklar listesine aldığımı, yine bu tezin çalışılması ve yazımı sırasında patent ve telif haklarını ihlal edici bir davranışımın olmadığı beyan ederim. Selen BĐRDAL
3 iii ĐTHAF Aileme ithaf ediyorum.
4 iv TEŞEKKÜR Her koşulda yanımda olan, desteklerini hiçbir zaman esirgemeyen sevgili annem Leman Birdal a, babam Kenan Birdal a ve ağabeyim Serkan Birdal a gönülden minnetlerimi sunmayı bir borç bilirim. Yüksek lisans eğitimime, anabilim dalımıza beni kabul ederek başlamamı sağlayan Prof.Dr. Đsmail Seçkin, Prof.Dr Faruk Alkan, Prof.Dr. Hüseyin Oktar, Prof.Dr Oktay Arda, Prof.Dr. Mustafa Taşyürekli ve Prof.Dr. Şenol Ertürkoğlu na teşekkürlerimi bildirmeyi bir borç bilirim. Tez konumu belirlememde ve devamını sağlamamda bilgi ve fikirleriyle yanımda olan danışman hocam Prof.Dr. Faruk Alkan a, üroloji kliniği hekimleri Prof.Dr. Bülent Alıcı ve Prof.Dr. Nur Ahmet Erözenci ye teşekkürlerimi sunarım. Cerrahpaşa Tıp Fakültesi Histoloji ve Embriyoloji kürsüsündeki Murat Başar ve Dr. Hande Tutkan a ve sahip oldukları bilgi ve deneyimleri ile desteklerini esirgemeyip yanımda oldukları için en içten teşekkürlerimi sunarım. Bununla birlikte başta sevgili arkadaşlarım Günseli Gecir, Sibel Demirci ve Mediha Eser olmak üzere diğer tüm çalışma arkadaşlarıma teşekkür ederim. Tezimin elektron mikroskopi parçalarının hazırlanmasında yardımcı olan bölümümüz teknsiyenleri Azize Hardal Gümüşyazıcı, Ercüment Boztaş ve Marmara Üniversitesi Tıp Fakültesi Histoloji ve Embriyoloji A.D daki sevgili arkadaşım Özlem Tuğçe Çilingir e teşekkürlerimi bildirmeyi bir borç bilirim. Elektron mikroskopi kesitlerimi resimlerken yardımcı olan Đstanbul Üniversitesi Tıp Fakültesi Histoloji ve Embriyoloji A.D teknisyeni Ebru Karabulut a teşekkür ederim. Bu çalışma, Đstanbul Üniversitesi Bilimsel Araştırma Projeleri Birimi tarafından desteklenmiştir. Proje No: 4134
5 v ĐÇĐ DEKĐLER TEZ ONAYI... ERROR! BOOKMARK OT DEFI ED. BEYAN...ĐĐ ĐTHAF... ĐĐĐ TEŞEKKÜR... ĐV ĐÇĐNDEKĐLER... V TABLOLAR LĐSTESĐ...VĐĐ ŞEKĐLLER VE RESĐMLER LĐSTESĐ ĐX SEMBOLLER / KISALTMALAR LĐSTESĐ...VĐĐĐ ÖZET... XĐ ABSTRACT...XĐĐ 1. GĐRĐŞ VE AMAÇ GENEL BĐLGĐLER Erkek Üreme Sistemi Testis Gelişimi Testis Histolojisi Peritübüler Doku Sertoli Hücreleri Leydig Hücreleri Testisin Damar, Lenfatik ve Sinir Sistemi Tubuli Rekti Rete Testis Duktuli Efferentes Epididim Duktus Deferens Ejakülatör Kanal Yardımcı (Aksesuar) Genital Bezler Germinal Hücreler ve Spermatogenez Spermatogonyumlar Spermatositler Spermatidler.25
6 vi Sperm Erkek Gametlerinde Poli (ADP-riboz) Polimerazın Potansiyel Biyolojik Rolü Poli (ADP-riboz) Polimeraz (PARP) Đnfertil Erkeğin Değerlendirilmesi Semen Analizi Toplanması Fiziksel Özellikler Sperm Konsantrasyonunun Hesaplanması Motilite Morfoloji Đlave Semen Parametreleri GEREÇ VE YÖNTEMLER Gereçler Yöntemler Semen Örneklerinin Alınması Örneklerin Alınması ve Takip Yöntemi Anilin Mavisi Boyama Yöntemi Elektron Mikroskopi Yöntemi Đmmunositokimya Yöntemi Apopitoz Tayini BULGULAR Anilin Mavisi Boyanması Elektron Mikroskopi Bulguları Đmmunositokimya Bulguları Apopitoz Tayini Bulguları TARTIŞMA 62 KAYNAKLAR.66 FORMLAR..77 ETĐK KURUL KARARI..78 ÖZGEÇMĐŞ.79
7 vii TABLOLAR LĐSTESĐ Tablo 3-1: Çalışmada Kullanılan Deneklere Ait Özellikler 50
8 viii ŞEKĐLLER VE RESĐMLER LĐSTESĐ Şekil 2-1: Erkek Üreme Sistemi.. 3 Şekil 2-2: Testislerin Gelişimi..6 Şekil 2-3: Testis Histolojik Yapısı. 8 Şekil 2-4: Testis Enine Kesiti.10 Şekil 2-5: Sertoli Hücreleri Arasındaki Tıkayıcı Bağlantılar.12 Şekil 2-6: Seminifer Tübül Kesiti...14 Şekil 2-7: Epididim Enine Kesiti...17 Şekil 2-8: Duktus Deferens Enine Kesiti 19 Şekil 2-9: Spermatogenez.. 22 Şekil 2-10: Sperm Kuyruğu Orta Parçası...30 Şekil 2-11:Sperm Kuyruğu Esas Parçası Şekil 2-12:Sperm Yapısı. 33 Şekil 2-13:PARP Yapısal Bölgeleri...36 Şekil 2-14:DNA Hasarı Sonrası PARP Fonksiyonu.. 39 Resim 4-1: Anilin Mavisi Boyanmış IM Resmi 56 Resim 4-2: KG EM Resmi 57 Resim 4-3: HG EM Resmi 57 Resim 4-4: HG EM Resmi. 58 Resim 4-5: KG EM Resmi. 58 Resim 4-6: HG EM Resmi. 59 Resim 4-7: PARP-1 Đmmün Boyanması Resim 4-8: Apopitotik Đndeks Tayini. 61
9 ix SEMBOLLER / KISALTMALAR LĐSTESĐ HG KG PAR PARP DNA ICSI ATP MIS LH hcg PAS Hasta Grubu Kontrol Grubu Poli (ADP-Riboz) Poli (ADP-Riboz) Polimeraz Deoksiribonükleik asit Đntra Sitoplazmik Sperm Enjeksiyonu Adenozin Trifosfat Müllerian Đnhibe Edici Madde Luteinizan Hormon Đnsan Koryonik Gonadotropin Periyodik asit schiff DER Düz Yüzlü Endoplazmik Retikulum HL Hemalaun H+E Hematoksilen + Eozin DHT Dehidrotestosteron G1, G2, S Hücre siklusu aktif fazları N DNA miktarı n kromozom sayısı µm Mikrometre NLS Nüklear Lokalizasyon Segmenti ADPR Adenozin di fosfat riboz DBD DNA Bağlayıcı Etki Alanı AMD Otomodifikasyon Etki Alanı CD Katalitik Etki Alanı NAD Nikotinamid Adenin Dinukleotid H Histon
10 x p53 3-ABA ÜYT WHO NaHCO 3 PSA H 2 O 2 IM EM Tümör Süpresör Proteini 3- Aminobenzamid Üremeye Yardımcı Teknikler Dünya Sağlık Örgütü Sodyum Bikarbonat Prostat Spesifik Antijen Hidrojen Peroksit Işık Mikroskopi Elektron Mikroskopi
11 xi ÖZET c Poli (ADP-riboz) polimerazın infertil insan ejakulat sperminde incelenmesi: sperm anolalileri ile olan ilişkisi. Birdal S 2010, Đstanbul Üniversitesi Sağlık Bilimleri Enstitüsü, Histoloji-Embriyoloji ABD. Yüksek Lisans. Đstanbul. Erkek faktörlü infertilite, infertilite vakalarının yalnızca % 20 lik kesiminden sorumlu olup, diğer % lık dilimini de etkilediği düşünülmektedir. Son 10 yıl içinde erkek infertilitesinin olası sebeplerinden biri olarak ejakulat spermdeki DNA bütünlüğü çalışılmıştır. Enfeksiyon ile ilgili oksidatif stres, kimyasal uyarana maruz kalınması gibi çok sayıda olası sperm DNA hasar sebepleri bulunur. Poli (ADP-riboz)ilasyon (PAR), hücre enerji seviyesinden etkilenen, DNA-hasar bağımlı bir süreç olup, major bir enzim olan poli (ADP-riboz) polimeraz ile kontrol edilmektedir. 18 farklı proteinden oluşan PARP ailesinde PARP-1 en iyi bilinen üyesi olup, DNA da oluşan hasarın keşfi ve onarımında iyi tanımlanmış bir rolü vardır. Aşırı DNA hasarının oluştuğu durumlarda PARP molekülünün 24 ve 89 kda luk parçalara ayrıldığı yapılan araştırmalar ile kanıtlanmıştır. Bu çalışmamızda infertil hastalardan alınan semen örneklerindeki apopitoza giden sperm hücrelerinde, PARP molekülünün bölündüğünü ve infertiliteye yol açan sperm anomalileri ile doğrudan ilişkili olup olmadığını gösterebilmeyi amaçladık. Semen örnekleri infertilite şikayeti ile androloji polikliniğine başvuran 16 hastadan toplanmıştır. Yapılan spermiyogram analizleri sonucunda sperm sayısı ml de 20 milyondan az olan 8 oligoastenoteratopermik hastayı hasta grubu, sperm sayısı ml de 20 milyondan fazla olan 8 hastayı da kontrol grubu olarak tayin ettik. Elektron mikroskopi yöntemi hastaların sperm örneklerinde apopitozun morfolojik değişikliklerini tanımlamak için kullanıldı. Apopitoz tayini için peroksidaz in situ apopitoz tespit kiti ile boyanan örneklerin hasta grubuna ait olanlarında apopitotik hücre oranı yüksek çıkarken (p<0,004), immunositokimya yöntemi ile PARP-1 antikoru uygulanan örneklerden kontrol grubuna ait olanlarda bölünmemiş PARP seviyesi hasta grubuna kıyasla yüksek çıkmıştır (p<0,001). Bu nedenle sınırlı DNA hasarı durumunda, DNA zincir kırıklarını onararak hücreyi koruyan PARP, zararlı etkenlere maruz kalan sperm hücrelerinde parçalara ayrıldığı zaman DNA yı onaramayacak ve hücre apopitoza gidecektir. Bu veriler doğrultusunda, semen örneklerinde sağlıklı sperm populasyonunda azalma görülen bireylerde infertilite vakalarının baş gösterebileceği düşünüldü. Anahtar Kelimeler : Erkek faktörlü infertilite, Sperm, Poli (ADP-riboz) polimeraz, Đmmunohistokimya, Elektron mikroskop Bu çalışma, Đstanbul Üniversitesi Bilimsel Araştırma Projeleri Birimi tarafından desteklenmiştir. Proje No: 4134
12 xii ABSTRACT Determination of c Poly (ADP-ribose) polymerase in infertile ejaculate human sperm: it s relatioship with sperm anomalies. Birdal S 2010, Istanbul University, Institute of Health Science, Histology and Embryology Dept., Istanbul. Male factor infertility is responsible for only 20% of infertility cases and is thought to affect in the other 30 to 40%. One possible cause of male infertility that has been studied in last decade is the integrity of DNA in the nucleus of mature ejaculate spermatozoa. There are many possible cause of sperm DNA damage including oxidative stress associated with infections and chemical exposure. Poly (ADP-ribosyl)ation is a DNA damage dependent process which is affected by cell energy level and its intracellular level is controlled by poly (ADP-ribose) polymerase (PARP). PARP-1 is the best-known member of the PARP family which is comprised of as many as 18 distinct proteins. PARP-1 has a well characterized role in DNA damage detection and repair. Under conditions of extensive DNA damage PARP is cleaved into 89 and 24 kda fragments was confirmed by the researchers. In this study we aimed to show PARP cleavage in sperm samples which are taken from infertile patients and relationship between PARP cleavage and male factor infertility caused by sperm anomalies. Semen samples were collected from patients who were attending andrology clinics because of infertility. According to spermiogram analysis, we detected 8 oligoasthenoretatospermatic males as patient group which have less than 20 million sperm count per ml in their semen samples and 8 male patients as control group which have more than 20 million sperm counts per ml in their semen samples. Electron microscopy was used to identify morphological features of apoptosis in these patient sperm samples.for detection of apoptosis, samples belonged to the group of patients staining with peroxidase in situ apoptosis detection kit, has a high percentage of apoptotic cells (p<0,004), in immunocytochemistry method PARP-1 antibody was applied to semen samples belonging to control group have a high percantage of whole PARP levels when compared to samples belonging to patient group (p<0.001). Therefore in the case of limited DNA damage, PARP protecting cells by repair of DNA strand breaks is cleaved into the fragments when the sperm cells are exposed to the extensive harmful effects. Because of this, sperm cells will undergo to apoptosis. In line with these data we thought that reduction in populations of healthy sperm in the semen samples from individuals can cause male factor infertility. Key Words: Male factor infertility, Sperm, Poly (ADP-ribose) polymerase, Immunohistochemistry, Electron Microscopy The present work was supported by the Research Fund of Istanbul University. Project No. 4134
13 1. GĐRĐŞ VE AMAÇ Erkekte infertilite, bir erkeğin sağlıklı bir kadınla korunmasız cinsel ilişkiye girmesine rağmen 1 yılın sonunda gebeliğin gerçekleşmemesi olarak tanımlanır. Evli çiftlerde yaklaşık olarak %10-15 oranında infertilite görülmektedir (1). Đnfertilitenin yaklaşık %20-50 sinin erkekle ilgili olabileceği bildirilmektedir (2). Erkek infertilitesinin olası nedenleri arasında kaynağı bilinmeyen sorunlar, varikosel, tıbbi müdahalelerin neden olduğu hatalar, kusurlu sperm üretimi ve erektil fonksiyon bozuklukları bulunmaktadır (3), (4). Son on yılda ergin ejakulat sperm nukleusunda DNA bütünlüğü, erkek infertilitesinin olası bir nedeni olarak yoğun şekilde çalışılmıştır (5), (6). Sperm DNA hasarının birçok olası nedenleri arasında tamamlanmamış apopitoz, enfeksiyonlar ile ilgili oksidatif stres, kimyasallara maruz kalma ve sitoplazmik kalıntıların aşırı birikimi ile ilgili spermiyogenez kusurları bulunmaktadır (7), (8). Đntrasitoplazmik sperm enjeksiyonu (ICSI) ile genetik hastalıkların döllere geçmesi söz konusu olduğundan, erkek gametlerin genetik bütünlüğü ile ilgili yapılan araştırmalar üzerine yoğunlaşılmıştır (9). Programlı hücre ölümü olarak tanımlanan apopitoz, hücresel adenozin trifosfatın (ATP) düşük seviyesine, enerji ve proteine bağlı olan süreçtir (10). Đnsan spermi, apopitoz veya apopitoz benzeri koşullara maruz kalabilecek hassasiyettedir (11), (12). Sperm DNA hasarı, tamamlanmamış (abortif) apopitoz nedeni ile, spermiogenez aşamaları esnasında DNA paketlenmesi sırasında veya sonucunda oluşabilir (13), (14). Poli(ADP-riboz)ilasyon, hücrenin enerji düzeyinden etkilenen, DNA hasarına bağımlı bir süreçtir. Poli(ADP-riboz) (PAR) düzeyi, PAR katabolizmasından sorumlu büyük bir enzim olan poli(adp-riboz) glikohidrolaz ve poli(adp-riboz) polimerazın birbirleri ile olan karşıt aktiviteleri aracılığıyla kontrol edilir. Poli(ADP-riboz) metabolizması, biyolojik yapı ve süreçlerin geniş bir alanında önemlidir. DNA onarımı ve genomik bütünlüğün korunması, transkripsiyonel düzenleme, sentromer ve sentrozomal fonksiyon, mitotik iğ oluşumu, telomer dinamiği, endozomal vezikül trafiği, apopitoz ve nekroz biyolojik yapı ve süreçlerin büyük çoğunluğunu oluşturmaktadır (15), (16). Đnsanlarda Poli(ADP-riboz) polimeraz ailesi, 18 farklı proteinden oluşur; PARP-1 en fazla sentezlenen üyesidir (17). PARP -1, poli(adp-riboz)ilasyon sürecinde birincil rol oynar.
14 2 PARP-1 in DNA hasar tespiti ve onarımında iyi belirlenmiş bir rolü vardır. PARP- 1 aracılığıyla protein ribozilasyonu, oksidanlar, alkillenme veya iyonize radyasyon ile indüklenen DNA hasarına hızlı bir yanıt niteliğindedir (18), (19). Poli (ADP-riboz) polimerazın testiküler germ hücrelerinde fonksiyonel bir rol oynadığı belgelenmiştir (20), (21). Germ hücreleri, DNA hasarının onarımı için PARP a ihtiyaç duyar (22). Maymon ve ark. öncü germ hücrelerinde PARP ekspresyonunu saptadılar (23). Çalışmalarının sonucu, tüm spermatogenez süresince PARP ın germ hücre nukleusunda lokalize olduğunu gösterdi. Bu durum, germ hücre farklılaşmasında PARP ın muhtemelen DNA bütünlüğünü korumada önemli bir rolü olduğunu tespit eder (21), (22). PARP ın ergin insan sperminde DNA hasarını onarıp, onaramadığı tam olarak belirlenememiştir. Son zamanlarda PARP ın tüm spermatogenezde farklı homologlarda varlığı bildirildi ve önemli bir role sahip olduğu gösterildi. Bu anlamda Poli(ADP-riboz) polimeraz, olgunlaşma/transfer işlemleri sırasında sperm DNA sını koruyabileceği, ayrıca sperm kromatininin yeniden düzenlenmesinde rol oynayabileceği anlaşıldı (24). Bütün veya bölünmüş PARP varlığı hakkında birbirleri ile çelişen belgelerin varlığı söz konusudur (25), (26). Yakın zamanda PARP-1, PARP-9 ve PARP-2 olarak tanımlanan PARP homologlarının ejakulat insan spermindeki varlığı tespit edildi (27). Sperm DNA hasarı/onarımında PARP proteinleri için bir rol olduğunu düşündüren sperm olgunluğu ile PARP proteinlerinin miktarı arasında pozitif bir korelasyonun varlığı araştırmalar ile kanıtlandı (27). Bu çalışmamızda, infertil hastalardan alınan semen örneklerinde, ışık mikroskopi yöntemiyle, bölünmüş PARP molekülünün sperm anomalileri ile olan ilişkisini gösterebilmeyi, bu amaca destek olarak aynı örneklerin elektron mikroskobu ile ultrastrüktürlerindeki olası değişiklikleri saptamaya çalıştık.
15 3 2. GE EL BĐLGĐLER 2.1. Erkek Üreme Sistemi Üreme sistemleri erkek ve kadında oldukça farklı histolojik yapı gösterselerde embriyolojik olarak aynı kaynaktan köken alırlar (28),(29). Erkek üreme sistemi; (a) haploid erkek gametlerin (sperm) devamlı üretimlerinden, beslenmelerinden ve geçici olarak depolanmalarından; (b) erkek seks hormonlarının (androjenler) sentezi ve sekresyonundan sorumludur. Erkek üreme sistemi; (a) sperm üreten, sentezleyen ve androjenleri salgılayan testislerden; (b) dışarıya sperm taşınmasından sorumlu olan dış kanallar sistemini oluşturan epididim, duktus deferens, ejekülatör kanal ve erkek üretrasının bir parçasından; (c) salgıları semen kitlesini oluşturan ve ejeküle sperme besinler sağlayan aksesuar yapılar olan glandula veziküloza, prostat, ve bulbo üretral bezlerden; (d) erektil doku esaslı çiftleşme organı penisten oluşur (30),(31),(32). Şekil 2-1: Erkek üreme sistemi (43)
16 4 Ana organ olarak kabul edilen testislerde, sürekli üretim ile gamet hücreleri olarak bilinen spermler üretilir. Bu işlem tümüyle spermatogenez olarak adlandırılır. Genital kanallar, spermin olgunlaşması, depolanması ve taşınması ile ilgilidir. Yardımcı bezler, ejakülata katılan karışık salgıları üreten, genital sistemin kanalları boyunca yerleşmiş bezlerdir. Penis ise, erkekte cinsin kopulasyon organı olarak hem ejakülatı vajinaya taşır hem de üretilen idrarın vücuttan atılmasını sağlar. Testislerde üretilen spermler, epididimde depo edilir. Ejakülasyon olduğunda, duktus deferense geçer, glandula vesiküloza, prostat ve bulboüretral bezlerin salgılarını da alarak üretraya geçer ve penisten dışarı atılır. Bu sıvıya ejakülat denir (33) Testis Gelişimi Primordiyal germ hücreleri ilk kez 4 haftalık fetüste vitellüs kesesi duvarının endoderminden ortaya çıkar. 4. ve 6. haftalar arasında, yaklaşık olarak primordiyal germ hücresi ameboid hareketlerle vitellüs kesesinden bağırsak tüpüne, oradan da mezenter boyunca arka vücut duvarının sağ ve sol yanlarına göç eder. Arka vücut duvarında, yaklaşık olarak primordiyal germ hücresi 10. torasik vertebra seviyesinde mezenşim içinde bulunur ve mezonefroz hücreleriyle sölomik örtü epitelinin hücrelerini, bir çift genital kabarıklık oluşturmak üzere, çoğalmak için uyarır. Sölomik epitelyal kordonlar, farklanmamış gonadın dış korteks ve iç medulla bölgelerini oluşturmak için, gonadal kabarıklığın mezenşimi içine doğru büyürler. Fetal gelişimin 7. haftasına kadar, her iki cinsiyet için genel tek bir gonad tipi vardır. Bu gonadal gelişimin farklanmamış dönemidir. Bundan sonra erkekte korteks geriler ve medulla testisi oluşturur. Testisin gelişimi, Y kromozomunun cinsiyet belirleyici bölgesi üzerindeki gen tarafından kodlanan ve testis-belirleyici faktör olarak adlandırılan bir gen ürünü ile kontrol edilir. Fetal testis, tubuli rekti (düz tübüller) aracılığı ile rete testise bağlanan tubuli konkorti seminiferi (kıvrıntılı tohum borucukları) oluşturacak olan kordonlardan meydana gelir. Bu kordonlar, sölomik epitelden köken alan Sertoli hücrelerinden ve primordiyal germ hücrelerinden köken alan spermatogonyumlardan oluşur.
17 5 Seminifer kordonlar, mezonefrik mezenşimden köken alan Leydig hücreleri tarafından birbirinden ayrılmıştır. Fetal Sertoli hücreleri, Müller kanallarının uterovajinal primordiyum şeklinde gelişmesini engelleyen Müllerian inhibe edici madde (MIS) salgılar. MIS yokluğunda, Müller kanalları varlığını sürdürür ve dişi iç genital organları haline gelir. Gebeliğin 8. haftasında fetal Leydig hücreleri testosteron üretir, testosteron salgılanması, fetal hipofiz lüteinize edici hormon (LH) salgılamadığı için, plasental insan koryonik gonadotropin (hcg) tarafından düzenlenir. Wolff kanalının sefalik ucu epididimi, duktus deferensi ve ejakülatör kanalı oluşturur. Duktus deferensin bir çıkıntısı seminal vezikülleri oluşturur. Prostat çift orijine sahiptir: glandüler epitel, prostatik üretra endoderminin dışa doğru büyümesinden gelişir; stroma ve düz kas çevre mezoderminden türer. Pubertede bu hücre kordonları tüpler haline gelir (32), (34).
18 6 Şekil 2-2: Testislerin gelişimi (128)
19 Testis Histolojisi Testisler karın boşluğunun dışında skrotum içinde yer alan bir çift organdır. Testisler etrafı periton ile çevrilmeden karın boşluğunun arka duvarında gelişmeye başlarlar. Gelişimleri sırasında skrotuma inerken peritonun bir kısmını da birlikte sürüklerler. Bu periton kesesi sonrasında tunika vaginalise dönüşerek testisin skrotum içinde hareketli olmasını sağlar. Bu yerleşimleri testislerin vücut ısısından 2 0 C-3 0 C derece düşük bir ısıda olmalarını sağlar. Normal spermatogenez için 34 0 C ila 35 0 C gereklidir (34). Testisler hem spermleri üretir hem de androjenleri üreterek salgıladıkları için bileşik, tübüler, halokrin, iç salgı ve dış salgı bezi olarak kabul edilebilirler. Hipofiz Leydig hücreleri ve Sertoli hücreleri arasındaki sistematik ilişkilerle ayarlanabilen hormonal kontrol düzeneği, testislerin düzenli çalışması için gereklidir. (28),(35). Testisler dıştan kalın, gergin ve bağ dokusundan zengin bir kapsül ile sarılıdır. Bu kılıf tunika albuginea olarak adlandırılır. Kapsül üst kısımda kesintiye ugrar. Burası mediastinum testis ve epididim in yerleştiği yerdir (30). Mediastinumda, tunika albugineadan testisin içine dogru kesintili bağ dokusu bölmeleri uzanır. Bunlarda, septula testis adıyla testisi piramidal bölmelere ayıran interstisyumun elemanlarıdır. Piramidal bölmeler (lobüller) her testiste adet, tabanları testisin kapsülüne, uç kısımlarıda mediastinuma uzanan yapılardır. Testise ilişkin damar ve sinirler septalar aracılığı ile interstisyuma ulaşırlar (30),(31),(36). Testiküler lobüllerin her biri, 1-4 adet, çok kıvrımlı tübül yapısı taşır. Bu tübüller kör bir uçla başlayıp mediastinum testise ulaşırlar. Her seminifer tübül cm uzunluğa ve mm çapa sahiptir. Seminifer tübüller insan testisinin % 66 kadarını oluşturur. Erişkin bir erkekte, her testisin ağırlığı yaklaşık 12 gr ve hacmi ml dir. Boyutları 2.5x3x4.5 cm kadardır (30), (Şekil 2-3).
20 Şekil 2-3: Testis histolojik yapısı (37). 8
21 Peritübüler Doku Seminifer tübüller belirgin bir bazal membran üzerine oturmuşlardır ve aralarında gevşek bağ dokusu bulunur. Bu bağ dokusuna tunika propria veya yaygın olarak peritübüler doku denilmektedir. Bağ dokusu ile desteklenmiş bu doku, seminifer tübülleri, tübüller arası (interstisyel) dokudan ayırır. Tübüller arası dokunun damar ve sinirleri peritübüler dokuyu aşamazlar. Bu nedenle de seminifer tübüller damarsız yapılardır. Peritübüler doku, değişik türlerde farklılık gösterirse de genel düzenlenmesinde hücresiz ve hücreli katlar içerir (30), (38). Hücresiz katlar, kollajen liflerle desteklenmis fibriller ve glikoproteinlerden zengin bir ara madde taşır, kimyasal içeriğinden ötürü PAS (+) reaksiyon verir. Hücreli katta, fibroblast benzeri yassı myoid hücreler vardır. Bu hücreler düz kas hücrelerine ve fibroblastlara benzeyen özellikler gösterir, seminifer epitelin etrafında halkalar oluşturacak şekilde düzenlenmiştir. Sitoplazmasında düz yüzlü endoplazmik retikulum (DER), miyofibril ve miyoflamentlere sıklıkla rastlanır. Bu hücrelerin düzenli kasılmaları, seminifer tübül içinde pasif hareket eden spermatogonyal hücrelerin kanal sistemine doğru hareket etmelerini kolaylaştırır (30),(31). Seminifer tübül enine kesitlerinde bazal membranla sınırlanmış bir sıra epitel hücresi bazalden lümene kadar dizilmiştir. Bu epitele seminifer epitel denir. Seminifer epitel içinde iki temel hücre populasyonu mevcuttur. Bunlardan birisi birçok önemli görevi üstlenmiş destek hücreleri olan Sertoli hücreleri, diğeri ise spermatogenik veya germinal hücrelerin oluşturduğu hücre gruplarıdır. (30),(31). Peritübüler doku, interstisyumdan tübül içine madde geçisini engellemez. Germinal epitelyumun beslenmesi, perfüzyon yolu ile peritübüler dokunun geçirgenligi aracılığında olur (30),(31).(39). Yaşlanmanın doğal sonucu olarak peritübüler doku kalınlığı artar, bu yüzden sperm üretiminde düşüşe ve seminifer tübül hacminde azalmaya neden olur. Daha genç dönemlerde miyoid hücreleride içeren peritübüler dokunun kalınlaşması bazı infertilite olgularının tanımlayıcı özellikleri arasında bulunur (30), (40).
22 10 Şekil 2-4: Testis enine kesitinde intertübüler boşlukta Leydig hücreleleri, seminifer tübüller, seminifer tübül duvarı ve lümeni ( PAS+HL) (32) Sertoli Hücreleri Sertoli ( sustanteküler ) hücreleri puperteye kadar seminifer epitelin dominant hücre tipidir. Puperteden sonra, seminifer tübülleri döşeyen hücrelerin yaklaşık %10 unu oluşturur. Daha ileri yaştaki erkeklerde spermatogenetik hücre populasyon seviyesi düştüğü zaman, Sertoli hücreleri tekrar epitelin ana elemanı haline gelir. Hücre sitoplazmasında çok sayıda mitokondri, lipid damlacıkları ve düz yüzlü endoplazmik retikulum bulunmaktadır. Golgi kompleksi iyi gelişmiştir. Hücre iskeleti elemanları iyi gelişmiş olup, gerek hücreye gerekse gelişmekte olan germ hücrelerine mekanik destek sağlar. Sertoli hücreleri bazal laminadan seminifer tübül lümenine doğru uzanan prizmatik hücrelerdir. Tübüller arası boşluk ve seminifer tübül lümeni arasında köprü hücreler olarak görev yaparlar. Sertoli hücrelerinin apikal ve lateral hücre membranlarının
23 11 düzensiz sınırları vardır, gelişmekte olan spermatogenik hücrelere kriptalar sağlayarak ev sahipliği yaparlar. Bazolateral bölgelerinde Sertoli hücreleri komşu Sertoli hücreleri ile okludens bağlantıları oluştururlar. Bazolateral okludens (sıkı) bağlantıları: (a) seminifer epitelini bir bazal ve bir adluminal kompartmana bölerler; ve (b) gelişmekte olan spermatosit ve spermatidleri otoimmün reaksiyonlardan koruyan kan-testis bariyeri olarak adlandırılan yapıyı oluştururlar. Bunun yanı sıra tutturucu bağlantı, ektoplazmik özelleşme ve tubulobulbar kompleksler Sertoli hücreleri ve Sertoli hücreleri ile germ hücreleri arasında bulunmaktadır. Sertoli hücreleri seminifer epitelin bazale yakın kısmında sıkı bağlantı kompleksleri ile birbirlerine bağlanırlar. Bu bağlantı kompleksleri sayesinde seminifer epitel, zonula okludensin altında kalan dar bazal kompartman ve lümene doğru yer alan geniş adluminal kompartman olmak üzere iki bölüme ayrılır. Kan-testis bariyeri olarak adlandırılan bu bağlantı kompleksi adluminal kompartmandaki spermatogenik hücreleri bazal kompartmandan ve çevre bağ dokusundan ayırır (Şekil 2-5). Spermatogenez puberteden sonra başladığından, yeni gelişen germ hücreleri yüzeylerinde farklı reseptörlere ve farklı sayıda kromozomlara sahip olabilirler, bu yüzden kan-testis bariyerinin sağladığı izolasyon germ hücrelerinin immün sistem tarafından tanınmasını engeller.
24 12 Şekil 2-5: Yan yana Sertoli hücreleri arasındaki tıkayıcı (okludens) bağlantılar kantestis bariyerini oluşturur. Tıkayıcı bağlantılar referans noktasıdır; çünkü Seminifer epiteli bazal ve adluminal olmak üzere iki kompartmana ayırır. Spermatogonyumlar bazal kompartmanda yerleşmiştir, spermatosit ve spermatidler adluminal pozisyonu doldurur. (32)
25 13 Sertoli hücrelerinin görevleri: Gelişmekte olan spermatogenik hücreleri desteklemek, beslemek ve korumak: Spermatogenik hücreler birbirlerinie sitoplazmik köprülerle bağlıdırlar. Bu hücresel ağ Sertoli hücrelerinin sitoplazmik uzantıları ve yüzeylerindeki kriptaları ile fiziksel olarak desteklenir. Çünkü spermatogenik hücreler kriptalar içersine yerleşmişlerdir. Spermatosit, spermatid ve spermler kan-testis bariyeri ile kan dolaşımından izole edildikleri için Sertoli hücrelerinin mekanik desteği de söz konusudur. Fagositoz: Spermiyogenez sonunda spermatidler tarafından atılan hücre sitoplazmasının fazlası (atık cisimler), Sertoli hücreleri tarafından fagosite edildikten sonra lizozomların yardımı ile parçalanırlar. Olgun spermatidlerin spermiasyon sürecinde aktin aracılı kasılmalarla, seminifer tübül lümenine salınımını kolaylaştırmak Sekresyon: Sertoli hücreleri seminifer tübüllere, spermlerin taşınmasında kullanılan protein ve iyonlar bakımından zengin bir sıvı salgılar. Androjen bağlayıcı protein (ABP) adı verilen bu sıvının üretimi follikül stimule edici hormon (FSH) ve testosteron kontrolü altında gerçekleştirilir. Đnhibin ve aktivin alt ünitelerini (α ve β alt üniteleri) salgılamak: Đnhibin (α β heterodimeri) hipotalamustan ve ön hipofizden salınan gonadotropin salgılatıcı faktor (GnRH) ve folikül stimule edici hormon (FSH) üzerine negatif feedback bir etki gösterir. Aktivin (αα veya ββ homodimer) FSH salınımı üzerine pozitif feedback etki gösterir. Anti-Müllerian hormon üretimi: Embriyonel gelişim esnasında erkek fetusta Müller kanallarının gerilemesini sağlayan bir glikoproteindir. Kan-testis bariyerini oluşturmak Sertoli hücreleri puberteden sonra bölünmezler. Enfeksiyon, kötü beslenme, radyasyon ışınlarına maruz kalma gibi olumsuz koşullara karşı oldukça dayanıklı hücrelerdir. Bu zararlı etkilere maruz kalma durumu söz konusu olduğunda spermatogenik hücrelere nazaran sağ kalım oranları çok daha yüksektir. (32), (41).
26 14 Şekil 2-6: Seminifer tübül kesitinde Sertoli hücreleri ve spermatogenik hücreler ile intertisyal alanda Leydig hücreleri görülüyor (42) Leydig Hücreleri Leydig hucre toplulukları intertubuler, alanda kan damarları, lenfatik kanal veya sinuzoidler yakınında yerleşmiştir. Bu nedenle seminifer tübüllerin yakın çevresinde bulunurlar. Diğer birçok endokrin hücrelerin aksine mezenşimal kökenlidir. Olgun leydig hücreleri poligonal şekillidir. Nukleus yuvarlak ve heterokromatinden fakirdir. Bir veya iki nukleolus içerir, çok iyi gelişmiş SER e sahiptir. Çok sayıda tubuler kristalı mitokondri, lipid ve yağ tanecikleri içerir. Sitoplazmasında 20 µm uzunluğunda, 3 µm kalınlığında, proteinden yapılmış reinke kristali denilen yapılar mevcuttur. Hücre yapısı ve kapillerlerle olan ilişkisine bakılınca Leydig hücrelerinin endokrin yapıda olduğu hemen anlaşılmaktadır. Leydig hücreleri Luteinleştirici Hormon (LH) etkisinde olup testosteron salgılar. Serumda bulunan testosteronun yaklaşık % 95 i Leydig hücreleri tarafından sentezlenir. Kalan testosteron ise adrenal korteks tarafından üretilir. Testosteron sekonder erkeklik karakterlerinin gelişmesinden sorumludur. Yetişkinde spermatogenezin devamlılığı için gereklidir. (32), (41).
27 Testisin Damar, Lenfatik ve Sinir Sistemi Testislerin kan dolaşımı böbreklerin kan dolaşımı ile yakın ilişki içindedir, çünkü her iki organın embriyolojik kökenleri aynıdır. Testislerin arterleri (internal spermatik arter) aortadan böbrek arterlerinin çıktığı yerin hemen altından kaynaklanır. Spermatik kordonun içinde ilerleyerek testise ulaşır. Ayrıca eksternal spermatik arter ve duktus deferensi besleyen arterle beslenir. Testiste kapiller endoteli fenestrasyon göstermez (30),(36),(44). Lenfatikler, seminifer tübüllerin peritübüler hücrelerine ve Leydig hücrelerine yaklaşan geniş labirentler oluştururlar. Lenf damarları, septula testisteki ve tunika albugineadaki geniş lenf damarlarına boşalırlar. Buradan da lomber aortik lenf düğümlerine ulaşırlar. Kapillerler, tübüller arası venlere boşalırlar, bunlarda ışınsal venlerle birleşir ve venöz pleksuslara açılırlar. Testiste dönüş, pampiniform pleksusta sonlanır. Venöz kanallardan oluşan bu sistemde, venlerle arterler çok yakın seyreder (45). Sinirler, testiküler arterlere yakın seyreden testiküler pleksusu oluştururlar. Hem sinaptik vazomotor lifler hem de duysal lifler vardır. Testisler basınç ve ağrı hissine karşı hassastırlar (41), (44), (46) Tubuli Rekti Testisin her lobulindeki seminifer tübüller aniden birleşerek bir araya gelir ve tubuli rektileri oluşturur. Bu bölgede epitel de dereceli bir değişiklikle tek katlı alçak prizmatik veya kübik bir görünüm alır. Tubuli rekti boyunca spermatogenetik hücrelere rastlanmaz (30), (47) Rete Testis Tunika albugineanın yapmış olduğu mediastinum testis içinde çok sayıda damarların arasında genişlikleri farklı olabilen ve birbirleri ile bağlantılı ağ şeklinde bir yapı oluşturan kanallar sistemidir. Buradaki epitel tubuli rekti epitelinden organellerce biraz zayıf olmakla birlikte aynı yapıya sahiptir. Bu hücrelerin hemen hepsi apikalde tek bir sile sahiptir. Ayrıca kısa mikrovilluslar görülmektedir. Gelişimi tubuli rektilerin devamı olarak görülür (30), (47).
28 Duktuli Efferentes Mediastinum testisteki rete testis adet kanalla sonlanır. Bu kanallara duktuli efferentes denir. Duktuli efferentesler tunika albugineayı delerek testisten epididime geçer. Bunlar çok kıvrıntılı borucuklar olup bunların hepsi bir arada dıştan bağ dokusu ile sarılarak epididimin başının bir kısmını yaparlar. Yani hepsi tek bir borucuk olan epididime açılırlar. Duktuli efferentes epitelinde 2 tip hücre vardır. Bunlardan birincisi koyu boyanan prizmatik hücrelerdir. Bu hücreler titrek tüylüdür. Tüy hareketi epididime doğrudur. Đkinci tip hücreler kübik hücrelerdir. Bu hücrelerin apikali mikrovillili olup sitoplazmaları granüllüdür. Salgı yapar, rezorbsiyonla ilgilidir. Bazal membranın dışında bağ dokusu ve epididime yaklaştıkça kalınlaşan sirküler kas tabakası mevcuttur. Bazalde intraepitelyal makrofaj ve lenfositler görülür (30), (47) Epididim Testiküler sıvının % 99 u epididimde absorblanır. Epididim üç bölgede incelenir: 1- Kaput epididim (baş) 2- Korpus epididim (gövde) 3- Kauda epididim (kuyruk) Baş ve gövde kısımlarındaki kas hareketleri spontan ve ritmiktir. Kuyruk kısmı sempatik sinirlerle innerve olup ejekulasyon refleksiyle kuvvetli kasılır. Kaputun büyük kısmı duktuli efferenteslerin son kısmı tarafından oluşturulur. Bu bölgeden sonra duktus deferense doğru gittikçe genişleyen bir lümenle birçok kıvrıntılar yaparak ilerler. Epiteli yalancı çok katlıdır ve iki ana hücre tipinden oluşur. Lümenden bazal laminaya uzanan prizmatik esas hücreler. Esas hücrelerin apikal bölümü dallanmış sterosilya ve iyi gelişmiş bir golgi aparatı, lizozomlar ve veziküller sergiler. Bazal lamina ile ilişkili olan piramit şekilli bazal hücreler. Bazal hücreler, esas hücrelerin farklılanmamış öncüleri olarak dikkate alınır (Şekil 2-7).
29 17 Şekil 2-7: Epididimin yalancı çok katlı prizmatik epitel hücrelerinin boyları eşit yükseklikte ve sabit tüylüdür. Boya H+E Büyütme x96 (42) Lümen hafif asidiktir. Kaslar sirküler ve longitudinal olarak dizilir. Kuyrukta longitudinal kaslar ilave olur, gevşek bir bağ dokusu ile sarılır. Kas tabakası epididim kanalı boyunca spermin taşınmasını kolaylaştırmak için peristaltik hareketler gösterir. Lümende spermler depo edilir. Testosteron etkisi altındadırlar. Spermlerin ilk defa hareketlenmesi burada olur (30), (32), (41), (47) Duktus Deferens Epididimin kuyruğundan sonra kanal birden bire kalınlaşarak duktus deferensi oluşturur. 2 mm çapında 40 cm uzunluğundadır. Üç tabakalıdır: 1- Tunika Mukoza 2- T. Muskularis 3- T. Adventisya (eksterna) Tunika mukoza epitel ve lamina propriyadan kuruludur. Epitel psödostratifiye ve stereosilyalıdır. Yer yer lamina propria ile birlikte longitudinal plaklar yapar. Bu nedenle lümen yıldız şeklinde görülür. Elastik liflerce zengindir.
30 18 Tunika muskularis kuvvetli bir kas tabakasıdır. Kaslar longitudinal-sirkülerlongitudinal olarak düzenlenmiştir. Bu kaslar bol miktarda elastik lif içeren bir bağ dokusu içine yerleşmişlerdir. Kas tabakaları bu nedenle kesinlikle birbirinden ayırdedilemezler. Tunika adventisya çok miktarda elastik lif içeren bir tabakadır. Çok sayıda kan damarı ve sinir vardır (Şekil 2-8). Duktus deferens vesika ürinerianın arkasında üreteri çaprazladıktan sonra ampul şeklinde genişler bu bölgeye ampulla duktus deferens denir. Ampullanın yapısı glandula vesikulozaya benzer. Burada lümen geniş olup mukoza yüksek plikalar yapar. Bu plikalardan çıkan yan dallar birbirleriyle bağlanarak hepsi lümenle irtibatlı cepçikler yapar. Burada glandula vesikulozaya bağlı olan bir kesecik durumu oluşmuştur ve boşaltım yollarının salgılarını da taşıyan sıvı ile birlikte spermlerin depolandığı bir yapı ortaya çıkar. Tek katlı prizmatik bir epiteli vardır. Salgı yapar. Spermlerin buradaki depolanma ve bekleme süreleri 6 hafta kadar olabilir (30), (32), (41).
31 Şekil 2-8: Duktus deferens enine kesiti (saydam kamera çizimi). Boya: H+E (42) 19
32 Ejakülatör Kanal 2 cm uzunluğunda 0,5 mm çapında bir kanaldır. Ampulla duktus deferensin devamı olarak prostatın içinde veru montanumda üretra prostatikaya açılan bir çift kanaldır. Mukoza epiteli prizmatiktir. Üretraya açıldığı yerde epitel çok katlı bir durum alır, değişkendir. Lamina propria elastik liflerden zengindir. Lamina propriadan başka tabaka olmayıp civar bağ dokusu ile kaynaşır (47) Yardımcı (aksesuar) Genital Bezler Erkek üreme sisteminin yardımcı bezleri seminal vezikülleri, prostat bezini ve Cowper in bulboüretral bezlerini kapsar. Seminal veziküller ve prostat seminal sıvının çoğunu üretir ve onların fonksiyonu androjenler (testosteron ve DHT) tarafından düzenlenir. Seminal veziküller androjene bağımlı organlardır. Her bir seminal vezikül üç bileşenden oluşur: (1) bir dış bağ dokusu; (2) bir orta, sirküler ve longitudinal düz kas tabakası, ve (3) tek katlı kübikten yalancı çok katlı prizmatiğe doğru değişen bir epitel ile döşenmiş olan, iç tarafta yer alan katlantılı mukoza. Epitel hücreleri, salgı granülleri içeren vezikülleri olan büyük bir golgi aygıtı sergiler. Seminal veziküller fruktozdan zengin visköz bir sıvı salgılar ve insan seminal sıvısının yaklaşık % ine katkı sağlar. Fruktoz ejakülasyonla atılan spermin ana enerji kaynağıdır. Her bir seminal vezikülün boşaltıcı kanalı, ampulla duktus deferens ile birleşir. Ampulla duktus deferensten sonraki kanala ejakülatör kanal adı verilir. Ejakülatör kanal prostat içersinde ilerleyerek prostatik üretraya bağlanır. Prostat en büyük yardımcı genital bezdir. Đçeriklerini uzun boşaltım kanalları aracılığıyla prostatik üretraya boşaltan adet dallanmış tübüloalveolar bezden oluşur. Prostatik bezler üç bölgede düzenlenmiştir: (a) periüretral mukozal bezler, (b) periüretral submukozal bezler, ve (c) esas bezler olarak adlandırılan periferal birleşik bezler. Bezler tek katlı ya da yalancı çok katlı (psödostratifiye) prizmatik epitel ile döşelidir. Lümen, glikoproteinden zengin ve bazen kalsiyum birikme alanı olan prostatik taşlar (corpora amilasea) içerir. Hücreler bol miktarda granüllü endoplazmik retikulum ve golgi aygıtına sahiptir. Salgı ürünleri prostat-özgün asit fosfotaz, prostat-özgün antijen, amilaz ve fibrinolizin içerir.
33 21 Bulboüretral bezler mukus salgılayan bir epitel ile döşelidir. Oldukça bol galaktoz ve ortalama miktarda siyalik asit içeren salgı (sekresyon) penil üretraya boşaltılır. Bu salgı yağlayıcı bir fonksiyona sahiptir ve penil üretra boyunca dışarı çıkan semenin önünde gider (32), (41), (47). 2.2 Germinal Hücreler ve Spermatogenez Germinal hücreler; spermatogonyum, spermatosit, spermatid ve spermlerdir (30),(31),(35). Bunlar primordial germ hücrelerinden köken alan gonositlerden kaynaklanırlar. Hem dişide hem de erkekte ilk primordial germ hücreleri 4. haftada yolk kesesi endodermis duvarında gelişerek gonad taslaklarına doğru yol alır. Gonadların oluşmasını işaret eden ilk belirtiler 5. haftada başlar. Seminifer tübül bazal membranı üzerinde oturan spermatogonyumlar, küçük diploid germ hücreleridir, puberteye kadar bölünmezler (48), (49). Doğumdan önceki dönemde ortaya çıkan germ hücrelerinde üç tür spermatogonyum gelişir. Bunlar çekirdeklerinin açık ve koyu boyanması ile ayırt edilen açık tip A (Ap), koyu tip A (Ad) ve B tipi spermatogonyumlardır. B tipi spermatogonyumlar primer spermatositlerle süreklilik sağlar. Yani tip B spermatogonyumların son mitoz bölünmesinden sonra primer spermatositler ortaya çıkar. Gonositlerden üreyen ilkel spermatogonyumun ileri derecede özelleşmiş sperm haline gelinceye kadar geçirdigi sürece spermatogenez denir (30),(31), (Şekil 2-9). Spermatogenez 3 aşama göz önünde bulundurularak anlatılabilir: a) Spermatogonial (spermatogenez) aşama, spermatogonyumların mitoz ile çoğalmaları, bu mitozlar sonunda oluşan yeni hücrelerdeki değişiklikler ve özellikleri ile bunlardan bazılarının spermatosit I leri oluşturmalarını ifade eder. b) Mayoz bölünme aşaması c) Spermiogenez (spermiohistogenez) aşaması ise mayoz bölünmeyi tamamlamış olan hücrelerin sperm oluşturmak üzere geçirdiği değişiklikleri ifade eder (32).
34 Şekil 2-9: Spermatogenez (43) 22
35 Spermatogonyumlar Spermatogonyumlar, bazal kompartmanda bazal lamina ile direkt ilişkide olan diploid spermatogenetik hücrelerdir. Sertoli hücreleri arasındaki tıkayıcı bağlantıların altında yer alırlar ve bu nedenle kan-testis bariyerinin altında kalırlar (32). Histolojik preparatlardaki testis kesitlerinde 3 tip spermatogonyum ayırt edilir. Histolojik boya özelliklerine göre açık renkte boyananlar Ap (pale), koyu renkte boya alanlar ise Ad (dark) ve B tipi spermatogonyumları oluştururlar. Açık veya soluk A tipi spermatogonyumlar B tiplerinden daha azdır. Oval veya yuvarlak sekilli bu hücreler her zaman bazal lamina üzerine otururlar. Hücre sekline uyum gösteren yuvarlak veya oval çekirdeği ince kromatinlidir. Genelde tek bir nukleolus görülür. A tipi spermatogonyumların sitoplazmasında organeller dağınıktır. Mitokondriler yuvarlak şekillidir ve çekirdek yakınında bulunur. Belirgin golgi kompleksi ve dağınık ribozomlar izlenir. Mitokondriler genellikle 3-5 tanesi bir arada, homojen, RNA dan zengin yoğun bir madde ile yapışmış görülürler. Açık A tipi spermatogonyumlar yedek hücrelerdir. Gerektiğinde spermatogenezi başlatmak için devreye girerler (30),(31),(35). Koyu A tipi spermatogonyumların bir türü de bazal lamina ile bağlantıları daha sıkı olan, uzamış spermatogonyumlar olarak tarif edilmiştir. Bunlar koyu bazofilik boyanan, oval heterokromatik nukleuslara sahip, küçük hücrelerdir (40),(49). Seminifer epitelin kök ya da rezerv hücreleri olarak değerlendirilirler (40),(49),(50). Düzensiz aralıklarla bölünerek, hem yeni koyu tip A spermatogonyumları, hem de açık tip A hücreleri meydana getirirler (40),(48),(49),(50),(51). Sitoplazmik organeller açık tiplerden pek farklı değildir. Spermatogonyumların en çok bulunan tipi B tipi spermatogonyumlardır. Bunlar da bazal lamina üzerine otururlar. Fakat bazal lamina ile bağlantıları daha azdır. Hücrelerin çekirdeği merkezi olarak yerleşmiş ve yuvarlak şekillidir. Çekirdekte bir ya da iki koyu boyanan çekirdekçik bulunur. Sitoplazmada diğer A tiplerine göre daha fazla ribozom bulunur. Oval yerine yuvarlak olan nukleusları dışında açık tip A spermatogonyumlara benzerler (40),(49). Mitozla birkaç kere bölünerek çoğalırlar ve primer spermatositleri oluştururlar (49). Ap tipi spermatogonyunmlar B tipi spermatogonyumları oluşturmak için mitozla bölünmeye devam ederler.
36 24 B tipi spermatogonyumlar son mitotik bölünmelerinden sonra mayoz bölünme safhasına girmek üzere G1, S ve G2 fazlarına girerek büyümeye başlar. Bu sırada yavaş fakat belirgin bir büyüme göstererek çapları 18 mikrona ulaşır ve bazal membrandan ayrılırlar. Bu hücreler artık primer spermatosit adını alırlar. Đlk ortaya çıkan primer spermatositlerin uzun profaz dönemleri olduğundan sayıca artarak bir yığılım gösterirler. Bu hücreler I. mayoz bölünmenin preleptoten, leptoten, zigoten, pakiten ve diploten safhalarını geçirerek sekonder spermatositlere dönüşürler. Bunlar da mitoz bölünmeyi andıran II. mayoz bölünmeyi geçirerek haploid kromozom sayısına sahip olan spermatidleri oluştururlar. Spermatidler herhangi bir bölünme geçirmeden, bir seri değişiklikler geçirerek spermi oluştururlar. Spermatositler ve spermatidler gibi spermlerde ilk aşamada birbirlerine sitoplazmik köprüler aracılığı ile bağlıdırlar. Böylece kardeş hücrelerle gelişim birlikteliğini sürdürmek için fiziksel bir devamlılık sağlanır (30),(52) Spermatositler Başarılı mitotik bölünmeler geçiren tip B spermatogonyumlar, son S fazını (DNA sentezi) tamamladıktan hemen sonra mayoz bölünmenin profaz aşamasına girerler. Spermatogenik hücrelerin yaşam süresindeki esas DNA sentez aktivitesinin bu son turu, mayozun profaz I aşamasına başlayan bir primer spermatositin spermatogonyuma göre iki kat DNA miktarına sahip olacağını belirler. Primer spermatosit 4N DNA miktarına sahiptir. Spermatositler mayoz hücre bölünmesinin her iki aşamasınıda sperm spesifik antikorların oluşmasını önlemek amacıyla, Sertoli hücreleri arasındaki tıkayıcı bağlantıların oluşturduğu kan-testis bariyerinin hemen üzerinde seminifer tübülün adluminal kompartmanında tamamlarlar. Bir diploid (2n) primer spermatosit iki adet sekonder spermatositi (n) oluşturmak üzere mayoz bölünmenin 1. aşamasına (1. mayoz) girer. Sekonder spermatositler çok hızlı bir şekilde interfaz aşaması ve belirgin bir DNA sentezi olmayan (sadece tamir DNA sentezi meydana gelir.) mayozun 2. aşamasına (2. mayoz) girerler. Her bir sekonder spermatosit (n) ikinci mayoz bölünmeyi geçirerek ikişer spermatid (n) meydana getirir. Spermatidler spermiyogenez adı verilen özel değişimler geçirerek sperm haline gelen n kromozom sayılı hücrelere dönüşür.
37 25 Birinci mayoz bölünme aşamasının sonunda primer spermatositin 4N DNA miktarı sekonder spermatositte 2N ye düşer. Đkinci mayoz bölünme aşamasının sonunda 2N DNA miktarı 1N ye düşer. Meydana gelen spermatidler haploid spermatidlerdir. Birinci mayoz bölünme aşaması uzun bir süreç (yaklaşık 24 gün) olduğundan ve ikinci mayoz bölünme aşaması çok kısa (2 saat) olduğundan, sekonder spermatositler seminifer tübüllerde en az gözlemlenen hücrelerdir (32), (47). Tip B spermatogonyumların en son mitotik bölünmesinin ardından, ortaya çıkan yavru hücreler DNA sentezlerler (S fazı), G2 fazına ilerlerler, ve 4N DNA içerikleri ile birinci mayoz bölünmeye başlarlar. Birinci mayoz bölünme aşaması yaklaşık 10 gün süren uzun bir profaz ile karakterizedir. Birinci mayoz bölünmenin profaz evreleri; leptoten (ipliksi), zigoten (eşleşen), pakiten (kalınlaşan), diploten (çift görünen) ve diyakinez (uzaklaşan) evreleridir. Bu evreler 4 temel olay ile karakterizedir: (a)zigoten-pakiten evresinde homolog kromozomların (otozomlar ve seks kromozomları X ve Y) eşleşmesini veya sinapsını kolaylaştıran sinaptonemal kompleks oluşumu; (b) homolog kromozomların eşleşmesi (sinapsis); (c) krossingover ( homolog kromozomların kardeş olmayan kromatidleri arasında genetik bilgi değişimi); (d) ayrılma (eşleşmiş homolog kromozomların ayrılması). Bu uzun profaz evresinden sonra, kardeş kromatid çiftleri metafaz, anafaz ve telofaz evrelerinden geçer ve yavru hücrelere sekonder spermatositlere- paylaştırılırlar. Đkinci mayoz bölünmenin profaz, metafaz, anafaz ve telofaz evrelerinin sonunda kardeş kromatidler yavru hücrelere spermatidlere- paylaştırılırlar. Mayoz bölünmenin 3 önemli sonucu: (a) sperm ve oosit her bir homolog kromozom çiftinin sadece bir temsilcisini içerir. (b) anne ve babadan gelen kromozomlar rastgele dağılırlar. (c) krossing over genetik çeşitliliği arttırır (32), (47) Spermatidler Spermatositlerin ikinci mayoz bölünmelerinden sonra haploid kromozoma sahip spermatidler oluşur. Haploid spermatidler seminifer tübül lümenine yakın adluminal kompartmanda yerleşmişlerdir. Erken dönemde spermatidler nispeten küçük, küresel
38 26 şekilli hücrelerdir. Nukleusları ince kromatinlidir, arada yoğun kromatin yumakları vardır. Nukleus kısa sürede daha da küçülür. Sitoplazmada dağınık olarak yerleşmiş düz endoplazmik retikulum, küçük ve perifere dizili, yuvarlak, kristası belirgin olmayan mitokondriler ve iyi gelişmiş golgi kompleksi görülür. Granüllü endoplazmik retikulum azdır. Hücre zarı altında dizilmiş küçük mitokondriler spermatid sitoplazmasının tanınmasını kolaylaştırır (30),(52). Nukleolus yakınında tipik, kitle halinde kromatin cisimciği görülür. Bu yapı düzensiz, koyu, fibrilli ve granüllü sahalar içerir, ribonükleoproteinden zengindir. Çekirdek ve sitoplazmasında bir seri değişiklikler gösteren spermatidde, birbirini takip eden fazlar izlenir. Spermatid olgunlaşması sırasındaki değişiklikler türlere göre farklılıklar göstersede genel özellikleri ile hemen hemen aynıdır.. Spermatidler Sertoli hücre sitoplazma kriptaları içinde gömülüdürler. Spermatidler spermiyogenez adı verilen oldukça farklılaşmış bir hücresel değişime uğrarlar. Spermiyogenez, spermatogenezin son aşamasıdır. Birbirine sitoplazmik köprülerle bağlı olan spermatidlerin sperm haline gelişini açıklar. Bu değişimler 3 bölgenin oluşumu ile ilgili olarak incelenebilir. Baş ve boyun oluşumu: Sperm başının oluşumu esnasında hem genetik materyale sahip nukleusunda ve hem de fekondasyon (dölleme) için gerekli yapıların oluşması için bazı organellerde, önemli yapısal hareketler ve değişimler görülür. Nukleusdaki değişimler, nukleusun kromatin yoğunlaşması ile hacimce azalmasını ve de başın türe özgü şekil almasını sağlar. Yani gereğinde sperm ile tür tayini bile yapılabilir. Kromatin yoğunlaşması DNA paketlerinin sıkılaşması ile sağlanır. DNA nın paketlenmesi DNA histon komplekslerinde histonların yerine protaminlerin yerleşmesi ile sağlanır. Sonuçta ortaya çıkan nukleusun veya bir anlamda başın şekli sperm hareketini kolaylaştırırken bir yandan da hem fiziksel hasarlara ve hem de mutasyonlara engel olunur. Yoğunlaşmanın, kromatine eşlik eden bazı proteinlerin sertleşmesine sebep olduğu ve yeni protein yapılmasına, DNA-protein komplekslerinin oluşmasına engel olarak, izin vermediği bilinmektedir. Nukleusda protaminlere, histonlara ve sperm özel bazik proteinlere rastlanır. Sperm için gerekli bazı proteinlerin devamlı yapımı ise daha önceden depo edilmiş m-rna lar sayesinde gerçekleşir.
39 27 Akrozom oluşumu; Sperm başının görüntüsünü farklı şekle sokup türe göre farklı görünüm sağlayabilen akrozom, golgi kaynaklı olup, hidrolitik enzimler içerdiğinden lizozom karakterindedir. Đçeriği karbonhidratça zengin akrozin, asitfosfataz ve nöromidaz gibi enzimlere sahiptir. Önce golgi veziküllerinde membranla çevrili proakrozomal granüller oluşur. Daha sonra bu granüller akrozomal vezikül içinde toplanıp birleşerek akrozomal granül adlı tek bir granül haline gelir. Akrozomal vezikül yavaş yavaş nüvenin tepesine yerleşirken, bir yandan yapılmakta olan proakrozomal granüllerin katılımı ile büyür. Akrozom tamamlanıp son şeklini alırken, golgi post nükler bölgeye çekilir. Akrozom oluşurken birbirine dik açılarla konuşlanmış sentriyol çiftleri, birbirinden uzaklaşır ve birisi proksimale diğeri distale, kuyruğun oluşacağı tarafa çekilir. Distal sentriyol hücrenin uzun eksenine paralel yerleşir ve aksonemanın oluşmasına öncülük ettiği gibi boynun bağlayıcı parçasının oluşmasına katkıda bulunur ve tamamen ortadan kalkar. Aksonema uzaması uç kısma devamlı eklenen dimerler sayesinde olur. Bu esnada proksimal sentriyol hafifçe uzayan nüveye yaklaşır ve bazı memelilerde tamamen kaybolur. Akrozom oluşup nukleusun apikaline yerleşirken, nukleus hücre membranına yaklaşır, uzar, yassılaşır ve kromatin yoğunlaşması başlar. Sitoplazma kuyruk tarafına inmeye başlar. Eş zamanlı olarak sitoplazmada görülen mikrotübüller dar ağzı akrozomal takke hizasında olan konik bir manşet oluşturup, sitoplazma ile birlikte özellikle mitokondrilerin kuyruk tarafına inmesine yol gösterir. Orta parçanın oluşması aşamasında mitokondriler spermin orta parçasının sonunu belirleyen annulusa kadar kuyruğun orta parçasına yerleşir. Bu toplanma esnasında birbirleriyle kaynaşarak sayılarını azaltır ve büyürler. Önceleri yuvarlak olan mitokondriler sonradan helezonik bir yerleşim oluşturmak için uzayıp büklümlenirler. Ard arda dizilerek helezon oluşturan mitokondriler bir motor ve pervanesi gibi birlikte çalışan kuyruğun enerji kaynağıdır. Kuyruk yapısı cins ve türe has değişiklikler gösterir. Bütün türlerde ortak olan aksonemadır. Memelilerin spermlerinin kuyruk enine kesitleri gelişmiş dış yoğun fibrillere ve bunları tamamen saran, longitüdinal bir sütuna bağlı fibröz bir kılıfa sahiptir (34), (43).
40 28 Spermiyogenez tamamlanırken gerçekleşen olaylar: Sonuncu spermatid olgunlaşma evresi sırasında mitokondriyonlar gelişen kuyruk boyunca dizilmelerini tamamlar; kuyruk keratin içeren dış yoğun liflerle sarılı bulunan merkezi bir aksonemden (9+2 mikrotubüller) oluşur. Çekirdek uzar ve yoğunlaşır, ve manşet kaudal yönde göç eder. Olgunlaşma işlemi, çekirdek son uzamış, yoğunlaşmış şeklini aldığında, manşet dağılmaya başladığında ve dış yoğun lifler tamamen organize olduğunda tamamlanır. Kuyruk 2 ana parçadan oluşur: (a) mitokondriyonların bulunduğu orta parça; (b) kuyruğun fibröz kılıfla sarılı olduğu esas parça. Bir annulus (son halka), sperm kuyruğunun orta parça - ana parça geçişinin sınırlarını belirler. Olgun spermatidden ayrılan sitoplazma artığı olan artık cisimcik, spermiasyon (seminifer tübül lümenine olgun spermatidlerin salınımı) oluşurken, spermiyogenez sonunda Sertoli hücreleri tarafından fagosite edilir. Somatik histonların arjinin ve lizince zengin protaminlerle yer değiştirmesi olayı, çekirdek yoğunlaşması, spermiyogenezin son basamağını tanımlar. Bu yer değişimi sperm genomik DNA sını stabilize eder ve korur (32) Sperm Sperm, ovumla birleşerek haploid sayıdaki kromozomlarını yine haploid sayıdaki ovum kromozomları ile birleştiren erkek üreme hücresidir. Đnsanda yaklaşık 60 µm uzunluğundadır. Baş, boyun ve kuyruk olmak üzere 3 kısımdan oluşur. Baş : Memelilerin sperm baş özellikleri çok özel farklılıklara rağmen birbirine benzer. Đnsanda 4,3,1 µm ölçülerindedir. Başın ön bölümü nukleustan oluşur. Nukleusun apikal 2/3 sini akrozomdan oluşan baş takkesi kaplar. Geri kalan 1/3 lük bölüme postakrozomal bölge adı verilir. Akrozomun apikal bölgesi şekil olarak türe özgü yapıdadır. Bütün türlerdeki ortak niteliği ovumun çeper yapılarını dokunduğu noktada eriterek erken genetik materyalinin ovum içine geçmesini (fekondensasyon) sağlamaktır. Bu nedenle akrozom içinde çeşitli enzimler bulunur. Akrozomun posteriyör kısmında akrozom membranları birbirine anteriyördeki membranlardan daha yakındırlar ve akrozom yoğunluğu bu bölgede daha fazladır. Bu bölgeye ekvatoryal segment adı verilir. Sperm ovuma gerektiği kadar yaklaştığı zaman akrozomal reaksiyon başlar, akrozomal membran ile plazma membranının vezikülleşerek
41 29 dağılmasına sebep olur. Ortama yayılan enzimler dokunma bölgesinde ovum çeperini eritirken akrozomun ekvatoryal bölge hizasında sperm membranı ile oolemma kaynaşır. Akrozomun ekvatoryal bölgesi karşılıklı iki membranın aralarında oluşan köprüler sayesinde dağılmadan kalır. Ekvatoryal segment sperm ile oosit II nin ilk kontak yeridir. Akrozomun bittiği yerden boyun kısmına kadar olan nuklear bölgeye postakrozomal bölge adı verilir. Bu bölge hizasında hücre membranı yoğun bir plaklaşma gösterir. Başın mekaniksel bir işlevi yoktur. Boyun: Kuyruğun temelini oluşturmanın yanında, baş ile kuyruğun birbirine sıkıca tutunmalarını sağlar. Boyun ana parçasını bağlantı parçası (connecting piece) oluşturur. Bu kısımda baş konkav, bağlantı parçası ise konveks bir konumla birbirine uygun bir yerleşim gösterir. Bağlantı parçası ile baş arasında ince flaman benzeri yapılar vardır. Bu yapılar baş ve boyunun bir anlamda baş ile kuyruğun bağlantısını sağlayarak çok önemli bir görevi üstlenirler. Bağlantı parçasının bağlantı bölgesinin arka bölümü 9 tane segmentleşmiş sütundan oluşmaktadır. Bu sütunlar kuyruğa ait 9 adet dış yoğun fibrilin ön uçlarına tutunur. Bazı memeli türlerinde proksimal sentriol bağlantı parçasında gömülü olarak bulunur. Kuyruk: Yaklaşık 55 µm uzunluğundadır. Üç kısım olarak incelenir. Orta parça 5-9 µm uzunluğunda 1 µm çapındadır. Kuyruğu oluşturan aksonema ve dış yoğun fibrillere ek olarak helezon tarzında dizilmiş büyük mitokondrilere sahiptir (Şekil 2-10).
42 30 Şekil 2-10: Sperm kuyruğu orta parçasında 9+2 mikrotübüler aksonem kuyruğun merkezini kaplar. (32) Esas parça 45 µm uzunluğundadır. Gittikçe incelerek devam eder (Şekil 2-11). Şekil 2-11: Sperm kuyruğunun esas parçası (32)
43 31 içerir. Son parça 5-10 µm uzunluğundadır. Sadece aksonema ve çevre sitoplazmayı Orta parçanın oluşumu oldukça yüksek değişiklikler gösterir. Mitokondrilerin konfigürasyonu türe göre bile değişiklik göstermektedir. Primitif sperm de mitokondriler önce bir küme oluşturacak şekilde bir araya gelir, daha sonra sayıları azalır. Bu olayın mitokondrilerin birleşmesi ile başlıyor olması muhtemeldir. Memelilerde mitokondriler aksonemanın temeline doğru hareket eder ve orada dış yoğun fibrillere temas kurar. Mitokondriler annulusun ardı sıra yerleşmekte ve annulus ilerledikçe aşağıya inmektedir. Annulus orta parçanın posteriorunu belirler. Önceleri yuvarlak bir şekli olan ve ard arda dizilen mitokondriler daha sonra helezonik bir yerleşim oluşturacak şekilde uzun silindirik ve sarılgan bir şekil alırlar. Esas parça spermin en uzun kısmını oluşturur. Spermin kuyruğu çok düzenli bir yapıya sahiptir. Spermin motoru aksonema, yakıt deposu ise mitokondrilerdir. Aksonema başın oluşumu sırasında kuyruğun oluşacağı tarafta uzun eksene paralel, proksimal sentriyole dikey konumda yerleşen distal sentriolün yapımını başlattığı bir organeldir. Aksonema merkezde bir çift mikrotübül ile çevrede 9 çift mikrotübül ve merkez mikrotübüller ile çevre mikrotübüllerin arasında birleştirici konumda radial tarzda yerleşmiş yapılardan oluşmuştur. Mikrotübüller kuyruğun başlangıcından sonuna kadar devam eder. Merkezdeki mikrotubuller tam bir çember şeklinde dizilmiş silindirik 13 adet tubulden yapılmıştır. Çevre mikrotubul çiftlerinin yapısı biraz farklılık göstermektedir. Mikrotübül çiftlerinden birisini oluşturan silindirik tubuller merkezdekiler gibi 13 adet olup enine kesitlerde tam bir çember görünümü oluştururlar. Çiftin ikincisi ise 10 adet tubulden oluşmakta ve açık ağzı O şeklindeki birinci mikrotubulle kapatılacak şekilde ona yaklaşmaktadır. O şeklindeki mikrotubulün diğer tarafında ise dinein kolları bulunur. Mikrotubulleri oluşturan tubuller tubulin proteininden, dinein kolları ise dinein I proteininden yapılır. Bu yapı ATPaz aktivitesine sahiptir, kimyasal enerjinin fiziksel enerjiye dönüşümünü sağlar. Düşünülen komşu çiftler arasındaki kayma hareketi dinein kolları sayesinde yapılmaktadır. Dinein sayesinde ATP nin hidrolizi ile elde edilen enerji kullanılarak komşu çiftlerin kayma hareketi sağlanır. Merkezi mikrotubuller periferik mikrotubullerin hareketine uygun şekilde, radial bağlantılar sayesinde hareket eder. Bu
44 32 sistemik hareket sonuçta kuyruğun pervanemsi hareketine ve spermin yol almasına sebep olur. Aksonema kuyruğun sonuna kadar devam eder. Aksonema 9 adet dışyoğun fibril ile çevrelenir. Bu fibriller kuyruğun ucuna yaklaştıkça incelir, çoğu zaman sona ulaşmadan biter. Görevinin kuyruğa sağlamlık kazandırmak olduğu kabul edilir. Sperm kuyruğunun orta parçasından alınan bir enine kesitte merkezden dışarı doğru izlenebilecek yapılar; Bir adet merkezi mikrotubul çifti, Çevrede radyal bağlarla merkez çifte bağlanmış 9 adet kaynaşık mikrotubul çifti, Mikrotubul çiftlerinin dışında 9 adet dış yoğun fibril, dış kısmında kesitin geçtiği konuma göre görüntü veren (EM de) fibröz kılıf ve dışında hücre membranı olarak sıralanır. Kuyruğun son parçası çok kısa olan ve orijinal yapısı gittikçe kaybolan aksonema ve onu saran hücre membranından ibarettir (34), (43).
45 33 Şekil 2-12: Sperm yapısı: Baş ve kuyruk yapısı. 1) Baş; iki elemandan oluşur (a) nukleus (b) akrozom. 2) Bağlantı parçası; proksimal ve distal sentriyolden oluşur. 3) Orta parça; sperm kuyruğunun baş bölgesinden sarmalımsı mitokondriyal kılıfa kadar uzanır. 4) Annulus (son halka); mitokondri sarmalının son dönümünün altında yoğun bir halkadır, orta parçanın esas parçaya dönüştüğü halkadır. 5) Esas parça; annulustan uzanır. (a) dairesel yerleşmiş fibröz kılıf iskeleti, (b) yedi dış yoğun lif, (c) merkezi aksonemden oluşur. 6) Son parça; plazma membranı ile sarılmış 9+2 mikrotübüler aksonem içerir (32).
46 Erkek Gametlerinde Poli (ADP-riboz) Polimerazın Potansiyel Biyolojik Rolü Erkek fertilitesi, spermatogenezi çeşitli düzeylerde değiştirebilen çeşitli davranışsal, çevresel ve genetik faktörler tarafından etkilenir (53),(54). Erkek germ hücreleri çok çeşitli endojen ve eksojen ajanlara maruz kalır. Endojen ajanlar hücrelerin metabolizma faaliyetleri sırasında oluşturulan reaktif oksijen ve nitrojen türlerini içermektedir (55),(56). Eksojen ajanlar genomik DNA yı hasara uğratabilen çeşitli çevresel faktörler içerir. Bu genotoksik ajanlar DNA tek ve çift iplik kırıkları şeklindeki DNA lezyonlarını ortaya çıkarabilir (57),(58). Đnsan spermindeki DNA hasarı tamamlanmamış apopitoz, anormal kromatin paketlenmesi, reaktif oksijen türlerinin üretimi ve sertoli hücrelerinden erken salınımı ile oluşabilir (59),(60). Spermatogenez sırasında sperm başı içine DNA kompakt hale geldiği zaman oluşan torsiyonal stresin etkisini azaltmak için nukleus içindeki germ hücre DNA sı üzerinde topoizomerazlar tarafından çentik oluşturulur. Spermatogenezin farklı aşamaları sırasında DNA zincir kırıklarının sürekliliği, olgun spermdeki DNA hasarının tespitine katkıda bulunur (61),(62). Spermatidler haploid olarak, hata eğilimli DNA tamir mekanizmaları ile çift zincir DNA kırıklarını onarmak zorundadırlar (63). Erkek üreme hücresi DNA kalitesine olan ilgi son yıllarda artmıştır. Đntra sitoplazmik sperm enjeksiyonu (ICSI) gibi prosedürlerde fertilizasyon için spermin doğal seçilim basamağı atlanır, böylece konjenital anomali olasılığı artmaktadır.. Birçok değerlendirme, sperm DNA bütünlüğünün kökenini, sperm DNA bütünlüğünü ve onun yardımcı üreme tekniklerinin sonucu üzerine olan etkisini analiz eden mevcut teknolojileri ele almıştır (64),(65). Çevre, yaşam tarzı ve mesleki tehlikeler gibi faktörler DNA tamir yollarını, erkek fertilitesini ve sonraki embriyo gelişimini etkileyebilir (66),(67) Poli (ADP-riboz) Polimeraz (PARP) Nüklear bir enzim olan PARP, kimyasallara maruz kalınması ve ışınlama gibi eksojen ajanlar ile birlikte endojen süreçler tarafından oluşturulan DNA lezyonlarını onarmak için birincil tamir mekanizmalarındandır (68),(69). PARP, germ hücrelerindeki DNA hasar tamirindeki rolü de dahil olmak üzere testis germ hücrelerinde iyi tanımlanmış bir role sahiptir (20),(21),(70). Ancak insan ejakulat spermi içinde PARP için benzer bir rol halen araştırılmaktadır. Son 10 yılda erkek infertilitesi ve olgun ejakulat spermi içindeki DNA bütünlüğü arasındaki ilişki artan bir ilgi görmüştür (5), (64), (71),
47 35 (72). Son yıllarda, ICSI ile genetik hastalıkların aktarımı konusunda erkek gametlerin genomik bütünlüğü üzerine odaklanılmış (73),(74) ve onarım yollarına dahil olan proteinlerin testisde eksprese edildiği gösterilmiştir (75). PARP proteinleri zincir kırıklarının tespitine, baz eksizyon onarım yolları ve nükleotid onarım yolları içindeki sinyalizasyona katılmaktadır (76),(77). PARP-1 prototiptir ve PARP ailesinin en çok eksprese edilen üyesidir. PARP ailesi, PARP imzası olarak rol oynayan 50 aminoasit rezidüsünden yapılmış olan korunmuş katalitik bölgesi ile 18 homologdan (PARP 1-18) meydana gelmektedir. Bu bölgede PAR zincirleri başlatılır, uzatılır ve zincirlerin dallanması oluşabilir. PARP, DNA baz ekzisyon tamiri, DNA replikasyonu ve transkripsiyonu gibi bir çok genomik işlemlere dahil olan, aynı zamanda DNA dizi kırıklarına cevap vermek için substrat olarak kullandığı NAD molekülünden poli ( ADP-riboz) u sentezler (78).
48 36 Şekil 2-13: PARP ın yapısal bölgeleri ve ayrılmış olan parçaları A) D A bağlayıcı bölgesi, nukleozom bağlanması ve nüklear lokalizasyon segmenti ( LS) için çinko parmaklar (F1-F3) içerir; otomodifikasyon bölgesi Lizin amino asidi ile bağlanması aracılığıyla ADP riboz (ADPR) polimerlerinin eklenmesinden sorumludur ve katalitik bölge PARP imzası ve PARP enzimatik aktivitesine sahiptir. B) Üzerinde ayrılma bölgesi ile tam boy PARP molekülü. C) Kaspaz tarafından PARP ın parçalara ayrılması (123). PARP enzimlerin katalitik birincil işlevi ADP-riboz gruplarını aspartat ve karboksi-terminal lizin protein rezidülerine transfer etmektir. PARP 200 kadar ADP riboz gruplarının eklenmesi ile doğrusal veya dallanmış şekilde alıcı proteinlerin a.a dizilerini uzatabilirler (70). Çeşitli PARP enzimleri farklı subsellüler lokalizasyon paternlerine sahip olabilirler. PARP 1 ve 2 hücrelerin çekirdeğinde bulunurlar ve nüklear enzimler olarak
49 37 kabul edilirler. Bunun aksine, PARP-3 hem çekirdek hem de sitoplazmada bulunur (16),(79). PARP ailesinin belki de en çok çalışılan üyesi olan PARP-1, insanlarda kromozom 1 üzerinde bulunan ADP-transferaz geni tarafından kodlanan 113 kda luk enzimdir (80),(81). PARP-1 in belirli sinyal yollarına cevap niteliğinde kromatin yapısı ve transkripsiyon süreçlerinin düzenlenmesine dahil olduğu bildirilmiştir (82). PARP-1 in protein yapısı iyi tanımlanmıştır. PARP-1 DNA bağlayıcı etki alanı (DBD), otomodifikasyon etki alanı (AMD) ve katalitik etki alanı (CD) olmak üzere 3 fonksiyonel etki alanından ibarettir. Otomodifikasyon etki alanı, ADP-riboz polimerlerinin PARP-1 in kendisine ilavesinden sorumludur. PARP1 güçlü bir şekilde, DNA onarım işlemleri sırasında doğrudan çift dizi DNA kırıkları ya da dolaylı olarak hasarlı bazların enzimatik ekzisyonu ile oluşturulmuş tek ve çift dizi DNA kırıkları ile ilişkilidir. PARP enzimlerinin substratı olan NAD, ADP-riboz ve nikotinamid oluşumunun bölünmesi ile meydana gelir. Otomodifikasyon bölgesinin C terminus üzerindeki hidrojen bağları üzerinden ADP-riboz monomeri PARP-1 ile bağlanır (17). PARP, ADP-riboz gruplarını çeşitli protein substratlarına eklemektedir (83). PARP enzimleri kromatini yeniden yapılandırmak için nukleozom proteinlerini modifiye eder. Her iki histon H1 ve H2B poli ADP-ribozun alıcılarıdır, en büyüğü H1 dir (84),(85). PARP etkinliği nukleozom proteinleri ile sınırlı değildir; tümör supresör proteini olarak bilinen p53 PARP-1 tarafından değiştirilir. Bu değişiklik transkripsiyonel olarak p53 ü inaktive eder (86). PARP aktivasyonunun düzenlenmesi, bu enzimin tedavi seçeneklerini keşfetmek için önemlidir. Moleküllerin çeşitli tipleri, histonların da dahil olduğu PARP faaliyetinin aktivatörleri olarak tespit edilmiştir. Histonlar arasında H1 ve H2B, PARP1 tarafından değiştirilir, H1 ve H3 karşılıklı olarak PARP1 tarafından etkinleştirilir (87),(88). PARP faaliyeti bir dizi metal iyonları (magnezyum ve kalsiyum gibi) ve poliaminler tarafından etkinleştirilir. Bu arada, kalsiyum iyonları da oksidatif stres ile ilişkili patofizyolojide önemli bir rol oynayabilir ve PARP aktivitesi üzerinde oksidatif stresin etkisini açıklayacak bir bağlantı sağlayabilir (89),(90).
50 38 PARP ın en önemli rolü, özellikle tek dizi kırıklarının çözümünde olduğu gibi DNA tamir kapasitesidir. PARP 1 ve 2 nin baz ekzisyon tamirinde fonksiyonel olduğu gösterilmiştir (91). PARP-1/PARP-2 DNA kırıkları ile aktive olur ve diğer ana DNA tamir proteinleri ve DNA bağlayıcı proteinler ile birlikte hasarlı DNA dizisini tamir etmek için etkileşim içindedir. DNA hasarının erken evresinde sıcaklık şok proteini, PAR oluşumu için ek etkinleştirme sağlayabilir (92). PARP-1 DNA nın kırık dizilerine bağlanır ve kendini otomodifiye eder. Daha sonra ADP-riboz grubundan aldığı negatif yük nedeniyle tek DNA dizisinden ayrılır. DNA dizisinden ayrılan PARP, DNA kırıklarının yeniden birleştirilmesine dahil olan DNA ligaz 3α ile ilişkilidir. Bir hücrenin DNA bütünlüğünü korumak için gerekli enzimleri toplamaya yeteneği olduğundan PARP-1, DNA hasar onarımı için sinyal yolağının önemli bir parçasıdır. PARP-1 i eksik olan hücrelerin baz ekzisyon tamir (BER) aktivitesini inhibe ettikleri gösterilmiştir (93). PARP sadece DNA hasar onarımında sinyal yolağının bir parçası olarak görev yapmaz, onarım sürecinede dahil olur. Özellikle PARP-1 in DNA kırık uçlarına bağlanması, nukleazlar tarafından yıkılmasını engelleyebilir (94).
51 39 Şekil 2-14: D A hasarı sonrası PARP fonksiyonunun şematik temsili. D A hasarını takiben PARP, hem kendisinin hem de komşu nüklear proteinlerin ADPribozilasyonunu katalizler. Bu değişiklik normal, canlı hücrelerde D A hasarı sinyalizasyonuna ve D A onarımına dahil olur (sağda). Apopitoz sırasında PARP kaspazlar tarafından bölünür, D A hasarı ile aktif hale gelemez, apoptotik hücrelerin kendi D A larını onarmalarını engeller (solda) (124). Son zamanlarda ortaya konulan bir model, DNA hasar onarımına PARP ın katılımının feedback mekanizmaları tarafından düzenlendiğini ileri sürmektedir (95). PARP-1 ilk olarak DNA kırık bölgesi için gereklidir ve DNA bağlayıcı etki alanı aracılığıyla bu bölgeye bağlanır. PARP moleküllerinin birikimi daha sonra diğer tamir faktörlerini biraraya toplayan bir sinyal yaratır ve PARP ın pozitif feedback mekanizmasını biçimlendirir. PARP faaliyeti, hücre ölümünü ve aşırı PAR birikimini engelleyen negatif feedback mekanizmasına neden olur (96), (97). Apopitoz, memeli sperminin normal süreçlerinden biridir. Spermatogenezin tüm aşamalarında olgun sperm üretmek ve anormal spermi ortadan kaldırmak için kendiliğinden düzenlenir. Spermatogenez sırasında çok sayıda sperm ölür ve ortadan kalkar. Bu Sertoli hücrelerinin sınırlı sayıda germ hücrelerinin korunmasına ve aşırı
52 40 sayıdaki germ hücrelerinin ortadan kaldırılmasına neden olan yeteneğine bağlı olabilir. Ayrıca apopitozun, geçmişte bazı hücresel kontrol noktalarını devreye sokmayan hücreleri yok etme işlevi olabilir (98). Daha da önemlisi genetik anormalliklerin döllere geçmiş olmasını engellemek için apopitoz gerekli olabilir (99). Germ hücre ölümüne sebep olan etkenlerin ortadan kaldırılmasının erkek fertilitesi açısından önemli etkileri olabilir. Olgun spermatosit ve spermatid sayısının sabit olduğu ve spermatogenezin zayıf olduğu infertil erkeklerde apopitozun artmış olduğu görülür (100). Đnfertilite vakaları ile birlikte görülen apopitoz oranındaki artış, kapsamlı DNA hasarının görüldüğü germ hücrelerinin eliminasyonuna neden olur. Spermiyogenezin bütün safhalarında yetmezlik olan hastalarda görülen DNA hasarındaki bu artış döllenmenin düşük oranda olmasından sorumlu olabilir (101). Ejakulat spermdeki PARP ın tespiti için yapılan araştırmalarda başarılı sonuçlar alınmıştır. Son zamanlarda yapılan çalışmalarda, PARP-1, 2 ve 9 un dahil olduğu çeşitli PARP izoformları ejakulat spermde tespit edilmiştir. Ayrıca PARP varlığı ile sperm olgunluğu arasında direkt bir ilişki görülmüştür. Olgunlaşmamış sperm ile karşılaştırıldığında olgun spermde PARP-1, 2 ve 9 un arttığı görüldü. Fertil erkeklerden alınan ejakulat spermde daha yüksek düzeyde PARP-1, 2 ve 9 un görülmüş olması, infertil erkeklerle karşılaştırıldığı zaman, PARP ve erkek infertilitesi arasında olası bir ilişkiyi gösterir. PARP aktivitesi, spermdeki oksidatif ve kimyasal hasara cevaptaki rolünü belirlemek için modüle edilmiştir. PARP ın inhibitörü olan 3- aminobenzamid ( 3-ABA ) varlığında kimyasal ve oksidatif stresin indüklediği apopitozun yaklaşık olarak 2 kat arttığı rapor edilmiştir. Bundan anlaşılıyor ki PARP, oksidatif ve kimyasal hasara maruz kalan spermin korunmasında önemli bir rol oynamaktadır. (27). Son dönemlerde infertil erkeklerin sperm DNA hasarının etkisi önem kazanmıştır. DNA hasarının yüksek indeksinin bir olasılıkla kötü sperm kalitesine yol açabileceği gösterilmiştir. Bu faktörlerin incelenmesi gibi çalışmaların sonunda elde edilen bilgiler özellikle ejakulat spermdeki genetik bütünlüğün korunmasında yardımcı olacaktır. Sıçan spermatid ve spermatositlerinde yoğun DNA hasarına in vivo reaktif oksijen türleri hasarının ve radyasyonun yol açtığı ve PARP inhibitörlerinin ise DNA hasar onarımında gecikmeye neden olduğu gösterilmiştir (22). Đlgili araştırmacılar hasar veren ajanlardan
53 41 kurtarılan hücrelerin PARP aktivasyonunda 3 kat artış olduğunu göstermeyi başardılar (91),(102). DNA onarımındaki PARP ın rolü ve spermatogenez aşamaları sırasındaki varlığı, ejakulat spermdeki genomik bütünlüğün korunmasına PARP ın dahil olduğunu gösteriyor. Ancak PARP ın varlığı sadece ejakulat sperm örneklerinde gösterilmiştir. Ayrıca Jha ve ark. PARP varlığı ile erkek fertilitesi arasında bir ilişkinin bulunuduğunu ileri sürmüşlerdir (22). Bu çalışmada araştırmacılar infertil erkeklerin sperminde PARP seviyelerindeki azalmaya, düşük kaliteli semen örneklerinde görülen artmış DNA hasarının sebep olabileceğini göstermişlerdir. Germ hücrelerindeki PARP aracılı DNA hasar onarımı erkek fertilitesinde hala keşfedilmemiş bir karışıklıktır. Özellikle üreme tıbbında PARP ın DNA onarımındaki tam rolünü açıklamak için daha fazla çalışmaya ihtiyaç duyulur. (75),(77),(82),(103). Kaspaz ve fosfotidilserin gibi apoptotik göstergelerin tespiti başarılı bir şekilde çeşitli infertilite koşulları ile ilişkilendirilmiştir: Henüz apoptotik marker olarak PARP kullanımı tam olarak araştırılmamıştır. Germ hücreleri biyolojik veya kimyasal gerilim ile karşı karşıya kaldıkları zaman oksidatif stres gibi koşullar ortaya çıkar (104),(105),(106),(107). Oksidatif stres gelişmekte olan sperm ile ilgili proteinlerin modifikasyonuna ve seminifer tübüllerden spermin premature halde salınmasına neden olabilir. Oksidatif stresin en önemli etkisi DNA hasarına neden olmaktır. PARP, oksidatif stresin sonucu olarak hücrede oluşabilen değişikliklerin tümüne yanıt verir. Erkek fertilitesindeki PARP ın rolü, diğer hücresel süreçlerdeki, rolü gibi iyi tanımlanmamıştır. Spermatogenez sırasında testis içinde PARP algılanması gibi yeterli kanıt bulunur, ve ejakulat spermde böyle bir rolün varlığı önerilir (22),(24). Ayrıca, önemli bir DNA tamir enzimi olarak PARP ın rolü sperm genomik bütünlüğünün korunması ile ilgilidir. Benzer şekilde hücre ölüm yolundaki PARP ın rolü, spermatogenez süreci sırasında anormal spermin eliminasyon işlemi içinde önemlidir.
54 Đnfertil Erkeğin Değerlendirilmesi Üremeye yardımcı tekniklerin (ÜYT) uygulanmaya başlanmasıyla, erkek infertilitesinin tedavisinde de yeni bir dönem başlamış oldu. Özellikle 1992 yılında Palermo tarafından ilk kez intrasitoplazmik sperm enjeksiyonu (ICSI) ile başarılı gebelik elde edilmesinin ardından, daha önce tedavi şansı bulunmayan erkeklerin yaklaşık %50'si baba olma şansını elde ettiler (108). Normal sağlıklı bir çiftin bir ay içerisinde gebe kalma şansları %20-25, 6 ay içerisinde %75 ve bir yıl içerisinde ise %90 dır (109). Hem erkek hem de kadın için 24 yaşında fertilizasyon oranları en yüksektir. Fertilizasyon oranları bu yaştan sonra her iki cinstede de düşmeye başlar (110). Đnfertilite olgularının %30-40 ında hem erkek hem de kadın faktörleri birlikte görülürken, yaklaşık %20 si tamamıyla erkek faktöründen kaynaklanır (111). Đnfertil çiftlerde uygulanan yardımcı üreme tekniklerinde özellikle sperm nüklear kalitesi kesin olarak belirlenememektedir. ICSI uygulaması için, toplanan sperm örneklerinin yoğunluk derecelendirmesi, yüzdürme ya da standart yıkama yöntemi ile yıkandıktan sonra sadece mikroskop altındaki görüntüsüne bakılarak normal morfolojiye ve hareketliliğe sahip spermin seçilmesi implantasyon başarısızlığı ve/veya gebelik kayıplarına yol açabilir. ICSI de DNA hasarlı spermin kullanılma olasılığının dikkatli değerlendirilmesi gerekmektedir. Spermdeki bu onarım mekanizmalarının daha iyi anlaşılması ve sağlıklı gebeliklerin oluşumundaki mekanizmaların önemi için tüm yetkiyi elinde tutuyor olabilir. Erkek infertilitesinin genetik nedenleri daha iyi anlaşıldıkça, yardımcı üreme tekniklerine başlamadan önce erkeğin yeterli değerlendirilmesi ve danışmanlık konularının ne derece önemli oldugu da ortaya çıkmıştır. Dünya Sağlık Örgütü (WHO) kriterleri göz önünde bulundurulduğu zaman erkek infertilitesi kendini çoğunlukla oligo-(sayı azlığı), asteno-(hareketlilikte azalma), terato- (normal morfoloji yuzdesinde azalma) spermi olarak gösterir. Sperm hareketliliğinin kaybı ve fertilizasyon kapasitesinin azalması, spermde ROS üretimiyle de ilişkili olabilir. Aşırı ROS üretiminin, oligospermiye ve zayıf sperm fonksiyonuna sebep olduğu yapılan çalışmalar ile gösterilmiştir. Oligospermi, sperm yoğunluğunun 20 milyon/ml'den az olması durumudur. Genelde motilite ve morfoloji bozukluğu da birlikte eşlik eder. Oligozoosperminin ayırt edilebilir en yaygın etyolojisi varikosel olmakla birlikte, diğer semen parametrelerinde de
55 43 sıklıkla anormallik gözlenir. Erkek infertilitesinde gerek medikal gerekse cerrahi pek çok tedavi yöntemi denenmişse de günümüzde en etkin tedavi yöntemi yardımcı üreme tekniklerinin kullanımıdır. (112). Đnfertilite şikayeti ile başvuran erkeğin detaylı hikayesi ve fizik muayenesinden sonra yapılacak basit ve ekonomik ilk test semen analizidir (41) Semen Analizi Semen analizi infertil erkeğin değerlendirilmesinde en önemli yeri tutsada, semen parametrelerinin ölçülmesinin bir fertilite ölçütü olması gerekmediği de bilinmelidir. Semen parametrelerinin kalitesi azaldıkça istatistiksel olarak gebelik şansı da azalır. Buna rağmen doğru şekilde yapılmış bir semen analizi infertil erkeğin değerlendirilmesinde önemli bir araçtır. Sperm üretimi günlük olarak değişebildiğinden, infertilite değerlendirilmesi için en az iki semen analizi yapılmalıdır. Đki örnek arasında geçen zaman en az 7 gün ve en fazla 3 hafta olmalıdır. Đki değerlendirmenin sonuçları birbirinden çok farklı ise üçüncü bir değerlendirme yapılmalıdır (113) Toplanması Örnek toplanmadan önceki cinsel perhiz süresinin sabit tutulması, aynı hastaya ait farklı semen örneklerinin doğru biçimde karşılaştırılmasının yapılabilmesi için önem taşır. Örnek minimum 48 saatlik perhiz sonrası toplanmalıdır. Fakat cinsel perhiz 7 günü geçmemelidir. Örnekler geniş ağızlı, temiz kaplarda toplanmalıdır. Semen örneği muayenenin yapıldığı yerde ya da evde toplanır ve toplama kabı nakil süresince sıcak kalabilmesi için vücutla temas edecek sekilde giysinin içinde muhafaza edilerek tetkikin yapılacağı yere ulaştırılır. Örnekler genelikle masturbasyon ile toplanır. Eğer hasta istemezse, uygun özel kondomlar da kullanılabilir. Lateks kondomlar kullanılmamalıdır. Örnek toplanmasında geri çekme yöntemi alternatif bir yöntem olmakla birlikte, ejakulatın ilk kısmı kaybedilebilecegi ve içine bakteri ya da vajenin asit sekresyonu karışabileceği için ideal değildir. Toplanan örnek ilk bir iki saat içinde incelenmelidir (113).
56 Fiziksel özellikler Taze ejakulat koagulan şeklindedir ve 5 ila 25 dakika arasında likefiye, bazen 60 dakikayı bulur. Semenin likefaksiyonu, prostattan kaynaklanan ve prostat spesifik antijen ile plazminojen aktivatörünü içeren proteazlar tarafından gerçekleşir (41). Normal örnek homojen, gri opak görünüme sahiptir. Sperm konsantrasyonu düşükse daha az opak görülür. Kırmızı kan hücresi varsa kırmızı kahverengi, sarılık ya da vitamin kullanımı varsa sarı görülebilir (113). Beyaz görülmesi ise lökosit varlığını düşündürür. (112) Likefiye örneğin viskositesi koagulasyondan farklı olarak değerlendirilmelidir. Viskoziteyi kontrol için 5 ml geniş ağızlı pipete örnek dikkatlice çekilir ve yerçekiminin etkisi ile damlaması beklenir. Bu sırada damla ile pipet arasında oluşan ince ipliğin uzunluğu gözlenir. Anormal viskozitelerde bu uzunluk 2 cm den daha fazladır (113). Semen ph sı prostat bezinin asit, seminal veziküllerin de alkali salgıları nedeni ile arasında değişmektedir. Semen ph sı, aralığı 6.1 ile 10.0 olan ph kağıları ile ölçülür. Semen ph sının 7 nin altında olması semene idrar karışması veya enfeksiyon olasılığını düşündürmelidir. Yüksek ph aynı zamanda enfeksiyonlarda da görülmektedir (112) Sperm Konsantrasyonunun Hesaplanması Sperm sayısı anlamına da gelen seminal plazmadaki sperm konsantrasyonunun ölçümünde önemli olan noktalar; spermin tam hareketsizliği, örneği seyreltmek için uygun çözeltinin seçimi ve örneğin homojen dağılımının sağlanmasıdır. Sperm konsantrasyonunun ölçümü Makler sayma kamarası veya Neubauer hemositometrik metodu ile yapılır. En iyi metodun Neubauer kamarası olduğu kabul edilmektedir. Neubauer kamarası 25 büyük kamara taşımaktadır. Semenin seyreltilmesi için kullanılan çözelti sodyum bikarbonat (NaHCO 3 ) ve formalin içermelidir. Renklendirici olarak tripan mavisi kullanılabilir (112).
57 Motilite Motilite kuyruk hareketi gösteren sperm yüzdesidir (41). Đdeal olarak ejakulasyondan sonraki ilk 1-2 saat içerisinde ve oda sıcaklığında ( C) bakılabilir C nin altındaki sıcaklıklar sperm motilitesini olumsuz etkileyeceği için oda sıcaklığı sabit tutulmalıdır (112). 200 spermatozoayı degerlendirmek için en az beş mikroskopik alanda sistemik değerlendirme yapılır (113). Genelde faz kontrast mikroskopu alanında görülen spermlerin motilitesi WHO kriterlerine göre hareketleri; (a) Hızlı ileri hareketli, (b) Yavaş ileri hareketli, (c) Yerinde hareketli ve (d) Hareketsiz spermler Şeklinde sınıflandırılır. Genel olarak spermin hızlı ileri hareketli olarak değerlendirilmesi için saniyede 20 µm lik yol kat etmelidir ki bu da spermin 1 saniyede yarı uzunluğu kadar mesafe alması olarak düşünülmelidir (112), (113) Morfoloji WHO kriterlerine göre sperm hücre populasyonu %50 nin üzerinde morfolojik defekt taşımaktadır (113). Normal spermin tanımlanması, postkoital servikal mukustan ya da zona pellusida yüzeyinden alınan spermlerin incelenmesi ile yapılmıştır (115), (116), (117). Eski sistemlere göre sperm normal (oval baş), amorf (irregüler baş), ince sivri baş (tapered), büyük ve küçük baş ile immatür gibi kategorilerden birine girecek şekilde sınıflandırılmaktadır (120). Bu sistemlere göre sınırda formlar normal olarak sınıflandırılır. % 60 ın üzerinde normal formda sperm içeren, immatür formların %3 den az olduğu örnekler de normal olarak tanımlanır. Ancak günümüzde birçok labaratuar normal spermin tanımlanmasını yaparken daha kesin kriterler kullanır. Sınırda formlar anormal olarak kabul edilir (118), (119). Bu kriterleri kullanarak, Kruger ve arkadasları, sperm sayısı 20 milyon/ml nin ve motilitesi %30 un üzerinde olan bir grup erkekte, eğer kesin kriterlere göre normal
58 46 sperm oranı % 14 den az ise IVF ile fertilizasyon oranının %37, %14 ün üzerinde ise %91 olduğunu bulmuştur (118). Takip eden çalışmaların hepsi olmasa da çoğu benzer sonuçlar vermiştir (121). Şekilleri önemli ölçüde farklı olmasa da boyanmış insan spermlerinin başları, orijinal semendeki canlı spermlerin başlarından hafifçe daha küçüktürler. Spermlerin normal morfoloji değerlerini saptarken kesin kriterler kullanılmalıdır (115). Fiksasyon ve boyama etkisinden kaynaklanan hafif azalmayı da hesaba katarak başın boyu µm ve genişligi µm olmalıdır. Başın boyunun, genişliğine oranı 1.5 ile 1.75 arasında olmalıdır (119). Baş bölgesinin %40-70 ini kapsayan iyi tanımlanmış bir akrozomal bölgesi olmalıdır. Orta kısım ince uzun ve genişliği 1 µm dan az, boyu baş uzunluğunun 1.5 katı ve başa aksial olarak bağlanmış olmalıdır. Sitoplazmik artıklar normal baş alanının yarısından az olmalıdır. Kuyruk dümdüz, düzgün biçimli, orta kısımdan ince, kıvrılmamış ve yaklaşık 45 µm uzunlukta olmalıdır. Bu sınıflandırma şemasına göre bütün sınırdaki sperm tipleri anormal kabul edilir (115). Aşağıdaki defekt kategorileri dikkate alınmalıdır: 1. Baş şekli ve büyüklük defektleri: Sınırda baş anomalileri: Bu grup hafif anomaliler olup, spermi belirli bir anomali grubuna sokmaz. Hafifçe uzamış baş, oval şeklin hafif bozulması, armutsu şekil alması hafif amorf olarak isimlendirilir. Şiddetli anomalilar: Büyük baş, küçük baş, uzamış baş (tapering), konik (piriform), vakuollü baş, çift nukleuslu baş, çift baş, nokta baş, yuvarlak baş, amorf, vakuollü veya bütün bu defektlerin bir arada bulunuşu. Akrozom anomalileri: Primer akrozom anomalileri spermatogenez sırasında ortaya çıkmaktadır. Akrozomun sperm başının %40 ından az, %70 inden fazla olduğu durumlarda küçük ve büyük akrozom yapıları ortaya çıkmaktadır. Akrozomun bulunmaması spesifik defekt olarak olarak özellik taşır. ukleus anomalileri: Vakuoller, nukleus kistleri, ekvatoryal bölgede girintiçıkıntılar ( Diadem defekti) 2. Boyun ve orta kısım defektleri: Sırası ile bunlar; bükük boyun (boyun ve kuyruk, başın uzun eksenine 90 dereceden büyük bir açı yapar), orta kısmın başa asimetrik girişi, kalın ve şekilsiz orta kısım, anormal derecede ince orta kısım (mesela hiç
59 47 mitokondrial kılıf yok), sitoplazmik artık taşıması veya bunların herhangi bir kombinasyonu. 3. Kuyruk defektleri: Sırasıyla kısa, birden çok, u-şeklinde kıvrık, kırık veya bükük kuyruklar (> 90 derece). Düzensiz genişlikte kuyruklar, halkalı kuyruklar, veya bunların herhangi bir kombinasyonu. 4. Sitoplazmik artıklar: Normal bir sperm baş alanının 1/3 ünden büyük olanlar. Artıklar genelde orta kısım etrafında bulunur (113). Sitoplazmik damlacık immatürite belirtisidir (112) Đlave semen parametreleri Seminal veziküller androjen bağımlı mekanizma ile fruktoz yaparlar. Normal semen fruktoz konsantrasyonu mg/dl arasında değişir. Sitrat, karnitin, α-glükozidaz, fruktoz, granülosit elastaz, çinko, PSA, glukoz, pepsinojen C, insülin- benzeri büyüme faktörü, bağlayıcı protein-3 ve prostaglandin D sentetaz gibi çok sayıda başka seminal plazma komponentlerinin ölçümleri de yapılmaktadır. Her ne kadar belirli bileşiklerin düzeyleri spermatojenik aktivite ile ilişki gösterebilmekteyse de, bu ölçümlerin günümüzde klinik faydası bulunmamaktadır (119), (122). Semen analiz sonuçlarının yorumlanmasında kullanılan referans değerlerin, yeterli olan minimum seviye şeklinde tanımlanması daha doğru olur. Dünya Saglık Örgütü (WHO) aşağıdaki referans değerleri tanımlamıştır: Volüm: 2 ml ve yukarısı ph: 7.2 ve yukarısı Sperm konsantrasyonu: mililitrede 20 milyon ve üzerinde olması Total sperm sayısı: 40 milyon ve üzeri olması Motilite: %50 ya da daha üzerinde spermin a+b derecesi motilite, %25 ya da fazlasının a derecesi motilite göstermesi Morfoloji: kesin kriterlere göre %15 ya da üzerinin düzgün olması Canlılık: Spermlerin %75, ya da üzerinde canlı olması Lökosit: 1 milyon/ml den az (113).
60 48 3. GEREÇ VE YÖ TEM 3.1. Gereçler Poli-L-Lizin Kaplı Lam (Thermo) Lamel (ISOLAB, Almanya) Lam (ISOLAB, Almanya) Entellan (Merck, Almanya) Anilin mavisi ( Merck, Almanya) Pipet ucu mavi Pipet ucu sarı Pipet ucu beyaz PBS (Phosphate buffered saline) (Santa Cruz) Supra sperm ( Medi Cult, Ref A) DMEM (Dulbecco s Modified Eagle Medium) (Invitrogen, Ref ) Paraformaldehit (Merck, Almanya) Potasyum hidroksit (Merck, Almanya) Sitrat tampon (Lab Vision) Hidrojen peroksit (Merc, Almanya) Metil alkol (Merc, Almanya) Tween 20 (Sigma Aldrich) Normal Goat Serum (Vector, 40512) PARP-1 (Santa Cruz) Biotinylated anti-rabbit IgG (Vector, 40221) PAP pen (Lab Vision) Vectastain ABC Elite kit (Vector Lab) DAB chromogen substrate ( Roche, ) Ethanol ( Merck, Almanya) Toluen ( Merck, Almanya ) ApopTag Peroxidase In situ Apoptosis Detection Kit ( CHEMICON ) Simpo-Mount ( Golden Bridge International Inc. ) Gluteraldehit ( Merck, Almanya ) Osmiyum tetraoksit ( Merck, Almanya ) Propilen oksit ( Merck, Almanya ) Araldit seti ( Fluka, Japonya ) (10951)
61 49 Araldit seti ( Fluka, Japonya ) (10952) Araldit seti ( Fluka, Japonya ) (10953) Cam bıçak ( EMS ) Grid ( EMS ) Uranil asetat ( Merck, Almanya ) Kurşun sitrat ( Merck, Almanya) Mikropipet 1-10 (MediSys) Mikropipet (MediSys) Mikropipet (MediSys) Etüv (Heraeus, Almanya) Ultramikrotom (Reichert, Avusturya) Işık mikroskop (Leica, Almanya) Elektron mikroskop (Jeol, Japonya) 3.2. Yöntemler Bu çalışma, Cerrahpaşa Tıp Fakültesi Histoloji ve Embriyoloji A.D da yürütülmüştür. Çalışmada Cerrahpaşa Tıp Fakültesi Üroloji A.D Androloji Kliniği ne infertilite nedeni ile başvuran 16 hastadan alınan semen örnekleri kullanılmıştır. Yapılan spermiyogram analizleri sonucunda sperm sayısı ml de 20 milyondan az, normal morfolojisi <%9, hareketlilik <%50 ve ileri hareketlilik <%20 olan 8 oligoastenoteratospermik hasta grubu, sperm sayısı ml de 20 milyondan fazla, hareketliliği>%50, ileri hareketliliği >%25 ve normal morfolojili sperm >%9 olan 8 hastayı da normospermik grup olarak tayin ettik. Çalışma için Đstanbul Üniversitesi Đnsan Etik Kurulu onayı alınmıştır ve bütün çalışmalar Etik Kurul Yönetmeliği esaslarına uygun olarak gerçekleştirilmiştir.
62 Semen Örneklerinin Alınması Semen örnekleri hastalardan en az 2 en fazla 7 günlük cinsel perhiz sonrası masturbason yolu ile toplandı ve spermiyogram değerlendirmesi Kruger Kesin Kriterleri referans alınarak, faz kontrast mikroskopu aracılığı ile yapılmıştır. Deneklere ait sperm kriterleri Tablo-3.1 de gösterilmektedir. sya SPERM SAYISI SPERM MORFOLOJİ SPERM HAREKETLİLİĞİ KONTROL 32,25±1,36 64,38±11,28 %26±1,9 %57±4 OLIGOASTENOTERATOSPERMi 33,63±1,77 12,88±1,84 %6,4±0,6 %22±5 P DEĞERİ p>0,05 p<0,001 p<0,001 p<0,001 Tablo 3.1. Çalışmada kullanılan deneklere ait özellikler Örneklerin Hazırlanması ve Takip Yöntemi Çalışmamızda alınan örneklerin değerlendirilmesinde 4 farklı yöntem kullanılmıştır. Işık mikroskopu için asidik anilin mavisi boyası kullanılmıştır. Bu boyama yöntemi ile sperm hücrelerine genel bakış sağlamak ve genetik anormalliklerden dolayı hücre nukleusundaki boyanma farklılıklarını göstermek istenmiştir. Đmmunositokimya yöntemi ile sperm nukleusu içersindeki PARP molekül seviyesinin artıp artmadığı gözlenmiştir. ApopTag Peroxidase In situ Apoptosis Detection Kit (Roche) yöntemi kullanılarak apopitotik ve sağlıklı hücre ayrımı yapılmıştır. Son yöntem olan elektron mikroskopi yöntemi ile de hücre ince yapısını, varsa apopitoza giden hücrelerdeki değişiklikleri göstermek amaçlanmıştır. Alınan semen örneklerinin likefiye olması için ortalama 30 dakika (15-60 dakika) 37 0 C lik inkübatör içinde bekletilmiştir. Likefiye olan semen örneğinden mikropipetle çekilen 10 µl ejakulat Makler sayım kamarasına damlatılarak faz kontrast mikroskobu altında spermiyogramı yapılmıştır.
63 51 Semen örneklerinin yıkanmasında yoğunluk derecelendirmesi uygulanmıştır. %80 oranında Suprasperm ve %20 oranında sperm yıkama medyumu eklenen semen örnekleri 2000 rpm de 15 dakika santrifüjlenerek birinci yıkaması yapıldı ve üstte kalan süpernatan atıldı. Pellet üzerine 1/1 oranında sperm yıkama medyumu konularak 15 dakika 1600 rpm de santrifüj edildi. Süpernatan atıldıktan sonra üzerine üzerine 1/1 oranında sperm yıkama mediumu konularak % 5 lik CO 2 içeren etüv içinde 1 saat bekletildi. % 5 lik CO 2 içeren etüvde yüzmeye bırakılan örneklerin üzerinden mikropipetle 10 µl çekilerek lam üzerine damlatıldı. Bir lamel aracılığıyla 45 0 lik açı ile lam üzerine yayma yapıldı. Her bir hastaya ait örnekten 3 er adet yayma preparat hazırlandı. Lamlar 20 dakika havada kurumaya bırakıldı. Daha önce hazırlanmış olan % 4 lük paraformaldehit solüsyonunda dakika fikse edildi. Fiksasyon sonrası lamlar PBS (phosphate buffered saline)e alınarak buzdolabında de boyanmak üzere saklandı Anilin Mavisi Boyama Yöntemi 100 ml lik distile suya 5 gr asidik anilin mavisi karıştırılarak hazırlanan boya ile yayma preparatlar boyanmıştır. Kromozomal yoğunlaşmanın yeterince görülmediği preparatlarda histon/protamin değişimindeki anormallikten ötürü histonlar pozitif reaksiyon vererek sperm nukleusları koyu mavi olarak boyandı Elektron Mikroskopi Yöntemi Yukarıda tarif edildiği gibi yıkanan sperm örneklerinden elde edilen pelletler PBS ile seyreltilmiş olan %1 lik gluteraldehite alınarak 1000 rpm de 5 dakika santrifüj edildi. Dibe çöktürülen pelletlerin üzerindeki glutaraldehit enjektörle çekilerek yerine % 4 lük glutaraldehit konuldu ve 4 saat buzdolabında C de bekletildi. Bu 4 saatin sonunda glutaraldehitten arındırılan pelletler PBS e alınarak gece boyunca C de bekletildi. Gece boyunca PBS de bekletilen örnekler, üzerlerindeki PBS uzaklaştırıldıktan sonra 10 cc PBS içine 100 mg osmiyum tetraoksit karıştırılması ile oluşturulan osmiyum tetraoksit fiksatifi ile 1 saat bekletildi. 1 saatin sonunda kararan pelletlerden osmiyum tetraoksit dökülmeden önce 1600 rpm de 10 dakika santrifüj edildi. Sonrasında osmiyum tetraoksitten arındırılan pellet örneklerine yeterli miktarda PBS konulduktan sonra 1500 rpm de 10 dakika santrifüj edildi. PBS de totalde 15 dakika bekletildi. PBS aşaması sonrasında örneklerdeki suyun giderilmesi için başta % 70 alkol olmak üzere sırasıyla % 80, % 90, % 96 alkollerde 10 ar dakika bekletildi. Alkol serilerinden geçirilirken toplamda bekletildikleri 10 ar dakikanın ikişer dakikasında tüm örnekler 1500 rpm de
64 52 santrifüj edilmiştir. % 100 alkolde 2 kere 10 ar dakika bekletilerek örnekler içindeki su tamamen giderildi. Sonrasında saf propilen oksit içinde 2 defa olmak üzere 10 ar dakika bekletildi. Son propilende 10 dakika bekletildikten sonra 3:1 oranında hazırlanan propilen oksit/araldit karışımında 1 saat bekletildi. Daha sonra sırasıyla 2:1 oranında propilen oksit/araldit ve 1:1 oranında propilen oksit/aralsit karışımlarında 1 er saat tutuldu. Propilen oksit/araldit karışımlarında 1 er saat bekletildikten sonra saf araldite alınan örnekler aralditin polimerizasyonu için 24 saat süresince 45 0 C lik etüvde, 2 gün boyunca da 60 0 C lik etüvde bekletildi. Polimerizasyon aşamasını tamamlayan örnekler kesime hazırdır. Bloklar bir jilet aracılığı ile trimlenmiş ve Zeiss UM3 ultramikrotomu ile özel cam bıçaklar kullanılarak 500 Å kalınlığında ince kesitler alınmıştır. Su dolu havuzda toplanan kesitler önceden temizlenmiş 200 meshlik gridlere alınmış ve kurumaya bırakılmıştır. Gridler ile toplanan parçalar, 80 ml metil alkol içinde 2 gr uranil asetat eritilerek hazırlanan uranil asetat çözeltisi içersinde 45 dakika karanlık ortamda bekletilerek boyandı. Sonraki aşamada gridler % 50 alkol ve 2 kere de distile suda kısaca çalkalandı. Gridlerin kontrastlama işleminin tamamlanabilmesi için hazırlanan kurşun sitrat çözeltisinde 5 dakika boyandıktan sonra 2 şer kez distile suda çalkalandı ve havada kurutulmaya bırakıldı. JEOL JEM-1011 model elektron mikroskobunda incelenen kesitlerin SIS Systems dijital kamera ile fotoğrafları çekildi Đmmunositokimya Yöntemi Đmmunositokimya boyanacak olan preparatlar de bekletildikleri buzdolabından çıkarılarak oda sıcaklığına gelmesi beklendi. Sperm hücrelerinin fiksasyon aşamaları sırasında kaybettiği antijenik yapıyı kazanması için yayma preparatlar, piyasada 1:10 oranında sulandırılacak şekilde kullanıma hazır olarak bulunan sitrat tampon çözeltisinin 10 ml sine 90 ml distile su ilave edilerek hazırlanan sitrat tamponu içine alındı. Sitrat tampon içindeki preparatlar mikrodalga fırında kaynayıncaya kadar ısıtıldı. Kaynadıktan sonra fırın kapatılarak 5 dakika beklendi. Kaynatma ve ardından 5 dakika bekleme işlemi 3 kez tekrarlandı. 3. kaynatmadan sonra oda sıcaklığına getirilen preparatlar PBS de 3 defa 5 er dakika yıkandı. Preparatlar, hücrelerin hedef bölgeleri dışındaki zemin boyanmasının engellenmesi için 12 ml %30 H 2 O 2, 54 ml metanol ve 54 ml distile su ile hazırlanan % 3 lük H 2 O 2 çözeltisi içinde 15 dakika inkübasyona bırakıldı. Sonrasında PBS ile 3 kere 5 er dakika yıkama yapıldı. PBS ile
65 53 yıkamanın son aşamasından sonra lamların etrafı hidrofobik kalem (PAPpen) ile çizilerek sonrasında uygulanacak olan antikor ve serumların hedef bölgenin dışına taşması engellenmiş oldu. Hücrelerdeki antikorların bağlanması için bloklama serumu uygulandı. 1:1000 oranında tween-20/pbs ile hazırlanan T-PBS in 950 µl sine 50 µl Normal Goat Serum eklenerek % 5 lik bloklama serumu hazırlandı. Yayma preparatların üzerine bloklama serumu damlatılarak 30 dakika inkubasyona bırakıldı. Đnkubasyonun sonunda PBS ile yıkanan preparatlara, 1:50 oranında Poli (ADP-riboz) polimeraz / PBS ile hazırlanan birincil antikor damlatılarak gece boyunca buzdolabında C de inkubasyona bırakıldı. Ertesi gün PBS ile arındırılan preparatlar 3 kez 5 er dakika PBS ile yıkandı µl PBS içine 3 µl konularak sulandırılan Biotinylated goat anti-rabbit IgG sekonder antikorun damlatıldığı preparatlar oda sıcaklığında 30 dakika bekletildi. Đnkubasyonun 15. dakikasında standart prosedürüne uygun olarak hazırlanan ABC solusyonu, buzdolabında de yarım saat olgunlaşmaya bırakıldı. 30 dakikalık sekonder antikor uygulamasından sonra preparatlar 3 kez 5 er dakika PBS ile yıkandı. Sonrasında T-PBS solusyonuna alınan preparatlara olgunlaşması tamamlanmış olan ABC solusyonu damlatılarak 30 dakika boyunca oda sıcaklığında inkube edildi. Süre sonunda 3 kez 5 er dakika PBS ile yıkanan örnekler üzerine DAB boya kiti tarafından sağlanan kromojen damlatılarak boyama reaksiyonu başlatılmış oldu. Mikroskop altında yapılan boyama işleminde optimum boyanma süresi 2 dakika olarak tespit edildi. Kromojen çözeltisi PBS ile yıkanarak reaksiyon sona erdirildi. PBS e alınan preparatlar sırasıyla % 70, % 80, % 90 ve % 100 alkollerde 5 er dakika tutulduktan sonra, 10 ar dakika olmak üzere 3 kez toluolden geçirildi. Ardından kullanılan immunositokimya ürünlerini destekleyen su bazlı SimpoMount kapatma solusyonu ile preparatlar kapatıldı. Đmmün boyamaların yoğunluğu HSCORE analizi kullanılarak yarı nicel bir şekilde çözümlendi. Đmmün boyanma yoğunluğu kategorilere ayrıldı: 0 (boyanma yok), 1 (zayıf), 2 (orta dereceli boyanma) ve 3 (yoğun boyanma). Her örnekten, HSCORE = Σi i*pi (i, yoğunluk derecesini; Pi de hücrelerin yüzdesini ifade etmektedir) olacak şekilde bir HSCORE değeri elde edildi. Her slayt için 200 mikroskobik büyütmede 5 farklı alan incelendi. HSCORE incelemesi bağımsız iki araştırıcı tarafından yapıldı ve ortalama değer alınarak kullanıldı.
66 Apopitoz Tayini Apopitotik hücrelerin tesbiti için deney ve kontrol gruplarından alınan örnekler ApopTag Peroxidase In situ Apoptosis Detection Kit i kullanılarak boyandı. Daha önceden hazırlamış olduğumuz yayma preparatlar 2 kere 5 er dakika PBS ile yıkandı. Yıkama sırasında hazırlamış olduğumuz 20 0 C de bekleterek soğuttuğumuz 2:1 oranında etanol/asetik asit karışımı içine alınan preparatlar tekrar 5 dakika boyunca 20 0 C de bekletildi. Sonrasında tekrar 2 kere 5 er dakika PBS de yıkandı. PBS ile yıkama sonrasında 15 ml H 2 O ml d H 2 O ile hazırlanan % 3 lük H 2 O 2 solusyonuna alınan preparatlar oda sıcaklığında 5 dakika bekletildi. 5 dakikanın sonunda 2 kez 5 er dakikalık PBS yıkaması tekrarlandı. Slaytlarda yaymanın yapıldığı bölge hidrofobik kalemle çizilerek etrafı iyice kurulandı ve kit içindeki talimatlara uygun olarak hazırlanan equilibration tamponu damlatıldı, 20 saniye bekletildikten sonra fazla tampon silkelenerek uzaklaştırıldı. Daha sonra kit içinde bulunan reaksiyon tamponunu ile seyreltilen TdT enzimi her bir slayta damlatılarak 1 saat boyunca 37 0 C lik etüvde bekletildi. Etüvden çıkarılan parçalar, 102 ml d H 2 O ya 3 ml Stop Wash tamponu damlatılarak hazırlanan solusyonda preparatlar önce 15 saniye çalkalandı, sonra 10 dakika oda sıcaklığında inkübe edildi. Đnkübasyon sonrası 3 kere 1 er dakika PBS ile yıkaması yapıldı. Yıkama sonrasında peroksidaz bağımlı anti-digoksigenin antikoru yıkama banyosuna yerleştirilmiş olan slaytlara damlatılarak 30 dakika boyunca oda sıcaklığında inkübe edildi. Antikorla inkübasyon aşamasından sonra PBS ile 3 kere 1 er dakika yıkanan slaytlar için boyama aşamasına geçildi. Boyama işlemi için DAB kromojen kiti kullanıldı. Üretici firmanın talimatı ile 1:10 oranında seyreltilen DAB kromojeni her bir slayta damlatılarak mikroskop altında reaksiyon verme süresi takip edildi. Boyama işleminin son aşaması olarak her preparata, 0,5 gr metilen yeşilinin 100 ml 0.1 M sodyum asetat içinde çözündürülmesi ile hazırlanan metilen yeşili boyası damlatılarak zıt boyama yapıldı. Sonrasında dh 2 O ile çalkalanan preparatlar havada kurumaya bırakıldı. Tamamen kuruyan preparatlar entellan (Merck) kapatma solusyonu ile kapatılarak mikroskop altında incelendi. Đncelenen preparatlarda apopitotik hücreler ve apopitotik olmayan hücrelerin sayısı belirlendi. Her slayt için apopitotik hücrelerin tüm hücrelere oranı hesaplanarak Apopitotik Đndeks belirlendi.
67 55 Đstatistiksel Analiz Normospermik ve oligoastenoteratospermik gruplar arasındaki istatistiksel fark Student s t-test kullanılarak yapıldı ve p<0.05 istatistiksel olarak anlamlı olarak kabul edildi.
68 56 4. BULGULAR 4.1. Anilin Mavisi Boyanması Sperm morfolojisinin ve kromatin yoğunlaşmasının incelenmesi için Anilin mavisi boyaması yapıldı. Buna göre oligoastenoteratospermik örneklerde normospermik örneklere göre istatistiksel olarak anlamlı derecede yoğun anilin mavisi boyanması gözlendi (p<0.05) (Şekil 4-1). Şekil 4.1. Anilin Mavisi boyaması. a) Normospermik grup b) Oligoastenoteratospermik grup Elektron Mikroskopi Bulguları Bu çalışmada elektron mikroskopik yöntemler kullanarak apopitozun morfolojik değişikliklerini göstermeyi amaçladık. Işık mikroskopu ile tam olarak görülemeyen kromozomal anormallikler ve apopitotik vakuol oluşumları elektron mikroskopi yöntemi ile kolayca görülmüştür.
69 57 Resim 4-2: Kromatin kondensasyonu normal olan sağlıklı sperm (*) ile kromatin yoğunlaşmasının görüldüğü apopitotik (Ap) sperm (x12 000). Resim 4-3: uklear kromatin yoğunlaşması (*) ve vakuollerin (V) görüldüğü apopitotik spermler (x12 000).
70 58 Resim 4-4: üklear kromatinde yoğunlaşma ve vakuol oluşumu ile kendini gösteren apopitotik sperm (x20 000). Resim 4-5: ormal (*) ve apopitotik (Ap) sperm (x12 000).
71 59 Resim 4-6: Hem nüklear kromatinde vakuol oluşumunun (V) hem de kromozomal yoğunlaşmanın görüldüğü apopitotik bir sperm hücresi (x30 000). Elektron mikroskopisi ile sitolojik detaylar, anilin mavisi ile boyamanın yapıldığı ışık mikroskopi yöntemine kıyasla daha iyi incelenebilmektedir. Normospermik gruptan alınan örneklerde normal morfolojiye sahip spermler de görülebilirken (Resim 4-2), (Resim 4-5), oligoasthenoteratospermik grubundan alınan örneklerde çoğunlukla nukleer kromozomda yoğunlaşma ve vakuol oluşumu gibi apopitotik özellikler sergileyen sperm hücreleri (Resim 4-3), (Resim 4-4), (Resim 4-6) görülmektedir.
72 Đmmunositokimya Bulguları Kullanmış olduğumuz PARP-1 antikoru, hücrelerde sınırlı DNA hasarı durumunda faaliyete geçen bütün PARP-1 (113 kda) molekülünü tanımaktadır. Bu nedenle azalmış PARP-1 ekspresyonu hücre hasarını düşündürmektedir. Oligoasthenoteratospermik gruptaki örneklerde PARP-1 immün boyanma yoğunluğu, normospermik gruptakilere kıyasla istatistiksel olarak anlamlı şekilde azalmıştır (p<0.001) (Resim 4-7). Resim 4-7. PARP-1 immün boyanması a- Normospermik grupta yoğun PARP-1 ekspresyonu. b- Oligoasthenoteratospermik grup. c- Negatif kontrol. d- * vs. Kontrol, p<0.001.
73 Apopitoz Tayini Bulguları ApopTag Peroxidase In situ Apoptosis Detection Kit (Roche) kullanılarak üreticinin protokolüne uyularak yapılan apopitoz tayininde oligoasthenoteratospermik örneklerde apopitotik indeksin normospermik örneklere göre istatistiksel açıdan anlamlı derecede artmış olduğunu gözlemledik (p<0.004) (Resim 4-8). Resim 4-8. Apopitotik indeks tayini. a- Normospermik grup b- Oligoasthenoteratospermik grupta apopitotik spermler yoğun olarak görülmektedir. c- Negatif kontrol d- * vs. Oligoasthenoteratospermi, p<0.004.
Şekil 1. Mitoz bölünmenin profaz evresi.
 KONU 9. HÜCRE BÖLÜNMESİ MİTOZ BÖLÜNME Mitoz bölünme tek hücreli canlılardan, çok hücreli canlılara ve insana kadar birçok canlı grubu tarafından gerçekleştirilebilir. Mitoz bölünme sonunda bölünen hücrelerden
KONU 9. HÜCRE BÖLÜNMESİ MİTOZ BÖLÜNME Mitoz bölünme tek hücreli canlılardan, çok hücreli canlılara ve insana kadar birçok canlı grubu tarafından gerçekleştirilebilir. Mitoz bölünme sonunda bölünen hücrelerden
EŞEY ORGANLARI VE EŞEY HÜCRELERİNİN OLUŞUMU
 ERKEK ÜREME SİSTEMİ EŞEY ORGANLARI VE EŞEY HÜCRELERİNİN OLUŞUMU ERKEK ÜREME SİSTEMİ Başlıca dört ana yapıdan oluşur; Testisler Genital kanallar Yardımcı bezler Penis TESTİSLER Testisler, hormon ve eşey
ERKEK ÜREME SİSTEMİ EŞEY ORGANLARI VE EŞEY HÜCRELERİNİN OLUŞUMU ERKEK ÜREME SİSTEMİ Başlıca dört ana yapıdan oluşur; Testisler Genital kanallar Yardımcı bezler Penis TESTİSLER Testisler, hormon ve eşey
Hücre. 1 µm = 0,001 mm (1000 µm = 1 mm)!
 HÜCRE FİZYOLOJİSİ Hücre Hücre: Tüm canlıların en küçük yapısal ve fonksiyonel ünitesi İnsan vücudunda trilyonlarca hücre bulunur Fare, insan veya filin hücreleri yaklaşık aynı büyüklükte Vücudun büyüklüğü
HÜCRE FİZYOLOJİSİ Hücre Hücre: Tüm canlıların en küçük yapısal ve fonksiyonel ünitesi İnsan vücudunda trilyonlarca hücre bulunur Fare, insan veya filin hücreleri yaklaşık aynı büyüklükte Vücudun büyüklüğü
HAYVANSAL HÜCRELER VE İŞLEVLERİ. YRD. DOÇ. DR. ASLI SADE MEMİŞOĞLU RESİM İŞ ZEMİN KAT ODA: 111
 HAYVANSAL HÜCRELER VE İŞLEVLERİ YRD. DOÇ. DR. ASLI SADE MEMİŞOĞLU RESİM İŞ ZEMİN KAT ODA: 111 asli.memisoglu@deu.edu.tr KONULAR HAYVAN HÜCRESİ HAYVAN, BİTKİ, MANTAR, BAKTERİ HÜCRE FARKLARI HÜCRE ORGANELLERİ
HAYVANSAL HÜCRELER VE İŞLEVLERİ YRD. DOÇ. DR. ASLI SADE MEMİŞOĞLU RESİM İŞ ZEMİN KAT ODA: 111 asli.memisoglu@deu.edu.tr KONULAR HAYVAN HÜCRESİ HAYVAN, BİTKİ, MANTAR, BAKTERİ HÜCRE FARKLARI HÜCRE ORGANELLERİ
Hücre Nükleusu, Nükleus Membranı, Nükleus Porları. Doç. Dr. Ahmet Özaydın
 Hücre Nükleusu, Nükleus Membranı, Nükleus Porları Doç. Dr. Ahmet Özaydın Nükleus (çekirdek) ökaryotlar ile prokaryotları ayıran temel özelliktir. Çekirdek hem genetik bilginin deposu hem de kontrol merkezidir.
Hücre Nükleusu, Nükleus Membranı, Nükleus Porları Doç. Dr. Ahmet Özaydın Nükleus (çekirdek) ökaryotlar ile prokaryotları ayıran temel özelliktir. Çekirdek hem genetik bilginin deposu hem de kontrol merkezidir.
Canlılarda mitoz, amitoz ve mayoz olmak üzere üç çeşit bölünme görülür.
 HÜCRE BÖLÜNMELERİ Canlılarda mitoz, amitoz ve mayoz olmak üzere üç çeşit bölünme görülür. I. MİTOZ BÖLÜNME Mitoz bölünme tek hücreli canlılardan, çok hücreli canlılara ve insana kadar bir çok canlı grubu
HÜCRE BÖLÜNMELERİ Canlılarda mitoz, amitoz ve mayoz olmak üzere üç çeşit bölünme görülür. I. MİTOZ BÖLÜNME Mitoz bölünme tek hücreli canlılardan, çok hücreli canlılara ve insana kadar bir çok canlı grubu
Üreme (Reprodüksiyon)
 VEYSEL TAHİROĞLU ÜREME ORGANLARI Üreme organları üremeye ilişkin işlevlerin (gametlerin oluşumu, cinsel birleşme, gebelik, doğum vs.) gerçekleşmesini sağlayan organlardır. Üreme (Reprodüksiyon) Tüm canlıların
VEYSEL TAHİROĞLU ÜREME ORGANLARI Üreme organları üremeye ilişkin işlevlerin (gametlerin oluşumu, cinsel birleşme, gebelik, doğum vs.) gerçekleşmesini sağlayan organlardır. Üreme (Reprodüksiyon) Tüm canlıların
Çekirdek 4 bölümden oluşur Çekirdek zarı: karyolemma Kromatin: Chromatin Çekirdekcik: Nucleolus Çekirdek sıvısı: karyolymph
 NUKLEUS Bir hücrenin tüm yapılarının ve etkinliklerinin kodlandığı kromozomu Ayrıca, DNA sını dublike edecek ve 3 tip RNA yı ribozomal (rrna), haberci (mrna) ve transfer (trna)-sentezleyecek ve işleyecek
NUKLEUS Bir hücrenin tüm yapılarının ve etkinliklerinin kodlandığı kromozomu Ayrıca, DNA sını dublike edecek ve 3 tip RNA yı ribozomal (rrna), haberci (mrna) ve transfer (trna)-sentezleyecek ve işleyecek
ERKEK ÜREME SİSTEMİ HİSTOLOJİSİ
 ERKEK ÜREME SİSTEMİ HİSTOLOJİSİ Prof. Dr. Bülent AHISHALI Histoloji ve Embriyoloji Anabilim Dalı Erkek Üreme Sistemi Testis Genital kanallar İntratestiküler Ekstratestiküler Yardımcı bezler Seminal veziküller
ERKEK ÜREME SİSTEMİ HİSTOLOJİSİ Prof. Dr. Bülent AHISHALI Histoloji ve Embriyoloji Anabilim Dalı Erkek Üreme Sistemi Testis Genital kanallar İntratestiküler Ekstratestiküler Yardımcı bezler Seminal veziküller
Örtü Epiteli Tipleri:
 Tek Katlı: Tek Katlı Yassı Epitel Tek Katlı Kübik Epitel Tek Katlı Prizmatik Örtü Epiteli Tipleri: Basit Kinosilyalı Çizgili Kenarlı Yalancı Çok Katlı( Psödostratifiye) Prizmatik Epitel Çok Katlı: Çok
Tek Katlı: Tek Katlı Yassı Epitel Tek Katlı Kübik Epitel Tek Katlı Prizmatik Örtü Epiteli Tipleri: Basit Kinosilyalı Çizgili Kenarlı Yalancı Çok Katlı( Psödostratifiye) Prizmatik Epitel Çok Katlı: Çok
S evresi: Organellerin iki katına çıkarılması devam ederken DNA sentezi olur.
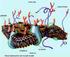 HÜCRE DÖNGÜSÜ İnterfaz: Bölünmeyen bir hücre interfaz durumundadır. Bu safhada replikasyon ve bölünme için hazırlık yapılır. Çekirdek belirgindir, bir yada daha fazla çekirdekçik ayırt edilebilir. Kromozomlar
HÜCRE DÖNGÜSÜ İnterfaz: Bölünmeyen bir hücre interfaz durumundadır. Bu safhada replikasyon ve bölünme için hazırlık yapılır. Çekirdek belirgindir, bir yada daha fazla çekirdekçik ayırt edilebilir. Kromozomlar
Mitoz bölünme, hücredeki kalıtım maddesinin yavru hücrelere eşit miktarda bölünmesini sağlayan karmaşık bir olaydır.
 Mitoz bölünme, hücredeki kalıtım maddesinin yavru hücrelere eşit miktarda bölünmesini sağlayan karmaşık bir olaydır. Hücre mitozla bölünmeden önce DNA eşlemesi olur. Hücre mitozla bölünmeye başlamadan
Mitoz bölünme, hücredeki kalıtım maddesinin yavru hücrelere eşit miktarda bölünmesini sağlayan karmaşık bir olaydır. Hücre mitozla bölünmeden önce DNA eşlemesi olur. Hücre mitozla bölünmeye başlamadan
İstanbul Tıp Fakültesi Tıbbi Biyoloji ABD Prof.Dr. Filiz AYDIN
 İstanbul Tıp Fakültesi Tıbbi Biyoloji ABD Prof.Dr. Filiz AYDIN Fertilizasyonda 46 kromozom Her bir kromozom çift kromadit-(92) Hücre bölündükten sonra her hücre de 46 kromozom bulunur Mitoz bölünme G1
İstanbul Tıp Fakültesi Tıbbi Biyoloji ABD Prof.Dr. Filiz AYDIN Fertilizasyonda 46 kromozom Her bir kromozom çift kromadit-(92) Hücre bölündükten sonra her hücre de 46 kromozom bulunur Mitoz bölünme G1
ayxmaz/biyoloji 2. DNA aşağıdaki sonuçlardan hangisi ile üretilir Kalıp DNA yukarıdaki ana DNAdan yeni DNA molekülleri hangi sonulca üretilir A B C D
 1. DNA replikasyonu.. için gereklidir A) sadece mitoz B) sadece mayoz C) mitoz ve mayoz D) sadece gamet oluşumu E) sadece protein sentezi 2. DNA aşağıdaki sonuçlardan hangisi ile üretilir Kalıp DNA yukarıdaki
1. DNA replikasyonu.. için gereklidir A) sadece mitoz B) sadece mayoz C) mitoz ve mayoz D) sadece gamet oluşumu E) sadece protein sentezi 2. DNA aşağıdaki sonuçlardan hangisi ile üretilir Kalıp DNA yukarıdaki
Mayoz Bölünmenin Oluşumu
 MAYOZ BÖLÜNME NEDİR? 03 Ocak 2012, 23:39 Osman BEDEL MAYOZ BÖLÜNME NEDİR? Kromozom sayılarının nesiller boyu sabit tutulması mayoz bölünme ile sağlanır. Mayoz özel bir hücre bölünmesidir. Bu bölünme ile
MAYOZ BÖLÜNME NEDİR? 03 Ocak 2012, 23:39 Osman BEDEL MAYOZ BÖLÜNME NEDİR? Kromozom sayılarının nesiller boyu sabit tutulması mayoz bölünme ile sağlanır. Mayoz özel bir hücre bölünmesidir. Bu bölünme ile
HÜCRE BÖLÜNMESİ VE ÜREME. Mitoz Bölünme ve Eşeysiz Üreme 1
 HÜCRE BÖLÜNMESİ VE ÜREME Mitoz Bölünme ve Eşeysiz Üreme 1 Hücrenin bölünmeye başlamasından itibaren onu takip eden diğer hücre bölünmesine kadar geçen zaman aralığına hücre döngüsü denir. Hücreler belli
HÜCRE BÖLÜNMESİ VE ÜREME Mitoz Bölünme ve Eşeysiz Üreme 1 Hücrenin bölünmeye başlamasından itibaren onu takip eden diğer hücre bölünmesine kadar geçen zaman aralığına hücre döngüsü denir. Hücreler belli
İNSANDA ÜREME, BÜYÜME VE GELİŞME
 İNSANDA ÜREME, BÜYÜME VE GELİŞME Canlıların kendine benzer yavrular oluşturmasına üreme denir. Üreme tüm canlılar için ortak özellik olup canlının neslinin devamlılığını sağlar. Canlılar neslini devam
İNSANDA ÜREME, BÜYÜME VE GELİŞME Canlıların kendine benzer yavrular oluşturmasına üreme denir. Üreme tüm canlılar için ortak özellik olup canlının neslinin devamlılığını sağlar. Canlılar neslini devam
Mitoz. - Mitozda 2 yavru hücre oluşur ve bunların genetik yapısı birbirinin ve ana hücrenin aynıdır.
 Mitoz - Mitozda 2 yavru hücre oluşur ve bunların genetik yapısı birbirinin ve ana hücrenin aynıdır. - 2n --- 4n (anafaz) ------2n - İdentik kardeş kromatidler ayrılarak yavru hücrelere giderler. - Somatik
Mitoz - Mitozda 2 yavru hücre oluşur ve bunların genetik yapısı birbirinin ve ana hücrenin aynıdır. - 2n --- 4n (anafaz) ------2n - İdentik kardeş kromatidler ayrılarak yavru hücrelere giderler. - Somatik
Hücre çekirdeği (nucleus)
 Hücre çekirdeği (nucleus) Toplam hücre hacmının 1/20-1/10'unu kapsar. Değişik hücrelerde mekanik etkilerle, yer ve şekil değiştirebilir, bu nedenle hücrelerde farklı şekillerde görülebilir. Çekirdek, hücre
Hücre çekirdeği (nucleus) Toplam hücre hacmının 1/20-1/10'unu kapsar. Değişik hücrelerde mekanik etkilerle, yer ve şekil değiştirebilir, bu nedenle hücrelerde farklı şekillerde görülebilir. Çekirdek, hücre
Epitel hücreleri glikokaliks denen glikoprotein örtüsü ile çevrilidir. Epitel hücrelerinin birbirine yapışmasını sağlar. Epitel hücrelerinin üzerine
 EPİTEL DOKU EPİTEL DOKU Birbirine bitişik hücrelerden yapılmıştır. Hücreler arası madde çok azdır. Ektoderm, mezoderm ve endoderm olmak üzere her üç embriyon yaprağından köken alır. Epitel dokusu mitoz
EPİTEL DOKU EPİTEL DOKU Birbirine bitişik hücrelerden yapılmıştır. Hücreler arası madde çok azdır. Ektoderm, mezoderm ve endoderm olmak üzere her üç embriyon yaprağından köken alır. Epitel dokusu mitoz
Prenatal devre insan ve memeli hayvanlarda uterus içerisinde geçer. Kanatlı hayvanlarda ise yumurta içinde kuluçkada geçen devredir.
 Embriyoloji, genel anlamıyla canlıların oluşmasını ve gelişmesini inceleyen bir bilim dalıdır. İnsan ve memeli hayvanların doğumdan önceki, kanatlı hayvanların ise kuluçka dönemindeki hayatını inceler.
Embriyoloji, genel anlamıyla canlıların oluşmasını ve gelişmesini inceleyen bir bilim dalıdır. İnsan ve memeli hayvanların doğumdan önceki, kanatlı hayvanların ise kuluçka dönemindeki hayatını inceler.
YAZILIYA HAZIRLIK TEST SORULARI. 10. Sınıf
 YAZILIYA HAZIRLIK TEST SORULARI 10. Sınıf 1) Hücre döngüsünün interfaz evresini yeni tamamlamış bir hücre ile bu hücrenin döngü sonunda oluşturduğu yeni hücrelerde; I. DNA miktarı II. Gen Sayısı III. Gen
YAZILIYA HAZIRLIK TEST SORULARI 10. Sınıf 1) Hücre döngüsünün interfaz evresini yeni tamamlamış bir hücre ile bu hücrenin döngü sonunda oluşturduğu yeni hücrelerde; I. DNA miktarı II. Gen Sayısı III. Gen
ÜREME SİSTEMİ FİZYOLOJİSİ DOÇ.DR.MİTAT KOZ
 ÜREME SİSTEMİ FİZYOLOJİSİ DOÇ.DR.MİTAT KOZ Kadın ve erkek üreme sistemi dölün üretilmesi amacı ile özelleşmiş özel organlardan oluşmaktadır. Bazı üreme organları cinsiyet hücrelerini üretir, diğerleri
ÜREME SİSTEMİ FİZYOLOJİSİ DOÇ.DR.MİTAT KOZ Kadın ve erkek üreme sistemi dölün üretilmesi amacı ile özelleşmiş özel organlardan oluşmaktadır. Bazı üreme organları cinsiyet hücrelerini üretir, diğerleri
DOKU. Dicle Aras. Doku ve doku türleri
 DOKU Dicle Aras Doku ve doku türleri Doku Bazı özel görevler üstlenmiş hücre topluluklarıdır. Bir doku aynı yönde özelleşmiş hücre ve hücreler arası maddelerin bir araya gelmesiyle oluşmuştur. İntrauterin
DOKU Dicle Aras Doku ve doku türleri Doku Bazı özel görevler üstlenmiş hücre topluluklarıdır. Bir doku aynı yönde özelleşmiş hücre ve hücreler arası maddelerin bir araya gelmesiyle oluşmuştur. İntrauterin
KAS DOKUSU. Kontraksiyon özelliği gelişmiş hücrelerden oluşur Kas hücresi : Fibra muskularis = Kas teli = Kas iplikleri
 KAS DOKUSU Kontraksiyon özelliği gelişmiş hücrelerden oluşur Kas hücresi : Fibra muskularis = Kas teli = Kas iplikleri Kasın Fonksiyonu Hareket Solunum Vücut ısısının üretimi İletişim Organların kontraksiyonu
KAS DOKUSU Kontraksiyon özelliği gelişmiş hücrelerden oluşur Kas hücresi : Fibra muskularis = Kas teli = Kas iplikleri Kasın Fonksiyonu Hareket Solunum Vücut ısısının üretimi İletişim Organların kontraksiyonu
ADIM ADIM YGS-LYS 37. ADIM HÜCRE 14- ÇEKİRDEK
 ADIM ADIM YGS-LYS 37. ADIM HÜCRE 14- ÇEKİRDEK 3) Çekirdek Ökaryot yapılı hücrelerde genetik maddeyi taşıyan hücre kısmıdır. Prokaryot hücreli canlılarda bulunmaz. GÖREVLERİ: 1) Genetik maddeyi taşıdığından
ADIM ADIM YGS-LYS 37. ADIM HÜCRE 14- ÇEKİRDEK 3) Çekirdek Ökaryot yapılı hücrelerde genetik maddeyi taşıyan hücre kısmıdır. Prokaryot hücreli canlılarda bulunmaz. GÖREVLERİ: 1) Genetik maddeyi taşıdığından
DİŞİ EŞEY HÜCRELERİNİN GELİŞMESİ OLGUNLAŞMASI. Doç. Dr. A. Gürol BAYRAKTAROĞLU
 DİŞİ EŞEY HÜCRELERİNİN GELİŞMESİ OLGUNLAŞMASI Doç. Dr. A. Gürol BAYRAKTAROĞLU OVOGENEZİS Dişi eşey hücresinin gelişip olgunlaşmasına ovogenezis denir. Spermatogenezisteki gibi çoğalma, büyüme ve olgunlaşma
DİŞİ EŞEY HÜCRELERİNİN GELİŞMESİ OLGUNLAŞMASI Doç. Dr. A. Gürol BAYRAKTAROĞLU OVOGENEZİS Dişi eşey hücresinin gelişip olgunlaşmasına ovogenezis denir. Spermatogenezisteki gibi çoğalma, büyüme ve olgunlaşma
II.Hayvansal Dokular. b.bez Epiteli 1.Tek hücreli bez- Goblet hücresi 2.Çok hücreli kanallı bez 3.Çok hücreli kanalsız bez
 II.Hayvansal Dokular Hayvanların embriyonik gelişimi sırasında Ektoderm, Mezoderm ve Endoderm denilen 3 farklı gelişme tabakası (=germ tabakası) bulunur. Bütün hayvansal dokular bu yapılardan ve bu yapıların
II.Hayvansal Dokular Hayvanların embriyonik gelişimi sırasında Ektoderm, Mezoderm ve Endoderm denilen 3 farklı gelişme tabakası (=germ tabakası) bulunur. Bütün hayvansal dokular bu yapılardan ve bu yapıların
CANLILARDA ÜREME. Üreme canlıların ortak özelliğidir. Her canlının kendine benzer canlı meydana getirebilmesi üreme ile gerçekleşir
 CANLILARDA ÜREME EYLÜL 3.HAFTA MİTOZ VE EŞEYSİZ ÜREME Her canlının kendine benzer canlı meydana getirebilmesi üreme ile gerçekleşir Üreme canlıların ortak özelliğidir 3 4 Canlılar hücrelerden meydana gelir
CANLILARDA ÜREME EYLÜL 3.HAFTA MİTOZ VE EŞEYSİZ ÜREME Her canlının kendine benzer canlı meydana getirebilmesi üreme ile gerçekleşir Üreme canlıların ortak özelliğidir 3 4 Canlılar hücrelerden meydana gelir
DİŞİ ÜREME ORGANLARI
 DİŞİ ÜREME ORGANLARI Dişi üreme organları dişi gamet hücresi ovumu (yumurtayı) üreten ovaryumlar ile ovumun döllendiği, döllenme sonrasında gebeliğin şekillendiği ve gelişen yavrunun dışarı çıkarıldığı
DİŞİ ÜREME ORGANLARI Dişi üreme organları dişi gamet hücresi ovumu (yumurtayı) üreten ovaryumlar ile ovumun döllendiği, döllenme sonrasında gebeliğin şekillendiği ve gelişen yavrunun dışarı çıkarıldığı
Özofagus Mide Histolojisi
 Özofagus Mide Histolojisi Sindirim kanalını oluşturan yapılar Gastroıntestınal kanal özafagustan başlayıp anüse değin devam eden değişik çaptaki bir borudur.. Ağız, Farinks (yutak), özafagus(yemek borusu),
Özofagus Mide Histolojisi Sindirim kanalını oluşturan yapılar Gastroıntestınal kanal özafagustan başlayıp anüse değin devam eden değişik çaptaki bir borudur.. Ağız, Farinks (yutak), özafagus(yemek borusu),
BÖLÜM I HÜCRE FİZYOLOJİSİ...
 BÖLÜM I HÜCRE FİZYOLOJİSİ... 1 Bilinmesi Gereken Kavramlar... 1 Giriş... 2 Hücrelerin Fonksiyonel Özellikleri... 2 Hücrenin Kimyasal Yapısı... 2 Hücrenin Fiziksel Yapısı... 4 Hücrenin Bileşenleri... 4
BÖLÜM I HÜCRE FİZYOLOJİSİ... 1 Bilinmesi Gereken Kavramlar... 1 Giriş... 2 Hücrelerin Fonksiyonel Özellikleri... 2 Hücrenin Kimyasal Yapısı... 2 Hücrenin Fiziksel Yapısı... 4 Hücrenin Bileşenleri... 4
ERKEK EŞEY HÜCRELERİNİN GELİŞMESİ ve OLGUNLAŞMASI. Doç. Dr. A. Gürol BAYRAKTAROĞLU
 ERKEK EŞEY HÜCRELERİNİN GELİŞMESİ ve OLGUNLAŞMASI Doç. Dr. A. Gürol BAYRAKTAROĞLU Embriyoloji, genel anlamıyla canlıların oluşmasını ve gelişmesini inceleyen bir bilim dalıdır. İnsan ve memeli hayvanların
ERKEK EŞEY HÜCRELERİNİN GELİŞMESİ ve OLGUNLAŞMASI Doç. Dr. A. Gürol BAYRAKTAROĞLU Embriyoloji, genel anlamıyla canlıların oluşmasını ve gelişmesini inceleyen bir bilim dalıdır. İnsan ve memeli hayvanların
HÜCRENİN YAŞAM DÖNGÜSÜ
 HÜCRENİN YAŞAM DÖNGÜSÜ *Hücrenin yaşam döngüsü: Hücrenin; bir bölünme sonundan, ikinci bir bölünme sonuna kadar olan zaman sürecinde; geçirdiği yaşamsal olaylara hücrenin yaşam döngüsü denir. Hücreler,
HÜCRENİN YAŞAM DÖNGÜSÜ *Hücrenin yaşam döngüsü: Hücrenin; bir bölünme sonundan, ikinci bir bölünme sonuna kadar olan zaman sürecinde; geçirdiği yaşamsal olaylara hücrenin yaşam döngüsü denir. Hücreler,
MOTOR PROTEİNLER. Doç. Dr. Çiğdem KEKİK ÇINAR
 MOTOR PROTEİNLER Doç. Dr. Çiğdem KEKİK ÇINAR Hücre iskeleti, Hücre şeklini ve sitoplazmanın organizasyonunu belirleyen bir yapı iskelesi görevi yapar. Hücre hareketlerinin gerçekleşmesinden sorumludur.
MOTOR PROTEİNLER Doç. Dr. Çiğdem KEKİK ÇINAR Hücre iskeleti, Hücre şeklini ve sitoplazmanın organizasyonunu belirleyen bir yapı iskelesi görevi yapar. Hücre hareketlerinin gerçekleşmesinden sorumludur.
Hücre Yapısı: Somatik ve Germ Hücrelerinin Bölünme ve Farklanmaları. Yrd.Doç.Dr.Sevda Söker
 Hücre Yapısı: Somatik ve Germ Hücrelerinin Bölünme ve Farklanmaları Yrd.Doç.Dr.Sevda Söker Embriyonal yaşamın başlangıcından itibaren hücre bölünmesi başlar ve gelişmeyle ilgili her aşama hücre bölünmesiyle
Hücre Yapısı: Somatik ve Germ Hücrelerinin Bölünme ve Farklanmaları Yrd.Doç.Dr.Sevda Söker Embriyonal yaşamın başlangıcından itibaren hücre bölünmesi başlar ve gelişmeyle ilgili her aşama hücre bölünmesiyle
10. SINIF KONU ANLATIMI 6 MAYOZ BÖLÜNME-3
 10. SINIF KONU ANLATIMI 6 MAYOZ BÖLÜNME-3 Mayoz Bölünmenin Genel Özellikleri Üreme ana hücrelerinde görülür. Üreme hücrelerinin oluşmasını sağlar. Sadece 2n kromozomlu hücrelerde görülür. 4 yeni hücre
10. SINIF KONU ANLATIMI 6 MAYOZ BÖLÜNME-3 Mayoz Bölünmenin Genel Özellikleri Üreme ana hücrelerinde görülür. Üreme hücrelerinin oluşmasını sağlar. Sadece 2n kromozomlu hücrelerde görülür. 4 yeni hücre
2n n. Kromozom sayısı. Zaman
 Mitoz Döllenme Mitoz MAYOZ BÖLÜNME 10. SINIF ÜNİTE, KONU, KAZANIM VE AÇIKLAMALARI 10.1.2. ve Eşeyli Üreme 10.1.2.1. u açıklar. a. un evreleri temel düzeyde işlenir. Evreler açıklanırken mikroskop, görsel
Mitoz Döllenme Mitoz MAYOZ BÖLÜNME 10. SINIF ÜNİTE, KONU, KAZANIM VE AÇIKLAMALARI 10.1.2. ve Eşeyli Üreme 10.1.2.1. u açıklar. a. un evreleri temel düzeyde işlenir. Evreler açıklanırken mikroskop, görsel
Seminifer kanalın en alt sırasında yerleşmiş ve aralarında mitoz bölünmeler geçirerek devamlı çoğalan hücreler spermatogonyum lardır.
 SPERMATOGENEZİS Olgun erkek eşey hücresinin meydana gelişidir, (spermatogonyum, primer spermatosit, sekonder spermatosit, spermatid, sperm hücrelerinden ibarettir) Goniyogenezis, spermatositogenezis ve
SPERMATOGENEZİS Olgun erkek eşey hücresinin meydana gelişidir, (spermatogonyum, primer spermatosit, sekonder spermatosit, spermatid, sperm hücrelerinden ibarettir) Goniyogenezis, spermatositogenezis ve
Dr. Ezgi Öztaş. İstanbul Üniversitesi, Eczacılık Fakültesi Farmasötik Toksikoloji Anabilim Dalı
 STREPTOZOTOSİN İLE DİYABET OLUŞTURULAN SIÇANLARDA GLİKLAZİD VE ATORVASTATİN KOMBİNASYON TEDAVİSİNİN ERKEK ÜREME SİSTEMİ ÜZERİNE ETKİLERİNİN ARAŞTIRILMASI Dr. Ezgi Öztaş İstanbul Üniversitesi, Eczacılık
STREPTOZOTOSİN İLE DİYABET OLUŞTURULAN SIÇANLARDA GLİKLAZİD VE ATORVASTATİN KOMBİNASYON TEDAVİSİNİN ERKEK ÜREME SİSTEMİ ÜZERİNE ETKİLERİNİN ARAŞTIRILMASI Dr. Ezgi Öztaş İstanbul Üniversitesi, Eczacılık
Endokrin Sistem. Paratiroid Tiroid Pankreas Surrenal bez. Dr.Murat TOSUN
 Endokrin Sistem Paratiroid Tiroid Pankreas Surrenal bez Dr.Murat TOSUN TİROİD VE PARATİROİD BEZLER Embriyolojik dönemde Tiroid bezi 4. hafta civarında farenks tabanında tuberculum impar ve copula arasındaki
Endokrin Sistem Paratiroid Tiroid Pankreas Surrenal bez Dr.Murat TOSUN TİROİD VE PARATİROİD BEZLER Embriyolojik dönemde Tiroid bezi 4. hafta civarında farenks tabanında tuberculum impar ve copula arasındaki
HÜCRE #6 HÜCRE İSKELET ELEMANLARI ÇEKİRDEK SELİN HOCA
 HÜCRE #6 HÜCRE İSKELET ELEMANLARI ÇEKİRDEK SELİN HOCA HÜCRE İSKELET ELEMANLARI Sitoplazmanın içinde bulunan özel proteinlerdir. 3 çeşit hücre iskelet elemanı bulunur. Her iskelet elemanının görev ve yapısı
HÜCRE #6 HÜCRE İSKELET ELEMANLARI ÇEKİRDEK SELİN HOCA HÜCRE İSKELET ELEMANLARI Sitoplazmanın içinde bulunan özel proteinlerdir. 3 çeşit hücre iskelet elemanı bulunur. Her iskelet elemanının görev ve yapısı
KAS FİZYOLOJİSİ. Yrd.Doç.Dr. Önder AYTEKİN
 KAS FİZYOLOJİSİ Yrd.Doç.Dr. Önder AYTEKİN Uyarılabilen dokular herhangi bir uyarıya karşı hücre zarlarının elektriksel özelliğini değiştirerek aksiyon potansiyeli oluşturup, iletebilme özelliği göstermektedir.
KAS FİZYOLOJİSİ Yrd.Doç.Dr. Önder AYTEKİN Uyarılabilen dokular herhangi bir uyarıya karşı hücre zarlarının elektriksel özelliğini değiştirerek aksiyon potansiyeli oluşturup, iletebilme özelliği göstermektedir.
YGS YE HAZIRLIK DENEMESi #13
 YGS YE HAZIRLIK DENEMESi #13 1) Canlılarda özelliklerin genlerle kontrol edildiği ve her genin en az bir özellikten sorumlu olduğu bilindiğine göre, I. Diploid canlılarda her özellik için iki gen bulunması
YGS YE HAZIRLIK DENEMESi #13 1) Canlılarda özelliklerin genlerle kontrol edildiği ve her genin en az bir özellikten sorumlu olduğu bilindiğine göre, I. Diploid canlılarda her özellik için iki gen bulunması
ABSTRACT ANAHTAR SÖZCÜKLER / KEY WORDS
 I ÖZ Bu çalışmada Kepez/AYDIN dan Haziran 2005 tarihinde toplanan 10 yetişkin L. stellio nun (5, 5 ) sindirim kanalının bir bölümünü oluşturan ince barsak ve kalın barsağının genel histolojik yapısı ortaya
I ÖZ Bu çalışmada Kepez/AYDIN dan Haziran 2005 tarihinde toplanan 10 yetişkin L. stellio nun (5, 5 ) sindirim kanalının bir bölümünü oluşturan ince barsak ve kalın barsağının genel histolojik yapısı ortaya
Düz Kas. Nerede???? İçi boş organların duvarı, Kan damarlarının duvarı, Göz, Kıl follikülleri. Mesane. Uterus. İnce bağırsak
 Nerede???? İçi boş organların duvarı, Kan damarlarının duvarı, Göz, Kıl follikülleri. Düz Kas Mesane Uterus İnce bağırsak Düz Kas İşlevleri İstemsiz kasılma Bazı düz kas hücreleri kollajen, elastin, glikozaminoglikan,
Nerede???? İçi boş organların duvarı, Kan damarlarının duvarı, Göz, Kıl follikülleri. Düz Kas Mesane Uterus İnce bağırsak Düz Kas İşlevleri İstemsiz kasılma Bazı düz kas hücreleri kollajen, elastin, glikozaminoglikan,
BİYOLOJİ VE BİLİMSEL YÖNTEM... 1 Bilim ve Bilimsel Yöntem... 2
 İÇİNDEKİLER Sayfa BİYOLOJİ VE BİLİMSEL YÖNTEM... 1 Bilim ve Bilimsel Yöntem... 2 CANLILARIN OLUŞUMU... 5 CANLILARIN ORTAK ÖZELLİKLERİ... 9 CANLILARIN SINIFLANDIRILMASI... 11 SİSTEMATİK... 13 BİTKİ VE HAYVANLARIN
İÇİNDEKİLER Sayfa BİYOLOJİ VE BİLİMSEL YÖNTEM... 1 Bilim ve Bilimsel Yöntem... 2 CANLILARIN OLUŞUMU... 5 CANLILARIN ORTAK ÖZELLİKLERİ... 9 CANLILARIN SINIFLANDIRILMASI... 11 SİSTEMATİK... 13 BİTKİ VE HAYVANLARIN
ENDOTEL YAPISI VE İŞLEVLERİ. Doç. Dr. Esra Atabenli Erdemli
 ENDOTEL YAPISI VE İŞLEVLERİ Doç. Dr. Esra Atabenli Erdemli Endotel, dolaşım sistemini döşeyen tek katlı yassı epiteldir. Endotel hücreleri, kan damarlarını kan akımı yönünde uzunlamasına döşeyen yassı,
ENDOTEL YAPISI VE İŞLEVLERİ Doç. Dr. Esra Atabenli Erdemli Endotel, dolaşım sistemini döşeyen tek katlı yassı epiteldir. Endotel hücreleri, kan damarlarını kan akımı yönünde uzunlamasına döşeyen yassı,
HÜCRE. Yrd.Doç.Dr. Mehtap ÖZÇELİK Fırat Üniversitesi
 HÜCRE Yrd.Doç.Dr. Mehtap ÖZÇELİK Fırat Üniversitesi Hücre Canlıların en küçük yapı taşıdır Bütün canlılar hücrelerden oluşur Canlılar tek hücreli ya da çok hücreli olabilir Bitki ve hayvan hücresi = çok
HÜCRE Yrd.Doç.Dr. Mehtap ÖZÇELİK Fırat Üniversitesi Hücre Canlıların en küçük yapı taşıdır Bütün canlılar hücrelerden oluşur Canlılar tek hücreli ya da çok hücreli olabilir Bitki ve hayvan hücresi = çok
07.11.2014. Fetus Fizyolojisi. 10.Sınıf Kadın Sağlığı Hastalıkları ve Bakımı
 10.Sınıf Kadın Sağlığı Hastalıkları ve Bakımı 8.Hafta ( 03-07 / 11 / 2014 ) FETUS FİZYOLOJİSİ 1.Embriyonun Gelişmesi 1.) Plasenta 2.) Amnion Kesesi ve Amnion Sıvısı Slayt No: 9 1.) EMBRİYONUN GELİŞMESİ
10.Sınıf Kadın Sağlığı Hastalıkları ve Bakımı 8.Hafta ( 03-07 / 11 / 2014 ) FETUS FİZYOLOJİSİ 1.Embriyonun Gelişmesi 1.) Plasenta 2.) Amnion Kesesi ve Amnion Sıvısı Slayt No: 9 1.) EMBRİYONUN GELİŞMESİ
HÜCRE FİZYOLOJİSİ Hücrenin fiziksel yapısı. Hücre membranı proteinleri. Hücre membranı
 Hücrenin fiziksel yapısı HÜCRE FİZYOLOJİSİ Hücreyi oluşturan yapılar Hücre membranı yapısı ve özellikleri Hücre içi ve dışı bileşenler Hücre membranından madde iletimi Vücut sıvılar Ozmoz-ozmmotik basınç
Hücrenin fiziksel yapısı HÜCRE FİZYOLOJİSİ Hücreyi oluşturan yapılar Hücre membranı yapısı ve özellikleri Hücre içi ve dışı bileşenler Hücre membranından madde iletimi Vücut sıvılar Ozmoz-ozmmotik basınç
Ayxmaz/biyoloji. Şekil 2.
 Şekil 1. 1) Yukarıdaki üreme süreci aşağıdakilerden hangisine örnek gösterilir: a) hermafroditlik b) oogami c) sporlanma d) patenogenez e) izogami 2) Aşağıdakilerden hangisi eşeysiz üreme özelliği değildir?
Şekil 1. 1) Yukarıdaki üreme süreci aşağıdakilerden hangisine örnek gösterilir: a) hermafroditlik b) oogami c) sporlanma d) patenogenez e) izogami 2) Aşağıdakilerden hangisi eşeysiz üreme özelliği değildir?
HÜCRE BÖLÜNMESİ. 1- Amitoz Bölünme 2- Mitoz Bölünme 3- Mayoz bölünme. -G1 -Profaz -S -Metafaz -G2 -Anafaz -Telofaz
 HÜCRE BÖLÜNMESİ 1- Amitoz Bölünme 2- Mitoz Bölünme 3- Mayoz bölünme A:İNTERFAZ B: MİTOZ -G1 -Profaz -S -Metafaz -G2 -Anafaz -Telofaz TERİMLER Sentromer Metafaz aşamasında kromozomlar üzerindeki boğumlanma
HÜCRE BÖLÜNMESİ 1- Amitoz Bölünme 2- Mitoz Bölünme 3- Mayoz bölünme A:İNTERFAZ B: MİTOZ -G1 -Profaz -S -Metafaz -G2 -Anafaz -Telofaz TERİMLER Sentromer Metafaz aşamasında kromozomlar üzerindeki boğumlanma
HİSTOLOJİ. DrYasemin Sezgin
 HİSTOLOJİ DrYasemin Sezgin HİSTOLOJİ - Canlı vücudunu meydana getiren hücre, doku ve organların çıplak gözle görülemeyen (mikroskopik) yapılarını inceleyen bir bilim koludur. - Histolojinin sözlük anlamı
HİSTOLOJİ DrYasemin Sezgin HİSTOLOJİ - Canlı vücudunu meydana getiren hücre, doku ve organların çıplak gözle görülemeyen (mikroskopik) yapılarını inceleyen bir bilim koludur. - Histolojinin sözlük anlamı
LENFOİD SİSTEM DR GÖKSAL KESKİN ARALIK-2014
 LENFOİD SİSTEM DR GÖKSAL KESKİN ARALIK-2014 Lenfoid Sistem Lenfositlerin, mononükleer fagositlerin ve diğer yardımcı rol oynayan hücrelerin bulunduğu, yabancı antijenlerin taşınıp yoğunlaştırıldığı, Antijenin
LENFOİD SİSTEM DR GÖKSAL KESKİN ARALIK-2014 Lenfoid Sistem Lenfositlerin, mononükleer fagositlerin ve diğer yardımcı rol oynayan hücrelerin bulunduğu, yabancı antijenlerin taşınıp yoğunlaştırıldığı, Antijenin
B unl a r ı B i l i yor mus unuz? MİTOZ. Canlının en küçük yapı biriminin hücre olduğunu 6. sınıfta öğrenmiştik. Hücreler; hücre zarı,
 MİTOZ Canlının en küçük yapı biriminin hücre olduğunu 6. sınıfta öğrenmiştik. Hücreler; hücre zarı, sitoplazma ve çekirdekten meydana gelmiştir. Hücreler büyüme ve gelişme sonucunda belli bir olgunluğa
MİTOZ Canlının en küçük yapı biriminin hücre olduğunu 6. sınıfta öğrenmiştik. Hücreler; hücre zarı, sitoplazma ve çekirdekten meydana gelmiştir. Hücreler büyüme ve gelişme sonucunda belli bir olgunluğa
EMBRİYOLOJİ VE GENETİK DERSİNE GİRİŞ ARŞ. GÖR. KEVSER İLÇİOĞLU
 EMBRİYOLOJİ VE GENETİK 1 DERSİNE GİRİŞ ARŞ. GÖR. KEVSER İLÇİOĞLU 2/16 EMBRİYOLOJİ NEDİR? Embriyoloji; zigottan, hücreler, dokular, organlar ile tüm vücudun oluşmasına kadar geçen ve doğuma kadar devam
EMBRİYOLOJİ VE GENETİK 1 DERSİNE GİRİŞ ARŞ. GÖR. KEVSER İLÇİOĞLU 2/16 EMBRİYOLOJİ NEDİR? Embriyoloji; zigottan, hücreler, dokular, organlar ile tüm vücudun oluşmasına kadar geçen ve doğuma kadar devam
*Canlıların canlılık özelliği gösteren en küçük yapı birimine hücre denir.
 Fen ve Teknoloji 1. Ünite Özeti Hücre Canlılarda Üreme, Büyüme ve Gelişme. *Canlıların canlılık özelliği gösteren en küçük yapı birimine hücre denir. *Hücrenin temel kısımları: hücre zarı, sitoplâzma ve
Fen ve Teknoloji 1. Ünite Özeti Hücre Canlılarda Üreme, Büyüme ve Gelişme. *Canlıların canlılık özelliği gösteren en küçük yapı birimine hücre denir. *Hücrenin temel kısımları: hücre zarı, sitoplâzma ve
Sayfa BİYOLOJİ VE BİLİMSEL YÖNTEM... 1 Bilim ve Bilimsel Yöntem... 2
 İÇİNDEKİLER Sayfa BİYOLOJİ VE BİLİMSEL YÖNTEM... 1 Bilim ve Bilimsel Yöntem... 2 CANLILARIN OLUŞUMU... 6 CANLILARIN ORTAK ÖZELLİKLERİ... 11 CANLILARIN SINIFLANDIRILMASI... 13 SİSTEMATİK... 34 BİTKİ VE
İÇİNDEKİLER Sayfa BİYOLOJİ VE BİLİMSEL YÖNTEM... 1 Bilim ve Bilimsel Yöntem... 2 CANLILARIN OLUŞUMU... 6 CANLILARIN ORTAK ÖZELLİKLERİ... 11 CANLILARIN SINIFLANDIRILMASI... 13 SİSTEMATİK... 34 BİTKİ VE
Fertilizasyon ve Erken Embriyogenez
 Fertilizasyon ve Erken Embriyogenez Prof.Dr. Alp Can Histoloji-Embriyoloji ABD Embriyoloji (Gelişim Bilimi) [embriyo=cenin, logos=bilim] Tanımsal (deskriptif embriyoloji) Gelişim mekanizmaları İnsanın
Fertilizasyon ve Erken Embriyogenez Prof.Dr. Alp Can Histoloji-Embriyoloji ABD Embriyoloji (Gelişim Bilimi) [embriyo=cenin, logos=bilim] Tanımsal (deskriptif embriyoloji) Gelişim mekanizmaları İnsanın
ADIM ADIM YGS LYS. 73. Adım ÜREME BÜYÜME GELİŞME EMBRİYONİK ZARLAR İNSAN EMBRİYOSUNUN GELİŞİMİ-1
 ADIM ADIM YGS LYS 73. Adım ÜREME BÜYÜME GELİŞME EMBRİYONİK ZARLAR İNSAN EMBRİYOSUNUN GELİŞİMİ-1 EMBRİYONUN DIŞINDA YER ALAN ZARLAR Zigotun gelişmesi ardından oluşan embriyo; sürüngen, kuş ve memelilerde
ADIM ADIM YGS LYS 73. Adım ÜREME BÜYÜME GELİŞME EMBRİYONİK ZARLAR İNSAN EMBRİYOSUNUN GELİŞİMİ-1 EMBRİYONUN DIŞINDA YER ALAN ZARLAR Zigotun gelişmesi ardından oluşan embriyo; sürüngen, kuş ve memelilerde
KALP KASI Kalpte ve kalpten çıkan büyük damarlarda bulunur. Miyofilamanların organizasyonu iskelet kasındakilerle aynıdır; histolojik kesitlerde
 KALP KASI Kalpte ve kalpten çıkan büyük damarlarda bulunur. Miyofilamanların organizasyonu iskelet kasındakilerle aynıdır; histolojik kesitlerde enine çizgilenme gösterirler. Kalp kası hücreleri interkalar
KALP KASI Kalpte ve kalpten çıkan büyük damarlarda bulunur. Miyofilamanların organizasyonu iskelet kasındakilerle aynıdır; histolojik kesitlerde enine çizgilenme gösterirler. Kalp kası hücreleri interkalar
HÜCRE FİZYOLOJİSİ PROF.DR.MİTAT KOZ
 HÜCRE FİZYOLOJİSİ PROF.DR.MİTAT KOZ 1 HÜCRE Kompleks çok hücreli organizmaların, (hayatın karakteristik özelliklerine sahip) en küçük yapısal birimine HÜCRE denir. Hücreler yaşayan organizmaların yapısal
HÜCRE FİZYOLOJİSİ PROF.DR.MİTAT KOZ 1 HÜCRE Kompleks çok hücreli organizmaların, (hayatın karakteristik özelliklerine sahip) en küçük yapısal birimine HÜCRE denir. Hücreler yaşayan organizmaların yapısal
Doksorubisin uygulanan PARP-1 geni silinmiş farelerde FOXO transkripsiyon faktörlerinin ekspresyonları spermatogenez sürecinde değişiklik gösterir
 Doksorubisin uygulanan PARP-1 geni silinmiş farelerde FOXO transkripsiyon faktörlerinin ekspresyonları spermatogenez sürecinde değişiklik gösterir Çiler Çelik-Özenci*, Nilay Kuşcu*, Nayçe Bektaş*, Ece
Doksorubisin uygulanan PARP-1 geni silinmiş farelerde FOXO transkripsiyon faktörlerinin ekspresyonları spermatogenez sürecinde değişiklik gösterir Çiler Çelik-Özenci*, Nilay Kuşcu*, Nayçe Bektaş*, Ece
Bütün hücrelerin olmazsa olmazları. Plazma zarı Yarı-sıvı sitosol Kromozom Ribozom
 Bütün hücrelerin olmazsa olmazları Plazma zarı Yarı-sıvı sitosol Kromozom Ribozom Hücre Ökaryotik hücre Nukleus var Zarla çevrili organeller var Genellikle prokaryotik hücreye oranla daha büyüktür. Ökaryotlardaki
Bütün hücrelerin olmazsa olmazları Plazma zarı Yarı-sıvı sitosol Kromozom Ribozom Hücre Ökaryotik hücre Nukleus var Zarla çevrili organeller var Genellikle prokaryotik hücreye oranla daha büyüktür. Ökaryotlardaki
ADIM ADIM YGS-LYS 32. ADIM HÜCRE 9- SİTOPLAZMA
 ADIM ADIM YGS-LYS 32. ADIM HÜCRE 9- SİTOPLAZMA 2) Sitoplazma Hücrenin içini dolduran sıvıdır. İçinde inorganik ve organik maddeler vardır. Ayrıca görevleri birbirinden farklı olan organeller de bulunur.
ADIM ADIM YGS-LYS 32. ADIM HÜCRE 9- SİTOPLAZMA 2) Sitoplazma Hücrenin içini dolduran sıvıdır. İçinde inorganik ve organik maddeler vardır. Ayrıca görevleri birbirinden farklı olan organeller de bulunur.
HÜCRE SİKLUSU. Hücrenin bir bölünme sonundan diğer ikinci bölünme sonuna kadar geçen devrine hücre siklusu adı verilir.
 HÜCRE SİKLUSU Hücrenin bir bölünme sonundan diğer ikinci bölünme sonuna kadar geçen devrine hücre siklusu adı verilir. Mitoz (M), G 1 (= 1. Aralık), Sentez (S) ve G 2 olmak üzere birbirini izleyen dört
HÜCRE SİKLUSU Hücrenin bir bölünme sonundan diğer ikinci bölünme sonuna kadar geçen devrine hücre siklusu adı verilir. Mitoz (M), G 1 (= 1. Aralık), Sentez (S) ve G 2 olmak üzere birbirini izleyen dört
LABORATUVAR-6 KONU-2 Hücre - IV.Kromozomlar ve Genler
 LABORATUVAR-6 KONU-2 Hücre - IV.Kromozomlar ve Genler Biçimlenmiş ve yoğunlaşmış kromatin materyaline kromozom denir. Kromozomlar Mitoz ve/veya Mayoz bölünmenin Profaz safhasında görülmeye başlar ve Metafaz
LABORATUVAR-6 KONU-2 Hücre - IV.Kromozomlar ve Genler Biçimlenmiş ve yoğunlaşmış kromatin materyaline kromozom denir. Kromozomlar Mitoz ve/veya Mayoz bölünmenin Profaz safhasında görülmeye başlar ve Metafaz
LYS ANAHTAR SORULAR #6. Mitoz ve Mayoz Bölünme Eşeyli ve Eşeysiz Üreme İnsanda Üreme
 LYS ANAHTAR SORULAR #6 Mitoz ve Mayoz Bölünme Eşeyli ve Eşeysiz Üreme İnsanda Üreme 1) 2n = 40 kromozomlu memeli türünde, Dişinin ovaryumlarında yumurta hücresi oluşurken anafaz I evresinde gonozomların
LYS ANAHTAR SORULAR #6 Mitoz ve Mayoz Bölünme Eşeyli ve Eşeysiz Üreme İnsanda Üreme 1) 2n = 40 kromozomlu memeli türünde, Dişinin ovaryumlarında yumurta hücresi oluşurken anafaz I evresinde gonozomların
GOÜ TIP FAKÜLTESİ DÖNEM I III. KURUL
 III. Kurul Hücresel Metabolizma ve Moleküler Tıp III. Kurul Süresi: 6 hafta III. Kurul Başlangıç Tarihi: 23 Aralık 2009 III. Kurul Bitiş ve Sınav Tarihi: 1 2 Şubat 2010 Ders Kurulu Sorumlusu: Yrd. Doç.
III. Kurul Hücresel Metabolizma ve Moleküler Tıp III. Kurul Süresi: 6 hafta III. Kurul Başlangıç Tarihi: 23 Aralık 2009 III. Kurul Bitiş ve Sınav Tarihi: 1 2 Şubat 2010 Ders Kurulu Sorumlusu: Yrd. Doç.
YAZILIYA HAZIRLIK SORULARI. 10. Sınıf 1 MİTOZ BÖLÜNME EŞEYSİZ ÜREME
 YAZILIYA HAZIRLIK SORULARI 10. Sınıf 1 MİTOZ BÖLÜNME EŞEYSİZ ÜREME Hücre döngüsü uzun bir interfaz ve kısa bir bölünme evresinden oluşur. Hücre bölünmesi tüm canlılarda büyüme, gelişme ve onarım sağlar.
YAZILIYA HAZIRLIK SORULARI 10. Sınıf 1 MİTOZ BÖLÜNME EŞEYSİZ ÜREME Hücre döngüsü uzun bir interfaz ve kısa bir bölünme evresinden oluşur. Hücre bölünmesi tüm canlılarda büyüme, gelişme ve onarım sağlar.
ÜREME SİSTEMİ (Systema genitalia)
 ÜREME SİSTEMİ (Systema genitalia) Neslin devamında kadın genital organlarının görevi erkek genital organlarının görevinden daha komplekstir. Kadın üreme sistemine ait organlar hem dişi üreme hücresi olan
ÜREME SİSTEMİ (Systema genitalia) Neslin devamında kadın genital organlarının görevi erkek genital organlarının görevinden daha komplekstir. Kadın üreme sistemine ait organlar hem dişi üreme hücresi olan
SANKO ÜNİVERSİTESİ TIP FAKÜLTESİ 2015-2016 EĞİTİM-ÖĞRETİM YILI DERS KURULU 102: HÜCRE VE DOKU SİSTEMLERİ
 05-06 EĞİTİM-ÖĞRETİM YILI DERS KURULU 0: HÜCRE VE DOKU SİSTEMLERİ Ders Kurulu Başkanı: / Başkan Yardımcıları: / Histoloji Embriyoloji Yrd. Doç. Dr. Bahadır Murat Demirel / Üyeler: / Tıbbi / Dersin AKTS
05-06 EĞİTİM-ÖĞRETİM YILI DERS KURULU 0: HÜCRE VE DOKU SİSTEMLERİ Ders Kurulu Başkanı: / Başkan Yardımcıları: / Histoloji Embriyoloji Yrd. Doç. Dr. Bahadır Murat Demirel / Üyeler: / Tıbbi / Dersin AKTS
EŞEYLİ ÜREME EŞEY HÜCRELERİ VE DÖLLENME (FERTİLİZASYON) Eşeysel üreme haploit ve diploit hücrelerin her ikisini de gerektirir.
 EŞEYLİ ÜREME EŞEY HÜCRELERİ VE DÖLLENME (FERTİLİZASYON) Eşeysel üreme haploit ve diploit hücrelerin her ikisini de gerektirir. Mayoz ve mitoz bölünmelerin olduğu yaşam evreleri vardır. EŞEYLİ ÜREMENİN
EŞEYLİ ÜREME EŞEY HÜCRELERİ VE DÖLLENME (FERTİLİZASYON) Eşeysel üreme haploit ve diploit hücrelerin her ikisini de gerektirir. Mayoz ve mitoz bölünmelerin olduğu yaşam evreleri vardır. EŞEYLİ ÜREMENİN
AMAÇ: Ökaryotik hücrelerin bölünme mekanizmasını ve kromozom morfolojilerini öğrenmek.
 19.11.2014/Çarşamba Lab 6 KONU: Hücre Bölünmesi ve Kromozom Morfolojisi AMAÇ: Ökaryotik hücrelerin bölünme mekanizmasını ve kromozom morfolojilerini öğrenmek. KAZANIMLAR: Ökaryotik hücrelerin nasıl çoğaldıkları
19.11.2014/Çarşamba Lab 6 KONU: Hücre Bölünmesi ve Kromozom Morfolojisi AMAÇ: Ökaryotik hücrelerin bölünme mekanizmasını ve kromozom morfolojilerini öğrenmek. KAZANIMLAR: Ökaryotik hücrelerin nasıl çoğaldıkları
Artan bilgi ile birlikte hasta ve ailelerin bilinçlendirilmesi
 Bugün gelinen noktada genetik Artan bilgi ile birlikte hasta ve ailelerin bilinçlendirilmesi «Genetik bilgiden hastaların ve ailelerin yararlanması için tüm sağlık çalışanları insan genetiğinin temelinde
Bugün gelinen noktada genetik Artan bilgi ile birlikte hasta ve ailelerin bilinçlendirilmesi «Genetik bilgiden hastaların ve ailelerin yararlanması için tüm sağlık çalışanları insan genetiğinin temelinde
ERİŞKİN ERKEK SIÇANLARDA DOKSORUBİSİN İLE OLUŞTURULAN TESTİS HASARI ÜZERİNE L-KARNİTİNİN ETKİSİ
 T.C. ESKİŞEHİR OSMANGAZİ ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ HİSTOLOJİ VE EMBRİYOLOJİ ANABİLİM DALI ERİŞKİN ERKEK SIÇANLARDA DOKSORUBİSİN İLE OLUŞTURULAN TESTİS HASARI ÜZERİNE L-KARNİTİNİN ETKİSİ YÜKSEK
T.C. ESKİŞEHİR OSMANGAZİ ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ HİSTOLOJİ VE EMBRİYOLOJİ ANABİLİM DALI ERİŞKİN ERKEK SIÇANLARDA DOKSORUBİSİN İLE OLUŞTURULAN TESTİS HASARI ÜZERİNE L-KARNİTİNİN ETKİSİ YÜKSEK
11. SINIF KONU ANLATIMI 32 DUYU ORGANLARI 1 DOKUNMA DUYUSU
 11. SINIF KONU ANLATIMI 32 DUYU ORGANLARI 1 DOKUNMA DUYUSU DUYU ORGANLARI Canlının kendi iç bünyesinde meydana gelen değişiklikleri ve yaşadığı ortamda mevcut fiziksel, kimyasal ve mekanik uyarıları alan
11. SINIF KONU ANLATIMI 32 DUYU ORGANLARI 1 DOKUNMA DUYUSU DUYU ORGANLARI Canlının kendi iç bünyesinde meydana gelen değişiklikleri ve yaşadığı ortamda mevcut fiziksel, kimyasal ve mekanik uyarıları alan
İstanbul Tıp Fakültesi Tıbbi Biyoloji ABD Prof. Dr. Filiz Aydın
 İstanbul Tıp Fakültesi Tıbbi Biyoloji ABD Prof. Dr. Filiz Aydın Mitokondri, ökaryotik organizmanın farklı bir organeli Şekilleri küremsi veya uzun silindirik Çapları 0.5-1 μm uzunlukları 2-6 μm Sayıları
İstanbul Tıp Fakültesi Tıbbi Biyoloji ABD Prof. Dr. Filiz Aydın Mitokondri, ökaryotik organizmanın farklı bir organeli Şekilleri küremsi veya uzun silindirik Çapları 0.5-1 μm uzunlukları 2-6 μm Sayıları
10.Sınıf Biyoloji. Üreme ve Gelişme. cevap anahtarı
 10.Sınıf Biyoloji 4 Üreme ve Gelişme cevap anahtarı 4 EŞEYLİ ÜREME. **Eşeyli üreme: Erkek ve dişi gametlerin birleşerek, yeni bir canlı meydana getirmesine eşeyli üreme denir. (1) bölünme ve (2) esasına
10.Sınıf Biyoloji 4 Üreme ve Gelişme cevap anahtarı 4 EŞEYLİ ÜREME. **Eşeyli üreme: Erkek ve dişi gametlerin birleşerek, yeni bir canlı meydana getirmesine eşeyli üreme denir. (1) bölünme ve (2) esasına
MAYOZ VE EŞEYLİ YAŞAM DÖNGÜLERİ
 MAYOZ VE EŞEYLİ YAŞAM DÖNGÜLERİ Kalıtıma giriş Ebeveynler yavrularına gen adı verilen kodlanmış bilgileri verirler. Genler DNA parçalarıdır. Çoğu gen, hücreyi özgün enzimler ve diğer proteinleri sentezlemesi
MAYOZ VE EŞEYLİ YAŞAM DÖNGÜLERİ Kalıtıma giriş Ebeveynler yavrularına gen adı verilen kodlanmış bilgileri verirler. Genler DNA parçalarıdır. Çoğu gen, hücreyi özgün enzimler ve diğer proteinleri sentezlemesi
CANLILARIN ORTAK ÖZELLİKLERİ
 1 CANLILARIN ORTAK ÖZELLİKLERİ 1.Hücresel yapıdan oluşur 2.Beslenir 3.Solunum yapar 4.Boşaltım yapar 5.Canlılar hareket eder 6.Çevresel uyarılara tepki gösterir 7.Büyür ve gelişir (Organizasyon) 8.Üreme
1 CANLILARIN ORTAK ÖZELLİKLERİ 1.Hücresel yapıdan oluşur 2.Beslenir 3.Solunum yapar 4.Boşaltım yapar 5.Canlılar hareket eder 6.Çevresel uyarılara tepki gösterir 7.Büyür ve gelişir (Organizasyon) 8.Üreme
11. SINIF KONU ANLATIMI 42 SİNDİRİM SİSTEMİ 1 SİNDİRİM SİSTEMİ ORGANLARI
 11. SINIF KONU ANLATIMI 42 SİNDİRİM SİSTEMİ 1 SİNDİRİM SİSTEMİ ORGANLARI Canlılar hayatsal faaliyetlerini gerçekleştirebilmek için ATP ye ihtiyaç duyarlar. ATP yi ise besinlerden sağlarlar. Bu nedenle
11. SINIF KONU ANLATIMI 42 SİNDİRİM SİSTEMİ 1 SİNDİRİM SİSTEMİ ORGANLARI Canlılar hayatsal faaliyetlerini gerçekleştirebilmek için ATP ye ihtiyaç duyarlar. ATP yi ise besinlerden sağlarlar. Bu nedenle
Sıkı bağ dokusu yapısında parankimi yada dalak pulpasını. birbiriyle devamlılık gösteren bölümlere ayıran trabekulaların
 Sıkı bağ dokusu yapısında parankimi yada dalak pulpasını birbiriyle devamlılık gösteren bölümlere ayıran trabekulaların uzandığı fibroelastik bir kapsülle sarılıdır. Dalağın orta çizgisindeki hilumda kapsül
Sıkı bağ dokusu yapısında parankimi yada dalak pulpasını birbiriyle devamlılık gösteren bölümlere ayıran trabekulaların uzandığı fibroelastik bir kapsülle sarılıdır. Dalağın orta çizgisindeki hilumda kapsül
Bağ doku. Mezodermden köken alır. En Yaygın bulunan dokudur ( Epitel, Kas, Kemik sinir)
 Bağ doku Mezodermden köken alır En Yaygın bulunan dokudur ( Epitel, Kas, Kemik sinir) Bağ dokunun Fonksiyonları Diğer organ ve dokuların Fonksiyonal ve yapısal desteğini sağlar. kan damarları aracılığı
Bağ doku Mezodermden köken alır En Yaygın bulunan dokudur ( Epitel, Kas, Kemik sinir) Bağ dokunun Fonksiyonları Diğer organ ve dokuların Fonksiyonal ve yapısal desteğini sağlar. kan damarları aracılığı
Mayoz ve Eşeyli Üreme Biyoloji Ders Notları
 A. Mayoz Bölünme Mayoz ve Eşeyli Üreme Biyoloji Ders Notları Eşeyli üremenin temelidir. Eşey ana hücrelerinden (2n), eşey hücrelerini (n) oluşturan özelleşmiş bölünme şeklidir. Mayoz I ve II olarak birbirini
A. Mayoz Bölünme Mayoz ve Eşeyli Üreme Biyoloji Ders Notları Eşeyli üremenin temelidir. Eşey ana hücrelerinden (2n), eşey hücrelerini (n) oluşturan özelleşmiş bölünme şeklidir. Mayoz I ve II olarak birbirini
Hücre canlının en küçük yapı birimidir.
 Hücre canlının en küçük yapı birimidir. Bitkilerde bulunan hücredir.bu hücrelerde hücre duvarı bulunduğundan hayvan hücresinden ayrılır. Hücre duvarı vardır. Kofulu büyük ve az sayıdadır. Şekli dikdörtgen
Hücre canlının en küçük yapı birimidir. Bitkilerde bulunan hücredir.bu hücrelerde hücre duvarı bulunduğundan hayvan hücresinden ayrılır. Hücre duvarı vardır. Kofulu büyük ve az sayıdadır. Şekli dikdörtgen
(ZORUNLU) MOLEKÜLER İMMÜNOLOJİ I (TBG 607 TEORİK 3, 3 KREDİ)
 T. C. İSTANBUL BİLİM ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ TIBBİ BİYOLOJİ VE GENETİK ANABİLİM DALI YÜKSEK LİSANS PROGRAMI 2015-2016 EĞİTİM-ÖĞRETİM YILI DERS İÇERİKLERİ I. YARIYIL (ZORUNLU) MOLEKÜLER
T. C. İSTANBUL BİLİM ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ TIBBİ BİYOLOJİ VE GENETİK ANABİLİM DALI YÜKSEK LİSANS PROGRAMI 2015-2016 EĞİTİM-ÖĞRETİM YILI DERS İÇERİKLERİ I. YARIYIL (ZORUNLU) MOLEKÜLER
Konu: Mitoz Bölünme ve Eşeysiz Üreme
 Konu: Mitoz Bölünme ve Eşeysiz Üreme Hücre bölünmesi tüm canlılarda görülen ortak bir özelliktir. Hücre büyüyüp gelişirken madde ve enerji gereksinimleri artar. Sitoplâzma hücre zarına oranla daha hızlı
Konu: Mitoz Bölünme ve Eşeysiz Üreme Hücre bölünmesi tüm canlılarda görülen ortak bir özelliktir. Hücre büyüyüp gelişirken madde ve enerji gereksinimleri artar. Sitoplâzma hücre zarına oranla daha hızlı
HÜCRE. Dicle Aras. Hücre bölünmesi, madde alışverişi ve metabolizması
 HÜCRE Dicle Aras Hücre bölünmesi, madde alışverişi ve metabolizması Hücre Bölünmesi Hücre bölünme ve çoğalması iki şekilde gerçekleşir. Vücut soma hücrelerinin bölünme ve çoğalma biçimi Mitoz (mitosis),
HÜCRE Dicle Aras Hücre bölünmesi, madde alışverişi ve metabolizması Hücre Bölünmesi Hücre bölünme ve çoğalması iki şekilde gerçekleşir. Vücut soma hücrelerinin bölünme ve çoğalma biçimi Mitoz (mitosis),
YGS YE HAZIRLIK DENEMESi #4
 YGS YE HAZIRLIK DENEMESi #4 1) Bir hücrenin X maddesini difüzyonla almakta olduğu görülmüştür. Bu hücre ve içerisinde bulunduğu ortamla ilgili, I. Ortamdaki X yoğunluğu hücreden daha fazladır. II. X in
YGS YE HAZIRLIK DENEMESi #4 1) Bir hücrenin X maddesini difüzyonla almakta olduğu görülmüştür. Bu hücre ve içerisinde bulunduğu ortamla ilgili, I. Ortamdaki X yoğunluğu hücreden daha fazladır. II. X in
Kalbin Kendi Damarları ve Kan kaynakları; Koroner Damarlar
 Kalbin Kendi Damarları ve Kan kaynakları; Koroner Damarlar Kalp kası beyinden sonra en fazla kana gereksinim duyan organdır. Kalp kendini besleyen kanı aortadan ayrılan arterlerden alır. Bu arterlere koroner
Kalbin Kendi Damarları ve Kan kaynakları; Koroner Damarlar Kalp kası beyinden sonra en fazla kana gereksinim duyan organdır. Kalp kendini besleyen kanı aortadan ayrılan arterlerden alır. Bu arterlere koroner
GENİTAL SİSTEM EMBRİYOLOJİSİ
 GENİTAL SİSTEM EMBRİYOLOJİSİ Prof. Dr. Bülent AHISHALI İstanbul Tıp Fakültesi Histoloji ve Embriyoloji Anabilim Dalı Primordial germ hücreleri 2. haftada epiblastta oluşur 3. haftada yolk kesesi duvarına
GENİTAL SİSTEM EMBRİYOLOJİSİ Prof. Dr. Bülent AHISHALI İstanbul Tıp Fakültesi Histoloji ve Embriyoloji Anabilim Dalı Primordial germ hücreleri 2. haftada epiblastta oluşur 3. haftada yolk kesesi duvarına
KAS DOKUSU. Prof.Dr. Ümit TÜRKOĞLU
 KAS DOKUSU Prof.Dr. Ümit TÜRKOĞLU 1 Kas dokusu, kimyasal enerjiyi mekanik enerjiye dönüştürerek hareketi sağlayan bir dokudur. Toplam vücut ağırlığının Yenidoğanda % 25 Genç erişkin dönemde % 40 ve yaşlılık
KAS DOKUSU Prof.Dr. Ümit TÜRKOĞLU 1 Kas dokusu, kimyasal enerjiyi mekanik enerjiye dönüştürerek hareketi sağlayan bir dokudur. Toplam vücut ağırlığının Yenidoğanda % 25 Genç erişkin dönemde % 40 ve yaşlılık
İstanbul Tıp Fakültesi Tıbbi Biyoloji ABD Prof.Dr. Filiz AYDIN
 İstanbul Tıp Fakültesi Tıbbi Biyoloji ABD Prof.Dr. Filiz AYDIN G1 kromozomu S sonu G2 kromozomu Genler Sentromer Kardeş kromatid Dublike olmamış Dublike olmuş Mitoza girerken kromozomlar iki kromatid halindedir.
İstanbul Tıp Fakültesi Tıbbi Biyoloji ABD Prof.Dr. Filiz AYDIN G1 kromozomu S sonu G2 kromozomu Genler Sentromer Kardeş kromatid Dublike olmamış Dublike olmuş Mitoza girerken kromozomlar iki kromatid halindedir.
DÖNEM 2- I. DERS KURULU AMAÇ VE HEDEFLERİ
 DÖNEM 2- I. DERS KURULU AMAÇ VE HEDEFLERİ Kan, kalp, dolaşım ve solunum sistemine ait normal yapı ve fonksiyonların öğrenilmesi 1. Kanın bileşenlerini, fiziksel ve fonksiyonel özelliklerini sayar, plazmanın
DÖNEM 2- I. DERS KURULU AMAÇ VE HEDEFLERİ Kan, kalp, dolaşım ve solunum sistemine ait normal yapı ve fonksiyonların öğrenilmesi 1. Kanın bileşenlerini, fiziksel ve fonksiyonel özelliklerini sayar, plazmanın
SANKO ÜNİVERSİTESİ TIP FAKÜLTESİ EĞİTİM-ÖĞRETİM YILI DERS KURULU 102: HÜCRE VE DOKU SİSTEMLERİ
 Ders Kurulu Başkanı: Prof. Dr. Şahin A. Sırmalı / Histoloji ve Embriyoloji Başkan Yardımcıları: Doç. Dr. Ayşegül Çört / Tıbbi Biyokimya / Üyeler: Prof. Dr. İlker Saygılı / Tıbbi Biyokimya / / Dersin AKTS
Ders Kurulu Başkanı: Prof. Dr. Şahin A. Sırmalı / Histoloji ve Embriyoloji Başkan Yardımcıları: Doç. Dr. Ayşegül Çört / Tıbbi Biyokimya / Üyeler: Prof. Dr. İlker Saygılı / Tıbbi Biyokimya / / Dersin AKTS
ERİŞKİN ERKEK SIÇANLARDA METOTREKSAT KAYNAKLI TESTİS HASARINDA KURKUMİNİN ETKİSİ
 T.C. ESKİŞEHİR OSMANGAZİ ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ HİSTOLOJİ VE EMBRİYOLOJİ ANABİLİM DALI ERİŞKİN ERKEK SIÇANLARDA METOTREKSAT KAYNAKLI TESTİS HASARINDA KURKUMİNİN ETKİSİ YÜKSEK LİSANS TEZİ
T.C. ESKİŞEHİR OSMANGAZİ ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ HİSTOLOJİ VE EMBRİYOLOJİ ANABİLİM DALI ERİŞKİN ERKEK SIÇANLARDA METOTREKSAT KAYNAKLI TESTİS HASARINDA KURKUMİNİN ETKİSİ YÜKSEK LİSANS TEZİ
D.Ü TIP FAKÜLTESİ DERS YILIDÖNEM II ÜROGENİTAL SİSTEM VE HASTALIKLARIN BİOLOJİK TEMELLERİ DERS KURULU. Doç.Dr.
 D.Ü TIP FAKÜLTESİ 2012-2013 DERS YILIDÖNEM II ÜROGENİTAL SİSTEM VE HASTALIKLARIN BİOLOJİK TEMELLERİ DERS KURULU Doç.Dr.Engin DEVECİ ERKEK GENİTAL SİSTEMİ HİSTOLOJİSİ TESTİS Testis Testis içi genital kanallar
D.Ü TIP FAKÜLTESİ 2012-2013 DERS YILIDÖNEM II ÜROGENİTAL SİSTEM VE HASTALIKLARIN BİOLOJİK TEMELLERİ DERS KURULU Doç.Dr.Engin DEVECİ ERKEK GENİTAL SİSTEMİ HİSTOLOJİSİ TESTİS Testis Testis içi genital kanallar
GELİŞİMİN 1. VE 2. HAFTASI
 GELİŞİMİN 1. VE 2. HAFTASI (Fertilizasyon, Segmentasyon, İmplantasyon ve Bilaminar disk) PROF. DR. İSMAİL SEÇKİN FERTİLİZASYON A ) Germ hücrelerinin fertilizasyon bölgesine taşınması Oositin ampullaya
GELİŞİMİN 1. VE 2. HAFTASI (Fertilizasyon, Segmentasyon, İmplantasyon ve Bilaminar disk) PROF. DR. İSMAİL SEÇKİN FERTİLİZASYON A ) Germ hücrelerinin fertilizasyon bölgesine taşınması Oositin ampullaya
