Merhabalar, Öncelikle Klinik Farmakoloji Çalışma Grubu na benimle bağlantı kurdukları ve üyeliğe kabul ettikleri için çok teşekkür ederim.
|
|
|
- Yavuz Bulut
- 8 yıl önce
- İzleme sayısı:
Transkript
1 Merhabalar, Öncelikle Klinik Farmakoloji Çalışma Grubu na benimle bağlantı kurdukları ve üyeliğe kabul ettikleri için çok teşekkür ederim. Umarım grup aracılığı ile ülkemizde gelişiminden büyük mutluluk duyduğum klinik farmakoloji konusunda artan bilinç ve organizasyonlara gelecekte daha aktif katkım olabilir. Bültenimizdeki ilk yazımda Türkiye'de ilgili tartışmaları uzaktan takip ettiğim bir konu olan ve su an görev aldığım İsveç te klinik ilaç araştırmalarının değerlendirilmesi ve onayından bahsetmek istedim. Medical Product Agency (MPA), lokal adıyla Läkemedelsverket, İsveç in Uppsala şehrinde yer alan, ülkede ilaçlar, tıbbi teknik ve doğal ürünlerin kontrol ve onayından sorumlu resmi kurum olup hastaların ve sağlık kuruluşlarının güvenli ve etkin ürünleri amaç ve ticari değerlerine uygun kullanımını sağlamak üzere çalışmaktadır. Kurumda çoğunluğu eczacı, doktor ve çeşitli konularda doktora yapmış uzmanlar olmak üzere yaklaşık 600 kişi görevlidir. Benim görev aldığım birim, Klinik Çalışmalar ve Lisanslar, klinik ilaç araştırmaları ve lisans başvurularının değerlendirildiği ve onaylandığı, klinisyenler, eczacılar, preklinik araştırmacıları ve asistanlarıyla 28 kişilik bir ekipten oluşmaktadır. Ayrıca tıbbi teknik ürünlerin denendiği çalışmalar da tıbbi teknik birimiyle ortak olarak onaylanmaktadır (1). Klinik ilaç araştırmaları bir ilacın klinik, farmakokinetik ya da farmakodinamik etkilerinin ortaya çıkarılması veya doğrulanmasını amaçlayan sistematik incelemelerdir. Bu çalışmaların amacı ilaçların muhtemel yan etkilerini saptamak, güvenliliğini ve etkililiğini tayin edebilmek için emilim, dağılım, metabolizma veya atılımlarının incelenmesi de olabilir. İsveç'te insanlar üzerinde yapılacak, prospektif, gözlemsel çalışmalar hariç bütün ilaç çalışmaları için MPA dan izin alınması zorunludur. Bu izni almaksızın çalışma başlatan veya yürütmekte olan araştırıcılar için kanun hükmünde yaptırımlar söz konusudur. Çalışılan ilaç ruhsatsız veya ruhsatlı olabildiği gibi ek etki ve/veya güvenlilik değerlendirimi, farklı farmasötik form veya ruhsatlı olduğundan farklı bir endikasyon için deneniyor olabilir. Gözlemsel çalışmalar halen tartışılıyor ve farklı ülkelerde farklı yorumlanabiliyor olsa da ilacın ruhsatına uygun kullanımının söz konusu olduğu ve tedavi şemasına 1
2 çalışma protokolüne göre karar verilmeyen, yani tedavinin çalışmaya dahil olma kararından ayrı olarak yapılacağı, ek tanı veya denetleme gerektirmeyen ve data analizi için daha çok epidemiyolojik metodlarin kullanıldığı çalışmalar olarak tanımlanmaktadır. Tıbbi teknik ürünler ise bir hastalığın veya tıbbi engelin tanı, tedavi veya önlenmesinde, anatomik veya fizyolojik bir prosesin incelenmesi veya değiştirilmesinde ya da fertilizasyon için kullanılan ürünler olarak tanımlanmaktadır. MPA ya son 10 yıl içerisinde gelen klinik ilaç araştırma başvurularının sayısı yıllık ortalama 450 civarındayken son zamanlarda Avrupa Birliği içerisinde azalış gösteren trende paralel olarak kurumumuza 2010 yılında toplam 335 çalışma için başvuru yapılmıştır. Avrupa Birliği içerisinde klinik ilaç araştırmalarının azalmasının sebepleri arasında son yıllarda yaşanan ekonomik krizin yansıması, klinik faz çalışmaları ve piyasada kullanıma ulaşabilen ilaç sayısındaki azalma, faz I çalışmalarının modifikasyonlar ve kombinasyonlar nedeniyle seyreltilmesi, çalışmaların masraflar, daha istekli araştırıcı ve hasta potansiyeli nedeniyle başka coğrafi alanlara kaydırılması, yeni tip ilaçların piyasaya ulaşma zamanının uzaması, faz 4 çalışmalarının gözlemsel çalışmalarla yer değiştirmesi gibi nedenlerin bulunduğu düşünülmektedir. Kurumumuza ulaşan ve geçerli olarak kabul edilen klinik araştırma başvuruları klinik, preklinik, istatistik, kinetik ve araştırmada denenen ürüne bağlı olarak eczacı veya biyoteknoloji incelemesi için ilgili uzmanlara dağıtılır. İlk değerlendirmeler en geç 30 gün içerisinde tamamlanarak başvurunun kabul edildiği veya değiştirilmesi, tamamlanması gereken kısımlar olduğu takdirde ilgili yorumlar başvuranlara iletilir ve ilgili soruların cevaplandığı ve beklenen değişikliklerin yapılmış olduğu dokümanların kurumumuza ulaştırılması rica edilir. Bu tamamlayıcı başvuru sonrasındaki değerlendirmeler de ilk başvuruyu takiben 60 gün içerisinde sonlandırılır yılı içerisinde kurumumuza yapılan 335 başvurudan %32 si primer değerlendirmede (30. gün), %64 u tamamlayıcı değişiklikler sonrasında kabul edilmiş (60. gün), %3 ü bilimsel nedenlerle geri çevrilmiş ve %1 i de yönetimsel olarak reddedilmiştir. Tamamlayıcı bilgilerin en sık istendiği konular arasında toksikoloji, fotosensitivite, etkilendirme ve GMP lisansı (iyi imalat prosedürü), doz, çalışmaya dahil etme ve etmeme kriterleri bulunmaktadır. Başvurular için ilgili destek gerek başvurular sırasında gerekse bilimsel danışma için başvurulduğu takdirle ilacın gelişim programı ve/veya protokol düzeyinde tarafımızdan sağlanmakta olup gerekse websayfamız aracılığıyla ayrıntılı açıklamalarla sağlanmıştır. Ayrıca Avrupa İlaç Ajansı (EMA, European Medicines Agency) ve insanlar için tıbbi ürünler komitesi (CHMP, Committee for Medicinal Products for Human Use) tarafından sağlanan hastalıklar veya klinik çalışmalar ile ilgili kılavuzlar ve görüş makalelerinin de dikkate alınması tavsiye edilir (2). 2
3 Klinik çalışmaların güvenli, değerlendirilebilir ve klinik olarak anlamlı bir soruya cevap olması temel beklentilerdir. Şu anki yönetmelik Avrupa komisyonunun klinik araştırmalar direktifi 2001/20/EC (3) olup 2012 yılına kadar güncelleştirilmesinin tamamlanması öngörülmekte, ayrıca Avrupa Birliği içerisinde klinik ilaç çalışmaları ile ilgili olarak şeffaflığın arttırılması amacıyla EUDRA-CT veritabanının kamuya açık hale getirilmesi planlanmıştır. 1 Mayıs 2004 sonrasında insanlar üzerinde yapılan klinik ilaç araştırmaları için başvuru ve değerlendirmelerde Avrupa Birliği içerisinde ortak ilkeler benimsenmiştir. Üye ülkeler arasında harmonizasyonun iyileştirilmesine ve endüstrinin isteği üzerine birlik içerisinde çok merkezli çalışmalar için ortak onay verilmesine, yıllık güvenlilik raporlarının yeni formatının (DSUR, developmental safety update report) geliştirilmesine çalışılmaktadır. Ayrıca yeni ilaç adaylarının insanlar üzerinde ilk kez denendiği çalışmalar için (FTIM, first time in man) titiz bir inceleme yapılmakta olup bu çalışmalarda güvenliğin optimizasyonu amacıyla insanlar için tıbbi ürünler komisyonu (CHMP, Committee for Medicinal Products for Human Use) tarafından temel ilkeler belirlenmiş ve ilgili bir kılavuz hazırlanmıştır (4). Klinik çalışmalar için yapılacak başvurularda zorunlu dokümantasyon içerisinde; *Başvuru mektubu ve formu *ICH-GCP (International Conference on Harmonisation - Good Clinical Practice) ile uyumlu çalışma protokolü *Araştırıcı broşürü (IB, investigator s brochur), araştırılan tıbbi ürün dosyası (IMPD, Investigational Medicinal Product Dossier) veya ürün karakteristik özeti (SPC, summary of product characteristics) *İlaç etiket metni *Etik kurul izni (15 gün içerisinde yapılmış başvuru) almakta, *Ve eğer varsa bilimsel danışma kurulunun görüşü, pediatrik araştırma planı, aynı ilacın denendiği diğer klinik çalışmalar ve ilaç ruhsatlandırma komisyonları ile ilgili bilgi ve ilaç paketi üzerinde yer alacak metinin de eklenmesi tercihen beklenmektedir. Tıbbi teknik çalışmalarında ise; *Klinik araştırıcı broşürü (CIB) *Klinik araştırma planı (CIP) *Ana taleplere uyulduğuna dair güvence *Etik kurul onayı veya başvurunun yapıldığını gösterir belge *Sigorta ile ilgili dokuman *Ürünün işaretlendiği metin *Araştırıcının özgeçmişi 3
4 *Varsa karsılaştırılan ürün ile ilgili dokümantasyon *Birlikte kullanılan ilaç ile ilgili bilgi (örneğin SPC). 30 Mart 2010 tarihli Avrupa Komisyonunun klinik araştırmalar konusundaki ayrıntılı yönetmeliği ( detailed guidance ) sonrasında ilgili resmi kurum ile etik komiteleri arasında klinik ilaç araştırmalarının değerlendirilmesi konusundaki görev ayırımı da biraz daha netleşmiştir. Bu yönetmeliğe göre ülkeye spesifik talepler mümkün olmayacak ve klinik ilaç çalışma başvuruları elektronik olarak yapılacaktır. Referans güvenlilik bilgisinin nerede bulunacağının (araştırıcı broşürü veya ürün karakteristik özeti) bir mektupla bildirilmesi, çalışma protokolünün mutlaka bir özet içermesi, protokolün içerisinde çalışmaya ve çalışılan ilaca dair risk/yarar değerlendirmesinin yapıldığı veya hastaların çalışmaya nasıl dahil edileceği ve bilgilendirilmiş olurlarının nasıl alınacağı gibi (her ne kadar İsveç te bilinci kapalı hastalar üzerinde çalışma yapılması mümkün olmasa da bu kısım özellikle bilgilendirilmiş olur veremeyecek durumda olan hastalar için belirlenmiştir) ek bölümler talep edilmektedir. Çalışma sponsoru çalışmanın bitimini takiben örneğin uzatılmış takip gibi önemli protokol düzeltmelerini (substantial amendment) bildirebilecektir. Söz konusu ayrıntılı yönetmelikte ayrıca çalışma protokollerinde yapılan ve bildirilmesi zorunlu düzeltmelerin (substantial amendments) tanımı, hangi kuruma bildirileceği netleştirilmiştir. Böylece etik kurullar tarafından onaylanmış olan protokol değişikliklerinin bilgilendirme amaçlı olarak kurumumuza gönderilmemesi, araştırıcıların ve araştırma merkezlerinin yeterliliği, hasta bilgilendirilmesi ve bilgilendirilmiş olur formlarının da sadece etik kurullarca değerlendirilmesi beklenmektedir (5). Çalışma protokolünde yapılan önemli düzeltmelerin (substantial amendments) de kurumumuza bildirilmesi ve onay alınması gerekmektedir. Bu başvurular ile ilgili kararlar da başvurudan sonraki 35 gün içerisinde sponsora bildirilmektedir. İlgili düzeltmeler sadece başvurunun onaylanması halinde yürürlüğe konulabilir. Bu konuda uygulanan yönetmelik, 2001/20/EC yönetmeliğini kapsayan ve destekleyen, ayrıca tıbbi ürünlerin denendiği klinik çalışmaların, önemli düzeltmelerin ve çalışma sonlandırılmasının ilgili makamlarca onayını düzenleyen ayrıntılı yönetmeliktir. Önemli düzeltmeler çalışmaya katılanların güvenliğini, fiziksel veya zihinsel sağlamlığını (risk/yarar oranı) veya çalışmanın bilimsel değerini etkileyen değişiklikler olarak tanımlanır. Değişikliğin bu tanıma uyup uymadığının kararı sponsora ait olup bu konuda ilgili resmi kurum ücretsiz olarak ve gecikmeksizin görüş bildirmelidir. Buna göre örneğin araştırıcı broşürünün yıllık güncelleştirilmesi eğer risk/yarar oranını değiştirmiyorsa önemli bir düzeltme olarak sınıflandırılmamaktadır. Bunun yanında sponsor yapılan düzeltmelerin ilgili klinik çalışmanın tamamen yeni bir çalışma olarak değerlendirilip değerlendirilmeyeceğinin de bilincinde olmalıdır ki bu durumda yeni bir başvuru yapılması daha uygundur. Önemli değişikliklerle ilgili olarak sponsor protokol numarası, çalışma 4
5 başlığı ve sponsorun değişikliği identifiye eden özgün kodlamasını içeren, imzalı başvuru mektubu ile ilgili düzeltme başvuru formu düzeltmelerin listesi, sebebi, çalışmanın EudraCT numarası, ve eğer düzeltme birden çok çalışmayı etkiliyorsa EudraCT numaraları ve düzeltme kodları bildirilmelidir. Düzeltmenin tanımının protokolün önceki ve yeni versiyonunun değişikliklerin ayrıntılı olarak gösterildiği ve sadece değişikliklerin gösterildiği dokümantasyonlarla sağlanması, ayrıca protokolün yeni versiyonunun da tarih ve versiyon numarasıyla bildirilmesi gerekmektedir. Klinik çalışmalarda gözlenen yan etkilerin bildirilmesi sponsorun sorumluluğunda olup ilgili resmi kuruma yıllık güvenlilik raporu şeklinde ve/veya şüpheli beklenmeyen ciddi reaksiyonların (SUSARs, suspected unexpected serious adverse reactions) daha acil olarak rapor edildiği şekilde uygulanabilmektedir (6). SUSAR görülen hastaların güvenliliğinin takibi ve değerlendirilmesi mutlaka yapılmalıdır. Eğer yıllık güvenlilik raporu birden fazla çalışma protokolünü kapsıyorsa ilgili EudraCT numaralarının da başvuruda bildirilmesi zorunludur. SUSAR tipi yan etkilerin ayrıca sponsor veya temsilcisi tarafından EudraVigilance veritabanına girilmesi zorunludur. Ticari olmayan ve kısıtlı ekonomisi olan sponsorlar için SUSAR rapor edilmesinde MPA yardımcı olmaktadır. Ayrıca şimdiden kurumumuz tarafından DSUR (developmental safety update report) formatındaki yan etki raporları kabul edilmeye başlanmıştır (7). Lisans sistemi İsveç te piyasada olmayan veya ruhsatlandırılmamış olmasına rağmen onaylı alternatifinin yokluğu nedeniyle sağlık kurumlarında kullanımına ihtiyaç duyulan ilaçların reçete edilebilmesine olanak veren ulusal bir uygulama olup farklı Avrupa ülkelerinde farklı uygulamaları vardır. Kısaca lisans bir eczanenin ruhsatsız bir ilacı izin verilen bir hastanın reçetesi karşılığında temin etmesine izin verir. Her hasta ve her eczane için ayrıca başvurulması beklenmekte, ilgili karar da bu bazda ilgili eczaneye bildirilmektedir. MPA nın bu uygulaması oldukça kısa bir süre içerisinde gerçekleştirilmekte olup başka ülkelerde bulunabilen named patient basis programının benzeridir. Veterinerlikte kullanılan ilaçlar için de herhangi bir klinikte tedavi edilen hayvanlar için bu iznin verilmesi mümkündür. Bu uygulamanın Türkiye'de olup olmadığı hakkında bir bilgiye henüz maalesef ulaşamadım. Başvuru prosedürü sürecinde herhangi bir hekim tarafından yazılan reçeteye dayanarak ilgili eczane öncelikle ilacın teminini kontrol eder ve elektronik başvuru formunu doldurup MPA ya başvuruda bulunur. MPA her başvuru için vakaya özel olarak hekimler veya veteriner hekimlerin görüş bildirdiği ve yürürlükteki mevzuata göre bir değerlendirmede bulunur ve eğer kabul edilebilir standartlar varsa (GMP, farmasötik kalite gibi) bu iznin verilmesi mümkün olabilir. Bu iznin geçerliliği bir yıl olup, reçete eden hekim hastayı bilgilendirmekle ve ilacın muhtemel yan etkilerini kurumuna bildirilmekle sorumludur. Bu sistem ancak kısıtlanmış şartlar altında ve vaka spesifik 5
6 olan bu uygulama ancak ruhsatlı bir alternatifin bulunmadığı ve mutlaka gerekli görülen tedaviler için kullanılabilir. İnsani amaçlı ilaca erken ulaşım programı (CUP, Compessionate Use Programme) Avrupa Birliği içerisinde henüz ruhsatlandırılmamış ancak etkililiği gösterilmiş bir ilacın başka tedavi alternatifi olmayan, yaşamı tehdit eden, kronik veya ciddi sakatlığa yol açan hastalığı olan, fakat bu ilaçla yapılan klinik çalışmalara katılması mümkün olmayan hastalara ulaştırılabilmesine olanak sağlayan bir uygulamadır. İnsani amaçlı ilaca erken ulaşım programı için basvurulabilecek ilacın güvenliliği ile ilgili bilgiler ilacın içinde bulunduğu geliştirilme aşamasına bağlı olarak sınırlı olabilir. Ancak toksisite ve farmakokinetik çalışmalarının tamamlanmış ve analiz edilmiş olması gerekir. Bununla birlikte hastalara verilecek en iyi doz aralığı ve sıklığı, ilacın güvenlilik profili konusunda hala belirsizlikler söz konusu olabilir. Program üye ülkeler tarafından koordine edilmekte ve uygulanmakta olup, böyle bir programın ne zaman ve nasıl başlatılacağı üye ülkelerin ulusal yasalarıyla bağımsız olarak düzenlenir. Avrupa İlaç Ajansı EMA nın insanlar için ilaçlar komitesi CHMP üye ülkelere insani amaçla erken erişilebilen ilaçların nasıl kullanılacağı ve dağıtılacağı konusunda tavsiyede bulunabilir ve hangi hastaların tedaviden faydalanabileceğinin tayininde yardımcı olabilir. Komite bu tavsiyeleri üye ülkenin isteği üzerine sağlayacak olup bu tavsiyeler üye ülkenin ulusal yasalarının gerektirdiklerinin yerini alamaz. Program en az iki hasta için başlatılabilir ve bu program aracılığı ile bu durumdaki hastalarını tedavi etmek isteyen hekimler ilgili resmi kuruma başvurarak gerekli prosedürü takip etmek ve herhangi bir yan etki görüldüğünde ilgili resmi kuruma bildirmekle yükümlüdürler. Avrupa İlaç Ajansı nın bu konudaki düzenlemeye (Article 83 of Regulation (EC) No 726/2004) uygun kılavuzuna ajansın websayfasından ulaşılabilir (8). Bu program Türkiye de de yürürlükte olup ilgili kılavuza İlaç Eczacılık Genel Müdürlüğü nün web sayfasından ulaşılabilir (9). İsveç te bu program ile ilgili düzenleme ve kılavuz henüz yürülüğe girmemiş olup, bu konudaki hazırlıklar devam etmektedir. Bu süre zarfında CUP ile ilgili yapılan başvurular klinik çalışmalar ve lisanslar çerçevesinde değerlendirilmektedir. Umuyorum ki bu makaleyle Türkiye de ve diğer Avrupa Ülkeleri nde benzer uygulamaları olan klinik ilaç araştırmaları ve ilgili diğer uygulamaların resmi kurumlarda nasıl değerlendirildiği konusunda özet bilgi verebilmişimdir. Değerli meslektaşlarımın soruları olursa benimle bağlantı kurmalarını rica eder, iyi calışmalar dilerim. Selamlar, Arzu Güneş Granberg 6
7 Referanslar: regulatory.jsp&murl=menus/regulations/regulations.jsp&mid=wc0b01ac058001ff Detailed guidance for the request for authorisation of a clinical trial on a medicinal product for human use to the competent authorities, notification of substantial amendments and declaration of the end of the trial 6. df jsp&murl=menus/regulations/regulations.jsp&mid=WC0b01ac058007e
FARMAKOVİJİLANS. İlaç Endüstrisinde İlaç Güvenliliği İzlemi: Uygulama Örnekleri
 FARMAKOVİJİLANS İlaç Endüstrisinde İlaç Güvenliliği İzlemi: Uygulama Örnekleri Ecz. Neslihan Gülenoğlu Pfizer İlaçları Ltd.Şti Ürün Güvenliği Sorumlusu 16/12/2005 16/12/2005 Gündem Farmakovijilans Organizasyonu
FARMAKOVİJİLANS İlaç Endüstrisinde İlaç Güvenliliği İzlemi: Uygulama Örnekleri Ecz. Neslihan Gülenoğlu Pfizer İlaçları Ltd.Şti Ürün Güvenliği Sorumlusu 16/12/2005 16/12/2005 Gündem Farmakovijilans Organizasyonu
İNSANİ AMAÇLI İLACA ERKEN ERİŞİM PROGRAMI KILAVUZU - Sağlık Bakanlığı Çarşamba, 26 Ekim :49 - Son Güncelleme Çarşamba, 26 Ekim :49
 İNSANİ AMAÇLI İLACA ERKEN ERİŞİM PROGRAMI KILAVUZU (Sağlık Bakanlığı İlaç ve Eczacılık Genel Müdürlüğü Ekim 2005) COMPASSIONATE USE Tanım Bu program ülkemizde, Bakanlıkça ruhsatlandırılmış ve ulaşılabilir
İNSANİ AMAÇLI İLACA ERKEN ERİŞİM PROGRAMI KILAVUZU (Sağlık Bakanlığı İlaç ve Eczacılık Genel Müdürlüğü Ekim 2005) COMPASSIONATE USE Tanım Bu program ülkemizde, Bakanlıkça ruhsatlandırılmış ve ulaşılabilir
Prof.Dr. Şule Kalkan Dokuz Eylül Üniversitesi Tıp Fakültesi Tıbbi Farmakoloji Anabilim Dalı Klinik Toksikoloji Bilim Dalı Dokuz Eylül Üniversitesi
 Prof.Dr. Şule Kalkan Dokuz Eylül Üniversitesi Tıp Fakültesi Tıbbi Farmakoloji Anabilim Dalı Klinik Toksikoloji Bilim Dalı Dokuz Eylül Üniversitesi Klinik Araştırmalar Etik Kurulu Üyesi Klinik Araştırma
Prof.Dr. Şule Kalkan Dokuz Eylül Üniversitesi Tıp Fakültesi Tıbbi Farmakoloji Anabilim Dalı Klinik Toksikoloji Bilim Dalı Dokuz Eylül Üniversitesi Klinik Araştırmalar Etik Kurulu Üyesi Klinik Araştırma
Farklı Araştırma Türleri Ve Farklı Başvuru Dosyaları
 Farklı Araştırma Türleri Ve Farklı Başvuru Dosyaları Uzm. Meral Demir İ.Ü.İstanbul Tıp Fakültesi Tıbbi Farmakoloji Anabilim Dalı İ.Ü.İstanbul Tıp Fakültesi Klinik Araştırmalar Etik Kurulu Öğretim Üyesi
Farklı Araştırma Türleri Ve Farklı Başvuru Dosyaları Uzm. Meral Demir İ.Ü.İstanbul Tıp Fakültesi Tıbbi Farmakoloji Anabilim Dalı İ.Ü.İstanbul Tıp Fakültesi Klinik Araştırmalar Etik Kurulu Öğretim Üyesi
Gözlemsel Araştırmalar
 Ocak 2009-1 Klinik Araş+rmalar Derneği Bilgi Kaynağı İlaçla yapılan Gözlemsel Araştırmalar İlaç olmadan yapılan Gözlemsel Araştırmalar Gerekli Dökümanlar Gözlemsel Araştırmalar İçin Nasıl Başvurmalı Türkiye
Ocak 2009-1 Klinik Araş+rmalar Derneği Bilgi Kaynağı İlaçla yapılan Gözlemsel Araştırmalar İlaç olmadan yapılan Gözlemsel Araştırmalar Gerekli Dökümanlar Gözlemsel Araştırmalar İçin Nasıl Başvurmalı Türkiye
Geleneksel Bitkisel Tıbbi Ürünler. 15. Hafta
 Geleneksel Bitkisel Tıbbi Ürünler 15. Hafta Bitkisel Tıbbi Ürün Etkin madde olarak bir veya birden fazla bitkisel drog, bitkisel drog preparatı ya da bu bitkisel preparatlardan bir veya bir kaçının yer
Geleneksel Bitkisel Tıbbi Ürünler 15. Hafta Bitkisel Tıbbi Ürün Etkin madde olarak bir veya birden fazla bitkisel drog, bitkisel drog preparatı ya da bu bitkisel preparatlardan bir veya bir kaçının yer
İlaç Güvenliliğinin Sağlanmasında İlaç Sanayinin Sorumlulukları ve Prosedürler 22.Ulusal Farmakoloji Kongresi 07 Kasım 2013
 İlaç Güvenliliğinin Sağlanmasında İlaç Sanayinin Sorumlulukları ve Prosedürler 22.Ulusal Farmakoloji Kongresi 07 Kasım 2013 Selcen Erdem AIFD Ruhsat Çekirdek Grubu Başkan Yardımcısı Novartis Ruhsatlandırma
İlaç Güvenliliğinin Sağlanmasında İlaç Sanayinin Sorumlulukları ve Prosedürler 22.Ulusal Farmakoloji Kongresi 07 Kasım 2013 Selcen Erdem AIFD Ruhsat Çekirdek Grubu Başkan Yardımcısı Novartis Ruhsatlandırma
GÖZLEMSEL ÇALIŞMALAR BAŞVURU FORMU
 A. BAŞVURUNUN YAPILDIĞI YER Türkiye İlaç ve Tıbbi Cihaz Kurumu ve Klinik Araştırmalar Etik Kuruluna yapılacak olan başvurular için aynı form kullanılmalı ve ilgili kutu işaretlenmelidir. Türkiye İlaç ve
A. BAŞVURUNUN YAPILDIĞI YER Türkiye İlaç ve Tıbbi Cihaz Kurumu ve Klinik Araştırmalar Etik Kuruluna yapılacak olan başvurular için aynı form kullanılmalı ve ilgili kutu işaretlenmelidir. Türkiye İlaç ve
İLAÇ DIŞI KLİNİK ARAŞTIRMALARI BAŞVURU FORMU
 A. BAŞVURUNUN YAPILDIĞI YER Türkiye İlaç ve Tıbbi Cihaz Kurumu ve Etik Kurula yapılacak olan başvurular için aynı form kullanılmalı ve ilgili kutu işaretlenmelidir. A.1. Türkiye İlaç ve Tıbbi Cihaz Kurumu
A. BAŞVURUNUN YAPILDIĞI YER Türkiye İlaç ve Tıbbi Cihaz Kurumu ve Etik Kurula yapılacak olan başvurular için aynı form kullanılmalı ve ilgili kutu işaretlenmelidir. A.1. Türkiye İlaç ve Tıbbi Cihaz Kurumu
THE ROLE OF ETHICS COMMITTEE IN CLINICAL RESEARCH
 THE ROLE OF ETHICS COMMITTEE IN CLINICAL RESEARCH Prof. Dr. Mehmet Melli Ankara Ü. Tıp Fak. Tıbbi Farmakoloji Ab.D. Öğretim Ü. Ankara Üniversitesi Klinik Araş. Etik Kurulu Başkanı 18th International Pharmaceutical
THE ROLE OF ETHICS COMMITTEE IN CLINICAL RESEARCH Prof. Dr. Mehmet Melli Ankara Ü. Tıp Fak. Tıbbi Farmakoloji Ab.D. Öğretim Ü. Ankara Üniversitesi Klinik Araş. Etik Kurulu Başkanı 18th International Pharmaceutical
AKILCI İLAÇ KULLANIMI
 AKILCI İLAÇ KULLANIMI Sunum Planı Akılcı İlaç Kullanımı (AİK) Kavramı AİK te Paydaşlar AİK Süreç Akılcı Olmayan İlaç Kullanımı ve Problemin Boyutu Türkiye deki AİK Uygulamalarına Genel Bakış AKILCI İLAÇ
AKILCI İLAÇ KULLANIMI Sunum Planı Akılcı İlaç Kullanımı (AİK) Kavramı AİK te Paydaşlar AİK Süreç Akılcı Olmayan İlaç Kullanımı ve Problemin Boyutu Türkiye deki AİK Uygulamalarına Genel Bakış AKILCI İLAÇ
görev ve yetkilerinin tümünü veya bir kısmını yazılı bir sözleşmeyle devrettiği bağımsız kuruluşu, ifade eder. Başvuru ve bildirimlerin şekli ve
 TÜRKİYE İLAÇ VE TIBBİ CİHAZ KURUMU KOZMETİK ÜRÜN VEYA HAMMADDELERİ ÜZERİNDE YAPILAN ETKİNLİK VE GÜVENLİLİK ÇALIŞMALARI İLE KLİNİK ARAŞTIRMALARINDA BAŞVURU ŞEKLİNE İLİŞKİN KILAVUZ Amaç MADDE 1- (1) Kozmetik
TÜRKİYE İLAÇ VE TIBBİ CİHAZ KURUMU KOZMETİK ÜRÜN VEYA HAMMADDELERİ ÜZERİNDE YAPILAN ETKİNLİK VE GÜVENLİLİK ÇALIŞMALARI İLE KLİNİK ARAŞTIRMALARINDA BAŞVURU ŞEKLİNE İLİŞKİN KILAVUZ Amaç MADDE 1- (1) Kozmetik
Final Klinik Çalışma Raporlarının Hazırlanması ve Değerlendirilmesinde. Edilmesi Gereken Noktalar
 Final Klinik Çalışma Raporlarının Hazırlanması ve Değerlendirilmesinde Dikkat Edilmesi Gereken Noktalar Uz. Dr. Selda Emre Aydıngöz Serbest Tıbbi Yazar, Ankara Bir klinik araştırmanın tamamlanmasını takiben
Final Klinik Çalışma Raporlarının Hazırlanması ve Değerlendirilmesinde Dikkat Edilmesi Gereken Noktalar Uz. Dr. Selda Emre Aydıngöz Serbest Tıbbi Yazar, Ankara Bir klinik araştırmanın tamamlanmasını takiben
İLAÇ, KOZMETİK ÜRÜNLER İLE TIBBİ CİHAZLARDA RUHSATLANDIRMA İŞLEMLERİ ECZ HAFTA
 İLAÇ, KOZMETİK ÜRÜNLER İLE TIBBİ CİHAZLARDA RUHSATLANDIRMA İŞLEMLERİ ECZ 961 7. HAFTA Yeni Ürün Ruhsat Başvuru Dokümanları Common Technical Document (CTD) Başvuru Formatı Modül 1 İdari Bilgiler CTD başvuru
İLAÇ, KOZMETİK ÜRÜNLER İLE TIBBİ CİHAZLARDA RUHSATLANDIRMA İŞLEMLERİ ECZ 961 7. HAFTA Yeni Ürün Ruhsat Başvuru Dokümanları Common Technical Document (CTD) Başvuru Formatı Modül 1 İdari Bilgiler CTD başvuru
KLİNİK ARAŞTIRMALAR BAŞVURU FORMU
 A. BAŞVURUNUN YAPILDIĞI YER Türkiye İlaç ve Tıbbi Cihaz Kurumu ve Klinik Araştırmalar Etik Kuruluna veya Biyoyararlanım/Biyoeşdeğerlik Çalışmaları Etik Kuruluna yapılacak olan başvurular için aynı form
A. BAŞVURUNUN YAPILDIĞI YER Türkiye İlaç ve Tıbbi Cihaz Kurumu ve Klinik Araştırmalar Etik Kuruluna veya Biyoyararlanım/Biyoeşdeğerlik Çalışmaları Etik Kuruluna yapılacak olan başvurular için aynı form
Doç. Dr. Berna TERZİOĞLU BEBİTOĞLU
 Doç. Dr. Berna TERZİOĞLU BEBİTOĞLU Mevzuat Uygun ve güncel başvuru formu İlgili belgeler İmzalar İzin belgeleri Etik kurul: Gönüllülerin hakları, güvenliği ve esenliğinin korunması amacıyla araştırma
Doç. Dr. Berna TERZİOĞLU BEBİTOĞLU Mevzuat Uygun ve güncel başvuru formu İlgili belgeler İmzalar İzin belgeleri Etik kurul: Gönüllülerin hakları, güvenliği ve esenliğinin korunması amacıyla araştırma
Yurt Dışından İlaç Temini Ve Kullanımı Kılavuzu
 Yurt Dışından İlaç Temini Ve Kullanımı Kılavuzu YURT DIŞINDAN İLAÇ TEMİNİ VE KULLANIMI KILAVUZU Amaç MADDE 1 - (1) Bu Kılavuz, ülkemizde ruhsatlandırılmamış ve/veya ruhsatlandırıldığı hâlde çeşitli sebeplerle
Yurt Dışından İlaç Temini Ve Kullanımı Kılavuzu YURT DIŞINDAN İLAÇ TEMİNİ VE KULLANIMI KILAVUZU Amaç MADDE 1 - (1) Bu Kılavuz, ülkemizde ruhsatlandırılmamış ve/veya ruhsatlandırıldığı hâlde çeşitli sebeplerle
Yönetmelik. Yeditepe Üniversitesinden. Yeditepe Üniversitesi Klinik Araştırmalar Etik Kurulu Yönergesi
 Yönetmelik Yeditepe Üniversitesinden Yeditepe Üniversitesi Klinik Araştırmalar Etik Kurulu Yönergesi AMAÇ Madde 1- Bu yönergenin amacı, Yeditepe Üniversitesi ne bağlı tüm akademik birimlerde insanı temel
Yönetmelik Yeditepe Üniversitesinden Yeditepe Üniversitesi Klinik Araştırmalar Etik Kurulu Yönergesi AMAÇ Madde 1- Bu yönergenin amacı, Yeditepe Üniversitesi ne bağlı tüm akademik birimlerde insanı temel
KLİNİK ARAŞTIRMALARDA MERKEZ ORGANİZASYON YÖNETİMİ ESASLARINA İLİŞKİN KILAVUZ
 1. AMAÇ VE KAPSAM Bu kılavuz, Klinik Araştırmalar Hakkında Yönetmelikte Değişiklik Yapılmasına Dair Yönetmelik kapsamında ülkemizde yürütülmekte olan klinik araştırmalarda görev alan sorumlu araştırmacının,
1. AMAÇ VE KAPSAM Bu kılavuz, Klinik Araştırmalar Hakkında Yönetmelikte Değişiklik Yapılmasına Dair Yönetmelik kapsamında ülkemizde yürütülmekte olan klinik araştırmalarda görev alan sorumlu araştırmacının,
İKU Kılavuzuna Göre Klinik Araştırmalarda Taraflar ve Sorumlulukları (araştırmacı, destekleyici, Etik Kurullar)
 İKU Kılavuzuna Göre Klinik Araştırmalarda Taraflar ve Sorumlulukları (araştırmacı, destekleyici, Etik Kurullar) Prof. Dr. İlhan ÖZTOP Dokuz Eylül Üniversitesi Onkoloji Enstitüsü Klinik Araştırmalar Klinik
İKU Kılavuzuna Göre Klinik Araştırmalarda Taraflar ve Sorumlulukları (araştırmacı, destekleyici, Etik Kurullar) Prof. Dr. İlhan ÖZTOP Dokuz Eylül Üniversitesi Onkoloji Enstitüsü Klinik Araştırmalar Klinik
Dr. Şebnem Yıldırımoğlu. Mart 2015
 Dr. Şebnem Yıldırımoğlu Mart 2015 Avrupa Birliği Yasa Yapma Süreci Yeni regülasyonun amaçları Temel Adımlar Onay Süreci Onay Süreler Değişiklikler Avrupa Birliği ni klinik çalışmalar icin daha çekici
Dr. Şebnem Yıldırımoğlu Mart 2015 Avrupa Birliği Yasa Yapma Süreci Yeni regülasyonun amaçları Temel Adımlar Onay Süreci Onay Süreler Değişiklikler Avrupa Birliği ni klinik çalışmalar icin daha çekici
İmza... Tarih... Bir klinik çalışmaya başlamadan önce gönüllülerin çalışmaya alınması için gerekenlerin planlanması
 SÇP No: 5 Gönüllülerin seçilmesi ve kaydedilmesi Versiyon no: 2 Geçerlilik tarihi: Aralık 2015 Onaylayan: Prof. Dr. Hamdi Akan İmza... Tarih... I. Amaç Bir klinik çalışmaya başlamadan önce gönüllülerin
SÇP No: 5 Gönüllülerin seçilmesi ve kaydedilmesi Versiyon no: 2 Geçerlilik tarihi: Aralık 2015 Onaylayan: Prof. Dr. Hamdi Akan İmza... Tarih... I. Amaç Bir klinik çalışmaya başlamadan önce gönüllülerin
İLAÇLARIN GÜVENLİ KULLANIMI İLE İLGİLİ TEMEL KAVRAMLAR
 İLAÇLARIN GÜVENLİ KULLANIMI İLE İLGİLİ TEMEL KAVRAMLAR İlaç Beşeri Tıbbi Ürün/Ürün: Hastalığı tedavi etmek ve/veya önlemek, bir teşhis yapmak veya bir fizyolojik fonksiyonu düzeltmek, düzenlemek veya değiştirmek
İLAÇLARIN GÜVENLİ KULLANIMI İLE İLGİLİ TEMEL KAVRAMLAR İlaç Beşeri Tıbbi Ürün/Ürün: Hastalığı tedavi etmek ve/veya önlemek, bir teşhis yapmak veya bir fizyolojik fonksiyonu düzeltmek, düzenlemek veya değiştirmek
GÖNÜLLÜLER ÜZERİNDE YAPILACAK KOZMETİK ÜRÜN VEYA HAMMADDELERİNİN ETKİNLİK VE GÜVENLİLİK ÇALIŞMALARI İLE KLİNİK ARAŞTIRMALARI İÇİN BAŞVURU FORMU
 Sayfa No: 1/7 A. BAŞVURUNUN YAPILDIĞI YER Türkiye İlaç ve Tıbbi Cihaz Kurumu Kozmetik Ürünler Daire Başkanlığı ve Kozmetik Klinik Araştırmalar Etik Kuruluna yapılacak olan başvurular için aynı form kullanılmalı
Sayfa No: 1/7 A. BAŞVURUNUN YAPILDIĞI YER Türkiye İlaç ve Tıbbi Cihaz Kurumu Kozmetik Ürünler Daire Başkanlığı ve Kozmetik Klinik Araştırmalar Etik Kuruluna yapılacak olan başvurular için aynı form kullanılmalı
TIBBİ CİHAZ KLİNİK ARAŞTIRMALARI BAŞVURU REHBERİ
 TIBBİ CİHAZ KLİNİK ARAŞTIRMALARI BAŞVURU REHBERİ Bu rehberde geçen kavramlara karşılık gelen ifadeler; İyi Klinik Uygulamalar Kılavuzu, Klinik Araştırmalar Yönetmeliği ve Tıbbi Cihaz Yönetmeliklerinde
TIBBİ CİHAZ KLİNİK ARAŞTIRMALARI BAŞVURU REHBERİ Bu rehberde geçen kavramlara karşılık gelen ifadeler; İyi Klinik Uygulamalar Kılavuzu, Klinik Araştırmalar Yönetmeliği ve Tıbbi Cihaz Yönetmeliklerinde
Yeni Farmakovijilans Yönetmeliği
 Yeni Farmakovijilans Yönetmeliği Prof.Dr.Semra Şardaş Marmara Üniversitesi,Eczacılık Fakültesi TÜRKİYE DE İLAÇ GÜVENLİLİĞİ İLE İLGİLİ MEYDANA GELEN GELİŞMELER 1985 1987 2005 2010 2011 2014 Türk İlaç Advers
Yeni Farmakovijilans Yönetmeliği Prof.Dr.Semra Şardaş Marmara Üniversitesi,Eczacılık Fakültesi TÜRKİYE DE İLAÇ GÜVENLİLİĞİ İLE İLGİLİ MEYDANA GELEN GELİŞMELER 1985 1987 2005 2010 2011 2014 Türk İlaç Advers
İYİ KLİNİK UYGULAMALARI KILAVUZU
 Sayfa 1 / 5 İYİ KLİNİK UYGULAMALARI KILAVUZU [Önceki Sayfa] [Sonraki Sayfa] [İlk Sayfa] [Dokümanlar Sayfası] T.C. SAĞLIK BAKANLIĞI İlaç ve Eczacılık Genel Müdürlüğü Sayı: 51748 29 Aralık 1995 Konu: Klinik
Sayfa 1 / 5 İYİ KLİNİK UYGULAMALARI KILAVUZU [Önceki Sayfa] [Sonraki Sayfa] [İlk Sayfa] [Dokümanlar Sayfası] T.C. SAĞLIK BAKANLIĞI İlaç ve Eczacılık Genel Müdürlüğü Sayı: 51748 29 Aralık 1995 Konu: Klinik
Yıldırım Beyazıt Üniversitesi
 ÜRÜN TANITIM ELEMANLARININ YETERLİLİK BELGESİ EĞİTİM PROGRAMI DERS İÇERİKLERİ (TASLAK) 1. AKILCI İLAÇ KULLANIMI (AİK) Akılcı İlaç Kullanımı (AİK) Nedir? Akılcı Olmayan İlaç Kullanımı Nedir? AİK in ve Genel
ÜRÜN TANITIM ELEMANLARININ YETERLİLİK BELGESİ EĞİTİM PROGRAMI DERS İÇERİKLERİ (TASLAK) 1. AKILCI İLAÇ KULLANIMI (AİK) Akılcı İlaç Kullanımı (AİK) Nedir? Akılcı Olmayan İlaç Kullanımı Nedir? AİK in ve Genel
DESTEKLEYİCİ VE SÖZLEŞMELİ ARAŞTIRMA KURULUŞU İLE İLGİLİ İYİ KLİNİK UYGULAMALARI DENETİMLERİNİN YÜRÜTÜLMESİNE İLİŞKİN KILAVUZ
 DESTEKLEYİCİ VE SÖZLEŞMELİ ARAŞTIRMA KURULUŞU İLE İLGİLİ İYİ KLİNİK UYGULAMALARI DENETİMLERİNİN YÜRÜTÜLMESİNE İLİŞKİN KILAVUZ 1. GİRİŞ Bu kılavuz, destekleyicinin merkezinde veya destekleyicinin araştırmayla
DESTEKLEYİCİ VE SÖZLEŞMELİ ARAŞTIRMA KURULUŞU İLE İLGİLİ İYİ KLİNİK UYGULAMALARI DENETİMLERİNİN YÜRÜTÜLMESİNE İLİŞKİN KILAVUZ 1. GİRİŞ Bu kılavuz, destekleyicinin merkezinde veya destekleyicinin araştırmayla
T.C. Sağlık Bakanlığı nın Farmakovijilans Uygulamaları
 T.C. Sağlık Bakanlığı nın Farmakovijilans Uygulamaları Uzm. Ecz. Demet Aydınkarahaliloğlu Sağlık Bakanlığı İlaç ve Eczacılık Genel Müdürlüğü ÖZET TADMER Türk İlaç Advers Etkilerini İzleme ve Değerlendirme
T.C. Sağlık Bakanlığı nın Farmakovijilans Uygulamaları Uzm. Ecz. Demet Aydınkarahaliloğlu Sağlık Bakanlığı İlaç ve Eczacılık Genel Müdürlüğü ÖZET TADMER Türk İlaç Advers Etkilerini İzleme ve Değerlendirme
Prof. Dr. Ayşen Bulut
 ETİK KURULA BAŞVURU DOSYALARI, İLGİLİ FORMLAR VE KONTROL LİSTELERİ Prof. Dr. Ayşen Bulut İstanbul Üniversitesi İstanbul Tıp Fakültesi Klinik Araştırmalar Etik Kurul Üyesi Araştırma Önerilerini Değerlendirme
ETİK KURULA BAŞVURU DOSYALARI, İLGİLİ FORMLAR VE KONTROL LİSTELERİ Prof. Dr. Ayşen Bulut İstanbul Üniversitesi İstanbul Tıp Fakültesi Klinik Araştırmalar Etik Kurul Üyesi Araştırma Önerilerini Değerlendirme
İ.Ü. ECZACILIK FAKÜLTESİ LİSANS EĞİTİMİ STAJ YÖNERGESİ
 İ.Ü. ECZACILIK FAKÜLTESİ LİSANS EĞİTİMİ STAJ YÖNERGESİ BİRİNCİ BÖLÜM Amaç, Kapsam, Dayanak ve Tanımlar Amaç Madde 1- Bu Yönergenin amacı; İstanbul Üniversitesi Eczacılık Fakültesinin vizyonu, misyonu ve
İ.Ü. ECZACILIK FAKÜLTESİ LİSANS EĞİTİMİ STAJ YÖNERGESİ BİRİNCİ BÖLÜM Amaç, Kapsam, Dayanak ve Tanımlar Amaç Madde 1- Bu Yönergenin amacı; İstanbul Üniversitesi Eczacılık Fakültesinin vizyonu, misyonu ve
İSTANBUL ÜNİVERSİTESİ ECZACILIK FAKÜLTESİ STAJ UYGULAMA İLKE VE ESASLARI
 İSTANBUL ÜNİVERSİTESİ ECZACILIK FAKÜLTESİ STAJ UYGULAMA İLKE VE ESASLARI Amaç: İstanbul Üniversitesi Eczacılık Fakültesinin vizyonu, misyonu ve ilgili yönetmeliklerle belirlenen amaç ve ilkeleri doğrultusunda
İSTANBUL ÜNİVERSİTESİ ECZACILIK FAKÜLTESİ STAJ UYGULAMA İLKE VE ESASLARI Amaç: İstanbul Üniversitesi Eczacılık Fakültesinin vizyonu, misyonu ve ilgili yönetmeliklerle belirlenen amaç ve ilkeleri doğrultusunda
Beşeri Tıbbi Ürünlerin Güvenliğinin İzlenmesi. ve Değerlendirilmesi Hakkında Yönetmelik ve Kılavuz Neler Getiriyor?
 Beşeri Tıbbi Ürünlerin Güvenliğinin İzlenmesi ve Değerlendirilmesi Hakkında Yönetmelik ve Kılavuz Neler Getiriyor? Uzm.Ecz. Demet AYDINKARAHALİLOĞLU S.B. İlaç ve Ecz. Gn. Md. Türkiye Farmakovijilans Merkezi
Beşeri Tıbbi Ürünlerin Güvenliğinin İzlenmesi ve Değerlendirilmesi Hakkında Yönetmelik ve Kılavuz Neler Getiriyor? Uzm.Ecz. Demet AYDINKARAHALİLOĞLU S.B. İlaç ve Ecz. Gn. Md. Türkiye Farmakovijilans Merkezi
ERZİNCAN ÜNİVERSİTESİ ECZACILIK FAKÜLTESİ LİSANS EĞİTİMİ STAJ DERSLERİ UYGULAMA İLKE VE ESASLARI
 ERZİNCAN ÜNİVERSİTESİ ECZACILIK FAKÜLTESİ LİSANS EĞİTİMİ STAJ DERSLERİ UYGULAMA İLKE VE ESASLARI Madde 1. Dayanak: Erzincan Üniversitesi Eczacılık Fakültesi Lisans Eğitimi Staj Dersleri Uygulama İlke ve
ERZİNCAN ÜNİVERSİTESİ ECZACILIK FAKÜLTESİ LİSANS EĞİTİMİ STAJ DERSLERİ UYGULAMA İLKE VE ESASLARI Madde 1. Dayanak: Erzincan Üniversitesi Eczacılık Fakültesi Lisans Eğitimi Staj Dersleri Uygulama İlke ve
Destekleyicinin Sorumlulukları ve Kayıt Zorunluluğu
 Destekleyicinin Sorumlulukları ve Kayıt Zorunluluğu Nurşah (Ömeroğlu) Çetinkaya NER Medikal Araştırma Danışmanlık Yönetici Ortak Klinik Araştırmalar Derneği Yönetim Kurulu Üyesi Destekleyici Bir klinik
Destekleyicinin Sorumlulukları ve Kayıt Zorunluluğu Nurşah (Ömeroğlu) Çetinkaya NER Medikal Araştırma Danışmanlık Yönetici Ortak Klinik Araştırmalar Derneği Yönetim Kurulu Üyesi Destekleyici Bir klinik
ECZACILIK FAKÜLTESİ KLİNİK ECZACILIK
 ECZACILIK FAKÜLTESİ KLİNİK ECZACILIK PROGRAM KOORDİNATÖRÜ Prof. Dr. Rümeysa DEMİRDAMAR, rdemirdamar@neu.edu.tr YÜKSEK LİSANS DERSLERİ EKE 600 Uzmanlık Alanı Dersi Z 4 0 4 EKE 601 Klinik Eczacılık I S 5
ECZACILIK FAKÜLTESİ KLİNİK ECZACILIK PROGRAM KOORDİNATÖRÜ Prof. Dr. Rümeysa DEMİRDAMAR, rdemirdamar@neu.edu.tr YÜKSEK LİSANS DERSLERİ EKE 600 Uzmanlık Alanı Dersi Z 4 0 4 EKE 601 Klinik Eczacılık I S 5
AKILCI İLAÇ KULLANIMI. Dr.Şenol Çomoğlu
 AKILCI İLAÇ KULLANIMI Dr.Şenol Çomoğlu 2 AKILCI İLAÇ KULLANIMI Akılcı İlaç Kullanımı tanımı ilk defa 1985 yılında Dünya Sağlık Örgütü tarafından yapılmıştır. Kişilerin klinik bulgularına ve bireysel özelliklerine
AKILCI İLAÇ KULLANIMI Dr.Şenol Çomoğlu 2 AKILCI İLAÇ KULLANIMI Akılcı İlaç Kullanımı tanımı ilk defa 1985 yılında Dünya Sağlık Örgütü tarafından yapılmıştır. Kişilerin klinik bulgularına ve bireysel özelliklerine
İLAÇ, KOZMETİK ÜRÜNLER İLE TIBBİ CİHAZLARDA RUHSATLANDIRMA İŞLEMLERİ ECZ HAFTA
 İLAÇ, KOZMETİK ÜRÜNLER İLE TIBBİ CİHAZLARDA RUHSATLANDIRMA İŞLEMLERİ ECZ 961 4. HAFTA Beşeri Tıbbi Ürünler Beşeri tıbbi ürün/ürün: Hastalığı tedavi etmek ve/veya önlemek, bir teşhis yapmak veya bir fizyolojik
İLAÇ, KOZMETİK ÜRÜNLER İLE TIBBİ CİHAZLARDA RUHSATLANDIRMA İŞLEMLERİ ECZ 961 4. HAFTA Beşeri Tıbbi Ürünler Beşeri tıbbi ürün/ürün: Hastalığı tedavi etmek ve/veya önlemek, bir teşhis yapmak veya bir fizyolojik
KLİNİK ARAŞTIRMALAR VE İYİ KLİNİK UYGULAMALARI İLE İLGİLİ EĞİTİM PROGRAMLAMA VE DEĞERLENDİRME İLKELERİ KILAVUZU
 1. AMAÇ Bu kılavuz, iyi klinik uygulamaları ve klinik araştırmalar konusunda düzenlenmesi planlanan eğitim programlarına ilişkin Türkiye İlaç ve Tıbbi Cihaz Kurumuna yapılacak başvurunun şekli ve içeriği
1. AMAÇ Bu kılavuz, iyi klinik uygulamaları ve klinik araştırmalar konusunda düzenlenmesi planlanan eğitim programlarına ilişkin Türkiye İlaç ve Tıbbi Cihaz Kurumuna yapılacak başvurunun şekli ve içeriği
Klinik Araştırmalar İle İlgili Eğitim Programlama Ve Değerlendirme İlkeleri Kılavuzu
 Klinik Araştırmalar İle İlgili Eğitim Programlama Ve Değerlendirme İlkeleri Kılavuzu 1. AMAÇ Bu kılavuz, iyi klinik uygulamaları ve klinik araştırmalar konusunda düzenlenmesi planlanan eğitim programlarına
Klinik Araştırmalar İle İlgili Eğitim Programlama Ve Değerlendirme İlkeleri Kılavuzu 1. AMAÇ Bu kılavuz, iyi klinik uygulamaları ve klinik araştırmalar konusunda düzenlenmesi planlanan eğitim programlarına
SÇP No: 2. Yazılı Hasta Onamının (Bilgilendirilmiş Olur Formu) Alınması. Ankara Üniversitesi Hematoloji Bilim Dalı Çalışma Prosedürleri
 SÇP No: 2 Ankara Üniversitesi Hematoloji Bilim Dalı Yazılı Hasta Onamının (Bilgilendirilmiş Olur Formu) Alınması Versiyon no: 1 Geçerlilik tarihi: Aralık 2013 Onaylayan: Prof. Dr. Hamdi Akan İmza... Tarih...
SÇP No: 2 Ankara Üniversitesi Hematoloji Bilim Dalı Yazılı Hasta Onamının (Bilgilendirilmiş Olur Formu) Alınması Versiyon no: 1 Geçerlilik tarihi: Aralık 2013 Onaylayan: Prof. Dr. Hamdi Akan İmza... Tarih...
GİRİŞİMSEL OLMAYAN KLİNİK ARAŞTIRMALAR ETİK KURULU
 GİRİŞİMSEL OLMAYAN KLİNİK ARAŞTIRMALAR ETİK KURULU Nurten Akarsu, Tıp Doktoru, Bilim Doktoru Hacettepe Üniversitesi Tıp Fakültesi nakarsu@hacettepe.edu.tr İlaç ve Biyolojik Ürünlerin Klinik Araştırmaları
GİRİŞİMSEL OLMAYAN KLİNİK ARAŞTIRMALAR ETİK KURULU Nurten Akarsu, Tıp Doktoru, Bilim Doktoru Hacettepe Üniversitesi Tıp Fakültesi nakarsu@hacettepe.edu.tr İlaç ve Biyolojik Ürünlerin Klinik Araştırmaları
(1) ATRG L 268, 3.10.1998, s. 1.
 2119/98/AT sayılı Avrupa Parlamentosu ve Konsey Kararı çerçevesinde bulaşıcı hastalıkların önlenmesi ve kontrolü için erken uyarı ve yanıt sistemi hakkında 22 Aralık 1999 tarihli KOMİSYON KARARI [C(1999)
2119/98/AT sayılı Avrupa Parlamentosu ve Konsey Kararı çerçevesinde bulaşıcı hastalıkların önlenmesi ve kontrolü için erken uyarı ve yanıt sistemi hakkında 22 Aralık 1999 tarihli KOMİSYON KARARI [C(1999)
İlaç geliştirme süreci
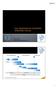 Hamdi Akan Ankara Tıp Fakültesi, Ankara İlaç geliştirme süreci Pre-Klinik araştırmalar Klinik araştırmalar Onay sonrası Keşif Hayvan/in vitro test Sentez ve formülasyon Kısa süreli Uzun süreli Faz I Faz
Hamdi Akan Ankara Tıp Fakültesi, Ankara İlaç geliştirme süreci Pre-Klinik araştırmalar Klinik araştırmalar Onay sonrası Keşif Hayvan/in vitro test Sentez ve formülasyon Kısa süreli Uzun süreli Faz I Faz
AKILCI İLAÇ KULLANIMI
 AKILCI İLAÇ KULLANIMI İ.Ü. İstanbul Tıp Fakültesi Kadın Hastalıkları ve Doğum ABD Perinatoloji BD Prenatal-Tanı Tedavi Ünitesi Dr. Tuğba Saraç Sivrikoz Akılcı İlaç Kullanımı Akılcı İlaç Kullanımı tanımı
AKILCI İLAÇ KULLANIMI İ.Ü. İstanbul Tıp Fakültesi Kadın Hastalıkları ve Doğum ABD Perinatoloji BD Prenatal-Tanı Tedavi Ünitesi Dr. Tuğba Saraç Sivrikoz Akılcı İlaç Kullanımı Akılcı İlaç Kullanımı tanımı
AKILCI İLAÇ KULLANIMI. Dr. M. Kürşat Tigen
 AKILCI İLAÇ KULLANIMI Dr. M. Kürşat Tigen İLAÇLAR Hastalıklardan korunma, teşhis, tedavi veya vücudun herhangi bir faaliyetini değiştirmek amacıyla kullanılan kimyasal, bitkisel, biyolojik kaynaklı ürünler
AKILCI İLAÇ KULLANIMI Dr. M. Kürşat Tigen İLAÇLAR Hastalıklardan korunma, teşhis, tedavi veya vücudun herhangi bir faaliyetini değiştirmek amacıyla kullanılan kimyasal, bitkisel, biyolojik kaynaklı ürünler
AKILCI İLAÇ KULLANIMININ YAYGINLAŞTIRILMASI
 AKILCI İLAÇ KULLANIMININ YAYGINLAŞTIRILMASI Uzm. Dr. Burçak Deniz DEDEOĞLU Akılcı İlaç Kullanımı Şube Müdürü AKILCI İLAÇ KULLANIMI Kişilerin klinik bulgularına ve bireysel özelliklerine göre uygun ilacı,
AKILCI İLAÇ KULLANIMININ YAYGINLAŞTIRILMASI Uzm. Dr. Burçak Deniz DEDEOĞLU Akılcı İlaç Kullanımı Şube Müdürü AKILCI İLAÇ KULLANIMI Kişilerin klinik bulgularına ve bireysel özelliklerine göre uygun ilacı,
DİCLE ÜNİVERSİTESİ ECZACILIK FAKÜLTESİ STAJ YÖNERGESİ
 DİCLE ÜNİVERSİTESİ ECZACILIK FAKÜLTESİ STAJ YÖNERGESİ BİRİNCİ BÖLÜM Amaç, Kapsam, Dayanak ve Tanımlar Amaç Madde 1 Bu yönergenin amacı, Dicle Üniversitesi Eczacılık Fakültesi öğrencilerinin eğitim ve öğretim
DİCLE ÜNİVERSİTESİ ECZACILIK FAKÜLTESİ STAJ YÖNERGESİ BİRİNCİ BÖLÜM Amaç, Kapsam, Dayanak ve Tanımlar Amaç Madde 1 Bu yönergenin amacı, Dicle Üniversitesi Eczacılık Fakültesi öğrencilerinin eğitim ve öğretim
T.C. SAĞLIK BAKANLIĞI TÜRKİYE İLAÇ VE TIBBİ CİHAZ KURUMU ÜLKEMİZDE BİTKİSEL ÜRÜNLERİN PİYASAYA ÇIKIŞ SÜREÇLERİ
 T.C. SAĞLIK BAKANLIĞI TÜRKİYE İLAÇ VE TIBBİ CİHAZ KURUMU ÜLKEMİZDE BİTKİSEL ÜRÜNLERİN PİYASAYA ÇIKIŞ SÜREÇLERİ Dr. Ecz. Aslı CAN AĞCA Türkiye İlaç ve Tıbbi Cihaz Kurumu İlaç, Biyolojik ve Tıbbi Ürünler
T.C. SAĞLIK BAKANLIĞI TÜRKİYE İLAÇ VE TIBBİ CİHAZ KURUMU ÜLKEMİZDE BİTKİSEL ÜRÜNLERİN PİYASAYA ÇIKIŞ SÜREÇLERİ Dr. Ecz. Aslı CAN AĞCA Türkiye İlaç ve Tıbbi Cihaz Kurumu İlaç, Biyolojik ve Tıbbi Ürünler
SENATO KARARLARI ERCİYES ÜNİVERSİTESİ SAĞLIK UYGULAMA VE ARAŞTIRMA MERKEZİ ENFEKSİYON KONTROL KURULUNUN KURULUŞ VE ÇALIŞMA YÖNERGESİ
 SENATO KARARLARI Karar Tarihi: 07/02/2014 Toplantı Sayısı:02 Sayfa:1 Erciyes Üniversitesi Sağlık Uygulama ve Araştırma ve Uygulama Merkezi Enfeksiyon Kontrol Kurulunun Kuruluş ve Çalışma Yönergesi hk.
SENATO KARARLARI Karar Tarihi: 07/02/2014 Toplantı Sayısı:02 Sayfa:1 Erciyes Üniversitesi Sağlık Uygulama ve Araştırma ve Uygulama Merkezi Enfeksiyon Kontrol Kurulunun Kuruluş ve Çalışma Yönergesi hk.
TÜRKİYE DE KLİNİK ARAŞTIRMALAR VE GÖZLEMSEL İLAÇ ÇALIŞMALARINDA KAYIT ZORUNLULUĞU
 TÜRKİYE DE KLİNİK ARAŞTIRMALAR VE GÖZLEMSEL İLAÇ ÇALIŞMALARINDA KAYIT ZORUNLULUĞU Uzm. Ecz. Süheyla TOPRAK Türkiye İlaç ve Tıbbi Cihaz Kurumu Klinik Araştırmalar Dairesi BY/BE Çalışmaları Değerlendirme
TÜRKİYE DE KLİNİK ARAŞTIRMALAR VE GÖZLEMSEL İLAÇ ÇALIŞMALARINDA KAYIT ZORUNLULUĞU Uzm. Ecz. Süheyla TOPRAK Türkiye İlaç ve Tıbbi Cihaz Kurumu Klinik Araştırmalar Dairesi BY/BE Çalışmaları Değerlendirme
Klinik Araştırmalar Etik Kurul Gözüyle. Prof. Dr. Hasibe ARTAÇ Selçuk Üniversitesi Tıp Fakültesi Çocuk İmmünoloji ve Allerji BD
 Klinik Araştırmalar Etik Kurul Gözüyle Prof. Dr. Hasibe ARTAÇ Selçuk Üniversitesi Tıp Fakültesi Çocuk İmmünoloji ve Allerji BD Klinik Araştırma nedir? Bir veya birden fazla araştırma ürününün klinik, farmakolojik
Klinik Araştırmalar Etik Kurul Gözüyle Prof. Dr. Hasibe ARTAÇ Selçuk Üniversitesi Tıp Fakültesi Çocuk İmmünoloji ve Allerji BD Klinik Araştırma nedir? Bir veya birden fazla araştırma ürününün klinik, farmakolojik
EĞİTİMİNDE TFD nin ROLÜ
 İLAÇLA AKILCI TEDAVİ EĞİTİMİNDE TFD nin ROLÜ Prof. Dr. Ersin Yarış Karadeniz adeniz Teknik Üniversitesi Tıp Fakültesi Farmakoloji Ab.D. Türk Farmakoloji Derneği Akılcı İlaç Eğitimi Kurulu Başkanı ICIUM
İLAÇLA AKILCI TEDAVİ EĞİTİMİNDE TFD nin ROLÜ Prof. Dr. Ersin Yarış Karadeniz adeniz Teknik Üniversitesi Tıp Fakültesi Farmakoloji Ab.D. Türk Farmakoloji Derneği Akılcı İlaç Eğitimi Kurulu Başkanı ICIUM
BİTKİLERDEN İLACA GİDERKEN TEMEL VE KLİNİK FARMAKOLOJİ
 BİTKİLERDEN İLACA GİDERKEN TEMEL VE KLİNİK FARMAKOLOJİ ITAM Projesi II Toplantısı Tıbbi bitkilerden ilaca giden yol Bezmialem Vakıf Üniversitesi 31 Mayıs 2013 Prof.Dr.Aydin Erenmemişoğlu NEDEN ARAŞTIRMA
BİTKİLERDEN İLACA GİDERKEN TEMEL VE KLİNİK FARMAKOLOJİ ITAM Projesi II Toplantısı Tıbbi bitkilerden ilaca giden yol Bezmialem Vakıf Üniversitesi 31 Mayıs 2013 Prof.Dr.Aydin Erenmemişoğlu NEDEN ARAŞTIRMA
YERELLEŞME KAPSAMINDAKİ BAŞVURULARIN TEKNİK DEĞERLENDİRME SÜRECİ
 YERELLEŞME KAPSAMINDAKİ BAŞVURULARIN TEKNİK DEĞERLENDİRME SÜRECİ Dr. Ecz. Nihal SAAT YERLİKAYA w w w. t i t c k. g o v. t r 1 Ürünlerin bitmiş ürün üretim yerinin bir tesisten başka bir tesise transferi
YERELLEŞME KAPSAMINDAKİ BAŞVURULARIN TEKNİK DEĞERLENDİRME SÜRECİ Dr. Ecz. Nihal SAAT YERLİKAYA w w w. t i t c k. g o v. t r 1 Ürünlerin bitmiş ürün üretim yerinin bir tesisten başka bir tesise transferi
SOSYAL GÜVENLİK KURUMU KOCAELİ SOSYAL GÜVENLİK İL MÜDÜRLÜĞÜ KOCAELİ SAĞLIK SOSYAL GÜVENLİK MERKEZİ HİZMET STANDARTLARI
 SIRA NO HİZMETİN ADI 1 Şahıs Fatura Ödemeleri SOSYAL GÜVENLİK KURUMU KOCAELİ SOSYAL GÜVENLİK İL MÜDÜRLÜĞÜ KOCAELİ SAĞLIK SOSYAL GÜVENLİK MERKEZİ HİZMET STANDARTLARI BAŞVURUDA İSTENEN BELGELER Protez ve
SIRA NO HİZMETİN ADI 1 Şahıs Fatura Ödemeleri SOSYAL GÜVENLİK KURUMU KOCAELİ SOSYAL GÜVENLİK İL MÜDÜRLÜĞÜ KOCAELİ SAĞLIK SOSYAL GÜVENLİK MERKEZİ HİZMET STANDARTLARI BAŞVURUDA İSTENEN BELGELER Protez ve
TÜRK KULAK BURUN BOĞAZ VE BAŞ BOYUN CERRAHİSİ DERNEĞİ KULAK BURUN BOĞAZ OKULLARI LARİNGOLOJİ-FONİATRİ OKULU YÖNERGESİ
 Sayfa 1 / 7 BİRİNCİ BÖLÜM Amaç, Kapsam, Dayanak, Tanımlar Amaç Madde 1. Bu yönerge, Türk Kulak Burun Boğaz ve Baş-Boyun Cerrahisi Derneği Tüzüğünde 15 Nisan 2014 tarihinde yapılan düzenlemelerle kurulan
Sayfa 1 / 7 BİRİNCİ BÖLÜM Amaç, Kapsam, Dayanak, Tanımlar Amaç Madde 1. Bu yönerge, Türk Kulak Burun Boğaz ve Baş-Boyun Cerrahisi Derneği Tüzüğünde 15 Nisan 2014 tarihinde yapılan düzenlemelerle kurulan
KLİNİK ARAŞTIRMA NEDİR & ETİK KURULLAR NEDEN ÖNEMLİDİR
 KLİNİK ARAŞTIRMA NEDİR & ETİK KURULLAR NEDEN ÖNEMLİDİR Prof. Dr. Yağız Üresin İstanbul Tıp Fakültesi Tıbbi Farmakoloji Anabilim Dalı ve Klinik Farmakoloji BD İ.Ü.İstanbul Tıp Fakültesi Klinik Araştırmalar
KLİNİK ARAŞTIRMA NEDİR & ETİK KURULLAR NEDEN ÖNEMLİDİR Prof. Dr. Yağız Üresin İstanbul Tıp Fakültesi Tıbbi Farmakoloji Anabilim Dalı ve Klinik Farmakoloji BD İ.Ü.İstanbul Tıp Fakültesi Klinik Araştırmalar
KLİNİK ARAŞTIRMALARA İLİŞKİN ETİK KURUL GÖRÜŞÜ BAŞVURUSUNDA BAŞVURU ŞEKLİ VE SUNULACAK BELGELER HAKKINDA KILAVUZ
 KLİNİK ARAŞTIRMALARA İLİŞKİN ETİK KURUL GÖRÜŞÜ BAŞVURUSUNDA BAŞVURU ŞEKLİ VE SUNULACAK BELGELER HAKKINDA KILAVUZ 1. Giriş Klinik Araştırmalar Hakkındaki Yönetmelik hükümlerine göre yürütülecek bir klinik
KLİNİK ARAŞTIRMALARA İLİŞKİN ETİK KURUL GÖRÜŞÜ BAŞVURUSUNDA BAŞVURU ŞEKLİ VE SUNULACAK BELGELER HAKKINDA KILAVUZ 1. Giriş Klinik Araştırmalar Hakkındaki Yönetmelik hükümlerine göre yürütülecek bir klinik
BVKAE www.bornovavet.gov.tr
 Türkiye Veteriner İlaçları Pazarı Sorunlar ve Çözüm Önerileri Uluslararası Süt Sığırcılığı ve Süt Ürünleri Çalıştayı ve Sergisi 28-29 Nisan, 2008 - Konya İsmail Özdemir VİSAD - Veteriner Sağlık Ürünleri
Türkiye Veteriner İlaçları Pazarı Sorunlar ve Çözüm Önerileri Uluslararası Süt Sığırcılığı ve Süt Ürünleri Çalıştayı ve Sergisi 28-29 Nisan, 2008 - Konya İsmail Özdemir VİSAD - Veteriner Sağlık Ürünleri
KLİNİK ARAŞTIRMALARDA ETİK KURULA BAŞVURU ŞEKLİNE İLİŞKİN KILAVUZ
 1. AMAÇ Bu kılavuz, klinik araştırmayı yürütmek üzere etik kurula yapılacak başvurunun şekli ve içeriği ile ilgili olarak rehberlik sunmak üzere hazırlanmıştır. 2. BAŞVURU VE BİLDİRİMLERİN ŞEKLİ VE İÇERİĞİ
1. AMAÇ Bu kılavuz, klinik araştırmayı yürütmek üzere etik kurula yapılacak başvurunun şekli ve içeriği ile ilgili olarak rehberlik sunmak üzere hazırlanmıştır. 2. BAŞVURU VE BİLDİRİMLERİN ŞEKLİ VE İÇERİĞİ
Tıbbi Cihazlarda Klinik Araştırmalar ve Yeni Gereklilikler IPTS Dr. Ali Sait SEPTİOĞLU
 Tıbbi Cihazlarda Klinik Araştırmalar ve Yeni Gereklilikler IPTS 2016 Dr. Ali Sait SEPTİOĞLU Sağlık Sektörü Sağlık Hizmeti Sunumunda Bileşenler Tıbbi gereçler Vücuda yerleştirilebilir aktif tıbbi cihazlar,
Tıbbi Cihazlarda Klinik Araştırmalar ve Yeni Gereklilikler IPTS 2016 Dr. Ali Sait SEPTİOĞLU Sağlık Sektörü Sağlık Hizmeti Sunumunda Bileşenler Tıbbi gereçler Vücuda yerleştirilebilir aktif tıbbi cihazlar,
İlaçla-İlgili Sorunlar için Sınıflandırma
 İlaçla-İlgili Sorunlar için Sınıflandırma (14.01.2010 da revize edilmiştir) 2003-2010 Pharmaceutical Care Network Europe Foundation Vakıf, sınıflandırmanın kullanım ve validasyon sonuçları konusunda bilgilendirildiği
İlaçla-İlgili Sorunlar için Sınıflandırma (14.01.2010 da revize edilmiştir) 2003-2010 Pharmaceutical Care Network Europe Foundation Vakıf, sınıflandırmanın kullanım ve validasyon sonuçları konusunda bilgilendirildiği
Akut Resusitasyon Araştırmalarında Bilgilendirilmiş Onam Alma - Uluslararası Durum Belirleme Anketi -
 Bu anket çalışması, bir uluslararası araştırma ekibi tarafından bilgilendirilmiş onam alınamayacak kişilerde akut resusitasyon çalışmalarındaki uluslararası kabul edilebilirlik ve düzenleyici durumu tespit
Bu anket çalışması, bir uluslararası araştırma ekibi tarafından bilgilendirilmiş onam alınamayacak kişilerde akut resusitasyon çalışmalarındaki uluslararası kabul edilebilirlik ve düzenleyici durumu tespit
İLAÇ RUHSAT e-başvuru FORMU KULLANICI KILAVUZU. Doküman: EUP Revizyon No: R-06 Tarih: 26.05.2014
 Sayfa: 0/15 İLAÇ RUHSAT e-başvuru FORMU KULLANICI Revizyon Tarihi Açıklama Revizyon No 10.05.2010 İlaç ruhsat e-başvuru formu kullanıcı kılavuzunun ilk yayınlanma tarihi 10.06.2010 e-başvuru formundan
Sayfa: 0/15 İLAÇ RUHSAT e-başvuru FORMU KULLANICI Revizyon Tarihi Açıklama Revizyon No 10.05.2010 İlaç ruhsat e-başvuru formu kullanıcı kılavuzunun ilk yayınlanma tarihi 10.06.2010 e-başvuru formundan
İYİ KLİNİK UYGULAMA VE ÜLKEMİZİN İLK İYİ KLİNİK UYGULAMA MERKEZİ ERCİYES ÜNİVERSİTESİ HAKAN ÇETİNSAYA İKUM. Prof. Dr. Aydın Erenmemişoğlu
 İYİ KLİNİK UYGULAMA VE ÜLKEMİZİN İLK İYİ KLİNİK UYGULAMA MERKEZİ ERCİYES ÜNİVERSİTESİ HAKAN ÇETİNSAYA İKUM Prof. Dr. Aydın Erenmemişoğlu Biyoeşdeğerlik, eşdeğer ilaç v.b. dendiğinde toplumda ilk akla gelen
İYİ KLİNİK UYGULAMA VE ÜLKEMİZİN İLK İYİ KLİNİK UYGULAMA MERKEZİ ERCİYES ÜNİVERSİTESİ HAKAN ÇETİNSAYA İKUM Prof. Dr. Aydın Erenmemişoğlu Biyoeşdeğerlik, eşdeğer ilaç v.b. dendiğinde toplumda ilk akla gelen
SIKÇA SORULAN SORULAR. 1- Gönüllü insanlar üzerinde yapılması planlanan klinik araştırma için izin alınması gerekir mi?
 1- Gönüllü insanlar üzerinde yapılması planlanan klinik araştırma için izin alınması gerekir mi? Evet, Sağlık Hizmetleri Temel Kanunu, Türk Ceza Kanunu 90. maddesi ve ilgili yönetmelik gereğince izin alınması
1- Gönüllü insanlar üzerinde yapılması planlanan klinik araştırma için izin alınması gerekir mi? Evet, Sağlık Hizmetleri Temel Kanunu, Türk Ceza Kanunu 90. maddesi ve ilgili yönetmelik gereğince izin alınması
TUCRIN (Türkiye Klinik Araştırma Altyapıları Ağı)
 TUCRIN (Türkiye Klinik Araştırma Altyapıları Ağı) 1 Tarihçe Kuruluş: Avrupa Birliği 6. Çerçeve Programı Avrupa Klinik Araştırma Altyapıları Ağı (ECRIN) 2004 7. Çerçeve Programı ile büyüme (2012-2015) Amaç:
TUCRIN (Türkiye Klinik Araştırma Altyapıları Ağı) 1 Tarihçe Kuruluş: Avrupa Birliği 6. Çerçeve Programı Avrupa Klinik Araştırma Altyapıları Ağı (ECRIN) 2004 7. Çerçeve Programı ile büyüme (2012-2015) Amaç:
YURT DIŞI ÜRETİM TESİSLERİNİN GMP DENETİMİ İÇİN YAPILACAK MÜRACAATA DAİR KILAVUZ
 YURT DIŞI ÜRETİM TESİSLERİNİN GMP DENETİMİ İÇİN YAPILACAK MÜRACAATA DAİR KILAVUZ İÇİNDEKİLER 1- GMP Denetimine İlişkin Genel Prensipler 2-Daha Önce Bakanlığımızca Denetlenmiş ve GMP Uygunluğu Almış Başvurular
YURT DIŞI ÜRETİM TESİSLERİNİN GMP DENETİMİ İÇİN YAPILACAK MÜRACAATA DAİR KILAVUZ İÇİNDEKİLER 1- GMP Denetimine İlişkin Genel Prensipler 2-Daha Önce Bakanlığımızca Denetlenmiş ve GMP Uygunluğu Almış Başvurular
BAŞVURU FORMU. Ürünün Ticari İsmi, gücü: 1- BAŞVURUNUN TİPİ
 BAŞVURU FORMU Ürünün Ticari İsmi, gücü: 1- BAŞVURUNUN TİPİ 1.1 - Bu başvuru, Veteriner Tıbbi Ürünlerde Yapılacak Değişikliklerle İlgili Yönetmelik hükümleri doğrultusunda Pazarlama İzni Genişletilmesi
BAŞVURU FORMU Ürünün Ticari İsmi, gücü: 1- BAŞVURUNUN TİPİ 1.1 - Bu başvuru, Veteriner Tıbbi Ürünlerde Yapılacak Değişikliklerle İlgili Yönetmelik hükümleri doğrultusunda Pazarlama İzni Genişletilmesi
Eczacılıkta Bilimsel Çalışma İlkeleri II (4 1 5)
 Eczacılıkta Bilimsel Çalışma İlkeleri II (4 1 5) 1 Çalışmanın organizasyonu 2 Çalışmanın organizasyonu 3 Ön çalışmaların yapılması 4 Ön çalışmaların yapılması 5 Ön çalışmaların yapılması 6 Çalışma ile
Eczacılıkta Bilimsel Çalışma İlkeleri II (4 1 5) 1 Çalışmanın organizasyonu 2 Çalışmanın organizasyonu 3 Ön çalışmaların yapılması 4 Ön çalışmaların yapılması 5 Ön çalışmaların yapılması 6 Çalışma ile
[Dünya Tabipler Birliği nin Eylül 1995, Bali, Endonezya da yapılan toplantısında kabul edilmiştir.]
![[Dünya Tabipler Birliği nin Eylül 1995, Bali, Endonezya da yapılan toplantısında kabul edilmiştir.] [Dünya Tabipler Birliği nin Eylül 1995, Bali, Endonezya da yapılan toplantısında kabul edilmiştir.]](/thumbs/27/10348699.jpg) [Dünya Tabipler Birliği nin Eylül 1995, Bali, Endonezya da yapılan toplantısında kabul edilmiştir.] Giriş Hekimler, hastaları ve geniş toplum kesimleri arasındaki ilişkilerde son yıllarda önemli değişikler
[Dünya Tabipler Birliği nin Eylül 1995, Bali, Endonezya da yapılan toplantısında kabul edilmiştir.] Giriş Hekimler, hastaları ve geniş toplum kesimleri arasındaki ilişkilerde son yıllarda önemli değişikler
Akılcı İlaç Kullanımı. Uzm.Dr.M.Bünyamin GÜCÜYENER 2015
 Akılcı İlaç Kullanımı Uzm.Dr.M.Bünyamin GÜCÜYENER 2015 Akılcı İlaç Kullanımı Akılcı İlaç Kullanımı tanımı ilk defa 1985 yılında Dünya Sağlık Örgütü tarafından yapılmıştır. Kişilerin klinik bulgularına
Akılcı İlaç Kullanımı Uzm.Dr.M.Bünyamin GÜCÜYENER 2015 Akılcı İlaç Kullanımı Akılcı İlaç Kullanımı tanımı ilk defa 1985 yılında Dünya Sağlık Örgütü tarafından yapılmıştır. Kişilerin klinik bulgularına
TİTCK/ DESTEK VE LABORATUVAR HİZMETLERİ BAŞKAN YARDIMCILIĞI/ ANALİZ VE KONTROL LABORATUVAR DAİRESİ BAŞKANLIĞI BATCH RELEASE PROSEDÜRÜ PR26/KYB
 TİTCK/ DESTEK VE LABORATUVAR HİZMETLERİ BAŞKAN YARDIMCILIĞI/ ANALİZ VE KONTROL LABORATUVAR DAİRESİ BAŞKANLIĞI PR26/KYB Sayfa No: 1/12 1. AMAÇ ve KAPSAM Bu prosedür, Tıbbi Biyolojik Ürünler Laboratuvarına
TİTCK/ DESTEK VE LABORATUVAR HİZMETLERİ BAŞKAN YARDIMCILIĞI/ ANALİZ VE KONTROL LABORATUVAR DAİRESİ BAŞKANLIĞI PR26/KYB Sayfa No: 1/12 1. AMAÇ ve KAPSAM Bu prosedür, Tıbbi Biyolojik Ürünler Laboratuvarına
ANKARA ÜNİVERSİTESİ ECZACILIK FAKÜLTESİ STAJ PROGRAMI
 ANKARA ÜNİVERSİTESİ ECZACILIK FAKÜLTESİ STAJ PROGRAMI I. Dönem Eczane Staj Programı 2. ve 3. sınıflar arasındaki yaz aylarında 1 ay süre ile yapılır. A. Serbest Eczane stajı: 1.Eczacılığın Tanımı 2.Eczacının
ANKARA ÜNİVERSİTESİ ECZACILIK FAKÜLTESİ STAJ PROGRAMI I. Dönem Eczane Staj Programı 2. ve 3. sınıflar arasındaki yaz aylarında 1 ay süre ile yapılır. A. Serbest Eczane stajı: 1.Eczacılığın Tanımı 2.Eczacının
Prof. Dr. Hayri T. ÖZBEK Çukurova Ünviversitesi, Algoloji Bilim Dalı
 Prof. Dr. Hayri T. ÖZBEK Çukurova Ünviversitesi, Algoloji Bilim Dalı ĠLAÇ NEDĠR? Dünya Sağlık Örgütü ne (DSÖ) göre; Fizyolojik sistemleri, patolojik durumları alanın yararına değiştirmek, incelemek amacıyla
Prof. Dr. Hayri T. ÖZBEK Çukurova Ünviversitesi, Algoloji Bilim Dalı ĠLAÇ NEDĠR? Dünya Sağlık Örgütü ne (DSÖ) göre; Fizyolojik sistemleri, patolojik durumları alanın yararına değiştirmek, incelemek amacıyla
RİSK BAZLI DENETİM BAŞVURULARINDA KULLANILACAK KONTROL LİSTESİ Soru Cevap Açıklama
 RİSK BAZLI DENETİM BAŞVURULARINDA KULLANILACAK KONTROL LİSTESİ Soru Cevap Açıklama 1. Risk bazlı denetim başvurusu daha önce Kurumumuzca yapılan yerinde denetim sonucu sertifika düzenlenen ürünler için
RİSK BAZLI DENETİM BAŞVURULARINDA KULLANILACAK KONTROL LİSTESİ Soru Cevap Açıklama 1. Risk bazlı denetim başvurusu daha önce Kurumumuzca yapılan yerinde denetim sonucu sertifika düzenlenen ürünler için
TEPDAD Çalışma Yönetmeliği
 TEPDAD Çalışma Yönetmeliği sürüm. 1.1. 2010 (19.12. 2010 tarihli TEPDAD Genel Kurulu nda kabul edilmiştir) MADDE 1- Dayanak ve Amaç Bu yönetmelik, Tıp Eğitimi Programlarını Değerlendirme ve Akreditasyon
TEPDAD Çalışma Yönetmeliği sürüm. 1.1. 2010 (19.12. 2010 tarihli TEPDAD Genel Kurulu nda kabul edilmiştir) MADDE 1- Dayanak ve Amaç Bu yönetmelik, Tıp Eğitimi Programlarını Değerlendirme ve Akreditasyon
FARMAKOVİJİLANS. Uzm. Dr. Mahluga Jafarova Demirkapu
 FARMAKOVİJİLANS Uzm. Dr. Mahluga Jafarova Demirkapu Konular 1. Farmakovijilans 2. Advers reaksiyonlar 3. İlaçlara bağlı sorunlar 4. Farmakovijilans bilgi akışı 5. Advers ilaç reaksiyonu bildirim formu
FARMAKOVİJİLANS Uzm. Dr. Mahluga Jafarova Demirkapu Konular 1. Farmakovijilans 2. Advers reaksiyonlar 3. İlaçlara bağlı sorunlar 4. Farmakovijilans bilgi akışı 5. Advers ilaç reaksiyonu bildirim formu
SIKÇA SORULAN SORULAR. 1. Gönüllü insanlar üzerinde yapılması planlanan klinik araştırma için izin alınması gerekir mi?
 1. Gönüllü insanlar üzerinde yapılması planlanan klinik araştırma için izin alınması gerekir mi? Evet, Sağlık Hizmetleri Temel Kanunu Ek Madde 10, Türk Ceza Kanununun 90. maddesi ve ilgili diğer mevzuat
1. Gönüllü insanlar üzerinde yapılması planlanan klinik araştırma için izin alınması gerekir mi? Evet, Sağlık Hizmetleri Temel Kanunu Ek Madde 10, Türk Ceza Kanununun 90. maddesi ve ilgili diğer mevzuat
SIKÇA SORULAN SORULAR. 1. Gönüllü insanlar üzerinde yapılması planlanan klinik araştırma için izin alınması gerekir mi?
 1. Gönüllü insanlar üzerinde yapılması planlanan klinik araştırma için izin alınması gerekir mi? Evet, Sağlık Hizmetleri Temel Kanunu Ek Madde 10, Türk Ceza Kanununun 90. maddesi ve ilgili diğer mevzuat
1. Gönüllü insanlar üzerinde yapılması planlanan klinik araştırma için izin alınması gerekir mi? Evet, Sağlık Hizmetleri Temel Kanunu Ek Madde 10, Türk Ceza Kanununun 90. maddesi ve ilgili diğer mevzuat
RUHSAT YENİLEME BAŞVURU FORMU
 RUHSAT YENİLEME BAŞVURU FORMU (İcat edildiği) Aktif Madde (ler): Farmakoterapötik sınıflandırma (Grup + ATC kodu): Farmasötik Form(lar) ve doz( Strength)(ler): Uygulama yol(ları) : Ruhsat numarası: ruhsat
RUHSAT YENİLEME BAŞVURU FORMU (İcat edildiği) Aktif Madde (ler): Farmakoterapötik sınıflandırma (Grup + ATC kodu): Farmasötik Form(lar) ve doz( Strength)(ler): Uygulama yol(ları) : Ruhsat numarası: ruhsat
T.C. İNÖNÜ ÜNİVERSİTESİ ECZACILIK FAKÜLTESİ STAJ YÖNERGESİ ( BAHAR YARIYILINDAN İTİBAREN UYGULANACAKTIR)
 T.C. İNÖNÜ ÜNİVERSİTESİ ECZACILIK FAKÜLTESİ STAJ YÖNERGESİ (2016-2017 BAHAR YARIYILINDAN İTİBAREN UYGULANACAKTIR) AMAÇ VE KAPSAM MADDE 1 1(1) Bu yönerge, İnönü Üniversitesi Ön lisans ve Lisans Eğitim-Öğretim
T.C. İNÖNÜ ÜNİVERSİTESİ ECZACILIK FAKÜLTESİ STAJ YÖNERGESİ (2016-2017 BAHAR YARIYILINDAN İTİBAREN UYGULANACAKTIR) AMAÇ VE KAPSAM MADDE 1 1(1) Bu yönerge, İnönü Üniversitesi Ön lisans ve Lisans Eğitim-Öğretim
Akılcı İlaç Kullanımı. Prof. Dr. Rümeysa Demirdamar Lefke Avrupa Üniversitesi Eczacılık Fakültesi Kurucu Dekan
 Akılcı İlaç Kullanımı Prof. Dr. Rümeysa Demirdamar Lefke Avrupa Üniversitesi Eczacılık Fakültesi Kurucu Dekan 23.09.2016 Akılcı İlaç Kullanımı Kişilerin uygun ilacı, uygun süre ve dozda, en düşük fiyata
Akılcı İlaç Kullanımı Prof. Dr. Rümeysa Demirdamar Lefke Avrupa Üniversitesi Eczacılık Fakültesi Kurucu Dekan 23.09.2016 Akılcı İlaç Kullanımı Kişilerin uygun ilacı, uygun süre ve dozda, en düşük fiyata
İLAÇ UYGULAMA PROSEDÜRÜ
 Sayfa 1 / 5 1.AMAÇ: Hakkari Devlet Hastanesi nde ilaç hatalarının önlenmesi amacıyla stratejilerin belirlenmesi, ilaç kullanım sürecinin tüm safhalarında görev alan sağlık bakımı sunanların rollerinin
Sayfa 1 / 5 1.AMAÇ: Hakkari Devlet Hastanesi nde ilaç hatalarının önlenmesi amacıyla stratejilerin belirlenmesi, ilaç kullanım sürecinin tüm safhalarında görev alan sağlık bakımı sunanların rollerinin
2 Haziran, 2005 Ankara - Türkiye. Rui Santos Ivo
 AB DE ve TÜRKİYE'DE JENERİK İLAÇ ENDÜSTRİSİ PANELİ AB DE JENERİK REKABETİN TEŞVİK EDİLMESİNDE PORTEKİZ MODELİ 2 Haziran, 2005 Ankara - Türkiye Rui Santos Ivo Başkan İlaç ve Eczacılık Kurumu (INFARMED)
AB DE ve TÜRKİYE'DE JENERİK İLAÇ ENDÜSTRİSİ PANELİ AB DE JENERİK REKABETİN TEŞVİK EDİLMESİNDE PORTEKİZ MODELİ 2 Haziran, 2005 Ankara - Türkiye Rui Santos Ivo Başkan İlaç ve Eczacılık Kurumu (INFARMED)
w w w. t i t c k. g o v. t r
 w w w. t i t c k. g o v. t r ARAŞTIRMA İLACINA KLİNİK ARAŞTIRMA DIŞINDA ERİŞİM Uzm. Dr. Banu BAYAR Akılcı İlaç Kullanımı ve İlaç Tedarik Yönetimi Dairesi İlaç Tedarik ve Onay Birimi 1 2. Ulusal Klinik
w w w. t i t c k. g o v. t r ARAŞTIRMA İLACINA KLİNİK ARAŞTIRMA DIŞINDA ERİŞİM Uzm. Dr. Banu BAYAR Akılcı İlaç Kullanımı ve İlaç Tedarik Yönetimi Dairesi İlaç Tedarik ve Onay Birimi 1 2. Ulusal Klinik
İ.Ü. ECZACILIK FAKÜLTESİ SERBEST ECZANE STAJI STAJ DEĞERLENDİRME RAPORU
 İ.Ü. ECZACILIK FAKÜLTESİ SERBEST ECZANE STAJI STAJ DEĞERLENDİRME RAPORU DERECELENDİRMESİ ÇOK İYİ 5 İYİ 4 ORTA 3 ZAYIF 2 YETERSİZ 1 İKİNCİ DÖNEM 1 Staj yapılan eczane hakkında genel bilgileri bilir: Eczacının
İ.Ü. ECZACILIK FAKÜLTESİ SERBEST ECZANE STAJI STAJ DEĞERLENDİRME RAPORU DERECELENDİRMESİ ÇOK İYİ 5 İYİ 4 ORTA 3 ZAYIF 2 YETERSİZ 1 İKİNCİ DÖNEM 1 Staj yapılan eczane hakkında genel bilgileri bilir: Eczacının
İyi Farmakovijilans Uygulamaları (İFU) Kılavuzu. Modül II Ek İzleme
 İyi Farmakovijilans Uygulamaları (İFU) Kılavuzu Modül II Ek İzleme TÜRKİYE İLAÇ VE TIBBİ CİHAZ KURUMU 15.07.2014 İçindekiler BÖLÜM I Giriş 1.1. Giriş... 2 BÖLÜM II Yapılar ve süreçler 2.1. İlaçlara ek
İyi Farmakovijilans Uygulamaları (İFU) Kılavuzu Modül II Ek İzleme TÜRKİYE İLAÇ VE TIBBİ CİHAZ KURUMU 15.07.2014 İçindekiler BÖLÜM I Giriş 1.1. Giriş... 2 BÖLÜM II Yapılar ve süreçler 2.1. İlaçlara ek
Akılcı İlaç Kullanımı ( ) Uzm. Dr. Şermin BÖREKÇİ Cerrahpaşa Tıp Fakültesi Göğüs Hastalıkları Anabilim Dalı
 Akılcı İlaç Kullanımı (29.05.2016) Uzm. Dr. Şermin BÖREKÇİ Cerrahpaşa Tıp Fakültesi Göğüs Hastalıkları Anabilim Dalı Sunu Planı 1. Akılcı İlaç Kullanımı Tanım 2. Akılcı İlaç Kullanımı Sorumluluk Sahibi
Akılcı İlaç Kullanımı (29.05.2016) Uzm. Dr. Şermin BÖREKÇİ Cerrahpaşa Tıp Fakültesi Göğüs Hastalıkları Anabilim Dalı Sunu Planı 1. Akılcı İlaç Kullanımı Tanım 2. Akılcı İlaç Kullanımı Sorumluluk Sahibi
AKILCI İLAÇ KULLANIMI OTURUMLARI İÇİN ÖRNEK SUNUM. Dr. Sibel Aşçıoğlu Hayran Hacettepe Üniversitesi Tıp Fakültesi İnfeksiyon Hastalıkları AD
 AKILCI İLAÇ KULLANIMI OTURUMLARI İÇİN ÖRNEK SUNUM Dr. Sibel Aşçıoğlu Hayran Hacettepe Üniversitesi Tıp Fakültesi İnfeksiyon Hastalıkları AD AKILCI İLAÇ KULLANIMI Akılcı İlaç Kullanımı tanımı ilk defa 1985
AKILCI İLAÇ KULLANIMI OTURUMLARI İÇİN ÖRNEK SUNUM Dr. Sibel Aşçıoğlu Hayran Hacettepe Üniversitesi Tıp Fakültesi İnfeksiyon Hastalıkları AD AKILCI İLAÇ KULLANIMI Akılcı İlaç Kullanımı tanımı ilk defa 1985
HEM NADİR HEM YETİM...
 HEM NADİR HEM YETİM... KARANLIKTAN IŞIĞA AIFD - Araştırmacı Ilaç Firmaları Derneği Yetim İlaç Çalışma Grubu Dr. Haluk Germeyan Alexion AJANDA Nadir Hastalıklar: Tanım ve toplum üzerindeki yükü Yetim İlaçlar:
HEM NADİR HEM YETİM... KARANLIKTAN IŞIĞA AIFD - Araştırmacı Ilaç Firmaları Derneği Yetim İlaç Çalışma Grubu Dr. Haluk Germeyan Alexion AJANDA Nadir Hastalıklar: Tanım ve toplum üzerindeki yükü Yetim İlaçlar:
Ulusal İlaç Formülerinin Rasyonel Farmakoterapideki Rolü
 Ulusal İlaç Formülerinin Rasyonel Farmakoterapideki Rolü Prof. Dr. Sibel GÖKSEL Ege Üniversitesi Tıp Fakültesi Farmakoloji Anabilim Dalı Amaç Akılcı ilaç sürecinin bir ülkede etkin olarak uygulanmasında
Ulusal İlaç Formülerinin Rasyonel Farmakoterapideki Rolü Prof. Dr. Sibel GÖKSEL Ege Üniversitesi Tıp Fakültesi Farmakoloji Anabilim Dalı Amaç Akılcı ilaç sürecinin bir ülkede etkin olarak uygulanmasında
Yeni İlaçların Geliştirilmesi
 Yeni İlaçların Geliştirilmesi Prof. Dr. Meral TUNCER B.Ü.Tıp Fakültesi, Farmakoloji AbD AR-GE PROJE HAZIRLAMA, YÖNETME VE UYGULAMA EĞİTİM PROGRAMI Ankara, 24 Aralık 2015 Klinik-Öncesi Değerlendirme Sentezle
Yeni İlaçların Geliştirilmesi Prof. Dr. Meral TUNCER B.Ü.Tıp Fakültesi, Farmakoloji AbD AR-GE PROJE HAZIRLAMA, YÖNETME VE UYGULAMA EĞİTİM PROGRAMI Ankara, 24 Aralık 2015 Klinik-Öncesi Değerlendirme Sentezle
DÜNYADAN SEKTÖREL HABERLER
 DÜNYADAN SEKTÖREL HABERLER OCAK 2012 Türk Eczacıları Birliği tarafından hazırlanmıştır. Willy Brandt Sok. no:9 06690 Çankaya Ankara İçindekiler: Belçika da Dermatolojik Majistraller İçin Kar Marjları %30
DÜNYADAN SEKTÖREL HABERLER OCAK 2012 Türk Eczacıları Birliği tarafından hazırlanmıştır. Willy Brandt Sok. no:9 06690 Çankaya Ankara İçindekiler: Belçika da Dermatolojik Majistraller İçin Kar Marjları %30
TÜRKİYE İLAÇ VE TIBBÎ CİHAZ KURUMU GÖREV VE ÇALIŞMA USUL VE ESASLARI HAKKINDA YÖNERGE. BİRİNCİ BÖLÜM Genel Hükümler
 TÜRKİYE İLAÇ VE TIBBÎ CİHAZ KURUMU GÖREV VE ÇALIŞMA USUL VE ESASLARI HAKKINDA YÖNERGE BİRİNCİ BÖLÜM Genel Hükümler Amaç MADDE 1- (1) Bu Yönergenin amacı, Türkiye İlaç ve Tıbbî Cihaz Kurumu nun görevleri
TÜRKİYE İLAÇ VE TIBBÎ CİHAZ KURUMU GÖREV VE ÇALIŞMA USUL VE ESASLARI HAKKINDA YÖNERGE BİRİNCİ BÖLÜM Genel Hükümler Amaç MADDE 1- (1) Bu Yönergenin amacı, Türkiye İlaç ve Tıbbî Cihaz Kurumu nun görevleri
AKILCI İLAÇ KULLANIMI. Dr. M. Bülent Sönmez 9. Ulusal Alkol ve Madde Bağımlılığı Kongresi 10-12 Aralık 2015, Edirne
 AKILCI İLAÇ KULLANIMI Dr. M. Bülent Sönmez 9. Ulusal Alkol ve Madde Bağımlılığı Kongresi 10-12 Aralık 2015, Edirne AKILCI İLAÇ KULLANIMI Akılcı İlaç Kullanımı tanımı ilk defa 1985 yılında Dünya Sağlık
AKILCI İLAÇ KULLANIMI Dr. M. Bülent Sönmez 9. Ulusal Alkol ve Madde Bağımlılığı Kongresi 10-12 Aralık 2015, Edirne AKILCI İLAÇ KULLANIMI Akılcı İlaç Kullanımı tanımı ilk defa 1985 yılında Dünya Sağlık
yapılacak araştırmadaki kullanım güvenliliği ile ilgili karar verebilmek için yeterince bilgi sağlamalıdır. Klinik öncesi ve/veya klinik verilerde,
 Klinik Araştırmalar için Bakanlığa Başvuru Şekli, Önemli Değişikliklerin Bildirimi ve Çalışmanın Sona Erdiğinin Beyan Edilmesine İlişkin Kılavuz / 28.01.2009 1. Kapsam Bu kılavuz, bir klinik araştırmayı
Klinik Araştırmalar için Bakanlığa Başvuru Şekli, Önemli Değişikliklerin Bildirimi ve Çalışmanın Sona Erdiğinin Beyan Edilmesine İlişkin Kılavuz / 28.01.2009 1. Kapsam Bu kılavuz, bir klinik araştırmayı
HASTANE OTOMASYON PROGRAMI E-REÇETE KULLANIM REHBERİ. Öncelikle"SGK Kurumsal Hekim Şifresi" Alınması Gereklidir
 HASTANE OTOMASYON PROGRAMI E-REÇETE KULLANIM REHBERİ DÜZENLEYEN : MELTEM DİNÇ KÖKMEN Öncelikle"SGK Kurumsal Hekim Şifresi" Alınması Gereklidir 03.12.2012 tarihinden itibaren yatan hastalarda e-reçete uygulamasına
HASTANE OTOMASYON PROGRAMI E-REÇETE KULLANIM REHBERİ DÜZENLEYEN : MELTEM DİNÇ KÖKMEN Öncelikle"SGK Kurumsal Hekim Şifresi" Alınması Gereklidir 03.12.2012 tarihinden itibaren yatan hastalarda e-reçete uygulamasına
