TÜRKİYE CUMHURİYETİ ANKARA ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ İNTRASTOPLAZMİK SPERM ENJEKSİYONU (İCSİ) YAPILAN SIĞIR OOSİTLERİNDE KALSİYUM İYONOF
|
|
|
- Şebnem Ceren
- 6 yıl önce
- İzleme sayısı:
Transkript
1 TÜRKİYE CUMHURİYETİ ANKARA ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ İNTRASTOPLAZMİK SPERM ENJEKSİYONU (İCSİ) YAPILAN SIĞIR OOSİTLERİNDE KALSİYUM İYONOFOR, 6-DİMETİLAMİNOPURİN ve ETANOLÜN EMBRYO GELİŞİMİNE ETKİLERİNİN ARAŞTIRILMASI Ömer KORKMAZ DOĞUM VE JİNEKOLOJİ ANABİLİM DALI DOKTORA TEZİ DANIŞMAN Prof. Dr. Şükrü KÜPLÜLÜ 2008 ANKARA
2 TÜRKİYE CUMHURİYETİ ANKARA ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ İNTRASTOPLAZMİK SPERM ENJEKSİYONU (İCSİ) YAPILAN SIĞIR OOSİTLERİNDE KALSİYUM İYONOFOR, 6-DİMETİLAMİNOPURİN ve ETANOLÜN EMBRYO GELİŞİMİNE ETKİLERİNİN ARAŞTIRILMASI Ömer KORKMAZ DOĞUM VE JİNEKOLOJİ ANABİLİM DALI DOKTORA TEZİ DANIŞMAN Prof. Dr. Şükrü KÜPLÜLÜ Bu tez Bilim İnsanı Yetiştirme Projesi tarafından 2005K proje numarası ile desteklenmiştir 2008 ANKARA
3 Ankara Üniversitesi Sağlık Bilimleri Enstitüsü Doğum ve Jinekoloji Anabilim Dalı Doktora Programı Çerçevesinde yürütülmüş olan bu çalışma, aşağıdaki jüri tarafından Doktora Tezi olarak kabul edilmiştir. Tez Savunma Tarihi: Prof. Dr. Erol ALAÇAM Ankara Üniversitesi Jüri Başkanı Prof. Dr. Şükrü KÜPLÜLÜ Ankara Üniversitesi Prof. Dr. Tayfur BEKYÜREK Erciyes Üniversitesi Prof. Dr. Mustafa KAYMAZ Ankara Üniversitesi (Raportör) Doç. Dr. Ongun UYSAL Ankara Üniversitesi
4 Kabul ve Onay İçindekiler Önsöz Simgeler ve Kısaltmalar Şekiller Çizelgeler İÇİNDEKİLER i ii vi Viii X Xi 1. GİRİŞ İn Vitro Embriyo Üretiminin Tanımı İn Vitro Embriyo Üretiminin Tarihsel Gelişimi İn Vitro Embriyo Üretiminin Aşamaları İn Vitro Oosit Toplama Teknikleri Aspirasyon Tekniği Follikül Diseksiyonu Ovaryum Dilimleme Tekniği Transilliminasyon (ışık geçiren) aspirasyon tekniği Sığır Oositlerinin Sınıflandırılması ve Seleksiyonu Sığır Oositlerinin Maturasyonu Nükleer Maturasyon Sitoplazmik Maturasyon Spermatozoon Kapasitasyonu Spermatozoon Ayıraç Yöntemleri Swim-up Tekniği Glass-wool Filtrasyon Tekniği Percoll Density Gradient Fertilizasyon İn Vivo Fertilizasyon Spermatozoanın Kumulus Hücrelerine Penetrasyonu Spermatozoanın Zona Pellusidaya Tutunması ve 16 Katetmesi Oosit ve Spermatozoa Hücre Zarlarının Birleşmesi 17 (Gamet Füzyonu) In Vitro Fertilizasyon Fertilizasyon Esnasında Sığır Oositlerindeki Fizyolojik 20 Değişimler İntraselüler Ca 2+ Salınımı Histone H1 Kinazdaki Değişimler In Vitro Fertilizasyonu Etkileyen Faktörler In Vitro Kapasitasyon Ajanları Sığır Ovidukt Sıvısı Folliküler Sıvı Heparin Sığır Serum Albumini Kalsiyum İyonofor Fertilizasyon Vasatları 29
5 Su Kalitesi Kültür Şartları Işığın Etkisi Mikromanüplasyon Teknikleri Zona İnceltme Zona Delme Subzonal Sperm Enjeksiyonu (SUZI) İntrasitoplazmik Sperm Enjeksiyonu (ICSI) ICSI uygulaması Sığırda ICSI Enjeksiyon İçin Sperm Yavaşlatıcı Vasat Enjeksiyon Pipetleri Sığır Oositlerinin Aktivasyonu Oosit Aktivasyonu İçin Yapay Uyarıcılar ICSI Uygulanmış Sığır Oositlerinin Aktivasyon 47 Gerekliliği ve Çalışmanın Hipotezi 2. GEREÇ ve YÖNTEM Gereç Oosit Kaynağı Laboratuvar Alet ve Gereçleri Kimyasal Malzemeler, Vasat Katkı Maddeleri ve 52 Vasatlar 2.2. Yöntem Çalışmada Kullanılan Vasatların İçerikleri ve Hazırlanışı Ovaryum Taşıma Vasatının Hazırlanması Ovaryum Yıkama Vasatının Hazırlanması Oosit Maturasyon Vasatının hazırlanması Stok Solüsyonlarının Hazırlanması Tyrode`nin Laktat (TL) Solüsyonlarının Hazırlanması Tyrode`nin Albumin Laktat Piruvat (TALP) Vasatının 57 Hazırlanması Fosfatlı Tampon Solüsyonunun (PBS) Hazırlanması Polyvinyl Pyrrolidonun (PVP) Hazırlanması Embriyo Kültür Vasatının (Charles Rosenkrans- 59 1,CR1,aa) Hazırlanması Çalışmanın Şematik Sunumu Grupların Oluşturulması ve Uygulama Ovaryumların Toplanması ve Laboratuvara Getirilmesi Follikül Aspirasyonu ve Oosit Seleksiyonu Oositlerin Maturasyonu Spermanın ICSI İçin Hazırlanması Maturasyon İşlemine Tabi Tutulan Matür ve İmmatür 64 Oositlerin ICSI İçin Hazırlanması Sığır Oositlerinde İntrasitoplazmik Sperm Enjeksiyonu 64 (ICSI) Uygulaması
6 İntrastoplazmik Sperm Enjeksiyonu Uygulamasına 64 Hazırlık İntrastoplazmik Sperm Enjeksiyonu Tekniği ICSI Uygulanmış Oositlerin Kimyasal Aktivasyonu ICSI Uygulanan Oositlerde Kalsiyum İyonofor ile 67 Aktivasyon ICSI Uygulanan Oositlerde Kalsiyum İyonofor+6-69 Dimetilaminopurin ile Kombine Aktivasyon ICSI Uygulanan Oositlerde Etanol ile Aktivasyon Embriyo Kültürü İstatistiksel Değerlendirme BULGULAR Ovaryumların Oosit Potansiyeli A, B ve C Kalite Oositlerin Maturasyon Kapasitesi Intrasitoplazmik Sperm Enjeksiyonunun Pratik Önemi ICSI Uygulamasından Sonra Her Kalite Oositteki 75 Aktivatör Gruplarında Embriyonik Gelişime Ulaşma Bulguları A Kalite Oositlerde Ca İyonofor Aktivasyonun Embriyonik Gelişime Etkileri A Kalite Oositlerde Ca İyonofor+6-DMAP Kombine 76 Aktivasyonun Embriyonik Gelişime Etkileri A Kalite Oositlerde Etanol ile Aktivasyonun Embriyonik 77 Gelişime Etkileri B Kalite Oositlerde Ca İyonofor ile Aktivasyonun Embriyonik Gelişime Etkileri B Kalite Oositlerde Ca İyonofor+6-DMAP Kombine 80 Aktivasyonun Embriyonik Gelişime Etkileri B Kalite Oositlerde Etanol ile Aktivasyonun Embriyonik 81 Gelişime Etkileri C Kalite Oositlerde Ca İyonofor ile Aktivasyonun Embriyonik Gelişime Etkileri C Kalite Oositlerde Ca İyonofor+6-DMAP Kombine 85 Aktivasyonun Embriyonik Gelişime Etkileri C Kalite Oositlerde Etanol ile Aktivasyonun Embriyonik 85 Gelişime Etkileri 4. TARTIŞMA Oosit Kaynağı Maturasyon Intrasitoplazmik Sperm Enjeksiyonu (ICSI) Oosit Aktivasyon Metotları A Kalite Oositlerde Kalsiyum İyonofor ile Aktivasyonun 96 Embriyonik Gelişime Etkileri A Kalite Oositlerde Kalsiyum İyonofor+6-DMAP 102
7 Kombine Aktivasyonun Embriyonik Gelişime Etkileri A Kalite Oositlerde Etanol ile Aktivasyonun Embriyonik Gelişime Etkileri B ve C Kalite Oositlerde Kullanılan Aktivasyon Yöntemleri SONUÇ ve ÖNERİLER 113 ÖZET 114 SUMMARY 116 KAYNAKLAR 118 ÖZGEÇMİŞ 128
8 ÖNSÖZ Son yıllarda ucuz ve bol hayvansal gıdanın üretilmesi ve insanlarda üreme sorunlarının çözümüne model oluşturması yönünden, hayvanlarda reprodüktif biyoteknoloji üzerine çalışmalarda artış vardır. Biyoteknoloji, canlı materyal ile teknolojik çalışmaların birleştirilmesi veya benzer materyallerin, endüstrinin faydasına sunulması olarak tanımlanmaktadır. Reproduktif amaçlı yapılan biyoteknolojik çalışmalar; in vitro maturasyon (IVM), in vitro yöntemle embriyo elde etme (IVP), embriyo kültürü, oosit ve embriyo dondurma, embriyoda cinsiyetin belirlenmesi, embriyo transferi, embriyo mikro-cerrahisi, klonlama, pronukleus transplantasyonu, spermanın in vitro kapasitasyonu ve mikro enjeksiyonu ile fertilizasyon çalışması gibi alanlarda yoğunlaşmaktadır. Yardımcı fertilizasyon metotlarından biri olan intrasitoplazmik sperm enjeksiyonu (ICSI), spermatozoonun bir oosit sitoplazması içine mekanik olarak yerleştirilmesi işlemidir. Bu teknik kullanılarak, sperm penetrasyonu için normal bariyerler olan kumulus hücresi-hyaluronik asit matriksi, zona pellusida ve ooplazmik membran pas geçilmektedir. Bu nedenle ICSI yöntemi spermin oosite penetrasyonu ile ilgili problemlerin aşılmasında yardımcı olmaktadır. Erkekten elde edilen spermin yaklaşık üçte biri kullanılarak in vitro ortamda yüksek oosit penetrasyon oranı elde edilebilmektedir. İntrasitoplazmik sperm enjeksiyonu küçük laboratuar hayvanlarında ve özellikle insanlarda erkek infertilite problemlerinin çözümünde sık kullanılan bir tekniktir. İnsan ve farelerden farklı olarak, sığırlarda sperm enjeksiyonu ile ilgili çok az yayın bulunmaktadır. İlk ICSI yöntemi ile elde edilen buzağılar kısa süre önce Japonya da doğmuş olmasına rağmen, ineklerde ICSI ile canlı yavru elde edilen az sayıda çalışma rapor edilmiştir. Bu türlerde, sperm enjeksiyonunu takiben fertilizasyon ve bölünme oranı çok düşüktür. Fertilizasyon ve bölünme oranları, kalsiyum iyonofor (A 23187), etanol, dimetilaminopurin (DMAP), sodyum pirofosfat, sikloheksamid, butorolaktan, bohamin ve elektrik stimülasyonu gibi oosit aktivasyonunu sağlayan kimyasal ve mekanik tedavilerle artırılabilmektedir.
9 Hayvancılık alanında embriyo transferi ile genetik olarak üstün dişilerin immatur oositlerinden üstün özellikli yavrular elde edilebilmektedir. Bununla birlikte IVF ile embriyo elde edilirken bazı şartlar ve erkek infertilitesi sınırlayıcı olabilmektedir. Bu nedenle ICSI gibi yeni gelişmekte olan yöntemler kullanılarak en uygun oosit ve sperma seçilerek birçok sorun ortadan kaldırılabilmektedir. Sunulan çalışma, hayvancılık alanına yeni giren biyoteknolojik çalışmalardan biri olan ICSI metodunu sığır oositlerine uygulanması, sığırlarda in vitro embriyo üretiminde başarısız olunan bu metodun en önemli aşamalarından biri olan oosit aktivasyon yöntemlerinin karşılaştırılması yönünden aydınlatıcı bir çalışma özelliğini taşımaktadır. Doktora programım süresince her konuda yardım ve ilgisini esirgemeyen ve tez konusunu seçmemde yol gösteren danışman hocam sayın Prof. Dr. Şükrü KÜPLÜLÜ ye, Ankara Üniversitesi Veteriner Fakültesi Doğum ve Jinekoloji Anabilim Dalı Öğretim Üyelerine, tezimin kurgu ve planlama aşamalarındaki yardımlarından dolayı ReproCure (Nevada, Las Vegas) bilim direktörü Doç. Dr. Levent KESKİNTEPE` ye, çalışma düzeneğini oluşmasında büyük katkıları olan ve ön çalışmalar sırasında laboratuarını bize açan ve bilimsel tecrübelerini esirgemeyen Amerika Birleşik Devletleri, Missouri-Columbia Üniversitesi, Veteriner Fakültesi öğretim üyesi Doç. Dr. Yüksel AĞCA` ya şükranlarımı sunarım. Ayrıca çok değerli aileme, her koşulda bana destek olan eşim Deniz ve varlığı ile hayata anlam katan oğlum Rüzgar`a teşekkürü borç bilirim.
10 SİMGELER ve KISALTMALAR % Yüzde C Santigrat derece > Büyüktür < Küçüktür α Alfa A I Anafaz I AR Akrozom Reaksiyonu ark. Arkadaşları ATP Adenozin Trifosfat β Beta BSA Sığır Serum Albumini Ca Kalsiyum CaCl 2 Kalsiyum Klorür CHX camp cm CO 2 CR1aa dk DMAP DNA DTT EFAF EGF FCS Frak V FSH G g GAG GnRH GV GVBD hcg HCl Hepes H 2 O IGF ICSI IL IP3 InsP 3 R IU IVF Sikloheksomid Siklik Adenozin Monofosfat Santimetre Karbondioksit Aminoasitli Charles Rosencrans mediumu Dakika Dimetilaminopurin Deokiribonükleik asit Dithiotroidol Yağ Asidi Bulunmayan Epidermal Büyüme Faktörü Fötal Buzağı Serumu Kısım (fraksiyon) V Follikül Uyarıcı Hormon Gauge Santrifüj Devir Sabiti Glikozaminoglikan Gonadotropin Salınım Hormonu Germinal Vezikül Germinal Vezikül Dağılması İnsan Koriyonik Gonadotropini Hidroklorik Asit N-(2 hidroksietil)-piperazin-n -(2 etanosulfonikasit) Su Insulin Benzeri Büyüme Faktörü İntra Sitoplazmik Sperm Enjeksiyonu Interleukin inositol 1,4,5-triphosphate inositol 1,4,5-triphosphate receptör International Ünite In Vitro Fertilizasyon
11 IVM KCl kda K KH KOK l LH µg µl µm M I M II MDF MEM MF MgCl 2 mg ml mm mm MPF mrna N N 2 Na NaCl NaOH Na 2 O 2 S 2 NaHCO 3 NF ng O 2 Pb PBS pg ph PRL PVP T I TALP TCM TGF TKE VEGF YÜ In Vitro Maturasyon Potasyum Klorür Kilodalton Potasyum Kutup Hücresi Kumulus Oosit Kompleksi Litre Luteinleştirici Hormon Mikrogram Mikrolitre Mikrometre Metafaz I Metafaz II Matürasyon Düzenleyici Faktör Minimum Esansiyal Medyum Monospermik Fertilizasyon Magnezyum klorür Miligram Mililitre Milimetre Milimolar Matürasyon Destekleyici Faktör Haberci (mesenger) Ribonükleik Asit Normal Azot Sodyum Sodyum Klorür Sodyum Hidroksit Sodyum Metabisülsit Sodyum Bikarbonat Fertilize Olmayan Oosit Nanogram Oksijen Kutup Hücresi Fosfatlı Tampon Solüsyonu Pikogram Asitlik Sabiti Prolaktin Polyvinylpyrrolidone Telofaz I Tyrode nin Albumin Laktat Pürivat Vasatı Doku Kültürü Vasatı Transforme Edici Büyüme Faktörleri Tam Kumulus Ekspansiyonu Vasküler Epitelial Büyüme Faktörü Yardımcı Üreme Teknikleri
12 ŞEKİLLER Şekil Fertilizasyonu takiben sperm faktör oosit 23 aktivasyonu (Boni ve ark., 2007) Şekil ICSI uygulaması için hazırlanan petrinin şematik 65 görünümü Şekil ICSI uygulamasının şematik görünümü 67 Şekil ICSI uygulanmış oositlerde Ca iyonofor ile 68 aktivasyonun şeması Şekil ICSI uygulanmış oositlerde Ca iyonofor ve 6- DMAP kombine aktivasyonun şeması 70 Şekil ICSI uygulanmış oositlerde etanol ile 71 aktivasyonun şeması Şekil Farklı kalite oositler (20X0,30 PH büyütmede) 73 Şekil Kumulus ekspansiyonu (a) ve 1. kutup hücresi 74 şekillenen (b) oositler (40X0,50 PH büyütmede) Şekil ICSI uygulaması 75 Şekil A kalite oositlerde farklı aktivasyon metotlarında 79 embriyonik gelişim aşamalarının oranları Şekil A kalite oositlerde bölünme, morula ve blastosist 79 görüntüleri (40X0,50PH büyütmede) Şekil B kalite oositlerde farklı aktivasyon metotlarında 83 embriyonik gelişim aşamalarının oranları Şekil B Kalite oositlerde bölünme, morula ve blastosist 84 görünümleri (40X0,50 PH büyütmede) Şekil C kalite oositlerde farklı aktivasyon metotlarında 87 embriyonik gelişim aşamalarının oranları Şekil Tüm grupların bölünme, blastosist ve morula oranları 88
13 ÇİZELGELER Çizelge Stok Solüsyonlarının İçerikleri ve Hazırlanması 56 Çizelge TL Solüsyonlarının İçerikleri ve Hazırlanması 57 Çizelge TALP Solüsyonlarının Hazırlanması 58 Çizelge PBS-A Solüsyonun İçerik ve Miktarı (700 ml) 58 Çizelge PBS-B Solüsyonun İçerik ve Miktarı 58 Çizelge Embriyo Kültür Vasatının (CR1 aa) İçeriği 60 Çizelge Deney Düzeneğinin Gruplandırılması 61 Çizelge Farklı Kalite Oositlerin Maturasyonunda Kumulus 74 Ekspansiyon ve 1. Kutup Hücresi Atılım Oranları Çizelge A Kalite Oositlerde Ca İyonofor Aktivasyonunun 76 Embriyonik Gelişime Etkisi Çizelge A Kalite Oositlerde Ca İyonofor ve 6-DMAP 77 Aktivasyonunun Embriyonik Gelişime Etkisi Çizelge A kalite Oositlerde Etanol Aktivasyonunun 77 Embriyonik Gelişime Etkisi Çizelge A Kalite Oositlerde Farklı Aktivasyon Metotlarının 78 Embriyonik Gelişime Etkileri Çizelge B Kalite Oositlerde Ca İyonofor Aktivasyonunun 80 Embriyonik Gelişime Etkisi Çizelge B Kalite Oositlerde Ca İyonofor ve 6-DMAP 81 Aktivasyonunun Embriyonik Gelişime Etkisi Çizelge B Kalite Oositlerde Etanol Aktivasyonunun 82 Embriyonik Gelişime Etkisi Çizelge B Kalite Oositlerde Farklı Aktivasyon Metotlarınnın 82 Embriyonik Gelişime Etkisi Çizelge C Kalite Oositlerde Ca İyonofor Aktivasyonunun 84 Embriyonik Gelişime Etkisi Çizelge C Kalite Oositlerde Ca İyonofor ve 6-DMAP 85 Aktivasyonunun Embriyonik Gelişime Etkisi Çizelge C Kalite Oositlerde Etanol Aktivasyonunun 86 Embriyonik Gelişime Etkisi Çizelge C Kalite Oositlerde Farklı Aktivasyon Metotlarının 86 Embriyonik Gelişime Etkisi Çizelge Tüm Gruplarda Bölünme, Morula ve Blastosist Oranları 87 Çizelge Oosit Kalitesi ve Kimyasal Aktivatörlerin 90 Embriyonik Bölünme Aşamasına Etkisinin Multiple Lojistik Regresyon Analizi ile Araştırılması Çizelge Oosit Kalitesi ve Kimyasal Aktivatörlerin 91 Embriyonik Morula Aşamasına Etkisinin Multiple Lojistik Regresyon Analizi ile Araştırılması Çizelge Oosit Kalitesi ve Kimyasal Aktivatörlerin 92 Embriyonik Blastosist Aşamasına Etkisinin Multiple Lojistik Regresyon Analizi ile Araştırılması
14 1. GİRİŞ 1.1. İn Vitro Embriyo Üretiminin Tanımı İn vitro embriyo üretimi, bir türe ait embriyonun laboratuvar ortamında üretilmesidir. İn vitro embriyo üretiminde amaç; vücut içerisinde dişi ve erkek gametlerde meydana gelen hormonal ve fizyolojik olayların, gerek gamet ile vücut arasındaki sinyallerin, gerekse de vücudun fizyolojik ortamının taklit edilerek, türe ait embriyoların yine türe özgü transfer aşamalarına kadar büyütülmesidir. Bilimsel tarifinde ise in vitro embriyo üretimi, in vivo ya da in vitro mature oositlerin toplanarak taze ya da dondurulmuş spermayla döllenip elde edilen pronükleer oositlerin ya da zigotun türe özgü bir süre kültüre edilerek geliştirilmesidir (Gordon, 2003) İn Vitro Embriyo Üretiminin Tarihsel Gelişimi Yirminci yüzyılın başlarında sığır embriyolarının gelişimleri ve metabolik ihtiyaçları hakkında çok fazla bilgi yoktu. Metabolizma açısından, diğer memeli embriyoları, özellikle fare ile aralarında bir benzerlik olduğu düşüncesi hâkimdi. Fare embriyoları ile ilgili çalışmaların, sığır embriyo kültürlerine bir temel oluşturduğu, bu çalışmaların ışığında, sığır embriyolarının gelişiminde gerekli olan koşulların (O 2 düzeyi, vasat içeriği vb.) teorik temelleri atıldığı bildirilmektedir (Thompson, 2000). Gordon (2003), in vitro embriyo üretiminin tarihçesini anlattığı bir yazısında bilim adamlarının üreme fizyolojisi üzerine yüzyıllarca yaptıkları çalışmalara rağmen 20. yüzyılın ilk yarısında bilinenler denizkestanesi yumurtaları hakkındakilerle sınırlıydı, Gregory Pincus ve arkadaşlarının 1950 yılında memeli yumurtaları ve Austin in 1951 yılında ve Chang`ın 1951 yılında
15 kapasitasyon üzerine araştırmaları sonucu fertilizasyon olayı aydınlanmaya başlamıştır diye bildirmektedir. İn vitro fertilizasyonda (IVF) ilk başarılı çalışma hamster gametleri ile yapılmıştır. Bu çalışmalar spermatozoanın in vitro kapasite edilmesi ile memeli in vitro fertilizasyonunda yapılan ilk çalışmadır (Yanagimachi ve Chang, 1963). Chang (1959) tarafından, tavşan yumurtalarında in vitro fertilizasyon çalışması da klinik infertilite tedavisi gibi insan IVF çalışmalarına önemli bir yol gösterici olmuştur ve 1953 yılları arasında çok sayıda in vitro fertil memeli oositi çalışması yapılmıştır. Sığır oositlerinde ilk başarılı in vitro maturasyon (IVM) ve IVF çalışmaları Iritani ve Niwa (1977) tarafından Japonya da yapılmıştır yılında Brackett ve ark., nın yaptığı sığır oositlerinde IVF çalışmalarının devamı olarak in vitro fertilizasyon metodu ile doğan ilk buzağının ise Amerik Birleşik Devletleri`nde elde edildiği bildirilmektedir (Brackett ve ark., 1984). İn vitro fertilizasyon (IVF) tekniği, temel bilimler ve uygulamalı bilimler alanında çok iyi kurulmuş bir teknolojidir. Embriyo üretimini sağlayan bu teknoloji bilimsel araştırmalarda, insan infertilitesinin tedavisinde, besi hayvanlarının üretiminin ve soyu tükenmekte olan hayvanların sayısının artırılmasında kullanılmaktadır. Birçok tür için IVF protokolleri rutin olarak yüksek üretim veya uygun koşullara sahip fertil ovaryumlardan, alıcı dişilere transfer edildiğinde canlı yavru elde edilebilen embriyo üretimini sağlanabilindiği bildirilmektedir (Bavister, 2002). Reprodüktif biyoteknolojiler, son 15 yıl içinde büyük gelişmeler kaydetmiştir. Sığır embriyolarının in vitro üretimi (IVP) klasik ovulasyon indükleme teknikleri ve implantasyon öncesi embriyo gelişimi çalışmaları karşısında güvenilir bir alternatif olarak kabul edildiği belirtilmektedir (Bavister, 1995). İnsanlarda da ilk başarılı IVF çalışmasını takiben yardımcı üreme teknolojilerini kullanan hasta sayısında hızla artış görüldüğü bildirilmektedir (Menezo ve ark., 2000).
16 Ülkemizde in vitro fertilizasyon konusunda ilk çalışmalar tavşanlar üzerinde 1984 yılında Tekeli tarafından yapılmış ve ilk in vitro kuzular da 2001 yılında ele edilmiştir (Birler ve ark., 2002) yılından bu yana ülkemizde birçok bilim insanı reprodüktif biyoteknolojinin hemen hemen her dalında sistemli ve başarılı çalışmalarını yürütmektedir. Bu alandaki en son gelişmede 2007 yılında İstanbul Üniversitesi Veteriner Fakültesinde Prof. Dr. Sema Birler ve arkadaşlarının yürüttüğü Transgenik Hayvan Üretim Projesinde bir koyuna somatik hücre nükleus transferi uygulaması ile Oyalı adında Türkiye`nin ilk klon kuzusu elde edilmesidir. Ülkemiz bu çalışma ile bu alanda ilk 10 ülke arasına girmiştir İn Vitro Embriyo Üretiminin Aşamaları İn vitro embriyo üretimi çok aşamalı bir işlem olup, ovaryumların toplanması, toplanan ovaryumlardan oositlerin aspirasyonu, aspire edilen oositlerin in vitro maturasyonu (IVM), mature oositlerin in vitro fertilizasyonu (IVF) ve embriyo kültürünü kapsamaktadır (Leibfried-Rutledge ve ark., 1989; Küplülü ve Ün, 2001). İn vitro embriyo üretiminin başarısı, bu aşamaların ayrı ayrı başarısıyla ilgilidir. İn vitro maturasyonun başarısı IVF in, IVF başarısı ise zigot oluşumunu dolayısıyla in vitro embriyo kültürü sonucunu etkileyebilmektedir İn Vitro Oosit Toplama Teknikleri Sığır oositlerinin ovaryumlardan toplanması amacıyla aspirasyon, follikül diseksiyonu, ovaryum dilimleme ve transilliminasyon aspirasyon olmak üzere başlıca 4 ana teknik kullanılmaktadır (Duran, 2000, Gordon, 2003).
17 Aspirasyon Tekniği Sığır oositlerinin toplanmasında, veziküler folliküllerin aspirasyonu yaygın olarak kullanılan bir tekniktir. Bu amaçla özel olarak yapılmış aspiratörler kullanılabileceği gibi, 5-10 ml lik enjektörlerin ucuna takılmış 18 G lik iğneler de kullanılabilmektedir. Bu teknik uygulaması pratik olmakla birlikte, folliküllerin sadece %30 60 ından oosit elde etmek mümkün olmaktadır. Oysa daha zaman alıcı olan follikül diseksiyon tekniğinde, bu oran %100 e kadar ulaşmaktadır. Ayrıca aspirasyon yöntemi ile toplanan oositlerin yaklaşık olarak %43 ü morfolojik olarak normal olmaktadır. Bu teknikte ovaryum başına elde edilen kullanılabilir kalitedeki oosit sayısı 5-8 adet olduğu bildirilmektedir. Dezavantajlarına rağmen, pratik olması ve çok sayıda ovaryumun işlenebilmesine olanak vermesi nedeniyle, aspirasyon yöntemi tercih edilmektedir. Çok sayıda ovaryumun işlenmesinin önemli olduğu ticari embriyo üretimi yapılan laboratuvarlarda, aspirasyon tekniğini oosit kalitesinin önemli olduğu durumlarda ise diseksiyon yöntemi önerilmektedir (Gordon, 2003) Follikül Diseksiyonu Veziküler folliküllerin (2-8 mm) diseksiyonunu takiben, parçalayarak oosit toplanması, öncelikle koyunlarda kullanılmış bir tekniktir. Bu teknikte öncelikle oositi çevreleyen kumulus hücrelerine zarar vermeden oosit elde edilmesi amaçlanmaktadır. En büyük avantajı atretik ve atretik olmayan folliküllerin belirlenebilmesidir. Follikülün homojen olarak saydam ve açık renkte olması, damarlaşmanın iyi, stratum granulozum tabakasının düzenli oluşu, follikülün atretik olmadığını göstermektedir. Diğer taraftan, atretik folliküllerin damarlaşması zayıftır ve donuk gri renktedirler. Diseksiyon tekniğinde aspirasyonda olduğu gibi, oositi çevreleyen kumulus hücrelerine zarar verilmediği için, fazla sayıda kaliteli oosit elde etmek mümkün olmaktadır. Ayrıca, kaliteli oositlere ait kumulus oophorus follikül duvarına
18 sıkıca bağlandığı için, bunlar aspirasyonla her zaman alınamamaktadır (Gordon, 2003) Ovaryum Dilimleme Tekniği Ovaryum dilimleme tekniği direkt olarak uygulanabildiği gibi, aspirasyon sonrası da yapılabilmektedir. Ovaryum başına arasında oosit elde etmek mümkün olmaktadır. Özellikle koyun, keçi gibi küçük ovaryumlu hayvanlarda, ovaryum yüzeyinin dilimlenmesi iyi sonuçlar vermektedir. Bu teknikte, çok sayıda oosit elde edilmekle birlikte, mayotik olarak yetersiz oositler de toplanabilmektedir. Çok sayıda ovaryumun işlenmesi için uygun olmamakla birlikte, az sayıdaki ovaryum için önerilmektedir (Duran, 2000) Transilliminasyon (ışık geçirgen) Aspirasyon Tekniği Arav tarafından 2001 yılında geliştirilen bu yeni teknik, ovaryumun medulla ve korteksinde ışık geçirgenliği yardımı ile oosit aspirasyonu için kortikal follüküllerin görüntülenmesinin sağlanması ile uygulanılmaktadır. Bu yüzden bu tekniğe ışık geçirgen (transilliminasyon) aspirasyon tekniği (TAO) denilmektedir. Bu teknik ile ovaryum başına elde edilen oosit oranının %50 artırılacağı bildirilmektedir (Arav, 2001; Gordon, 2003). Ovaryumun merkezinin aydınlatılabilmesi ile klasik ışıklandırmadan daha fazla sayıda follükül gözlenebilmektedir. Aspirasyon işlemi geleneksel olarak 18-g iğneyle yapılan bu teknikle ovaryum başına 7,3 oosit elde edildiği bildirilmektedir (Arav, 2001) Sığır Oositlerinin Sınıflandırılması ve Seleksiyonu Ovaryumlardaki folliküllerden elde edilen her oosit mature olamamakta veya mature olsa da canlı bir bireye dönüşme yeteneğini sergileyememektedir.
19 Gerçekte kabul edilen maturasyon kriteri, fertilize olabilme ve fertilizasyon sonrası erkek pronukleusunu oluşturabilme yeteneğidir. Ancak, folliküler çevreden ayrılan bir oositin maturasyon ve fertilizasyon yeteneğini kesin olarak söylemek imkânsızdır. Bu nedenle folliküllerden aspire edilen değişik morfolojik özelliklere sahip oositlerin maturasyon kapasitesi ile ilgili fikir veren follikül ölçüsü, kumulus hücrelerinin varlığı ve kumulus-oosit kompleksinin (KOK) morfolojisi gibi kriterler kullanılarak oosit seleksiyon yöntemleri geliştirilmiştir. Morfolojik açıdan iyi olan oositler ticari vasatlarda rahatlıkla maturasyonu tamamlarken, morfolojik bozukluklar sergileyen oositlerin maturasyon başarıları çok sınırlıdır (Gordon, 2003). Morfolojik sınıflandırmada oositin sitoplazma görüntüsü ve çevreleyen hücrelerle olan bağı dikkate alınmaktadır. Günümüzde KOK morfolojisi yönünden en çok kullanılan üç sınıflandırma yöntemi bulunmaktadır (Gordon, 2003). Loos ve ark. (1989) nın tarif ettiği sistemde 1. Kalite; Kompakt çok katlı kumulus hücre katmanı, homojen ooplazma, KOK şeffaf görünümlü, 2. Kalite; Kompakt çok katlı kumulus hücre katmanı, homojen ooplazma ancak oosit periferinde karaltılı görünüm, daha az şeffaf görünüme sahip 3. Kalite; Daha az kompakt çok katlı kumulus hücre katmanı, düzensiz ooplazmada koyu lekeler, 1 ve 2 den daha karanlık görünümlü, 4. Kalite; Şişmiş kumulus katmanı, kumulus hücreleri koyu jel kıvamında, düzensiz ooplazmada koyu lekeler ve tüm KOK karanlık ve düzensiz görünümlü oositler olarak bildirilmektedir. Younis ve arkadaşlarının (1989) nın tarif ettiği sisteme göre: Seçkin; Homojen görünümlü ooplazma ve zona pellusidaya sıkıca tutunmuş kompakt kumulus hücre katmanı içeren, Seçkin olmayan; Tam olmayan diğer tip kumulus hücre katmanları ve heterojen görünümlü ooplazma içeren oositler olarak belirtilmektedir.
20 Brackett ve Zuelke (1993) nin tarif ettiği sistem de ise: 1. Kalite; 4 kattan fazla sayıda kompakt kumulus hücre katmanı ve kumlu ooplazma görünüme sahip, 2. Kalite; 2-3 katlı kompakt kumulus hücre katmanı ve kumlu veya hafif kumlu ooplazma görünümü içeren, 3. Kalite; 1-2 katlı hafif/düzensiz kompakt kumulus hücre katmanı ve hafif kumlu ya da homojen ooplazma görünüme sahip, 4. Kalite; Çıplak oosit ve homojen/jel görünümlü ooplazması bulunan oositler olarak nitelendirilmektedir. Yalnızca kumulus hücrelerinin morfolojik durumuna bakılarak A, B, C ve D şeklinde de sınıflandırma yapılmaktadır. Homojen görünümlü bir sitoplazma, oositi çevreleyen, bozulmamış ve kompakt yapıda kumulus hücreleri, matur olmayan oositlerin maturasyon ve embriyonik gelişimlerin en önemli işaretlerindendir (Kanagawa, 1995; Akyol, 2005). Oosit değerlendirmede pratik olarak sadece kumuluslara bakıldığında (Akyol, 2007); A kalite: etrafında 5-6 sıradan daha fazla kumulus hücreleri bulunan ve homojen yapı gösteren oositler, B kalite: etrafında 2-4 sıra kumulus hücre bulunan veya az bir kısmında kumulus bulunmayan oositler, C kalite: etrafında kumulus hücresi bulunmayan oositler, D kalite: etrafındaki kumulus hücre yığını dejenere durumda olan oositler olarak ayrılmaktadır Sığır Oositlerinin Maturasyonu Maturasyon, diploid (2n) kromozom sayısına sahip olan oositlerin, mayoz bölünmeyle kromozom sayılarının haploide (n) indirgenmesi ve bu süreçte bir organel yapılanması sonucu oositin fertilizasyon yeteneğini kazanması olarak tanımlanmaktadır (Xu ve ark., 1986). Oositlerin maturasyonu, nükleer ve sitoplazmik maturasyon olmak üzere iki aşamada gerçekleşmektedir (Bevers ve ark., 1997).
21 Nükleer Maturasyon Memeli oositleri, fötal gelişim sırasında veya postnatal dönemin başında mayotik bölünmeye başlar ve uzayan profazın ilk gelişmiş bölünmesi olan diploten aşamasına kadar devam eder. Diploten aşamasından metafaz aşamasına geçiş diakenezis olarak tanımlanmaktadır (Callesen ve ark., 1986). Diakenezis boyunca nükleer membranların sayısında artış şekillenir, nükleer gözenekler kaybolur ve iki katlı küçük keseler kaybolmadan önce nükleer membran parçalanır. Mayozun başlamasının ilk belirtileri olan bu olaylar germinal vezikül dağılması (GVBD) olarak adlandırılır (Kubelka ve ark., 1988). Sığırlarda germinal vezikül dağılması, oositin follikülden ayrılması sırasında ya da LH uyarımından sonraki birkaç saat içinde gerçekleşir. Germinal vezikül dağılması oositin, maturasyon vasatına konulmasından ortalama 6,6 saat sonra gerçekleşmektedir. Daha sonra kromozomlar yoğunlaşmaktadır. Bu dönemde bilinmeyen nedenler sonucu mayotik bölünme durur ve oositin büyük kabarcıklı çekirdeği, germinal vezikül (GV) olarak tanımlanmaktadır (Sirard ve ark., 1989; Loos ve ark., 1991). Nükleer maturasyon, oosit çekirdeğinin germinal vezikül aşamasından metafaz II (M II) aşamasına geçişini içeren süreç olarak tanımlanmaktadır. Nükleer maturasyonda GVBD, kromozomların yoğunlaşması, iğ ipliği oluşumu, ilk kutup hücresinin atılımıyla homolog kromozomların ayrımı olaylarını içerir ve M II aşamasında durur (Kubelka ve ark., 1988). Sığır oositlerinin nükleer maturasyonu ortalama 24 saatte tamamlanmaktadır (Sirard ve ark., 1989). Anafaz I boyunca homolog kromozomlar ayrılır ve kromozomlar kutuplara doğru göç eder. Telofaz I aşamasında, kromozomlar nükleer membranla sarılı olarak her iki kutupta bulunur. İkinci mayotik bölünme kromozom replikasyonu gerçekleşmeden oluşur ve oositler M II aşamasına ulaşır (Mayes, 2002).
22 Nükleer aşamalar Süre (saat) a Germinal vezikül (GV) 0-6,6 Germinal vezikül dağılması (GVBD) 6,6-8,0 b Yoğunlaşma (Condensed) 8,0-10,3 c Metafaz I (M I) 10,3-15,4 d Anafaz I (A I) 15,4-16,6 e Telofaz I (T I) 16,6-18,0 F Metafaz II (M II) ve Kutup hücresi (Pb) 18,0-24, Sitoplazmik Maturasyon Fertilizasyon ve embriyonik gelişim için oosit sitoplazmasında meydana gelen değişikliklerin gerçekleştiği süreç, sitoplazmik maturasyon olarak tanımlanır. Sitoplazma maturasyonunda, çekirdek, çekirdekçik, mitokondri, ribozom, golgi kompleksi gibi yapılarda yer değiştirme, farklı fonksiyon kazanma ve haberci RNA nın (mrna) modifikasyonu gibi olaylar gözlenmektedir (Smith, 2001). Shamsuddin ve ark. (1993), sitoplazmik maturasyonun üç aşamada gerçekleştiğini belirtmiştir. Buna göre ilk aşamada mitokondriler, endoplazmik retikulumla yakınlaşmakta, ikinci aşamada lipid damlacıkları ve veziküllerin sayı ve boyut olarak azalmaları ve perifere yönlenmeleri gerçekleşmektedir. Üçüncü aşamada ise kortikal granüllerin subplazmalemma bölgesine doğru hareket etmeleri ile sitoplazmik maturasyon tamamlanmaktadır (Shamsuddin ve ark., 1993; Mayes, 2002). Memelilerde antral follikülden çıkan oositler in vitro kültür ortamında bekletildiklerinde mayotik (nükleer) maturasyon kendiliğinden başlamaktadır. Bu olay, oositlerin muhtemelen gap junction bağlantılarıyla kumulus hücreleri
23 tarafından üretilen ya da folliküler sıvıdaki substratların baskılayıcı etkisinden kurtulmasından kaynaklanmaktadır. Ancak in vitro ortamda mature olan sığır oositlerinin gelişme yeteneği ile nükleer maturasyon oranları çok yakın olmasına rağmen, oositlerin sitoplazmik maturasyonu nükleer maturasyondan daha önce tamamlanmaktadır. Bu nedenle sığır embriyolarının erken gelişim döneminde sorunlar meydana gelmektedir. Çünkü nükleer ve sitoplazmik maturasyon in vitro fertilizasyonu (IVF) takiben embriyonik gelişim için gereklidir (Kuzmina ve ark., 1999; Ikeda ve ark., 2000). Ancak başka araştırmacılar, oosit maturasyonunda fertilizasyon ve erken embriyonik gelişimi desteklemek amacıyla sitoplazmada birtakım değişiklikler şekillenmesinin (sitoplazmik maturasyon) çok önemli olduğunu, çünkü nükleer maturasyonun tamamlanmasının embriyo gelişimi için tek başına yeterli olmadığını belirtmişlerdir (Sirard ve ark., 1989; Yang ve ark., 1998). Sığır oositlerinde, kültür sonucunda, kumulus ekspansiyonu istenen düzeyde şekillenmiş (pipet ucuyla manuple edildiğinde kumulus hücrelerinin dağılması) ve birinci kutup hücresi perivitellin boşlukta izlenen oositler mature oosit olarak kabul edilir (Gordon, 2003) Spermatozoon Kapasitasyonu Spermatozoona fertilizasyon yeteneğini ve yeterliliğini kazandıran tüm fizyolojik değişimlere kapasitasyon adı verilmektedir. Bir başka ve daha basit tanımla, spermatozoanın etrafını çeviren glikoprotein kılıftan kurtulmasına kapasitasyon denmektedir. Boğa spermatozoası, epididimiste mature olur ve ejakulasyonla atılır. Ejakulat içerisindeki spermatozoon fertilizasyon yeteneğine sahip değildir ve dişi genital sistemde bazı fizyolojik değişimlere uğrayarak bu yeteneği kazanır (Gordon ve Lu, 1990). Kapasitasyon türe spesifik bir özellik taşımamaktadır. Örneğin boğa spermatozoaları östrustaki tavşan uterusunda, teke spermatozoası ise
24 östrustaki domuz uterusunda kapasite olabilmektedir. Buna ek olarak kapasitasyon organa bağlı bir olay da değildir. Tavşan spermatozoonu uterus haricinde kolon, idrar kesesi, vesicula seminalis ve gözün anterior kamarasında kapasite olabilmektedir. Kapasitasyonun başladığı ve tamamlandığı bölge ise türe özgü farklılıklar sergilemektedir. Örneğin, çiftleşme sırasında spermanın direkt olarak uterusa bırakıldığı türlerde (aygır ve domuz) kapasitasyon uterusta başlarken, ejakulatın vaginaya bırakıldığı türlerde (kedi, köpek, boğa ve koç) ise kapasitasyon transservikal göç sırasında başlar. Kapasitasyon olgusunda asıl önemli unsur dişinin endokrinolojik durumudur. Siklusun östrojenik evresinde kapasitasyon aktive edilirken, progesteron ağırlıklı dönemde ve yalancı gebelikte inhibe olmaktadır (Muyan, 1984). Spermatozoalar testislerden ayrılıp kaput epididimise girdiklerinde dölleme yeteneğine sahip değillerdir. Epididimis pasajı sırasında spermatozoalarda epididimal maturasyon şekillenir ve maturasyon hücre içerisinde devam ederken, hücre dışında da epididimal sekresyonlar görülür. Bu sekresyonların en önemlisi spermatozoa başına geçirilen glikoprotein kılıftır. Bu glikoprotein kılıfın görevi, spermatozoayı dişi genital kanaldaki göçü sırasında karşılaşacağı engellere karşı korumak ve böylece prematür bir akrozom reaksiyonunu önlemektir. Bu birinci protein kılıfa ek olarak spermatozoa ejakulasyon sırasında seminal plazma ile karıştığında ikinci ancak daha az güçlü bir glikoprotein kılıfla kaplanır (Xu ve Greve, 1988). Spermatozoaların gelişiminde dalgalı bir seyir izlenmekte, kanal başkalaşımı sırasında kapasite olan spermatozoanın, epididimis pasajı sırasında dekapasite olması ilgi çekmektedir. Bu nedenle gerek in vivo ve gerekse in vitro spermatozoon kapasitasyonunun irdelenmesinde spermatogenezis de göz önünde bulundurulmalıdır (Knobil ve Neill, 1988). Spermatogenezis, testisin tubulus seminiferus kontortus adı verilen kıvrımlı kanallarında gerçekleşir ve goniogenezis, spermatositogenezis ve
25 spermiogenezis adı verilen üç dönemi kapsar (Brackett ve Zuelke, 1993). Boğalarda spermatogenezis 60 gün sürmektedir (Hafez, 1993) Spermatozoon Ayıraç Yöntemleri Swim-up Tekniği Motilite, spermatozoanın reprodüktif kanalı geçip oositi fertilize edebilmesi için gerekli bir aşamadır. Spermatozoa başının oosite penetrasyonu ve zona pellusidayı geçmesi spermatozoonun kuyruğu sayesinde gerçekleşir. Swimup tekniği motil spermatozoonun seçimi amacıyla kullanılan ekonomik bir yöntemdir (Gordon, 2003; Allamaneni ve ark., 2005). Bu tekniğin kolay uygulanabilir, ucuz ve yüksek motiliteye sahip spermatozoon elde edilmesi gibi olumlu yönleri bulunmaktadır. Ancak çok miktarda motil spermayı gerektirmesi, diğer tekniklere göre spermatozoon eldesinin az olması, spermatozoonun serbest oksijen radikallerin etkisine maruz kalması ve normal kromatine sahip spermatozoon miktarının diğer tekniklere göre daha düşük olması gibi olumsuz etkileri bulunduğu belirtilmektedir (Henkel ve Schill, 2007) Glass-wool Filtrasyon Tekniği Bu teknik, filtrasyon işlemi sonrası sadece canlı spermatozoa elde edilmesi prensibine dayanmaktadır. Dondurulmuş sığır spermasının ayrıştırılmasında glass-wool filtrasyon tekniğinin, swim-up tekniğine göre daha başarılı olduğu ancak bu tekniğin en geç 3 dakika içerisinde tamamlanmasının gerektiği belirtilmiştir (Gordon, 2003). Bu tekniğin kolay hazırlanabilir olması, iyi motiliteye sahip spermatozoon elde edilmesi, spermatozoon eldesinin yeterli olması, filtrasyon sonrası lökositlerin büyük oranda elimine edilmesi ve
26 serbest oksijen radikallerinin düşük oranda etkili olması gibi olumlu yönleri bulunmakla birlikte pahalı olması ve diğer tekniklere göre kalıntı bırakması gibi olumsuz yönlerinin olduğu bildirilmektedir (Henkel ve Schill, 2007) Percoll Density Gradient Bu teknik, spermanın iki farklı yoğunluktaki (%90; %45) percoll solüsyonuyla yüksek devirde santrifüjü sonrası motil spermatozoonun ayrışması prensibine dayanmaktadır. Percoll density gradient tekniğinde elde edilen kaliteli motil spermatozoon oranı, swim-up tekniğine göre daha yüksek bulunmuştur (Gordon, 2003). Bu tekniğin, yüksek yoğunlukta motil spermatozoon elde edilmesi, ayrıştırma işlemi sonucu lökositlerin ve serbest oksijen radikallerinin elimine edilmesi gibi avantajları bulunmaktadır. Bunun yanında percoll kalıntılarının (endotoksinlerin) spermatozoon için risk oluşturması gibi dezavantajlarından dolayı son dönemlerde özellikle insan hekimliğinde kullanım sıklığı azalmıştır (Henkel ve Schill, 2007) Fertilizasyon Fertilizasyon, iki gametin birleşerek somatik kromozom sayılarının meydana gelmesi ve yeni bir bireyin gelişmesi ile ortaya çıkan karmaşık bir süreçtir İn Vivo Fertilizasyon Memeli fertilizasyonu erkek ve dişi gametlerin birleşmesini içermektedir. Bu olayın başarılı olması için birleşmeden önce birçok adımın gerçekleşmesi gerekmektedir. Birçok memelide eksternal fertilizasyondan ziyade internal fertilizasyon bulunmaktadır. Fertilizasyonda ilk adım, dişi genital kanalda erkek semenin depolanmasıdır. Bu başlangıç aşamasında spermatozoa vajinadan servikse oradan uterusa ve ovidukt ampullasına göç etmelidir. Bu
27 sperm transportu spermin ileri hareketliliği ve uterus düz kaslarının kontraksiyonları ile olmaktadır. Transport esnasında fertilize oosit ovidukta ulaşana kadar, spermatozoa kapasitasyon diye adlandırılan kritik değişimlere maruz kalır. Kapasitasyon, hala net olarak anlaşılamamıştır. Kapasite olmuş spermde aerobik gilikolisis motilite artışı gözlenir. Ek olarak değişimlerin birçoğu spermin akrozom reaksiyonuna girmesine izin verir. Bu değişimler membran sağlamlığının azalması, kalsiyum geçirgenliğinin artması, spermin yüzeyindeki kalmodulin bağlayıcı proteinlerin kaybı ve sperm motilitesinin artmasını sağlayan çeşitli proteinlerin fosforilizasyonun artmasını içermektedir. Fertilizasyonunun görülmesi için kapasite olabilecek spermin oositle birleşmesi gerekmektedir. Memelilerin birçoğunda ovule olmuş matür oosit gevşek katlı hücrelerle çevrilmiştir ve bu yapı kumulus oophorusları oluşturur. Kapasite olmuş sperm, kumulus ile glikoproteinle kaplı oositin zona pellusidadaki reseptörlerle bağlanmasını sağlamalıdır. Spermatozoa, zona pellusidaya ulaştığında zonadaki proteinler akrozom reaksiyonuna neden olmaktadır. Akrozom, spermlerin hyalorinidaz ve akrosin gibi enzim içeren dış yüzeylerinin membrana bağlandığı kesedir. Akrozom reaksiyonu başladığında enzimlerin artışı ile akrozomun dış membranı kaybolur. Bu enzimler tahminen zonanın içinde parçalanarak fertilize olabilecek spermatozoonun oosite doğru hareketini sağlar. Spermatozoon oolemma ile kaynaştığı zaman genellikle spermin tamamı oositin stoplasmasında, sperm-oosit membran birleşmesinden oluşan bir yapı olarak bütünleşir. Sperm oosit birleşmesi olarak dişi gametin aktivasyonuna yol açar. Aktivasyon, oositin mayosisin metafaz II safhasına ulaşması ve kortikal granüllerin eksositosisi ile karakteristikdir. Oositin mayosisi tamamlaması ve ikinci kutup cisimciğinin oluşması aşamasında sperm yoğunlaşmaya başlar. Sperm nükleer zarı yıkımlanır ve protaminler sıkıca bağlanmış haldedir. DNA, oositin sitoplazmasında sperm yoğunlaştırıcı faktörlere maruz kalan sperm nükleusu olan histonlarla yer değiştirir. Glutationun azalması bu mekanizmayı etkileyen unsurlardan biri olmasına rağmen bu faktörlerin ne olduğu tam olarak açıklanamamaktadır. Bir sonraki aşamada bozulmamış çekirdek zarlı pronüklei
28 içinde sperm nükleusu ve haploid oosit nükleusunun metamorfozu oluşur. Bu pronükleuslar DNA sentezine maruz kalarak oositin merkezine doğru göç eder ve yan yana halde bir yapı oluşturur (singami). Bu pronükleus birleşmesi sonucu erkek ve dişi gamet kromozomları, ilk mitotik hücre bölünmesinde iki hücreli embriyo aşamasından önce, birbirine karışmış olur (Keller, 2001; Akyol, 2005; Bebitoğlu, 2008). Fertilizasyon, spermatozoa ve ovumun birleşmesi ile yeni bir bireyin şekillenmesidir. Fertilizasyon süreci, spermatozoanın oosit etrafındaki yapıları (kumulus hücreleri ve zona pellusida) aşması, oolemma ile birleşip kaynaşması ve oosit sitoplazması içinde serbest kalması şeklinde üç aşamada incelenmektedir. Daha sonra erkek ve dişi gametlere ait çekirdek materyalleri reorganize olarak pronukleusları şekillendirirler. Fertilizasyonun yaklaşık saatte tamamlandığı bildirilmektedir (Telfer, 1998) Spermatozoanın Kumulus Hücrelerine Penetrasyonu Spermatozoaların ejakulasyon noktasından, fertilizasyon noktasına olan göçleri (genital kanal transportu) yaklaşık 5-6 saat sürmektedir. Genital kanal transportu sonucu oviduktun istmus bölgesine spermatozoon ulaşmakta ve bunlardan yalnızca tanesi, 4-12 saat sonra ampulla bölgesinde canlılıklarını sürdürebilmektedir. Fertilizasyon bölgesindeki spermatozoalar oosite ulaşabilmek amacıyla, oosit çevresindeki kumulus hücrelerini aşmak zorundadırlar. Bu amaçla, spermatozoa kumulus hücreleri arasında ilerlerken kuyruk hareketleriyle bu hücrelerin arasını açar, akrozom reaksiyonu sırasında salgıladıkları hyaluronidaz enzimi aracılığı ile de kumulus hücrelerinin iyice ayrışmasını ve dağılmasını sağlar (Cupps, 1991; Hafez, 1993). Akrozom, spermatogenezis sırasında gelişen ve spermatozoa nukleusunun yaklaşık yarısını örten şapka benzeri bir organeldir. Akrozom
29 içerisindeki enzimlerin bir kısmı (hiyaluronidaz, akrozin, asit proteinaz, esteraz nöroaminidaz, fosfataz, fosfolipaz A, β-n-asetilglukozaminidaz, arilsülfataz, arilamidaz, kollajenaz) 1980 yılından önce tanımlanmış olmalarına karşın, β- N-asetilhekzosaminidaz, β-galaktosidaz, β-glukuronidaz, α-l-fukosidaz, fosfolipaz C, katepsin D, peptil peptidaz ve ornitin dekarboksilaz gibi bazı özel enzimlerin varlığı ise 1980 den sonra tanımlanabilmiştir. Bu enzimlerin tümü yalnızca akrozom içeriğinde bulunurken proakrozinin büyük kısmı iç akrozomal membran üzerine toplanmıştır (Muyan, 1984). Kalsiyum iyonları memeli spermatozoalarında akrozom reaksiyonunun başlamasında temel faktördür. Kapasitasyon sonucunda geçirgenliği değişen plazma membranından dışarı çıkan Ca iyonlarının, plazma membranı ile dış akrozomal membranı birbirinden ayrı tutan negatif yüzey gerilim yükünü nötralize ederek, bu iki membranın birleşmesini sağladığı ileri sürülmektedir. Bu teoriye göre Ca iyonları membranda su ve katyon geçirgenliğinde değişikliklere neden olarak akrozomun şişmesini ve yırtılmasını sağlamaktadır. Akrozom reaksiyonu sonucu ortaya çıkan hyaluronidaz enzimi, kumulus hücrelerini birbirine bağlayan hyaluronik asit kompleksi bağını eritir. Buna ek olarak spermatozoanın uyarılmış kuyruk hareketleri yardımıyla bu örtüyü geçmesi mümkün olur (Gordon, 2003) Spermatozoanın Zona Pellusidaya Tutunması ve Katetmesi Spermatozoanın fertilizasyon sürecinde aşması gereken ikinci yapı zona pellusidadır (ZP) ve zona pellusidanın aşılabilmesi spermatozoanın iç akrozomal membranındaki enzimlerin (zona lizin ve tripsin benzeri enzimler) salgılanarak aktive olması ile sağlanır. Spermatozoa zona pellusidaya ulaştığında, oositin ekvatoriyal çizgisi üzerinde bulunan sperma bağlayıcı reseptöre (ZP3) tutunur ve iç akrozomal enzimleri salgılayarak ZP nin derinlerine doğru ilerlemeye başlar (akrozom reaksiyonu). Zona pellusidayı kateden spermatozoanın perivitellin boşluğa geçip oolemma ile ilişkiye
30 girmesi sonucu zona reaksiyonu (kortikal reaksiyon) başlar (Hafez, 1993; Gordon, 2003). Zona reaksiyonununda, oositten salgılanan kortikal granüllerin içerdiği enzimler önce, dört sülfatlı glikoprotein yapıda olan ZP2 yi ZPα ya dönüştürür, sonra ZP3 ü modifiye eder ve böylece ZP yüzeyinde varolan spermatozoa bağlayıcı reseptörler (ZP1, ZP2 ve ZP3) inaktive olarak spermatozoaların ZP ye tutunması engellenir. Bu olaya polispermik blok adı verilmektedir (Akyol, 2005; Hafez, 1993; Gordon, 2003). Spermatozoanın zona pellusidayı aşması 5-15 dakikada tamamlanırken, perivitellin boşluğu geçmesi ise 1-2 saniyede gerçekleşmektedir (Hafez, 1993) Oosit ve Spermatozoa Hücre Zarlarının Birleşmesi (Gamet Füzyonu) Birleşme spermatozoanın halen sağlam olan postekvatoriyal kısmıyla gerçekleşir. Spermatozoa hücre zarını dışarıda bırakarak baş ve kuyruğu ile oolemma içerisine girer (Xu ve Greve, 1988; Shamsuddin ve ark., 1996). Spermatozoanın oolemma içerisine girişiyle beraber oositte zona reaksiyonu, ikinci mayoz bölünme tamamlanır ve oositin metabolik aktivasyonu gerçekleşir (Farin ve ark., 1997) In Vitro Fertilizasyon Arzu edilen İn vivo fertilizasyonu engelleyen ya da olmamasını sağlayan birçok faktör mevcuttur. İnfertilite, prematüre ölüm veya implantasyon öncesi genetik hasar bu istenilmeyen duruma örnek olarak verilebilir. Bu gibi durumlarda embriyo üretiminde yardımcı üreme teknikleri (YÜT) kullanılmaktadır. Bu amaçla, suni tohumlama, gamet intrafallopian transferi,
31 in vitro fertilizasyon, subzonal sperm enjeksiyonu (SUZI), intrasitoplazmik sperm enjeksiyon (ICSI) ve bir çok diğer teknik YÜT olarak kullanılmaktadır. ICSI, IVF de en sık kullanılan tekniklerden biridir (Keller, 2001). İn vitro fertilizasyon sırasında, normalden çok farklı koşulların etkisine rağmen in vivo fertilizasyonun birçok aşaması görev almalıdır. Örneğin; oositler maturasyon aşamasına ulaşmadığından fertilizasyona hazır olmak için maturasyon, in vitro olarak yapılmalıdır. Bu follükül uyarıcı hormon (FSH), lüteinleştirici hormon (LH), östrojen gibi hormonların ve büyüme faktörlerin de eklenebildiği maturasyon vasatında inkübasyon aşamasını gerektirir. İn vitro maturasyonda, kullanılan vasat, hormonlar, hormon konsantrasyonları, inkübatörün sıcaklığı ve maturasyon zamanı çeşitli farklılıklara sebep olur. Genellikle IVF için oositlerin kumulus genişlemesi ve nükleer maturasyonuna (birinci kutup cisimciğinin tespiti ile karakterizedir) bakılarak matüre olup olmadıklarına karar verilir. Benzer olarak spermatozoa da fertilizasyon için hazırlanmalıdır. IVF için epididimisden taze alınmış veya dondurulup çözdürülmüş sperm kullanılır. Eğer sperm taze olarak alınırsa, kapasitasyonu engellemesin diye seminal sıvı uzaklaşana kadar yıkanmalıdır. Dondurulmuş çözdürülmüş spermatozoa, percoll gradient gibi bazı hücre ayırıcı santrifüj teknikleri kullanılarak donmanın dondurucuda oluşan genişleticilerden ayrılmalıdır. Swim-up yöntemi de dengeleyici vasatların kullanımıyla pratikde sık kullanılan yöntemlerden biridir. Bu teknik, canlı sperm yoğunluğu ile ölü ve dejenere spermatozoaları birbirinden ayırmak gibi bir avantaja sahiptir. Başlangıçta spermatozoa yıkanarak kapasite olmaktadır. Spermin in vivo kapasitasyonu dişi genital sistemde doğal olarak gerçekleşmektedir. İn vitro kapasitasyon için ise fertilizasyon vasatına bazı kimyasallar eklenmelidir. Bu kimyasallar in vivo faktörlerin bazı aktivitilerini taklit eden heparin gibi glikozaminoglikanlardır (Keller, 2001). Kapasite olmuş spermatozoa ve mature oosit beraber mineral yağ ile kaplanmış fertilizasyon vasatı içeren droplara konarak uygun zamana kadar inkübatörde tutulur. Eğer IVF koşulları optimize ise, zigot olduğunu
32 varsaydığımız yapıyı kültür vasatına alırız veya transfer ederiz. IVF metodunun yapay olmasından dolayı in vivo fertilizasyonda karşılaşmayacağımız birçok endişe verici prosedür ile karşılaşılabilir. Örneğin oosite eklenecek spermatozoa sayısı polispermi riskini minimize edecek şekilde maksimum fertilizasyon etkinliği için dikkatli olarak hesaplanmalıdır. İn vivo fertilizasyonda, fertilizasyon anında ampulladaki spermatozoa sayısı dişi genital sistemin filtre etkisi göstermesinden dolayı başlangıçta olduğundan daha az sayıdadır. Isı düzeyindeki dalgalanmalar da kapasitasyon reaksiyonunu ve sperm-oosit etkileşiminin diğer aşamalarını etkileyen unsurlardan biridir. Kültür süresi de önemli etkiye sahiptir. Normalde uterusta kaldığından daha kısa sürede in vitro kültüre olan embriyoların gelişimi olumsuz etkileneceğinden endişilenilir (Keller, 2001). Bu uyarılara ve endişelere rağmen IVF, başlangıç çalışmalara göre birçok türde başarı ile uygulanabilmektedir. Louise Brown, 1978 yılında IVF yöntemi ile dünyaya gelen ilk bebektir ve şu anda sağlıklı genç bir birey olarak hayatını sürdürmektedir. Bundan birkaç sene sonra ise, 1982 yılında, in vivo matür oositlerin kullanıldığı IVF yöntemiyle ilk canlı buzağı elde edilmiştir. IVF prosedürü, insan hekimliğinde uygun infertil çiftlerde veya hayvansal üretim endüstrisinde az bulunan hayvanlarda veya istenilen ırk özelliklerine sahip değerli embriyolarda kullanılmaktadır. Ek olarak, nesli tükenen hayvan ırklarında da IVF başarılı olarak uygulanmaktadır. Bu gibi durumlarda sadece IVF yeterli olmamakta ICSI gibi farklı yöntemler önemli rol oynamaktadır (Keller, 2001).
33 Fertilizasyon Esnasında Sığır Oositlerindeki Fizyolojik Değişimler Oosit maturasyonunda mayosiz esnasında oositler fertilizasyona hazırlık amacıyla bir dizi nükleer ve sitoplazmik değişime uğrar. Maturasyonda hücre içi organellerin yeniden yapılanması ve Ca 2+ salınımı, sitoplasmik değişim sırasında germinal vezikül dağılımı, kromatin yoğunlaşması, ağ ipliği oluşumu gibi aşamaları içerir. Memeli oositlerinde hücre içi Ca 2+ salınımı tam anlaşılmamakla beraber fertilizasyon ve embriyonik gelişimi etkilemektedir (Chung, 1999) İntraselüler Ca 2+ Salınımı Genel inanış, sperm oosit birleşimi esnasında hücre içindeki endoplazmik retikulumdan yüksek oranda Ca 2+ salınımı olduğudur. Bu hücre içi Ca 2+ salınımı, oositin plasma membranından Na + /H + değişimini tetikler ve sonuç olarakta kısa süreliğine hücre içi ph sında artış görünür. P H artışı ile birlikte sitoplasmada inhibitör proteinler ortadan kalkar bunun sonucunda da protein ve DNA sentezi, lipit metabolizması, oosit oksidatif geçişin geri dönüşümsüz aktivasyonu başlar. Elektrikle uyarılan fare oositlerinde Ca 2+ salınımının fare oosit maturasyonunda spontan olarak salınan inositol 1,4,5-triphosphate receptör (InsP3R) ün açığa çıkmasına aracılık ettiği bildirilmektedir (Chung, 1999; Malcuit ve ark., 2006). Fertilizasyonda kısa süreli kalsiyum artışı kortikal granülün eksositozisini indükler. Binlerce kortikal granül perivitellin boşlukta oosit plazma membranın alt kısımlarında birleşmiş haldedir. Zona pellusidadaki kortikal granüller zona pellusidada sertleşmeye sağlayan birçok enzim içermektedir ki bu reaksiyona zona reaksiyonu denmektedir. Zona reaksiyonu zona pellusida da sperm bağından sonra polispermi açısından blok oluşturur (Chung, 1999).
34 Memeli oositlerinde Ca 2+ salınımı 20 saat kadar sürebilmektedir. Mayosisin tamamlanması ile fertilizasyonda sperm ile tekrarlanan kısa süreli Ca 2+ salınım tetiklenir. Ca 2+ salınımı interfaz esanasında değil, sperm varlığının sonucu olarak germinal vezikül dağılımından sonra oluşur. İnterfaz safhasına girildiğinde pronükleus oluşurken kalsiyum salınımı durur. Bu durağan dönem spermin indüklediği Ca 2+ un salındığı dönemdir. Her hücre içi kalsiyum çıkıntıları sentral ooplasma oluşmadan önce oositin periferinde odaklanır oradan periferal bölgenin girişine dağılır. Bu periferal Ca 2+ dalgalanması sonrası ooplasmada yaygın hücre içi Ca 2+ artışıyla devam eder. Bununla beraber bu merkezi Ca 2+ artışı sadece kalsiyumun periferal ooplasmada azaldığı anda pik yapar (Chung, 1999). Hamster oositinde en fazla hücre içi Ca 2+ artışı spermatozoonun yumurta plasma membranına penetrasyonundan saniye sonra oluşur. Ca 2+ salınımı spermin birleşim alanlarına yakın yerlerde olur. Bu olay 4-7 saniye ile saniye arasında olmaktadır. İlginç olarak, Ca 2+ patlaması hızlı bir şekilde olurken düzenli aralıklara 2 dakika ile 60 dakika arasında devam eder. Fertilize olmuş matür fare oositinde ilk büyük Ca 2+ salınımı fertilizasyondan sonra 3-4 dakika aralıklarla artarak çoğalan, küçük salınımları takip ederek 1-3 saat içinde oluşur. Matüre olmayan oositlerde sadece 2-3 salınım olduktan sonra kalsiyum salınımı 1 saat içinde durur. Fertilize fare ve hamster oositlerinde sitoplazmik Ca 2+ artışı hem plasma membrandaki Ca 2+ kanallarının açıklılığının hem de kalsiyumun depolanmasının devamlılığını sağlar. ICSI ile fertilize edilmiş insan oositinde de dakika gibi daha uzun zamanlarda da olsa Ca 2+ salınımı olmaktadır. Fertilize olmamış sığır oositinde başlangıçta temel olarak hücre içi Ca 2+ un salınımı 5 saat sürmektedir ve ortalama konsantrasyonu 100nM civarındadır (Chung, 1999). Fertilizasyon sırasında sığır oositinde 3 farklı hücre içi Ca 2+ salınım aşaması vardır: Bunlardan en önemlisi spermin uyardığı Ca 2+ yükselmesidir. Ca 2+ un bu dönemdeki değeri ortalama 56±11 nm dur. Pik yaptığı dönemlerde ise bu değer 870±184 nm civarındadır ki bu kısa süreli
35 yükselmelerde ulaştığı değerden (420±27nM) çok yüksektir. Sperm penetrasyonundan sonra hücre içi Ca 2+ salınımı artması oositinin iç ve dış çeperindeki delinmeleri gösterir. Ek olarak ilk artıştan birkaç saat önce sperm kapasitasyonu için zaman gerekmektedir ki kapasitasyon sığırlarda diğer türlere nazaran daha uzun sürmektedir. Döllenmeden 9 saat sonra (sperm penetrasyonundan yaklaşık 3-5 saat sonra) bir oosit için ortalama 2,8±1,6 kez ve 24,3±7,3 dakika civarı süren Ca 2+ salınımını olmaktadır. Memeli oositlerinde gelişimin aktive olması için fertilizasyon esnasında kalsiyum açığa çıkması şarttır. Bu mekanizma, tam çözülmemekle beraber sperm tarafından tetiklenmekte ve uzun süre devamı sağlanmaktadır. Ayrıca spermin, oosit plazma membranındaki reseptörleri etkilemekte ve bunun sonucu olarak da hücre içi Ca 2+ artışının uyarıldığı düşünülmektedir (Chung, 1999; Yazawa ve ark 2000)
36 Şekil Fertilizasyonu takiben sperm faktör oosit aktivasyonu (Boni ve ark., 2007). * FC: Fertilizasyon, RF:relativefluorescence, pa:picoampere. Şekil de spermin oosite girmesi ile phosphatidylinositol 4,5- bisphosphate (PIP 2 ) nin hidrolizi ve 1,2-diacylglycerol (DAG) ve inositol 1,4,5- trisphosphate (IP 3 ) ün üretimi şematize edilmiştir. IP 3 özel bir reseptör olan IP 3 R-1 i stimüle eder. Bu da endoplasmik retikulumdan (ER) serbest Ca 2+ salınımının artışına sebep olur.
37 Histone H1 Kinazdaki Değişimler Matür memeli oositleri maturasyon destekleyici faktör (Maturating promonotion factor, (MDF)) sayesinde mayozun metafaz II safhasına ulaşmış haldedir. MDF, siklinler ve hücre siklusunda G2 den M ve G1 den S fazlarına geçişte temel rol oynar p34cdc2 proteinlerinin iki kere düzenlenme oluşan bir faktördür. Hücre siklusunun ileri interfaz aşamalarında p34cdc2, siklin ile bir yapı oluşturur ve G2/M dönüşümünde p34cdc2-siklin kompleksi defosfarilasyonu ve p34cdc2 ile histon H1 kinaz aktivasyonu ile oluşur. MDF ün kinaz aktivasyonu Ca 2+ un salınımı ile başlar ve bu reaksiyon germinal vezikül yıkımlanması, kromozom yoğunlaşması, iğ ipliği oluşumu ve mature olmayan memeli oositin metafaz II safhasına girmesine yol açar (Chung, 1999). Oositlerin yapay aktivasyonu veya fertilizasyonda görülen mayotik duraksama, MDF ün inaktivasyonu ile oluşur. Metafaz II safhasının oluşması ise histon kinaz aktivasyonunun sona ermesiyle ilişkilidir. Fertilizasyon, oositte periyodik olarak Ca 2+ yükselmesini tetikler ve bunun sonucunda da siklin bozunlanması ve p34cdc2 fosforilasyonu ile MDF ün inaktivasyonu sağlanır. Oositlerde histon H1 kinaz inaktivasyonu mayozun tekrar başlaması ve ilk embriyonik hücre siklusuna girilmesini sağlar. Histon H1 kinaz inaktivasyonu hücre dışı Ca 2+ a bağlıdır ve bir seri Ca 2+ stimulasyonu ile düzenlenir. Ca 2+ artışı ve histon H1 kinaz etkileşimi fertilizasyonda kritik rol oynar. Fertilizasyon esnasında Ca 2+ reaksiyonu sperm tarafından uyarılır ve böylece mayosisin bitimi ile sonuçlanan kinaz aktivasyonun son bulması gerçekleşir. Fertilize oositte histon H1 kinaz aktivitesi, inseminasyondan 5 saat sonra orijinal seviyesi olan %19±1.2 lere düşer ve 8 saat sonunda tamamıyla son bulur (Chung, 1999). Histon H1 kinaz aktivasyonunun düşmesi tek fazlı Ca 2+ salınımına yol açabilir. Bir saat içinde histon H1 kinaz %44±11,5 oranında inaktifdir ancak bu inaktivasyon kısa sürelidir. Tek fazlı Ca 2+ uyarımından 2 saat sonra
38 aktivasyon artmaya başlar ve 4 saate kadar artış hızlanır ve 6. saatte sonlanır. Bununla beraber tek fazlı Ca 2+ uyarımının histon H1 kinaz inaktivasyonunu tetiklemesine rağmen inaktivasyon başlangıcından sonra histon H1 kinaz tekrar aktive olur. Histon H1 kinazın erken reaktivasyonu, embriyo gelişimine zararlı etkiler doğurabilir. MDF ün aktive olması, kromozom yoğunlaşmasını indükler. Hücre siklusunun erken döneminde histon H1 kinaz reaktivasyonu embriyonik kromatinin erken yoğunlaşmasını tetikleyebilir. Tek fazlı Ca 2+ stimülasyonundan sonra embriyonik kromatinin erken yoğunlaşması, pronükleer formasyonun uyarılmasına yetmeyecek bir aktivasyon ile metafaz III e girilmeyi sağlayabilir. Buna ek olarak erken embriyonik kromatin yoğunlaşması, diğer aşamalarda kromatin yoğunlaşması artan H1 kinaz aktivesi etkisiyle görülebilir ki buda hasarlı embriyonik gelişime sebep olabilir. İlk hücre siklusundaki H1 kinaz reaktivasyonun embriyo gelişimi üzerine olumsuz etkileri vardır (Chung, 1999). Kinaz reaktivasyonun gecikmesi veya reaktivasyon süresinin azalması Ca 2+ stimülasyon sayısını artırır. Tek bir uyarım bile H1 kinaz inaktivasyonunu başlamasına yeterlidir. Sonraki Ca 2+ stimülasyonları için bazal H1 kinaz aktivitenin devamı gerekmektedir. Fertilizasyonda kısa süreli çoklu Ca 2+ artışının fonksiyonlarından biri de, inaktif formdaki MDF ün devamlılığıdır. Kısa süreli Ca 2+ artışı hücre siklusunun başlamasına yol açar. Bu başlangıç DNA sentezinin ve p34cdc2 fosforilizasyonun uyarılmasını da sebep olur. Bununla beraber benzer olarak elektrik uyarımı ile yapılan yapay oosit aktivasyonunun çoklu Ca 2+ yükselmesi etkisiyle MDF ün devamlılığı ve histon H1 kinaz inaktivasyonu sağlanır. Bu yöntemde 22 dakika aralıklı 3 Ca 2+ uyarımı olduğunda histon H1 kinaz inaktivasyonu ilk stimülasyondan sonraki 1 saat içinde gözlenmektedir. Bu tekrarlayan düşüşleri takiben H1 kinaz aktivitesi 3-4 saat içinde orijinal seviyesinin %20±2,5 civarında kalır. İlk stimülasyondan 4-5 saat sonra histon H1 kinaz aktivasyonu kademeli olarak 8 saate kadar artmaya başlar ve %38±15 e kadar yükselir. Bununla beraber histon H1 kinaz başlangıç stimülasyonundan sonra hızlı bir şekilde inaktive
39 olur ve ilk stimülasyondan 5 saat sonra tekrar aktive olmaya başlar. Çünkü başlangıç uyarımından 5 saat sonra MDF ün aktive olması ile histon H1 fosforilizasyonunda artış gözlenir (Chung, 1999). İlk stimülasyondan sonraki 8 saate kadar 6 Ca 2+ stimülasyonu ile bazal histon H1 kinaz aktivitesi devam eder. Bu aktivite ilk uyarımı takiben 1 saat içinde %14±04 e düşerek 8 saate kadar bazal seviyede (%14-19) devam eder. Bu 6 uyarımdan sonraki 8 saate kadar histon H1 kinaz reaktivasyonu gözlenmez. Bu nedenle Ca 2+, stimülasyon sayısı uyarılmış oositlerde histon H1 kinaz reaksiyonunun başlangıcını ve genişliğini düzenleyebilir. Bununla beraber bu uygulamada partenogenetik gelişim düşük gözlemlenmektedir. Bazal histon H1 kinaz aktivitesi fertilize oositlerdekine benzer olsa da bu aktivasyon prosedüründe MDF ün yokluğu veya uzaması gibi zararlı etkiler oluşabilir. Hücre siklusunun bu aşamasında MDF ün reaktivasyonu embriyonik gelişim üzerine zararlı etkileri olabilir. Alternatif olarak bu oositlere aşırı uyarım uygulanabilir. Ca 2+ aşırı uyarımın bazal MDF aktivitesi üzerine etkisi olmamasına rağmen çok fazla hücre içi Ca 2+ hücre fonksiyonlarını etkileyerek oosit aktivasyonu sağlanabilir (Chung, 1999) In Vitro Fertilizasyonu Etkileyen Faktörler In Vitro Kapasitasyon Ajanları Sığır spermatozalarının in vitro kapasitasyonu amacıyla yüksek-güçlü iyonik sıvılar, sığır follikül sıvısı, sığır ovidukt sıvısı, heparin, vasat ph sının yükseltilmesi, lipozomlar, kalsiyum iyonofor (A23187), Percoll gradient/hipotaurin, ovidukt hücre katmanları, test yolk ve kafein kullanılmaktadır (Gordon, 2003).
40 Sığır Ovidukt Sıvısı Sığır ovidukt sıvısı, in vitro ortamda spermatozoonun kapasitasyonu ve motilitesini desteklemektedir. Spermatozoalar, folliküler evredeki oviduktal sıvıda, luteal evredeki oviduktal sıvıya göre daha hızlı kapasite olmaktadır. Kapasitasyon faktörleri olarak bilinen glukozaminoglikanlar östrus dönemindeki oviduktal sıvıda bulunmaktadır. Ayrıca östrus döneminde ovidukt epiteli ve ovidukt tarafından sentezlenen proteinler, spermatozoon kapasitasyonu, motilitesi ve fertilize olma kabiliyetini artırmaktadır (Anderson ve Killian, 1994). Folliküler ve oviduktal sıvıda bulunan yüksek yoğunluğa sahip lipoproteinlerde (HDL) spermatozoon kapasitasyonunu uyarmaktadır. Sadece dişi genital kanalında bulunan lipoproteinlerin miktarı en çok ovulasyon sırasında artmaktadır (Lane ve ark., 1999) Folliküler Sıvı Follikül sıvısının içeriğinde bulunan düşük moleküler ağırlıktaki proteoglikanlar sayesinde kapasitasyonun gerçekleştiği düşünülmektedir. Proteoglikanlar heteropolisakkarit yan zincirine sahiptir. Bu yan zincirler glikozaminoglikanları (GAG) içermektedir. Folliküler sıvıda bulunan heparin benzeri glikozaminoglikanlar spermatozoon kapasitasyonunda önemli rol oynamaktadır (Lane ve ark., 1999) Heparin Sığır spermatozoalarının kapasitasyonu amacıyla en çok kullanılan ajanlar, glikozaminoglikanlar ve özellikle de heparindir (Gordon, 2003). Heparinin kullanım amacı, in vivo ortamda seminal plazmadaki heparin bağlayıcı proteinlerin ve dişi reprodüktif kanalında heparinin bulunmasından dolayıdır (Duran, 2000). Spermatozoonun heparin ile kapasitasyonu, heparinin spermatozoaya bağlanması, heparinin dozu ve süresine bağlıdır. Heparinle
41 kapasitasyonda vasatın Ca 2+ ve bikarbonat içermesi ve ph nın 7 ya da daha yüksek olması gerekir. Heparinle uyarılan kapasitasyonda Ca 2+, serbest Ca ve hücre içi ph artmaktadır. Glikoz, fruktoz ya da mannoz gibi glikolitik substratlar spermatozoaların heparinle kapasitasyonunu baskılamaktadır (Uguz ve ark., 1994). Kapasitasyon amacıyla, heparinin spermatozoa ile fertilizasyondan önce muamelesi gerçekleştirilebildiği gibi, son dönemlerde heparinin doğrudan fertilizasyon vasatına katılmasıyla da kapasitasyonun gerçekleştiği belirtilmiştir. Bu tekniğin, fertilizasyonun yanı sıra embriyo gelişimini de olumlu etkilediği bildirilmiştir (Gordon, 2003) Sığır Serum Albumini In vitro fertilizasyon vasatlarında rutin olarak kullanılan sığır serum albuminin (BSA) başlıca rolü, önemli ölçüde kapasitasyonu bağlayıcı role sahip kolesterol ve çinkonun spermatozoadan uzaklaştırılmasını sağlamaktır (Duran, 2000). Hücre membranına bağlı olan kolesterol kapasitasyon sürecinde sperm plazma memranından uzaklaşmaktadır. Aynı şekilde çinko da kapasitasyonun erken döneminde plazma membranından ayrılmaktadır (Gordon, 2003) Kalsiyum İyonofor Kalsiyum iyonofor (A 23187), kapasitasyonun erken aşamalarında sığır spermatozoasına Ca 2+ girişine neden olmasından dolayı spermatozoa kapasitasyonu ve akrozom reaksiyonunu desteklemektedir. Ayrıca iyonofor uygulaması, sığır spermatozoasının respiratorik aktivitesini artırmaktadır (Duran, 2000; Gordon, 2003).
42 Bu tekniklerin dışında sığır spermatozoasının kapasitasyonu amacıyla Test yolk buffer, kalsiyum bulunmayan Tyrode vasatı, Platelet aktivasyon faktörü, lipozomlar, amino asit ve katekolaminler, şelat ajanları ve progesteron kullanılmaktadır (Gordon, 2003) Fertilizasyon Vasatları Sığırlarda in vivo fertilizasyon, in vivo ortamda tuba uterinanın ampulla kısmında meydana gelmektedir. In vitro fertilizasyon sistemlerinde fertilizasyon vasatının bu ortamdaki şartları taklit edebilmesi, bir başka ifadeyle sekonder oosit ve kapasite olmuş spermatozoa için uygun bir ortam sağlaması ve spermatozoanın oosite penetrasyonunu kolaylaştırması gerekmektedir (Abdoon, 2008). Bu amaçla 25 mm sodyum bikarbonat, %0,6 BSA, sodyum laktat ve sodyum pirüvat katkılı modifiye Tyrode nin vasatları kullanılmaktadır. Fertilizasyon vasatı olarak daha az sıklıkla Brackett- Olimphant (BO) vasatı ve Charles Rosenkrans-1 (CR1) aa da kullanılmaktadır (Gordon, 2003; Kanagawa ve ark., 1995) Su Kalitesi Su, IVM ve IVF vasatları için en önemli unsurlardan biridir. In vitro maturasyon ve fertilizasyon sistemleri için kullanılacak suyun bütün kontamine edici etkenlerden arındırılmış, ultra saf su olması gerekmektedir. Bu amaçla suyun, distilasyon, deiyonizasyon, filtrasyon, adsorbsiyon ve ultrafiltrasyon işlemlerine tabi tutulması gerekmektedir (Abdoon, 2008) Kültür Şartları Pinynopummintr ve Bavister (1994), %5 CO2 li hava ile %5 CO2, %5 O2 ve %90 N2 karışımından oluşan ortamları karşılaştırdıklarında, düşük oksijen
43 konsantrasyonunun (%5-10) sığır oositlerinin in vitro maturasyon ve fertilizasyonu üzerinde olumsuz etkisinin olduğunu belirtmişlerdir. Ayrıca aynı araştırmacılar, ortamın maksimum neme sahip olmasının vasatın buharlaşmasını engellediğini bildirilmişlerdir Işığın Etkisi Sığır oositlerinin IVF sinde oosit ve spermatozoon, güneş ışığı ya da suni ışığa kaçınılmaz bir şekilde maruz kalmaktadır. Bu süreçte iki ışık türünün de olumsuz etkilerinin olduğu bilinmektedir. Bu amaçla embriyonun gelişim sürecinde karanlık ortamların ışıklı ortamlara göre daha yararlı olduğu belirtilmektedir (Abdoon, 2008; Gordon, 2003) Mikromanuplasyon Teknikleri Gamet manuplasyon yöntemleri, potansiyel uygulama pratiğinin yanı sıra, normal sperm-oosit ilişkisi hakkında yapılan araştırmalarda da kullanılabilmektedir. Fare, hamster, tavşan ve sığır oositlerine sperm enjeksiyonunun başarısını etkileyen faktörler hakkında birçok çalışma yapılmıştır (Markert, 1983; Keefer ve Brackett, 1987; Clarke ve Johnson, 1988; Lassalle ve Testart, 1988; Martin ve ark., 1988; Keefer ve ark., 1990). Sperm motilitesinde anormallik veya sperm sayısının az olduğu durumlarda kullanılan dört yardımcı fertilizasyon tekniği bulunmaktadır. Bu teknikler; Zona inceltme (Zona thinning), Zona delme (Zona drilling), Subzonal sperm enjeksiyonu (SUZI), İntrasitoplazmik sperm enjeksiyonu (ICSI) dur (Gordon, 2003). İlk üç teknikte ZP bariyeri kaldırılmaktadır. Bununla birlikte bu tekniklerde sperm hala motil ve vitellin membranla birleşebilme kapasitesine sahip olmalıdır. Dördüncü metot olan intrasitoplazmik sperm enjeksiyonunda
44 ise sperm, ooplazma içine enjekte edilerek hem ZP bariyeri geçilmekte hem de sperm-oosit membranı birleşmesi gerçekleşmektedir. ICSI yönteminde spermin motil olmasına ihtiyaç yoktur, canlı hatta bozulmamış olması yeterlidir (Meng ve Wolf, 1997; Hinrichs, 2005). Bu yöntem ile değerli evcil ve egzotik hayvan türlerinin spermalarının uzun süre saklanarak kullanılmasını sağlamakta, spermanın kapasitasyon ve depolanma sorunlarının üstesinden gelinmesine yardımcı olmaktadır. Ancak tüm bu dört teknik, oosite zarar verme ve polispermi gibi bir dizi risk içermektedir. Bununla birlikte, bu teknikler çok pahalı donanımlar ve çok iyi yetişmiş personel gerektirmektedir (Keefer, 1990). Mikromanuplasyon yöntemlerinde, uzun mesafeli objektiflerle çalışabilen invert mikroskop veya bir alana sabitlenmiş mikroskop, mikromaniplatörler ve cam pipetlerin hazırlanabilmesi için iğne puller ile mikroforge sistemleri gerekmektedir. Oosit holding pipetinin ölçüleri araştırmacılara göre farklılık göstermekle birlikte, genellikle dış çapı µm ve iç çapı da 5-20 µm arasında olmaktadır. Enjeksiyon pipetlerinin şekli ve ölçüleri yapılacak tekniğe göre farklılık göstermektedir. Kısmi zona diseksiyonunda keskin uçlu mikropipetler kullanılırken, zona açma yönteminde keskin uçlu mikrokancalar kullanılmaktadır. Zona delmek için kullanılacak enjeksiyon iğneleri 4-8 µm gibi daha küçük dış çapa ve 2-5 µm luk iç çapa sahiptir. Sperm yerleştirme veya enjeksiyonu için kullanılacak enjeksiyon iğneleri daha konik ve daha büyük ölçülerde olmaktadır. Sperm enjeksiyon iğnelerinin ölçüleri ise enjekte edilecek spermin büyüklüğüne bağlıdır. Pipetlerin basınç/emme kontrolü amacıyla geliştirilen farklı hidrolik sistemler mevcuttur. Mikropipetler, bir mikrometre enjektörü veya mikroenjektör ünitesine tüplerle bağlantılıdır. Tüp sistemi ve enjektör hortumları, hafif silikon yağı ya da su ile doldurulmaktadır. Maniplatörün kurulum seçenekleri genellikle, ulaşılabilen donanımlara, laboratuvarda kullanılmak üzere öğrenilen tekniklere ve personelin tercihine göre değişmektedir (Keefer, 1990).
45 Zona İnceltme Sperm-ZP karşılaşması ve bağlanması, gametler arası ilişkide ilk aşamadır. Bağlanma, ZP (ZP3) da bulunan sperm reseptörleri ve sperm plazma membranında bulunan proteinlerin bir araya gelmesi ile meydana gelmektedir (Gordon, 2003). Zona inceltme metodu, geçmişinde fertilizasyon problemleri olan hastalarda kullanılmaktadır. Bu yöntemin, düşük penetrasyon yeteneği olan sperme sahip erkekler için faydalı bir yöntem olduğu bildirilmektedir. (Kiessling ve ark., 1988; Mordel ve ark., 1992) Zona Delme Zona delme yöntemi, ZP da mekanik olarak, lazer ablasyonu veya zona üzerine mikroenjektör ile çözücü madde uygulanarak küçük bir yol açmak olarak tanımlanmaktadır. İlk zona delme yöntemi fare oositlerinde, oosit zarından spermin girebileceği kadar bir delik açılarak gerçekleştirilmiş ve bu teknik ile canlı yavrular elde edildiği bildirilmiştir (Depypere ve ark., 1988). Barlow ve arkadaşları (1991), Proksimal epididimal tıkanmanın olduğu ve yalnız kaput bölgesindeki sperme ulaşılabilen hastalarda bu tekniğin kullanılabileceğini rapor etmektedir. Edirisinghe ve arkadaşları (1991), zona delme yöntemi ile partenogenetik aktivasyon olmadan %97 den fazla zigotta blastosist aşaması meydana geldiğini bildirmektedir. Fare ve hamster oositlerinde yapılan çalışmalarda ZP nın hatasız olarak delinmesinde lazer teknolojisinin başarılı olduğu belirtilmektedir. Bu türlerde yapılan lazerle zona delme çalışmaları ile düşük sperm konsantrasyonlarında, embriyo gelişimine herhangi bir yan etki olmadan IVF etkinliğinde gelişmeler sağlamıştır. Son yıllarda lazer teknolojisinde meydana gelen bu gelişmeler, biyomedikal çalışmalar ve uygulamalar açısından önayak olunmuştur (Gordon, 2003).
46 Subzonal Sperm Enjeksiyonu (SUZI) Subzonal sperm enjeksiyonu (SUZI) yöntemi (aynı zamanda zona altına inseminasyon (UZI), sperm mikroinseminasyon (SMI) ve sperm transferi ile mikroinseminasyon (MIST) olarakda adlandırılmaktadır) ile elde edilen ilk canlı yavru, Mann (1988) tarafından fareler üzerine yapılan bir çalışmada elde edilmiştir. Spermin perivitellin boşluğa mikroenjeksiyonu ya da SUZI, insan IVF çalışmalarında erkek infertilitesi açısından etkili bir tedavi seçeneği olmaktadır. Subzonal sperm enjeksiyonu yöntemi ile birçok çocuk dünyaya gelmiştir (Gordon, 2003). Sığır oositleri üzerinde çok sınırlı sayıda SUZI çalışması yapılmıştır. Yapılan çalışmalar ise Almanya (Schwiderski ve ark., 1990), ABD (Yang ve ark., 1990; Heuwieser ve ark., 1991) ve Tayland (Pavasuthipaisit ve ark., 1994) da gerçekleştirilmiştir. Subzonal sperm enjeksiyonu (SUZI) yöntemi sığırlarda, sperm-oosit etkileşimi açısından dikkate değer bir teknik olarak belirtilmekle birlikte, fertilizasyon oranları genellikle düşük bulunmaktadır (Gordon, 2003) İntrasitoplazmik Sperm Enjeksiyonu (ICSI) Yardımcı fertilizasyon tekniklerinden biri olan ICSI, spermatozoonun direkt oositin sitoplazması içine mekanik olarak yerleştirilmesi metodudur. Bu metot, aynı zamanda oosit sitoplazmasına direkt inseminasyon (DISCO), direkt intrasitoplazmik inseminasyon (DICI), intrasitoplazmik inseminasyon (ICI) ve sitoplazma içine mikroinseminasyon (MIMIC) olarak ta adlandırılmaktadır. Bu tekniğin kullanılması ile sperm penetrasyonunu içeren kumulus hücresihiyaluronik asit matriks bariyeri, zona pellusida ve ooplazmik membran pas geçilmektedir. Bu bariyerlerin intrasitoplazmik sperm enjeksiyonu (ICSI) uygulanarak pas geçilmesi ile fertilizasyon ve embriyo gelişiminde sperm gibi çeşitli rollerin sürece etkisi ayrıntılı olarak araştırılabilmektedir (Chung ve ark.,
47 2000). ICSI, diğer yardımcı üreme teknikleri amacıyla kullanılan mikromaniplasyon yöntemlerinden daha sık kullanım alanı bulmuş ve bir çok tür üzerinde çalışılmıştır (Ogura ve ark., 2003). İntrasitoplazmik sperm enjeksiyonu (ICSI) yönteminde herhangi bir sperm tipi (sperm başı, immotil sperm, ölü sperm ve kusurlu sperm) ile kapasitasyon ya da akrozom reaksiyonuna gerek kalmadan fertilizasyon sağlanabilmektedir (Gordon, 2003). Goto ve arkadaşlarının (1990) yaptığı bir çalışmada, in vitro şartlarda maturasyonu sağlanan oositin sitoplazmasına ölü boğa spermi enjekte edilerek embriyonik gelişme izlenmiştir. Bu çalışmanın sonucunda sağlıklı, canlı ve normal bir buzağının doğumu gerçekleştiği bildirilmektedir. Boğa spermi, epididimis boyunca olan değişiklikler gibi birtakım olaylarla fiziksel ve kimyasal şartlara çok dirençli bir çekirdeğe sahiptir. Aynı durum insan spermi için de geçerli olmaktadır. Boğa sperm çekirdeğinin düşük ısılara direnci, dondurulmuş-çözdürülmüş semen ile yapılan suni tohumlamalar sonucu doğan milyonlarca buzağı ile kanıtlanmıştır. Diğer taraftan, 30 dakika boyunca 90 C ısıya maruz kalan insan spermasının hamster oositine enjeksiyonunun ardından pronükleus geliştiği de ortaya konmuştur (Katayose ve ark. 1992; Gordon, 2003). Deoksiribonükleik asit (DNA) ile sperm-spesifik temel proteinler, protaminler ve kromatini yoğunlaştıran olgular arasındaki ilişki sperm çekirdeğini yapısal olarak istikrarlı ve genetik olarak inaktif tutmaktadır. Sığır gibi çiftlik hayvanlarında, spermin epididimisten geçişi sırasında gerçekleşen protaminlerin disülfid kemikleri ile yaptıkları geniş çapraz bağlantılar sayesinde sperm çekirdeği daha istikrarlı (fiziksel ve kimyasal etkenlere karşı dirençli) hale gelmektedir (Gordon, 2003). Memeli sperm DNA sı, mitotik kromozomlardan en az 6 kat daha yoğun bir özelliğe sahip olan en sağlam sıkıştırılmış ökaryotik DNA dır (Ward ve Coffey, 1991). ICSI, küçük laboratuvar hayvanlarında ve insanda iyi oturmuş bir yöntemdir ve insanlarda, özellikle erkek hastalarda gözlenen ciddi infertilite problemleri nedeniyle popülaritesi gittikçe artan bir tekniktir (Palermo ve ark.,
48 1992). İnsan, fare ve tavşanlarda yapılan çalışmaların aksine, sığırlarda sperm enjeksiyonu ile ilgili az sayıda çalışma bulunmaktadır. İlk ICSI buzağıları doğmuş olsalar da, bu türde başarıyı etkileyen faktörler hala yeterince açıklığa kavuşmamıştır. Ancak bu sonuç ile in vitro şartlarda mature edilen sığır oositlerinin sperm mikroenjeksiyonu yöntemi ile fertilize edilebildiği ve elde edilen zigotların gelişim aşamalarını tamamlayabildiği ortaya konmaktadır (Goto ve ark., 1990). Westhusin ve ark. (1984) tarafından yapılan sığır oositlerinde sperm enjeksiyonu sonrası pronükleer biçimlenme çalışmasından beri birçok araştırmacı, sığırlarda ICSI tekniğinin geliştirilmesi amaçlı çok sayıda araştırma yapmıştır. Ancak ICSI tekniğinde en sık karşılaşılan problem, mikroenjeksiyon yapılan sığır oositlerinde düşük oranda canlı embriyo elde edilmesi olarak belirtilmektedir. Sperm enjeksiyonu ile ilgili bir problem de belirsiz sperm dekondenzasyon seviyesi ile mikroenjeksiyon sonrası pronükleer biçimlenme arasındaki ilişkidir. Sınırlayıcı faktörlerden biri, sığır oositlerinin enjeksiyon sürecine fare ve tavşan oositlerine oranla daha az duyarlı olmasıdır. Sperm enjeksiyonu sonrası sığır oositlerinin ancak %2 si aktive olmaktadır. Bu nedenle sığır oositlerinde sperm mikroenjeksiyonu sonrası canlı embriyo oranları diğer türlerden daha düşük olmaktadır. Diğer türlerden farklı olarak, sığır oositlerinin farklı tedavi yöntemleri ile aktive edilmesi gerektiği ortaya konulmaktadır (Chung, 2000). Yapılan araştırmalar, sığır oositlerine sperm enjeksiyonunun SUZI tekniğinden daha yüksek fertilizasyon oranı sağladığını bildirmektedir. Sperm enjeksiyonu ile kısa kuyruklu sperme bağlı infertilite problemi olan boğalarda başarılı fertilizasyonlar elde edildiği rapor edilmektedir. Bu gibi sonuçlar gösteriyor ki, boğa infertilitesi ya da fertilite zayıflığı gibi sebeplere bağlı durumlarda sperm enjeksiyonu IVF e oranla çok daha üstün olmaktadır (Heuwieser ve ark., 1992). Catt ve ark. (1994) tarafından yapılan bir çalışmada ICSI metodu ile yapılan fertilizasyonların SUZI metoduna göre tartışılmaz bir üstünlük sağladığı ortaya konmuştur. Aynı çalışmada, sperm hasarı (sperm kuyruğunun pipet ile kırılması) oositin normal fertilizasyon
49 sürecini başarıyla tamamlayabilme oranını artırmakta olduğu belirtilmektedir. Bununla birlikte, oositi aktive eden sinyallerin sperm hasarıyla serbest kalan bileşenler olup olmadığı tam olarak açıklanmamıştır. Hiramato 1962 yılında ilk ICSI tekniğini denizkestaneleri gametlerinde denemiştir. Çok cesurca olan bu ilk uygulamada teknik olarak tek bir spermatozoonun seçilip cam mikro iğnelerle oositin stoplasmasına injeksiyonunu kapsamaktadır da hamsterda ICSI uygulanana kadar bu teknik memelilerde kullanılamamıştır (Uehara ve Yanagimachi, 1976) yılında Palermo ve arkadaşları ICSI yöntemiyle ilk sağlıklı bebek elde ederek tüm dünya basınında manşetlerde yerini aldı. İlk ICSI uygulamasından günümüze kadar İnsan hekimliğinde bu teknik yaygın olarak kullanılmaya başlanmıştır. Araştırıcılar birçok evcil ve laboratuvar hayvanlarda ve bitki çeşitlerinde ICSI tekniği kullanmışlardır. ICSI insan klinik sahasında, hayvan model deneylerine bakmaksızın, yaygın olarak kullanılan metotlardan biridir. ICSI laboratuvar hayvanı olarak en sık farelerde kullanılmaktadır ancak elde edilen sonuçlara bakılacak olursa insandaki uygulamaya nazaran daha zor olduğu kabul edilmektedir. İnsanda ICSI sonrası fertilizasyon oranı değişik kliniklerde %30 ile % 70 arasında bulunmaktadır. Beşeri hekimlikte kullanılan ICSI nin başarı oranı daha yüksek olmasının bir sebebide oosit yoğunluğunun farelerdekinden daha düşük olmasıdır. Bu sperm enjeksiyonu esnasında görüşün daha net olmasından dolayı büyük kolaylık sağlamaktadır. Ek olarak diğer hayvan türlerinin ICSI de model olarak kullanıldığında sebebi tam olarak açıklanamamakla beraber daha büyük zorluklarla karşılanılmaktadır (Keller, 2001). Hayvanlarda ICSI denemelerindeki problemlere rağmen fertilizasyonda görülen aşamaların anlaşılması için önemli rol oynadığından beri bu tekniğe hala büyük oranda ilgi vardır. Hayvanlarda ICSI ayrıca ticari olarak ve doğal kaynakların kullanımı açısından kayda değer potansiyel sergilemektedir. Ayrıca hayvan modelleri üzerine çalışmak son günlerde rapor edilen ICSI
50 yöntemiyle doğan bebeklerde görülen gelişim bozukluğu ve kromozom anomalilerinin artmasından beri önemli yer edinmiştir (Terada ve ark., 2003; Terada ve ark., 2004). Bu tekniğin uzun zamanlı etkilerinin araştırılması için bilim adamlarının hayvanlarda sistematik olarak ICSI deneylerini artırmaları gerektiği bildirilmektedir (Keller, 2001; Hewitson, 2004) ICSI Uygulaması ICSI, geleneksel fertilizasyonun kapasitasyon, akrozom reaksiyon, zona penetrasyonu, sperm-oosit membran birleşimi gibi birçok aşamasını atlamamızı olanak sağlar. Spermatositten spermatozoa aşamasına geçene kadarki farklı aşamalarda bulunan enjeksiyon için kullanılacak sperm veya sperm nükleus hücreleri ve gamet birleşmesinin zamanı kesinlikle iyi ayarlanmalıdır. ICSI de gamet etkileşimi, oosit aktivasyonu ve sperm yoğunlaşması çalışmalarda önemli farklılıklara yol açar. ICSI nin geleceği ve nasıl işleyeceğini anlamaya yönelik çalışmalar yapılırken araştırıcılar liyofilize sperm kullanarak farelerde yavru elde etmişlerdir. Bu başarılı sonuçları diğer türlerde kullanarak YÜT hızlı bir şekilde ilerlemeye başlamıştır. Liyofilize sperm kullanımı, karmaşık kriyopreservatiflerin kullanımına ve pahalı saklama yöntemlerine alternatif olmuştur (Keller, 2001). Ticari ICSI uygulamalarında, kolaylıkla nasıl verim elde edeceğimizi görmek, ICSI nin değerli veya nadir bulunan hayvanların infertilite tedavisinde kullanılmasını sağlayacaktır. ICSI aynı zamanda reprodüktif materyal olarak tehlikede olan, suni tohumlama ve in vitro fertilizasyonun uygun olmadığı durumlarda da kullanılır. Son yıllarda da transgenik fare üretiminde ICSI, sperm ile DNA vektörü olarak kullanım alanı bulmuştur. ICSI DNA nın pronükleer enjeksiyonu veya nükleer transferde transgenik donor hücrelerde alternatif olarak kullanılmaya başlamıştır (Keller, 2001; McEvoy, 2003; Kaneko ve ark., 2005). ICSI uygulamalarındaki tüm bu olumlu gelişmelerin yanı sıra beşeri hekimlikde ICSI uygulamalarını takiben
51 kromozom anomalili doğan bebek oranında artış olduğu da bildirilmektedir (Terada ve ark., 2004). ICSI sonrası kısmen yüksek oranda görülen kromozom anomalilerin sebebi, ICSI uygulamasının kendisinden kaynakalanabileceği gibi bu yardımcı üreme tekniğinin insanlarda sıklıkla erkek infertilite tedavisinde kullanıldığından erkeğe ait sitogenetik anomalinin enjeksiyon ediliyor olabilmesinin sebeb olduğundan kuşkulanılmaktadır (Terada ve ark., 2003) Sığırda ICSI Fertilize sığır oositlerinde ICSI nin kullanılabilirliğini ilk kez sperm enjeksiyonu sonrası pronükleus formuna ulaşarak Westhusin ve arkadaşları (1984) göstermiştir. Birkaç yıl sonra in vitro matüre oosite dondurulmuş çözdürülmüş sperm enjeksiyonu sonrası ilk ICSI buzağısı dünyaya gelmiştir (Goto ve ark., 1990). ICSI metodu kullanarak yavru elde etmek son derece güçtür. Sadece birkaç çalışmada ICSI uygulaması sonrası canlı buzağı elde edildiği rapor edilmektedir (Galli ve Lazzari, 2005). Aslında sığırlarda geleneksel ICSI hakkındaki yayınlar spermin sıklıkla enjeksiyon sırasında pronüklei formunun aksadığını ispat etmektedir ve enjekte edilmiş oositlerin gelişme potansiyeli düşüktür (Keller, 2001). Sığırda ICSI sonrası düşük aktivasyon oranını yükseltmek için yapılan denemelerde, araştırıcılar gelişimi ve pronükleus biçimlenimi desteklemek için eksojen aktivasyon uyarıcıları kullanmaktadırlar. Sığır ICSI sinin aktivasyonunda, etanol, iyonomisin (A23187), iyonomisini takiben 6- dimetilaminopurin (DMAP) veya sikloheksimid (CHX) kullanılmaktadır. Bununla beraber bu denemeler, sığır ICSI kullanımında kullanılabilirliği ispatlanmamıştır (Keller, 2001). Son yapılan çalışmalarda, ticari gerçeklikten hala uzak olan sığırlarda ICSI uygulamasının aktivasyon veya sperm tedavisinin pronükleus oluşumu
52 ve gelişim oranlarını düzelttiği gösterilmektedir. Son zamanlardaki pronükleus biçimlenme oranındaki ilerlemeler ICSI de piezoenjeksiyon sistemin kullanımı ile de gerçekleşmiştir. Piezo enjektör sisteminin kullanımının sonucu olarak blastosist biçiminin oluşması için gerekli olan ekstra aktivasyon sağlanmaktadır. Bu teknikle normal ICSI de zor elde edilen canlı hayvan elde etme oranlarını yükseltebilir. Piezo enjeksiyonun, aktivasyon metodunun ve sperm tedavisinin düzeltilmesi ile başarı oranı, pronükleusun ve gelişimin şekillenmesi, insan ICSI kullanım sonuçlarına yaklaşacağı bildirilmektedir. Bu uygulamaya özgü olumlu etkiler ICSI nin kullanım etkinliğini artırabilir. Bununla beraber piezo enjeksiyon hem çok pahalı hem de uygulaması zordur. Ayrıca bu sistemde kullanılan civa laboratuvar ortamlarda kesinlikle el değmemesi gereken tehlikeli bir elementtir (Keller, 2001) Enjeksiyon İçin Sperm Yavaşlatıcı Vasat İntrasitoplazmik sperm enjeksiyonu, potansiyel uygulamasının yanı sıra sperm gibi çeşitli bileşenlerinin normal fertilizasyonda ve embriyo gelişiminde sürece etkisinin araştırılması için de yararlı bir yöntemdir. Rutin olarak ICSI de, motil spermatozoanın seçilerek enjeksiyondan hemen önce hareketsiz hale getirilir. Sperm hareketsizliği, sperm kuyruğunun mikroenjeksiyon pipeti ile petri tabanına bastırılarak kırılması (Keskintepe ve ark., 1997), kriyoprotektan olmaksızın dondurulması (Goto ve ark., 1990; Keefer ve ark., 1990) veya ses dalgaları (Keefer, 1989; Goto, 1993) gibi yöntemlerle gerçekleştirilmektedir. Bu hareketsizleştirme, ICSI ile yapılan fertilizasyon oranlarında artışa neden olmaktadır (Dozortesv ve ark., 1995). ICSI uygulamasında önemli faktörlerden biri de büyük molekül ağırlığına sahip ve spermin yavaşlatılmasında kullanılan polyvinylpyrrolidone (PVP) un konsantrasyonudur. PVP aynı zamanda ICSI den önce spermatozoa nın enjeksiyon pipetinin iç çapına yapışmasını engeller. Sperm yavaşlatıcı
53 olarak PVP kullanımının başarılı bir sperm enjeksiyonu için mutlaka gerekli olduğu bildirilmektedir (Gordon ve Carroll, 1997; Chung, 1999) Enjeksiyon Pipetleri ICSI esnasında kullanılacak enjeksiyon pipeti hem spermatozoonun kafasını çekebilmeye yetecek genişlikte olmalı ve hem de zonayı ve oositin plasma membranını delebilecek kadar keskin olmalıdır. Kullanılan enjeksiyon pipetinin iç ve dış çapı oositlerinin ICSI sonrası gelişimi ve fertilizasyonu etkilemektedir. Geniş pipet kullanımında uygulanan mekanik kuvvet artacağından ve enjeksiyon esnasında nakledilecek enjeksiyon sıvısında da artış olacağından oosit zarar görecek ve embriyonik gelişim duracaktır. Daha küçük yarıçaplı enjeksiyon pipetlerin kullanıldığı uygulamalarda embriyonik gelişim oranlarının istatistikî olarak daha yüksek olduğu bildirilmektedir (Chung, 1999) Sığır Oositlerinin Aktivasyonu ICSI uygulamalarında karşılaşılan problemlerden en önemlisi oosit aktivasyonudur. Oosit aktivasyonunda tetik mekanizmayı başlatan sinyal kalsiyum olup, sperm-oosit füzyonu esnasında spermatozoa içerisinde bulunan bir faktör oosit içerisinden kalsiyum çıkışını başlatır (Aydos, 2008). Araştırıcılar oosit aktivasyonu ile ilgili problemlerin sığır ICSI sinde karşılaşılabilecek zorlukların başında geldiğini ve aktivasyon olayını daha yakından incelememiz gerektiğini bildirmektedir (Horiuchi, 2006). Oosit aktivasyonu partenogenezis veya fertilizasyonda embriyonik gelişimi başlatan en önemli aşama olarak tanımlanmaktadır. Memelilerde sperm ve oosit birleşmesinde, endoplasmik retikulum kökenli kalsiyum dalgalanmasının artması sonucu oositin stoplasmasından bir seri kalsiyum salınımı olur. Bu hücre içi serbest kalsiyum iyon konsantrasyonun artması ile oosit
54 aktivasyonunun tetiklenmesine yol açar. Oosit aktivasyonunda erken ve geç olmak üzere iki safha vardır. Erken dönemde Ca 2+ artışı ve kortikal granüllerde eksositosis gözlenirken. Geç dönemde ise mayosis destekleyici faktörün etkisiyle kutup cisimciğinin atılımı, pronükleusların oluşumu ve DNA sentezi oluşmaktadır. Artış biçimi türden türe farklılık gösterse de kalsiyum, aktivasyon başlatıcısıdır (Okitsu ve ark., 2001; Keller, 2001; Williams 2002). Oosit aktivasyonu ikinci mayotik bölünmenin yeniden başlaması olarak tanımlanabilir. Oositlerin anafaz II, telofaz II, metafaz III veya pronükleer formasyona ulaşması aktivasyonun olduğunu göstermektedir. Oosit aktivasyonu normalde sperm ile tetiklenir. Spermin yol açtığı bu uyarım olmasa zigot veya pronükleus formu oluşamaz. Aktivasyonda ooplasmanın hacmi küçülür ve perivitellin boşluktan sıvı çekilir. Aynı zamanda ooplasmadaki spermatozoonun başı şişer karakteristik yapısını kaybeder ve jel kıvamına dönüşür. Oluşan bu yapının nükleusu erkek pronükleusuna benzer (Chung, 1999). Sperm, belkide oositin metafaz II safhasına ulaştıktan sonra tekrar aktivasyonundan ve embriyonik gelişimin başlamasından sorumludur. Hala spermin bunu nasıl yaptığı kesin olarak anlaşılmamıştır. Sperm kaynaklı oosit aktivasyonu hakkında birçok teori vardır. Reseptör teorisine göre: spermatozoon fahri hormonlar gibi rol oynayarak oolemmaya reseptör bağlar. Bu da G proteinler ve tirosin kinaz yolu ile reseptör kaynaklı inositol-1,4,5- trifosfat (IP 3 ) ın üretilmesine sebep olur. Sonuçta oositin iç haznelerinden kalsiyum salınımı ve aktivasyon gerçekleşir. Memeli oositlerinde reseptör kaynaklı IP 3 ün bulunmakta olması bu teoriyi desteklemektedir. Ayrıca bu yolla uyarımın sonucu olarak kalsiyum salınımının G-proteinleri veya tirozin kinazı gerektirdiği gösterilmiştir. Bununla birlikte oolemmal sperm reseptörleri veya hücre içi sinyalisazyon yollarının direk uyarımının fertilizasyonda görüldüğü gibi Ca 2+ salınımına sebep olduğu dair çok az kanıt vardır (Okitsu ve ark., 2001; Keller, 2001; Williams, 2002; Malcuit ve ark., 2006).
55 İkinci hipotez; oositin sitoplasmasındaki bazı yapılarla etkileşimden ve gamet füzyonunda oositin içindeki spermden dağılan çözünebilir sperm faktörünün kalsiyum salınımını tetiklemesini anlatır. Sperm yolu veya kalsiyum salınım teorisi basitçe spermden Ca 2+ iyonlarının salıverilmesidir. Sperm ayrıca IP 3 ve fosfolipaz C veya fosfolipaz aktivatör gibi diğer Ca 2+ salıverici yapıları da içermektedir. Spermin sitosolünden köken alan proteinler veya farklı proteinlerin etkisi de diğer hipotezleri oluşturmaktadır (Keller, 2001; Williams, 2002). Spermin direkt olarak oositin sitoplasmasına enjekte edildiği deneylerde sperm faktörü teorisinin reseptör hipotezini destekleyecek şekilde Ca 2+ salınımını ve oosit aktivasyonu gözlenmiştir. Ek olarak birçok farklı türde sitosolik sperm ekstraklarının oosite enjeksiyonu ve somatik hücreler oosit aktivasyonu destekleyerek fertilizasyondakine benzer kalsiyum sinyallerine neden olduğu görülmüştür (Okitsu ve ark., 2001). Birçok laboratuvar, yönlendirici çalışmalar ile bu teorilerin doğruluğunu betimlemektedir. Sperm kökenli Ca 2+ iyonları, Ca 2+ enjeksiyonunda yalnız başına sperm oosit birleşiminde görüldüğü gibi salınıma yol açmaz ve gamet birleşmesinde spermin oosite girişinde Ca 2+ bulunmamaktadır. Sperm kaynaklı IP 3 de oosite enjekte edildiğinde fertilizasyondaki gibi Ca 2+ üretimine sebep olmaz. Bu teoriye alternatif olarak taze sperm fosfolipazı oositte IP 3 ün devamlı olarak küçük miktarlarda üretimine yol açmaktadır. Bu teori IP 3 ile yapılan deneylerde fertilizasyondakine benzer bir şekilde Ca 2+ salınımına yol açacağını vaat etmektedir (Keller, 2001). Son yıllarda yapılan çalışmalarda hamster sperminde bulunan oscillin adı verilen bir proteinin, adını salınımın İngilizcesi olan oscillation kelimesinden almıştır, sperm faktörüne aday olabileceği düşünülmektedir (Parrington ve ark., 1996). Şaşırtıcı çalışmaların biri de denizkestanelerinde spermdeki nitrik oksit sentazın sperm faktörü olduğudur. Tepesi kesilmiş
56 sperm kullanıldığında nitrik oksit sentazın oositte yeterli ve gerekli Ca 2+ salınımına yol açtığı görülmüştür (Kuo ve ark., 2000). Oosit aktivasyonu etkisindeki aşamalar embriyonik gelişin başlamasının işareti olarak büyük önem taşımaktadır. Partenogenetik çalışmalar, oosit aktivasyonu ve erken embriyonik aşamaları hakkında çok ciddi bilgiler verebilir. Ek olarak ICSI ve nükleer transfer gibi reprodüktif teknolojilerin uygulanılabilirliği oositin aktivasyonun anlaşılmasına ve başarısının artmasına bağlıdır (Keller, 2001) Oosit Aktivasyonu İçin Yapay Uyarıcılar Özellikle ICSI yöntemi ile sığır embriyo üretim çalışmalarında aktivasyon sağlamak amacı ile son yıllarda 5-50 µm kalsiyum iyonofor (Ock ve ark., 2003; Yoo ve ark., 2003; Oikawa ve ark., 2005), kalsiyum iyonofor ve 10 µg/ml puromisin (Murase ve ark., 2004), kalsiyum iyonofor ve 3 saat sonra 1.9 mm 6-dimetilaminopurin (Guang-Pen Li ve ark., 2004; Oikawa ve ark., 2005), sadece 2 mm 6-dimetilaminopurin (Lagutina ve ark., 2004), kalsiyum iyonoforu ve sikloheksemid (Suttner ve ark., 2000), kalsiyum iyonoforu ve sodyum pirofosfat (Yoo ve ark., 2003), %7 etanol (Nakamura ve ark., 2002; Oikawa ve ark., 2005; Skrzyszowka ve ark.,2007), 10 µg/ml sikloheksemid (Lagutina ve ark., 2004), 10 µg/ml sikloheksemid ve 5 µg/ml sitosyalizin B (Lagutina ve ark., 2004), 100 µm thimersol (Guang-Peng Li ve ark., 2003) gibi kimyasal aktivasyon yöntemlerinin kullanıldığı bildirilmektedir. Memelilerde sperm-oosit birleşmesi hücre içi serbest Ca 2+ konsantrasyonunu artırır ve histon H1 kinaz aktivitesini durdurur. Kortikal granül eksositosisi, mayozun tekrar devamlılığı ve hücre bölünmesi gibi oosit aktivasyonun birçok aşamasının sonucu olarak Ca 2+ artar. Bütün bu aşamalar normal fertilizasyon ve erken embriyonik gelişimde çok önemlidir. Etanol, iyonomisin ve elektrik uygulaması gibi birçok yapay uyarıcı fertilizasyonda
57 hücre içi kalsiyum konsantrayonunu artırarak pronükleer formasyon ve erken embriyonik gelişime yol açabilir (Chung, 1999). Bununla beraber bu aktivatörlerin birçoğu spermin yol açtığı aktivasyondan fark edilebilir derecede farklı bir Ca 2+ salınım mekanizmasına sebep olur. Memelilerde fertilizasyonda birçok yapay aktivatör tekrarlayan değil tak fazlı Ca 2+ salınımına yol açar. Bu daha az etkili ve tek fazlı Ca 2+ salınımı, spermin sebep olduğu aktivasyondan farklılığının birisidir. Bütün bunlara rağmen bu aktivatörler sığırda olduğu gibi birçok türde fertilize edilmeyen oositlerde partenogenetik aktivitede kullanılmaktadır (Keller, 2001). Oosit aktivasyonu için kullanılan yapay aktivatörlerden kalsiyum iyonofor, oosit aktivasyonu için düşük seviyede olması gereken maturasyon destekleyici faktörün (MDF) dengelenmesi için en sık kullanılan aktivatördür. Etanol de, matafaz II oositi aktive etmekte ve ileri embriyo aşamalarda plasma membrandan IP-3 ün stimulosyonuna yol açarak IP-3 kaynaklı Ca 2+ salınımını desteklemektedir. Bu özelliklerinden faydalanmak için etanolun % 7 lik çözeltisi 5-7 dakikalık süreçte oosit aktivasyonunda kullanılır. Oosit aktivasyonunda kombine tedavi, fosforilisazyon veya protein sentez inhibitörü ile yapılmaktadır. Bu amaçla sığır oositlerinde, kalsiyum iyonoforu takiben sikloheksemid vaya H1 histon kinaz inhibitörü olan 6-dimetilaminopurin kullanılmaktadır. DMAPìn etkisi, mayosizte protein kinazın inhibasyonuna yol açarak kromatin ve mikrotubullerin düzenlemesi ve protein fosforilizasyon inhibasyonu ile olmaktadır. DMAP tedavisinden sonra sığır oositlerin aktivasyonu pronükleer formasyona ve birinci mitotik hücre siklusunun interfaz aşamasına girmesine sebep olur. Sikloheksemid, DMAP gibi protein desteğinin devamını inhibe etmesinin yanı sıra DNA replikasyonunu başlatması amacıyla kullanılmaktadır. Oosit aktivasyonu ile ilgili yapılan erken dönem çalışmalarda butirolakton I ve bohemin cyclin dependent kinaz (CDKs) inhibitörü olarak kullanıldığı bilinmektedir. CDKs in inhibisyonu metafaz II oositin cdc2 kinaz aktivasyonun azaldığını işaret etmektedir (Yoo, 2003).
58 Son yıllarda birçok yayında, yapay aktivatörlerle partenogenetik sığır embriyo üretimi geliştirilmesi ile blastosist oranının % 15 den fazla olduğu rapor edilmektedir. Bu oranlardaki artış aslında hücre siklus kontrolünün in vitro kültür tekniklerinki kadar anlaşılmasını sağlayan çalışmaların artmasıyla oluşmuştur. Bilinmektedir ki Ca 2+ salınımı aslında oositin metafaz safhasının devamlılığını işaret eder. Bu yüzden aktivasyon aslında spermin aktivasyonu tetiklediği oosit ile sperm arasındaki karşılıklı etkilenmedir. Embriyonik hücre döngüsünün başlarında oosit aktivasyonu esnasında oositte aktif mayosis destekleyici faktör azalmalıdır. Mitojen aktiviteli protein kinaz seviyesi de pronükleus oluşumu için azalmalıdır. Siklik dönemde mayosis destekleyici faktörün düşüşü ve artışı görülür ancak pik yapması mature oositin metafaz II safhasına ulaştığında olur. Yüksek mayosis destekleyici faktör seviyesi kromatin yoğunlaşması ve ağ formuna karşılık gelir. Ek olarak yüksek mitojen aktiveli protein kinaz seviyesi muhtemelen oositte siklin B oranını düşüren sitotastik faktörün aktivitesinden sorumludur. Fertilizasyonda oosit aktivasyonu için Ca 2+ un salındığı yönde muhtemelen birçok etkileyen faktör vardır. Ca 2+ hareketliliğine bağlı aşamalar sitositatik faktör aktivitesini, siklin B yıkımlanmasını, MDF aktivasyonun azalmasını ve mitosisin başlangıcını durdurur. Siklin düşüşünün başlangıcında MDF inaktive olur. Eğer yeni bir MDF yoksa bu aktif MDF ün seviyesinin ilk embriyonik hücre bölünmesinde başarılı olacağını işaret eder. Oosit aktivasyonu, birkaç saat sonra MDF ün inaktivasyonu olacak olsa bile mitojen aktiviteli protein kinaz seviyesininin düşüşünün uyarılmasına da sebep olur (Keller, 2001). Yapay aktivasyonda tek fazlı Ca 2+ salınımı gözlensede etanol ve iyonomisin gibi aktivatörlerin kullanıldığında aktivasyon oranları tutarlı ve güvenilir değildir. Problemlerin bir kısmı yeni mature olmuş genç oositlerde (maturasyondan sonraki 24 saate kadar) protein sentezi ve siklin B rejenerasyonların hala devam etmesi, Ca 2+ artışının düşmesine sebep olduğundan kaynaklanır. Belki bu MDF ün gecici inaktivasyonunu sağlayabilir fakat normalde oositler aktivasyondan sonra stimulasyonların düşüşü ile MDF
59 ün rejenerasyonuna uğrar. Bu tamamlanmamış aktivasyonun sonucu olarak oositler metafaz III aşamasına ulaşır ve metafaz II den anafaz II geçişleri ile ileri embriyonik gelişime katılır (Keller, 2001). Suni aktivasyon, spermden temizlenmiş ejekulatın oosite enjeksiyonu ile de yapılabilir. Sperm ekstratları, sperm komponentleri veya doğal fertilizasyonda oosit aktivasyonuna yol açan sperm faktörleri içerebilir. Birçok türde sperm faktörünün oosit içine enjeksiyonu fertilizasyonda çok benzeyen tekrarlayan Ca 2+ salınımına sebep olur. Bir türden alınan sperm ekstratları diğer türlerin oositlerini aktive edebilir. Sperm faktörü potansiyel olarak aktivasyonu başlatmaktadır ki yapılan araştırmalarda bu faktörler yardımı ile oosit aktivasyonun artışı, aktivasyonun ve embriyonik gelişimin nasıl başladığını anlamamıza yardımcı olacaktır. Bu faktörler izole edilebilirse, ICSI veya nükleer transfer gibi uygulamalarda daha doğal aktivasyon uyarımları sağlamak için kullanılabilir. Bu faktörlerin izolasyonu aktivasyonda Ca 2+ salınım mekanizmasının sadece metafaz II aşamasından çıkışının garantilenmesinde sorumlu değil ekspresyonu ve transkripsiyon aktivite için sinyal görevi gördüğünü belirtmektedir. Ca 2+ salınımın düşük veya hiç olmadığı aktivasyonların sonucu oluşan blastosistlerde daha düşük düzeyde inner cell mass (iç hücre kütlesi) oluşur. Trophektoderm hücre oranı da in vitro fertilizasyon veya çoklu salınıma sebep olan aktivatörlerin kullanımına nazaran daha azdır (Keller, 2001). Yardımcı üreme tekniklerinin bütün basamakları, canlı yavru elde etme potansiyelinin artırılması için sürekli bir düzenleme ve gelişime maruz kalmak zorundadır. Kullanılan aktivatörler; kullanışlı, uygulaması kolay, güvenilir, yüksek embriyonik gelişim oranlarını sağlayabilen ve genetik materyali zarar vermeyen yapıda olmalıdır. Birçok farklı aktivatör denenmiş olmasına rağmen bir türün oosit aktivasyonun sistematik olarak kıyaslandığı birkaç yayın vardır. Bir türe ait oositlerin aktivasyonunda kullanılan farklı kimyasal aktivatörlerin embriyonik gelişime etkilerinin araştırılması sonucu elde edilen bu tarz kıyaslamalı bilgiler, araştırıcılar için ICSI ve nükleer transfer uygulamaları gibi
60 temel reprodüktif biyolojide aktivatörlerin kullanılması için çok değerli bilgiler olduğu belirtilmektedir (Keller, 2001) ICSI Uygulanmış Sığır Oositlerinin Aktivasyon Gerekliliği ve Çalışmanın Hipotezi Reprodüktif biyoteknoloji uygulamalarından biri olan intrasitoplazmik sperm enjeksiyonunda embriyonik gelişim, küçük labaratuvar hayvanlarında ve insanda başarı ile sağlanırken inekte ICSI sonrası oosit aktivasyonu ve embriyonik gelişimin olmaması türlere göre oosit aktivasyonu ve embriyonik gelişimin fizyolojisinde farklılıklar olduğu düşüncesini ortaya koymaktadır. Günümüzde reprodüktif biyoloji alanındaki invitro çalışmalar ekonomik, bilimsel ve etik sebeplerden dolayı mezbahadan elde edilen sığır oositleri üzerinde çalışmayı gerektirmektedir. Bu kapsamda özellikle ICSI yöntemi ile sığır embriyo üretim çalışmalarında aktivasyon sağlamak amacı ile kalsiyum iyonofor, 6-dimetilaminopurin, etanol gibi aktivatörler ile araştırmalar yapılmış olmasına rağmen henüz tatmin edici sonuçlara ulaşılmamıştır. İn vitro embriyo üretim çalışmalarında genellikle, A kalite oositler kullanılmakta, buna karşılık ovaryum oosit potansiyelinin önemli bir çoğunluğunu oluşturan B ve C kalite oositlerden ICSI tekniği ile embriyo üretim çalışmaları henüz yapılmamıştır. Sunulan çalışmada ise: I- Mezbahadan toplanan inek ve düve ovaryumlarının yüzeysel folliküllerinden aspire edilen oositlere ICSI tekniğinin uygulanması; II- ICSI uygulanmış değişik kalitedeki oositlerde (A, B ve C kalite oosit) embriyonik gelişimin başlatılmasında etkin kimyasal aktivatörlerin (Kalsiyum iyonofor, kalsiyum iyonofor+6-dmap kombine, etanol) ortaya konması;
61 III- B ve C kalite oosit potansiyelinin embriyo üretiminde kullanılabilirliğinin araştırılması ve reprodüktif biyoteknoloji çalışmalarına katkı sağlaması amaçlanmıştır.
62 2. GEREÇ ve YÖNTEM Gereç Bu tezin ön çalışmaları ile deney düzeneğinin bir kısmı 15 Mayıs-15 Ağustos 2007 tarihleri arasında Amerika Birleşik Devletleri, Missouri-Columbia Üniversitesi, Veteriner Fakültesi`nde (College of Veterinary Medicine) gerçekleştirildi. Deney düzeneğinin diğer bir kısmı ve çalışmanın laboratuvar aşamalarının tamamı Ankara Üniversitesi Veteriner Fakültesi Doğum ve Jinekoloji Anabilim Dalı İnvitro Fertilizasyon Laboratuvarında gerçekleştirildi. Çalışmanın oosit materyali, 17-Ağustos-2007 ile 4-Nisan-2008 tarihleri arasında gerçekleştirilen 29 mezbaha ziyaretinden toplanan 786 ovaryumdan sağlandı Oosit Kaynağı Bu çalışma, Ankara ili Çubuk ilçesi mezbahanesinde kesilen inek ve düvelerden elde edilen 786 ovaryumdan 6416 follikül aspirasyonu yapılarak 1216 adet A kalite, 1123 adet B kalite ve 1336 adet C kalite oosit olmak üzere toplanan toplam 3675 adet oositte gerçekleştirildi. Toplanan bu oositlerden ICSI yapmak üzere 420 adet A kalite, 400 adet B kalite ve 415 adet C kalite olmak üzere toplam 1235 oosit işleme konuldu Laboratuvar Alet ve Gereçleri Mikromaniplatör seti: ICSI uygulamaları için NARISHIGE MMN1 (Japan) marka mikromaniplatör sistemi olan, LEICA DMIL (Germany) marka invert mikroskopu bulunan ve görüntüleme sistemi olarak İnvert mikroskoba
63 uyumlu LEICA DFC 280 (Germany) marka dijital kamera donanımlı mikromaniplatör sistemi kullanıldı. Stereomikroskop (LEICA M205C, Germany): Oositlerin değerlendirilmesi sınıflandırılması ve embriyonik gelişim aşamalarının niteliksel tayini için ısıtma tablalı ve dijital görüntüleme sistemi bulunan stereomikroskop kullanıldı. İnkübatör: (Biotech Galaxy, U. K.) Vasatların, oositlerin ve embriyoların bekletilmesi ve kültür işlemleri %5 CO 2 ortamlı, 38,5 C o sıcaklığa ayarlı mutlak neme sahip tek gazlı inkübatör kullanıldı. Laminar flow DanLaf VFSS (Denmark): IVM ve IVF uygulama aşamalarının tümünde steril ortamın sağlanması için ısıtma tablalı laminar flow kullanıldı. ph metre: IVM ve IVF vasatlarının ph sını belirlemek amacıyla Hanna Instruments (Portekiz) marka ph metre kullanıldı. Ozmometre (KNAUER, Germany): Vasatların ozmolaritesini saptamak amacıyla ozmometre kullanıldı. Konvansiyonel Etüv (Nüve EN 120, Türkiye): Taşıma ve yıkama vasatının ısıtılması için 37 C o ye ayarlı etüv kullanıldı. Buzdolabı: Hazırlanan vasat ve kimyasalları uygun ısıda korumak amacı ile kullanıldı. Otoklav (ALP): Kullanılan malzemelerin sterilizasyonu yapmak için kullanıldı. Sıcak su banyosu (PolyScience 9106, U.S.A): Ovaryumların aspirasyon sırasında uygun sıcaklıkta bekletilmeleri için kullanıldı. Sıvı azot tankı (Air Liuide GT 21): Spermanın saklanması amacıyla kullanıldı. Hassas terazi (Shimadzu BX 32017): Kimyasalların tartılması amacı ile kullanıldı.
64 Santrifüj (Selecta CENCON): Spermatozoonları fertilizasyona hazırlamak için kullanıldı. Vorteks (Ika MS 31): Solusyonların hazırlanmasında kullanıldı. Holding mikropipet (Humagen, MPH-MED-30): ICSI uygulamasında oositin sabit tutulması için, iç çapı µm olan holding pipet kullanıldı. ICSI mikropipet (enjeksiyon mikropipeti) (Humagen, MIC-35-30): ICSI uygulamasında spermin oosit içine enjeksiyonu için, dış çapı µm olan mikro pipet kullanıldı. Termos: Ovaryumların taşınması sırasında sıcaklığın korunmasını sağlamak amacı ile 2 litre kapasiteli termos kullanıldı. Dijital Derece (Hanna Instruments): Taşıma vasatının sıcaklığını ölçmek için kullanıldı. 18 G luk Kanül ve 10 ml lik Plastik Enjektör: Folliküler oositlerin aspirasyonu amacı ile kullanıldı. 15 ml lik Santrifüj Tüpü (CC ): Oositlerin yıkanması ve toplanması amacı ile kullanıldı. Pipet uçları: Vasatların dozlanmasını sağlamak için 0,1-1 ml lik (CC 4901), 1-10 ml lik (CC 4797), ml lik (CC 4799) pipet uçları kullanıldı. Otomatik pipet (Nichiryo): Vasatların dozlanmasını sağlamak amacı ile kullanıldı. Pasteur Pipet 150 mm (İsolab ): Oositlerin toplanması amacı ile kullanıldı. Pasteur Pipet 5.75 (Humagen ): oosit/embriyo ların droplara alınması için kullanıldı.
65 Steril petri: kullanılacak droplar otuzbeş mm lik (CC ), 60X15 mm lik (CC ), ve 90X15 mm lik petrilerde hazırlandı. Elli ml lik santrifüj tüpü (CC ): Vasatları saklama kabı amacı ile kullanıldı. Enjektör filtresi, 0,22 µm, (CC ): Vasatların sterilizasyonu sağlamak için kullanıldı ml lik konik tüp (CC ): Hazırlanan katkı maddelerinin saklanması amacıyla kullanıldı Kimyasal Malzemeler, Vasat Katkı Maddeleri ve Vasatlar NaCl (Sigma-Aldrich, Co, S9888): Ovaryumların taşıma vasatı olarak %0,9 luk çözeltisi kullanıldı. Antibiyotik antimikotik solüsyon (Biol. Ind ): Taşıma vasatı, maturasyon ve fertilizasyon vasatlarında olası kontaminasyonları engellemek amacı ile ticari solüsyonu kullanıldı. TCM-199 Vasatı (Sigma-Aldrich Co, M 7528): Maturasyon vasatı, çalışma vasatı ve oosit yıkama solüsyonu olarak ticari solüsyonu kullanıldı. Ultra saf su: IVM ve IVF vasatlarının hazırlanması için kullanıldı. HEPES (Biol. Ind.): IVM vasatın hazırlanması için kullanıldı. NaHCO3 (Biol. Ind ): IVM ve kültür vasatının hazırlanması için kullanıldı. Epidermal büyüme faktörü: Maturasyon vasatı katkı maddesi olarak Sigma Co E 9644 ticari preparatı kullanıldı. Sığır serum Albumini (Frak. V): Vasat katkı maddesi Biol. Ind. S ticari preparatı kullanıldı.
66 Sığır serum Albumini (EFAF): Vasat katkı maddesi olarak Biol. Ind. SE marka preparatı kullanıldı. Fötal Buzağı Serumu (FCS): Vasat katkı maddesi Sigma N4762 ticari preparatı kullanıldı. Na-Laktat %60 (Sigma Co L 4263): Vasatlarda enerji kaynağı sağlamak amacı ile kullanıldı. Kalsiyum iyonofor A23187: Oosit aktivasyonunda Sigma C-7522 marka ticari preparatı kullanıldı. 6-DMAP: Oosit aktivasyonunda Sigma-aldrich D-2629 marka ticari preparatı kullanıldı. Etanol: Oosit aktivasyonunda Riedel De Haen marka ticari preparatı kullanıldı. Steril mineral yağ: Vasatlarda buharlaşmayı engellemek amacı ile hazırlanan dropların üzerini kaplamada Sigma Co M 8410 marka ticari solüsyonu kullanıldı. NaCl (Ambresco 2372 B 441): Vasat katkı maddesi olarak kullanıldı. KCl (Biol. Ind B): Vasat katkı maddesi olarak kullanıldı. CaCl 2.2H2O (Serva 16491): Vasat katkı maddesi olarak kullanıldı. MgCl 2.+6H20 (Ambresco 2934 B02): Vasat katkı maddesi olarak kullanıldı. Na pirüvat (Sigma Co P 4562): Vasat katkı maddesi olarak kullanıldı. Fenol kırmızısı: Vasat katkı maddesi olarak kullanıldı. BME 50X (Sigma-aldrich Co, B6766): Vasat katkı maddesi olarak kullanıldı. MEM 100X (Sigma-aldrich Co, M7145): Vasat katkı maddesi olarak kullanıldı. L-Glutamin (Sigma-aldrich Co, G5792): Vasat katkı maddesi olarak kullanıldı.
67 Na 2 HPO 4 (Sigma-aldrich Co, S2554): Vasat katkı maddesi olarak kullanıldı. KH 2 PO 4 (Sigma-aldrich Co, P0662): Vasat katkı maddesi olarak kullanıldı. Glukoz (Sigma-aldrich Co, G5767): Vasat katkı maddesi olarak kullanıldı. Spermatazoon (17,5x10 6 spermatozoon/payet): ICSI işlemlerinde kullanılmak üzere Lalahan Hayvancılık Araştırma Enstitüsüne ait payetler kullanıldı. Heparin: Spermatazoonun kapasitasyonu gerçekleştirmek amacı ile Sigma Co H3149 marka preparat kullanıldı Yöntem Sunulan bu çalışma, mezbahadan kesilen inek ve düvelerden toplanan ovaryumların laboratuvara iletilmesi, ovaryumlardan oosit aspirasyonu, oositlerin sınıflandırılarak maturasyonu, ICSI, oosit aktivasyon işlemlerinin başlatılması ve embriyonik gelişim aşamalarının izlenilmesi gibi karmaşık bir süreci kapsamaktadır. Ovaryumların taşınmasında, yıkanmasında, maturasyonunda, oositin ve spermin hazırlanmasında, ICSI ve aktivasyon uygulamalarında aşamaya uygun vasatlar kullanıldı. Çalışma, çok sayıda işlemi koordinasyon içinde yürütmek gereğini ortaya çıkarmaktadır. Yöntemin kolay anlaşılabilmesi için kullanılan vasatların içerikleri va hazırlama teknikleri bir ana başlık halinde sunulmuştur.
68 Çalışmada Kullanılan Vasatların İçerikleri ve Hazırlanışı Ovaryum Taşıma Vasatının Hazırlanması Taşıma vasatı için Chung (1999)`un bildirdiği şekilde, mezbaha ziyaretinden 12 saat önce 500 ml distile su içinde 4,5 gr NaCl katılarak %0,9 luk izotonik solüsyon hazırlandı. Bu solüsyonun 37 C o ye ayarlı etüvde bekletildikten sonra materyal toplamasından önce (1ml/lt) 0,5 ml antibiyotik-antimikotik solüsyon (Biol. Ind ) eklendi Ovaryum Yıkama Vasatının Hazırlanması Mezbahadan toplanan ovaryumların aspirasyon işleminden önce yıkanması amacı ile Chung (1999)`un tanımladığı gibi, aspirasyondan 12 saat önce 500 ml distile su içinde 4,5 gr NaCl katılarak %0,9 luk izotonik yıkama vasatı hazırlandı. Bu solüsyonun 37 C o ye ayarlı etüvde bekletildi Oosit Maturasyon Vasatının Hazırlanması Maturasyon vasatı olarak Guang Peng Li ve ark., (2004) bildirdiği şekilde, doku kültür medyumu TCM 199 (M7528, Sigma-Aldrich Co.) ticari solüsyona 3 mg/ml oranında sığır serum albumini (BSA Frak. V) (Biol. Ind. S ) eklenerek hazırlandı. Gruplarda yer alan IVM vasatlarına, kullanılmadan 12 saat önce ml sinde, 100 IU penisilin, 100 µg streptomisin olacak şekilde antibiyotik solüsyonu eklendi. Ayrıca vasatlara, katkı maddeleri olarak, 100 ng/ml epidermal growt faktör (EGF) ile edildi. Maturasyon vasatının ph`sının 7,2-7,4 aralığında ve osmolaritesinin de mosm aralığında olmasına özen gösterildi.
69 Stok Solüsyonlarının Hazırlanması Bu çalışmada spermin hazırlanmasında kullanılan Sperm-Tyrode nin albumin laktat piruvat (Sp-TALP), oositlerin kumulus komplekslerinden soyulmasında kullanılan HEPES-Tyrode nin albumin laktat piruvat (HEPES-TALP) ve ICSI uygulamasında kullanılan İnvitro-Tyrode nin albumin laktat piruvat (IVF- TALP) vasatları ve bu vasatların hazırlanmasında gerekli olan Tyrode nin laktat (TL) solüsyonları (Sperm TL, HEPES TL, IVF TL) ICSI uygulamasından 24 saat önce Hansen (2000) in belirttiği gibi, laminar flow altında taze olarak hazırlandı. TL solüsyonları ve TALP vasatlarının yapımında gereken stok solüsyonlar ise Stok 19 NaHCO 3 hariç, laminar flow altında bir defaya mahsus olacak şekilde, Hansen (2000)`in belirttiği şekilde hazırlandı ve tüm çalışma boyunca kullanılmak üzere uygun koşullarda saklandı. Stok 19 NaHCO 3 ise her hafta taze olarak hazırlandı. Bu stok solusyonların içerikleri, hazırlama yöntemleri ve saklama koşulları çizelge de olarak sunulmuştur. Çizelge : Stok Solüsyonların İçerikleri ve Hazırlanması Stok solüsyonu Hazırlanması Stok 1 Na laktat % 98 lik şurup tarzında satın alındı + 4 C o de saklandı ve ışıktan korundu Stok 2 Na piruvat 100 ml ultra saf suda g Na piruvat çözdürüldü + 4 C o de saklandı Stok 7 Heparin 10 ml ultra saf suda 20 mg heparin çözdürüldü -20 C o de saklandı Stok 8 gentamisin 5 mg/ml konsantrasyonda olacak şekilde sulandırıldı -20 C o de saklandı Stok 17 NaCl 50 ml ultra saf suda g çözdürüldü ve + 4 C o de saklandı Stok 18 KCl 50 ml ultra saf suda g çözdürüldü ve + 4 C o de saklandı Stok 19 NaHCO 3 50 ml ultra saf suda g çözdürüldü ve + 4 C o de saklandı. Her hafta taze olarak hazırlandı Stok 20 PO 4 50 ml ultra saf suda NaH 2 PO 4 +H 2 O g çözdürüldü ve + 4 C o de saklandı Stok 21 M HEPES 400 ml ultra saf suya 119 g HEPES eklendi ph ı 7.0 a ayarlandı ve 500 ml e tamamlandı + 4 C o de saklandı Stok 22 CaCl 2 50 ml ultra saf suda g CaCl 2 +2H 2 O çözdürüldü ve + 4 C o de saklandı Stok 23 MgCl 2 50 ml ultra saf suda g MgCl 2 +6H 2 O çözdürüldü ve + 4 C o de saklandı
70 Tyrode`nin Laktat (TL) Solüsyonlarının Hazırlanması Sperm-Tyrode nin albumin laktat piruvat (Sp-TALP), HEPES-Tyrode nin albumin laktat piruvat (HEPES-TALP) İnvitro-Tyrode nin albumin laktat piruvat (IVF-TALP) vasatlarının hazırlanması için gerekli olan Tyrode nin laktat (TL) solüsyonları (Sperm TL, HEPES TL, IVF TL) Hansen`in (2000) bildirdiği şekilde ICSI işleminden 24 saat önce laminar flow altında taze olarak hazırlandı. TL solusyonların içerikleri hazırlama yöntemleri çizelge de sunulmuştur. TL solüsyonlarının ph`sının 7,2-7,4 aralığında ve osmolaritesinin de mosm aralığında olmasına özen gösterildi. Çizelge : TL Solüsyonlarının İçerikleri ve Hazırlanması İçerik Sp-TL HEPES-TL IVF-TL Ultra Saf Su (ml) 39,6 22,125 20,0785 Stok 17 NaCl (ml) 2,17 1,25 1,25 Stok 18 KCl (ml) 0,98 0,5 0,5 Stok 19 Bikarbonat (ml) 5 0,2 2,5 Stok 20 Fosfat (ml) 0,5 0,25 0,25 Stok 1 Na-Laktat (ml) 0,184 0,0465 0,0615 Stok 21 Hepes (ml) 0,5 0,25 - Stok 22 Ca Klor. (ml) 0,5 0,25 0,25 Stok 23 Mg klor. (ml) 0,55 0,125 0,125 ph 7,4 7,3 7,4 Osmolarite (mosm) Tyrode nin Albumin Laktat Piruvat (TALP) Vasatının Hazırlanması Spermin hazırlanmasında kullanılan SP-TALP, oositlerin hazırlanmasında kullanılan HEPES-TALP ve ICSI işlemlerinde kullanılan IVF-TALP vasatları ICSI uygulamasından 6-8 saat önce Hansen (2000) in belirttiği şekilde laminar flow altında taze olarak hazırlandı. Bu vasatların içerikleri ve hazırlanma yöntemleri çizelge de sunulmuştur. Bu çalışmada Sp-TALP vasatına sperm kapasitasyonunun desteklenmesi açısından ek olarak 10 µg/ml dozunda heparin ilave edildi.
71 Çizelge TALP Solüsyonlarının Hazırlanması İçerik Sp-TALP HEPES-TALP IVF-TALP TL (ml) 9, BSA Frak. V (mg) BSA EFAF (mg) Stok 2 Piruvat 0,5 0,1 0,1 Stok 8 antibiyotik (ml) 0,1 0,1 0,1 Stok 7 Heparin (µl) Fosfatlı Tampon Solüsyonunun (PBS) Hazırlanması Çalışmada 5 µm kalsiyum iyonofor ve 1,9 mm 6-DMAP`ın dozlama işlemlerinde kullanılan PBS solüsyonu Japan International Cooperation Agency`nin (2007) belirttiği şekilde laminar flow altında çalışma öncesinde hazırlandı ve + 4C o de muhafaza edildi. PBS için 700 ml PBS-A solüsyonu ve 100 ml PBS-B solüsyonu karıştırıldı ve bu karışıma 1 g glukoz ve 0,036 g sodyum piruvat eklendi. PBS-A ve PBS-B nin içerikleri ve hazırlanması çizelge ve de sunulmuştur (Japan International Cooparation Agency, 2007). Çizelge : PBS-A Solüsyonun İçerik ve Miktarı (700 ml) Sodyum klorid NaCl 8,0 g Potasyum klorid KCl 0,2 g Sodyum hidrojen fosfat Na 2 HPO 4 1,15 g Potasyum dihidrojen fosfat KH 2 PO 4 0,2 g Hazırlanan bu PBS-A solüsyonu ultrasaf su ile 700 ml e tamamlandı. Çizelge : PBS-B Solüsyonun İçerik ve Miktarı Kalsiyum klorid anhidrid CaCl 2 1,0 g Kalsium klorid dihidrat: CaCl 2H O 2 2 1,1395 g Magnesyum klorid (heksahidrat) MgCl 6H O 2 2 1,0 g
72 Hazırlanan bu solüsyon 100 ml`e tamamlanarak PBS-B stok solusyonu oluşturuldu. 10 ml stok solüsyondan alınıp ultra saf su ile 100 ml e tamamlanarak PBS-B solüsyonu yapıldı. 5 µm Ca iyonofor aktivatörünü hazırlanmasında kalsiyum ve magnesyumsuz PBS kullanıldığından PBS-B solüsyonu yerine PBS-A (100ml) kullanıldı Polyvinyl Pyrrolidon`un (PVP) Hazırlanması Sperm enjeksiyonu öncesi spermin enjektör pipetini çekme işlemini kolaylaştırmak amacı ile sperm hareketini yavaşlatmak için kullanılan toz halindeki PVP, % 4 lük çözeltisi olacak şekilde PBS içinde çözdürülerek +4 C o de saklandı Embriyo Kültür Vasatının (Charles Rosenkrans-1, CR1,aa) Hazırlanması Embriyo kültür vasatı olarak kullanılan CR1aa vasatı, ICSI uygulamasından 6-8 saat önce laminar flow altında hazırlandı. Bu vasat ICSI sonrası beşinci gün taze olarak yeniden hazırlandı ve embriyolar, taze hazırlanan CR1aa damlalarına aktarıldı. CR1aa vasatı hazırlanmasında öncelikle NaCl 3,3515 g; KCl 0,1155 g; NaHCO 3 1,1005 g; Na Piruvat 0,0220 g; Fenol kırmızısı 1ml olmak üzere STOK 1 solüsyonu hazırlandı. Bu solüsyon ultra saf su ile 380 ml`e tamamlandı. Sonra Hemi kalsiyum laktat dan 0,2998 g alınıp ultra saf su ile 100 ml e tamamlanarak STOK 2 solüsyonu hazırlandı. Sonra Kanagawa ve ark. larının (1995) bildirdiği yönteme uygun olarak CR1 aa vasatı hazırlandı. Bu vasatın hazırlama yöntemi ve içeriği çizelge de sunulmuştur.
73 Çalışmada kullanılmak üzere hazırlanan bütün vasatlar, solüsyonlar ve stok solüsyonlar kullanılmadan veya saklanmadan önce 0,22 µm lük enjektör filtresi ile filtre edildi. Çizelge : Embriyo Kültür Vasatının (CR1 aa) İçeriği STOK 1 STOK 2 BME 50X MEM 100X L-Glutamin BSA-FAF FCS Penisilin Streptomisin 76 ml 20 ml 2 ml 1 ml 1 ml 0,3 g 5 ml 100 IU/ml 100 µg/ml Çalışma Metotunu Liste Tarzında Sunumu 1-Ovaryumların mezbahaneden toplanması ve termos içinde 37C o taşıma vasatında laboratuvara getirilmesi. 2-Ovaryumların yıkama vasatı ile yıkanması ve ısıtma tablasında kurutma kağıdı ile kurutulması. 3-Follükül aspirasyonu (18G iğne ile). 4-Oosit seleksiyonu (A kalite, B kalite ve C kalite). 5-Oositlerin maturasyon vasatına alınması ve 24 saat kültürü (39 C %5). 6-Oositlerin kumulus oosit komplekslerinin soyulması. 7-Spermanın ICSI için hazırlanması (Swim up). 8-ICSI uygulaması.
74 9-Gruplara göre oositlerde aktivasyon işlemi. 10-Embriyonik gelişim aşamalarının gözlenmesi Grupların Oluşturulması ve Uygulama Oositler, ovaryum aspirasyonundan sonra Brackett ve Zuelke (1993)`nin tarif ettiği şekilde A (etrafında 4 sıradan daha fazla kumulus hücreleri bulunan ve homejen yapı gösteren oositler), B (etrafında 2-4 sıra kumulus hücresi bulunan veya az bir kımında kumulus bulunmayan oositler) ve C kalite (etrafında kumulus hücresi bulunmayan oositler) olarak ayrıldı. Maturasyon işlemine tabi tutulan A, B ve C kalite oositler eşit olarak üçer uygulama (Kalsiyum iyonofor, kalsiyum iyonofor+6-dmap kombine ve etanol aktivasyonlarının yapıldığı) ve aktivasyon uygulanmayan bir kontrol grubu olmak üzere dörter alt gruba ayrılarak toplam 12 gruba ayrıldı. Çizelge : Deney Düzeneğin Gruplandırılması Oosit Kalitesi Kullanılan Aktivatör Grup Adı A Kalite Kalsiyum İyonofor GrupACa Kalsiyum İyonofor ve 6-DMAP GrupACaD Etanol GrupAE Kontrol (aktivatör yok) GrupAK B Kalite Kalsiyum İyonofor GrupBCa Kalsiyum İyonofor ve 6-DMAP GrupBCaD Etanol GrupBE Kontrol (aktivatör yok) GrupBK C Kalite Kalsiyum İyonofor GrupCCa Kalsiyum İyonofor ve 6-DMAP GrupCCaD Etanol GrupCE Kontrol (aktivatör yok) GrupCK Ovaryumların Toplanması ve Laboratuvara Getirilmesi İnek ve düve karkasından uzaklaştırılan ovaryumlar 3 saat içerisinde ml sinde, 100 IU penisilin ve 100 µg streptomisin katkılı, 37C 500 ml %0,9 luk NaCl taşıma vasatı bulunan termos içerisinde laboratuvara getirildi.
75 In vitro fertilizasyon laboratuvarına getirilen ovaryumlar, kandan ve taşıma vasatından uzaklaştırılmak amacıyla 37 C deki %0,9 luk NaCl ile iki kez yıkanarak 37 C ye ayarlanan ısıtmalı tabla üzerine serilen kurutma kâğıtlarına alınarak 5 dakika kurumaya bırakıldı Follikül Aspirasyonu ve Oosit Seleksiyonu Aspirasyon işlemi, Keskintepe ve Bracket`in (2000) tarif ettiği şekilde, ucuna 18 G luk kanüller takılmış 10 ml lik plastik enjektörlerle gerçekleştirildi. 2-8 mm lik periferal folliküller aspirasyon için tercih edildi. Aspirasyona başlamadan önce enjektöre 0,5 ml maturasyon vasatı çekildi. Elde edilen follikül sıvıları sıcak su banyosu içerisinde bulunan 15 ml lik konik santrifüj tüplerinde biriktirildi. Oositlerin dibe çökmesi için bu tüpler 39 C ye ayarlanmış inkübatörde 5 dakika süre ile bekletildi. Bu süre sonunda üstteki süpernatant atılarak vasattan 5 ml eklenerek oositlerin yıkanması ve diğer hücrelerden ayrılmaları sağlandı. Yıkama işlemi 3 kez tekrarlandı. Yıkama işlemi sonunda tüpün dibinde kalan 1 ml lik vasat önceden laminar flow üzerindeki ısıtmalı tablada 37 C lik sıcaklığa ulaşmış 60x15 mm ölçülerindeki steril petrilere pipet yardımı ile aktarılarak seleksiyon işlemi gerçekleştirildi. Stereo mikroskop (Leica M205C, Germany) altında oositler Brackett ve Zuelke (1993) nin tanımladığı şekil modifiye edilerek Akyol (2007)`un bildirdiği gibi; zona pellusidası sağlam, sitoplazması bir örnek kumlu görünümlü, çevresinde sıkı şekilde 4 ve daha yukarı kumulus hücre katı bulunan oositler A kalite, etrafında 2-4 sıralı kumulus hücresi bulunan veya az bir sıralı kumulus hücresi bulunmayan ve kumlu veya hafif kumlu ooplazma görünümüne sahip oositler B kalite, etrafında kumulus hücresi bulunmayan ve homojen jel görünümlü oositlerde C kalite oositler olarak sınıflandırılarak işleme alındı.
76 Oositlerin Maturasyonu Maturasyon vasatı, maturasyon işleminden 6-8 saat önce %5 CO2 li atmosferde, 38,5 Cº`de ve maksimum nem ortamında kültüre bırakıldı. Maturasyon işleminde her 10 oosit, 50 µl lik vasat damlasının içine alınarak steril mineral yağ altında inkubasyona alındı. Maturasyon 38,5 Cº`de, %5 CO 2`li atmosferde, maksimum nem içeren ortamda gerçekleştirildi. Kültürün 24. saatinden itibaren, kumulus ekspansiyonu ve 1. kutup hücresinin atılıp atılmadığı kriterlerine göre maturasyon oranları belirlendi Spermanın ICSI İçin Hazırlanması Ticari payetlerde bulunan dondurulmuş spermatazoonlar ICSI işlemine hazırlamak için oositlerin maturasyon süresinin tamamlanmasından ve ICSI uygulamasından 1-2 saat önceden başlanarak Allamaneni ve ark., (2005)`nın bildirdiği şekil, modifiye edilerek aşağıda sunulan swim-up prosedürü uygulandı. Bu yöntemde; 3 adet payet (17,5x10 6 spermatozoon/payet) 37 C sıcak su banyosunda (PolyScience 9106, USA) 30 saniye süreyle çözdürülerek içinde 1ml Sp-TALP bulunan bir tüpe aktarıldı. Bu işlemden sonra, tüp içeriği 320 g de 5 dakika santrifüj edildi. Tüpün dip kısmında 0,5-1 ml içerik kalancıya kadar üstteki süpernatant atıldı. Dipte kalan tortudan 250 µl süspansiyon alınarak, önceden 1 ml Tyrode nin albumin laktat pirüvat sperm medyumu (Sperm-TALP) konmuş olan 2-3 tüpün dip kısmına yavaşça bırakıldı. Bu tüpler daha sonra 45 açıyla, 38 C de 1 saat inkübasyona alındı. Her tüpün üst kısmındaki 800 µl süpernatant alınarak bir tüpe aktarıldı. Süpernatantın alındığı tüp 320 g de 5 dk süreyle santrifüj edildi. Dip kısımda 500 µl kalıncaya kadar süpernatant atıldı. Hazırlanan sperm, ICSI uygulamasında kullanılmak üzere ependorf tüpe aktarılarak inkübatörde bekletildi.
77 Maturasyon İşlemine Tabi Tutulan Matür ve İmmatür Oositlerin ICSI için Hazırlanması Çalışmada kullanılan her kalite oosit maturasyon süresinin bitiminden sonra matur olup olmadığına bakılmaksızın %0,2 lik tripsin içeren hepesli Tyrode nin Albumin Laktat Pirüvat medyumuna (HEPES-TALP) aktarıldı. En dıştaki kumulus hücrelerinin ayrılmasını sağlamak amacıyla pipetasyon işlemi uygulanıp, iki kez Hepes-TALP ile yıkandı. Oositler daha sonra ICSI işlemine kadar Tyrode nin Albumin Laktat Pirüvat fertilizasyon vasatı (IVF-TALP) bulunan 35 mm lik petrilerde hazırlan mineral yağ ile kaplı 100 µl lik damlalara onarlı gruplar halinde aktarıldı Sığır Oositlerine İntrasitoplazmik Sperm Enjeksiyonu (ICSI) Uygulaması Oositlerin (A, B ve C kalite) sperm mikroenjeksiyonu, 24 saatlik maturasyon süresinin bitiminden hemen sonra invert mikroskop donanımlı mikromaniplatör sistemi ile gerçekleştirildi İntrasitoplazmik Sperm Enjeksiyonu Uygulamasına Hazırlık Sperm mikro enjeksiyonunda, dış çapı µm olan enjeksiyon pipeti ve oositin tutulması için (holding) iç çapı µm olan tutucu pipet kullanıldı. Önce holding, sonra da enjeksiyon pipetinin optik mikroskopta, sırasıyla 4X/0.10 PH, 10X/0.22 PH, 20X/0.30 PH ve 40X/0.50 PH büyütmeli objektifler kullanılarak netlik ve görüntü ayarları yapıldı. ICSI uygulamaları 40X/0,50 PH büyütmede yapılırken damla geçişleri 4X/0,10 PH objektifte yapıldı. ICSI uygulamasının yapılacağı uygulama petrisi olarak 90X15 lik petrinin kapağı kullanıldı. Petrinin tutucu pipetine yakın tarafına (petrinin sol yarımı) 20 µl lik IVF-TALP damlaları (oositlerin yerleştirilmesi için) konuldu. Petrinin sağ yarımına sıra ile 3-4 spermi konulacağı 10 ug/ml heparin eklenmiş 20 µl lik
78 Sp-Talp damlaları konuldu ve bu damlaya %4 PVP solüsyonunu eklenerek petri mineral yağ ile kaplandı. Petrinin sol tarafındaki damlalar içine ICSI uygulanacak oositler (1 oosit/damla), sağ tarafındaki damlalara ise sperm yerleştirildi (şekil ). Şekil ICSI uygulaması için hazırlanan petrinin şematik görünümü İntra sitoplazmik Sperm Enjeksiyonu Tekniği
79 Stereo mikroskop altında 40X0.50PH büyütme ile petrideki Sp-TALP damlası içinde bulunan spermatozoidin mikroenjeksiyon pipetine çekilmesinden önce spermatozoidin hareketini yavaşlatarak pipete çekilmesini kolaylaştırmak amacı ile başka bir pipete çekilen % 4 PVP solüsyonundan bir miktar spermin bulunduğu Sp-TALP damlasına verildi. Hareketi yavaşlayan spermatozidler enjeksiyon iğnesinin ucu ile yapılan yuvarlama hareketi yardımı ile kuyruğu kırılarak hareketsizliği sağlandı. Bu şekilde enjeksiyon pipeti (iğnesi) içine bir miktar vasat ile birlikte alındı. Spermatozoid, enjeksiyon esnasında fazla solüsyonun da oosite enjeksiyonunu engellemek için iğnenin uç kısmına getirildi. Petrinin sol tarafında IVF-TALP damlasında bulunan oositlerden kutup cisimciği olanlar, kutup cisimciği saat 6 veya 12 yönünde tutularak oositin zona pellusidanın saat 3 yönündeki tarafı, içinde sperm olan enjeksiyon iğnesi ile dikkatli bir şekilde tek seferde delinerek aşıldı. Oolemma da enjeksiyon iğnesi ile tek seferde aşıldıktan sonra oositin yaklaşık 2/3 lük kısmına kadar gidilerek bir parça ooplasma geri çekilerek sperm ve ooplasma enjekte edildi (şekil ) Mature olamayan oositlerde ise tutma ve enjeksiyon işleminde kriter kullanılmadı. ICSI işlemi uygulanan oositler, üzerleri mineral yağ ile örtülü 100 µl lik (TCM 199+% 5 calf serumu) kültür damlalarına aktarılarak (5ml/1 oosit hesabı ile) aktivasyon işlemine kadar % 5 CO 2 atmosfer ve 38,5 C o de kültüre edildi ICSI Uygulanmış Oositlerin Kimyasal Aktivasyonu Sperm enjekte edilen oositler, Oikawa ve arkadaşlarının (2005) tanımladığı şekilde, kalsiyum iyonofor, kalsiyum iyonofor+6-dmap kombine ve etanol olmak üzere üç farklı aktivasyon yöntemi ile aktive edildi.
80 Şekil ICSI uygulamasının şematik görünümü ICSI Uygulanan Oositlerde Kalsiyum İyonofor ile Aktivasyon ICSI uygulanan oositlerin kalsiyum iyonofor ile aktivasyonu için alttan çizilerek 2 yarıma ayrılan 60 mm lik petrinin, sol yarımına PBS de çözdürülmüş 5µM kalsiyum iyonofor içeren 3 adet 100µl lik damla konuldu. Diğer yarımana ise 3 tane 100 µl TCM 199+%5 CS içeren damla konuldu ve mineral yağ ile kaplandı. Etüvde bulunan ICSI uygulanmış oositler, ucu inceltilmiş pastör pipeti ile bulundukları damla vasatın içinden alınarak petri içinde önceden hazırlanan 5µM kalsiyum iyonofor içeren 100µl lik damlalara sıra ile aktarılarak yıkandı, 3. damlada % 5 CO 2 atmosfer ve 38,5 C o sıcaklıkta 5 dakika boyunca aktivasyon işlemine tabi tutuldular. Bu işlemden sonra
81 petrinin sağ tarafında hazırlanan yıkama damlalarında (TCM 199+%5 CS) 3 defa yıkanarak kültür vasatına aktarılacak hale getirildiler. Yıkama ve aktivasyon işlemleri tamamlanan oositler kültür vasatına aktarılmadan önce aktivasyon ve yıkama vasatlarından arındırılmaları amacı ile hazırlanan kültür vasatı ile birkaç defa damlacıktan damlacığa aktarma yöntemi ile yıkandı ve ve 35 mm lik ayrı bir petri içinde bulunan CR1aa embriyo kültür damlacıklarına aktarılarak 38,5 C o de %5 CO2 li ortamda kültüre edildi (şekil ) Şekil ICSI uygulanmış oositlerde Ca iyonofor ile aktivasyonun şeması
82 ICSI Uygulanan Oositlerde Kalsiyum İyonofor+6- Dimetilaminopurin ile Kombine Aktivasyon ICSI uygulanan oositlerde Ca iyonofor ve 6-DMAP kombine aktivasyon için, 90 mm lik petri, altından çizilerek 4 çeyrek parçaya ayrıldı. Sol üst çeyreğe 3 adet 5µM kalsiyum iyonofor içeren 100 µl lik damla, sol alt çeyreğe 3 adet TCM199+%5CS içeren 100 µl lik damla, sağ alt çeyreğe 100 µl lik 1,9 mm DMAP içeren damla ve sağ üst çeyreğe de 3 adet 100 µl TCM 199+%5CS damla hazırlanarak mineral yağ ile kaplandı. Sperm enjeksiyonundan sonra oositler kalsiyum iyonofor içeren 100 µl lik damlalardan damlalara geçirilerek 3 kere yıkandıktan sonra 5 dakika boyunca 5µM kalsiyum iyonofor ile aktive edildi. Bu aşamadan sonra TCM 199+%5CS damlalarında 3 defa yıkanıp aynı solüsyon ile % 5 CO 2 ve 38,5 C o sıcaklıkta 3 saat kültüre edildi. İnkübasyondan sonra 1,9 mm DMAP`lı damlalardan geçirilerek 3 defa yıkanan oositlere, 3 saat boyunca 1,9 mm DMAP ile aktive edildi. Aktivasyon işleminden sonra TCM 199+%5CS içeren damlalarda 3 defa yıkanıp ardından 3 kere CR1aa vasatında yıkanarak CR1aa embriyo kültürüne alındı.
83 Şekil ICSI uygulanmış oositlerde Ca iyonofor ve 6-DMAP kombine aktivasyonun şeması ICSI Uygulanan Oositlerde Etanol ile Aktivasyon ICSI uygulanan oositlerin etanol ile aktivasyonu altı çizilerek 4 çeyreğe ayrılan 60 mm lik petri içinde gerçekleştirildi. Etüvden alınan oositler sol üst çeyreğe yerleştirilmiş 3 adet yıkama damlasında (TCM 199+%5CS) sıra ile yıkandıktan sonra %5 CO 2 ve 38,5 C o sıcaklıkta 4 saat kültüre edildi. Bu işlemden sonra petrinin sol alt çeyreğinde hazırlanan aktivasyon damlalarına (TCM+%7 etanol+%1pvp) aktarılarak 3 defa yıkandı. Üçüncü damlada 5 dakika boyunca aktive edildi. Aktivasyon işleminden sonra bu oositler petrinin sağ alt
84 ve üst çeyreğinde hazırlanan yıkama damlarında (TCM 199+%5 CS) 3 kere yıkandıktan sonra CR1aa içeren damlalarda yıkanarak CR1aa embriyo kültürüne alınıp inkübatöre konuldu (şekil ) Her kalite oositteki kontrol gruplarında ise bu aktivasyon işlemlerinin hiçbiri uygulanmadan sadece İntrasitoplazmik sperm enjeksiyonu yapıldıktan sonra CR1aa içeren droplarda 3 kere yıkandıktan sonra direkt embriyo kültürüne (CR1aa) alındı. Şekil ICSI uygulanmış oositlerde etanol ile aktivasyonun şeması Embriyo Kültürü
85 Uygulama ve kontrol gruplarına ait ve ICSI uygulanan oositler 10 arlı gruplar halinde üzerleri mineral yağ ile kapatılmış 50 µl lik embriyo kültür vasatı (CR1aa+3mg/ml BSA) içeren damlalara aktarılarak % 5 CO 2 atmosfer ve 38,5 C o lik etüvde kültüre edildi. Oositlerin kültür işleminin 24. saatinde bölünme, 120. (beşinci gün) saatte morula evresine ulaşma oranı kaydedildi. Bu aşamada kültür vasatı değiştirilerek 168. (yedinci gün) saate uzatılarak blastosist aşamasına ulaşım oranları stereo mikroskop altında belirlenerek sonuçlar niteliksel olarak kaydedildi İstatistiksel Değerlendirme ICSI uygulamalarında farklı oosit kalitelerinin (A, B ve C kalite) ve kullanılan değişik kimyasal yöntemlerin (kalsiyum iyonofor, kalsiyum iyonofor+6-dmap kombine ve etanol) bölünme, morula ve blastosist gibi embriyonik gelişim aşamalarına etki dereceleri SPSS (Statistic Packet of Social Science) (serial: ) Paket Programında multiple lojistic regresyon analizi ve Hosmer-Lemeshow H + istatistiği kullanılarak değerlendirildi. Farklı kalite oositlerde aktivasyon uygulanan gurupların kontrol grubuna göre bölünme, morula ve blastosit aşamalarına ulaşma oranlarının farklılığının anlamlığı ise aynı paket proğramında, chi square istatistiği kullanılarak değerlendirildi.
86 3. BULGULAR 3.1. Ovaryumların Oosit Potansiyeli Bu çalışmada, Ankara ili, Çubuk ilçe mezbahanesinden toplanan ve oosit kaynağı olarak kullanılan inek ve düve ovaryumlarının (786 adet), yüzeysel folliküllerinin; 1216 adet A (%33,08; birim ovaryumdan 1,54 adet), 1123 adet B (%30,56; birim ovaryumdan 1,43 adet) ve 1336 adet C kalite (%36,35; birim ovaryumdan 1,7 adet) oosit potansiyeline sahip olduğu gözlemlendi (şekil 3.1.1). Bu oositler içinde B ve C kalite oosit sayısı A kalite oositlere göre yüksek bulundu. A kalite oositler B kalite oositler C kalite oositler Şekil 3.1.1: Farklı kalite oositler (20X0,30 PH büyütmede) 3.2. A, B ve C Kalite Oositlerin Maturasyon Kapasitesi Maturasyon işleminden sonra A, B ve C kalite oositlerin tam kumulus ekspansiyonu şekillenme kriterine göre, maturasyon oranları; A kalite oositlerde %94,28; B kalite oositlerde %62,75; C kalite oositlerde %0 olarak bulundu. Birinci kutup hücresi atılım kriterine göre ise maturasyon; A kalite oositlerde %89,52; B kalite oositlerde %55,75; C kalite oositlerde ise %1,45 olarak bulundu (çizelge 3.2.1).
87 1. Kutup hücresi a b Şekil Kumulus ekpansiyonu (a) ve 1. kutup hücresi şekillenen (b) oositler (40X0,50 PH büyütmede) Çizelge Farklı Kalite Oositlerin Maturasyonunda Kumulus Ekspansiyon ve 1. Kutup Hücresi Atılım Oranları. Maturasyon Grupları Oosit Sayısı TKE(%) KH (%) A kalite (94,28) a 376 (89,52) a B kalite (62,75) b 223 (55,75) b C kalite (0) 6 (1,45) c TKE: Tam kumulus ekspansiyonu gerçekleşen oosit KH: 1. kutup hücresini atan oosit a, b ve c: Aynı sütunda farklı harfler taşıyan gruplar arasındaki fark önemlidir (p<0,05) Intrasitoplazmik Sperm Enjeksiyonun Pratik Önemi Uygulamada sperm mikroenjeksiyon ve oosit tutucu pipetin aynı düzlemde tutulmasının zahmetli ve uygulama için büyük öneme sahip olduğu gözlemlendi. Mikroenjeksiyon uygulamaları esnasında (şekil 3.3.1), spermatozoidin mikroenjeksiyon pipetine çekilmesinin zaman alıcı zahmetli bir iş olduğu ve 10 oositin ICSI uygulamalarının zaman içinde kazanılan tüm tecrübelere rağmen dakikada tamamlanabildiği saptandı. Enjeksiyon esnasında enjeksiyon pipetinin zona pellusida ve ooplasmada mekanik hasara yol açtığı bazı olgularda oolemmanın bütünlüğünün bozulduğu ve hatta
88 ooplasmada enjeksiyon esnasında oluşan açıklıktan dışarıya (perivitellin boşluğa) taştığı gözlendi. Çalışmada, enjeksiyon esnasında oluşan ooplasma ve oolemmadaki mekanik hasar gözlenen oositlerin değerlendirme dışı bırakılmasına özen gösterildi. oolemma ooplazma KH ZP ZP Sperm enjeksiyonundan önce ooplasmanın pipete çekilmesi KH: Kutup Hücresi, ZP: Zona Pellusida. Şekil ICSI uygulaması (40X0,50 PH büyütmede) Enjeksiyon sonrası zona pellusida ve oolemma da oluşan fiziksel hasar 3.4. ICSI Uygulamasından Sonra Her Kalite Oositteki Aktivatör Gruplarında Embriyonik Gelişime Ulaşma Bulguları A kalite Oositlerde Ca iyonofor Aktivasyonunun Embriyonik Gelişime Etkileri ICSI uygulamasından sonra, Ca iyonofor ile aktive edilen 110 adet A kalite oositin 46 tanesinin (%41,82) 24. saatte bölündüğü, 22 tanesinin (%20) 5. günde morula aşamasına ulaştığı ve 14 (%12,73) tanesinin de 7. günde blastosist aşamasına kadar ulaştığı gözlendi (çizelge ). A kalite oositlerde aktivasyonun uygulanmadığı kontrol grubunda ise 100 adet oositin 30 tanesinin (%30) bölündüğü, 11 tanesinin (%11) morula ve 4 (%4)
89 tanesinin de blastosist aşamalarına kadar ulaştığı gözlendi (çizelge ). Grup ACa da kontol grubuna göre bütün embriyonik aşamalara ulaşma oranları arasındaki fark istatistiki olarak anlamlı bulundu (p<0,05). Çizelge A kalite Oositlerde Ca İyonofor Aktivasyonunun Embriyonik Gelişime Etkisi Embriyonik Gelişim Aşamaları Bölünme (24. saat) Morula (5. Gün) Blastosist (7. Gün) Grup Var Yok Var Yok Var Yok (n) n (%) n (%) n (%) n (%) n (%) n (%) ACa (110) 46 a (41,82) 64 (58,18) 22 a (20) 88 (80) 14 a (12,73) 96 (87,27) AK (100) 30 b (30) 70 (70) 11 b (11) 89 (89) 4 b (4) 96 (96) a, b: aynı sütunda farklı harflerin bulunduğu rakamlar arasındaki fark anlamlıdır A Kalite Oositlerde Ca iyonofor+6-dmap Kombine Aktivasyonun Embriyonik Gelişime Etkileri ICSI uygulanmış A kalite oositlerde Ca iyonofor ve 6-DMAP ile aktive edilen 110 adet oositin 77 tanesinin (%70) 24. saatte bölündüğü, 57 tanesinin (%51,82) 5. günde morula ve 34 (%30,90) tanesinin de 7. günde blastosist aşamalarına kadar ulaştığı gözlendi. A kalite oositlerde aktivasyonun uygulanmadığı kontrol grubunda ise 100 adet oositin 30 tanesinin (%30) bölündüğü, 11 tanesinin (%11) morula ve 4 (%4) tanesinin de blastosist aşamalarına kadar ulaşdığı gözlendi (çizelge ). Grup ACaD da kontol grubuna göre bütün embriyonik aşamalara ulaşma oranları arasındaki fark istatistiki olarak anlamlı bulundu (p<0,05).
90 Çizelge A Kalite Oositlerde Ca İyonofor ve 6-DMAP Aktivasyonunun Embriyonik Gelişime Etkisi. Embriyonik Gelişim Aşamaları Bölünme (24. saat) Morula (5. Gün) Blastosist (7. Gün) Grup (n) Var n (%) Yok n (%) Var n (%) Yok n (%) Var n (%) Yok n (%) ACaD (110) 77 a (70) 33 (30) 57 a (51,82) 53 (48,12) 34 a (30,9) 76 (69,1) AK (100) 30 b (30) 70 (70) 11 b (11) 89 (89) 4 b (4) 96 (96) a, b: aynı sütunda farklı harflerin bulunduğu rakamlar arasındaki fark anlamlıdır A Kalite Oositlerde Etanol ile Aktivasyonun Embriyonik Gelişime Etkileri ICSI uygulaması sonrası A kalite oositlerde etanol ile aktive edilen 100 adet oositin 47 tanesinin (%47) 24. saatte bölündüğü, 32 tanesinin (%32) 5. günde morula ve 23 (%23) tanesinin de 7. günde blastosist aşamalarına kadar ulaştığı gözlendi (çizelge ). A kalite oositlerde kontrol grubun da ise 100 adet oositin 30 tanesinin (%30) bölündüğü, 11 tanesinin (%11) morula ve 4 (%4) tanesinin de blastosist aşamalarına kadar ulaştığı gözlendi. Grup AE de kontol grubuna göre bütün embriyonik aşamalara ulaşma oranları arasındaki fark istatistiki olarak anlamlı bulundu (p<0,05). Çizelge A Kalite Oositlerde Etanol Aktivasyonunun Embriyonik Gelişime Etkisi Grup (n) Embriyonik Gelişim Aşamaları Bölünme (24. saat) Morula (5. Gün) Blastosist (7. Gün) Var n (%) Yok n (%) Var n (%) a, b: aynı sütunda farklı harflerin bulunduğu rakamlar arasındaki fark anlamlıdır Yok n (%) Var n (%) Yok n (%) AE (100) 47 a (47) 53 (53) 32 a (32) 68 (68) 23 a (23) 77 (77) AK (100) 30 b (30) 70 (70) 11 b (11) 89 (89) 4 b (4) 96 (96)
91 Çizelge A Kalite Oositlerde Farklı Aktivasyon Metotlarının Embriyonik Gelişime Etkileri Gruplar Bölünme Morula Blastosist (n) n (%) n (%) n (%) ACa (110) 46 a (41,82) 22 a (20) 14 a (12,73) ACaD (110) 77 b (70) 57 b (51,82) 34 b (30,90) AE (100) 47 a (47) 32 c (32) 23 c (23) AK (100) 30 c (30) 11 d (11) 4 d (4) a,b,c,d: aynı sütündaki farklı harfler içeren rakamlar arasında fark anlamlıdır (p<0,05) ICSI sonrası A kalite oositlerde farklı aktivasyon metotlarının uygulandığı gruplarda en yüksek 24. saat bölünme oranı %70 ile Ca iyonofor+6-dmap kombine aktivasyon grubunda görülürken, bunu %47 bölünme ile etanol grubu takip etti. Sadece Ca iyonoforun kullanıldığı grupta %41,82 bölünme gözlenirken kontrol grubundaki bölünme oranının deneme guruplarına nazaran çok düşük olduğu (%30) dikkat çekti. Tüm deneme gruplarındaki bölünme oranlarının kontrol grubu ile farkı istatistiki olarak anlamlı bulundu (şekil ) A kalite oositlerde aktivasyon gruplarında en yüksek 5. gün morula aşamasına ulaşma oranı benzer şekilde Ca iyonofor+6-dmap grubunda gözlenirken (%51,82) bunu sıra ile etanol (%32) ve Ca iyonofor grubu (%20) takip etti. Kontrol grubundaki embriyoların ise %11 oranında morula aşmasına ulaştığı gözlendi. A kalite oositlerde tüm deneme gruplarındaki morula oranlarının kontrol grubu ile farkı istatistiki olarak anlamlı bulundu (şekil ) A kalite oositlerde aktivasyon gruplarında 7. gün blastosist aşamasına ulaşma oranları açısından gruplara bakıldığında %30,90`lık oran ile en yüksek değer Ca iyonofor+6-dmap kombine grubunda gözlenirken etanol grubunda %23, Ca iyonofor grubunda %12,73 ve kontrol grubunda ise sadece %4 blastosist oranları elde edildiği kaydedildi. A kalite oositlerde tüm
92 deneme gruplarındaki blastosist oranlarının kontrol grubu ile farkı istatistiki olarak anlamlı bulundu bölünme morula blastosist Ca iyonofor Ca + DMAP ethanol Kontroll Şekil : A kalite oositlerde farklı aktivasyon metotlarında embriyonik gelişimin aşamalarının oranları 24. saatte bölünme 5. günde morula 7. günde blastosist Şekil : A kalite oositlerde bölünme, morula ve blastosist görüntüleri (40X0,50PH büyütmede)
93 B Kalite Oositlerde Ca İyonofor ile Aktivasyonun Embriyonik Gelişime Etkileri ICSI uygulanmış B kalite oositlerde Ca iyonofor ile aktive edilen 101 adet oositin 20 tanesinin (%19,80) 24. saatte bölündüğü, 10 tanesinin (%9,90) 5. günde morula ve 6 (%5,94) tanesinin de 7. günde blastosist aşamalarına kadar ulaştığı gözlendi (çizelge ). B kalite oositlerde aktivasyonun uygulanmadığı kontrol grubuna ait 93 adet oositin ise 12 tanesinin (%12,90) bölündüğü, 4 tanesinin (%4,30) morula ve 2 (%2,15) tanesinin de blastosist aşamalarına kadar ulaşdığı gözlendi. Grup BCa da kontol grubuna göre bölünme ve morula aşamalara ulaşma oranları arasındaki fark istatistiki olarak anlamlı bulundu (p<0,05). Çizelge B Kalite Oositlerde Ca İyonofor Aktivasyonunun Embriyonik Gelişime Etkisi. Grup (n) Embriyonik Gelişim Aşamaları Bölünme (24. saat) Morula (5. Gün) Blastosist (7. Gün) Var n (%) Yok n (%) Var n (%) Yok n (%) Var n (%) Yok n (%) BCa (101) 20 a (19,8) 81 (80,2) 10 a (9,9) 91 (90,1) 6 (5,94) 95 (94,06) BK (100) 12 b (12,9) 81 (87,1) 4 b (4,3) 89 (95,7) 2 (2,15) 91 (97,85) a, b: aynı sütunda farklı harflerin bulunduğu rakamlar arasındaki fark anlamlıdır B Kalite Oositlerde Ca İyonofor+6-DMAP Kombine Aktivasyonun Embriyonik Gelişime Etkileri ICSI uygulanmış B kalite oositlerde Ca iyonofor ve 6-DMAP ile aktive edilen 100 adet oositin 31 tanesinin (%31) 24. saatte bölündüğü, 23 tanesinin (%23) 5. günde morula ve 14 (%14) tanesinin de 7. günde blastosist aşamalarına kadar ulaştığı gözlendi (çizelge ). B kalite oositlerde aktivasyonun uygulanmadığı kontrol grubuna ait 93 adet oositin ise 12 tanesinin (%12,90) bölündüğü, 4 tanesinin (%4,30) morula ve 2 (%2,15) tanesinin de blastosist aşamalarına kadar ulaşdığı gözlendi. Grup ABCaD da
94 kontol grubuna göre bütün embriyonik aşamalarına ulaşma oranları arasındaki fark istatistiki olarak anlamlı bulundu (p<0,05). Çizelge B Kalite Oositlerde Ca İyonofor ve 6-DMAP Aktivasyonunun Embriyonik Gelişime Etkisi. Embriyonik Gelişim Aşamaları Bölünme (24. saat) Morula (5. Gün) Blastosist (7. Gün) Grup Var Yok Var Yok Var Yok (n) n (%) n (%) n (%) n (%) n (%) n (%) BCaD (100) 31 a (31) 69 (69) 23 a (23) 77 (77) 14 a (14) 86 (86) BK (100) 12 b (12,9) 81 (87,1) 4 b (4,3) 89 (95,7) 2 b (2,15) 91 (97,85) a, b: aynı sütunda farklı harflerin bulunduğu rakamlar arasındaki fark anlamlıdır B Kalite Oositlerde Etanol ile Aktivasyonun Embriyonik Gelişime Etkileri ICSI uygulanmış B kalite oositlerde etanol ile aktive edilen 106 adet oositin 17 tanesinin (%16,03) 24. saatte bölündüğü, 9 tanesinin (%8,49) 5. günde morula ve 4 (%3,77) tanesinin de 7. günde blastosist aşamalarına kadar ulaştığı gözlendi (çizelge ). B kalite oositlerde aktivasyonun uygulanmadığı kontrol grubuna ait 93 adet oositin ise 12 tanesinin (%12,90) bölündüğü, 4 tanesinin (%4,30) morula ve 2 (%2,15) tanesinin de blastosist aşamalarına kadar ulaşdığı gözlendi. Grup BE da kontol grubuna göre sadece bölünme aşamasına ulaşma oranları arasındaki fark istatistiki olarak anlamlı bulundu (p<0,05).
95 Çizelge B Kalite Oositlerde Etanol aktivasyonunun Embriyonik Gelişime Etkisi. Grup (n) Embriyonik Gelişim Aşamaları Bölünme (24. saat) Morula (5. Gün) Blastosist (7. Gün) Var n (%) Yok n (%) Var n (%) Yok n (%) Var n (%) Yok n (%) BE (106) 17 a (16,03) 89 (83,97) 9 (8,49) 97 (91,51) 4 (3,77) 102 (96,23) BK (100) 12 b (12,9) 81 (87,1) 4 (4,3) 89 (95,7) 2 (2,15) 91 (97,85) a,b: aynı sütunda farklı harflerin bulunduğu rakamlar arasındaki fark anlamlıdır Çizelge B Kalite Oositlerde Farklı Aktivasyon Metotlarınnın Embriyonik Gelişime Etkisi. Gruplar (n) Bölünme Morula Blastosist n (%) n (%) n (%) BCa (101) 20 a (19,8) 10 a (9,9) 6 a (5,94) BCaD (100) 31 b (31) 23 b (23) 14 b (14) BE (106) 17 a (16,3) 9 a (8,49) 4 a (3,77) BK (93) 12 c (12,9) 4 a (4,3) 2 a (2,15) a,b,c: aynı sütunda farklı harflerin bulunduğu rakamlar arasındaki fark anlamlıdır ICSI uygulanmış B kalite oositlerde farklı aktivasyon metotlarının uygulandığı gruplarda en yüksek 24. saatte bölünme oranı %31 ile Ca iyonofor+6-dmap kombine aktivasyon grubunda görülürken, bunu %19,8 bölünme ile Ca iyonofor grubu takip etti. Etanolün kullanıldığı grupta %16,3 bölünme gözlenirken kontrol grubundaki bölünme oranının ise %12,9 olduğu kaydedildi. B kalite oositlerde tüm deneme gruplarındaki bölünme oranlarının kontrol grubu ile farkı istatistiki olarak anlamlı bulundu (şekil ) B kalite oositlerde en yüksek 5. gün morula oranı gene Ca iyonofor+6- DMAP grubunda gözlenirken (%23) bunu sıra ile Ca iyonofor (%9,9) ve
96 etanol (%8,49) grubu takip etti. Kontrol grubundaki embriyoların ise %2,15 oranında morula aşmasına ulaştığı gözlendi. (şekil ) Blastosist oranları açısından gruplara bakıldığında %14 blastosist aşamasına ulaşma oranı ile en yüksek Ca iyonofor+6-dmap kombine grubunda gözlenirken Ca iyonofor grubunda %5,94, etanol grubunda %3,77 ve kontrol grubunda ise sadece %2,15 blastosist oranları elde edildiği kaydedildi. B kalite oositlerde sadece grup BCaD de blastosit oranının kontrol grubu ile farkı istatistiki olarak anlamlı bulundu (şekil ) bölünme morula blastosist Ca iyonofor Ca + DMAP ethanol kontrol Şekil B kalite oositlerde farklı aktivasyon metotlarında embriyonik gelişim aşamalarının oranları.
97 24. saatte bölünme 5. günde morula 7. günde blastosist Şekil B Kalite oositlerde bölünme, morula ve blastosist görünümleri (40X0,50 PH büyütmede) C Kalite Oositlerde Ca iyonofor ile Aktivasyonun Embriyonik Gelişime Etkileri ICSI uygulanmış C kalite oositlerde Ca iyonofor ile aktive edilen 100 adet oositin 2 tanesinin (%2) 24 saatte bölündüğü, 1 tanesinin (%1) 5. günde morula aşamasına ulaşırken blastosist aşamasına ulaşan olmadığı gözlendi (çizelge ). C kalite oositlerde ICSI uygulamasını takiben aktivasyon uygulanmadığı kontrol grubuna ait 100 adet oositin 1 tanesinin (%1) bölündüğü ancak morula ve blastosist aşamasına ulaşan oosit olmadığı gözlendi. Çizelge C Kalite Oositlerde Ca İyonofor Aktivasyonunun Embriyonik Gelişime Etkisi Embriyonik Gelişim Aşamaları Bölünme (24. saat) Morula (5. Gün) Blastosist (7. Gün) Grup (n) Var n (%) Yok n (%) Var n (%) Yok n (%) Var n (%) Yok n (%) CCa (100) 2 (2) 98 (98) 1 (1) 99 (99) 0 (0) 100 (100) CK (100) 1 (1) 99 (99)
FERTİLİZASYON-Döllenme
 FERTİLİZASYON-Döllenme Tanım Spermatozoon ile Oosit II nin birleşerek yeni bir canlı olan ZİGOT u şekillendirmesi Ovulasyonla yumurta yoluna atılan Oosit korona radiata hücreleri ile sarılıdır. - Oosit
FERTİLİZASYON-Döllenme Tanım Spermatozoon ile Oosit II nin birleşerek yeni bir canlı olan ZİGOT u şekillendirmesi Ovulasyonla yumurta yoluna atılan Oosit korona radiata hücreleri ile sarılıdır. - Oosit
BİYOTEKNOLOJİ NEDİR? Canlılar aracılığı ile ürün ve hizmet üretmektir
 BİYOTEKNOLOJİ NEDİR? Canlılar aracılığı ile ürün ve hizmet üretmektir Reprodüktif Biyoteknolojinin Amacı Canlılarda in vivo ve in vitro koşullarda gen kaynaklarının uzun süreli korunması ve daha fazla
BİYOTEKNOLOJİ NEDİR? Canlılar aracılığı ile ürün ve hizmet üretmektir Reprodüktif Biyoteknolojinin Amacı Canlılarda in vivo ve in vitro koşullarda gen kaynaklarının uzun süreli korunması ve daha fazla
Fertilizasyon ve Erken Embriyogenez
 Fertilizasyon ve Erken Embriyogenez Prof.Dr. Alp Can Histoloji-Embriyoloji ABD Embriyoloji (Gelişim Bilimi) [embriyo=cenin, logos=bilim] Tanımsal (deskriptif embriyoloji) Gelişim mekanizmaları İnsanın
Fertilizasyon ve Erken Embriyogenez Prof.Dr. Alp Can Histoloji-Embriyoloji ABD Embriyoloji (Gelişim Bilimi) [embriyo=cenin, logos=bilim] Tanımsal (deskriptif embriyoloji) Gelişim mekanizmaları İnsanın
SIĞIR OOSİTLERİNDE İNTRASİTOPLAZMİK SPERM ENJEKSİYONU (ICSI), ICSI SONRASI OOSİTLERİN AKTİVASYONU VE GELİŞİM AŞAMALARININ DEĞERLENDİRİLMESİ
 SIĞIR OOSİTLERİNDE İNTRASİTOPLAZMİK SPERM ENJEKSİYONU (ICSI), ICSI SONRASI OOSİTLERİN AKTİVASYONU VE GELİŞİM AŞAMALARININ DEĞERLENDİRİLMESİ Duygu BAKİ ACAR DOĞUM ve JİNEKOLOJİ ANABİLİM DALI DOKTORA TEZİ
SIĞIR OOSİTLERİNDE İNTRASİTOPLAZMİK SPERM ENJEKSİYONU (ICSI), ICSI SONRASI OOSİTLERİN AKTİVASYONU VE GELİŞİM AŞAMALARININ DEĞERLENDİRİLMESİ Duygu BAKİ ACAR DOĞUM ve JİNEKOLOJİ ANABİLİM DALI DOKTORA TEZİ
İN VİTRO EMBRİYO ÜRETİMİ
 İN VİTRO EMBRİYO ÜRETİMİ İn vitro döllemenin tarihçesi Karl von Baer (1825): Modern embriyolojinin babası olarak da kabul edilir. Köpek ovaryumu ve ovositleri üzerine ilk ciddi çalışmaları yapmıştır. Walter
İN VİTRO EMBRİYO ÜRETİMİ İn vitro döllemenin tarihçesi Karl von Baer (1825): Modern embriyolojinin babası olarak da kabul edilir. Köpek ovaryumu ve ovositleri üzerine ilk ciddi çalışmaları yapmıştır. Walter
Şekil 1. Mitoz bölünmenin profaz evresi.
 KONU 9. HÜCRE BÖLÜNMESİ MİTOZ BÖLÜNME Mitoz bölünme tek hücreli canlılardan, çok hücreli canlılara ve insana kadar birçok canlı grubu tarafından gerçekleştirilebilir. Mitoz bölünme sonunda bölünen hücrelerden
KONU 9. HÜCRE BÖLÜNMESİ MİTOZ BÖLÜNME Mitoz bölünme tek hücreli canlılardan, çok hücreli canlılara ve insana kadar birçok canlı grubu tarafından gerçekleştirilebilir. Mitoz bölünme sonunda bölünen hücrelerden
Spermatozoanın Dişi Genital Kanalındaki Hareketi. Üreme Biyolojisi ve Yapay Tohumlama Prof. Dr. Fatin CEDDEN
 Spermatozoanın Dişi Genital Kanalındaki Hareketi Üreme Biyolojisi ve Yapay Tohumlama Prof. Dr. Fatin CEDDEN Döllenme Sperm hücresinin ovuma girip kaynaşması olayına (fekondasyon) Döllenme denir. Bu olgu
Spermatozoanın Dişi Genital Kanalındaki Hareketi Üreme Biyolojisi ve Yapay Tohumlama Prof. Dr. Fatin CEDDEN Döllenme Sperm hücresinin ovuma girip kaynaşması olayına (fekondasyon) Döllenme denir. Bu olgu
Üreme Biyolojisi ve Yapay Tohumlama
 Üreme Biyolojisi ve Yapay Tohumlama 7. Hafta Prof. Dr. Gürsel DELLAL Döllenme (Fertilizasyon=Fekondasyon): -Sperm ve oositin II in birleşmesi -Ovulasyonda kendisini saran corona radiata hücre katı ile
Üreme Biyolojisi ve Yapay Tohumlama 7. Hafta Prof. Dr. Gürsel DELLAL Döllenme (Fertilizasyon=Fekondasyon): -Sperm ve oositin II in birleşmesi -Ovulasyonda kendisini saran corona radiata hücre katı ile
Sığrlarda Embryo Transferi. Prof.Dr.Serhat Pabuccuoğlu
 Sığrlarda Embryo Transferi Prof.Dr.Serhat Pabuccuoğlu BİYOTEKNOLOJİ NEDİR? Canlılar aracılığı ile ürün ve hizmet üretmektir Reprodüktif Biyoteknolojinin Amacı Canlılarda in vivo ve in vitro koşullarda
Sığrlarda Embryo Transferi Prof.Dr.Serhat Pabuccuoğlu BİYOTEKNOLOJİ NEDİR? Canlılar aracılığı ile ürün ve hizmet üretmektir Reprodüktif Biyoteknolojinin Amacı Canlılarda in vivo ve in vitro koşullarda
YUMURTA TİPLERİ BÖLÜNME ŞEKİLLERİ İNVİTRO FERTİLİZASYON VE EMBRİYO NAKLİ. Doç. Dr. Alev Gürol BAYRAKTAROĞLU
 YUMURTA TİPLERİ BÖLÜNME ŞEKİLLERİ İNVİTRO FERTİLİZASYON VE EMBRİYO NAKLİ Doç. Dr. Alev Gürol BAYRAKTAROĞLU Yumurta tipleri : Çeşitli hayvan yumurtaları, taşıdıkları lecithus (vitellus) maddesinin azlığına
YUMURTA TİPLERİ BÖLÜNME ŞEKİLLERİ İNVİTRO FERTİLİZASYON VE EMBRİYO NAKLİ Doç. Dr. Alev Gürol BAYRAKTAROĞLU Yumurta tipleri : Çeşitli hayvan yumurtaları, taşıdıkları lecithus (vitellus) maddesinin azlığına
DİŞİ EŞEY HÜCRELERİNİN GELİŞMESİ OLGUNLAŞMASI. Doç. Dr. A. Gürol BAYRAKTAROĞLU
 DİŞİ EŞEY HÜCRELERİNİN GELİŞMESİ OLGUNLAŞMASI Doç. Dr. A. Gürol BAYRAKTAROĞLU OVOGENEZİS Dişi eşey hücresinin gelişip olgunlaşmasına ovogenezis denir. Spermatogenezisteki gibi çoğalma, büyüme ve olgunlaşma
DİŞİ EŞEY HÜCRELERİNİN GELİŞMESİ OLGUNLAŞMASI Doç. Dr. A. Gürol BAYRAKTAROĞLU OVOGENEZİS Dişi eşey hücresinin gelişip olgunlaşmasına ovogenezis denir. Spermatogenezisteki gibi çoğalma, büyüme ve olgunlaşma
10. SINIF KONU ANLATIMI. 16 ÜREME BÜYÜME GELİŞME Döllenme ve Aile Planlaması Soru Çözümü
 10. SINIF KONU ANLATIMI 16 ÜREME BÜYÜME GELİŞME Döllenme ve Aile Planlaması Soru Çözümü DÖLLENME Dişi üreme sistemine giren sperm hücreleri yumurta hücresinin salgıladığı FERTİLİZİN sayesinde yumurta hücresini
10. SINIF KONU ANLATIMI 16 ÜREME BÜYÜME GELİŞME Döllenme ve Aile Planlaması Soru Çözümü DÖLLENME Dişi üreme sistemine giren sperm hücreleri yumurta hücresinin salgıladığı FERTİLİZİN sayesinde yumurta hücresini
CANLILARDA DÖLLENME PROF.DR. NURSEL GÜL
 CANLILARDA DÖLLENME GİRİŞ Erkek ve dişi gametin birleşmesi olup iki olayında nedenidir. Bu iki önemli olayın birisi yumurtanın aktive olması yani gelişime engel olduğu bildirilen sitostatik faktörün etkisiz
CANLILARDA DÖLLENME GİRİŞ Erkek ve dişi gametin birleşmesi olup iki olayında nedenidir. Bu iki önemli olayın birisi yumurtanın aktive olması yani gelişime engel olduğu bildirilen sitostatik faktörün etkisiz
DİŞİ ÜREME ORGANLARI
 DİŞİ ÜREME ORGANLARI Dişi üreme organları dişi gamet hücresi ovumu (yumurtayı) üreten ovaryumlar ile ovumun döllendiği, döllenme sonrasında gebeliğin şekillendiği ve gelişen yavrunun dışarı çıkarıldığı
DİŞİ ÜREME ORGANLARI Dişi üreme organları dişi gamet hücresi ovumu (yumurtayı) üreten ovaryumlar ile ovumun döllendiği, döllenme sonrasında gebeliğin şekillendiği ve gelişen yavrunun dışarı çıkarıldığı
ÜNİTE 7 FERTİLİZASYON VE ZİGOTUN OLUŞUMU
 ÜNİTE 7 FERTİLİZASYON VE ZİGOTUN OLUŞUMU Prof. Dr. Süleyman KAPLAN 7.1. Fertilizasyondan Hemen Önce Gametlerin Durumu Erkek cinsiyet hücresi olan sperm fertilizasyondan önce sitoplâzmasının çoğunu kaybederek
ÜNİTE 7 FERTİLİZASYON VE ZİGOTUN OLUŞUMU Prof. Dr. Süleyman KAPLAN 7.1. Fertilizasyondan Hemen Önce Gametlerin Durumu Erkek cinsiyet hücresi olan sperm fertilizasyondan önce sitoplâzmasının çoğunu kaybederek
Giriş Fertilizasyon Pre-Embriyogenez
 Giriş Fertilizasyon Pre-Embriyogenez Prof.Dr. Alp Can Histoloji-Embriyoloji Anabilim Dalı Embriyoloji (Gelişim Bilimi) [embriyo=cenin, logos=bilim] İnsanın gelişimindeki yapı-işlev ilişkisi Tanımsal (deskriptif
Giriş Fertilizasyon Pre-Embriyogenez Prof.Dr. Alp Can Histoloji-Embriyoloji Anabilim Dalı Embriyoloji (Gelişim Bilimi) [embriyo=cenin, logos=bilim] İnsanın gelişimindeki yapı-işlev ilişkisi Tanımsal (deskriptif
Canlılarda mitoz, amitoz ve mayoz olmak üzere üç çeşit bölünme görülür.
 HÜCRE BÖLÜNMELERİ Canlılarda mitoz, amitoz ve mayoz olmak üzere üç çeşit bölünme görülür. I. MİTOZ BÖLÜNME Mitoz bölünme tek hücreli canlılardan, çok hücreli canlılara ve insana kadar bir çok canlı grubu
HÜCRE BÖLÜNMELERİ Canlılarda mitoz, amitoz ve mayoz olmak üzere üç çeşit bölünme görülür. I. MİTOZ BÖLÜNME Mitoz bölünme tek hücreli canlılardan, çok hücreli canlılara ve insana kadar bir çok canlı grubu
İN-VİTRO FERTİLİZASYON (IVF) VE EMBRİYO TRANSFERİ (ET)
 İN-VİTRO FERTİLİZASYON (IVF) VE EMBRİYO TRANSFERİ (ET) Yardımcı üreme tekniklerinin (YÜT) (Assisted Reproduction Techniques, ART) temel amacı, infertil çiftin sağlıklı bir bebek sahibi olmasıdır. IVF-ET
İN-VİTRO FERTİLİZASYON (IVF) VE EMBRİYO TRANSFERİ (ET) Yardımcı üreme tekniklerinin (YÜT) (Assisted Reproduction Techniques, ART) temel amacı, infertil çiftin sağlıklı bir bebek sahibi olmasıdır. IVF-ET
LYS ANAHTAR SORULAR #6. Mitoz ve Mayoz Bölünme Eşeyli ve Eşeysiz Üreme İnsanda Üreme
 LYS ANAHTAR SORULAR #6 Mitoz ve Mayoz Bölünme Eşeyli ve Eşeysiz Üreme İnsanda Üreme 1) 2n = 40 kromozomlu memeli türünde, Dişinin ovaryumlarında yumurta hücresi oluşurken anafaz I evresinde gonozomların
LYS ANAHTAR SORULAR #6 Mitoz ve Mayoz Bölünme Eşeyli ve Eşeysiz Üreme İnsanda Üreme 1) 2n = 40 kromozomlu memeli türünde, Dişinin ovaryumlarında yumurta hücresi oluşurken anafaz I evresinde gonozomların
TÜRKİYE CUMHURİYETİ ANKARA ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ
 TÜRKİYE CUMHURİYETİ ANKARA ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ FARKLI BÜYÜKLÜKTEKİ SIĞIR OOSİTLERİNİN MATURASYON VE FERTİLİZASYONU ÜZERİNE İNSÜLİN BENZERİ BÜYÜME FAKTÖRÜ-1 (IGF-1) VE EPİDERMAL BÜYÜME
TÜRKİYE CUMHURİYETİ ANKARA ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ FARKLI BÜYÜKLÜKTEKİ SIĞIR OOSİTLERİNİN MATURASYON VE FERTİLİZASYONU ÜZERİNE İNSÜLİN BENZERİ BÜYÜME FAKTÖRÜ-1 (IGF-1) VE EPİDERMAL BÜYÜME
HÜCRE BÖLÜNMESİ VE ÜREME. Mitoz Bölünme ve Eşeysiz Üreme 1
 HÜCRE BÖLÜNMESİ VE ÜREME Mitoz Bölünme ve Eşeysiz Üreme 1 Hücrenin bölünmeye başlamasından itibaren onu takip eden diğer hücre bölünmesine kadar geçen zaman aralığına hücre döngüsü denir. Hücreler belli
HÜCRE BÖLÜNMESİ VE ÜREME Mitoz Bölünme ve Eşeysiz Üreme 1 Hücrenin bölünmeye başlamasından itibaren onu takip eden diğer hücre bölünmesine kadar geçen zaman aralığına hücre döngüsü denir. Hücreler belli
Çiftlik Hayvanlarında Cinsiyetin Denetimi
 Çiftlik Hayvanlarında Cinsiyetin Denetimi Cinsiyetin belirlenmesi Demokritus (MÖ: 470-402) Sağ testisten erkek, sol testisten dişi yavruların dünyaya geldiğini ileri sürmüştür. Fötal yaşamda cinsiyetin
Çiftlik Hayvanlarında Cinsiyetin Denetimi Cinsiyetin belirlenmesi Demokritus (MÖ: 470-402) Sağ testisten erkek, sol testisten dişi yavruların dünyaya geldiğini ileri sürmüştür. Fötal yaşamda cinsiyetin
Sperm sıvısı ve sperm sıvısının bileşimi
 Sperm sıvısı ve sperm sıvısının bileşimi Çiftlik Hayvanlarında Üreme Biyolojisi ve Yapay Tohumlama Prof Dr Fatin CEDDEN Giriş Sperm sıvısı (semen) spermatozoa ve seminal plazmadan meydana gelir Seminal
Sperm sıvısı ve sperm sıvısının bileşimi Çiftlik Hayvanlarında Üreme Biyolojisi ve Yapay Tohumlama Prof Dr Fatin CEDDEN Giriş Sperm sıvısı (semen) spermatozoa ve seminal plazmadan meydana gelir Seminal
GELİŞİMİN 1. VE 2. HAFTASI
 GELİŞİMİN 1. VE 2. HAFTASI (Fertilizasyon, Segmentasyon, İmplantasyon ve Bilaminar disk) PROF. DR. İSMAİL SEÇKİN FERTİLİZASYON A ) Germ hücrelerinin fertilizasyon bölgesine taşınması Oositin ampullaya
GELİŞİMİN 1. VE 2. HAFTASI (Fertilizasyon, Segmentasyon, İmplantasyon ve Bilaminar disk) PROF. DR. İSMAİL SEÇKİN FERTİLİZASYON A ) Germ hücrelerinin fertilizasyon bölgesine taşınması Oositin ampullaya
YGS YE HAZIRLIK DENEMESi #12
 YGS YE HAZIRLIK DENEMESi #12 1) İnsanda döllenme sırasında, I. Spermdeki çekirdek, sentrozomun yumurtaya geçmesi II. Spermdeki akrozomun patlayarak zona pellusidayı eritmesi III. Yumurtadaki salgı maddelerinin
YGS YE HAZIRLIK DENEMESi #12 1) İnsanda döllenme sırasında, I. Spermdeki çekirdek, sentrozomun yumurtaya geçmesi II. Spermdeki akrozomun patlayarak zona pellusidayı eritmesi III. Yumurtadaki salgı maddelerinin
Prenatal devre insan ve memeli hayvanlarda uterus içerisinde geçer. Kanatlı hayvanlarda ise yumurta içinde kuluçkada geçen devredir.
 Embriyoloji, genel anlamıyla canlıların oluşmasını ve gelişmesini inceleyen bir bilim dalıdır. İnsan ve memeli hayvanların doğumdan önceki, kanatlı hayvanların ise kuluçka dönemindeki hayatını inceler.
Embriyoloji, genel anlamıyla canlıların oluşmasını ve gelişmesini inceleyen bir bilim dalıdır. İnsan ve memeli hayvanların doğumdan önceki, kanatlı hayvanların ise kuluçka dönemindeki hayatını inceler.
Yardımcı üreme teknolojisi (YÜT) son yıllarda birçok infertil çiftin çocuk sahibi olmalarını sağlamaktadır.
 İlknur M. GÖNENÇ Yardımcı üreme teknolojisi (YÜT) son yıllarda birçok infertil çiftin çocuk sahibi olmalarını sağlamaktadır. Bilim adamları Miriam F. Menkin ve John Rock ın ilk olarak 1944 yılında bir
İlknur M. GÖNENÇ Yardımcı üreme teknolojisi (YÜT) son yıllarda birçok infertil çiftin çocuk sahibi olmalarını sağlamaktadır. Bilim adamları Miriam F. Menkin ve John Rock ın ilk olarak 1944 yılında bir
Canlılarda Üreme ve Gelişme 1.Üreme Hücreleri (Gametler) 1.1.Erkek Üreme Hücreleri Spermler akrozom 1.2.Dişi Üreme Hücreleri Yumurtalar vitellus
 Canlılarda Üreme ve Gelişme 1.Üreme Hücreleri (Gametler) Üreme hücreleri erkeklerde sperm dişilerde yumurta adını alır.yumurtanın meydana gelişi oogenezis, spermin meydana gelişi ise spermatogenezis adını
Canlılarda Üreme ve Gelişme 1.Üreme Hücreleri (Gametler) Üreme hücreleri erkeklerde sperm dişilerde yumurta adını alır.yumurtanın meydana gelişi oogenezis, spermin meydana gelişi ise spermatogenezis adını
Hücre. 1 µm = 0,001 mm (1000 µm = 1 mm)!
 HÜCRE FİZYOLOJİSİ Hücre Hücre: Tüm canlıların en küçük yapısal ve fonksiyonel ünitesi İnsan vücudunda trilyonlarca hücre bulunur Fare, insan veya filin hücreleri yaklaşık aynı büyüklükte Vücudun büyüklüğü
HÜCRE FİZYOLOJİSİ Hücre Hücre: Tüm canlıların en küçük yapısal ve fonksiyonel ünitesi İnsan vücudunda trilyonlarca hücre bulunur Fare, insan veya filin hücreleri yaklaşık aynı büyüklükte Vücudun büyüklüğü
HAYVANSAL HÜCRELER VE İŞLEVLERİ. YRD. DOÇ. DR. ASLI SADE MEMİŞOĞLU RESİM İŞ ZEMİN KAT ODA: 111
 HAYVANSAL HÜCRELER VE İŞLEVLERİ YRD. DOÇ. DR. ASLI SADE MEMİŞOĞLU RESİM İŞ ZEMİN KAT ODA: 111 asli.memisoglu@deu.edu.tr KONULAR HAYVAN HÜCRESİ HAYVAN, BİTKİ, MANTAR, BAKTERİ HÜCRE FARKLARI HÜCRE ORGANELLERİ
HAYVANSAL HÜCRELER VE İŞLEVLERİ YRD. DOÇ. DR. ASLI SADE MEMİŞOĞLU RESİM İŞ ZEMİN KAT ODA: 111 asli.memisoglu@deu.edu.tr KONULAR HAYVAN HÜCRESİ HAYVAN, BİTKİ, MANTAR, BAKTERİ HÜCRE FARKLARI HÜCRE ORGANELLERİ
Giriş ve Genel Tanımlamalar Fer/lizasyon
 Dönem 1-Sunum 1/ 2016 Giriş ve Genel Tanımlamalar Fer/lizasyon Prof.Dr. Alp Can Ankara Üniversitesi Tıp Fakültesi Histoloji-Embriyoloji ABD www.alpcan.com Embriyoloji (Gelişim Bilimi) [embriyo=cenin, logos=bilim]
Dönem 1-Sunum 1/ 2016 Giriş ve Genel Tanımlamalar Fer/lizasyon Prof.Dr. Alp Can Ankara Üniversitesi Tıp Fakültesi Histoloji-Embriyoloji ABD www.alpcan.com Embriyoloji (Gelişim Bilimi) [embriyo=cenin, logos=bilim]
Mayoz Bölünmenin Oluşumu
 MAYOZ BÖLÜNME NEDİR? 03 Ocak 2012, 23:39 Osman BEDEL MAYOZ BÖLÜNME NEDİR? Kromozom sayılarının nesiller boyu sabit tutulması mayoz bölünme ile sağlanır. Mayoz özel bir hücre bölünmesidir. Bu bölünme ile
MAYOZ BÖLÜNME NEDİR? 03 Ocak 2012, 23:39 Osman BEDEL MAYOZ BÖLÜNME NEDİR? Kromozom sayılarının nesiller boyu sabit tutulması mayoz bölünme ile sağlanır. Mayoz özel bir hücre bölünmesidir. Bu bölünme ile
Çiftlik Hayvanlarında Embriyo Aktarımı. Prof Dr Fatin Cedden
 Çiftlik Hayvanlarında Embriyo Aktarımı Prof Dr Fatin Cedden İlk embriyo transferi 1890 da Walter Heape tarafından Büyük Britanya da tavşan üzerinde gerçekleştirildi Sığırda yapılan ilk embriyo transferi
Çiftlik Hayvanlarında Embriyo Aktarımı Prof Dr Fatin Cedden İlk embriyo transferi 1890 da Walter Heape tarafından Büyük Britanya da tavşan üzerinde gerçekleştirildi Sığırda yapılan ilk embriyo transferi
İNSANDA ÜREME, BÜYÜME VE GELİŞME
 İNSANDA ÜREME, BÜYÜME VE GELİŞME Canlıların kendine benzer yavrular oluşturmasına üreme denir. Üreme tüm canlılar için ortak özellik olup canlının neslinin devamlılığını sağlar. Canlılar neslini devam
İNSANDA ÜREME, BÜYÜME VE GELİŞME Canlıların kendine benzer yavrular oluşturmasına üreme denir. Üreme tüm canlılar için ortak özellik olup canlının neslinin devamlılığını sağlar. Canlılar neslini devam
KLONLAMA. Prof. Dr. Fatma Savran Oğuz
 KLONLAMA Prof. Dr. Fatma Savran Oğuz Tek yumurta ikizleri doğal klonlardır. Araştırıcılar ilk önceleri bu doğal olayı taklit ederek klonlama çalışmalarına başlamışlardır. Tek yumurta ikizlerinde embriyo
KLONLAMA Prof. Dr. Fatma Savran Oğuz Tek yumurta ikizleri doğal klonlardır. Araştırıcılar ilk önceleri bu doğal olayı taklit ederek klonlama çalışmalarına başlamışlardır. Tek yumurta ikizlerinde embriyo
Transgenik Hayvan Üretimi. Hayvancılıkta biyoteknoloji dersi
 Transgenik Hayvan Üretimi Hayvancılıkta biyoteknoloji dersi TRANSGENİK HAYVAN TEKNOLOJİSİ Transgenik hayvanlar gen transferi yoluyla hücrelerinde yabancı genleri taşıyan hayvanlardır. Çiftlik hayvanlarına
Transgenik Hayvan Üretimi Hayvancılıkta biyoteknoloji dersi TRANSGENİK HAYVAN TEKNOLOJİSİ Transgenik hayvanlar gen transferi yoluyla hücrelerinde yabancı genleri taşıyan hayvanlardır. Çiftlik hayvanlarına
CANLILARDA ÜREME. Üreme canlıların ortak özelliğidir. Her canlının kendine benzer canlı meydana getirebilmesi üreme ile gerçekleşir
 CANLILARDA ÜREME EYLÜL 3.HAFTA MİTOZ VE EŞEYSİZ ÜREME Her canlının kendine benzer canlı meydana getirebilmesi üreme ile gerçekleşir Üreme canlıların ortak özelliğidir 3 4 Canlılar hücrelerden meydana gelir
CANLILARDA ÜREME EYLÜL 3.HAFTA MİTOZ VE EŞEYSİZ ÜREME Her canlının kendine benzer canlı meydana getirebilmesi üreme ile gerçekleşir Üreme canlıların ortak özelliğidir 3 4 Canlılar hücrelerden meydana gelir
ADIM ADIM YGS-LYS 37. ADIM HÜCRE 14- ÇEKİRDEK
 ADIM ADIM YGS-LYS 37. ADIM HÜCRE 14- ÇEKİRDEK 3) Çekirdek Ökaryot yapılı hücrelerde genetik maddeyi taşıyan hücre kısmıdır. Prokaryot hücreli canlılarda bulunmaz. GÖREVLERİ: 1) Genetik maddeyi taşıdığından
ADIM ADIM YGS-LYS 37. ADIM HÜCRE 14- ÇEKİRDEK 3) Çekirdek Ökaryot yapılı hücrelerde genetik maddeyi taşıyan hücre kısmıdır. Prokaryot hücreli canlılarda bulunmaz. GÖREVLERİ: 1) Genetik maddeyi taşıdığından
DÖLLENME VE BÖLÜNMELER
 DÖLLENME VE BÖLÜNMELER Ovulasyonda kendisini saran corona radiata hücreleri ile birlikte ovaryumdan atılan ve ovidukta düşen yumurta hücresi, ovidukt silyumlarının ve düz kas kontraksiyonlarının etkisiyle
DÖLLENME VE BÖLÜNMELER Ovulasyonda kendisini saran corona radiata hücreleri ile birlikte ovaryumdan atılan ve ovidukta düşen yumurta hücresi, ovidukt silyumlarının ve düz kas kontraksiyonlarının etkisiyle
EMBRİYOLOJİ VE GENETİK DERSİNE GİRİŞ ARŞ. GÖR. KEVSER İLÇİOĞLU
 EMBRİYOLOJİ VE GENETİK 1 DERSİNE GİRİŞ ARŞ. GÖR. KEVSER İLÇİOĞLU 2/16 EMBRİYOLOJİ NEDİR? Embriyoloji; zigottan, hücreler, dokular, organlar ile tüm vücudun oluşmasına kadar geçen ve doğuma kadar devam
EMBRİYOLOJİ VE GENETİK 1 DERSİNE GİRİŞ ARŞ. GÖR. KEVSER İLÇİOĞLU 2/16 EMBRİYOLOJİ NEDİR? Embriyoloji; zigottan, hücreler, dokular, organlar ile tüm vücudun oluşmasına kadar geçen ve doğuma kadar devam
ÇOK HÜCRELİ ORGANİZMALARIN GELİŞİMİ
 ÇOK HÜCRELİ ORGANİZMALARIN GELİŞİMİ Seçici gen ifadesi embriyonun gelişmesini sağlayan 4 temel işlevi denetler: 1. Hücre çoğalması 2. Hücre farklılaşması 3. Hücre etkileşimleri 4. Hücre hareketi HÜCRE
ÇOK HÜCRELİ ORGANİZMALARIN GELİŞİMİ Seçici gen ifadesi embriyonun gelişmesini sağlayan 4 temel işlevi denetler: 1. Hücre çoğalması 2. Hücre farklılaşması 3. Hücre etkileşimleri 4. Hücre hareketi HÜCRE
HÜCRE. Yrd.Doç.Dr. Mehtap ÖZÇELİK Fırat Üniversitesi
 HÜCRE Yrd.Doç.Dr. Mehtap ÖZÇELİK Fırat Üniversitesi Hücre Canlıların en küçük yapı taşıdır Bütün canlılar hücrelerden oluşur Canlılar tek hücreli ya da çok hücreli olabilir Bitki ve hayvan hücresi = çok
HÜCRE Yrd.Doç.Dr. Mehtap ÖZÇELİK Fırat Üniversitesi Hücre Canlıların en küçük yapı taşıdır Bütün canlılar hücrelerden oluşur Canlılar tek hücreli ya da çok hücreli olabilir Bitki ve hayvan hücresi = çok
KAPASİTASYON. Çiftlik Hayvanlarında Yapay Tohumlama Prof. Dr. Fatin CEDDEN
 KAPASİTASYON Çiftlik Hayvanlarında Yapay Tohumlama Prof. Dr. Fatin CEDDEN Giriş Sıçanlarda 1951 yılında yapılan ilk çalışmalarda dişinin uterusunda 10-12 saat geçirmedikçe, spermatozoanın dölleme kabiliyetini
KAPASİTASYON Çiftlik Hayvanlarında Yapay Tohumlama Prof. Dr. Fatin CEDDEN Giriş Sıçanlarda 1951 yılında yapılan ilk çalışmalarda dişinin uterusunda 10-12 saat geçirmedikçe, spermatozoanın dölleme kabiliyetini
HÜCRENİN YAŞAM DÖNGÜSÜ
 HÜCRENİN YAŞAM DÖNGÜSÜ *Hücrenin yaşam döngüsü: Hücrenin; bir bölünme sonundan, ikinci bir bölünme sonuna kadar olan zaman sürecinde; geçirdiği yaşamsal olaylara hücrenin yaşam döngüsü denir. Hücreler,
HÜCRENİN YAŞAM DÖNGÜSÜ *Hücrenin yaşam döngüsü: Hücrenin; bir bölünme sonundan, ikinci bir bölünme sonuna kadar olan zaman sürecinde; geçirdiği yaşamsal olaylara hücrenin yaşam döngüsü denir. Hücreler,
Gonadlar: Dişide ovaryumlar (yumurtalıklar), erkekte de testislerdir. Gametler: Yeni bir canlının gelişmesini başlatmak için bir araya gelen dişi ve
 Gonadlar: Dişide ovaryumlar (yumurtalıklar), erkekte de testislerdir. Gametler: Yeni bir canlının gelişmesini başlatmak için bir araya gelen dişi ve erkek cinsiyet hücreleridir. Gametogenezis: Dişi ve
Gonadlar: Dişide ovaryumlar (yumurtalıklar), erkekte de testislerdir. Gametler: Yeni bir canlının gelişmesini başlatmak için bir araya gelen dişi ve erkek cinsiyet hücreleridir. Gametogenezis: Dişi ve
Mitoz. - Mitozda 2 yavru hücre oluşur ve bunların genetik yapısı birbirinin ve ana hücrenin aynıdır.
 Mitoz - Mitozda 2 yavru hücre oluşur ve bunların genetik yapısı birbirinin ve ana hücrenin aynıdır. - 2n --- 4n (anafaz) ------2n - İdentik kardeş kromatidler ayrılarak yavru hücrelere giderler. - Somatik
Mitoz - Mitozda 2 yavru hücre oluşur ve bunların genetik yapısı birbirinin ve ana hücrenin aynıdır. - 2n --- 4n (anafaz) ------2n - İdentik kardeş kromatidler ayrılarak yavru hücrelere giderler. - Somatik
YGS YE HAZIRLIK DENEMESi #18
 YGS YE HAZIRLIK DENEMESi #18 1) Bakterilerin gerçekleştirdiği, I. Kimyasal enerji sayesinde besin sentezleme II. Işık enerjisini kimyasal bağ enerjisine dönüştürme III. Kimyasal bağ enerjisini ATP enerjisine
YGS YE HAZIRLIK DENEMESi #18 1) Bakterilerin gerçekleştirdiği, I. Kimyasal enerji sayesinde besin sentezleme II. Işık enerjisini kimyasal bağ enerjisine dönüştürme III. Kimyasal bağ enerjisini ATP enerjisine
YAZILIYA HAZIRLIK TEST SORULARI. 10. Sınıf
 YAZILIYA HAZIRLIK TEST SORULARI 10. Sınıf 1) Hücre döngüsünün interfaz evresini yeni tamamlamış bir hücre ile bu hücrenin döngü sonunda oluşturduğu yeni hücrelerde; I. DNA miktarı II. Gen Sayısı III. Gen
YAZILIYA HAZIRLIK TEST SORULARI 10. Sınıf 1) Hücre döngüsünün interfaz evresini yeni tamamlamış bir hücre ile bu hücrenin döngü sonunda oluşturduğu yeni hücrelerde; I. DNA miktarı II. Gen Sayısı III. Gen
Mitoz bölünme, hücredeki kalıtım maddesinin yavru hücrelere eşit miktarda bölünmesini sağlayan karmaşık bir olaydır.
 Mitoz bölünme, hücredeki kalıtım maddesinin yavru hücrelere eşit miktarda bölünmesini sağlayan karmaşık bir olaydır. Hücre mitozla bölünmeden önce DNA eşlemesi olur. Hücre mitozla bölünmeye başlamadan
Mitoz bölünme, hücredeki kalıtım maddesinin yavru hücrelere eşit miktarda bölünmesini sağlayan karmaşık bir olaydır. Hücre mitozla bölünmeden önce DNA eşlemesi olur. Hücre mitozla bölünmeye başlamadan
DEHİDRE KÖPEKLERDE BİKARBONATLI SODYUM KLORÜR SOLÜSYONUNUN HEMATOLOJİK VE BİYOKİMYASAL PARAMETRELERE ETKİSİ
 T.C. ADNAN MENDERES ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ İÇ HASTALIKLARI ANABİLİM DALI VİH-YL 2007 0002 DEHİDRE KÖPEKLERDE BİKARBONATLI SODYUM KLORÜR SOLÜSYONUNUN HEMATOLOJİK VE BİYOKİMYASAL PARAMETRELERE
T.C. ADNAN MENDERES ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ İÇ HASTALIKLARI ANABİLİM DALI VİH-YL 2007 0002 DEHİDRE KÖPEKLERDE BİKARBONATLI SODYUM KLORÜR SOLÜSYONUNUN HEMATOLOJİK VE BİYOKİMYASAL PARAMETRELERE
YGS YE HAZIRLIK DENEMESi #13
 YGS YE HAZIRLIK DENEMESi #13 1) Canlılarda özelliklerin genlerle kontrol edildiği ve her genin en az bir özellikten sorumlu olduğu bilindiğine göre, I. Diploid canlılarda her özellik için iki gen bulunması
YGS YE HAZIRLIK DENEMESi #13 1) Canlılarda özelliklerin genlerle kontrol edildiği ve her genin en az bir özellikten sorumlu olduğu bilindiğine göre, I. Diploid canlılarda her özellik için iki gen bulunması
Prof Dr Bülent GÜLEKLİ Dokuz Eylül Üniversitesi Tıp Fakültesi Kadın Hastalıkları ve Doğum ABD Reprodüktif Endokrinoloji Bilim Dalı Öğretim Üyesi
 Üreme Tıbbı Derneği ve TJOD Ankara Şubesi Ortak Eğitim Toplantısı HER YÖNÜYLE PCOS 24 Şubat 2013 Prof Dr Bülent GÜLEKLİ Dokuz Eylül Üniversitesi Tıp Fakültesi Kadın Hastalıkları ve Doğum ABD Reprodüktif
Üreme Tıbbı Derneği ve TJOD Ankara Şubesi Ortak Eğitim Toplantısı HER YÖNÜYLE PCOS 24 Şubat 2013 Prof Dr Bülent GÜLEKLİ Dokuz Eylül Üniversitesi Tıp Fakültesi Kadın Hastalıkları ve Doğum ABD Reprodüktif
*Canlıların canlılık özelliği gösteren en küçük yapı birimine hücre denir.
 Fen ve Teknoloji 1. Ünite Özeti Hücre Canlılarda Üreme, Büyüme ve Gelişme. *Canlıların canlılık özelliği gösteren en küçük yapı birimine hücre denir. *Hücrenin temel kısımları: hücre zarı, sitoplâzma ve
Fen ve Teknoloji 1. Ünite Özeti Hücre Canlılarda Üreme, Büyüme ve Gelişme. *Canlıların canlılık özelliği gösteren en küçük yapı birimine hücre denir. *Hücrenin temel kısımları: hücre zarı, sitoplâzma ve
İstanbul Tıp Fakültesi Tıbbi Biyoloji ABD Prof.Dr. Filiz AYDIN
 İstanbul Tıp Fakültesi Tıbbi Biyoloji ABD Prof.Dr. Filiz AYDIN Fertilizasyonda 46 kromozom Her bir kromozom çift kromadit-(92) Hücre bölündükten sonra her hücre de 46 kromozom bulunur Mitoz bölünme G1
İstanbul Tıp Fakültesi Tıbbi Biyoloji ABD Prof.Dr. Filiz AYDIN Fertilizasyonda 46 kromozom Her bir kromozom çift kromadit-(92) Hücre bölündükten sonra her hücre de 46 kromozom bulunur Mitoz bölünme G1
2003 ÖSS BİYOLOJİ SORULARI VE CEVAPLARI
 2003 ÖSS BİYOLOJİ SORULARI VE CEVAPLARI 1. Bir hücrede oksijenli solunum, protein sentezi, fotosentez olaylarının tümünün gerçekleşebilmesi için, bu hücrede; I. ribozom, II. kloroplast, III. mitokondri,
2003 ÖSS BİYOLOJİ SORULARI VE CEVAPLARI 1. Bir hücrede oksijenli solunum, protein sentezi, fotosentez olaylarının tümünün gerçekleşebilmesi için, bu hücrede; I. ribozom, II. kloroplast, III. mitokondri,
GENİTAL SİKLUS Östrus Siklusu
 GENİTAL SİKLUS Östrus Siklusu Tanım Purbertiye ulaşan bir dişide hormonların kontrolü (hipotalamus, hipofiz ve ovaryum dan salınan) altında ovaryum ve uterusta meydana gelen değişiklikler Genital siklus
GENİTAL SİKLUS Östrus Siklusu Tanım Purbertiye ulaşan bir dişide hormonların kontrolü (hipotalamus, hipofiz ve ovaryum dan salınan) altında ovaryum ve uterusta meydana gelen değişiklikler Genital siklus
Uluslararası nsan Bilimleri Dergisi ISSN: 1303-5134
 Uluslararası nsan Bilimleri Dergisi ISSN: 1303-5134 www.insanbilimleri.com 29.09.2004 DÖLLENME VE DÖLLENME ANOMAL LER N N YARDIMLA ÜREME TEKN KLER NDEK ÖNEM Dr. F. Gürcan BEB TO LU * gurcanbebitoglu@yahoo.com
Uluslararası nsan Bilimleri Dergisi ISSN: 1303-5134 www.insanbilimleri.com 29.09.2004 DÖLLENME VE DÖLLENME ANOMAL LER N N YARDIMLA ÜREME TEKN KLER NDEK ÖNEM Dr. F. Gürcan BEB TO LU * gurcanbebitoglu@yahoo.com
DOKUZ EYLÜL ÜNİVERSİTESİ
 3/0/016 00:00:00 Döner Sermaye İşletmesi Teklif No 016130 İLAN HASTANEMİZİN İHTİYACI OLAN AŞAĞIDA YAZILI MALZEME(LER) TEKLİF ALMA SURETİYLE SATIN ALINACAKTIR. İLGİLENEN FİRMALARIN 6/0/016 TARİHİ, SAAT
3/0/016 00:00:00 Döner Sermaye İşletmesi Teklif No 016130 İLAN HASTANEMİZİN İHTİYACI OLAN AŞAĞIDA YAZILI MALZEME(LER) TEKLİF ALMA SURETİYLE SATIN ALINACAKTIR. İLGİLENEN FİRMALARIN 6/0/016 TARİHİ, SAAT
ERKEK EŞEY HÜCRELERİNİN GELİŞMESİ ve OLGUNLAŞMASI. Doç. Dr. A. Gürol BAYRAKTAROĞLU
 ERKEK EŞEY HÜCRELERİNİN GELİŞMESİ ve OLGUNLAŞMASI Doç. Dr. A. Gürol BAYRAKTAROĞLU Embriyoloji, genel anlamıyla canlıların oluşmasını ve gelişmesini inceleyen bir bilim dalıdır. İnsan ve memeli hayvanların
ERKEK EŞEY HÜCRELERİNİN GELİŞMESİ ve OLGUNLAŞMASI Doç. Dr. A. Gürol BAYRAKTAROĞLU Embriyoloji, genel anlamıyla canlıların oluşmasını ve gelişmesini inceleyen bir bilim dalıdır. İnsan ve memeli hayvanların
YGS YE HAZIRLIK DENEMESi #5
 YGS YE HAZIRLIK DENEMESi #5 Miktar 1) I.Hemoglobinin yapısındaki karbon atomu sayısını tespit etmek II. Solunumda kullanılacak gazların hangi molekülle taşınacağını tespit etmek III. Kanın ph ını tespit
YGS YE HAZIRLIK DENEMESi #5 Miktar 1) I.Hemoglobinin yapısındaki karbon atomu sayısını tespit etmek II. Solunumda kullanılacak gazların hangi molekülle taşınacağını tespit etmek III. Kanın ph ını tespit
BMM307-H02. Yrd.Doç.Dr. Ziynet PAMUK
 BMM307-H02 Yrd.Doç.Dr. Ziynet PAMUK ziynetpamuk@gmail.com 1 BİYOELEKTRİK NEDİR? Biyoelektrik, canlıların üretmiş olduğu elektriktir. Ancak bu derste anlatılacak olan insan vücudundan elektrotlar vasıtasıyla
BMM307-H02 Yrd.Doç.Dr. Ziynet PAMUK ziynetpamuk@gmail.com 1 BİYOELEKTRİK NEDİR? Biyoelektrik, canlıların üretmiş olduğu elektriktir. Ancak bu derste anlatılacak olan insan vücudundan elektrotlar vasıtasıyla
DOKUZ EYLÜL ÜNİVERSİTESİ
 07/02/2019 00:00:00 Döner Sermaye İşletmesi Teklif No: 2019832 İLAN HASTANEMİZİN İHTİYACI OLAN AŞAĞIDA YAZILI MALZEME(LER) TEKLİF ALMA SURETİYLE SATIN ALINACAKTIR. İLGİLENEN FİRMALARIN 11/02/2019 TARİHİ,
07/02/2019 00:00:00 Döner Sermaye İşletmesi Teklif No: 2019832 İLAN HASTANEMİZİN İHTİYACI OLAN AŞAĞIDA YAZILI MALZEME(LER) TEKLİF ALMA SURETİYLE SATIN ALINACAKTIR. İLGİLENEN FİRMALARIN 11/02/2019 TARİHİ,
ERKEN BÖLÜNME DEĞERLENDİRMESİNİN İNTRASİTOPLAZMİK SPERM ENJEKSİYONU SONUÇLARIYLA İLİŞKİLENDİRİLMESİ
 T. C. İSTANBUL BİLİM ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ HİSTOLOJİ VE EMBRİYOLOJİ ANABİLİM DALI ERKEN BÖLÜNME DEĞERLENDİRMESİNİN İNTRASİTOPLAZMİK SPERM ENJEKSİYONU SONUÇLARIYLA İLİŞKİLENDİRİLMESİ Biyolog
T. C. İSTANBUL BİLİM ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ HİSTOLOJİ VE EMBRİYOLOJİ ANABİLİM DALI ERKEN BÖLÜNME DEĞERLENDİRMESİNİN İNTRASİTOPLAZMİK SPERM ENJEKSİYONU SONUÇLARIYLA İLİŞKİLENDİRİLMESİ Biyolog
In vitro Embryo Production and Transfer in Cattle. Numan AKYOL* Sedat Hamdi KIZIL* Tahir KARAŞAHİN*
 Lalahan İN VİTRO Hay. SIĞIR Araşt. EMBRİYOSU Enst. Derg. ÜRETİM 2007, 47 VE (1) TRANSFERİ 1-8 İN VİTRO SIĞIR EMBRİYOSU ÜRETİM VE TRANSFERİ In vitro Embryo Production and Transfer in Cattle Numan AKYOL*
Lalahan İN VİTRO Hay. SIĞIR Araşt. EMBRİYOSU Enst. Derg. ÜRETİM 2007, 47 VE (1) TRANSFERİ 1-8 İN VİTRO SIĞIR EMBRİYOSU ÜRETİM VE TRANSFERİ In vitro Embryo Production and Transfer in Cattle Numan AKYOL*
Prof Dr Bulent GULEKLI Dokuz Eylul Universitesi Tıp Fakültesi Kadın Hast ve Doğum Anabilim Dalı ve Üreme Endokrinolojis Bilim dalı Izmir
 Prof Dr Bulent GULEKLI Dokuz Eylul Universitesi Tıp Fakültesi Kadın Hast ve Doğum Anabilim Dalı ve Üreme Endokrinolojis Bilim dalı Izmir ART için ovarian stimulasyonu ve ovulasyon indüksiyonundaki problemler
Prof Dr Bulent GULEKLI Dokuz Eylul Universitesi Tıp Fakültesi Kadın Hast ve Doğum Anabilim Dalı ve Üreme Endokrinolojis Bilim dalı Izmir ART için ovarian stimulasyonu ve ovulasyon indüksiyonundaki problemler
ıo. Urünün raf ömrü üretim tarihinden itibaren i yıl olmalıdır.
 12)VİTRİFİKASYON KİT TEKNİK ŞART AMESİ I. Oosit, Embryo ve Blastosistlerin Vitrifikasyon yöntemi ile dondurulması amacı ile kullaru lmalıd ır. 2. Ürün Equilihrnıion Solution - ES (white cap) i x 1 ml.
12)VİTRİFİKASYON KİT TEKNİK ŞART AMESİ I. Oosit, Embryo ve Blastosistlerin Vitrifikasyon yöntemi ile dondurulması amacı ile kullaru lmalıd ır. 2. Ürün Equilihrnıion Solution - ES (white cap) i x 1 ml.
AMAÇ: Ökaryotik hücrelerin bölünme mekanizmasını ve kromozom morfolojilerini öğrenmek.
 19.11.2014/Çarşamba Lab 6 KONU: Hücre Bölünmesi ve Kromozom Morfolojisi AMAÇ: Ökaryotik hücrelerin bölünme mekanizmasını ve kromozom morfolojilerini öğrenmek. KAZANIMLAR: Ökaryotik hücrelerin nasıl çoğaldıkları
19.11.2014/Çarşamba Lab 6 KONU: Hücre Bölünmesi ve Kromozom Morfolojisi AMAÇ: Ökaryotik hücrelerin bölünme mekanizmasını ve kromozom morfolojilerini öğrenmek. KAZANIMLAR: Ökaryotik hücrelerin nasıl çoğaldıkları
ÜREME SİSTEMİ FİZYOLOJİSİ DOÇ.DR.MİTAT KOZ
 ÜREME SİSTEMİ FİZYOLOJİSİ DOÇ.DR.MİTAT KOZ Kadın ve erkek üreme sistemi dölün üretilmesi amacı ile özelleşmiş özel organlardan oluşmaktadır. Bazı üreme organları cinsiyet hücrelerini üretir, diğerleri
ÜREME SİSTEMİ FİZYOLOJİSİ DOÇ.DR.MİTAT KOZ Kadın ve erkek üreme sistemi dölün üretilmesi amacı ile özelleşmiş özel organlardan oluşmaktadır. Bazı üreme organları cinsiyet hücrelerini üretir, diğerleri
FARE EMBRİYOLARI İLE PARTENOTLARININ GELİŞİMSEL POTANSİYELLERİ VE MORFOLOJİK ÖZELLİKLERİNİN KARŞILAŞTIRILMASI. Arş. Gör. İrem MATUR YÜKSEK LİSANS TEZİ
 T.C. ÇUKUROVA ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ HİSTOLOJİ-EMBRİYOLOJİ ANABİLİM DALI FARE EMBRİYOLARI İLE PARTENOTLARININ GELİŞİMSEL POTANSİYELLERİ VE MORFOLOJİK ÖZELLİKLERİNİN KARŞILAŞTIRILMASI Arş.
T.C. ÇUKUROVA ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ HİSTOLOJİ-EMBRİYOLOJİ ANABİLİM DALI FARE EMBRİYOLARI İLE PARTENOTLARININ GELİŞİMSEL POTANSİYELLERİ VE MORFOLOJİK ÖZELLİKLERİNİN KARŞILAŞTIRILMASI Arş.
ayxmaz/biyoloji 2. DNA aşağıdaki sonuçlardan hangisi ile üretilir Kalıp DNA yukarıdaki ana DNAdan yeni DNA molekülleri hangi sonulca üretilir A B C D
 1. DNA replikasyonu.. için gereklidir A) sadece mitoz B) sadece mayoz C) mitoz ve mayoz D) sadece gamet oluşumu E) sadece protein sentezi 2. DNA aşağıdaki sonuçlardan hangisi ile üretilir Kalıp DNA yukarıdaki
1. DNA replikasyonu.. için gereklidir A) sadece mitoz B) sadece mayoz C) mitoz ve mayoz D) sadece gamet oluşumu E) sadece protein sentezi 2. DNA aşağıdaki sonuçlardan hangisi ile üretilir Kalıp DNA yukarıdaki
ADIM ADIM YGS-LYS 32. ADIM HÜCRE 9- SİTOPLAZMA
 ADIM ADIM YGS-LYS 32. ADIM HÜCRE 9- SİTOPLAZMA 2) Sitoplazma Hücrenin içini dolduran sıvıdır. İçinde inorganik ve organik maddeler vardır. Ayrıca görevleri birbirinden farklı olan organeller de bulunur.
ADIM ADIM YGS-LYS 32. ADIM HÜCRE 9- SİTOPLAZMA 2) Sitoplazma Hücrenin içini dolduran sıvıdır. İçinde inorganik ve organik maddeler vardır. Ayrıca görevleri birbirinden farklı olan organeller de bulunur.
Çekirdek 4 bölümden oluşur Çekirdek zarı: karyolemma Kromatin: Chromatin Çekirdekcik: Nucleolus Çekirdek sıvısı: karyolymph
 NUKLEUS Bir hücrenin tüm yapılarının ve etkinliklerinin kodlandığı kromozomu Ayrıca, DNA sını dublike edecek ve 3 tip RNA yı ribozomal (rrna), haberci (mrna) ve transfer (trna)-sentezleyecek ve işleyecek
NUKLEUS Bir hücrenin tüm yapılarının ve etkinliklerinin kodlandığı kromozomu Ayrıca, DNA sını dublike edecek ve 3 tip RNA yı ribozomal (rrna), haberci (mrna) ve transfer (trna)-sentezleyecek ve işleyecek
EŞEYLİ ÜREME EŞEY HÜCRELERİ VE DÖLLENME (FERTİLİZASYON) Eşeysel üreme haploit ve diploit hücrelerin her ikisini de gerektirir.
 EŞEYLİ ÜREME EŞEY HÜCRELERİ VE DÖLLENME (FERTİLİZASYON) Eşeysel üreme haploit ve diploit hücrelerin her ikisini de gerektirir. Mayoz ve mitoz bölünmelerin olduğu yaşam evreleri vardır. EŞEYLİ ÜREMENİN
EŞEYLİ ÜREME EŞEY HÜCRELERİ VE DÖLLENME (FERTİLİZASYON) Eşeysel üreme haploit ve diploit hücrelerin her ikisini de gerektirir. Mayoz ve mitoz bölünmelerin olduğu yaşam evreleri vardır. EŞEYLİ ÜREMENİN
 1- Aşağıda verilen mayoz bölünme geçirmekte olan hücrelerin evrelerini ve her birinin kromozom sayısını yazınız. (6*1,5=9 ) 5- Mayoz bölünmede kalıtsal çeşitliliği sağlayan olaylar nelerdir? (2*4=8 ) Profaz_I
1- Aşağıda verilen mayoz bölünme geçirmekte olan hücrelerin evrelerini ve her birinin kromozom sayısını yazınız. (6*1,5=9 ) 5- Mayoz bölünmede kalıtsal çeşitliliği sağlayan olaylar nelerdir? (2*4=8 ) Profaz_I
10. SINIF KONU ANLATIMI 6 MAYOZ BÖLÜNME-3
 10. SINIF KONU ANLATIMI 6 MAYOZ BÖLÜNME-3 Mayoz Bölünmenin Genel Özellikleri Üreme ana hücrelerinde görülür. Üreme hücrelerinin oluşmasını sağlar. Sadece 2n kromozomlu hücrelerde görülür. 4 yeni hücre
10. SINIF KONU ANLATIMI 6 MAYOZ BÖLÜNME-3 Mayoz Bölünmenin Genel Özellikleri Üreme ana hücrelerinde görülür. Üreme hücrelerinin oluşmasını sağlar. Sadece 2n kromozomlu hücrelerde görülür. 4 yeni hücre
SPERMANIN ALINMASI VE MUAYENESİ VEYSEL TAHİROĞLU
 SPERMANIN ALINMASI VE MUAYENESİ VEYSEL TAHİROĞLU SPERMA Memeli spermatozoitleri hareket yeteneği bulunan, haploid yapıda ve dişi oositine bağlanma yeteneği olan hücrelerdir. Spermatozoon baş, orta bölüm
SPERMANIN ALINMASI VE MUAYENESİ VEYSEL TAHİROĞLU SPERMA Memeli spermatozoitleri hareket yeteneği bulunan, haploid yapıda ve dişi oositine bağlanma yeteneği olan hücrelerdir. Spermatozoon baş, orta bölüm
YGS YE HAZIRLIK DENEMESi #21
 YGS YE HAZIRLIK DENEMESi #21 1) Aşağıda bazı dönüşüm tepkimeleri gösterilmiştir. a 2) Enzimlerin çalışma hızına etki eden faktörlerle ilgili; RH RH ADP + Pi ATP I II b Buna göre a ve b yönlerindeki değişimlerle
YGS YE HAZIRLIK DENEMESi #21 1) Aşağıda bazı dönüşüm tepkimeleri gösterilmiştir. a 2) Enzimlerin çalışma hızına etki eden faktörlerle ilgili; RH RH ADP + Pi ATP I II b Buna göre a ve b yönlerindeki değişimlerle
YGS YE HAZIRLIK DENEMESi #15
 YGS YE HAZIRLIK DENEMESi #15 1) Bir hücrede meydana gelen bölünme evrelerinden birine ait şekil yukarıdaki gibi ise; I. Diploit kromozomludur. II. Glikozu nişasta şeklinde depolar. III. Sitoplazması boğumlanma
YGS YE HAZIRLIK DENEMESi #15 1) Bir hücrede meydana gelen bölünme evrelerinden birine ait şekil yukarıdaki gibi ise; I. Diploit kromozomludur. II. Glikozu nişasta şeklinde depolar. III. Sitoplazması boğumlanma
İnfertil Dişiler. Çiftleşme zorlukları. Deneyimsiz erkek. Normal çiftleşmeden sonra başarısız gebelik. Seyrek östrus. Deneyimsiz dişi.
 İnfertil Dişiler Çiftleşme zorlukları Deneyimsiz erkek Deneyimsiz dişi Erkekte fizyolojik problemler Dişide Dişinin hazır olmaması Vulval stenosis Vestibuler konstrüksiyon Vaginal Vaginal hiperplazi ya
İnfertil Dişiler Çiftleşme zorlukları Deneyimsiz erkek Deneyimsiz dişi Erkekte fizyolojik problemler Dişide Dişinin hazır olmaması Vulval stenosis Vestibuler konstrüksiyon Vaginal Vaginal hiperplazi ya
2n n. Kromozom sayısı. Zaman
 Mitoz Döllenme Mitoz MAYOZ BÖLÜNME 10. SINIF ÜNİTE, KONU, KAZANIM VE AÇIKLAMALARI 10.1.2. ve Eşeyli Üreme 10.1.2.1. u açıklar. a. un evreleri temel düzeyde işlenir. Evreler açıklanırken mikroskop, görsel
Mitoz Döllenme Mitoz MAYOZ BÖLÜNME 10. SINIF ÜNİTE, KONU, KAZANIM VE AÇIKLAMALARI 10.1.2. ve Eşeyli Üreme 10.1.2.1. u açıklar. a. un evreleri temel düzeyde işlenir. Evreler açıklanırken mikroskop, görsel
Genital siklus Pubertaya ulaşan bir dişide, hipotalamus ve hipofiz bezinin kontrolü altında ovaryum ve uterusta bazı değişiklikler meydana gelir.
 Genital siklus Pubertaya ulaşan bir dişide, hipotalamus ve hipofiz bezinin kontrolü altında ovaryum ve uterusta bazı değişiklikler meydana gelir. Ovaryumda meydana gelen değişiklikler ovogenezis ve ovulasyon
Genital siklus Pubertaya ulaşan bir dişide, hipotalamus ve hipofiz bezinin kontrolü altında ovaryum ve uterusta bazı değişiklikler meydana gelir. Ovaryumda meydana gelen değişiklikler ovogenezis ve ovulasyon
 ÜREME SİSTEMİNİN GÖREV YAPI ve İŞLEYİŞİ 11. SINIF ÜNİTE, KONU, KAZANIM VE AÇIKLAMALARI 11.1.7. Üreme Sistemi ve Embriyonik Gelişim Anahtar Kavramlar; büyüme, embriyonik gelişim, gelişme, hamilelik, invitro
ÜREME SİSTEMİNİN GÖREV YAPI ve İŞLEYİŞİ 11. SINIF ÜNİTE, KONU, KAZANIM VE AÇIKLAMALARI 11.1.7. Üreme Sistemi ve Embriyonik Gelişim Anahtar Kavramlar; büyüme, embriyonik gelişim, gelişme, hamilelik, invitro
MİTOZ ÇALIŞMA KÂĞIDI A. Aşağıdaki resimli bulmacayı çözünüz.
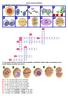 MİTOZ ÇALIŞMA KÂĞIDI A. Aşağıdaki resimli bulmacayı çözünüz. B. Numaralandırılmış evrelerle ilgili aşağıdaki cümlelerde ifadeyi doğru tamamlayan koyu renkli ifadeyi yuvarlak içine alınız. 2. / 5. resimde
MİTOZ ÇALIŞMA KÂĞIDI A. Aşağıdaki resimli bulmacayı çözünüz. B. Numaralandırılmış evrelerle ilgili aşağıdaki cümlelerde ifadeyi doğru tamamlayan koyu renkli ifadeyi yuvarlak içine alınız. 2. / 5. resimde
Tüp Bebek Merkezi her şey bebek için
 Tüp Bebek Merkezi her şey bebek için Yeni bir hayata dair minik bir ses, kocaman bir umut. Medicana International İstanbul Hastanesi Tüp Bebek Merkezi deneyimli uzman kadrosu ve son teknoloji ürünü tıbbi
Tüp Bebek Merkezi her şey bebek için Yeni bir hayata dair minik bir ses, kocaman bir umut. Medicana International İstanbul Hastanesi Tüp Bebek Merkezi deneyimli uzman kadrosu ve son teknoloji ürünü tıbbi
HÜCRE #6 HÜCRE İSKELET ELEMANLARI ÇEKİRDEK SELİN HOCA
 HÜCRE #6 HÜCRE İSKELET ELEMANLARI ÇEKİRDEK SELİN HOCA HÜCRE İSKELET ELEMANLARI Sitoplazmanın içinde bulunan özel proteinlerdir. 3 çeşit hücre iskelet elemanı bulunur. Her iskelet elemanının görev ve yapısı
HÜCRE #6 HÜCRE İSKELET ELEMANLARI ÇEKİRDEK SELİN HOCA HÜCRE İSKELET ELEMANLARI Sitoplazmanın içinde bulunan özel proteinlerdir. 3 çeşit hücre iskelet elemanı bulunur. Her iskelet elemanının görev ve yapısı
TOPRAK TOPRAK TEKSTÜRÜ (BÜNYESİ)
 TOPRAK Toprak esas itibarı ile uzun yılların ürünü olan, kayaların ve organik maddelerin türlü çaptaki ayrışma ürünlerinden meydana gelen, içinde geniş bir canlılar âlemini barındırarak bitkilere durak
TOPRAK Toprak esas itibarı ile uzun yılların ürünü olan, kayaların ve organik maddelerin türlü çaptaki ayrışma ürünlerinden meydana gelen, içinde geniş bir canlılar âlemini barındırarak bitkilere durak
ÖZET CEVAP: Oosit retrivalin hemen ardından intrauterin hcg uygulaması implantasyon oranlarını, kimyasal ve klinik gebelik oranlarını artırmaktadır.
 Intrauterine administration of hcg immediately after oocyte retrieval and the outcome of ICSI: a randomized controlled trial Oosit Retrivalden hemen sonra intrauterin hcg uygulamasının ICSI sonuçları üzerine
Intrauterine administration of hcg immediately after oocyte retrieval and the outcome of ICSI: a randomized controlled trial Oosit Retrivalden hemen sonra intrauterin hcg uygulamasının ICSI sonuçları üzerine
YGS YE HAZIRLIK DENEMESi #22
 YGS YE HAZIRLIK DENEMESi #22 1) Zigottan başlayıp yeni bir bireyin meydana gelmesiyle sonlanan olayların hepsine birden gelişme denir. Embriyonun gelişimi sırasında, I. Morula II. Gastrula III. Blastula
YGS YE HAZIRLIK DENEMESi #22 1) Zigottan başlayıp yeni bir bireyin meydana gelmesiyle sonlanan olayların hepsine birden gelişme denir. Embriyonun gelişimi sırasında, I. Morula II. Gastrula III. Blastula
GENEL SORU ÇÖZÜMÜ ENDOKRİN SİSTEM
 GENEL SORU ÇÖZÜMÜ ENDOKRİN SİSTEM 1) Aşağıdaki hormonlardan hangisi uterusun büyümesinde doğrudan etkilidir? A) LH B) Androjen C) Östrojen Progesteron D) FUH Büyüme hormonu E) Prolaktin - Testosteron 2)
GENEL SORU ÇÖZÜMÜ ENDOKRİN SİSTEM 1) Aşağıdaki hormonlardan hangisi uterusun büyümesinde doğrudan etkilidir? A) LH B) Androjen C) Östrojen Progesteron D) FUH Büyüme hormonu E) Prolaktin - Testosteron 2)
2006 ÖSS BİYOLOJİ SORULARI VE CEVAPLARI
 2006 ÖSS BİYOLOJİ SORULARI VE CEVAPLARI 1. BÖLÜM 1. I. Adaptasyon II. Mutasyon III. Kalıtsal varyasyon Bir populasyondaki bireyler, yukarıdakilerden hangilerini "doğal seçilim ile kazanır? D) I veii E)
2006 ÖSS BİYOLOJİ SORULARI VE CEVAPLARI 1. BÖLÜM 1. I. Adaptasyon II. Mutasyon III. Kalıtsal varyasyon Bir populasyondaki bireyler, yukarıdakilerden hangilerini "doğal seçilim ile kazanır? D) I veii E)
CANLILARIN ORTAK ÖZELLİKLERİ Beslenme Boşaltım Üreme Büyüme Uyarıları algılama ve cevap verme Hareket Solunum Hücreli yapı
 CANLILARIN ORTAK ÖZELLİKLERİ Beslenme Boşaltım Üreme Büyüme Uyarıları algılama ve cevap verme Hareket Solunum Hücreli yapı Hayvan hücreleri mikroskop ile incelendiğinde hücre şekillerinin genelde yuvarlak
CANLILARIN ORTAK ÖZELLİKLERİ Beslenme Boşaltım Üreme Büyüme Uyarıları algılama ve cevap verme Hareket Solunum Hücreli yapı Hayvan hücreleri mikroskop ile incelendiğinde hücre şekillerinin genelde yuvarlak
DOKUZ EYLÜL ÜNİVERSİTESİ
 08/06/06 00:00:00 Döner Sermaye İşletmesi Teklif No 064084 İLAN HASTANEMİZİN İHTİYACI OLAN AŞAĞIDA YAZILI MALZEME(LER) TEKLİF ALMA SURETİYLE SATIN ALINACAKTIR. İLGİLENEN FİRMALARIN 0/06/06 TARİHİ, SAAT
08/06/06 00:00:00 Döner Sermaye İşletmesi Teklif No 064084 İLAN HASTANEMİZİN İHTİYACI OLAN AŞAĞIDA YAZILI MALZEME(LER) TEKLİF ALMA SURETİYLE SATIN ALINACAKTIR. İLGİLENEN FİRMALARIN 0/06/06 TARİHİ, SAAT
Ayxmaz/biyoloji. Hayvansal organizmalarda gamet ve gamet oluşumu oluşumu:
 MAYOZ BÖLÜNME Mayoz-1 evreleri: Mayoz bölünme homolog kromozomların ve kardeş kromatidlerin ayrılmasını sağlayan ardışık iki bölünme bütünüdür. Homolog kromozomların ayrılmasına neden olan birinci evreye
MAYOZ BÖLÜNME Mayoz-1 evreleri: Mayoz bölünme homolog kromozomların ve kardeş kromatidlerin ayrılmasını sağlayan ardışık iki bölünme bütünüdür. Homolog kromozomların ayrılmasına neden olan birinci evreye
MOTOR PROTEİNLER. Doç. Dr. Çiğdem KEKİK ÇINAR
 MOTOR PROTEİNLER Doç. Dr. Çiğdem KEKİK ÇINAR Hücre iskeleti, Hücre şeklini ve sitoplazmanın organizasyonunu belirleyen bir yapı iskelesi görevi yapar. Hücre hareketlerinin gerçekleşmesinden sorumludur.
MOTOR PROTEİNLER Doç. Dr. Çiğdem KEKİK ÇINAR Hücre iskeleti, Hücre şeklini ve sitoplazmanın organizasyonunu belirleyen bir yapı iskelesi görevi yapar. Hücre hareketlerinin gerçekleşmesinden sorumludur.
DOĞUM BİLGİSİ VE SUNİ TOHUMLAMA
 DOĞUM BİLGİSİ VE SUNİ TOHUMLAMA LBV208U KISA ÖZET DİKKAT Burada ilk 4 sahife gösterilmektedir. Özetin tamamı için sipariş veriniz www.kolayaof.com 1 1.ÜNİTE Üreme Organları ve Gametogenezis ÜREME ORGANLARI
DOĞUM BİLGİSİ VE SUNİ TOHUMLAMA LBV208U KISA ÖZET DİKKAT Burada ilk 4 sahife gösterilmektedir. Özetin tamamı için sipariş veriniz www.kolayaof.com 1 1.ÜNİTE Üreme Organları ve Gametogenezis ÜREME ORGANLARI
S evresi: Organellerin iki katına çıkarılması devam ederken DNA sentezi olur.
 HÜCRE DÖNGÜSÜ İnterfaz: Bölünmeyen bir hücre interfaz durumundadır. Bu safhada replikasyon ve bölünme için hazırlık yapılır. Çekirdek belirgindir, bir yada daha fazla çekirdekçik ayırt edilebilir. Kromozomlar
HÜCRE DÖNGÜSÜ İnterfaz: Bölünmeyen bir hücre interfaz durumundadır. Bu safhada replikasyon ve bölünme için hazırlık yapılır. Çekirdek belirgindir, bir yada daha fazla çekirdekçik ayırt edilebilir. Kromozomlar
2017 / 2018 EĞİTİM ÖĞRETİM YILI
 2017 / 2018 EĞİTİM ÖĞRETİM YILI DERS KURULU 2 (TIP 121) TEMEL TIP BİLİMLERİNE GİRİŞ II KURUL II KOORDİNATÖRÜ: Yard.Doç.Dr. Bahire Küçükkaya Başlama Tarihi: 13.11.17 Bitiş Tarihi: 05.01.18 KURUL SINAVI
2017 / 2018 EĞİTİM ÖĞRETİM YILI DERS KURULU 2 (TIP 121) TEMEL TIP BİLİMLERİNE GİRİŞ II KURUL II KOORDİNATÖRÜ: Yard.Doç.Dr. Bahire Küçükkaya Başlama Tarihi: 13.11.17 Bitiş Tarihi: 05.01.18 KURUL SINAVI
Hücre çekirdeği (nucleus)
 Hücre çekirdeği (nucleus) Toplam hücre hacmının 1/20-1/10'unu kapsar. Değişik hücrelerde mekanik etkilerle, yer ve şekil değiştirebilir, bu nedenle hücrelerde farklı şekillerde görülebilir. Çekirdek, hücre
Hücre çekirdeği (nucleus) Toplam hücre hacmının 1/20-1/10'unu kapsar. Değişik hücrelerde mekanik etkilerle, yer ve şekil değiştirebilir, bu nedenle hücrelerde farklı şekillerde görülebilir. Çekirdek, hücre
Gen Klonlama ve Uygulamaları. Fatma Savran Oğuz İstanbul Tı Fakültesi Tıbbi Biyoloji Anabilim Dalı
 Gen Klonlama ve Uygulamaları Fatma Savran Oğuz İstanbul Tı Fakültesi Tıbbi Biyoloji Anabilim Dalı Klonlama Gen klonlaması : DNA segmentleri veya bir genin kopyalarının Reproduktif klonlama : Bir canlının
Gen Klonlama ve Uygulamaları Fatma Savran Oğuz İstanbul Tı Fakültesi Tıbbi Biyoloji Anabilim Dalı Klonlama Gen klonlaması : DNA segmentleri veya bir genin kopyalarının Reproduktif klonlama : Bir canlının
13 HÜCRESEL SOLUNUM LAKTİK ASİT FERMANTASYONU
 13 HÜCRESEL SOLUNUM LAKTİK ASİT FERMANTASYONU Laktik Asit Fermantasyonu Glikozdan oksijen yokluğunda laktik asit üretilmesine LAKTİK ASİT FERMANTASYONU denir. Bütün canlılarda sitoplazmada gerçekleşir.
13 HÜCRESEL SOLUNUM LAKTİK ASİT FERMANTASYONU Laktik Asit Fermantasyonu Glikozdan oksijen yokluğunda laktik asit üretilmesine LAKTİK ASİT FERMANTASYONU denir. Bütün canlılarda sitoplazmada gerçekleşir.
