T.C. SÜLEYMAN DEMİREL ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ
|
|
|
- Esen Özbilgin
- 5 yıl önce
- İzleme sayısı:
Transkript
1 T.C. SÜLEYMAN DEMİREL ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ BAZI OMURGALI TÜRLERİNDE LARİNKS, TRAKE VE BRONKUS MUKOZALARININ HİSTOLOJİK VE HİSTOKİMYASAL YAPILARI Cansever YAVAŞ Danışman: Yard.Doç.Dr. Kenan ÇINAR YÜKSEK LİSANS TEZİ BİYOLOJİ ANABİLİM DALI ISPARTA-2009
2 Fen Bilimleri Enstitüsü Müdürlüğüne; Bu çalışma jürimiz tarafından BİYOLOJİ ANABİLİM DALI' nda oybirliği/oyçokluğu ile YÜKSEK LİSANS TEZİ olarak kabul edilmiştir. Başkan: Prof. Dr.Yaşar AKSOYLAR Süleyman Demirel Üniversitesi Fen Edebiyat Fakültesi Biyoloji Bölümü Üye: Prof. Dr. Abdullah Diler Süleyman Demirel Üniversitesi Eğirdir Su Ürünleri Fakültesi Su Ürünlüri Avlama ve İşleme Bölümü Üye: Yard. Doç. Dr. Kenan ÇINAR Süleyman Demirel Üniversitesi Fen Edebiyat Fakültesi Biyoloji Bölümü (İmza) (İmza) (İmza) ONAY Bu tez 20/01/2009 tarihinde yapılan tez savunma sınavı sonucunda, yukarıdaki jüri üyeleri tarafından kabul edilmiştir..../.../2009 Prof.Dr. Mustafa KUŞÇU Enstitü Müdürü
3 İÇİNDEKİLER Sayfa İÇİNDEKİLER..i ÖZET....ii ABSTRACT....iii TEŞEKKÜRLER...iv ŞEKİLLER DİZİNİ...v ÇİZELGELER DİZİNİ vi 1.GİRİŞ.1 2.KAYNAK ÖZETLERİ MATERYAL VE YÖNTEM ARAŞTIRMA BULGULARI Histolojik Bulgular Histokimyasal Bulgular TARTIŞMA SONUÇ KAYNAKLAR...44 ÖZGEÇMİŞ 53 i
4 ÖZET Yüksek Lisans Tezi BAZI OMURGALI TÜRLERİNDE LARİNKS, TRAKE VE BRONKUS MUKOZALARININ HİSTOLOJİK VE HİSTOKİMYASAL YAPILARI Cansever YAVAŞ Süleyman Demirel Üniversitesi Fen Bilimleri Enstitüsü Biyoloji Anabilim Dalı Juri: Prof. Dr. Yaşar AKSOYLAR Prof. Dr. Abdullah DİLER Yard. Doç. Dr. Kenan ÇINAR (Danışman) Bu çalışmada bazı omurgalı türlerinde (Keçi= Capra aegagrus hircus, Sığır= Bos primigenius taurus, Bıldırcın= Coturnix coturnix, Serçe= Passer domesticus, Rat= Rattus norvegicus, Tavşan= Oryctolagus cuniculus) gırtlak=larinks, soluk borusu=trake ve bronş=bronkus mukozalarının histolojik yapı ve histokimyasal karakterlerinin belirlenmesi amaçlanmıştır. Larinks, trake ve bronkuslarının histolojik olarak önemli farklılıklar gösterdiği belirlendi. Bu farklılıkların özellikle mukozal yüzeyin şeklinde, bezlerin karakterinde ve goblet hücrelerinin dağılımları ile ilişkili olduğu saptandı. Çalışılan türlerin larinks, trake ve bronkus L. epitelyalis inde glikoproteinlere rastlanmazken, bez ve goblet hücrelerinde asidik mukosubstansların varlığı belirlendi. Tüm türlerin larinks ve trake epitel, bez ve goblet hücrelerinde nötral mukosubstanslara rastlanmadı. Fakat bronkus goblet hücreleri ile sığır ve keçi bronşial bezlerinde nötral mukosubstansların bulunduğu belirlendi. Anahtar Kelimeler: Larinks, trake, bronkus, histoloji, histokimya, musin, glikoprotein. 2009, 53 sayfa ii
5 ABSTRACT M.Sc. Thesis HISTOLOGICAL AND HISTOCHEMICAL STRUCTURES OF MUCOSAS OF THE LARYNX, TRACHEA AND BRONCHUS IN SOME VERTEBRATE SPECIES. Cansever YAVAŞ Süleyman Demirel University School of Appliedand Natural Sciences Biology Department Thesis Committee: Prof. Dr. Yaşar AKSOYLAR Prof. Dr. Abdullah DİLER Yard. Doç. Dr. Kenan ÇINAR (Danışman) In this study, histological structures and histochemical characterization of mucosa of larynx, trachea and bronchus were purposed to detect in some vertebrate species (Goat= Capra aegagrus hircus, Neat= Bos primigenius taurus, Quail= Coturnix coturnix, Sparrow= Passer domesticus, Rat= Rattus norvegicus, Rabbit= Oryctolagus cuniculus). Histological differences in larynx, trachea and bronchus were determined. It was detected that these differences especially were related to structure of mucosal surface, character of glands and distribution of mucous cells. While epithelium of larynx, trachea and bronchus did not observe glycoproteins in all species, mucous cells and glands contained acidic mucosubtances. It was observed that epithelium, glands and mucous cells of larynx and trachea did not contain neutral mucosubstances in all species. But it was detected that neutral mucosubstances in the mucous cells of bronchus and glands of neat and goat bronchus. Key Words: Larynx, trachea, bronchus, histology, histochemistry, mucin, glycoprotein. 2009, 53 sayfa iii
6 TEŞEKKÜR Bu araştırma için beni yönlendiren, karsılaştığım zorlukları bilgi ve tecrübesi ile aşmamda yardımcı olan değerli Danışman Hocam Yrd. Doç. Dr. Kenan ÇINAR a, literatür araştırmalarımda ve preparatların incelenmesinde yardımcı olan değerli arkadaşlarım Dilek DİLER ve Emel DEMİRBAĞ a teşekkürlerimi sunarım YL-07 No`lu Proje ile tezimi maddi olarak destekleyen Süleyman Demirel Üniversitesi Bilimsel Araştırma Projeleri Yönetim Birimi Başkanlığı na teşekkür ederim. Tezimin her aşamasında beni yalnız bırakmayan aileme sonsuz sevgi ve saygılarımı sunarım. Cansever YAVAŞ ISPARTA, 2009 iv
7 ŞEKİLLER DİZİNİ Şekil 4.1. Sığır larinksi mukoza yüzeyindeki girintili yapı Şekil 4.2. Rat larinksi L. epitelyalis indeki inveginasyon ve mukozal yüzey Şekil 4.3. Bıldırcın larinksi L. epitelyalis indeki inveginasyonlar.18 Şekil 4.4. Serçe trakesi mukozal yüzeyi.19 Şekil 4.5. Rat trakesi L.epitelyalis inde gruplaşmış goblet hücreleri...20 Şekil 4.6. Sığır bronkusunda kıkırdaklar arasındaki gruplaşmış bezler.. 20 Şekil 4.7. Laringeal bezlerde AB ph 1.0 (+) özellik..23 Şekil 4.8. Trake goblet hücrelerinde AB ph 1.0 (+) özellik...24 Şekil 4.9. Trakeal bezlerde AB ph 1.0 (+) özelik..24 Şekil Bronkus bezleri AB ph 1.0 (+) özellik...25 Şekil Bronkus goblet hücrelerinde AB ph 1.0 (+) özelik Şekil Laringeal bezlerde AB ph 0.5 (+) özellik Şekil Trake goblet hücrelerinde AB ph 0.5 (+) özellik Şekil Trakeal bezlerde AB ph 0.5 (+) özellik Şekil Bronkus goblet hücresi AB ph 0.5 (+) özellik Şekil Laringeal bezlerde PAS/AB ph 2.5 boyamasında AB baskın özellik.30 Şekil Trakeal bezlerde PAS/AB ph 2.5 boyamasında AB baskın özellik...30 Şekil Trake goblet hücrelerinde PAS/ AB ph 2.5 boyamasında AB baskın özellik.31 Şekil Bronkus bezlerinde PAS/AB ph 2.5 (+) özelik Şekil Bronkus goblet hücrelerinde PAS/AB ph 2.5 (+) özellik...32 Şekil Laringeal bezlerde KOH/ PAS (+) özellik Şekil 4.22.Trakeal bezlerde KOH/PAS (+) özellik.34 Şekil Trake goblet hücrelerinde KOH/PAS (+) özellik.34 Şekil Bronkus bezlerinde KOH/PAS (+) özellik...35 Şekil Bronkus goblet hücrelerinde KOH/PAS (+) özellik v
8 ÇİZELGELER DİZİNİ Çizelge 3.1. Uygulanacak teknik ve belirlenecek mukosubstans tipi. 16 Çizelge 4.1. Mukosubstansların sığır, keçi ve rat ın larinks, trake ve bronkuslarında dağılımı ve yoğunlukları Çizelge 4.2. Mukosubstansların tavşan, bıldırcın ve serçe nin larinks, trake ve bronkuslarında dağılımı ve yoğunlukları vi
9 1. GİRİŞ Solunum sistemi, burun girişinden alveollere kadar uzanan, bazı korunma mekanizmalarına sahip, dış ortama açık bir sistemdir. Bu yol üzerindeki organlar da dışarıdan gelen her türlü patojenin etkisi altında kalmaktadır (Tahamiler, 2007). Solunan havada gerek solunum yollarının, gerekse diğer organ ve sistemlerin yapı ve işlevini olumsuz yönde etkileyecek çok fazla fiziksel, kimyasal ve biyolojik faktörler bulunmaktadır. Solunan havanın soğukluk-sıcaklığı, kuruluk-nemliliği, radyasyon içeriği, içerdiği partiküllerin mekanik etkisi gibi fiziksel faktörler; gaz veya partikül halinde havada bulunan sülfür oksitler, azot oksitler, karbondioksit, karbonmonoksit, ozon, hidrokarbonlar, kurşun gibi kimyasallar; virüsler, bakteriler, parazitler, funguslar gibi mikroorganizmalar ile polenler ve çok çeşitli organik tozlardan oluşan biyolojik faktörlerle her an yoğun temas halindedir (Huxley vd., 1978). Burun delikleri ile başlayan bu sistemde de tıpkı sindirim sisteminde olduğu gibi, doğal delikler çevresinde deri benzeri yapılar görülür (derisel ya da kutan mukoza). Solunum sisteminde dar bir alanı kaplayan bu mukoza, yerini daha sonra glanduler mukozaya bırakır. Solunuma elverişli olan bu glanduler mukozalı bölüme respiratorik mukoza da denir (Tanyolaç, 1999). Respiratorik mukozanın Lamina epitelyalis (L. epitelyalis) i yalancı çok katlı, silyumlu, çok sayıda goblet hücreli prizmatik epitelden meydana gelir (Martini vd., 2000). Solunum sistemine ait örtü epiteli, farinksin inferior kısmı ve son iletim kısımları ile alveoller haricinde, respiratuar kanalın girişi ile bronkus ve bronkulusları astarlar (Erkoçak, 1982; Demirsoy, 1992; Martini vd., 2000). Epitel yapısı, solunum yollarında bazı bölgelerde farklılık gösterir. Fizyolojik gereksinime bağlı olarak, burun boşluğuna girişte çok katlı yassı, trake ve bronkus çatallanma bölgeleri ile farinks ve larinks epitelyumi yalancı çok katlı prizmatik karaktelidir (Erbengi, 1990). Epitelyum hücrelerinin apikal yüzündeki kinosilyumlar ince ve yapışkan bir mukus tabakasıyla örtülüdür. Kinosilyumların hareketi ile ilerleyen bu mukus intraepitelyal goblet hücrelerinden ve bağ dokusu tabakası içinde bulunan ekzoepitelyal serö-müköz bezlerden salgılanır (Erkoçak, 1982). Nazal boşluktaki kinosilyumlar, mukusta yakalanmış zararlıları ve mikroorganizmaları tutar. Solunum kanalının alt 1
10 kısımlarında da kinosilyumlar, solunum yollarını temizleyen bir mukus merdiven oluşturarak farinks doğrultusunda salınma hareketi yapar (Martini vd., 2000). Solunum sistemi, farklı fonksiyonları olan 3 ana bölümden ibarettir. Bunlardan ilki hava iletimi bölümüdür. Bu bölüm birbirini takip eden burun boşlukları ve onlara eşlik eden sinüsler, nazofarinks, orofarinks, larinks, trake, bronkus ve bronkuluslardan oluşur. Bir diğer bölüm hava ve kan arasındaki gaz değişiminin gerçekleştiği bölümüdür. Bu bölüm birbirini takip eden bronkuluslar, alveolar kanallar, alveolar keseler ve alveollerden oluşur. Bir diğer bölüm ise göğüs kafesinin inspirasyon ve ekspirasyon hareketleri tarafından idare edilen ventilasyon mekanizması bölümüdür (Kierszenbaum, 2006). Solunum yollarında iletici bölümün genel olarak 4 görevi vardır. Kemik, kıkırdak ya da fibröz ve elastik bağ dokusu ve düz kaslarla iletimin sağlanması, burundaki kıllar, mukus, silyumlarla süzme işleminin gerçekleştirilmesi, L. propria daki bezler ve goblet hücrelerinin salgılarıyla nemlendirme işleminin yapılması ve L. propria da bulunan damar ağı ile ısıtma işleminin yapılmasıdır (http1). Kanatlılarda oldukça karışık bir yapıya sahip olan solunum sistemi memelilerdekinden belirgin bazı farklılıklar gösterir (Kuru, 2001). Bunlar trakeyal halkaların tam halka şeklinde olması, sirinks ve hava keselerinin bulunması, akciğerlerin lobsuz olması, vokal kordların bulunmaması şeklinde sıralanabilir (Cover, 1953; Doğuer ve Erengin, 1964; Meleod vd., 1964; Major, 1967; King ve Molony, 1971; Hodges, 1974; King ve McLelland, 1984; Banks, 1993; Dellman, 1993; Reece, 1996). Üst solunum yolu nares (dış burun deliği), burun boşluğu, sinüsler, orofarinks (gırtlak) ve trakeden; alt solunum yolu ise sirinks, bronşlar, akciğerler ve hava keselerinden oluşur (http2). Hava, inspirasyon ve ekspirasyon sırasında akciğerler boyunca tek yönlü ilerler (Kuethe, 1988; Brown vd., 1995; Fedde, 1998; Maina ve Africa, 2000). Gaz değişim alanları paleopulmonik parabronşlardır (Brown vd., 1995; Fedde, 1998; Maina, 2002). Solunum sisteminin başlangıcını oluşturan burun boşluğu, önde naris denilen burun delikleri ile dış ortama,arkada choana (apertura nasalis posterior) denilen iki açıklıkla 2
11 nasopharynx e açılır (Ozan vd., 2007). Burun boşluğu, septum nasi denilen (ortada kıkırdak ve kemik septumla) bir bölme ile ikiye ayrılmıştır (Erkoçak, 1982; Demirsoy, 1992; Tanyolaç, 1999; Ozan vd., 2007). Burun boşluğunun çatısında ve dış duvarında (concha nasalis superior) üzerine lokalize olan pars (regio) olfaktorio da koku duyusunun reseptör hücreleri olan bipolar nöronlar, destek hücreler ve basal hücreler ile glandulla olfaktoria (gll.olfaktoria) (Bowman bezleri) denilen bezler bulunur (Ozan vd., 2007). Tavuk ve diğer bazı kanatlılarda naris in doralinde bulunan bölgeye operculum nasale, ventralinde bulunan kıkırdak yaprağa ise lamelle verticalis naris (atrial concha) adı verilir. Kanatlı hayvanlarda conchalar burun boşluğunun caudalinde yerleşmesi nedeniyle memeli hayvanlarda bulunan meatusların karşılığı olarak sadece meatus nasalis adıyla tek bir yol bulunur. Kuşlarda cavitas nasalis, koku ve solunum havasında bulunan partiküllerin tutulması fonksiyonlarının yanında, memelilerden farklı olarak su ve enerji tasarrufunda önemli rol oynar (Dursun, 2002). Histolojik yapı bakımından burun boşluğu mukozal karakter olarak üç değişik bölgeye (Regiyo vestibularis, regiyo respiratorya, regiya olfaktorya) ayrılmaktadır (Tanyolaç, 1999). Kıkırdak ve kemik kısımların üzerini örten tunika mukoza L. epitelyalis, Lamina propria (L. propria) ve submukoza olmak üzere üç kısımdan yapılmıştır. Lamina muskularis (L. muskularis) yoktur (Kayalı, 1992). Burun boşluğu epitelin karakterine göre; ön (regio vestibularis), arka (regio respiratoria) ve üst (regio olfaktoria) olmak üzere üç bölgeye ayrılmıştır. Regio vestibularis burun boşluğunun girişidir. Vestibul kutan mukoza ile kaplıdır. Burada keratinleşmiş çok katlı yassı epitel bulunmaktadır. Burun boşluğunun iç kısımlarına doğru gidildikçe keratinleşme azalır ve sonunda kaybolur. Ayrıca L. propria ve submukoza, kan ve lenf damarlarınca zengindir (Erkoçak, 1982; Kayalı, 1992; Tanyolaç, 1999; Martini vd., 2000). Regio respiratoria, burun boşluğunun en geniş bölümüdür. Glandular mukozaya sahiptir. Yalancı çok katlı prizmatik epitelle örtülüdür. goblet hücreleri boldur. Kinesilyumların hareketi larinkse doğrudur (Tanyolaç, 1999). Regio olfaktoria, koku duyusuyla ilgili olup insanda burun boşluğu tavanında küçük bir yer kaplar (Erkoçak, 1982). Üst konka bölgesinde yer alan bu bölümün mukozasına olfaktorik mukoza da denir. Bu mukoza glandular özelliktedir 3
12 ve regio respiratoria dakinden daha kalındır. Goblet hücreleri ve tipik kinesilyumlu prizmatik hücreler bulunmaz (Tanyolaç, 1999). Burun boşluğunun görevi, havadaki yabancı cisimleri vestibulde bulunan uzun kıllarla tutmak ve nazal mukozaya geçişlerine engel olmak ve nem- ısıyı ayarlamaktır (Erkoçak, 1982; Martini vd., 2000). Burun boşluğundan sonra gelen farinks, kafa tabanından cartilago cricoidea nın alt kenarına kadar uzanır (Ozan vd., 2007). İç burun delikleri ile larinks ve özofagusun giriş kısımları arasında yer alır (Martini vd., 2000). En geniş yeri başlangıcı, en dar yeri ise özofagusla birleşme yeridir (Ozan vd., 2007). Sindirim ve solunum sistemleri için ortak bir bölgedir (Martini vd., 2000). Mukozasının çeşitli hücresel kompozisyonları olması nedeniyle üç bölgeye ayrılır. Bunlardan nazofarinks respiratorik mukoza ile kaplıdır. Epitel hücreleri arasında gobet hücreleri bulunur (Tanyolaç, 1999). L. propria da birçok küçük seröz ve müköz mikst bezler ile lenf folikülleri içeren gevşek bağ dokusu tabakası bulunur (Erkoçak, 1982). Nazofarinks yutkunma sırasında yumuşak damak ile küçük dil nazofarinksin kapanmasını sağlayarak, besinlerin burun boşluğuna geçişini önler (Tanyolaç, 1999) ve östaki borusu ile orta kulağa bağlı olup orta kulaktaki hava basıncının dış çevre ile dengelenmesini sağlar (Marieb, 2001). Kuşlarda farinks tavanının ortasında bulunan infundibular yarık (Ostium pharyngeum tubae auditivae isimli yarık) yutak boşluğunu orta kulak ile birleştirir. Bunun yanlarında glandulae pterygoideae ile glandulae tubariae nın akıtıcı delikleri yer alır (Dursun, 2002). Orofarinks ağız boşluğunun posteriorundadır ve onun devamı halindedir. İnferior olarak yumuşak damaktan epiglottise kadar uzanır (Marieb, 2001). Kutan bir mukoza örtüsüne sahiptir. L. epitelyalis i çok katlı yassı epitelden yapılmıştır. L. propria da bezler yoktur (Tanyolaç, 1999). Orafarinks yutkunma sırasında, hem besinlerin hem de solunan havanın geçişini sağlar. Farinksin son bölümünü oluşturan laringofarinks çok katlı yassı epitelyum ile kaplıdır. Orofarinks gibi besinler ve hava için bir geçiş yeri oluşturur (Marieb, 2001). Larinks, farinks i trakeye bağlayan düzensiz bir boru şeklindedir (Erkoçak, 1982; Kayalı, 1992; Tanyolaç, 1999). 4
13 Larinksin mukozası gırtlağın başlangıç bölümünde ve sesin meydana gelmesinde şiddetli zorlamalara uğrayan pilika vokalis lerde kutan, geri kalan bölümde respiratorik karakterdedir (Martini vd., 2000; Marieb, 2001). Epiglottisin lingual yüzeyi ve laringeal yüzeyin üst kısmı nonkeratinize çok katlı yassı epitel ile örtülüdür. Yassı epitel, epiglottisin inferior larengeal kısmında solunum tipi epitel ile birleşir. Epiglottisin inferior larengeal kısmında epitel altında serö-müköz bezler vardır. Solunum tipi epitel yalancı vokal kordları, ventrikülü ve subglottisi de örtmektedir. Gerçek vokal kordlar nonkeratinize çok katlı yassı epitel ile döşelidir (Gnepp, 2000; Kirchner vd., 2004; Rosai, 2004). Larinksin solunum epiteli yalancı çok katlı silyalı kolumnar tiptedir. Silyalı epitel yalancı vokal kordlar, ventrikül ve subglottiste bulunmaktadır. Kolumnar epitelin en alt kısmında küçük, yuvarlak hücrelerden oluşan bazal veya rezerv hücreler bulunur. Epitel altındaki L. propria da çoğunluğu müköz olan mikst bezler bulunur. Bu bezlerin boşaltıcı kanalları epitelyal yüzeye açılır. Ayrıca L. propria da lenfoid nodüller mevcuttur. Ayrı olarak submukoza bulunmaz (Kirchner vd., 2004). Larinksin çok katlı yassı epitelinde dar sitoplazmalı, ovoid nükleuslu, yüzeye dik şekilde dizilenim gösteren bir bazal tabaka vardır. Çok katlı yassı epitel yüzeyi altındaki L. propria incedir ve bezler, lenfoid doku ve kan damarlarından yoksun yoğun bir bağ dokusu mevcuttur. L. propria altında vokal ligamenti oluşturan iri demetler halindeki paralel elastik lifler ve bu liflere paralel olarak vokal kordların gerilimini düzenleyen iskelet kası demetlerinden oluşan vokal kaslar bulunur. Yalancı vokal kordlarda serömüsinöz bezler ve silyalı kolumnar epitel yapısı gözükmektedir. Vokal kas, elastik lif ve Reinke boşluğunu içeren gerçek vokal kordda ise çok katlı yassı epitel gözlenmektedir (Lewis ve Prentice, 1980). Duvarı çeşitli kıkırdaklar tarafından desteklenir. Larinksin kıkırdaklarından geniş ve tek olan üç tanesi (tiroid, krikoid, epiglottis) larinksin gövdesini şekillendirir (Martini vd., 2000; Marieb, 2001). Tiroid ve krikoid kıkırdaklar tamamen hiyalin kıkırdaktan meydana gelir (Erkoçak, 1982; Kayalı, 1992; Tanyolaç, 1999). Epiglottis, larinksin üst bölümündedir ve bulunduğu yer ve görev yönünden büyük önem taşır (Tanyolaç, 5
14 1999). Epiglottis tamamen elastik kıkırdaktan yapılmıştır (Erkoçak, 1982; Kayalı, 1992; Tanyolaç, 1999). Larinks aynı zamanda üç çift küçük kıkırdak içerir (Kayalı, 1992; Tanyolaç, 1999; Martini vd., 2000; Marieb, 2001). Bunlardan en önemlisi olan çift aritenoid kıkırdaklar, krikoid kıkırdağın genişlemiş kısmının superior kenarı ile eklem yapar (Martini vd., 2000; Marieb, 2001). Kornikulat kıkırdaklar, aritenoid kıkırdaklarla eklem yapar. Kornikulat ve aritenoid kıkırdaklar glottisin açılıp kapanmasını ve ses yapımını sağlar. Uzamış, kavisli kuneiform kıkırdaklar, epiglottis ile her bir aritenoid kıkırdağın yanal yüzü arasında yerleşmiş olan ariepiglotitik kıvrım içine uzanır (Martini vd., 2000). Kanatlılarda larinks, tek olarak bulunan cartilago cricoide ve cartilago procricoidea ile iki adet cartilago arytenoidea olmak üzere dört kıkırdaktan şekillenir (Dursun, 2002). Kıkırdaklar birbirine ligamentlerle bağlıdır ve hareketleri intrinsik ve ekstrinsik kaslarla sağlanır (Kayalı, 1992; Tanyolaç, 1999; Marieb, 2001; Martini vd., 2000). Larinksin synovidal eklemleri art. procricoarytenoidea, art. procricocricoidea art. intraricoidea ve art. cricoartytenoidea dır. m. dilator glottidis ve m. constrictor glottidis larinksin iç kaslarını oluşturur. Larinksin mukozası, altında bulunan cort. arytenoidea ile kaslardan dolayı çıkıntılı bir şekilde görülür. Buna mons laryngealis adı verilir. Mons laryngealis kutan mukoza ile örtülüdür ve sivri uçları özofagusa doğru olan papilla sıralarını bulundurur. Mons glottidis de bulunan ve larinksin boşluğu olan cavitas laryngealis e açılan yarık şeklindeki deliğe glottis adı verilir. Cavitas laryngealis respiratorik mukoza ile örtülüdür (Dursun, 2002). Bu organ (Larinks) aynı zamanda ses çıkarma ile ilgili yapısal özelliklere sahiptir (Kayalı, 1992; Tanyolaç, 1999). Kuşlarda sesin oluşumu fonksiyonunu syrinx üstlenmiştir. Syrinks 2. veya 3. torakal omuz hizasında, trake ile bronkus primarius arasında yer alıp (Dursun, 2002), trakenin bifurkasyon yerinde göğüs boşluğu içerisinde uzanır (Doğuer, 1964; Meleod vd., 1964; Major, 1967; King ve Molony, 1971; Warner, 1972; Hodges, 1974; King ve McLelland,1984; Banks, 1993; Dellman, 1993; Can ve Keçeci, 1996; Reece, 1996;). Orjin aldığı oluşuma göre 3 sınıfa ayrılır. Bunlar tracheabronchial syrinx, tracheal syrinx ve bronchial syrinx tir. Kuşların çoğunda hem tracheal hem de bronchial kıkırdaktan köken aldığı için 6
15 tracheabronchial syrinx tipi bulunmaktadır (Dursun, 2002). Syrinx kuşlara özgü olup, ses çıkartma organıdır (Mania, 1989; Dursun, 2002). Lariksin devamı olarak cartilago cricoidea nın alt kenarı seviyesinde başlayan trake (Ozan vd., 2007), larinks ve bronkuslar arasında (Tanyolaç,1999), kuşlarda boynun ventralinde, derinin hemen altında, larinksten syrinx e kadar uzanır (Dursun, 2002; Maina ve Africa 2000). Dorsalinde yemek borusu bulunur (Tanyolaç, 1999; Dursun, 2002). Solunum sisteminin iletici bölümünün büyük bir kısmını oluşturur. Lümenden itibaren trakenin duvar yapısına katılan oluşumlar; mukoza, kıkırdak halkalar ile ligamentler, muskularis ve adventisyadır. Mukoza respiratorik mukoza özelliğindedir (Tanyolaç, 1999). L. epitelyalis yalancı çok katlı pirizmatik örtü epiteli ile örtülüdür (Hodges, 1974; Erkoçak,1982). Goblet hücreleri sayıca fazladır. L. propria gevşek bağ dokusu karakterindedir (Erkoçak, 1982). Submukoza çoğunlukla serömüköz karakterli bezler içerir (Kayalı, 1992; Tanyolaç, 1999; Martini vd., 2000). Trake trakeal kıkırdak içerir (Tanyolaç, 1999; Martini vd., 2000; Ozan vd., 2007) ve her trakeal kıkırdak elastik halkalı ligamentlerle komşu kıkırdağa bağlıdır. Kuşlarda Epitel içinde basit alveolar müköz bezler bulunur (http3). Trakenin sirinkse doğru uzanan mukoza kısmında mukus bezlerinin çoğu mukus goblet hücreleri ile yer değiştirir. L. propria kan damarları ve lenfoid hücreler içeren sıkı düzensiz bağ dokudan oluşmuştur. Submukoza ise birçok elastik fibril içerir. Bu kısım perikondrium ile devam eder (Hodges, 1974). Her trakeal kıkırdak C şeklindedir. C-şekilli trakeal kıkırdakların açık kısımları, posterior olarak özofagusa bakar (Tanyolaç, 1999; Martini vd., 2000). Kanatlılarda boyun uzunluklarına bağlı olarak kıkırdak halkaların sayısı değişmektedir (Dursun, 2002). Buna rağmen bazı kuşlarda 1.5 metreye kadar çıkabilir ve göğüs kemiği ve omurga boşluğunda kıvrım yapar (http4). Tipik bir kuş trakesi benzeri büyüklükteki memeli trakesinden 1.29 kez daha geniş, 2.7 kez daha uzundur. Kuşlar daha büyük tidal hacim ve daha düşük solunum sıklığı ile daha büyük trakeal boşluğa sahiptir (Ludders, 2001). Trake de, sayıları arasında değişen kıkırdak halkaların sağ ve sol yarımları geniş olup, medianlarında birer çentik bulunur. Kıkırdak halkaların geniş kısımları mediandaki çentik aracılığıyla birbiri üzerine geçer. Bu nedenle ligamentum annulare bulunmaz (Bell ve Freeman, 1971; Dursun, 2002). Trakenin özofagusa bitişik arka duvarında 7
16 kıkırdak yoktur. Bu açıklığı, enine uzanan düz kas telleri (Musculus transversus trachea) kapatır (Tanyolaç, 1999). Trakede 4 adet kas bulunur. Bunlar m.tracheolateralis, m.sternotrachealis, m.cleidotrachealis ve m.sternohyoidideus tur (Dursun, 2002). Trake dallanarak her akciğerin hilusuna giren sağ ve sol primer bronkusları oluşturur (Kierszenbaum, 2006). Bu dallanma kuşlarda syrinxte olur (Maina, 1989). Bu haliyle bir ağacın gövdeden itibaren dallanışını andırır. Bronkusların ekstrapulmonal ve intrapulmonal bölümleri vardır. (Tanyolaç, 1999). Yaklaşık 2.5 cm uzunluğunda olan bu sağ primer (ana) bronkus; sol ana bronkustan daha geniş, daha kısa ve daha dik seyirlidir. Yaklaşık 5 cm uzunluğunda olan sol primer bronkus; sağ ana bronkustan daha dar, daha uzun ve daha oblik seyirlidir (Ozan vd.,2007). Bronkuslar küçüldüklerinde, düzensiz kıkırdak plaklar gözlenir. Hiyalin kıkırdaktan ibaret olan her kıkırdak plakları, lifleri perikondriyuma karşı bağ dokusu demetleri ile kuşatılmıştır. Bronşiyal mukoza ve kıkırdak plakları arasında düz kas demetleri gözlenir. Mukoza tipik olarak solunum epiteli ile döşenmiştir. L. propria da düz kas hücre demetleri tabakası dışına çıkıntı yapan salgı asinusları ile serömüköz bezler görülür. Boşaltma kanalları bronşiyal lümene açılır (Kierszenbaum, 2006). Memeli hayvanların yaşamlarını sürdüremeyecekleri kadar yüksek yerlerde oksijen gereksinimini karşılayan kanatlı akciğeri, bir primer bronş (bronchus, mesobronchus), dört adet sekonder bronş grubu, çok sayıda tersiyer bronş (parabronchus) ile bunlarla ilişkili atria ve hava kapilarlarından oluşur (Bell ve Freeman, 1971; Hodges, 1974; Nickel vd.,1977; King ve McLelland, 1984; Dellman, 1993; Banks, 1993; Taşbaş vd., 1994; Maina ve Africa, 2000). Kuşlarda primer bronkus akciğerlere girer ve sonra mesobronkus olarak adlandırılır. Mesobronkusların dalları, daha ufak olan tüplerdir ve bunlar ventrabronkus olarak adlandırılır. Ventrabronkus daha küçük parabronkusa öncülük eder. Parabronkuslar birkaç mm uzunluğundadır ve mm çapındadır (kuşların büyüklüğüne göre) 8
17 (Mania, 1989) ve duvarları yüzlerce ince, dallanmış hava kapillaları içerir. Bunlarda kan kapillaları ile sonlanır (Welty ve Baptista, 1988). Bronkuslar dallandıkça çapları küçülür. Dallandıkça çapları küçülen bronkusların yapılarında da değişmeler olur. Gittikçe küçülen kıkırdak parçalar bir yerde kaybolur (Tanyolaç, 1999). Bronkuluslar kıkırdak ve bezlerden yoksundur fakat ilk bölümde birkaç goblet hücresi bulunabilir. Yalancı çok katlı silyumlu prizmatik örtü epitelinin yüksekliği azalır. Sonunda terminal bronkuluslarda basit silyumlu kuboidal karaktere dönüşür. L. propria düz kaslardan, elastik ve kollagen liflerden oluşur (Kierszenbaum, 2006). Bronkulusların ilk bölümü bronkulus verus dur. Burada epitel tabakası başlangıçta tek katlı prizmatik, sonra kübik hücrelidir. Bu hücrelerde kinosilyum taşırlar. Ancak arada tek tük silyumsuz klara hücreleri de görülür. L. propria geniş değildir. İnce olan L. muskularis miyo-elastik özelliktedir, yani düz kas telleri elastik ipliklerle desteklenir. Bunun dışında dar bir bağ doku bulunur (Tanyolaç, 1999). Bunlar bronkulus respiratoryus u oluştururlar (Erkoçak, 1982; Martini vd., 2000). Bronkulus respiratoryus, bronkulusların son bölümüdür. Duvarları iyice incelmiştir. Epitel önce tek sıralı kübik sonra yassıdır. Başlangıçta tek tük görülen silyumlu hücreler, ileriye doğru yerlerini tamamen silyumsuz klara hücrelrine bırakırlar. Goblet hücreleri kaybolur. Propria ve miyo-elastik özellikte olan muscularis çok incedir. Bu borucukların gaz alışverişine uygun olarak uç kısımları da 2 3 kola ayrılarak duktus alveolaris lere açılırlar (Tanyolaç, 1999). Kuşlarda solunum sistemine ait ince duvarlı, kese görünümündeki yapılar hava keseleridir. Bronkusların ekstra pulmonal genişlemeleri ile şekillenmişlerdir. Bronkuslar aracılığı ile akciğerler ile iştiraktedirler. Birçok kuşta 1 tane interklavikular kesecik, 2 tane servikal kesecik, 2 tane anterior thorasic kesecik, 2 tane posterior thorasic kesecik ve 2 tane abdominal keseciktir olmak üzere 9 tane hava keseciği bulunur (Dursun, 2002). Fonksiyonel olarak bu 9 hava keseciği, anterior keseciklere (interklavikular, servial ve anterior thorasic) ve posterior keseciklere (posterior thorasic ve abdominal) 9
18 ayrılabilir. Hava keseciklerinin duvarları çok incedir ve birkaç tane kan damarına sahiptir. Bundan dolayı gaz değişiminde doğrudan rolü yoktur. Akciğerleri havalandırmakta rol oynarlar (Powell, 2000). 10
19 2. KAYNAK ÖZETLERİ Mukus glikoproteinleri; solunum yolları dışında gastrointestinal kanal epiteli ve salgı bezleri ile ter bezleri, salgı bezleri, meme ve tümör hücrelerinden (Strous ve Dekker, 1992), epitel hücreleri (epiteliyal müsinler), fibroblast ve mast hücreleri gibi bazı bağdoku hücrelerince de (bağdoku müsinleri) salgılanırlar (Bancroft vd., 1990). Solunum yolları mukusları glikoproteince zengin respiratorik sekresyon ürünleridir. Mukus fiziksel ve kimyasal özellikleri açısından viskoz bir solüsyondur (Samet vd.,1994). Solunum yolu mukusu farklı hücreler tarafından salgılanır. Mukusun kaynakları; alveoler sıvı, hava yollarındaki epitel hücreleri arasındaki sekretuar hücreler (mukoz hücreler (goblet), seröz hücreler, klara hücreleri), submukozal bezler (mukoz ve seröz bezler), kan akımından alveol ve hava yollarına olan sıvı transüdasyonudur (Witek ve Schachter,1994). Bu iş için özelleşmiş hücreler olan Goblet hücreleri esas olarak trakede, az sayıda bronşlarda, silyumlu hücreler arasında yerleşim gösterirler (Wheater vd., 1979). Klara hücreleri küçük havayollarında çok yoğun olarak bulunan hücre tipi olup gobletler gibi havayolu epitelinin diğer hücre tipleri içinde farklılaşma yeteneği gösterirler (Sleigh vd., 1988). Bu hücrelerin sol ya da perisiliar akışkan tabakaya katkıda bulundukları bilinmektedir (Mountone ve Cataletto, 1990). Goblet hücrelerinin müsin salgısı, asit veya nötr olması bakımından, memeli türleri arasında farklılıklar gösterir (Nogueria ve Godinho, 1981; Fawcett, 1986; Junqueira vd., 1995). Goblet hücrelerinin salgısı, mukozayı korur ve kayganlaştırır. Glikoprotein yapısındaki bu salgı maddesi, apikal sitoplazmada birikerek hücrenin bu bölümünün genişlemesine ve böylece nükleusun bazal sitoplazmaya itilmesine neden olur. Bu salgı maddesi Hemotoksilen-Eozin yöntemi ile boyanmadığından, goblet hücresinin apikal bölümü açık renkte izlenir (Fawcett, 1986; Kalaycı, 1986; Ross vd., 1995; Junqueira vd., 1995; Stevens ve Lowe, 1997). Seröz hücreler diğer glikoprotein salgılayan hücrelerdir. Bu hücreler esas olarak nötral türde glikoproteinler üretirler (Jeffery, 1991). Salgılanan mukusun hareketi burun boşluğu istikametine doğru olup silyumlu epitel hücreler tarafından gerçekleştirilir (Moutone ve Cataletto, 1990). Silyumlar perisiliyar sıvı içinde çıkıntılar oluştururlar (Rhodin, 1966; Wheater vd., 1979). Mukusun 11
20 viskoelastikiyetinin ve mukosiliar temizlemeyi sağlayan silyumların hareketleri için su içeriği çok önemlidir (Silberg, 1988; Sheehan vd., 1991). Mukosiliyer klerans solunum sisteminin en önemli savunma mekanizmasıdır. Mukosiliyer transporttaki değişiklikler mukus retansiyonuna, bakteri kolonizasyonuna ve infeksiyonlara neden olabilmektedir. Mukusun mukosiliar kleransın sağlanmasının yanı sıra; hava yolu hidrasyonu, perisiliyer tabakanın kalınlığının ayarlanması, bakteriyel adezyonun önlenmesi, filtrasyon ve difüzyon bariyeri, respiratuar hücrelerin korunmasında görevi vardır (Houtmeyers, 1999). Ayrıca solunum yollarının yenilenmesinin sağlaması, vizkoelastikiyeti sayesinde inspire edilmiş hava ile akciğer içine alınmış olan materyalin temizlenmesi ve tutularak taşınmasında biyolojik taşıyıcı kemer oluşturmak gibi (Samet vd, 1994) fonksiyonları vardır. Mukus jel, bakteriler için bir bariyer olarak işlev görür. Bakteriler ona yapışır ve daha sonra çoğalır (Thornton ve Sheehan, 2004). Solunum yollarının çeşitli hastalıklarında (örneğin; kronik bronşit, kistik fibrozis gibi) mukosiliyer klerans farklı mekanizmalarla bozulmaktadır (Houtmeyers vd., 1999). Normal havayolu sekresyonuna zıt olarak solunumla ilgili hastalıklarda, havayollarında üretilen mukus önemli ölçüde serum proteini içermektedir. Bu proteinlerin bronşitis ve bronşektazis gibi bazı patolojik kondüsyonların karakteristik havayolu sekresyonlarının reolojisindeki değişimler için sorumlu olduğuna inanılmaktadır (Boat ve Cheng, 1980; Rubin, 2002). Mukus, kinosilyumun gevşeme ve vurma hareketlerinin olduğu perisiliar tabaka olarak bilinen sulu sol tabaka, hipofaz (7-10 μm) ve kinosilyumun uç kısımlarının üzerinde uzanan daha yüzeysel jel tabaka, epifaz (0.5-2 μm) olmak üzere iki fazlı bir yapıdan oluşur (Boat ve Cheng, 1980; Rubin, 2002). Perisiliar sıvı tabakasının derinliği, üst havayollarının üzerine örten mukus ve silyumlar arasındaki etkileşimin özelliği geniş ölçüde belirlenmiştir. En uygun perisiliar sıvı derinliği ve kompozisyonu, itici 12
21 vuruş ve zayıflamanın oluşabilmesi için geri alma vuruşu süresince, silyumların tepesinden mukusa doğru enerjinin etkili transveri için gereklidir (Sleigh, 1988). Mukus; Musinler (Glikoproteinler) (% 2), salgı ve serum proteinleri (%1), lipitler (% 1), inorganik tuzlar (% 1) ve su (% 95) dan oluşur (Boat ve Cheng, 1980; Phipps, 1984; Tharton vd., 1990; Thornton ve Sheehan, 2004). Çalışmada belirlenmesi amaçlanan musinler, protein bir omurgaya O-Glikozid bağlarının yüzlerce oligosakkarid zincirlerle bağlanmasıyla oluşan yüksek moleküler glikokonjugat kümeleridir (Rose, 1992). Tipik müsin monomeri çubuk şekillidir ve amino asitlerin homojen olmayan bir komposizyonuna sahiptir. Birçok tipte O-bağlı oligosakkaridler, şeker zincirini oluşturan ve dolayısıyla ihtiyaç duyulan özellikte protein veren serin, threonin ve prolin gibi amino asitlere bağlanır. Müsinler önemli ölçüde su tutar ve böylelikle mukus elastik, visköz özellik kazanır. Ayrıca şeker tabakası, proteini proteolizise dirençli hale getirir (Thornton ve Sheehan, 2004). Musinler, mukus örtünün büyük kompenentleri olup kompleks ve heterojen moleküllerdir (Rose, 1992). Mukus glikoproteinleri (musinler) respiratorik sekresyonun esas bileşenleridir (http5). Respiratorik kanal mukus glikoproteinleri yüksek karbohidrat içeriğe sahip moleküllerdir (Boat ve Cheng, 1980). İnsan trakeobronşial dallarının mukus bezlerinde sülfatlı ve siyalik asit içeren musinler farklı çevresel faktörler (sigara, toz, duman,formaldehit, vs.) ve bazı respiratorik hastalıklarda (astım, sistik fibrozis ve bronşit) daha fazla salgılanmaktadır (Kollerstrom vd., 1977; Poitiers vd., 1980; Samet ve Cheng, 1994). Musin hipersekresyonunun muhtemel mekanizmaları goblet hücreleri içinde salgı oluşturmayan hücrelerin metaplazisi, goblet hücre hiperplazisi, submukozal bez hiperplazisi, varolan glikoprotein depolarının salınımına neden olmakta ve submukozal bezlerdeki hücreler ya da goblet hüreleri tarafından musin biyosentez oranında artış olmaktadır (Wheater vd., 1979). Epiteliyal müsinler hidrofobiktir ve çeşitli makromoleküller ile ilişkilidirler ki, bu makromoleküllerin kalite ve sayısı mukusun fizikokimyasal özelliklerini de 13
22 etkileyebilir. Epiteliyal müsinlerin salgısı, birçok yangı ajanlarını kapsayan çeşitli faktörler tarafından sitimule edilir (Kim vd., 1997). Solunum yolu müsinleri, salgı ve membran ile ilişkili form olmak üzere ikiye ayrılır. Salgı formları, salgı hücreleri tarafından sentezlenir, depolanır ve hücrenin apikal yüzeyinden eksositoz yoluyla dışarı atılır, böylece mukus jelin şekillenmesine yardım eder. Membran ile ilişkili formları ise plazma membranına bağlanır (Jeffery ve Li, 1997). Respiratorik epitel, nötral, sialo ve sülfatlı müsinleri içerirler. Bu müsinlerin çeşitliliği hayvan türlerine göre farklılık gösterir (Kim vd., 1997). Müsinlerde anyonik (asidik) grupların bulunması mukusun fiziksel ve infeksiyöz ajanlara bağlama özelliklerini etkiler (Boat ve Cheng, 1980). Müsinlerin bileşiminde hastalıklara bağlı olan şekillenen değişiklikler hakkındaki bilgiler sınırlı olup bu değişikliklerin biyolojik rolleri tam olarak bilinmemektedir (Shimizu vd., 2001). Musinler sülfat ya da siyalik asitler gibi asidik gruplarının içeriğine bağlı olarak nötral ve asidik gruplar olarak sınıflandırılır (Jones, 1977). Asidik musinler, 5 alt grupta incelemek mümkündür. Güçlü Sülfatlı Bağ Doku Musinleri, düşük ph değeri sayesinde elverişli katyonik boyalarla ve çoğu kez PAS negatif olduğu zaman standart oksidasyon periyodunda tepki gösterirler. Fibroblastlar, endotelyal hücreler, osteositler, chondrositler ve mast hücreleri gibi çeşitli hücreler bu yüksek sülfatlı maddeleri üretirler. Güçlü Sülfatlı Epitelyal Musinler, epitelyal kökenlidir ve histokimyasal olarak düşük ph değerleri sayesinde katyonik boyalarla sülfat bağ dokusu musinleri gibi tepki gösterirler fakat PAS kullanılarak mevcudiyeti anlaşılabilir. Zayıf Sülfat Epitelyal Musinleri (Sulfomusin), Alcian blue sayesinde alışılmamış tekniklerle boyanması ve otoradyolojik tekniklerle doğruluğu kavranabilir. Tracheobronkial mukus bezleri bu partüküler musinlere örnek olarak gösterilebilir. Sialomusinler, nöraminik asit türevlerini içeren epitelyal orjinli musinlerdir. Bunlar tek veya daha yaygın olarak, diğer asidik ve nötral tip musinlerle karışım halinde bulunur (Bancroft vd., 1996). Hematopoetik bölgelerdeki hücre proliferasyonu, farklılaşması ve apoptozisin düzenlenmesinde bir reseptör olarak görev yapar (Verfaillie, 1998; Levesque vd., 1999; Watt ve Chan, 2000). Sülfatlı Sialomusinler, ya tek olarak ya da nadiren sülfomusinler ve sialomusinlerin 14
23 karışımı halinde bazı durumlarda bulunurlar. Histokimyasal olarak sülfatlı siolomusinler (Zayıf sülfatlı musinler hariç) reaksiyon vermeleriyle karakterize edilirler (Bancroft vd., 1996). Nötral Musin tiplerinde hekzos grupları ile ilişkili çeşitli hekzoaminlerden, asidik olmayan reaktif grupları bulunur. Bunlar epitelyaldir ve solunum kanalı goblet hücrelerinden salgılanırlar (Bancroft vd., 1996). Seröz hücreler diğer glikoprotein salgılayan hücrelerdir ve bu hücreler esas olarak nötral tipte glikoprotein üretirler (Forrest ve Lee, 1991). Alcian blue-pas tekniği, asit müsinleri nötral müsinlerden ayıran en uygun yöntemlerden biridir. Bu yöntemle asit müsinler mavi, nötral müsinler kırmızı ve mikst olanlar mor renkte boyanır (Bancroft ve Cook, 1984). Bu çalışmada bazı omurgalı türlerinde (Keçi= Capra aegagrus hircus, Sığır= Bos primigenius taurus, Bıldırcın= Coturnix coturnix, Serçe= Passer domesticus, Rat= Rattus norvegicus, Tavşan= Oryctolagus cuniculus) gırtlak=larinks, soluk borusu=trake ve bronş=bronkus mukozalarının histolojik yapı ve histokimyasal karakterlerinin belirlenmesi amaçlanmıştır. 15
24 3. MATERYAL VE YÖNTEM Bu çalışmada bazı erişkin omurgalı türlerine (keçi= Capra aegagrus hircus, sığır= Bos primigenius taurus, bıldırcın= Coturnix coturnix, serçe= Passer domesticus, rat= Rattus norvegicus, tavşan= Oryctolagus cuniculus) ait larinks, trake ve bronkuslardan alınan doku örnekleri materyal olarak kullanıldı. Örnekler %10 luk formaldehit solüsyonunda 24 saat süreyle tespit edildi. Rutin histolojik doku takibinden geçirilecek olan örnekler, parafinde bloklandı. Histokimyasal yapının belirlenmesinde kullanılan boyaların ph ının belirlenesi için ph metre kullanıldı. 5 6 mikrometre kalınlığında alınan kesitlere histolojik ve histokimyasal yapının belirlenmesi için çizelge 3.1 de belirtilen boyama teknikleri uygulandı: Çizelge 3.1. Uygulanacak teknik ve belirlenecek mukosubstans tipi PAS (Periodic Acid/ Schiff) AB ph 2.5 M. AB ph 1.0 M. AB ph 0.5 M. AB ph 0.3 M. AB ph 0.06 M. AF ( Aldehyde fuchsin) Okside olabilen visinal diol ve/veya glikojenli glikoproteinlerin belirlenmesi (Mc Manus,1948) Karboksil gruplu (Siyalik veya uranik asit) ve/veya sülfat esterli glikoproteinlerin belirlenmesi (Lev ve Spicer, 1964) O-sülfat esterli glikoproteinlerin belirlenmesi (Lev ve Spicer, 1964) Güçlü sülfatlı glikoproteinlerin belirlenmesi (Lev ve Spicer, 1964) Güçlü sülfat ve zayıf sülfatlı glikoproteinlerin belirlenmesi (Scott ve Dorling, 1965) Karboksil grup (siyalik asit ya da uranik asit) ya da sülfat esterli glikoproteinlerin belirlenmesi (Scott ve Dorling, 1965) Sülfatlı asidik glikoproteinler belirlenmesi (Gomari, 1952) PAS/AB ph 2.5 M. Nötral ve/veya güçlü asidik glikoproteinlerin belirlenmesi (Mowry, 1956) AF/AB ph 2.5 M. Güçlü sülfatlı glikoproteinlerin belirlenmesi (Spicer ve Mayer, 1960) KOH/PAS Siyalik asitli glikoproteinlerin belirlenmesi (Culling vd., 1976) Hemotoksilen/Eosin Genel histolojik yapının belirlenmesi (Culling vd., 1976) 16
25 4. ARAŞTIRMA BULGULARI 4.1.Histolojik Bulgular Larinks Sığırda (Şekil 4.1) mukoza yüzeyinin lümene doğru çok sayıda gitrintili çıkıntılı yapıya sahip olduğu saptandı. L. epitelyalis te az sayıda goblet hücresi gözlendi. Submukozada yer alan bezlerin tamamının seröz karakter gösterdiği saptandı. Şekil 4.1. Sığır larinksi mukoza yüzeyindeki girintili yapı (ok). HE Yöntemi. x700. Keçide düzgün bir luminal yüzeye sahip olduğu belilenen larinksin, L. epitelyalis inde yerleşim gösteren goblet hücrelerinin sığırdaki ile benzer şekilde az sayıda olduğu ve bezlerin seröz karakterde oldukları gözlendi. Tavşanda mukozal yüzeyin lümene bakan kısmının düzgün görünümde olduğu ve L. epitelyalis teki oldukça az sayıdaki goblet hücrelerinin tek sıra halide düzenli bir yerleşim gösterdiği saptandı. L. epitelyalis te az sayıda yüzeye kadar uzanan heterokromatik çekirdekli hücrelere rastlandı. Bezlerin büyük çoğunluğunun müköz karakterde olduğu ancak az sayıda seröz ve seromüköz bezlerin de bulunduğu saptandı. Ratta (Şekil 4.2) L. epitelyalis in az sayıda invaginasyonlar oluşturduğu belirlendi. Mukoza yüzeyin lümene bakan kısmının düzgün yapılı olduğu gözlendi. Bezlerin belirli bölgelerde topluluk oluşturduğu ve seröz karakter gösterdiği gözlendi. 17
26 Şekil 4.2. Rat larinksi L. epitelyalis indeki inveginasyon (kalın ok) ve mukozal yüzey (ince ok). HE Yöntemi. x700. Bıldırcın (Şekil 4.3) ve serçe larinkslerinin L. epitelyalis lerinin mukoza içerisine doğru çok sayıda invaginasyon oluşturduğu belirlendi. Goblet hücrelerinin çoğunun bu çöküntüler içerisinde gruplar halinde bulunduğu tespit edildi. Ayrıca submukozda seröz bezlere rastlandı. Şekil 4.3. Bıldırcın larinksi L. epitelyalis indeki inveginasyon (ok). HE Yöntemi. x Trake Sığır trakesinde yapılan histolojik incelemelerde mukoza yüzeyinin lümene bakan kısmının düzgün yapılı olduğu, goblet hücrelerinin tek sıra halinde ve düzenli bir yerleşim göstermediği ve çok sayıda olan submukozal bezlerin seröz karakter gösterdiği saptandı. 18
27 Keçide mukoza yüzeyinin sığır trakesinde olduğu gibi düzgün yapılı olduğu tespit edildi. Submukozadaki bezlerin seröz karakterde ve kıkırdağa yakın yerleşim gösterdiği gözlendi. Ayrıca Tunika adventisya ile kıkırdaklar arasındaki bezlerin de seröz karakter gösterdiği belirlendi. Lepitelyalis te goblet hücrelerinin tek sıra halinde düzenli bir yerleşim gösterdiği tespit edildi. Tavşanda goblet hücrelerinin yaygın ve tek sıra halinde düzenli bir dağılım gösterdiği, ancak submukozada bezlere rastlanmadı. Bıldırcında L. epitelyalis in mukoza içerisine doğru çok sayıda invaginasyon oluşturduğu ve goblet hücrelerinin çoğunun bu çöküntüler içerisinde gruplar halinde bulunduğu, az sayıda goblet hücresinin ise yüzey epitelinde yerleşim gösterdikleri belirlendi. Submukozada seröz karakterli bezlere rastlanmadı. Serçede mukozal yüzeyin lümene bakan kısmının düzgün yapılı olduğu (Şekil 4.4) ve goblet hücrelerinin yaygın olarak bulunduğu gözlenirken, submukozada bezlerin bulunmadığı tespit edildi. Şekil 4.4. Serçe trakesi mukozal yüzeyi (ok). HE Yöntemi. x700. Ratta mukozal yüzeyin lümene bakan kısmının girintili çıkıntılı bir yapıya sahip olduğu, L. epitelyalis te goblet hücrelerinin yer yer gruplar halinde bulunduğu (Şekil 4.5) belirlenirken, submukozada bezlere rastlanmadı. 19
28 Şekil 4.5. Rat trakesi L.epitelyalis inde gruplaşmış goblet hücreleri (oklar). HE Yöntemi. x Bronkus Sığır bronkusunun mukoza yüzeyinin lümene bakan kısmının düzgün yapılı olduğu, bezlerin submukozada ve kıkırdağa yakın kısımlarda, özellikle parçalı kıkırdaklar arasında bol miktarda, kümeler şeklinde bulunduğu (Şekil 4.6) ve seröz özellik gösterdiği saptandı. Şekil 4.6. Sığır bronkusunda kıkırdaklar arasındaki kümeleşmiş bezler (oklar). HE Yöntemi. x 300. Keçide kıkırdakların oldukça parçalı olduğu, bezlerin submukoza ile bronkus kıkırdakları arasında ve kıkırdak halkaların üst üste geldiği bölgelerde, yerleşim gösterdiği belirlendi. Kümeleşme yapan bu bezlerin çoğunun muköz, bazılarının ise 20
29 seröz karakter gösterdiği tespit edildi. L. epitelyalis te goblet hücrelerinin tek sıra halinde düzenli bir yerleşim gösterdiği belirlendi. Bıldırcında L. epitelyalis in mukoza içerisine doğru çok sayıda invaginasyon oluşturduğu belirlendi. Goblet hücrelerinin çoğunun bu çöküntüler içerisinde gruplar halinde, az sayıda goblet hücresinin ise yüzey epitelinde yerleşim gösterdikleri belirlendi. Submukozada seröz karakterli bezlere rastlandı. Serçede L. epitelyalis te bulunan goblet hürelerinin oldukça az sayıda olduğu saptanırken submukozada bezlere rastlanmadı. Ratta trakede olduğu gibi mukozal yüzeyin lümene bakan kısmının girintili çıkıntılı olduğu ve L. epitelyalis deki goblet hücrelerinin yer yer gruplar halinde bulunduğu belirlendi. Submukozada seröz karakterli bezlere rastlandı. 21
30 4.2. Histokimyasal Bulgular Uygulanan histokimyasal boyama yöntemleri sonucunda elde edilen bulguların bölgelere göre dağılım ve yoğunlukları çizelge 4.1 ve çizelge 4.2 de belirtilmiştir AB ph 2.5 Boyaması Larinks Sığır, keçi, tavşan, serçe ve bıldırcın larinksinin bez ve goblet hücrelerinde AB ph 2.5 (Karboksil gruplu (Siyalik veya uranik asit) ve/veya sülfat esterli glikoproteinler) boyamasına karşı çok güçlü reaksiyon gözlenirken, rat larinksinin bez ve goblet hücrelerinde güçlü reaksiyon gözlendi Trake Keçi trakesinin bez ve goblet hücrelerinde, rat, tavşan ve bıldırcın trakesinin goblet hücrelerinde AB ph 2.5 a karşı çok güçlü reaksiyon gerçekleşirken, sığır trakesinin bez ve goblet hücrelerinde ve serçe trakesinin goblet hücrelerinde güçlü reaksiyon gözlendi Bronkus Sığır bronkusunun bez ve goblet hücrelerinde, bıldırcın ve serçe bronkusunun goblet hücrelerinde AB ph 2.5 a karşı güçlü reaksiyon gözlenirken, keçi bronkusunun bez ve goblet hücrelerinde ve rat bronkusunun goblet hücrelerinde çok güçlü reaksiyon gözlendi. Tavşan bronkusunun goblet hücrelerinde ise bu yönteme karşı zayıf reaksiyon gözlendi. 22
31 4.2.2.AB ph 1.0 Boyaması Larinks Sığır (Şekil 4.7.a), tavşan (Şekil 4.7.b), serçe (Şekil 4.7.c) ve bıldırcın (Şekil 4.7.d) larinksinin bez ve goblet hücrelerinde AB ph 1.0 (O-sülfat esterli glikoproteinler) boyamasına karşı çok güçlü reaksiyon gözlenirken, keçi (Şekil 4.7.e) larinksinin bez ve goblet hücrelerinde güçlü reaksiyon tespit edildi. Rat larinksinin goblet hücrelerinde reaksiyonun çok zayıf olduğu belirlenirken bezlerde ise reaksiyona rastlanmadı. Şekil 4.7. Laringeal bezlerde AB ph 1.0 (+) özellik; a: Sığır, b: Tavşan, c: serçe, d: Bıldırcın, e: Keçi, (oklar). x
32 Trake Sığır (Şekil 4.8.a), keçi (Şekil 4.8.b), bıldırcın (Şekil 4.8.c), serçe (Şekil 4.8.d) ve rat (Şekil 4.8.e) trakesinin goblet hücrelerinde AB ph 1.0 a karşı güçlü, tavşan (Şekil 4.8.f) trakesi goblet hücrelerinde ise zayıf reaksiyon gözlendi. Ayrıca sığır (Şekil 4.9.a) ve keçi (Şekil 4.9.b) trakesinin bezlerinde güçlü reaksiyon gözlendi. Şekil 4.8. Trake goblet hücrelerinde AB ph 1.0 (+) özellik; a: Sığır, b: Keçi, c: Bıldırcın, d: Serçe, e: Rat, f: Tavşan, (oklar). x700. Şekil 4.9. Trakeal bezlerde AB ph 1.0 (+) özelik; a: Sığır, b: Keçi, (oklar). x
33 Bronkus Keçi (Şekil 4.10.a) bronkusunun bezlerinde güçlü, sığır (Şekil 4.10.b) bronkusunun bezlerinde ise zayıf AB ph 1.0 (+) reaksiyon gözlendi. Keçi ve sığır (Şekil 4.11.a) bronkusunun goblet hücrelerinde güçlü, serçe (Şekil 4.11.b) bronkusunun goblet hücrelerinde AB ph 1.0 a karşı zayıf reaksiyon gözlendi. Rat bronkusunun goblet hücrelerinde çok zayıf reaksiyon tespit edilirken, tavşan ve bıldırcında AB ph 1.0 (+) reaksiyon gözlenmedi. Şekil Bronkus bezleri AB ph 1.0 (+) özellik; a: Keçi, b: Sığır, (oklar). x700. Şekil Bronkus goblet hücrelerinde AB ph 1.0 (+) özelik; a: Sığır, b: Serçe, (oklar). x
34 AB ph 0.5 Boyaması Larinks Bıldırcın (Şekil 4.12.a) ve tavşan (Şekil 4.12.b) larinksinin bez ve goblet hücrelerinde AB ph 0.5 (Güçlü sülfatlı glikoproteinler) boyamasına karşı çok güçlü reaksiyon gözlenirken, serçe (Şekil 4.12.c) larinksinin bez ve goblet hücrelerinde güçlü reaksiyon gözlendi. Sığır (Şekil 4.12.d) ve rat (Şekil 4.12.e) larinksinin bez ve goblet hücreleri ile keçi (Şekil 4.12.f) larinksinin bezlerinde zayıf reaksiyon belirlenirken, keçi goblet hücrelerinde reaksiyon gözlenmedi. Şekil Laringeal bezlerde AB ph 0.5 (+) özellik; a: Bıldırcın, b: Tavşan, c: Serçe, d: Sığır, e: Rat, f: Keçi, (oklar). x Trake Sığır (Şekil 4.13.a), keçi (Şekil 4.13.b), tavşan (Şekil 4.13.c), bıldırcın (Şekil 4.13.d) ve serçe (Şekil 4.13.e) trakesinin goblet hücrelerinde AB ph 0.5 e karşı zayıf 26
35 reaksiyon gözlendi. Rat trakesinin goblet hücrelerinde ise reaksiyon gözlenmedi. Sığır (Şekil 4.14.a) trakesinin bezlerinde zayıf, keçi (Şekil 4.14.b) trakesinin bezlerinde ise güçlü reaksiyon gözlendi. Şekil Trake goblet hücrelerinde AB ph 0.5 (+) özellik; a. Sığır, b: Keçi, c: Tavşan, d: Bıldırcın, e: Serçe, (oklar). x700. Şekil Trakeal bezlerde AB ph 0.5 (+) özellik; a: Sığır, b: Keçi (oklar). x
36 Bronkus Sığır bronkusunun bez ve goblet hücrelerinde, keçi (Şekil 4.15.a) bronkusunun bezlerinde ve tavşan (Şekil 4.15.b), bıldırcın (Şekil 4.15.c), serçe (Şekil 4.15.d) bronkusunun goblet hücrelerinde AB ph 0.5 e karşı çok zayıf reaksiyon belirlenirken, rat bronkusunun bez ve goblet hücreleri ile keçi bronkusunun goblet hücrelerinin AB ph 0.5 (-) karakterde olduğu tespit edildi. Şekil Bronkus goblet hücresi AB ph 0.5 (+) özellik; a:keçi, b: Tavşan, c: Bıldırcın, d: serçe, (oklar). x AB 0.3 M ve AB 0.06 boyaması Çalışılan türlerin larinksinin belirtilen bölgelerinde (epitel, bez ve goblet hücreleri) AB 0.3 ve AB 0.06 boyamalarına karşı reaksiyon gözlenmedi PAS ve AF Boyaması Larinks Çalışılan türlerin larinksinin belirtilen bölgelerinde (epitel, bez ve goblet hücreleri) PAS (Okside olabilen visinal diol ve/veya glikojenli glikoproteinler) ve AF (Sülfatlı asidik glikoproteinler) boyamalarına karşı reaksiyon gözlenmedi. 28
37 Trake Yapılan PAS boyamasına karşı serçe trakesinin goblet hücrelerinde zayıf reaksiyon gözlenirken, çalışılan diğer türlerin belirtilen bölgelerinde (epitel, bez ve goblet hücreleri) reaksiyon gözlenmedi. Çalışılan türlerin trakelerinin belirtilen bölgelerinde AF (+) karakterli mukosubstanslara rastlanmadı Bronkus Sığır ve keçi bronkusunun bez ve goblet hücrelerinde PAS yöntemine karşı gerçekleşen reaksiyonun çok güçlü olduğu, bıldırcın ve serçe bronkusunun goblet hücrelerindeki reaksiyonun ise güçlü olduğu gözlendi. Rat ve tavşan bronkusunun goblet hücrelerinde ise zayıf PAS (+) reaksiyonunun olduğu belirlendi. Çalışılan türlerin belirtilen bölgelerinde AF boyamasına karşı reaksiyon gözlenmedi PAS/AB ph 2.5 Boyaması Larinks Yapılan PAS/AB ph 2.5 kombinasyon boyama yönteminde, sığır (Şekil 4.16.a), serçe (Şekil 4.16.b), bıldırcın (Şekil 4.16.c), larinksinin bez ve goblet hücrelerinde ve keçi (Şekil 4.16.d) larinksinin bezlerinde AB ph 2.5 un çok güçlü, rat (Şekil 4.16.e) ve tavşan (Şekil 4.16.f), larinksinin bez ve goblet hücrelerinde ise AB ph 2.5 in güçlü olarak baskın olduğu gözlendi. Keçi larinksinin goblet hücrelerinde ise zayıf olarak AB ph 2.5 in baskın olduğu gözlenmiştir. 29
38 Şekil Laringeal bezlerde PAS/AB ph 2.5 boyamasında AB baskın özellik, a: Sığır, b: Serçe, c: Bıldırcın, d: Keçi, e: Rat, f: Tavşan (oklar). x Trake Sığır (Şekil 4.17.a) ve keçi (Şekil 4.17.b) trakeal bezleri ile çalışılan bütün türlerin goblet hücrelerinde (Şekil 4.18.a,b,c,d,e,f) karboksil gruplu (AB ph 2.5) mukosubstanslaarın nötral (PAS) mukosubstanslara göre daha baskın oldukları tespit edildi. Şekil Trakeal bezlerde PAS/AB ph 2.5 boyamasında AB baskın özellik; a: Sığır, b: Keçi, (oklar). x
39 Şekil Trake goblet hücrelerinde PAS/ AB ph 2.5 boyamasında AB baskın özellik; a: Sığır, b: Keçi, c: Rat, d: Tavşan, e: Bıldırcın, f: Serçe, (oklar). x Bronkus Yapılan PAS/AB ph 2.5 kombine boyama sonucunda keçi (Şekil 4.19.a) ve sığır (Şekil 4.19.b) bronkus bezlerinin, sığır (Şekil 4.20.a), tavşan (Şekil 4.20.b), keçi (Şekil 4.20.c), ve serçe bronkusunun goblet hücrelerinin hem karboksilli hem de nötral mukosubstansları içerdiği, rat (Şekil 4.20.d) ve bıldırcın (Şekil 4.20.e) bronkusunun goblet hücrelerinde ise AB ph 2.5 in baskın olduğu belirlendi. 31
40 Şekil Bronkus bezlerinde PAS/AB ph 2.5 (+) özelik; a: Keçi, b: Sığır, (oklar). x700. Şekil Bronkus goblet hücrelerinde PAS/AB ph 2.5 (+) özellik; a: Sığır, b: Tavşan, c: Keçi, d: Rat, e: Bıldırcın, (oklar). x AF/AB ph 2.5 Boyaması Larinks Yapılan AF/AB ph 2.5 kombine boyamasında çalışılan türlerin tümünde larinkslerinin bez ve goblet hücrelerinde AB ph 2.5 in baskın olduğu gözlendi. 32
41 Trake Çalışılan türlerin trakelerinin bez ve goblet hücrelerinde karboksil gruplu mukosubstansların sülfatlı asidik mukosubstanslara göre daha yoğun oldukları belirlendi Bronkus Sığır ve keçi bronkuslarının bez ve goblet hücrelerinde, rat, tavşan, bıldırcın ve serçe bronkuslarının goblet hücrelerinde AB ph 2.5 in baskın olduğu tespit edildi KOH/PAS Larinks Yapılan KOH/PAS (Siyalik asitli glikoproteinler) boyamasında sığır (Şekil 4.21.a), keçi, bıldırcın (Şekil 4.21.b), ve serçe (Şekil 4.21.c), larinksinin bez ve goblet hücrelerinde çok güçlü reaksiyon gözlenirken, rat larinksi bez ve goblet hücrelerinde güçlü, tavşan (Şekil 4.21.d), larinksi bez ve goblet hücrelerinde ise zayıf reaksiyon gözlendi. Şekil Laringeal bezlerde KOH/ PAS (+) özellik; a: Sığır, b: Bıldırcın, c: Serçe, d: Tavşan (oklar). x
42 Trake Sığır (Şekil 4.22.a) trakesinin bezlerinde, keçi (Şekil 4.23.a), sığır (Şekil 4.23.b) ve bıldırcın (Şekil 4.23.c) trakesinin goblet hücrelerinde KOH/PAS uygulamasına karşı çok güçlü reaksiyon gözlendi. Serçe ve rat (Şekil 4.23.d) trakesinin goblet hücrelerinde zayıf, tavşan (Şekil 4.23.e) trakesinin goblet hücrelerinde ise çok zayıf reaksiyon belirlendi. Şekil 4.22.Trakeal bezlerde KOH/PAS (+) özellik. a.sığır (ok). x700. Şekil Trake goblet hücrelerinde KOH/PAS (+) özellik. a.sığır, b. Keçi, c. Tavşan, d. Rat, e. Bıldırcın (oklar).x
43 Bronkus Keçi (Şekil 4.24.a) ve sığır (Şekil 4.24.b) bronkuslarının bezlerinde, keçi (Şekil 4.25.a), sığır (Şekil 4.25.b), bıldırcın (Şekil 4.25.c) ve serçe bronkuslarının goblet hücrelerinde çok güçlü reaksiyon belirlenirken, rat ve tavşan (Şekil 4.25.d) bronkuslarının goblet hücrelerinde zayıf reaksiyon tespit edildi. Şekil Bronkus bezlerinde KOH/PAS (+) özellik; a: Keçi, b: Sığır, (oklar) x700 Şekil Bronkus goblet hücrelerinde KOH/PAS (+) özellik; a: Keçi, b: Sığır, c: Bıldırcın, d: Tavşan (oklar). x
44 Çizelge 4.1. Mukosubstansların sığır, keçi ve rat ın larinks, trake ve bronkuslarında dağılımı ve yoğunlukları Sığır Keçi Rat Larinks Trake Bronkus Larinks Trake Bronkus Larinks Trake Bronkus Epit. Bez G.H. Epit. Bez G.H. Epit. Bez G.H. Epit. Bez G.H. Epit. Bez G.H. Epit. Bez G.H. Epit. Bez G.H. Epit. G.H. Epit. G.H. AB ph AB ph AB ph AB ph AB ph PAS PAS/AB ph AB b AB b ---- AB b AB b --- eb eb --- AB b AB b --- AB b AB b --- eb eb --- AB b AB b --- AB b --- AB b AF AF/AB ph AB b AB b ---- AB b AB b --- AB b AB b --- AB b AB b --- AB b AB b --- AB b AB b --- AB b AB b --- AB b --- AB b KOH/PAS Ept: Epitel, G.H: Goblet hücresi, AB: Alcian Blue, PAS: Periyodik asit/schiff solüsyon, AF: Aldahit fuksin; (+4): Çok güçlü reaksiyon, (+3): Güçlü reaksiyon, (+2): Zayıf reaksiyon, (+1): Çok zayıf reaksion, (---): Reaksiyon yok, b: Baskın, eb: Eş baskın 36
45 Çizelge 4.2. Mukosubstansların tavşan, bıldırcın ve serçe nin larinks, trake ve bronkuslarında dağılımı ve yoğunlukları Tavşan Bıldırcın Serçe Larinks Trake Bronkus Larinks Trake Bronkus Larinks Trake Bronkus Epit. Bez G.H. Epit. G.H. Epit. G.H. Epit. Bez G.H. Epit. G.H. Epit. G.H. Epit. Bez G.H. Epit. G.H. Epit. G.H. AB ph AB ph AB ph AB ph AB ph PAS PAS/AB ph AB b AB b --- AB b --- AB b --- AB b AB b --- AB b --- AB b --- AB b AB b --- AB b --- eb AF AF/AB ph AB b AB b --- AB b --- AB b --- AB b AB b --- AB b --- AB b --- AB b AB b --- AB b --- AB b KOH/PAS Ept: Epitel, G.H: Goblet hücresi, AB: Alcian Blue, PAS: Periyodik asit/schiff solüsyon, AF: Aldahit fuksin; (+4): Çok güçlü reaksiyon, (+3): Güçlü reaksiyon, (+2): Zayıf reaksiyon, (+1): Çok zayıf reaksion, (---): Reaksiyon yok, b: Baskın, eb: Eş baskın 37
46 5. TARTIŞMA Bu çalışmada çalışılan türlerin larinks, trake ve bronkuslarının histolojik olarak önemli farklılıklar gösterdiği belirlendi. Bu farklılıkların özellikle mukozal yüzeyin şekli, bezlerin karakteri ve goblet hücrelerinin dağılımları ile ilişkili olduğu saptandı. Larinksin mukozal yüzeyi sığırda girintili çıkıntılı bir yapı sergilerken, keçi ve tavşanda düzgündü. Bıldırcın ve serçede mukozal yüzeyde çok sayıda inveginasyonlar mevcutken, ratta düzgün olan mukozal yüzeyde yer yer inveginasyonlara rastlandı. Laringeal bezler sığır, keçi, rat, bıldırcın ve serçede seröz karakter gösterirken, tavşanda çoğunluğu müköz karakterli olan ve az sayıda seröz ve serömüköz karekterli bezler belirlendi. Sığır, keçi ve rat larinkslerinin goblet hücrelerinin az sayıda olduğu, tavşanda ise oldukça az sayıda olan goblet hücrelerinin bulunduğu, bıldrcın ve serçede ise goblet hücrelerinin inveginasyonlar içinde gruplar halinde bulunduğu belirlendi. Trakenin mukozal yüzeyi sığır, keçi, tavşan, serçe ve ratta düzgün bir yapı sergilerken, bıldırcında mukozal yüzeyde iveginasyonlara rastlandı. Trakeal bezlerin sığır ve keçide bulunduğu ve seröz karakter göstediği belirlendi. Sığır, keçi ve tavşan trakesi goblet hücrelerinin epielide tek sıra halinde gözlenirken, ratta goblet hücrelerinin gruplar halinde, serçede ise yaygın olarak dağılım gösterdiği saptandı. Bronkusların mukozal yüzeyi sığır, keçi ve serçede düzgün, ratta ise girintili çıkıntılı bir yapıda olduğu belirlendi. Sığır ve keçi bronkuslarında belirlenen bezlerin sığırda seröz, keçide müköz karakter gösterdiği ve gruplar şeklinde bulundukları saptandı. 38
47 Hamsterda larinks ve trake birleşme yerinin dışında bezlerin bulunmadığı bildirilmiştir (Widdicombe vd., 2000). Mochizuki vd. (1982) nin rat, Pastor vd., (2005) nin insan laringeal bezler üzerine yapmış oldukları çalışmalar sonucunda larinkste bol miktarda seröz ve müköz karakterli bezlerin bulunduğunu belirtmişlerdir. Bu çalışmada ise ratta bezlerin larinksin belirli bölgelerinde toplandığı ve bu bezlerin seröz karakter gösterdiği belirlendi. Ayrıca bu çalışmada sığır ve keçi larinksinde yer alan bezlerin de seröz karakterli olduğu saptandı. Bonte vd. (1969) ile Hallen vd. (1996) tavşanlarda elde ettikleri bulgularla uyumlu olarak bu çalışmada da tavşan larinksinde de müköz ve seröz bezlerin bulunduğu tespit edildi. Demirkan vd. (2007) nin yapmış oldukları çalışmada bıldırcın larinksinin L. propria sı ve submukozasında serömuköz bezlerin bulunduğunu bildirmişlerdir. Bu çalışmada ise bıldırcın larinksinin submukozasında seröz bezlerin bulunduğu tespit edidi. Trakeal bezlere yönelik olarak farklı hayvan türlerinde yapılan çalışmalarda bu bezlerin mukozal yerleşimlerinde farklılıklar bulunduğu belirtilmektedir. Kedi (Jeffery, 1978) trakesinde submukozal bezlerin çok fazla olduğu, geyik (Jeffery, 1978) ve tavşan (Widdicombe vd., 2000) trakesinde ise submukozal bezlerin bulunmadığı bildirilmiştir. Bu çalışmada da araştırıcıların (Jeffery, 1978; Widdicombe vd., 2000) bulgularıyla uyumlu olarak tavşan trakesinde bezlere rastlanmadı. Ratlarda ise ilk üç trakeal halkanın arasında ve çevresinde yaygın olmakla beraber trakenin diğer bölgelerinde de çok nadir olarak bezlerin bulunduğu açıklanmaktadır (Choi vd., 2000). Jones vd. (1973); Hayashi vd. (1979); Spicer vd. (1982); Ohtsuka vd. (1997) nin yapmış oldukları çalışmada rat trakesinin üst bölümünde bezlerin yaygın olduğunu belirtmişlerdir. Çınar ve Yavaş (2008) ın albino farede yapmış oldukları çalışmada trakeal bezlerin kıkırdak halkaları arasında ve çevresinde yerleşim gösterdiklerini bildirmişlerdir. Araştırıcıların (Jones vd.,1973; Hayashi vd., 1979; Spicer vd., 1982; Ohtsuka vd., 1997; Choi vd., 2000; Çınar ve Yavaş, 2008) bulgularıyla zıt olarak bu çalışmada ratların trakesinde submukozal bezlere rastlanmadı. Fareler üzerinde yapılan çalışmada goblet hücrelerinin solunum yolu boyunca düzensiz olarak dağıldığı (Olesen vd.,1987), kedi trakesinde goblet hürelerinin bol 39
48 miktarda bulunduğu ve geyik trakesinde ise bu hücrelere rastlanmadığı bildirilmiştir (Jeffery, 1978). Çınar ve Yavaş (2008) Albino fare üzerinde yapmış oldukları çalışmada goblet hücrelerinin trake L. epitelyalisinde bol miktarda bulunduğunu bildirmişlerdir. Bu çalışmada da sığır trakesi goblet hücrelerinin tek sıra halinde düzgün bir yerleşim göstermediği, keçi ve tavşan trakesininde ise goblet hücrelerinin tek sıra halinde düzgün bir yerleşim gösterdiği, ratta ise bu hücrelerin yer yer gruplar halinde oldukları belirlendi. Farklı türlerde yapılan çalışmalar sonucunda insan, at, maymun, evcil domuz ve koyun bronkusunda submukozal bezlerin bulunduğu ancak albino rat bronkusunda submukozasında bu bezlerin bulunmadığı bildirilmişitir (Rolanda vd., 1964). Bu çalışmada ise araştırıcıların (Rolanda vd., 1964) bulgularıyla benzer olarak sığır ve keçi bronkuslarında submukozal bezlerin bulunduğu, rat ve tavşanda ise bu bezlerin bulunmadığı tespit edildi. Aynı araştırıcıların (Rolanda vd., 1964) çalıştıkları türlerden sadece evcil domuz bronkusunda goblet hücrelerinin bulunmadığını bildirmelerine karşın, bu çalışmada çalışılan bütün türlerin bronkus epitelinde goblet hücrelerine rastlandı. Solunum yolu epitelinin hidrasyonu ve korunmasında önemli bir rol oynayan mukus, goblet hücreleri ve submukozal bezlerden salgılanır. Epitel hücre yüzeyinde yer alan mukus glikoproteinleri, submukozal bezlerdekine göre galaktoz ve N- asetilglukozamine bağlı bol sialik asit ve oldukça az sülfatlı glikoproteinleri içerir (Sherman vd., 1981). Mukus goblet hücreleri karboksilli, sülfatlı ve nötral kompleks karbohidratları ile uçlarda galaktoza bağlı sialik asid taşıyan oligosakkarid zincirleri içeren glikoproteinleri içerir (Zaccone, 1983). Bu çalışmada çalışılan türlerin larinks, trake ve bronkuslarının histokimyasal olarak önemli faklılıklar gösterdiği belirlendi. Larinks ve trake epitelinde ugulanan histokimyasal boyamalara karşı hiçbir reaksiyon gözlenmezken, laringeal ve trakeal bezlerde ve goblet hücrelerinde güçlü olarak asidik mukosubstansların varlığı belirlendi. Larinks ve trake epitel, bez ve goblet hücrelerinde nötral mukosubstanslara rastlanmadı. 40
49 Çalışılan türlerin larinks ve trakelerindeki histokimyasal bulgulardan farklı olarak bronkus goblet hücrelerinde, sığır ve keçi bronşial bezlerinde nötral mukosubstansların bulunduğu belirlendi. Mochizuki vd. (1982) rat solunum sistemi üzerine yapmış oldukları çalışmada laringeal bezlerin yoğun olarak nötral ve sülfatlı, daha az yoğunlukta da siyalik asitli glikopretein içerdiklerini bildirmişlerdir. İnsan submukozal laringeal bezlerinde yapılan çalışmada seröz ve müköz bez hücrelerinin siyalosülfomusinleri ürettiği belirtilmektedir (Pastor vd., 2005). Bu çalışmada ise rat laringeal bezlerinde güçlü olarak karboksil gruplu (siyalik veya uranik asitli) ve /veya sülfat esterli ve siyalik asitli glikoproteinlerin, zayıf olarakta O- sülfat esterli glikoproteinlerin varlığı tespit edildi. Kuluçkadan sonra 21 günlük bıldırcın laringeal bezlerinin karboksil gruplu ve nötral mukosubstanları içerdiği açıklanmaktadır (Liman vd., 2001). Bu çalışmada ise araştırıcıların bulgusuyla uyumlu olarak serçe ve bıldırcın laringeal bez içeriğinin AB ph 2.5 (+) özellikte olduğu saptandı. Ancak bezlerde nötral mukosubstansa rastlanmadı. Bıldırcın (Liman vd., 2001) laringeal bezlerinde sialomusinlerin, zayıf sülfatlı epitelyal musinlerin ve zayıf olarak ta nötral musinlerin olduğunu bildirmiştir. Bu çalışmada ise araştırmacıların (Liman vd., 2001) bulgularıyla benzer şekilde bıldırcın laringeal bezlerinde sialomusinlerin bulunduğu ancak nötral ve zayıf sülfatlı epitelyal musinlerin bulunmadığı belirlendi. Ayrıca bıldırcın laringeal bezlerinde güçlü olarak karboksil gruplu, güçlü sülfatlı ve O-sülfat esterli mukosubstansların bulunduğu tespit edildi. Kedi, geyik (Jeffery, 1978) ve keçi (Kahwa ve Purton, 1996) trakesinde yapılan çalışmalarda, mukusun önemli bir rezervini oluşturan goblet hücrelerinin sülfat esterli (Asidik mukosubstans) mukosubstansları, deve (Raji ve Naserpowr, 2006) trakesi goblet hücrelerinin hem asidik hem de nötral tipte mukosubstans ürettiği bildirilmiştir. Bu çalışmada araştırıcıların (Jeffery, 1978; Kahwa ve Purton, 1996; Raji ve Naserpowr, 2006) bulgularıyla benzer şekilde trakeal bezler ve goblet hücrelerinde asidik mukosubstanslar belirlendi. Ancak Raji ve Noserpowr (2006) tarafından bildirildiği gibi belirtilen bölgelerde nötral mukosubstanslara rastlanmadı. Vajner vd. (2001a, 2001b) yapmış oldukları çalışmada tavşan trakesi goblet hücrelerinin bol miktarda sülfat esterli, az miktarda sialik asit içeren ve çok az 41
50 miktarda nötral mukosubstans ürettiğini bildirmişlerdir. Bu çalışmada da tavşan trakesinde elde edilen bulgularla benzer bulgular elde edildi. Albino farede yapılan çalışmada güçlü asidik ve az miktarda nötral mukosubstans içeren goblet hücrelerinin varlığı bildirilmektedir (Çınar ve Yavaş, 2008). Çınar ve Yavaş (2008) ın bulgularıyla benzer şekilde ratta trakeal goblet hücrelerinin asidik mukosubstans içerdiği ancak buna karşın nötral mukosubstanslara rastlanmadı. Macaca maymununun (Heidsiek vd., 1987) trakesinde yapılan çalışmada trake içindeki toplam salgı ürünlerinin hem asidik hem de nötral tipte mukosubstans içerdiği bildirilmektedir. Bu çalışmada ise araştırmacıların (Heidsiek vd., 1987) bulgularının aksine çalışılan türlerin hiçbirinde trake epitelinde mukosubstansa raslanmadı. Ayrıca sığır ve keçi trakeal bezlerinde asidik mukosubstanslara rastlanırken nötral mukosubstanslara rastlanmadı. Kedi (Sherman vd., 1981) trakesinde yapılan çalışmada yüzey epitelinden salgılanan musinin siyalik asit içerdiği, submukozal bezlerden salgılanan musinlerin ise daha çok sülfomusinlerden oluştuğu bildirilmiştir. Yaban gelinciği (Jacop ve Poddar, 2004) trakesinde submukozal bezlerin nötral musinler açısından baskın olduğu, az miktarda da sülfo ve sialomusinlerin bulunduğu belirtilmektedir. Bu çalışmada ise çalışılan türlerde trake yüzey epitelinin siyalik asitli, sülfatlı ve nötral müsinler içermediği, ancak çalışılan türlerden sadece sığır ve keçide trakeal bezlerde sialomusinlerin varlığı tespit edildi. Çınar ve Yavaş (2008) albino farede yaptıkları çalışmada trake epitel ve bezlerinden bol miktarda karboksil gruplu (Siyalik veya uranik asit) ve/veya sülfat esterli glikoproteinler, az miktarda sülfatlı ve nötral musin ürettiğini belirtmişlerdir. Bu çalışmada ise çalışılan türlerden rat trakesinin yüzey epitelinde karboksil gruplu, sülfatlı ve nötral musinlere rastlanmadı. Çınar ve Yavaş (2008) albino fare bronkus epitel, bez ve goblet hücrelerinin güçlü olarak, karboksil gruplu (Siyalik veya uranik asit) ve/veya sülfat esterli, zayıf olarak güçlü sülfatlı, sülfatlı ve nötral glikoproteinler içerdiğini bildirmektedirler. Bu çalışmada ise rat bronkus epitelinin karboksil gruplu, güçlü sülfatlı, sülfatlı ve nötral glikopreteinleri içermediği ancak goblet hücrelerinin karboksil gruplu ve nötral glikoproteinleri içerdiği tespit edildi. 42
51 Plopper vd. (1988) tavşan bronkus mukus bezlerinde az miktarda okside olabilen visinol diol ve/veya glikojenli glikoproteinler bulunduğunu bildirmişlerdir. Araştırıların (Plopper vd., 1988) bulgularıyla benzer şekilde tavşan bronkusunun goblet hücrelerinin az miktarda nötral glikoprotein içrdiği tespit edildi. Jacop ve Podder (1982, 2004) yaban gelinciğinde trakeobronşial submukozal bez ve goblet hücrelerinde nötral mukosubstansların asidik mukosubstanslara baskın olduğunu ve ayrıca sülfatlı ve sialomusinlerin bulunduğunu ancak sialomusinlerin goblet hücrelerinde daha az yoğunlukta olduklarını bildirmişlerdir. At (Rolanda vd., 1964) bronkus submukozal bezlerinde asidik ve nötral mukosubstansların karışım halinde bulunduğu, insan (Lamb ve Red, 1972) bronkus submukozal bezlerinin asidik mukosubstans içerdiği, maymun (Plopper, 1988) bronkus goblet hücrelerinin fazla miktarda sülfomusin ve bezlerin nötral mukosubstans içerdiği bildirilmiştir. Araştırıcılar (Rolanda vd., 1964) evcil domuz bronkus bezlerinin PAS ve AB ph 2.5 (+), köpek bronkus bezlerinin ise PAS (-) ve AB ph 2.5 (+) olduğunu belirtmişlerdir. Bu çalışmada ise sığır bronkus bezlerinde asidik mukosubstansların baskın olduğu, keçide ise PAS ve AB ph 2.5 (+) materyalin eşit yoğunlukta olduğu tespit edildi. Ancak bu çalışmada sığır ve keçinin bronkuslarının epitel ve goblet hücrelerinde AF (+) mukosubstansa rastlanmadı. Ayrıca araştırıcıların (Jacop ve Podder, 1982; Plopper, 1988) bulgularıyla benzer şekilde bronkusların submukozal bezleri ve goblet hücrelerinde sialik asit karakterli mukosubstans belirlendi. 6. SONUÇ Bu çalışmada elde edilen bulgulara göre, mukosubstansların yoğunluğu türlerde farklılık göstermektedir. Larinks, trake ve bronkusta daha yoğun olarak karboksil gruplu (siyalik ve uranik asit) ve/ veya sülfat esterli, O-sülfat esterli ve Siyalik asitli glikoproteinlerin bulunduğu, ayrıca bronkusta diğer çalışılan bölgelere göre daha yoğun olarak nötral musinlerin bulunduğu sonucuna varılmıştır. Çalışma sonucunda elde edilen bulguların yapılacak olan diğer histolojik, histokimyasal, histopatolojik ve farmakolojik çalışmalara ışık tutacağı inanmaktayız. 43
52 7. KAYNAKLAR Bancroft JD, Cook HC., Manual of histological techniques. Edinburg. Churchill Livingstone, 52 (111), Bancroft, J.D., Steven, A. And Turner, D.R., Theory and Practice of Histological Techniques. Churchill Livingstone, 129s. New York, London, Edinburg, Madrid, Melbourne, San Franscisco, Tokyo. Bancroft JD, Stevens A. Theory and Practice of Histological Techniques (3 Ed), Techniques Churchill Livingstone 1990: Banks, W.J., Applied Veterinary Histology. Third Edition, St. Louis Baltimore, Boston, Chicago, London, Philadelphia, Sydney, Toronto, Bell, D.J., Freeman, B.M., Physiology and Biochemistry of the Domestic Fowl. Academic Press, London, New York Boat, T.F., Cheng, PW., Biochemistry of airway mucus secretions. Federation proceedings., 39 (13), Bonte, F.J., Stembridge, V.I, Reef, J.D., Effects of ionizing radiation upon the immature rabbit larynx. American Journal of Roentgenology, Radium Therapy and Nuclear Medicine, 105, Brown, R.; Kovacs, C.E.; Butler, J.P.; Wang, N.; Lehr, J.; Banzett, R.B., The Avian Lung: Is There An Aerodynamic Expiratory Valve? The Journal of Experimental Biology., 198, Can. R., Keçeci, H Kafes Kuşlarının Hastalıklarında Teşhis ve Tedavi Yöntemleri. Veteriner Hekimliği Derneği Dergisi, 67, Choi, H.K., Finkbeiner, W.E., Widdicombe, J.H., A comparative study of mammalian tracheal mucous glands. Journal of Anatomy., 197 (3), Cover, M. S., Cross and Microscopic Anatomy of the Respiratory System of the Turkey. American Journal of Veterinary Research., Culling, C.F.A., Reid, and Dunn, W.L., A new histochemical method fort he identification and visualization of both side chain acylated and non-acylated sialic acids. Journal of Histochemistry and Cytochemistry., 24, Çınar, K., Yavaş, C., Albino fare (Mus musculus subsp.) de trakea, bronş ve bronşiol mukozalaının histokimyasal yapısı. S.D.Ü. Tıp Fakültesi Dergisi., 15 (1),
53 Dellman, H.D., Textbook of Veterinary Histology. Fourth Edition. Lea & Febiger, Philadelphia, Demirkan, A.Ç., Hazıroğlu, R.M., Kürtül, İ., Gross morphological and histological features of larynx, trachea and syrinx in japanese quail. Anatomia Histologia Embryologia., 36, Demirsoy, A., Yaşamın Temel Kuramları-Omurgalılar/ Amniyota, Cilt III/ Kısım II. Meteksan A.Ş., 942 s. Ankara. Dellmann HD., Textbook of Veterinary Histology (4 th ed), Lea & Febiger Philadelphia, printed in the United States of America, Doğuer S., Erengin, Z., Evcil Kuşların Komparatif Anatomisi, Ankara üniversitesi Basımevi. Dursun N. Evcil Kuşların Anatomisi (1. baskı), Medisan Yayınevi, ANKARA, 2002: Erbengi, T., Histoloji 2, Güneş kitapevi, 344 s.ankara. Erkoçak, A., Özel Histoloji. İstanbul Üniversitesi Cerrahpaşa Tıp Fakültesi Yayınları, 280 s. Ankara. Fawcett, D.W. Bloom and Fawcett A Textbook of Histology. 11th ed. Philadelphia. WB Saunders company 1986; Fedde, M.R., Relationship of structure and function of the avian respiratory system to disease susceptibility. Poultry Science., 77(8), Forrest, J.B., Lee, R.M.K.W., The Bronchial wall: İntegrated form and function. The Lung: scientific foundations. Raven Press Gnepp DR. Diagnostic Surgical Pathology of the Head and Neck. 1st ed. Philadelphia: WB Saunders; Experimental Study of Bronchial Glands* R Gomari, G., Gomari s Aldehyde Fuchsin stain. In: Cellular Pathology Technique (C.F.A. Culling, R.T. Allison, and W.T. Barr, eds), Butterworths, pp.238. London. Hallen, L., Johansson, C., Laurent, C., Dahlquıst, A., Hyaluronan localization in the rabbit larynx. Anatomical Record., 246, Hayashi, M., Sornberger, G.C., Huber, G.L., Morphometricanalyses of tracheal gland secretion and hypertrophy in male and female rats after experimental exposure to tobacco smoke. American Review of Respiratory Disease., 119,
54 Heidsiek, J.G., Hyde, D.M., Plopper, C.G., Judith, A., George S.T Quantitative histochemistry of mucosubstance in tracheal epithelium of the macaque monkey. The Journal of Histochemistry and Cytochemistry., 35 (4), Houtmeyers, E., Gosselink, R., Gayan-Ramirez, G., Decramer, M., Regulation of mucociliary clearance in health and disease. European Journal of Respiratory., 13, Huxley, E.J., Viroslav, J., Gray, W.P., Pierce, A.K., Pharyngeal aspiration in normal adults and patients with depressed consciousness. American Journal of Medicine., 64, Hodges, R. D.,1974. The Histology of the Fowl. Academic Press. London, New York, San Francisco. http1://www20.uludag.edu.tr/%7eilkin/dersnotlarim.htm. Erişim Tarihi: http2:// Erişim Tarihi: http3://trc.ucdavis.edu/mjguinan/apc100/modules/respiratory/airways/trachea6/trach e.html. Erişim Tarihi: http4://people.eku.edu/ritchisong/birdrespiration.html. Erişim Tarihi: http5://theses.lub.lu.se/postgrad//search.tkl?field_query1=pubid&query1=med_64&r ecordformat=display. Erişim Tarihi: Jacob, S., Poddar, S Mucous cells of the tracheobronchial tree in the ferret. Histochemistry., 73:599. Jacob, S., Poddar, S., Mucous cells of the tracheobronchial tree in the ferret, Biomedical and Life Scienses., 73, Jeffery PK., Structure and function of mucus-secreting cells of cat and goose airway epithelium. Ciba found Symp., 54, Jeffery PK, Li D., Airway mucosa: secretory cells, mucus and mucin genes. European Journal of Respiratory., 10, Jeffery, P. K., D. Gaillard, and T. Moret Human airway secretory cells during development and in mature epithelium. European Journal of Respiratory. 5: Jones, R., Modification of mucus in animal models of disease. Proceedings of International Symposium on Mucus in Helalth and Disease. Raven Pres., pp New York. 46
55 Jones, R., Bolduc. P., Reid, L., Goblet cell glycoprotein and tracheal gland hypertrophy in rat airways: the effect of tobacco smoke with or without the anti-in ammatory agent phenylmethyloxadiazole. British Journal of Experimental Pathology, 54, Junqueira, L.C., Carneiro, J., Kelley, R.O., Basic Histology. 7th ed. Philadelphia. Apleton & Lange 1995; Kahwa, C.K.B., Purton, M., Histological and histochemical study of epithelial lining of the respiratory tract in adult goats, Small Ruminant Research., 2, Kalaycı Ş., Histoloji. Uludağ Üniversitesi Basımevi, Bursa. Kayalı, H., Özel Histoloji. Yorum Basın Yayın Sanayi Ltd. Şti., 213 s. Ankara. Kirchner, J.A., Carter, D., Pathology of the Larynx. In: Mills SE, Carter D, Greenson JK, Oberman HA, Reuter V, Stoler MH, editors., Sternberg's Diagnostic Surgical Pathology. 4thed. Philadelphia: Lippincott Williams & Wilkins, p King, A.S., McLelland, J., Birds their Structure and Function. Second Edition, Bailliere Tindall, London, Philadelphia, Toronto, Mexico City, Rio De Janeiro, Sydney, Tokyo, Hong Kong, King, A. S., Molony, V., The Anatomy of Respiration, Physiology and Biochemistry of the Domestic Fowl. Academic. Press, London, New York, Ed. by Bell, D. J. Freeman, B. M. Kim, K.C., et al., Airway goblet cell mucin: its structure and regulation of secretion. European Journal of Respiratory., 10, Kierszenbaum, A.L., çev: Demir, R., Histoloji ve Hücre Biyolojisi (Patolojiye Giriş). Palme Yayıncılık s, Ankara. Kollerstrom, N., Lord, P.W., Whimster, W.F., A Difference in the composition of bronchial mucus between smokers and non-smokers. Thorax, 32 (2), Kuethe, D.O., Fluid mechanical valving of air flow in bird lungs. Journal of Experimental Biology., 136, Kuru, M., Omurgalı Hayvanlar. Palme Yayıncılık, Ankara. Lamb, D., Reid, L., Quantitative distribution of various types of acid glycoprotein in mucous cells of human bronchi, Biomedical and Life Sciences, 4,
56 Lev, R., Spicer, S.S., Specific staining of sulphate groups eith alcian blue at low ph. Journal of Histochemistry and Cytochemistry., 12, 309. Levesque, J.P, Zannettino, A.C, Pudney, M., Niutta,S., Haylock, S.N, Snapp, K.R, Kansas, G.S., Berndt, M.C., Simmons, P.J., PSGL-1-mediated adhesion of human hematopoietic progenitors to P-selectin results in suppression of hematopoiesis. Immunity, 11, Lewis DJ, Prentice DE The ultrastructure of rat laryngeal epithelia. Journal of Anatomy., 130, Liman N., Bayram G., Koçak M., Histological and histochemical studies on the lingual, preglottal and laryngeal salivary glands of the Japanese quail (Coturnix coturnix japonica) at the post-hatching period. Anatomia Histologia Embryologia., 30 (6): Ludders, J.W Inhaled Anesthesia for Birds. In: Recent Advances in Veterinary Anesthesia and Analgesia: Companion Animals (R. D. Gleed and J. W. Ludders, eds.). International Veterinary Information Service, Ithaca, NY. Maina, J.N. and Africa, M., Inspiratory Aerodynamic Valving In The Avian Lung: Functional Morphology Of The Extrapulmonary Primary Bronchus. The Journal of Experimental Biology., 203, Maina, J.N., Some recent advances on study and understanding of the functional design of the avian lung: morphological and morphometric perspectives. Biologia Reviews., 77(1), Marieb, E.N., Human Anatomy &Physiology. Fifth edition, Addison Wesley Longman, pp USA. Major, O. Y., Antomy and Histology of the Respiratory System of the Fowl (Gallus Domesticus). The Veterinary Bulletin, 37, Maina, J.N., The morphometry of the avian lung. in Form and Function in Birds (A.S. King and J. McLelland, eds.). Academic Press, pp London. Meleod, W. M., Trotter, D. M, Lumb, J. W., Avian Anatomy. Burgess Publishing Company, Minesota. Martini, F.H., Timmans, M.J., McKinley, M.P., Human Anatomy. Third edition, prentice Hall, pp New Jersey. McManus, J.F.A., Histological and histochemical uses of periodic acid. Stain Technol., 23,
57 Mochizuki, I., Setser, M.E., Martinez, J.R., Spicer, S.S., Reproductive System Carbohydrate histochemistry of rat respiratory glands. Anotomy Record., 202 (1), Mountone, A.J., Cataletto, M.B., Mechanical defense, mechanisms of lung. Pulmonary Phisiology. Philadelphia, the Mowry, R.W., Alcian blue techniques for the histochemical study of acidic carbohydrates. Journal of Histochemistry and Cytochemistry., 4, Nickel, R., Schummer, Seiferle, E.,1977. Anatomy of the Domestic Birds. Translation by W.G. Siller and P.A.L. Wight, Verlag Paul Parey, Berlin, Hamburg, Nogueria JC, Godinho HP., Histology and mucosubstances histochemistry of the duodenum in suckling, prepuberal and puberal zebus (Bos indicus). Anatomy Anz., 149, Ohtsuka, R., Doi, K., Itagaki, S., Histological characteristics of respiratory system in Brown Norway rat. Experimental Animals, 46, Olesen KL., Cerkez V., Tos M., Quantitative features of goblet cells in the rat tracheobronchial tree, 64(5): Ozan, H., Bozkurt, M.C., Tağıl, S.M (3.Baskı). Anatomi. Kelebek matbaacılık s. İstanbul. Pastor, L., Ferran, A., Calvoi, A., Sprekelsen, C., Horn, R., Marin, J.A., Morphological and histochemical study of human submucosal laryngeal glands. Respiratory Biology., 239 (4): Phipps, R.J., Production of airway secretions. Seminars in Respiratory Medicine., 5, Plopper, C.G., Heidsiek, J.G., Weir, A. J., George, J. A. St., Hyde, D. M., Tracheobronchial epithelium in the adult rhesus monkey: A quantitative histochemical and ultrastructural study. American Journal of Anatomy., 184:(1), Poiters,W., Lord, P.W., Biles, B., Whimster, W.F., Bronchial gland histochemistry in lungs removed for canser, Thorax, 35 (7), Powell, F.L Respiration in Avian Physiology, fifth edition (G. Causey Whittow, ed.). Academic Press, New York, NY., pp Raji, A.R., Naserpour, M Light and electron microskopic studies of trachea in the one-humped camel (Camelus dromedarius). Anatomia Histologia Embryologia., 36,
58 Reece, W. O Physiology of Domestic Animals. Second Edition, William and Wilkins, Baltimore, Phidelphia, London, Paris, Bankok, Buenos Aires, Hon Kong, M.nich, Sydney, Tokyo, Wroclaw. Rhodin, J.A.G., Ultrastructure and function of the human tracheal mucosa. American Review of Respiratory Disease., 93, Rolando,V., Goca, M.D., Otto, C., Brantigan, M.D., and Milton, B., Kress, M.D., An experimental study of bronchial glands. Diseases of the chest., 46, Rosai J. Rosai and Ackerman s Surgical Pathology. 9th ed Toronto: Mosby Inc. Rose, M.C., Mucins: Function, and role in pulmonary diseases, Lung Cellular and Molecular Physiology, 263, Ross M.H, Romrell LJ, Kaye GI., Histology: A test and atlas (3nd ed). Baltimore, Maryland, USA, Rubin B.K Physiology of airway mucus clearance. Respir Care; 47: Samet, J.M., Cheng, P.W., Pi-Wan, The role of airway Mucus in Pulmonary Toxicology, Environmental Health Perspectives, 102, Scot, J.E., Dorling, J., Differential staining of acid glycosaminoglycans (mucopolysaccharides) by Alcian blue in salt solutions. Histochemie, 21, Sheehan, J.K., Thornton, D.J., Somerville, M., Carlstedt, I., Mucin structure, The structure and heterogeneity of mucin glycoproteins, American Review of Respiratory Disease., 144, 4-9. Sherman, J.M., Cheng, P.W., Tandler, B., Boat, T.F., Mucous glycoproteinsfrom cat tracheal goblet cells and mucous glands separated with EDTA, American Review of Respiratory Disease., 124, Shimizu T., Hirano, H., Shimizu, S., Kishioka, C., Sakakura, Y., Majima, Y., Differential properties of mucous glycoproteins in rat nasal epithelium. American Journal of Respiratory and Critical Care Medicine, 164, Silberg, A., Models of mucus structure. In: Methods in Branchial Mucology, Raveb Pres, New York. Spicer, S.S., Mayer, D.R., Aldehyde Fuchsin/Alcian Blue. In: Cellular Pathology Technique (C.F.A. Culling, R.T.Allison, and W.T. Barr, eds)., pp.233. London: Butterworths. 50
59 Spicer, S.S., Setser, M.E., Mochizuki, I., Simson, J.A.V., The histology and tne structure of glands in the rat respiratory tract. Anatomical Record., 202, Sleigh, M.A., Blake, J.R., Liron, N., The propulsion of mucus by cilia. American Review of Respiratory Disease., 137 (3), Straus, G.J., Dekker, J., Mucin-type glycoproteins, Critical Reviews in Biochemistry and Molecular Biology., 27 (1-2), Stevens A, Lowe J., Human Histology. 2nd ed London, Philadelphia, Sydney. Mosby. Tahamiler, R., Üst Solunum Yolları İnfeksiyonlarında Sitolojik Bulguların Tanı Değeri, Cerrahpaşa Tıp Dergisi. 38: (3 5), Tanyolaç, A., Özel Histoloji, Yorum Basın Yayın Sanayi Ltd. Şti., 213 s., Ankara. Taşbaş, M. Hazıroğlu, M.,Çakır, A. Özer, M., Denizli Horozunun Solunum Sisteminin Morfolojisi III. Pulmo, Sacci Pneumatici. Ankara Veteriner Fakültesi Dergisi., 41(2) Tharnton, D.J., Davies, J.R., Krayanbrink, M., Richardson, P.S., sheehan, J.K., Carlstedt, I., Mucus glycoproteins from normal human tracheobranchial secretions. Journal of Biochemistry., 265, Thornton DJ, Sheehan JK From Mucins to Mucus. Proceedings of the American Thoracic Society., 1, Vajner, L., Konradova, V., Uhlik, J., Zocova, J. 2001a. Mucin histochemistry of tracheal goblet cells after oral admistration of ambroxol. Acta Veterinaria. 70, Vajner, L., Konradova, V., Uhlik, J., Zocova, J. 2001b. The effect of oral administration of salbutamol on the glycoconjugate composition in goblet cells of the tracheal epithelium in rabbit. Veterinary Medicine., 46, Verfaillie,C.M., Adhesion receptors as regulators of the hematopoietic process. Blood, 92, Warner, R. W The Syrinx in Family Columbidae. Journal of Zoology., 166, Watt, S.M, Chan,J.Y-H CD164 a novel sialomucin on CD34+ cells. Leuk Lymphoma, 37,
60 Welty, J.C. and L. Baptista The life of birds, fourth edition. Saunders College Publishing, New York, NY. Wheater, P.R., Burkitt, H.G., Daniel, V.G., Functional Histology, New York, Churchill Livingston. Widdicombe, J.H., Chen, L.L.K., Sporer, H., Choi, H.K., Pecson, I.S., Distribution of tracheal and laryngeal mucous glands in some rodents and the rabbit, Journal of Anatomy., 198, Witek T.J., Schachter EN., Pharmacology and Therapeutics in Respiratory Care. 1st ed. Philadelphia: WB Saunders Comp., Zaccone, G., Histochemical studies of acid proteoglycans and glycoproteins and activities of hydrolytic and oxidoreductive enzymes in the skin epidermis of the fish Blennius sanguinolentus pallas (Teleostei: Blenniidae). Histochemistry, 78(2):
61 ÖZGEÇMİŞ Doğum Tarihi: Doğum Yeri ve yılı: AYDIN / Medeni hali: Evli Yabancı dili: Almanca Eğitim Durumu (Kurum ve Yıl) Lise: Germencik Lisesi Lisans: Süleyman Demirel Üniversitesi Fen Edebiyat Fakültesi Biyoloji Bölümü Yüksek Lisans: Süleyman Demirel Üniversitesi Fenbilimleri Enstitüsü Biyoloji ABD Çalıstığı Kurum/Kurumlar ve Yıl: Adnan Menderes Üniversitesi - Araştırma ve Uygulama Hastanesi Odyoloji Bölümü (Odyometri Teknikeri) Süleyman Demirel Üniversitesi - Eğirdir Su Ürünleri Fakültesi (Memur) 2000 Süleyman Demirel Üniversitesi - Araştırma ve Uygulama Hastanesi Odyoloji Bölümü (Memur/Odyometri Teknikeri) Süleyman Demirel Üniversitesi - Araştırma ve Uygulama Hastanesi Kan Merkezi (Biyolog) Devam ediyor Yayınlar 1- Çınar, K., Yavaş, C Albino fare (Mus musculus subsp.) de trakea, bronş ve bronşiol mukozalaının histokimyasal yapısı. S.D.Ü. Tıp Fak. Derg., 15 (1),
Solunum Sistemi. Havadan aldığı O 2 ni kana verip kandan aldığı CO 2 i havaya veren bir ucu açık öbür ucu kapalı bir sistemdir.
 SOLUNUM SİSTEMİ Solunum Sistemi Havanın içeriye alındığı burun delikleriyle başlar, solunum yollarıyla devam eder ve gaz alış verişinin gerçekleştiği akciğerlerde son bulur. Havadan aldığı O 2 ni kana
SOLUNUM SİSTEMİ Solunum Sistemi Havanın içeriye alındığı burun delikleriyle başlar, solunum yollarıyla devam eder ve gaz alış verişinin gerçekleştiği akciğerlerde son bulur. Havadan aldığı O 2 ni kana
Özofagus Mide Histolojisi
 Özofagus Mide Histolojisi Sindirim kanalını oluşturan yapılar Gastroıntestınal kanal özafagustan başlayıp anüse değin devam eden değişik çaptaki bir borudur.. Ağız, Farinks (yutak), özafagus(yemek borusu),
Özofagus Mide Histolojisi Sindirim kanalını oluşturan yapılar Gastroıntestınal kanal özafagustan başlayıp anüse değin devam eden değişik çaptaki bir borudur.. Ağız, Farinks (yutak), özafagus(yemek borusu),
SOLUNUM SİSTEMİ. 1. Burun Boşluğu (Cavum nasi) 2. Nazofarinks 3. Larinks (Gırtlak) 4. Trakeya (Hava borusu) 5. Akciğerler
 SOLUNUM SİSTEMİ 1. Burun Boşluğu (Cavum nasi) 2. Nazofarinks 3. Larinks (Gırtlak) 4. Trakeya (Hava borusu) 5. Akciğerler Solunum sistemi Solunum sistemi bir ucu açık diğer ucu kapalı bir kanal sistemidir.
SOLUNUM SİSTEMİ 1. Burun Boşluğu (Cavum nasi) 2. Nazofarinks 3. Larinks (Gırtlak) 4. Trakeya (Hava borusu) 5. Akciğerler Solunum sistemi Solunum sistemi bir ucu açık diğer ucu kapalı bir kanal sistemidir.
II.Hayvansal Dokular. b.bez Epiteli 1.Tek hücreli bez- Goblet hücresi 2.Çok hücreli kanallı bez 3.Çok hücreli kanalsız bez
 II.Hayvansal Dokular Hayvanların embriyonik gelişimi sırasında Ektoderm, Mezoderm ve Endoderm denilen 3 farklı gelişme tabakası (=germ tabakası) bulunur. Bütün hayvansal dokular bu yapılardan ve bu yapıların
II.Hayvansal Dokular Hayvanların embriyonik gelişimi sırasında Ektoderm, Mezoderm ve Endoderm denilen 3 farklı gelişme tabakası (=germ tabakası) bulunur. Bütün hayvansal dokular bu yapılardan ve bu yapıların
ABSTRACT ANAHTAR SÖZCÜKLER / KEY WORDS
 I ÖZ Bu çalışmada Kepez/AYDIN dan Haziran 2005 tarihinde toplanan 10 yetişkin L. stellio nun (5, 5 ) sindirim kanalının bir bölümünü oluşturan ince barsak ve kalın barsağının genel histolojik yapısı ortaya
I ÖZ Bu çalışmada Kepez/AYDIN dan Haziran 2005 tarihinde toplanan 10 yetişkin L. stellio nun (5, 5 ) sindirim kanalının bir bölümünü oluşturan ince barsak ve kalın barsağının genel histolojik yapısı ortaya
Burun, anatomik olarak, yüz üzerinde alınla üst dudak arasında bulunan, dışa çıkıntılı, iki delikli koklama ve solunum organı. Koku alma organıdır.
 Burun, anatomik olarak, yüz üzerinde alınla üst dudak arasında bulunan, dışa çıkıntılı, iki delikli koklama ve solunum organı. Koku alma organıdır. Burun boşluğu iki delikle dışarı açılır. Diğer taraftan
Burun, anatomik olarak, yüz üzerinde alınla üst dudak arasında bulunan, dışa çıkıntılı, iki delikli koklama ve solunum organı. Koku alma organıdır. Burun boşluğu iki delikle dışarı açılır. Diğer taraftan
Solunum, genel anlamda canlı organizmada gaz değişimini ifade etmek için kullanılır.
 SOLUNUM SİSTEMLERİ Solunum, genel anlamda canlı organizmada gaz değişimini ifade etmek için kullanılır. 1. Dış Solunum Solunum organlarıyla dış ortamdan hava alınması ve verilmesi, yani soluk alıp vermeye
SOLUNUM SİSTEMLERİ Solunum, genel anlamda canlı organizmada gaz değişimini ifade etmek için kullanılır. 1. Dış Solunum Solunum organlarıyla dış ortamdan hava alınması ve verilmesi, yani soluk alıp vermeye
Solunum yolları Solunum yolları
 Solunum yolları Üst solunum yolları; nasus (burun), pars nasalis pharyngis (burun yutağı) ve larynx (gırtlak) şeklinde, Alt solunum yolları; trachea (soluk borusu), bronşlar (büyük hava yolları), akciğerler
Solunum yolları Üst solunum yolları; nasus (burun), pars nasalis pharyngis (burun yutağı) ve larynx (gırtlak) şeklinde, Alt solunum yolları; trachea (soluk borusu), bronşlar (büyük hava yolları), akciğerler
solunum >solunum gazlarının vücut sıvısı ile hücreler arasındaki değişimidir.
 GAZ ALIŞVERİŞİ O2'li solunum yapan canlıların bazılarında O2'in alınıp CO2'in atılmasını sağlayan yapılar bulunur.bu yapı ve organlar solunum sistemini oluşturur. solunum ------>solunum organlarıyla dış
GAZ ALIŞVERİŞİ O2'li solunum yapan canlıların bazılarında O2'in alınıp CO2'in atılmasını sağlayan yapılar bulunur.bu yapı ve organlar solunum sistemini oluşturur. solunum ------>solunum organlarıyla dış
Solunum Sistemi Fizyolojisi
 Solunum Sistemi Fizyolojisi 1 2 3 4 5 6 7 Solunum Sistemini Oluşturan Yapılar Solunum sistemi burun, agız, farinks (yutak), larinks (gırtlak), trakea (soluk borusu), bronslar, bronsioller, ve alveollerden
Solunum Sistemi Fizyolojisi 1 2 3 4 5 6 7 Solunum Sistemini Oluşturan Yapılar Solunum sistemi burun, agız, farinks (yutak), larinks (gırtlak), trakea (soluk borusu), bronslar, bronsioller, ve alveollerden
DOKU. Dicle Aras. Doku ve doku türleri
 DOKU Dicle Aras Doku ve doku türleri Doku Bazı özel görevler üstlenmiş hücre topluluklarıdır. Bir doku aynı yönde özelleşmiş hücre ve hücreler arası maddelerin bir araya gelmesiyle oluşmuştur. İntrauterin
DOKU Dicle Aras Doku ve doku türleri Doku Bazı özel görevler üstlenmiş hücre topluluklarıdır. Bir doku aynı yönde özelleşmiş hücre ve hücreler arası maddelerin bir araya gelmesiyle oluşmuştur. İntrauterin
11. SINIF KONU ANLATIMI 32 DUYU ORGANLARI 1 DOKUNMA DUYUSU
 11. SINIF KONU ANLATIMI 32 DUYU ORGANLARI 1 DOKUNMA DUYUSU DUYU ORGANLARI Canlının kendi iç bünyesinde meydana gelen değişiklikleri ve yaşadığı ortamda mevcut fiziksel, kimyasal ve mekanik uyarıları alan
11. SINIF KONU ANLATIMI 32 DUYU ORGANLARI 1 DOKUNMA DUYUSU DUYU ORGANLARI Canlının kendi iç bünyesinde meydana gelen değişiklikleri ve yaşadığı ortamda mevcut fiziksel, kimyasal ve mekanik uyarıları alan
Gaz Alışverişi, İnsanda Solunum Sistemi
 A. GAZ ALIŞ VERİŞİ Gaz Alışverişi, İnsanda Solunum Sistemi Canlılarda hayatsal olayların sürdürülebilmesi için gerekli olan enerji hücresel solunumla elde edilir. Genellikle oksijenli olarak gerçekleşen
A. GAZ ALIŞ VERİŞİ Gaz Alışverişi, İnsanda Solunum Sistemi Canlılarda hayatsal olayların sürdürülebilmesi için gerekli olan enerji hücresel solunumla elde edilir. Genellikle oksijenli olarak gerçekleşen
HİSTOLOJİ. DrYasemin Sezgin
 HİSTOLOJİ DrYasemin Sezgin HİSTOLOJİ - Canlı vücudunu meydana getiren hücre, doku ve organların çıplak gözle görülemeyen (mikroskopik) yapılarını inceleyen bir bilim koludur. - Histolojinin sözlük anlamı
HİSTOLOJİ DrYasemin Sezgin HİSTOLOJİ - Canlı vücudunu meydana getiren hücre, doku ve organların çıplak gözle görülemeyen (mikroskopik) yapılarını inceleyen bir bilim koludur. - Histolojinin sözlük anlamı
11. SINIF KONU ANLATIMI 42 SİNDİRİM SİSTEMİ 1 SİNDİRİM SİSTEMİ ORGANLARI
 11. SINIF KONU ANLATIMI 42 SİNDİRİM SİSTEMİ 1 SİNDİRİM SİSTEMİ ORGANLARI Canlılar hayatsal faaliyetlerini gerçekleştirebilmek için ATP ye ihtiyaç duyarlar. ATP yi ise besinlerden sağlarlar. Bu nedenle
11. SINIF KONU ANLATIMI 42 SİNDİRİM SİSTEMİ 1 SİNDİRİM SİSTEMİ ORGANLARI Canlılar hayatsal faaliyetlerini gerçekleştirebilmek için ATP ye ihtiyaç duyarlar. ATP yi ise besinlerden sağlarlar. Bu nedenle
Epitel hücreleri glikokaliks denen glikoprotein örtüsü ile çevrilidir. Epitel hücrelerinin birbirine yapışmasını sağlar. Epitel hücrelerinin üzerine
 EPİTEL DOKU EPİTEL DOKU Birbirine bitişik hücrelerden yapılmıştır. Hücreler arası madde çok azdır. Ektoderm, mezoderm ve endoderm olmak üzere her üç embriyon yaprağından köken alır. Epitel dokusu mitoz
EPİTEL DOKU EPİTEL DOKU Birbirine bitişik hücrelerden yapılmıştır. Hücreler arası madde çok azdır. Ektoderm, mezoderm ve endoderm olmak üzere her üç embriyon yaprağından köken alır. Epitel dokusu mitoz
İSKELET YAPISI VE FONKSİYONLARI
 İSKELET YAPISI VE FONKSİYONLARI 1- Vücuda şekil vermek 2- Kaslara bağlantı yeri oluşturmak ve hareketlerin yapılmasına olanaksağlamak 3- Vücut ağırlığını taşımak 4- Vücudun yumuşak kısımlarını korumak
İSKELET YAPISI VE FONKSİYONLARI 1- Vücuda şekil vermek 2- Kaslara bağlantı yeri oluşturmak ve hareketlerin yapılmasına olanaksağlamak 3- Vücut ağırlığını taşımak 4- Vücudun yumuşak kısımlarını korumak
Apertura thoracis superior (göğüs girişi) Apertura thoracis inferior (göğüs çıkışı) Toraks duvarını oluşturan tabakalar
 solunum sistemi 1 TORAKS (GÖĞÜS) DUVARI Toraks (göğüs) Apertura thoracis superior (göğüs girişi) Apertura thoracis inferior (göğüs çıkışı) Toraks duvarını oluşturan tabakalar Toraks duvarı kasları 2 SOLUNUM
solunum sistemi 1 TORAKS (GÖĞÜS) DUVARI Toraks (göğüs) Apertura thoracis superior (göğüs girişi) Apertura thoracis inferior (göğüs çıkışı) Toraks duvarını oluşturan tabakalar Toraks duvarı kasları 2 SOLUNUM
KULUÇKA SONRASI DÖNEMDE TAVUK (GALLUS GALLUS DOMESTICA) DUODENUM GOBLET HÜCRELERİNİN HİSTOKİMYASAL YAPISI. Dilek DİLER*, Seval KELEK, Kenan ÇINAR
 SDÜ FEN DERGİSİ (E-DERGİ). 2009, 4 (1) 40-53 KULUÇKA SONRASI DÖNEMDE TAVUK (GALLUS GALLUS DOMESTICA) DUODENUM GOBLET HÜCRELERİNİN HİSTOKİMYASAL YAPISI Dilek DİLER*, Seval KELEK, Kenan ÇINAR Süleyman Demirel
SDÜ FEN DERGİSİ (E-DERGİ). 2009, 4 (1) 40-53 KULUÇKA SONRASI DÖNEMDE TAVUK (GALLUS GALLUS DOMESTICA) DUODENUM GOBLET HÜCRELERİNİN HİSTOKİMYASAL YAPISI Dilek DİLER*, Seval KELEK, Kenan ÇINAR Süleyman Demirel
DİCLE ÜNİVERSİTESİ TIP FAKÜLTESİ DÖNEM II. KAN-DOLAŞIM ve SOLUNUM DERS KURULU
 DİCLE ÜNİVERSİTESİ TIP FAKÜLTESİ DÖNEM II KAN-DOLAŞIM ve SOLUNUM DERS KURULU Doç.Dr. Engin DEVECİ Solunum Sistemi Havanın akciğerlere girip çıkması Solunan havadaki oksijenin kandaki karbondioksit ile
DİCLE ÜNİVERSİTESİ TIP FAKÜLTESİ DÖNEM II KAN-DOLAŞIM ve SOLUNUM DERS KURULU Doç.Dr. Engin DEVECİ Solunum Sistemi Havanın akciğerlere girip çıkması Solunan havadaki oksijenin kandaki karbondioksit ile
EÜFBED - Fen Bilimleri Enstitüsü Dergisi Cilt-Sayı: 2-1 Yıl: 2009
 51 KANGAL BALIKLARININ (GARRA RUFA) SOLUNGAÇLARINDAKİ MUKUS HÜCRELERİNİN HİSTOKİMYASI ÜZERİNE ÇALIŞMA STUDY ON THE HISTOCHEMISTRY OF MUCOUS CELLS IN THE GILLS OF KANGAL FISH (GARRA RUFA) Dilek DİLER 1*
51 KANGAL BALIKLARININ (GARRA RUFA) SOLUNGAÇLARINDAKİ MUKUS HÜCRELERİNİN HİSTOKİMYASI ÜZERİNE ÇALIŞMA STUDY ON THE HISTOCHEMISTRY OF MUCOUS CELLS IN THE GILLS OF KANGAL FISH (GARRA RUFA) Dilek DİLER 1*
Solunum: Solunum sistemi" Eritrositler" Dolaşım sistemi"
 Solunum Fizyolojisi Solunum: O 2 'nin taşınarak hücrelere ulaştırılması, üretilen CO 2 'in uzaklaştırılması." Bu işlevin gerçekleştirilebilmesi için üç sistem koordinasyon içinde çalışır:" " Solunum sistemi"
Solunum Fizyolojisi Solunum: O 2 'nin taşınarak hücrelere ulaştırılması, üretilen CO 2 'in uzaklaştırılması." Bu işlevin gerçekleştirilebilmesi için üç sistem koordinasyon içinde çalışır:" " Solunum sistemi"
T.C SÜLEYMAN DEMĠREL ÜNĠVERSĠTESĠ FEN BĠLĠMLERĠ ENSTĠTÜSÜ
 T.C SÜLEYMAN DEMĠREL ÜNĠVERSĠTESĠ FEN BĠLĠMLERĠ ENSTĠTÜSÜ DENĠZLĠ HOROZU VE TAVUĞU (Gallus gallus domesticus) ĠLE SÜLÜN (Phasianus colchicus) SĠRĠNKSLERĠNDE BAĞ DOKUSU FĠBRĠLLERĠNĠN DAĞILIMI ÖZNUR ÖNAL
T.C SÜLEYMAN DEMĠREL ÜNĠVERSĠTESĠ FEN BĠLĠMLERĠ ENSTĠTÜSÜ DENĠZLĠ HOROZU VE TAVUĞU (Gallus gallus domesticus) ĠLE SÜLÜN (Phasianus colchicus) SĠRĠNKSLERĠNDE BAĞ DOKUSU FĠBRĠLLERĠNĠN DAĞILIMI ÖZNUR ÖNAL
Kalbin Kendi Damarları ve Kan kaynakları; Koroner Damarlar
 Kalbin Kendi Damarları ve Kan kaynakları; Koroner Damarlar Kalp kası beyinden sonra en fazla kana gereksinim duyan organdır. Kalp kendini besleyen kanı aortadan ayrılan arterlerden alır. Bu arterlere koroner
Kalbin Kendi Damarları ve Kan kaynakları; Koroner Damarlar Kalp kası beyinden sonra en fazla kana gereksinim duyan organdır. Kalp kendini besleyen kanı aortadan ayrılan arterlerden alır. Bu arterlere koroner
BÖLÜM I HÜCRE FİZYOLOJİSİ...
 BÖLÜM I HÜCRE FİZYOLOJİSİ... 1 Bilinmesi Gereken Kavramlar... 1 Giriş... 2 Hücrelerin Fonksiyonel Özellikleri... 2 Hücrenin Kimyasal Yapısı... 2 Hücrenin Fiziksel Yapısı... 4 Hücrenin Bileşenleri... 4
BÖLÜM I HÜCRE FİZYOLOJİSİ... 1 Bilinmesi Gereken Kavramlar... 1 Giriş... 2 Hücrelerin Fonksiyonel Özellikleri... 2 Hücrenin Kimyasal Yapısı... 2 Hücrenin Fiziksel Yapısı... 4 Hücrenin Bileşenleri... 4
Hücre. 1 µm = 0,001 mm (1000 µm = 1 mm)!
 HÜCRE FİZYOLOJİSİ Hücre Hücre: Tüm canlıların en küçük yapısal ve fonksiyonel ünitesi İnsan vücudunda trilyonlarca hücre bulunur Fare, insan veya filin hücreleri yaklaşık aynı büyüklükte Vücudun büyüklüğü
HÜCRE FİZYOLOJİSİ Hücre Hücre: Tüm canlıların en küçük yapısal ve fonksiyonel ünitesi İnsan vücudunda trilyonlarca hücre bulunur Fare, insan veya filin hücreleri yaklaşık aynı büyüklükte Vücudun büyüklüğü
HİSTOLOJİ ATLASI UYGULAMA KILAVUZU
 HİSTOLOJİ ATLASI UYGULAMA KILAVUZU Dağıtım ve Pazarlama Adresleri http://www.fenomenyayincilik.com/ http://www.akcag.com.tr/ http://www.tumkitaplar.com/kitap/index.pl?yayinevi=153 http://www.idefix.com/kitap
HİSTOLOJİ ATLASI UYGULAMA KILAVUZU Dağıtım ve Pazarlama Adresleri http://www.fenomenyayincilik.com/ http://www.akcag.com.tr/ http://www.tumkitaplar.com/kitap/index.pl?yayinevi=153 http://www.idefix.com/kitap
Kınalı keklikte palpebral konjunktivanın histokimyasal yapısı
 262 Kınalı keklikte palpebral konjunktivanın histokimyasal yapısı Funda PEKMEZCİ, Kenan ÇINAR* Süleyman Demirel Üniversitesi, Fen-Edebiyat Fakültesi, Biyoloji Bölümü, 32260 Isparta Anahtar Kelimeler: Konjunktiva,
262 Kınalı keklikte palpebral konjunktivanın histokimyasal yapısı Funda PEKMEZCİ, Kenan ÇINAR* Süleyman Demirel Üniversitesi, Fen-Edebiyat Fakültesi, Biyoloji Bölümü, 32260 Isparta Anahtar Kelimeler: Konjunktiva,
DOKULAR. A-Hücreler B-Hücrelerarası madde (intersellüler substans) veya -Temel madde (Fundamental substans)
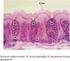 DOKULAR A-Hücreler B-Hücrelerarası madde (intersellüler substans) veya -Temel madde (Fundamental substans) Hücre farklılaşması sonucu 4 temel doku: 1.EPİTEL 2. DESTEK 3. KAS 4. SİNİR DOKU Destek dokular:
DOKULAR A-Hücreler B-Hücrelerarası madde (intersellüler substans) veya -Temel madde (Fundamental substans) Hücre farklılaşması sonucu 4 temel doku: 1.EPİTEL 2. DESTEK 3. KAS 4. SİNİR DOKU Destek dokular:
EPİTEL DOKUSU. Prof. Dr. Levent ERGÜN
 EPİTEL DOKUSU Prof. Dr. Levent ERGÜN https://www.google.com.tr/search?q=centrosome&espv=2&biw=1280&bih=918&source=lnms&tbm=isch&sa=x&ved=0ahukewjvgupqk7dsahvrd5okhsgcc- 0Q_AUIBigB#tbm=isch&q=epitehelial+cell+types&*&imgrc=leEWEd2z9XOqMM:
EPİTEL DOKUSU Prof. Dr. Levent ERGÜN https://www.google.com.tr/search?q=centrosome&espv=2&biw=1280&bih=918&source=lnms&tbm=isch&sa=x&ved=0ahukewjvgupqk7dsahvrd5okhsgcc- 0Q_AUIBigB#tbm=isch&q=epitehelial+cell+types&*&imgrc=leEWEd2z9XOqMM:
HİSTOLOJİ VE EMBRİYOLOJİ ANABİLİM DALI. Doç. Dr. Meltem KURUŞ Yrd.Doç. Dr. Aslı ÇETİN
 HİSTOLOJİ VE EMBRİYOLOJİ ANABİLİM DALI Program Yürütücüsü Programın Kadrolu Öğretim Üyeleri : Prof. Dr. Nigar VARDI : Doç. Dr. Mehmet GÜL Doç. Dr. Meltem KURUŞ Yrd.Doç. Dr. Aslı ÇETİN Programa Kabul İçin
HİSTOLOJİ VE EMBRİYOLOJİ ANABİLİM DALI Program Yürütücüsü Programın Kadrolu Öğretim Üyeleri : Prof. Dr. Nigar VARDI : Doç. Dr. Mehmet GÜL Doç. Dr. Meltem KURUŞ Yrd.Doç. Dr. Aslı ÇETİN Programa Kabul İçin
KİNEZYOLOJİ ÖĞR.GÖR. CİHAN CİCİK
 KİNEZYOLOJİ ÖĞR.GÖR. CİHAN CİCİK 1 2 Lokomotor sistemi oluşturan yapılar içinde en fazla stres altında kalan kıkırdaktır. Eklem kıkırdağı; 1) Kan damarlarından, 2) Lenf kanallarından, 3) Sinirlerden yoksundur.
KİNEZYOLOJİ ÖĞR.GÖR. CİHAN CİCİK 1 2 Lokomotor sistemi oluşturan yapılar içinde en fazla stres altında kalan kıkırdaktır. Eklem kıkırdağı; 1) Kan damarlarından, 2) Lenf kanallarından, 3) Sinirlerden yoksundur.
PULMONES (AKCİĞERLER) DOÇ.DR.M.CUDİ TUNCER D.Ü.TIP FAKÜLTESİ ABD
 PULMONES (AKCİĞERLER) DOÇ.DR.M.CUDİ TUNCER D.Ü.TIP FAKÜLTESİ ABD İntrapulmoner hava yolları (Segmenta bronchopulmonalia) Bronchus principalis (primer) Bronchus lobaris (sekundar) Bronchus segmentalis (tersiyer)
PULMONES (AKCİĞERLER) DOÇ.DR.M.CUDİ TUNCER D.Ü.TIP FAKÜLTESİ ABD İntrapulmoner hava yolları (Segmenta bronchopulmonalia) Bronchus principalis (primer) Bronchus lobaris (sekundar) Bronchus segmentalis (tersiyer)
SİNDİRİM SİSTEMİ 8. HAFTA. Yrd. Doç. Dr. Kadri KULUALP Yrd. Doç. Dr. Önder AYTEKİN
 SİNDİRİM SİSTEMİ 8. HAFTA Yrd. Doç. Dr. Kadri KULUALP Yrd. Doç. Dr. Önder AYTEKİN SİNDİRİM SİSTEMİNİN İŞLEYİŞİ Canlı organizmaların hayatlarını devam ettirebilmeleri için enerji almaları gerekmektedir.
SİNDİRİM SİSTEMİ 8. HAFTA Yrd. Doç. Dr. Kadri KULUALP Yrd. Doç. Dr. Önder AYTEKİN SİNDİRİM SİSTEMİNİN İŞLEYİŞİ Canlı organizmaların hayatlarını devam ettirebilmeleri için enerji almaları gerekmektedir.
HAYVANSAL HÜCRELER VE İŞLEVLERİ. YRD. DOÇ. DR. ASLI SADE MEMİŞOĞLU RESİM İŞ ZEMİN KAT ODA: 111
 HAYVANSAL HÜCRELER VE İŞLEVLERİ YRD. DOÇ. DR. ASLI SADE MEMİŞOĞLU RESİM İŞ ZEMİN KAT ODA: 111 asli.memisoglu@deu.edu.tr KONULAR HAYVAN HÜCRESİ HAYVAN, BİTKİ, MANTAR, BAKTERİ HÜCRE FARKLARI HÜCRE ORGANELLERİ
HAYVANSAL HÜCRELER VE İŞLEVLERİ YRD. DOÇ. DR. ASLI SADE MEMİŞOĞLU RESİM İŞ ZEMİN KAT ODA: 111 asli.memisoglu@deu.edu.tr KONULAR HAYVAN HÜCRESİ HAYVAN, BİTKİ, MANTAR, BAKTERİ HÜCRE FARKLARI HÜCRE ORGANELLERİ
Örtü Epiteli Tipleri:
 Tek Katlı: Tek Katlı Yassı Epitel Tek Katlı Kübik Epitel Tek Katlı Prizmatik Örtü Epiteli Tipleri: Basit Kinosilyalı Çizgili Kenarlı Yalancı Çok Katlı( Psödostratifiye) Prizmatik Epitel Çok Katlı: Çok
Tek Katlı: Tek Katlı Yassı Epitel Tek Katlı Kübik Epitel Tek Katlı Prizmatik Örtü Epiteli Tipleri: Basit Kinosilyalı Çizgili Kenarlı Yalancı Çok Katlı( Psödostratifiye) Prizmatik Epitel Çok Katlı: Çok
Kalın Barsak Mukoza. Villi yoktur Kıvrımlar yoktur. Distal bölümde (Rectal) vardır DR. OKTAY ARDA
 Dr. Oktay Arda 2 Kalın Barsak Mukoza Villi yoktur Kıvrımlar yoktur Distal bölümde (Rectal) vardır 3 Kalın BarsakGuddelri Uzundur Çok sayıda: Goblet Hücresi Absorbsiyon Hücresi Silindirik Kısa, düzensiz
Dr. Oktay Arda 2 Kalın Barsak Mukoza Villi yoktur Kıvrımlar yoktur Distal bölümde (Rectal) vardır 3 Kalın BarsakGuddelri Uzundur Çok sayıda: Goblet Hücresi Absorbsiyon Hücresi Silindirik Kısa, düzensiz
GÖRSEL OLMAYAN DUYU SİSTEMLERİ
 GÖRSEL OLMAYAN DUYU SİSTEMLERİ MEKANİK DUYULAR İnsanlarda dokunma, basınç, sıcaklık ve ağrı gibi bir çok duyu bulunmaktadır. Bu duyulara mekanik duyular denir. Mekanik duyuların alınmasını sağlayan farklı
GÖRSEL OLMAYAN DUYU SİSTEMLERİ MEKANİK DUYULAR İnsanlarda dokunma, basınç, sıcaklık ve ağrı gibi bir çok duyu bulunmaktadır. Bu duyulara mekanik duyular denir. Mekanik duyuların alınmasını sağlayan farklı
HÜCRE MEMBRANINDAN MADDELERİN TAŞINMASI. Dr. Vedat Evren
 HÜCRE MEMBRANINDAN MADDELERİN TAŞINMASI Dr. Vedat Evren Vücuttaki Sıvı Kompartmanları Vücut sıvıları değişik kompartmanlarda dağılmış Vücuttaki Sıvı Kompartmanları Bu kompartmanlarda iyonlar ve diğer çözünmüş
HÜCRE MEMBRANINDAN MADDELERİN TAŞINMASI Dr. Vedat Evren Vücuttaki Sıvı Kompartmanları Vücut sıvıları değişik kompartmanlarda dağılmış Vücuttaki Sıvı Kompartmanları Bu kompartmanlarda iyonlar ve diğer çözünmüş
Anatomik Sistemler. Hastalıklar Bilgisi Ders-2 İskelet-Kas-Sinir Sistemleri
 Anatomik Sistemler Hastalıklar Bilgisi Ders-2 İskelet-Kas-Sinir Sistemleri Anatomik Sistem İskelet Sistemi İskeletin Görevleri Vücuda şekil verir. Vücuda destek sağlar. Göğüs kafes ve kafatası kemikleri
Anatomik Sistemler Hastalıklar Bilgisi Ders-2 İskelet-Kas-Sinir Sistemleri Anatomik Sistem İskelet Sistemi İskeletin Görevleri Vücuda şekil verir. Vücuda destek sağlar. Göğüs kafes ve kafatası kemikleri
Hücre Nükleusu, Nükleus Membranı, Nükleus Porları. Doç. Dr. Ahmet Özaydın
 Hücre Nükleusu, Nükleus Membranı, Nükleus Porları Doç. Dr. Ahmet Özaydın Nükleus (çekirdek) ökaryotlar ile prokaryotları ayıran temel özelliktir. Çekirdek hem genetik bilginin deposu hem de kontrol merkezidir.
Hücre Nükleusu, Nükleus Membranı, Nükleus Porları Doç. Dr. Ahmet Özaydın Nükleus (çekirdek) ökaryotlar ile prokaryotları ayıran temel özelliktir. Çekirdek hem genetik bilginin deposu hem de kontrol merkezidir.
SOLUNUM SİSTEMİ (SISTEMA RESPIRATORIUM)
 SOLUNUM SİSTEMİ (SISTEMA RESPIRATORIUM) Atmosferdeki O2 in kana geçmesi, kan dolaşımındaki CO2 in atmosfere geri verilmesi işlemine solunum (respirasyon) denilir. Solunum iki fazdan meydana gelir. Soluk
SOLUNUM SİSTEMİ (SISTEMA RESPIRATORIUM) Atmosferdeki O2 in kana geçmesi, kan dolaşımındaki CO2 in atmosfere geri verilmesi işlemine solunum (respirasyon) denilir. Solunum iki fazdan meydana gelir. Soluk
Öğr. Gör. Dr. İlker BÜYÜK, Botanik, 3. Hafta: Bitkisel Dokular KOLONİ VE DOKULAŞMA
 KOLONİ VE DOKULAŞMA Yeryüzünde çok sayıda tek hücreli canlı vardır ve bunlar basit yapılıdır. Oysaki çok hücreli olmak gelişmiş canlı olmanın gereklerindendir. Çünkü tek hücreli bir canlı (örneğin Euglena
KOLONİ VE DOKULAŞMA Yeryüzünde çok sayıda tek hücreli canlı vardır ve bunlar basit yapılıdır. Oysaki çok hücreli olmak gelişmiş canlı olmanın gereklerindendir. Çünkü tek hücreli bir canlı (örneğin Euglena
Toraks; gövde nin boyun ile abdomen arasında yer alan parçasıdır. Toraks oniki çift kaburga, sternum, kıkırdak kaburgalar ve oniki torakal omur dan
 Toraks; gövde nin boyun ile abdomen arasında yer alan parçasıdır. Toraks oniki çift kaburga, sternum, kıkırdak kaburgalar ve oniki torakal omur dan oluşur. Bu kemik ve kıkırdak yapılar toraks kafesini
Toraks; gövde nin boyun ile abdomen arasında yer alan parçasıdır. Toraks oniki çift kaburga, sternum, kıkırdak kaburgalar ve oniki torakal omur dan oluşur. Bu kemik ve kıkırdak yapılar toraks kafesini
SOLUNUM SİSTEMİ FİZYOLOJİSİ 19/11/2015 SOLUNUM SİSTEMİ MEKANİZMASI SOLUNUM SİSTEMİ MEKANİZMASI SOLUNUM SİSTEMİ MEKANİZMASI
 VE FİZYOLOJİSİ FİZYOLOJİSİ Müge BULAKBAŞI Yüksek Hemşire Canlılığın sürdürülebilmesi için vücuda oksijen alınması gerekir. Solunumla alınan oksijen, kullanılarak metabolizma sonucunda karbondioksit açığa
VE FİZYOLOJİSİ FİZYOLOJİSİ Müge BULAKBAŞI Yüksek Hemşire Canlılığın sürdürülebilmesi için vücuda oksijen alınması gerekir. Solunumla alınan oksijen, kullanılarak metabolizma sonucunda karbondioksit açığa
OMÜ TIP FAKÜLTESİ DERS YILI DÖNEM I HAYATIN DEVAMI III UYGULAMA REHBERİ
 OMÜ TIP FAKÜLTEİ 2016-2017 DER YILI DÖNEM I HAYATIN DEVAMI III UYGULAMANIN ADI: indirim Kanalı Histolojisi UYGULAMA REHBERİ I. AMAÇ: indirim kanalını oluşturan organların duvar yapılarının ana hatları
OMÜ TIP FAKÜLTEİ 2016-2017 DER YILI DÖNEM I HAYATIN DEVAMI III UYGULAMANIN ADI: indirim Kanalı Histolojisi UYGULAMA REHBERİ I. AMAÇ: indirim kanalını oluşturan organların duvar yapılarının ana hatları
DENEY HAYVANLARI ANATOMİSİ
 DENEY HAYVANLARI DENEY HAYVANLARI ANATOMİSİ Deney Hayvanı: Hipotezi bilimsel kurallara göre kurulmuş araştırmalarda ve biyolojik testlerde kullanılan hayvanlardır. Günümüzde en sık kullanılan deney hayvanları;
DENEY HAYVANLARI DENEY HAYVANLARI ANATOMİSİ Deney Hayvanı: Hipotezi bilimsel kurallara göre kurulmuş araştırmalarda ve biyolojik testlerde kullanılan hayvanlardır. Günümüzde en sık kullanılan deney hayvanları;
A. TOHUMLU BİTKİLERİN TEMEL KISIMLARI
 Bitkilerin Yapısı Biyoloji Ders Notları A. TOHUMLU BİTKİLERİN TEMEL KISIMLARI Karasal bitkiler iki organ sistemine sahiptir. Toprakların su ve mineral alınmasını sağlayan toprak altı kök sistemi ve gövde,
Bitkilerin Yapısı Biyoloji Ders Notları A. TOHUMLU BİTKİLERİN TEMEL KISIMLARI Karasal bitkiler iki organ sistemine sahiptir. Toprakların su ve mineral alınmasını sağlayan toprak altı kök sistemi ve gövde,
HAYVANLARDA SOLUNUM SİSTEMLERİ. YRD. DOÇ. DR. ASLI SADE MEMİŞOĞLU kisi.deu.edu.tr/asli.memisoglu
 HAYVANLARDA SOLUNUM SİSTEMLERİ YRD. DOÇ. DR. ASLI SADE MEMİŞOĞLU asli.memisoglu@deu.edu.tr kisi.deu.edu.tr/asli.memisoglu GAZ ALIŞVERİŞİ Oksijenli solunum yapan hücreler besinlerle alınan monomerlerden
HAYVANLARDA SOLUNUM SİSTEMLERİ YRD. DOÇ. DR. ASLI SADE MEMİŞOĞLU asli.memisoglu@deu.edu.tr kisi.deu.edu.tr/asli.memisoglu GAZ ALIŞVERİŞİ Oksijenli solunum yapan hücreler besinlerle alınan monomerlerden
Hücreler arası Bağlantılar ve Sıkı bağlantı. İlhan Onaran
 Hücreler arası Bağlantılar ve Sıkı bağlantı İlhan Onaran Doku organisazyonu: Hücrelerin bağlanması 1- Hücre-matriks bağlantıları: ekstraselüler matriks tarafından hücrelerin bir arada tutulması 2- Hücre-hücre
Hücreler arası Bağlantılar ve Sıkı bağlantı İlhan Onaran Doku organisazyonu: Hücrelerin bağlanması 1- Hücre-matriks bağlantıları: ekstraselüler matriks tarafından hücrelerin bir arada tutulması 2- Hücre-hücre
SOLUNUM SİSTEMİ FİZYOLOJİSİ. Yrd.Doç.Dr. Önder AYTEKİN
 SOLUNUM SİSTEMİ FİZYOLOJİSİ Yrd.Doç.Dr. Önder AYTEKİN 2 Solunumun amacı, dokulara oksijen sağlamak ve karbon dioksidi uzaklaştırmaktır. Bu amaç gerçekleştirilirken, solunum dört büyük fonksiyonel olaylar
SOLUNUM SİSTEMİ FİZYOLOJİSİ Yrd.Doç.Dr. Önder AYTEKİN 2 Solunumun amacı, dokulara oksijen sağlamak ve karbon dioksidi uzaklaştırmaktır. Bu amaç gerçekleştirilirken, solunum dört büyük fonksiyonel olaylar
HISTOLOJIDE BOYAMA YÖNTEMLERI. Dr. Yasemin Sezgin. yasemin sezgin
 HISTOLOJIDE BOYAMA YÖNTEMLERI Dr. Yasemin Sezgin yasemin sezgin HÜRESEL BOYAMANIN TEMEL PRENSİPLERİ Hem fiziksel hem kimyasal faktörler hücresel boyamayı etkilemektedir BOYAMA MEKANIZMASı Temelde boyanın
HISTOLOJIDE BOYAMA YÖNTEMLERI Dr. Yasemin Sezgin yasemin sezgin HÜRESEL BOYAMANIN TEMEL PRENSİPLERİ Hem fiziksel hem kimyasal faktörler hücresel boyamayı etkilemektedir BOYAMA MEKANIZMASı Temelde boyanın
*Canlıların canlılık özelliği gösteren en küçük yapı birimine hücre denir.
 Fen ve Teknoloji 1. Ünite Özeti Hücre Canlılarda Üreme, Büyüme ve Gelişme. *Canlıların canlılık özelliği gösteren en küçük yapı birimine hücre denir. *Hücrenin temel kısımları: hücre zarı, sitoplâzma ve
Fen ve Teknoloji 1. Ünite Özeti Hücre Canlılarda Üreme, Büyüme ve Gelişme. *Canlıların canlılık özelliği gösteren en küçük yapı birimine hücre denir. *Hücrenin temel kısımları: hücre zarı, sitoplâzma ve
İskelet ve kemik çeşitleri nelerdir?
 On5yirmi5.com İskelet ve kemik çeşitleri nelerdir? İskelet ve kemik çeşitleri nelerdir? Yayın Tarihi : 16 Kasım 2012 Cuma (oluşturma : 1/4/2017) A. İSKELET ÇEŞİTLERİ Hayvanların çoğunda, vücuda destek
On5yirmi5.com İskelet ve kemik çeşitleri nelerdir? İskelet ve kemik çeşitleri nelerdir? Yayın Tarihi : 16 Kasım 2012 Cuma (oluşturma : 1/4/2017) A. İSKELET ÇEŞİTLERİ Hayvanların çoğunda, vücuda destek
Bağ doku. Mezodermden köken alır. En Yaygın bulunan dokudur ( Epitel, Kas, Kemik sinir)
 Bağ doku Mezodermden köken alır En Yaygın bulunan dokudur ( Epitel, Kas, Kemik sinir) Bağ dokunun Fonksiyonları Diğer organ ve dokuların Fonksiyonal ve yapısal desteğini sağlar. kan damarları aracılığı
Bağ doku Mezodermden köken alır En Yaygın bulunan dokudur ( Epitel, Kas, Kemik sinir) Bağ dokunun Fonksiyonları Diğer organ ve dokuların Fonksiyonal ve yapısal desteğini sağlar. kan damarları aracılığı
Toraks; gövde nin boyun ile abdomen arasında yer alan parçasıdır. Toraks oniki çift kaburga, sternum, kıkırdak kaburgalar ve oniki torakal omur dan
 Toraks; gövde nin boyun ile abdomen arasında yer alan parçasıdır. Toraks oniki çift kaburga, sternum, kıkırdak kaburgalar ve oniki torakal omur dan oluşur. Bu kemik ve kıkırdak yapılar toraks kafesini
Toraks; gövde nin boyun ile abdomen arasında yer alan parçasıdır. Toraks oniki çift kaburga, sternum, kıkırdak kaburgalar ve oniki torakal omur dan oluşur. Bu kemik ve kıkırdak yapılar toraks kafesini
Canlıların yapısına en fazla oranda katılan organik molekül çeşididir. Deri, saç, tırnak, boynuz gibi oluşumların temel maddesi proteinlerdir.
 Canlıların yapısına en fazla oranda katılan organik molekül çeşididir. Deri, saç, tırnak, boynuz gibi oluşumların temel maddesi proteinlerdir. Proteinlerin yapısında; Karbon ( C ) Hidrojen ( H ) Oksijen
Canlıların yapısına en fazla oranda katılan organik molekül çeşididir. Deri, saç, tırnak, boynuz gibi oluşumların temel maddesi proteinlerdir. Proteinlerin yapısında; Karbon ( C ) Hidrojen ( H ) Oksijen
İ. Ü İstanbul Tıp Fakültesi Tıbbi Biyoloji Anabilim Dalı Prof. Dr. Filiz Aydın
 İ. Ü İstanbul Tıp Fakültesi Tıbbi Biyoloji Anabilim Dalı Prof. Dr. Filiz Aydın Canlının en küçük birimi Hücre 1665 yılında ilk olarak İngiliz bilim adamı Robert Hooke şişe mantarından kesit alıp mikroskopta
İ. Ü İstanbul Tıp Fakültesi Tıbbi Biyoloji Anabilim Dalı Prof. Dr. Filiz Aydın Canlının en küçük birimi Hücre 1665 yılında ilk olarak İngiliz bilim adamı Robert Hooke şişe mantarından kesit alıp mikroskopta
Mekanik zedelenmelerde nazik olan solunum yüzeylerinin korunması
 SOLUNUM SİSTEMLERİ Hücre işlevlerinin yürütülmesi için gerekli enerji, genellikle biyolojik oksidasyonlardan elde edilir. Hücresel solunumda besin maddeleri parçalanarak enerji elde edilir. Burada O 2
SOLUNUM SİSTEMLERİ Hücre işlevlerinin yürütülmesi için gerekli enerji, genellikle biyolojik oksidasyonlardan elde edilir. Hücresel solunumda besin maddeleri parçalanarak enerji elde edilir. Burada O 2
DİŞİ ÜREME ORGANLARI
 DİŞİ ÜREME ORGANLARI Dişi üreme organları dişi gamet hücresi ovumu (yumurtayı) üreten ovaryumlar ile ovumun döllendiği, döllenme sonrasında gebeliğin şekillendiği ve gelişen yavrunun dışarı çıkarıldığı
DİŞİ ÜREME ORGANLARI Dişi üreme organları dişi gamet hücresi ovumu (yumurtayı) üreten ovaryumlar ile ovumun döllendiği, döllenme sonrasında gebeliğin şekillendiği ve gelişen yavrunun dışarı çıkarıldığı
CLASSİS: ARACHNİDA (ÖRÜMCEKGİLLER)
 CLASSİS: ARACHNİDA (ÖRÜMCEKGİLLER) Vücut prosoma ve opisthosomadan oluşmuştur. Cephalothorax bölümü kısadır. Abdomen ise bazı türlerde mesosoma ve metasoma olarak ikiye ayrılmış (akrep), bazı türlerde
CLASSİS: ARACHNİDA (ÖRÜMCEKGİLLER) Vücut prosoma ve opisthosomadan oluşmuştur. Cephalothorax bölümü kısadır. Abdomen ise bazı türlerde mesosoma ve metasoma olarak ikiye ayrılmış (akrep), bazı türlerde
MİDE (Gaster-Ventrikulus )
 MİDE (Gaster-Ventrikulus ) Besin maddelerinin toplandığı geniş boşluklu bir organdır. Organ duvarının lumene bakan bölümü (tunika mukoza), evcil hayvanlarda farklı yapısal özellikler gösterir. Buna göre
MİDE (Gaster-Ventrikulus ) Besin maddelerinin toplandığı geniş boşluklu bir organdır. Organ duvarının lumene bakan bölümü (tunika mukoza), evcil hayvanlarda farklı yapısal özellikler gösterir. Buna göre
Solunum Sistemi Ne İş Yapar?
 Solunum Sistemi Solunum Sistemi Ne İş Yapar? O 2 değişimi Havadan kana Kandan hücrelere CO 2 değişimi Hücrelerden kana Kandan havaya Kan ph sının düzenlenmesi Ses çıkartma Solunum Sistemi: Genel Bakış
Solunum Sistemi Solunum Sistemi Ne İş Yapar? O 2 değişimi Havadan kana Kandan hücrelere CO 2 değişimi Hücrelerden kana Kandan havaya Kan ph sının düzenlenmesi Ses çıkartma Solunum Sistemi: Genel Bakış
HÜCRE FİZYOLOJİSİ Hücrenin fiziksel yapısı. Hücre membranı proteinleri. Hücre membranı
 Hücrenin fiziksel yapısı HÜCRE FİZYOLOJİSİ Hücreyi oluşturan yapılar Hücre membranı yapısı ve özellikleri Hücre içi ve dışı bileşenler Hücre membranından madde iletimi Vücut sıvılar Ozmoz-ozmmotik basınç
Hücrenin fiziksel yapısı HÜCRE FİZYOLOJİSİ Hücreyi oluşturan yapılar Hücre membranı yapısı ve özellikleri Hücre içi ve dışı bileşenler Hücre membranından madde iletimi Vücut sıvılar Ozmoz-ozmmotik basınç
FAQ-TIENS DICHO II.Nesil Meyve&Sebze Temizleyici
 FAQ-TIENS DICHO II.Nesil Meyve&Sebze Temizleyici 1. II.Nesil Meyve&Sebze Temizleyici tam olarak nedir ve nasıl çalışılır? TIENS DICHO II.Nesil Meyve&Sebze Temizleyici bir temizleme ürünü olup, gerçek hayata
FAQ-TIENS DICHO II.Nesil Meyve&Sebze Temizleyici 1. II.Nesil Meyve&Sebze Temizleyici tam olarak nedir ve nasıl çalışılır? TIENS DICHO II.Nesil Meyve&Sebze Temizleyici bir temizleme ürünü olup, gerçek hayata
Solunum Sistemi Fizyolojisi
 Solunum Sistemi Fizyolojisi Solunum Sistemi Solunum sistemi, kan ile atmosfer havası arasında gaz değişimini oluşturabilecek şekilde özelleşmiş bir sistemdir. Solunum sistemindeki gaz değişimi ile hücrelerde
Solunum Sistemi Fizyolojisi Solunum Sistemi Solunum sistemi, kan ile atmosfer havası arasında gaz değişimini oluşturabilecek şekilde özelleşmiş bir sistemdir. Solunum sistemindeki gaz değişimi ile hücrelerde
VÜCUDUMUZDA SISTEMLER. Destek ve Hareket
 VÜCUDUMUZDA SISTEMLER Destek ve Hareket DESTEK VE HAREKET SİSTEMİ Vücudun hareket etmesini sağlamak Vücutta bulunan organlara destek sağlamak Destek ve Hareket Sistemi İskelet Sistemi Kaslar Kemikler Eklemler
VÜCUDUMUZDA SISTEMLER Destek ve Hareket DESTEK VE HAREKET SİSTEMİ Vücudun hareket etmesini sağlamak Vücutta bulunan organlara destek sağlamak Destek ve Hareket Sistemi İskelet Sistemi Kaslar Kemikler Eklemler
TEMEL İLK YARDIM VE ACİL MÜDAHALE
 1 TEMEL İLK YARDIM VE ACİL MÜDAHALE GİRİŞ : Bir yaralı, hasta ya da kazazedeye ilk yardım yapabilmek ya da herhangi bir yardımda bulunabilmek için, öncelikle gerekenlerin doğru yapılabilmesi için, insan
1 TEMEL İLK YARDIM VE ACİL MÜDAHALE GİRİŞ : Bir yaralı, hasta ya da kazazedeye ilk yardım yapabilmek ya da herhangi bir yardımda bulunabilmek için, öncelikle gerekenlerin doğru yapılabilmesi için, insan
Systema Respiratorium
 SOLUNUM SİSTEMİ NASUS Systema Respiratorium 2005-2005 LARYNX 1 PULMO Prof. Dr. Mehmet YILDIRIM İ.Ü. Cerrahpaşa TIP Fakültesi Anatomi Anabilim Dalı CANLILAR ALEMİNDE SOLUNUMUN TEMEL DÜZENLENİŞİ İNSAN Ductus
SOLUNUM SİSTEMİ NASUS Systema Respiratorium 2005-2005 LARYNX 1 PULMO Prof. Dr. Mehmet YILDIRIM İ.Ü. Cerrahpaşa TIP Fakültesi Anatomi Anabilim Dalı CANLILAR ALEMİNDE SOLUNUMUN TEMEL DÜZENLENİŞİ İNSAN Ductus
TORAKS DUVARI ANATOMİSİ (Kemik yapılar ve yumuşak dokular) Dr. Recep Savaş Ege Üniversitesi Tıp Fakültesi Radyoloji AD, İzmir
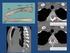 TORAKS DUVARI ANATOMİSİ (Kemik yapılar ve yumuşak dokular) Dr. Recep Savaş Ege Üniversitesi Tıp Fakültesi Radyoloji AD, İzmir Özet: Göğüs duvarı anatomisi Kesitsel anatomi Varyasyonel görünümler Toraks
TORAKS DUVARI ANATOMİSİ (Kemik yapılar ve yumuşak dokular) Dr. Recep Savaş Ege Üniversitesi Tıp Fakültesi Radyoloji AD, İzmir Özet: Göğüs duvarı anatomisi Kesitsel anatomi Varyasyonel görünümler Toraks
DR. OKTAY ARDA. İnce Barsak. Sindirimin Sona Erdiği Yer Besin Maddesi Absorbsiyonu Endokrin Sekrasyonu
 Dr. Oktay Arda İnce Barsak Sindirimin Sona Erdiği Yer Besin Maddesi Absorbsiyonu Endokrin Sekrasyonu İnce Barsak Uzunluğu ~ 5 m Temasın Uzun Süreli olması Yiyecekler Sindirim Enzimleri Sindirilmiş Ürünler
Dr. Oktay Arda İnce Barsak Sindirimin Sona Erdiği Yer Besin Maddesi Absorbsiyonu Endokrin Sekrasyonu İnce Barsak Uzunluğu ~ 5 m Temasın Uzun Süreli olması Yiyecekler Sindirim Enzimleri Sindirilmiş Ürünler
9. SINIF KONU ANLATIMI 5 CANLININ TEMEL BİLEŞENLERİ -İNORGANİK MADDELER 1- SU
 9. SINIF KONU ANLATIMI 5 CANLININ TEMEL BİLEŞENLERİ -İNORGANİK MADDELER 1- SU Canlıların yapısına katılan maddeler çeşitli özellikler nedeni ile temel olarak iki grupta incelenir. Canlının Temel Bileşenleri
9. SINIF KONU ANLATIMI 5 CANLININ TEMEL BİLEŞENLERİ -İNORGANİK MADDELER 1- SU Canlıların yapısına katılan maddeler çeşitli özellikler nedeni ile temel olarak iki grupta incelenir. Canlının Temel Bileşenleri
Akciğerin Embryolojisi Akif Turna
 Akciğerin Embryolojisi Akif Turna Neden Embryoloji? Neden Embryoloji? Organların gelişimini (organogenesis) anlamak Neden Embryoloji? Organların gelişimini (organogenesis) anlamak Fonksiyonlarını daha
Akciğerin Embryolojisi Akif Turna Neden Embryoloji? Neden Embryoloji? Organların gelişimini (organogenesis) anlamak Neden Embryoloji? Organların gelişimini (organogenesis) anlamak Fonksiyonlarını daha
Biochemistry Chapter 4: Biomolecules. Hikmet Geçkil, Professor Department of Molecular Biology and Genetics Inonu University
 Biochemistry Chapter 4: Biomolecules, Professor Department of Molecular Biology and Genetics Inonu University Biochemistry/Hikmet Geckil Chapter 4: Biomolecules 2 BİYOMOLEKÜLLER Bilim adamları hücreyi
Biochemistry Chapter 4: Biomolecules, Professor Department of Molecular Biology and Genetics Inonu University Biochemistry/Hikmet Geckil Chapter 4: Biomolecules 2 BİYOMOLEKÜLLER Bilim adamları hücreyi
ADIM ADIM YGS-LYS 5. ADIM CANLININ TEMEL BİLEŞENLERİ -İNORGANİK MADDELER 1- SU
 ADIM ADIM YGS-LYS 5. ADIM CANLININ TEMEL BİLEŞENLERİ -İNORGANİK MADDELER 1- SU Canlıların yapısına katılan maddeler çeşitli özellikler nedeni ile temel olarak iki grupta incelenir. Canlının Temel Bileşenleri
ADIM ADIM YGS-LYS 5. ADIM CANLININ TEMEL BİLEŞENLERİ -İNORGANİK MADDELER 1- SU Canlıların yapısına katılan maddeler çeşitli özellikler nedeni ile temel olarak iki grupta incelenir. Canlının Temel Bileşenleri
12. SINIF KONU ANLATIMI 24 STOMA VE TERLEME (TRANSPİRASYON)
 12. SINIF KONU ANLATIMI 24 STOMA VE TERLEME (TRANSPİRASYON) STOMA Genellikle yaprakta bulunan bitkide gaz alışverişini sağlayan küçük gözeneklerdir. Bitkinin yaşadığı iklim koşuluna bağlı olarak konumu
12. SINIF KONU ANLATIMI 24 STOMA VE TERLEME (TRANSPİRASYON) STOMA Genellikle yaprakta bulunan bitkide gaz alışverişini sağlayan küçük gözeneklerdir. Bitkinin yaşadığı iklim koşuluna bağlı olarak konumu
SAFRA KANAL SİSTEMİ VE SAFRA KESESİ. Yrd.Doç.Dr.Sevda Söker
 SAFRA KANAL SİSTEMİ VE SAFRA KESESİ Yrd.Doç.Dr.Sevda Söker Safra Kanal Sistemi; Safranın hepatositten safra kesesine Safra kesesinden bağırsağa aktığı Çapı giderek artan kanallar sistemi En küçük dalı,
SAFRA KANAL SİSTEMİ VE SAFRA KESESİ Yrd.Doç.Dr.Sevda Söker Safra Kanal Sistemi; Safranın hepatositten safra kesesine Safra kesesinden bağırsağa aktığı Çapı giderek artan kanallar sistemi En küçük dalı,
DUYUSAL ve MOTOR MEKANİZMALAR
 DUYUSAL ve MOTOR MEKANİZMALAR Duyu Algılama, Tepki Verme ve Beyin Algılama beyinsel analiz tepki Sıcaklık, ışık, ses, koku duyu reseptörleri: elektriksel uyarılara dönüşür Uyarı beyin korteksindeki talamus
DUYUSAL ve MOTOR MEKANİZMALAR Duyu Algılama, Tepki Verme ve Beyin Algılama beyinsel analiz tepki Sıcaklık, ışık, ses, koku duyu reseptörleri: elektriksel uyarılara dönüşür Uyarı beyin korteksindeki talamus
ADIM ADIM YGS-LYS 52. ADIM CANLILARIN SINIFLANDIRILMASI-12 HAYVANLAR ALEMİ 3- OMURGALI HAYVANLAR SORU ÇÖZÜMÜ
 ADIM ADIM YGS-LYS 52. ADIM CANLILARIN SINIFLANDIRILMASI-12 HAYVANLAR ALEMİ 3- OMURGALI HAYVANLAR SORU ÇÖZÜMÜ Halkalı solucanlar çift cinsiyetli olmalarına rağmen döllenme kendi kendine değil, iki ayrı
ADIM ADIM YGS-LYS 52. ADIM CANLILARIN SINIFLANDIRILMASI-12 HAYVANLAR ALEMİ 3- OMURGALI HAYVANLAR SORU ÇÖZÜMÜ Halkalı solucanlar çift cinsiyetli olmalarına rağmen döllenme kendi kendine değil, iki ayrı
Organizmanın en sert dokusudur. Kemik dokusunun hücreler arası maddesinin içinde kollajen teller ve inorganik elemanlar bulunur. İnorganik elemanlar
 KEMİK DOKUSU Organizmanın en sert dokusudur. Kemik dokusunun hücreler arası maddesinin içinde kollajen teller ve inorganik elemanlar bulunur. İnorganik elemanlar hidroksiapatit kristalleri olarak tanımlanır.
KEMİK DOKUSU Organizmanın en sert dokusudur. Kemik dokusunun hücreler arası maddesinin içinde kollajen teller ve inorganik elemanlar bulunur. İnorganik elemanlar hidroksiapatit kristalleri olarak tanımlanır.
SANKO ÜNİVERSİTESİ TIP FAKÜLTESİ 2015-2016 EĞİTİM-ÖĞRETİM YILI DERS KURULU 102: HÜCRE VE DOKU SİSTEMLERİ
 05-06 EĞİTİM-ÖĞRETİM YILI DERS KURULU 0: HÜCRE VE DOKU SİSTEMLERİ Ders Kurulu Başkanı: / Başkan Yardımcıları: / Histoloji Embriyoloji Yrd. Doç. Dr. Bahadır Murat Demirel / Üyeler: / Tıbbi / Dersin AKTS
05-06 EĞİTİM-ÖĞRETİM YILI DERS KURULU 0: HÜCRE VE DOKU SİSTEMLERİ Ders Kurulu Başkanı: / Başkan Yardımcıları: / Histoloji Embriyoloji Yrd. Doç. Dr. Bahadır Murat Demirel / Üyeler: / Tıbbi / Dersin AKTS
AMPHİOXUS TA ZİGOT TAN SONRAKİ GELİŞMELER
 AMPHİOXUS TA ZİGOT TAN SONRAKİ GELİŞMELER Amphioxus (Branchiostoma lanceolatum): Derin olmayan tuzlu sularda, kumda kazdıkları oyuklarda yaşar. Omurga ya da kafa bulunmaz. Çiftleşme mevsiminde bu oyuklardan
AMPHİOXUS TA ZİGOT TAN SONRAKİ GELİŞMELER Amphioxus (Branchiostoma lanceolatum): Derin olmayan tuzlu sularda, kumda kazdıkları oyuklarda yaşar. Omurga ya da kafa bulunmaz. Çiftleşme mevsiminde bu oyuklardan
MAKEDONYA BİYOLOGLAR BİRLİĞİ. Çözümler
 MAKEDONYA BİYOLOGLAR BİRLİĞİ Biyoloji dersinden 8.sınıflar için Belediye Yarışması TOPLAM PUAN 100 Çözümler 1. Verilen resimde insan vücuduna bulunan dokuz tane organik sistem gösterilmiştir. Her birinin
MAKEDONYA BİYOLOGLAR BİRLİĞİ Biyoloji dersinden 8.sınıflar için Belediye Yarışması TOPLAM PUAN 100 Çözümler 1. Verilen resimde insan vücuduna bulunan dokuz tane organik sistem gösterilmiştir. Her birinin
KAN DOKUSU. Prof. Dr. Levent ERGÜN
 KAN DOKUSU Prof. Dr. Levent ERGÜN 1 Kan Dokusu Plazma (sıvı) ve şekilli elemanlarından oluşur Plazma fundememtal substans olarak kabul edilir. Kanın fonksiyonları Transport Gaz, besin, hormon, atık maddeler,
KAN DOKUSU Prof. Dr. Levent ERGÜN 1 Kan Dokusu Plazma (sıvı) ve şekilli elemanlarından oluşur Plazma fundememtal substans olarak kabul edilir. Kanın fonksiyonları Transport Gaz, besin, hormon, atık maddeler,
ÜNİTE 4 DÜNYAMIZI SARAN ÖRTÜ TOPRAK
 ÜNİTE 4 DÜNYAMIZI SARAN ÖRTÜ TOPRAK ÜNİTENİN KONULARI Toprağın Oluşumu Fiziksel Parçalanma Kimyasal Ayrışma Biyolojik Ayrışma Toprağın Doğal Yapısı Katı Kısım Sıvı Kısım ve Gaz Kısım Toprağın Katmanları
ÜNİTE 4 DÜNYAMIZI SARAN ÖRTÜ TOPRAK ÜNİTENİN KONULARI Toprağın Oluşumu Fiziksel Parçalanma Kimyasal Ayrışma Biyolojik Ayrışma Toprağın Doğal Yapısı Katı Kısım Sıvı Kısım ve Gaz Kısım Toprağın Katmanları
BELKİDE BİYOLOJİNİN EN TEMEL KONUSU EN ZEVKLİ KONUSUNA BAŞLAYALIM ARKADAŞLAR!!!
 DERS : BİYOLOJİ KONU: HÜCRE BELKİDE BİYOLOJİNİN EN TEMEL KONUSU EN ZEVKLİ KONUSUNA BAŞLAYALIM ARKADAŞLAR!!! Canlıların canlılık özelliği gösteren en küçük yapı birimidir.( Virüsler hariç) Şekil: Bir hayvan
DERS : BİYOLOJİ KONU: HÜCRE BELKİDE BİYOLOJİNİN EN TEMEL KONUSU EN ZEVKLİ KONUSUNA BAŞLAYALIM ARKADAŞLAR!!! Canlıların canlılık özelliği gösteren en küçük yapı birimidir.( Virüsler hariç) Şekil: Bir hayvan
4- Solunum Sisteminin Çalışması : Solunum sistemi soluk (nefes) alıp verme olayları sayesinde çalışır.
 SOLUNUM SİSTEMİ Canlılar yaşamsal faaliyetlerini sürdürebilmek için enerjiye ihtiyaç duyarlar. İhtiyaç duyulan bu enerji besinlerden karşılanır. Hücre içerisinde besinlerden enerjinin üretilebilmesi için,
SOLUNUM SİSTEMİ Canlılar yaşamsal faaliyetlerini sürdürebilmek için enerjiye ihtiyaç duyarlar. İhtiyaç duyulan bu enerji besinlerden karşılanır. Hücre içerisinde besinlerden enerjinin üretilebilmesi için,
KAS DOKUSU. Kontraksiyon özelliği gelişmiş hücrelerden oluşur Kas hücresi : Fibra muskularis = Kas teli = Kas iplikleri
 KAS DOKUSU Kontraksiyon özelliği gelişmiş hücrelerden oluşur Kas hücresi : Fibra muskularis = Kas teli = Kas iplikleri Kasın Fonksiyonu Hareket Solunum Vücut ısısının üretimi İletişim Organların kontraksiyonu
KAS DOKUSU Kontraksiyon özelliği gelişmiş hücrelerden oluşur Kas hücresi : Fibra muskularis = Kas teli = Kas iplikleri Kasın Fonksiyonu Hareket Solunum Vücut ısısının üretimi İletişim Organların kontraksiyonu
Hayvan Yapı ve İşlevine Giriş
 Hayvan Yapı ve İşlevine Giriş İşlevsel Anatomi Hayvan dokularında yapı-işlev ile bağlantılıdır. Evrimsel süreçte doğal seçilim yapının işleve uymasında rol oynar. Anatomi, bir organizmanın yapısını, Fizyoloji
Hayvan Yapı ve İşlevine Giriş İşlevsel Anatomi Hayvan dokularında yapı-işlev ile bağlantılıdır. Evrimsel süreçte doğal seçilim yapının işleve uymasında rol oynar. Anatomi, bir organizmanın yapısını, Fizyoloji
SOLUNUM SİSTEMİ HİSTOLOJİSİ VE EMBRİYOLOJİSİ. Prof. Dr. Bülent AHISHALI İstanbul Tıp Fakültesi Histoloji ve Embriyoloji AD
 SOLUNUM SİSTEMİ HİSTOLOJİSİ VE EMBRİYOLOJİSİ Prof. Dr. Bülent AHISHALI İstanbul Tıp Fakültesi Histoloji ve Embriyoloji AD Solunum sistemi işlevleri / yapısal bileşenleri Gaz değişimi Tip 1 alveolar epitel
SOLUNUM SİSTEMİ HİSTOLOJİSİ VE EMBRİYOLOJİSİ Prof. Dr. Bülent AHISHALI İstanbul Tıp Fakültesi Histoloji ve Embriyoloji AD Solunum sistemi işlevleri / yapısal bileşenleri Gaz değişimi Tip 1 alveolar epitel
SİNİR SİSTEMLERİ. SANTRAL SİNİR SİSTEMİ Beyin. Anatomik Olarak PERİFERİK SİNİR SİSTEMİ His Motor
 ANATOMİ Anatomi, vücut bölümlerinin yapısını ve gelişimini inceleyen bir bilim dalıdır. Bu bilim dalı, vücut bölümlerinin yapılaşması ve biçimleri ile ilgilendiği için, Morfoloji'nin bir alt grubu veya
ANATOMİ Anatomi, vücut bölümlerinin yapısını ve gelişimini inceleyen bir bilim dalıdır. Bu bilim dalı, vücut bölümlerinin yapılaşması ve biçimleri ile ilgilendiği için, Morfoloji'nin bir alt grubu veya
Doç. Dr. Alev Gürol BAYRAKTAROĞLU
 Doç. Dr. Alev Gürol BAYRAKTAROĞLU EXTRAEMBRİYONAL KESELERİN MEYDANA GELİŞİ Zigottan sonraki gelişmelerle uterusa ulaşmış olan blastosist in intrauterin tesirlere ve dış basınçlara karşı korunması gerekir.
Doç. Dr. Alev Gürol BAYRAKTAROĞLU EXTRAEMBRİYONAL KESELERİN MEYDANA GELİŞİ Zigottan sonraki gelişmelerle uterusa ulaşmış olan blastosist in intrauterin tesirlere ve dış basınçlara karşı korunması gerekir.
11. SINIF KONU ANLATIMI 43 SİNDİRİM SİSTEMİ 2 SİNDİRİM SİSTEMİ ORGANLARI
 11. SINIF KONU ANLATIMI 43 SİNDİRİM SİSTEMİ 2 SİNDİRİM SİSTEMİ ORGANLARI 4) Mide Tek gözlü torba şeklinde olan, kaburgaların ve diyaframın altında karın boşluğunun sol üst bölgesinde, yemek borusu ve ince
11. SINIF KONU ANLATIMI 43 SİNDİRİM SİSTEMİ 2 SİNDİRİM SİSTEMİ ORGANLARI 4) Mide Tek gözlü torba şeklinde olan, kaburgaların ve diyaframın altında karın boşluğunun sol üst bölgesinde, yemek borusu ve ince
KİNEZYOLOJİ ÖĞR.GÖR. CİHAN CİCİK
 KİNEZYOLOJİ ÖĞR.GÖR. CİHAN CİCİK 1 COLUMNA VERTEBRALİS 2 COLUMNA VERTEBRALİS 1) Columna vertebralis pelvis üzerine merkezi olarak oturmuş bir sütuna benzer ve destek vazifesi görerek vücudun dik durmasını
KİNEZYOLOJİ ÖĞR.GÖR. CİHAN CİCİK 1 COLUMNA VERTEBRALİS 2 COLUMNA VERTEBRALİS 1) Columna vertebralis pelvis üzerine merkezi olarak oturmuş bir sütuna benzer ve destek vazifesi görerek vücudun dik durmasını
SİNÜS - AĞRI, BASINÇ, AKINTI
 SİNÜS - AĞRI, BASINÇ, AKINTI Yardım edin sinüslerim beni öldürüyor! Bunu daha önce hiç söylediniz mi?. Eğer cevabınız hayır ise siz çok şanslısınız demektir. Çünkü her yıl milyonlarca lira sinüs problemleri
SİNÜS - AĞRI, BASINÇ, AKINTI Yardım edin sinüslerim beni öldürüyor! Bunu daha önce hiç söylediniz mi?. Eğer cevabınız hayır ise siz çok şanslısınız demektir. Çünkü her yıl milyonlarca lira sinüs problemleri
Doç. Dr. Alev Gürol BAYRAKTAROĞLU
 Doç. Dr. Alev Gürol BAYRAKTAROĞLU EXTRAEMBRİYONAL KESELERİN MEYDANA GELİŞİ VE GÖBEK KORDONU Zigottan sonraki gelişmelerle uterusa ulaşmış olan blastosist in intrauterin tesirlere ve dış basınçlara karşı
Doç. Dr. Alev Gürol BAYRAKTAROĞLU EXTRAEMBRİYONAL KESELERİN MEYDANA GELİŞİ VE GÖBEK KORDONU Zigottan sonraki gelişmelerle uterusa ulaşmış olan blastosist in intrauterin tesirlere ve dış basınçlara karşı
SOLUNUM SİSTEMİ ANATOMİSİ. Öğr. Gör. Nurhan BİNGÖL
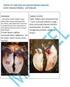 SOLUNUM SİSTEMİ ANATOMİSİ Öğr. Gör. Nurhan BİNGÖL SOLUNUM YOLLARININ YAPI VE İŞLEVLERİ Solunum, fizyolojik bir olaydır ve yaşam için gerekli oksijeni sağlar. Dış ortamdan alınan hava içindeki oksijen ile
SOLUNUM SİSTEMİ ANATOMİSİ Öğr. Gör. Nurhan BİNGÖL SOLUNUM YOLLARININ YAPI VE İŞLEVLERİ Solunum, fizyolojik bir olaydır ve yaşam için gerekli oksijeni sağlar. Dış ortamdan alınan hava içindeki oksijen ile
Solunum Sistemi Fizyolojisi
 Solunum Sistemi Fizyolojisi Solunum Sistemi Ne İş Yapar? O 2 değişimi Havadan kana Kandan hücrelere CO 2 değişimi Hücrelerden kana Kandan havaya Kan ph sının düzenlenmesi Ses çıkartma Solunum Sistemi:
Solunum Sistemi Fizyolojisi Solunum Sistemi Ne İş Yapar? O 2 değişimi Havadan kana Kandan hücrelere CO 2 değişimi Hücrelerden kana Kandan havaya Kan ph sının düzenlenmesi Ses çıkartma Solunum Sistemi:
OMÜ TIP FAKÜLTESİ DERS YILI DÖNEM I HAYATIN DEVAMI II UYGULAMA REHBERİ
 OMÜ TIP FAKÜLTEİ 2016-2017 DER YILI DÖNEM I HAYATIN DEVAMI II UYGULAMANIN ADI: indirim Kanalı Histolojisi UYGULAMA REHBERİ I. AMAÇ: indirim kanalını oluşturan organlarıdan Özofagus ve Midenin duvar yapılarının
OMÜ TIP FAKÜLTEİ 2016-2017 DER YILI DÖNEM I HAYATIN DEVAMI II UYGULAMANIN ADI: indirim Kanalı Histolojisi UYGULAMA REHBERİ I. AMAÇ: indirim kanalını oluşturan organlarıdan Özofagus ve Midenin duvar yapılarının
