T.C. SÜLEYMAN DEMĠREL ÜNĠVERSĠTESĠ FEN BĠLĠMLERĠ ENSTĠTÜSÜ
|
|
|
- Özge Erem
- 5 yıl önce
- İzleme sayısı:
Transkript
1 T.C. SÜLEYMAN DEMĠREL ÜNĠVERSĠTESĠ FEN BĠLĠMLERĠ ENSTĠTÜSÜ MĠKROSPOR KÜLTÜRÜ ĠLE MAKARNALIK BUĞDAY BĠTKĠSĠNDE (Triticum durum Desf.) EMBRĠYO ÜRETĠMĠ VE BĠTKĠ REGENERASYONU Yasemin COġKUN DanıĢman: Prof. Dr. Çiğdem SAVAġKAN DOKTORA TEZĠ BĠYOLOJĠ ANABĠLĠM DALI ISPARTA
2
3 ĠÇĠNDEKĠLER Sayfa İÇİNDEKİLER...i ÖZET... iii ABSTRACT... iv TEŞEKKÜR... v ŞEKİLLER DİZİNİ... vi ÇİZELGELER DİZİNİ... viii SİMGELER DİZİNİ... x 1. GİRİŞ KAYNAK ÖZETLERİ Buğday (Triticum sp.) Mikrospor Kültür Tekniği ile Yapılan Çalışmalar Arpa (Hordeum sp.) Mikrospor Kültür Tekniği ile Yapılan Çalışmalar MATERYAL VE YÖNTEM Materyal Yöntem Donör bitkilerin yetiştirilmesi Kültüre alınacak mikrosporların gelişim dönemlerinin belirlenmesi Başakların toplanması Başakların sterilizasyonu Başak ve anterlere uygulanan önişlemler Mikrosporların izolasyonu Kültür ortamının hazırlanması ve mikrosporların aktarımı Mikrosporlardan embriyoid oluşumu ve farklılaşma ortamının hazırlanması Regenerasyon ortamının hazırlanması Verilerin değerlendirilmesi ARAŞTIRMA BULGULARI Farklı Önişlem Uygulamalarının Mikrospor Kültüründe Genotiplere Etkisi Farklı önişlem uygulamalarının Triticum durum Desf. cv. Kızıltan-91 çeşidine etkisi i
4 Farklı önişlem uygulamalarının Triticum durum Desf. cv. Ç-1252 çeşidine etkisi Farklı önişlem uygulamalarının Triticum durum Desf. cv. Mirzabey 2000 çeşidine etkisi Farklı önişlem uygulamalarının Triticum durum Desf. cv. Kunduru-1149 çeşidine etkisi Farklı önişlem uygulamalarının Triticum aestivum L. cv. Gün-91 çeşidine etkisi Mikrospor kültüründe bölünen mikrospor sayısının, embriyoid sayısına (> 2 mm) ve bitki regenerasyonuna etkisi M Mannitol (+4ºC) Önişlem Uygulamasının Mikrospor Kültüründe Genotiplere Etkisi TARTIŞMA VE SONUÇ KAYNAKLAR ÖZGEÇMİŞ ii
5 ÖZET Doktora Tezi MĠKROSPOR KÜLTÜRÜ ĠLE MAKARNALIK BUĞDAY BĠTKĠSĠNDE (Triticum durum Desf.) EMBRĠYO ÜRETĠMĠ VE BĠTKĠ REGENERASYONU Yasemin COġKUN Süleyman Demirel Üniversitesi Fen Bilimleri Enstitüsü Biyoloji Anabilim Dalı DanıĢman: Prof. Dr. Çiğdem SAVAġKAN Bu çalışma, dört farklı durum buğdayı Triticum durum Desf. cvs. Kızıltan-91, Ç-1252, Mirzabey 2000 ve Kunduru-1149 (tetraploid-aabb, 2n=4x=28) genotipleri kullanılarak, mikrospor kültürü yoluyla embriyoid ve bitki regenerasyonu elde etmede etkili bir protokol geliştirmek amacıyla yapılmıştır. Ayrıca, mikrospor kültür tekniğine cevabının yüksek olduğu bilinen ekmeklik buğday genotipi Triticum aestivum L. cv. Gün-91 (heksaploid- AABBDD, 2n=6x=42) kontrol grubu olarak kullanılmıştır. Mikrospor kültürü yöntemi oluşturulurken denemelerde, dört makarnalık buğday genotipi için en iyi önişlem uygulaması, mikrospor izolasyon yöntemi ve heksitol çeşidi (mannitol veya sorbitol) belirlenmeye ve uygun kültür ortamları hassasiyetle hazırlanmaya çalışılmıştır. Bu tez çalışmasında, makarnalık ve ekmeklik buğday genotiplerinde beş farklı önişlem uygulaması [1. soğuk önişlem (+4ºC), M mannitol (+4ºC) a. ovaryumsuz, b. ovaryum eklenmiş, M sorbitol (+4ºC), M mannitol (oda sıcaklığı)] kullanılmıştır. Tüm genotiplerde bölünen mikrospor sayısına, embriyoid benzeri yapılara, 2 mm den büyük ve küçük embriyoid sayısına, yeşil ve albino bitki regenerasyonuna ve toplam bitki regenerasyonuna ait sonuçlar karşılaştırılmıştır. Makarnalık ve ekmeklik buğday çeşitlerinde embriyoid oluşumu ve toplam bitki regenerasyonunda en iyi sonuçlar 0.4 M mannitol ve +4ºC önişlem uygulaması ile Gün-91 çeşidinden elde edilmiştir. Makarnalık buğday genotipleri arasından ise en fazla embriyoid oluşumu Kızıltan-91 çeşidinde görülmüştür. En fazla bitki regenerasyonu Kunduru-1149 çeşidinden elde edilmiştir. Genotipler ile önişlem uygulamaları arasındaki etkileşim P<0.01 seviyesinde önemli bulunmuştur. Çalışmamızda genotipler ve karakterler arası ilişkiler incelendiğinde, bölünen mikrospor sayısının ve toplam bitki regenerasyonunun genlerden sırasıyla r= 0.452* ve r=0.679** olarak pozitif etkilendiği belirlenmiştir. Fakat embriyoid oluşumunda genler tarafından herhangi bir etki olmamıştır. Embriyoid oluşumunun, çevresel stres faktörlerine diğer bir ifade ile önişlem uygulamalarına bağlı olarak değiştiği görülmüştür. Anahtar Kelimeler: Androgenesis, bitki regenerasyonu, embriyoid, haploid, mannitol, mikrospor kültürü, Triticum durum Desf. 2011, 115 sayfa iii
6 ABSTRACT Ph.D. Thesis EMBRYO PRODUCTION AND PLANT REGENERATION IN DURUM WHEAT (Triticum durum Desf.) USING MICROSPORE CULTURE Yasemin COġKUN Süleyman Demirel University Graduate School of Applied and Natural Sciences Department of Biology Supervisor: Prof. Dr. Çiğdem SAVAġKAN In this study, four different durum wheat genotypes (Triticum durum Desf. cvs. Kızıltan- 91, Ç-1252, Mirzabey 2000 and Kunduru-1149 ) (tetraploid-aabb, 2n=4x=28) have been investigated to improve an efficient protocol for production embryoids and plant regeneration through microspore culture technique. In addition, Triticum aestivum L. cv. Gün-91 (heksaploid-aabbdd, 2n=6x=42) was used as a control group because of its high androgenetic response to microspore culture. Experiments were performed on to determine the highest pretreatment condition for four durum wheat genotypes and to identify a suitable microspore isolation method and also to find the best hexitol (mannitol or sorbitol) preparing a proper culture medium for embryogenesis. In this thesis research, five different pretreatments [1. cold pretreatment (+4ºC), M mannitol (+4ºC) a. without ovary, b. with ovary, M sorbitol (+4ºC), M mannitol (room temperature)] were used in durum and bread wheat genotypes. The number of dividing microspores, embryo-like structures, the number of embryoids bigger than 2 mm and smaller than 2 mm, green and albino plant regeneration and total plant regeneration were compared of all genotypes. According to the results, the highest amount of embryoid formation and total of plant regeneration were observed in Triticum aestivum L. cv. Gün-91 using 0.4 M mannitol and +4ºC cold pretreatment. The highest embryo formation was observed in Kızıltan-91 within the durum genotypes studied in this research. However Kunduru-1149 produced the highest plant regeneration. The interaction between genotypes and pretreatments was found significant (P<0.01). According to the correlation between genotypes and characters, dividing microspores and total plant regeneration were affected by genes positively respectively at r= 0.452* and r=0.679**. On the other hand, the embryo formation did not affect by genes. It has changed by environmental stress factors in other words pretreatmet conditions. Key Words: Androgenesis, plant regeneration, embryoid, haploid, mannitol, microspore culture, Triticum durum Desf. 2011, 115 pages iv
7 TEġEKKÜR Yirminci yüzyılın ikinci yarısına damgasını vuran Biyoteknolojinin, her geçen gün artan önemine dayanarak makarnalık buğday genotiplerinde mikrospor kültürü çalışmasını tez konusu olarak öneren danışman hocam Sayın Prof. Dr. Çiğdem SAVAŞKAN a, çalışmam süresince gördüğüm değerli yardımları, bilgi birikimini paylaşımı ve her türlü desteği için yürekten teşekkür ederim. Tez çalışmalarımın yürütülmesi sırasında bilgi ve desteklerini benden esirgemeyen değerli hocalarım Sayın Prof. Dr. İsmail TÜRKAN a ve Prof. Dr. Hasan ÖZÇELİK e sonsuz teşekkür ederim. Tez çalışmalarım sırasında destek ve yardımlarını gördüğüm, acı tatlı her şeyi paylaşıp sıkıntılarımı hafifleten ve hayata dair birçok şeyi paylaştığım değerli arkadaşım Arş. Gör. Rağbet Ezgi DURAN a teşekkür ederim. Bitkilerin yetiştirilmesinde ve laboratuvar çalışmaları sırasında yardımcı olan Arş. Gör. Mehmet Tolgahan HAKAN a ve Tunhan DEMİRCİ ye çok teşekkür ederim. Doktora eğitimim boyunca desteklerini gördüğüm, bundan sonra da bilgi ve tecrübelerine her zaman başvuracağım Biyoloji Bölümü ndeki bütün değerli hocalarıma sevgi, saygı ve teşekkürlerimi sunarım D-08 No`lu Proje ile tezimi maddi olarak destekleyen Süleyman Demirel Üniversitesi Bilimsel Araştırma Projeleri Koordinasyon Birimi ne teşekkür ederim. TÜBİTAK-Yurt İçi Doktora Bursiyeri olarak, tez çalışmalarımı gerçekleştirme ve bilime katkı sağlama yolunda doktora eğitimim boyunca sağladıkları destek için TÜBİTAK- Bilim İnsanı Destekleme Daire Başkanlığı (BİDEB) na sonsuz saygı ve teşekkürlerimi sunarım. Tüm yaşamımda olduğu gibi doktoram boyunca da sonsuz anlayış ve manevi desteklerini hiçbir zaman esirgemeyen sevgili anne ve babama kelimelerle ifade edemeyeceğimi bilsem de sonsuz şükranlarımı sunuyorum. Sizi çok seviyorum v Yasemin COŞKUN ISPARTA, 2011
8 ġekġller DĠZĠNĠ Sayfa Şekil 1.1. Mikrosporların in vivo ve in vitro koşullarda gösterdikleri alternatif yollar... 4 Şekil 3.1. Bitki büyütme odasında yetiştirilen donör bitkiler...40 Şekil 3.2. Mikrospor gelişme dönemleri...41 Şekil 3.3. Başakların toplanması...42 Şekil 3.4. Kılçıkları kesilen başaklar...43 Şekil 3.5. Başaklara uygulanan farklı önişlemler...43 Şekil 3.6. Anterlerin stereo mikroskop altında başaklardan alınması...43 Şekil 3.7. Anterlerin mannitol çözeltisine alınması...44 Şekil 3.8. Başakçıktan alınan ovaryumların petri kabında +4ºC de buzdolabında muhafazası...45 Şekil 3.9. Farklı önişlem uygulamaları sonucu anterdeki mikrosporların görünümü...45 Şekil Filtre sistemi ve vakum pompası...46 Şekil Filtre kağıdı üzerindeki anterlerin cam çubuk ile ezilmesi...47 Şekil İzole edilen mikrosporların santrifüj edilmesi...47 Şekil Santrifüj edilen mikrosporların dibe çökmesiyle oluşan tortu...47 Şekil İzole edilen mikrosporların mikroskop altındaki görünüşleri...48 Şekil Mikrosporların ovaryumlar ile birlikte MMS4 indüksiyon ortamına alınışı Şekil Kızıltan-91 çeşidinde 0.4 M mannitol ve 0.4 M sorbitol uygulamsında embriyoid oluşumu...51 Şekil Farklı önişlem uygulamaları sonucu Kızıltan-91 çeşidine ait kültür ortamında oluşan olgun embriyoidler...51 Şekil Mikrosporlardan oluşan embriyoidler...52 Şekil Çeşitlere ait olgun embriyoidlerin MMS5 farklılaşma ortamına aktarımı Şekil Triticum durum Desf. cv. Kunduru-1149 çeşidine ait albino ve yeşil bitki regenerasyonu...53 vi
9 Şekil 4.1. Mikrosporların 7 gün 0.4 M mannitol önişlem uygulaması sonrasındaki fibriler sitoplazmaya sahip iki farklı embriyogenik görünümü (yıldız-şekli)...60 Şekil 4.2. İndüksiyon ortamında 10 gün sonra bölünme yeteneği gösteren mikrosporların iki farklı görünümü...61 Şekil 4.3. İndüksiyon ortamında 20 gün sonra mikrosporlar arasında görülen embriyogenik yapı...61 Şekil 4.4. İndüksiyon ortamında 30 gün sonra oluşan büyük (2 mm-solda) ve küçük (<2 mm-sağda) embriyoidler...62 Şekil 4.5. Genotiplere ait 30 gün sonra oluşan olgun embriyoidler...63 Şekil 4.6. Triticum durum Desf. cv. Kızıltan-91 çeşidine ait albino ve yeşil bitki regenerasyonu...64 Şekil 4.7. Farklı önişlem uygulamalarının Kızıltan-91 çeşidinde mikrospor kültüründe karakterlere etkisi...68 Şekil 4.8. Farklı önişlem uygulamalarının Ç-1252 çeşidinde mikrospor kültüründe karakterlere etkisi...72 Şekil 4.9. Farklı önişlem uygulamalarının Mirzabey 2000 çeşidinde mikrospor kültüründe karakterlere etkisi...75 Şekil Farklı önişlem uygulamalarının Kunduru-1149 çeşidinde mikrospor kültüründe karakterlere etkisi...79 Şekil Farklı önişlem uygulamalarının Gün-91 çeşidinde mikrospor kültüründe karakterlere etkisi...83 Şekil Genotiplere ait farklı önişlem uygulamalarının mikrospor kültüründeki karakterlere etkisi...85 Şekil Genotiple ait 0.4 M mannitol ile soğuk önişlem uygulamasının mikrospor kültüründe karakterlere etkisi...91 vii
10 ÇĠZELGELER DĠZĠNĠ Sayfa Çizelge 1.1. Mikrospor kültürü için ön görülen yöntem basamakları... 7 Çizelge 3.1. Başak ve anterlere uygulanan farklı önişlem ve ortam koşulları...44 Çizelge 3.2. Buğday mikrospor kültüründe mikrospor indüksiyonu (MMS4) ve embriyo farklılaşması (MMS5) için kullanılan modifiye MS kültür ortamları ve orijinal MS kültür ortamı...49 Çizelge 4.1. Buğday genotiplerinde incelenen karakterlere ait varyans analizi sonuçları...56 Çizelge 4.2. Genotiplere ait farklı önişlem uygulamalarının mikrospor kültüründeki etkisi...59 Çizelge 4.3. Triticum durum Desf. cv. Kızıltan-91 çeşidine ait farklı önişlem uygulamaları ile mikrospor kültürü sonucu elde edilen bulgular...66 Çizelge 4.4. Farklı önişlem uygulamalarının Triticum durum Desf. cv. Kızıltan-91 çeşidine ait embriyo benzeri yapılar, embriyoid ve bitki regenerasyonu üzerine etkisi...67 Çizelge 4.5. Triticum durum Desf. cv. Ç-1252 çeşidine ait farklı önişlem uygulamaları ile mikrospor kültürü sonucu elde edilen bulgular...70 Çizelge 4.6. Farklı önişlem uygulamalarının Triticum durum Desf. cv. Ç-1252 çeşidine ait embriyo benzeri yapılar, embriyoid ve bitki regenerasyonu üzerine etkisi...71 Çizelge 4.7. Triticum durum Desf. cv. Mirzabey 2000 çeşidine ait farklı önişlem uygulamaları ile mikrospor kültürü sonucu elde edilen bulgular...73 Çizelge 4.8. Farklı önişlem uygulamalarının Triticum durum Desf. cv. Mirzabey 2000 çeşidine ait embriyo benzeri yapılar, embriyoid ve bitki regenerasyonu üzerine etkisi...74 Çizelge 4.9. Triticum durum Desf. cv. Kunduru-1149 çeşidine ait farklı önişlem uygulamaları ile mikrospor kültürü sonucu elde edilen bulgular...77 Çizelge Farklı önişlem uygulamalarının Triticum durum Desf. cv. Kunduru çeşidine ait embriyo benzeri yapılar, embriyoid ve bitki regenerasyonu üzerine etkisi...78 viii
11 Çizelge Triticum aestivum L. cv. Gün-91 çeşidine ait farklı önişlem uygulamaları ile mikrospor kültürü sonucu elde edilen bulgular...81 Çizelge Farklı önişlem uygulamalarının Triticum aestivum L. cv. Gün-91 çeşidine ait embriyo benzeri yapılar, embriyoid ve bitki regenerasyonu üzerine etkisi...82 Çizelge İncelenen karakterler arası ilişkiler (r)...84 Çizelge Makarnalık ve ekmeklik buğday genotiplerinde 0.4 M mannitol (+4ºC) önişlem uygulaması ile mikrospor kültürü sonucu elde edilen bulgular...87 Çizelge Genotiplere ait 0.4 M mannitol ile soğuk önişlem uygulamasının embriyo benzeri yapılar, embriyoid ve bitki regenerasyonu üzerine etkisi...88 ix
12 SĠMGELER DĠZĠNĠ 2,4-D 2-HNA ABA AgNO 3 AGP BAP CIMMYT FAO HMF IAA ICARDA IWWIP KIN MES MET MS MMS4 MMS5 NAA PAA PEG TARM v/w 2,4-dikloro fenoksi asetik asit 2-hidroksinikotinik asit Absisik asit Gümüş nitrat Arabinogalaktan proteinleri Benzil amino purin Uluslararası Mısır ve Buğday Geliştirme Merkezi Birleşmiş Milletler Gıda ve Tarım Örgütü 5-hidroksimetilfurfural Indol-3-asetik asit Uluslararası Kurak Alanlar Tarımsal Araştırma Merkezi Uluslararası Kışlık Buğday Geliştirme Programı Kinetin 2- (N-morfolino) etanesülfonik asit Paklobutrazol Murashige ve Skoog kültür ortamı Modifiye edilmiş (indüksiyon) Murashige ve Skoog kültür ortamı Modifiye edilmiş (farklılaşma) Murashige ve Skoog kültür ortamı Naftalen asetik asit Fenil asetik asit Polietilen glikol Tarla Bitkileri Merkez Araştırma Enstitüsü ağırlık/hacim x
13 1. GİRİŞ Angiospermler, haploid gametofit ve diploid sporofit generasyonları arasında değişen bir hayat devri gösterirler. Diploid sporofit nesil, mayoz bölünme ile sporları meydana getirir; sporlar da haploid gametofitleri ortaya çıkarır ve sonra mitoz bölünme yardımı ile haploid gametler üreme yeteneği gösterir. Gametofit safhasında, anter lokuluslarındaki mikrospor ana hücreleri mayoz ve mitoz bölünmeler geçirerek erkek gametofitlere veya polen tanelerine dönüşürler (Zheng, 2003). Bazı çevresel faktörlerle (donör bitkilerin yetiştiği fiziksel ortam koşulları, önişlem uygulamaları, kültür ortamı içeriği gibi) olgunlaşmamış polenler (mikrosporlar) gametofitik safhadan sporofitik safhaya doğru bir gelişme gösterebilirler. Bunun sonucunda, embriyoid adı verilen embriyo benzeri yapılar oluşmaktadır (Reynolds, 1997; Touraev et al., 2001; Zheng et al., 2001). Embriyoidler, hem haploid hem de doubled haploid bitkileri meydana getirebilirler. Bitki hücresinin totipotensi özelliğini mükemmel bir şekilde ortaya koyan bu olaya androgenesis ya da mikrospor embriyogenesis adı verilir. Mikrospor embriyogenesis çalışmalarının en büyük avantajı gametik kromozom sayısına sahip haploid hücreler ile homojen bir populasyon oluşturarak embriyolar üretmektir. Mikrosporlardan meydana gelen embriyoların oranı yalnızca % 1-2 olmasına karşın, bu oran çok sayıda haploid bitki oluşturmak için yeterli olmuştur (Cistue and Kasha, 2005). Haploid bitkiler, somatik hücrelerindeki kromozom sayısı, ait olduğu bitki türünün gamet hücrelerinde bulunan kromozom sayısı (n) kadar olan bitkilerdir. Bu bitkiler, generatif organ ve hücreleri oluşturma yönüne gitmeden önce konsantrasyonu belli çözeltilerle muamele edildiklerinde n sayıdaki kromozom sayısı iki katına çıkartılarak normal gamet ve tohum üretimi sağlamaktadır (Savaşkan vd., 1997). Bu bitkilere doubled haploid bitkiler adı verilir. Doubled haploid bitkilerin genotipleri homozigot olduğundan heterozigot bitkilerde resesif durumda olan karakterler homozigot olarak ifade edilebilir. Heterojen ya da heterozigot genotiplerde resesif durumda pek çok önemli gen bulunmaktadır. Bunlar biyotik (hastalık oluşturanlar ve zararlılar) ve abiyotik (tuzluluk, kuraklık ve soğuk gibi) faktörlere dirençlilik genleri, 1
14 kalite ve verimliliğe ait genler olabilir. Bu genler doubled haploid bitkilerde homozigot olarak dominant genlerin etkisinden kurtulmuş olarak fenotipte ifade edilebilirler (Hakkı vd., 2001; Savaşkan vd., 2003). Mikrosporlarda rekombinasyondan kaynaklanan varyasyon, bu hücrelerin her birinde farklı genetik bilginin bulunduğu anlamına gelmektedir. Rekombinasyondan sonra genlerin gametlere dağılımı mikrosporların taşıdığı genetik özellikleri belirlemektedir. Ayrıca iki farklı A ve B ebeveynlerinin çaprazlanmasıyla melez bireyler meydana gelmektedir. Buna F 1 generasyonu denir. F 1 generasyonunda genlerin dağılımı Mendel kurallarına göre 3:1 oranında olabilir. Mendel kurallarından ayrılışlarda ise genlerin gametlere dağılım oranları farklılıklar gösterebilir. Bu oranlarda gen yapısının dominant veya çekinik özellikte olması ile F 2 generasyonuna ait bitkilerde genetik dağılımın daha fazla ve çeşitli olacağını işaret etmektedir. Bu da fenotipe kantitatif ve kalitatif karakterler olarak yansımaktadır (Savaşkan vd., 2001). Mikrospor kültür tekniğinde her bir mikrosporu kültür ortamında kullanırken taşıdıkları genetik varyasyonu birer birer regenerant bitki olarak alma olasılığı vardır. Bu regenerant bitkilerin hücrelerinde kromozom sayısı haploiddir (n). Yani normalde vücut hücrelerinde taşımaları gereken kromozom sayısının yarısına eşittir. Oysa fertil bitkilerin hücrelerinde 2n sayıda kromozomları olması gerekir. Bunun için mikrosporlarla üretilen haploid bitkilere, döl almaşında bitkinin generatif devresine erişmeden, örneğin monokotillerde başaklanma devresi öncesi, kromozom sayısını iki katına çıkartıcı işlem yapılmalıdır. Bu işlemin temel özelliği hücre bölünmesinde iğ ipliklerini etkilemek, böylece kromozom sayısını ikiye katlamaktır. İğ ipliklerini etkileyerek kromozomların kutuplara dağılmasını engelleyen kimyasal maddeler (kolhisin gibi) vardır. Bu maddeler belli konsantrasyonda bir süre için kullanılır. Böylece her mikrospora mayoz sonunda dağılmış olan genetik bilgi, varyasyonu oluşturan genler ister resesif isterse dominant olsun, tam olarak ikiye katlandığından homozigot olacak ve fenotipte kendini gösterebilecektir. Buna doubled haploid sistem denir. Bunun anlamı, doubled haploid bitkilerde kromozom sayısı 2n seviyeye ulaştığından morfolojik karakterlerde değişiklikler fertil olarak izlenebilecek, 2
15 kantitatif özellikte olanları sayısal olarak ve ölçümlerle hesaplanabilecek, kalitatif özelliklerin ise analizleri yapılabilecektir (Savaşkan vd., 2001; Savaşkan vd., 2003). Günümüzde tek bir basamakta homozigot hatlar elde etmek için androgenesis yoluyla (anter ve mikrospor kültür teknikleri) doubled haploid bitkiler üretilebilmektedir. Androgenesis tekniklerinden biri olan mikrospor kültürü, yeni varyeteler geliştirmede, moleküler ve genetik manipülasyonlarda ve bitki gelişme biyolojisi ile ilgili temel araştırmaların birçok alanında kullanılmaktadır. Bu teknik etkili bir bitki regenerasyonu yöntemiyle gametik hücreler, genetik transformasyon ve transgenik çalışmalar için de tercih edilmiştir. Ayrıca, tek hücrelere doğrudan ulaşma ve doğru embriyoid oluşumu, mikrospor kültür tekniğini embriyogenesis ve diğer bitki geliştirme biyolojisi çalışmaları için ideal bir yöntem yapmıştır (Vicente et al., 1991; Zheng, 2003). Biyoteknolojik çalışmalar için oldukça önemli olan mikrospor embriyogenesisi, bitkilerin totipotensi özelliklerini çalışmak için de model bir sistem oluşturur (Cistue and Kasha, 2005). Olgunlaşmamış mikrosporların, anter içerisinden izole edilerek in vitro koşullarda özel hazırlanmış besin ortamlarında geliştirilmesi ve bunlardan haploid embriyoların elde edilmesi işlemine mikrospor kültürü adı verilmektedir (Şekil 1.1.). Mikrospor kültürü yoluyla haploid bitkilerin elde edilmesi ilk kez Nitsch (1974) tarafından bildirilmiştir. İlk mikrospor kültürü çalışmaları tütün (Nicotiana tabacum L.) ve mısır (Zea mays L.) bitkilerinde gerçekleştirilmiştir (Pesticelli et al., 1989). Günümüzde ise anterlerden izole edilen mikrosporların kültüre alınmasıyla birçok bitki türünde başarılı sonuçlar elde edilmiştir. Patates (Uhrig, 1985), kolza (Lichter, 1982), Datura (Nitsch and Norreel, 1973), çeltik (Chen et al., 1981) ve patlıcan (Miyoshi, 1996) türlerinde mikrospor kültürü yoluyla elde edilmiş haploid bitkiler bulunmaktadır. 3
16 Şekil 1.1. Mikrosporların in vivo ve in vitro koşullarda gösterdikleri alternatif yollar (Maluszynski et al., 2003) 4
17 Mikrospor kültürü, anter kültürünün bazı olumsuz özelliklerini ortadan kaldırmak ve böylece elde edilecek haploid embriyo sayısını artırmak amacıyla geliştirilmiş bir yöntemdir. Mikrospor kültürünün avantajlarını aşağıdaki gibi sıralamak mümkündür (Pierik, 1989; Hess, 1992; Foroughi-Wehr and Wenzel, 1993). a) Anter kültüründe, mikrosporlardan başka anter çeperi, septum veya tapetum gibi diploid yapıya sahip anter dokularından da embriyo oluşması durumuyla karşılaşılabilmektedir. Oluşan diploid embriyoların yaşama kuvvetleri, her zaman haploidlere oranla daha fazla olmakta ve haploid embriyolarla istenmeyen bir rekabete girmektedirler. Mikrospor kültürü yapılarak, diploid yapıya sahip anter dokuları ortamdan uzaklaştırılmakta ve böylece donör bitkinin yapısına sahip embriyo regenerasyon olasılığı tamamen ortadan kaldırılmaktadır. b) Anter kültüründe mikrosporlar, besin ortamındaki maddeleri anter çeperinden geçtikten sonra alabilmektedir. Mikrospor kültüründe ise besin maddelerinin mikrosporlara taşınmasında engel olarak görülebilecek anter çeperi uzaklaştırıldığından, mikrosporların besin ortamıyla doğrudan teması sağlanmış olmaktadır. c) Anterde bulunan bazı engelleyici maddeler [absisik asit (ABA) veya toksik maddeler], anter çeperiyle birlikte ortamdan uzaklaştırılacağından sorun olmaktan çıkmaktadırlar. d) Tek bir mikrospordan doğrudan embriyoya dönüşüm sağlanabildiğinden gen transferi çalışmaları için çok uygun bir kültür yöntemidir. Agrobacterium aracılığı ile genetik transformasyon çalışmalarında önemli avantajlar sağlamaktadır. e) Biyotik veya abiyotik kökenli stres koşullarına dayanıklılık amaçlandığında in vitro seleksiyon için çok uygun bir yöntemdir. 5
18 f) Mikrosporlar, mutasyon araştırmaları ve genetik manipülasyonlar için anterlere göre daha uygun bir başlangıç materyalidir. Ayrıca diğer bir üreme hücresi olan ovaryuma göre de sayısal bakımından daha avantajlıdır. g) Kültür koşullarında embriyo oluşumunu izlemek, anter kültürüne göre daha kolay olmaktadır. h) Daha fazla sayıda homojen materyal ile çalışma olanağı sağlar ve sayısal olarak haploid embriyo verimi, bazı türlerde anter kültürüne oranla daha yüksektir. Örneğin, mikrospor kültürü kolzada embriyo üretimi bakımından anter kültürüne göre çok daha verimlidir (Babaoğlu vd., 2002). Mikrospor kültürünün yukarıda açıklanan avantajlarına rağmen, günümüzde halen bu yolla haploid bitki regenerasyonu sağlamak zordur ve mikrosporun in vitro koşullarda gelişerek farklılaşması, çok özelleşmiş tekniklere gereksinim duyar. Ayrıca, anter kültürüne göre çok daha fazla karmaşık besin ortamlarının kullanılması gereklidir. Bununla birlikte mikrospor kültürü, Brassica napus L., Capsicum annuum L., Datura innoxia Mill., Daucus carota L., Ginkgo biloba L., Hordeum vulgare L., Gossypium sp., Petunia sp., Rosa sp., Lycopersicum esculentum Mill., Brassica oleracea L., Nicotiana tabacum L., Secale cereale L. ve Triticum aestivum L. gibi türlerde olumlu sonuçlar vermiş ve haploid embriyoların elde edilmesi için elverişli olduğu görülmüştür (Maluszynski et al., 2003). Mikrospor kültüründe başarı, mikrospor embriyogensisi için uygun yöntem basamaklarının kullanılmasına bağlıdır (Çizelge 1.1.). Androgenetik mikrospor sayısı ve mikrospor başına elde edilen embriyo sayısı, birçok faktörün etkisi altında bulunmaktadır. Mikrospor kültüründen elde edilecek başarıyı etkileyen faktörlerin bir bölümü genetik olup, mikrosporların alındığı donör bitkilerin genotipine bağlıdır. Diğer bir bölümü ise, mikrospor kültürü tekniğinin uygulanması sırasındaki çevre koşullarıyla ilişkilidir. 6
19 Çizelge 1.1. Mikrospor kültürü için ön görülen yöntem basamakları (Zheng, 2003) Basamak Manipülasyon Parametreler Sonuç I Önişlem Yüksek (33ºC)/düşük (4ºC) Canlı mikrosporlar (Embriyogenik sıcaklık, açlık (mannitol) ve (bazıları fibril Potansiyel indüksiyonu) kimyasal sitoplazmasıyla veya yıldız-benzeri yapısıyla karakterize olur II İzolasyon ve Laboratuvar blender Homojen Saflaştırma (hız ve uzunluk); embriyogenik filtrasyon ve yoğunluk mikrospor santrifüjleme (0.58 M populasyonu maltoz üzerine 0.3 M mannitol) III İndüksiyon % 9 maltoz, bitki büyüme Düşük oranda ortamı düzenleyicileri (2,4-D, PAA, embriyogenik (embriyoid gelişimi) kinetin), ovaryumlar, 26-28ºC aborsiyon; sıcaklık, mosmol yüksek sayıda kg -1 H 2 O ozmolarite olgun embriyoid IV Bitkiye dönüşüm Yarı-katı kültür ortamı; Yeşil bitkilerin (embriyoid gelişimi) M sakkaroz; bitki oluşumu büyüme düzenleyicileri yok; ışıklandırma Mikrospor kültüründe başarı, çok büyük bir oranda mikrosporların alındığı bitkilerin genotipine bağlıdır. Şimdiye dek çalışılmış olan bitki türlerinde; aynı kültür koşulları altında, mikrosporların kültür tekniğine yanıtları bakımından genotipler arasında büyük farklılıklar gözlenmiştir (Holme et al., 1999; Cistue et al., 2006; Lantos et al., 2006). Donör bitkinin genotipi kültür tekniğine oldukça uygun olsa da, mikrosporlardan in vitro koşullarda haploid embriyo uyartımını başarabilmek için bu bitkilerin yetiştirildiği ortam koşulları da oldukça önemlidir. Bitkilerin yetiştirildiği dönemdeki ışık yoğunluğu ve kalitesi, günlük ışıklanma süresi, sıcaklık, havadaki CO 2 konsantrasyonu ve bitkinin beslenme koşulları başta olmak üzere tüm çevresel faktörler, o bitkilerden alınan mikrosporlardan elde edilecek başarı üzerinde etkili olabilmektedir (Zheng, 2003). Ayrıca, çeşitli hastalıklar ve böceklenme gibi çevresel stres faktörlerinden de kaçınılmalıdır (Zheng et al., 2001). 7
20 Buğday, arpa, çeltik ve çavdar gibi tahıl bitkilerinde, donör bitkinin yetişme koşullarının mikrospor kültüründeki başarısı üzerinde çok etkili olduğu bilinmektedir. Donör bitkinin yetiştirilmesi aşamasında uygun yetişme koşulları sağlanamadığında, mikrospor kültürü tekniğine çok benzer bir teknik olan anter kültüründeki başarısı yüksek Igri buğday çeşidi bile sadece albino embriyolar oluşturabilmekte, tek bir yeşil normal haploid bitki elde etmek mümkün olamamaktadır (Foroughi-Wehr and Wenzel, 1993). Çeşitli araştırıcılar, donör bitkilerin yetiştirildiği koşulların mikrospor kültürü üzerindeki etkisini, anterlerin içerisinde oluşan embriyogenik mikrosporların oranına bağlamaktadır. Bununla birlikte donör bitki yetiştirme koşullarının etkisi, yalnızca mikrospor morfolojisi değil, aynı zamanda bitkideki fizyolojik ve biyokimyasal olaylar üzerindedir. Yetiştirildiği çevre koşullarının etkisi altında, aminoasitler ve büyüme düzenleyiciler gibi içsel maddeler bakımından farklı kompozisyonlara sahip mikrosporlar kültüre alındıklarında, bunların androgenik verimlilik bakımından farklılık göstermeleri doğaldır (Babaoğlu vd., 2002). In vitro androgenesisin başarıyla uyartılmasında etkili olan en önemli faktörlerden birisi, anterlerin donör bitkiden izole edildiği anda mikrosporların içinde bulundukları gelişme dönemidir. Çoğu bitki türünün mikrospor kültürlerindeki en iyi sonuçlar, tek çekirdekli mikrospor döneminin orta-geç safhasındaki mikrosporları içeren anterlerden alınmaktadır (Rudolf et al., 1999; Zheng, 2003). Bazı bitki türlerinde ise mikrosporların pre-mitotik (Bakos et al., 2007) ya da erken-çift çekirdekli (Soriano et al., 2007) safhaları da uygun olabilmektedir. Mikrosporlar içerisinde nişasta depolanmaya başladıktan sonra, gelişmeyi sporofitik yöne kaydırmak ve haploid embriyo elde etmek için yapılacak uyarılar etkili olamamaktadır. Anterlerdeki mikrosporların gelişme dönemini tespit etmek amacıyla sitolojik gözlemler yapmak gerekmektedir (Reynolds, 1993). Doğru aşamadaki mikrosporları bulunduran anterlerin ve tomurcukların morfolojik özellikleri tanımlandığında, mikrospor kültürü için tomurcuk toplama daha kolay bir işlem haline gelmektedir. Bununla birlikte, doğru aşamadaki anterlerin bulunduğu çiçek tomurcuğunun büyüklüğü; genotipe, tomurcuğun bitki üzerinde bulunduğu yere ve bitki yaşına bağlıdır. 8
21 Mikrospor kültüründe, uygun dönemde toplanan mikrosporlara yapılan önişlem uygulamalarının oldukça önemli etkileri vardır. Mikrospor embriyogenesisine olumlu yönde etki eden önişlemler, soğuk ve sıcaklık şokları, şeker açlığı (mannitol) ve başaklara, anterlere veya mikrosporlara yapılan kimyasal uygulamalardır. Nitrojen açlığı, kısa gün ve düşük sıcaklıklar da mikrospor kültüründe embriyo artışı sağlayan diğer önişlem uygulamaları arasındadır (Reynolds, 1997; Indrianto et al., 1999; Konzak et al., 1999). Ayrıca su stresi, anaerobik koşullar, radyasyon ve indükleyici kimyasallar da donör bitkilere dışarıdan uygulanarak mikrospor embriyogenesisini arttırmaktadır (Imamura and Harada, 1980; 1981; Kyo and Harada, 1986; Touraev et al., 1997; Konzak et al., 1999). Soğuk önişlem uygulamaları, mikrosporların metabolizmasını yavaşlatmakta, böylece mikrosporların normal sıcaklıklarda (25-28 C) kültüre alınıncaya kadar tekrar mitoz bölünmeye devam etmesi için hücre döngüsünü durdurmaktadır. Ayrıca önişlem sırasında zayıf ve yaşama gücü olmayan mikrosporlar hemen kahverengileşip ölmekte, böylece güçlü mikrosporlar kültüre alınmakta ve in vitro koşullarda yüksek oranda regenere olabilmektedir (Zheng, 2003). Mikrospor içerisinde nişasta birikimi, mikrospor kültürü için kritik bir önem taşımaktadır. Birinci polen mitozunu geçirdikten sonra mikrosporlarda nişasta birikimi artmakta ve artık bu aşamaya gelmiş olan mikrosporları embriyo oluşturmak üzere sporofitik gelişmeye yönlendirme şansı kalmamaktadır. Düşük sıcaklıklarda; birinci polen mitozu aşamasında tutulan mikrospor sayısında artış olmakta ve nişasta üretimi bloke edilmektedir. Nişasta içeriği düşük tek çekirdekli mikrosporlar, kültür koşullarında embriyo oluşturmak üzere sporofitik gelişmeye doğru daha kolay yönlendirilebilmektedir (Foroughi-Wehr and Wenzel, 1993). Şeker açlığı olarak adlandırılan mannitol önişlem uygulaması, tahıllarda çeşitli konsantrasyonlarda uygulandığında mikrospor kültüründe embriyo oluşum yüzdesini arttırmıştır (Caredda et al., 2000; Kasha et al., 2001; Cistue et al., 2006). Mannitol, bir yandan mikrosporları gametik safhadan sporofitik safhaya yönelmesini teşvik ederken, diğer yandan anter çeperini zayıflatmaktadır (Lantos et al., 2006). Bitkinin anter duvar dokusunu inceltirken diğer yandan bu mikrosporların gamet oluşumuna 9
22 (polen) gidişini engellemek için belli bir süre en uygun konsantrasyonlu mannitol çözeltisini kullanmak gerekmektedir (Touraev et al., 1996). Yapılan önişlemlerin amacı sadece mikrospor embriyogenesisini arttırmak değil, aynı zamanda olgun embriyoların ve yeşil bitkilerin oluşabileceği en iyi kalitedeki mikrosporları elde etmektir. Bu yüzden tek bir önişlem uygulaması yerine iki veya daha fazla yöntemi bir arada kullanmak mikrospor kültüründe başarıyı daha da fazla arttıracaktır (Liu et al., 2002a). Önişlem uygulamaları ile mikrosporlardan embriyo oluşumu farklı gelişim basamakları ile meydana gelebilmektedir. Tek çekirdekli mikrosporda meydana gelen ilk değişim mitotik bölünmedir. Mannitol veya sıcaklık (33ºC) önişlem uygulamalarında ilk çekirdek bölünmesi çoğu zaman simetrik olmaktadır. Bu olay ilk mitoz bölünme sırasında asimetrik iğ ipliklerinin bozulması ile çekirdeğin merkeze doğru kayması ve etrafını sitoplazmik uzantılarla ayrılmış vakuoller ile kaplamasıyla sonuçlanır. Bu durum, Indrianto vd. (2001) tarafından yıldız-şekli olarak tanımlanmaktadır. Birçok simetrik çekirdek bölünmesinin ardından da embriyo oluşumu gözlenmektedir (Cistue and Kasha, 2005). Soğuk önişlem uygulamasında ise iğ ipliklerinde herhangi bir kısıtlama olmadığından ilk çekirdek bölünmesi asimetrik olarak gerçekleşmektedir. Görüldüğü üzere, önişlem çeşidi ve süresi ilk mitotik bölünmenin simetrisini değiştirmekte ve mikrospor embriyogenesisin yolunu etkilemektedir. Embriyogenik mikrosporlar daha sonra besin ortamlarına alındıklarında hızlı bir şekilde bölünmekte ve yaklaşık dört hafta içerisinde embriyo haline gelmektedir (Zheng et al., 2001). İyi gelişen olgun embriyolar zigotik embriyolara oldukça benzemektedir. Buğday mikrosporlarının kültüre alınmasıyla tek bir başaktan binlerce embriyo elde edilebilmekte ve doubled haploid bitki üretimi ile biyoteknoloji ve genetik transformasyon çalışmalarında uygulanabilir yöntemler için kullanılabilmektedir. Embriyogenik mikrosporların önceden tanımlanmış bölünme şekli, buğday genotiplerinin kültür yöntemine olacak cevabını anlamak için uygun bir kriter olabilmekte ve önişlem uygulamalarının embriyogenik uyumuna etkisini belirleyebilmektedir (Kasha et al., 2001). 10
23 Mikrospor kültür tekniğini etkileyen diğer bir faktörde, mikrosporların anterden izolasyon yöntemidir. Tek çekirdekli dönemde oldukları belirlenen mikrosporlar, anterlerden ya mekanik olarak ayrılırlar; ya da başlangıçta bir süre sıvı besin ortamlarının içerisinde bekletilen anterlerden ortamın içerisine dökülmeleri sağlanır. Mikrospor izolasyonu; dökülme, manyetik çubukla karıştırma, maserasyon veya laboratuvar blenderı ile parçalama gibi yöntemlerle yapılabilmektedir (Cistue et al., 2006). Dört yöntem arasından en fazla başarı sağlayan yöntem, % 75 sağlam mikrospor eldesi ile blender yöntemi olmuştur (Gustafson et al., 1995). Blender yönteminde başaklar bir iki parçaya bölünerek blender içerisine konulmakta ve bıçaklar yardımıyla mikrosporlar başak ve anterlerinden doğrudan ayrılmaktadır. Fakat ovaryumların da kullanılacağı kültür ortamlarında, anterler ilk önce ovaryumlar ile birlikte pinsetler yardımıyla alındığından mikrosporları anterlerinden ayırmada maserasyon yöntemi tercih edilmektedir. Tekniği etkileyen diğer bir faktör mikrosporların konulduğu kültür ortamıdır. Bitki türlerinin çoğuna cevap verebilecek bir mikrospor kültür ortamı geliştirmek kolay değildir. Çünkü mikrospor cevabının aynı türdeki farklı genotipler arasında bile farklılık gösterdiği bir olayda, ortak bir besin ortamı kullanmak çok zordur. Bu yüzden, kültüre alınacak çeşidin mikrosporlarını embriyogenesise teşvik eden kültür ortamındaki karbonhidratlar, bitki büyüme düzenleyicileri, mineraller ve vitaminler gibi besin maddeleri, ozmolarite ve ortamın yoğunluğu oldukça önemli olmaktadır (Zheng et al., 2001). Günümüzde her türde ve hatta çeşit bazında önerilen sayısız besin ortamı kompozisyonu bulunmaktadır. Temel besin ortamı olarak, mikrospor kültüründe en fazla MS (Murashige and Skoog, 1962), Nitsch (1974) ve Hunter- FHG (1988) ortamları kullanılmaktadır. Buğday mikrospor kültürü için, N6 (Chu, 1978) veya MS besin ortamlarından modifiye edilerek hazırlanan (Hu et al., 1995) çeşitli kültür ortamları başarılı sonuçlar vermektedir. Karbon kaynağı olarak mikrospor kültüründe büyük bir çoğunlukla maltoz kullanılmaktadır. Bunun yanı sıra sakkaroz, maltoz ve sakkaroz karışımı, glukoz ve sakkaroz karışımı (Dias, 2001) gibi uygulamalar da bulunmaktadır. Zheng (2003), buğday mikrospor kültüründe sakkaroz kullanımının kültür ortamı ozmolaritesinde 11
24 dalgalanmalar oluşturması nedeniyle toksik etki gösterdiğini tespit etmiştir. Ortamda sakkaroz yerine maltoz kullanmanın bu tür olumsuz etkileri ortadan kaldırdığı, embriyoidlerin daha kaliteli ve yeşil bitki oranının albino bitki oranından daha fazla olduğu görülmüştür. Şekerin besin ortamlarında ozmotik basıncı ayarlayıcı bir etkisinin bulunması (Reinert and Bajaj, 1977), bunun yanında yüksek düzeydeki şekerin, enerji kaynağı olarak solunumu ve metabolik aktiviteyi artırarak hücre bölünmesi ve embriyoid oluşumunu artırması, yüksek şeker içeriğinin kullanımının gerekçeleri olarak görülmektedir. Mikrospor kültüründe başarılı sonuçlar elde etmek için, kültür ortamındaki bitki büyüme düzenleyicileri de oldukça önemlidir. Genel olarak ilk aşamada gametofitik dokuları sporofitik gelişmeye dönüştürme yönünde uyaracak oksinler gerekli iken; bitkiye dönüşüm aşamasında sitokininlerin varlığına gereksinim duyulur. 2,4-dikloro fenoksi asetik asit (2,4-D) ve fenil asetik asit (PAA) mikrospor kültüründe oksin kaynağı olarak sıklıkla kullanılmaktadır. Sitokinin olarak da çoğunlukla kinetin, sonra da benzil amino pürin (BAP) kullanımı yaygındır. 2,4-D, kinetin ve PAA kombinasyonu buğday mikrospor kültüründe embriyoid gelişimi için oldukça iyi sonuçlar vermiştir (Liu et al., 2002a). Uygun bitki büyüme düzenleyicileri kombinasyonu oluşturmak genotip çeşidine, donör bitkilerin kalitesine, önişlem yöntemine ve kültür ortamındaki mikrosporların fizyolojik durumuna göre değişmektedir. Bunun yanı sıra kültür ortamındaki bitki büyüme düzenleyicilerinin miktarını ayarlamak kaliteli ve çok sayıda embriyoid elde etmek için oldukça önemli olmuştur (Zheng, 2003). Son yıllarda mikrospor kültür ortamına ovaryum eklenerek (ovary co-culture) yapılan çalışmalar oldukça başarılı sonuçlar vermiştir (Bruins et al., 1996; Puolimatka et al., 1996; Devaux and Li, 2001; Cistue et al., 2006). Buğday mikrospor kültür ortamına 5-10 tane ovaryum eklenmesiyle embriyoidlerin ve regenerant bitkilerin sayısı önemli derecede artmıştır (Zheng et al., 2002). Kültür ortamına eklenen ovaryumlar sağlıklı durumda olmalı ve başaktan mikrosporların alındığı safhadan daha olgun bir zamanda (mikrosporlar üç çekirdekli evrede iken) toplanmalıdırlar (Castillo and Cistue, 1993). Mikrospor kültürüne az uyumlu 12
25 genotipler için besin ortamında ovaryum bulunması daha da önem kazanmıştır. Çünkü ovaryum ilave edilmeyen ortamlardan hiç embriyoid elde edilememiştir (Zheng et al., 2002). Ovaryum eklenmeyen ortamdaki çok hücreli yapılarda bir azalma görülmüştür (Liu et al., 2002a). Kültür ortamındaki çoğu mikrospor, ortamda ovaryum olmadığı zaman 14 günden sonra bölünmeyi durdurmakta ve bundan dolayı da ekzin tabakasından çıkamadıklarından embriyogenik gelişmeyi tamamlayamamaktadırlar (Devaux and Li, 2001). Besin ortamında kullanılan glutamin, prolin gibi aminoasitler, gümüş nitrat (AgNO 3 ) gibi etilen biyosentezini inhibe edici maddeler (Paksoy et al., 1995) veya aktif kömür gibi katkı maddeleri de mikrospor kültüründen elde edilecek başarıyı artırma yönünde kullanılan çeşitli kimyasal maddeler arasında yer almaktadır. Ortama katılan aktif kömür, sakkaroz içeren besin ortamlarının otoklavda sterilizasyonu sırasında ortaya çıkan 5-hidroksimetilfurfural (HMF) maddesini adsorbe etmekte ve ortamın yapısını hafif asidik bir karaktere dönüştüren bu maddenin olumsuz etkisini ortadan kaldırabilmektedir (Fridborg et al., 1978). İzole edilen mikrosporların inkübasyonu sırasındaki ışığın nicelik ve niteliği, ya da sıcaklık gibi çevresel koşullar mikrospor kültüründen sağlanacak başarı üzerinde etki yapan diğer bir grup faktördür. Başlangıçta mikrosporlar genellikle karanlıkta ve C ler arasında kültüre alınmaktadır. Kültürün ilerleyen aşamalarında düşük ışık yoğunluğu (2000 lüks) ve değişik günlük ışıklanma sürelerinde bekletilen mikrosporlarda embriyo oluşumu gerçekleştikten sonra; regenere olan bitkiler daha yüksek ışık yoğunluğuna ( lüks) sahip koşullara aktarılmaktadır. Mikrospor kültüründen elde edilecek başarıyı etkileyen çok sayıdaki faktör bir arada değerlendirildiğinde temel faktör olarak genotip ve donör bitki yetiştirme koşullarının, tüm etkilerin başında geldiği görülmektedir. Genetik olarak mikrospor kültürüne yatkınlığı olan bir bitki ile çalışılıyor ve bitki uygun koşullarda yetiştiriliyorsa, önemli düzeyde yüksek bir başarı potansiyeli ile işe başlanıyor demektir. Bundan sonra uygulanacak mikrospor kültürü teknikleri, elde edilecek haploid embriyo sayısını artırmaya yönelik uyarıları yapmakta ve var olan kapasiteyi 13
26 harekete geçirmektedir (Babaoğlu vd., 2002). Yöntemdeki başarı, izlenen basamakların her bitki türü ve hatta aynı tür içerisindeki farklı genotiplerde uygun bir şekilde kullanılmasına bağlıdır. Bu yüzden her genotip için en uygun yöntemler seçilmeli ve denemeler sonucunda genotipler için ayrı protokoller oluşturulmalıdır. Buğday, dünyada ve Türkiye de stratejik bir öneme sahip olup, insan beslenmesindeki önemi nedeniyle günümüzde tarımı yapılan kültür bitkileri içerisinde ilk sırada yer almaktadır. İnsanların temel enerji ve protein kaynağı olarak görülen buğday, Türkiye de günlük enerji ihtiyacının ortalama % 40 ını karşılanmaktadır. Ülkemizin ekili alanları dikkate alındığında, bu alanların yaklaşık % 50 sini tahıllar, tahılların ekim alanlarının da yaklaşık % 70 ini buğday oluşturmaktadır (Anonymous, 2008). Makarnalık buğday ise özellikle Akdeniz ülkelerinde yetiştirilmekte olup sanayi ve teknolojik olarak önemi büyüktür. Yurdumuz, özellikle Güneydoğu Anadolu, Orta Anadolu, Trakya-Marmara Bölgeleri ve bu bölgelerin diğer bölgelere geçiş oluşturan ekolojileri ile kaliteli makarnalık buğday üretimi için uygundur. Bununla beraber, hemen hemen toplam buğday ekim alanının yaklaşık % 50'sini oluşturan bu bölgelerde makarnalık buğday ekimi oldukça düşük oranlarda yapılmaktadır (Ayçiçek ve Yürür, 1997). Makarnalık buğdayda verim ve kalite genetik faktörler kadar çevre şartlarından da önemli derecede etkilenmektedir. Bu nedenle, dünyada ve ülkemizde ekim alanları sınırlıdır (Sönmez ve Kıral, 2004). Makarnalık buğdaylar tetraploid (2n=4x=28, AABB) bitkiler olup, kalite özellikleri ve kullanım alanları bakımından heksaploid (2n=6x=42, AABBDD) Triticum aestivum ve Triticum compactum buğdaylarından çok farklı ve özel bir konuma sahiptir (Güleç vd., 2010). Gen merkezi Güneydoğu Anadolu, Mezopotamya ve bir miktar da Kafkas bölgesi olup (Kimber and Feldman, 1987) bu merkezlerden Dünya ya yayılmıştır. Ekimi ve üretimi için marjinal topraklar istemektedir. Daha fazla azotlu gübreye gereksinim duyar. Anadolu topraklarında ise binlerce yıldır tarımı yapılmaktadır. Çok sayıda yerel çeşitler vardır ve bu yerel çeşitler özellikle Cumhuriyet in kurulmasından sonra planlı kalkınma dönemlerinde yeni ve modern genotiplerin meydana getirilmesinde anaç olarak kullanılmışlardır (Kınacı, 1993). 14
27 Dünya nüfusunun hızlı artışına paralel olarak tarımsal alanların tükenmesi ve buna karşılık verimin belirli miktarın üzerine çıkamayacağı endişesi, buğday üzerindeki araştırmaları yüksek verim üzerine yoğunlaştırmıştır. Bu amaçla pek çok araştırma enstitüsü çalışmalarına hızla devam etmektedir. Meksika da CIMMYT (Uluslararası Mısır ve Buğday Geliştirme Merkezi), Suriye de ICARDA (Uluslararası Kurak Alanlar Tarımsal Araştırma Merkezi) ve 1980'lerin ortasında Türkiye ve CIMMYT tarafından kışlık buğday ıslah çalışmaları için IWWIP (Uluslararası Kışlık Buğday Geliştirme Programı) kurulmuştur. Ülkemizde de önemli sayıda kuruluş (TARM gibi), bu konuda araştırmalarını sürdürmektedir. Heksaploid (AABBDD) olan ekmeklik buğdaydan (Triticum aestivum L.) mikrospor kültürü ile yeşil bitkiler elde edilmiş ve yapılan çalışmalarla geliştirilerek regenerant bitki sayısı artırılmıştır (Zheng et al., 2002; Bakos et al., 2003; Patel et al., 2004; Soriano et al., 2007; Shirdelmoghanloo et al., 2009). Tetraploid (AABB) olan makarnalık buğdayın ise (Triticum durum Desf.) anter ve mikrospor kültürüne daha dirençli genotipler olduğu bildirilmiştir (Jauhar, 2003; Cistue et al., 2006). Yapılan çalışmalarda, çoğu makarnalık buğday genotipinin anter veya mikrospor kültürüne cevabı az olduğundan, yeşil regenerant bitki sayısının oldukça düşük oranda olduğu ya da meydana gelen bitkilerin çoğunun albino olduğu belirtilmiştir (J Aiti et al., 2000; Ferrie and Caswell, 2010). Buğdayda androgenik cevabın, genetik ve çevresel faktörlerle (donör bitkilerin yetişme koşulları, stres uygulamaları, kültür ortamı içeriği gibi) ilişkili olduğu uzun zamandır bilinmektedir (Ghaemi et al., 1994; Mentewab and Sarrafi, 1997). Yapılan genetik çalışmalarıyla, androgenesis ile ilgili genlerin kromozomlar üzerindeki yeri tespit edilmeye çalışılmıştır (Ben Amer et al., 1997). Zhang ve Li (1984), 2A ve 2D kromozomlarının androgenesis ile ilgili oldukça fazla gen taşıdığını, bununla beraber 2B, 4A, 5A ve 5B kromozomlarının ise embriyo oluşumunu engelleyici genler taşıdığını tespit etmişlerdir. Ben Amer vd. (1997), ekmeklik buğdayda 2B kromozomu üzerinde doku kültürünü etkileyen üç kantitatif karakter lokulusu belirlemiştir. Halbuki, kallus oluşumu ve bitki regenerasyonu birbirinden bağımsız iki kalıtsal özellik olarak görünmektedir (Holme et al., 1999). Birçok araştırıcı, 15
28 ekmeklik buğdayda (AABBDD) yüksek androgenik cevap almak için D genomunun oldukça önemli olduğunu belirtmektedir. Durum buğdayında (AABB) bu genin olmayışının, bu türlerde düşük embriyo oluşumu ve yeşil bitki regenerasyonuna neden olduğu düşünülmektedir (Ghaemi et al., 1995; Cattaneo and Vaccino, 2001). Mikrospor kültür tekniğine az uyumlu veya dirençli olan genotiplere doubled haploid bitki üretimini artırmaya yönelik genlerin aktarılma çalışmaları genetik transformasyon yoluyla yapılabilmektedir (Touraev et al., 2001). Bununla birlikte, bu yöntemleri uygulamadan önce yararlı genlerin bulunması ve dirençli genotiplere aktarılması gerekmektedir. Androgenesisle ilgili genlerin manipülasyon çalışmaları yaygınlaşmadan önce, genotipik problemlerin üstesinden gelmek için kültür tekniğini geliştirecek metotlar bulmak bitkilerin doğal yapısını korumak adına daha etkili bir yöntem olacaktır (Zheng, 2003). Bu çalışmamızın amacı, yurdumuza ait dört farklı durum buğdayı genotiplerinden (Triticum durum Desf. cvs. Kızıltan-91, Ç-1252, Mirzabey 2000 ve Kunduru ) mikrospor kültürü yoluyla embriyoid ve bitki regenerasyonu elde etmek için etkili bir protokol geliştirmektir. Mikrospor kültürü yöntemi oluşturulurken birçok farklı deneme yapılarak; biri yerel çeşit olan dört makarnalık buğday genotipimiz için en iyi önişlem uygulaması, mikrospor izolasyon yöntemi ve heksitol çeşidi (mannitol veya sorbitol) tespit edilmeye çalışılmıştır. Ayrıca, makarnalık buğday genotiplerinde embriyoid gelişimi (farklılaşma) ve bitki üretiminde kullanılması gereken kültür ortamları belirlenerek hassasiyetle hazırlanmıştır. 16
29 2. KAYNAK ÖZETLERİ Bu bölümün birinci kısmında, mikrospor kültür tekniği ile ilgili buğday çeşitlerinde yapılmış olan farklı çalışmalar sunulmuştur. İkinci kısımda ise, buğday bitkisi gibi tahıllar ve monokotiller içerisinde yer alan ve denemelerinin benzerlik göstermesinden dolayı arpa bitkisinde yapılan mikrospor kültürü çalışmalarına da yer verilmiştir Buğday (Triticum sp.) Mikrospor Kültür Tekniği ile Yapılan Çalışmalar Hu vd. (1995), buğdayda (T. aestivum) gen transformasyon araştırmalarına uygun yüksek bitki regenerasyonu elde etmek amacıyla mikrospor kültür tekniğinde çeşitli önişlem, izolasyon yöntemleri ve kültür ortamındaki hormonların etkilerini araştırmışlardır. Denemelerde yazlık bir çeşit olan Triticum aestivum L. cv. Chris kullanılmıştır. Yapılan çalışmalarda, üç farklı önişlem uygulaması [0.4 M mannitol, FHG ortamının (Kasha et al., 1990) makro elementleri ve 0.4 M mannitol + FHG ortamının makro elementleri birlikte] kullanılmıştır. Anterler bu uygulamalarda farklı sürelerde (4, 7, 10 ve 14 gün) tutulmuştur. Ayrıca, önişlem uygulamalarında farklı konsantrasyonlarda ABA (0, 1.5, 3.0, 4.5 ve 6.0 mg/l) da kullanılmıştır. Mikrosporların izolasyonu da dört farklı şekilde (vorteks kullanılarak, sonikasyon, karıştırma ve homojenizatör + ezme) yapılmıştır. Sıvı MS kültür ortamında 6 farklı konsantrasyonda PAA (0, 1, 2, 4, 7 ve 10 mg/l) kullanılmıştır. Denemeler sonucunda, sadece 0.4 M mannitol + FHG ortamının makro elementleri ile birlikte kullanılınca mikrospor bölünmesi ve embriyo oluşumu bir arada gözlenmiştir. 0.4 M mannitol uygulaması ile mikrospor bölünmesi gözlenirken embriyo oluşumu olmamıştır. Önişlem sürelerinde 4 gün uygulaması başarılı sonuç verirken, en iyi sonuç 7 gün uygulamasından alınmıştır. ABA önişlem uygulamasında ise en iyi sonuçlar 3 ile 6 mg/l arasındaki konsantrasyonlarda görülmüştür. En iyi yeşil bitki regenerasyon oranı 4.5 mg/l ABA kullanılarak elde edilmiştir. En iyi izolasyon yöntemi vorteks kullanılarak elde edilmiştir. Diğer yöntemlerde mikrospor canlılık oranı oldukça düşmüştür. Kültür ortamında kullanılan PAA konsantrasyonları arasında % 68 oranında mikrospor bölünmesi, 93 embriyo ve 92 yeşil bitki regenerasyonu ile en iyi 17
30 sonucu 4 mg/l PAA vermiştir. Bu çalışmalar sonucunda en iyi parametreler ile toplamda 114 yeşil bitki elde edilmiş ve % 75 i fertil doubled haploid bitki üretmiştir. Hu ve Kasha (1997), mikrospor kültür tekniğinde embriyo oluşumunu ve yeşil bitki regenerasyonunu artırmak amacıyla ekmeklik buğday (T. aestivum) çeşitlerinde kültür ortamına ilave edilen ovaryumların etkisini araştırmışlardır. Denemelerde beş farklı yazlık buğday çeşidi ( Chris, Sinton, Marquis, Veery S ve Ciano ) ve dört F 1 genotipi kullanılmıştır. Yapılan çalışmalarda üç farklı kültür ortamı (MMS1, MMS2 ve MMS3) ve farklı oranlarda PAA (2 mg/l ve 4 mg/l) kullanılmıştır. Kültür ortamına eklenen ovaryumlar hem soğuk önişlem hem de önişleme tabi tutulmadan doğrudan kullanılmıştır. Soğuk önişleme alınan ovaryumlar, anterler geç tek çekirdekli mikrospor safhasındayken toplanmış ve +4 C de 1 hafta buzdolabında muhafaza edilmiştir. Ovaryumlar kültür ortamlarında farklı sürelerde (7, 14, 21 ve 30 gün) bekletilmiştir. Ayrıca farklı sayıda besin ortamına ilave edilen ovaryumların (10-20) da karşılaştırılması yapılmıştır. Alınan sonuçlarda soğuk önişlem ve taze ovaryum eklenmesi arasında önemli bir fark görülmemiştir. Fakat bekletme sürelerinde 21 günden sonraki petri kaplarında embriyo oluşumunun diğer sürelere göre çok daha etkili olduğu tespit edilmiştir. Petri başına 20 tane ovaryumun eklenmesi de diğer uygulamalara göre daha yüksek sonuçlar vermiştir. Köhler ve Wenzel (1985), ovaryumlardan salgılanan protein ve amino asitlerin kültür ortamındaki mikrosporların gelişimine katkıda bulunabileceğini söylemişlerdir. Ayrıca 2 mg/l PAA bulunan MMS3 kültür ortamı buğday mikrospor kültürüne en iyi cevap veren ortam olmuştur. Ziauddin vd. (1992), ovaryumlardan salgılanan ve büyümeyi teşvik eden maddenin, PAA ya benzer bir madde olduğunu ve kültür ortamına ilave edilen 10 mg/l PAA nın ovaryumların yerine geçebileceğini bildirmişlerdir. Hansen ve Andersen (1998), buğday (T. aestivum) mikrospor kültüründe kolhisinin embriyo oluşumu, regenerasyon, yeşil bitki oranı ve kromozom katlanması üzerindeki etkilerini araştırmışlardır. Mikrosporlar, 8 farklı konsantrasyonda kolhisin (0, 3, 10, 30, 100, 300, 1000 ve 3000 µm) içeren 1 ml lik CHB-2 (Chu et al., 1990) 18
31 ortamına alınmıştır. Ayrıca mikrosporlar kolhisinde iki farklı sürede (24 ve 48 saat) tutulmuştur. Kontrol uygulamasında başak başına ( mikrospor) ortalama 220 embriyo alınmıştır. Regenerant bitkilerden ise % 68 si yeşil, bunlardan % 15 i fertil bitki meydana getirebilmiştir. Kolhisin uygulamalarının kromozom katlanması üzerinde önemli etkileri olmuştur. Yaklaşık 1 mm konsantrasyonunda kolhisin kullanmakla fertil bitkilerin sayısı % 53 oranında artmıştır. En fazla embriyo oluşumu ve bitki regenerasyonu, 24 saat kolhisin uygulamasında gözlenirken, en fazla yeşil bitki oranı ve fertil bitki sayısı, 48 saat kolhisin uygulamasıyla elde edilmiştir. En fazla sayıda doubled haploid bitki ise µm konsantrasyonları arasında kolhisin uygulanarak elde edilmiştir. Denemeler sonucunda başak başına ortalama 23 doubled haploid bitki alınmıştır. Holme vd. (1999), kuzey-batı Avrupa kışlık buğday ile doğu Avrupa buğday hatlarının anter kültürü ve mikrospor kültür tekniklerine verdikleri cevabı karşılaştırmışlardır. Denemelerde 145 kuzey-batı ile 27 doğu Avrupa kışlık ekmeklik buğday (T. aestivum) hattı kullanılmıştır. Denemeler sonucunda, doğu Avrupa buğday hatlarından 100 anterden 3.6 yeşil bitki elde edilirken, kuzey-batı Avrupa buğday hatlarından 100 anterden sadece 0.4 yeşil bitki elde edilebilmiştir. Halbuki her iki hattın da yeşil regenere bitki oluşturma kapasitesinin iyi olduğu bilinmektedir. Bu farklılık doğu Avrupa buğday hatlarının yüksek embriyo oluşturma kapasitelerinden kaynaklanmaktadır. Mikrospor kültür tekniği 85 buğday hattında anter kültürüne göre 3.7 kat daha fazla yeşil bitki regenerasyonu meydana getirmiştir. Mikrospor kültür tekniğinde yeşil bitki kapasitesinin daha fazla olmasının sebebi, mikrosporlardan meydana gelen embriyoların ve regenerasyon miktarının daha fazla olmasından kaynaklanmaktadır. Indrianto vd. (1999), buğday mikrospor kültüründe önişlem uygulamalarında kullanılan soğuk, sıcak şok ve açlık gibi stres faktörlerinin mikrospor embriyogenesisi üzerindeki etkilerini araştırmışlardır. Denemelerde, kışlık buğday genotiplerinden Capo, Ferdinand ve Julius kullanılmıştır. Önişleme alınacak başaklar, mikrosporlar geç-tek çekirdekli veya premitotik safhada iken toplanmıştır. Başaklar 7-14 gün arasında 4ºC de soğuk önişleme alınmıştır. Mikrosporlar 19
32 anterlerinden karıştırma yöntemi ile izole edilmiştir. İzole edilen mikrosporlar, B (Kyo and Harada, 1986) (20 mm KCl, 1 mm MgSO 4, 1 mm CaCl 2, 1 mm KH 2 PO 4 /K 2 HPO 4, 0.3 M mannitol) ve A2 (Touraev et al., 1996) (½ N6-mikrotuzları, ½ B5 mikrotuz ve vitaminleri, 32 g/l Fe-NaEDTA, 10 mm MES, 8.5 mm glutamin ve 0.3 M maltoz) ortamında 2 gün, 3 farklı sıcaklıklarda (4, 25 ve 33ºC) inkübe edilmiştir gün sonra globular şeklindeki embriyolar A2R (A2 regenerasyon ortamı) regenerasyon ortamına aktarılmıştır. Denemeler sonucunda, en iyi indüksiyon (3-4 hafta sonra oluşan çok hücreli yapılar) oranı ( Ferdinand % 23.9 ve Capo % 23.1) hemen toplanan başaklardan izole edilen mikrosporların, mannitol içeren B ortamına, 2 gün ve 33ºC de inkübe edilmesiyle elde edilmiştir. 0.3 M maltoz içeren A2 ortamı mikrospor embriyogenesis ve bitki regenerasyonu olarak en iyi cevabı vermiştir. Maltozun buğday mikrospor kültürü üzerindeki etkisi spesifik olup, bitki hücreleri tarafından yavaş kullanılması, kültür ortamında erken etki göstermesi ve ortamın ozmolaritesini sabit tutması açısından oldukça önemli olmuştur. Zheng vd. (2001), buğday (T. aestivum) mikrospor kültür tekniğinde mikrosporları indükleyici kimyasallar ile önişleme alarak, embriyo ve yeşil bitki oranını artırmayı amaçlamışlardır. Denemelerde Triticum aestivum L. cvs. Calorwa, Chris, Pavon 76, Waldron, WED 202 ve WPB 926 genotipleri kullanılmıştır. Mikrosporlar anterlerinden mikro-blender ile izole edilmiştir. İzole edilen mikrosporlar, öncelikle indükleyici kimyasallarla (antranilik asit, benzotriazol, benzotriazol-5-karboksilik asit, 2,3-butanedion monoksim, DL-histidin, 2,4-dihidroksi primidin 5-karboksilik asit, 2,3-pridin karboksilik asit, violurik asit monohidrat ve sulfanilamid) önişleme alınmıştır. Daha sonra A çözeltisine (mg/l: KCl, 1492; MgSO 4.7H 2 O, 246; CaCl 2.2H 2 O, 148; KH 2 PO 4, 136; H 3 BO 3, 3; KI, 0.5; MnSO 4.4H 2 O, 8.0; ZnSO 4.7H 2 O, 3.0; FeSO 4.7H 2 O, 56.0; maltoz, 9000; 2-HNA, 50) farklı konsantrasyonlardaki 2-hidroksi nikotinik asit (2-HNA) (0.06, 0.12, 0.18 ve 0.30 mm) ilavesi ile karanlıkta, 25ºC ve saat tutulmuştur. Mikrosporlar, filtrelerden geçirildikten sonra % 21 maltoz ile santrifüj edilmiş ve NPB-99 (Konzak et al., 1999) kültür ortamında ovaryumlarında (8-10 tane) eklenmesiyle 27ºC de inkübe edilmiştir. Denemeler sonucunda, 48 saat süreyle 0.18 mm konsantrasyonunda 2-20
33 HNA kimyasal çözeltisi ile en fazla embriyo oluşumu ve bitki regenerasyonu elde edilmiştir. Embriyo oluşumu, başak başına arasında değişmiştir. Yeşil bitki oranı ise % ve doubled haploid bitkilerin sayısı da % arasında olmuştur. Önişlemlerde kullanılan kimyasal indükleyici maddelerden benzotriazol-5- karboksilik asit ve violurik asit monohidratın da mikrosporların canlılığını koruduğunu ve mikrospor embriyogenesisini teşvik ettiği görülmüştür. Liu vd. (2002a), buğday (T. aestivum) mikrospor kültür tekniğinde yeni kimyasal bir formülasyon kullanarak etkili bir mikrospor embriyogenesis metodu geliştirmeyi amaçlamışlardır. Ayrıca embriyonik mikrosporlar için uygun bir kültür ortamı geliştirerek doubled haploid bitkilerin sayısını artırmayı hedeflemişlerdir. Denemelerde Chris, Pavon 76, WED , Yecora Rojo, Calorwa, Waldron, Wawawai yazlık buğday ile Capa ve Svilena kışlık buğday genotipleri kullanılmıştır. Önişlem uygulamasında başaklara indükleyici kimyasallar olarak 0-1 g/l 2-HNA, 10-6 mol/l 2,4-D ve 10-6 mol/l BAP kullanılmıştır. İzole edilen mikrosporlar ovaryumlar ile birlikte sıvı NPB-99 kültür ortamında farklı ozmotik basınçlarda tutulmuşlardır. Denemelerde indükleyici kimyasal olarak 2-HNA kullanılmasıyla, bir başaktan alınan mikrosporların % 50 sinden fazla embriyogenik farklılaşmaya doğru gidebilmiştir. Uygulamadan sonra embriyogenik mikrosporlarda hücre duvarına yakın sekiz veya daha fazla vakuol gözlenmiştir. Bu vakuoller merkezde bulunan sitoplazmayı çevrelemiştir. Embriyogenik mikrosporlar genellikle kimyasal uygulama yapılmayan mikrosporlara (25-45 µm) göre daha büyük boyutta (yaklaşık 50 µm) olmuştur. 100 mg/l 2-HNA kullanılan uygulamalarda embriyoidlerin miktarı artarken, daha fazla konsantrasyonda 2-HNA kullanımı ile yeşil bitki oluşumunda herhangi bir fark gözlenmemiştir. Önişlem uygulamasında 1g/l 2-HNA kullanımı ise toksik etki göstererek başakların gövde dokusunda bozulmalara ve mikrosporların ölümüne yol açmıştır. Embriyoid oluşumu için NPB- 99 kültür ortamındaki en uygun ozmotik basınç ise 300 mosmol/kg H 2 O olmuştur. Liu vd. (2002b), bazı ekmeklik buğday (T. aestivum) çeşitlerinde mikrospor kültür tekniği ile önişlem uygulamasına yapılan bazı indükleyici kimyasalların eklenmesi sonucu albino bitki oluşumunu azaltmayı amaçlamışlardır. Denemelerde albino bitki 21
34 oluşumunun fazla görüldüğü WED ilkbahar buğday ve Svilena kışlık buğdayı genotipleri kullanılmıştır. Yapılan önişlemde kimyasal indükleyici olarak % 0.01 (w/v) 2-HNA, 10 mg/l 2,4-D, 2 mg/l BAP ve 3 mg/l gibberellik asit kullanılmıştır. Bu kimyasallara ilaveten % 10 NPB 98 başlangıç ortamı da eklenmiştir. İzole edilen mikrosporlar sıvı NPB 98 kültür ortamına alınmışlardır. Embriyolar 1-2 mm büyüklüğüne ulaştıkları zaman katı (Zhuang and Xu, 1983) ortamına aktarılmışlardır. Orta seviyede albino bitki meydana getirdiği bilinen WED çeşidinde bu kimyasalların kullanılmasıyla bitki regenerasyonu % 15, yeşil bitki oranı ise % 27 artmıştır. Mikrospor kültür tekniğine uyumlu bir genotip olan Svilena çeşidi ise yapılan kimyasal ilavesiyle olumsuz etkilenmezken, yeşil bitki oranında ve embriyo oluşumunda herhangi bir değişiklik görülmemiştir. Yapılan denemeler sonucunda, WED gibi mikrospor kültürüne az uyumlu genotiplerde bu tip kimyasal madde ilavelerinin, mikrosporları iyi kalitede geliştirdiği, embriyo ve yeşil bitkilerin oluşumunda büyük artışlar meydana getirdiği tespit edilmiştir. Zheng vd. (2002), mikrospor kültürüne uyumlu ve dirençli olan ekmeklik buğday (T. aestivum) genotiplerinde kültür ortamına ilave edilen ovaryumların mikrospor embriyogenesis üzerindeki etkilerini araştırmışlardır. Denemelerdeki üç farklı amaç; (1) ovaryumların kültür ortamındaki etkisini, (2) kültür ortamındaki bulunma sürelerini ve yoğunluğunu, (3) taze ovaryum ile kültüre alınmış ovaryumların doubled haploid bitki üretimi üzerindeki etkisini araştırmak olmuştur. Yapılan çalışmalarda, mikrospor kültür tekniğine uyumlu olan yazlık buğday genotiplerinden Chris, Pavon 76, WED ve dirençli olan genotiplerden Waldron ve WPB 926 kullanılmıştır. Anterlerinden izole edilen mikrosporlar kültür ortamına hem taze ovaryumlar hem de NPB-99 ortamında kültüre edilmiş ovaryumlar ile birlikte konulmuştur. Ayrıca, ovaryumların kültür ortamındaki süreleri (4, 7, 10, 14, 21, 28, 35, 37 ve 40 gün) ve yoğunlukları (petri başına 2, 5, 10, 15, 20 ve 30 adet) karşılaştırılmıştır. Denemeler sonucunda, mikrospor kültür tekniğine uyumlu genotiplerden izole edilen mikrosporlarda, taze ovaryumlar kullanılarak elde edilen androgenik embriyo miktarı 4.5 kat artmıştır. Aynı şartlarda tekniğe dirençli genotiplerde bu başarı elde edilemezken, NPB-99 ortamında kültür edilmiş 22
35 ovaryumlar kullanılarak oluşan embriyo miktarı 100 kattan daha fazla artmıştır. En fazla embriyo miktarı 7 ve 10 gün süreyle ovaryumlarla kültüre alınan mikrosporlardan elde edilmiştir. Hücre bölünmesi, proembriyo ve embriyo miktarı bakımından en başarılı sonucu, 10 gün süreyle ortamda tane ovaryumun bulunması vermiştir. Sonuç olarak, mikrospor kültür tekniğine uyumlu genotiplerde mikrospor embriyogenesisini artırmak için ortama taze ovaryum eklenmesi yararlı olmuştur. Fakat daha önemlisi dirençli genotiplerde kültüre alınmış ovaryum ya da taze ovaryum ile kültüre alınmış ovaryumları birlikte kullanmak, regenerasyon yeteneği yüksek embriyolar elde edebilmek için etkili bir parametre olmuştur. Patel vd. (2004), ekmeklik buğdayda (T. aestivum) mikrospor kültür tekniği ile embriyo oluşumu ve yeşil bitki regenerasyonunu arttırmaya yönelik çalışmalar yapmışlardır. Birinci denemede, kültür ortamları, büyüme regülatörleri ve kültür ortamına ovaryum eklenmesi ile oluşan embriyo ve bitki regenerasyonu oranları karşılaştırılmıştır. Denemelerde iki çeşit kültür ortamı [CHB (Chu et al., 1990) ve MC17 (Luckett et al., 1991)] ve dört farklı bitki büyüme regülatörü (1mg/l PAA, 2mg/l PAA, 4 mg/l PAA ve 0.5 mg/l 2,4-D) kullanılmıştır. Ayrıca bu uygulamalar hem ovaryum eklenerek hem de ovaryum yokluğunda elde edilen sonuçlarla karşılaştırılmıştır. Denemeler sonucunda, CHB kültür ortamı ve 0.5 mg/l 2,4-D bitki büyüme regülatörü ilave edilmiş besin ortamı en iyi embriyo ve yeşil bitki regenerasyonu oranlarını vermiştir. Ovaryum eklenmeyen ortamda ise hiç embriyo oluşumu gözlenmemiştir. İkinci denemelerde, indüksiyon ortamı olarak CHB besin ortamı ve 0.5 mg/l 2,4-D bitki büyüme regülatörü kullanılmıştır. Bu ortama beş farklı katılaştırcı madde (2.5 g/l agaroz, 2.5 g/l agarjel, 2.5 g/l gelrite, % 4 (v/w) buğday nişastası ve % 4 (v/w) arpa nişastası), sıvı ortam ve sıvı ortama ilaveten fiziksel destekleyici araçlar (süzgeç ve filtre kağıdı) eklenerek embriyo ve yeşil bitki regenerasyonu oluşum yüzdeleri karşılaştırılmıştır. Bu sekiz uygulamadan mikrosporlardan oluşan embriyo (100 anterden 296 embriyo) ve yeşil bitki regenerasyonu (100 anterden 71 yeşil bitki) olarak en iyi sonucu, 2.5 g/l gelrite ile yapılan denemelerden alınmıştır. Üçüncü denemede ise indüksiyon ortamı olarak CHB, büyüme regülatörü olarak 0.5 mg/l 2,4-D ve katılaştırıcı madde olarak gelrite kullanılmıştır. Kültür ortamına eklenerek yapılan beş farklı uygulamada 17 çeşit 23
36 aminoasit, 0.1 mg/l MET (paklobutrazol), 0.5 mg/l ansimidol, % 16 v/w hindistan cevizi suyu ve spent ortamı (filtre sterilize edilen sıvı CHB ortamı) kullanılmıştır. Bu uygulamalardan en iyi sonuç, spent ortamı (100 anterden embriyo ve 71.8 yeşil bitki) ve MET (100 anterden embriyo ve 65.3 yeşil bitki) ilavesi ile elde edilen ortamlardan alınmıştır. Labbani vd. (2005), makarnalık buğdayda (Triticum durum Desf.) farklı önişlem uygulamalarının mikrospor kültür tekniğine olan etkilerini araştırmışlardır. Yapılan çalışmalarda, tetraploid (2n=4x=28, AABB) iki durum buğdayı (Triticum turgidum subsp. durum (Desf.) Husn.) Cham 1, Jennah Khetifa (JK) ve kontrol grubu olarak heksaploid (2n=6x=42, AABBDD) ekmeklik buğdayı (Triticum aestivum subsp. aestivum) Pavon 76 kullanılmıştır. Daha önce yapılan denemelerde, bu iki durum buğdayı genotipinin anter kültürü ile yeşil bitki üretiminde dirençli genotipler olduğu tespit edilmiştir. Başaklarda 5 farklı önişlem uygulaması (3 gün soğuk önişlem, 5 hafta soğuk önişlem, 3 gün +4 C M mannitol, önce 5 hafta +4 C de soğuk önişlem sonra 3 gün +4 C M mannitol ve önce 3 gün +4 C M mannitol sonra 5 hafta +4 C de soğuk önişlem) kullanılmıştır. Denemeler sonucunda, genotipler arasında embriyo oluşumu açısından büyük farklılıklar tespit edilmiştir. Cham 1 genotipi bütün önişlem uygulamalarında düşük oranda embriyo meydana getirmiştir. JK genotipi ise tüm önişlem uygulamalarına iyi cevap verirken, özellikle 3 gün +4 C M mannitol uygulaması (% 0.71 embriyo) ile embriyo oluşumunda en iyi sonuçlar elde edilmiştir. Bitki regenerasyonu açısından en iyi sonuç ise 5 hafta soğuk önişlem uygulaması ile elde edilmiştir. Bütün önişlem uygulamaları dahil iki durum buğdayı genotipinde mikrospordan embriyo elde edilmiştir. Bitki regenerasyonu ise Cham 1 genotipinde 0 dan % 7.38 e ve JK genotipinde 0 dan % 3.42 ye yükselmiş ve toplamda 150 yeşil bitki (% 85 i doubled haploid) elde edilmiştir. Cistue vd. (2006), makarnalık buğday (T. turgidum) çeşitlerinden doubled haploid bitkiler elde etmek amacıyla etkili bir mikrospor kültürü yöntemi geliştirmeyi amaçlamışlardır. En uygun yöntemi belirlemek amacıyla birçok genotipe farklı kültür ortamları ve hormon kombinasyonları uygulanmıştır. Çalışmalarda 5 24
37 makarnalık buğday genotipi ( Arcolino, Simeto, Anton, Durtres ve Semolon ) ve kültür yeteneği yüksek 20 F 1 hibrit çeşidi kullanılmıştır. Çeşitlere ait anterler, 0.7 M mannitol ve 30 mm CaCl 2.2H 2 O içeren katı kültür ortamında 5-6 gün 24ºC karanlıkta önişleme alınmıştır. Önişlem uygulamasından sonra mikrosporlar homojenizatör ile anterlerden ayrıştırılmıştır. İzole edilen mikrosporlar, 300 g/l Ficoll-400 ve 10 tane ovaryum içeren C 17 (Wang and Chen, 1986) kültür ortamına alınmıştır. Kullanılan besin ortamlarına iki farklı hormon kombinasyonu eklenmiştir. A ortamı 1 mg/l 2,4-D + 1 mg/l BAP, B ortamı ise 1 mg/l 2,4-D + 1 mg/l KIN içermektedir. Başlangıç ortamından sonra mikrosporlar iki farklı regenerasyon ortamına [J25-8 (Jensen, 1983) ve FHG] alınmıştır. Kullanılan iki farklı hormon kombinasyonundan 1 mg/l BAP içeren kültür ortamı, embriyo oluşumu ve yeşil bitki regenerasyonu bakımından 1 mg/l KIN içeren kültür ortamına göre daha başarılı sonuçlar vermiştir. Ayrıca BAP kullanılarak yapılan denemelerde, daha fazla iki veya üç sürgünlü embriyo meydana gelmiştir. Kültür ortamlarından da J25-8, modifiye FHG kültür ortamına göre daha başarılı sonuçlar vermiştir. Toplam 35 çeşitte yapılan mikrospor kültüründen 407 yeşil bitki elde edilmiştir. Tüm çeşitlerden yeşil bitki elde edilebilmiş ve bunların % 67 sinden doubled haploid bitki oluşturulmuştur. 407 bitkiden de 275 tanesi tamamen fertil ve tohum oluşturabilmiştir. Lantos vd. (2006), on farklı Macar ekmeklik buğday (T. aestivum) çeşidinin mikrospor kültür tekniği ile embriyo ve bitki regenerasyonu oluşturma kapasitesini araştırmışlardır. Yapılan denemelerde bir yazlık buğday ( CY-45 ) ve 9 kışlık buğday ( GK Mini Mamó, GK Garaboly, GK Hargita, GK Csongrád, GK Délibáb, GK Élet, GK Kata, GK Bán, Mv Palotás ) genotipi kullanılmıştır. Başaklardan toplanan anterler 5 ml 0.3 M mannitol ve 200 mg/l antibiyotik ile önişleme alınmıştır. Mikrosporlar anterlerden cam bir çubuk ve naylon filtreler yardımıyla (200 µm) izole edilmiştir. İzole edilen mikrosporlar, 1000 mg/l glutamin, 0.5 mg/l 2,4-D ve 0.5 mg/l kinetin içeren modifiye W 14 (Jia et al., 1994) besin ortamında kültüre alınmıştır. Ayrıca ortama petri başına 10 tane ovaryum eklenmiştir. Katılaştırıcı madde olarak gelrite kullanılmıştır. Mikrospor kültür tekniğine, en iyi uyumu CY-45, GK Elet, GK Csongrad ve Gk Mini Mano 25
38 genotipleri göstermiştir. Bitki regenerasyonu yönünden ise en iyi sonuçları CY-45 ve GK Elet genotipleri vermiştir. Toplam on genotipten 7 genotip çeşitli oranlarda yeşil bitki üretirken, bunlardan 3 tanesi sadece albino bitki meydana getirebilmiştir. Bu çalışmada aynı tür içinde dahi farklı genotiplerin mikrospor kültür tekniğine farklı cevap verdiği görülmektedir. Letarte vd. (2006), iki farklı ekmeklik buğday çeşidinin mikrospor kültürü tekniğinde kültür ortamına eklenen Larcol ve arabinogalaktan-proteinlerinin (AGP) embriyo oluşumu ve yeşil bitki regenerasyonuna etkisini araştırmışlardır. Denemelerde Triticum aestivum L. cvs. Chris ve Pavon 79 genotipleri kullanılmıştır. Başaklar, 0.4 M mannitolde, 7 gün, 4ºC de, karanlıkta önişleme alınmıştır. İzole edilen mikrosporlar, MMS4 (2 g/l PAA, 0.5 mg/l kinetin, 90 g/l maltoz, 355 mg/l U2.5 amino asit karışımı ve 975 mg/l glutamin ile modifiye edilen MS kültür ortamı) indüksiyon ortamına alınmıştır. Kültür ortamına çeşitli konsantrasyonlarda (1, 5, 10, 25, 50 ve 100 mg/l) Larcol ve AGP ilave edilmiştir. Ayrıca kültür ortamına başaklardan yeni alınmış veya 1 hafta 4ºC de saklanmış 8 tane ovaryum da eklenmiştir. Embriyolar 2 mm büyüklüğe ulaştıklarında, MMS5 (0.5 mg/l PAA, 0.2 mg/l kinetin, 0.5 mg/l GA 3, 30 g/l maltoz, 255 mg/l U2.5 amino asit karışımı ve 10 mm CuSO 4 ) farklılaşma ortamına alınmışlardır. Ortama 10 mg/l Larcol eklenmesi her iki çeşitte de ortamda ovaryum olsun ya da olmasın mikrospor ölümünü azaltmıştır. Ovaryumların da varlığı ile 10, 25 ve 50 mg/l Larcol, her iki çeşitte de yüksek oranda embriyo oluşturmuştur. Buğday mikrospor kültüründe ortama ilave edilen AGP nin ise, mikrosporların embriyo oluşumunu ve yeşil bitki regenerasyonunu önemli derecede artırdığı tespit edilmiştir. En fazla yeşil bitki oluşumu, 10 mg/l AGP kullanılan ortamlarda elde edilmiştir. 10 mg/l Larcol ile 1 mg/l AGP kullanılan ortamlardan elde edilen yeşil bitki sayısı eşit olmuştur. Bu da AGP nin Larcol e göre daha güçlü olduğunu göstermektedir. Shariatpanahi vd. (2006), ekmeklik buğday (T. aestivum) çeşitlerinden haploid/doubled haploid bitki üretimi için sıcaklık, soğuk ve açlık gibi stres uygulamaları olmadan etkili bir buğday mikrospor kültür yöntemi geliştirmeyi amaçlamışlardır. Denemelerde üç yazlık ( Falat, Rasool ve Bobwhite ) ve üç 26
39 kışlık F 1 ( F071, ve ) buğday genotipi kullanılmıştır. Başaklar hiçbir önişleme alınmadan doğrudan kullanılmıştır. Mikrosporlar anterlerden besin olmayan ortamda, manyetik karıştırıcı ile izole edilmiştir. İzole edilen mikrosporlar A2 kültür ortamına alınmış ve ilk embriyogenik mikrosporlar elde edildiğinde kültür ortamını değiştirmeden ortama 6-7 tane ovaryum ve fitohormonlar (1 mg/l 2,4-D ve 0.2 mg/l kinetin) eklenmiştir. Embriyolar oluşana kadar kültür ortamı C de karanlıkta inkübe edilmiştir. Daha sonra embriyolar A2R regenerasyon ortamına aktarılmıştır. Yazlık buğday çeşitleri kışlık çeşitlere göre daha fazla yeşil bitki regenerasyonu meydana getirmiştir. Yapılan denemeler sonucunda, stres uygulamaları olmadan da yüksek oranda regenerasyon ve yeşil bitki elde edilebileceği görülmüştür. Elde edilen verilerde stres parametrelerine ihtiyaç duyulmadan doubled haploid bitki üretilebilmesi, şeker ve nitrojen içermeyen ortamda izole edilen mikrosporların yeterli bir stres ortamında oldukları için cevap verdiği düşünülmektedir. Bakos vd. (2007), makarnalık (Triticum turgidum L. cv. Martondur 1 ) ve ekmeklik (Triticum aestivum L. cv. Mv Pálma ) buğday genotiplerinin mikrospor kültür tekniğinde soğuk önişlem, açlık ve sıcaklık şokları gibi farklı önişlem uygulamalarının mikrospor indüksiyonu, embriyo oluşumu ve regenerasyon kabiliyetlerindeki etkilerini araştırmışlardır. Önişlem uygulamaları arasında, başakların 0, 2, 7 ve 14 gün +4ºC de, anterlerin 0.4 M mannitol + Fmakro elementlerle 3 gün 33ºC de ve bu uygulamaların çeşitli kombinasyonları bulunmaktadır. İzole edilen mikrosporlar A2 indüksiyon ortamına ve embriyolar B5 (Gamborg et al., 1968) regenerasyon ortamına alınmıştır. Yüksek sıcaklıklarda açlık uygulaması mikrospor embriyogenesis için önemli bir parametre olmuştur. En iyi sonuçlar, yüksek sıcaklıkta yapılan açlık uygulaması ile iki gün soğuk önişlem (203 ± 34 embriyo benzeri yapılar/100 anter) ve soğuk önişlem yapılmayan (212 ± 77 embriyo benzeri yapılar/100 anter) uygulamalardan alınmıştır. Labbani vd. (2007), mikrospor kültür tekniğinde Triticum turgidum subsp. durum cv. Jennah Khetifa makarnalık buğday çeşidinde mannitol ile farklı soğuk önişlem sürelerinin embriyo oluşumu ve yeşil bitki regenerasyon üretimi üzerindeki etkilerini 27
40 araştırmışlardır. Denemelerde donör bitkilerden elde edilen başaklar, 0.3 M mannitol ile farklı sürelerde (3, 5, 6, 7, 8, 10 ve 12 gün) 4ºC de soğuk önişleme alınmıştır. Anterlerden izole edilen mikrosporlar, sıvı CHB3 (Chu et al., 1990) besin ortamında kültüre alınmıştır. Her bir petri kabına yaklaşık 5-10 tane olgunlaşmamış taze ovaryum eklenmiş ve 28ºC de, gün, karanlıkta inkübe edilmiştir. Mikrosporlardan oluşan embriyolar, 3-5 hafta sonra hormon içermeyen katı MS regenerasyon ortamına aktarılmıştır. Üç hafta sonra yeşil ve albino bitkiler sayılarak istatistik analizleri yapılmıştır. Denemeler sonucunda embriyo oluşumu ve yeşil bitki regenerasyonu üzerinde en başarılı sonucu, 0.3 M mannitol ve 7 günlük soğuk önişlem süresi vermiştir. Toplam mikrospordan olgun embriyo ve yaklaşık 85 yeşil bitki elde edilmiştir. Ortalama mikrospordan yeşil bitki elde edilmiştir. Bu çalışma bu zamana kadar mikrospor kültürü ile durum buğdayında yapılmış olan en yüksek embriyo oluşumu ve yeşil bitki regenerasyonu sonuçlarını vermiştir. Soriano vd. (2007), ekmeklik buğdayda (T. aestivum) kolhisinin anter ve mikrospor kültüründe kromozom katlanması ve androgenesis üzerindeki etkilerini araştırmışlardır. Denemelerde, yazlık ekmeklik buğday genotiplerinden Chris (mikrospor kültür tekniğine uyumlu), Pavon (orta-yüksek uyumlu), Caramba (az uyumlu) ve bir doubled haploid hat DH34033 (az uyumlu) kullanılmıştır. Anterler önişleme, anter kültürü için mikrosporlar orta veya geç-tek çekirdekli ve mikrospor kültürü için geç-tek çekirdekli veya erken-çift çekirdekli safhadayken alınmıştır. Kolhisin denemelerde iki farklı uygulamada (önişlem ve kültür ortamı) kullanılmıştır g/l mannitol, 5.9 g/l CaCl 2 ve FHG ortamı içeren önişlem uygulamasına üç farklı konsantrasyonda (0, 150 ve 300 mg/l) ve MMS3 (Hu and Kasha, 1997) kültür ortamına da yine üç farklı konsantrasyonda (kontrol (0), 150 ve 300 mg/l) kolhisin eklenmiştir. Anter ve mikrospor kültürünün her ikisinde de kolhisin eklenmesinden 1 saat sonra kromozom katlanma oranları hızla artmıştır. Denemeler sonucunda, düşük uyum yeteneği olan iki genotipte de Caramba (% 75) ve DH24033 (% 118) en yüksek kromozom katlanması oranı 300 mg/l kolhisin uygulamasında görülmüştür. Pavon genotipinde mikrospor kültür tekniği kullanılarak 300 mg/l kolhisin ile embriyo oluşumunda 2 kat ve yeşil bitki 28
41 regenerasyonu oranında ise 3 kat artış meydana geldiği tespit edilmiştir. Fakat anter kültüründe bu parametrelerde herhangi bir değişiklik gözlenmemiştir. Santra vd. (2008), buğday (Triticum sp.) mikrospor kültüründe etkili bir yöntem geliştirmek için çalışmalar yapmışlardır. Denemelerde, yeşil bitki dönüşümü için en iyi önişlem uygulaması, askorbik asit içeren kültür ortamı ve regenerasyon ortamı belirlenmeye çalışılmıştır. Dört buğday genotipinde iki farklı önişlem uygulaması (0.4 M mannitol +4ºC ve 0.3 M mannitol + inorganik bileşikler + oda sıcaklığı) kullanılmıştır. Regenerasyon ortamı olarak beş farklı ortam (RG1, MS + BAP, kinetin ve tirozin; RG2, kinetin ve NAA; RG3, MS + BAP ve AgNO 3 ; RG4, MMS5 + kinetin ve PAA; RG5, askorbik asit ile modifiye ortam) hazırlanmıştır. Denemeler sonucunda, askorbik asit kullanılarak modifiye edilen regenerasyon ortamı en fazla yeşil bitki meydana getirmiştir. 0.4 M mannitol +4ºC de önişlem uygulamasıyla da en fazla embriyo, bitki regenerasyonu ve yeşil bitki oranı elde edilmiştir. Cistue vd. (2009), makarnalık buğdayda Cistue vd. (2006) nin geliştirdiği indüksiyon ortamında modifikasyonlar meydana getirmeyi ve yeşil bitki regenerasyonu ile mikrospor embriyogenesisini artırmak için donör bitkilere uygun ortam koşulları oluşturmayı amaçlamışlardır. Denemelerde, üç makarnalık buğday (T. turgidum) genotipi ( Ciccio, Claudio ve Lanuza ) kullanılmıştır. Birinci denemede, mikrosporlar 200 g/l Ficoll-400 ile C 17 kültür ortamına alınmıştır. Ayrıca ortama daha olgunlaşmış bir başağa ait 10 tane ovaryum eklenmiştir. Kontrol ortamı, 90 mg/l glutatiyon ve 500 mg/l glutamin içeren modifiye C 17 (C 17 m) ile karşılaştırılmıştır. İkinci denemede, 200 g/l Ficoll-400 içeren C 17 m ortamı, 300 g/l Ficoll-400 içeren C 17 m ortamı ile karşılaştırılmıştır. Üçüncü denemede ise, daha güçlü donör bitki yetiştirmek amacıyla sulama sırasında yapılan makro (nitrik nitrojen, amonyum nitrojen, üre kaynaklı nitrojen, fosforik anhidrid, potasyum oksit) ve mikro (bor, bakır, çinko, demir, mangan ve molibden) elementlerin karşılaştırılması yapılmıştır. Denemeler sonucunda, modifiye C 17 ortamı ile elde edilen embriyo benzeri yapılar ve yeşil bitki regenerasyonu C 17 ortamına göre daha fazla olmuştur. 300 g/l Ficoll-400 içeren C 17 m ortamının kullanılması ile Arcolino 29
42 çeşidinde yeşil bitki oranı 0.8 den 6.0 a, Claudio çeşidinde ise 25.8 den 55 e yükselmiştir. Ayrıca sulama sırasında makro ve mikro elementlerin kullanılması, daha gelişmiş, güçlü ve büyük başakların oluşmasını sağlamıştır. Toplam 1000 anterden, Ciccio ve Claudio çeşitlerinden sırasıyla 36.5 ve fertil bitki elde edilmiştir. Bu yöntem daha sonra yüksek üreme değerine sahip 10 F 1 bitkisinden fertil DH bitkiler elde etmek için de kullanılmıştır. Bu bitkilerden 849 yeşil bitki elde edilmiştir. Shirdelmoghanloo vd. (2009), Triticum aestivum cv. Falat çeşidinde çeşitli stres parametrelerinin ve embriyo indüksiyon ortamlarının mikrospor embriyogenesis ve yeşil bitki regenerasyonu üzerindeki etkilerini araştırmışlardır. Birinci denemede, başaklara kontrol grubuyla birlikte 5 farklı önişlem uygulaması (kontrol, 3 hafta soğuk önişlem, 7 gün soğuk önişlem + mannitol, 3 hafta soğuk önişlem + mannitol, soğuk önişlem + kimyasal + sıcaklık) yapılmıştır. İkinci denemede ise, başaklar 4ºC de 3 hafta önişleme alındıktan sonra 5 farklı kültür ortamına [NPB-99, C17, W14, CHB-2 ve P2 (Chuang et al., 1978)] alınmıştır. NPB-99 ve C17 ortamında, 0.2 mg/l 2,4-D mg/l kinetin + 1 mg/l PAA, W14 ortamında 2 mg/l 2,4-D mg/l kinetin, CHB-2 ortamında 0.5 mg/l 2,4-D mg/l kinetin ve P2 ortamında 1.5 mg/l 2,4-D mg/l kinetin kullanılmıştır. Denemeler sonucunda, 21 gün soğuk önişlem (4ºC) + mannitol (0.3 M) uygulaması en yüksek embriyo oluşumunu ( embriyo/başak) vermiştir. En düşük embriyo oluşumu (6.91 embriyo/başak) ise soğuk önişlem + kimyasal + sıcaklık ile yapılan uygulamalar ile alınmıştır. Yeşil bitki regenerasyonu açısından ise en yüksek oranı (% 40.33) 7 gün soğuk önişlem + mannitol uygulaması vermiştir. Kültür ortamlarından C17 ( embriyo/başak), NPB-99 ( embriyo/başak) ve W14 ( embriyo/başak) en yüksek embriyo oranını verirken, CHB-2 ortamı yeşil bitki regenerasyonu (% 50.76) açısından diğerlerine göre daha iyi sonuçlar vermiştir. Ayed vd. (2010), makarnalık buğdayda (Triticum turgidum subsp. durum Desf.) farklı önişlem uygulamalarının mikrospor kültür tekniği ile elde edilen yeşil bitki regenerasyonu üzerindeki etkilerini araştırmışlardır. Denemelerde üç makarnalık buğday ( Azizi, Khiar ve Razzek ) genotipi kullanılmıştır. Başaklarda kontrol 30
43 grubu dahil 8 farklı önişlem uygulaması (kontrol, 5 hafta soğuk önişlem, 12 gün 0.3M mannitol, 7 gün 0.3 M mannitol, 5 gün 0.7 M mannitol, 5 gün % 1.5 PEG 4000, 10 gün % 1 PEG 4000 ve 15 gün % 1 PEG 4000 ) kullanılmıştır. İzole edilen mikrosporlar ovaryumlar ile birlikte CHB3 kültür ortamına alınmış ve 27 C de karanlıkta inkübe edilmiştir. Denemeler sonucunda, en iyi embriyo oluşum oranı 5 hafta +4 C de yapılan önişlem uygulaması ile Khiar genotipinde alınmıştır. 15 gün % 1 PEG 4000 uygulaması hariç diğer bütün önişlem uygulamalarında mikrosporlar bölünme yeteneği göstermiştir. Fakat 15 gün % 1 PEG 4000 önişlem uygulaması, mikrosporlar için öldürücü etki yapmıştır. Beş hafta +4 C deki önişlem uygulamasından sonra embriyo oluşumundaki en iyi etkiyi 10 gün % 1 PEG 4000 uygulaması göstermiştir. Kullanılan genotipler arasında iki tanesi ( Razzek ve Khiar ) mikrospor kültür tekniğine iyi cevap verirken, Azizi genotipi embriyo ve bitki regenerasyonu meydana getirememiştir. Khiar genotipi 414 embriyo, 66 bitki regenerasyonu ve 43 yeşil bitki meydana getirmiştir. Islam (2010a), ekmeklik buğdayda (T. aestivum) bitki regenerasyonu elde etmek için etkili ve uygulanabilir bir mikrospor kültür sistemi geliştirmeyi amaçlamıştır. Regenerasyon miktarını artırmak amacıyla çalışmalar embriyo yaşı, büyüklüğü ve şekli üzerine yoğunlaşmıştır. Denemelerde, mikrospor kültür tekniğine uyumlu olan üç ekmeklik buğday genotipi ( Barkat, Kanchan ve Pavon 76 ) kullanılmıştır. Başaklar 3-15 gün arasında, 4 C de, karanlıkta önişleme alınmıştır. Mikrosporlar anterlerinden steril cam bir çubuk veya homojenizatör ile ayrılmıştır. İzole edilen mikrosporlar kültür ortamında 28 C de inkübe edilmiştir. Denemeler sonucunda, embriyo büyüklüğünün regenerasyon üzerinde önemli bir etki gösterdiği tespit edilmiştir. Embriyo büyüklükleri, büyük (> mm), orta ( mm) ve küçük (<1.0 mm) şeklinde üç gruba ayrılmıştır. Büyük embriyoların daha fazla yeşil bitki ürettiği gözlemlenirken, küçük embriyoların düşük regenerasyon yeteneğine sahip oldukları belirtilmiştir. Embriyo yaşının ve şeklinin de regenerasyon üzerinde önemli bir faktör olduğu tespit edilmiştir. Yapılan çalışmalarda erken safhada (3-5 hafta) yarı katı regenerasyon ortamına aktarılan embriyoların, daha geç safhada (6-8 hafta) aktarılan embriyolara göre çok daha fazla yeşil bitki ürettiği gözlemlenmiştir. Altı haftadan sonra regenerasyon ortamına aktarılan embriyolarda, daha erken safhada 31
44 aktarılan embriyolara göre çok daha fazla albino bitki elde edilmiştir. Bu sonuçlar embriyo şeklinin de (globular, kalp ve torpedo) regenerasyon için önemli olduğunu göstermektedir. Büyük ve kalp şeklindeki embriyolar, yüksek oranda yeşil bitki ve düşük oranda albino bitkiler meydana getirmiştir. Islam (2010b), buğday (T. aestivum) mikrospor kültüründe kolhisinin fertil bitki oluşumu üzerindeki etkisini araştırmıştır. Denemelerde, anter ve mikrospor kültür tekniğine uyumlu, yazlık ekmeklik buğday genotipi DH83Z kullanılmıştır. Başaklar, mikrosporlar geç-tek çekirdekli ve erken-çift çekirdekli safhada iken toplanmış ve 3-14 gün arasında, +4ºC de, karanlıkta önişleme alınmıştır. Denemeler hem anter kültüründe hem de mikrospor kültüründe uygulanmıştır. Birinci denemede, anterler 100 mg/l kolhisin içeren üç ayrı ön-kültür ortamına [PC (preculture), WM (washing medium) ve modifiye AMC (Schmid, 1990)] alınmıştır. Kontrol ortamına ise kolhisin eklenmemiştir. İkinci denemede ise cam bir çubuk yardımıyla izole edilen mikrosporlar yine 100 mg/l kolhisin içeren üç farklı ön-kültür ortamına (PC, WM ve AMC) alınmış ve 6-8 tane ovaryum ile birlikte 27ºC de, karanlıkta inkübe edilmiştir. AMC indüksiyon ortamına ise üç farklı konsantrasyonda kolhisin (50, 100 ve 150 mg/l) eklenmiştir. Denemeler sonucunda, anter kültüründe uygulanan kolhisinin embriyo oluşumu ve yeşil bitki regenerasyonunu artırdığı görülmüştür. Birinci denemede mikrospor kültüründe mikrosporlara doğrudan uygulanan kolhisinin embriyo oluşumunu 3-4 kat azaltırken, fertil bitki regenerasyonunu artırdığı tespit edilmiştir. Anter ve mikrospor kültüründe kullanılan kolhisinin kromozom katlanması oranını (% 84.94), kolhisin kullanılmayan uygulamaya göre (% 55.26) artırdığı görülmüştür. İkinci denemede ise, AMC kültür ortamında kullanılan üç farklı konsantrasyondaki kolhisinin embriyo oluşumunu ve yeşil bitki oranının azalttığı görülürken, albino bitkilerin regenerasyonunu uyardığı tespit edilmiştir. Kolhisin embriyo miktarını azaltırken, çalışmanın asıl amacı olan fertil bitki oranını artırmıştır. Diploid bitkilerin oranı (% 81.73) her üç uygulama ile kontrol grubuna (% 72.40) göre artış göstermiştir. 32
45 2.2. Arpa (Hordeum sp.) Mikrospor Kültür Tekniği ile Yapılan Çalışmalar Castillo vd. (2000), arpada (Hordeum vulgare L.) doubled haploid bitkiler elde etmek amacıyla anter ve mikrospor kültür tekniklerini karşılaştırmışlardır. Yapılan çalışmalarda, kültür tekniklerine farklı uyum gösteren üç arpa genotipinde ( Hop, Igri ve Reinette ) embriyo oluşumu ve yeşil bitki regenerasyon miktarının artırmak için en uygun mikrospor yoğunluğu ve regenerasyon kültür ortamı bileşenleri tespit edilmeye çalışılmıştır. Anterler ilk önce 0.7 M mannitol ve 8 g/l agaroz ile katılaştırılmış önişlem ortamına alınmıştır. Anter kültürü için, anterler doğrudan 1.5 ml FHG indüksiyon ortamına alınmıştır. Mikrospor kültürü için ise homojenizatör ile izole edilen mikrosporlar farklı yoğunluklarda (1.2, 2.4, 6.0 ve 12.0 x 10 5 mikrospor / ml) 1 ml FHG kültür ortamına alınmıştır. Altı farklı kültür ortamı (62 g/l veya 31 g/l maltoz, 0.73 g/l glutamin + 1 g/l kazein, 0.5 mg/l IAA, 2 mg/l NAA, 100 mg/l PAA) hazırlanmıştır gün sonra iyi gelişen embriyolar, 0.5 mg/l IAA ve 1 mg/l BAP içeren FHG regenerasyon ortamına aktarılmıştır. Denemeler sonucunda, anter kültürü ve mikrospor kültürü tekniklerinin her ikisinden de yeşil bitki meydana gelmiştir. Bu da denemelerde kullanılan kültür yöntemlerinin etkili olduğunu göstermiştir. 2.4 x 10 5 mikrospor / ml mikrospor yoğunluğu kullanılarak yapılan denemelerde her üç genotipte de en fazla mikrospor bölünme, embriyo ve yeşil bitki oranı görülmüştür. 12 x 10 5 mikrospor / ml mikrospor yoğunluğunda ise mikrospor bölünme oranı oldukça düşmüştür. Glutamin ve kazein içermeyen, 31 g/l maltoz, IAA ve NAA içeren kültür ortamı en fazla yeşil bitki meydana getiren ortam olmuştur. Kasha vd. (2001), arpada (H. vulgare) anter kültüründen daha etkili bir teknik olan mikrospor kültür tekniğinde kullanılan önişlem ve izolasyon yöntemlerini geliştirmeyi amaçlamışlardır. Denemelerde, yazlık ve kışlık, 2-sıralı ve 6-sıralı 30 farklı arpa genotipi kullanılmıştır. Başaklarda yedi farklı önişlem uygulaması (28 gün, 4ºC, soğuk önişlem; 21 gün, 4ºC, soğuk önişlem; 4 gün, 0.3 M mannitol, 4ºC; 4 gün, 0.3 M mannitol, 25ºC; 3 gün, 0.3 M mannitol, 4ºC; 7 gün, 0.3 M mannitol, 4ºC ve 21 gün, 0.3 M mannitol, 4ºC) kullanılmıştır. 4ºC ve 0.3 M mannitol uygulamasında farklı süreler de (0, 4, 7, 14, 21 ve 28) denenmiştir. Mikrosporlar 33
46 anterlerden blender ile izole edilmiş ve PAA kullanılan FHG ortamına alınmıştır. Embriyolar 1-2 mm büyüklüğe ulaştıklarında farklılaşma ortamına alınmış ve 1-2 hafta sonra MS regenerasyon ortamına aktarılmıştır. Denemeler sonucunda, 21 gün 0.3 M mannitol, 4ºC de önişleme alınan mikrosporlardan en fazla embriyo oluşumu (15377) meydana gelmiştir. Fakat bitki regenerasyonu açısından en başarılı sonucu 4 gün, 0.3 M mannitol, 4ºC uygulaması (% 97) vermiştir. Farklı sürelerde 4ºC de, 0.3M mannitolde tutulan mikrosporlardan en fazla embriyo oluşumu ise (10213) 28 gün önişlem uygulamasıyla alınmıştır. Li ve Devaux (2001), mikrospor kültürüne dirençli arpa (H. vulgare) genotiplerinde embriyo ve bitki regenerasyonu oluşumunda ovaryumların etkisini araştırmışlardır. Denemelerde, dört yazlık ( Celinka, Cooper, Cork ve Douchka ) ve üç kışlık ( Gotic, Nikel ve Maeva ) arpa genotipi kullanılmıştır. Üç genotipe üç farklı önişlem uygulaması [0.3 M mannitol, 0.3 M mannitol + 10 mm CaCl 2 ve B ortamı (Kyo and Harada, 1986)] kullanılmıştır. 4 gün önişlem uygulamasından sonra, mikrosporlar blender ile izole edilmiştir. İzole edilen mikrosporlar, FW1B (modifiye FHG) sıvı ortamında 26ºC de 7-8 gün inkübasyona alınmıştır. Ovaryumlar inkübasyon ortamına farklı sayı (0-20 / ml ortam) ve sürelerde (0, 10, 20, 30 ve 40 gün) konulmuştur. Denemelerde, B ortamı mikrospor embriyogenesisinde en iyi sonucu verirken, Igri genotipinde sık kullanılan 0.3 M mannitolun dirençli genotiplerde etkili olmadığı görülmüştür. Ovaryum kullanılarak elde edilen sonuçlarda, kontrol grubuna göre embriyo oluşumunda 2.1 kat, yeşil bitki regenerasyonunda 2.4 kat artış olmuştur. Beş ovaryum / ml ortam ve 20 gün kültür ortamında tutulan ovaryumlardan embriyo oluşumu ve bitki regenerasyonu olarak en iyi sonuçlar elde edilmiştir. Mikrospor kültür tekniğine dirençli genotiplerde önişlem uygulamalarında B ortamı, embriyogenik mikrosporların ve indüksiyon ortamında ovaryum kullanılması hücre bölünmelerini artırmıştır. Ritala vd. (2001), arpada (H. vulgare) mikrospor kültürü yoluyla yeşil regenerant bitki oluşumunu artırmak amacıyla etkili bir protokol geliştirmeyi amaçlamışlardır. Denemelerde donör bitki ekim zamanının, farklı önişlem uygulamalarının, izolasyon yöntemlerinin, kültür ortamlarının ve kültür ortamına eklenen glutamin ve bakırın 34
47 bitki regenerasyonu üzerindeki etkilerine bakılmıştır. Üç farklı önişlem uygulaması (başaklar +4ºC de karanlıkta a- alüminyum folyo ile suya batırılmış, b- su ilave edilmiş petri kaplarında, ve c- suyla nemlendirilmiş filtre kağıtları ile petri kaplarında) 0-4 hafta arasında değişen sürelerde yapılmıştır. Kültür ortamı olarak 108C (modifiye N6) ortamı kullanılmıştır ve ortamda glutaminin yokluğu ile bakır ilavesinin etkilerine bakılmıştır. Mart-Ekim ayları arasında serada yetiştirilen bitkilerden Kasım-Şubat arasında yetiştirilen bitkilere göre daha fazla yeşil bitki regenerasyonu elde edilmiştir. Sonuçlar, farklı dönemlerde yetiştirilen donör bitkilerin meydana getirdiği başakların kalitesini etkilediğini göstermektedir. Yapılan önişlem uygulamaları bitki regenerasyonunu olumlu etkilemiştir. Dört hafta, 4ºC de, nemlendirilmiş filtre kağıtları ile petri kaplarında önişleme alınan başaklar ile en iyi yeşil regenerant bitki oranı elde edilmiştir. Kültür ortamına glutaminin ilave edilmemesi yeşil regenerant bitki oluşumunda herhangi bir değişikliğe neden olmazken albino bitki oluşumunu artırmıştır. Ortama bakırın ilave edilmesinde de yeşil bitki regenerasyonunda herhangi bir değişiklik görülmemiştir. Li ve Devaux (2005), arpada (H. vulgare) mikrospor kültürü ile anter kültürü tekniklerini kullanarak yeşil bitki regenerasyonunu artırmak amacıyla çalışmalar yapmışlardır. Denemelerde, iki kültür tekniğinin yeşil bitki üretimi, soğuk ve mannitol ile yapılan önişlem uygulamalarına alınan mikrospor safhalarının etkisi ve ortamların sterilizasyon yöntemlerinin mikrospor kültürüne etkisi, yeni ve uygun bir prosedür geliştirmek amacıyla karşılaştırılmıştır. Yapılan çalışmalarda, altı kışlık arpa genotipi ( Gotic, Hispanic, Igri, Jerka, Lyric ve Plaisant ) kullanılmıştır. Anter ve mikrospor kültür tekniklerinin karşılaştırıldığı birinci denemede başaklar aynı şartlarda önişleme alınıp daha sonra kültür ortamına aktarılmıştır. İkinci denemede mikrosporlar soğuk ve mannitol ile yapılan önişleme farklı safhalarda (erken-orta, orta-geç, geç tek çekirdekli ve çift çekirdekli safha) alınmıştır. Üçüncü denemede ise kullanılan kültür ortamı üç farklı şekilde (1. Otoklavlama: 121 C de 15 dakika, 2. Filtre sistemiyle: 0.2 µm por büyüklüğünde filtre ile ve 3. Filtre + otoklavlama: organik bileşikler filtre ile inorganik bileşikler otoklav ile) sterilize edilmiştir. Denemeler sonucunda, tüm genotipler arasında mikrospor kültür tekniği (100 anterden 3.6 ile 287 arasında) anter kültürüne (0 ile 35
48 29.6 arasında ) göre 9.3 kat daha fazla yeşil bitki meydana getirmiştir. Mikrospor kültür tekniği ile tüm genotiplerde yeşil bitki meydana gelirken anter kültürü ile iki genotipte yeşil bitki oluşumu gözlenmemiştir. Soğuk ve mannitol ile yapılan önişlem uygulamalarında mikrospor safhası embriyo oluşumu bakımından değişik sonuçlar vermiştir. Soğuk önişlem uygulamasında en iyi sonuç orta-tek çekirdekli safha (562.3 embriyo, yeşil bitki) ile alınırken, mannitol uygulamasında ise geç-tek çekirdekli safha (548.5 embriyo yeşil bitki) en iyi sonucu vermiştir. Filtre ile sterilize edilmiş kültür ortamı (89.2), otoklavlanmış ortama (20.7) göre 4 kat daha fazla yeşil bitki oluşturmuştur. Fakat hem filtre hem de otoklavlanarak kullanılan ortamdan alınan sonuçlar (105.6) her ikisine göre daha fazla olmuştur. Oleszczuk vd. (2006), arpada (H. vulgare) mikrospor kültür tekniği ile mikrosporlara, anterlere ve başaklara yapılan farklı soğuk önişlem uygulamalarının embriyo oluşumu ve yeşil bitki regenerasyonu oluşumu üzerindeki etkilerini araştırmışlardır. Yapılan çalışmalarda birçok farklı önişlem uygulaması ve kombinasyonları kullanılmıştır. Bunlar; 4ºC de 2 hafta başaklara uygulanan soğuk önişlem (önişlem A), izole edilmiş anterlerin 32ºC de 24 saat (önişlem B), 26ºC de 3 gün (önişlem C) ve 4ºC de 3 gün (önişlem D) 0.3 M mannitolde inkübasyonu; 4ºC de 2 hafta başaklara uygulanan soğuk önişlemden sonra 3 gün 26ºC de mannitolde tutma (önişlem E); mikrosporların 32ºC de 24 saat (önişlem F) ve 4ºC de 3 gün (önişlem G) mannitolde önişleme alınması gibi farklı uygulamalar denenmiştir. Kontrol grubu olarak da hiç önişlem uygulanmayan başaklar kültüre alınmıştır. Her bir önişlem uygulamasında 40 adet başak kullanılmıştır. İndüksiyon ortamı olarak K99 (Deutsch et al., 2004) kullanılmış ve ortama 1 mg/l BAP, 100 mg/l myo-inositol ve 250 mg/l kazein hidrolizat ilave edilmiştir. Bitki regenerasyonu için ise katı ortamı (Zhuang and Xu, 1983) kullanılmış ve 27ºC de inkübasyona alınmıştır. Yapılan denemeler sonucunda, en fazla mikrospor bölünme oranı (% 35) ve androgenesise en yüksek cevap (% 0.03) veren uygulama 32ºC de 24 saat mannitolde önişleme alınan mikrosporlardan alınan uygulama olmuştur. En çok yeşil bitki regenerasyonu, haploid bitki ve doubled haploid bitki oranı da bu uygulama ile elde edilmiştir. 36
49 Echavarri vd. (2008), mikrospor kültür tekniğine az, orta ve iyi uyumlu arpa genotiplerinde farklı konsantrasyonlardaki çinko sülfatın (ZnSO 4 ) mikrospor embriyogenesisi üzerindeki etkilerini araştırmışlardır. Denemelerde, iki 2-sıralı kışlık ( Igri ve Reinette ) ve bir 6-sıralı kışlık ( Hop ) arpa genotipi kullanılmıştır. Igri mikrospor kültür tekniğine uyumlu bir genotipken, Reinette orta ve Hop ise az uyumlu bir genotiptir. Birinci denemede genotiplere ait anterler, 0.7 M mannitol, 40 mm CaCl 2, 8 g/l agar ve farklı konsantrasyonlarda ZnSO 4 (0-kontrol, 30, 90, 180, 300 ve 600 µm) içeren önişlem ortamına alınmıştır. Önişlemden sonra anterler 2 ml sıvı FHG indüksiyon ortamına aktarılmıştır. İkinci denemede, anterler önce beş farklı konsantrasyonda ZnSO 4 (0, 90, 180, 300 ve 600 µm) içeren önişlem ortamına, sonra aynı konsantrasyonlarda ZnSO 4 içeren 2 ml FHG indüksiyon ortamına alınmıştır. Üçüncü denemede, anterlerden izole edilen mikrosporlar 4 gün önişleme alındıktan sonra, 30-kontrol, 90, 180 ve 300 µm ZnSO 4 içeren sıvı FHG ortamında inkübe edilmiştir. Denemeler sonucunda, sadece önişlemde kullanılan ZnSO 4 konsantrasyonları arasında herhangi bir fark gözlenmemiştir. Hem önişlem hem de indüksiyon ortamında kullanılan uygulamalardan Igri ve Reinette genotiplerde en etkili doz 180 µm ZnSO 4, Hop genotipinde ise 90 µm ZnSO 4 uygulamasında görülmüştür. 180 µm ZnSO 4 uygulaması ile Igri ve Reinette genotiplerinde embriyo ve yeşil bitki oluşumunda sırasıyla % 30 ve % 300 oranında artış gözlenmiştir. Mikrospor kültüründe kullanılan µm ZnSO 4 arasındaki konsantrasyonların hepsi % oranında embriyo ve yeşil bitki oluşumunu artırmıştır. Tüm bu sonuçlar, kültür safhasında Zn +2 kullanılmasının embriyo sayısını ve yeşil bitki oluşumunu artırdığını göstermektedir. Lu vd. (2008), arpada mikrospor embriyogenesisini artırmak için etkili bir mikrospor kültür tekniği geliştirmeyi amaçlamışlardır. Kültür ortamına ilave edilen çiçekçiklerin mikrospor kültüründeki etkilerine bakılmıştır. Yapılan denemelerde 4 diploid hat (S23, E2, SD1 ve A11) ve bir tetraploid hat (93A) kullanılmıştır. Uygun dönemdeki başaklara 15 gün 4ºC de soğuk önişlem uygulanmıştır. İndüksiyon ortamı olarak modifiye edilmiş N6 (Chu and Hill, 1988) ortamı kullanılmış ve ortama 2,4-D ve kinetin ilave edilmiştir. Farklılaşma ortamı olarak ise MS ortamı ve BA, kinetin ve NAA büyüme regülatörleri kullanılmıştır. Regenerasyonu artırmak amacıyla 37
50 çiçekçikler indüksiyon ortamına ilave edilmiştir. Yapılan denemeler sonucunda, ortama ilave edilen çiçekçiklerin çok hücreli ve embriyo benzeri yapılar ile yeşil bitki oranını arttırdığı tespit edilmiştir. Tetraploid bitkiden alınan çiçekçikler diploid olanlara göre daha etkili olmuştur. S23 hattı için, tetraploid bitkilerden alınan çiçekçiklerin kullanılması mikrospor kültüründe hiç çiçekçik kullanılmamasına göre, çok hücreli yapıların oluşumunda 2.6 kat ve embriyo benzeri yapıların oluşmasında ise 7.8 kat artış meydana getirmiştir gün soğuk önişlemde tutulan çiçekçikler tutulmayanlara göre ve tek çekirdekli mikrosporlardan alınan çiçekçiklerde iki çekirdekli olanlara göre daha fazla regenere bitki geliştirmişlerdir. 38
51 3. MATERYAL VE YÖNTEM 3.1. Materyal Denemelerde, dört makarnalık (tetraploid-aabb) Triticum durum Desf. cvs. Kızıltan-91, Ç-1252, Mirzabey 2000 ve Kunduru-1149 (2n=4x=28) ve bir ekmeklik (heksaploid-aabbdd) Triticum aestivum L. cv. Gün-91 (2n=6x=42) buğday genotipi kullanıldı. Genotiplere ait tohumlar Ankara Tarla Bitkileri Merkez Araştırma Enstitüsü nden (TARM) temin edildi. Kızıltan-91, Ç-1252, Mirzabey 2000 ve Gün-91 çeşitleri Ankara TARM tarafından tescil edilmiştir. Bunlardan Kızıltan-91, ülkemizde bilinen en iyi makarnalık çeşittir. Ayrıca, orta boylu ve protein oranı % arasında olup, makarnalık buğday ekim alanlarının % 26 sını oluşturmaktadır. Kunduru-1149 ise Eskişehir Tarımsal Araştırma Merkezi nde seleksiyon yolu ile ıslah edilen eski çeşitlerimizdendir Yöntem Donör bitkilerin yetiştirilmesi Denemeler bölümümüz bünyesinde 2003 yılında kurulan Bitki Doku Kültürü ve Biyodozimetri Laboratuvarı ve bu laboratuvara bağlı olan bitki büyütme odasında yürütüldü. Makarnalık ( Kızıltan-91, Ç-1252, Mirzabey 2000 ve Kunduru ) ve ekmeklik ( Gün-91 ) buğday genotiplerine ait tohumlar Aralık ve Eylül olmak üzere iki dönemde ekildi. Makarnalık buğday genotiplerinin birinci döneme ait ekimleri Aralık 2009 da, ekmeklik buğday genotipinin ekimi ise Ocak 2010 da yapıldı. İkinci döneme ait tüm genotiplerin ekimi Eylül 2010 döneminde tamamlandı. Bitkilerin uygun gelişimini sağlamak amacıyla 3 : 1 oranında torf toprağı : kum karışımı hazırlandıktan sonra, her bir saksıya 3 adet tohum ekildi. Zayıf gelişim gösteren bitkilerden bir tanesi alındı. Bitkiler 16 saat ışık / 8 saat karanlıkta, 18º ± 2ºC / 24º ± 2ºC (ışık / karanlık) sıcaklıkta, lüks ışık şiddetinde ve %
52 nem oranında (Peak Tech 3695-dijital multitester) yetiştirildi (Şekil 3.1.a, b). Haftada iki gün (pazartesi ve perşembe) olmak üzere düzenli sulamaları yapılıp, uygun aralıklarla kimyasal gübre (N:P:K) verildi. Kimyasal gübre, 26.5 g (NH 4 ) 2 SO 4, 13 g P 2 O 5, 9 g KCl olarak tartılarak 2 litre distile su (dh 2 O) ile hazırlandı ve her bir saksıya 50 ml ilave edildi. Gerekli zamanlarda böceklenmeye karşı kimyasal ilaçlama yapıldı. a b Şekil 3.1. Bitki büyütme odasında yetiştirilen donör bitkiler Kültüre alınacak mikrosporların gelişim dönemlerinin belirlenmesi Anterlerin donör bitkiden izole edildiği anda mikrosporların hangi gelişme döneminde olduğunu tespit etmek için sitolojik gözlemler yapıldı. Makarnalık ve ekmeklik buğday çeşitlerine ait farklı gelişme dönemlerine sahip başakçıklardaki anterler pinsetler yardımıyla çıkarılarak lam üzerine alındı. Jilet yardımıyla birkaç bölüme ayrılan anter parçalarının üzerine bir damla % 2 lik aseto-karmin damlatıldı ve üzerine lamel kapatılarak bastırıldı. Böylece mikrospor çekirdeklerinin boyanması sağlandı. Hazırlanan preparatlarda yapılan mikroskobik gözlemler ile mikrosporların gelişim aşamaları ortaya konuldu (Kasha et al., 2001). Mikrospor kültürü için en uygun olduğu belirlenen orta-geç tek çekirdekli mikrospor (Şekil 3.2.e) aşamasının bayrak yaprağının tam olarak yaprak kınından çıkmadan önceki başakta olduğu ve anterlerin ise açık yeşimlisi renkte oldukları belirlendi. 40
53 por çekirdek a) çok-erken tek çekirdekli b) erken tek çekirdekli c) erken-orta tek çekirdekli d) orta tek çekirdekli e)*orta-geç tek çekirdekli f) geç tek çekirdekli g) ilk polen mitozu h) erken iki çekirdekli i) iki çekirdekli Şekil 3.2. Mikrospor gelişme dönemleri (*mikrospor kültürü için uygun safha) Başakların toplanması Orta-geç tek çekirdekli mikrospor safhasında olduğu tespit edilen başaklar, ikinci nodyumun altından kesilerek ml dh 2 O bulunan 250 ml lik erlenmayerler içerisine konuldu (Şekil 3.3.). Alınan bitkilerin başak kısmı alüminyum folyo içerisine sarılarak çeşitlere göre etiketlendi. Kardeş başaklar da aynı morfolojik gelişmeye ulaşıncaya kadar +4ºC de buzdolabında muhafaza edildi. Önişlem için yeterli sayıda (5-10 adet) başak toplanıncaya kadar işlem sürdürüldü. 41
54 a b c d e Şekil 3.3. Başakların toplanması a ve b. bayrak yaprağından tam olarak yaprak kınından çıkmadan önceki başaklar, c. ve d. alüminyum folyoya sarılmış ve etiketlenmiş başaklar, e. toplanan başakların saf su içerisindeki görünümleri Başakların sterilizasyonu Başaklar önişleme alınmadan önce yüzey sterilizasyonları yapıldı. Donör bitkiler bitki büyütme odasında steril toprak ile yetiştirildiğinden, yüzey sterilizasyonları için sadece % 70 lik etanol kullanıldı. Laminar (steril) kabin içerisinde ilk nodyumun üstünden kesilen ve bayrak yaprağın üst kısmı alınan başakların yaprak kınlarının üzerinden % 70 lik etanol ile yüzey sterilizasyonları yapıldı Başak ve anterlere uygulanan önişlemler Yüzey sterilizasyonları yapıldıktan sonra yaprak kınından çıkarılan başakların kılçıkları kesilip (Şekil 3.4.), 9 cm lik steril petri kaplarına alındı. Çeşitli önişlem uygulamalarından sonra petri kaplarının etrafı parafilm ile kapatıldı (Şekil 3.5.). 42
55 Daha sonra petriler alümiyum folyo ile sarılarak üzerlerine petri sayısı, çeşit, önişleme alınma tarihi ve başak sayısı gibi bilgiler yazıldı. a b Şekil 3.4. Kılçıkları kesilen başaklar a. makarnalık buğday, b. ekmeklik buğday a) soğuk önişlem (+4ºC) b) 0.4 M mannitol ile önişlem c) çeşitlere ait başaklar Şekil 3.5. Başaklara uygulanan farklı önişlemler a) stereo mikroskop b) başakçık içindeki anterler c) iki loblu anter Şekil 3.6. Anterlerin stereo mikroskop altında başaklardan alınması 43
56 Başaklara farklı önişlemler (1. +4ºC de soğuk önişlem, 2. +4ºC M mannitol, 3. +4ºC M sorbitol ve 4. oda sıcaklığı M mannitol) uygulandı (Çizelge 3.1.). Bu uygulamalardan sonra anterler başaklardan steril pinsetler yardımıyla stereo mikroskop altında alındı (Şekil 3.6.) ve uygulama çeşidine göre 0,4 M mannitol veya sorbitol bulunan 3 cm lik petrilere konuldu (Şekil 3.7.). Anterlerin alındığı sırada ovaryumlar da az miktarda saf su bulunan başka bir petri kabı içerisine alınarak mikrosporlar kültüre alınıncaya kadar +4ºC de buzdolabında muhafaza edildi (Şekil 3.8.). Çizelge 3.1. Başak ve anterlere uygulanan farklı önişlemler ve ortam koşulları No Materyal Önişlem Ortam Koşulları (1) Başak 0.5 ml saf su bulunan perilerde +4ºC, 7 gün, karanlık Anter (2) Başak Anter (3) Başak Anter (4) Başak Anter 0.4 M mannitol 0.4 M mannitole kısmen batırılmış 0.4 M mannitol 0.4 M sorbitole kısmen batırılmış 0.4 M sorbitol 0.4 M mannitole kısmen batırılmış 0.4 M mannitol Oda sıcaklığı, 1 gün, karanlık +4ºC, 7 gün, karanlık Oda sıcaklığı, 1 gün, karanlık +4ºC, 7 gün, karanlık Oda sıcaklığı, 1 gün, karanlık Oda sıcaklığı, 5 gün, karanlık Oda sıcaklığı, 1 gün, karanlık Şekil 3.7. Anterlerin mannitol çözeltisine alınması 44
57 Şekil 3.8. Başakçıktan alınan ovaryumların petri kabında +4ºC de buzdolabında muhafazası Farklı önişlem uygulamaları sonucunda anterlerin yapısı ve mikrosporların durumu ışık mikroskobu altında incelendi (Şekil 3.9.). Şekil 3.9. Farklı önişlem uygulamaları sonucu anterdeki mikrosporların görünümü 45
58 Mikrosporların izolasyonu Anterlerden izole edilecek mikrosporlar por açıklığı 100 µm olan filtre kağıdı içeren steril filtre sistemi (Millipore Sterifil) içerisine alındı ve vakum pompası (Şekil 3.10.) ile mannitol bulunan önişlem sıvısından ayrıldı. Filtre üzerinde bulunan anterler cam bir çubuk yardımıyla ezildi (Şekil 3.11.) ve tortunun üzerinden mannitol dökülerek tekrar vakum pompasıyla sıvısından ayrıldı. Anterlerinden ayrılan mikrosporları içeren süzüntü santrifüj tüplerine alınarak 3500 rpm de 5 dakika santrifüj edildi (Şekil 3.12.). Dibe çöken tortu tekrar por açıklığı 41 µm olan filtre kağıdı içeren steril filtre sistemi ile süzüldü. Böylece mikrosporlar anter çeper dokusundan tamamen uzaklaştırılmış oldu. Toplanan mikrosporlar 0.4 M mannitolde 2-3 kez yıkandıktan sonra tekrar 3500 rpm de 5 dakika santrifüj edildi. Santrifüj işlemi 2 kere tekrarladı böylece mikrosporlar sıvının dibinde toplanmış oldu (Şekil 3.13.). Sıvıdan alınan örneklerle mikrospor canlılığına mikroskop altında bakıldı (Şekil 3.14.). Mikrospor canlılığı % ın altında olduğu durumlarda mikrosporlar % 20 maltoz çözeltisine alınarak santrifüj edildi. Ölü mikrosporlar dibe çöktü. Canlı mikrosporlar ise yüzeye çıkarak pipet yardımıyla toplandı. Toplanan mikrosporlar 0.4 M mannitol ile 3500 rpm de 5 dakika santrifüj edildi. Mikrospor yoğunluğunu tespit etmek amacıyla mikrosporların hemositometre (thoma) lamı (Neubauer) altında sayımları yapıldı. Şekil Filtre sistemi ve vakum pompası 46
59 Şekil Filtre kağıdı üzerindeki anterlerin cam çubuk ile ezilmesi Şekil İzole edilen mikrosporların santrifüj edilmesi Şekil Santrifüj edilen mikrosporların dibe çökmesiyle oluşan tortu 47
60 a b c Şekil a. ve b. İzole edilen mikrosporların mikroskop altındaki görünüşleri, c. İzole edilmiş mikrospor tanesinin x100 objektifte ölçümü (22µm) Kültür ortamının hazırlanması ve mikrosporların aktarımı Ayrıştırılan mikrosporlar steril pipetler yardımıyla embriyo gelişimi için indüksiyon ortamına aktarıldı. Buğday mikrosporlarının embriyo gelişimi için MS ortamından modifiye edilmiş MMS4 indüksiyon ortamı kullanıldı (Çizelge 3.2.). Bu ortam MS kültür ortamına göre, daha az inorganik nitrojen (NH 4 NO 3 ), daha fazla organik nitrojen (glutamin) ve inositol, sükroz yerine maltoz, indolasetik asit (IAA) yerine fenilasetik asit (PAA), agaroz yerine fitajel ve ek olarak arabinogalakatan-proteinleri (AGP) içermektedir. Kimyasal maddeler hassas terazide tartılarak, makrotuzların (x10), mikrotuzların (x100), demir kaynağının (x100) ve vitaminlerin (x100) 10 ar ve 100 er katları şeklinde önce stok çözeltileri hazırlandı. Diğer bileşenler (glutamin, myo-inositol, maltoz, AGP, prolin, kazein ve fitajel) ise ortama doğrudan ilave edildi. Hormonlar kültür ortamına ilave edilmeden önce 1mg/ml şeklinde stok çözeltileri hazırlandı. Hormonlar suda çözünmediğinden, stok çözeltileri hazırlanmadan önce oksinlerin etanol veya NaOH, sitokininlerin ise HCl içerisinde çözünmesi gerekmektedir. Oksin olarak kullanılan PAA 1ml etanolde, sitokininlerden kinetin ise 1ml 1 N HCl de çözündü. PAA doğal bir hormon olduğu için otoklavlama sırasında yapısı bozulabilmektedir. Bu yüzden kültür ortamından ayrı olarak 0.22 µm por büyüklüğündeki selüloz nitrat filtresi bulunan steril filtre sisteminden geçirilerek kültür ortamı soğuduktan sonra üzerine eklendi. Kültür ortamı hazırlandıktan sonra ph 5.8 e ayarlandı ve 121 C 1 atm basıçta 20 dakika otoklav ile sterilize edildi. 48
61 Çizelge 3.2. Buğday mikrospor kültüründe mikrospor indüksiyonu (MMS4) ve embriyo farklılaşması (MMS5) için kullanılan modifiye MS kültür ortamları ve orijinal MS kültür ortamı Bileşikler Makrotuzlar Orijinal MS Ortamı (mg/l) MMS4 Indüksiyon Ortamı (mg/l) Modifiye MS Ortamı MMS5 Farklılaşma Ortamı (mg/l) KNO NH 4 NO KH 2 PO MgSO 4.7H 2 O CaCl 2.2H 2 O Mikrotuzlar MnSO 4.5H 2 O H 3 BO ZnSO 4.7H 2 O CoCl 2.6H 2 O CuSO 4.5H 2 O Na 2 MoO 4.2H 2 O KI Demir Kaynakları FeSO 4.7H 2 O Na 2 EDTA Vitaminler Tiamin HCl Nikotinik asit Pridoksin HCl Diğer Bileşikler Glutamin Myo-Inositol Sakkaroz Maltoz PAA IAA 1 * - - Kinetin 1 * Larcol TM Agar Fitajel GA Kazein Prolin ph *MS ortamında regenerasyon için bu hormonlar çıkarılmıştır ve agar yerine 3.0 g/l fitajel kullanılmıştır. 49
62 Hazırlanan ortam, laminar (steril) kabinet içerisinde 9 cm lik petrilere 1/3 oranında dağıtıldı. Anterlerden izole edilen mikrosporlar ( mikrospor/ml) 1 ml lik pipetler yardımıyla damlalar halinde kültür ortamına ilave edildi. Embriyo gelişimini önemli oranda artırdığı için petrilere 20 tane ovaryum eklendi (Şekil 3.15.). Petri kapları parafilm ile 2 kez sarılarak kapatıldı ve karanlık koşullarda 28 ± 1 C ye ayarlanmış inkübatöre alındı. Embriyoid gelişimi günlük olarak stereo mikroskop altında kontrol edildi. Embriyo oluşumunu artırmak için hazırlanan kültür ortamı hem yarı katı hem de ficoll-400 kullanılarak sıvı olarak hazırlandı. Sıvı ortam 3 cm lik petrilere 3 ml olarak dağıtıldı. İzole edilen mikrosporlardan steril pipetler yardımıyla 1.5 ml çekilerek sıvı ortam üzerine eklendi. Ortama 4-6 tane ovaryum eklenerek petriler parafilm ile 2 kez sarılarak alüminyum folyo ile kapatıldı ve 28 ± 1 C ye ayarlanmış inkübatöre alındı. a b c d Şekil Mikrosporların ovaryumlar ile birlikte MMS4 indüksiyon ortamına alınışı a. Ç-1252, b. Kızıltan-91, c. Kunduru-1149, d. Mirzabey
63 Mikrosporlardan embriyoid oluşumu ve farklılaşma ortamının hazırlanması Mikrosporların 28 ± 1 C de inkübasyonundan gün sonra, embriyoidler oluşmaya başladı (Şekil 3.16.). Yarı katı kültür ortamındaki mikrosporlardan gün sonra olgun embriyoidler elde edilirken (Şekil 3.17.), sıvı ortamdaki embriyoid gelişimi daha yavaş olup olgun embriyoidler ancak gün sonra alındı. Şekil Kızıltan-91 çeşidinde. 0.4 M mannitol ile (solda), 0.4 M sorbitol uygulamasında (sağda) embriyoid oluşumu a) Soğuk önişlem (+4ºC) (1) b) 0.4 M mannitol (+4ºC) (2) c) 0.4 M sorbitol (+4ºC) (3) d) 0.4 M mannitol (oda sıcaklığı) (4) Şekil Farklı önişlem uygulamaları sonucu Kızıltan-91 çeşidine ait kültür ortamında oluşan olgun embriyoidler 51
64 a b Şekil Mikrosporlardan oluşan embriyoidler a. 20. gün sonunda mikroskop altında (x4) görülen globular embriyoid (bar: 0.5 mm), b. 30. gün sonunda oluşan olgun embriyoid (bar: 2 mm) Embriyoidler 1-2 mm lik büyüklüğe ulaştıklarında (Şekil 3.18.) MS ortamından modifiye edilmiş MMS5 farklılaşma ortamına alındı (Şekil 3.19.). MMS5 farklılaşma ortamı MMS4 indüksiyon ortamına çok benzemektedir. MMS4 indüksiyon ortamına göre, daha az maltoz (90 g/l yerine 30 g/l), 2 mg/l PAA yerine 0.2 mg/l PAA, 0.5 mg/l kinetin ve 0.5 mg/l GA 3 içermektedir. Ayrıca mg/l CuSO 4 yerine miktarı artırılarak 2.5 mg/l CuSO 4 eklendi (Çizelge 3.2.). MMS5 farklılaşma ortamına alınan embriyoidler 25 C de karanlıkta 1-2 hafta bekletildi. Şekil Çeşitlere ait olgun embriyoidlerin MMS5 farklılaşma ortamına aktarımı 52
65 Regenerasyon ortamının hazırlanması Sürgün ve kök gelişimi için embriyolar hormon bulunmayan MS kültür ortamına aktarıldı. Bitki regenerasyonu elde etmek amacıyla MS ortamında 30 g/l sükroz ve 8 g/l agar kullanıldı. Embriyolar 16 saat ışık / 8 saat karanlık fotoperiyodunda ve 25 C sıcaklıkta inkübatöre alınarak, bitki regenerasyonu (Şekil 3.20.) gözleninceye kadar bekletildi. a b Şekil Triticum durum Desf. cv. Kunduru-1149 çeşidine ait a. albino, b. yeşil bitki regenerasyonu 53
66 Verilerin değerlendirilmesi Anterlerden izole edilen mikrosporların yoğunluğu hemositometre (thoma) lamı ile sayıldı. Bölünen mikrosporların (%) frekansı, 10. günde indüksiyon ortamında bölünen mikrosporlar ile bölünmeyen mikrosporların hemositometre lamında sayılması ile hesaplandı. Bütün denemelerdeki embriyoid sayısı indüksiyon ortamının 30. günün sonunda sayılması ile elde edildi. Embriyoidler iki özelliğe göre sayıldı: 2 mm den küçük (<2 mm, mm) ve 2 mm den büyük (>2 mm) embriyoidler. Sadece 2mm den büyük olan embriyoidler farklılaşma ortamına (MMS5) alındı. Yeşil ve albino bitkilerin sayısı ve regenerasyon oranı, 2 mm den büyük embriyoidlerin sayısına göre hesaplandı. Deneme tesadüf parselleri deneme desenine göre 3 tekrarlamalı olarak kuruldu. Genotiplere ait (Triticum durum Desf. cvs. Kızıltan-91, Ç-1252, Mirzabey 2000 ve Kunduru-1149 ve Triticum aestivum L. cv. Gün-91 ) bölünen mikrospor sayısı (%), embriyoid benzeri yapılar, embriyoid sayısı (0.5 2 mm ve >2 mm), yeşil, albino ve toplam regenerant bitki sayımları her bir önişlem uygulaması için ayrı ayrı yapıldı. Elde edilen sonuçların istatistiksel analizleri varyans analizi (ANOVA) ve Duncan çoklu karşılaştırma testine göre değerlendirildi. Ayrıca veriler birbirleriyle korelasyon (r) katsayıları hesap edilerek karşılaştırıldı. 54
67 4. ARAŞTIRMA BULGULARI Makarnalık ve ekmeklik buğday genotiplerinde mikrospor kültür tekniği ile iki farklı deneme yapılmıştır. Birinci deneme basamağında, genotiplere ovaryumsuz ve ovaryum eklenmiş olarak beş farklı önişlem [1. soğuk önişlem (+4ºC), M mannitol (+4ºC) a. ovaryumsuz, b. ovaryum eklenmiş, M sorbitol (+4ºC), M mannitol (oda sıcaklığı)] uygulanmıştır. İkinci deneme basamağında ise, en başarılı sonucu veren 0.4 M mannitol (+4ºC) önişlem uygulaması ile deneme tüm genotipler için tekrarlanarak yeşil bitki regenerasyon kapasitesi artırılmaya çalışılmıştır Farklı Önişlem Uygulamalarının Mikrospor Kültüründe Genotiplere Etkisi Mikrospor kültür tekniğine cevabının yüksek olduğu bilinen (Zheng, 2003; Cistue and Kasha, 2005; Ferrie and Caswell, 2010) ekmeklik buğday genotipi Gün-91 kontrol grubu olarak kullanılmıştır. Ekmeklik ve diğer tüm makarnalık buğday genotiplerinde yapılan uygulamalardan alınan sonuçların ortalamaları varyans analizi ile değerlendirilmiştir. Bölünen mikrospor sayısı, embriyoid benzeri yapılar, embriyoid oluşumu (2 mm den küçük ve büyük), yeşil, albino ve toplam bitki regenerasyonuna ait genotip, önişlem ve genotipxönişlem ilişkisi ile ilgili değerlerin varyansı Çizelge 4.1 de ayrıntılı olarak gösterilmiştir. Denemenin birinci basamağında, Triticum durum Desf. cvs. Kızıltan-91, Ç-1252, Mirzabey 2000 ve Kunduru-1149 ve Triticum aestivum L. cv. Gün-91 çeşitlerine ait başaklardan toplam 5472 anter alınmış ve farklı önişlem uygulamaları sonucunda toplam olarak bölünen mikrospor sayısı % 29.35, embriyoid benzeri yapılar % 24.80, 2 mm den küçük embriyoidlerin sayısı % 17.98, 2 mm den büyük embriyoidlerin sayısı % 11.20, yeşil bitki regenerasyonu % 1.96, albino bitki regenerasyonu % ve toplam bitki regenerasyonu % olarak elde edilmiştir (Çizelge 4.2.). 55
68 Çizelge 4.1. Buğday genotiplerinde incelenen karakterlere ait varyans analizi sonuçları Varyasyon Bölünen Mikrospor Embriyoid Benzeri Yapılar s.d. Kaynakları K.T. K.O. F K.T. K.O. F Tekerrür öd öd Konular ** ** Genotip ** ** Önişlem ** ** G X Ö ** ** Hata Genel ** P<0.01 düzeyinde önemli, öd önemli değil 56
69 Çizelge 4.1. (devam) Embriyoid Oluşumu Varyasyon s.d. 2 mm den küçük 2 mm den büyük Kaynakları K.T. K.O. F K.T. K.O. F Tekerrür öd öd Konular ** ** Genotip ** ** Önişlem ** ** G X Ö ** ** Hata Genel ** P<0.01 düzeyinde önemli, öd önemli değil 57
70 Çizelge 4.1. (devam) Bitki Regenerasyonu Varyasyon s.d. Yeşil Albino Toplam Kaynakları K.T. K.O. F K.T. K.O. F K.T. K.O. F Tekerrür öd öd öd Konular ** ** ** Genotip ** ** ** Önişlem ** ** ** G X Ö ** ** ** Hata Genel ** P<0.01 düzeyinde önemli, öd önemli değil 58
71 Çizelge 4.2. Genotiplere ait farklı önişlem uygulamalarının mikrospor kültüründeki etkisi Genotip Alınan Anter Bölünen Mikrospor Embriyoid Benzeri Embriyoid Oluşumu Bitki Regenerasyonu (adet) (%) Yapılar (%) <2 mm (%) >2 mm (%) Yeşil (%) Albino (%) Toplam (%) Kızıltan c b b ab 2.21 ab 8.82 bc b Ç b b b b 1.63 ab 8.94 bc bc Mirzabey c bc b b 0.00 b 8.00 c 8.00 c 2000 Kunduru d c b 9.15 b 2.20 ab b b 1149 Gün a a a a 3.62 a a a Ortalama * Her bir karakter sütununda ayrı harfle gösterilen değerler arasındaki fark P<0.01 düzeyinde önemlidir. 59
72 Orta-geç tek çekirdekli safhada oldukları belirlenen mikrosporların bulunduğu başaklar farklı önişlem uygulamalarına alınmış, 7 gün sonra 0.4 M mannitol (+4ºC) önişlem uygulaması sonucunda izole edilen mikrosporlarda çekirdek merkeze doğru kayarak etrafını vakuoller kaplamıştır. Vakuollerin etrafı sitoplazmik uzantılarla çevrelenmiştir. Mikrosporlar yıldız şekli nde görülmüş ve bu yapılar indüksiyon ortamında tekrarlanan simetrik bölünmeler sonucunda embriyoidleri meydana getirmiştir (Şekil 4.1.a, b). a b Şekil 4.1. Mikrosporların 7 gün 0.4 M mannitol önişlem uygulaması sonrasındaki fibriler sitoplazmaya sahip iki farklı embriyogenik görünümü (yıldız-şekli) Önişlem uygulamalarından sonra anterlerden izole edilen mikrosporlar MMS4 indüksiyon ortamına alınmıştır. Mikrosporlar 10 gün sonra bölünme yeteneği göstermiş (Şekil 4.2.a, b) ve bölünme yeteneği gösteren ile göstermeyen mikrosporlar hemositometre lamı ile sayılmıştır. Ekmeklik buğday genotipi olarak kullanılan Gün-91 çeşidinde tüm önişlem uygulamalarında toplam bölünen mikrospor sayısı % ile en yüksek değeri verirken, en düşük mikrospor bölünme yüzdesi % ile Kunduru-1149 çeşidinde görülmüştür (P<0.01) (Çizelge 4.2.). Makarnalık buğday genotipleri arasında ise en yüksek mikrospor bölünme yüzdesi % ile Ç-1252 çeşidinde görülmüştür. Bunu sırasıyla % ve % değerleriyle Kızıltan-91 ve Mirzabey 2000 çeşitleri takip etmiştir (Çizelge 4.2.). 60
73 a b Şekil 4.2. İndüksiyon ortamında 10 gün sonra bölünme yeteneği gösteren mikrosporların iki farklı görünümü İndüksiyon ortamında (MMS4) 20 gün sonra embriyo benzeri yapılar ve embriyoidler gözlemlenmeye başlanmıştır (Şekil 4.3.). Ekmeklik buğday genotipi Gün-91 % ile en yüksek embriyoid benzeri yapıları oluştururken, Kunduru çeşidi % ile en düşük oranı vermiştir (P<0.01) (Çizelge 4.2.). Makarnalık buğday genotipleri arasında en yüksek embriyoid benzeri yapıları % ile Ç-1252 çeşidinde görülmüştür ve bunu Kızıltan-91 ve Mirzabey 2000 çeşitleri sırasıyla % ve % değerleriyle takip etmiştir (Çizelge 4.2.). Embriyoid Mikrosporlar Şekil 4.3. İndüksiyon ortamında 20 gün sonra mikrosporlar arasında görülen embriyogenik yapı 61
74 MMS4 indüksiyon ortamında 30 gün sonra 2 mm den küçük (<2 mm, mm) ve 2 mm den büyük (>2 mm) embriyoidler gözlenerek sayımları ayrı ayrı yapılmıştır (Şekil 4.4.). Ekmeklik buğday genotipi Gün-91 2 mm den küçük embriyoid sayısında % ile en yüksek değeri oluştururken, Kunduru-1149 çeşidi % ile en düşük oranı vermiştir (P<0.01) (Çizelge 4.2.). Makarnalık buğday genotipleri arasında 2 mm den küçük embriyoid sayısı olarak en yüksek değeri % ile Kızıltan-91 çeşidi vermiştir (Çizelge 4.2.). Ç-1252 ve Mirzabey 2000 çeşitlerinin değerleri ise birbirine çok yakın olup sırasıyla % ve % olmuştur (Çizelge 4.2.). Şekil 4.4. İndüksiyon ortamında 30 gün sonra oluşan büyük (2 mm-solda) ve küçük (<2 mm-sağda) embriyoidler (bar: 2 mm) Sadece 2 mm den büyük embriyoidler MS regenerasyon ortamına aktarılmış ve bunlarda bitki regenerasyonuna geçiş kabiliyeti görülmüştür (Şekil 4.5.). Bütün genotipler arasında 2 mm den büyük embriyoid sayısı olarak en yüksek değeri % ile ekmeklik buğday genotipi Gün-91 verirken, Kunduru-1149 çeşidi % 9.15 ile en düşük oranı vermiştir (P<0.01) (Çizelge 4.2.). Makarnalık buğday genotipleri arasında 2 mm den büyük embriyoid sayısı olarak en yüksek değeri % ile Kızıltan-91 çeşidi vermiştir (Çizelge 4.2.). Ç-1252 ve Mirzabey 2000 çeşitlerinin değerleri ise yine birbirine çok yakın olup sırasıyla % ve % olmuştur (Çizelge 4.2.). 62
75 a. T. durum Desf. cv. Kızıltan-91 b. T. durum Desf. cv. Ç-1252 c. T. durum Desf. cv. Mirzabey 2000 d. T. durum Desf. cv. Kunduru-1149 e. T. aestivum L. cv. Gün-91 Şekil 4.5. Genotiplere ait 30 gün sonra oluşan olgun embriyoidler (bar: 2 mm) Regenerasyon ortamına 30 gün sonra aktarılan embriyoidlerden (>2 mm) yeşil ve albino bitkiler alınmıştır (Şekil 4.6.). Yeşil bitki regenerasyonunda tüm genotipler arasında ekmeklik buğday genotipi Gün-91 % 3.62 ile en yüksek değeri verirken, 63
76 Mirzabey 2000 çeşidi ile hiç yeşil bitki regenerasyonu elde edilememiştir (P<0.01) (Çizelge 4.2.). Makarnalık buğday genotipleri arasında en yüksek yeşil bitki regenerasyonu % 2.21 ve % 2.20 olarak sırasıyla Kızıltan-91 ve Kunduru-1149 çeşitlerinde görülmüştür (Çizelge 4.2.). Ç-1252 çeşidi ise % 1.63 oranında yeşil bitki regenerasyonu üretmiştir (Çizelge 4.2.). a b Şekil 4.6. Triticum durum Desf. cv. Kızıltan-91 çeşidine ait a. albino ve b. yeşil bitki regenerasyonu 64
77 Albino bitki regenerasyonunda tüm genotipler arasında ekmeklik buğday genotipi Gün-91 % ile en yüksek değeri verirken, Mirzabey 2000 çeşidi % 8.00 ile en düşük değeri vermiştir (P<0.01) (Çizelge 4.2.). Makarnalık buğday genotipleri arasında ise en yüksek albino bitki regenerasyonu % ile Kunduru-1149 çeşidinde görülmüştür (Çizelge 4.2.). Kızıltan-91 ve Ç-1252 çeşitlerinin değerleri birbirine çok yakın olup sırasıyla % 8.82 ve % 8.94 olmuştur (Çizelge 4.2.). Toplam bitki regenerasyonu olarak bütün genotipler arasında en yüksek bitki regenerasyonunu % ile ekmeklik buğday genotipi Gün-91 oluştururken, en düşük bitki regenerasyonunu % 8.00 ile Mirzabey 2000 çeşidi meydana getirmiştir (P<0.01) (Çizelge 4.2.). Makarnalık buğday genotipleri arasında ise en yüksek oran % ile Kunduru-1159 çeşidinde görülmüştür ve bunları % ve % ile sırasıyla Kızıltan-91 ve Ç-1252 çeşitleri takip etmiştir (Çizelge 4.2.) Farklı önişlem uygulamalarının Triticum durum Desf. cv. Kızıltan-91 çeşidine etkisi Mikrospor kültür tekniğinde beş farklı önişlem uygulaması [1. soğuk önişlem (+4ºC), M mannitol (+4ºC) a. ovaryumsuz, b. ovaryum eklenmiş, M sorbitol (+4ºC), M mannitol (oda sıcaklığı)] için Triticum durum Desf. cv. Kızıltan- 91 çeşidinden toplam 1167 anter alınmış ve bölünen mikrospor sayısı ortalama % olmuştur (Çizelge 4.3.). Bölünen mikrosporlardan alınan embriyoid benzeri yapılar % 24.51, 2 mm den küçük embriyoidler % 17.05, 2 mm den büyük embriyoidler % 11.65, yeşil bitki regenerasyonu % 2.21, albino bitki regenerasyonu % 8.82 ve toplam bitki regenerasyonu % olarak elde edilmiştir (Çizelge 4.4.). Önişlem uygulamalarından sonra indüksiyon ortamına mikrosporlarla birlikte ortalama 20 tane ovaryum da eklenmiştir (Şekil 3.15.). Ovaryumların indüksiyon ortamında mikrosporlara olan etkisine bakmak amacıyla, 0.4 M mannitol (+4ºC) uygulamasında karakterler, 20 tane ovaryum eklenmeden (2a) ve eklenerek (2b), iki şekilde değerlendirilmiştir (Çizelge 4.3.; 4.4.). 65
78 Çizelge 4.3. Triticum durum Desf. cv. Kızıltan-91 çeşidine ait farklı önişlem uygulamaları ile mikrospor kültürü sonucu elde edilen bulgular Genotip Önişlem Uygulaması Alınan Anter Ovaryum Sayısı / Bölünen Mikrospor Embriyoid Benzeri Embriyoid Oluşumu (adet) Bitki Regenerasyonu (adet) No* (adet) Petri Başına (%) Yapılar (adet) <2 mm (0.5-2 mm) >2 mm Yeşil Albino Toplam (1) c (2) (a) e (b) a Kızıltan-91 (3) b (4) d Ortalama Toplam *Önişlem Uygulamaları: 1. soğuk önişlem (+4ºC), M mannitol (+4ºC) a. ovaryumsuz, b. ovaryum eklenmiş, M sorbitol (+4ºC), M mannitol (oda sıcaklığı). ** Her bir karakter sütununda ayrı harfle gösterilen değerler arasındaki fark P<0.01 düzeyinde önemlidir. 66
79 Çizelge 4.4. Farklı önişlem uygulamalarının Triticum durum Desf. cv. Kızıltan-91 çeşidine ait embriyo benzeri yapılar, embriyoid ve bitki regenerasyonu üzerine etkisi Genotip Önişlem Embriyoid Embriyoid Oluşumu Bitki Regenerasyonu Uygulaması Benzeri No Yapılar (%) <2 mm (%) >2 mm (%) Yeşil (%) Albino (%) Toplam (%) Kızıltan -91 (1) a c c 0.00 b 9.52 a 9.52 b (2) (a) 5.10 d 4.31 e 0.00 d 0.00 b 0.00 b 0.00 c (b) b a a 5.77 a 9.61 a a (3) b b b 0.00 b 7.89 a 7.89 b (4) c d c 0.00 b 8.00 a 8.00 b Ortalama * Her bir karakter sütununda ayrı harfle gösterilen değerler arasındaki fark P<0.01 düzeyinde önemlidir. Farklı önişlem uygulamaları arasından en yüksek bölünen mikrospor sayısı % ile 0.4 M mannitol (+4ºC) uygulamasında görülürken, en düşük oran % 6.25 ile ovaryum eklenmeyen 0.4 M mannitol (+4ºC) uygulamasında görülmüştür (P<0.01) ve bu oran Şekil 4.7. de diğer karakterlerle ve önişlem uygulamaları ile karşılaştırmalı olarak verilmiştir. Beş farklı önişlem uygulaması arasından ise en düşük bölünen mikrospor sayısı % ile 0.4 M mannitol (oda sıcaklığı) uygulamasıyla elde edilirken, soğuk önişlem (+4ºC) ile % ve 0.4 M sorbitol (+4ºC) ile % değerleri alınmıştır (Çizelge 4.3.). Embriyoid benzeri yapılarda en yüksek oran % ile soğuk önişlem (+4ºC) uygulamasında elde edilmiştir (Çizelge 4.4.). Bunu % 32.54, % ve % değerleri ile sırasıyla 0.4 M mannitol (+4ºC), 0.4 M sorbitol (+4ºC) ve 0.4 M mannitol (oda sıcaklığı) uygulamaları takip etmiştir (Çizelge 4.4.). En düşük oran ise % 5.10 ile ovaryum eklenmeyen 0.4 M mannitol (+4ºC) uygulamasında görülmüştür (Çizelge 4.4.). Bu uygulamalardan alınan değerler arasındaki fark istatistiksel olarak önemli bulunmuştur (P<0.01). Bölünen mikrosporlardan elde edilen 2 mm den büyük ve küçük embriyoidlerin, ovaryum eklenmeden ve eklenerek alınan yüzdeleri Şekil 4.7. de karşılaştırmalı olarak verilmiştir. Ovaryum eklenmeyen önişlem uygulamasındaki tüm karekterlere ait değerlerde önemli bir düşüş görülmüştür. 67
80 Denemeler sonucunda, 2 mm den küçük embriyoid sayısı olarak en yüksek oran % ile 0.4 M mannitol (+4ºC) uygulamasında görülürken, bunu sırasıyla % ile 0.4 M sorbitol (+4ºC), % ile soğuk önişlem (+4ºC) ve % ile 0.4 M mannitol (oda sıcaklığı) uygulamaları takip etmiştir (Çizelge 4.4.). En düşük oran ise % 4.31 ile ovaryum eklenmeyen 0.4 M mannitol (+4ºC) uygulamasında görülmüştür (Çizelge 4.4.). Bu uygulamalardan alınan değerler arasındaki fark istatistiksel olarak önemli bulunmuştur (P<0.01). Şekil 4.7. Farklı önişlem uygulamalarının Kızıltan-91 çeşidinde mikrospor kültüründe karakterlere etkisi Denemelerde, 2 mm den büyük embriyoid sayısına bakıldığında yine en yüksek oran % ile 0.4 M mannitol (+4ºC) uygulamasında görülmüştür ve bunu % ile 0.4 M sorbitol (+4ºC) uygulaması takip ederken, soğuk önişlem (+4ºC) ve 0.4 M mannitol (oda sıcaklığı) uygulamalarının değerleri birbirine çok yakın olup sırasıyla % ve % olmuştur (P<0.01) (Çizelge 4.4.). Ovaryum eklenmeyen 0.4 M mannitol (+4ºC) uygulamasında embriyoid (>2 mm) oluşumu gözlenmemiştir. Yeşil ve albino bitki regenerasyonu bakımından sırasıyla % 5.77 ve % 9.61 ile en yüksek değerler 0.4 M mannitol (+4ºC) uygulamasında görülmüştür (Çizelge 4.4.). 68
81 Diğer uygulamalarda yeşil bitki regenerasyonu görülmezken, albino bitki regenerasyonu % 9.52 ile soğuk önişlem (+4ºC), % 8.00 ile 0.4 M mannitol (oda sıcaklığı) ve % 7.89 ile 0.4 M sorbitol (+4ºC) uygulamalarıyla elde edilmiştir (Çizelge 4.4.) Farklı önişlem uygulamalarının Triticum durum Desf. cv. Ç-1252 çeşidine etkisi Önişlem uygulamaları için Triticum durum Desf. cv. Ç-1252 çeşidinden toplam 1124 anter alınmış ve bölünen mikrospor sayısı % olmuştur (Çizelge 4.5.). Embriyoid benzeri yapılar % 25.80, 2 mm den küçük embriyoidlerin sayısı % 16.19, 2 mm den büyük embriyoidlerin sayısı % 10.94, yeşil bitki regenerasyonu % 1.63, albino bitki regenerasyonu % 8.94 ve toplam bitki regenerasyonu % olarak elde edilmiştir (Çizelge 4.6.). Farklı önişlem uygulamaları arasından en yüksek bölünen mikrospor sayısı % ile 0.4 M mannitol (+4ºC) uygulamasında görülürken, en düşük oran % 5.88 ile ovaryum eklenmeyen 0.4 M mannitol (+4ºC) uygulamasında görülmüştür (P<0.01) (Çizelge 4.5.). Önişlem uygulamaları arasından ise bölünen mikrosporlarda en düşük oran % ile 0.4 M mannitol (oda sıcaklığı) uygulamasıyla elde edilmiştir (Çizelge 4.5.). Soğuk önişlem (+4ºC) ile % ve 0.4 M sorbitol (+4ºC) ile % değerleri elde edilmiştir (Çizelge 4.5.). Önişlem uygulamaları arasında bölünen mikrosporlarda elde edilen değerler arasındaki karşılaştırmalar Şekil 4.8. de verilmiştir. Embriyoid benzeri yapılarda en yüksek değer % ile 0.4 M sorbitol (+4ºC) uygulamasında ve farklı uygulamalardan alınan sonuçlar arasında en düşük değer ise % 4.41 ile ovaryum eklenmeyen 0.4 M mannitol (+4ºC) uygulamasında görülmüştür (Çizelge 4.6.). Bu uygulamalardan alınan değerler arasındaki fark istatistiksel olarak önemli bulunmuştur (P<0.01). Soğuk önişlem (+4ºC) ve 0.4 M mannitol (oda sıcaklığı) uygulamalarının değerleri ise birbirine çok yakın olup sırasıyla % ve % olmuştur (Çizelge 4.6.). 0.4 M mannitol (+4ºC) uygulamasında ise %
82 Çizelge 4.5. Triticum durum Desf. cv. Ç-1252 çeşidine ait farklı önişlem uygulamaları ile mikrospor kültürü sonucu elde edilen bulgular Genotip Ç-1252 Önişlem Uygulaması Alınan Anter Ovaryum Sayısı / Bölünen Mikrospor Embriyoid Benzeri Embriyoid Oluşumu (adet) Bitki Regenerasyonu (adet) No (adet) Petri Başına (%) Yapılar (adet) <2 mm (0.5-2 mm) >2 mm Yeşil Albino Toplam (1) b (2) (a) d (b) a (3) b (4) c Ortalama Toplam * Her bir karakter sütununda ayrı harfle gösterilen değerler arasındaki fark P<0.01 düzeyinde önemlidir. 70
83 Çizelge 4.6. Farklı önişlem uygulamalarının Triticum durum Desf. cv. Ç-1252 çeşidine ait embriyo benzeri yapılar, embriyoid ve bitki regenerasyonu üzerine etkisi Genotip Önişlem Embriyoid Embriyoid Bitki Regenerasyonu Uygulaması Benzeri Oluşumu No Yapılar (%) <2 mm (%) >2 mm (%) Yeşil (%) Albino (%) Toplam (%) (1) b c bc 0.00 b 3.70 c 3.70 d (2) (a) 4.41 d 2.57 d 0.00 d 0.00 b 0.00 d 0.00 e Ç-1252 (b) c a a 4.16 a ab a (3) a a b 0.00 b a b (4) b b c 0.00 b 9.09 b 9.09 c Ortalama * Her bir karakter sütununda ayrı harfle gösterilen değerler arasındaki fark P<0.01 düzeyinde önemlidir. oranında embriyoid benzeri yapılar elde edilmiştir (Çizelge 4.6.). Önişlem uygulamaları arasında embriyoid benzeri yapılardan elde edilen değerler arasındaki karşılaştırmalar Şekil 4.8. de verilmiştir. Denemeler sonucunda, 2 mm den küçük embriyoid sayısı olarak en yüksek değer % ile 0.4 M mannitol (+4ºC) uygulamasında görülürken, bunu sırasıyla % ile 0.4 M sorbitol (+4ºC), % ile 0.4 M mannitol (oda sıcaklığı) ve % ile soğuk önişlem (+4ºC) uygulamaları takip etmiştir (Çizelge 4.6.). En düşük oran ise % 2.57 ile ovaryum eklenmeyen 0.4 M mannitol (+4ºC) uygulamasında görülmüştür (Çizelge 4.6.). Bu uygulamalardan alınan değerler arasındaki fark istatistiksel olarak önemli bulunmuştur (P<0.01). Denemelerde, 2 mm den büyük embriyoid sayısına bakıldığında yine en yüksek oran % ile 0.4 M mannitol (+4ºC) uygulamasında görülmüştür (Çizelge 4.6.). Bunu % ile 0.4 M sorbitol (+4ºC) uygulaması takip ederken, soğuk önişlem (+4ºC) % ve 0.4 M mannitol (oda sıcaklığı) % oranında embriyoid oluşturmuştur (Çizelge 4.6.). Ovaryum eklenmeyen 0.4 M mannitol (+4ºC) uygulamasında embriyoid (>2 mm) oluşumu gözlenmemiştir. Önişlem uygulamaları 71
84 arasında embriyoid oluşumuyla elde edilen değerler arasındaki karşılaştırmalar Şekil 4.8. de verilmiştir. Şekil 4.8. Farklı önişlem uygulamalarının Ç-1252 çeşidinde mikrospor kültüründe karakterlere etkisi Tüm uygulamalar arasında sadece 0.4 M mannitol (+4ºC) uygulaması ile % 4.16 oranında yeşil bitki regenerasyonu elde edilmiştir. Albino bitki regenerasyonu bakımından % ile en yüksek değeri 0.4 M sorbitol (+4ºC) uygulaması verirken, en düşük oran % 3.70 ile soğuk önişlem (+4ºC) uygulamasında görülmüştür (P<0.01) (Çizelge 4.6.). 0.4 M mannitol (+4ºC) ve 0.4 M mannitol (oda sıcaklığı) uygulamaları sırasıyla % ve % 9.09 oranında albino bitki regenerasyonu meydana getirmiştir (Çizelge 4.6.) Farklı önişlem uygulamalarının Triticum durum Desf. cv. Mirzabey 2000 çeşidine etkisi Önişlem uygulamaları için Triticum durum Desf. cv. Mirzabey 2000 çeşidinden toplam 1152 anter alınmış ve bölünen mikrospor sayısı % olmuştur (Çizelge 4.7.). Embriyoid benzeri yapılar % 23.18, 2 mm den küçük embriyoidlerin sayısı % 72
85 Çizelge 4.7. Triticum durum Desf. cv. Mirzabey 2000 çeşidine ait farklı önişlem uygulamaları ile mikrospor kültürü sonucu elde edilen bulgular Genotip Mirzabey 2000 Önişlem Uygulaması Alınan Anter Ovaryum Sayısı / Bölünen Mikrospor Embriyoid Benzeri Embriyoid Oluşumu (adet) Bitki Regenerasyonu (adet) No (adet) Petri Başına (%) Yapılar (adet) <2 mm (0.5-2 mm) >2 mm Yeşil Albino Toplam (1) b (2) (a) d (b) a (3) b (4) c Ortalama Toplam * Her bir karakter sütununda ayrı harfle gösterilen değerler arasındaki fark P<0.01 düzeyinde önemlidir. 73
86 Çizelge 4.8. Farklı önişlem uygulamalarının Triticum durum Desf. cv. Mirzabey 2000 çeşidine ait embriyo benzeri yapılar, embriyoid ve bitki regenerasyonu üzerine etkisi Genotip Önişlem Embriyoid Embriyoid Bitki Regenerasyonu Uygulaması Benzeri Oluşumu No Yapılar (%) <2 mm (%) >2 mm (%) Yeşil (%) Albino (%) Toplam (%) (1) a c c 0.00 a 4.00 b 4.00 b (2) (a) 6.43 c 3.21 d 0.00 d 0.00 a 0.00 c 0.00 c Mirzabey (b) b a a 0.00 a a a 2000 (3) a b ab 0.00 a 9.37 a 9.37 a (4) a ab b 0.00 a 5.00 b 5.00 b Ortalama * Her bir karakter sütununda ayrı harfle gösterilen değerler arasındaki fark P<0.01 düzeyinde önemlidir , 2 mm den büyük embriyoidlerin sayısı % ve albino bitki regenerasyonu % 8.00 olurken, yeşil bitki regenerasyonu elde edilememiştir (Çizelge 4.8.). Farklı önişlem uygulamaları arasından en yüksek bölünen mikrospor sayısı % ile 0.4 M mannitol (+4ºC) uygulamasında görülürken, en düşük oran % 6.60 ile ovaryum eklenmeyen 0.4 M mannitol (+4ºC) uygulamasında görülmüştür (P<0.01) (Çizelge 4.7.). Önişlem uygulamaları arasından ise en düşük oran % ile 0.4 M mannitol (oda sıcaklığı) uygulamasıyla elde edilmiştir (Çizelge 4.7.). Soğuk önişlem (+4ºC) ile % ve 0.4 M sorbitol (+4ºC) ile % değerleri elde edilmiştir (Çizelge 4.7.). Önişlem uygulamaları arasında bölünen mikrosporlarda elde edilen değerler arasındaki karşılaştırmalar Şekil 4.9. da verilmiştir. Embriyoid benzeri yapılarda en yüksek oran % ile soğuk önişlem (+4ºC) uygulamasında elde edilmiştir (Çizelge 4.8.). En düşük oran ise % 6.43 ile ovaryum eklenmeyen 0.4 M mannitol (+4ºC) uygulamasında görülmüştür (Çizelge 4.8.). Önişlem uygulamaları arasında ise en düşük oran % ile 0.4 M mannitol (+4ºC) uygulamasında görülmüştür ve bunu 0.4 M sorbitol (+4ºC) ve 0.4 M mannitol (oda 74
87 sıcaklığı) uygulamaları sırasıyla % ve % değerleriyle takip etmiştir (Çizelge 4.8.). Bu uygulamalardan alınan değerler arasındaki fark istatistiksel olarak önemli bulunmuştur (P<0.01). Önişlem uygulamaları arasında embriyoid benzeri yapılarda elde edilen değerler arasındaki karşılaştırmalar Şekil 4.9. da verilmiştir. Şekil 4.9. Farklı önişlem uygulamalarının Mirzabey 2000 çeşidinde mikrospor kültüründe karakterlere etkisi Denemeler sonucunda, 2 mm den küçük embriyoid sayısı olarak en yüksek oran % ile 0.4 M mannitol (+4ºC) uygulamasında görülürken, bunu sırasıyla % ile 0.4 M mannitol (oda sıcaklığı), % ile 0.4 M sorbitol (+4ºC) ve % ile soğuk önişlem (+4ºC) uygulamaları takip etmiştir (Çizelge 4.8.). En düşük oran ise % 3.21 ile ovaryum eklenmeyen 0.4 M mannitol (+4ºC) uygulamasında görülmüştür. Bu uygulamalardan alınan değerler arasındaki fark istatistiksel olarak önemli bulunmuştur (P<0.01). Denemelerde, 2 mm den büyük embriyoid sayısına bakıldığında yine en yüksek oran % ile 0.4 M mannitol (+4ºC) uygulamasında görülmüştür (Çizelge 4.8.). Bunu % ile 0.4 M sorbitol (+4ºC) uygulaması takip ederken, 0.4 M mannitol (oda sıcaklığı) % ve soğuk önişlem (+4ºC) % oranında embriyoid 75
88 oluşturmuştur (Çizelge 4.8.). Ovaryum eklenmeyen 0.4 M mannitol (+4ºC) uygulamasında embriyoid (>2 mm) oluşumu ve bitki regenerasyonu gözlenmemiştir. Önişlem uygulamaları arasında embriyoid oluşumuyla elde edilen değerler arasındaki karşılaştırmalar Şekil 4.9. da verilmiştir. Mirzabey 2000 çeşidinden yeşil bitki regenerasyonu elde edilememiştir. Albino bitki regenerasyonu bakımından % ile en yüksek değeri 0.4 M mannitol (+4ºC) uygulaması verirken, en düşük oran % 4.00 ile soğuk önişlem (+4ºC) uygulamasında görülmüştür (P<0.01) (Çizelge 4.8.). 0.4 M sorbitol (+4ºC) ve 0.4 M mannitol (oda sıcaklığı) uygulamaları sırasıyla % 9.37 ve % 5.00 oranında albino bitki regenerasyonu meydana getirmiştir (Çizelge 4.8.) Farklı önişlem uygulamalarının Triticum durum Desf. cv. Kunduru-1149 çeşidine etkisi Önişlem uygulamaları için Triticum durum Desf. cv. Kunduru-1149 çeşidinden toplam 994 anter alınmış ve bölünen mikrospor sayısı % olmuştur (Çizelge 4.9.). Embriyoid benzeri yapılar % 20.82, 2 mm den küçük embriyoidlerin sayısı % 15.79, 2 mm den büyük embriyoidlerin sayısı % 9.15, yeşil bitki regenerasyonu % 2.20, albino bitki regenerasyonu % ve toplam bitki regenerasyonu % olarak elde edilmiştir (Çizelge 4.10.). Farklı önişlem uygulamaları arasından en yüksek bölünen mikrospor sayısı % ile 0.4 M mannitol (+4ºC) uygulamasında görülürken, en düşük oran % 5.50 ile ovaryum eklenmeyen 0.4 M mannitol (+4ºC) uygulamasında görülmüştür (P<0.01) (Çizelge 4.9.). Önişlem uygulamaları arasından ise en düşük oran % ile 0.4 M mannitol (oda sıcaklığı) uygulamasıyla elde edilmiştir (Çizelge 4.9.). Soğuk önişlem (+4ºC) ile % ve 0.4 M sorbitol (+4ºC) ile % değerleri elde edilmiştir (Çizelge 4.9.). Önişlem uygulamaları arasında bölünen mikrosporlarda elde edilen değerler arasındaki karşılaştırmalar Şekil da verilmiştir. Ovaryum eklenmeyen önişlem uygulamasında bölünen mikrospor sayısı dahil tüm karakterlere ait değerlerde önemli bir düşüş görülmüştür. 76
89 Çizelge 4.9. Triticum durum Desf. cv. Kunduru-1149 çeşidine ait farklı önişlem uygulamaları ile mikrospor kültürü sonucu elde edilen bulgular Genotip Kunduru Önişlem Uygulaması Alınan Anter Ovaryum Sayısı / Bölünen Mikrospor Embriyoid Benzeri Embriyoid Oluşumu (adet) Bitki Regenerasyonu (adet) No (adet) Petri Başına (%) Yapılar (adet) <2 mm (0.5-2 mm) >2 mm Yeşil Albino Toplam (1) bc (2) (a) d (b) a (3) b (4) c Ortalama Toplam * Her bir karakter sütununda ayrı harfle gösterilen değerler arasındaki fark P<0.01 düzeyinde önemlidir. 77
90 Çizelge Farklı önişlem uygulamalarının Triticum durum Desf. cv. Kunduru çeşidine ait embriyo benzeri yapılar, embriyoid ve bitki regenerasyonu üzerine etkisi Genotip Önişlem Embriyoid Embriyoid Bitki Regenerasyonu Uygulaması Benzeri Oluşumu No Yapılar (%) <2 mm (%) >2 mm (%) Yeşil (%) Albino (%) Toplam (%) (1) a c b 0.00 b ab b (2) (a) 6.19 d 5.24 d 0.00 d 0.00 b 0.00 c 0.00 c Kunduru- (b) a a a 6.25 a a a 1149 (3) b b a 0.00 b ab b (4) c c 6.00 c 0.00 b 8.33 b 8.33 b Ortalama * Her bir karakter sütununda ayrı harfle gösterilen değerler arasındaki fark P<0.01 düzeyinde önemlidir. Embriyoid benzeri yapılarda en yüksek oran % ile soğuk önişlem (+4ºC) uygulamasında elde edilmiştir (Çizelge 4.10.). En düşük oran ise % 6.19 ile ovaryum eklenmeyen 0.4 M mannitol (+4ºC) uygulamasında görülmüştür (Çizelge 4.10.). Önişlem uygulamaları arasında ise en düşük oran % ile 0.4 M mannitol (oda sıcaklığı) uygulamasında görülmüştür ve bunu 0.4 M sorbitol (+4ºC) ve 0.4 M mannitol (+4ºC) uygulamaları sırasıyla % ve % değerleriyle takip etmiştir (Çizelge 4.10.). Bu uygulamalardan alınan değerler arasındaki fark istatistiksel olarak önemli bulunmuştur (P<0.01). Önişlem uygulamaları arasında embriyoid benzeri yapılarda elde edilen değerler arasındaki karşılaştırmalar Şekil da verilmiştir. Denemeler sonucunda, 2 mm den küçük embriyoid sayısı olarak en yüksek oran % ile 0.4 M mannitol (+4ºC) uygulamasında görülürken, bunu sırasıyla % ile 0.4 M sorbitol (+4ºC), % ile soğuk önişlem (+4ºC) ve % ile 0.4 M mannitol (oda sıcaklığı) uygulamaları takip etmiştir (Çizelge 4.10.). En düşük oran ise % 5.24 ile ovaryum eklenmeyen 0.4 M mannitol (+4ºC) uygulamasında 78
91 görülmüştür (Çizelge 4.10.). Bu uygulamalardan alınan değerler arasındaki fark istatistiksel olarak önemli bulunmuştur (P<0.01). Şekil Farklı önişlem uygulamalarının Kunduru-1149 çeşidinde mikrospor kültüründe karakterlere etkisi Denemelerde, 2 mm den büyük embriyoid sayısına bakıldığında yine en yüksek oran % ile 0.4 M mannitol (+4ºC) uygulamasında görülmüştür ve bunu % ile 0.4 M sorbitol (+4ºC) uygulaması takip etmiştir (Çizelge 4.10.). Soğuk önişlem (+4ºC) uygulaması % ve 0.4 M mannitol (oda sıcaklığı) uygulaması % 6.00 oranında embriyoid oluşturmuştur (Çizelge 4.10.). Ovaryum eklenmeyen 0.4 M mannitol (+4ºC) uygulamasında embriyoid (>2 mm) oluşumu ve bitki regenerasyonu gözlenmemiştir. Önişlem uygulamaları arasında embriyoid oluşumunda elde edilen değerler arasındaki karşılaştırmalar Şekil da verilmiştir. Tüm uygulamalar arasında sadece 0.4 M mannitol (+4ºC) uygulaması ile % 6.25 oranında yeşil bitki regenerasyonu elde edilmiştir (Çizelge 4.10.). Albino bitki regenerasyonu bakımından % ile en yüksek değeri 0.4 M mannitol (+4ºC) uygulaması verirken, en düşük oran % 8.33 ile 0.4 M mannitol (oda sıcaklığı) uygulamasında görülmüştür (P<0.01) (Çizelge 4.10.). 0.4 M sorbitol (+4ºC) ve soğuk 79
92 önişlem (+4ºC) uygulamalarının değerleri birbirine çok yakın olup sırasıyla % ve % oranında albino bitki regenerasyonu meydana getirmiştir (Çizelge 4.10.) Farklı önişlem uygulamalarının Triticum aestivum L. cv. Gün-91 çeşidine etkisi Önişlem uygulamaları için Triticum aestivum L. cv. Gün-91 çeşidinden toplam 1035 anter alınmış ve bölünen mikrospor sayısı % olmuştur (Çizelge 4.11.). Embriyoid benzeri yapılar % 29.66, 2 mm den küçük embriyoidlerin sayısı % 25.12, 2 mm den büyük embriyoidlerin sayısı % 13.91, yeşil bitki regenerasyonu % 3.62, albino bitki regenerasyonu % ve toplam bitki regenerasyonu % olarak elde edilmiştir (Çizelge 4.12.). Farklı önişlem uygulamaları arasından en yüksek bölünen mikrospor sayısı % ile 0.4 M mannitol (+4ºC) uygulamasında görülürken, en düşük oran % ile ovaryum eklenmeyen 0.4 M mannitol (+4ºC) uygulamasında görülmüştür (P<0.01) (Çizelge 4.11.). Önişlem uygulamaları arasından ise en düşük oran % ile 0.4 M mannitol (oda sıcaklığı) uygulamasıyla elde edilmiştir (Çizelge 4.11.). Soğuk önişlem (+4ºC) ile % ve 0.4 M sorbitol (+4ºC) ile % değerleri elde edilmiştir (Çizelge 4.11.). Önişlem uygulamaları arasında bölünen mikrosporlarda elde edilen değerler arasındaki karşılaştırmalar Şekil de verilmiştir. Embriyoid benzeri yapılarda en yüksek oran % ile soğuk önişlem (+4ºC) uygulamasında elde edilmiştir (Çizelge 4.12.). En düşük oran ise % 9.09 ile ovaryum eklenmeyen 0.4 M mannitol (+4ºC) uygulamasında görülmüştür (Çizelge 4.12.). Önişlem uygulamaları arasında ise en düşük oran % ile 0.4 M mannitol (oda sıcaklığı) uygulamasında görülmüştür ve bunu 0.4 M sorbitol (+4ºC) ve 0.4 M mannitol (+4ºC) uygulamaları sırasıyla % ve % değerleriyle takip etmiştir (Çizelge 4.12.). Bu uygulamalardan alınan değerler arasındaki fark istatistiksel olarak önemli bulunmuştur (P<0.01). Önişlem uygulamaları arasında embriyoid benzeri yapılarda elde edilen değerler arasındaki karşılaştırmalar Şekil de verilmiştir. 80
93 Çizelge Triticum aestivum L. cv. Gün-91 çeşidine ait farklı önişlem uygulamaları ile mikrospor kültürü sonucu elde edilen bulgular Genotip Gün-91 Önişlem Uygulaması Alınan Anter Ovaryum Sayısı / Bölünen Mikrospor Embriyoid Benzeri Embriyoid Oluşumu (adet) Bitki Regenerasyonu (adet) No (adet) Petri Başına (%) Yapılar (adet) <2 mm (0.5-2 mm) >2 mm Yeşil Albino Toplam (1) b (2) (a) e (b) a (3) c (4) d Ortalama Toplam * Her bir karakter sütununda ayrı harfle gösterilen değerler arasındaki fark P<0.01 düzeyinde önemlidir. 81
94 Çizelge Farklı önişlem uygulamalarının Triticum aestivum L. cv. Gün-91 çeşidine ait embriyo benzeri yapılar, embriyoid ve bitki regenerasyonu üzerine etkisi Genotip Önişlem Embriyoid Embriyoid Bitki Regenerasyonu Uygulaması Benzeri Oluşumu No Yapılar (%) <2 mm (%) >2 mm (%) Yeşil (%) Albino (%) Toplam (%) (1) a a b 4.00 b a a (2) (a) 9.09 c 6.82 c 0.00 c 0.00 c 0.00 d 0.00 d Gün-91 (b) b a a 7.02 a bc a (3) b b b 0.00 c b b (4) b b b 0.00 c c c Ortalama * Her bir karakter sütununda ayrı harfle gösterilen değerler arasındaki fark P<0.01 düzeyinde önemlidir. Denemeler sonucunda, 2 mm den küçük embriyoid sayısı olarak en yüksek oran % ile 0.4 M mannitol (+4ºC) uygulamasında görülürken, bunu sırasıyla % ile soğuk önişlem (+4ºC), % ile 0.4 M sorbitol (+4ºC) ve % ile 0.4 M mannitol (oda sıcaklığı) uygulamaları takip etmiştir (Çizelge 4.12.). En düşük oran ise % 6.82 ile ovaryum eklenmeyen 0.4 M mannitol (+4ºC) uygulamasında görülmüştür (Çizelge 4.12.). Bu uygulamalardan alınan değerler arasındaki fark istatistiksel olarak önemli bulunmuştur (P<0.01). Denemelerde, 2 mm den büyük embriyoid sayısına bakıldığında yine en yüksek oran % ile 0.4 M mannitol (+4ºC) uygulamasında görülmüştür (Çizelge 4.12.). Bunu değerleri birbirine çok yakın olan % ile soğuk önişlem (+4ºC) ve % ile 0.4 M sorbitol (+4ºC) uygulamaları takip etmiştir (Çizelge 4.12.). 0.4 M mannitol (oda sıcaklığı) ise % oranında embriyoid oluşturmuştur (Çizelge 4.12.). Ovaryum eklenmeyen 0.4 M mannitol (+4ºC) uygulamasında embriyoid (>2 mm) oluşumu ve bitki regenerasyonu gözlenmemiştir. Bu uygulamalardan alınan değerler arasındaki fark istatistiksel olarak önemli bulunmuştur (P<0.01). 82
95 Şekil Farklı önişlem uygulamalarının Gün-91 çeşidinde mikrospor kültüründe karakterlere etkisi Tüm uygulamalar arasında 0.4 M mannitol (+4ºC) % 7.02 ve soğuk önişlem (+4ºC) % 4.00 oranında yeşil bitki regenerasyonu meydana getirmiştir (Çizelge 4.12.). Albino bitki regenerasyonu bakımından % ile en yüksek değeri soğuk önişlem (+4ºC) uygulaması verirken, en düşük oran % ile 0.4 M mannitol (oda sıcaklığı) uygulamasında görülmüştür (P<0.01) (Çizelge 4.12.). 0.4 M sorbitol (+4ºC) ve 0.4 M mannitol (+4ºC) uygulamalarının değerleri sırasıyla % ve % oranında albino bitki regenerasyonu meydana getirmiştir (Çizelge 4.12.). Önişlem uygulamaları arasında bitki regenerasyonunda elde edilen değerler arasındaki karşılaştırmalar Şekil de verilmiştir Mikrospor kültüründe bölünen mikrospor sayısının, embriyoid sayısına (> 2 mm) ve bitki regenerasyonuna etkisi Bölünen mikrospor sayısı en fazla % ile Gün-91 ekmeklik buğday çeşidinde görülmüştür. Makarnalık buğday genotiplerinden ise Ç-1252 ve Kızıltan-91 çeşitlerinde bölünen mikrosporların değerleri sırasıyla % ve % olmuştur ve Gün-91 e en yakın değerler olarak bulunmuştur (Şekil 4.12.). Yine bitki 83
96 regenerasyonunda kullanılabilir embriyoid (> 2 mm) sayısı ise Kunduru-1149 dışında diğer makarnalık buğday genotiplerinde Gün-91 de olduğu gibi % 10 u geçmemiştir (Şekil 4.12.). Bununla beraber toplam bitki regenerasyonunda ise Gün- 91 e en yakın değeri Kunduru-1149 makarnalık buğday genotipi vermiştir (Şekil 4.14.). Bu üç karakterden alınan sonuçlarla yapılan korelasyon (r) hesaplamaları, bölünen mikrospor sayısının genotiplerle pozitif ve önemli (r= 0.452*), kullanılabilir embriyoid sayısının (> 2 mm) ise genotiplerle önemsiz (r= öd ) etkileşimde olduğunu göstermiştir (Çizelge 4.13.). Genotiplerden üretilen toplam bitki regenerasyonu ile genotipler arasındaki korelasyon pozitif ve önemlidir (r= 0.679**). Bölünen mikrospor sayısı ile embriyoid sayısı arasında yapılan korelasyon hesaplamasında r= 0.864** bulunmuştur (Çizelge 4.13.). Dolayısıyla negatif bir ilişki görülmemiştir. Bölünen mikrospor sayısı 2 mm den büyük embriyoidlerin oluşumunu desteklemiştir ve embriyoidler de toplam bitki regenerasyonunda önemli etkileşime neden olmuştur (r= 0.612**) (Çizelge 4.13.). Bölünen mikrospor sayısı ile toplam bitki regenerasyonu arasındaki korelasyon da (r= 0.612**) pozitif ve önemli bulunmuştur (Çizelge 4.13.). Çizelge İncelenen karakterler arası ilişkiler (r) Karakterler Genotip Bölünen Mikrospor Embriyoid Oluşumu (> 2 mm) Toplam Bitki Regenerasyonu Genotip * öd 0.679** Bölünen Mikrospor ** 0.725** Embriyoid Oluşumu (> 2 mm) Toplam Bitki Regenerasyonu ** ** 0.01, *0.05, öd önemli değil 84
97 Şekil Genotiplere ait farklı önişlem uygulamalarının mikrospor kültüründeki karakterlere etkisi 85
98 M Mannitol (+4ºC) Önişlem Uygulamasının Mikrospor Kültüründe Genotiplere Etkisi İkinci deneme basamağında, Triticum durum Desf. cvs. Kızıltan-91, Ç-1252, Mirzabey 2000 ve Kunduru-1149 ve Triticum aestivum L. cv. Gün-91 çeşitlerine ait başaklardan toplam 1603 anter alınmış ve 0.4 M mannitol (+4ºC) soğuk önişlem uygulaması ile toplam bölünen mikrospor sayısı % olarak bulunmuştur (Çizelge 4.14.). Çalışmanın bu basamağında toplam embriyoid benzeri yapılar % 45.66, 2 mm den küçük embriyoidlerin sayısı % 52.09, 2 mm den büyük embriyoidlerin sayısı % 14.97, yeşil bitki regenerasyonu % 5.83, albino bitki regenerasyonu % ve toplam bitki regenerasyonu % olarak elde edilmiştir (Çizelge 4.15.). Mikrospor kültür tekniğine cevabının yüksek olduğu bilinen (Zheng, 2003; Cistue and Kasha, 2005; Ferrie and Caswell, 2010) ekmeklik buğday genotipi Gün-91 kontrol grubu olarak kullanılmıştır. Ekmeklik buğday genotipi olarak kullanılan Gün-91 çeşidinde bölünen mikrospor sayısı % ile en yüksek değeri verirken, en düşük mikrospor bölünme yüzdesi % ile Kunduru-1149 çeşidinde görülmüştür (P<0.01) (Çizelge 4.14.). Makarnalık buğday genotipleri arasında ise en yüksek mikrospor bölünme yüzdesi % ile Ç-1252 çeşidinde görülmüştür ve bunu sırasıyla % ve % değerleriyle Kızıltan-91 ve Mirzabey 2000 çeşitleri takip etmiştir (Çizelge 4.14.). Bu uygulamalardan alınan değerler arasındaki fark istatistiksel olarak önemli bulunmuştur (P<0.01). Embriyoid benzeri yapılar bakımından yine en yüksek oranı % ile ekmeklik buğday genotipi Gün-91 verirken, en düşük oranı % ile Mirzabey 2000 çeşidi vermiştir (P<0.01) (Çizelge 4.15.). Makarnalık buğday genotipleri arasında ise en yüksek oranı % ile Kızıltan-91 çeşidi vermiştir (Çizelge 4.15.). Ç-1252 ve Kunduru-1149 çeşitleri sırasıyla % ve % değerlerini vermiştir (Çizelge 4.15.). 86
99 Çizelge Makarnalık ve ekmeklik buğday genotiplerinde 0.4 M mannitol (+4ºC) önişlem uygulaması ile mikrospor kültürü sonucu elde edilen bulgular Genotip Alınan Anter Ovaryum Sayısı / Bölünen Mikrospor Embriyoid Benzeri Embriyoid Oluşumu (adet) Bitki Regenerasyonu (adet) (adet) Petri Başına (%) Yapılar (adet) <2 mm (0.5-2 mm) >2 mm Yeşil Albino Toplam Kızıltan b Ç b Mirzabey c Kunduru c Gün a Ortalama Toplam * Her bir karakter sütununda ayrı harfle gösterilen değerler arasındaki fark P<0.01 düzeyinde önemlidir. 87
100 Çizelge Genotiplere ait 0.4 M mannitol ile soğuk önişlem uygulamasının embriyo benzeri yapılar, embriyoid ve bitki regenerasyonu üzerine etkisi Genotip Embriyoid Benzeri Yapılar (%) Embriyoid Bitki Regenerasyonu Oluşumu <2 mm >2 mm Yeşil Albino (%) (%) (%) (%) Toplam (%) Kızıltan b b b 3.66 c 9.76 c d Ç b c b 3.51 c 7.02 d e Mirzabey c c b 4.54 c b c 2000 Kunduru c d b 8.33 b a b 1149 Gün a a a a a a Ortalama * Her bir karakter sütununda ayrı harfle gösterilen değerler arasındaki fark P<0.01 düzeyinde önemlidir. MMS4 indüksiyon ortamında genotiplerden alınan embriyoidler, 2 mm den küçük (<2 mm, mm) ve 2 mm den büyük (>2 mm) olarak ayrı ayrı sayılmıştır. Genotiplerde denemenin bu basamağında alınan ortalamalar arasındaki fark istatistiksel olarak önemli bulunmuştur (P<0.01). Ekmeklik buğday genotipi Gün mm den küçük embriyoid sayısında % ile en yüksek değeri ve Kunduru çeşidi % ile en düşük oranı vermiştir (P<0.01) (Çizelge 4.15.). Makarnalık buğday genotipleri arasında 2 mm den küçük embriyoid sayısı olarak en yüksek değer % ile Kızıltan-91 çeşidinden elde edilmiştir (Çizelge 4.15.). Ç ve Mirzabey 2000 çeşitlerinin değerleri ise birbirine çok yakın olup sırasıyla % ve % olmuştur (Çizelge 4.15.). Denemelerde, 2 mm den büyük embriyoid sayısı olarak bütün genotipler arasında en yüksek değeri % ile ekmeklik buğday genotipi Gün-91 verirken, Mirzabey 2000 çeşidi % ile en düşük oranı oluşturmuştur (P<0.01) (Çizlege 4.15). Makarnalık buğday genotipleri arasından ise 2 mm den büyük embriyoid sayısı 88
101 olarak en yüksek değer % ile Kızıltan-91 çeşidinden elde edilmiştir. Kunduru-1149 ve Ç-1252 çeşitlerinin değerleri ise yine birbirine çok yakın olup sırasıyla % ve % olmuştur (Çizelge 4.15.). MS regenerasyon ortamına sadece 2 mm den büyük embriyoidler aktarılmış, yeşil ve albino bitki regenerasyonu sayımları yapılmıştır. Yeşil bitki regenerasyonunda tüm genotipler arasında ekmeklik buğday genotipi Gün-91 % ile en yüksek değeri verirken, Ç-1252 çeşidi % 3.51 ile en düşük değeri vermiştir (P<0.01) (Çizelge 4.15.). Makarnalık buğday genotipleri arasında en yüksek yeşil bitki regenerasyonu % 8.33 ile Kunduru-1149 çeşidinde görülmüştür (Çizelge 4.15.). Mirzabey 2000 ve Kızıltan-91 çeşitleri ise sırasıyla % 4.54 ve % 3.66 oranında yeşil bitki regenerasyonu üretmiştir (Çizelge 4.15.). Albino bitki regenerasyonunda tüm genotipler arasında ekmeklik buğday genotipi Gün-91 % ile en yüksek değeri verirken, Ç-1252 çeşidi % 7.02 ile en düşük değeri vermiştir (P<0.01) (Çizelge 4.15.). Makarnalık buğday genotipleri arasında ise en yüksek albino bitki regenerasyonu % ile Kunduru-1149 çeşidinde görülmüştür (Çizelge 4.15.). Mirzabey 2000 ve Kızıltan-91 çeşitlerinin değerleri sırasıyla % ve % 9.76 olmuştur (Çizelge 4.15.). Toplam bitki regenerasyonu olarak bütün genotipler arasında en yüksek bitki regenerasyonunu % ile ekmeklik buğday genotipi Gün-91 oluştururken, en düşük bitki regenerasyonunu % ile Ç-1252 çeşidi meydana getirmiştir (P<0.01) (Çizelge 4.15.). Makarnalık buğday genotipleri arasında ise en yüksek oran % ile Kunduru-1159 çeşidinde görülmüştür ve bunları % ve % ile sırasıyla Mirzabey 2000 ve Kızıltan-91 çeşitleri takip etmiştir (Çizelge 4.15.). Genotiplerin mikrospor kültüründe 0.4 M mannitol ile soğuk önişlem uygulaması, gerek ekmeklik buğday genotipi Gün-91 ve gerekse makarnalık buğday çeşitleri Kızıltan-91, Ç-1252, Mirzabey 2000 ve Kunduru-1149 da ele alınan yedi karakterden (bölünen mikrospor sayısı, embriyoid benzeri yapılar, 2 mm den büyük ve küçük embriyoid sayısı, yeşil ve albino bitki regenerasyonu ve toplam bitki 89
102 regenerasyonu) özellikle bölünen mikrospor sayısı, embriyoid benzeri yapılar ve üretilen embriyoid sayısında beklendiği gibi yüksek bulgular elde edilmiştir (Şekil 4.13.). Bu bulgular ve % değerleri Şekil te karşılaştırılmıştır. 90
103 Şekil Genotiplere ait 0.4 M mannitol ile soğuk önişlem uygulamasının mikrospor kültüründe karakterlere etkisi 91
104 5. TARTIŞMA VE SONUÇ Anterden izole edilen mikrosporlar, uygun kültür koşulları ve stres faktörleri ile normal gametofitik gelişim safhalarından sporofitik safhaya doğru bir gelişme göstererek, embriyo ve haploid veya doubled haploid bitkileri meydana getirebilirler. Doubled haploid bitkileri meydana getirebilecek mikrospor kültür tekniği, homozigot hatları kısa sürede verdiğinden dünya çapındaki laboratuvarlarda çalışılarak yeni varyeteler geliştirmenin yanı sıra genomik, gen ekspresyonu ve genetik harita gibi temel çalışma alanları için mükemmel bir sistem olmuştur (Ferrie and Caswell, 2010). Mikrospor kültür tekniği ile birçok bitki türünde başarılı sonuçlar elde edilse de, bitki regenerasyonunu artırmaya yönelik daha etkili yöntemler geliştirmek amacıyla çalışmalar devam etmektedir. Özellikle tekniğe dirençli genotipler üzerine yapılan çalışmalar ile haploidi araştırmalarında bir canlanma söz konusu olmuştur (Touraev et al., 2009). Mikrospor kültür tekniğine dirençli olduğu bilinen durum buğdayı genotiplerinde tekniği etkileyen faktörler üzerinde çalışmalar yapılması doubled haploid bitki oluşumunu artırarak tekniğin daha verimli kullanılmasına olanak sağlayacaktır. Tekniği etkileyen en önemli faktörler arasında mikrosporların alındığı bitkinin genotipi, donör bitkilerin fizyolojisi, mikrosporların gelişim safhası, önişlem koşulları ve kültür ortamlarının fiziksel ve kimyasal özellikleri yer almaktadır (Zheng, 2003; Cistue and Kasha, 2005; Shariatpanahi et al., 2006; Segui-Simarro and Nuez, 2008). Tüm bu faktörler içerisinde uygulanan önişlem çeşidi, mikrosporların sadece embriyolara gelişiminde değil, aynı zamanda embriyoların yeşil bitkilere dönüşümünde de rol oynadığından mikrospor kültür tekniği için ayrı bir önemi bulunmaktadır (Shariatpanahi et al., 2006). Bu çalışmada dört makarnalık (tetraploid-aabb) Triticum durum Desf. cvs. Kızıltan-91, Ç-1252, Mirzabey 2000 ve Kunduru-1149 (2n=4x=28) ve bir ekmeklik (heksaploid-aabbdd) Triticum aestivum L. cv. Gün-91 (2n=6x=42) buğday genotipi kullanılarak farklı önişlem uygulamaları ile uygun bir mikrospor kültür tekniği protokolü belirlenmeye çalışılmıştır. Tekniği etkileyen birçok faktörün 92
105 bulunmasından dolayı ve dirençli bir genotiple çalışıldığı için tekniğe daha uyumlu olan ekmeklik buğday genotipi kontrol grubu olarak kullanılmıştır. Donör bitkileri yetiştirme koşulları, mikrosporların alındığı andaki gelişim safhaları, mikrosporların izolasyon yöntemleri ve kültür ortamları uzun denemeler sonucunda tespit edilmiş ve en iyi yöntem ile beş farklı önişlem uygulamasının [1. soğuk önişlem (+4ºC), M mannitol (+4ºC) a. ovaryumsuz, b. ovaryum eklenmiş, M sorbitol (+4ºC), M mannitol (oda sıcaklığı)] karşılaştırılması yapılmıştır. Buğday mikrospor kültüründe embriyoid oluşumu, bitki regenerasyonu ve yeşil / albino bitki oranları kalıtsal özellikler olup büyük ölçüde bitkinin genotipine bağlıdır (Torp et al., 2001). Farklı bitki türlerinde yapılmış çalışmalarda, aynı kültür koşulları altında, mikrosporların kültür tekniğine olan cevapları bakımından genotipler arasında büyük farklılıklar olduğu tespit edilmiştir. Holme vd. (1999), 145 kuzey-batı ve 27 doğu Avrupa kışlık ekmeklik buğday hatları kullanarak, aynı ortam koşullarında doğu Avrupa buğday hatlarının mikrospor kültür tekniğinde daha başarılı sonuçlar verdiklerini ve bu farklılığın doğu Avrupa buğday hatlarının yüksek oranda embriyo oluşturma kapasitelerinden kaynaklandığını belirtmişlerdir. Cistue vd. (2006), makarnalık buğday genotipleri kullanarak yaptıkları mikrospor kültürü çalışmalarında, 5 çeşit, 1 seçilmiş hat ve 20 F 1 melezinden elde ettikleri embriyo ve yeşil bitki oranları arasında önemli farklılıklar elde ettiklerini ve bu farklılıkların genotipe bağlı olduğunu bildirmişlerdir. Haploid bitki elde etmek istenilen genotipten yüksek düzeyde androgenetik cevap alabilmek için çeşitli çalışmalar yapılmıştır. Özellikle mikrospor kültür tekniğine dirençli genotiplerde en başarılı ve etkili yöntemlerden biri, kültür koşullarını genotiplere göre optimize etmektir. Patel vd. (2004), üç farklı ekmeklik buğday türü için kullandıkları iki farklı kültür ortamlarının bitki regenerasyonu için farklı cevap verdiklerini görmüşlerdir. Bakos vd. (2007) makarnalık ve ekmeklik buğday genotiplerinde mikrospor kültüründe farklı önişlem uygulamaları ile tekniğe dirençli makarnalık buğday genotiplerinde mikrospor bölünme yüzdesi ve embriyo benzeri yapıların oluşumunda ekmeklik buğday genotiplerindeki parametrelere yakın 93
106 değerler elde etmeyi başarmışlardır. Bu da kültür koşullarını dirençli genotiplere göre ayarlamanın başarılı bir yöntem olduğunu vurgulamaktadır. Çalışmamızda kullandığımız genotipler arasında ekmeklik buğday genotipi Gün- 91 in, tekniğe daha dirençli olan makarnalık buğday genotiplerine göre daha iyi sonuçlar vermiştir. Makarnalık buğday genotipleri arasında ise farklı önişlem uygulamaları ile yapılan denemede bölünen mikrospor sayısı, embriyoid benzeri yapılar ve embriyoid oluşumunda en yüksek değerler Ç-1252 ve Kızıltan-91 çeşitlerinde görülürken, toplam bitki regenerasyonu en fazla Kunduru-1149 çeşidinde görülmüştür. Kunduru-1149 eski makarnalık buğday çeşitlerimizden olup uzun boylu ( cm) ve protein oranı % dır. Başakların uzun boylu olması yatmaya hassasiyeti de beraberinde getirmektedir. Kızıltan-91, Ç-1252 ve Mirzabey 2000 ise orta boylu (90-95 cm) ve sağlam saplı makarnalık çeşitleri olup protein miktarları % dir (Anonim, 2009). Buğdayda bitki boyu verim ve kalite yönünden oldukça önemlidir. Uzun boylu bitkilerde başak boyunun da uzun olmasıyla yağışın bol olduğu zamanlarda yatmaya sebep olmakta, verim ve kaliteyi düşürmektedir. Rht genleri boyu kısaltmak ve yatmayı önlemek amacıyla yaygın olarak kullanılmaktadır (Eser vd., 1993). Bu genler, bitki boyunu azaltmakla beraber kardeşlenme sayısını ve başak başına düşen dane sayısını artırdığı için verimi de artırmaktadır. Fakat yapılan analizler sonucunda dane boyu ve protein içeriğinin azaldığı tespit edilmiştir (Poehlman and Sleeper, 1995). Genellikle bitki boyu ve dane boyu arasında pozitif bir korelasyon mevcuttur. Buğdayda kısa boyluluğu ifade eden Rht1 ve Rht2 genleridir ve bunlar sırasıyla 4A ve 4D kromozomu üzerinde bulunmaktadır (Poehlman and Sleeper, 1995). Rht genleri makarnalık buğdaya transfer edilerek kısa boyluluğun sağlanmasında da kullanılmıştır (Eser vd., 1993). Buğday bitkisinde mikrospor kültürü yoluyla haploid bitkiler meydana getirme kapasitesinin genetik esaslara dayandığı anlaşılmasına rağmen, bu özelliklerin kalıtımı ve genetik analizleri ile ilgili çalışmaların sayısı çok azdır. Çalışmamızda genotipler ve karakterler arası ilişkiler incelendiğinde, bölünen mikrospor sayısı (r= 94
107 0.452*) ve toplam bitki regenerasyonunun (r=0.679**) genotiplere bağlı olduğu, embriyoid sayısının ise (r=0.221 öd ) genotip etkisinden çok bölünen mikrosporların önişlem uygulamaları gibi çevresel stres faktörlerine bağlı olarak değişebildiği görülmüştür. Bu çalışmada farklı çevresel stres faktörleri (önişlem uygulamaları) embriyoid sayısının artırılması için mikrosporlara uygulanmıştır. Uygulanan önişlemlerin mikrosporların embriyoid üretimini artırmasında etkili olduğu istatistiksel hesaplamalarla ortaya konmuştur (Çizelge 4.4.; 4.6.; 4.8.; 4.10.; 4.12.). Bunun yanı sıra artan embriyoid üretiminde kültür ortamına ovaryum eklenmesinin kullanışlı embriyoid sayısını artışındaki etkisi önemlidir (P< 0.01) (Çizelge 4.4.; 4.6.; 4.8.; 4.10.; 4.12.). Genetik faktörlerin yanı sıra mikrosporlardan androgenetik cevap alabilmek için donör bitkilerin yetiştirilme koşullarının önemli olup, mikrospor kültür tekniğinde genotip x çevre interaksiyonunun olduğu görülmüştür (Cistue and Kasha, 2005). Kültür tekniğinden sürekli cevap alabilmek için her tür için çevresel koşulları optimize etmek gerekmektedir. Hatta aynı türe ait farklı çeşitlerin (yazlık-kışlık buğday) dahi farklı fizyolojik istekleri olabilmektedir (Kasha et al., 1990; Jähne and Lörz, 1995). Işık yoğunluğu, kalitesi ve fotoperiyot özelliklerinin kontrolü ve koordinasyonu mikrospor kültüründe iyi sonuçlar almak için önemli olduğu belirtilmiştir (Kasha et al., 2003). Zheng vd. (2002), ekmeklik buğday genotiplerini saat ışıkta 27ºC de ve 7-8 saat karanlıkta 17ºC de yetiştirerek mikrospor kültür tekniğinde iyi sonuçlar almışlardır. Jauhar (2003), mikrospor kültürüne ekmeklik buğdaya oranla cevabının düşük olduğu bilinen durum buğdayını serada yetiştirmiş ve iyi sonuçlar almıştır. Bununla birlikte Cistue vd. (2006), bitki yetiştirme odasındaki donör bitkileri haftada bir veya iki kez gübreleyerek (20:20:20 / N:P:K) daha güçlü bitkiler elde etmiştir. NPK desteği bütün buğday genotiplerinde mikrospor kültür tekniğinden güçlü mikrosporlar elde etmek için önemli bir faktör olmuştur. Donör bitkinin yetiştirilme aşamasında uygun yetiştirilme koşulları sağlanamadığında sadece albino bitkiler oluşmakta, tek bir yeşil haploid bitki elde etmek mümkün olamamaktadır (Foroughi-Wehr and Wenzel, 1993). Çalışmamızda donör bitkiler, bitki büyütme odasında, 16 saat ışık / 8 saat karanlıkta, 18º ± 2ºC / 24º ± 2ºC (ışık / karanlık) sıcaklıkta, lüks ışık şiddetinde ve % nem 95
108 oranında kontrollü koşullarda yetiştirilmiştir. Uygun aralıklarla kimyasal gübre (N:P:K) ilave edilmiş ve böceklenmeye karşı kimyasal ilaçlama yapılmıştır. Mikrospor kültür tekniğinde, yeşil haploid bitkiler mikrosporlardan elde edildiği için sporofitik safhaya yönelme gücü fazla olan mikrosporlarla kültüre başlamak en önemli faktörler içerisinde yer almıştır. Dolayısıyla anterlerin donör bitkiden izole edildiği anda mikrosporların içinde bulundukları gelişme dönemi embriyo oluşumunu etkilemektedir. Ekmeklik buğdayda mikrospor kültüründeki en iyi sonuçlar, mikrosporların çoğunun orta veya geç tek çekirdekli dönemde iken alınan başaklarda olduğu tespit edilmiştir (He and Quyang, 1984; Kasha et al., 2001). Durum buğdayında ise, mikrosporlar geç tek çekirdekli veya erken çift çekirdekli safhada iken en iyi sonuçlar alınmıştır (J Aiti et al., 2000). Buğday bitkisinden alınacak androgenetik cevapta, anterlerdeki mikrosporların yapıları ve kaliteleri de oldukça önemli olmuştur. Segui-Simarro ve Nuez (2008), mikrospor kültüründe daha fazla embriyo oluşumunun daha az sayıda mitokondriye sahip, daha az miktarda nişasta içeren ve daha küçük yapılı mikrospor oluşumunun bitkideki cinsiyet dengesi ile ilişkili olduğu, yetiştirme koşullarının dişilik yönünde gelişmeyi artırması halinde sporofitik gelişmeye yönelen mikrosporların sayısının da arttığını ortaya koymuşlardır. Çalışmamızda % 2 lik aseto-karmin ile yapılan sitolojik gözlemler sonucunda orta-geç tek çekirdekli veya erken çift çekirdekli mikrosporlar kullanılmıştır. Uygun safhada bulunan mikrosporların bayrak yaprağın tam kınından çıkmamış olan başakta olduğu tespit edilmiştir. Bununla birlikte, doğru aşamadaki anterlerin bulunduğu başakların durumu, genotipe ve çiçekçiklerin başakta bulunduğu yere göre değişmiştir. Ekmeklik buğday genotipi Gün-91 de uygun safhadaki mikrosporlar (orta-geç tek çekirdekli) anterler açık yeşil, başaklar yaprak kınından çıkmadan ve dolgunlaşmadan önce alınmıştır. Makarnalık buğday genotiplerinde ise uygun safhadaki mikrosporlar (erken çift çekirdekli) anterler yeşil, başaklar yaprak kınından çıkmadan fakat dolgunlaşmış iken alınmıştır. Androgenesisi teşvik etmek için kullanılan önişlem çeşidinin, mikrosporları gametik safhalarından sporofitik safhaya doğru yöneltmede oldukça büyük önemi olmuştur. Önişlem çeşitleri fiziksel, fizyolojik ve kimyasal şeklinde olup başaklara, anterlere 96
109 ve izole edilmiş mikrosporlara uygulanmıştır (Zoriniants et al., 2005). Bazı çalışmalarda soğuk önişlem ile mannitol uygulaması şeklinde ikili kombinasyonlar da oluşturulmuştur (Kasha et al., 2003). Önişlem uygulamalarının çeşidi ve süresi de mikrosporların gametofitik gelişimini durdurmak ve embriyoya dönüşümünü teşvik etmek için çok önemli olmuştur. Buğday mikrospor kültüründe soğuk ve sıcak şeklinde yapılan önişlem uygulamaları iyi sonuçlar vermiştir. Tourev vd. (1996), mikrospor kültüründe ekmeklik buğday mikrosporlarını 33ºC de 4 gün önişleme alarak iyi sonuçlar elde etmiştir. Tuvesson vd. (2000), buğday başaklarını birkaç gün 4ºC de soğuk önişleme aldıklarında mikrospor kültüründeki başarı ve kendiliğinden oluşan kromozom katlanmaları artmıştır. Durum buğdayında ise Ghaemi vd. (1995) başakları karanlıkta su içeren şişelerde 4ºC de 7 gün tutarak embriyo oluşumunda negatif bir etki gözlemlerken, bitki regenerasyonundan pozitif sonuçlar almışlardır. Soğuk önişlem ve genotip arasında da bir interaksiyonun olduğu görülmüştür (Mentewab and Sarrafi, 1997). Saidi vd. (1997), başakları karanlıkta 0-15 gün 3ºC de tutarak, 8. günde aldıkları sonuçlar ile soğuk önişlemin embriyogenesisi önemli derecede artırdığını tespit etmişlerdir. Mikrospor kültüründe embriyoid oluşumu ve bitkiye dönüşüm üzerinde soğuk önişlem uygulamalarının normal gametofitik gelişmeyi durdurduğu ve nişasta üretimini bloke ettiği görülmüştür (Kasha et al., 2003). Ayrıca, kültürlerin inkübasyonu süresince kahverengine dönüşen ve yaşlanarak toksik maddeler salgılayabilen anter çeperi, kültür öncesi uygulanan soğuk şokları sayesinde daha geç yaşlanmakta ve olumsuz etkileri önemli düzeyde engelleyebilmektedir. Embriyogenesisi teşvik etmek için kullanılan bir başka önişlem uygulaması ise mannitoldür. Mannitol uygulamasının mikrosporlarda sadece besin yetersizliğine yol açtığı düşünülse de (Roberts-Oehlschlager and Dunwell, 1990), hücre duvarı oluşumunu durdurarak normal mikrospor gelişimini engellediği de görülmüştür (Kasha et al., 2001; Shim et al., 2006). Kasha vd. (2003), petri kaplarına aldığı başaklara 0.4 M mannitol ve 4ºC de buzdolabında muhafaza ederek mikrospor kültüründen iyi sonuçlar almıştır. Cistue vd. (2006), hem ekmeklik hem de makarnalık buğday başaklarını 4-6 gün 24ºC de 0.7 M mannitolde tutarak embriyo 97
110 oluşumunu iyi yönde etkilediğini görmüşlerdir. Mejza vd. (1993), 0.3 M mannitol ile soğuk önişlem uygulamalarını karşılaştırdıklarında mannitolün embriyo oluşumunu daha fazla artırdığını tespit etmişlerdir. Yapılan çalışmalarda mannitol ve soğuk önişlem uygulamalarının bir arada kullanılmasının her ikisini ayrı ayrı kullanmaktan çok daha iyi sonuçlar verdiği gözlemlenmiştir. Labbani vd. (2007), makarnalık buğday genotiplerinde 0.3 M mannitol ve 7 gün soğuk önişlemin embriyo oluşumu ve yeşil bitki regenerasyonunu önemli düzeyde artırdığını belirtmişlerdir. Mannitol ile soğuk önişlem uygulamalarının bir arada kullanılmasının, mikrosporlardaki mitotik aktiviteyi durdurduğu, bütün mikrosporları aynı safhada tuttuğu ve büyük oranda embriyo benzeri yapıların oluşumunu sağladığı gözlemlenmiştir (Hu and Kasha, 1999). Ayrıca Wojnarowiez vd. (2004) önişlem uygulamasında mannitol kullandıklarında, plastitlerin nişasta biriktirmediği ve mikrospordan gelişen embriyolarda plastitlerin kloroplastlara dönüştüğünü belirtmişlerdir. Mannitol önişlem uygulamasının genotipler arasında da farklı sonuçlar verdiği görülmüştür. Labbani vd. (2005), mannitol önişlem uygulaması ile makarnalık buğday genotiplerinde embriyo oluşumu yönünden farklılıklar elde etmiştir. Cham 1 genotipinde 0.1 M mannitol ile düşük oranda embriyo oluşumu gözlenirken, JK genotipinde embriyo oluşumu oldukça yüksek olmuştur. Çalışmamızda, makarnalık ve ekmeklik buğday genotiplerinde beş farklı önişlem uygulaması [1. soğuk önişlem (+4ºC), M mannitol (+4ºC) a. ovaryumsuz, b. ovaryum eklenmiş, M sorbitol (+4ºC), M mannitol (oda sıcaklığı)] kullanılmıştır. Kızıltan-91, Ç-1252, Mirzabey 2000, Kunduru-1149 ve Gün- 91 çeşitlerinde bölünen mikrospor sayısı, embriyoid oluşumu ve toplam bitki regenerasyonunda en iyi sonuçlar 0.4 M mannitol ve +4ºC önişlem uygulaması ile elde edilmiştir. Embriyoid benzeri yapılar ise Kızıltan-91, Mirzabey 2000, Kunduru-1149 ve Gün-91 çeşitlerinde soğuk önişlem uygulamasında, Ç-1252 çeşidinde ise 0.4 M sorbitol (+4ºC) uygulamasında daha fazla görülmüştür. Makarnalık buğday genotiplerinde 0.4 M mannitol ve +4ºC önişlem uygulamasından sonra embriyo oluşumunda (> 2 mm) en iyi sonuçlar 0.4 M sorbitol (+4ºC) önişlem uygulaması ile elde edilmiştir. Mannitol ve sorbitol altı karbonlu polioller (şeker alkolü) olup, hidroksil grubunun bağlanma şekliyle farklılık gösterirler. 98
111 Çalışmamızda mannitolün genotiplerde gerek embriyo oluşumu gerekse bitki regenerasyonunda sorbitole göre daha iyi sonuçlar verdiği görülmüştür. Yine mannitol ve soğuk önişlemin bir arada kullanılmasıyla, mannitolün oda sıcaklığında kullanılmasından daha iyi sonuçlar elde edilmiştir. Bu da iki stres faktörünü bir arada kullanmanın daha önceki yapılan çalışmalarda olduğu gibi (Kasha et al., 2003; Labbani et al., 2007) embriyo oluşumu ve bitki regenerasyonunu olumlu yönde etkilediğini göstermiştir. Genotipler ile önişlem uygulamaları arasındaki etkileşim P<0.01 seviyesinde önemli olmuştur. Genotipler arasında 0.4 M mannitol ve +4ºC önişlem uygulaması ile embriyo oluşumunda (> 2 mm) en yüksek sonuçlar (% 25.33) ekmeklik buğday genotipi Gün-91 de görülmüştür. Makarnalık buğday genotiplerinde ise embriyo oluşumu (> 2 mm) sırasıyla Kızıltan-91 (% 20.63), Ç-1252 (% 17.77), Mirzabey 2000 (% 16.90) ve Kunduru-1149 (% 15.09) şeklinde olmuştur. 0.4 M mannitol ve +4ºC önişlem uygulaması ile toplam bitki regenerasyonunda ise yine en yüksek oran (% 21.05) ekmeklik buğday genotipi Gün-91 de elde edilmiştir. Androgenesise ekmeklik buğday genotipinin makarnalık buğday genotiplerinden daha kabiliyetli olduğu yaptığımız çalışmalarla da desteklenmiştir. Makarnalık buğday genotiplerinden en fazla toplam bitki regenerasyonu (% 18.75) Kunduru-1149 çeşidinden elde edilmiştir. Burada makarnalık buğday genotipleri arasında en düşük embriyo oluşumunun Kunduru-1149 çeşidinde görülürken, en yüksek toplam bitki regenerasyonunun yine Kunduru-1149 da olması dikkat çekmektedir. Bunun sebebinin Kunduru-1149 çeşidinin içerdiği regenerasyona kabiliyetli genlerin olduğu düşünülmektedir. Nitekim, Savaşkan vd. (1997), yaptıkları cinslerarası melezleme çalışmalarında Kunduru-1149 çeşidinden elde ettikleri haploid embriyoların sayısı diğer makarnalık buğday çeşidi olan Berkmen-469 ile benzer iken, yeşil bitki regenerasyonu Kunduru-1149 da Berkmen-469 ve Çakmak-79 çeşitlerinden önemli olarak fazla bulunmuştur. Mikrospor kültür tekniğinde mikrosporların anterden izolasyon yöntemleri de oldukça önemli olmuştur. Mikrosporların anterden izolasyonu sırasında canlılıklarını korumaları, anterden kolaylıkla ayrılmaları ve yoğunlukları embriyo oluşumunu ve 99
112 bitki regenerasyonunu etkilemiştir (Kasha et al., 2003). Hu vd. (1995), vorteks, sonikasyon, karıştırma ve homojenizatör ile dört farklı şekilde kullandıkları izolasyon yöntemleri arasında en iyi yöntemin vorteks olduğunu belirtmişlerdir. Diğer yöntemlerde mikrospor canlılık oranı oldukça düşmüştür. Gustafson vd. (1995) dökülme, manyetik çubukla karıştırma, maserasyon veya laboratuvar blenderı ile parçalama gibi yöntemler arasından en fazla başarı sağlayan yöntemin, % 75 sağlam mikrospor eldesi ile laboratuvar blenderı olduğunu tespit etmişlerdir. Kültür ortamında ovaryumlar da kullanılacağı zaman ise, maserasyon yöntemi tercih edilmektedir. Çalışmamızda ovaryumlar da kullanıldığı için anterler başaklardan pinsteler yardımıyla alınmış ve 0.4 M mannitol çözeltisi içerisine alınmıştır. Anterler daha sonra filtre sisteminden geçirilip filtre üzerindeki anterler cam çubuk ile ezilmiştir. Ezilme sonucunda anterlerinden ayrılan mikrosporlar sıvı içerisinde toplanmıştır. Mikrospor canlılığı ve yoğunluğu mikroskop altında kontrol edilmiştir. Çalışmamızın ön denemelerinde laboratuvar blenderı da kullanılmıştır. Fakat kültür ortamında ovaryumlar da kullanılacağı için ve aynı anda çok fazla başağa ihtiyaç duyulmasından dolayı bu yöntem tercih edilmemiştir. Mikrosporları embriyogenik potansiyele doğru teşvik ettikten sonra embriyogenesisin meydana gelebilmesi için onlara uygun ortam koşulları sağlamak gerekmiştir. Makarnalık ve ekmeklik buğday genotipleri için mikrospor bölünmesini teşvik etmek amacıyla birçok kültür ortamı geliştirilmiştir (Szarejko, 2003). Mikrospor kültüründe durum buğdayı için kullanılan indüksiyon ortamları halen geliştirilmekte ve birçok araştırma devam ettirilmektedir. Otani ve Shimada (1995), makarnalık buğday mikrospor kültüründe PII, C17, W14 ve MN6 adında dört farklı kültür ortamını karşılaştırmış ve C17 ortamının embriyoid oluşumunda en etkili kültür ortamı olduğunu belirtmişlerdir. Hu ve Kasha (1997), buğday mikrospor kültüründe MMS1, MMS2 ve MMS3 şeklinde üç farklı kültür ortamı kullanmış ve MMS3 kültür ortamının etkili sonuçlar verdiğini görmüşlerdir. Son yıllardaki araştırmalar, sadece temel kültür bileşikleri üzerine değil aynı zamanda hormon çeşitleri, ortama ilave edilen farklı proteinler (arabino-galaktan proteinleri) ve ovaryumlar üzerine yoğunlaşmıştır. Ortama ilave edilen hormonların 100
113 miktarı ve çeşidi embriyo oluşumu ve kalitesi bakımından son derece önemli olmuştur. Bitki türleri için kullanılması gereken en etkili hormon çeşidi ve konsantrasyonu ile ilgili genel bir görüş olmamakla birlikte, embriyoid oluşumu için olabildiğince en düşük oranların kullanılması gerektiği belirtilmektedir. Çünkü indüksiyon ortamındaki yüksek miktarlardaki hormon konsantrasyonları bitki üretimini olumsuz yönde etkilemekte, hücre bölünmesi ve farklılaşmasını embriyoid oluşumundan çok kallus oluşumuna doğru teşvik etmektedir. Buğday mikrospor kültüründe kullanılan 2,4-D ve PAA oksin çeşitleri ile kinetin ve 6-benzil amniopürin sitokinin çeşitleri ile iyi sonuçlar elde edilmiştir (Zheng et al., 2001; Liu et al., 2002a; Kasha et al., 2003). Hu vd. (1995), ekmeklik buğdayda indüksiyon ortamına 0, 1, 2, 4, 7 ve 10 mg/l dozlarında altı farklı şekilde PAA kullanmış ve 4 mg/l PAA nın en iyi embriyoid ve yeşil bitki regenerasyonunu verdiğini belirtmişlerdir. Hu ve Kasha (1997), kullandıkları farklı kültür ortamlarında 2 ve 4 mg/l PAA ilave etmiş ve en iyi sonuçları 2 mg/l PAA içeren kültür ortamından almışlardır. Donör bitkilerin yetiştirilme koşulları içsel hormon düzeyini önemli ölçüde etkilemiştir. Dolayısıyla izole edilen mikrosporlar aynı hormon düzeylerini kültür ortamından da istenmektedir. Bitkilerin yetiştirildiği ortamdaki stres faktörleri bitkilerin hormon düzeylerini değiştirebilmektedir (Cistue and Kasha, 2005). Mikrospor kültür ortamına ovaryum eklenmesi, bölünen mikrospor sayısını ve embriyo oluşumunu önemli düzeyde artırmıştır (Mejza et al., 1993; Hu and Kasha, 1997; Devaux and Li, 2001). Zheng vd. (2002), mikrospor kültür tekniğine dirençli genotiplerde kültür ortamına tane ovaryumun eklenmesinin embriyoid oluşumunu 100 kat kadar artırdığını ve hücre bölünmesini hızlandırdığını tespit etmişlerdir. Ovaryum ilave edilmeyen ortamlardan ise hiç embriyoid elde edilememiştir. Bu da ovaryumların dirençli genotipler için kritik bir faktör olduğunu göstermektedir. Hu ve Kasha (1997), MMS3 ortamına ilave edilen 20 tane ovaryumun embriyoid oluşumunu önemli düzeyde artırdığını tespit etmişlerdir. Köhler ve Wenzel (1985), kültür ortamındaki ovaryumlardan salgılanan protein ve amino asitlerin mikrosporların gelişimine katkıda bulunduğundan dolayı embriyoid oluşumunun arttığını düşünmüşlerdir. 101
114 Mikrospor kültür ortamında oldukça etkili olan bir başka madde ise arabinogalaktan proteinleri (AGP) dir. Letarte vd. (2006), buğday mikrospor kültüründe ortama 1, 5, 10, 25, 50 ve 100 mg/l Larcol ve AGP ilave ettiklerinde 10 mg/l AGP nin embriyo oluşumunu ve yeşil bitki regenerasyonunu önemli düzeyde arttırdığını, 10 mg/l den sonraki konsantrasyonlarda embriyo sayısında herhangi bir değişimin olmadığını görmüşlerdir. Kasha vd. (2003), mikrospor kültür ortamında AGP ve ovaryumların etkisini araştırmış, AGP ve ovaryum bulunmayan ortamda mikrospor canlılığının % 18.8 e kadar düştüğünü ve embriyo oluşumunun gözlemlenmediğini belirtmişlerdir. Ovaryum bulunan fakat AGP bulunmayan ortamda mikrospor canlılığının % 35.5 ve embriyo oluşumunun 1650 olduğunu, 10 mg/l AGP bulunan ortamda ise ovaryumla mikrospor canlılığının % 78.3, embriyo oluşumunun 4250, ovaryumsuz ise mikrospor canlılığının % 77.8, embriyo oluşumunun 50 olduğunu tespit etmişlerdir. Bu da kültür ortamında AGP nin tek başına yeterli olmayacağını, ovaryumların da mutlaka indüksiyon ortamında kullanılması gerektiğini göstermiştir. Çalışmamızda, mikrosporlar anterlerinden izole edildikten sonra MMS4 indüksiyon ortamına aktarılmıştır. MMS4 kültür ortamında oksin çeşidi olarak 2 mg/l PAA ve embriyo oluşumu üzerinde önemli etkisi bulunan 10 mg/l AGP kullanılmıştır. Ayrıca ovaryumların da etkisini karşılaştırmak amacıyla kullanılan beş farklı önişlem arasından 0.4 M mannitol + 4ºC uygulamasında ovaryum ve ovaryum kullanılmadan sonuçlar elde edilmiştir. Tüm genotiplerde ovaryum kullanılmayan indüksiyon ortamından 2 mm den büyük embriyoid ve bitki regenerasyonu elde edilememiştir. Embriyoid benzeri yapılar ve 2 mm den küçük embriyoidlerin sayısı da ovaryum kullanılan ortamlardan alınan sonuçlara göre çok düşük olmuştur. Bu da mikrospor kültüründe indüksiyon ortamında ovaryum kullanmanın çok önemli olduğunu, hatta kullanılmadığı durumlarda teknikten hiç sonuç alınamadığı için kritik bir faktör olduğunu göstermiştir. Sonuç olarak, dört makarnalık Triticum durum Desf. cvs. Kızıltan-91, Ç-1252, Mirzabey 2000 ve Kunduru-1149 ve bir ekmeklik Triticum aestivum L. cv. Gün- 91 buğday genotiplerinin bitki büyütme odasında kontrollü koşullar altında ekimleri yapılarak yetiştirilmiştir. Mikrospor çekirdeğinin uygun safhada olduğu dönemdeki 102
115 başaklar toplanarak, soğuk önişlem (+4ºC), 0.4 M mannitol (+4ºC) a. ovaryumsuz, b. ovaryum eklenmiş, 0.4 M sorbitol (+4ºC), 0.4 M mannitol (oda sıcaklığı) şeklinde beş farklı önişlem uygulamasına alınmıştır. Önişlem uygulamasından sonra mikrosporlar anterlerinden uygun şekilde izole edilerek ovaryumlar ile birlikte MMS4 indüksiyon ortamına aktarılmıştır. Bu çalışmada toplam 7075 anter alınmış ve 0.4 M mannitol (+4ºC) önişlem uygulaması ile Gün-91 ekmeklik buğday genotipinde en fazla embriyoid oluşumu ve bitki regenerasyonu elde edilmiştir. Mikrospor kültür tekniğine dirençli olarak belirtilen makarnalık buğday genotipleri arasından ise, en fazla embriyoid oluşumu Kızıltan-91 çeşidinde görülürken en fazla bitki regenerasyonu Kunduru-1149 çeşidinden elde edilmiştir. Embriyoid oluşumunun düşük olduğu Kunduru-1149 makarnalık buğday genotipinin bitki regenerasyonuna kabiliyetli genlere sahip olduğu bu tez çalışmasında ortaya konan faktörlerden biridir. Ayrıca yine, mikrospor kültür tekniğine uyumlarının zor olduğu tespit edilen makarnalık buğday genotiplerinde indüksiyon ortamına ilave edilen ovaryumların mikrosporlarda regenerasyon üretebilecek embriyo (>2mm) sayısına etkisinin oldukça büyük olduğu belirlenmiştir. Ovaryum ilave edilmeyen ortamlardan tüm genotiplerden embriyoid oluşumu ve bitki regenerasyonu elde edilememiştir. Bu çalışma ile tekniğe dirençli makarnalık buğday genotipleri için haploid bitki üretimine giderken mikrospor kültür tekniğinde optimum koşullar sağlanarak embriyoid oluşumu ve yeşil bitki regenerasyonu elde etme kapasitesi ortaya konmaya çalışılmıştır. 103
116 6. KAYNAKLAR Anonim, Tarla Bitkileri Araştırma Merkezi, TARM. İnternet Sitesi. Erişim Tarihi: Anonymous, Food and Agriculture Organization, FAO. İnternet Sitesi. Erişim Tarihi: Ayçiçek, M., Yürür, N., Türkiye tarımında makarnalık buğday üretimi ve önemi. Uludağ Üniversitesi Ziraat Fakültesi Dergisi, 11, Ayed, O.S., De Buyser, J., Picard, E., Trifa, Y., Amara, H.S., Effect of pretreatment on isolated microspores culture ability in durum wheat (Triticum turgidum subsp. durum Desf.). Journal of Plant Breeding and Crop Science, 2 (2), Babaoğlu, M., Gürel, E., Özcan, S., Bitki Biyoteknolojisi I: Doku Kültürü ve Uygulamaları. Selçuk Üniversitesi Vakfı Yayınları, 374s. Konya. Bakos, F., Darko, E., Ponya, Z., Barnabas, B., Regeneration of fertile wheat (Triticum aestivum) plants from isolated zygotes using wheat microspore culture as nurse cells. Plant Cell, Tissue and Organ Culture, 74, Bakos, F., Fabian, A., Barnabas, B., Isolated microspore cultures of a Hungarian durum wheat (Triticum turgidum L.) cultivar, Martondur 1. Acta Agronomica Hungarica, 55 (2), Ben Amer, I.M., Korzun, V., Worland, A.J., Borner, A., Genetic mapping of QTL controlling tissue-culture response on chromosome 2B of wheat (Triticum aestivum L.) in relation to major genes and RFLP markers. Theoretical and Applied Genetics, 94, Bruins, M.B.M., Rakoczy-Trojanowska, M., Snijders, C.H.A., Isolated microspore culture in wheat (Triticum aestivum L.): the effect of co-culture of wheat or barley ovaries on embryogenesis. Cereal Research Communications, 24, Caredda, S., Doncoeur, C., Devaux, P., Sangwan, R.S., Clement, C., Plastid differentation during androgenesis in albino and non-albino producing cultivars of barley (Hordeum vulgare L.). Sexual Plant Reproduction, 13, Castillo, A.M., Cistue, L., Production of gynogenic haploids of Hordeum vulgare. Plant Cell Reports, 12,
117 Castillo, A.M., Valles, M.P., Cistue, L., Comparison of anther and isolated microspore cultures in barley. Effects of culture density and regeneration medium. Euphytica, 113, 1-8. Cattaneo, M., Vaccino, P., Dihaploid production for wheat breeding programmes: The Italian experience. In: Biotechnological approaches for utilization of gametic cells. COST 824 final meeting, 1 5 July, Bled, Slovenia, pp Chen, Y., Zuo, Q., Li, S., Lu, D., Zheng, S., Green plant regenerated from isolated rice pollen grains in vitro and the induction factors. Acta Genetics Sinica, 8, Chu, C.C., The N6 medium and its applications to anther culture of cereal crops Proceeding of Symposium on Plant Tissue Culture. Science Press, pp , Beijing. Chu, C.C., Hill, R.D., An improved anther culture method for obtaining higher frequency of pollen embyroids in Triticum aestivum L. Plant Science, 55, Chu, C.C., Hill, R.D., Brule-Babel, A.L., High frequency of pollen embryoid formation and plant regeneration in Triticum aestivum L. on monosaccharide containing media. Plant Science, 66, Chuang, C.C., Ouyang, J.W., Chia, H., Chou, S.M., A set of potato media for wheat anther culture. In: Plant Tissue Culture. Science Press, pp , Peking. Cistue, L., Kasha, K.J., Gametic embryogenesis in Triticum: a study of some critical factors in haploid (microspore) embryogenesis. Plant Cell Monographs, 2, Cistue, L., Soriano, M., Castillo, A.M., Valles, M.P., Sanz, J.M., Echavarri, B., Production of doubled haploids in durum wheat (Triticum turgidum L.) through isolated microspore culture. Plant Cell Reports, 25, Cistue, L., Romagosa, I., Battle, F., Echavarri, B., Improvements in the production of doubled haploids in durum wheat (Triticum turgidum L.) through isolated microspore culture. Plant Cell Reports, 28, Deutsch, F., Kumlehn, J., Ziegenhagen, B., Fladung, M., Stable haploid poplar callus lines from immature pollen culture. Physiologia Plantarum, 120, Devaux, P., Li, H., Enhancement of microspore culture efficiency of recalcitrant barley genotypes. Plant Cell Reports, 20,
118 Dias, J.S., Effect of incubation temperature regimes and culture medium on brocolli microspore culture embryogenesis. Euphytica, 119, Echavarri, B., Soriano, M., Cistue, L., Valles, M.P., Castillo, A.M., Zinc sulphate improved microspore embryogenesis in barley. Plant Cell, Tissue and Organ Culture, 93, Eser, V., Zencirci, N., Baran, İ., Yalvaç, K., Makarnalık buğdayda (Triticum durum Desf.) boy yönünden genetik varyasyonun diallel analiz metoduyla araştırılması. Tarla Bitkileri Merkez Araştırma Enstüsü Dergisi, 2 (2), Ferrie, A.M.R., Caswell, K.L., Isolated microspore culture techniques and recent progress for haploid and doubled haploid plant production. Plant Cell, Tissue and Organ Culture, 104, Foroughi-Wehr, B., Wenzel, G., Andro- and parthenogenesis. In: Plant Breeding: Principles and Prospects. (Hayvard, M.D., Bosemark, N.O., Ramagosa, I., -eds) Chapman&Hall, pp , London. Fridborg, G., Pedersen, M., Landström, L.E., Eriksson, T., The effect of activated charcoal on tissue cultures adsorbtion of metabolites inhibiting morphogenesis. Physiologia Plantarum, 43, Gamborg, O.L., Miller, R.A., Ojima, K., Nutrient requirements of suspension cultures of soybean root cells. Experimental Cell Research, 50, Ghaemi, M., Sarrafi, A., Alibert, G., The effects of silver nitrate, colchicine, cupric sulfate and genotype on the production of embryoids from anthers of tetraploid wheat (Triticum turgidum). Plant Cell, Tissue and Organ Culture, 36, Ghaemi, M., Sarrafi, A., Alibert, G., Influence of genotype, media composition, cold pre-treatment and their interactions on androgenesis in durum wheat (Triticum turgidum). Cereal Research Communications, 23, Gustafson, V.D., Baenziger, P.S., Wright, M.S., Stroup, W.W., Yen, Y., Isolated wheat microspore culture. Plant Cell, Tissue and Organ Culture, 42, Güleç, T.E., Sönmezoğlu, Ö.A., Yıldırım, A., Makarnalık buğdaylarda kalite ve kaliteyi etkileyen faktörler. GOÜ, Ziraat Fakültesi Dergisi, 21 (1), Hakkı, E.E., Savaşkan, Ç., Akkaya, M.S., Genotyping of Anatolian doubledhaploid durum lines with SSR markers. Euphytica, 122,
119 Hansen, N.J.P., Andersen, S.B., In vitro chromosome doubling with colchicine during microspore culture in wheat (Triticum aestivum L.). Euphytica, 102, He, D.G., Quyang, J.W., Callus and plantlet formation from cultured wheat anthers at different developmental stages. Plant Science Letters, 33, Hess, D., Biotechnologie der Pflanzen. Verlag Eugen Ulmer, p. 173, Stuttgart. Holme, I.B., Olesen, A., Hansen, N.J.P., Andersen, S.B., Anther and isolated microspore culture response of wheat lines fromn northwestern and eastern Europe. Plant Breeding, 118, Hu, T.C., Ziauddin, A., Simion, E., Kasha, K.J., Isolated microspore culture of wheat (Triticum aestivum L.) in a defined media I. Effects of pretreatment, isolation methods, and hormones. In Vitro Cellular & Developmental Biology, 31, Hu, T., Kasha, K.J., Improvement of isolated microspore culture of wheat (Triticum aestivum L.) through ovary co-culture. Plant Cell Reports, 16, Hu, T., Kasha, K.J., A cytological study of pretreatments used to improve isolated microspore cultures of wheat (Triticum aestivum L.) cv. Chris. Genome, 42, Hunter, C.P., Plant regeneration from microspores of barley, Hordeum vulgare L. Ph.D. Thesis. Wye College, University of London, London. Imamura, J., Harada, H., Effects of absisic acid and water stress on the embryo and plant formation in anther cultures of Nicotiana tabacum cv. Samsun. Zeitschrift für Pflanzenphysiologie, 100, Imamura, J., Harada, H., Stimulation of tobacco pollen embryogenesis by anaerobic treatment. Zeitschrift für Pflanzenphysiologie, 103, Indrianto, A., Heberle-Bors, E., Touraev, A., Assessment of various stresses and carbohydrates for their effect on the induction of embryogenesis in isolated wheat microspores. Plant Science, 143, Indrianto, A., Barinova, I., Touraev, A., Heberle-Bors, E., Tracking individual wheat microspores in vitro: identification of embryogenic microspores and body axis formation in the embryo. Planta, 212, Islam, S.M.S., 2010a. Effect of embryoids age, size and shape for improvement of regeneration efficiency from microspore-derived embryos in wheat (Triticum aestivum L.). Plant Omics Journal, 3 (5),
120 Islam, S.M.S., 2010b. The effect of colchicine pretreatment on isolated microspore culture of wheat (Triticum aestivum L.). Australian Journal of Crop Science, 4 (9), J Aiti, F., El Jaafari, S., El Hadrami, I., Nachit, M., Baum, M., De Buyser, J., Picard, E., Problématique de la culture de microspores chez le blé dur Triticum turgidum L. var. durum. In: Durum wheat improvement in the Mediterranean region: New challenges. Instituto Agronómico Mediterráneo Zaragoza, pp Jähne, A., Lörz, H., Cereal microspore culture. Plant Science, 109, Jauhar, P.P., Haploid and doubled haploid production in durum wheat by anther culture. In: Doubled haploid production in crop plants: A manual. (Maluszynski, M., Kasha, K.J., Forster, B.P., Szarejko, I., -eds) Kluwer Academic Publishers, pp , Dordrecht. Jensen, C.J., Producing haploid plants by chromosome elimination. In: Cell and tissue culture techniques for cereal crop improvement. Science Press, pp , Beijing, China. Jia, X., Zhuang, J., Hu, S., Ye, C., Nie, D., Establishment and application of the medium of anther culture of intergeneric hybrids of Triticum aestivum x Triticum-Agropyron. Scientia Agricultura Sinica, 27, Kasha, K.J., Ziauddin, A., Cho, U.H., Haploids in cereal improvelnent: anther and microspore culture. In: Gene manipulation in plant improvement. (Gustafson, J.P., -ed) II. New York Plenum Press, pp Kasha, K.J., Simion, E., Oro, R., Yao, Q.A., Hu, T.C., Carlson, A.R., An improved in vitro technique for isolated microspore culture of barley. Euphytica, 120, Kasha, K.J., Simion, E., Miner, M., Letarte, J., Hu, T.C., Haploid wheat isolated microspore culture protocol. In: Doubled haploid production in crop plants: A manual. (Maluszynski, M., Kasha, K.J., Forster, B.P., Szarejko, I., - eds.) Kluwer Academic Publishers, pp , Dordrecht. Kınacı, E., Cumhuriyetten bugüne makarnalık buğday araştırmaları ve gelişmeler. Makarnalık Buğday ve Mamülleri Sempozyumu, 30 Kasım-3 Aralık, Ankara. Kimber, G., Feldman, M., Wild Wheat. An Introduction. Special Report 353. College of Agriculture, University of Missouri, Columbia. Konzak, C.F., Polle, E., Liu, W., Zheng, Y.M., Methods for generating doubled haploid plants. US Patent No: 6,362,393 B1. 108
121 Köhler, F., Wenzel, G., Regeneration of isolated barley microspores in conditioned media and trials to characterize the responsible factor. Journal of Plant Physiology, 121, Kyo, M., Harada. H., Control of the developmental pathway of tobacco pollen in vitro. Planta, 168, Labbani, Z., Richard, N., De Buyser, J., Picard, E., Chlorophyllian durum wheat plants obtained by isolated microspores culture: importance of the pretreatments. Comptes Rendus Biologies, 328, Labbani, Z., De Buyser, J., Picard, E., Effect of mannitol pretreatment to improve green plant regeneration on isolated microspore culture in Triticum turgidum ssp. durum cv. Jennah Khetifa. Plant Breeding, 126 (6), Lantos, C., Parcisi, S., Zofajova, A., Weyen, J., Pauk, J., Isolated microspore culture of wheat (Triticum aestivum L.) with Hungarian cultivars. Acta Biologica Szegediensis, 50, Letarte, J., Simion, E., Miner, M., Kasha, K.J., Arabinogalactans and arabinogalactan-proteins induce embryogenesis in wheat (Triticum aestivum L.) microspore culture. Plant Cell Reports, 24, Li, H., Devaux, P., Enhancement of microspore culture efficiency of recalcitrant barley genotypes. Plant Cell Reports, 20, Li, H., Devaux, P., Isolated microspore culture overperforms anther culture for green plant regeneration in barley (Hordeum vulgare L.). Acta Physiologiae Plantarum, 27, Lichter, R., Induction of haploid plants from isolated pollen of Brassica napus. Zeitschrift für Pflanzenphysiologie, 105, Liu, W., Zheng, M.Y., Polle, E.A., Konzak, C.F., 2002a. Highly efficient doubledhaploid production in wheat (Triticum aestivum L.) via induced micropsore embryogenesis. Crop Science, 42, Liu, W., Zheng, M.Y., Konzak, C.F., 2002b. Improving green plant production via isolated microspore culture in bread wheat (Triticum aestivum L.). Plant Cell Reports, 20, Lu, R., Wang, Y., Sun, Y., Shan, L., Chen, P., Huang, J., Improvement of isolated microspore culture of barley (Hordeum vulgare L.): the effect of floret co-culture. Plant Cell, Tissue and Organ Culture, 93, Luckett, D., Venkatanagappa, S., Darvey, N., Smithard, R., Anther culture of Australian wheat germplasm using modified C17 medium and membrane rafts. Australian Journal of Plant Physiology, 18,
122 Maluszynski, M., Kasha, K.J., Forster, B.P., Szarejko, I., Doubled Haploid Production in Crop Plants. Kluwer Academic Publishers, 428p. Dordrecht, Boston/London. Mejza, S.J., Morgant, V., DiBona, D., Wong, J.R., Plant regeneration from isolated microspores of Triticum aestivum. Plant Cell Reports, 12, Mentewab, A., Sarrafi, A., Influence of genotype and cold pre-treatment on the production of embryoids and their regeneration in tetraploid and hexaploid wheats. Journal of Genetics and Breeding, 51, Miyoshi, K., Callus induction and plantlet formation through culture of isolated microspores of eggplant (Solanum melongena L.). Plant Cell Reports, 15 (6), Murashige, T., Skoog, F., A revised medium for rapid growth and bioassays with tobacco tissue culture. Physiologia Plantarum, 15, Nitsch, C., Norreel, K., Effect d un choc thermique sur le pouvoir embryogene du pollen de Datura innoxia cultive dans l anthere ou isole de l anthere. Academia Sciences, 276, Nitsch, C., La culture de pollen isole sur milieu synthetique. Academia Sciences, 278, Oleszczuk, S., Sowa, S., Zimny, J., Androgenic response to preculture stress in microspore cultures of barley. Protoplasma, 228, Otani, M., Shimada, T., Effect of synthetic medium on microspore-derived embryoid formation of tetraploid wheat species. Cereal Research Communications, 23, Paksoy, M., Ellialtıoğlu, Ş., Sarı, N., Abak, K., Bazı Brassica sp. türlerinde anter kültürüne etki eden faktörler üzerinde araştırmalar. Doğa Türk Botanik Dergisi, 19, Patel, M., Darvey, N.L., Marshall, D.R., Berry, J.O., Optimization of culture conditions for improved plant regeneration efficiency from wheat microspore culture. Euphytica, 140, Pesticelli, S.M., Mitchell, J.C., Jones, A.M., Pareddy, D.R., Petolini, J.F., High frequency androgenesis from isolated microspore of maize. Plant Cell Reports, 7, Pierik, R.L.M., In vitro culture of higher plants. Marthinus Nijhoff Publishers, p. 344, Dordrecht, Boston, Lanchaster. 110
123 Poehlman, L., Sleeper, J., The effect of Rht genes on grain protein durum wheat. Crop Science, 23 (3), Puolimatka, M., Laine, S., Pauk, J., Effect of ovary co-cultivation and culture medium on embryogenesis of directly isolated microspores of wheat. Cereal Research Communications, 24, Reinert, J., Bajaj, Y.P.S., Anther Culture. In: Haploid production and its significance. (Reinert, J., Bajaj, Y.P.S., -eds) Plant Cell, Tissue and Organ Culture. Springer Verlag, pp , New York. Reynolds, T.L., A cytological analysis of microspores of Triticum aestivum (Poaceae) during normal ontogeny and induced embryogenic development. American Journal of Botany, 80 (5), Reynolds, T.L., Pollen embryogenesis. Plant Molecular Biology, 33, Ritala, A., Mannonen, L., Oksman-Caldentey, K.M., Factors affecting the regeneration capacity of isolated barley microspores (Hordeum vulgare L.). Plant Cell Reports, 20, Roberts-Oehlschlager, S.L., Dunwell, J.M., Barley anther culture: Pretreatment on mannitol stimulates production of microspore-derived embryos. Plant Cell, Tissue and Organ Culture, 20, Rudolf, K., Bohanec, B., Hansen, M., Microspore culture of white cabbabe, Brassica oleracea var. capitata L.: Genetic improvement of non-responsive cultivars and effect of genome doubling agents. Plant Breeding, 118, Saidi, N., Cherkaoui, S., Chlyah, A., Chlyah, H., Embryo formation and regeneration in Triticum turgidum ssp. durum anther culture. Plant Cell, Tissue and Organ Culture, 51, Santra, M., Ankrah, N., von Wettstein, D., Kidwell, K.K., A high efficiency microspore culture technique for producing double haploid wheat plants. Plant & Animal Genomes XVI Conference, January, San Diego, CA. Savaşkan, Ç., Ellerbrook, C., Fish, L.J., Snape, J.W., Doubled haploid production in Turkish durum wheats using crosses with maize. Plant Breeding, 116, Savaşkan, Ç., Şenay, A., Denli, E., Yerli makarnalık buğday çeşitlerimizden üretilen katlanmış diploid hatların kışlık ekimle kalitatif ve kantitatif özelliklerinin araştırılması. IV. Tarla Bitkileri Kongresi, Eylül, Tekirdağ,
124 Savaşkan, Ç., Akinci, C., Donmez, E., Keser, M., Yalvac, K., The relationships between the grain characters of Anatolian durum wheat genotypes. Tenth International Wheat Genetics Symposium, 1-6 September, Italy, Schmid, J.E., In vitro production of haploids in Triticum spelta. In: Biotechnology in Agriculture and Forestry. (Bajaj, Y.P.S., -eds) vol. 13, pp Segui-Simarro, J.M., Nuez, F., How microspores transform into haploid embryos: changes associated with embryogenesis induction and microsporederived embryogenesis. Physiologia Plantarum, 134, Shariatpanahi, M.E., Belogradova, K., Hessamvaziri, L., Heberle-Bors, E., Touraev, A., Efficient embryogenesis and regeneration in freshly isolated and cultured wheat (Triticum aestivum L.) microspores without stress pretreatment. Plant Cell Reports, 25, Shim, Y.S., Kasha, K.J., Simion, E., Letarte, J., The relationship between induction of embryogenesis and chromosome doubling in microspore cultures. Protoplasma, 228, Shirdelmoghanloo, H., Moieni, A., Mousavi, A., Effects of embryo induction media and pretreatments in isolated microspore culture of hexaploid wheat (Triticum aestivum L. cv. Falat). African Journal of Biotechnology, 8 (22), Soriano, M., Cistue, L., Valles, M.P., Castillo, A.M., Effects of colchicine on anther and microspore culture of bread wheat (Triticum aestivum L.). Plant, Cell, Tissue and Organ Culture, 91, Sönmez, F., Kıral, A.S., Bazı makarnalık buğday çeşitlerinin (T.durum Desf.) erbaa şartlarında adaptasyonlarının incelenmesi. GOÜ., Ziraat Fakültesi Dergisi, 21 (2), Szarejko, I., Major media composition. In: Doubled haploid production in crop plants: A manual. (Maluszynski, M., Kasha, K.J., Forster, B.P., Szarejko, I., - eds) Kluwer Academic Publishers, pp , Dordrecht. Torp, A.M., Hansen, A.L., Andersen, S.B., Chromosomal regions associated with green plant regeneration in wheat (Triticum aestivum L.) anther culture. Euphytica, 119, Touraev, A., Indrianto, A., Wratschko, I., Vicente, O., Heberle-Bors, E., Efficient microspore embryogenesis in wheat (Triticum aestivum L.) induced by starvation at high temperature. Sexual Plant Reproduction, 9,
125 Touraev, A., Vicente, O., Heberle-Bors, E., Initation of microspore embryogenesis by stres. Trends Plant science, 2, Touraev, A., Prosser, M., Heberle-Bers, E., The microspore: a haploid multipurpose cell. Advances in Botanical Research, 35, Touraev, A., Forster, B.P., Jain, S.M., Advances in haploid production in higher plants. Springer, 348p. Berlin. Tuvesson, S., Ljungberg, A., Johansson, N., Karlsson, K.E., Suijs, L.W., Josset, J.P., Large-scale production of wheat and triticale double haploids through the use of a single-anther culture method. Plant Breeding, 119, Uhrig, H., Genetic selection and liquid medium conditions improve the yield of androgenetic plants from diploid potatoes. Theoretical and Applied Genetics, 71, Vicente, O., Benito-Moreno, R.M., Heberle-Bors, E., Pollen cultures as a tool to study plant development. Cell Biology Reverse, 25, Wang, P., Chen, Y.R., A study on the application of C17 medium for anther culture. Acta Botanica Sinica, 28, Wojnarowiez, G., Caredda, S., Devaux, P., Sangwan, R., Cle ment, C., Barley anther culture: assessment of carbohydrate effects on embryo yield, green plant production and differential plastid development in relation with albinism. Journal of Plant Physiology, 161, Zhang, Y.L., Li, D.S., Anther culture of monosomics in Triticum aestivum. Hereditas, 6, Zheng, M.Y., Liu, W., Weng, Y., Polle, E., Konzak, C.F., Culture of freshly isolated wheat (Triticum aestivum L.) microspores treated with inducer chemicals. Plant Cell Reports, 20, Zheng, M.Y., Weng, Y., Liu, W., Konzak, C.F., The effect of ovaryconditioned medium on microspore embryogenesis in common wheat (Triticum aestivum L.). Plant Cell Reports, 20, Zheng, M.Y., Microspore culture in wheat (Triticum aestivum) doubled haploid production via induced embryogenesis. Plant Cell, Tissue and Organ Culture, 73, Zhuang, J.J., Xu, J., Increasing differentation frequencies in wheat pollen callus. In: Cell and tissue culture techniques for cereal crop improvement. (Hu, H., Vega, M.R., -eds) Science Press, p. 431, Beijing. 113
126 Ziauddin, A., Marsolais, A., Simion, E., Kasha, K.J., Improved plant regeneration from wheat anther and barley microspore culture using phenyl acetic acid (PAA). Plant Cell Reports, 11, Zoriniants, S., Tashpulatov, A.S., Heberle-Bors, E., Touraev, A., The role of stress in the induction of haploid embryogenesis. In: Haploids in crop improvement II. Biotechnology in agriculture and forestry. (Palmer, C.E., Keller, W.A., Kasha, K.J., -eds) Springer, pp , Berlin, Heidelberg, New York. 114
127 ÖZGEÇMİŞ Adı Soyadı : Yasemin COŞKUN Doğum Yeri ve Yılı: Willich / ALMANYA 1980 Medeni Hali : Bekâr Yabancı Dili : İngilizce ve Almanca Eğitim Durumu (Kurum ve Yıl) Lise : Isparta Anadolu Lisesi ( ) Lisans : Dokuz Eylül Üniversitesi, Buca Eğitim Fakültesi, Biyoloji Öğretmenliği ( ) Yüksek Lisans : Süleyman Demirel Üniversitesi, Biyoloji Anabilim Dalı ( ) Çalıştığı Kurum/Kurumlar ve Yıl: Süleyman Demirel Üniversitesi, Fen-Edebiyat Fakültesi, Biyoloji Bölümü (Araştırma Görevlisi, 2006-devam ediyor) Yayınları (SCI ve diğer makaleler) 1. Coşkun, Y., Duran, R.E., Savaşkan, Ç., Influential effects of arabinogalactan-proteins on plant regeneration using calli derived from wheat mature embryos. African Journal of Agricultural Research, 5 (17), Duran, R.E., Coşkun, Y., Savaşkan, Ç., Tuzun makarnalık buğday genotiplerinde (Triticum durum Desf.) bazı kalitatif ve kantitatif özellikler üzerine etkisi. Süleyman Demirel Üniversitesi, Fen Bilimleri Enstitüsü Dergisi, 14 (1), Savaşkan, Ç., Coşkun, Y., Bitki Embriyolojisi Uygulama Kılavuzu. ISBN: , Süleyman Demirel Üniversitesi Yayınları, Yayın No:81, Isparta. 4. Savaşkan, Ç., Coşkun, Y. ve Duran, R.E., Mikroteknik Ders Notları ve Uygulama Kılavuzu. ISBN: , Süleyman Demirel Üniversitesi Yayınları, Yayın No:84, Isparta. 115
SOMATİK EMBRİYOGENESİS
 4.DERS EMBRİYO KÜLTÜRÜ Bitkilerin tohumlarından ya da tohum taslaklarından embriyoların aseptik koşullarda izole edilerek yapay besin ortamları üzerinde kültüre alındığı in vitro tekniktir. Embriyo kültürü
4.DERS EMBRİYO KÜLTÜRÜ Bitkilerin tohumlarından ya da tohum taslaklarından embriyoların aseptik koşullarda izole edilerek yapay besin ortamları üzerinde kültüre alındığı in vitro tekniktir. Embriyo kültürü
TARIMSAL BİYOTEKNOLOJİYE GİRİŞ
 TARIMSAL BİYOTEKNOLOJİYE GİRİŞ Bitki Doku Kültürü Adnan Menderes Üniversitesi Tarımsal Biyoteknoloji Bölümü TB101 Çiğdem Yamaner (Yrd. Doç. Dr.) 4. Hafta (08.10.2013) ADÜ Tarımsal Biyoteknoloji Bölümü
TARIMSAL BİYOTEKNOLOJİYE GİRİŞ Bitki Doku Kültürü Adnan Menderes Üniversitesi Tarımsal Biyoteknoloji Bölümü TB101 Çiğdem Yamaner (Yrd. Doç. Dr.) 4. Hafta (08.10.2013) ADÜ Tarımsal Biyoteknoloji Bölümü
HAPLOİD BİTKİ ÜRETİMİ. Doç.Dr. Yıldız AKA KAÇAR
 HAPLOİD BİTKİ ÜRETİMİ Doç.Dr. Yıldız AKA KAÇAR Somatik hücrelerindeki kromozom sayısı, ait oldukları bitki türünün gamet hücrelerinde bulunan kromozom sayısı kadar olan bitkilere haploid bitkiler denmektedir.
HAPLOİD BİTKİ ÜRETİMİ Doç.Dr. Yıldız AKA KAÇAR Somatik hücrelerindeki kromozom sayısı, ait oldukları bitki türünün gamet hücrelerinde bulunan kromozom sayısı kadar olan bitkilere haploid bitkiler denmektedir.
T.C. SÜLEYMAN DEMİREL ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ
 T.C. SÜLEYMAN DEMİREL ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ HEKSAPLOİD (EKMEKLİK) BUĞDAY (Triticum aestivum L.) BİTKİSİNDE ANDROGENEZ İLE KALLUS ÜRETİMİ VE BİTKİ REGENERASYONU Tunhan DEMİRCİ Danışman: Prof.
T.C. SÜLEYMAN DEMİREL ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ HEKSAPLOİD (EKMEKLİK) BUĞDAY (Triticum aestivum L.) BİTKİSİNDE ANDROGENEZ İLE KALLUS ÜRETİMİ VE BİTKİ REGENERASYONU Tunhan DEMİRCİ Danışman: Prof.
TR0100017 BUĞDAY x MISIR MELEZLEMESİ İLE DURUM BUĞDAYDA HAPLOİD EMBRİYO ÜRETİMİ
 TR117 BUĞDAY x MISIR MELEZLEMESİ İLE DURUM BUĞDAYDA HAPLOİD EMBRİYO ÜRETİMİ SAVAŞKAN Ç.,* ELLERBROOK C.,** FISH L.J.** SNAPE J.W." Nükleer Araştırma ve Eğitim Merkezi, 615, Saray, Ankara. * John Innes
TR117 BUĞDAY x MISIR MELEZLEMESİ İLE DURUM BUĞDAYDA HAPLOİD EMBRİYO ÜRETİMİ SAVAŞKAN Ç.,* ELLERBROOK C.,** FISH L.J.** SNAPE J.W." Nükleer Araştırma ve Eğitim Merkezi, 615, Saray, Ankara. * John Innes
YAZILIYA HAZIRLIK TEST SORULARI. 10. Sınıf
 YAZILIYA HAZIRLIK TEST SORULARI 10. Sınıf 1) Hücre döngüsünün interfaz evresini yeni tamamlamış bir hücre ile bu hücrenin döngü sonunda oluşturduğu yeni hücrelerde; I. DNA miktarı II. Gen Sayısı III. Gen
YAZILIYA HAZIRLIK TEST SORULARI 10. Sınıf 1) Hücre döngüsünün interfaz evresini yeni tamamlamış bir hücre ile bu hücrenin döngü sonunda oluşturduğu yeni hücrelerde; I. DNA miktarı II. Gen Sayısı III. Gen
Doç.Dr. Yıldız AKA KAÇAR
 Doç.Dr. Yıldız AKA KAÇAR Selülozik yapıdaki hücre çeperleri, mekanik ya da enzimatik yollarla çıkarılmış olan hücrelere protoplast denilmektedir. Protoplast kültürü ise, izole edilen Protoplast kültürü
Doç.Dr. Yıldız AKA KAÇAR Selülozik yapıdaki hücre çeperleri, mekanik ya da enzimatik yollarla çıkarılmış olan hücrelere protoplast denilmektedir. Protoplast kültürü ise, izole edilen Protoplast kültürü
BİYOLOJİ VE BİLİMSEL YÖNTEM... 1 Bilim ve Bilimsel Yöntem... 2
 İÇİNDEKİLER Sayfa BİYOLOJİ VE BİLİMSEL YÖNTEM... 1 Bilim ve Bilimsel Yöntem... 2 CANLILARIN OLUŞUMU... 5 CANLILARIN ORTAK ÖZELLİKLERİ... 9 CANLILARIN SINIFLANDIRILMASI... 11 SİSTEMATİK... 13 BİTKİ VE HAYVANLARIN
İÇİNDEKİLER Sayfa BİYOLOJİ VE BİLİMSEL YÖNTEM... 1 Bilim ve Bilimsel Yöntem... 2 CANLILARIN OLUŞUMU... 5 CANLILARIN ORTAK ÖZELLİKLERİ... 9 CANLILARIN SINIFLANDIRILMASI... 11 SİSTEMATİK... 13 BİTKİ VE HAYVANLARIN
22.04.2015 MBG 112 BİYOLOJİ II BİTKİLERDE ÜREME VE BİYOTEKNOLOJİ YRD. DOÇ. DR. YELDA ÖZDEN. Döl almaşı
 MBG 112 BİYOLOJİ II BİTKİLERDE ÜREME VE BİYOTEKNOLOJİ YRD. DOÇ. DR. YELDA ÖZDEN Döl almaşı Angiospermlerde; Baskın döl sporofit, Gametofit indirgenmiş, Sporofit üreme yapısı olan çiçeği oluşturur. Ovaryum
MBG 112 BİYOLOJİ II BİTKİLERDE ÜREME VE BİYOTEKNOLOJİ YRD. DOÇ. DR. YELDA ÖZDEN Döl almaşı Angiospermlerde; Baskın döl sporofit, Gametofit indirgenmiş, Sporofit üreme yapısı olan çiçeği oluşturur. Ovaryum
BİTKİLERDE DOKU KÜLTÜRÜ DERSİ SOMAKLONAL VARYASYON KONUSU İLE İLGİLİ SORULAR Gizem TERZİ
 BİTKİLERDE DOKU KÜLTÜRÜ DERSİ SOMAKLONAL VARYASYON KONUSU İLE İLGİLİ SORULAR Gizem TERZİ 1) İn vitro kültür sırasında ortaya çıkan ve rejenere olan bitkilerde gözlenen değişiklikler Somaklonal Varyasyon
BİTKİLERDE DOKU KÜLTÜRÜ DERSİ SOMAKLONAL VARYASYON KONUSU İLE İLGİLİ SORULAR Gizem TERZİ 1) İn vitro kültür sırasında ortaya çıkan ve rejenere olan bitkilerde gözlenen değişiklikler Somaklonal Varyasyon
Sayfa BİYOLOJİ VE BİLİMSEL YÖNTEM... 1 Bilim ve Bilimsel Yöntem... 2
 İÇİNDEKİLER Sayfa BİYOLOJİ VE BİLİMSEL YÖNTEM... 1 Bilim ve Bilimsel Yöntem... 2 CANLILARIN OLUŞUMU... 6 CANLILARIN ORTAK ÖZELLİKLERİ... 11 CANLILARIN SINIFLANDIRILMASI... 13 SİSTEMATİK... 34 BİTKİ VE
İÇİNDEKİLER Sayfa BİYOLOJİ VE BİLİMSEL YÖNTEM... 1 Bilim ve Bilimsel Yöntem... 2 CANLILARIN OLUŞUMU... 6 CANLILARIN ORTAK ÖZELLİKLERİ... 11 CANLILARIN SINIFLANDIRILMASI... 13 SİSTEMATİK... 34 BİTKİ VE
FARKLI KÜLTÜR ORTAMLARININ VE OKSİNLERİN TETRAPLOİD BUĞDAYDA (Triticum durum Desf.) HAPLOİD EMBRİYO ÜRETİMİNE VE BİTKİ REGENERASYONUNA ETKİSİ
 FARKLI KÜLTÜR ORTAMLARININ VE OKSİNLERİN TETRAPLOİD BUĞDAYDA (Triticum durum Desf.) HAPLOİD EMBRİYO ÜRETİMİNE VE BİTKİ REGENERASYONUNA ETKİSİ Yasemin COŞKUN YÜKSEK LİSANS TEZİ BİYOLOJİ ANABİLİM DALI ISPARTA
FARKLI KÜLTÜR ORTAMLARININ VE OKSİNLERİN TETRAPLOİD BUĞDAYDA (Triticum durum Desf.) HAPLOİD EMBRİYO ÜRETİMİNE VE BİTKİ REGENERASYONUNA ETKİSİ Yasemin COŞKUN YÜKSEK LİSANS TEZİ BİYOLOJİ ANABİLİM DALI ISPARTA
Doğal koşullarda poliploid bitkilerin ortaya çıkması mümkündür, ancak bunların oluşum frekansı düşüktür.
 POLİPLOİDİ ISLAHI Bir canlı türünde genom olarak bilenen temel kromozom sayısı x ile gösterilir. Gamet hücrelerinde kromozom sayısı n=x tir. Bu kromozom sayısı seviyesine haploid veya monoploid adı verilmektedir.
POLİPLOİDİ ISLAHI Bir canlı türünde genom olarak bilenen temel kromozom sayısı x ile gösterilir. Gamet hücrelerinde kromozom sayısı n=x tir. Bu kromozom sayısı seviyesine haploid veya monoploid adı verilmektedir.
Mendel Genetiği, Kalıtım, Gen Mühendisliği ve Biyoteknoloji
 Mendel Genetiği, Kalıtım, Gen Mühendisliği ve Biyoteknoloji MENDEL GENETİĞİ Ebeveyn (ana-baba) ile oğul bireyler arasındaki benzerlik ve farklılıkların nasıl veya hangi oranlarda ortaya çıkabileceğini
Mendel Genetiği, Kalıtım, Gen Mühendisliği ve Biyoteknoloji MENDEL GENETİĞİ Ebeveyn (ana-baba) ile oğul bireyler arasındaki benzerlik ve farklılıkların nasıl veya hangi oranlarda ortaya çıkabileceğini
FEN ve TEKNOLOJİ / KALITIM KALITIM İLE İLGİLİ KAVRAMLAR
 KALITIM İLE İLGİLİ KAVRAMLAR 1 Kalıtım : Bir canlının sahip olduğu özelliklerin nesilden nesile aktarılması olayına kalıtım denir. Genetik: Canlı soyları arasındaki benzerlik ve farklılıkların ortaya çıkmasını
KALITIM İLE İLGİLİ KAVRAMLAR 1 Kalıtım : Bir canlının sahip olduğu özelliklerin nesilden nesile aktarılması olayına kalıtım denir. Genetik: Canlı soyları arasındaki benzerlik ve farklılıkların ortaya çıkmasını
GENETİK I BİY 301 DERS 7
 GENETİK I BİY 301 DERS 7 İçerik Kısım 1: Genler, Kromozomlar ve Kalıtım Kısım 2: DNA-Yapısı, Replikasyonu ve Varyasyonu Kısım 3: Genetik bilginin ifadesi ve düzenlenmesi Kısım 4: Genomik Analiz Kısım 5:
GENETİK I BİY 301 DERS 7 İçerik Kısım 1: Genler, Kromozomlar ve Kalıtım Kısım 2: DNA-Yapısı, Replikasyonu ve Varyasyonu Kısım 3: Genetik bilginin ifadesi ve düzenlenmesi Kısım 4: Genomik Analiz Kısım 5:
UYGULAMA KONUSU SÜRESİ BAŞLAMA TARİHİ BİTİŞ TARİHİ EĞTĞİMİN YAPILACAĞI YER 1 Doubled Haploid Çalışmaları
 TARLA BİTKİLERİ MERKEZ ARAŞTIRMA ENSTİTÜSÜ BİTKİ ISLAHI KURSU UYGULAMALI EĞİTİM PROGRAMI (2017) Sıra No UYGULAMA KONUSU SÜRESİ BAŞLAMA TARİHİ BİTİŞ TARİHİ EĞTĞİMİN YAPILACAĞI YER 1 Doubled Haploid Çalışmaları
TARLA BİTKİLERİ MERKEZ ARAŞTIRMA ENSTİTÜSÜ BİTKİ ISLAHI KURSU UYGULAMALI EĞİTİM PROGRAMI (2017) Sıra No UYGULAMA KONUSU SÜRESİ BAŞLAMA TARİHİ BİTİŞ TARİHİ EĞTĞİMİN YAPILACAĞI YER 1 Doubled Haploid Çalışmaları
ADIM ADIM YGS LYS. 91. Adım KALITIM -17 GENETİK VARYASYON MUTASYON MODİFİKASYON ADAPTASYON - REKOMBİNASYON
 ADIM ADIM YGS LYS 91. Adım KALITIM -17 GENETİK VARYASYON MUTASYON MODİFİKASYON ADAPTASYON - REKOMBİNASYON GENETİK VARYASYON Aynı türün bireyleri arasındaki farklılığa VARYASYON denir. Varyasyonların hepsi
ADIM ADIM YGS LYS 91. Adım KALITIM -17 GENETİK VARYASYON MUTASYON MODİFİKASYON ADAPTASYON - REKOMBİNASYON GENETİK VARYASYON Aynı türün bireyleri arasındaki farklılığa VARYASYON denir. Varyasyonların hepsi
KALITIM-2 MENDEL İN ÇALIŞMALARI SELİN HOCAYLA BİYOLOJİ DERSLERİ
 KALITIM-2 MENDEL İN ÇALIŞMALARI SELİN HOCAYLA BİYOLOJİ DERSLERİ Gregor MENDEL kalıtımın esaslarını belirleyen bilim adamıdır. Kalıtımın kurucusu olarak bilinir.yaptığı çalışmalar MENDEL KANUNLARI adını
KALITIM-2 MENDEL İN ÇALIŞMALARI SELİN HOCAYLA BİYOLOJİ DERSLERİ Gregor MENDEL kalıtımın esaslarını belirleyen bilim adamıdır. Kalıtımın kurucusu olarak bilinir.yaptığı çalışmalar MENDEL KANUNLARI adını
CANLILARDA ÜREME. Üreme canlıların ortak özelliğidir. Her canlının kendine benzer canlı meydana getirebilmesi üreme ile gerçekleşir
 CANLILARDA ÜREME EYLÜL 3.HAFTA MİTOZ VE EŞEYSİZ ÜREME Her canlının kendine benzer canlı meydana getirebilmesi üreme ile gerçekleşir Üreme canlıların ortak özelliğidir 3 4 Canlılar hücrelerden meydana gelir
CANLILARDA ÜREME EYLÜL 3.HAFTA MİTOZ VE EŞEYSİZ ÜREME Her canlının kendine benzer canlı meydana getirebilmesi üreme ile gerçekleşir Üreme canlıların ortak özelliğidir 3 4 Canlılar hücrelerden meydana gelir
Mayoz Bölünmenin Oluşumu
 MAYOZ BÖLÜNME NEDİR? 03 Ocak 2012, 23:39 Osman BEDEL MAYOZ BÖLÜNME NEDİR? Kromozom sayılarının nesiller boyu sabit tutulması mayoz bölünme ile sağlanır. Mayoz özel bir hücre bölünmesidir. Bu bölünme ile
MAYOZ BÖLÜNME NEDİR? 03 Ocak 2012, 23:39 Osman BEDEL MAYOZ BÖLÜNME NEDİR? Kromozom sayılarının nesiller boyu sabit tutulması mayoz bölünme ile sağlanır. Mayoz özel bir hücre bölünmesidir. Bu bölünme ile
BİTKİ DOKU KÜLTÜRLERİ. Yrd. Doç. Dr. Hüseyin UYSAL ADNAN MENDERES ÜNİVERSİTESİ ZİRAAT FAKÜLTESİ TARIMSAL BİYOTEKNOLOJİ BÖLÜMÜ 2.
 BİTKİ DOKU KÜLTÜRLERİ Yrd. Doç. Dr. Hüseyin UYSAL ADNAN MENDERES ÜNİVERSİTESİ ZİRAAT FAKÜLTESİ TARIMSAL BİYOTEKNOLOJİ BÖLÜMÜ 2. Ders İN VİTRO KÜLTÜR ESASLARI* *Bitki Biyoteknolojisi, Rüştü Hatipoğlu, Adana,
BİTKİ DOKU KÜLTÜRLERİ Yrd. Doç. Dr. Hüseyin UYSAL ADNAN MENDERES ÜNİVERSİTESİ ZİRAAT FAKÜLTESİ TARIMSAL BİYOTEKNOLOJİ BÖLÜMÜ 2. Ders İN VİTRO KÜLTÜR ESASLARI* *Bitki Biyoteknolojisi, Rüştü Hatipoğlu, Adana,
YGS YE HAZIRLIK DENEMESi #4
 YGS YE HAZIRLIK DENEMESi #4 1) Bir hücrenin X maddesini difüzyonla almakta olduğu görülmüştür. Bu hücre ve içerisinde bulunduğu ortamla ilgili, I. Ortamdaki X yoğunluğu hücreden daha fazladır. II. X in
YGS YE HAZIRLIK DENEMESi #4 1) Bir hücrenin X maddesini difüzyonla almakta olduğu görülmüştür. Bu hücre ve içerisinde bulunduğu ortamla ilgili, I. Ortamdaki X yoğunluğu hücreden daha fazladır. II. X in
HÜCRE BÖLÜNMESİ A) MİTOZ BÖLÜNME a) Hazırlık evresi:
 HÜCRE BÖLÜNMESİ Hücre bölünmesi tüm canlılarda görülen ortak bir özelliktir. Hücre büyüyüp gelişirken madde ve enerji gereksinimleri artar. Sitoplâzma hücre zarına oranla daha hızlı büyümesinden dolayı,
HÜCRE BÖLÜNMESİ Hücre bölünmesi tüm canlılarda görülen ortak bir özelliktir. Hücre büyüyüp gelişirken madde ve enerji gereksinimleri artar. Sitoplâzma hücre zarına oranla daha hızlı büyümesinden dolayı,
İnce çeperli parankima hücrelerinin kitlesel yapısı. Kallus
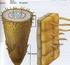 İnce çeperli parankima hücrelerinin kitlesel yapısı Kallus Kallus oluşumu Köklerde ve gövdede yaralı bölgede kallus oluşur.. Kallus oluşumu: Erythrina ağacı Yapraktan kallus oluşumu Vaskular dokudan kallus
İnce çeperli parankima hücrelerinin kitlesel yapısı Kallus Kallus oluşumu Köklerde ve gövdede yaralı bölgede kallus oluşur.. Kallus oluşumu: Erythrina ağacı Yapraktan kallus oluşumu Vaskular dokudan kallus
T.C. SELÇUK ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ
 T.C. SELÇUK ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ BAZI ARPA GENOTİPLERİNDE DOKU KÜLTÜRÜ UYGULAMALARI İLE HAPLOİD BİTKİ ÜRETİMİNİN VE EMBRİYO KÜLTÜRÜNÜN ARAŞTIRILMASI Münüre TANUR ERKOYUNCU YÜKSEK LİSANS
T.C. SELÇUK ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ BAZI ARPA GENOTİPLERİNDE DOKU KÜLTÜRÜ UYGULAMALARI İLE HAPLOİD BİTKİ ÜRETİMİNİN VE EMBRİYO KÜLTÜRÜNÜN ARAŞTIRILMASI Münüre TANUR ERKOYUNCU YÜKSEK LİSANS
Dicle Üniversitesi Fen Bilimleri Enstitüsü Dergisi
 DUFED 6 (3) (2017) 130-136 Dicle Üniversitesi Fen Bilimleri Enstitüsü Dergisi dergi anasayfa: http://www.dufed.org Farklı pamuk çeşitlerinde anter kültürü tekniğiyle kallustan embriyoid elde edilmesi Embriyoid
DUFED 6 (3) (2017) 130-136 Dicle Üniversitesi Fen Bilimleri Enstitüsü Dergisi dergi anasayfa: http://www.dufed.org Farklı pamuk çeşitlerinde anter kültürü tekniğiyle kallustan embriyoid elde edilmesi Embriyoid
Aşağıda mitoz bölünme safhaları karışık olarak verilmiştir.
 2015/2016 EĞİTİM ÖĞRETİM YILI FEN VE TEKNOLOJİ DERSİ ÖRNEK 8.SINIFLAR 1.DÖNEM 1.YAZILI Adı Soyadı : No: Sınıf: Resimdeki türlerin bazı hücrelerindeki kromozom sayılarını yazınız. (4x2p) Aşağıda mitoz bölünme
2015/2016 EĞİTİM ÖĞRETİM YILI FEN VE TEKNOLOJİ DERSİ ÖRNEK 8.SINIFLAR 1.DÖNEM 1.YAZILI Adı Soyadı : No: Sınıf: Resimdeki türlerin bazı hücrelerindeki kromozom sayılarını yazınız. (4x2p) Aşağıda mitoz bölünme
Konu: Mitoz Bölünme ve Eşeysiz Üreme
 Konu: Mitoz Bölünme ve Eşeysiz Üreme Hücre bölünmesi tüm canlılarda görülen ortak bir özelliktir. Hücre büyüyüp gelişirken madde ve enerji gereksinimleri artar. Sitoplâzma hücre zarına oranla daha hızlı
Konu: Mitoz Bölünme ve Eşeysiz Üreme Hücre bölünmesi tüm canlılarda görülen ortak bir özelliktir. Hücre büyüyüp gelişirken madde ve enerji gereksinimleri artar. Sitoplâzma hücre zarına oranla daha hızlı
Tarımsal Araştırmalar Genel Müdürlüğü. Tohum, Çeşit ve Islah Çalışmaları
 Tarımsal Araştırmalar Genel Müdürlüğü Tohum, Çeşit ve Islah Çalışmaları Doç. Dr. Masum BURAK Genel Müdür Buğday, Lisanslı Depoculuk ve Vadeli İşlemler Kongresi, 12 Mart 2011, Antalya Tohum, Çeşit ve Islah
Tarımsal Araştırmalar Genel Müdürlüğü Tohum, Çeşit ve Islah Çalışmaları Doç. Dr. Masum BURAK Genel Müdür Buğday, Lisanslı Depoculuk ve Vadeli İşlemler Kongresi, 12 Mart 2011, Antalya Tohum, Çeşit ve Islah
YGS YE HAZIRLIK DENEMESi #5
 YGS YE HAZIRLIK DENEMESi #5 Miktar 1) I.Hemoglobinin yapısındaki karbon atomu sayısını tespit etmek II. Solunumda kullanılacak gazların hangi molekülle taşınacağını tespit etmek III. Kanın ph ını tespit
YGS YE HAZIRLIK DENEMESi #5 Miktar 1) I.Hemoglobinin yapısındaki karbon atomu sayısını tespit etmek II. Solunumda kullanılacak gazların hangi molekülle taşınacağını tespit etmek III. Kanın ph ını tespit
Canlılarda mitoz, amitoz ve mayoz olmak üzere üç çeşit bölünme görülür.
 HÜCRE BÖLÜNMELERİ Canlılarda mitoz, amitoz ve mayoz olmak üzere üç çeşit bölünme görülür. I. MİTOZ BÖLÜNME Mitoz bölünme tek hücreli canlılardan, çok hücreli canlılara ve insana kadar bir çok canlı grubu
HÜCRE BÖLÜNMELERİ Canlılarda mitoz, amitoz ve mayoz olmak üzere üç çeşit bölünme görülür. I. MİTOZ BÖLÜNME Mitoz bölünme tek hücreli canlılardan, çok hücreli canlılara ve insana kadar bir çok canlı grubu
Stres Koşulları ve Bitkilerin Tepkisi
 Stres Koşulları ve Bitkilerin Tepkisi Stres nedir? Olumsuz koşullara karşı canlıların vermiş oldukları tepkiye stres denir. Olumsuz çevre koşulları bitkilerde strese neden olur. «Biyolojik Stres»: Yetişme
Stres Koşulları ve Bitkilerin Tepkisi Stres nedir? Olumsuz koşullara karşı canlıların vermiş oldukları tepkiye stres denir. Olumsuz çevre koşulları bitkilerde strese neden olur. «Biyolojik Stres»: Yetişme
B unl a r ı B i l i yor mus unuz? MİTOZ. Canlının en küçük yapı biriminin hücre olduğunu 6. sınıfta öğrenmiştik. Hücreler; hücre zarı,
 MİTOZ Canlının en küçük yapı biriminin hücre olduğunu 6. sınıfta öğrenmiştik. Hücreler; hücre zarı, sitoplazma ve çekirdekten meydana gelmiştir. Hücreler büyüme ve gelişme sonucunda belli bir olgunluğa
MİTOZ Canlının en küçük yapı biriminin hücre olduğunu 6. sınıfta öğrenmiştik. Hücreler; hücre zarı, sitoplazma ve çekirdekten meydana gelmiştir. Hücreler büyüme ve gelişme sonucunda belli bir olgunluğa
Asmada Tozlanma ve Döllenme Biyolojisi I- Megasporogenez ve Mikrosporogenez
 Asmada Tozlanma ve Döllenme Biyolojisi I- Megasporogenez ve Mikrosporogenez Asma polenleri 25-15 µm boyutlarında Çiçek tozu verimi: ort. 3500 adet/anter Birhan KUNTER Birhan KUNTER Çiçeklenme Sürme ile
Asmada Tozlanma ve Döllenme Biyolojisi I- Megasporogenez ve Mikrosporogenez Asma polenleri 25-15 µm boyutlarında Çiçek tozu verimi: ort. 3500 adet/anter Birhan KUNTER Birhan KUNTER Çiçeklenme Sürme ile
ÖZET. Yüksek Lisans Tezi. Đmge Đ. TOKBAY. Adnan Menderes Üniversitesi Fen Bilimleri Enstitüsü Tarla Bitkileri Anabilim Dalı
 iii ÖZET Yüksek Lisans Tezi AYDIN EKOLOJĐK KOŞULLARINDA FARKLI EKĐM ZAMANI VE SIRA ARALIĞININ ÇEMEN (Trigonella foenum-graecum L.) ĐN VERĐM VE KALĐTE ÖZELLĐKLERĐNE ETKĐSĐ Đmge Đ. TOKBAY Adnan Menderes
iii ÖZET Yüksek Lisans Tezi AYDIN EKOLOJĐK KOŞULLARINDA FARKLI EKĐM ZAMANI VE SIRA ARALIĞININ ÇEMEN (Trigonella foenum-graecum L.) ĐN VERĐM VE KALĐTE ÖZELLĐKLERĐNE ETKĐSĐ Đmge Đ. TOKBAY Adnan Menderes
Şekil 1. Mitoz bölünmenin profaz evresi.
 KONU 9. HÜCRE BÖLÜNMESİ MİTOZ BÖLÜNME Mitoz bölünme tek hücreli canlılardan, çok hücreli canlılara ve insana kadar birçok canlı grubu tarafından gerçekleştirilebilir. Mitoz bölünme sonunda bölünen hücrelerden
KONU 9. HÜCRE BÖLÜNMESİ MİTOZ BÖLÜNME Mitoz bölünme tek hücreli canlılardan, çok hücreli canlılara ve insana kadar birçok canlı grubu tarafından gerçekleştirilebilir. Mitoz bölünme sonunda bölünen hücrelerden
YAZILI SINAV CEVAP ANAHTARI BİYOLOJİ
 YAZILI SINAV CEVAP ANAHTARI BİYOLOJİ CEVAP 1: (TOPLAM 9 PUAN) 1.1: Eğer terleme ve su emilimi arasındaki ilişkide ortam sıcaklığının etkisini öğrenmek istiyorsa; deneyi aynı sayıda yaprağa sahip aynı tür
YAZILI SINAV CEVAP ANAHTARI BİYOLOJİ CEVAP 1: (TOPLAM 9 PUAN) 1.1: Eğer terleme ve su emilimi arasındaki ilişkide ortam sıcaklığının etkisini öğrenmek istiyorsa; deneyi aynı sayıda yaprağa sahip aynı tür
HÜCRE BÖLÜNMESİ VE KALITIM
 HÜCRE BÖLÜNMESİ VE KALITIM Mitoz Bölünme Hücreler neden mitoz bölünme geçirir? 1 Büyüme ve gelişme için 2 Yıpranan doku ve organların onarılması için 3 Eşeysiz üreyen canlılarda üremenin sağlanması için.
HÜCRE BÖLÜNMESİ VE KALITIM Mitoz Bölünme Hücreler neden mitoz bölünme geçirir? 1 Büyüme ve gelişme için 2 Yıpranan doku ve organların onarılması için 3 Eşeysiz üreyen canlılarda üremenin sağlanması için.
10. SINIF KONU ANLATIMI 12 EŞEYLİ VE EŞEYSİZ ÜREME SORU ÇÖZÜMÜ
 10. SINIF KONU ANLATIMI 12 EŞEYLİ VE EŞEYSİZ ÜREME SORU ÇÖZÜMÜ Eşeysiz Üreme ile ilgili, I. Canlının yararlı özelliklerinin korunmasını sağlar. II. Canlının değişen ortam koşullarına uyumunu artırır. III.
10. SINIF KONU ANLATIMI 12 EŞEYLİ VE EŞEYSİZ ÜREME SORU ÇÖZÜMÜ Eşeysiz Üreme ile ilgili, I. Canlının yararlı özelliklerinin korunmasını sağlar. II. Canlının değişen ortam koşullarına uyumunu artırır. III.
MAHMUT ASLAN - FEN BİLİMLERİ ÖĞRETMENİ
 1. Mayoz bölünme aşağıda verilenlerden hangisinde gerçekleşebilir? A) B) Yumurta Polen ana C) D) Mide Deri 4. Üreme ana hücrelerinde, biri anneden, biri babadan gelen iki takım (2n) kromozom bulunur. Aşağıda
1. Mayoz bölünme aşağıda verilenlerden hangisinde gerçekleşebilir? A) B) Yumurta Polen ana C) D) Mide Deri 4. Üreme ana hücrelerinde, biri anneden, biri babadan gelen iki takım (2n) kromozom bulunur. Aşağıda
Seleksiyon Islahı. Toplu seleksiyon Teksel seleksiyon Klon seleksiyonu
 Seleksiyon Islahı Toplu seleksiyon Teksel seleksiyon Klon seleksiyonu Seleksiyon Doğal olarak meydana gelmiş bir varyabiliteye sahip populasyonlardan ıslah amaçlarına uygun bitkileri seçip, bunlara daha
Seleksiyon Islahı Toplu seleksiyon Teksel seleksiyon Klon seleksiyonu Seleksiyon Doğal olarak meydana gelmiş bir varyabiliteye sahip populasyonlardan ıslah amaçlarına uygun bitkileri seçip, bunlara daha
YARASA VE ÇİFTLİK GÜBRESİNİN BAZI TOPRAK ÖZELLİKLERİ ve BUĞDAY BİTKİSİNİN VERİM PARAMETRELERİ ÜZERİNE ETKİSİ
 ATATÜRK ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ DOKTORA TEZİ YARASA VE ÇİFTLİK GÜBRESİNİN BAZI TOPRAK ÖZELLİKLERİ ve BUĞDAY BİTKİSİNİN VERİM PARAMETRELERİ ÜZERİNE ETKİSİ TARIMSAL YAPILAR VE SULAMA ANABİLİM
ATATÜRK ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ DOKTORA TEZİ YARASA VE ÇİFTLİK GÜBRESİNİN BAZI TOPRAK ÖZELLİKLERİ ve BUĞDAY BİTKİSİNİN VERİM PARAMETRELERİ ÜZERİNE ETKİSİ TARIMSAL YAPILAR VE SULAMA ANABİLİM
Materyal: Rosa sp. (gül; dikotil çiçek) ve Lilium sp. (zambak; monokotil çiçek)
 KONU 10. ÜREME VE GELİŞME I. Bitki Hücrelerinde Üreme ve Gelişme: Materyal: Rosa sp. (gül; dikotil çiçek) ve Lilium sp. (zambak; monokotil çiçek) Yöntem: Rosa sp. ve Lilium sp. tam çiçeğinden alınan enine
KONU 10. ÜREME VE GELİŞME I. Bitki Hücrelerinde Üreme ve Gelişme: Materyal: Rosa sp. (gül; dikotil çiçek) ve Lilium sp. (zambak; monokotil çiçek) Yöntem: Rosa sp. ve Lilium sp. tam çiçeğinden alınan enine
ÇOK HÜCRELİ ORGANİZMALARIN GELİŞİMİ
 ÇOK HÜCRELİ ORGANİZMALARIN GELİŞİMİ Seçici gen ifadesi embriyonun gelişmesini sağlayan 4 temel işlevi denetler: 1. Hücre çoğalması 2. Hücre farklılaşması 3. Hücre etkileşimleri 4. Hücre hareketi HÜCRE
ÇOK HÜCRELİ ORGANİZMALARIN GELİŞİMİ Seçici gen ifadesi embriyonun gelişmesini sağlayan 4 temel işlevi denetler: 1. Hücre çoğalması 2. Hücre farklılaşması 3. Hücre etkileşimleri 4. Hücre hareketi HÜCRE
Arpa (Hordeum vulgare L.) Bitkisinde Mikrobiyel Gübrelerin Çimlenme Üzerine Etkisinin Belirlenmesi. Çiğdem KÜÇÜK, Cenap CEVHERİ
 Arpa (Hordeum vulgare L.) Bitkisinde Mikrobiyel Gübrelerin Çimlenme Üzerine Etkisinin Belirlenmesi Çiğdem KÜÇÜK, Cenap CEVHERİ Hayvan yemi olarak tüketilen tahıllar içinde; yem değeri en üstün olan arpa,
Arpa (Hordeum vulgare L.) Bitkisinde Mikrobiyel Gübrelerin Çimlenme Üzerine Etkisinin Belirlenmesi Çiğdem KÜÇÜK, Cenap CEVHERİ Hayvan yemi olarak tüketilen tahıllar içinde; yem değeri en üstün olan arpa,
Uygun koşullar altında gelişen bir bitkinin ilk çiçek taslaklarının görüldüğü zamana kadar geçen dönemi gençlik (juvenile) olarak isimlendirilir.
 GENERATİF BÜYÜME VE GELİŞME Uygun koşullar altında gelişen bir bitkinin ilk çiçek taslaklarının görüldüğü zamana kadar geçen dönemi gençlik (juvenile) olarak isimlendirilir. Çiçek tohum ve meyve gelişiminden
GENERATİF BÜYÜME VE GELİŞME Uygun koşullar altında gelişen bir bitkinin ilk çiçek taslaklarının görüldüğü zamana kadar geçen dönemi gençlik (juvenile) olarak isimlendirilir. Çiçek tohum ve meyve gelişiminden
LYS ANAHTAR SORULAR #7. Kalıtım
 LYS ANAHTAR SORULAR #7 Kalıtım 1) Bir bitki türünde mavi çiçek rengi geni (A), gri çiçek rengi genine (a) baskındır. Bu bitki türünde çiçek rengi karakteri açısından farklı fenotiplere sahip bitkilerin
LYS ANAHTAR SORULAR #7 Kalıtım 1) Bir bitki türünde mavi çiçek rengi geni (A), gri çiçek rengi genine (a) baskındır. Bu bitki türünde çiçek rengi karakteri açısından farklı fenotiplere sahip bitkilerin
10. SINIF KONU ANLATIMI 6 MAYOZ BÖLÜNME-3
 10. SINIF KONU ANLATIMI 6 MAYOZ BÖLÜNME-3 Mayoz Bölünmenin Genel Özellikleri Üreme ana hücrelerinde görülür. Üreme hücrelerinin oluşmasını sağlar. Sadece 2n kromozomlu hücrelerde görülür. 4 yeni hücre
10. SINIF KONU ANLATIMI 6 MAYOZ BÖLÜNME-3 Mayoz Bölünmenin Genel Özellikleri Üreme ana hücrelerinde görülür. Üreme hücrelerinin oluşmasını sağlar. Sadece 2n kromozomlu hücrelerde görülür. 4 yeni hücre
YGS YE HAZIRLIK DENEMESi #12
 YGS YE HAZIRLIK DENEMESi #12 1) İnsanda döllenme sırasında, I. Spermdeki çekirdek, sentrozomun yumurtaya geçmesi II. Spermdeki akrozomun patlayarak zona pellusidayı eritmesi III. Yumurtadaki salgı maddelerinin
YGS YE HAZIRLIK DENEMESi #12 1) İnsanda döllenme sırasında, I. Spermdeki çekirdek, sentrozomun yumurtaya geçmesi II. Spermdeki akrozomun patlayarak zona pellusidayı eritmesi III. Yumurtadaki salgı maddelerinin
Doku kültüründeki zorluklar. Virüs Bakteri Mantar Mikoplazma Böcek ve diğerleri ile kontaminasyon
 Doku kültüründeki zorluklar Virüs Bakteri Mantar Mikoplazma Böcek ve diğerleri ile kontaminasyon Virüsler We do not have the possibility to prove a culture is free of bacteria. Sometimes symptoms of bacterial
Doku kültüründeki zorluklar Virüs Bakteri Mantar Mikoplazma Böcek ve diğerleri ile kontaminasyon Virüsler We do not have the possibility to prove a culture is free of bacteria. Sometimes symptoms of bacterial
Rahim ağzı kanseri hücreleri doku kültürü mikroskopik görüntüsü.
 Doç.Dr.Engin DEVECİ HÜCRE KÜLTÜRÜ Hücre Kültürü Araştırma Laboratuvarı, çeşitli hücrelerin invitro kültürlerini yaparak araştırmacılara kanser, kök hücre, hücre mekaniği çalışmaları gibi konularda hücre
Doç.Dr.Engin DEVECİ HÜCRE KÜLTÜRÜ Hücre Kültürü Araştırma Laboratuvarı, çeşitli hücrelerin invitro kültürlerini yaparak araştırmacılara kanser, kök hücre, hücre mekaniği çalışmaları gibi konularda hücre
МАКЕДОНСКО БИОЛОШКО ДРУШТВО MAKEDONYA CUMHURİYETİ BİYOLOGLAR BİRLİĞİ BİYOLOJİ 4.CUMHURİYET YARIŞМАSI LİSE (II) İKİNCİ SINIF
 20.05.2017 МАКЕДОНСКО БИОЛОШКО ДРУШТВО MAKEDONYA CUMHURİYETİ BİYOLOGLAR BİRLİĞİ BİYOLOJİ 4.CUMHURİYET YARIŞМАSI LİSE (II) İKİNCİ SINIF 1. Verilen ifadelerden doğru olanların önündeki D harfini, yanlış
20.05.2017 МАКЕДОНСКО БИОЛОШКО ДРУШТВО MAKEDONYA CUMHURİYETİ BİYOLOGLAR BİRLİĞİ BİYOLOJİ 4.CUMHURİYET YARIŞМАSI LİSE (II) İKİNCİ SINIF 1. Verilen ifadelerden doğru olanların önündeki D harfini, yanlış
ORMAN AĞACI ISLAHI. Yrd. Doç. Dr. DENİZ GÜNEY ( GÜZ DÖNEMİ)
 ORMAN AĞACI ISLAHI Yrd. Doç. Dr. DENİZ GÜNEY (2015-2016 GÜZ DÖNEMİ) MELEZ VE MELEZ GÜCÜ (HETEROSİS): Kalıtsal özellikleri farklı iki bireyin çaprazlanması olayına "Melezleme" denir. Melezleme sonunda ortaya
ORMAN AĞACI ISLAHI Yrd. Doç. Dr. DENİZ GÜNEY (2015-2016 GÜZ DÖNEMİ) MELEZ VE MELEZ GÜCÜ (HETEROSİS): Kalıtsal özellikleri farklı iki bireyin çaprazlanması olayına "Melezleme" denir. Melezleme sonunda ortaya
A. Tahıl ve Tahıl Ürünlerinin Sınıflandırılması B. Mikrobiyel Bozulmalar C. Depolama Koşulları
 A. Tahıl ve Tahıl Ürünlerinin Sınıflandırılması B. Mikrobiyel Bozulmalar C. Depolama Koşulları TAHIL ve TAHIL ÜRÜNLERİNİN SINIFLANDIRILMASI Tahıl, Graminiae familyasının tohumları olan buğday, çavdar,
A. Tahıl ve Tahıl Ürünlerinin Sınıflandırılması B. Mikrobiyel Bozulmalar C. Depolama Koşulları TAHIL ve TAHIL ÜRÜNLERİNİN SINIFLANDIRILMASI Tahıl, Graminiae familyasının tohumları olan buğday, çavdar,
Mutasyon: DNA dizisinde meydana gelen kalıcı değişiklik. Polimorfizm: iki veya daha fazla farklı fenotipin aynı tür popülasyonunda bulunmasıdır.
 Allel: Bir genin seçenekli biçimi Wild Tip: Normal allel. Bireylerin çoğunda bulunan Mutasyon: DNA dizisinde meydana gelen kalıcı değişiklik Polimorfizm: iki veya daha fazla farklı fenotipin aynı tür popülasyonunda
Allel: Bir genin seçenekli biçimi Wild Tip: Normal allel. Bireylerin çoğunda bulunan Mutasyon: DNA dizisinde meydana gelen kalıcı değişiklik Polimorfizm: iki veya daha fazla farklı fenotipin aynı tür popülasyonunda
A-PDF Merger DEMO : Purchase from to remove the watermark
 A-PDF Merger DEMO : Purchase from www.a-pdf.com to remove the watermark Mısır (Zea mays) Bitkisinde Anter Kültürü Olanakları Üzerine Araştırmalar Soner Yiğit SARIER Yüksek Lisans Tezi Tarla Bitkileri Anabilim
A-PDF Merger DEMO : Purchase from www.a-pdf.com to remove the watermark Mısır (Zea mays) Bitkisinde Anter Kültürü Olanakları Üzerine Araştırmalar Soner Yiğit SARIER Yüksek Lisans Tezi Tarla Bitkileri Anabilim
Biyolistik - Gen Silahı. İlker Gönülalp Yıldız Teknik Üniversitesi Biyoloji Bölümü
 Biyolistik - Gen Silahı İlker Gönülalp Yıldız Teknik Üniversitesi Biyoloji Bölümü Biyolistik Biyolistik, biyolojik ve balistik kelimelerinin kısaltmalarının birleştirilmesi şeklinde adlandırılan, hücrelerin
Biyolistik - Gen Silahı İlker Gönülalp Yıldız Teknik Üniversitesi Biyoloji Bölümü Biyolistik Biyolistik, biyolojik ve balistik kelimelerinin kısaltmalarının birleştirilmesi şeklinde adlandırılan, hücrelerin
YGS YE HAZIRLIK DENEMESi #17
 YGS YE HAZIRLIK DENEMESi #17 1) Memeli bir hayvanın vücudunda gerçekleşen biyokimyasal tepkimelerden bazıları aşağıdaki gibidir. I Glikojen Glikoz ATP III Buna göre I, II ve III ile gösterilen metabolik
YGS YE HAZIRLIK DENEMESi #17 1) Memeli bir hayvanın vücudunda gerçekleşen biyokimyasal tepkimelerden bazıları aşağıdaki gibidir. I Glikojen Glikoz ATP III Buna göre I, II ve III ile gösterilen metabolik
Ayxmaz/biyoloji. Şekil 2.
 Şekil 1. 1) Yukarıdaki üreme süreci aşağıdakilerden hangisine örnek gösterilir: a) hermafroditlik b) oogami c) sporlanma d) patenogenez e) izogami 2) Aşağıdakilerden hangisi eşeysiz üreme özelliği değildir?
Şekil 1. 1) Yukarıdaki üreme süreci aşağıdakilerden hangisine örnek gösterilir: a) hermafroditlik b) oogami c) sporlanma d) patenogenez e) izogami 2) Aşağıdakilerden hangisi eşeysiz üreme özelliği değildir?
10.Sınıf Biyoloji. Genetik. cevap anahtarı
 10.Sınıf Biyoloji 4 Genetik cevap anahtarı 4 1 KALITIM Canlı bireylere ait olan özelliklerin, yavru bireylere aktarılmasını inceleyen bilim dalına kalıtım denir. Aristo m.ö. 350 yılında kalıtımın kan yoluyla
10.Sınıf Biyoloji 4 Genetik cevap anahtarı 4 1 KALITIM Canlı bireylere ait olan özelliklerin, yavru bireylere aktarılmasını inceleyen bilim dalına kalıtım denir. Aristo m.ö. 350 yılında kalıtımın kan yoluyla
Bitkisel Üretimde Genetiği Değiştirilmiş Ürünler: Efsaneler ve Gerçekler
 VI. ULUSAL MOLEKÜLER BİYOLOJ VE BİYOTEKOLOJİ KONGRESİ Bitkisel Üretimde Genetiği Değiştirilmiş Ürünler: Efsaneler ve Gerçekler Yrd. Doç. Dr. Yılmaz Kaya Ondokuz Mayıs Üniversitesi Tarımsal Biyoteknoloji
VI. ULUSAL MOLEKÜLER BİYOLOJ VE BİYOTEKOLOJİ KONGRESİ Bitkisel Üretimde Genetiği Değiştirilmiş Ürünler: Efsaneler ve Gerçekler Yrd. Doç. Dr. Yılmaz Kaya Ondokuz Mayıs Üniversitesi Tarımsal Biyoteknoloji
W. Murcott mandarin çeşidinde anter kültürü çalışmaları
 Araştırma Makalesi/Research Article Derim, 2014, 31 (2):37-50 W. Murcott mandarin çeşidinde anter kültürü çalışmaları Yıldız AKA KAÇAR 1* Özhan ŞİMŞEK 1 Dicle DÖNMEZ 2 Melda BONCUK 1 Turgut YEŞİLOĞLU 1
Araştırma Makalesi/Research Article Derim, 2014, 31 (2):37-50 W. Murcott mandarin çeşidinde anter kültürü çalışmaları Yıldız AKA KAÇAR 1* Özhan ŞİMŞEK 1 Dicle DÖNMEZ 2 Melda BONCUK 1 Turgut YEŞİLOĞLU 1
Modern Bitki Biyoteknolojisi
 Modern Bitki Biyoteknolojisi Ali TETİK Eylül, 2001 AJANDA: Biyoteknoloji Nedir? Biyoteknolojinin Genel Kullanım Alanları Bitki Islahında Biyoteknoloji ve Gen Tekniği Biyoteknoloji ile Yeni Bitkilerin elde
Modern Bitki Biyoteknolojisi Ali TETİK Eylül, 2001 AJANDA: Biyoteknoloji Nedir? Biyoteknolojinin Genel Kullanım Alanları Bitki Islahında Biyoteknoloji ve Gen Tekniği Biyoteknoloji ile Yeni Bitkilerin elde
İKLİM KOŞULLARINA KARŞI FARKLI ADAPTASYON YETENEKLERİNE SAHİP BİBERLERDE (Capsicum annuum L.) ANTER KÜLTÜRÜNE MEVSİM ETKİSİ
 İKLİM KOŞULLARINA KARŞI FARKLI ADAPTASYON YETENEKLERİNE SAHİP BİBERLERDE (Capsicum annuum L.) ANTER KÜLTÜRÜNE MEVSİM ETKİSİ In Peppers (Capsicum annuum l.), That Adaptation to Climate Conditions Against
İKLİM KOŞULLARINA KARŞI FARKLI ADAPTASYON YETENEKLERİNE SAHİP BİBERLERDE (Capsicum annuum L.) ANTER KÜLTÜRÜNE MEVSİM ETKİSİ In Peppers (Capsicum annuum l.), That Adaptation to Climate Conditions Against
APOMİKSİS. Öte yandan apomiksis ıslahçı açısında yeni varyasyonların oluşturulamaması gibi bir soruna da neden olmaktadır.
 APOMİKİ Döllenme gerçekleşmeden ve kromozom sayısı yarıya inmeden Yumurta hücresinden tohum oluşumudur. Vegetatif çoğalma yöntemidir. Bahçe bitkilerinin değişik kültür veya yabani türlerinde apomiksis
APOMİKİ Döllenme gerçekleşmeden ve kromozom sayısı yarıya inmeden Yumurta hücresinden tohum oluşumudur. Vegetatif çoğalma yöntemidir. Bahçe bitkilerinin değişik kültür veya yabani türlerinde apomiksis
10. Sınıf II. Dönem Biyoloji Dersi 1. Yazılı Sınavı
 Ad Soyadı: No: Tarih: 10. Sınıf II. Dönem Biyoloji Dersi 1. Yazılı Sınavı 1) Modern genetik veya biyoteknoloji çalışmalarına 4 örnek veriniz. İstediğiniz birini açıklayınız. (10p) 2) Diploit bir erkek
Ad Soyadı: No: Tarih: 10. Sınıf II. Dönem Biyoloji Dersi 1. Yazılı Sınavı 1) Modern genetik veya biyoteknoloji çalışmalarına 4 örnek veriniz. İstediğiniz birini açıklayınız. (10p) 2) Diploit bir erkek
YGS YE HAZIRLIK DENEMESi #8
 YGS YE HAZIRLIK DENEMESi #8 1) Arkebakteriler sıra dışı koşullarda bile yapısı bozulmadan kalabilen enzimlere sahiptir. Arkelere ait bu enzimler, I. Kalitesi düşük metal cevherlerinin işlenmesi, II. Zehirli
YGS YE HAZIRLIK DENEMESi #8 1) Arkebakteriler sıra dışı koşullarda bile yapısı bozulmadan kalabilen enzimlere sahiptir. Arkelere ait bu enzimler, I. Kalitesi düşük metal cevherlerinin işlenmesi, II. Zehirli
YÜKSEKÖĞRETİM KURULU YARDIMCI DOÇENT 01.12.2014. : Sinop Üniversitesi Fen Edebiyat Fakültesi Biyoloji Bölümü Sinop
 HÜLYA SİPAHİ ÖZGEÇMİŞ YÜKSEKÖĞRETİM KURULU YARDIMCI DOÇENT 01.12.2014 Adres : Sinop Üniversitesi Fen Edebiyat Fakültesi Biyoloji Bölümü Sinop Telefon : 3682715516-4206 E-posta Doğum Tarihi : Faks : Kadro
HÜLYA SİPAHİ ÖZGEÇMİŞ YÜKSEKÖĞRETİM KURULU YARDIMCI DOÇENT 01.12.2014 Adres : Sinop Üniversitesi Fen Edebiyat Fakültesi Biyoloji Bölümü Sinop Telefon : 3682715516-4206 E-posta Doğum Tarihi : Faks : Kadro
TÜBİTAK 1003 Buğday Tuzluluğu Projesinin Üçüncü Dönem Raporu Özeti
 TÜBİTAK 1003 Buğday Tuzluluğu Projesinin Üçüncü Dönem Raporu Özeti Toprak tuzluluğu, özellikle kurak ve yarı kurak bölgelerde buğday verimliliğini etkileyen başlıca tarımsal sorunlardan biridir. Ayrıca,
TÜBİTAK 1003 Buğday Tuzluluğu Projesinin Üçüncü Dönem Raporu Özeti Toprak tuzluluğu, özellikle kurak ve yarı kurak bölgelerde buğday verimliliğini etkileyen başlıca tarımsal sorunlardan biridir. Ayrıca,
Bağlantı ve Kromozom Haritaları
 Bağlantı ve Kromozom Haritaları Prof. Dr. Sacide PEHLİVAN 3. Mart. 2017 Bir kişide DNA nın şifrelediği özelliklerin tümü kalıtsal özelliklerdir. DNA üzerinde nükleotitlerden yapılı en küçük ifade edilebilir
Bağlantı ve Kromozom Haritaları Prof. Dr. Sacide PEHLİVAN 3. Mart. 2017 Bir kişide DNA nın şifrelediği özelliklerin tümü kalıtsal özelliklerdir. DNA üzerinde nükleotitlerden yapılı en küçük ifade edilebilir
T.C. SÜLEYMAN DEMİREL ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ
 T.C. SÜLEYMAN DEMİREL ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ TUZLU KOŞULLAR İÇİN GELİŞTİRİLEBİLECEK BUĞDAY GENOTİPLERİNİN ANTER KÜLTÜR TEKNİĞİNE UYUMU Rağbet Ezgi DURAN Danışman: Prof.Dr. Çiğdem SAVAŞKAN
T.C. SÜLEYMAN DEMİREL ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ TUZLU KOŞULLAR İÇİN GELİŞTİRİLEBİLECEK BUĞDAY GENOTİPLERİNİN ANTER KÜLTÜR TEKNİĞİNE UYUMU Rağbet Ezgi DURAN Danışman: Prof.Dr. Çiğdem SAVAŞKAN
ADIM ADIM YGS LYS 64. ADIM EŞEYSİZ ÜREME 2
 ADIM ADIM YGS LYS 64. ADIM EŞEYSİZ ÜREME 2 4) Partenogenez Döllenmemiş yumurtadan mitoz bölünmeler ile canlı gelişimine PARTENOGENEZ denir. Arı, karınca, su piresi ve bazı kertenkele gibi canlılarda görülür.
ADIM ADIM YGS LYS 64. ADIM EŞEYSİZ ÜREME 2 4) Partenogenez Döllenmemiş yumurtadan mitoz bölünmeler ile canlı gelişimine PARTENOGENEZ denir. Arı, karınca, su piresi ve bazı kertenkele gibi canlılarda görülür.
GENEL. Zaman Konu Eğitimci(ler)
 GENEL Zaman Konu Eğitimci(ler) 6.02.2017 9:30-10:00 Kayıt/AÇILIŞ 10:00-10:45 Tarla Bitkileri Islahında Güncel Durum ve Gelecek Hedefleri Doç. Dr. Taner AKAR 1 11:00-11:45 Sebze Islahında Güncel Durum ve
GENEL Zaman Konu Eğitimci(ler) 6.02.2017 9:30-10:00 Kayıt/AÇILIŞ 10:00-10:45 Tarla Bitkileri Islahında Güncel Durum ve Gelecek Hedefleri Doç. Dr. Taner AKAR 1 11:00-11:45 Sebze Islahında Güncel Durum ve
T.C. SÜLEYMAN DEMİREL ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ ISPARTA İLİ KİRAZ İHRACATININ ANALİZİ
 T.C. SÜLEYMAN DEMİREL ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ ISPARTA İLİ KİRAZ İHRACATININ ANALİZİ Danışman Doç. Dr. Tufan BAL YÜKSEK LİSANS TEZİ TARIM EKONOMİSİ ANABİLİM DALI ISPARTA - 2016 2016 [] TEZ
T.C. SÜLEYMAN DEMİREL ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ ISPARTA İLİ KİRAZ İHRACATININ ANALİZİ Danışman Doç. Dr. Tufan BAL YÜKSEK LİSANS TEZİ TARIM EKONOMİSİ ANABİLİM DALI ISPARTA - 2016 2016 [] TEZ
14 HhBbeeAa X HhBbEeAa genotipli bireylerin çaprazlanmasından oluşacak bireyler kaç farklı genotipte olabilir? A) 16 B) 54 C) 27 D) 11 E) 4
 KALITIM 1 AaBb X AaBb şeklindeki çaprazlanmadan 256 oğul birey oluşmuştur. ab fenotipindeki bireyler oluştuktan kısa bir süre A) 32 B) 64 C) 128 D) 192 E) 240 2 2) Bir karakter üzerinde A, B, C, D, E şeklinde
KALITIM 1 AaBb X AaBb şeklindeki çaprazlanmadan 256 oğul birey oluşmuştur. ab fenotipindeki bireyler oluştuktan kısa bir süre A) 32 B) 64 C) 128 D) 192 E) 240 2 2) Bir karakter üzerinde A, B, C, D, E şeklinde
ÇUKUROVA ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ
 ÇUKUROVA ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ YÜKSEK LİSANS TEZİ BİBERLERDE (Capsicum annuum L.) ANTER KÜLTÜRÜNDE MEVSİM ETKİSİ VE MİKROSPOR GELİŞİMİ BAHÇE BİTKİLERİ ANABİLİM DALI ADANA 2011 ÇUKUROVA ÜNİVERSİTESİ
ÇUKUROVA ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ YÜKSEK LİSANS TEZİ BİBERLERDE (Capsicum annuum L.) ANTER KÜLTÜRÜNDE MEVSİM ETKİSİ VE MİKROSPOR GELİŞİMİ BAHÇE BİTKİLERİ ANABİLİM DALI ADANA 2011 ÇUKUROVA ÜNİVERSİTESİ
ADIM ADIM YGS- LYS 92. ADIM KALITIM 18 GENETİK MÜHENDİSLİĞİ VE BİYOTEKNOLOJİ ÇALIŞMA ALANLARI
 ADIM ADIM YGS- LYS 92. ADIM KALITIM 18 GENETİK MÜHENDİSLİĞİ VE BİYOTEKNOLOJİ ÇALIŞMA ALANLARI GENETİK MÜHENDİSLİĞİ Belirli bir amaca yönelik olarak genetik madde üzerinde yapılan çalışmaları içerir. Canlıların
ADIM ADIM YGS- LYS 92. ADIM KALITIM 18 GENETİK MÜHENDİSLİĞİ VE BİYOTEKNOLOJİ ÇALIŞMA ALANLARI GENETİK MÜHENDİSLİĞİ Belirli bir amaca yönelik olarak genetik madde üzerinde yapılan çalışmaları içerir. Canlıların
Hardy Weinberg Kanunu
 Hardy Weinberg Kanunu Neden populasyonlarla çalışıyoruz? Popülasyonları analiz edebilmenin ilk yolu, genleri sayabilmekten geçer. Bu sayım, çok basit bir matematiksel işleme dayanır: genleri sayıp, tüm
Hardy Weinberg Kanunu Neden populasyonlarla çalışıyoruz? Popülasyonları analiz edebilmenin ilk yolu, genleri sayabilmekten geçer. Bu sayım, çok basit bir matematiksel işleme dayanır: genleri sayıp, tüm
ORMAN AĞACI ISLAHI. Yrd. Doç. Dr. DENİZ GÜNEY ( GÜZ DÖNEMİ)
 ORMAN AĞACI ISLAHI Yrd. Doç. Dr. DENİZ GÜNEY (2015-2016 GÜZ DÖNEMİ) Hızlı nüfus artışı, sanayi ve teknolojideki gelişmeler, küresel ısınmanın etkileriyle birleşerek ekosistem dengesi üzerinde yoğun baskı
ORMAN AĞACI ISLAHI Yrd. Doç. Dr. DENİZ GÜNEY (2015-2016 GÜZ DÖNEMİ) Hızlı nüfus artışı, sanayi ve teknolojideki gelişmeler, küresel ısınmanın etkileriyle birleşerek ekosistem dengesi üzerinde yoğun baskı
2006 ÖSS BİYOLOJİ SORULARI VE CEVAPLARI
 2006 ÖSS BİYOLOJİ SORULARI VE CEVAPLARI 1. BÖLÜM 1. I. Adaptasyon II. Mutasyon III. Kalıtsal varyasyon Bir populasyondaki bireyler, yukarıdakilerden hangilerini "doğal seçilim ile kazanır? D) I veii E)
2006 ÖSS BİYOLOJİ SORULARI VE CEVAPLARI 1. BÖLÜM 1. I. Adaptasyon II. Mutasyon III. Kalıtsal varyasyon Bir populasyondaki bireyler, yukarıdakilerden hangilerini "doğal seçilim ile kazanır? D) I veii E)
HÜCRE BÖLÜNMESİ VE ÜREME. Mitoz Bölünme ve Eşeysiz Üreme 1
 HÜCRE BÖLÜNMESİ VE ÜREME Mitoz Bölünme ve Eşeysiz Üreme 1 Hücrenin bölünmeye başlamasından itibaren onu takip eden diğer hücre bölünmesine kadar geçen zaman aralığına hücre döngüsü denir. Hücreler belli
HÜCRE BÖLÜNMESİ VE ÜREME Mitoz Bölünme ve Eşeysiz Üreme 1 Hücrenin bölünmeye başlamasından itibaren onu takip eden diğer hücre bölünmesine kadar geçen zaman aralığına hücre döngüsü denir. Hücreler belli
YGS YE HAZIRLIK DENEMESi #22
 YGS YE HAZIRLIK DENEMESi #22 1) Zigottan başlayıp yeni bir bireyin meydana gelmesiyle sonlanan olayların hepsine birden gelişme denir. Embriyonun gelişimi sırasında, I. Morula II. Gastrula III. Blastula
YGS YE HAZIRLIK DENEMESi #22 1) Zigottan başlayıp yeni bir bireyin meydana gelmesiyle sonlanan olayların hepsine birden gelişme denir. Embriyonun gelişimi sırasında, I. Morula II. Gastrula III. Blastula
3) Aşağıda verilen ifadelerden hangisi mayoz bölünmenin sebep olduğu faydalardan değildir?
 1) 3) Aşağıda verilen ifadelerden hangisi mayoz bölünmenin sebep olduğu faydalardan değildir? A) Genetik yapısı aynı hücreler oluşur. B) Tür içi çeşitliliğin ortaya çıkmasını sağlar. C) Eşeyli üreme için
1) 3) Aşağıda verilen ifadelerden hangisi mayoz bölünmenin sebep olduğu faydalardan değildir? A) Genetik yapısı aynı hücreler oluşur. B) Tür içi çeşitliliğin ortaya çıkmasını sağlar. C) Eşeyli üreme için
10. SINIF KONU ANLATIMI 37 KALITIM 18 GENETİK MÜHENDİSLİĞİ VE BİYOTEKNOLOJİ ÇALIŞMA ALANLARI
 10. SINIF KONU ANLATIMI 37 KALITIM 18 GENETİK MÜHENDİSLİĞİ VE BİYOTEKNOLOJİ ÇALIŞMA ALANLARI GENETİK MÜHENDİSLİĞİ Belirli bir amaca yönelik olarak genetik madde üzerinde yapılan çalışmaları içerir. Canlıların
10. SINIF KONU ANLATIMI 37 KALITIM 18 GENETİK MÜHENDİSLİĞİ VE BİYOTEKNOLOJİ ÇALIŞMA ALANLARI GENETİK MÜHENDİSLİĞİ Belirli bir amaca yönelik olarak genetik madde üzerinde yapılan çalışmaları içerir. Canlıların
Ege Sahil Kuşağına Uygun Kavuzsuz Yulaf Çeşidinin Geliştirilmesi Beslenme Yaklaşımı
 Ege Sahil Kuşağına Uygun Kavuzsuz Yulaf Çeşidinin Geliştirilmesi Beslenme Yaklaşımı 07.10.2016 Özge YILDIZ Gıda Yük. Müh. Aydın İMAMOĞLU, Seda PELİT Ege Tarımsal Araştırma Enstitüsü Müdürlüğü İzmir Proje:
Ege Sahil Kuşağına Uygun Kavuzsuz Yulaf Çeşidinin Geliştirilmesi Beslenme Yaklaşımı 07.10.2016 Özge YILDIZ Gıda Yük. Müh. Aydın İMAMOĞLU, Seda PELİT Ege Tarımsal Araştırma Enstitüsü Müdürlüğü İzmir Proje:
Bitkide Fosfor. Aktif alım açısından bitki tür ve çeşitleri arasında farklılıklar vardır
 Fosfor alımı ve taşınımı Kök hücreleri ve > Bitkide Fosfor ksilem özsuyunun P kapsamı > toprak çözeltisinin P kapsamı (100-1000 kat) P alımı aktif alım şeklinde gerçekleşir Aktif alım açısından bitki tür
Fosfor alımı ve taşınımı Kök hücreleri ve > Bitkide Fosfor ksilem özsuyunun P kapsamı > toprak çözeltisinin P kapsamı (100-1000 kat) P alımı aktif alım şeklinde gerçekleşir Aktif alım açısından bitki tür
Hastalıksız Bitki Üretimi ile Mikroçoğaltım
 Hastalıksız Bitki Üretimi ile Mikroçoğaltım Doç. Dr. Yıldız Aka Kaçar Mikroçoğaltım Bir bitkiden alınan ve tam bir bitkiyi oluşturabilme potansiyeline sahip bitki kısımlarından (embriyo, gövde, sürgün,
Hastalıksız Bitki Üretimi ile Mikroçoğaltım Doç. Dr. Yıldız Aka Kaçar Mikroçoğaltım Bir bitkiden alınan ve tam bir bitkiyi oluşturabilme potansiyeline sahip bitki kısımlarından (embriyo, gövde, sürgün,
TOPRAK TOPRAK TEKSTÜRÜ (BÜNYESİ)
 TOPRAK Toprak esas itibarı ile uzun yılların ürünü olan, kayaların ve organik maddelerin türlü çaptaki ayrışma ürünlerinden meydana gelen, içinde geniş bir canlılar âlemini barındırarak bitkilere durak
TOPRAK Toprak esas itibarı ile uzun yılların ürünü olan, kayaların ve organik maddelerin türlü çaptaki ayrışma ürünlerinden meydana gelen, içinde geniş bir canlılar âlemini barındırarak bitkilere durak
TRAKYA BÖLGESİ MAKARNALIK BUĞDAY TESCİL RAPORU
 T.C. GIDA, TARIM VE HAYVANCILIK BAKANLIĞI Tohumluk Tescil Ve Sertifikasyon Merkez Müdürlüğü TRAKYA BÖLGESİ MAKARNALIK BUĞDAY TESCİL RAPORU TR 5825 Ankara-2016 TR 5825 MAKARNALIK BUĞDAY ÇEŞİT ADAYININ TESCİLİ
T.C. GIDA, TARIM VE HAYVANCILIK BAKANLIĞI Tohumluk Tescil Ve Sertifikasyon Merkez Müdürlüğü TRAKYA BÖLGESİ MAKARNALIK BUĞDAY TESCİL RAPORU TR 5825 Ankara-2016 TR 5825 MAKARNALIK BUĞDAY ÇEŞİT ADAYININ TESCİLİ
KALITIM #12 MODERN GENETİK UYGULAMALARI (BİYOTEKNOLOJİ) SELİN HOCA
 KALITIM #12 MODERN GENETİK UYGULAMALARI (BİYOTEKNOLOJİ) SELİN HOCA BİYOTEKNOLOJİ Canlılara temel bilimlerin ve mühendislik ilkelerinin uygulanmasıdır. Gen mühendisliği, genetik madde lan DNA üzerinde yapılan
KALITIM #12 MODERN GENETİK UYGULAMALARI (BİYOTEKNOLOJİ) SELİN HOCA BİYOTEKNOLOJİ Canlılara temel bilimlerin ve mühendislik ilkelerinin uygulanmasıdır. Gen mühendisliği, genetik madde lan DNA üzerinde yapılan
Meyve ve Sebze ile ilgili kavramlar ve GDO
 Meyve ve Sebze ile ilgili kavramlar ve GDO Doğal Ürünler! Bu ürünler tamamen doğal koşullarda üretilen ürünlerdir. Kimyasal gübre ve tarım ilacı kullanmadan, doğal tohumlarla üretilirler. Organik Ürünler!
Meyve ve Sebze ile ilgili kavramlar ve GDO Doğal Ürünler! Bu ürünler tamamen doğal koşullarda üretilen ürünlerdir. Kimyasal gübre ve tarım ilacı kullanmadan, doğal tohumlarla üretilirler. Organik Ürünler!
Bir populasyonun birey sayısı, yukarıdaki büyüme eğrisinde görüldüğü gibi, I. zaman aralığında artmış, II. zaman aralığında azalmıştır.
 2000 ÖSS BİYOLOJİ SORULARI VE CEVAPLARI 1. Bir populasyonun birey sayısı, yukarıdaki büyüme eğrisinde görüldüğü gibi, I. zaman aralığında artmış, II. zaman aralığında azalmıştır. Aşağıdakilerden hangisinde
2000 ÖSS BİYOLOJİ SORULARI VE CEVAPLARI 1. Bir populasyonun birey sayısı, yukarıdaki büyüme eğrisinde görüldüğü gibi, I. zaman aralığında artmış, II. zaman aralığında azalmıştır. Aşağıdakilerden hangisinde
ÜREME. Canlıların kendilerine benzer canlı fertler (yavrular) meydana getirerek neslini devam ettirmesine üreme denir.
 1 ÜREME Canlıların kendilerine benzer canlı fertler (yavrular) meydana getirerek neslini devam ettirmesine üreme denir. *Eşeysiz üreme: EŞEYSİZ ÜREME Tek bir ata bireyin, kendisiyle aynı genetik özelliklere
1 ÜREME Canlıların kendilerine benzer canlı fertler (yavrular) meydana getirerek neslini devam ettirmesine üreme denir. *Eşeysiz üreme: EŞEYSİZ ÜREME Tek bir ata bireyin, kendisiyle aynı genetik özelliklere
PAMUKKALE ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ. BİBER (Capsicum Annuum L.) ISLAH MATERYALLERİNDEN DİHAPLOİD HATLARIN ÜRETİMİ
 PAMUKKALE ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ BİBER (Capsicum Annuum L.) ISLAH MATERYALLERİNDEN DİHAPLOİD HATLARIN ÜRETİMİ YÜKSEK LİSANS TEZİ Fatma Nur KAPLAN Anabilim Dalı : Biyoloji Tez Danışmanı: Doç.
PAMUKKALE ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ BİBER (Capsicum Annuum L.) ISLAH MATERYALLERİNDEN DİHAPLOİD HATLARIN ÜRETİMİ YÜKSEK LİSANS TEZİ Fatma Nur KAPLAN Anabilim Dalı : Biyoloji Tez Danışmanı: Doç.
LYS 2 ÖZ-DE-BÝR YAYINLARI BÝYOLOJÝ DENEME SINAVI. 2. Otsu bitkilerde, ÜNÝVERSÝTE HAZIRLIK
 LS 2 ÜNÝVERSÝTE HAIRLIK Ö-DE-BÝR AINLARI BÝOLOJÝ DENEME SINAVI A Soru sayýsý: 0 anýtlama süresi: 5 dakika Bu testle ilgili yanýtlarýnýzý optik formdaki Biyoloji bölümüne iþaretleyiniz. Doðru yanýtlarýnýzýn
LS 2 ÜNÝVERSÝTE HAIRLIK Ö-DE-BÝR AINLARI BÝOLOJÝ DENEME SINAVI A Soru sayýsý: 0 anýtlama süresi: 5 dakika Bu testle ilgili yanýtlarýnýzý optik formdaki Biyoloji bölümüne iþaretleyiniz. Doðru yanýtlarýnýzýn
YGS YE HAZIRLIK DENEMESi #23
 YGS YE HAZIRLIK DENEMESi #23 1) Embriyo Amniyon Sıvısı 2) Bakterilerin ve paramesyumun konjugasyonu sırasında; I. Sitoplazmadaki serbest deoksiribonükleotitlerin azalması II. Kalıtsal çeşitlilik artışı
YGS YE HAZIRLIK DENEMESi #23 1) Embriyo Amniyon Sıvısı 2) Bakterilerin ve paramesyumun konjugasyonu sırasında; I. Sitoplazmadaki serbest deoksiribonükleotitlerin azalması II. Kalıtsal çeşitlilik artışı
Doç.Dr. Yıldız AKA KAÇAR
 Doç.Dr. Yıldız AKA KAÇAR EMBRİYO KÜLTÜRÜ Yüksek bitkilerin tohumlarından ve tohum taslaklarından embriyoların izole edilerek belli ortamlarda kültüre alınmasına embriyo kültürü denir. Bitki embriyolarının
Doç.Dr. Yıldız AKA KAÇAR EMBRİYO KÜLTÜRÜ Yüksek bitkilerin tohumlarından ve tohum taslaklarından embriyoların izole edilerek belli ortamlarda kültüre alınmasına embriyo kültürü denir. Bitki embriyolarının
ANKARA ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ DÖNEM PROJESİ İMAR ÖZELLİKLERİNİN TAŞINMAZ DEĞERLERİNE ETKİLERİ. Yeliz GÜNAYDIN
 ANKARA ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ DÖNEM PROJESİ İMAR ÖZELLİKLERİNİN TAŞINMAZ DEĞERLERİNE ETKİLERİ Yeliz GÜNAYDIN TAŞINMAZ GELİŞTİRME ANABİLİM DALI ANKARA 2012 Her hakkı saklıdır ÖZET Dönem Projesi
ANKARA ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ DÖNEM PROJESİ İMAR ÖZELLİKLERİNİN TAŞINMAZ DEĞERLERİNE ETKİLERİ Yeliz GÜNAYDIN TAŞINMAZ GELİŞTİRME ANABİLİM DALI ANKARA 2012 Her hakkı saklıdır ÖZET Dönem Projesi
YAZILIYA HAZIRLIK SORULARI. 10. Sınıf 1 MİTOZ BÖLÜNME EŞEYSİZ ÜREME
 YAZILIYA HAZIRLIK SORULARI 10. Sınıf 1 MİTOZ BÖLÜNME EŞEYSİZ ÜREME Hücre döngüsü uzun bir interfaz ve kısa bir bölünme evresinden oluşur. Hücre bölünmesi tüm canlılarda büyüme, gelişme ve onarım sağlar.
YAZILIYA HAZIRLIK SORULARI 10. Sınıf 1 MİTOZ BÖLÜNME EŞEYSİZ ÜREME Hücre döngüsü uzun bir interfaz ve kısa bir bölünme evresinden oluşur. Hücre bölünmesi tüm canlılarda büyüme, gelişme ve onarım sağlar.
