KİMYASAL BAĞLAR. Atomları Bir Arada Tutan Kuvvet
|
|
|
- Gizem Özbilen
- 7 yıl önce
- İzleme sayısı:
Transkript
1 KİMYASAL BAĞLAR Birleşiğin en küçük parçasın oluşturan ve en az iki atomun birleşmesinden meydana gelen kararlı yapı moleküldür. Moleküldeki atomları bir arada tutan kuvvet ise kimyasal bağlardır. Atomları Bir Arada Tutan Kuvvet Atomun en ilginç karakteristik özelliği, bileşik oluşturmak için öteki atomlarla bağ yapma ve birleşme özelliğidir. Dalton: bileşik atomların birleşmesi sonucu oluştukları keşfetmiş, ancak atomların birbirine nasıl bağlandıklarını açıklayamamıştır. Günümüzde elementlerin aynı tür atomlardan, bileşiklerin ise farklı tür atomlardan oluştuklarını ve bileşiklerin, kendini oluşturduğu elementlerden farklı özellikle gösterdiklerini biliyoruz. Örneğin; sodyum ve klor atomlarından oluşan yemek tuzunun özellikleri, onu oluşturan sodyum ve klor elementinin özelliklerinden oldukça farklıdır. Ayrıca yemek tuzunun özellikleri; karbon, hidrojen ve oksijen elementlerinden oluşan çay şekerinin özelliklerinden de farklılık gösterir. Ancak yemek tuzu ile çay şekeri katı ve kristal yapılı olmak gibi kısmet benzer olan özellikleri de gösterebilir. Her iki bileşiğin temelde farklı olan kristal yapılarında atomlar çok düzeli bir şekilde birbirine bağlanarak kristal örgü içerisinde belirli bir konum alır. Bu maddeler, dışarıdan bir etki yapmadığı sürece seçim ve hacimlerini korur. Bu durum, her iki maddenin örgü yapısında atomların belli konumda kalıyor olmasından kaynaklanır. Eğer bu iki madde ayrı ayrı ısıtılırsa, çay şekeri düşük sıcaklıkta erir ve geride karbon bırakarak bozulur. Yemek tuzu ise yüksek sıcaklıkta (801 o C ta) eriyerek sıvı hale geçer. Dışarıdan verilen ısı enerjisiyle, bir zorlama sonucu, bu katılardaki düzenli örgü yapısının bozulması, atomları belirli bir örgü düzeninde bir arada tutan atomlar arası kuvvetlerin varlığını gösterir. Hatta, her iki maddede örgü yapısının farklı sıcaklıklarda bozulması, farklı katı maddelerdeki atomlar arası çekim kuvvetlerinin büyüklüklerinin de farklı olduğu açıklar. Bir başka ifade ile çay şekerinin kristal yapısına neden olan atomlar arası etkileşmeler, yemek tuzundakine göre daha zayıftır. 1
2 Yukarıda belirttiğimiz gibi yemek tuzu, iki farklı elementten, çay şekeri üç farklı elementten oluşur. Ancak her iki maddede örgü düzenlerini sağlayan kuvvetler, yani atomlar arası etkileşme kuvvetleri çok farklıdır. Bununla beraber farklı tür ve sayıda atom, aralarında farklı kuvvetlerdeki etkileşimlerle birbirine sıkı biçimde bağlanarak belirli kümeler oluşturur. Aynı ya da farklı cinsten atomların kuvvetli etkileşimlere kümeler halinde bir arada tutulmalarını sağlayan kuvvetlere kimyasal bağ denir. Yüksek sıcaklıkta hidrojene atom halinde rastlanır. Ancak normal şartlarda hidrojen gazı, H 2 formülü ile gösterilen iki atomlu kümler halindedir. Bunun nedeni, yüksek enerjili ve kararsız olan hidrojen atomlarının daha az enerji ve kararlı olan H 2 kümeleri haline geçme eğilimidir. Bu eğilimin sonucu olarak, hidrojen atomları aralarında bağ yaparak H 2 kümelerini oluşturur ve dışarıya bir miktar enerji verir.böylece hidrojen atomları daha az enerji ve kararlı hale geçer. H (g) + H (g) H 2(g) + 432,6 kj Atomlar bağ yaparken açığa çıkan enerji, bu bağları kopararak molekülü atomlarına ayırmak için verilmesi gereken enerjiye eşittir. Bu enerjiye kimyasal bağ enerjisi denir. Bir molekülde bağ enerjilerinin toplamının büyüklüğü, molekülün kararlılığının bir ölçüsüdür. Kimyasal bağlarla bir arada duran bir atomlar kümesinin fiziksel ve kimyasal özellikleri, onu oluşturan her tür atomunkinden çok farklıdır. Kaldı ki bu özellikler o kümeye has ayırt edici özelliklerdir. Örneğin: canlılığın bir parçası olan su bileşiği, iki hidrojen ve bir oksijen atomunun bir araya gelmesinden oluşur. Hidrojen renksiz, kokusuz ve yanıcı bir gazdır. Oksijen ise yine renksiz, kokusuz ve yakıcı bir gazdır. İki hidrojen ve bir oksijen atomunun bir araya gelerek kuvvetli etkileşimlerle oluşturduğu su kümesi, oda sıcaklığında sıvı bir maddedir. Yanıcı yada yakıcı bir gazdır. Normal koşullarda su : 0 o C ta donan, 100 o C ta kaynayan bir maddedir. Bu özellikler suyun ayırt edici özellikleridir. 2
3 Asal gaz atomlarının değerlik orbitalleri, tamamen elektronlarla dolu ve değerlik elektronları çekirdeğe eşit uzaklıktadır. Bu durumda, asal gaz atomları küresel simetrik olup iyonlaşma enerjileri oldukça yüksektir. Bu yüzden asal gaz atomlarından elektron koparmak zordur. Ayrıca asal gaz atomlarının değerlik orbitalleri dolu olduğundan dışarıdan elektron alamaz. Bu durum, asal gaz atomlarına en az enerjili ve kararlı yapı sağlar. Diğer elemen atomları ise aralarında elektron alış verişi yaparak ya da elektron ortaklığı kuran elektron dizilişlerini asal gazların elektron dizilişine benzetir. Böylece bu atomlar daha az enerjili, daha kararlı, nötr kümler haline gelir. Atomların elektron alış verişi ya da elektron ortaklığı yoluyla elektron dizilişlerini 1s 2 elektron dağılımlı He asal gazı elektron dizilişine benzetmelerine dublete varma denir. Elektron dizilişlerini ns 2 ns 6 (n, herhangi bir enerji düzeyi numarasıdır.) elektron dizilişli Ne, Ar gibi asal gazların elektron dizilişlerine benzetmelerine ise oktete varma denir. Atomların oktetlerini tamamlamaları için iki temel yol geçerlidir. Birinci yol, elektron kazanma veya kaybetme, ikinci yol ise elektronlarını paylaşmaktır. Atomlar, asal gaz yapısına ulaşmak için iki yoldan birini seçer. Bu farklı seçim sonucu atomlar iyonik ya da kovalent bağ yaparak kararlı yapı oluşturur. Kimyasal bağ oluşumunun gerçekleşmesinde iki temel faktör söz konusudur. 1. Atomların asal gaz yapısına ulaşabilme çabaları, 2. Karşıt yüklerin birbirlerini çekmesi. Elektron Nokta Yapısı (Lewis Yapısı) Levis simgesi, iç orbital elektronları ve çekirdeği gösteren bir simge ile değerlik elektronlarını gösteren noktalardan oluşur. Amerikalı bilim adamı, G.N. Lewis in ( Levis ) adı verilen bu simgelerde her elektron bir nokta ile belirtildiğinden elektron nokta simgeleri olarak da bilinir. Bir elementin elektron nokta yapısı elementin sembolü etrafına değerlik elektronu kadar nokta koyarak yazılır. Aşağıda ikinci sıra elementlerinin elektron nokta yapıları tablo 1 da gösterilmiştir. 3
4 TABLO 1 :İkinci Sıra Elementlerin Elektron - Nokta Yapısı (Lewis Simgeleri) 1. İyonik Bağ Periyodik cetvelin sonunda bulunan metaller ile periyodik cetvelin sağında bulunan ametaller bir araya geldiklerinde, aralarında elektron aktarımı olur. Çünkü metallerin iyonlaşma enerji düşük olduğundan, en dış kabuklarında bulunan değerlik elektronları kolaylıkla verir. Böylece elektron dizilişleri soy gazların elektron dizilişlerine benzer. Bu arada pozitif yüklü iyonlar (katyonlar) oluşur. Her bir metalin oluşturduğu iyonun yükü, verebileceği değerlik elektronu sayı ile sınırlıdır (tablo 2). Örneğin periyodik cetvelde 1a grubunda yer alan soydun metalinin değerlik elektron sayısı bir, bileşiklerde iyon yükü +1 dir. TABLO 2 :IA,IIA ve IIIA Grubu Elementlerin Değerlik Elektronları ve İyon Yükleri Grubu En dış kabuktaki Değerlik Verebileceği İyon yükü İyon degerlik elektron elektron örneği elektronlarının sayısı sayısı dizilişi IA ns Na + IIA ns Ca +2 IIIA ns 2 np Al +3 Diğer yandan, elektron ilgisi yüksek olan ametaller, atomların en dış kabuklarına elektron alarak elektron dizilişlerini soy gazlara benzetir. Bu arada negatif 4
5 yüklü iyonlar (anyonlar) oluşur. Her bir ametalin oluşturabileceği iyon yükü, değerlik orbitallerindeki eksi elektronlar yerine alabileceğin elektron sayısı kadardır (tablo 3). Örneğin; periyodik cetvelin 2. periyot VIA grubunda yer alan oksijen atomunun değerlik elektron sayısı 6 dır. Değerlik orbitallerde bulunması gereken elektron sayısı 8 dir. Oksijen atomu oktetini sağlamak üzere dışarıdan 2 elektron almalı -2 yüklü iyon oluşturmalıdır. Sıkça karşılaştığımız anyonların bazıları ; flüorür (F - ), klorür (C - ), sülfür (O -2 ) ve nitrür (N -3 ) dür. TABLO 3 :VA; VIA ve VIIA Grubu Elementlerin Değerlik Elektronları ve İyon Yükleri Grubu En dış kabuktaki Değerlik Verebileceği İyon yükü İyon örneği degerlik elektron elektron elektronlarının sayısı sayısı dizilişi VA ns 2 np N -3 VIA ns 2 np O -2 VIIIA ns 2 np Cl - Bir atomdan elektron kopartılabilmesi, belirli bir enerjinin (iyonlaşma enerjisinin) elektron koparılacak atom tarafından alınmasını gerektirir. Gerekli iyonlaşma enerjisinin sağlanabileceği durumlarda, bir atomdan elektronlar kopartılarak diğer atomun orbitallerine aktarılabilir. Elektron kaybeden atom pozitif iyon (katyon), elektron alan atom negatif iyon (anyon ) haline geçer. İyonik bağ, zıt yüklü bu iyonlar arasındaki elektrostatik çekme kuvveti sonucu oluşur. Katyon ve anyonlar arasındaki elektrostatik çekim kuvvetiyle açıklanabilen kimyasal bağlara iyonik bağ denir. Bu tür bağları içeren bileşiklere ise iyonik yapılı bileşikler denir. Metal ve ametal atomları arasında oluşan iyonik yapılı bileşiklerden bazıları; kalsiyum oksit (CaO), magnezyum klorür (MgCl 2 ), sodyum nitrür (Na 3 N), potasyum sülfür (K 2 S)dür. 5
6 NaCl bileşiğinde iyonik bağ oluşumu : 11Na elektron dizilişi : 1s 2 2s 2 2p 6 3s 1 17Cl elektron dizilişi : 1s 2 2s 2 2p 6 3s 2 3p 5 şeklindedir. Na elementinin iyonlaşma enerjisi ve elektron ilgisi küçüktür. 3s orbitalindeki bir tane değerlik elektronunu kolaylıkla vererek elektron dizilişini, 1s 2 2p 2 2p 6 şeklinde 10Ne asal gaz elektron dizilişine benzeterek oktete varır. Na + haline gelir. Na (1s 2 2s 2 2p 6 3s 1 ) Na + (1s 2 2s 2 2p 6 ) +e - İyonlaşma enerjisi ve elektron ilgisi büyük olan Cl is Na atomundan ayrılan bir elektronu alarak elektron dizilişini 1s 2 2s 2 2p 6 3s 2 3p 6 şekline sokar. Cl - iyonu haline gelerek 18 Ar asal gazının elektron dizilişine (oktete) ulaşır. Cl (1s 2 2s 2 2p 6 3s 2 3p 5 ) +e - Cl - (1s 2 2s 2 2p 6 3s 2 3p 6 ) Farklı yüklere sahip Na + ve Cl - iyonları Coulomb (Kulon) kanunu gereği birbirini elektrostatik çekim kuvvetleriyle çekerek iyonik bağ oluşturur. Bu iyonlar dışarıya enerji vererek iyonik NaCl bileşiğini meydana getirir. NaCl ün Lewis yapısı aşağıdaki gibidir. İyonik bağlı bileşiklerde, her anyon ve katyon, çevresindeki zıt yüklü anyon ya da katyonu elektrostatik çekim kuvvetleriyle çeker. Bu şekilde uzayın her doğrultusunda iyonlar arasındaki enerjinin en az olacağı bir sıralama ile çok sayıda iyonun bir arada bulunduğu örgü yapısı oluşur. İyonların bu üzgün örgü yapısı oluşur. İyonların bu düzgün örgü yapısına iyonik kristal denir. İyonik bileşikler normal şartlarda katı hâlde bulunur. Katı hâldeki iyonik bileşiklerde çok sayıda anyon ve kalyonun düzenli bir biçimde kristal içinde yer alır. Katılarda kristal örgü yapısı nedeniyle bileşik formülü, maddedeki farklı atomların oranlarını yansıtan en basit bir birimdir. Bu birime bileşik formülü denir. Buna göre sodyum klorür için kullandığımız NaCl formülü bu maddenin en basit formülüdür. Bu formül sodyum klorür bileşiğinde, sodyum iyonlarının sayısının klorür iyonlarının sayısına eşit olduğunu gösterir. 6
7 İyonik bir bileşik olan magnezyum klorürün formülü, MgCl 2, şeklindedir. Bu formül, magnezyum klorür bileşiği için en basit formüldür. MgCl 2 formülü, bileşikle, magnezyum iyonları ile bu iyonların daima iki katı kadar klorür iyonlarının bulunması gerektiğini gösterir. İyonik bileşiklerde katyon ve anyonların sayıları arasında daima sabit bir oran vardır. Bu oran, iyonik bileşiğin miktarına bağlı değildir. Söz gelimi magnezyum klorür bileşiğinde klorür iyonlarının magnezyum iyonlarına oranı ikidir. Günlük yaşamda sıkça karşılaştığımız ve kendilerini oluşturan elementlerden çok farklı fiziksel ve kimyasal özellik taşıyan bazı iyonik bileşikler; yemek tuzu (NaCl), cehennem taşı (AgNO 3 ), çamaşır sodası (Na 2 CO 3 ), şap [Al 2 (SO 4 ) 3 ], güherçile (KNO 3 ), göztaşı (CuSO 4 ), demir pası (Fe 2 O 3 ) ve nışadırdır (NH 4 CI). 2. Kovalent Bağ Kimyasal bağların oluşumunda, atomların elektron alıp vermeleri veya karşılıklı elektron ortaklığı kurmaları gerekliğine işaret etmiştik. İyonlaşma enerjileri çok yüksek ve elektron ilgileri birbirine çok yakın olan atomların veya aynı cins atomların elektron alış verişi sonucu bağ yapmaları çok zordur. Bu atomlar, kararlı bir yapı oluşturmak için daha kolay bir yol olarak en dış kabuklarındaki elektronları aralarında karşılıklı ortak kullanmayı tercih eder. Bazı bileşiklerde atomları bir arada tutan kuvvet, her atomun en dış kabuğundaki elektronların ortaklaşa kullanılması sonucu doğar. Atomların karşılıklı olarak birbirlerinin elektronlarını ortak kullanmalarıyla oluşan bağa Kovalent bağ denir. Kovalent bağlarda bağlayıcı kuvvet, ortak kullanılan elektronların her iki atomun çekirdeği tarafından çekilme kuvvetleridir. Bağın kararlılığı ise bu çekme kuvvetleri ile çekme kuvvetleri sonucu açığa çıkan enerjiden dolayı kovalent bağlı atom çiftinin enerjilerinin azalmasıdır. Kovalent bağ genellikle ametal-ametal arasında oluşan bileşiklerde görülür. Örneğin; su (H 2 O), karbondioksit (CO 2 ), amonyak (NH 3 ) ametal atomlarının birbirine kovalent bağlarla bağlandığı bileşiklerdir. Aynı ya da farklı cins, belirli sayıda atomun kovalent bağlarla oluşturduğu en küçük birime molekül denir. Bir molekülde bulunan her türdeki atom sayıları belirlidir ve 7
8 bu sayılar molekül formülüyle gösterilir. Molekül formülü, maddenin bir molekülünde bulunan her bir elementin atom sayısını gösterir. Örneğin; her bir molekülünde 2 hidrojen ve l oksijen atomu içerdiği bilinen su bileşiğinin molekül formülü, H 2 O'dur. Molekül yapılı bileşiklerde temel birim olan molekül, tek başına da kararlıdır. Örneğin; su molekülünün (H 2 O) gaz halindeki kimyasal özellikleri, sıvı ya da katı hâldeki kimyasal özellikleriyle aynıdır. O hâlde molekül birimi maddenin tüm hâllerinde tek başına kararlı olmalıdır. Kimyasal bağların pek çoğunun oluşumunda, elektronların bir atomdan diğerine aktarılması tam gerçekleşmiş kabul edilmez. Örneğin; iki hidrojen atomundan meydana gelen H 2 molekülünde, hidrojen atomlarından birinin elektron vermesi, diğerinin bu elektronu alması mantığa aykırı düşer. Çünkü, elektron ilgisi ve iyonlaşma enerjisi her hidrojen atomunda aynıdır. Bu-durumda hidrojen atomları arasında elektron alış verişi söz konusu değildir. Elektronlar, hidrojen atomları arasında ortaklaşa kullanılır ve kovalent bağ meydana gelir. 1H atomunun elektron dağılımı, 1s 1 şeklindedir. Yani hidrojen atomunun 1s orbitalinde tek bir elektronu vardır ve 1s 1 değerlik orbitali yan doludur. Pauli dışarılama prensibine göre, bir orbitalde zıt spinli (dönüşlü) olmak şanıyla en fazla iki elektron bulunmalıdır. Bu durumda iki hidrojen atomu, 1s orbitallerini doldurabilmek üzere karşılıklı birer elektronlarını ortaklayarak (eşleyerek) elektron sistemlerini 2 He asal gazı elektron sistemine benzetmeli ve dublete varabilmelidir. Bu olay, elektron-nokta yapısında (Lewis yapısı) Şekil l.a'daki gibi gösterilir. Hidrojen atomları aralarında, H 2 formülüyle gösterilen hidrojen molekülünü oluşturur (Şekil 1.b). a. H 2 molekülünde kovalent bağlamanın elektron-nokta yapısı ve tek bağ oluşumu b. Hidrojenin molekül modeli Hidrojen molekülünde iki atom çekirdeği tarafından ortak kullanılan ve çekilen elektron çifti, bir kovalent bağı temsil eder. Bu bağ H H şeklinde de ifade edilebilir. 8
9 Oksijen atomunun ( 8 0) elektron dizilişi, 1s 2 2s 2 2p 3 x 2p 1 y 2p 1 z şeklindedir. Oksijen atomunun p y ve p z değerlik orbitalleri yarı doludur ve bu orbitallerde eşlenmemiş elektron sayısı 2 tanedir. İki oksijen atomu, eşlenmemiş ikişer elektronu karşılıklı olarak eşleyerek kendi aralarında iki kovalent bağ oluşturur. İki atom arasındaki kurulan iki kovalent bağ, çift bağ olarak adlandırılır (Şekil 2.a). Oksijen atomları aralarında. O 2 formülüyle gösterilen oksijen molekülünü oluşturur (Şekil 2.b). Yine, elektron dağılımı, 7N: 1s 2 2s 2 2p 1 x 2p 1 y 2p 1 z şeklimle olan azot atomları değerlik orbitallerinde eşlenmemiş elektron sayısı 3'tür. O hâlde, iki azot atomu, karşılıklı üçer elektronlarını ortaklayarak kendi aralarında üç kovalent bağ oluşturur. İki atom arasında kurulan üç kovalent bağ, üçlü bağ olarak adlandırılır (Şekil 3.a). Azot atomları aralarında, N 2 formülüyle gösterilen azot molekülünü oluşturur (Şekil 3.b). Yukarıda örnek verdiğimiz hidrojen, oksijen ve azot atomlarının gerek kendi aralarında, gerekse başkaca atomlarla yapmaları gereken kovalent bağ sayısı; hidrojen atomu için l. oksijen atomu için 2 ve azot atomu için 3 tanedir. Çünkü, bir atomun oluşturabileceği kovalent bağ sayısı, o atomun elektron dizilişi ile ilgilidir. Bir atomun oluşturabileceği kovalent bağ sayısı, değerlik orbitallerindeki eşlenmemiş elektron sayısı kadardır. Hidrojen Flüorürün Kovalent Bağ Yapısı Hidrojen ve flüor atomlarının elektron dizilişi şöyledir: 1H : 1s 1, 9f : 1s 2 2s 2 2p 2 x 2p 2 y 2p 1 z Bu elektron dizilişine göre hidrojen ve flüor atomlarının değerlik orbitallerinde birer tane eşlenmemiş elektron vardır. Bu nedenle hidrojen ve flüor atomlarının 9
10 yapabileceği bağ sayısı birer tanedir. Kaldı ki hidrojen atomunun dubletini tamamlayabilmesi için l elektrona, flüor atomunun oktetini tamamlayabilmesi için l elektrona ihtiyacı vardır. Hidrojen ve flüor atomları karşılıklı birer elektronlarını ortaklaşa kullanarak değerlik orbitallerini doldurur ve eşlenmemiş elektronlarını eşleyerek aralarında bir kovalent bağ oluşturur (Şekil 4.a). H ve F atomları arasında. HF formülüyle gösterilen hidrojen flüorür molekülünü oluşturur (Şekil 4.b) Su molekülünün Kovalent Bağ yapısı Hidrojen ve oksijen atomlarının elektron dizilişi şöyledir: 1H: 1s 1, 8O : 1s 2 2s 2 2p 2 x 2p 1 y 2p 1 z Hidrojen atomunun değerlik orbitallerinde eşlenmemiş elektron sayısı l, oksijen atomunun 2 tanedir. Dolayısıyla hidrojen atomunun yapacağı kovalent bağ sayısı 1, oksijen atomunun 2 tanedir. Bu duruma göre bir oksijen atomu, iki hidrojen atomuyla birer kovalent bağ yaparak oktete, hidrojen atomları ise dublete vararak H 3 O formülüyle gösterdiğimiz su molekülünü oluşturmaktadır (Şekil 5.a. b). Azot triklorürür Kovalent Bağ Yapısı Azot triklorürün Kovalent Bağ Yapısı Azot ve klor atomlarının elektron dizilişi şöyledir: 7N: l S 2 2s : 2p' x 2py2 P ' 2,,,CI: ls : 2s j 2p"3s 2 3 P \ 3 P J y 3p' z 10
Nötr (yüksüz) bir için, çekirdekte kaç proton varsa çekirdeğin etrafındaki yörüngelerde de o kadar elektron dolaşır.
 ATOM ve YAPISI Elementin özelliğini taşıyan en küçük parçasına denir. Atom Numarası Bir elementin unda bulunan proton sayısıdır. Protonlar (+) yüklü olduklarından pozitif yük sayısı ya da çekirdek yükü
ATOM ve YAPISI Elementin özelliğini taşıyan en küçük parçasına denir. Atom Numarası Bir elementin unda bulunan proton sayısıdır. Protonlar (+) yüklü olduklarından pozitif yük sayısı ya da çekirdek yükü
Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı
 Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani madde yani bileşik
Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani madde yani bileşik
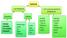
KİMYASAL BAĞLAR İYONİK BAĞ KOVALANT BAĞ POLAR KOVALENT BAĞ APOLAR KOVALENT BAĞ
 KİMYASAL BAĞLAR İYONİK BAĞ KOVALANT BAĞ POLAR KOVALENT BAĞ APOLAR KOVALENT BAĞ Atomlar bağ yaparken, elektron dizilişlerini soy gazlara benzetmeye çalışırlar. Bir atomun yapabileceği bağ sayısı, sahip
KİMYASAL BAĞLAR İYONİK BAĞ KOVALANT BAĞ POLAR KOVALENT BAĞ APOLAR KOVALENT BAĞ Atomlar bağ yaparken, elektron dizilişlerini soy gazlara benzetmeye çalışırlar. Bir atomun yapabileceği bağ sayısı, sahip
Elementlerin büyük bir kısmı tabiatta saf hâlde bulunmaz. Çoğunlukla başka elementlerle bileşikler oluşturmuş şekilde bulunurlar.
 Elementlerin büyük bir kısmı tabiatta saf hâlde bulunmaz. Çoğunlukla başka elementlerle bileşikler oluşturmuş şekilde bulunurlar. Elementlerin bileşik oluşturma istekleri onların kararlı yapıya ulaşma
Elementlerin büyük bir kısmı tabiatta saf hâlde bulunmaz. Çoğunlukla başka elementlerle bileşikler oluşturmuş şekilde bulunurlar. Elementlerin bileşik oluşturma istekleri onların kararlı yapıya ulaşma
Örnek : 3- Bileşiklerin Özellikleri :
 Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani
Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani
BİLEŞİKLER VE FORMÜLLERİ
 BİLEŞİKLER VE FORMÜLLERİ Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur). Bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere
BİLEŞİKLER VE FORMÜLLERİ Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur). Bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere
Yrd. Doç. Dr. H. Hasan YOLCU. hasanyolcu.wordpress.com
 Yrd. Doç. Dr. H. Hasan YOLCU hasanyolcu.wordpress.com En az iki atomun belli bir düzenlemeyle kimyasal bağ oluşturmak suretiyle bir araya gelmesidir. Aynı atomda olabilir farklı atomlarda olabilir. H 2,
Yrd. Doç. Dr. H. Hasan YOLCU hasanyolcu.wordpress.com En az iki atomun belli bir düzenlemeyle kimyasal bağ oluşturmak suretiyle bir araya gelmesidir. Aynı atomda olabilir farklı atomlarda olabilir. H 2,
Aşağıda verilen özet bilginin ayrıntısını, ders kitabı. olarak önerilen, Erdik ve Sarıkaya nın Temel. Üniversitesi Kimyası" Kitabı ndan okuyunuz.
 KİMYASAL BAĞLAR Aşağıda verilen özet bilginin ayrıntısını, ders kitabı olarak önerilen, Erdik ve Sarıkaya nın Temel Üniversitesi Kimyası" Kitabı ndan okuyunuz. KİMYASAL BAĞLAR İki atom veya atom grubu
KİMYASAL BAĞLAR Aşağıda verilen özet bilginin ayrıntısını, ders kitabı olarak önerilen, Erdik ve Sarıkaya nın Temel Üniversitesi Kimyası" Kitabı ndan okuyunuz. KİMYASAL BAĞLAR İki atom veya atom grubu
GENEL KİMYA. 4. Konu: Kimyasal türler, Kimyasal türler arasındaki etkileşimler, Kimyasal Bağlar
 GENEL KİMYA 4. Konu: Kimyasal türler, Kimyasal türler arasındaki etkileşimler, Kimyasal Bağlar Kimyasal Türler Doğada bulunan bütün maddeler tanecikli yapıdadır. Maddenin özelliğini gösteren küçük yapı
GENEL KİMYA 4. Konu: Kimyasal türler, Kimyasal türler arasındaki etkileşimler, Kimyasal Bağlar Kimyasal Türler Doğada bulunan bütün maddeler tanecikli yapıdadır. Maddenin özelliğini gösteren küçük yapı
BÖLÜM 2 ATOMİK YAPI İÇERİK. Atom yapısı. Bağ tipleri. Chapter 2-1
 BÖLÜM 2 ATOMİK YAPI İÇERİK Atom yapısı Bağ tipleri 1 Atomların Yapıları Atomlar başlıca üç temel atom altı parçacıktan oluşur; Protonlar (+ yüklü) Nötronlar (yüksüz) Elektronlar (-yüklü) Basit bir atom
BÖLÜM 2 ATOMİK YAPI İÇERİK Atom yapısı Bağ tipleri 1 Atomların Yapıları Atomlar başlıca üç temel atom altı parçacıktan oluşur; Protonlar (+ yüklü) Nötronlar (yüksüz) Elektronlar (-yüklü) Basit bir atom
GENEL KİMYA. 4. Konu: Kimyasal türler, Kimyasal türler arasındaki etkileşimler, Kimyasal Bağlar
 GENEL KİMYA 4. Konu: Kimyasal türler, Kimyasal türler arasındaki etkileşimler, Kimyasal Bağlar Kimyasal Türler Doğada bulunan bütün maddeler tanecikli yapıdadır. Maddenin özelliğini gösteren küçük yapı
GENEL KİMYA 4. Konu: Kimyasal türler, Kimyasal türler arasındaki etkileşimler, Kimyasal Bağlar Kimyasal Türler Doğada bulunan bütün maddeler tanecikli yapıdadır. Maddenin özelliğini gösteren küçük yapı
Bir atomdan diğer bir atoma elektron aktarılmasıyla
 kimyasal bağlar Kimyasal bağ, moleküllerde atomları bir arada tutan kuvvettir. Atomlar daha düşük enerjili duruma erişmek için bir araya gelirler. Bir bağın oluşabilmesi için atomlar tek başına bulundukları
kimyasal bağlar Kimyasal bağ, moleküllerde atomları bir arada tutan kuvvettir. Atomlar daha düşük enerjili duruma erişmek için bir araya gelirler. Bir bağın oluşabilmesi için atomlar tek başına bulundukları
ELEKTRONLARIN DĠZĠLĠMĠ
 ELEKTRONLARIN DĠZĠLĠMĠ Eğer bu üç elementin birer elektronu daha olsaydı, her birinde yeni bir katman oluşacaktı. Çünkü her üçünün de en dıştaki katmanları tamamen dolu durumdadır. 1.Katmanda en çok 2
ELEKTRONLARIN DĠZĠLĠMĠ Eğer bu üç elementin birer elektronu daha olsaydı, her birinde yeni bir katman oluşacaktı. Çünkü her üçünün de en dıştaki katmanları tamamen dolu durumdadır. 1.Katmanda en çok 2
Atomlar ve Moleküller
 Atomlar ve Moleküller Madde, uzayda yer işgal eden ve kütlesi olan herşeydir. Element, kimyasal tepkimelerle başka bileşiklere parçalanamayan maddedir. -Doğada 92 tane element bulunmaktadır. Bileşik, belli
Atomlar ve Moleküller Madde, uzayda yer işgal eden ve kütlesi olan herşeydir. Element, kimyasal tepkimelerle başka bileşiklere parçalanamayan maddedir. -Doğada 92 tane element bulunmaktadır. Bileşik, belli
PERİYODİK CETVEL
 BÖLÜM4 W Periyodik cetvel, elementlerin atom numaraları esas alınarak düzenlenmiştir. Bu düzenlemede, kimyasal özellikleri benzer olan (değerlik elektron sayıları aynı) elementler aynı düşey sütunda yer
BÖLÜM4 W Periyodik cetvel, elementlerin atom numaraları esas alınarak düzenlenmiştir. Bu düzenlemede, kimyasal özellikleri benzer olan (değerlik elektron sayıları aynı) elementler aynı düşey sütunda yer
Soygazların bileşik oluşturamamasının sebebi bütün orbitallerinin dolu olmasındandır.
 KİMYASAL BAĞLAR Kimyasal bağ, moleküllerde atomları birarada tutan kuvvettir. Bir bağın oluşabilmesi için atomlar tek başına bulundukları zamankinden daha kararlı (az enerjiye sahip) olmalıdırlar. Genelleme
KİMYASAL BAĞLAR Kimyasal bağ, moleküllerde atomları birarada tutan kuvvettir. Bir bağın oluşabilmesi için atomlar tek başına bulundukları zamankinden daha kararlı (az enerjiye sahip) olmalıdırlar. Genelleme
ÖĞRENME ALANI : MADDE VE DEĞİŞİM ÜNİTE 4 : MADDENİN YAPISI VE ÖZELLİKLERİ
 ÖĞRENME ALANI : MADDE VE DEĞİŞİM ÜNİTE 4 : MADDENİN YAPISI VE ÖZELLİKLERİ E BİLEŞİKLER VE FRMÜLLERİ (4 SAAT) 1 Bileşikler 2 Bileşiklerin luşması 3 Bileşiklerin Özellikleri 4 Bileşik Çeşitleri 5 Bileşik
ÖĞRENME ALANI : MADDE VE DEĞİŞİM ÜNİTE 4 : MADDENİN YAPISI VE ÖZELLİKLERİ E BİLEŞİKLER VE FRMÜLLERİ (4 SAAT) 1 Bileşikler 2 Bileşiklerin luşması 3 Bileşiklerin Özellikleri 4 Bileşik Çeşitleri 5 Bileşik
1. ÜNİTE: MODERN ATOM TEORİSİ İyon Yükleri ve Yükseltgenme Basamakları
 1. ÜNİTE: MODERN ATOM TEORİSİ 1.7. İyon Yükleri ve Yükseltgenme Basamakları Yüksüz bir atomun yapısındaki pozitif (+) yüklü protonlarla negatif () yüklü elektronların sayıları birbirine eşittir. Yüksüz
1. ÜNİTE: MODERN ATOM TEORİSİ 1.7. İyon Yükleri ve Yükseltgenme Basamakları Yüksüz bir atomun yapısındaki pozitif (+) yüklü protonlarla negatif () yüklü elektronların sayıları birbirine eşittir. Yüksüz
PERİYODİK CETVEL-ÖSS DE ÇIKMIŞ SORULAR
 PERİODİK CETVEL-ÖSS DE ÇIKMIŞ SORULAR 1. Bir elementin periyodik cetveldeki yeri aşağıdakilerden hangisi ile belirlenir? A) Atom ağırlığı B) Değerliği C) Atom numarası D) Kimyasal özellikleri E) Fiziksel
PERİODİK CETVEL-ÖSS DE ÇIKMIŞ SORULAR 1. Bir elementin periyodik cetveldeki yeri aşağıdakilerden hangisi ile belirlenir? A) Atom ağırlığı B) Değerliği C) Atom numarası D) Kimyasal özellikleri E) Fiziksel
MADDENİN YAPISI VE ÖZELLİKLERİ ATOM
 MADDENİN YAPISI VE ÖZELLİKLERİ ATOM ATOMUN YAPISI Elementlerin tüm özelliğini gösteren en küçük parçasına atom denir. Atomu oluşturan parçacıklar farklı yüklere sa-hiptir. Atomda bulunan yükler; negatif
MADDENİN YAPISI VE ÖZELLİKLERİ ATOM ATOMUN YAPISI Elementlerin tüm özelliğini gösteren en küçük parçasına atom denir. Atomu oluşturan parçacıklar farklı yüklere sa-hiptir. Atomda bulunan yükler; negatif
İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA
 İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA İNCELENİR Her tarafında aynı özelliği gösteren, tek bir madde
İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA İNCELENİR Her tarafında aynı özelliği gösteren, tek bir madde
İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA İNCELENİR
 KARIŞIMLAR İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA İNCELENİR Her tarafında aynı özelliği gösteren, tek
KARIŞIMLAR İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA İNCELENİR Her tarafında aynı özelliği gösteren, tek
KĠMYASAL ÖZELLĠKLER VE KĠMYASAL BAĞ
 Elektronların Dizilimi ve Kimyasal Özellikler Atomların katmanlarında belirli sayılarda elektron bulunmaktadır. Ancak bir atom, tek katmanlıysa ve bu katmanda iki elektronu varsa kararlıdır. Atomun iki
Elektronların Dizilimi ve Kimyasal Özellikler Atomların katmanlarında belirli sayılarda elektron bulunmaktadır. Ancak bir atom, tek katmanlıysa ve bu katmanda iki elektronu varsa kararlıdır. Atomun iki
ATOMİK YAPI. Elektron Yükü=-1,60x10-19 C Proton Yükü=+1,60x10-19 C Nötron Yükü=0
 ATOMİK YAPI Atom, birkaç türü birleştiğinde çeşitli molekülleri, bir tek türü ise bir kimyasal öğeyi oluşturan parçacıktır. Atom, elementlerin özelliklerini taşıyan en küçük yapı birimi olup çekirdekteki
ATOMİK YAPI Atom, birkaç türü birleştiğinde çeşitli molekülleri, bir tek türü ise bir kimyasal öğeyi oluşturan parçacıktır. Atom, elementlerin özelliklerini taşıyan en küçük yapı birimi olup çekirdekteki
Serüveni 3. ÜNİTE KİMYASAL TÜRLER ARASI ETKİLEŞİM GÜÇLÜ ETKİLEŞİM. o İYONİK BAĞ o KOVALENT BAĞ o METALİK BAĞ
 Serüveni 3. ÜNİTE KİMYASAL TÜRLER ARASI ETKİLEŞİM GÜÇLÜ ETKİLEŞİM o İYONİK BAĞ o KOVALENT BAĞ o METALİK BAĞ KİMYASAL TÜR 1. İYONİK BAĞ - - Ametal.- Kök Kök Kök (+) ve (-) yüklü iyonların çekim kuvvetidir..halde
Serüveni 3. ÜNİTE KİMYASAL TÜRLER ARASI ETKİLEŞİM GÜÇLÜ ETKİLEŞİM o İYONİK BAĞ o KOVALENT BAĞ o METALİK BAĞ KİMYASAL TÜR 1. İYONİK BAĞ - - Ametal.- Kök Kök Kök (+) ve (-) yüklü iyonların çekim kuvvetidir..halde
Element ve Bileşikler
 Element ve Bileşikler Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere element denir. Bir elementi oluşturan bütün atomların
Element ve Bileşikler Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere element denir. Bir elementi oluşturan bütün atomların
Atomlar birleştiği zaman elektron dağılımındaki değişmelerin bir sonucu olarak kimyasal bağlar meydana gelir. Üç çeşit temel bağ vardır:
 Atomlar birleştiği zaman elektron dağılımındaki değişmelerin bir sonucu olarak kimyasal bağlar meydana gelir. Üç çeşit temel bağ vardır: İyonik bağlar, elektronlar bir atomdan diğerine aktarıldığı zaman
Atomlar birleştiği zaman elektron dağılımındaki değişmelerin bir sonucu olarak kimyasal bağlar meydana gelir. Üç çeşit temel bağ vardır: İyonik bağlar, elektronlar bir atomdan diğerine aktarıldığı zaman
ATOMLAR ARASI BAĞLAR Doç. Dr. Ramazan YILMAZ
 ATOMLAR ARASI BAĞLAR Doç. Dr. Ramazan YILMAZ Sakarya Üniversitesi, Teknoloji Fakültesi, Metalurji ve Malzeme Mühendisliği Bölümü Esentepe Kampüsü, 54187, SAKARYA Atomlar Arası Bağlar 1 İyonik Bağ 2 Kovalent
ATOMLAR ARASI BAĞLAR Doç. Dr. Ramazan YILMAZ Sakarya Üniversitesi, Teknoloji Fakültesi, Metalurji ve Malzeme Mühendisliği Bölümü Esentepe Kampüsü, 54187, SAKARYA Atomlar Arası Bağlar 1 İyonik Bağ 2 Kovalent
ATOM BİLGİSİ Atom Modelleri
 1. Atom Modelleri BÖLÜM2 Maddenin atom adı verilen bir takım taneciklerden oluştuğu fikri çok eskiye dayanmaktadır. Ancak, bilimsel bir (deneye dayalı) atom modeli ilk defa Dalton tarafından ileri sürülmüştür.
1. Atom Modelleri BÖLÜM2 Maddenin atom adı verilen bir takım taneciklerden oluştuğu fikri çok eskiye dayanmaktadır. Ancak, bilimsel bir (deneye dayalı) atom modeli ilk defa Dalton tarafından ileri sürülmüştür.
GENEL KİMYA. Yrd.Doç.Dr. Tuba YETİM
 GENEL KİMYA KİMYASAL BAĞLAR Lewis Kuramı Kimyasal bağlanmada esas rolü dış kabuk elektronları (değerlik) oynar. Bazı durumlarda elektronlar bir atomdan diğerine aktarılır. Böylece oluşan (+) ve (-) yüklü
GENEL KİMYA KİMYASAL BAĞLAR Lewis Kuramı Kimyasal bağlanmada esas rolü dış kabuk elektronları (değerlik) oynar. Bazı durumlarda elektronlar bir atomdan diğerine aktarılır. Böylece oluşan (+) ve (-) yüklü
Yrd. Doç. Dr. H. Hasan YOLCU. hasanyolcu.wordpress.com
 Yrd. Doç. Dr. H. Hasan YOLCU hasanyolcu.wordpress.com En az iki atomun belli bir düzenlemeyle kimyasal bağ oluşturmak suretiyle bir araya gelmesidir. Aynı atomda olabilir farklı atomlarda olabilir. H 2,
Yrd. Doç. Dr. H. Hasan YOLCU hasanyolcu.wordpress.com En az iki atomun belli bir düzenlemeyle kimyasal bağ oluşturmak suretiyle bir araya gelmesidir. Aynı atomda olabilir farklı atomlarda olabilir. H 2,
TOBB Ekonomi ve Teknoloji Üniversitesi. Genel Kimya 101. Yrd.Doç.Dr.Zeynep OBALI e-mail: zobali@etu.edu.tr Ofis: z-83/2
 Genel Kimya 101 Yrd.Doç.Dr.Zeynep OBALI e-mail: zobali@etu.edu.tr Ofis: z-83/2 İyonik Bağ; İyonik bir bileşikteki pozitif ve negatif iyonlar arasındaki etkileşime iyonik bağ denir Na Na + + e - Cl + e
Genel Kimya 101 Yrd.Doç.Dr.Zeynep OBALI e-mail: zobali@etu.edu.tr Ofis: z-83/2 İyonik Bağ; İyonik bir bileşikteki pozitif ve negatif iyonlar arasındaki etkileşime iyonik bağ denir Na Na + + e - Cl + e
PERİYODİK CETVEL. Yanıt : D. www.kimyahocam.com. 3 Li : 1s2 2s 1 2. periyot 1A grubu. 16 S : 1s2 2s 2 2p 6 3s 2 3p 4 3.
 PERİODİK CETVEL Periyodik cetvel, elementlerin atom numaraları temel alınarak düzenlenmiş bir sistemdir. Periyodik cetvelde, nötr atomlarının elektron içeren temel enerji düzeyi sayısı aynı olan elementler
PERİODİK CETVEL Periyodik cetvel, elementlerin atom numaraları temel alınarak düzenlenmiş bir sistemdir. Periyodik cetvelde, nötr atomlarının elektron içeren temel enerji düzeyi sayısı aynı olan elementler
ATOMİK YAPI. Elektron Yükü=-1,60x10-19 C Proton Yükü=+1,60x10-19 C Nötron Yükü=0
 ATOMİK YAPI Elektron Yükü=-1,60x10-19 C Proton Yükü=+1,60x10-19 C Nötron Yükü=0 Elektron Kütlesi 9,11x10-31 kg Proton Kütlesi Nötron Kütlesi 1,67x10-27 kg Bir kimyasal elementin atom numarası (Z) çekirdeğindeki
ATOMİK YAPI Elektron Yükü=-1,60x10-19 C Proton Yükü=+1,60x10-19 C Nötron Yükü=0 Elektron Kütlesi 9,11x10-31 kg Proton Kütlesi Nötron Kütlesi 1,67x10-27 kg Bir kimyasal elementin atom numarası (Z) çekirdeğindeki
Elektronların Dağılımı ve Kimyasal Özellikleri
 Elektronların Dağılımı ve Kimyasal Özellikleri Helyum (2), neon (10), argon (18)in elektron dağılımları incelendiğinde Eğer bu üç elementin birer elektronu daha olsaydı, her birinde yeni bir katman oluşacaktı.
Elektronların Dağılımı ve Kimyasal Özellikleri Helyum (2), neon (10), argon (18)in elektron dağılımları incelendiğinde Eğer bu üç elementin birer elektronu daha olsaydı, her birinde yeni bir katman oluşacaktı.
Element ve Bileşikler
 Element ve Bileşikler Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere element denir. Bir elementi oluşturan bütün atomların
Element ve Bileşikler Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere element denir. Bir elementi oluşturan bütün atomların
MOLEKÜL GEOMETRİSİ ve HİBRİTLEŞME. (Kimya Ders Notu)
 MOLEKÜL GEOMETRİSİ ve HİBRİTLEŞME (Kimya Ders Notu) MOLEKÜL GEOMETRİSİ ve HİBRİTLEŞME Periyodik cetvelde A gruplarında bulunan elementler bileşik oluştururken kendilerine en yakın olan soygazın elektron
MOLEKÜL GEOMETRİSİ ve HİBRİTLEŞME (Kimya Ders Notu) MOLEKÜL GEOMETRİSİ ve HİBRİTLEŞME Periyodik cetvelde A gruplarında bulunan elementler bileşik oluştururken kendilerine en yakın olan soygazın elektron
BÖLÜM 2 ATOMİK YAPI İÇERİK. Atom yapısı. Bağ tipleri. Chapter 2-1
 BÖLÜM 2 ATOMİK YAPI İÇERİK Atom yapısı Bağ tipleri 1 Atomların Yapıları Atomlar başlıca üç temel atom altı parçacıktan oluşur; Protonlar (+ yüklü) Nötronlar (yüksüz) Elektronlar (-yüklü) Basit bir atom
BÖLÜM 2 ATOMİK YAPI İÇERİK Atom yapısı Bağ tipleri 1 Atomların Yapıları Atomlar başlıca üç temel atom altı parçacıktan oluşur; Protonlar (+ yüklü) Nötronlar (yüksüz) Elektronlar (-yüklü) Basit bir atom
Atomlar birleştiği zaman elektron dağılımındaki değişmelerin bir sonucu olarak kimyasal bağlar meydana gelir. Üç çeşit temel bağ vardır.
 Atomlar birleştiği zaman elektron dağılımındaki değişmelerin bir sonucu olarak kimyasal bağlar meydana gelir. Üç çeşit temel bağ vardır. 1-İyonik bağlar, elektronlar bir atomdan diğerine aktarıldığı zaman
Atomlar birleştiği zaman elektron dağılımındaki değişmelerin bir sonucu olarak kimyasal bağlar meydana gelir. Üç çeşit temel bağ vardır. 1-İyonik bağlar, elektronlar bir atomdan diğerine aktarıldığı zaman
Element atomlarının atom ve kütle numaraları element sembolleri üzerinde gösterilebilir. Element atom numarası sembolün sol alt köşesine yazılır.
 Atom üç temel tanecikten oluşur. Bunlar proton, nötron ve elektrondur. Proton atomun çekirdeğinde bulunan pozitif yüklü taneciktir. Nötron atomun çekirdeğin bulunan yüksüz taneciktir. ise çekirdek etrafında
Atom üç temel tanecikten oluşur. Bunlar proton, nötron ve elektrondur. Proton atomun çekirdeğinde bulunan pozitif yüklü taneciktir. Nötron atomun çekirdeğin bulunan yüksüz taneciktir. ise çekirdek etrafında
Paylaşılan elektron ya da elektronlar, her iki çekirdek etrafında dolanacaklar, iki çekirdek arasındaki bölgede daha uzun süre bulundukları için bu
 4.Kimyasal Bağlar Kimyasal Bağlar Aynı ya da farklı cins atomları bir arada tutan kuvvetlere kimyasal bağlar denir. Pek çok madde farklı element atomlarının birleşmesiyle meydana gelmiştir. İyonik bağ
4.Kimyasal Bağlar Kimyasal Bağlar Aynı ya da farklı cins atomları bir arada tutan kuvvetlere kimyasal bağlar denir. Pek çok madde farklı element atomlarının birleşmesiyle meydana gelmiştir. İyonik bağ
FZM 220. Malzeme Bilimine Giriş
 FZM 220 Yapı Karakterizasyon Özellikler İşleme Performans Prof. Dr. İlker DİNÇER Fakültesi, Fizik Mühendisliği Bölümü 1 Atomsal Yapı ve Atomlararası Bağ1 Ders Hakkında FZM 220 Dersinin Amacı Bu dersin
FZM 220 Yapı Karakterizasyon Özellikler İşleme Performans Prof. Dr. İlker DİNÇER Fakültesi, Fizik Mühendisliği Bölümü 1 Atomsal Yapı ve Atomlararası Bağ1 Ders Hakkında FZM 220 Dersinin Amacı Bu dersin
MADDE NEDİR? Çevremize baktığımızda gördüğümüz her şey örneğin, dağlar, denizler, ağaçlar, bitkiler, hayvanlar ve hava birer maddedir.
 MADDE NEDİR? Çevremize baktığımızda gördüğümüz her şey örneğin, dağlar, denizler, ağaçlar, bitkiler, hayvanlar ve hava birer maddedir. Her maddenin bir kütlesi vardır ve bu tartılarak bulunur. Ayrıca her
MADDE NEDİR? Çevremize baktığımızda gördüğümüz her şey örneğin, dağlar, denizler, ağaçlar, bitkiler, hayvanlar ve hava birer maddedir. Her maddenin bir kütlesi vardır ve bu tartılarak bulunur. Ayrıca her
kitabı olarak önerilen, Erdik ve Sarıkaya nın
 PERİYODİK CETVEL Aşağıda verilen özet bilginin ayrıntısını, ders kitabı olarak önerilen, Erdik ve Sarıkaya nın Temel Üniversitesi Kimyası" Kitabı ndan okuyunuz. Modern periyotlu dizge, elementleri artan
PERİYODİK CETVEL Aşağıda verilen özet bilginin ayrıntısını, ders kitabı olarak önerilen, Erdik ve Sarıkaya nın Temel Üniversitesi Kimyası" Kitabı ndan okuyunuz. Modern periyotlu dizge, elementleri artan
2. HAMLE web:
 2. HAMLE Nötron sayısı İZOTOP ATOM 1-Proton sayıları... nötron ve kütle numaraları.. atomlardır. 2-İzotop atomların fiziksel özellikleri. 3-Nötr izotop atomlar kimyasal özellikleri. 4-İzotop atomlar aynı
2. HAMLE Nötron sayısı İZOTOP ATOM 1-Proton sayıları... nötron ve kütle numaraları.. atomlardır. 2-İzotop atomların fiziksel özellikleri. 3-Nötr izotop atomlar kimyasal özellikleri. 4-İzotop atomlar aynı
Serüveni PERİYODİK ÖZELLİKLER DEĞİŞİMİ
 Serüveni PERİYODİK ÖZELLİKLER DEĞİŞİMİ PERİYODİK ÖZELLİKLERİN DEĞİŞİMİ ATOM YARIÇAPI Çekirdeğin merkezi ile en dış kabukta bulunan elektronlar arasındaki uzaklık olarak tanımlanır. Periyodik tabloda aynı
Serüveni PERİYODİK ÖZELLİKLER DEĞİŞİMİ PERİYODİK ÖZELLİKLERİN DEĞİŞİMİ ATOM YARIÇAPI Çekirdeğin merkezi ile en dış kabukta bulunan elektronlar arasındaki uzaklık olarak tanımlanır. Periyodik tabloda aynı
PERİYODİK CETVEL Mendeleev Henry Moseley Glenn Seaborg
 PERİYODİK CETVEL Periyodik cetvel elementleri sınıflandırmak için hazırlanmıştır. İlkperiyodik cetvel Mendeleev tarafından yapılmıştır. Mendeleev elementleri artan kütle numaralarına göre sıralamış ve
PERİYODİK CETVEL Periyodik cetvel elementleri sınıflandırmak için hazırlanmıştır. İlkperiyodik cetvel Mendeleev tarafından yapılmıştır. Mendeleev elementleri artan kütle numaralarına göre sıralamış ve
ANADOLU ÜNİVERSİTESİ ECZACILIK FAKÜLTESİ FARMASÖTİK KİMYA ANABİLİMDALI GENEL KİMYA II DERS NOTLARI (ORGANİK KİMYAYA GİRİŞ)
 ANADOLU ÜNİVERSİTESİ ECZACILIK FAKÜLTESİ FARMASÖTİK KİMYA ANABİLİMDALI GENEL KİMYA II DERS NOTLARI (ORGANİK KİMYAYA GİRİŞ) Hazırlayan: Doç. Dr. Yusuf ÖZKAY 1. Organik bileşik kavramının tarihsel gelişimi
ANADOLU ÜNİVERSİTESİ ECZACILIK FAKÜLTESİ FARMASÖTİK KİMYA ANABİLİMDALI GENEL KİMYA II DERS NOTLARI (ORGANİK KİMYAYA GİRİŞ) Hazırlayan: Doç. Dr. Yusuf ÖZKAY 1. Organik bileşik kavramının tarihsel gelişimi
MALZEME BİLGİSİ DERS 4 DR. FATİH AY.
 MALZEME BİLGİSİ DERS 4 DR. FATİH AY www.fatihay.net fatihay@fatihay.net GEÇEN HAFTA TEMEL KAVRAMLAR ATOMLARDA ELEKTRONLAR PERİYODİK TABLO BÖLÜM II ATOM YAPISI VE ATOMLARARASı BAĞLAR BAĞ KUVVETLERİ VE ENERJİLERİ
MALZEME BİLGİSİ DERS 4 DR. FATİH AY www.fatihay.net fatihay@fatihay.net GEÇEN HAFTA TEMEL KAVRAMLAR ATOMLARDA ELEKTRONLAR PERİYODİK TABLO BÖLÜM II ATOM YAPISI VE ATOMLARARASı BAĞLAR BAĞ KUVVETLERİ VE ENERJİLERİ
KİMYASAL BAĞLAR Kimyasal bağlar, Moleküllerde atomları birarada tutan
 KİMYASAL BAĞLAR Kimyasal bağlar, Moleküllerde atomları birarada tutan kuvvettir. Atomlar birleştiği zaman elektron dağılımındaki değişmelerin bir sonucu olarak kimyasal bağlar meydana gelir. Atomun sembolünün
KİMYASAL BAĞLAR Kimyasal bağlar, Moleküllerde atomları birarada tutan kuvvettir. Atomlar birleştiği zaman elektron dağılımındaki değişmelerin bir sonucu olarak kimyasal bağlar meydana gelir. Atomun sembolünün
Periyodik Tablo(sistem)
 Periyodik Tablo(sistem) Geçmişten Günümüze Periyodik Tablo Bilim adamları elementlerin sayısı arttıkça bunları benzer özelliklerine göre sıralamaya çalışmışlardır.(bunu süpermarketlerdeki ürünlerin dizilişlerine
Periyodik Tablo(sistem) Geçmişten Günümüze Periyodik Tablo Bilim adamları elementlerin sayısı arttıkça bunları benzer özelliklerine göre sıralamaya çalışmışlardır.(bunu süpermarketlerdeki ürünlerin dizilişlerine
Yrd.Doç.Dr. Emre YALAMAÇ. Yrd.Doç.Dr. Emre YALAMAÇ İÇERİK
 İÇERİK Elementlere, Bileşiklere ve Karışımlara atomik boyutta bakış Dalton Atom Modeli Atom Fiziğinde Buluşlar - Elektronların Keşfi - Atom Çekirdeği Keşfi Günümüz Atom Modeli Kimyasal Elementler Periyodik
İÇERİK Elementlere, Bileşiklere ve Karışımlara atomik boyutta bakış Dalton Atom Modeli Atom Fiziğinde Buluşlar - Elektronların Keşfi - Atom Çekirdeği Keşfi Günümüz Atom Modeli Kimyasal Elementler Periyodik
PERİYODİK SİSTEM VE ELEKTRON DİZİLİMLERİ#6
 PERİYODİK SİSTEM VE ELEKTRON DİZİLİMLERİ#6 Periyodik sistemde yatay sıralara Düşey sütunlara.. adı verilir. 1.periyotta element, 2 ve 3. periyotlarda..element, 4 ve 5.periyotlarda.element 6 ve 7. periyotlarda
PERİYODİK SİSTEM VE ELEKTRON DİZİLİMLERİ#6 Periyodik sistemde yatay sıralara Düşey sütunlara.. adı verilir. 1.periyotta element, 2 ve 3. periyotlarda..element, 4 ve 5.periyotlarda.element 6 ve 7. periyotlarda
ATOM ve YAPISI Maddelerin gözle görülmeyen (bölünmeyen) en parçasına atom denir. Atom kendinden başka hiçbir fiziksel ya da kimyasal metotlarla
 ATOM ve YAPISI Maddelerin gözle görülmeyen (bölünmeyen) en parçasına atom denir. Atom kendinden başka hiçbir fiziksel ya da kimyasal metotlarla kendinden farklı atomlara dönüşemezler. Atomda (+) yüklü
ATOM ve YAPISI Maddelerin gözle görülmeyen (bölünmeyen) en parçasına atom denir. Atom kendinden başka hiçbir fiziksel ya da kimyasal metotlarla kendinden farklı atomlara dönüşemezler. Atomda (+) yüklü
2+ 2- Mg SO 4. (NH 4 ) 2 SO 4 (amonyum sülfat) bileşiğini katyon ve anyonlara ayıralım.
 KONU: Kimyasal Tepkimeler Dersin Adı Dersin Konusu İYONİK BİLEŞİKLERİN FORMÜLLERİNİN YAZILMASI İyonik bağlı bileşiklerin formüllerini yazmak için atomların yüklerini bilmek gerekir. Bunu da daha önceki
KONU: Kimyasal Tepkimeler Dersin Adı Dersin Konusu İYONİK BİLEŞİKLERİN FORMÜLLERİNİN YAZILMASI İyonik bağlı bileşiklerin formüllerini yazmak için atomların yüklerini bilmek gerekir. Bunu da daha önceki
I. FOTOELEKTRON SPEKTROSKOPĠSĠ (PES) PES orbital enerjilerini doğrudan tayin edebilir. (Fotoelektrik etkisine benzer!)
 5.111 Ders Özeti #9 Bugün için okuma: Bölüm 1.14 (3.Baskıda, 1.13) Elektronik Yapı ve Periyodik Çizelge, Bölüm 1.15, 1.16, 1.17, 1.18, ve 1.20 (3.Baskıda, 1.14, 1.15, 1.16, 1.17, ve 1.19) Atom Özelliklerinde
5.111 Ders Özeti #9 Bugün için okuma: Bölüm 1.14 (3.Baskıda, 1.13) Elektronik Yapı ve Periyodik Çizelge, Bölüm 1.15, 1.16, 1.17, 1.18, ve 1.20 (3.Baskıda, 1.14, 1.15, 1.16, 1.17, ve 1.19) Atom Özelliklerinde
ÖĞRENME ALANI : MADDE VE DEĞĐŞĐM ÜNĐTE 3 : MADDENĐN YAPISI VE ÖZELLĐKLERĐ
 ÖĞRENME ALANI : MADDE VE DEĞĐŞĐM ÜNĐTE 3 : MADDENĐN YAPISI VE ÖZELLĐKLERĐ C- BĐLEŞĐKLER VE BĐLEŞĐK FORMÜLLERĐ (4 SAAT) 1- Bileşikler 2- Đyonik Yapılı Bileşik Formüllerinin Yazılması 3- Đyonlar ve Değerlikleri
ÖĞRENME ALANI : MADDE VE DEĞĐŞĐM ÜNĐTE 3 : MADDENĐN YAPISI VE ÖZELLĐKLERĐ C- BĐLEŞĐKLER VE BĐLEŞĐK FORMÜLLERĐ (4 SAAT) 1- Bileşikler 2- Đyonik Yapılı Bileşik Formüllerinin Yazılması 3- Đyonlar ve Değerlikleri
GENEL KİMYA. Yrd.Doç.Dr. Tuba YETİM
 GENEL KİMYA ATOMUN ELEKTRON YAPISI Bohr atom modelinde elektronun bulunduğu yer için yörünge tanımlaması kullanılırken, kuantum mekaniğinde bunun yerine orbital tanımlaması kullanılır. Orbital, elektronun
GENEL KİMYA ATOMUN ELEKTRON YAPISI Bohr atom modelinde elektronun bulunduğu yer için yörünge tanımlaması kullanılırken, kuantum mekaniğinde bunun yerine orbital tanımlaması kullanılır. Orbital, elektronun
MOL KAVRAMI I. ÖRNEK 2
 MOL KAVRAMI I Maddelerin taneciklerden oluştuğunu biliyoruz. Bu taneciklere atom, molekül ya da iyon denir. Atom : Kimyasal yöntemlerle daha basit taneciklere ayrılmayan ve elementlerin yapıtaşı olan taneciklere
MOL KAVRAMI I Maddelerin taneciklerden oluştuğunu biliyoruz. Bu taneciklere atom, molekül ya da iyon denir. Atom : Kimyasal yöntemlerle daha basit taneciklere ayrılmayan ve elementlerin yapıtaşı olan taneciklere
1H: 1s 1 1.periyot 1A grubu. 5B: 1s 2 2s 2 2p 1 2.periyot 3A grubu. 8O: 1s 2 2s 2 2p 4 2.periyot 6A grubu. 10Ne: 1s 2 2s 2 2p 6
 PERİYODİK CETVEL Periyodik cetvel, benzer kimyasal özellik gösteren elementlerin alt alta gelecek şekilde artan atom numaralarına göre sıralandıkları çizelgelerdir. Periyodik cetveli oluşturan yatay satırlara
PERİYODİK CETVEL Periyodik cetvel, benzer kimyasal özellik gösteren elementlerin alt alta gelecek şekilde artan atom numaralarına göre sıralandıkları çizelgelerdir. Periyodik cetveli oluşturan yatay satırlara
Chemistry, The Central Science, 10th edition Theodore L. Brown; H. Eugene LeMay, Jr.; and Bruce E. Bursten. Kimyasal Bağlar.
 Chemistry, The Central Science, 10th edition Theodore L. Brown; H. Eugene LeMay, Jr.; and Bruce E. Bursten Kimyasal Bağlar Kimyasal Bağlar 3 temel tip bağ vardır: İyonik İyonlar arası elektrostatik etkileşim
Chemistry, The Central Science, 10th edition Theodore L. Brown; H. Eugene LeMay, Jr.; and Bruce E. Bursten Kimyasal Bağlar Kimyasal Bağlar 3 temel tip bağ vardır: İyonik İyonlar arası elektrostatik etkileşim
İNSTAGRAM:kimyaci_glcn_hoca
 MODERN ATOM TEORİSİ ATOMUN KUANTUM MODELİ Bohr atom modeli 1 H, 2 He +, 3Li 2+ vb. gibi tek elektronlu atom ve iyonların çizgi spektrumlarını başarıyla açıklamıştır.ancak çok elektronlu atomların çizgi
MODERN ATOM TEORİSİ ATOMUN KUANTUM MODELİ Bohr atom modeli 1 H, 2 He +, 3Li 2+ vb. gibi tek elektronlu atom ve iyonların çizgi spektrumlarını başarıyla açıklamıştır.ancak çok elektronlu atomların çizgi
PERĐYODĐK ÇĐZELGE. Yrd.Doç.Dr. İbrahim İsmet ÖZTÜRK
 PERĐYODĐK ÇĐZELGE Yrd.Doç.Dr. İbrahim İsmet ÖZTÜRK 8.1. PERĐYODĐK ÇĐZELGENĐN GELĐŞMESĐ 8.2. ELEMENTLERĐN PERĐYODĐK SINIFLANDIRILMASI Katyon ve Anyonların Elektron Dağılımları 8.3.FĐZĐKSEL ÖZELLĐKLERDEKĐ
PERĐYODĐK ÇĐZELGE Yrd.Doç.Dr. İbrahim İsmet ÖZTÜRK 8.1. PERĐYODĐK ÇĐZELGENĐN GELĐŞMESĐ 8.2. ELEMENTLERĐN PERĐYODĐK SINIFLANDIRILMASI Katyon ve Anyonların Elektron Dağılımları 8.3.FĐZĐKSEL ÖZELLĐKLERDEKĐ
Oksijen, flor ve neon elementlerinin kullanıldığı alanları araştırınız.
 Oksijen, flor ve neon elementlerinin kullanıldığı alanları araştırınız. 3.2 KİMYASAL BAĞLAR Çevrenizdeki maddeleri inceleyiniz. Bu maddelerin neden bu kadar çeşitli olduğunu düşündünüz mü? Eğer bu çeşitlilik
Oksijen, flor ve neon elementlerinin kullanıldığı alanları araştırınız. 3.2 KİMYASAL BAĞLAR Çevrenizdeki maddeleri inceleyiniz. Bu maddelerin neden bu kadar çeşitli olduğunu düşündünüz mü? Eğer bu çeşitlilik
KİMYASAL BAĞLAR İYONİK BAĞLAR KOVALENT BAĞLAR
 KİMYASAL BAĞLAR Kimyasal bağ, moleküllerde atomları bir arada tutan kuvvettir. Atomlar daha düşük enerjili duruma erişmek için bir araya gelirler. Bir bağın oluşabilmesi için atomlar tek başına bulundukları
KİMYASAL BAĞLAR Kimyasal bağ, moleküllerde atomları bir arada tutan kuvvettir. Atomlar daha düşük enerjili duruma erişmek için bir araya gelirler. Bir bağın oluşabilmesi için atomlar tek başına bulundukları
ATOMLAR ARASI BAĞLAR
 MALZEME 2. HAFTA 1 ATOMSAL BAĞ ATOMLAR ARASI BAĞLAR Atomlar, atomlar arası bağ kuvvetleri ile bir araya gelirler. Malzemenin en küçük yapı taşı olan atomları bağ kuvvetleri bir arada tutar. Atomsal bağların
MALZEME 2. HAFTA 1 ATOMSAL BAĞ ATOMLAR ARASI BAĞLAR Atomlar, atomlar arası bağ kuvvetleri ile bir araya gelirler. Malzemenin en küçük yapı taşı olan atomları bağ kuvvetleri bir arada tutar. Atomsal bağların
KİMYASAL TÜRLER VE ETKİLEŞİMLER. Kimya Ders Notu
 KİMYASAL TÜRLER VE ETKİLEŞİMLER Kimya Ders Notu KİMYASAL TÜRLER Atomlar, moleküller iyonlar ve radikaller genel olarak kimyasal tür adı ile bilinirler. Atom: Bir elementin bütün özelliğini taşıyan en küçük
KİMYASAL TÜRLER VE ETKİLEŞİMLER Kimya Ders Notu KİMYASAL TÜRLER Atomlar, moleküller iyonlar ve radikaller genel olarak kimyasal tür adı ile bilinirler. Atom: Bir elementin bütün özelliğini taşıyan en küçük
ELEKTRONLARIN DİZİLİMİ, KİMYASAL ÖZELLİKLERİ VE
 ELEKTRONLARIN DİZİLİMİ, KİMYASAL ÖZELLİKLERİ VE ELEMENTLER ELEMENTLER METALLER AMETALLER SOYGAZLAR Hiçbir kimyasal ayırma yöntemi ile kendinden daha basit maddelere ayrıştırılamayan saf maddelere element
ELEKTRONLARIN DİZİLİMİ, KİMYASAL ÖZELLİKLERİ VE ELEMENTLER ELEMENTLER METALLER AMETALLER SOYGAZLAR Hiçbir kimyasal ayırma yöntemi ile kendinden daha basit maddelere ayrıştırılamayan saf maddelere element
maddelere saf maddeler denir
 Madde :Kütlesi olan her şeye madde denir. Saf madde: Aynı cins atom veya moleküllerden oluşan maddeye denir. Fiziksel yollarla kendisinden başka maddelere ayrışmayan maddelere saf maddeler denir Element:
Madde :Kütlesi olan her şeye madde denir. Saf madde: Aynı cins atom veya moleküllerden oluşan maddeye denir. Fiziksel yollarla kendisinden başka maddelere ayrışmayan maddelere saf maddeler denir Element:
Aşağıdaki bileşiklerde atomlar arasmda oluşan bağlan noktalı yerlere yazınız. (fi» jh» w& 12^S»ııNa, çf, 17CI) ı. ch4... 2...
 Aşağıdaki bileşiklerde atomlar arasmda oluşan bağlan noktalı yerlere yazınız. (fi» jh» w& 12^S»ııNa, çf, 17CI) ı. ch4... 2.... 3. MgCI2... 4. NaF... Bileşik Formülleri Bileşik formüllerinin yazılması İki
Aşağıdaki bileşiklerde atomlar arasmda oluşan bağlan noktalı yerlere yazınız. (fi» jh» w& 12^S»ııNa, çf, 17CI) ı. ch4... 2.... 3. MgCI2... 4. NaF... Bileşik Formülleri Bileşik formüllerinin yazılması İki
SCHRÖDİNGER: Elektronun yeri (yörüngesi ve orbitali) birer dalga fonksiyonu olan n, l, m l olarak ifade edilen kuantum sayıları ile belirlenir.
 . ATOMUN KUANTUM MODELİ SCHRÖDİNGER: Elektronun yeri (yörüngesi ve orbitali) birer dalga fonksiyonu olan n, l, m l olarak ifade edilen kuantum sayıları ile belirlenir. Orbital: Elektronların çekirdek etrafında
. ATOMUN KUANTUM MODELİ SCHRÖDİNGER: Elektronun yeri (yörüngesi ve orbitali) birer dalga fonksiyonu olan n, l, m l olarak ifade edilen kuantum sayıları ile belirlenir. Orbital: Elektronların çekirdek etrafında
ATOMİK YAPI VE ATOMLAR ARASI BAĞLAR. Aytekin Hitit
 ATOMİK YAPI VE ATOMLAR ARASI BAĞLAR Aytekin Hitit Malzemeler neden farklı özellikler gösterirler? Özellikler Fiziksel Kimyasal Bahsi geçen yapısal etkenlerden elektron düzeni değiştirilemez. Ancak diğer
ATOMİK YAPI VE ATOMLAR ARASI BAĞLAR Aytekin Hitit Malzemeler neden farklı özellikler gösterirler? Özellikler Fiziksel Kimyasal Bahsi geçen yapısal etkenlerden elektron düzeni değiştirilemez. Ancak diğer
BİYOLOJİK MOLEKÜLLERDEKİ
 BİYOLOJİK MOLEKÜLLERDEKİ KİMYASALBAĞLAR BAĞLAR KİMYASAL VE HÜCRESEL REAKSİYONLAR Yrd. Doç.Dr. Funda BULMUŞ Atomun Yapısı Maddenin en küçük yapı taşı olan atom elektron, proton ve nötrondan oluşmuştur.
BİYOLOJİK MOLEKÜLLERDEKİ KİMYASALBAĞLAR BAĞLAR KİMYASAL VE HÜCRESEL REAKSİYONLAR Yrd. Doç.Dr. Funda BULMUŞ Atomun Yapısı Maddenin en küçük yapı taşı olan atom elektron, proton ve nötrondan oluşmuştur.
Müh. Fak. G. Kimya Vize Soru ve Cevapları A Mühendislik Fakültesi Genel Kimya (Kimya Metal. ve Malz.)) Ara Sınav Soruları
 Müh. Fak. G. Kimya Vize Soru ve Cevapları A 08.11.2017 Adı ve Soyadı:.. Fak. No:... Mühendislik Fakültesi Genel Kimya (Kimya Metal. ve Malz.)) Ara Sınav Soruları 1) Bilinen tüm yöntemlerle kendisinden
Müh. Fak. G. Kimya Vize Soru ve Cevapları A 08.11.2017 Adı ve Soyadı:.. Fak. No:... Mühendislik Fakültesi Genel Kimya (Kimya Metal. ve Malz.)) Ara Sınav Soruları 1) Bilinen tüm yöntemlerle kendisinden
1. İskelet yapısını çiziniz. H ve F daima uç atomlardır. En düşük iyonlaşma enerjisine sahip element merkez atomudur (bazı istisnalar mevcuttur).
 5.111 Ders Özeti #11 Bugün için okuma: Bölüm 2.7 (3. Baskıda 2.8) Rezonans ve Bölüm 2.8 (3. Baskıda 2.9) Formal Yük. Ders #12 için okuma: Bölüm 2.9 (3. Baskıda 2.10) Radikaller ve Biradikaller, Bölüm 2.10
5.111 Ders Özeti #11 Bugün için okuma: Bölüm 2.7 (3. Baskıda 2.8) Rezonans ve Bölüm 2.8 (3. Baskıda 2.9) Formal Yük. Ders #12 için okuma: Bölüm 2.9 (3. Baskıda 2.10) Radikaller ve Biradikaller, Bölüm 2.10
MOLEKÜLLERİN ŞEKİLLERİ
 MOLEKÜLLERİN ŞEKİLLERİ Moleküllerin ve İyonların Lewis Yapısıyla Gösterimi 1- Oktet Kuralı Kullanılarak Lewis Yapılarının Yazımı: - Tek Bağlı Moleküller için Lewis Yapıları - Çok Katlı Bağ Moleküller için
MOLEKÜLLERİN ŞEKİLLERİ Moleküllerin ve İyonların Lewis Yapısıyla Gösterimi 1- Oktet Kuralı Kullanılarak Lewis Yapılarının Yazımı: - Tek Bağlı Moleküller için Lewis Yapıları - Çok Katlı Bağ Moleküller için
5.111 Ders Özeti #12. Konular: I. Oktet kuralından sapmalar
 5.111 Ders Özeti #12 Bugün için okuma: Bölüm 2.9 (3. Baskıda 2.10), Bölüm 2.10 (3. Baskıda 2.11), Bölüm 2.11 (3. Baskıda 2.12), Bölüm 2.3 (3. Baskıda 2.1), Bölüm 2.12 (3. Baskıda 2.13). Ders #13 için okuma:
5.111 Ders Özeti #12 Bugün için okuma: Bölüm 2.9 (3. Baskıda 2.10), Bölüm 2.10 (3. Baskıda 2.11), Bölüm 2.11 (3. Baskıda 2.12), Bölüm 2.3 (3. Baskıda 2.1), Bölüm 2.12 (3. Baskıda 2.13). Ders #13 için okuma:
SU VE KİMYASAL BAĞLAR. Yrd. Doç. Dr. Osman İBİŞ
 SU VE KİMYASAL BAĞLAR Yrd. Doç. Dr. Osman İBİŞ Kimyasal Bağlar ve Çeşitleri Nelerdir? Kimyasal bağ, çekirdekteki atomları bir arada tutan kuvvettir. İki ya da daha fazla atom arasında elektron alışverişi
SU VE KİMYASAL BAĞLAR Yrd. Doç. Dr. Osman İBİŞ Kimyasal Bağlar ve Çeşitleri Nelerdir? Kimyasal bağ, çekirdekteki atomları bir arada tutan kuvvettir. İki ya da daha fazla atom arasında elektron alışverişi
Bileşikteki atomların cinsini ve oranını belirten formüldür. Kaba formül ile bileşiğin molekül ağırlığı hesaplanamaz.
 BİLEŞİKLER Birden fazla elementin belirli oranlarda kimyasal yollarla bir araya gelerek, kendi özelligini kaybedip oluşturdukları yeni saf maddeye bileşik denir. Bileşikteki atomların cins ve sayısını
BİLEŞİKLER Birden fazla elementin belirli oranlarda kimyasal yollarla bir araya gelerek, kendi özelligini kaybedip oluşturdukları yeni saf maddeye bileşik denir. Bileşikteki atomların cins ve sayısını
Elektronların Dizilimi ve Kimyasal Bağlar
 Elektronların Dizilimi ve Kimyasal Bağlar Elektronların Dizilimi Elektronlar çekirdek çevresindeki yörüngelerde dönerek hareket ederler. Çekirdeğe en yakın yörünge 1 olmak üzere dışa doğru 2, 3,4... olarak
Elektronların Dizilimi ve Kimyasal Bağlar Elektronların Dizilimi Elektronlar çekirdek çevresindeki yörüngelerde dönerek hareket ederler. Çekirdeğe en yakın yörünge 1 olmak üzere dışa doğru 2, 3,4... olarak
GÜLEN MUHARREM PAKOĞLU ORTAOKULU FEN BİLİMLERİ 8 SORU BANKASI
 1- John Newlands: Bilinen elementleri artan atom ağırlıklarına göre sıralamıştır. Alexandre Beguyer de Chancourtois: İlk periyodik çizelgeyi oluşturmuştur. Elementler dışında bazı iyon ve bileşiklere de
1- John Newlands: Bilinen elementleri artan atom ağırlıklarına göre sıralamıştır. Alexandre Beguyer de Chancourtois: İlk periyodik çizelgeyi oluşturmuştur. Elementler dışında bazı iyon ve bileşiklere de
ATOM NEDİR? -Atom elementin özelliğini taşıyan en küçük parçasına denir. Her canlı-cansız madde atomdan oluşmuştur.
 DERS: KİMYA KONU : ATOM YAPISI ATOM NEDİR? -Atom elementin özelliğini taşıyan en küçük parçasına denir. Her canlı-cansız madde atomdan oluşmuştur. Atom Modelleri Dalton Bütün maddeler atomlardan yapılmıştır.
DERS: KİMYA KONU : ATOM YAPISI ATOM NEDİR? -Atom elementin özelliğini taşıyan en küçük parçasına denir. Her canlı-cansız madde atomdan oluşmuştur. Atom Modelleri Dalton Bütün maddeler atomlardan yapılmıştır.
1- ELEMENTLER: 2. BÖLÜM SAF MADDELER. saf madde denir.
 2. BÖLÜM SAF MADDELER Saf madde: Aynı cins taneciklerden oluşan ( yani aynı cins atomlardan ya da aynı cins moleküllerden oluşan ) maddelere saf madde denir. SAF MADDELER - Elementler - Bileşikler olmak
2. BÖLÜM SAF MADDELER Saf madde: Aynı cins taneciklerden oluşan ( yani aynı cins atomlardan ya da aynı cins moleküllerden oluşan ) maddelere saf madde denir. SAF MADDELER - Elementler - Bileşikler olmak
İÇERİK. Lewis Kuramı. Kovalent Bağlar. Polar Kovalent Bağlar. Lewis Yapılarının Yazımı. Oktet Kuralının Istisnaları.
 İÇERİK Lewis Kuramı Kovalent Bağlar Polar Kovalent Bağlar Lewis Yapılarının Yazımı Oktet Kuralının Istisnaları Molekül Şekilleri Prentice-Hall 2002 LEWIS KURAMI Lewis Kuramı kimyasal bağı gösteren en basit
İÇERİK Lewis Kuramı Kovalent Bağlar Polar Kovalent Bağlar Lewis Yapılarının Yazımı Oktet Kuralının Istisnaları Molekül Şekilleri Prentice-Hall 2002 LEWIS KURAMI Lewis Kuramı kimyasal bağı gösteren en basit
KİMYASAL TÜRLER ARASI ETKİLEŞİMLER
 KİMYASAL TÜRLER KİMYASAL TÜRLER ARASI ETKİLEŞİMLER Atom: Molekül: İyon: Bir elementin tüm kimyasal özelliklerini gösteren yapı taşıdır... : :.. He Ne H.... : Ar : N. Ȯ.. :.. Cl.. Kararlı atomlar (Soygazlar)
KİMYASAL TÜRLER KİMYASAL TÜRLER ARASI ETKİLEŞİMLER Atom: Molekül: İyon: Bir elementin tüm kimyasal özelliklerini gösteren yapı taşıdır... : :.. He Ne H.... : Ar : N. Ȯ.. :.. Cl.. Kararlı atomlar (Soygazlar)
Fen ve Teknoloji 8 KİMYASALBAĞLAR. Oksijen atomunun periyodik çizelgedeki yerini bulalım. Yük (değerlik e - sayısı) O 8 = 2) 6) Anahtar Kavramlar
 KİMYASALBAĞLAR Anahtar Kavramlar Kovalent Bağ İyonik Bağ KAZANIM 2.1 Metallerin elektron vermeye, ametallerin elektron almaya yatkın olduğunu fark eder. Oksijen atomunun periyodik çizelgedeki yerini bulalım.
KİMYASALBAĞLAR Anahtar Kavramlar Kovalent Bağ İyonik Bağ KAZANIM 2.1 Metallerin elektron vermeye, ametallerin elektron almaya yatkın olduğunu fark eder. Oksijen atomunun periyodik çizelgedeki yerini bulalım.
KİM-117 TEMEL KİMYA Prof. Dr. Zeliha HAYVALI Ankara Üniversitesi Kimya Bölümü
 KİM-117 TEMEL KİMYA Prof. Dr. Zeliha AYVALI Ankara Üniversitesi Kimya Bölümü Bu slaytlarda anlatılanlar sadece özet olup ayrıntılı bilgiler ve örnek çözümleri derste verilecektir. BÖLÜM 6 KİMYASAL BAĞLAR
KİM-117 TEMEL KİMYA Prof. Dr. Zeliha AYVALI Ankara Üniversitesi Kimya Bölümü Bu slaytlarda anlatılanlar sadece özet olup ayrıntılı bilgiler ve örnek çözümleri derste verilecektir. BÖLÜM 6 KİMYASAL BAĞLAR
Her madde atomlardan oluşur
 2 Yaşamın kimyası Figure 2.1 Helyum Atomu Çekirdek Her madde atomlardan oluşur 2.1 Atom yapısı - madde özelliği Elektron göz ardı edilebilir kütle; eksi yük Çekirdek: Protonlar kütlesi var; artı yük Nötronlar
2 Yaşamın kimyası Figure 2.1 Helyum Atomu Çekirdek Her madde atomlardan oluşur 2.1 Atom yapısı - madde özelliği Elektron göz ardı edilebilir kütle; eksi yük Çekirdek: Protonlar kütlesi var; artı yük Nötronlar
İyonlar. İyon? Pozitif veya negatif yükü olan bir atoma yada atomlar grubuna iyon denir.
 İyonlar İyon? Pozitif veya negatif yükü olan bir atoma yada atomlar grubuna iyon denir. 1 Atomlardan İyon Oluşumu ve İyon Bir atomdan iyon denilen yüklü bir parçacık oluşturulabilir. Bunun için, nötral
İyonlar İyon? Pozitif veya negatif yükü olan bir atoma yada atomlar grubuna iyon denir. 1 Atomlardan İyon Oluşumu ve İyon Bir atomdan iyon denilen yüklü bir parçacık oluşturulabilir. Bunun için, nötral
ATOMUN YAPISI VE PERIYODIK CETVEL
 ATOMUN YAPISI VE PERIYODIK CETVEL DALTON ATOM TEORISI - Tüm maddeler atomlardan yapılmıştır. - Farklı maddelerin atomlarıda birbirlerinden farklıdır. - Bir bileşiği oluşturan atomların kütleleri arasında
ATOMUN YAPISI VE PERIYODIK CETVEL DALTON ATOM TEORISI - Tüm maddeler atomlardan yapılmıştır. - Farklı maddelerin atomlarıda birbirlerinden farklıdır. - Bir bileşiği oluşturan atomların kütleleri arasında
MADDENİN YAPISI VE ÖZELLİKLERİ
 MADDENİN YAPISI VE ÖZELLİKLERİ 1. Atomun Yapısı KONULAR 2.Element ve Sembolleri 3. Elektronların Dizilimi ve Kimyasal Özellikler 4. Kimyasal Bağ 5. Bileşikler ve Formülleri 6. Karışımlar 1.Atomun Yapısı
MADDENİN YAPISI VE ÖZELLİKLERİ 1. Atomun Yapısı KONULAR 2.Element ve Sembolleri 3. Elektronların Dizilimi ve Kimyasal Özellikler 4. Kimyasal Bağ 5. Bileşikler ve Formülleri 6. Karışımlar 1.Atomun Yapısı
CANLILARIN KİMYASAL İÇERİĞİ
 CANLILARIN KİMYASAL İÇERİĞİ Prof. Dr. Bektaş TEPE Canlıların Savunma Amaçlı Kimyasal Üretimi 2 Bu ünite ile; Canlılık öğretisinde kullanılan kimyasal kavramlar Hiyerarşi düzeyi Hiyerarşiden sorumlu atom
CANLILARIN KİMYASAL İÇERİĞİ Prof. Dr. Bektaş TEPE Canlıların Savunma Amaçlı Kimyasal Üretimi 2 Bu ünite ile; Canlılık öğretisinde kullanılan kimyasal kavramlar Hiyerarşi düzeyi Hiyerarşiden sorumlu atom
ELEMENT VE BİLEŞİKLER
 ELEMENT VE BİLEŞİKLER ELEMENT : Aynı cins atomlardan meydana gelmiş saf maddelere denir. ÖZELLİKLERİ: 1.Yapılarında aynı cins atom bulundururlar. Demir elementi Demir atomları Demir elementinin yapısında
ELEMENT VE BİLEŞİKLER ELEMENT : Aynı cins atomlardan meydana gelmiş saf maddelere denir. ÖZELLİKLERİ: 1.Yapılarında aynı cins atom bulundururlar. Demir elementi Demir atomları Demir elementinin yapısında
ATOMUN YAPISI. Özhan ÇALIŞ. Bilgi İletişim ve Teknolojileri
 ATOMUN YAPISI ATOMLAR Atom, elementlerin en küçük kimyasal yapıtaşıdır. Atom çekirdeği: genel olarak nükleon olarak adlandırılan proton ve nötronlardan meydana gelmiştir. Elektronlar: çekirdeğin etrafında
ATOMUN YAPISI ATOMLAR Atom, elementlerin en küçük kimyasal yapıtaşıdır. Atom çekirdeği: genel olarak nükleon olarak adlandırılan proton ve nötronlardan meydana gelmiştir. Elektronlar: çekirdeğin etrafında
.NO 2,.ClO 2,.NO gibi moleküller radikal
 KİMYASAL TÜRLER Kimyasal türler maddelerin özelliklerini taşıyan en küçük yapı taşlarıdır. Bu türler atomlar, iyonlar, moleküller veya radikaller olabilir. Kimyasal türler Atom Molekül İyon Radikal ATOM
KİMYASAL TÜRLER Kimyasal türler maddelerin özelliklerini taşıyan en küçük yapı taşlarıdır. Bu türler atomlar, iyonlar, moleküller veya radikaller olabilir. Kimyasal türler Atom Molekül İyon Radikal ATOM
KĐMYASAL BAĞLAR. Molekül veya kimyasal bileşikler içerisinde atomların beraberce bulunmaları ancak kimyasal bağlar ile mümkün olmaktadır.
 KĐMYASAL BAĞLAR Molekül veya kimyasal bileşikler içerisinde atomların beraberce bulunmaları ancak kimyasal bağlar ile mümkün olmaktadır. Đki atom veya atom grubu arasında bir molekül oluşturmak üzere etkileşme,
KĐMYASAL BAĞLAR Molekül veya kimyasal bileşikler içerisinde atomların beraberce bulunmaları ancak kimyasal bağlar ile mümkün olmaktadır. Đki atom veya atom grubu arasında bir molekül oluşturmak üzere etkileşme,
Elektronların Dizilişi ve Kimyasal Özellikleri
 Elektronların Dizilişi ve Kimyasal Özellikleri ELEKTRON ALIŞVERİŞİ VE SONUÇLARI: Helyum (2), neon (10), argon (18)in elektron dağılımları incelendiğinde Eğer bu üç elementin birer elektronu daha olsaydı,
Elektronların Dizilişi ve Kimyasal Özellikleri ELEKTRON ALIŞVERİŞİ VE SONUÇLARI: Helyum (2), neon (10), argon (18)in elektron dağılımları incelendiğinde Eğer bu üç elementin birer elektronu daha olsaydı,
A. ATOMUN TEMEL TANECİKLERİ
 ÜNİTE 3 MADDENİN YAPISI VE ÖZELLİKLERİ 1. BÖLÜM MADDENİN TANECİKLİ YAPISI 1- ATOMUN YAPISI Maddenin taneciklerden oluştuğu fikri yani atom kavramı ilk defa demokritus tarafından ortaya atılmıştır. Örneğin;
ÜNİTE 3 MADDENİN YAPISI VE ÖZELLİKLERİ 1. BÖLÜM MADDENİN TANECİKLİ YAPISI 1- ATOMUN YAPISI Maddenin taneciklerden oluştuğu fikri yani atom kavramı ilk defa demokritus tarafından ortaya atılmıştır. Örneğin;
1. ÜNİTE: MODERN ATOM TEORİSİ
 . ÜNİTE: MODERN ATOM TEORİSİ.4. Elektron Dizilimi ve Periyodik Sisteme Yerleşim Atomun Kuantum Modeli oluşturulduktan sonra Bohr, yaptığı çalışmalarda periyodik cetvel ile kuantum teorisi arasında bir
. ÜNİTE: MODERN ATOM TEORİSİ.4. Elektron Dizilimi ve Periyodik Sisteme Yerleşim Atomun Kuantum Modeli oluşturulduktan sonra Bohr, yaptığı çalışmalarda periyodik cetvel ile kuantum teorisi arasında bir
ELEMENTLER VE SEMBOLLERİ
 ELEMENTLER VE SEMBOLLERİ Elementi oluşturmak için aynı tip atomlar bir araya gelir. Bir elementin bütün atomları birbiriyle aynı iken, farklı elementlerin atomları birbirinden farklıdır. Bazı elementleri
ELEMENTLER VE SEMBOLLERİ Elementi oluşturmak için aynı tip atomlar bir araya gelir. Bir elementin bütün atomları birbiriyle aynı iken, farklı elementlerin atomları birbirinden farklıdır. Bazı elementleri
