FAZ DİYAGRAMLARI VE DÖNÜŞÜMLERİ
|
|
|
- Aygül Koca
- 5 yıl önce
- İzleme sayısı:
Transkript
1 FAZ DİYAGRAMLARI VE DÖNÜŞÜMLERİ Prof. Dr. Ramazan YILMAZ Sakarya Üniversitesi, Teknoloji Fakültesi, Metalurji ve Malzeme Mühendisliği Bölümü Esentepe Kampüsü, 54187, SAKARYA
2 ÇÖZÜNEN VE ÇÖZEN İki maddeyi birbirleri ile karıştırarak bir bileşik veya alaşım yapmak istediğimiz zaman, bileşik veya alaşımı oluşturan maddelerden bir tanesine ÇÖZÜNEN (ERİYEN), diğerine ise ÇÖZEN (ERİTEN) adı verilir. Şeker ile su (C 12 H 22 O 11 H 2 O) karıştırarak bir Şekerli su (şurup) yaptığımızı düşünelim. Burada su eriten, şeker ise su içerisinde eriyen dir. Bakır ile çinkoyu karıştırarak bir bakır-çinko alaşımı yaptığımızı düşünelim. Bu alaşımda bakır eriten, çinko ise bakır içerisinde eriyen elementtir. Demir ile karbonu karıştırarak bir demir-karbon alaşımı yaptığımızda ise, demir eriten (çözen), karbon ise demir içerisinde eriyen (çözünen) elementtir
3 MADDELERİN KARIŞTIRILMASI Bir maddeyi veya malzemeyi birbiri ile karıştırdığımız zaman, üç farklı durum söz konusu olabilir. Bir madde, karıştırılan diğer bir madde içerisinde; 1. Sınırsız eriyebilirliğe (çözünebilirlik), 2. Sınırlı eriyebilirliğe veya 3. Birbiri içerisinde eriyemezlik Sınırsız eriyebilirliğe, su ile alkol karışımını örnek olarak verebiliriz. Su ile alkol oranları ne olursa olsun birbirleri ile karıştırıldığı zaman, tek bir sıvı faz (sıvı eriyik) meydana gelir. Çünkü su ve alkolün birbirleri içerisinde eriyebilirliği sınırsızdır. Bu çeşit karışımlara sınırsız eriyebilirlik adı verilir
4
5 SINIRSIZ ERİYEBİLİRLİK Bakır ile nikel elementleri hangi oranda olursa olsun, birbirleri ile karıştırıldığı zaman oda sıcaklığında tek bir katı faz (katı eriyik) oluştururlar. Bu katı faz içerisinde hem bakır, hem de nikel atomları homojen bir şekilde dağılmış halde bulunur. Dolayısıyla bakır ile nikelin de birbirleri içerisinde eriyebilirliği sınırsızdır
6 BİRBİRİ İÇERİSİNDE ERİYEMEZLİK Birbiri içerisinde eriyemezliğe en güzel örnek, su ile yağ karışımıdır. Su ile yağı birbirine karıştırdığımız zaman yoğunluk farkından dolayı yağ su üzerine çıkar. Su ile yağ birbirleri içerisinde eriyemezler. Bu nedenle su ile yağ karışımının olduğu kavanoz içerisinde, birbirine karışmayan iki farklı faz meydana gelir. Biri yağ fazı, diğeri ise su fazıdır
7 BİRBİRİ İÇERİSİNDE ERİYEMEZLİK Birbiri içerisinde eriyemezliğe en güzel örnek, su ile yağ karışımıdır. Su ile yağı birbirine karıştırdığımız zaman yoğunluk farkından dolayı yağ su üzerine çıkar. Su ile yağ birbirleri içerisinde eriyemezler. Bu nedenle su ile yağ karışımının olduğu kavanoz içerisinde, birbirine karışmayan iki farklı faz meydana gelir. Biri yağ fazı, diğeri ise su fazıdır
8 SINIRLI ERİYEBİLİRLİK Sınırlı eriyebilirliğe ise, su (H 2 O) ile şeker (C 12 H 22 O 11 ) karışımını örnek olarak verebiliriz. Bir miktar şeker, su ile karıştırıldığı zaman, su içerisinde şeker tamamen eriyerek (çözünerek) bir şeker-su karışımı elde edilir. Bu şeker-su karışımına daha fazla şeker ilave edilirse, belirli bir şeker miktarından sonra, su artık şekeri çözmez (eritmez). Çünkü su şekere doymuştur. Bundan sonra ilave edilecek şekerler, kavanozun dibinde çözünmemiş bir halde ve katı olarak birikecektir. Bu durumda su-şeker karışımı iki farklı faz içerecektir. Birisi şekere doymuş sıvı faz, diğeri ise, çözünmemiş haldeki katı şeker fazıdır. Bu çeşit karışımlara da sınırlı eriyebilirlik adı verilir
9 SINIRLI ERİYEBİLİRLİK Su içerisindeki şekerin eriyebilirliği sıcaklığa bağlı olarak değişir. Bu diyagramın x ekseni üzerinde soldan sağa doğru yüzde şeker miktarı, sağdan sola doğru yüzde su miktarı gösterilmektedir. Dikkat edilirse şekerin su içerisindeki eriyebilirlik sınırı hemen hemen dikey bir çizgi ile ifade edilmektedir. Bu diyagram sayesinde belirli miktardaki şekerin, hangi sıcaklıklarda ve ne kadar su içerisinde çözünebileceğini bulabiliriz
10 ÖRNEK 50 gr su ve 130 gr şekerimiz mevcuttur. 30 C de çözünemeyen şeker miktarı kaç gramdır? CEVAP: Önce Su-şeker diyagramından yararlanarak, 30 C de kaç gram şekerin kaç gram su tarafından çözebileceğini buluruz. Diyagramdan bakarak, 65 gr şeker 35 gram su içerinde çözündüğünü görebiliriz. Elimizde 130 gram şeker olduğuna göre, bu şeker miktarından bulduğumuz 92.8 gr şeker miktarını çıkartırsak, çözünmeyen şeker miktarını bulmuş oluruz = 37.2 gr şeker çözünmez, dipte birikir
11 ÖRNEK 50 gr su ve 80 gr şekerimiz mevcuttur. 0 C de çözünemeyen şeker miktarı kaç gramdır? CEVAP: Önce Su-şeker diyagramından yararlanarak, 0 C de kaç gram şekerin kaç gram su tarafından çözebileceğini buluruz. Diyagramdan bakarak, 60 gr şeker 40 gram su içerinde çözündüğünü görebiliriz
12 ÖRNEK 50 gr su ve 130 gr şekerimiz mevcuttur. 80 C de çözünemeyen şeker miktarı kaç gramdır? CEVAP: Önce Su-şeker diyagramından yararlanarak, 80 C de kaç gram şekerin kaç gram su tarafından çözebileceğini buluruz. Diyagramdan bakarak, 75 gr şeker 25 gram su içerinde çözündüğünü görebiliriz
13 ÖRNEK 50 gr su ve 130 gr şekerimiz mevcuttur. 100 C de çözünemeyen şeker miktarı kaç gramdır? CEVAP: Önce Su-şeker diyagramından yararlanarak, 100 C de kaç gram şekerin kaç gram su tarafından çözebileceğini buluruz. Diyagramdan bakarak,? gr şeker? gram su içerinde çözündüğünü görebiliriz
14 SINIRLI ERİYEBİLİRLİK Sınırlı eriyebilirliğe diğer bir örnek olarak magnezyum ile kurşun karışımını verebiliriz. Sıvı magnezyum içerisine sıvı kurşun ilave edersek, magnezyumkurşun karışımı bir sıvı eriyik elde ederiz
15 SINIRLI ERİYEBİLİRLİK Eğer sıvı eriği, oda sıcaklığına kadar soğutursak bir katı eriyik elde ederiz. Fakat sıvı eriyik % 41 den fazla kurşun içerirse, fazla kurşun atomları bazı magnezyum atomları ile birleşerek Mg 2 Pb bileşiği meydana getirirler. Dolayısıyla katı hal durumunda iki farklı fazdan söz edebiliriz. Birinci faz % 41 kurşun ile doymuş bir katı magnezyum eriği, diğer faz ise Mg 2 Pb bileşiğidir. Kurşunun magnezyum içerisindeki eriyebilirliği, sınırlı bir eriyebilirliktir
16 SAF METALLERİN TEKLİ FAZ DİYAGRAMLARI Saf metallerin faz diyagramları genellikle sıcaklık ve basınca bağlı olarak gösterilir. Bu tür bir faz diyagramından, metalin hangi sıcaklık ve basınç altında hangi faz dönüşümünü gerçekleştirdiğini öğrenebiliriz. Saf bir metal, sıcaklık ve basınç şartlarına bağlı olarak Katı, Sıvı, Gaz fazlarında olabilirler
17 MALZEME SEÇİMİNDE BASINÇ-SICAKLIK FAZ DİYAGRAMLARININ ÖNEMİ o Bir uçak veya uzay mekiği gövdesinin imalatı için malzeme seçerken, belirli basınç ve sıcaklıktaki malzemelerin davranışını bilmek gerekir. o Çünkü uzayda basınç düşüktür. o Sürtünmeden dolayı ise gövde malzemesi ısınacaktır. o Bundan dolayı en yüksek buharlaşma noktasına sahip, hafif bir malzeme tercih edilmelidir. o Aksi takdirde düşük basınçta ve yüksek sıcaklıkta buharlaşan bir metal, uçağın veya uzay mekiğinin düşmesine sebep olabilecektir
18 DENGE HALİNDEKİ SAF MAGNEZYUMA AİT BASINÇ-SICAKLIK TEKLİ FAZ DİYAGRAMI Sıcaklık ve basınca bağlı olarak, saf magnezyum üç farklı fazda bulunabilmektedir: 1) Katı magnezyum 2) Sıvı magnezyum 3) Magnezyum buharı
19 Diyagram üzerinde gösterilen ve 1 atmosfer basınç noktasından çizilen kesik çizginin birinci eğri (CD eğrisi) ile kesiştiği nokta (E noktası) magnezyumun ergime derecesini verir
20 İkinci eğri (CF) ile kesiştiği nokta ise (B noktası), magnezyumun buharlaşma derecesidir. Diyagramda görüleceği gibi, çok düşük basınçlarda katı magnezyum direk olarak buhar fazına dönüşebilmektedir
21 Diyagramda C harfiyle gösterilen bir üçlü kesişme noktası vardır. Bu noktada katı, sıvı ve buhar fazları birlikte bulunurlar. CD eğrisi üzerinde katı ve sıvı fazlar, CF eğrisi üzerinde de sıvı ve buhar fazları bir arada bulunurlar
22 DENGE HALİNDEKİ SAF DEMİRE AİT BASINÇ-SICAKLIK TEKLİ FAZ DİYAGRAMI Saf demir sıcaklık ve basınca bağlı olarak üç farklı fazda bulunabilmektedir: 1) katı demir, 2) sıvı demir 3) demir buharı
23 Bu diyagramın magnezyuma ait olan basınç-sıcaklık faz diyagramından farklılığı ise, katı demirin üç farklı katı faza sahip olmasıdır:
24 Demirin üç farklı fazın bir arada bulunduğu üç tane üçlü kesişme noktası vardır: Birinci üçlü noktada sıvı, buhar ve δ-demir fazları birlikte bulunurlar. İkinci üçlü noktada buhar, ϫ-demir ve δ- demir fazları birlikte bulunurlar. Üçüncü üçlü noktada buhar, ϫ-demir ve α-demir fazları birlikte bulunurlar
25 DENGE HALİNDEKİ SUYA (H 2 O) AİT BASINÇ-SICAKLIK TEKLİ FAZ DİYAGRAMI Su sıcaklık ve basınca bağlı olarak buz, sıvı ve buhar fazları olmak üzere üç farklı fazda bulunabilmektedir. Bir atmosfer basınç altındaki su, 1) 0 C altında buz, 2) C arasında sıvı 3) 100 C üstünde buhar fazlarını içerir
26
27 Suyun her üç fazının bir arada dengede bulunduğu şart: C ve atmosfer basıncı Bu noktaya (diyagramda M noktası) suyun üçlü noktası adı verilir. Suyun faz diyagramı Farmasötik Teknoloji açısından oldukça önemlidir. Sulu çözeltilerin kurutulması sırasında suyun faz diyagramından yararlanılmaktadır
28 Maddeler katı, sıvı ve gaz hallerde bulunmaktadır. Ancak gazlar kritik sıcaklıklarının üzerinde ısıtılır ve basınç uygulanırsa süper kritik faz adı verilen dördüncü bir faza geçerler. Bir maddenin kritik sıcaklığı (Tc), o sıcaklığın üzerinde ne kadar basınç uygulanırsa uygulansın sıvılaştırılamayacağı maksimum sıcaklıktır
29
30
31 ÖRNEK Soru: Suyun basınç-sıcaklık faz diyagramını dikkate alarak 0.1 atmosfer basınç altında; a) Buz fazının ergime sıcaklığını bulunuz? b) Suyun buharlaşma sıcaklığını bulunuz?
32 ÖRNEK ÇÖZÜM: a) Buz fazının ergime sıcaklığını bulunuz. Suyun basınç-sıcaklık faz diyagramı üzerinde 0.1 atm basınç değeri üzerinden düz bir çizgi çizilir. Bu çizginin buz-sıvı fazları arasındaki eğri (donma eğrisi) üzerindeki çakışma noktası buzun ergime sıcaklığını verir. Buzun 0.1 atm basınç altındaki ergime sıcaklığı yaklaşık 1 C dir
33 ÇÖZÜM: b) Suyun buharlaşma sıcaklığını bulunuz. Bu çizginin buhar-sıvı fazları arasındaki eğri (buharlaşma eğrisi) üzerindeki çakışma noktası suyun buharlaşma sıcaklığını verir. Suyun 0.1 atm basınç altındaki buharlaşma sıcaklığı 69 C dir
34 DENGE HALİNDEKİ CO 2 AİT BASINÇ-SICAKLIK TEKLİ FAZ DİYAGRAMI CO 2 faz diyagramı sıvı fazın 5.1 atm in altında oda sıcaklığında derhal gaz haline döneceği görülür. Normal atmosferik koşullarda (1 atm ve 25 C) ise gaz halindeki CO 2 in katı hale gelebilmesi için sıcaklığın C altına düşürülmesi gerekir. Bu noktaya süblimleşme noktası denir
35 Kuru buz normal basınç şartları altında sıvı halde bulunmayan karbondioksitin C'de ve 1 Atm basınçta dondurularak katı hale getirilmesi ile elde edilen buzdur. Kuru buz parçacıkları pelet halindedir. Pellet Halindeki Kuru Buz Tanecikleri
36
37 BASINÇ-SICAKLIK TEKLİ FAZ DİYAGRAMINDAN YARARLANMA CO2 o Soda üretiminde, o Basınçlı teneke kutularında, o Yangın söndürücüsü olarak, o Petrol elde edilmesinde, o Dondurulmuş gıdalarda kullanılır. Süperkritik CO2 o Tehlikeli solventler yerine kullanılarak ilaç ve kozmetik sektöründe partikül etkisi olarak o Kahvenin kafeinleştirilmesinde o Parfüm yapımında o Kuru temizlemede tehlikeli çözücüler yerine kullanılır
38 GİBBS FAZ KURALI J. Willard Gibbs tarafından ileri sürülen faz kuralı, denge halindeki gaz, sıvı ve katı sistemlere, basınç, sıcaklık ve birleşim gibi serbest değişkenlerin etkisi ile ilgilidir. Faz kuralı eşitliği, sistemin tanımlanabilmesi için gerekli değişken sayısının belirlenmesinde kullanılan bir araçtır. Gibbs tarafından geliştirilen faz kuralı; belirli sistemdeki fazların denge halinde bulunması için gerekli koşulları saptar. Fazların dengesini etkileyen üç etken; bileşim, sıcaklık ve basınç tır. Laboratuvardaki deneylerde basınç sürekli sabit tutulduğundan ihmal edilir
39 GİBBS FAZ KURALI P + V = C + 2 eşitliği sağlandığı taktirde denge durumunun mümkün olabileceği J. Willard Gibbs tarafından 1874 yılında gösterilmiştir. Bu eşitlikte; P (Phase) sistemdeki toplam faz sayısını, V (degrees of freedom) serbestlik derecesi veya denge halindeki sistemin serbest değişken sayısını (Variance of a system) (basınç P, sıcaklık T, bileşim C, hacim V gibi) ve C (Component) sistemin bileşen sayısını göstermektedir. Serbestlik derecesi sistemdeki fazların sayısını değiştirmeden bağımsız olarak değiştirilebilecek ortam koşullarını gösterir. Bunlar sıcaklık, basınç, bileşim, ph vb olabilir
40 SU (H 2 O) BASINÇ-SICAKLIK FAZ DİYAGRAMI Serbestlik derecesi (V), denge halindeki bir sistemde fazların sayısını değiştirmeden, bağımsız olarak değiştirilebilecek basınç, sıcaklık ve kimyasal bileşim olmak üzere üç değişkenin sayısını gösterir. Gibbs faz eşitliğinde kullanılan sabit 2 rakamı, iki adet değişken (basınç ve sıcaklık) olabileceğini ifade etmek amacıyla kullanılmıştır. Sabit basınçta P + V = C + 1 olur
41 GİBBS FAZ KURALI Bu diyagramda buhar fazı içerisindeki A noktasını ele alalım. Bu noktadaki bileşik sayısı C = 1 (sadece Su); Faz sayısı P = 1 (tek bir buhar fazı) A noktasındaki serbestlik derecesi (V)=2 dir P + V = C + 2 V = C P + 2 ; V = V = 2 bulunur. Sistemin tek faz olarak kalabilmesi için en az iki değişkeninin sabit tutulması gerekir; örneğin basınç ve sıcaklık Serbestlik derecesi, fazın kararlılığını devam ettirebildiği alan içerisindeki değişken şartların (sıcaklık, bileşim ve basınç gibi) sayısını ifade etmektedir. Yani o noktadaki fazın durumunu tarif edebilmek için birbirinden bağımsız olarak 2 değişkenin yani basınç ve sıcaklığın sabit tutulması gerekmektedir
42 Buhar ile sıvı faz bölgeleri arasındaki sınır çizgisi üzerinde bir noktayı düşünelim (örneğin C noktası) Bu noktadaki bileşik sayısı C = 1 (sadece Su) Fazların sayısı P = 2 (Buhar ve sıvı fazlar) Serbestlik derecesi (V)=? C noktasındaki serbestlik derecesi (V)=1 dir P + V = C + 2 V = C P + 2 V = V = 1 bulunur. Bu eğrilerin (donma, buharlaşma ve süblimasyon eğrileri) herhangi biri üzerinde iken suyun katı-sıvı, sıvı-buhar veya katıbuhar halinde olup olmadığını belirleyebilmek için bir tek değişkenin (sıcaklık veya basınç) bilinmesi yeterli olacaktır. Sistemin iki fazlı olarak kalabilmesi için en az bir değişkeninin sabit tutulması gerekir; örneğin basınç ve sıcaklık
43 Örneğin; 100 C de sistemin sıvı ve buhar fazları arasında dengede olduğu bilindiğine göre, bu dengenin korunabilmesi için 760 mm Hg (1 Atm) basıncından başka bir basınç olamayacağı anlaşılır. Başka bir ifadeyle; İki fazın dengede olduğu (donma, buharlaşma ve süblimasyon eğrileri üzerinde) sabit bir basınç seçilirse (örneğin 1 Atm), bu dengeyi sağlayan diğer değişken olan sıcaklık (örneğin 100 C) otomatik olarak belirlenir
44 Aynı diyagramda katı, sıvı ve buhar fazlarının kesiştiği üçlü noktayı ele alalım (T noktası) Bu noktadaki bileşik sayısı C = 1 (sadece su) Fazların sayısı P = 3 (sıvı, katı ve buhar) Serbestlik derecesi (V)=? T noktasındaki serbestlik derecesi (V)=1 dir P + V = C + 2 V = C P + 2 V = V = 0 bulunur. Bu noktada değişkenlerden (basınç ve sıcaklık) hiçbirinin değiştirilmemesi gerekir ki, üç faz bir arada bulunmaya devam edebilsin. Sistemin üç fazı aynı anda bulundurabilmesi için, şartların hiçbirinin değiştirilmemesi gerekir. Şartlardan herhangi birisi değişirse sistem iki veya tek faza döner
45 İKİ BİLEŞENLİ FAZ DİYAGRAMINDA GİBBS FAZ KURALI 2 noktasında: İki bileşenli diyagramlarda basınç, normal atmosferik basınç olduğundan sabit kabul edilir. Gibbs Faz Kuralı da; P + V = C + 1 olur. 1 noktasında: 1+V = 2+1 V=2 olur. Alfa α fazının kararlılık bölgesi içerisinde alaşımı tam olarak tanımlamak için 2 bağımsız değişkenin tanımlanması gerekir. 2+V = 2+1 V=1 olur. Değişken olarak sıcaklık seçilse buna bağlı olarak bileşim kendiliğinden belirlenmiş olur. 3 noktasında 3+V = 2+1 V=0 olur. Üç fazın dengede olduğu bu noktada bütün değişkenlerin sabit bir değer olması gerekmektedir
46 ÖDEV Soru 1: 120 gr su ve 340 gr şekerimiz mevcuttur. 60 C de çözünemeyen şeker miktarının kaç gram olduğunu Su-şeker faz diyagramından yararlanarak bulunuz. Soru 2: 120 gr su ve 340 gr şekerimiz mevcuttur. 100 C de çözünemeyen şeker miktarının kaç gram olduğunu Su-şeker faz diyagramından yararlanarak bulunuz. Soru 3: 50 gr su ve 100 gr şekerimiz mevcuttur. 100 C de çözünemeyen şeker miktarının kaç gram olduğunu Su-şeker faz diyagramından yararlanarak bulunuz
47 ÖDEV Soru 1: Suyun basınç-sıcaklık faz diyagramını dikkate alarak 1, 10, 100 atmosfer basınçlar altında; (a) Buz fazının ergime sıcaklıklarını bulunuz? (b) Suyun buharlaşma sıcaklıklarını bulunuz? Soru 2: Suyun basınç-sıcaklık faz diyagramını dikkate alarak atmosfer basınç altında suyun süblimleşme sıcaklığını bulunuz? Soru 3: CO 2 basınç-sıcaklık faz diyagramını dikkate alarak 0.5 atm, 50 atm basınçlar altında; (a) CO 2 in buharlaşma ve (b) süblimleşme sıcaklıklarını bulunuz? Soru 4: Basınç-sıcaklık faz diyagramlarından bir malzemeye ait hangi bilgilerin elde edilebileceğini yazınız? Soru 5: Denge halindeki saf magnezyuma ait basınç-sıcaklık tekli faz diyagramını çizerek 1 atm basınç altında sıvılaşma ve buharlaşma sıcaklıklarını ve üçlü noktadaki serbestlik derecesini bularak yorumlayınız? Soru 6: alfa ve beta gibi iki allotropik hali olan bir metale ait (örneğin titanyum) basınç-sıcaklık diyagramını internet yardımıyla bularak çiziniz. Bu diyagram üzerine serbestlik derecelerini yazınız. Mevcut eğrileri tanımlayınız?
48 ÖDEV Soru 7: Bir parça saf demir 10-6 Atm basınçta 1300 C de kadar 15 dakika içerisinde ısıtılmaktadır. Bu şartlar altında saf demirin özelliklerinde ne gibi bir değişiklik meydana gelir. Saf demir 1 Atm basınç altında aynı sıcaklığa ısıtılsa idi ne olurdu karşılaştırınız? Soru 8: Fe-C denge diyagramında aşağıda şekilde görülen A, B, C,D,E Gibbs faz kuralına göre serbestlik derecesini hesaplayarak yorumlayınız? Soru 9: Cu-Ni denge diyagramında aşağıda şekilde görülen A, B, C ve D Gibbs faz kuralına göre serbestlik derecesini hesaplayarak yorumlayınız?
49 Fe-C karbon denge diyagramı
50 Cu-Ni faz diyagramı
51
52
53
54
55
56
57
58
59
60
61 Bakırda çinkonun çözünürlüğü. Mavi çizgi çözünürlük sınırı belirler, fazla çinko eklendiğinde çözünürlük limiti aşılır ve iki faz birlikte var olur
62 Bu diyagramın en önemli tarafı üçlü noktanın (T), 5,11 atm gibi oldukça yüksek bir basınçta oluşudur. Bu basıncın altında sıvı CO 2 elde edilemez. 1 atm basınçta -78 C de CO 2 süblime olur yani katı hale geçer. Bu katı karbondioksite kuru buz denir
63
64 (ZrO 2 -zirkonya) Faz Diyagramı Önemli bir teknik seramik olan zirkonyum oksit in (ZrO 2 -zirkonya),demir gibi üç farklı polimorfu vardır
65 Silikanın (SiO 2 ) polimorfik dönüşümü Polimorfik dönüşüme sahip diğer önemli bir bileşik ise silikadır (SiO 2 ). Silika 3 farklı kristal formuna sahiptir: Kuvars, tridimit ve kristobalit
66 KAYNAKLAR D. R. Askeland, The Science and Engineering of Materials, Brooks/Cole Engineering Division, Monterey, W. D. Callister, Jr., Materials Science and Engineering, An Introduction, John Wiley&Sons, New York, H. Uzun, Faz Diyağramları internet sunusu İ. Özbek, Faz Diyağramları internet sunusu A. Alsaran Malzeme Bilgisi internet sunusu Çeşitli sunumlar Çeşitli internet web sayfaları
67 Dinlediğiniz için Teşekkür ederim!
FAZ DİYAGRAMLARI ve DÖNÜŞÜMLERİ HOŞGELDİNİZ
 FAZ DİYAGRAMLARI ve DÖNÜŞÜMLERİ Malzeme Malzeme Bilgisi Bilgisi HOŞGELDİNİZ 1 /94 2 /94 ÇÖZÜNEN ve ÇÖZEN İki maddeyi birbirleri ile karıştırarak bir bileşik veya alaşım yapmak istediğimiz zaman, bileşik
FAZ DİYAGRAMLARI ve DÖNÜŞÜMLERİ Malzeme Malzeme Bilgisi Bilgisi HOŞGELDİNİZ 1 /94 2 /94 ÇÖZÜNEN ve ÇÖZEN İki maddeyi birbirleri ile karıştırarak bir bileşik veya alaşım yapmak istediğimiz zaman, bileşik
BMM 205 Malzeme Biliminin Temelleri
 BMM 205 Malzeme Biliminin Temelleri Faz Diyagramları Dr. Ersin Emre Ören Biyomedikal Mühendisliği Bölümü Malzeme Bilimi ve Nanoteknoloji Mühendisliği Bölümü TOBB Ekonomi ve Teknoloji Üniversitesi Ankara
BMM 205 Malzeme Biliminin Temelleri Faz Diyagramları Dr. Ersin Emre Ören Biyomedikal Mühendisliği Bölümü Malzeme Bilimi ve Nanoteknoloji Mühendisliği Bölümü TOBB Ekonomi ve Teknoloji Üniversitesi Ankara
FAZ DİYAGRAMLARI ve DÖNÜŞÜMLERİ HOŞGELDİNİZ
 FAZ DİYAGRAMLARI ve DÖNÜŞÜMLERİ Malzeme Malzeme Bilgisi Bilgisi PROF. DR. HÜSEYİN UZUN HOŞGELDİNİZ Prof. Dr. Hüseyin UZUN-Metalurji ve Malzeme Mühendisliği Bölümü 1 /94 İkili Faz Diyagramından Hangi Bilgiler
FAZ DİYAGRAMLARI ve DÖNÜŞÜMLERİ Malzeme Malzeme Bilgisi Bilgisi PROF. DR. HÜSEYİN UZUN HOŞGELDİNİZ Prof. Dr. Hüseyin UZUN-Metalurji ve Malzeme Mühendisliği Bölümü 1 /94 İkili Faz Diyagramından Hangi Bilgiler
ÇÖKELME SERTLEŞTİRMESİ
 ÇÖKELME SERTLEŞTİRMESİ Prof. Dr. Ramazan YILMAZ Sakarya Üniversitesi, Teknoloji Fakültesi, Metalurji ve Malzeme Mühendisliği Bölümü Esentepe Kampüsü, 54187, SAKARYA ÇÖKELME SERTLEŞTİRMESİ (Yaşlandırma
ÇÖKELME SERTLEŞTİRMESİ Prof. Dr. Ramazan YILMAZ Sakarya Üniversitesi, Teknoloji Fakültesi, Metalurji ve Malzeme Mühendisliği Bölümü Esentepe Kampüsü, 54187, SAKARYA ÇÖKELME SERTLEŞTİRMESİ (Yaşlandırma
Faz ( denge) diyagramları
 Faz ( denge) diyagramları İki elementin birbirleriyle karıştırılması sonucunda, toplam iç enerji mimimum olacak şekilde yeni atom düzenleri meydana gelir. Fazlar, İç enerjinin minimum olmasını sağlayacak
Faz ( denge) diyagramları İki elementin birbirleriyle karıştırılması sonucunda, toplam iç enerji mimimum olacak şekilde yeni atom düzenleri meydana gelir. Fazlar, İç enerjinin minimum olmasını sağlayacak
METALLERDE KATILAŞMA
 METALLERDE KATILAŞMA Prof. Dr. Ramazan YILMAZ Sakarya Üniversitesi, Teknoloji Fakültesi, Metalurji ve Malzeme Mühendisliği Bölümü Esentepe Kampüsü, 54187, SAKARYA METALLERDE KATILAŞMA Metal ve alaşımlar,
METALLERDE KATILAŞMA Prof. Dr. Ramazan YILMAZ Sakarya Üniversitesi, Teknoloji Fakültesi, Metalurji ve Malzeme Mühendisliği Bölümü Esentepe Kampüsü, 54187, SAKARYA METALLERDE KATILAŞMA Metal ve alaşımlar,
şeklinde, katı ( ) fazın ağırlık oranı ise; şeklinde hesaplanır.
 FAZ DİYAGRAMLARI Malzeme özellikleri görmüş oldukları termomekanik işlemlerin sonucunda oluşan içyapılarına bağlıdır. Faz diyagramları mühendislerin içyapı değişikliği için uygulayacakları ısıl işlemin
FAZ DİYAGRAMLARI Malzeme özellikleri görmüş oldukları termomekanik işlemlerin sonucunda oluşan içyapılarına bağlıdır. Faz diyagramları mühendislerin içyapı değişikliği için uygulayacakları ısıl işlemin
Faz Dönüşümleri ve Faz (Denge) Diyagramları
 Faz Dönüşümleri ve Faz (Denge) Diyagramları 1. Giriş Bir cisim bağ kuvvetleri etkisi altında en düşük enerjili denge konumunda bulunan atomlar grubundan oluşur. Koşullar değişirse enerji içeriği değişir,
Faz Dönüşümleri ve Faz (Denge) Diyagramları 1. Giriş Bir cisim bağ kuvvetleri etkisi altında en düşük enerjili denge konumunda bulunan atomlar grubundan oluşur. Koşullar değişirse enerji içeriği değişir,
SInIrsIz KatI Erİyebİlİrlİk Faz DİyagramlarI (İkİlİ İzomorfİk Sİstemler)
 SInIrsIz KatI Erİyebİlİrlİk İkİlİ Faz DİyagramlarI (İkİlİ İzomorfİk Sİstemler) Prof. Dr. Ramazan YILMAZ Sakarya Üniversitesi, Teknoloji Fakültesi, Metalurji ve Malzeme Mühendisliği Bölümü Esentepe Kampüsü,
SInIrsIz KatI Erİyebİlİrlİk İkİlİ Faz DİyagramlarI (İkİlİ İzomorfİk Sİstemler) Prof. Dr. Ramazan YILMAZ Sakarya Üniversitesi, Teknoloji Fakültesi, Metalurji ve Malzeme Mühendisliği Bölümü Esentepe Kampüsü,
MALZEME BİLGİSİ DERS 7 DR. FATİH AY.
 MALZEME BİLGİSİ DERS 7 DR. FATİH AY www.fatihay.net fatihay@fatihay.net GEÇEN HAFTA KIRILMANIN TEMELLERİ KIRILMA ÇEŞİTLERİ KIRILMA TOKLUĞU YORULMA S-N EĞRİSİ SÜRÜNME GİRİŞ Basınç (atm) Katı Sıvı Buhar
MALZEME BİLGİSİ DERS 7 DR. FATİH AY www.fatihay.net fatihay@fatihay.net GEÇEN HAFTA KIRILMANIN TEMELLERİ KIRILMA ÇEŞİTLERİ KIRILMA TOKLUĞU YORULMA S-N EĞRİSİ SÜRÜNME GİRİŞ Basınç (atm) Katı Sıvı Buhar
PROF. DR. HÜSEYİN UZUN HOŞGELDİNİZ
 Sınırsız Katı Eriyebilirlik İkili Faz Diyagramları (İkili İzomorfik Sistemler) Malzeme Malzeme Bilgisi Bilgisi PROF. DR. HÜSEYİN UZUN HOŞGELDİNİZ 1 /94 Sınırsız Katı Eriyebilirlik İkili Faz Diyagramları
Sınırsız Katı Eriyebilirlik İkili Faz Diyagramları (İkili İzomorfik Sistemler) Malzeme Malzeme Bilgisi Bilgisi PROF. DR. HÜSEYİN UZUN HOŞGELDİNİZ 1 /94 Sınırsız Katı Eriyebilirlik İkili Faz Diyagramları
Faz kavramı. Kristal yapılı malzemelerin iç yapılarında homojen ve belirli özellikler gösteren bölgelere faz (phase) adı verilir.
 Faz kavramı Kristal yapılı malzemelerin iç yapılarında homojen ve belirli özellikler gösteren bölgelere faz (phase) adı verilir. Fazlar; bu atom düzenlerinden ve toplam iç yapıda bu fazların oluşturdukları
Faz kavramı Kristal yapılı malzemelerin iç yapılarında homojen ve belirli özellikler gösteren bölgelere faz (phase) adı verilir. Fazlar; bu atom düzenlerinden ve toplam iç yapıda bu fazların oluşturdukları
İKİLİ ÖTEKTİK FAZ DİYAGRAMLARI
 İKİLİ ÖTEKTİK FAZ DİYAGRAMLARI Prof. Dr. Ramazan YILMAZ Sakarya Üniversitesi, Teknoloji Fakültesi, Metalurji ve Malzeme Mühendisliği Bölümü Esentepe Kampüsü, 54187, SAKARYA İKİLİ ÖTEKTİK FAZ DİYAGRAMLARI
İKİLİ ÖTEKTİK FAZ DİYAGRAMLARI Prof. Dr. Ramazan YILMAZ Sakarya Üniversitesi, Teknoloji Fakültesi, Metalurji ve Malzeme Mühendisliği Bölümü Esentepe Kampüsü, 54187, SAKARYA İKİLİ ÖTEKTİK FAZ DİYAGRAMLARI
FAZ DİYAGRAMLARI ve DÖNÜŞÜMLERİ HOŞGELDİNİZ
 FAZ DİYAGRAMLARI ve DÖNÜŞÜMLERİ HOŞGELDİNİZ 1 /94 GİRİŞ * Endüstriyel amaçlı kullanılan malzemelerin pek çoğu saf metal değildir. Çünkü saf metaller, servis şartlarında istenilen mekanik özelikleri sağlayamamaktadırlar.
FAZ DİYAGRAMLARI ve DÖNÜŞÜMLERİ HOŞGELDİNİZ 1 /94 GİRİŞ * Endüstriyel amaçlı kullanılan malzemelerin pek çoğu saf metal değildir. Çünkü saf metaller, servis şartlarında istenilen mekanik özelikleri sağlayamamaktadırlar.
FAZ DİYAGRAMLARI VE DÖNÜŞÜMLERİ
 FAZ DİYAGRAMLARI VE DÖNÜŞÜMLERİ Prof. Dr. Ramazan YILMAZ Sakarya Üniversitesi, Teknoloji Fakültesi, Metalurji ve Malzeme Mühendisliği Bölümü Esentepe Kampüsü, 54187, SAKARYA FAZ DİYAGRAMLARI VE DÖNÜŞÜMLERİ
FAZ DİYAGRAMLARI VE DÖNÜŞÜMLERİ Prof. Dr. Ramazan YILMAZ Sakarya Üniversitesi, Teknoloji Fakültesi, Metalurji ve Malzeme Mühendisliği Bölümü Esentepe Kampüsü, 54187, SAKARYA FAZ DİYAGRAMLARI VE DÖNÜŞÜMLERİ
7. SİNTERLEME (PİŞİRME) İŞLEMİNDEKİ REAKSİYONLAR
 7. SİNTERLEME (PİŞİRME) İŞLEMİNDEKİ REAKSİYONLAR Seramik malzemeye mukavemet kazandırmak için yapılan sinterleme (pişirme) işlemi sırasında malzemenin; 1-) Hacmi küçülür 2-) Bulk yoğunluğu artar 3-) Malzemede
7. SİNTERLEME (PİŞİRME) İŞLEMİNDEKİ REAKSİYONLAR Seramik malzemeye mukavemet kazandırmak için yapılan sinterleme (pişirme) işlemi sırasında malzemenin; 1-) Hacmi küçülür 2-) Bulk yoğunluğu artar 3-) Malzemede
FAZ DİYAGRAMLARI ve DÖNÜŞÜMLERİ HOŞGELDİNİZ
 FAZ DİYAGRAMLARI ve DÖNÜŞÜMLERİ Malzeme Malzeme Bilgisi Bilgisi PROF. DR. HÜSEYİN UZUN HOŞGELDİNİZ Prof. Dr. Hüseyin UZUN-Metalurji ve Malzeme Mühendisliği Bölümü 1 /94 Ötektik bileşim Birbirlerini sınırlı
FAZ DİYAGRAMLARI ve DÖNÜŞÜMLERİ Malzeme Malzeme Bilgisi Bilgisi PROF. DR. HÜSEYİN UZUN HOŞGELDİNİZ Prof. Dr. Hüseyin UZUN-Metalurji ve Malzeme Mühendisliği Bölümü 1 /94 Ötektik bileşim Birbirlerini sınırlı
ONDOKUZ MAYIS ÜNİVERSİTESİ KİMYA MÜH. BÖLÜMÜ KML I LAB. ÜÇLÜ NOKTA SAPTANMASI DENEY FÖYÜ
 AMAÇ ONDOKUZ MAYIS ÜNİVERSİTESİ KİMYA MÜH. BÖLÜMÜ KML I LAB. ÜÇLÜ NOKTA SAPTANMASI DENEY FÖYÜ Çalışmanın amacı üç bileşenli sistemlerin incelenmesi ve bu sistemler için sıvı-sıvı faz diyagramlarının oluşturulmasıdır.
AMAÇ ONDOKUZ MAYIS ÜNİVERSİTESİ KİMYA MÜH. BÖLÜMÜ KML I LAB. ÜÇLÜ NOKTA SAPTANMASI DENEY FÖYÜ Çalışmanın amacı üç bileşenli sistemlerin incelenmesi ve bu sistemler için sıvı-sıvı faz diyagramlarının oluşturulmasıdır.
KİMYASAL BİLEŞİKLER İÇERİK
 KİMYASAL BİLEŞİKLER İÇERİK Mol, Molar Kütle Kimyasal Formülden Yüzde Bileşiminin Hesaplanması Bir Bileşiğin Yüzde Bileşiminden Kimyasal Formülünün Hesaplanması Organik Bileşiklerin Kimyasal Bileşiminin
KİMYASAL BİLEŞİKLER İÇERİK Mol, Molar Kütle Kimyasal Formülden Yüzde Bileşiminin Hesaplanması Bir Bileşiğin Yüzde Bileşiminden Kimyasal Formülünün Hesaplanması Organik Bileşiklerin Kimyasal Bileşiminin
Chapter 9: Faz Diyagramları
 Chapter 9: Faz Diyagramları İki elementi birleştirdiğimizde... ortaya çıkan denklik durumu nedir? genel olarak aşağıdakileri belirlersek... -- kompozisyon (örn., ağ% Cu - ağ% Ni), ve -- sıcaklık (T ) şunlara
Chapter 9: Faz Diyagramları İki elementi birleştirdiğimizde... ortaya çıkan denklik durumu nedir? genel olarak aşağıdakileri belirlersek... -- kompozisyon (örn., ağ% Cu - ağ% Ni), ve -- sıcaklık (T ) şunlara
FAZ DİYAGRAMLARI. DERS NOTLARI Genel Kavramlar ve Tek Bileşenli Faz Diyagramları. İçerik
 FAZ DİYAGRAMLARI DERS NOTLARI Genel Kavramlar ve Tek Bileşenli Faz Diyagramları İçerik KTÜ, Metalurji ve Malzeme Mühendisliği Bölümü Ders İçeriği Malzemelerin farklı sıcaklık, basınç ve bileşim değerlerinde
FAZ DİYAGRAMLARI DERS NOTLARI Genel Kavramlar ve Tek Bileşenli Faz Diyagramları İçerik KTÜ, Metalurji ve Malzeme Mühendisliği Bölümü Ders İçeriği Malzemelerin farklı sıcaklık, basınç ve bileşim değerlerinde
MMM291 MALZEME BİLİMİ
 MMM291 MALZEME BİLİMİ Yrd. Doç. Dr. Ayşe KALEMTAŞ Ofis Saatleri: Perşembe 14:00 16:00 ayse.kalemtas@btu.edu.tr, akalemtas@gmail.com Bursa Teknik Üniversitesi, Doğa Bilimleri, Mimarlık ve Mühendislik Fakültesi,
MMM291 MALZEME BİLİMİ Yrd. Doç. Dr. Ayşe KALEMTAŞ Ofis Saatleri: Perşembe 14:00 16:00 ayse.kalemtas@btu.edu.tr, akalemtas@gmail.com Bursa Teknik Üniversitesi, Doğa Bilimleri, Mimarlık ve Mühendislik Fakültesi,
FAZLARARASI DENGE ve FAZ KURALI
 FAZLARARASI DENGE ve FAZ KURALI FİGEN TIRNAKSIZ ir sistemin tektür (homojen) bir parçası olan ve sistemin diğer parçalarından kesin bir sınırla ayrılmış olan bölüme faz denir. Bu tanıma göre bir kap içindeki
FAZLARARASI DENGE ve FAZ KURALI FİGEN TIRNAKSIZ ir sistemin tektür (homojen) bir parçası olan ve sistemin diğer parçalarından kesin bir sınırla ayrılmış olan bölüme faz denir. Bu tanıma göre bir kap içindeki
ELEMENT VE BİLEŞİKLER
 ELEMENT VE BİLEŞİKLER 1- Elementler ve Elementlerin Özellikleri: a) Elementler: Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere
ELEMENT VE BİLEŞİKLER 1- Elementler ve Elementlerin Özellikleri: a) Elementler: Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere
ELEMENTLER VE BİLEŞİKLER
 ELEMENTLER VE BİLEŞİKLER 1- Elementler ve Elementlerin Özellikleri a) ELEMENTLER Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere
ELEMENTLER VE BİLEŞİKLER 1- Elementler ve Elementlerin Özellikleri a) ELEMENTLER Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere
Malzemeler yapılarının içerisinde, belli oranlarda farklı atomları çözebilirler. Bu durum katı çözeltiler olarak adlandırılır.
 KATI ÇÖZELTİ Malzemeler yapılarının içerisinde, belli oranlarda farklı atomları çözebilirler. Bu durum katı çözeltiler olarak adlandırılır. Katı çözeltilerin diğer bir ismi katı eriyiktir. Bir çözelti
KATI ÇÖZELTİ Malzemeler yapılarının içerisinde, belli oranlarda farklı atomları çözebilirler. Bu durum katı çözeltiler olarak adlandırılır. Katı çözeltilerin diğer bir ismi katı eriyiktir. Bir çözelti
CALLİSTER FAZ DİYAGRAMLARI ve Demir-Karbon Diyagramı
 CALLİSTER FAZ DİYAGRAMLARI ve Demir-Karbon Diyagramı Bileşen deyimi, çoğunlukla alaşımı oluşturan saf metaller ve/veya bileşikler için kullanılır. Örneğin bir bakır-çinko alaşımı olan pirinçte Cu ve Zn,
CALLİSTER FAZ DİYAGRAMLARI ve Demir-Karbon Diyagramı Bileşen deyimi, çoğunlukla alaşımı oluşturan saf metaller ve/veya bileşikler için kullanılır. Örneğin bir bakır-çinko alaşımı olan pirinçte Cu ve Zn,
6. Aşağıdaki tablodan yararlanarak X maddesinin ne olduğunu (A, B,C? ) ön görünüz.
 1. Lavosier yasası nedir, açıklayınız. 2. C 2 H 4 + 3O 2 2CO 2 + 2 H 2 O tepkimesine göre 2,0 g etilenin yeterli miktarda oksijenle yanması sonucu oluşan ürünlerin toplam kütlesi nedir, hesaplayınız. 3.
1. Lavosier yasası nedir, açıklayınız. 2. C 2 H 4 + 3O 2 2CO 2 + 2 H 2 O tepkimesine göre 2,0 g etilenin yeterli miktarda oksijenle yanması sonucu oluşan ürünlerin toplam kütlesi nedir, hesaplayınız. 3.
Fiziksel özellikleri her yerde aynı olan (homojen) karışımlara çözelti denir. Bir çözeltiyi oluşturan her bir maddeye çözeltinin bileşenleri denir.
 GENEL KİMYA 1 LABORATUARI ÇALIŞMA NOTLARI DENEY: 8 ÇÖZELTİLER Dr. Bahadır KESKİN, 2011 @ YTÜ Fiziksel özellikleri her yerde aynı olan (homojen) karışımlara çözelti denir. Bir çözeltiyi oluşturan her bir
GENEL KİMYA 1 LABORATUARI ÇALIŞMA NOTLARI DENEY: 8 ÇÖZELTİLER Dr. Bahadır KESKİN, 2011 @ YTÜ Fiziksel özellikleri her yerde aynı olan (homojen) karışımlara çözelti denir. Bir çözeltiyi oluşturan her bir
maddelere saf maddeler denir
 Madde :Kütlesi olan her şeye madde denir. Saf madde: Aynı cins atom veya moleküllerden oluşan maddeye denir. Fiziksel yollarla kendisinden başka maddelere ayrışmayan maddelere saf maddeler denir Element:
Madde :Kütlesi olan her şeye madde denir. Saf madde: Aynı cins atom veya moleküllerden oluşan maddeye denir. Fiziksel yollarla kendisinden başka maddelere ayrışmayan maddelere saf maddeler denir Element:
1 mol = 6, tane tanecik. Maddelerde tanecik olarak atom, molekül ve iyonlar olduğunda dolayı mol ü aşağıdaki şekillerde tanımlamak mümkündür.
 1 GENEL KİMYA Mol Kavramı 1 Mol Kavramı Günlük hayatta kolaylık olsun diye, çok küçük taneli olan maddeler tane yerine birimlerle ifade edilir. Örneğin pirinç alınırken iki milyon tane pirinç yerine ~
1 GENEL KİMYA Mol Kavramı 1 Mol Kavramı Günlük hayatta kolaylık olsun diye, çok küçük taneli olan maddeler tane yerine birimlerle ifade edilir. Örneğin pirinç alınırken iki milyon tane pirinç yerine ~
HACETTEPE ÜNĐVERSĐTESĐ ÖĞRETĐM TEKNOLOJĐLERĐ VE MATERYAL GELĐŞTĐRME KONU ANLATIMI. Hazırlayan: Hale Sümerkan. Dersin Sorumlusu: Prof. Dr.
 HACETTEPE ÜNĐVERSĐTESĐ ÖĞRETĐM TEKNOLOJĐLERĐ VE MATERYAL GELĐŞTĐRME KONU ANLATIMI Hazırlayan: Hale Sümerkan Dersin Sorumlusu: Prof. Dr.Đnci Morgil ANKARA 2008 ÇÖZELTĐLER Çözeltiler, iki ya da daha fazla
HACETTEPE ÜNĐVERSĐTESĐ ÖĞRETĐM TEKNOLOJĐLERĐ VE MATERYAL GELĐŞTĐRME KONU ANLATIMI Hazırlayan: Hale Sümerkan Dersin Sorumlusu: Prof. Dr.Đnci Morgil ANKARA 2008 ÇÖZELTĐLER Çözeltiler, iki ya da daha fazla
ÇÖZELTİLERİN KOLİGATİF ÖZELLİKLERİ
 ÇÖZELTİLERİN KOLİGATİF ÖZELLİKLERİ Çözeltilerin sadece derişimine bağlı olarak değişen özelliklerine koligatif özellikler denir. Buhar basıncı düşmesi, Kaynama noktası yükselmesi, Donma noktası azalması
ÇÖZELTİLERİN KOLİGATİF ÖZELLİKLERİ Çözeltilerin sadece derişimine bağlı olarak değişen özelliklerine koligatif özellikler denir. Buhar basıncı düşmesi, Kaynama noktası yükselmesi, Donma noktası azalması
DOKUZ EYLÜL ÜNİVERSİTESİ MÜHENDİSLİK FAKÜLTESİ DEKANLIĞI DERS/MODÜL/BLOK TANITIM FORMU. Dersin Orjinal Adı: PHASE DIAGRAMS. Dersin Kodu: MME 2006
 Dersi Veren Birim: Metalurji ve Malzeme Mühendisliği Dersin Türkçe Adı: FAZ DİYAGRAMLARI Dersin Orjinal Adı: PHASE DIAGRAMS Dersin Düzeyi:(Ön lisans, Lisans, Yüksek Lisans, Doktora) Lisans Dersin Kodu:
Dersi Veren Birim: Metalurji ve Malzeme Mühendisliği Dersin Türkçe Adı: FAZ DİYAGRAMLARI Dersin Orjinal Adı: PHASE DIAGRAMS Dersin Düzeyi:(Ön lisans, Lisans, Yüksek Lisans, Doktora) Lisans Dersin Kodu:
GAZLAR GAZ KARIŞIMLARI
 DALTON KISMİ BASINÇLAR YASASI Aynı Kaplarda Gazların Karıştırılması Birbiri ile tepkimeye girmeyen gaz karışımlarının davranışı genellikle ilgi çekicidir. Böyle bir karışımdaki bir bileşenin basıncı, aynı
DALTON KISMİ BASINÇLAR YASASI Aynı Kaplarda Gazların Karıştırılması Birbiri ile tepkimeye girmeyen gaz karışımlarının davranışı genellikle ilgi çekicidir. Böyle bir karışımdaki bir bileşenin basıncı, aynı
ELEMETLER VE BİLEŞİKLER ELEMENTLER VE SEMBOLLERİ
 ELEMENTLER VE SEMBOLLERİ Elementler Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere element denir. Elementler çok sayıda
ELEMENTLER VE SEMBOLLERİ Elementler Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere element denir. Elementler çok sayıda
Maddelerin ortak özellikleri
 On5yirmi5.com Maddelerin ortak özellikleri Maddelerin ortak özellikleri, ayırt edici özelliklerinin incelenip hallerine göre sınıflandırılmasının yapılması... Yayın Tarihi : 30 Ekim 2012 Salı (oluşturma
On5yirmi5.com Maddelerin ortak özellikleri Maddelerin ortak özellikleri, ayırt edici özelliklerinin incelenip hallerine göre sınıflandırılmasının yapılması... Yayın Tarihi : 30 Ekim 2012 Salı (oluşturma
Kütlesi,hacmi,eylemsizliği olan,tanecikli yapıdaki her şeye madde denir. Yer yüzünde gözümüzle görebildiğimiz her şey maddedir.
 Madde Tanımı Kütlesi,hacmi,eylemsizliği olan,tanecikli yapıdaki her şeye madde denir. Yer yüzünde gözümüzle görebildiğimiz her şey maddedir. MADDENİN MADDENİN HALLERİ HALLERİ maddenin haller i MADDENİN
Madde Tanımı Kütlesi,hacmi,eylemsizliği olan,tanecikli yapıdaki her şeye madde denir. Yer yüzünde gözümüzle görebildiğimiz her şey maddedir. MADDENİN MADDENİN HALLERİ HALLERİ maddenin haller i MADDENİN
Moleküllerarası Etkileşimler, Sıvılar ve Katılar - 11
 Moleküllerarası Etkileşimler, Chemistry, The Central Science, 10th edition Theodore L. Brown; H. Eugene LeMay, Jr.; and Bruce E. Bursten Sıvılar ve Katılar - 11 Maddenin Halleri Maddenin halleri arasındaki
Moleküllerarası Etkileşimler, Chemistry, The Central Science, 10th edition Theodore L. Brown; H. Eugene LeMay, Jr.; and Bruce E. Bursten Sıvılar ve Katılar - 11 Maddenin Halleri Maddenin halleri arasındaki
Örneğin; İki hidrojen (H) uyla, bir oksijen (O) u birleşerek hidrojen ve oksijenden tamamen farklı olan su (H 2
 On5yirmi5.com Madde ve özellikleri Kütlesi, hacmi ve eylemsizliği olan herşey maddedir. Yayın Tarihi : 21 Ocak 2014 Salı (oluşturma : 2/9/2016) Kütle hacim ve eylemsizlik maddenin ortak özelliklerindendir.çevremizde
On5yirmi5.com Madde ve özellikleri Kütlesi, hacmi ve eylemsizliği olan herşey maddedir. Yayın Tarihi : 21 Ocak 2014 Salı (oluşturma : 2/9/2016) Kütle hacim ve eylemsizlik maddenin ortak özelliklerindendir.çevremizde
MADDENİN AYIRT EDİCİ ÖZELLİKLERİ. Nazife ALTIN Bayburt Üniversitesi, Eğitim Fakültesi
 MADDENİN AYIRT EDİCİ ÖZELLİKLERİ Bayburt Üniversitesi, Eğitim Fakültesi www.nazifealtin.wordpress.com MADDENİN AYIRT EDİCİ ÖZELLİKLERİ Bir maddeyi diğerlerinden ayırmamıza ve ayırdığımız maddeyi tanımamıza
MADDENİN AYIRT EDİCİ ÖZELLİKLERİ Bayburt Üniversitesi, Eğitim Fakültesi www.nazifealtin.wordpress.com MADDENİN AYIRT EDİCİ ÖZELLİKLERİ Bir maddeyi diğerlerinden ayırmamıza ve ayırdığımız maddeyi tanımamıza
Birden çok maddenin kimyasal bağ oluşturmadan bir arada bulunmasıyla meydana gelen maddelere karışım denir.
 Anahtar Kavramlar Çözelti çözücü çözünen homojen hetorojen derişik seyreltik Birden çok maddenin kimyasal bağ oluşturmadan bir arada bulunmasıyla meydana gelen maddelere karışım denir. Solduğumuz hava;
Anahtar Kavramlar Çözelti çözücü çözünen homojen hetorojen derişik seyreltik Birden çok maddenin kimyasal bağ oluşturmadan bir arada bulunmasıyla meydana gelen maddelere karışım denir. Solduğumuz hava;
Maddelerin Sınıflandırılması. Yrd. Doç. Dr. H. Hasan YOLCU
 Maddelerin Sınıflandırılması Yrd. Doç. Dr. H. Hasan YOLCU Maddelerin Sınıflandırılması Madde Evet Saf Madde Sabit bir bileşimi varmı. Kimyasal formülle belirtilemiliyor mu? Hayır Karışım Element Bileşik
Maddelerin Sınıflandırılması Yrd. Doç. Dr. H. Hasan YOLCU Maddelerin Sınıflandırılması Madde Evet Saf Madde Sabit bir bileşimi varmı. Kimyasal formülle belirtilemiliyor mu? Hayır Karışım Element Bileşik
GENEL KİMYA. Yrd.Doç.Dr. Tuba YETİM
 GENEL KİMYA MOLEKÜLLER ARASI KUVVETLER Moleküller Arası Kuvvetler Yüksek basınç ve düşük sıcaklıklarda moleküller arası kuvvetler gazları ideallikten saptırır. Moleküller arası kuvvetler molekülde kalıcı
GENEL KİMYA MOLEKÜLLER ARASI KUVVETLER Moleküller Arası Kuvvetler Yüksek basınç ve düşük sıcaklıklarda moleküller arası kuvvetler gazları ideallikten saptırır. Moleküller arası kuvvetler molekülde kalıcı
DENEY 3. MADDENİN ÜÇ HALİ: NİTEL VE NİCEL GÖZLEMLER Sıcaklık ilişkileri
 DENEY 3 MADDENİN ÜÇ HALİ: NİTEL VE NİCEL GÖZLEMLER Sıcaklık ilişkileri AMAÇ: Maddelerin üç halinin nitel ve nicel gözlemlerle incelenerek maddenin sıcaklık ile davranımını incelemek. TEORİ Hal değişimi,
DENEY 3 MADDENİN ÜÇ HALİ: NİTEL VE NİCEL GÖZLEMLER Sıcaklık ilişkileri AMAÇ: Maddelerin üç halinin nitel ve nicel gözlemlerle incelenerek maddenin sıcaklık ile davranımını incelemek. TEORİ Hal değişimi,
Serüveni. 1.ÜNİTE: KİMYA BİLİMİ Kimyanın Sembolik Dili #3
 Serüveni 1.ÜNİTE: KİMYA BİLİMİ Kimyanın Sembolik Dili #3 MADDE SAF MADDE SAF OLMAYAN MADDE(KARIŞIM) ELEMENT BİLEŞİK HOMOJEN KARIŞIM HETEROJEN KARIŞIM METAL İYONİK BİLEŞİKLER SÜSPANSİYON AMETAL KOVALENT
Serüveni 1.ÜNİTE: KİMYA BİLİMİ Kimyanın Sembolik Dili #3 MADDE SAF MADDE SAF OLMAYAN MADDE(KARIŞIM) ELEMENT BİLEŞİK HOMOJEN KARIŞIM HETEROJEN KARIŞIM METAL İYONİK BİLEŞİKLER SÜSPANSİYON AMETAL KOVALENT
YouTube:Kimyafull Gülçin Hoca Serüveni DERİŞİM BİRİMLERİ Ppm-ppb SORU ÇÖZÜMLERİ
 Serüveni DERİŞİM BİRİMLERİ Ppm-ppb SORU ÇÖZÜMLERİ ppm Toplam madde miktarının milyonda 1 birimlik maddesine denir. NOT: 1 kg su = 1 Litre ppm =. 10 6 1 kg çözeltide çözünen maddenin mg olarak kütlesine
Serüveni DERİŞİM BİRİMLERİ Ppm-ppb SORU ÇÖZÜMLERİ ppm Toplam madde miktarının milyonda 1 birimlik maddesine denir. NOT: 1 kg su = 1 Litre ppm =. 10 6 1 kg çözeltide çözünen maddenin mg olarak kütlesine
MOL KAVRAMI I. ÖRNEK 2
 MOL KAVRAMI I Maddelerin taneciklerden oluştuğunu biliyoruz. Bu taneciklere atom, molekül ya da iyon denir. Atom : Kimyasal yöntemlerle daha basit taneciklere ayrılmayan ve elementlerin yapıtaşı olan taneciklere
MOL KAVRAMI I Maddelerin taneciklerden oluştuğunu biliyoruz. Bu taneciklere atom, molekül ya da iyon denir. Atom : Kimyasal yöntemlerle daha basit taneciklere ayrılmayan ve elementlerin yapıtaşı olan taneciklere
Malzeme Bilgisi Prof. Dr. Akgün ALSARAN. Temel kavramlar Faz Diyagramları
 Malzeme Bilgisi Prof. Dr. Akgün ALSARAN Temel kavramlar Faz Diyagramları İçerik Giriş Ergime ve katılaşma Faz diyagramları Faz kuralı Faz diyagramlarından sağlanan bilgiler Denge halleri Dğer reksiyon
Malzeme Bilgisi Prof. Dr. Akgün ALSARAN Temel kavramlar Faz Diyagramları İçerik Giriş Ergime ve katılaşma Faz diyagramları Faz kuralı Faz diyagramlarından sağlanan bilgiler Denge halleri Dğer reksiyon
ÇÖKELME SERTLEŞTİRMESİ HOŞGELDİNİZ
 ÇÖKELME SERTLEŞTİRMESİ Malzeme Malzeme Bilgisi Bilgisi PROF. DR. HÜSEYİN UZUN HOŞGELDİNİZ 1 ÇÖKELME SERTLEŞTİRMESİ (Yaşlandırma Sertleşmesi) Bazı metal alaşımlarının sertlik ve mukavemeti, soğuk deformasyon
ÇÖKELME SERTLEŞTİRMESİ Malzeme Malzeme Bilgisi Bilgisi PROF. DR. HÜSEYİN UZUN HOŞGELDİNİZ 1 ÇÖKELME SERTLEŞTİRMESİ (Yaşlandırma Sertleşmesi) Bazı metal alaşımlarının sertlik ve mukavemeti, soğuk deformasyon
METALLERDE KATILAŞMA HOŞGELDİNİZ
 METALLERDE KATILAŞMA Malzeme Malzeme Bilgisi Bilgisi PROF. DR. HÜSEYİN UZUN HOŞGELDİNİZ 1 /94 METALLERDE KATILAŞMA Metal ve alaşımlar, belirli bir sıcaklıktan sonra (ergime sıcaklığı) katı halden sıvı
METALLERDE KATILAŞMA Malzeme Malzeme Bilgisi Bilgisi PROF. DR. HÜSEYİN UZUN HOŞGELDİNİZ 1 /94 METALLERDE KATILAŞMA Metal ve alaşımlar, belirli bir sıcaklıktan sonra (ergime sıcaklığı) katı halden sıvı
KARIŞIM NEDİR? YANDAKİ RESİMDE GÖRÜLEN SALATA KARIŞIM MIDIR?
 KARIŞIMLAR KARIŞIM NEDİR? YANDAKİ RESİMDE GÖRÜLEN SALATA KARIŞIM MIDIR? Birden çok maddenin kimyasal bağ oluşturmadan bir arada bulunmasıyla meydana gelen maddelere karışım denir. Karışımlar görünümlerine
KARIŞIMLAR KARIŞIM NEDİR? YANDAKİ RESİMDE GÖRÜLEN SALATA KARIŞIM MIDIR? Birden çok maddenin kimyasal bağ oluşturmadan bir arada bulunmasıyla meydana gelen maddelere karışım denir. Karışımlar görünümlerine
SAF MADDE VE KARIŞIMLAR
 Bazı maddeler tek çeşit maddeden oluşur, yapısında kendinden başka madde içermez. Böyle maddelere saf madde denir. Örneğin tuzun yapısında sadece tuz maddesi bulunur, tuzun en küçük parçası yine tuzdur.
Bazı maddeler tek çeşit maddeden oluşur, yapısında kendinden başka madde içermez. Böyle maddelere saf madde denir. Örneğin tuzun yapısında sadece tuz maddesi bulunur, tuzun en küçük parçası yine tuzdur.
Radyoaktif elementin tek başına bulunması, bileşik içinde bulunması, katı, sıvı, gaz, iyon halinde bulunması radyoaktif özelliğini etkilemez.
 RADYOAKTİFLİK Kendiliğinden ışıma yapabilen maddelere radyoaktif maddeler denir. Radyoaktiflik çekirdek yapısıyla ilişkilidir. Radyoaktif bir atom hangi bileşiğin yapısına girerse o bileşiği radyoaktif
RADYOAKTİFLİK Kendiliğinden ışıma yapabilen maddelere radyoaktif maddeler denir. Radyoaktiflik çekirdek yapısıyla ilişkilidir. Radyoaktif bir atom hangi bileşiğin yapısına girerse o bileşiği radyoaktif
KTÜ, Metalurji ve Malzeme Mühendisliği Bölümü
 FAZ DİYAGRAMLARI DERS NOTLARI İçerik KTÜ, Metalurji ve Malzeme Mühendisliği Bölümü Peritektik Alaşım Sistemleri Peritektik Dönüşüm: Peritektik dönüşüm; ötektik dönüşüm gösteren alaşım sistemlerine benzer
FAZ DİYAGRAMLARI DERS NOTLARI İçerik KTÜ, Metalurji ve Malzeme Mühendisliği Bölümü Peritektik Alaşım Sistemleri Peritektik Dönüşüm: Peritektik dönüşüm; ötektik dönüşüm gösteren alaşım sistemlerine benzer
SEZEN DEMİR MADDE DOĞADA KARIŞIK HALDE BULUNUR
 Kütlesi, hacmi ve eylemsizliği olan her şey maddedir. Buna göre kütle hacim ve eylemsizlik maddenin ortak özelliklerindendir. Çevremizde gördüğümüz, hava, su, toprak v.s gibi her şey maddedir. Maddeler
Kütlesi, hacmi ve eylemsizliği olan her şey maddedir. Buna göre kütle hacim ve eylemsizlik maddenin ortak özelliklerindendir. Çevremizde gördüğümüz, hava, su, toprak v.s gibi her şey maddedir. Maddeler
Boya eklenmesi Kısmen karışma Homojenleşme
 DİFÜZYON 1 Katı içerisindeki atomların hareketi yüksek konsantrasyon bölgelerinden düşük konsantrasyon bölgelerine doğrudur. Kayma olayından farklıdır. Kaymada hareketli atom düzlemlerindeki bütün atomlar
DİFÜZYON 1 Katı içerisindeki atomların hareketi yüksek konsantrasyon bölgelerinden düşük konsantrasyon bölgelerine doğrudur. Kayma olayından farklıdır. Kaymada hareketli atom düzlemlerindeki bütün atomlar
Serüveni 4.ÜNİTE MADDENİN HALLERİ ORTAK VE AYIRDEDİCİ ÖZELLİKLER
 Serüveni 4.ÜNİTE MADDENİN HALLERİ ORTAK VE AYIRDEDİCİ ÖZELLİKLER MADDENİN HALLERİ MADDE MİKTARINA BAĞLI ÖZELLİKLER:(ORTAK ÖZELLİKLER) :Madde miktarının ölçüsüdür. :Maddenin boşlukta kapladığı yerdir Eylemsizlik:Maddenin
Serüveni 4.ÜNİTE MADDENİN HALLERİ ORTAK VE AYIRDEDİCİ ÖZELLİKLER MADDENİN HALLERİ MADDE MİKTARINA BAĞLI ÖZELLİKLER:(ORTAK ÖZELLİKLER) :Madde miktarının ölçüsüdür. :Maddenin boşlukta kapladığı yerdir Eylemsizlik:Maddenin
Gaz hali genel olarak molekül ve atomların birbirinden uzak olduğu ve çok hızlı hareket ettiği bir haldir.
 GAZLAR Maddeler tabiatta katı, sıvı ve gaz olmak üzere üç halde bulunurlar. Gaz hali genel olarak molekül ve atomların birbirinden uzak olduğu ve çok hızlı hareket ettiği bir haldir. Gaz molekülleri birbirine
GAZLAR Maddeler tabiatta katı, sıvı ve gaz olmak üzere üç halde bulunurlar. Gaz hali genel olarak molekül ve atomların birbirinden uzak olduğu ve çok hızlı hareket ettiği bir haldir. Gaz molekülleri birbirine
KARIŞIMLAR. Birden çok maddenin kimyasal bağ oluşturmadan bir arada bulunmasıyla meydana gelen mad-delere karışım denir.
 KARIŞIMLAR Birden çok maddenin kimyasal bağ oluşturmadan bir arada bulunmasıyla meydana gelen mad-delere karışım denir. 1-HETEROJEN KARIŞIMLAR (ADİ KARIŞIMLAR) Karışımı oluşturan maddeler karışımın her
KARIŞIMLAR Birden çok maddenin kimyasal bağ oluşturmadan bir arada bulunmasıyla meydana gelen mad-delere karışım denir. 1-HETEROJEN KARIŞIMLAR (ADİ KARIŞIMLAR) Karışımı oluşturan maddeler karışımın her
2-C- BAKIR VE ALAŞIMLARININ ISIL İŞLEMLERİ 2-C-3 MARTENSİTİK SU VERME(*)
 2-C- BAKIR VE ALAŞIMLARININ ISIL İŞLEMLERİ 2-C-3 MARTENSİTİK SU VERME(*) Sınai bakırlı alaşımlar arasında sadece soğukta iki veya çok fazlı alüminyumlu bakırlar pratik olarak mantensitik su almaya yatkındırlar.
2-C- BAKIR VE ALAŞIMLARININ ISIL İŞLEMLERİ 2-C-3 MARTENSİTİK SU VERME(*) Sınai bakırlı alaşımlar arasında sadece soğukta iki veya çok fazlı alüminyumlu bakırlar pratik olarak mantensitik su almaya yatkındırlar.
FARMASÖTİK TEKNOLOJİ I «ÇÖZELTİLER»
 FARMASÖTİK TEKNOLOJİ I «ÇÖZELTİLER» Uygun bir çözücü içerisinde bir ya da birden fazla maddenin çözündüğü veya moleküler düzeyde disperse olduğu tektür (homojen: her tarafta aynı oranda çözünmüş veya dağılmış
FARMASÖTİK TEKNOLOJİ I «ÇÖZELTİLER» Uygun bir çözücü içerisinde bir ya da birden fazla maddenin çözündüğü veya moleküler düzeyde disperse olduğu tektür (homojen: her tarafta aynı oranda çözünmüş veya dağılmış
BİLEŞİKLER ve FORMÜLLERİ
 BİLEŞİKLER ve FORMÜLLERİ Bileşikler ve Formülleri Bilinen yaklaşık 120 çeşit element vardır. Bu elementlerin yaklaşık % 90 ı tabiatta bulunur. Ancak bugün bilinen yaklaşık 30 milyon bileşik vardır. Buna
BİLEŞİKLER ve FORMÜLLERİ Bileşikler ve Formülleri Bilinen yaklaşık 120 çeşit element vardır. Bu elementlerin yaklaşık % 90 ı tabiatta bulunur. Ancak bugün bilinen yaklaşık 30 milyon bileşik vardır. Buna
GENEL KİMYA 101 ÖDEV 3
 TOBB EKONOMİ VE TEKNOLOJİ ÜNİVERSİTESİ-27 Kasım 2013 Bütün Şubeler GENEL KİMYA 101 ÖDEV 3 ÖNEMLİ! Ödev Teslim Tarihi: 6 Aralık 2013 Soru 1-5 arasında 2 soru Soru 6-10 arasında 2 soru Soru 11-15 arasında
TOBB EKONOMİ VE TEKNOLOJİ ÜNİVERSİTESİ-27 Kasım 2013 Bütün Şubeler GENEL KİMYA 101 ÖDEV 3 ÖNEMLİ! Ödev Teslim Tarihi: 6 Aralık 2013 Soru 1-5 arasında 2 soru Soru 6-10 arasında 2 soru Soru 11-15 arasında
MADDENİN HALLERİ VE TANECİKLİ YAPI
 MADDENİN HALLERİ VE TANECİKLİ YAPI MADDE BİLGİSİ Kütlesi hacmi ve eylemsizliği olan her şeye madde denir. Maddenin şekil almış haline cisim denir. Cam bir madde iken cam bardak bir cisimdir. Maddeler doğada
MADDENİN HALLERİ VE TANECİKLİ YAPI MADDE BİLGİSİ Kütlesi hacmi ve eylemsizliği olan her şeye madde denir. Maddenin şekil almış haline cisim denir. Cam bir madde iken cam bardak bir cisimdir. Maddeler doğada
MADDE NEDİR? Çevremize baktığımızda gördüğümüz her şey örneğin, dağlar, denizler, ağaçlar, bitkiler, hayvanlar ve hava birer maddedir.
 MADDE NEDİR? Çevremize baktığımızda gördüğümüz her şey örneğin, dağlar, denizler, ağaçlar, bitkiler, hayvanlar ve hava birer maddedir. Her maddenin bir kütlesi vardır ve bu tartılarak bulunur. Ayrıca her
MADDE NEDİR? Çevremize baktığımızda gördüğümüz her şey örneğin, dağlar, denizler, ağaçlar, bitkiler, hayvanlar ve hava birer maddedir. Her maddenin bir kütlesi vardır ve bu tartılarak bulunur. Ayrıca her
c harfi ile gösterilir. Birimi J/g C dir. 1 g suyun sıcaklığını 1 C arttırmak için 4,18J ısı vermek gerekir
 Saf bir maddenin 1 gramının sıcaklığını 1 C değiştirmek için alınması gereken ya da verilmesi gereken ısı miktarına ÖZ ISI denir. Öz ısı saf maddeler için ayırt edici bir özelliktir. Birimi J/g C dir.
Saf bir maddenin 1 gramının sıcaklığını 1 C değiştirmek için alınması gereken ya da verilmesi gereken ısı miktarına ÖZ ISI denir. Öz ısı saf maddeler için ayırt edici bir özelliktir. Birimi J/g C dir.
MIG-MAG KAYNAK METODUNDA KULLANILAN KAYNAK ELEKTROTLARI VE ELEKTROT SEÇİMİ
 MIG-MAG KAYNAK METODUNDA KULLANILAN KAYNAK ELEKTROTLARI VE ELEKTROT SEÇİMİ Prof. Dr. Ramazan YILMAZ Sakarya Üniversitesi, Teknoloji Fakültesi, Metalurji ve Malzeme Mühendisliği Bölümü Esentepe Kampüsü,
MIG-MAG KAYNAK METODUNDA KULLANILAN KAYNAK ELEKTROTLARI VE ELEKTROT SEÇİMİ Prof. Dr. Ramazan YILMAZ Sakarya Üniversitesi, Teknoloji Fakültesi, Metalurji ve Malzeme Mühendisliği Bölümü Esentepe Kampüsü,
ÖĞRENME ALANI : FİZİKSEL OLAYLAR ÜNİTE 2 : KUVVET VE HAREKET
 ÖĞRENME ALANI : FİZİKSEL OLAYLAR ÜNİTE 2 : KUVVET VE HAREKET A BASINÇ VE BASINÇ BİRİMLERİ (5 SAAT) Madde ve Özellikleri 2 Kütle 3 Eylemsizlik 4 Tanecikli Yapı 5 Hacim 6 Öz Kütle (Yoğunluk) 7 Ağırlık 8
ÖĞRENME ALANI : FİZİKSEL OLAYLAR ÜNİTE 2 : KUVVET VE HAREKET A BASINÇ VE BASINÇ BİRİMLERİ (5 SAAT) Madde ve Özellikleri 2 Kütle 3 Eylemsizlik 4 Tanecikli Yapı 5 Hacim 6 Öz Kütle (Yoğunluk) 7 Ağırlık 8
GIDALARIN BAZI FİZİKSEL NİTELİKLERİ
 GIDALARIN BAZI FİZİKSEL NİTELİKLERİ 1 Gıdaların bazı fiziksel özellikleri: Yoğunluk Özgül ısı Viskozite Gıdaların kimyasal bileşimi ve fiziksel yapılarına bağlı olarak BELLİ SINIRLARDA DEĞİŞİR!!! Kimyasal
GIDALARIN BAZI FİZİKSEL NİTELİKLERİ 1 Gıdaların bazı fiziksel özellikleri: Yoğunluk Özgül ısı Viskozite Gıdaların kimyasal bileşimi ve fiziksel yapılarına bağlı olarak BELLİ SINIRLARDA DEĞİŞİR!!! Kimyasal
ÖĞRETĐM TEKNOLOJĐSĐ VE MATERYAL GELĐŞTĐRME
 ÖĞRETĐM TEKNOLOJĐSĐ VE MATERYAL GELĐŞTĐRME KONU: MADDE VE ÖZELLĐKLERĐ (Konu Anlatımı) Hazırlayan: Pınar ÖZCAN Ders Sorumlusu: Prof. Dr. Đnci MORGĐL ANKARA,2008 MADDE VE ÖZELLĐKLERĐ MADDE Kütlesi, hacmi
ÖĞRETĐM TEKNOLOJĐSĐ VE MATERYAL GELĐŞTĐRME KONU: MADDE VE ÖZELLĐKLERĐ (Konu Anlatımı) Hazırlayan: Pınar ÖZCAN Ders Sorumlusu: Prof. Dr. Đnci MORGĐL ANKARA,2008 MADDE VE ÖZELLĐKLERĐ MADDE Kütlesi, hacmi
GENEL KİMYA. Yrd.Doç.Dr. Tuba YETİM
 GENEL KİMYA ÇÖZELTİLER Homojen karışımlara çözelti denir. Çözelti bileşiminin ve özelliklerinin çözeltinin her yerinde aynı olması sebebiyle çözelti, «homojen» olarak nitelendirilir. Çözeltinin değişen
GENEL KİMYA ÇÖZELTİLER Homojen karışımlara çözelti denir. Çözelti bileşiminin ve özelliklerinin çözeltinin her yerinde aynı olması sebebiyle çözelti, «homojen» olarak nitelendirilir. Çözeltinin değişen
Bölüm 3 SAF MADDENİN ÖZELLİKLERİ
 Bölüm 3 SAF MADDENİN ÖZELLİKLERİ 1 Amaçlar Amaçlar Saf madde kavramının tanıtılması Faz değişimi işleminin fizik ilkelerinin incelenmesi Saf maddenin P-v-T yüzeylerinin ve P-v, T-v ve P-T özelik diyagramlarının
Bölüm 3 SAF MADDENİN ÖZELLİKLERİ 1 Amaçlar Amaçlar Saf madde kavramının tanıtılması Faz değişimi işleminin fizik ilkelerinin incelenmesi Saf maddenin P-v-T yüzeylerinin ve P-v, T-v ve P-T özelik diyagramlarının
MADDE VE ÖZELLİKLERİ. Kimya Konu Tarama Testi-2
 MADDE VE ÖZELLİKLERİ Kimya Konu Tarama Testi-2 SORU 1: I. Renk, koku, tat ve uçuculuk tüm maddelerin ortak özelliğidir. II. Özkütle, esneklik katsayısı ve kaynama noktası tüm maddelerin ayırt edici özelliğidir.
MADDE VE ÖZELLİKLERİ Kimya Konu Tarama Testi-2 SORU 1: I. Renk, koku, tat ve uçuculuk tüm maddelerin ortak özelliğidir. II. Özkütle, esneklik katsayısı ve kaynama noktası tüm maddelerin ayırt edici özelliğidir.
KRİSTAL KAFES SİSTEMLERİ
 KRİSTAL KAFES SİSTEMLERİ Doç. Dr. Ramazan YILMAZ Sakarya Üniversitesi, Teknoloji Fakültesi, Metalurji ve Malzeme Mühendisliği Bölümü Esentepe Kampüsü, 54187, SAKARYA 1 Giriş 2 Kristal Yapısı ve Birim Hücreler
KRİSTAL KAFES SİSTEMLERİ Doç. Dr. Ramazan YILMAZ Sakarya Üniversitesi, Teknoloji Fakültesi, Metalurji ve Malzeme Mühendisliği Bölümü Esentepe Kampüsü, 54187, SAKARYA 1 Giriş 2 Kristal Yapısı ve Birim Hücreler
EYVAH ŞEKERĐM KAYBOLDU!!!!! 9. SINIF 4. ÜNĐTE KARIŞIMLAR
 EYVAH ŞEKERĐM KAYBOLDU!!!!! 9. SINIF 4. ÜNĐTE KARIŞIMLAR KĐMYA ĐLE ĐLĐŞKĐSĐ ve GÜNLÜK HAYATLA ĐLĐŞKĐSĐ ŞEKERĐN ÇAYDA YA DA BAŞKA BĐR SIVIDA KARIŞTIRILDIĞINDA KAYBOLMASI, KĐMYADA ÇÖZÜNME OLGUSUYLA AÇIKLANABĐLĐR.
EYVAH ŞEKERĐM KAYBOLDU!!!!! 9. SINIF 4. ÜNĐTE KARIŞIMLAR KĐMYA ĐLE ĐLĐŞKĐSĐ ve GÜNLÜK HAYATLA ĐLĐŞKĐSĐ ŞEKERĐN ÇAYDA YA DA BAŞKA BĐR SIVIDA KARIŞTIRILDIĞINDA KAYBOLMASI, KĐMYADA ÇÖZÜNME OLGUSUYLA AÇIKLANABĐLĐR.
ÇÖZÜNME ve ÇÖZÜNÜRLÜK
 ÇÖZÜNME ve ÇÖZÜNÜRLÜK Prof. Dr. Mustafa DEMİR M.DEMİR 05-ÇÖZÜNME VE ÇÖZÜNÜRLÜK 1 Çözünme Olayı Analitik kimyada çözücü olarak genellikle su kullanılır. Su molekülleri, bir oksijen atomuna bağlı iki hidrojen
ÇÖZÜNME ve ÇÖZÜNÜRLÜK Prof. Dr. Mustafa DEMİR M.DEMİR 05-ÇÖZÜNME VE ÇÖZÜNÜRLÜK 1 Çözünme Olayı Analitik kimyada çözücü olarak genellikle su kullanılır. Su molekülleri, bir oksijen atomuna bağlı iki hidrojen
İnstagram:kimyaci_glcn_hoca GAZLAR-2. İnstagram:kimyaci_glcn_hoca
 GAZLAR-2 GERÇEK GAZLAR Gazların davranışlarını açıklayan kinetik teoriye göre; 1. Gaz tanecikleri çok küçük hacme sahip olduklarından kabın hacmine göre gaz taneciklerinin hacmi ihmal edilebilir. 2. Gaz
GAZLAR-2 GERÇEK GAZLAR Gazların davranışlarını açıklayan kinetik teoriye göre; 1. Gaz tanecikleri çok küçük hacme sahip olduklarından kabın hacmine göre gaz taneciklerinin hacmi ihmal edilebilir. 2. Gaz
Malzeme Bilgisi Prof. Dr. Akgün ALSARAN. Temel kavramlar Demir-Karbon Denge Diyagramı
 Malzeme Bilgisi Prof. Dr. Akgün ALSARAN Temel kavramlar Demir-Karbon Denge Diyagramı İçerik Giriş Demir-sementit diyagramı Demir-grafit diyagramı Dökme demir 2 Giriş Demir, pek çok mühendislik alaşımının
Malzeme Bilgisi Prof. Dr. Akgün ALSARAN Temel kavramlar Demir-Karbon Denge Diyagramı İçerik Giriş Demir-sementit diyagramı Demir-grafit diyagramı Dökme demir 2 Giriş Demir, pek çok mühendislik alaşımının
Bölüm 3 SAF MADDENİN ÖZELLİKLERİ
 Bölüm 3 SAF MADDENİN ÖZELLİKLERİ 1 Amaçlar Saf madde kavramının tanıtılması Faz değişimi işleminin fizik ilkelerinin incelenmesi Saf maddenin P-v-T yüzeylerinin ve P-v, T-v ve P-T özelik diyagramlarının
Bölüm 3 SAF MADDENİN ÖZELLİKLERİ 1 Amaçlar Saf madde kavramının tanıtılması Faz değişimi işleminin fizik ilkelerinin incelenmesi Saf maddenin P-v-T yüzeylerinin ve P-v, T-v ve P-T özelik diyagramlarının
Ergime ve katılaşma 2/41
 Faz Diyagramları Ergime ve katılaşma Bir malzemenin eritilmesi ve katılaşması sırasında meydana gelen olayları bilerek bizler amacımıza uygun malzemeler elde edebiliriz. Bunun için erime ve katılaşma sırasında
Faz Diyagramları Ergime ve katılaşma Bir malzemenin eritilmesi ve katılaşması sırasında meydana gelen olayları bilerek bizler amacımıza uygun malzemeler elde edebiliriz. Bunun için erime ve katılaşma sırasında
Magnetic Materials. 7. Ders: Ferromanyetizma. Numan Akdoğan.
 Magnetic Materials 7. Ders: Ferromanyetizma Numan Akdoğan akdogan@gyte.edu.tr Gebze Institute of Technology Department of Physics Nanomagnetism and Spintronic Research Center (NASAM) Moleküler Alan Teorisinin
Magnetic Materials 7. Ders: Ferromanyetizma Numan Akdoğan akdogan@gyte.edu.tr Gebze Institute of Technology Department of Physics Nanomagnetism and Spintronic Research Center (NASAM) Moleküler Alan Teorisinin
BÖLÜM 3 DİFÜZYON (YAYINIM)
 BÖLÜM 3 DİFÜZYON (YAYINIM) 1 Mürekkebin suda yayılması veya kolonyanın havada yayılması difüzyona örnektir. En hızlı difüzyon gazlarda görülür. Katılarda atom hareketleri daha yavaş olduğu için katılarda
BÖLÜM 3 DİFÜZYON (YAYINIM) 1 Mürekkebin suda yayılması veya kolonyanın havada yayılması difüzyona örnektir. En hızlı difüzyon gazlarda görülür. Katılarda atom hareketleri daha yavaş olduğu için katılarda
Fiziksel özellikler nelerdir? Mekanik Elektriksel Termal Manyetik Optik
 DENGE DİYAGRAMLARI Fiziksel özellikler nelerdir? Mekanik Elektriksel Termal Manyetik Optik Malzemeler neden farklı özellikler gösterirler? Özellikler Fiziksel Kimyasal Bahsi gecen yapısal etkenlerden elektron
DENGE DİYAGRAMLARI Fiziksel özellikler nelerdir? Mekanik Elektriksel Termal Manyetik Optik Malzemeler neden farklı özellikler gösterirler? Özellikler Fiziksel Kimyasal Bahsi gecen yapısal etkenlerden elektron
ÖĞRETĐM TEKNOLOJĐSĐ VE MATERYAL GELĐŞTĐRME ÇÖZELTĐLER
 ÖĞRETĐM TEKNOLOJĐSĐ VE MATERYAL GELĐŞTĐRME ÇÖZELTĐLER Ders Sorumlusu: Prof. Dr. Đnci MORGĐL HAZIRLAYAN: NAZLI KIRCI ANKARA,2008 KONU ANLATIMI ÇÖZELTĐLER Đki ya da daha fazla kimyasal maddenin herhangi
ÖĞRETĐM TEKNOLOJĐSĐ VE MATERYAL GELĐŞTĐRME ÇÖZELTĐLER Ders Sorumlusu: Prof. Dr. Đnci MORGĐL HAZIRLAYAN: NAZLI KIRCI ANKARA,2008 KONU ANLATIMI ÇÖZELTĐLER Đki ya da daha fazla kimyasal maddenin herhangi
STOKİYOMETRİ. Kimyasal Tepkimelerde Kütle İlişkisi
 STOKİYOMETRİ Kimyasal Tepkimelerde Kütle İlişkisi Sülfür oksijen içerisinde yanarak kükürt dioksit oluşturur. Modeller elementel sülfürü (S8), oksijeni ve kükürt dioksit moleküllerini göstermektedir. Her
STOKİYOMETRİ Kimyasal Tepkimelerde Kütle İlişkisi Sülfür oksijen içerisinde yanarak kükürt dioksit oluşturur. Modeller elementel sülfürü (S8), oksijeni ve kükürt dioksit moleküllerini göstermektedir. Her
MADDE NEDİR? Çevremize baktığımızda gördüğümüz her şey örneğin, dağlar, denizler, ağaçlar, bitkiler, hayvanlar ve hava birer maddedir.
 MADDE NEDİR? Çevremize baktığımızda gördüğümüz her şey örneğin, dağlar, denizler, ağaçlar, bitkiler, hayvanlar ve hava birer maddedir. Her maddenin bir kütlesi vardır ve bu tartılarak bulunur. Ayrıca her
MADDE NEDİR? Çevremize baktığımızda gördüğümüz her şey örneğin, dağlar, denizler, ağaçlar, bitkiler, hayvanlar ve hava birer maddedir. Her maddenin bir kütlesi vardır ve bu tartılarak bulunur. Ayrıca her
DOKUZ EYLÜL ÜNİVERSİTESİ MÜHENDİSLİK FAKÜLTESİ DEKANLIĞI DERS/MODÜL/BLOK TANITIM FORMU. Dersin Kodu: MME 2004
 Dersi Veren Birim: Metalurji ve Malzeme Mühendisliği Dersin Türkçe Adı: ÇÖZELTİLER TERMODİNAMİĞİ Dersin Orjinal Adı: THERMODYNAMICS OF SOLUTIONS Dersin Düzeyi:(Ön lisans, Lisans, Yüksek Lisans, Doktora)
Dersi Veren Birim: Metalurji ve Malzeme Mühendisliği Dersin Türkçe Adı: ÇÖZELTİLER TERMODİNAMİĞİ Dersin Orjinal Adı: THERMODYNAMICS OF SOLUTIONS Dersin Düzeyi:(Ön lisans, Lisans, Yüksek Lisans, Doktora)
 Doğada ki maddelerin de hemen hemen hepsi karışım halinde bulunmaktadır. Soluduğumuz hava,içtiğimiz su,toprak,yediğimiz yemek birer karışımdır.karışım birden çok maddenin kimyasal bağ oluşturmadan bir
Doğada ki maddelerin de hemen hemen hepsi karışım halinde bulunmaktadır. Soluduğumuz hava,içtiğimiz su,toprak,yediğimiz yemek birer karışımdır.karışım birden çok maddenin kimyasal bağ oluşturmadan bir
10. Sınıf Kimya Konuları KİMYANIN TEMEL KANUNLARI VE TEPKİME TÜRLERİ Kimyanın Temel Kanunları Kütlenin korunumu, sabit oranlar ve katlı oranlar
 10. Sınıf Kimya Konuları KİMYANIN TEMEL KANUNLARI VE TEPKİME TÜRLERİ Kimyanın Temel Kanunları Kütlenin korunumu, sabit oranlar ve katlı oranlar kanunları Demir (II) sülfür bileşiğinin elde edilmesi Kimyasal
10. Sınıf Kimya Konuları KİMYANIN TEMEL KANUNLARI VE TEPKİME TÜRLERİ Kimyanın Temel Kanunları Kütlenin korunumu, sabit oranlar ve katlı oranlar kanunları Demir (II) sülfür bileşiğinin elde edilmesi Kimyasal
ÖĞRETĐM TEKNĐKLERĐ VE MATERYAL GELĐŞTĐRME
 ÖĞRETĐM TEKNĐKLERĐ VE MATERYAL GELĐŞTĐRME DERS SORUMLUSU: PROF. DR. ĐNCĐ MORGĐL ÖĞRENME ALANI: MADDE VE ÖZELLĐKLERĐ HAZIRLAYAN: Gökçegül DUYGUN 2008 ANKARA KONU ANLATIMI MADDE ve ÖZELLĐKLERĐ MADDE Kütlesi,
ÖĞRETĐM TEKNĐKLERĐ VE MATERYAL GELĐŞTĐRME DERS SORUMLUSU: PROF. DR. ĐNCĐ MORGĐL ÖĞRENME ALANI: MADDE VE ÖZELLĐKLERĐ HAZIRLAYAN: Gökçegül DUYGUN 2008 ANKARA KONU ANLATIMI MADDE ve ÖZELLĐKLERĐ MADDE Kütlesi,
BMM 205 Malzeme Biliminin Temelleri
 BMM 205 Malzeme Biliminin Temelleri Faz Diyagramları Dr. Ersin Emre Ören Biyomedikal Mühendisliği Bölümü Malzeme Bilimi ve Nanoteknoloji Mühendisliği Bölümü TOBB Ekonomi ve Teknoloji Üniversitesi Ankara
BMM 205 Malzeme Biliminin Temelleri Faz Diyagramları Dr. Ersin Emre Ören Biyomedikal Mühendisliği Bölümü Malzeme Bilimi ve Nanoteknoloji Mühendisliği Bölümü TOBB Ekonomi ve Teknoloji Üniversitesi Ankara
SAKARYA ÜNİVERSİTESİ SAKARYA MESLEK YÜKSEKOKULU
 TERMODİNAMİK Öğr. Gör. SAKARYA ÜNİVERSİTESİ SAKARYA MESLEK YÜKSEKOKULU TERMODİNAMİĞİN BİLİM OLARAK YERİ VE TEMEL KAVRAMLARI, TARİF EDİLEN SİSTEMLERİ VE BUNLARA AİT TEMEL ÖZELLİKLER. TERMODİNAMİĞİN TANIMI
TERMODİNAMİK Öğr. Gör. SAKARYA ÜNİVERSİTESİ SAKARYA MESLEK YÜKSEKOKULU TERMODİNAMİĞİN BİLİM OLARAK YERİ VE TEMEL KAVRAMLARI, TARİF EDİLEN SİSTEMLERİ VE BUNLARA AİT TEMEL ÖZELLİKLER. TERMODİNAMİĞİN TANIMI
ISI VE SICAKLIK. 1 cal = 4,18 j
 ISI VE SICAKLIK ISI Isı ve sıcaklık farklı şeylerdir. Bir maddeyi oluşturan bütün taneciklerin sahip olduğu kinetik enerjilerin toplamına ISI denir. Isı bir enerji türüdür. Isı birimleri joule ( j ) ve
ISI VE SICAKLIK ISI Isı ve sıcaklık farklı şeylerdir. Bir maddeyi oluşturan bütün taneciklerin sahip olduğu kinetik enerjilerin toplamına ISI denir. Isı bir enerji türüdür. Isı birimleri joule ( j ) ve
Paslanmaz Çelik Gövde. Yalıtım Sargısı. Katalizör Yüzey Tabakası. Egzoz Emisyonları: Su Karbondioksit Azot
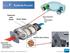 Paslanmaz Çelik Gövde Yalıtım Sargısı Egzoz Emisyonları: Su Karbondioksit Azot Katalizör Yüzey Tabakası Egzoz Gazları: Hidrokarbonlar Karbon Monoksit Azot Oksitleri Bu bölüme kadar, açıkça ifade edilmese
Paslanmaz Çelik Gövde Yalıtım Sargısı Egzoz Emisyonları: Su Karbondioksit Azot Katalizör Yüzey Tabakası Egzoz Gazları: Hidrokarbonlar Karbon Monoksit Azot Oksitleri Bu bölüme kadar, açıkça ifade edilmese
MMT444 Malzemelerde Simülasyon Termodinamik ve Kinetik
 K O C A E L İ ÜNİVERSİTESİ Metalurji ve Malzeme Mühendisliği Bölümü MMT444 Malzemelerde Simülasyon Termodinamik ve Kinetik 4 Termodinamik modelleme: ThermoCalc Doç. Dr. Ersoy Erişir 2015-2016 Bahar Yarıyılı
K O C A E L İ ÜNİVERSİTESİ Metalurji ve Malzeme Mühendisliği Bölümü MMT444 Malzemelerde Simülasyon Termodinamik ve Kinetik 4 Termodinamik modelleme: ThermoCalc Doç. Dr. Ersoy Erişir 2015-2016 Bahar Yarıyılı
Malzeme Bilgisi Prof. Dr. Akgün ALSARAN. Mekanizma ve etkileyen faktörler Difüzyon
 Malzeme Bilgisi Prof. Dr. Akgün ALSARAN Mekanizma ve etkileyen faktörler Difüzyon İçerik Difüzyon nedir Difüzyon mekanizmaları Difüzyon eşitlikleri Difüzyonu etkileyen faktörler 2 Difüzyon nedir Katı içerisindeki
Malzeme Bilgisi Prof. Dr. Akgün ALSARAN Mekanizma ve etkileyen faktörler Difüzyon İçerik Difüzyon nedir Difüzyon mekanizmaları Difüzyon eşitlikleri Difüzyonu etkileyen faktörler 2 Difüzyon nedir Katı içerisindeki
ATOM HAREKETLERİ ve ATOMSAL YAYINIM
 ATOM HAREKETLERİ ve ATOMSAL YAYINIM 1. Giriş Malzemelerde üretim ve uygulama sırasında görülen katılaşma, çökelme, yeniden kristalleşme, tane büyümesi gibi olaylar ile kaynak, lehim, sementasyon gibi işlemler
ATOM HAREKETLERİ ve ATOMSAL YAYINIM 1. Giriş Malzemelerde üretim ve uygulama sırasında görülen katılaşma, çökelme, yeniden kristalleşme, tane büyümesi gibi olaylar ile kaynak, lehim, sementasyon gibi işlemler
Çözeltiler. MÜHENDİSLİK KİMYASI DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN. Yrd. Doç. Dr. Atilla EVCİN Afyonkarahisar Kocatepe Üniversitesi 2006
 Çözeltiler Çözelti, iki veya daha fazla maddenin homojen bir karışımı olup, en az iki bileşenden oluşur. Bileşenlerden biri çözücü, diğeri ise çözünendir. MÜHENDİSLİK KİMYASI DERS NOTLARI Yrd. Doç. Dr.
Çözeltiler Çözelti, iki veya daha fazla maddenin homojen bir karışımı olup, en az iki bileşenden oluşur. Bileşenlerden biri çözücü, diğeri ise çözünendir. MÜHENDİSLİK KİMYASI DERS NOTLARI Yrd. Doç. Dr.
Fiziksel ve Kimyasal Değişmeler
 Fiziksel ve Kimyasal Değişmeler MADDEDEKİ DEĞİŞMELER: 1. Fiziksel Değişme (Olay): Maddenin dış yapısını (renk, tat, koku, saydamlık, iletkenlik, çözünürlük ) ilgilendiren özelliklerine fiziksel özellikler
Fiziksel ve Kimyasal Değişmeler MADDEDEKİ DEĞİŞMELER: 1. Fiziksel Değişme (Olay): Maddenin dış yapısını (renk, tat, koku, saydamlık, iletkenlik, çözünürlük ) ilgilendiren özelliklerine fiziksel özellikler
