T.C. YILDIZ TEKNİK ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ
|
|
|
- Aysun Taş
- 6 yıl önce
- İzleme sayısı:
Transkript
1 T.C. YILDIZ TEKNİK ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ VİSSERAL LEİSHMANİASİS ETMENİ LEİSHMANİA İNFANTUM ANTİJENİNE KARŞI HİBRİDOMA TEKNİĞİ İLE MONOKLONAL ANTİKOR ELDE EDİLMESİ SERKAN YAMAN YÜKSEK LİSANS TEZİ BİYOMÜHENDİSLİK ANABİLİM DALI DANIŞMAN YRD. DOÇ. DR. MELAHAT BAĞIROVA İSTANBUL 2012
2 T.C. YILDIZ TEKNİK ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ VİSSERAL LEİSHMANİASİS ETMENİ LEİSHMANİA İNFANTUM ANTİJENİNE KARŞI HİBRİDOMA TEKNİĞİ İLE MONOKLONAL ANTİKOR ELDE EDİLMESİ Serkan YAMAN tarafından hazırlanan tez çalışması tarihinde aşağıdaki jüri tarafından Yıldız Teknik Üniversitesi Fen Bilimleri Enstitüsü Biyomühendislik Anabilim Dalı nda YÜKSEK LİSANS TEZİ olarak kabul edilmiştir. Tez Danışmanı Yrd. Doç. Dr. Melahat BAĞIROVA Yıldız Teknik Üniversitesi Jüri Üyeleri Yrd. Doç. Dr. Melahat BAĞIROVA Yıldız Teknik Üniversitesi Prof. Dr. Adil M. ALLAHVERDİYEV Yıldız Teknik Üniversitesi Prof. Dr. Murat HÖKELEK İstanbul Üniversitesi
3 ÖNSÖZ Visseral leishmaniasis etmeni Leishmania infantum hücre yüzey antijenine karşı hibridoma tekniği ile monoklonal antikor elde edilmesi konu başlıklı yüksek lisans tez yolculuğum süresince engin bilgi ve deneyimi ile bu yolda ilerlememde yardımcı olan çok değerli danışman hocam Yrd. Doç. Dr. Melahat BAĞIROVA ya sonsuz saygı ve şükranlarımı sunarım. Bilgi, tecrübe ve çalışma aşkı ile çalışmalarımın ve bilimsel altyapımın sağlamlaşmasında destek olan değerli hocam Sayın Prof. Dr. Adil ALLAHVERDİYEV e Bu çalışmanın yerine getirilmesine imkan sağlayan Kimya-Metalurji Fakültesi Dekanlığına, Fen Bilimleri Enstitüsüne, Biyomühendislik Bölümü Başkanı Sayın Prof. Dr. İbrahim IŞILDAK a ve bölümümüzün değerli öğretim üyeleri ile asistanlarına Hücre temini konusundaki nazik yardımları için Ege Üniversitesi Biyomühendislik Bölümü Öğretim Üyesi Sayın Prof. Dr. S. İsmet Deliloğlu GÜRHAN a ve Arş. Gör. Mehmet Özgün ÖZEN e Deneysel çalışmam boyunca benden yardımlarını esirgemeyen ve desteklerini unutamayacağım doktora öğrencileri Rabia ÇAKIR KOÇ, Serhat ELÇİÇEK, Arş. Gör. Emrah Şefik ABAMOR, Arş. Gör. Murat TOPUZOĞULLARI, Olga Nehir ÖZTEL, Dr. Sezen CANIM ATEŞ, Serap YEŞİLKIR BAYDAR ile Yüksek Lisans öğrencisi Gökçe ÜNAL a Akademik hayatımın başlaması, devam etmesi ve olgunlaşmasında maddi, manevi her türlü desteği veren İLİM YAYMA VAKFI AİLESİ nin çok değerli mensuplarına ve İLİM YAYMA EĞİTİM MERKEZİ ne, Ayrıca öğrenim hayatım boyunca her türlü zorluğa rağmen hiçbir desteği benden esirgemeden bugünlere gelmeme vesile olan sevgili annem Fatma YAMAN, sevgili babam İsmail YAMAN ve sevgili anneannem Ayşe ORHAN a, çalışkanlık, disiplin, özgüven ve vazgeçmemeyi öğrenerek örnek aldığım sevgili abilerim Kemalettin YAMAN ile Cihat YAMAN a ve hayatım boyunca her türlü desteğiyle yanımda olan sevgili kardeşim Seval YAMAN a bütün içtenliğimle teşekkürü bir borç bilirim. Mayıs, 2012 Serkan YAMAN
4 İÇİNDEKİLER Sayfa SİMGE LİSTESİ... viii KISALTMA LİSTESİ... ix ŞEKİL LİSTESİ... xii ÇİZELGE LİSTESİ... xiii ÖZET... xiv ABSTRACT... xvi BÖLÜM 1 GİRİŞ Literatür Özeti Tezin Amacı Hipotez... 4 BÖLÜM 2 GENEL BİLGİLER Leishmaniasis Leishmania Parazitlerinin Hayat Döngüsü Promastigot Form Amastigot Form Leishmaniasis Hastalığının Formları Kütanöz Leishmaniasis Mukokütanöz Leishmaniasis Visseral Leishmaniasis Visseral Leishmaniasis etkeni L. infantum un Özellikleri Visseral Leishmaniasisin Epidemiyolojisi Hastalığın Tedavisi ve Kliniği iv
5 2.7.1 İmmün Sistem Adaptif İmmünite Antikorlar (İmmünoglobulinler) Antikorların Yapısı Antikor İzotipleri ve Fonksiyonları İmmün Sistemin Leishmaniasisdeki Rolü ve Leishmaniasise Karşı İmmün Cevap Leishmaniasis in Laboratuvar Tanısında Kullanılan Yöntemler Mikroskobik Tanı Yöntemleri Kültür Yöntemleri Moleküler Yöntemler Serolojik Yöntemler Monoklonal Antikor Teknolojisi Monoklonal Antikorların Poliklonal Antikorlar ile Kıyaslanması Hibridoma Teknolojisi İmmünizasyon İçin Seçilen Hayvanların Özellikleri Füzyon Çalışmalarında Kullanılacak Hücrelerin Özellikleri Füzyon Çalışmaları Sonrası Hibrid Hücrelerin Seçilmesi Monoklonal Antikorların Uygulama Alanları Leismaniasisin Tanısında Monoklonal Antikorların Önemi Antikor Saptanması Antijen Saptanması BÖLÜM 3 DENEYSEL ÇALIŞMALAR MATERYAL Ekipman Kimyasallar Deneylerde Kullanılan Tampon, Kültür Ortamları ve Kimyasalların Hazırlanışı Tamponlar Besiyerleri Deneylerde Kullanılan Deney Hayvanları Deneylerde Kullanılan Hücreler METOT L. infantum (MONI/EP126) Suşunun Kriyobanktan Çıkarılması L. infantum (MONI/EP126) Promastigot Kültürünün Yapılması v
6 3.2.3 Parazitlerin Thoma Lamında Sayımı P3-X63-Ag8.653 Myeloma Hücrelerinin Kriyobanktan Çıkarılması P3-X63-Ag8.653 Myeloma Hücrelerinin Kültürünün Yapılması P3-X63-Ag8.653 Myeloma Hücrelerinin Aminopterin Hassasiyetlerinin Sağlanması Füzyon Sonrası Besleyici Hücrelerin Hazırlanması Fare Periton Makrofajlarının Besleyici Hücre Olarak Elde Edilmesi Besleyici Besiyeri Hazırlanması Amaçlı J774 Makrofaj Hücre Kültürünün Elde Edilmesi J774 Makrofaj Hücre Kültüründen Destekleyici Besiyerlerinin Toplanması Parazitlerden Antijen Elde Edilmesi ve Miktarının Belirlenmesi Fare Deneyleri Balb/c Farelerin L. infantum Tüm Parazitleri ile İmmünizasyonu İndirekt ELISA Testi ile İmmünizasyon, Çapraz Reaksiyon ve Pozitif Kuyuların Kontrolü Füzyon Deneyleri İmmünize Olmuş Fareden Dalak Hücrelerinin Eldesi Tripan Mavisi ile Hücrelerin (Myeloma, Peritonel Makrofaj, J774 Makrofaj ve İmmün Dalak Hücreleri) Sayımı ve Canlılık Tayini İmmun Dalak Hücrelerinin Myeloma Hücreleri ile Füzyonu Hücre Füzyonu Füzyon Yapılan Hücrelerin Ekimi ve Kültürü Sınırlayıcı Sulandırma Yöntemi ile Hibridoma Hücre Hatlarının Alt Klonlarına Ayrılması Hibridoma Hücre Hatlarının Dondurulması ve Geri Kazanımı Hibridoma Hücre Hatlarının Dondurulması Hibridoma Hücre Hatlarının Kriyobanktan Çıkarılması Üretilen Antikorların Western Blot Yöntemiyle Antijen Spesifikliğinin Belirlenmesi SDS-Page Jel Elektroforezi Western Blotlama Antikor İzotiplerinin Belirlenmesi Monoklonal Antikorların Saflaştırılması Amonyum Sülfat Çöktürmesi Protein G İmmün Afinite Kolon Kromatografisi vi
7 BÖLÜM 4 DENEYSEL SONUÇLAR BÖLÜM İmmünizasyon Kontrolleri Birinci Füzyon Çalışmaları İçin İmmünize Edilen Farelerin Antikor Yanıtları İkinci Füzyon Çalışmaları İçin İmmünize Edilen Farelerin Antikor Yanıtları Füzyon Sonuçları Birinci Füzyon Sonuçları İkinci Füzyon Sonuçları Çapraz Reaksiyon Sonuçları Western Blot Sonuçları Monoklonal Antikorların Saflaştırılması SONUÇ ve ÖNERİLER KAYNAKLAR EK- A ETİK KURUL TUTANAĞI ÖZGEÇMİŞ vii
8 SİMGE LİSTESİ A 260 A 280 B 6 Balb/c bp cc cm cm 2 Da J774 kda M Mb Mg ml mm mm nm Sb α β γ δ ε κ µ Mü µg Mikrogram µl Mikrolitre µm Mikrometre C Santigrat Derece 260 nm dalga boyunda alınan absorbans değeri 280 nm dalga boyunda alınan absorbans değeri Tirozinaz gen mutasyonlu albino deney faresi Albino laboratuvar soy deney faresi (Albino laboratory bred mouse strain) Baz çifti Santimetre küp Santimetre Santimetre kare Dalton Fare tümör monosit hücre hattı Kilo Dalton Molar Megabaz Miligram Mililitre Milimetre Milimolar Nanometre Antimon Alfa Beta Gama Delta Epsilon Kappa viii
9 KISALTMA LİSTESİ AIDS AMP Anti-HER2/neu AP APRT APS BSA C bölgesi CD4 + CD8+ CFA C H1 C L CO 2 COOH DAT Dk DMSO DNA dtmp dump EDTA ELISA Fab Fc FACS FBS GMP GMP Gp63 H zinciri H 2 O HAT HCl HEPES HGPRT Edinilmiş Bağışıklık Eksikliği Sendromu (Acquired Immunodeficiency Syndrome) Adenozin Monofosfat İnsan meme kanseri hücre yüzey antijenine karşı üretilmiş antikor Alkalin Fosfataz Adenin Fosforibozil Transferaz Amonyum per sülfat Sığır Serum Albumin (Bovine Serum Albümine) Antikor yapısında değişmez Constant bölge CD4 hücre yüzey antijeni bulunduran lenfosit CD8 hücre yüzey antijeni bulunduran lenfosit Complete Freund s Adjuvan Antikor yapısında Ağır zincirdeki değişmez bölgenin 1. kıvrımı Antikor yapısında hafif zincirdeki değişmez bölge Karbondioksit Karboksilik asit Direk Aglütinasyon Testi Dakika Dimetil sülfoksit Deoksiribonükleik asit Deoksitimidin monofosfat Deoksiüridin monofosfat Etilen Diamin Tetra Asetik asit Enzim Bağlı İmmunosorbent Test (Enzyme Linked Immunosorbent Assay) Fragment antigen binding (antijen bağlayan bölge) Fragment crystallizable (kristalize olabilen bölge) Floresan Aktive Hücre Ayırımı (Fluorescence-activated cell sorting) Sığır Fetal Serum (Fetal Bovine Serum) İyi Üretim Uygulamaları (Good Manufacturing Practice) Guanozin monofosfat Leishmania yüzey membran metaloproteazı Antikor yapısında ağır heavy zincir Su Hipoksantin, Aminopterin, Timidin Hidroksi klorik asit 4-(2-hidroksietil)-1-piperazinetansülfonik asit Hipoksantin-Guanin Fosforibozil Transferaz ix
10 HGPRT - Hipoksantin-Guanin Fosforibozil Transferaz mutant HGPRT + Hipoksantin-Guanin Fosforibozil Transferaz normal HT Hipoksantin Timidin ICT İmmünokromatografik test (Immunocromatografic Test) IFAT İmmunofloresan antikor testi (Immunofluorescent Antibody Test) IFN-γ İnterferon gama IgA İmmünoglobulin A IgD İmmünoglobulin D IgE İmmünoglobulin E IgG İmmünoglobulin G IgM İmmünoglobulin M IHA İndirekt Hemaglutinasyon Testi (Indirect Hemagglutination Test) IL-10 İnterlökin 10 IL-12 İnterlökin 12 IL-13 İnterlökin 13 IL-4 İnterlökin 4 IL-5 İnterlökin 5 IMP İnozin monofosfat K 2 HPO 4 Potasyum fosfat (di) KATEX Yeni Latex Aglütinasyon Testi (New Latex Agglutination Test) KCl Potasyum klorür kdna Kinetoplasta ait deoksiribonükleik asit KH 2 PO 4 Potasyum fosfat (mono) KL Kütanöz Leishmaniasis KOH Potasyum hidroksit L zinciri Antikor yapısında hafif light zincir L.inf 15kDa ag Leishmania infantum 15 kda antijen LAT Lateks Aglütinasyon Testi (Latex Agglutination Test) LPG Lipofosfoglikan MACS Manyetik Aktive Hücre Ayırımı (Magnetic Activated Cell Sorting) MgCl 2 Magnezyum klorür MHC Major Histocompatibility Complex MKL Mukokütönöz leishmaniasis MKY Mikro kültür yöntemi mrna Mesajcı Ribonükleik Asit MW Moleküler Ağırlık (Molecular Weight) Na 2 HPO 4 Disodyum fosfat NaCl Sodyum klorür NaH 2 PO 4 Monosodyum fosfat NaHCO 3 Sodyum bikarbonat NaN 3 Sodyum azid NFB Nükleer faktör B NH 2 Amin (NH 4 )2SO 4 Amonyum sülfat NK Doğal öldürücü hücreler (Natural Killer cells) NO Azot monoksit (Nitrik Oksit) OD Optik Yoğunluk (Optical Density) PBS Fosfat Tampon Solüsyonu (Phosphate buffered saline) PZR Polimeraz Zincir Reaksiyonu (Polymerase Chain Reaction) PEG Polietilen Glikol x
11 PET Pozitron Emisyon Tomografisi (Positron Emission Tomography) ph Potansiyel hidrojen PNNP Para-Nitrofenilfosfat PVDF Poliviniliden florid (Polyvinylidene fluoride) RFLP Kesilmiş parça uzunluğu polimorfizmi (Restriction fragment Length Polymorphism) RIA Radyo İmmün Testi (Radio Immune Assay) Rk39 Leishmania LcKin proteini 39 aminoasit tekrar bölgesi) RNA Ribonükleik asit RPM Bir dakikadaki devir sayısı (Revolutions per minute) RPMI-1640 Roswell Park Memorial Institute-1640 SDS Sodium Dödesil Sülfat SDS-PAGE Sodium dödesil sülfat poliakrilamid jel elektroforezi SPECT Tek Foton Emisyon Bilgisayarlı Tomografi (Single Photon Emission Computerized Tomography) TEMED Tetrametil etilen diamin TGF-β Transforming growth factor β (transforme büyüme faktörü beta) Th 1 T helper 1 (Yardımcı T hücre yanıtı alt sınıf 1) Th 2 T helper 2 (Yardımcı T hücre yanıtı alt sınıf 2) TK Timidin Kinaz TMP Timidin monofosfat TNF-α Tümör nekroz faktör alfa UMP Üridin monofosfat UV Ultraviyole V bölgesi Antikor yapısında değişken Variable bölge VL Visseral Leishmaniasis WB Western Blotting ZnCl 2 Çinko klorür xi
12 ŞEKİL LİSTESİ Şekil 2.1 Leishmania türlerinin hayat döngüsü.. 6 Şekil 2.2 Leishmania parazitlerinin promastigot ve amastigot formları Şekil 2.3 Eski ve yeni kıtada VL in coğrafik dağılımı.. 11 Şekil 2.4 Türkiye'de leishmaniasis dağılımı Şekil 2.5 Antijenlere karşı B lenfositlerinin gösterdiği birincil ve ikincil yanıtlar 14 Şekil 2.6 İmmünoglobulin G nin 3 boyutlu kurdele modellemesi Şekil 2.7 Hibridoma teknolojisi ile in vitro monoklonal antikor üretim aşamaları. 23 Şekil 2.8 Hibridoma deneylerinde kullanılan BALB/c deney fareleri Şekil 2.9 Nükleotid sentezi için de novo ve kurtarma (salvage) yolakları. 26 Şekil 3.1 MONI/EP126 L. infantum parazitlerinin kültürdeki durumu (20X) Şekil 3.2 Log faz P3-X63-Ag8.653 myeloma hücreleri (20X). 41 Şekil azaguaninden 1 gün sonra hücrelerin durumu(40x) Şekil 3.4 Fare peritonel makrofajların alınması. 42 Şekil 3.5 Log faz J774 fare makrofaj hücreleri (20X) 43 Şekil 3.6 İmmünize Balb/c faresinden alınan dalaktan lenfosit izolasyonu Şekil 3.7 Thoma lamı üzerindeki yivler. 47 Şekil 3.8 Füzyon sonrası hücrelerin kültürdeki durumu (20X).. 49 Şekil gün sonra hücrelerin HAT içeren kültürdeki durumu (20X) 50 Şekil 3.10 Hücrelerin 10 gün sonra kültürdeki durumu (20X) Şekil 3.11 Hibridoma kültürünün büyük ölçekli kültürdeki durumu (20X) Şekil 4.1 İkinci immünizasyon sonrası Balb/c farelerin immün cevap seviyeleri.. 56 Şekil 4.2 Dördüncü immünizasyon sonrası Balb/c farelerin immün cevap seviyeleri 57 Şekil 4.3 Birinci füzyon birinci plaktaki hibridoma hücrelerinin L. infantum antijenine karşı gösterdikleri antikor cevapları 58 Şekil 4.4 Birinci füzyon ikinci plaktaki hibridoma hücrelerinin L. infantum antijenine karşı gösterdikleri antikor cevapları 59 Şekil 4.5 İkinci füzyon birinci plaktaki hibridoma hücrelerinin L. infantum antijenine karşı gösterdikleri antikor cevapları 60 Şekil 4.6 İkinci füzyon ikinci plaktaki hibridoma hücrelerinin L. infantum Şekil 4.7 antijenine karşı gösterdikleri antikor cevapları 61 Genişletilen klonların diğer proteinlerle çapraz reaksiyon testlerinin indirekt ELISA testi ile 405 nm de değerlendirilmesi 62 Şekil 4.8 1C3 Monoklonal antikorunun L. infantum tüm hücre lizat antijenine karşı gösterdiği spesifikliğin western blot analizi ile gösterilmesi 63 Şekil 4.9 1C3 klonunun ürettiği antikorların izotipinin belirlenmesi Şekil 4.10 Kolon sonrası toplanan tüplerin UV spektrofotometrik olarak protein içeriklerinin ölçülmesi. 64 Şekil 4.11 Protein verlığı görülen tüplerin L. infantum parazitlerine karşı antikor spesifikliğinin indirekt ELISA yöntemi ile belirlenmesi.. 64 Sayfa xii
13 ÇİZELGE LİSTESİ Sayfa Çizelge 2.1 Çeşitli klinik formala neden olan Leishmania türleri Çizelge 2.2 L. infantum genom özellikleri Çizelge 3.1 Deney gruplarının immünizasyon tarihleri Çizelge 3.2 SDS-PAGE yöntemi için dökülecek jelerin hazırlanışı Çizelge 4.1 Birinci füzyon sonuçları (*1C2; 1. plak, C-2. kuyu) Çizelge 4.2 İkinci füzyon sonuçları(*1c3; 1. plak, C-3. kuyu, 2B2; 2. plak, B-2. kuyu) xiii
14 ÖZET VİSSERAL LEİSHMANİASİS ETMENİ LEİSHMANİA İNFANTUM ANTİJENİNE KARŞI HİBRİDOMA TEKNİĞİ İLE MONOKLONAL ANTİKOR ELDE EDİLMESİ Serkan YAMAN Biyomühendislik Anabilim Dalı Yüksek Lisans Tezi Tez Danışmanı: Yard. Doç. Dr. Melahat BAĞIROVA Leishmaniasis, enfekte kum sineklerinin (Phlebotomus) kan emme esnasında memeli konaklara bulaştırdıkları hücre içi Leishmania protozoonlarının oluşturduğu bir hastalık grubudur. Hastalığın Visseral (VL), Kütanöz (KL) ve Mukokütanöz (MKL) olmak üzere 3 klinik formu mevcuttur. Dünyada her yıl 1,0-1,5 milyon kişi KL e, kişi ise VL e yakalanmaktadır. Ayrıca son yıllarda hastalığın etkenlerinde kullanılan antileishmanial ilaçlara, vektörlerinde ise insektisitlere karşı dirençliliğin gelişmesi ve küresel ısınmanın dünya üzerindeki etkisini arttırması nedeniyle hastalığın dünyada giderek yayılması beklenmektedir. Leishmaniasis aynı zamanda Türkiye nin de ciddi halk sağlığı problemlerinden biri olup Ege, Akdeniz, Orta Anadolu ve Güneydoğu Anadolu bölgelerinde görülmektedir. Hastalığın visseral formu tedavi edilmediğinde ölüme neden olmaktadır. Hastalığın tanısında çeşitli yöntemler (mikroskobik, kültür, moleküler ve serolojik) kullanılmaktadır. Bu yöntemler içerisinde parazite özel antijenleri hedefleyen monoklonal antikorların temel alındığı serolojik teknikler, yüksek duyarlılıkları ve spesifiklikleri ile leishmaniasis tanısının koyulabilmesi adına büyük bir avantaj sağlamaktadır. Ancak leishmaniasis in tanısında kullanılmak üzere geliştirilen serolojik tanı kitleri genellikle yurt dışından ithal edilmekte ve bu da ülke ekonomisine fazladan bir külfet oluşturmaktadır. Ülkemizde ise konu ile ilgili yeterince çalışma bulunmamaktadır. Şu ana kadar yapılan tek çalışmada KL e (Leishmania tropica) karşı monoklonal antikor geliştirme çalışması yapılmıştır. Ancak literatürden de bilindiği gibi KL için serolojik yöntemlerin duyarlılığı yüksek değildir. Diğer yandan ülkemizde, erken teşhisine daha çok ihtiyaç duyulan ve zamanında tanısı konulup tedavi edilmediğinde ölümcül olduğu bilinen VL e karşı monoklonal antikor geliştirilmesine yönelik ülkemizde yapılan hiçbir çalışma bulunmamaktadır. Ayrıca hibridoma teknolojisinde kullanılan sürecin tamamen in vitro hale getirilmesinde sorunların yaşandığı da bilinmektedir. Buna göre de bu tez çalışmasının amacı; ilk kez olarak ülkemizde VL nin tanısında kullanılan L. infantum antijenlerine karşı xiv
15 monoklonal antikorun üretilmesi ve L. infantum antijenlerine karşı monoklonal antikorun üretilmesi için hibridoma teknolojisinde kullanılan sürecin in vitro hale getirilmesi ile mevcut yöntemin optimize edilmesi olmuştur. Tez çalışması kapsamında, Hücre Kültürü ve Doku Mühendisliği Laboratuvarı nda hücre kültürü, ELISA, western blot, hibridoma, saflaştırma tekniklerine dayalı çeşitli yöntemler kullanıldı. Deneylerde L. infantum tüm parazit antijenleri 6-8 haftalık BALB/c farelere Freund adjuvanı ile birlikte enjekte edildi. Yüksek antikor yanıtı veren fareler ile füzyon çalışmaları gerçekleştirildi. Füzyon deneylerinde immünize farelerden izole edilen ve B lenfosit kaynağı olan dalak hücreleri, fare myeloma hücreleri (P3-X63- Ag8.653) ile polietilen glikol (MW 4000) varlığında birleştirildi. Füzyon sonrası hibridoma hücrelerinin gelişimini desteklemek amacıyla fare periton makrofajlarının yanı sıra, J774 fare monosit makrofaj hücre hattı metaboliti de kullanıldı. Deney sonuçlarına göre, incelenen 456 kuyunun 233 unda hibridoma hücrelerinin oluştuğu tespit edildi. ELISA testi ile incelenen 233 kuyunun 46 sında pozitiflik görüldü. Çapraz reaksiyon testlerinde en yüksek absorbans alınan 3 kuyunun kültürü büyük çapta üretildi. Sınırlayıcı sulandırımlar sonucu elde edilen 1C3 kuyusundaki hibridoma hücre hattının ürettiği monoklonal antikorlar western blot yöntemi ile 15kDa ağırlığında olan L. infantum antijenine karşı spesifik olduğu saptandı. Çalışmanın son aşamasında elde edilen süpernatant dializ ve protein G afinite kromatografi yöntemleri ile saflaştırıldı ve böylece L. infantumun 15 kda antijenine karşı spesifik olan monoklonal antikor elde edildi. Sonuç olarak bu çalışmada, ilk kez olarak ülkemizde L. infantum a karşı monoklonal antikor üreten hücre hattı elde edildi ve kriyoprezervasyonu gerçekleştirilerek kriyobankı oluşturuldu. Ayrıca leishmaniasise karşı hibridoma teknolojisinde kullanılan sürecin in vitro hale getirilmesi için ilk kez olarak fare periton makrofajları yerine J774 metabolitlerinin kullanılmasının uygun olabileceği gösterildi ve hibridoma teknolojisinde kullanılan sürecin tamamen in vitro hale getirilmesi amacıyla mevcut yöntem optimize edildi. Bu tez kapsamında elde edilen sonuçlar, ülkemizin ciddi halk sağlığı problemlerinden birisi olan VL nin tanısında monoklonal antikorlara dayalı yerli tanı kitlerinin geliştirilmesine yol açacaktır. Ayrıca bu hastalığa karşı üretilen monoklonal antikorların ileride farklı enzimatik, kemilüminesan ve manyetik ajanlarla konjuge edilmesi sonucunda çeşitli tanı sistemlerinde (Western Blot (WB), Enzim bağlı immunosorbent test (ELISA), İndirekt floresan Antikor testi (IFAT),İmmünokromatografik test (ICT) gibi) kullanılabileceğini göstermesi açısından oldukça önemli olacağı düşünülmektedir. Anahtar Kelimeler: Hibridoma teknolojisi, Leismaniasis, Leishmania 15kDa promastigot antijeni, Monoklonal antikor, Tanı kitleri YILDIZ TEKNİK ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ xv
16 ABSTRACT MONOCLONAL ANTIBODY PRODUCTION WITH HYBRIDOMA TECHNIQUE AGAINST THE ANTIGEN OF LEISHMANIA INFANTUM, CAUSATIVE AGENT OF VISCERAL LEİSHMANİASİS Serkan YAMAN Department of Bioengineering MSc. Thesis Advisor: Assist. Prof. Melahat BAĞIROVA Leishmaniasis is a parasitic disease which is transmitted to mammalian hosts by the bites of sand flies (phlebotomus) with infected intracellular Leishmania protozoon during bloodsucking. Different Leishmania species cause to the various important forms of the disease such as; visceral (VL), cutaneous (CL) and mucocutaneous (MCL) leishmaniasis depending on the parasite types and the host factors. In every year 1-1,5 million people suffer from Cutaneous Leishmaniasis (CL) and people from visceral leishmaniasis (VL) all around the world. Furthermore impact area of the disease is expected to extend over the world as a result of developing resistance to antileishmanial drugs in parasites and to insecticides in vectors, also by virtue of global warming. Therewithal leishmaniasis is one of the serious public health problems that occurs prevalently in Aegean, Mediterranean, Middle Anatolian and Southeast Anatolian regions of Turkey. Untreated VL form of the disease ends up with deaths. A variety of techniques (microscopic, culture, molecular and serological) are used in the diagnosis of the disease. Among these techniques, monoclonal antibody based serological techniques provide a great advantage with high sensitivity and specificity for diagnosis that is special to the parasite antigens. However, diagnostic kits used in the diagnosis of leishmaniasis are generally imported products and make a great expense to the economy of the country. The studies about the issue to overcome these kinds of problems are inadequate in our country. Up to now, only one medical specialization thesis has been completed about this issue and in that study monoclonal antibody has been produced against Leishmania tropica which is a factor of Cutaneous Leishmaniasis. However as it is known in literature serological techniques are not sensitive techniques for diagnosis of CL. On the other hand, in our country there is no study about development of monoclonal antibody against VL which is known as fatal if doesn t diagnose in time and to be treated. Furthermore, it is known that there are some problems in hybridoma techniques for providing in vitro whole processes. xvi
17 According to this, the aim of this thesis study as a first time in our country is to produce monoclonal antibody against L. infantum antigen which was used in the diagnosis of VL and to optimize the present method by optimizing the hybridoma technology process into in vitro stage. Within the scope of the thesis, in Cell Culture and Tissue Engineering Laboratory, cell culture, ELISA, western blot, hybridoma and purification techniques were used. In the experiments; L. infantum whole parasite antigens were injected to 6-8 week old BalB/c mice with adjuvant. Then the fusion studies were started with the mice which gave response of high antibody. In the fusion experiments the spleen cells which are the source of B lymphocyte were fused with the mouse myeloma cells (P3-X63-Ag8.653) in the existence of polyethylene glycol (MV 4000). After the fusion, in order to support hybridoma cells besides mouse peritoneal macrophages, J774 mouse monocyte-macrophage cell line metabolite was also used. According to the experimental results, it was detected that hybridoma cells were formed in examined 233 of 456 wells. It was seen that the 46 of 233 wells were positive according to ELISA test. The culture of three wells which showed the highest absorbance in cross-reaction tests, was largely produced. The monoclonal antibodies, the products of 1C3 hybridoma cell line which was obtained as a result of limiting dilutions. It was detected that the antibodies which were examined with western blot method, are specific to the L. infantum antigen which weights 15kda. At the end-stage of the study, supernatant which are obtained from culture were purified with dialysis and protein G affinity chromatography methods, so the monoclonal antibody which is specific to 15 kda antigen of L. infantum was obtained. As a result of this study for the first time in Turkey monoclonal antibody producing hybridoma cell line have been obtained against L. infantum and cryopreserved in cryobank. Additionally, in order to render whole in vitro processes of hybridoma technology, hybridomas were firstly supported with J774 macrophages cell line metabolites and in vitro current processes of hybridoma technique was optimized. Furthermore we showed that J774 metabolites provide the appropriate supporting environment. Obtained results within this thesis can lead to development of diagnostic kits to VL that is one of the important public health problems of Turkey. Furthermore the obtained monoclonal antibodies in this study is important in terms of showing that they can be also used in various diagnosis systems (such as; Western blot (WB), Enzyme Linked Immune Sorbent Assay (ELISA), Immune Fluorescein Assay (IFAT)and Immuno chromatographic test ICT)) by conjugating with enzymatic, chemiluminescence and magnetic agents. Key words: Hybridoma technology, Leishmaniasis, Leishmania 15 kda promastigot antigen, Monoclonal antibody, Diagnostic kits YILDIZ TECHNICAL UNIVERSITY GRADUATE SCHOOL OF NATURAL AND APPLIED SCIENCES xvii
18 BÖLÜM 1 GİRİŞ 1.1 Literatür Özeti Leishmaniasis, zorunlu hücre içi Leishmania parazitleri ile enfekte kum sineklerinin (Phlebotomus) kan emerken memelilere bulaştırdıkları protozoon bir hastalıktır. Leishmaniasisin tedavisinde ve kontrolünde yaşanan zorluklar nedeniyle ortalama yıllık ölüm vakası ile parazitik hastalıklar arasında malarya dan sonra ikinci önemli hastalık olarak gelmekte; ayrıca dünyada 12 milyon kişinin leishmaniasis ile enfekte olduğu ve her yıl 2 milyon yeni olgunun (1.5 milyon KL, VL) eklendiği tahmin edilmektedir [1], [2], [3], [4]. Küresel ısınmaya bağlı olarak da hastalığın endemik alanının giderek genişlemesi beklenmektedir. Leishmaniasis ülkemizin de içinde bulunduğu Akdeniz bölgesi ile birlikte dünyada 5 kıtada görülmekte; özellikle tropikal ve sub-tropikal bölgelerde endemik seyretmektedir [5]. Akdeniz bölgesinde L. major, L. tropica ve L. infantum olmak üzere üç Leishmania türüne rastlanılırken [6], ülkemizde en sık karşılaşılan türler L. infantum ve L. tropica dır [7]. VL in görüldüğü Ege ve Akdeniz kıyılarında L. infantum, KL in görüldüğü Güney ve Güneydoğu kesimlerinde ise L. tropica hastalığın etkeni olarak karşımıza çıkmaktadır. Son zamanlarda ise Akdeniz bölgesinin doğu kesimlerinde KL etkeni olarak yine L. infantum görüldüğüne dair çalışmalar mevcuttur [8]. Ülkemizde endemik alanlarda yaklaşık 20 milyon insan leishmaniasis enfeksiyonu riski altında yaşamaktadır. Uzun yıllardan beri leishmaniasis e karşı mücadele yapılmasına rağmen, hastalığın halen giderek yayılmasının esas nedeni; hastalığı taşıyan vektörlerde kullanılan insektisitlere, hastalığın etkenlerinde ise kullanılan ilaçlara karşı dirençliliğin gelişmesidir. AIDS ve diğer immün yetmezliklerin artması, seyahatler, savaşlar ve laboratuvar tanısındaki problemler de hastalığın yayılmasında önemli rol oynamaktadır 1
19 [9]. Bunun yanında VL nin neden olduğu immün yetersizliğe bağlı olarak, hastalarda bakterilerin neden olduğu süper enfeksiyonlar da görülebilmektedir [10]. Ayrıca şimdiye kadar leishmaniasise karşı çeşitli aşı geliştirme çalışmaları yapılmasına rağmen henüz geçerli bir aşı bulunamamıştır [2]. Leishmaniasis in tanı, tedavi ve kontrolü ise parazitik hastalıklar içerisinde zorlukları ile dikkat çekmektedir. Bu sebeplerden dolayı leishmaniasisle mücadele edebilmek için, tanı ve tedavi noktasında, hastalığı doğru ve ayırıcı olarak değerlendirmek esastır [11]. Ülkemizde 2005 yılından itibaren hekimlerin standart vaka tanımına göre tanı koyabildikleri VL hastalarını Sağlık Bakanlığı Bulaşıcı Hastalıklar Birimine bildirmeleri zorunludur [12]. Leishmaniasis in tanısında çeşitli yöntemler kullanılmaktadır. Bu yöntemlerden en yaygın ve uygulanması kolay olanı mikroskobik yöntemlerdir. Ancak mikroskobik yöntemlerde, duyarlılığın, örnekteki parazit sayısına bağlı olması ve deneyimli araştırmacıya gereksinim duyulması yöntemin birer dezavantajı olarak karşımıza çıkmaktadır [13]. Leishmaniasis tanısında kullanılan diğer yöntemlerden biri de klasik kültür yöntemidir. Klasik kültür yönteminin en büyük avantajı parazitin direk olarak gözle görülebilmesidir. Fakat yapılan bazı çalışmalarda, duyarlılığının örnekteki parazit sayısına bağlı olarak azaldığı ve tanı koyulabilmesi için uzun sürelere gereksinim duyulduğu rapor edilmiştir [14], [15]. Bununla birlikte bu yöntem kullanılarak asemptomatik enfeksiyonların tespit edilmesinin de oldukça zor olması önemli dezavantajlardır [16], [17]. Kültür yöntemleri içerisinde son yıllarda dünyanın çeşitli bölgelerinde uygulanan yeni mikro kültür yöntemi ise duyarlılığının örnekteki parazit sayısına bağlı olmaksızın hem KL de hem de VL de bir veya birkaç güne kadar sonuç verebilen bir yöntem olarak göze çarpmaktadır [14], [18], [19], [20], [21]. Hastada parazite ait genom parçalarını saptamaya yönelik moleküler yöntemlerin kullanılması ise moleküler tanı yöntemleri başlığı altında ver almaktadır. VL tanısında kullanılan moleküler yöntemlerden biri restriksiyon parça polimorfizmine dayalı polimeraz zincir reaksiyonudur (PZR-RFLP) [22] Ancak PZR hastada bulunan ölü parazit DNA sından dolayı yanlış pozitif sonuç verebilmekte [23] ve bazı asemptomatik kültür pozitif örneklerde PZR negatif sonuç verebilmektedir [24]. VL tanısında kullanılan enzim-bağlı immünosorbent testi, western blot, rk39 immünkromatografik tanı testi, immünfloresan antikor testi, direk aglütinasyon testi gibi serolojik yöntemler ise bu hastalığa tanı koyulmasında günümüzde en çok geliştirilen ve 2
20 kullanılan yöntemler olmuştur. Bu yöntemlerin büyük avantajı hasta serumunda veya idrarında parazite karşı oluşan antikor veya parazit antijenlerinin belirlenmesine dayanan invaziv olmayan yöntemler olmalarıdır [25], [26]. Serolojik tanı yöntemleri VL tanısında KL e göre daha sık kullanılmaktadır. Bu durum KL olgularında lezyonun lokal etkisinden dolayı antikor yanıtının tanı için yeterince belirleyici düzeylerde olmamasından kaynaklanmakta [27] ve araştırıcıları alternatif değerlendirme sistemleri geliştirmeye yöneltmektedir [28], [29], [30]. 1.2 Tezin Amacı Serolojik yöntemler temel olarak parazitin yüzey antijenlerini hedef alan primer veya sekonder monoklonal antikor temelli olarak geliştirilmekte ve erken teşhis için büyük bir avantaj sağlamaktadır. Fakat çeşitli hastalıkların tanısında kullanılan tanı kitleri ithal olarak temin edildiğinden, ülke ekonomisine olumsuz etki oluşturmaktadır. Bu gibi sorunları aşmak amacıyla konu ile ilgili ülkemizde yapılan çalışmalar da oldukça yetersizdir. Ülkemizde konu ile alakalı sadece bir tıpta uzmanlık tezi tamamlanabilmiş [31] ve bu çalışmada da KL etkeni olan L. tropica ya karşı monoklonal antikor üretilmiştir. Erken teşhisine daha çok ihtiyaç duyulan ve serolojik olarak daha yüksek spesifiteye sahip VL e karşı ise ülkemizde hiçbir çalışma bulunmamaktadır. Dünyada ise diğer tanı sistemlerine karşı monoklonal antikor üretilmesinde yaşanan zorluklarla beraber leishmaniasisin tanısında kullanılmak üzere monoklonal antikor üretilmesi çalışmalarında da çeşitli sorunlar mevcuttur. Böyle ki hali hazırda monoklonal antikor üretiminde kullanımına ihtiyaç duyulan deney hayvanlarının oluşturduğu kontaminasyon riskleri, etik ve ekonomik dezavantajlar nedeni ile monoklonal antikor üretim sürecinin yüksek derecede in vitro hale getirilmesi gibi gereklilikler de bulunmaktadır. Bu gibi ihtiyaçlar doğrultusunda VL nin tanısında kullanılan L. infantum antijenine karşı monoklonal antikorun üretilmesi ve mevcut yöntemin optimize edilmesi, VL enfeksiyon ajanlarının belirlenmesi, tiplendirilmesi ve tedavisi gibi birçok alanı kapsayan geniş bir yelpazede yararlı olabilecektir. Buna göre de bu tez çalışmasının amacı; ilk kez olarak ülkemizde VL nin tanısında kullanılan L. infantum antijenlerine karşı monoklonal antikorun üretilmesi ve L. infantum antijenlerine karşı monoklonal antikorun üretilmesi için hibridoma teknolojisinde kullanılan sürecin kısmen in vitro hale getirilmesi ile mevcut yöntemin optimize edilmesi olmuştur. 3
21 1.3 Hipotez Bu çalışmanın çıktıları üretilen monoklonal antikorların serolojik yöntemler arasında en yaygın şekilde kullanılan enzim bağlı immüno sorbent test (ELISA) sistemlerinde uygulanabilirliğinin ölçülmesi ve spesifikliğin belirlenmesi için gerekli alt yapıyı oluşturacaktır. Buna göre bu çalışma dahilinde hedefe ulaşmak için; Hibridoma çalışmalarında antijen olarak kullanılması amacıyla L. infantum parazitlerinin kültürlerinin elde edilmesi ve kültürlerden antijen izolasyonu, 6-8 haftalık Balb/c farelerin immünizasyonlarının periyodik olarak yapılması ve ELISA yöntemleri ile immünite kontrolllerinin gerçekleştirilmesi, Uygun füzyon hücreleri olan P3-X63-Ag8.653 myeloma hücrelerinin devamlı kültürünün elde edilmesi, İmmün hayvanlardan elde edilen dalak hücrelerinden lenfosit izolasyonu ve myeloma hücreleri ile füzyonlarının gerçekleştirilmesi, Farelerden alınan periton makrofaj hücrelerinin ve J774 fare monosit tümör makrofaj kültür metabolitlerinin hibrid hücrelerinin gelişiminin desteklenmesi amacıyla kullanılması, Füzyon sonrası hücrelerin seçici besiyerlerinde kültürlerinin yapılarak poliklonal hibridoma hücre serilerinin elde edilmesi ve kültür ortamında antikor varlığı tespiti, Leishmania antijenlerine karşı pozitif reaksiyon veren kuyuların büyük ölçekte çoğaltılarak dondurulması ve aynı zamanda kültürü yapılan hibridoma hücrelerinin destekleyici besiyeri içerisinde sınırlayıcı sulandırımları yapılarak tek klon hibrid hücrelerin çoğaltılması ve monoklonal antikor üreten hücre hatlarının elde edilmesi, Monoklonal antikor üreten hücre hatlarının ELISA test sistemleri ile özgünlüğünün kontrol edilmesi ve kültür ortamından saflaştırılması, Üretilen monoklonal antikorların ileride farklı enzimatik, kemilüminesan ve manyetik ajanlarla konjuge edilmesi ile çeşitli tanı sistemlerinde (Western blot, Enzim bağlı immünosorbent test, immünokromatografik test, İndirekt floresan antikor testi gibi) kullanılabileceğinin önerilmesi stratejileri belirlenmiştir. 4
22 BÖLÜM 2 GENEL BİLGİLER 2.1 Leishmaniasis Zorunlu hücre içi Leishmania parazitleri, trypanosomatidae ailesinin kinetoplastida sınıfına ait kan kamçılılarındandır. Leishmaniasis, enfekte dişi kum sinekleri tarafından kan emerken memeli konağa bulaştırılır [32], [33]. Leishmaniasisin konakta gelişebilmesi ve parazitin bulaşması; enfekte ettiği dokulara ulaşabilmesi, enfektivitesi ve konağın bağışıklık sistemi arasındaki kompleks etkileşimlere bağlıdır. Leishmaniasis konakta, klinik belirti vermeyen asemptomatik formdan iç organlarda gelişen ve tedavi edilmediğinde ölümcül olan VL gibi ağır formlara kadar farklı şekillerde seyredebilir [34]. Leishmania türleri hayat döngülerini omurgalı ve omurgasız olmak üzere iki konakta tamamlarlar. Omurgalı konak insan veya diğer memeliler, omurgasız konak ise kum sinekleridir (Phlebotomus). Leishmania parazitleri omurgalılarda amastigot formda, omurgasızlarda ise promastigot formda bulunur. Amastigot form büyük bir nükleusa ve küçük bir kinetoplasta sahip olup hareketsiz ve oval şekillidir. Promastigot form ise mekik biçiminde ve parazitin hareketini sağlayan kamçıya sahiptir. Leishmania nın bilinen türlerinden 12 si insanları enfekte edebilmektedir [35]. Ülkemizde ise L. donovani, L. infantum, L. tropica, L. major türlerinin neden olduğu enfeksiyonlar görülmektedir. Bu türlerden L. donovani ve L. infantum, insanlarda retiküloendotelyal sistem hücrelerine yerleşerek VL e, L. tropica ve L. major türleri ise deride KL e sebep olurlar [36], [37]. 2.2 Leishmania Parazitlerinin Hayat Döngüsü Enfekte bireylerden dişi kum sineklerinin kan emmeleri sırasında kanda bulunan makrofajlar içerisindeki Leishmania parazitlerinin amastigot formları dişi kum sineklerinin midesine geçer [38], [39]. Amastigotların bir kısmı, makrofajlar ile beraber 5
23 sindirilirken, bazı amastigotlar iğsi bir yapı alır ve burada kamçıları da gelişerek enfektif olmayan promastigotlara dönüşürler [34], [40], [41] (Şekil 2.1). Şekil 2.1 Leishmania türlerinin hayat döngüsü [42] Promastigot Form Parazitin enfekte Phlebotomus un bağırsaklarında görülen iğ şeklinde, μm uzunluğa ve 1,5-2,5 μm genişliğe sahip formdur. Promastigotlar hareketli formlar olup bu hareketlerini μm uzunluğunda bir ucundan uzanan kamçıları ile sağlarlar. Promastigotların elektron mikroskobu ile incelendiğinde; ortada nukleus, nukleus içerisinde nukleolus, kinetoplast, fibriler yapı gösteren kamçı, sitoplazmalarında endoplazmik retikulum, golgi aygıtı gibi yapıların varlığı görülmektedir [41], [43], [44] Kum sineklerinin midesine alınan parazitler ilk olarak burada bölünerek çoğalmaya başlarlar. Enfektif olmayan bu forma prosiklik promastigot denilmektedir [45]. Promastigotlar midenin ucuna geldikleri zaman kamçıları ile bağırsak epitel hücrelerinin mikrovilluslarına tutunurlar. Daha sonra promastigotlar [45] buradan göç ederek özofagus ve farinks duvarına tutunurlar. Özofagustan ayrılan promastigotlar günler arasında uzun ve küçük formlar halinde ağıza ulaşmakta ve burada bölünmeden hortuma göç etmektedirler. Enfektif form olan bu promastigotlara ise metasiklik promastigot adı verilmektedir [34], [40], [41]. Metasiklik promastigotlar vektörün ağız kısmına geçerek bir sonraki kan emiliminde memeli konağa girerler [38], [39]. 6
24 Şekil 2.2 Leishmania parazitlerinin promastigot ve amastigot formları [46], [47] Kum sineklerinin memelilerden kan emmeleri sırasında salgıladıkları tükrük salgısı ile birlikte metasiklik promastigotlar konağa verilir. Konağa geçen bu promastigotların bir kısmı konağın immün sistemi tarafından öldürülür. Canlı kalan promastigotlar makrofajlar veya dendritik hücreler tarafından fagosite edilir [44]. Fagosite edilmeleri işleminde hücre yüzeylerinde bol miktarda bulunan lipofosfoglikanlar (LPG) ve makrofajlardaki C3 reseptörlerinin rol oynadığı bilinmektedir. Fagositoz işleminde özellikle promastigot yüzey antijenleri olan gp63 ve LPG nin önemli rol oynadığı bildirilmiştir [48], [49]. Bu şekilde hücrelerin fagozomlarına alınan promastigotlar burada amastigot formuna dönüşürler. Ayrıca retiküloendoteliyal sistem hücrelerini de enfekte edebilen promastigotlar girdikleri hücrelerde çoğalıp hücreleri patlatarak serbest kalırlar [34], [40], [44], [50], [51] Amastigot Form Amastigotlar, lökositler, monositler, makrofajlar veya endotel hücreleri içerisinde bulunan oval şekilde ve genelde 2,5-5 μm çapındadırlar. Amastigotların sitoplazmasında bir nükleus ve kinetoplast bulunmaktadır. Kinetoplast nükleusa ek olarak farklı bir DNA içermektedir. Mitokondri ise bütün Leishmania türlerinde olduğu gibi sitoplazmada yalnızca bir tane bulunur. Amastigotlar da promastigotlara benzer şekilde bir kamçıya sahip olmakla beraber kamçı, kamçı cebi içinde bulunup hücre dışına çıkmamaktadır. Amastigotlar makrofajların asidik fagolizozomlarına dayanıklı olduklarından makrofaj içinde çoğalabilirler [34], [41], [52], [53]. Serbest hale geçen bu amastigotlar yeni makrofajları ve retiküloendoteliyal sistem hücrelerini enfekte ederek çoğalmaya devam ederler [44], [50]. Bu döngü dişi tatarcığın beslenmek için enfekte konağın kanını emmesiyle devam etmekte ve tam bir döngü çevre ısısına bağlı olarak ortalama 4-25 gün sürmektedir [54], [55]. 7
25 2.3 Leishmaniasis Hastalığının Formları Leishmaniasisin klinik formları; iç organlarda görülen VL şeklinde, deride meydana gelen KL şeklinde ve muköz dokularda ortaya çıkan MKL şeklinde olmak üzere 3 tip olarak karşımıza çıkmaktadır [56], [57]. Ülkemizde ise hastalık KL ve VL olmak üzere iki şekilde görülmektedir [32], [58]. Çizelge 2.1 Çeşitli klinik formlara neden olan Leishmania türleri [59] Leishmaniasis Kliniği Visseral Leishmaniasis Kütanöz Leishmaniasis Diffüz Kütanöz Leishmaniasis Mukokütanöz Leishmaniasis Hastalık etkeni L.donovani L. infantum L.chagasi L.tropica L.mexicana L.major L.aethiopica L.amazonensis L.brasiliansisguyanensis L. b. panamensis L.peruviana L. pifanoi L. mexicana L. Brasiliensis(espundia) Kütanöz Leishmaniasis KL; genelde L. tropica ve L. major türlerinin derinin retikuloendoteliyal hücrelerini enfekte etmesi ile oluşan [60], [61], deride papül, nodül ve yara oluşumu ile seyreden bir leishmaniasis formudur [62]. Papüller yaklaşık olarak 2 cm lik çaplarda olup lezyonlar kaşıntılıdır. İlk lezyon parazit memeli konağa girdikten ortalama 2 hafta ile 3 aylık bir süre sonra görülmeye başlar [63]. KL in geniş bir endemi alanı bulunmakta ve ülkemiz de dahil olmak üzere [64] dünyanın yaklaşık 83 ülkesinde endemik olarak görülmektedir [60], [61]. Ülkemizde KL, Güney-doğu bölgesi [65], [66] ve İç anadolu bölgesinde [32], [33], [58] konağın immunolojik durumu ve parazitin virulanslığı ile alakalı olarak pek çok klinik varyant halinde [64], endemik ve epidemik olarak görülmektedir [65], [66]. Ülkemizdeki başlıca KL etmeni L. tropica dır. Ancak L. infantum'un da KL'e neden olduğu son yıllarda yapılan çalışmalarda gösterilmiştir [8], [67]. 8
26 2.3.2 Mukokütanöz Leishmaniasis MKL genelde Güney Amerika da endemik olarak görülen bir hastalık olup etkeni L. braziliensis tir. Bu etken deri ve mukozalarda çoğalarak enfeksiyonlara neden olmaktadır [68]. Hastalığın belirtilerinin görülmesi nazal septumda, yumuşak ve sert damak kısımlarında çaplarının 10 cm ye kadar ulaşabildiği nodül, papül ya da vezikül benzeri lezyonlarının 10 gün ila birkaç ay arasında görülmesi ile gerçekleşir [69], [70]. KL e göre hayati tehlikesi daha yüksek olan ve acil tedavi gerektiren bir formdur [68]. MKL de hastalığın seyri, hastanın immünitesine ve parazitin immünolojisine bağlı olarak değişmekte ve hastaların %1-10 unda enfeksiyon mukozaya kadar ilerlemektedir [71], [72], [73]. Mukozaya ulaşan lezyonlar doku harabiyeti oluşturarak kendiliğinden iyileşmeyen yüz ve solunumla ilgili bozukluklar ile beraber burun ve çevresinde ciddi patolojik değişikliklere neden olur [63], [69] Visseral Leishmaniasis VL, kala-azar olarak da bilinen kronik bir hastalık olup küresel yaygınlıkta ağır enfeksiyon tablolarına ve ölümlere neden olan bir formdur [74]. VL etkeni eski dünyada (Afrika, Asya, Avrupa) L. donovani, L. infantum, yeni dünyada (Güney Amerika) ise L. chagasi dir [68], [75]. VL in etkeni olan bu parazitler zorunlu hücre içi parazitler olarak makrofaj hücrelerini enfekte ederek buralarda çoğalırlar. Promastigotlar mononükleer fagositlere tutunurlar ve ardından makrofajlar içerisinde sindirilmesi amacıyla fagositoz ile fagozom içerisine alınırlar. Makrofaj içerisine alınan promastigotlar, önemli biyokimyasal ve metabolik değişimler geçirerek zorunlu hücre içi form olan amastigotlara farklılaşır. Amastigotlar makrofaj içerisinde çoğalarak yeni hücreleri enfekte etmek üzere makrofajları patlatarak ortama yayılırlar [74], [76]. VL etkenleri (L. donovani, L. infantum/chagasi) retiküloendoteliyal sistem, karaciğer, dalak, kemik iliği, lenf bezleri hücrelerini de enfekte edebilmektedirler [44], [50]. Ayrıca konağın immünite durumuna bağlı olarak (çeşitli sebeplerle azalması veya baskılanması) tonsiller, larinks, özofagus ve barsak gibi organlar da etkilenebilmektedir [77], [78]. Belirtilerin ortaya çıkma süresi ortalama 2-4 aydır. Bu belirtiler vektörün kan emdiği bölgede 2-3 mm boyunda bir lezyon ile birlikte günde iki defa yükselen ateş (ortalama C bazen C), hepatosplenomegali, anemi ve lökopeni kilo kaybı gibi klinik semptomlardır [79]. Bu klinik belirtilerin görüldüğü bireyler tedavi edilmezse ciddi enfeksiyonlara ve ölümler meydana gelebilir [80]. Ülkemizde daha çok Akdeniz 9
27 ve Ege Bölgelerinde görülen VL diğer bölgelerimizde de sporadik olarak görülebilmektedir [81], [82]. 2.4 Visseral Leishmaniasis etkeni L. infantum un Özellikleri L. infantum, Euglenozoa şubesine mensup Kinetoplastida sınıfından Trypanosomatidae ailesine ait ökaryotik bir Leishmania türüdür [83]. Parazitin, diğer leishmania türleri gibi insan ve diğer memelilerde amastigot formunda, kum sineklerinde ise promastigot formunda geçirdiği evreler olmak üzere üzere iki yaşam formu bulunmaktadır [53]. Parazitin her formunda bulunan Kinetoplastlar, çubuk şeklinde mitokondriyal bir yapıdır. İçerilerinde sayıları on bini bulan çok küçük halkasal DNA lar ve 50 civarında da büyük halkasal DNA lar bulunmaktadır. Bu DNA lar genel olarak kinetoplastik DNA olarak adlandırılmakta ve kdna şeklinde kısaltılmaktadır. Kinetoplasttaki büyük halkaların mitokondrial ribozomal RNA yı kodladığı, küçük halkaların ise mrna nın düzenlenmesinde rol oynayan genleri kodladığı bilinmektedir [84]. Çizelge 2.2 L. infantum genom özellikleri [85], [86] Toplam genom boyutu (Mb) 32.1 Kromozom sayısı 36 Kromozom boyut dağılımı Toplam gen sayısı Pseudogen sayısı 41 Ortalama gen boyutu (bp) Gen yoğunluğu (Mb başına) 235 Genom kodlama yüzdesi 44.0 Kodlanan genlerde (G+C) yüzdesi 62.4 Toplam trna sayısı Visseral Leishmaniasisin Epidemiyolojisi VL dünyada 88 ülkede görülen ve bu ülkelerde yaşayan milyonlarca kişiyi tehdit eden bir hastalık olup hali hazırda yaklaşık 12 milyon kişinin bu parazit ile enfekte olduğu ve her yıl bu sayıya 500,000 kişinin eklendiği tahmin edilmektedir [87]. Bildirilen bu olgulardan yaklaşık her yıl 50,000 kişi VL nedeniyle hayatını kaybetmektedir. Antarktika kıtası dışında dünyanın bütün bölgelerinde endemik veya sporadik olarak 10
28 görülebilen VL etkenleri (L. donovani, L. infantum) genelde tropikal ve subtropikal bölgelerde görülmektedir. Dünyadaki VL olgularının %90 ı Hindistan ın belirli bölgeleri Bangladeş, Nepal, Sudan, Etiyopya ve Brezilya da görülmektedir [4], [88]. Şekil 2.3 Eski ve yeni kıtada VL in coğrafik dağılımı [1] Avrupa ve Akdeniz Bölgesinde de endemik olarak görülen VL, Türkiye den Portekiz e kadar olan Akdeniz kıyılarında görülmektedir. VL etkenlerinin bölgelere özel alt türleri de bulunmaktadır. Bunlar arasında; Çin, Hindistan, Sudan, Akdeniz ve Güney Amerika alt türleri bilinmektedir [3], [35]. Leishmania türlerinin sınıflandırılması oluşturdukları klinik belirtiler, coğrafik dağılımları ve etkenin çeşitli özelliklerine göre yapılmıştır. Son yıllarda ise izoenzim analiz teknikleri ve monoklonal antikorlar kullanılarak daha net tür ayrımlarına gidilmektedir [33], [89]. VL genelde ülkemizin kıyı bölgelerinde görülür. Fakat İç Anadolu, Doğu Anadolu, Marmara ve Batı Karadeniz bölgelerinden de vaka bildirimlerinin olması bu hastalığın ülkemizin her bölgesinde görülme riskinin bulunduğunu göstermektedir [53], [90], [91], [92], [93], [94], [95] (Şekil 2.4). 11
29 Şekil 2.4 Türkiye'de leishmaniasis dağılımı [96] 2.6 Hastalığın Tedavisi ve Kliniği VL e karşı günümüzde geliştirilmiş herhangi bir aşı ve kesin tedavi bulunmamakla beraber [2] hastaların tedavisinde günümüze kadar çeşitli antibiyotikler ve 3 değerlikli antimon (Sb) bileşikleri denenmiştir. Antibiyotiklerden istenilen sonuçlar alınamamış ve 3 değerlikli antimon bileşikleri ise yüksek toksisitesi nedeni ile tedavi amaçlı kullanılamamıştır. Günümüzde ise 5 değerlikli antimon bileşikleri daha az toksik olmaları ve tedaviye diğer ajanlardan daha net sonuçlar vermeleri nedeniyle tedavide kullanılmaktadır [97], [98], [99]. Klinik olarak VL de kırgınlık, ateş, kilo kaybı ve dalak büyüklüğü gibi belirtiler ortaya çıkar. Hastalık ilerledikçe hastalarda anemi, nötropeni ve poliklonal B hücresi çoğalmasına bağlı olarak hipergamaglobulinemi oluşur [59], [100]. VL tanısı, tanıda elde edilen klinik ve laboratuar bulgularının, tifo, malarya ve tüberküloz gibi diğer hastalıkların bulgularına benzer sonuçlar göstermesi dolayısıyla hastalığın tanısının koyulmasını zorlaştırmaktadır. Bundan dolayı tanıda laboratuvar metodlarının önemi fazladır [23]. 2.7 Leishmaniasisin İmmünitesi İmmün Sistem İmmün sistem, yabancı mikroorganizma istilalarına, özellikle patojen mikroorganizmaların yol açtığı enfeksiyon hastalıklarına karşı koyma görevini üstlenen, vücudun organ, doku ve hücrelerinde kurulu bir sistemi ve bu sistemin ortaya koyduğu direnci ifade eder. Bu sistemin enfeksiyonlara karşı verdikleri tepkiye immün yanıt adı 12
30 verilir [101]. Vücuda giren patojen mikroorganizma ve moleküllerin tanınmasında ve temizlenmesinde görev alan immün sistem hücreleri lenfosit adı verilen hematopoietik kökenli hücrelerdir. Bu hücreler genelde lenfoid dokularda, dolaşımda ve lenf sıvısında bulunurlar [102]. Vücudun herhangi bir patojen ile karşılaşması sonucu, immün sistem bu yabancı patojenlerin elimine edilmesi için lenfosit hücrelerinin aktifleşmesi vasıtasıyla harekete geçer. İmmün sistem vücudu bu tür çeşitli tehlikelerden korumak için 2 temel mekanizmaya sahiptir. Bunlar doğal ve edinsel immünitedir [103] Doğal İmmünite Doğal immünite, immün sistemin patojen mikroorganizma ve moleküllerin vücuda girişini engelleyen, doku ve hücrelere girmeyi başaran patojenleri ise ilk aşamada yok eden mekanizmasıdır. Doğal immünitenin ilk savunma hattını, epitel ve epitelde bulunan özel hücreler (makrofaj vb.) ile belirli enzimler (lizozim gibi) oluşturur. Patojenler epitelde bulunan bu bariyerleri bir şekilde geçerek dokulara ya da dolaşıma girerlerse, buralarda bulunan fagositler, doğal öldürücü hücreler gibi özelleşmiş lenfositler ve kompleman sistemin proteinlerini de içeren bir sistem tarafından saldırıya uğrarlar. Doğal immünitenin bütün bu mekanizmaları, patojenleri özgün olarak tanır ve ilk tepkiyi verir. Doğal bağışıklık yanıtları enfeksiyonlara karşı erken savunma sağladığı gibi, enfeksiyona yol açan yabancı maddelere karşı gelişen adaptif immün yanıtların oluşmasında da görev alırlar [104] Adaptif İmmünite Doğal immünite enfeksiyonlara karşı etkili olarak savaşsa da, patojenik mikroorganizmalar doğal immün yanıta karşı direnecek şekilde gelişirler. Enfektif ajanlara karşı savunma oluşturmak, adaptif immün yanıtın görevidir. Adaptif immün sistem, lenfositler ve onların antikor gibi ürünlerinden oluşur. Vücuda giren patojen ve yabancı antijenler doğal immünitenin elemesinden kaçabilirse adaptif immün yanıt tetiklenir. Adaptif immün yanıtın değişik tipteki mikroorganizmalarla savaşmak üzere özel mekanizmaları mevcuttur. Adaptif immünitenin bileşenleri lenfositler (B ve T hücreleri), antijen sunan hücreler (makrofajlar, B hücreleri, dendritik hücreler) ve plazma hücreleri (farklılaşmış B hücreleri) gibi hücrelerdir [105]. Adaptif immün cevabın iki ana alt yanıt sınıfı vardır; 13
31 Antikor bağımlı hümoral yanıt ve hücre bağımlı immün yanıt. Bu iki alt sınıf adaptif immün yanıtın iki ana hücre grubu tarafından yönetilir. Antikor bağımlı hümoral yanıtta, B hücrelerinden üretilen antikorlar vasıtasıyla hücre dışı (hümoral sıvı vs.) patojenler, hücre bağımlı immün yanıtta ise T lenfositler vasıtasıyla hücre içinde yaşayan patojenler yok edilir. Adaptif immünitenin hümoral yanıt aşamasında antikorlar dolaşıma ve diğer vücut sıvılarına salgılanırlar. Vücut sıvılarında bulunan antikorlar özel olarak üretildikleri toksin, antijen, patojen ve virüs benzeri yapılara bağlanarak bu patojenlerin etkisiz hale getirilmesini veya immün sistem hücreleri tarafından fagosite edilmesini sağlarlar. Antikorların önemli özelliklerinden bir tanesi de patojen ve virüslere bağlanarak konak hücrelere ve ilgili dokulara erişmelerini ve yerleşmelerini engellemektir [106]. Antikorlar, B hücrelerinin aktivasyonu antijene özgül hücrelerin çoğalması ve antikor salgılayan efektör hücrelere dönüşmesi ile üretilirler. Birincil yanıtta periferik lenfoid organlardaki naif B hücreler, antikor salgılayan hücrelere ve bellek hücrelerine farklılaşmak ve çoğalmak üzere aktive olurlar. İkincil yanıtta ise, bellek hücreleri hızlı bir şekilde aktive olurlar. Bazı antikor salgılayan plazma hücreleri ise kemik iliğine göç ederek burada uzun süre yaşayabilir. Daha sonra protein yapısındaki antijenlerle tekrarlanan karşılaşmalar yüksek antijen afiniteli antikorların üretimine neden olur (şekil 2.5) [104]. Şekil 2.5 Antijenlere karşı B lenfositlerinin gösterdiği birincil ve ikincil yanıtlar [104] 14
32 Bu şekilde hümoral immün sistem önceden karşılaştığı patojenlere karşı çok çabuk tepki verir. Aynı patojen ile uzun süre sonra gerçekleşen sekonder karşılaşmalar immün sistemi çok daha yüksek ve hızlı bir yanıt vermeye yönlendirir [107] Antikorlar (İmmünoglobulinler) Hümoral immünite glikoprotein ailesinden olan antikorlar (immünoglobulinler) ile yakından ilişkilidir. Antikorlar özel olarak üretildikleri antijenlere hümoral immünitenin hem tanıma hem de efektör safhasında bağlanabilmektedirler. Antikorlar ilk önce B lenfositlerinin membran yüzeyine bağlı olarak üretilirler. Antijen ile etkileşime geçen yüzey antikorları reseptör olarak iş görür ve B hücrelerini aktifleştirir. B lenfositleri hümoral immün cevabın oluşturulması için antijen tanıma safhasına bu bağlı antikorlar vasıtasıyla geçerler. Ayrıca antikorlar aktifleşmiş B hücreleri tarafından salgılanan formda da (IgG, IgA, IgE gibi) üretilirler. İmmunoglobülinlerin iki temel işlevi vardır; bunlardan birincisi spesifik antijenlerine bağlanmaktır, ikinci grup işlevi arasında komplement sistemi aktive etmek, opsonizasyon ve sinyal iletimi yer almaktadır. Bu işlevlerin herbiri immunoglobülinin değişik bölgeleri ile ilişkilidir. Glikoprotein yapıda olan immunoglobülinlerin yapılarındaki biyolojik olarak iş gören kısımları ise polipeptid birimleridir. Antikorlar immünojen özelliği bulunan metabolitleri, şekerleri, lipitleri, hormonları ve daha kompleks olarak fosfolipitleri, nükleik asit ve proteinleri içeren hemen hemen bütün biyolojik molekülleri tanıyabilme kabiliyetindedirler. Makromoleküller genelde antikorların antijen bağlayan kısımlarından çok daha büyüktürler. Bu yüzden bir antijen kendisine karşı üretildiği makromolekülün epitop veya determinant olarak adlandırılan özel bir bölgesine bağlanır. Makromoleküller genelde birden çok antikor bağlanan epitop bölgesi içerirler [104], [108] Antikorların Yapısı Antikorların çok geniş yelpazedeki antijenik yapıları spesifik olarak tanırlar ve immün yanıtta yer aldıkları görevlerde iş görebilmek için kendi aralarında alt gruplara ayrılırlar. Antikorların %82-96 sı polipeptid ve %4-18 i ise karbonhidrat yapıdadır [109]. Her antikor dört alt zincirden oluşan tetramer yapıda olup bunlardan kısa olan iki zincire hafif zincirler ya da L zincirleri, uzun olan diğer iki polipeptid zincirine ise ağır zincirler ya da H zincirleri adı verilir. Kollarda bulunan hafif ve ağır zincirlerin arasında ve ana 15
33 gövdedeki iki ağır zincir arasında bulunan disülfit bağları polipeptid zincirlerini birbirlerine bağlar (Şekil 2.6) [101], [107], [110]. Şekil 2.6 İmmünoglobulin G nin 3 boyutlu kurdele modellemesi [111] Kollardaki ağır (H) ve hafif (L) zincirlerin bir ucu -NH 2 ile sonlandığından bu uca amin uç, zincirlerin diğer ucu -COOH ile sonlandığından bu uçlara da karboksi uç adı verilir. Her polipeptid zincirinin amin uca yakın kısımları özgül antijene bağlanma bölgesi olup buna bağlı olarak aminoasit sırasında, diğer bölgelere göre birçok değişiklik görülür. Bu nedenle bu bölgelere değişken (V) bölge denir. Hafif zincir (L) ile ağır zincirin (H) değişken bölgeleri (V) bir araya gelerek Y şeklindeki antikorun her iki kolunda bulunan değişken bölgeleri (V) oluşturur. Yüzlerce değişik kombinasyonda ve özellikte değişken bölge (V) üretilebilmesi antikorlara geniş bir antijen tanıma özelliği kazandırmaktadır. Antikorun polipeptid zincirinin kalan ana kısmı genel olarak değişmez durum gösterdiğinden bu bölge sabit bölge (C) adını alır. Antikor polipeptid zincirlerindeki sabit bölgeler birkaç belirli sabit bölgeye (C) göre değişen efektör yanıtta iş görürler. Antikorun yapısındaki bu değişken (V) ve sabit bölgeler (C) de kendi aralarında alt kıvrımlara sahiptirler. Bu kıvrımlar polipeptid zincirinde birbirine disülfit bağlarıyla bağlıdırlar. Ağır (H) zincire bağlı olan değişken bölgelere VH, L zincirlerine bağlı olanlara da VL kıvrımları adı verilir. Değişken (V) bölgesinin hemen altındaki sabit bölgedeki (C) ağır zincir (H) üzerindeki kıvrıma CH1, aynı bölgede hafif zincir (L) üzerindeki kıvrıma CL kıvrımları adı verilir. Şekildeki hafif zincirde (L) bulunan sabit bölgesi (CL), ağır zincirin (H) değişken bölgesine (VH), bitişik olan CH1 bölgesi ile 16
34 disülfit bağları ile bağlanarak antikorun kendine özgü Y şeklini almasını sağlamaktadır [108], [110]. Antikor İzotipleri ve Fonksiyonları Memelilerde IgA, IgD, IgE, IgG ve IgM olmak üzere 5 sınıf antikor bulunmaktadır [107]. İmmunoglobülinlerdeki Ağır (H) zincirlerinin yapısı o immunoglobülinin tipini belirler. Ağır (H) zincirlerinin değişmez (C) bölgeleri arasındaki kimyasal farklılıklara göre 5 ayrı immünoglobulin tipi belirlenmiştir. Bunlar γ (gama), α (alfa), µ (mü), δ (delta) ve ε (epsilon) olarak adlandırılmaktadır. IgG de γ, IgA da α, IgM de µ, IgD de δ ve IgE de ε ağır zinciri bulunur. IgG, IgA ve IgD tipi antikorlarda Y şeklindeki molekülün ana gövde kısmında C H 2 ve C H 3 olmak üzere iki adet, IgM ve IgE tipi antikorlarda ise C H 2, C H 3 ve C H 4 olmak üzere üç adet C kıvrımı bulunur. IgG; molekülününün üç kolunun birleşim noktasından papain enzimi ile yapılan kesimler Y şeklindeki molekülün kollarını oluşturan antijenin bağlandığı iki değişken bölge ve biyolojik aktivite gösteren efektör kıvrımlarını taşıyan ana gövde olarak üç parçaya ayrıldığı görülmüştür. Antijenin bağlandığı iki parçaya Fab parçaları, ana gövde kısmına ise Fc parçası (kristalize olabilen fragment) adı verilmiştir. IgG serum antikorlarının yaklaşık %75 ini oluşturmaktadır. Ayrıca IgG sekonder immün yanıtta en baskın olarak görülen ve fetusa geçerek fetusun pasif olarak bağışıklanmasını sağlayan tek immünoglobülin tipidir. IgG sahip olduğu gama sabit zincirinin izotiplerine göre; IgG1, IgG2, IgG3 ve IgG4 olmak üzere 4 alt sınıfa ayrılmaktadır. IgG ayrıca lökositlerde bulunan Fc reseptörleri vasıtasıyla opsonizasyon, kompleman bağlanması ve fagositlerin aktifleştirilmesi gibi işlevlerde de iş görmektedir [107], [109], [112]. IgA; mukozal immün sistemin antikor tipidir ve genellikle virüslere karşı etki mekanizmasında iş görürler. IgA antikorları dimer yapısında olduğundan dolayı yapısındaki H ve L zincirleri daha çok sayıdadır. IgM; çoğu antijene karşı oluşturulan erken immün cevabın baskın antikor tipidir. Aynı zamanda B lenfositlerinin yüzeyinde pentamerik yapıda reseptör olarak bulunmaktadır. IgM, μ tipi H zincirler barındırır. Aktifleşen B hücresince salgılanan ilk antikor tipidir. B hücreleri daha sonra sınıf değişimi yaparak diğer tip antikorları salgılamaya başlarlar. IgD; iki adet δ (delta) yapısında H zinciri ile her birinde ya λ (lamda) ya da κ (kappa) yapısında ikişer adet L zincirleri bulundurur. 17
35 IgD serumda çok az miktarda bulunan monomer yapıda bir antikordur. IgM ile birlikte B lenfositlerinin yüzeyinde de bulunmaktadır. IgD nin fonksiyonu tam olarak bilinmemekle birlikte B lenfositlerinin gelişimleri ve farklılaşmaları sırasında görev aldığı ileri sürülmektedir. IgE; monomer yapısında ve iki adet ε (epsilon) H zinciri bulunur. Genel olarak alerjilerden sorumlu antikor tipidir. IgE mast hücrelerinin reseptörlerine bağlanarak antijeni ile bağlantı kurduğu hücrenin üzerine mast hücreleri tarafından degranülasyon yapılmasını sağlar. IgE tipi antikorlar genelde hücre dışı parazitik enfeksiyonlara karşı etkilidir. IgE moleküllerinin Fc bölgeleri dokulardaki mast hücrelerinin ve kandaki bazofillerin Fc reseptörüne yüksek afinite ile bağlanır. Antijenin bağlanması bu hücrelerin çok çeşitli sitokinler salgılamalarını ve biyolojik olarak aktifleşmelerini sağlar [113], [114] İmmün Sistemin Leishmaniasisdeki Rolü ve Leishmaniasise Karşı İmmün Cevap Kum sineklerinin ısırığı ile ısırık bölgesinde kan dolu mikrovasküler bir bölge oluşur. Bu durum küçük çapta inflamatuvar cevap oluşturarak nötrofillerin bölgeye göçüne neden olur [115], [116], [117]. İlk olarak bölgeye göç eden nötrofilleri hızlı bir şekilde enfekte eden promastigotlar enfeksiyonu başlatırlar [118]. Ortama göç eden nötrofiller parazitleri fagosite etmeleri sonucu çeşitli sitokinler sentezleyerek olay bölgesine makrofajların göçünü uyarır. Ortama gelen makrofajlar enfekte nötrofilleri fagosite etmekte ancak; bu aşamada transforme büyüme faktörü-β (TGF-β) gibi sitokinlerin salgılanmasını indükleyen parazitler [119], [120] immün yanıt oluşumunu engelleyerek makrofajlar içerisine elimine edilmeden girmeyi başarırlar. Ortama gelerek fagositoz gerçekleştiren bu makrofajlar ortama diğer immün sistem hücrelerinin (Doğal öldürücü hücreler (NK), dendritik hücreler ve yeni makrofajlar) gelmesini sağlarlar [121]. Yüzey membran metaloproteazı olan gp63 sayesinde, kompleman sistemin hücre lizisinden de kaçarak makrofaj içerisine girmeyi başaran promastigotlar enfekte ettikleri makrofajlarda fagolizozom benzeri özellikler gösteren vakuoller içerisinde amastigotlara dönüşerek burada hayatta kalmayı başarır ve çoğalırlar [122], [123], [124], [125]. Makrofajlar içerisinde bu safhada hayatta kalabilen promastigotların ağırlıklı olarak metasiklik promastigotlar olduğu rapor edilmiştir [126]. Makrofajların ise parazitleri elimine etmek için kullandıkları birincil efektör molekül nitrik oksittir 18
36 (NO). Makrofajların yeterli miktarda NO sentezleyebilmesi için, ortamda bazı immün faktörlerin bulunması gerekmektedir. Bu faktörler interferon-γ (IFN-γ) ve tümör nekroz faktör-α (TNF-α) sitokinleridir. IFN-γ tarafından uyarılan makrofajlar, NO sentezi gerçekleştirmek üzere uyarılmakta ardından TNF-α devreye girerek parazitin öldürülmesi işlemi başlamaktadır [127]. Ancak parazitlerin de makrofajların aktivasyonundan kaçmak üzere geliştirdikleri birçok strateji mevcuttur. Bunlar; diğer immün sistem hücrelerine makrofaj aktivasyonunu engelleyici çeşitli reseptörler sentezletmeleri [119], [120], makrofajın aktivasyonunda görev alan IL-12 ve nükleer faktör B (NFB) gibi sitokinlerin sentezini engellemeleri ile TGF-β ve IL-10 gibi makrofaj inhibe edici moleküllerin üretilmesini indüklemeleri gibi mekanizmalardır [128], [129]. Makrofaj aktivasyonu, leishmaniasis enfeksiyonlarında CD4 + T hücre cevabı ile de direkt olarak ilişkilidir. CD4 + hücreleri Th1 immün alt sınıf yanıtını oluşturan hücreler olarak, enfeksiyona karşı savaşmada temel rolü oynamaktadır [127]. Parazitlere karşı makrofaj aktivasyonu IFN-γ üretimi ve Th1 cavabının gelişimi ile yakından ilişkilidir [130], [131]. Parazitler IL-4, IL13, IL-10 ve TGF-β gibi sitokinlerin üretilmesini indükleyerek Th1 cevabını Th2 yönünde yönlendirmekte ve makrofaj fonksiyonlarını inhibe edebilmektedir [68]. Th1 CD4 + hücre cevabı ile IFN-γ, IL-12 ve TNF-α gibi sitokinlerin varlığında hastalığın kontrol altına alınabildiği gerçeği [132] ileride leishmaniasis immünterapi çalışmalarında olumlu sonuçlar elde edilebileceği umudunu güçlendirmektedir. B hücreleri ve antikorların leishmaniasisde koruyucu immünitenin sağlanmasındaki önemleri ise halen tartışmalı bir konudur. VL hastalarında Leishmania spesifik immünoglobulinlerin serumda yüksek seviyelerde bulunması hastalığın patolojisinin B hücreleri ve antikorlar ile alakalı olduğunu akla getirmektedir. VL e karşı oluşturulan Th1 ve Th2 hücre cevaplarının ikisinde de çeşitli immünoglobulin izotiplerinin üretildiği rapor edilmiştir, fakat bu antikorların koruyucu immünite ve patolojideki rolleri halen tam olarak bilinmemektedir [133]. Yine de antikor varlığının, leishmaniasis enfeksiyonlarından korunmada görev aldığı da literatürde rapor edilmiştir [134]. 2.8 Leishmaniasis in Laboratuvar Tanısında Kullanılan Yöntemler VL in laboratuvar tanısı; dokudaki parazitlerin mikroskobik yöntemlerle çeşitli ajanlarla boyanarak gösterilmesine dayalı (1), mikroskobik in vitro kültür yöntemleri ile konaktan alınan örneklerin kültür ortamında çoğaltılarak gösterilmesine (2), parazit 19
37 DNA sının konakta belirlenmesine (3) ve konakta parazitin antijenlerinin veya parzite karşı oluşan antikorların gösterilmesine (4) dayanan serolojik yöntemler olarak başlıca 4 grupta incelenebilir Mikroskobik Tanı Yöntemleri Tanıda en sık kullanılan yöntemlerdendir. Dalak, kemik iliği, karaciğer, deri lezyonu, lenf düğümü gibi dokulardan aspirasyon-yoluyla elde edilen örneklerin giemsa boyası ile boyanarak mikroskopta Leishmania parazitlerinin amastigot formunun görülmesi ile tanı konmaktadır [23]. Ancak hasta için ağrılı, riskli ve invaziv bir yöntemdir. Bu yöntemin bir dezavantajı da hastane koşullarında ve aseptik olarak deneyimli hekimler tarafından gerçekleştirilmesi gerekliliğidir [135] Kültür Yöntemleri Kültür yöntemi, hastadan alınan parazitlerin kültür ortamında üretilerek mikroskobik olarak hareketli parazitlerin görülmesine dayanan bir tanı yöntemidir. Bu yöntem ayrıca tür belirleme çalışmaları, serolojik tanı yöntemleri ve in vivo çalışmalarda kullanılmak için yeterli sayıda antijen elde etmek, makrofajlarla amastigotlar arasındaki ilişkiyi incelemek, in vitro ilaç çalışmaları yapabilmek için kullanılmaktadır [23]. Akut VL hastalarında kültürün duyarlılığı %90 olarak bildirilmiştir. Bu gibi yüksek duyarlılığına rağmen klasik kültür yönteminin tanı koyulabilmesi için uzun süreler gerektirdiği (15-35 gün) rapor edilmiştir [14], [18]. Allahverdiyev vd. [18] son zamanlarda geliştirdikleri yeni mikro kültür yöntemi ile (MKY) kapiler tüpte çok az miktarda (25-50 µl) sıvı besiyeri kullanarak, örnekte parazit sayısının az olduğu durumlarda bile sıvı kültürde çoğaltılmasının mümkün olduğu göstermişlerdir. Ayrıca mikroaerofilik bir ortam sağlanarak, kısa sürede amastigotların promastigotlara dönüştüğü ve bu promastigotların hızlı bir şekilde çoğaldığı da bilinmektedir [136]. Bu yöntemle promastigotların deri, kemik iliği, dalak aspirasyon materyallerinden ayrıca periferal kandan da üretilebilmesi mümkündür. MKY nin diğer avantajlarından biri ise; mikro kültürde üretilen parazitlerin PZR ile tiplendirilmesinde ve tanısında bu yöntemin duyarlılığının yükseltilmesini mümkün kılması ve asemptomatik VL modellerinde de sonuç verebilmesidir [8], [137]. Mikrokültür yönteminin bu gibi avantajları, bu yöntemi antileishmanial ilaç araştırmaları ve dirençlilik testleri için avantajlı bir yöntem haline getirmektedir [138]. 20
38 2.8.3 Moleküler Yöntemler Çeşitli moleküler yöntemler ile enfeksiyon tanımı için Leishmania DNA'sını belirlenmesi temel alınmıştır. Leishmania'ya özgü primerler ile PZR reaksiyonu gerçekleştirilerek tür tayini ve teşhis koyulmaktadır. Leishmania türlerini tiplendirmek için nested-pzr, multipleks PZR, kesilmiş parça uzunluğu polimorfizmi (RFLP) ve DNA dizi analizleri gibi yöntemler kullanılmaktadır. Bu yöntemler çok hassas oldukları halde, karmaşık olan prosesleri ve maliyetleri rutin uygulamalarda kullanılmalarını dezavantajlı hale getirmektedir [23], [139] Serolojik Yöntemler VL tanısında dünyanın birçok bölgesinde olduğu gibi ülkemizde de yüksek duyarlılık ve özgüllükte olan serolojik testler uygulanmaktadır [140]. Serolojik yöntemler hastadan alınan örneklerde Leishmania parazitlerine karşı üretilmiş antikorların veya Leishmania spesifik antikorlar vasıtasıyla antijenlerin tespit edilmesi temeline dayanmaktadır [23]. Leishmaniasis tanısında uzun zamandır uygulanan İndirekt Fluoresan Antikor Testi (IFAT) testinin yanısıra, ELISA, rk39 antijeninin kullanıldıgı dipstick testi ve Direkt Aglütinasyon Testi (DAT), indirekt Hemaglütinasyon Testi (IHA), lateks aglütinasyon testi (LAT) ve Western Blot teknikleri de yaygın olarak kullanılmaktadır [141], [142], [143], [144]. Tanı sistemlerinde ise monoklonal antikorlar antikor-antijen reaksiyonları temel alınarak daha spesifik ve duyarlı tanı sistemlerinin geliştirilmesine olanak sağlamaktadır. Örneğin bu antikorlar radyoaktif, floresan, enzimatik veya manyetik ajanlar ile işaretlenerek ELISA ve Radyo immün test) gibi gelişmiş tanı sistemleri ortaya koyulmaktadır. 2.9 Monoklonal Antikor Teknolojisi Monoklonal antikorlar doku kültürü laboratuvarlarında kültüre edilen hibridoma hücre hatlarından üretilirler. Her hibridoma klon hücresi aktifleştiği antijene özgü ve belirli bir antikor tipini üreten tek bir B hücresinden üretilmiştir. Bu hücrelerin ürettiği antikorlara monoklonal antikor denilmektedir. Hibridoma hücre hatları immünize donörlerin B hücreleri ile ölümsüz myeloma hücrelerinin belli şartlar altında birleştirilmesiyle elde edilerek monoklonal antikorların in vitro olarak üretilmesinde kullanılmaktadır. Monoklonal antikor tekniği ilk olarak 1975 yılında Milstein vd. [145] tarafından 21
39 tanımlanmıştır. Her monoklonal antikor kendisine karşı üretilen antijenin üzerindeki bir epitopa özgül olarak bağlanır. Monoklonal antikorlar yüksek derecede spesifiklik göstermekte ve çok nadir olarak diğer proteinlerle çapraz reaksiyon göstermektedirler [146]. Bu yüksek spesifikliği nedeniyle monoklonal antikorlar klinikte tedavi, antikor temelli tanımlama ve teşhis sistemleri geliştirilerek uzun zamandır uygulanmaktadır. Monoklonal antikorların kullanıldığı klinik uygulamalar arasında; kanser tanı ve tedavisi, organ nakli reddi, otoimmünite ve doku hasarı tedavileri ile tanısal görüntüleme gibi alanlar bulunmaktadır. Kanser tanısında monoklonal antikorlar hedef spesifik antikorlar tümör üzerindeki kanser anijenlerinin determinantlarına özgü olarak bağlanarak tümör yapısı hakkında bilgi verirken, tedavide ise antikor terapisi hastanın immün sisteminin ve doğal efektör mekanizmalarının kulanılarak tedavi edilmesi stratejisi üzerine kurulmuştur [112] Monoklonal Antikorların Poliklonal Antikorlar ile Kıyaslanması Poliklonal antikorlar farklı B hücre hatlarından kökenlenen ve her bir hücrenin hedef proteinin farklı epitoplarına karşı antikor üreterek salgılamasıyla oluşurlar. Monoklonal antikorlar tek antikor izotipine ait antikorlar içerirken poliklonal antikorların her biri farklı antikor farklı izotiplere (IgG, IgM, IgA vb.) ait olabilir. Monoklonal antikorların hedef protein spesifikliği olarak da poliklonal antikorlardan avantajları mevcuttur. Monoklonal antikorlar hedef proteinin tek bir epitopuna spesifik olarak bağlanan antikorları içermekte ve poliklonal antikor üretiminde kullanılan in vivo üretim yöntemi yerine hibridoma tekniği ile in vitro olarak üretilmeleri monoklonal antikorları üretim yönünden daha etik ve aynı spesifiklikteki antikorun sınırsız olarak elde edilmesi adına daha avantajlı hale getirmektedir. Bu özellikleri monokonal antikorları proteomik çalışmalarında ve tanı sistemlerinde poliklonal antikorlara göre daha yüksek spesifiklikte kullanılmalarını sağlamıştır. Tüm bu avantajlara rağmen in vitro monoklonal antikor üretimi poliklonal antikor üretimine göre halen zaman alıcı, zahmetli ve pahalı bir yöntemdir [147]. Fakat günümüzde bu gibi sorunları aşmak amacıyla iyi üretim koşullarında (GMP) ve büyük miktarlarda in vitro monoklonal antikor üretilebilmesi için biyoproses aşamalarının optimize edilmesi ve üretilmeleri gibi çalışmalar birçok biyoteknoloji şirketi tarafından büyük bir hızla devam etmektedir [148]. 22
40 2.9.2 Hibridoma Teknolojisi Hibridoma teknolojisi Kohler ve Milllstein [145] tarafından 1975 yılında koyun kırmızı kan hücreleri ile immünize olmuş farelerin dalak hücreleri ile ölümsüz myeloma hücrelerini füzyona uğratarak sürekli antikor üretebilen ölümsüz hücre hatlarını elde etmeleriyle ortaya çıkmış ve o günden bu yana araştırıcıların antikorlara bakışında, hastalıkların tanı ve tedavi stratejilerinde, aşı üretimi, patojenlerin antijenik yapılarının aydınlatılmasında ve immün yanıtların genetik regülasyonunun anlaşılması konularında bir devrim niteliğinde gelişmelere neden olmuştur [149]. Kohler ve Millstein [145] bu çalışmaları sonucunda 1984 yılında nobel ödülü ile ödüllendirilmeleri ve bunun ötesinde melezleme teknolojisini patentlememek konusundaki kararları, monoklonal antikorların bilim, ekonomi ve endüstri alanlarında çabucak ve yaygın şekilde kabul görmesiyle sonuçlanmıştır [150]. Hibridoma teknolojisi; hedef antijen ile immünize edilmiş hayvanlardan elde edilen lenfositler ile ölümsüz ve belirli bir kimyasal ajana karşı duyarlı myeloma hücrelerinin füzyonundan elde edilen hibrid hücreler içerisinden füzyona uğramayan hücrelerin selektif kimyasallar içeren besiyerlerinde seçilimi ve sınırlayıcı dilüsyon yöntemi ile tek bir hücreden klonlanmış, istenen hedefe özgü monoklonal antikor üretebilen hibridoma hücrelerinin elde edilmesini kapsamaktadır (şekil 2.7) [151]. Şekil 2.7 Hibridoma teknolojisi ile in vitro monoklonal antikor üretim aşamaları [152]; 23
41 A- Balb/c fareler istenilen antijene karşı bağışıklık kazandırılır. Daha sonra, en etkin bağışıklık kazanan fare ELISA yöntemiyle seçilir. B- Bağışıklık kazanan farenin dalağı, antikor üreten B lenfosit hücrelerini ayırmak için alınır. C- Kemik iliği kanser hücreleri olan ölümsüz myeloma hücreleri B lenfositleri ile füzyon için hazırlanır. D- İki hücre polietilen glikol (PEG) 4000 varlığında füzyona uğratılır. Füzyona maruz kalan hücreler daha sonra seçici besiyerlerinde kültürü gerçekleştirilerek, füzyona uğramamış hücrelerin ölmesi sağlanır. E- İstenen antijene özgü antikorlar üreten hibridoma klonları ELISA yöntemiyle seçilir. Sınırlayıcı dilüsyon yöntemini kullanarak, seçilen hücreler yeniden kültür plaklarına ekilir ve tek hücreden oluşan hibridoma kolonisi elde edilir. F- İstenilen antijene belirli antikor sentezleyen hibridoma kolonileri ELISA ve Western Blot gibi yöntemlerle seçilebilir. G- Seçilen hibrid hücreler in vitro olarak fazla miktarlarda üretilir. H- Üretilen antikorlar uygun metotlarla saflaştırılır [153] İmmünizasyon İçin Seçilen Hayvanların Özellikleri Fareler ve sıçanlar monoklonal antikor üretimi için hibridoma teknolojisinde elde edilme kolaylıkları, ucuz oluşları ve bağışıklık için iyi sonuç vermeleri nedeniyle tercih edilirler. İstenen antijene bağışıklık yanıtını almak için bağışıklık yanıtları güçlü olan ve hastalık geçirmemiş genç hayvanları kullanmak önemlidir. Hastalıklara karşı oluşturulan antikorlar çapraz reaksiyonlara sepep olabilir. Ayrıca fareler farklı sebeplerden dolayı bağışıklık sürecinde ölebilirler. Bu gibi problemleri engellemek için, 6-8 haftalık fareler seçilir. Hayvanların cinsiyeti göz önüne alındığında ise, dişi olanlar tercih edilmelidir, çünkü sosyal etkileşimde daha saldırgan olan erkek farelere göre grup olarak başarılı bir şekilde barındırılabilirler (Şekil 2.8). 24
42 Şekil 2.8 Hibridoma deneylerinde kullanılan Balb/c deney fareleri Füzyon Çalışmalarında Kullanılacak Hücrelerin Özellikleri Füzyon çalışmalarında kullanılacak myeloma hücre hattı lenfositlerin alındığı kaynak ile uyumu açısından önemlidir. Bundan dolayı füzyon çalışmalarında genellikle Balb/c fare ırklarından kaynaklanan myeloma hücre hatları kullanılmaktadır. Myeloma hücre hattı ve lenfositler aynı tür farelerden kökenlendiğinde in vivo da hibridoma hücrelerinin üremesini olumlu yönde etkilemektedir. Ayrıca seçilen myeloma hücre hattının monoklonal antikor üretimi için kendi kendine immunoglobulin salgılama kapasitesini kaybetmiş hücre hatları kulanılır. Bu durum istenilen antikorun salgılanmasını sağlayan lenfosit oranının azalmasına ve monoklonal antikor üretilen ortamın saflığının bozulmasına neden olmaktadır. İmmünoglobin salgılamayan Sp/0- Ag14 myeloma hücre hatları ilk defa 1978 yılında rapor edilmiştir [154]. Fakat bu hücre hattının bir füzyon partneri olarak kullanılmasında değişken etkilerin oluştuğu gözlemlenmiştir. Kearney vd. [155] ise 1979 yılında Balb/c kaynaklı, immunoglobulin salgılama kapasitelerini kaybetmiş, fakat hala melez hücre hatları için uygun antikor salgılanmasını sağlayan uygun bir füzyon partneri olan P3-X63-Ag8.653 myeloma hücre hattını tanımlamışlardır Füzyon Çalışmaları Sonrası Hibrid Hücrelerin Seçilmesi Hibridoma tekniğinin temeli immünize farelerden elde edilen ölümlü B lenfositlerinin ölümsüz myeloma hücreleriyle füzyona uğratılarak in vitro ortamda ölümsüz hücre 25
43 hatlarının ürettiği antikorların sınırsız olarak elde edilmesine dayanmaktadır. Bu amaca binaen gerçekleştirilen füzyon işlemleri sırasında ortamdaki bütün hücreler füzyona uğramamakta veya istenilmeyen füzyonların oluşumu (B lenfosit-b lenfosit, myelomamyeloma veya füzyona uğramamış B-lenfosit ve myeloma hücreleri) gözlenmektedir. Fakat füzyon deneylerinin sonucu olarak istenilen ortamda sadece antikor salgılama yeteneklerini kaybetmemiş myeloma-b lenfosit hibridlerinin bulunmasıdır. Bu sonucu elde edebilmek için araştırıcılar myeloma hücrelerinde çeşitli duyarlılıklar oluşturarak bu engeli aşma yoluna gitmişlerdir. Hayvan hücreleri nükleotid sentezlerini iki ana yolla gerçekleştirirler (şekil 2.9); Birinci yol temel moleküllerden ya da hücrede bozulmuş nükleik asit ürünlerinden nükleotid sentezlenildiği kurtarma yolağı (salvage pathway) dır. Bu yolak HGPRT (Hipoksantin-Guanin Fosforibozil Transferaz) enziminin varlığına dayanır. Nükleotid sentezinin ikinci yolu ise; pürin ve pirimidin (İnozin monofosfat (IMP), Adenozin Monofosfat (AMP), Guanozin Monofosfat (GMP), Üridin monofosfat (UMP), Deoksiüridin Monofosfat (dump) ve Deoksitimidin Monofosfat (dtmp)) öncüllerinden nükleik asitlerin yeniden üretildiği de novo sentez yolağıdır [156]. Şekil 2.9 Nükleotid sentezi için de novo ve kurtarma (salvage) yolakları [157] De novo sentez yolağı aminopterin gibi çeşitli kimyasal antifolatlar ile kapatıldığında hücreler kurtarma yolağı vasıtasıyla nükleotid sentezleyebilirler. Füzyon çalışmalarında kullanılan myeloma hücre hatları ise HGPRT - (kusurlu) mutasyona uğramış hücre hatlarıdır. HGPRT + hücreler hipoksantin ve timidin varlığında aminopterin gibi antifolatlara dirençlidirler. HGPRT - hücreler ise aminopterine karşı seçici olarak 26
44 duyarlıdır. B lenfosit-myeloma yönünden antikor üreten aktif saf kültürler elde edebilmek için füzyon öncesinde myeloma hücreleri 8-azaguanin mutajenik maddesiyle muamele edilerek HGPRT - mutant duyarlı myeloma hücre hatları elde edilir. Füzyon aşamalarına geçilmeden önce kültür ortamından 8-azaguanin en az 10 gün önce kaldırılarak myeloma hücreleri füzyon için hazırlanır. Myeloma hücrelerinde oluşturulan bu özellik kullanılarak füzyon sonrası HAT (hipoksantin, aminopterin, timidin) içeren besiyerinde inkübe edilen kültür içerisindeki füzyona uğramamış HGPRT - myeloma hücreleri aminopterin varlığında de novo sentez yolaklarını kullanamadıkları için ölürler. Kültür ortamındaki B lenfositleri ise kısa yaşam süreleri nedeniyle 4-5 gün içerisinde kültür ortamından elimine olacaklardır. Fakat ölümsüzlük özelliklerini myeloma hücresinden, HGPRT enzimini ise HGPRT + B-lenfositinden alan antikor üreten hibridoma hücreleri kültür ortamında devamlı bir şekilde çoğalabilirler [158]. Normal besiyerinde kültürü yapılan hayvan hücreleri de novo yolak ile pürin nükleotidlerini (AMP, GMP, IMP) ve timidilat (TMP) ile sentezler (mavi ile gösterilen kısım). Diagramın üst kısmında görüldüğü gibi (mavi kısım) aminopterin gibi antifolatlar tetrahidrofolatın aktive formundan formil ve metil gruplarının transferini engelleyerek, inozin monofosfat (IMP) ve timidin monofosfat (TMP) sentezini önler. Normal hücreler ayrıca nükleotid sentezlemek için kurtarma yolaklarını (kırmızı kısım) da kullanabilirler. Füzyon çalışmaları için kullanılan myeloma hücrelerinde kurtarma yolaklarındaki HGPRT (hipoksantin-guanin fosforibozil transferaz), APRT (adenin fosforibozil transferaz) veya TK (timidin kinaz) enzimleri eksiktir ve antifolat bulunduran besiyerinde yaşayamazlar [157] Monoklonal Antikorların Uygulama Alanları Monoklonal antikorlar, antikorların spesifik epitoplara bağlanabilme özelliklerinden yararlanılarak klinik ve araştırma alanlarında geniş bir yelpazede kullanılmaktadır. Bu uygulamalar basit olarak kalitatif ve kantitatif analizler ana başlığında toplanan aşağıdaki uygulama alanlarından oluşmaktadır; Birçok örneğin aynı anda çalışılabilmesine olanak veren çözünür antijenlerin belirlenmesi amacıyla çok geniş uygulama alanlarında kullanılan ELISA (enzim bağlı immünosorbent assay) tekniklerinde [159], 27
45 Dokulardaki veya hücrelerdeki ekspresyonu yapılan belirli antijenlerin analizlerinin yapılması amacıyla uygulanan immünofloresan veya immünohistokimya tekniklerinde [160], Onkolojide monoklonal antikor temelli moleküler tanı tekniklerinde [161] Çözünür antijenler için, saf antikorların inert resinlere kovalent olarak bağlanmasıyla elde edilmiş dolgu maddelerinin kromatografi tekniklerinde kullanılarak antijen saflaştırılmasında [160], [162], Hücre yüzey antijenlerine özgü üretilmiş antikorların çeşitli floresans (FACS teknikleri) veya manyetik (MACS teknikleri) ajanlar ile işaretlenerek kullanılmalarını içeren hücre saflaştırma tekniklerinde [163], [164], [165], [166], Antikorların nötralizasyon özelliklerinin kullanılarak çeşitli toksinlerin vs. elimine edilmesinde (Ör; anthrax letal faktör toksininin elimine edilmesi gibi) [167], Kanser hücrelerinin monoklonal antikorlara dayalı olarak yok edilmesini içeren immünoterapi uygulamalarında (Ör; Rituxan (anti-cd20) ve Herceptin (anti- HER2/neu) ticari monoklonal antikorlarının kullanılarak non-hodgkin s lenfoma ve göğüs kanseri tedavisinde)[168], [169], [170], [171], Monoklonal antikorların kullanıldığı ilaç taşıma ve hedefleme sistemlerinde kullanılmasını içermektedir [171], [172], [173] Leismaniasisin Tanısında Monoklonal Antikorların Önemi Monoklonal antikorlar bazı örnekleri yukarıda özetlenen çok geniş alana yayılmış kullanım alanları içerisinde leishmaniasisin serolojik olarak tanısının koyulması amacıyla geliştirilmiş teknikleri içerisinde de kendine yer bulmuştur. Monoklonal antikorların kullanılmasını içeren leishmaniasis tanı sistemleri serolojik yöntemlerin ana prensibine bağlı olarak olarak iki ana başlıkta toplanmaktadır. Bunlar; Leishmania spesifik antijen belirleme temelli ve Leishmania spesifik antikor belirleme temelli saptama yöntemleridir. 28
46 Antikor Saptanması VL tanısında hastada Leishmania parazitlerine karşı oluşturulmuş antikorların saptanması temeline dayanan tanı sistemleri non-spesifik metotlar olarak uygulanmaktadır. Yükselmiş antikor seviyelerine dayanan bu test sistemleri konağın durumuna göre pozitif değer verebilmektedirler. Spesifikliğin yüksek olmadığı bu sistemlerde aynı zamanda yanlış pozitiflikle sonuçlanan geniş bir duyarlılık ölçeği de görülmektedir [174], [175]. Bu gibi özellikleri antikor saptama temelli tanı sistemlerini güvenilemez hale getirmektedir. VL tanısında kullanılan, insan vücudunun parazitlere karşı oluşturduğu yüksek seviyeli antikorların diğer bazı hastalıklara karşı da yüksek seviyelerde bulunduğunun belirlenmesi [176] araştırıcıları VL hastalarında serolojik tanı yöntemlerinin antijen saptama temelli olarak geliştirilmesine yönlendirmiştir Antijen Saptanması Antijen belirleme temelli yöntemler antikor belirleme temelli serolojik yöntemlerden daha spesifik yöntemlerdir [177], [178]. Bu metot aynı zamanda immün sistem defekti sonucu (Ör. AIDS) antikor üretemeyen leishmaniasis hastalarında daha kullanışlı bir yöntem olarak da göze çarpmaktadır. Ayrıca monoklonal antikorların kullanılarak VL hastalarından alınan örneklerin incelenmesi çalışmalarında bazı Leishmania antijen fraksiyonlarının %96 ile %100arasında bir spesifikliğe sahip olduğu belirlenmiştir [177]. Antijen saptama temelli tanı sistemlerinin, tanı değerine yönelik yapılan bazı çalışmalarda da enfeksiyonun henüz başlamadan hastada tayin edilebilmesine olanak sağladıkları da rapor edilmiştir [179]. Bunlar gibi daha birçok örnekte olduğu gibi göze çarpan avantajlarından dolayı antijen saptama temelli tanı sistemleri giderek geniş alana yayılmaktadır. VL tanısında antijen saptama temelli serolojik tanı sistemleri, hastadaki antijenlerin parazite özgü monoklonal antikorlar vasıtasıyla yakalanarak tespit edilmesi temeline dayanmaktadır. Bu test sistemleri Competitive sandwich ELISA, new latex agglutination test (KATEX) [142], [143] gibi çeşitli sistemlerdir. Bu gibi sistemlerin gösterdiği yüksek spesifiklik ve duyarlılık, araştırıcılar tarafından L. infantum gibi enfeksizyöz ajanlara karşı geliştirilmiş ve halen geliştirilmekte olan tür spesifik monoklonal antikorların tanı sistemlerinde ve giderek artan bir uygulama alanlarında kullanılmalarına yol açmaktadır. 29
47 BÖLÜM 3 DENEYSEL ÇALIŞMALAR 3.1 MATERYAL Ekipman Steril hücre kültür odası Hava akımlı kabinler (Laminar flow -Thermo Scientific Hera safe, Faster BH- EN 2006) Karbondioksitli inkübatör (New Brunswick scientific CO C, FrioCell C) İnverted mikroskop (Olympus CKX41) Işık mikroskobu (Olympus) Santrifüj (Eppendorf, Thermo Micromax RF) Manyetik karıştırıcı (Heidolph MR3000) ph metre (HANNA instruments) Hassas terazi (Precisa Gravimetrics AG) Buz makinesi (Scotsman AF100) Vortex (LMS(laboratuvary medical supplies) VTX-3000L) Su banyoları (GFL (gesselschaft für labortechnik) mbh, Kerman) Isıtıcılı karıştırıcı (Heidolph instruments) ELISA çoklu plak yıkama cihazı (Thermo) 30
48 SDS-PAGE jel elektroforez sistemi (Hoefer) Güç kaynağı (Hoefer) Dondurucular (Beko(+4,-20 C), Arçelik(+4,-20 C), GFL(-40 C)) -195 C azot tankı ve azot taşıma tankları (DMC air liquid systems) Otoklav (Kerman, HIRAYAMA) UV-spektrofotometre (Jasco V-530) ELISA çoklu plak okuyucusu (spektrometre) (Thermo) Saf su ve ultra saf su sistemleri (GFL2104) Blotlama cihazı (Hoefer) Fraksiyon ayırım makinesi, (Fraction Collector BİO-RAD) 10, 50, 100, 1000 µl lik mikropipetler (Thermo, Pippetman) 100,300 µl lik çok kanallı pipetler (Thermo) 1-10, , μl lik tek kullanımlık pipet uçları (AxyGen) Santrifüj tüpleri -1, 2, 15, 50 ml. (Eppendorf, IsoLAB) ELISA 96 kuyulu plakları (TPP) Hücre kültürü plakları (TPP) Hücre kültür flaskları -25 cm 2, 75 cm 2 (TPP, Corning) Serolojik pipet tabancası (Thermo) Serolojik pipetler -1,5,10 ml (Blau Brand Germany) Steril pastör pipeti -3ml (LP ITALIANA SPA) PVDF membran(thermo) Diyaliz membranı (MWCO 50,000 Thermo) 3M Whatman filtre kâğıdı (Whatman 3MM Chr) Kriyotüpler (TPP) Makas, diseksiyon seti (Müller - Germany) 31
49 Süzgeç (BD Falcon) ml lik otoklavlanabilir cam şişeler (ISOLAB, SCHOTT) Hücre sayımı için thoma lamı (Menzel superior) 1-2, cc lik enjektör (Ayset) 0,22 μm ve 0, 45 μm lik şırınga filtreleri (MILLIPORE, TPP, Sartorius) Lateks eldiven (Broche) Kimyasallar Anti-fare polyvalen-ap konjugatı(sigma) Anti-fare IgG-AP konjugatı (Millipore) Protein ladder (low range) (Thermoscientific) Anti-fare polivalent immünoglobulin-ap konjugatı (Sigma) Freund complete adjuvan (Sigma) Hidroklorik asit, HCl (Riedel-de Haën) Protein G immün afinite kolonu (Sigma-P7700) BSA bovine serum albümin (Sigma) Tripan mavisi (Biologycal Industry) Yağsız süt tozu (AppliChem) 8-Azaguanin (Sigma) Hipoksantin aminopterin timidin, 50X HAT (PAN) Hipoksantin timidin, 100X HT (Gibco) Polietilen glikol-4000, PEG-4000 (Sigma) Amonyum sülfat, (NH 4 ) 2 SO 4 (merck) Sodyum klorür, NaCl (Sigma) Sodyum bikarbonat, NaHCO 3 (Merck) Glisin, (Fluka) 32
50 Magnezyum klorür, MgCl 2 (Fluka) Çinko Klorür, ZnCl 2 (Fluka) Sodyum azid, NaN 3 (Sigma) Potasyum hidroksit, KOH (Merck) Dipotasyum fosfat, K 2 HPO 4 (Sigma) Monopotasyum fosfat, KH 2 PO 4 (Sigma) Sodyum di hidrojen fosfat mono hidrat, NaH 2 PO 4. H 2 O (Merck) Disodyum hidrojen fosfat, Na 2 HPO 4 (Merck) KCl (Sigma) Akrilamid (Sigma) Trizma-Baz(Sigma) β-merkaptoetanol (Fluka) EDTA (AppliChem) Bromofenol mavisi (amresco) Sodyum dödesil sülfat (SDS) (Sigma) Sükroz (MERCK) Amonyum persülfat (MERCK) N,N,N,N -tetrametil etilendiamin (TEMED) (Sigma) Metanol (Merck) Formalin (Sigma) Mouse immunoglobulin subisotyping Kit (Thermoscientific) Lumi-phos WB kemilüminesasn substrat (Thermoscientific) Tween-20 (MP Biomedicals LLC) Paranitrofenil fosfat (Sigma) RPMI-1640 (Fenol redli ve fenol redsiz) besiyerleri (GIBCO Invitrogen) 33
51 HEPES (AppliChem) FBS-fetal bovine serum (GIBCO Invitrogen) Bis-akrilamid (Sigma) Tris (Sigma) DMSO (AppliChem) Gentamisin (GIBCO) Deneylerde Kullanılan Tampon, Kültür Ortamları ve Kimyasalların Hazırlanışı Tamponlar PBS Tamponu 8 g NaCl, 0,2 g KH 2 PO 4, 1,8 g Na 2 HPO 4.2H 2 O ve 2 g KCl tartılıp distile su eklenerek ph ı 7,4 e ayarlandı, ardından 1 lt ye tamamlanarak süzüldü ve otoklavlandı. PBS-Tween 20 Tamponu Hazırlanan fosfat tamponuna (PBS) %0,05 (hacim/hacim) olacak şekilde tween-20 eklendi. Kaplama Tamponu (ph; 9,6) 1,59 g Na 2 CO 3, 2,93 g NaHCO 3 ve 0,2 g NAN 3 tartılarak ph ı 9,6 ya ayarlandı, ardından distile su ile 1lt ye tamamlandı. Bloklama Çözeltisi 100 ml kaplama tamponuna %2 (ağırlık/hacim) olacak şekilde yağsız süt tozu eklendi. PBS/Tween20/süt tozu PBS/Tween20 çözeltisine %2 (ağırlık/hacim) olacak şekilde yağsız süt tozu eklendi. 34
52 Substrat Tamponu (ph:10,4) 0,02 g ZnCl 2, 0,04 g MgCl 2 ve 1,5 g glisin tartılarak distile su ile çözüldü ph; 10,4 e ayarlandı ve 200 ml ye tamamlandı. Substrat Çözeltisi 25 mg paranitrofenil fosfat 25 ml substrat tamponunda (ph:10,4) çözdürüldü. %50 PEG Çözeltisi (ağırlık/hacim) 10 g PEG-4000 (sigma) 121 C de 10 dk. boyunca otoklavlandı. Ardından 37 C de 10 ml. PBS içerisinde çözülerek 1 er ml halinda 4 C de karanlıkta saklandı. Stok Akrilamid Çözeltisi 29,2 g akrilamid ve 0,8 g bis tartılarak bir miktar distile suda çözüldü. Ardından distile su ile 100 ml'ye tamamlandı. 3 M Tris-HCl Tamponu (ph 8,8) 72,68 g Trizma-baz distile su ile çözüldü. 3N HCl ile ph 8,8 e ayarlandı. Ardından distile su ile 200ml ye tamamlandı 1,5 M Tris-HCl Tamponu (ph 6, 8) 35,35 g Trizma-bazdistile su ile çözüldü. 3N HCl ile ph 6,8 e ayarlandı. Ardından distile su ile 200 ml'ye tamamlandı. %10 SDS 10 g Sodyum dödesil sülfat (SDS) distile su ile 100 ml'ye tamamlandı. %10 Amonyum Persülfat (APS) 0,1 g APS kullanılmadan hemen önce distile su ile 1 ml'ye tamamlandı. 1 x Yürütme Tamponu (25 mm Tris, 192 mm glisin, %0,1 SDS, ph 8.3) 3.03 g tris, 14.4 g glisin ve 1 g sodyum dödesil sülfat (SDS) distile su ile çözüldü. ph 8,3 ayarlandı. Distile su ile 1 lt ye tamamlandı. 35
53 Örnek Yükleme Tamponu 2 ml 1,5 M Tris-HCl (ph 6,8), 0,5 g SDS, 5 g Sukroz, 0,25 ml β-merkaptoetanol ve 5 ml bromofenol mavisi (% 0,5 ağırlık/hacim) distile su ile 50 ml'ye tamamlandı. Bloklama Tamponu 5 g yağsız süt tozu tartılarak % 0.05 tween-20 içeren (hacim/hacim) PBS ile 100 ml ye tamamlandı. Transfer Tamponu 3.03 g tris, 14.4 glisin tartılarak, 200 ml metanol eklendi. Distile su eklenerek ph 8,3 e ayarlandı. Ardından distile su ile 1 lt ye tamamlandı. Protein-G İmmün Afinite Kolon Kromatografisi Bağlama Tamponu 26,7 g NaH 2 PO 4.H 2 O ve 28,4 g Na 2 HPO 4 tartılarak bir miktar distile su eklendi. Ardından ph 7,0 ye ayarlanarak 1 lt ye tamamlandı. Protein-G İmmün Afinite Kolon Kromatografisi Ayırma (elüsyon) Tamponu 7,5 g glisin tartılarak distile su eklenedi. Ardından 2M HCl ile ph ı 2,7 ye ayarlanarak 1lt ye tamamlandı. Protein-G immün afinite kolon kromatografisi dengeleme tamponu (nötralize edici) 121,1g Tris tartılarak distile su eklendi. Ardından 2M HCl ile ph 9,0 a ayarlanarak 1litre ye tamamlandı Besiyerleri Kültür Besiyeri Besiyeri %80 RPMI 1640, %20 fetal bovine serum (FBS), 50 μg/ml gentamisin oranlarında hazırlanarak +4 C de kullanıma hazır ve steril bir şekilde muhafaza edildi. 36
54 Seçici Besiyerleri A) HAT; Hipoksantin aminopterin timidin (50X HAT) supplement (PAN) 1lt. kültür besiyerine 20 ml. olacak şekilde eklendi. Kullanıma hazır ve ışık görmeyecek şekilde steril olarak -20 C de muhafaza edildi. B) HT; Hipoksantin timidin (100X HT) suplement 1 lt besiyerine 10 ml. olacak şekilde eklendi. Kullanıma hazır ve ışık görmeyecek şekilde steril olarak +4 C de muhafaza edildi. Dondurma Besiyeri %80 FBS, %10 RPMI-1640 ve %10 DMSO olacak şekilde hazırlandı Deneylerde Kullanılan Deney Hayvanları Füzyon çalışmaları için istenen antijene olumlu immün cevap verebilen 6-8 haftalık dişi Balb/c fare ırkları hibridoma ve immünizasyon çalışmalarında lenfosit donörü olarak kullanıldı Deneylerde Kullanılan Hücreler Myeloma Hücre Hattı Hibridoma çalışmalarında Ege Üniversitesi Biyomühendislik Bölümü Hayvan Hücre Kültürü Laboratuvarı sorumlu öğretim üyesi Sayın Prof. Dr. S.İsmet Deliloğlu Gürhan tarafından temin edilen P3-X63-Ag8.653 myeloma hücre hattı kullanıldı. Antikor üreten lenfosit hücreleri Periyodik olarak immünize edilmiş Balb/c farelerin dalak lenfosit hücreleri füzyon çalışmalarında antikor kaynağı hücreler olarak kullanıldı. Besleyici tabaka olarak fare periton makrofajları Füzyon sonrası destekleyici katman olarak Balb/c farelerin periton bölgesinden izole edilen makrofaj hücreleri kullanıldı. 37
55 J774 makrofaj hücre hattı Hibridoma hücrelerinin sınırlayıcı dilüsyonları sırasında destekleyici metabolit sağlayıcı olarak J774 makrofaj hücre hattı kullanıldı. Antijen eldesinde kullanılan Leishmania parazitleri İmmünizasyonda kullanılmak üzere antijen elde etmek amacıyla L. infantum (MONI/EP126) parazitleri hücre antijen kaynağı olarak kullanıldı. 38
56 3.2 METOT L. infantum (MONI/EP126) Suşunun Kriyobanktan Çıkarılması Sıvı azot tankından çıkartılan hücreler 27C su banyosunda çalkalanarak çözdürüldü. Çözdürülen hücre süspansiyonunun, 5 ml RPMI 1640 (%10 FBS) besiyeri bulunan flasklara ekimi yapıldı L. infantum (MONI/EP126) Promastigot Kültürünün Yapılması L. infantum parazitlerinin kültürü 27C etüvde (Friocell, 111) RPMI 1640 besiyeri kullanılarak gerçekleştirildi. Parazitlerin gelişimi ve morfolojik durumu inverted mikroskopta (Olympus CKX41) incelendi. Kültürün pasajı haftada bir kez yeni flaska 5 ml besiyeri eklenerek üzerine 2x10 5 parazit/ml olacak şekilde kültürden parazit eklenerek yapıldı (şekil 3.1). Şekil 3.1 MONI/EP126 L. infantum parazitlerinin kültürdeki durumu (20X) Parazitlerin Thoma Lamında Sayımı Kültür ortamındaki hareketli parazitleri fikse etmek amacı ile kültürden alınan 100µl örneğin üzerine 1:1 oranında %2 lik formalin eklendi ve 5 dakika bekletildi. Daha sonra fikse edilen hücrelerin Thoma lamında (Menzel superior) sayımı aşağıdaki formül kullanılarak yapıldı: 39
57 Parazit sayısı (1ml) = Ortalama hücre sayısı x Sulandırma katsayısı x Thoma lamı sabiti Ortalama hücre sayısı: Thoma lamının alt ve üst kamaralarında bulunan 16 karedeki hücrelerin aritmetik ortalaması Sulandırma katsayısı: Stoktan alınan hücrelerin sayımı için yapılan sulandırma katsayısı Thoma lamı sabiti: P3-X63-Ag8.653 Myeloma Hücrelerinin Kriyobanktan Çıkarılması Sıvı azot tankından çıkartılan P3-X63-Ag8.653 myeloma hücreleri 37 C su banyosunda hızlı bir şekilde çözündürüldü. Hücreler 15 ml lik santrifüj tüplerine aktarılarak üzerlerine 37 C de ısıtılan RPMI 1640 besiyerinden 5 ml ilave edildi. Hücreler daha sonra 700 rpm de 5 dakika santrifüj edildi. Süpernatant uzaklaştırıldı ve pellete 5 ml RPMI-1640 (%10 FBS) eklenerek hücreler yeniden süspanse edildi. Süspanse hale getirilen hücreler 25 cm 2 lik kültür flasklarına hücre/ml olacak şekilde transfer edildi ve 37 C de %5 CO 2 ve %98 nem içeren etüvde kültüre edildi P3-X63-Ag8.653 Myeloma Hücrelerinin Kültürünün Yapılması Kültüre alınan P3-X63-Ag8.653 myeloma hücrelerinin besiyerleri 2-3 günde bir gerekli miktarda değiştirilerek inverted mikroskop (Olympus) ile gelişimleri takip edildi. Tripan mavisi ile hücre sayımları yapılan hücrelerin 5x10 5 hücre/ml yoğunluğuna ulaştığında pasajları gerçekleştirildi (Şekil 3.2). 40
58 Şekil 3.2 Log faz P3-X63-Ag8.653 myeloma hücreleri (20X) P3-X63-Ag8.653 Myeloma Hücrelerinin Aminopterin Hassasiyetlerinin Sağlanması Gelişimleri takip edilen hücrelerin füzyonu sonrası HAT seçici besiyerinde aminopterin hassasiyetlerinin sağlanması amacıyla kültür ortamına 8-azaguanin (20μg/ml) eklenerek kültüre devam edildi (Şekil 3.3). Şekil azaguaninden 1 gün sonra hücrelerin durumu(40x) Aminopterin hassasiyeti sağlanan hücrelerin kültür ortamında bulunan 8-azaguanin füzyon işleminden en az 2 hafta önce kültür ortamından arındırıldı. P3-X63-Ag
59 myeloma hücreleri füzyon aşamasına yakın pasajları yapılarak füzyon aşamasında >%95 canlılıkta ve log fazında olmaları sağlandı Füzyon Sonrası Besleyici Hücrelerin Hazırlanması Fare Periton Makrofajlarının Besleyici Hücre Olarak Elde Edilmesi Periton makrofaj hücreleri füzyondan bir gün önce hazırlandı. Fare sakrifiye edilmeden önce 5 ml lik enjektör 3 ml soğutulmuş RPMI 1640 ile doldurularak 18G iğne enjektöre takıldı. Fareden alınacak makrofaj hücrelerinin enjektör yüzeyine tutunmasını engellemek amacıyla besiyeri içeren enjektör soğuk ortamda muhafaza edildi. Ardından fare yüksek dozda eter inhalasyonu ile sakrifiye edildi ve %70 lik alkol ile dezenfekte edildi. Steril kabin içerisinde sırt üstü yatırılan farenin karın bölgesi steril pens ve makas yardımıyla yanlara ve yukarı doğru açıldı ve sabitlendi. Açığa çıkan periton bölgesinin uygun ve kontaminasyona sebep olmayacak bir bölgesinden içeri soğutulmuş RPMI 1640 besiyeri organlara değmeden dikkatli bir şekilde dolduruldu (şekil 3.4). Şekil 3.4 Fare peritonel makrofajların alınması Besiyeri periton içerisine iyice dağıtıldıktan sonra enjektöre geri çekildi. Enjektör içindeki periton makrofaj hücreleri soğutulmuş HAT besiyeri ile süspanse edildi. Oda sıcaklığında 1000 rpm 5 dk. santrifüj sonrası süpernatant uzaklaştırılarak hücrelerin sayımı gerçekleştirildi. Tripan mavisi ile hücre sayımı sonrası hücre/ml olacak şekilde süspanse edilen hücreler çalışılacak hücre kültür plağı sayısına bağlı olarak, her kuyuya 100 μl besiyeri olacak şekilde dağıtıldı. Ardından plaklar 37 C lik %5 CO 2 ve 42
60 %98 nem koşullarındaki inkübatörde (New Brunswick scientific CO C) kültüre edildi Besleyici Besiyeri Hazırlanması Amaçlı J774 Makrofaj Hücre Kültürünün Elde Edilmesi Sıvı azot tankından çıkartılan J774 makrofaj hücreleri 37C su banyosunda çözdürüldü ve 5 ml RPMI 1640 (%10 FBS) besiyeri bulunan flasklara 1 x 10 5 hücre/ml olacak şekilde ekimi yapılarak, %5 CO 2 içeren etüvde (New Brunswick scientific CO C) 37 C de kültüre alındı. 48 saat sonra kültür ortamındaki 5 ml besiyerinin 2,5 ml si dökülerek yerine taze besiyeri eklendi. Yeterince çoğalan 25 cm 2 lik steril kültür flasklarındaki hücreler pipetleme yardımı ile yüzeyden ayrıldı ve RPMI 1640 (%10 FBS) içeren 15 ml lik santrifüj tüpü içerisinde 1000 rpm de 5 dakika santrifüj edildi. Süpernatant dökülerek dipteki hücre pelletinden tripan mavisi ile makrofaj sayımı yapıldı ve yeni flask içindeki 5 ml besiyerinde 1x10 5 hücre/ml makrofaj olacak şekilde ekim yapıldı (şekil3.5). Şekil 3.5 Log faz J774 fare makrofaj hücreleri (20X) J774 Makrofaj Hücre Kültüründen Destekleyici Besiyerlerinin Toplanması Kültürün durumu her gün inverted mikroskop (Olympus) ile incelendi. Yüzey kaplamasını tamamladığı tespit edilen makrofaj kültürleri süpernatantların toplanması amacıyla üzerlerine yeni besiyeri eklenmeden 48 saat boyunca kültüre edildi. 48 saat sonunda kültürlerden elde edilen besiyerleri 1500 rpm de 10 dk santrifüj edilerek 0,45 43
61 μm lik filtre (Millipore) ile süzüldü ve +4 C de aktiviteleri kaybolmadan 2 ay kadar saklandı [180] Parazitlerden Antijen Elde Edilmesi ve Miktarının Belirlenmesi Thoma lamında sayımları yapılan L. infantum parazitleri 15 ml lik santrifüj tüpüne alınarak 3 kez PBS 2000 rpm de 10 dk. yıkandı. Yıkanan parazitlerin üzerine dh 2 O eklenerek sıvı azotta 5 dk. boyunca dondurularak çözdürüldü. Bu işlem 6 kez tekrarlandı. Elde edilen antijen çözeltisinin içerdiği protein miktarı spektrofotometrik olarak belirlendi. Seyreltilen protein çözeltisinin 280nm (A 280 ) ve 260nm (A 260 ) dalga boylarındaki absorbansları ölçülü. Protein miktarının belirlenmesinde aşağıdaki formül kullanıldı: Protein derişimi (mg/ml): (1.5x A x A 260 )x sulandırım katsayısı Sulandırma katsayısı: Ölçüm için yapılan sulandırma katsayısı A 280 : Protein çözeltisinin 280 nm dalga boyunda gösterdiği absorbans değeri A 260 : Protein çözeltisinin 260 nm dalga boyunda gösterdiği absorbans değeri Fare Deneyleri Balb/c Farelerin L. infantum Tüm Parazitleri ile İmmünizasyonu 6-8 haftalık Balb/c fareler ilk enjeksiyon için PBS içerisinde çözündürülen antijen complete Freund adjuvant ile sonraki injeksiyonlar için ise saf antijen halinde enjekte edildi. İmmünizasyon prosedürü belirli aralıklarla en az 4 defa gerçekleştirildi (çizelge 3.1). Çizelge 3.1 Deney gruplarının immünizasyon tarihleri 1. İmmünizasyon İmmünizasyon İmmünizasyon İmmünizasyon Dondurup çözme ile parçalanmış 100 µg L. infantum paraziti ilk immünizasyon için complete Freund adjuvanı ile birlikte emülsifiye edilerek 6 haftalık farelere intraperitonal olarak yaklaşık 200 μl kadar enjekte edildi. Bundan sonraki 44
62 immünizasyonlar için çözünmüş tüm parazit antijenleri saf olarak PBS içerisinde çözündürülerek kullanıldı. Negatif kontrol olarak PBS ve adjuvan 1:1 oranında karıştırıldı ve fareye intraperitonel olarak injekte edildi. İkinci ve dördüncü immünizasyonlardan 7 gün sonra farelerde L. infantum parazitlerine karşı oluşan immun cevabın seviyesini ölçmek için fare kuyrukları steril makas ile 0.5 cm kesilerek kan alındı μl kan toplanarak içlerinde 75 µl EDTA bulunan santrifüj tüplerine aktarıldı. Alınan kanların serumları 3000 rpm de 5 dk. santrifüj ile ayrılarak oluşan antikor cevabın kontrolü indirekt ELISA metodu ile gerçekleştirildi. En yüksek antikor cevabını veren ikinci fare seçilerek füzyondan 3 gün önce adjuvansız yarım doz (50 µg) antijen ile intraperitonel ve intravenöz olarak immunize edilerek füzyon çalışmaları için hazır hale getirildi İndirekt ELISA Testi ile İmmünizasyon, Çapraz Reaksiyon ve Pozitif Kuyuların Kontrolü İmmünizasyon, pozitif kuyuların kontrolü ve çapraz reaksiyon testleri için ELISA testinde kullanılacak promastigotlar kültür ortamından alınarak sayımı yapıldı ve 2000 rpm de 8 dk. santrifüj edildi. Steril PBS ile 1:40 oranında sulandırılan promastigotlar sıvı nitrojen tankına daldırılarak 5 dk. boyunca 5 kez dondurulup ve 37 C lik su banyosunda çözüldü rpm 15 dk. santrifüj sonrası ayrılan supernatant 280 nm de protein miktarı belirlenerek ELISA testi için kullanıldı. Solüsyon içerisindeki antijen miktarı 5 µg/ml olacak şekilde ayarlandıktan sonra L. infantum parçalanmış bütün promastigot antijenleri [181] 96 kuycuklu ELISA plaklarına kaplama tamponu içerisinde 100 μl olacak şekilde kaplanıp +4 ºC de bir gece inkübasyona bırakıldı. Çapraz reaksiyon testleri için ise kuyular kaplama tamponu içerisinde %5 BSA, %2 yağsız süt tozu ve %1 fare serumu ile kaplandı. Ertesi gün plaklar %0,05 tween 20/PBS (hacim/hacim) tamponu ile 3 kez yıkanarak %2 süt tozu/kaplama tamponu (ağırlık/hacim) olarak hazırlanan yağsız süt tozu bloklama çözeltisi bütün kuyulara 150 μl kadar eklendi ve 37 ºC de bir saat inkübe edildi. İnkübasyon sonrası %0,05 Tween20/PBS (hacim/hacim) ile 3 kez gerçekleştirilen yıkama işleminin ardından hibridoma hücre süpernatantı veya 1/100, 1/300, 1/600 oranlarında %2 süt tozu/pbstween 20 (ağırlık/hacim) içerisinde sulandırılmış fare serumundan kuyulara 100 er μl eklenerek 37 ºC de bir saat bekletildi. Plaklar %0,05 tween 20/PBS (hacim/hacim) ile tekrar 3 kez yıkandıktan sonra, 1/1000 oranında %0,05 tween 20/PBS (hacim/hacim) ile seyreltilmiş anti-fare polivalent antikor-ap eklenerek 37ºC de bir saat inkübe edildi. Bu 45
63 işlemden sonra 5 kez %0,05 tween 20/PBS (hacim/hacim) ile tekrar yıkananan plaklara 1 mg/ml PNPP substrat tamponu çözeltisi eklendi. Plaklar oda sıcaklığında karanlıkta bırakıldı. Oluşan renk değişimi, ELISA okuyucusu ile 405 nm de 30 dakika ve bir saatlik okumalar gerçekleştirilerek belirlendi Füzyon Deneyleri İmmünize Olmuş Fareden Dalak Hücrelerinin Eldesi Çözünmüş tüm parazit antijen lizatı ile bağışıklanan fareler arasında en yüksek antikor yanıtı veren fareye füzyondan üç gün önce hatırlatma amacı ile adjuvansız yarım doz (50 µg) antijen-pbs süspansiyonu intraperitonal olarak enjekte edildi. Füzyon günü fare kapalı bir cam kabın içinde yüksek dozda dietil eter inhalasyonu ile sakrifiye edildi. %70 etanol ile yıkanarak diseksiyon tahtasına yatırılan farenin steril pensler ile derisi göğüs bölgesinden ayrıldı ve steril makas ile kesildi. Kesilen deri sıyrılarak diseksiyon tahtasına tutturuldu. Başka bir steril pens ve makas ile farenin periton boşluğu açılarak karın bölgesinin sol alt kısmından dalak çıkartıldı. 5 ml RPMI 1640 içeren 60 mm petri kabına koyulan dalaktan yağ ve diğer tutunan dokuların steril makas ve pens ile uzaklaştırıldı. Dalak steril şekilde 5 ml RPMI 1640 içeren 100 mm petri kabına alındı. 3 cc şırınga 1 ml RPMI 1640 ile dolduruldu ve dalağa birkaç bölgeden enjekte edilip petri kabı içerisinde yıkanarak organ içerisinde kalmış fazla kan uzaklaştırıldı. Ardından steril makas ile dalak 3 bölgeye ayrılarak 70 µm lik filtre içerisinde steril bir şırınganın tersi ile sadece fibröz doku kalana kadar ezildi (şekil 3.6). 46
64 Şekil 3.6 İmmünize Balb/c faresinden alınan dalaktan lenfosit izolasyonu Ardından filtre 2 ml RPMI 1640 ile yıkandı. Dalak hücrelerinin bulunduğu süspansiyon 15 ml lik santrifüj tüpüne alındı ve 3 dakika oda sıcaklığında bekletildi. Santrifüj tüpünün üzerindeki %95 lik kısım yeni bir santrifüj tüpüne alındı. Tripan mavisi ile boyanarak hücre sayımı yapıldı ve canlı hücre yüzdesi hesaplandı Tripan Mavisi ile Hücrelerin (Myeloma, Peritonel Makrofaj, J774 Makrofaj ve İmmün Dalak Hücreleri) Sayımı ve Canlılık Tayini Hücre süspansiyonunda ml de bulunan hücre sayısını ve hücre canlılıklarını hesaplamak için üzerinde alt ve üst kamaralarda olmak üzere çizgilerle 16 büyük kareye ayrılmış 1 mm 2 lik alan ve 0,1 mm derinliğe sahip bölgeler bulunduran Thoma lamı kullanıldı [182] (Şekil 3.7). Şekil 3.7 Thoma lamı üzerindeki yivler 47
65 Myeloma, peritonel makrofaj, J774 makrofaj hücreleri ve immün dalak hücreleri belirli oranlarda süspanse edildikten sonra tripan mavisi solüsyonundan (Biologycal Industry, ) 50 µl, PBS çözeltisinden 48 µl ve hücre süspansiyonundan 2 µl alınarak süspanse edildi. Süspansiyondan yaklaşık 20 µl alınarak lamel ile örtülmüş Thoma lamına yayıldı. İnverted mikroskop kullanılarak Thoma lamının alt ve üst kamaralarındaki 16şar büyük karedeki boyanmamış tüm hücreler sayılıp aritmetik ortalamalar alındı ve hücrelerin canlılıkları hesaplandı. Daha sonra aşağıdaki formül ile hücre sayısı hesaplandı; Hücre sayısı (1ml) = Ortalama canlı hücre sayısı x Sulandırma katsayısı x Thoma lamı sabiti Ortalama hücre sayısı: Thoma lamının alt ve üst kamaralarında bulunan 16 karedeki canlı hücrelerin aritmetik ortalaması Sulandırma katsayısı: Stoktan alınan hücrelerin sayımı için yapılan sulandırma katsayısı Thoma lamı sabiti: İmmun Dalak Hücrelerinin Myeloma Hücreleri ile Füzyonu Fareler sakrifiye edilmeden hemen önce, myeloma hücrelerinin canlılık yüzdesi tripan mavisi ile saptandı ve >%95 canlılıktaki P3-X63-Ag8.653 myeloma hücreleri 50 ml lik santrifüj tüpüne aktarıldı. Ardından dalak hücrelerinin bulunduğu süspansiyon tripan mavisi ile sayılarak 1x10 8 canlı dalak hücresi 15 ml lik santrifüj tüpüne alındı. Myeloma hücreleri 50 ml RPMI 1640 ile 1000 rpm de 5 dakika santrifüj edilerek 2 kere yıkandı ve 5 ml RPMI 1640 ile resüspanse edildi. 50 ml lik santrifüj tüpündeki myeloma hücrelerine dalak hücreleri eklenerek tüp RPMI 1640 ile dolduruldu. Süspansiyon 1000 rpm de 5 dk. oda sıcaklığında santrifüj edildi. Hücre pelleti 50 ml RPMI-1640 ile yıkanarak tekrar santrifüj edildi. Hücre pelleti 37 C lik karıştırmalı su banyosunda 2 dakika ısıtıldı. Tüpe hafifçe vurarak pellet çözdürüldü. Bu aşamadan sonra %50 PEG (polietilen glikol) 4000 solüsyonu ile füzyon aşamasına geçildi. Bu aşama kritik bir safha olduğu için kronometre kullanılarak aşağıdaki füzyon prosedürü izlendi; 48
66 Hücre Füzyonu Dalak ve P3-X63-Ag8.653 hücreleri ile steril %50 PEG solüsyonu; İlk 1. dk. boyunca tüp içerisine 1 ml %50 PEG 37 C de eklendi ve yavaşça karıştırıldı. Sonraki 2.dk. boyunca rpm de santrifüj edildi. Sonraki 3 dk. boyunca ml RPMI 1640 yavaşça eklendi. Sonraki 2 dk. boyunca ml RPMI 1640 yavaşça eklendi. Tüp tamamen RPMI 1640 ile dolduruldu. 700 rpm. de 5 dakika oda sıcaklığında santrifüj edildi. Süpernatant atıldı ve hücre pelleti 35 ml HT medyum ile süspanse edildi. Hücre süspansiyonu 37 C de, %5 CO 2 ve %98 nemli CO 2 inkübatörde 30 dk. inkübasyona bırakıldı. Şekil 3.8 Füzyon sonrası hücrelerin kültürdeki durumu (20X) Füzyon Yapılan Hücrelerin Ekimi ve Kültürü İnkübatörden alınan hücre süspansiyonu resüspanse edilerek 24 saat öncesinden 1x10 4 fare peritonal makrofajları ekilmiş 96 kuyucuklu plakların iç taraftaki 60 kuyucuğun her birine 100 μl hücre süspansiyonu olacak şekilde eklendi. Dışarıdaki 36 kuyucuk antibiyotikli PBS ile doldurularak 37 C, %5 CO 2 ve %98 nemli CO 2 inkübatörde inkübasyona bırakıldı. Kültürün 5. günü 100 μl HAT medyum her bir kuyucuğa eklendi. 49
67 Kültürün 5. gününden sonra hibrid hücrelerin HAT besiyerinde küçük koloniler şeklinde bölünerek gelişmeye başladıkları gözlendi (şekil 3.9). Şekil gün sonra hücrelerin HAT içeren kültürdeki durumu (20X) Kültürün 7. günü her bir kuyucuktan 100 μl alındı ve taze 100 μl HAT medyum eklendi. Bu kısım hibrid hücreler yüzeyin %10-50 sini kaplayana kadar tekrar edildi. Gelişimlerini sürdüren hibrid hücrelerin HAT medyumunda 2 hafta boyunca kültürleri devam ettirildi. 2 hafta sonra besiyeri HT medyumu ile değiştirildi. Hibrid ler klonlama prosedürleri tamamlanana kadar HT besiyeri ile büyütüldü. Füzyon sonrası elde edilen monoklonal antikor üreten hibrid hücrelerin belirlenmesi için indirekt ELISA yöntemi kullanıldı. Şekil 3.10 Hücrelerin 10 gün sonra kültürdeki durumu (20X) 50
68 Sınırlayıcı Sulandırma Yöntemi ile Hibridoma Hücre Hatlarının Alt Klonlarına Ayrılması ELISA yöntemiyle pozitif reaksiyon veren ve monoklonal antikor ürettiği belirlenen hibrid hücrelerin tek klondan oluşan soyunu elde etmek için klonlanacak hibridoma hücreleri kuyucuk başına 0.8 hücre düşecek şekilde hesaplanarak HT besiyeri ile seyreltildi. İlk adımda ml de 8 hücre olacak şekilde 100 μl dilüsyon ilave edildi (0.8 hücre/kuyucuk). Bunu takiben diğer bir plağa da ml de 80 hücre olacak şekilde 100 μl dilüsyon ilave edildi (8 hücre/kuyucuk). Bu dilüsyon, yapılan istatistiki çalışmalara göre kuyucukların %36 sında kuyucuk başına 1 hücrenin düşmesini sağlar [182]. Ardından sınırlayıcı sulandırma ile seyreltilen hücre süspansiyonlarına J774 ile 48 saat inkübe edilmiş kültür süpernatantları %25 oranında eklenerek 48 kuyucuklu plaklara 0,3 ml olacak şekilde aktarıldı ve 37 C, %5 CO 2 ve %98 nemli CO 2 inkübatörde inkübe edildi. İnkübasyonun 6. gününde, kuyucuk başına 150 μl olacak şekilde %25 J774 süpernatantı ilaveli taze besiyeri eklendi. Bundan sonraki hergün her kuyucuktan 150 μl eski besiyeri alınarak yerine 150 μl taze besiyeri ilave etmek suretiyle hücreler yeniden beslendi. Tam olarak kalıcı hücre hattı elde edildiğinde, hibrid hücrelerin kültürü myeloma hücre hattına benzer şekilde RPMI 1640 besiyerinde büyük ölçeklerde (25 cm 2, 75 cm 2 flask) sürdürüldü (şekil 3.11) ve hücreler daha sonra sıvı nitrojen tankında saklandı. Şekil 3.11Hibridoma kültürünün büyük ölçekli kültürdeki durumu (20X) 51
69 Hibridoma Hücre Hatlarının Dondurulması ve Geri Kazanımı Hibridoma Hücre Hatlarının Dondurulması Sınırlayıcı sulandırma çalışmalarından önce ELISA pozitif sonuç veren kuyulardaki ve daha sonraki çalışmalarda büyük ölçeğe alınan hibridoma hücreleri pipetle steril santrifüj tüplerine aktarılıp +4C de 1000 rpm de 5 dk., santrifüj edildi. Santrifüj edilen tüplerdeki pellet süspanse edildi ve son hacime eşit miktarda, %20 DMSO içeren dondurma solüsyonu yavaşça ilave edilerek kriyo tüplere aktarıldı. Kriyo tüpler +4C de 1 saat, 20C de 2 saat kaldıktan sonra, 40C derin dondurucuda 24 saat bekletildi, 24 saat sonunda sıvı nitrojen tankına aktarıldı Hibridoma Hücre Hatlarının Kriyobanktan Çıkarılması Hücreler 37 C su banyosunda hızlı bir şekilde çözündürüldü. Kriyotüplerin üst kısmı alkollü bir bez ile iyice temizlendi. Daha sonra hücreler 15 ml lik santrifüj tüplerine aktarılarak üzerlerine 37 C de ısıtılan RPMI 1640 besiyerinden 5 ml ilave edildi. Hücreler daha sonra 700 rpm de 5 dakika santrifüj edildi. Süpernatant uzaklaştırıldı ve pellete 5 ml RPMI 1640 eklenerek hücreler yeniden süspanse edildi. Süspanse hale getirilen hücreler 25 ve 75 cm 2 lik kültür flasklarına transfer edildi ve 37 C de %5 CO 2 ve %98 nem içeren etüvde inkübe edildi Üretilen Antikorların Western Blot Yöntemiyle Antijen Spesifikliğinin Belirlenmesi SDS-Page Jel Elektroforezi Sınırlayıcı sulandırma yöntemi ile alt klonlarına ayrılan hibridoma hücre hattının ürettiği antikorların L. infantum parazitlerinde hangi proteine karşı reaksiyon verdiğinin saptanması amacıyla antikorlara western blot yöntemi uygulandı. Öncelikle jelin döküleceği camlar %70 alkol ile temizlendi ve jel kaseti hazırlandı. Önce jelin ayırıcı kısmı çizelge 3.2 de belirtilen miktarlarda hazırlanarak kasete döküldü ve hava ile teması engellemek üzere jel yüzeyi 1 ml distile su ile kapatıldı. Polimerizasyon tamamlandıktan sonra yüzeydeki su uzaklaştırıldı ve üzerine yine çizelge 3.2 de belirtilen miktarlarda hazırlanmış yükleme jeli dökülerek tarak yerleştirildi. 52
70 Çizelge 3.2 SDS-PAGE yöntemi için dökülecek jelerin hazırlanışı %12 lik ayırıcı jel %4lük Yükleme jeli Saf Su 4.65ml 7.35 ml 3M Tris-HCl ph ml - 1.5M Tris-HCl ph6.8-1,25 ml %10(ağırlık/hacim) SDS 0.1 ml 0,1 ml Akrilamid/Bisakrilamid (%29,2/% ml 1.34 ml ağırlık/hacim) %10 amonyum persülfat (APS) 0,05ml 0.04 ml TEMED 7µl 15µl Polimerizasyon sonunda tarak dikkatlice çıkarıldı ve jel distile su ile yıkanarak elektroforez aletine (Hoefer) yerleştirildi ve sistem yürütme tamponu ile dolduruldu. Örnek yüklenmeden önce tüm cepler yükleme tamponuyla yıkandı. Western Blot testinde kullanılacak promastigotlar kültür ortamından alınarak sayımı yapıldı. Ardından 3x10 8 kadar L. infantum promastigotu 2000 rpm 8 dk. santrifüj edildi. Promastigotlar sıvı nitrojen tankında 5 kez dondurulup çözüldükten sonra rpm 15 dk santrifüj sonrası ayrılan supernatantın UV spektrometrede protein miktarları ölçülerek kuyu başına 30 ug protein düşecek şekilde 1:1 oranında örnek yükleme tamponu ile karıştırılıp 5 dakika boyunca 100 C de denatüre edildi. Denatüre edilen örnekler jeldeki her bir kuyucuğa 30 ul kadar yüklendikten sonra yaklaşık 40 dk. 200 voltta elektroforez işlemi gerçekleştirildi. Bromofenol mavisine ait bant jelin alt kenarına ulaştığında akım kesildi ve jel elektroforez tankından ve kasetten ayrılarak blotlama işlemleri için hazırlandı Western Blotlama 1 Örneklerin bulunduğu jel metanol içerisinde bekletilerek doyuruldu. Ardından jel ile aynı boyutlarda olmak üzere 6 adet 3M whatman kağıdı ve bir adet PVDF membran kesildi ve transfer tamponu içerisinde bir süre bekletilerek doyuruldu. Blotlama cihazına sırasıyla transfer tamponu ile ıslatılmış 3 adet whatman kağıdı, jel, membran ve en üste tekrar 3 adet whatman kağıdı arada hava kabarcığı kalmayacak şekilde konularak sistem hazırlandı. Blotlama yapılacak jelin alanı cm 2 cinsinden hesaplanarak 0,8 ile çarpıldı ve bulunan rakam güç kaynağına miliamper cinsinden yazıldı. 30 dk. kadar blotlama işlemi uygulanarak proteinler PVDF membrana aktarıldı. Blotlama işleminden sonra PVDF 53
71 membrana markerların geçip geçmediği kontrol edilerek membran sistemden ayrıldı. Transfer sonrası proteinlerin bağlanmış olduğu membran 1.5 saat bloklama tamponu içinde çalkalamaya bırakıldı. Bu süre sonunda membran 3 kez PBS-tween 20 tamponu ile 15 er dakika boyunca yıkandı. Ardından membran hibridoma hücre kültür süpernatantı ile l saat çalkalamaya bırakıldı. Ardından membran 3 kez PBS-tween 20 tamponu ile 15 er dakika süre ile tekrar yıkandı. Membran bloklama çözeltisi içinde 1:1000 oranında dilüe edilmiş alkalen fosfataz (AP) antikor ile 1 saat oda sıcaklığında inkübe edildi. Bu süre sonunda membran 3 kez kez PBS-tween 20 tamponu ile 15 er dakika süre ile yıkandı. AP işaretli sekonder antikor taşıyan spesifik bantları içeren membran üzerine substrat tamponu (Thermo Lumi-phos) eklenrek 3-5 dakika beklendi. Mavi renk oluşumu gözlenen bant kısımları L. infantum antijen tespiti için incelemeye alındı Antikor İzotiplerinin Belirlenmesi Üretilen antikorların izotiplerinin belirlenmesi bir sonraki aşama olan saflaştırma yönteminin belirlenebilmesi için gerekli olmaktadır. Bu amaçla elde edilen monoklonal antikorun izotipinin belirlenmesi için hibridoma hücre kültür süpernatantı 1:50 oranında sulandırılarak fare immunoglobulin Subisotyping Kit (Thermoscientific) içerisindeki her alt izotipe özgü (IgG 1, IgG 2a, IgG 2b, IgG 3, IgA ve IgM) anti-immünoglobulin emdirilmiş striplerin bulunduğu kasetlerdeki örnek haznelerine eklendi dakika beklendikten sonra kasetlerde bir adet kontrol C hizasında ve bir adet antikorun ait olduğu alt sınıf adının (IgG 1, IgG 2a, IgG 2b, IgG 3, IgA veya IgM) yazılı olduğu bölgenin hizasında iki adet kırmızı bant oluşumu ile alt izotipler belirlendi Monoklonal Antikorların Saflaştırılması Büyük ölçekte üretilen hibridoma hücrelerinden antikor saflaştırılması amacıyla hücre kültür üst sıvıları 1500 rpm de santrifüj edildikten sonra süpernatant 0,45 μm lik filtre (Millipore) ile süzülerek +4ºC de saklandı Amonyum Sülfat Çöktürmesi Hücre kültür ortamından toplanan supernatantın üzerine +4ºC de, bir karıştırıcı üzerinde doygun amonyum sülfat çözeltisi hacimce %33 olacak şekilde 30 dk. lık süre içerisinde eklendi. Bir gece +4ºC de karıştırıldıktan sonra rpm de 30 dk. +4ºC de santrifüj 54
72 edildi. Pellet 20 ml PBS ile çözüldü ve iki gün boyunca PBS tamponu periyodik olarak değiştirilerek +4ºC de diyaliz edildi Protein G İmmün Afinite Kolon Kromatografisi Hibridoma hücrelerinin ürettikleri monoklonal alt izotipleri belirlendikten sonra, immün afinite kolon kromatografisi ile saflaştırma aşamasına geçildi. Protein G afinite kolonu (Sigma) ilk önce 100 ml bağlama tamponu ile yıkandı. Hibridoma hücre kültürü ortamından amonyum sülfat çöktürmesi ve diyaliz ile saflaştırılan hibridoma üst sıvısı 0,45 μl lik filtreden (millipore) geçirildikten sonra ileri saflaştırma için kolon içerisine yüklendi. Ardından kolon bağlama tamponu ile tekrar doldurularak fraksiyonlar 1 er ml lik eppendorf tüplere toplandı. Tüplerin absorbans 280 nm deki değerleri ölçülerek değer 0 olduğunda kolon eleme tamponu ile yüklendi. Bağlı antikorların kolondan çıkmasını sağlayan eleme tamponu tüplerin absorbans değeri tekrar 280 nm yi gösterinceye kadar içlerinde 100 μl dengeleme tamponu içeren eppendorf tüplerde 1 er ml olacak şekilde toplandı. Toplanan fraksiyonlar ELISA ile test edilerek antikor bulunan tüpler saptandı. Ardından saflaştırılan monoklonal antikorlar %0.02 lik (ağırlık/hacim) sodyum azid (NaN 3 ) içerisinde -20ºC de saklandı. 55
73 OD 405 nm BÖLÜM 4 DENEYSEL SONUÇLAR 4.1 İmmünizasyon Kontrolleri Birinci Füzyon Çalışmaları İçin İmmünize Edilen Farelerin Antikor Yanıtları Füzyon deneylerinde kullanılan Balb/c farelerin L. infantum tüm promastigot lizat antijenleri ile ikinci immünizasyonlarından sonra, indirekt ELISA testi ile ölçülen immün cevap seviyeleri şekil 4.1 de verilmiştir. 1,2 1 0,8 0,6 0,4 0,2 0 Kontrol 1. Fare 2. Fare 3. Fare 4. Fare 5. Fare Şekil 4.1 İkinci immünizasyon sonrası Balb/c farelerin immün cevap seviyeleri Şekil 4.1 de görüldüğü gibi immünize edilen tüm farelerin kuyruklarından alınan serumların 1/600 sulandırımda yapılan indirekt ELISA test sonuçlarına göre immünize edilen farelerden alınan antikor seviyesi kontrole göre daha yüksektir. Bu da immünizasyonların başarılı bir şekilde gerçekleştiğini göstermektedir. Ancak en yüksek 56
74 OD 405 nm immün cevap 2 nolu farede belirlendi. Ayrıca 4 nolu farede de yüksek bir antikor cevabı olduğu da belirlenmiştir. Bu nedenle monoklonal antikor eldesi için en yüksek antikor seviyesinin görüldüğü 2 nolu fare seçilmiş ve füzyon deneylerine bu hayvan ile devam edilmiştir. Daha sonraki deneylerde de yine immunizasyon durumlarına göre fare seçimleri yapılmış, deney gruplarının tamamında immunizasyon oluşmasına rağmen yine de en yüksek cevabı veren fare tercih edilmiştir İkinci Füzyon Çalışmaları İçin İmmünize Edilen Farelerin Antikor Yanıtları İkinci füzyon çalışmaları için daha önceden immünize edilen Balb/c fareleri L. infantum tüm lizat antijenleri ile immünize edilmeye devam edilmiş ve dördüncü immünizasyonlardan sonraki antikor seviyeleri şekil 4.2 de verilmiştir. 1,8 1,6 1,4 1,2 1 0,8 0,6 0,4 0,2 0 Kontrol 1.Fare 3. Fare 4. Fare 5.Fare Şekil 4.2 Dördüncü immünizasyon sonrası Balb/c farelerin immün cevap seviyeleri Şekil 4.2 de farelerden alınan serumların 1/600 sulandırmalarında gerçekleştirilen test sonuçlarına göre farelerin tümünde immün yanıt oluştuğu görülmektedir. L. infantum tüm antijen lizatına karşı ELISA sonrasında 4 nolu fareden (OD 405 = 1,58) en iyi immün cevap alınarak ikinci füzyon deneylerinin sonraki adımları için seçildi ve füzyon çalışmaları için hazırlandı. 57
75 OD 405 nm 4.2 Füzyon Sonuçları Birinci Füzyon Sonuçları L. infantum promastigotlarına özgü monoklonal antikor elde edilmesi için farelerin dalaklarından alınan B hücreleri myeloma hücreleri ile PEG 4000 (sigma) varlığında füzyona uğratıldı. Seçici besiyerinde üreme gerçekleşen kuyulara ELISA testi uygulandı. Test sonuçları şekil 4.3 ve şekil 4.4 de gösterilmektedir. 1,6 1,4 1.füzyon 1,2 1 0,8 0,6 0,4 0,2 0 1A 1B 1C 1D 1E 1F 1G 1H Şekil 4.3 Birinci füzyon birinci plaktaki hibridoma hücrelerinin L. infantum antijenine karşı gösterdikleri antikor cevapları Şekil 4.3 de birinci füzyon sonucu elde edilmiş birinci plaktaki hibridoma hücrelerinin L. infantum antijenine karşı gösterdikleri antikor cevapları görülmektedir. ELISA testi ile antikor oluşumu tespit edilen 14 kuyudaki hibridoma hücreleri büyük ölçekli kültüre alındı. 1. Plak 58
76 OD 405 nm 1,4 1,2 1 0,8 0,6 0,4 0,2 0 1.füzyon 2A 2B 2C 2D 2E 2F 2G 2H 2.Plak Şekil 4.4 Birinci füzyon ikinci plaktaki hibridoma hücrelerinin L. infantum antijenine karşı gösterdikleri antikor cevapları Birinci füzyon sonucu elde edilmiş ikinci plaktaki hibridoma hücrelerinin L. infantum antijenine karşı gösterdikleri antikor cevapları görülmektedir. ELISA testi ile antikor oluşumu tespit edilen 20 kuyudaki hibridoma hücreleri büyük ölçekli kültüre alındı. Birinci füzyon sonunda 187 hibrid oluşumu gözlenen kuyudan antikor aktivitesine sahip 34 kuyu belirlendi. Bu 34 kuyudan en yüksek antikor cevabını veren kuyular arasından antikor salgılamaya devam eden 1 kuyu seçilerek sınırlayıcı sulandırma, Western Blot ve çapraz reaksiyon işlemleri için büyük ölçekte kültüre alındı. Füzyon sonuçları çizelge 4.1 de görülmektedir. Çizelge 4.1 Birinci füzyon sonuçları (*1C2; 1. plak, C-2. kuyu) Lenfosit hücresi 10 8 Myeloma hücresi 10 7 Çalışılan kuyu sayısı 360 Hibridoma oluşan kuyu sayısı 187 Antikor aktivitesi veren kuyu sayısı 34 L. infantum antijenine özgü Oluşan monoklonal antikor 1C2* 59
77 OD 405 nm İkinci Füzyon Sonuçları L. infantum promastigotlarına özgü monoklonal antikor elde edilmesi için immünizasyonlarına devam edilen farelerin 4. immünizasyon sonrası ikinci füzyon deneyleri gerçekleştirilmiş ve seçici besiyerinde (48 kuyulu plakta) üreme gerçekleşen kuyulara indirekt ELISA testi uygulandı. Sonuçları şekil 4.5 ve şekil 4.6 da gösterilmektedir. 1,6 1,4 1,2 2.Füzyon 1 0,8 0,6 0,4 0, Pozitif Negatif Kontrol Kontrol 1.Plak 1A 1B 1C 1D 1E 1F Şekil 4.5 İkinci füzyon birinci plaktaki hibridoma hücrelerinin L. infantum antijenine karşı gösterdikleri antikor cevapları Şekil 4.5 de ikinci füzyon sonucu elde edilmiş birinci plaktaki hibridoma hücrelerinin L. infantum antijenine karşı gösterdikleri antikor cevapları görülmektedir. ELISA testi ile antikor oluşumu tespit edilen 7 kuyudaki hibridoma hücreleri büyük ölçekli kültüre alındı. 60
78 OD 405 nm 2. Füzyon 1,6 1,4 1,2 1 0,8 0,6 0,4 0, Pozitif Negatif Kontrol Kontrol 2. Plak 2A 2B 2C 2D 2E 2F Şekil 4.6 İkinci füzyon ikinci plaktaki hibridoma hücrelerinin L. infantum antijenine karşı gösterdikleri antikor cevapları İkinci füzyon sonucu elde edilmiş ikinci plaktaki hibridoma hücrelerinin L. infantum antijenine karşı gösterdikleri antikor cevapları görülmektedir. ELISA testi ile antikor oluşumu tespit edilen 5 kuyudaki hibridoma hücreleri büyük ölçekli kültüre alındı. İkinci füzyon sonunda 46 hibrid oluşumu gözlenen kuyudan gerçekleştirilen ELISA testleri sonucu yüksek antikor aktivitesine sahip 12 kuyu seçildi ve bu kuyuların kültürleri büyük ölçeğe alındı. Bu 12 kuyudan en yüksek antikor cevabını veren ve antikor salgılamaya devam eden 2 kuyu seçilerek sınırlayıcı sulandırma, Western Blot ve çapraz reaksiyon işlemleri için büyük ölçekte kültüre alındı. Füzyon sonuçları çizelge 4.2 de görülmektedir. Çizelge 4.2 İkinci füzyon sonuçları(*1c3; 1. plak, C-3. kuyu, 2B2; 2. plak, B-2. kuyu) Lenfosit hücresi 10 8 Myeloma hücresi 10 7 Çalışılan kuyu sayısı 96 Hibridoma oluşan kuyu sayısı 46 Antikor aktivitesi veren kuyu sayısı 12 L. infantum antijenine özgü oluşan monoklonal antikor 2(1C3, 2B2) 61
79 OD 405 nm 4.3 Çapraz Reaksiyon Sonuçları Şekil 4.7 de göründüğü gibi 1(1C3) klonun L. infantum promastigotlarına karşı yüksek spesifiklik gösterdiği saptandı. Elde edilen monoklonal antikorların BSA, fare serumu ve süt tozu gibi antijenik yapılara karşı antikor cevabı göstermediği tespit edildi. Bu da elde edilen antikorların çapraz reaksiyonlarının olmadığını göstermektedir. Çapraz reaksiyon testleri sonucu L. infantum promastigotlarına özgü monoklonal antikor üreten üç klon (1C2, 1C3 ve 2B2) dan 1C3 klonu saflaştırma ve izotip analizi işlemleri için büyük ölçekte kültüre alındı. Diğer klonlar dondurma işlemleri gerçekleştirilerek sıvı azot içerisinde saklandı. 1,6 1,4 1,2 1 0,8 0,6 0,4 0,2 0 1C2 1C3 2B2 Şekil 4.7 Genişletilen klonların diğer proteinlerle çapraz reaksiyon testlerinin indirekt ELISA testi ile 405 nm de değerlendirilmesi 4.4 Western Blot Sonuçları Büyük ölçekte üretilen 1C3 klonunun ürettiği antikorun L. infantum antijen spesifikliği Western Blot yöntemi ile belirlendi. Şekil 4.8 de görüldüğü üzere 1C3 klonunun ürettiği antikorlar L. infantum 15 kda proteinine karşı reaksiyon verdiği görülmektedir. 62
80 Şekil 4.8 1C3 Monoklonal antikorunun L. infantum tüm hücre lizat antijenine karşı gösterdiği spesifikliğin western blot analizi ile gösterilmesi 4.6 Monoklonal Antikorların Saflaştırılması L. infantum promastigot antijenlerine özgü monoklonal antikor üreten 1C3 klonu büyük ölçekte üretildikten sonra saflaştırma işlemleri için antikor alt tipi belirlendi (şekil 4.9). Şekil 4.9 1C3 klonunun ürettiği antikorların izotipinin belirlenmesi Şekil 4.9 da görülen kontrol bölgelerinde (C) ve izotipin ait olduğu bölgede daha koyu olarak görülen renk değişimi, antikor tipinin IgG 1 alt sınıfına ait olduğunu göstermektedir. IgG 1 alt sınıfına ait olduğu tespit edilen monoklonal antikorları içeren hücre kültür süpernatantları toplanarak amonyum sülfat ile çöktürüldü, dializleri gerçekleştirildi ve protein G immünafinite kromatografisi ile saflaştırıldı. Kolon sonrası toplanan fraksiyonların 280 nm dalgaboyunda absorbansları ölçülerek içerdiği protein varlığı şekil 4.10 da gösterilmektedir. Şekilde görüldüğü gibi 4, 5, 6, 7, 8, 9, 10, 11, tüpler ve 26, 27, 28. tüplerde protein varlığı tespit edildi. 63
Global Leishmaniasis. Leishmaniasis. Türkiye de leishmaniasis. Leishmaniasis. Leishmaniasis
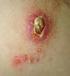 Leishmaniasis Leishmaniasis Leishmaniasis Tropik ve subtropik iklimlerde, Akdeniz bölgesi ülkelerde (88 ülke) görülür Her yıl 1,5 milyon yeni olgu eklenmektedir 350 milyon insan risk altında 23 farklı
Leishmaniasis Leishmaniasis Leishmaniasis Tropik ve subtropik iklimlerde, Akdeniz bölgesi ülkelerde (88 ülke) görülür Her yıl 1,5 milyon yeni olgu eklenmektedir 350 milyon insan risk altında 23 farklı
Yasemin Budama Kılınç1, Rabia Çakır Koç1, Sevim Meşe2, Selim Badur2,3
 Yasemin Budama Kılınç1, Rabia Çakır Koç1, Sevim Meşe2, Selim Badur2,3 1 Yıldız Teknik Üniversitesi, Biyomühendislik Bölümü, 34220, İstanbul 2 İstanbul Üniversitesi, İst. Tıp Fak., Mikrobiyoloji ABD, Viroloji
Yasemin Budama Kılınç1, Rabia Çakır Koç1, Sevim Meşe2, Selim Badur2,3 1 Yıldız Teknik Üniversitesi, Biyomühendislik Bölümü, 34220, İstanbul 2 İstanbul Üniversitesi, İst. Tıp Fak., Mikrobiyoloji ABD, Viroloji
Hidrazon Yapısındaki On Adet Bileşiğin Antileishmanial Aktivitesinin Araştırılması
 Hidrazon Yapısındaki On Adet Bileşiğin Antileishmanial Aktivitesinin Araştırılması Şahin Direkel 1, Seda Tezcan 1, Semra Utku 2, Gönül Aslan 1, Mehtap Gökçe 3, M. Fethi Şahin 3, Nuran Delialioğlu 1, Mahmut
Hidrazon Yapısındaki On Adet Bileşiğin Antileishmanial Aktivitesinin Araştırılması Şahin Direkel 1, Seda Tezcan 1, Semra Utku 2, Gönül Aslan 1, Mehtap Gökçe 3, M. Fethi Şahin 3, Nuran Delialioğlu 1, Mahmut
ADIM ADIM YGS LYS Adım DOLAŞIM SİSTEMİ 5 İNSANDA BAĞIŞIKLIK VE VÜCUDUN SAVUNULMASI
 ADIM ADIM YGS LYS 177. Adım DOLAŞIM SİSTEMİ 5 İNSANDA BAĞIŞIKLIK VE VÜCUDUN SAVUNULMASI İNSANDA BAĞIŞIKLIK VE VÜCUDUN SAVUNULMASI Hastalık yapıcı organizmalara karşı vücudun gösterdiği dirence bağışıklık
ADIM ADIM YGS LYS 177. Adım DOLAŞIM SİSTEMİ 5 İNSANDA BAĞIŞIKLIK VE VÜCUDUN SAVUNULMASI İNSANDA BAĞIŞIKLIK VE VÜCUDUN SAVUNULMASI Hastalık yapıcı organizmalara karşı vücudun gösterdiği dirence bağışıklık
VİROLOJİ -I Antiviral İmmunite
 VİROLOJİ -I Antiviral İmmunite Prof.Dr. Yılmaz Akça Prof.Dr. Feray Alkan Prof.Dr. Aykut Özkul Prof. Dr. Seval Bilge-Dağalp Prof.Dr. M. Taner Karaoğlu Prof.Dr. Tuba Çiğdem Oğuzoğlu DOĞAL SAVUNMA HATLARI-DOĞAL
VİROLOJİ -I Antiviral İmmunite Prof.Dr. Yılmaz Akça Prof.Dr. Feray Alkan Prof.Dr. Aykut Özkul Prof. Dr. Seval Bilge-Dağalp Prof.Dr. M. Taner Karaoğlu Prof.Dr. Tuba Çiğdem Oğuzoğlu DOĞAL SAVUNMA HATLARI-DOĞAL
Edinsel İmmün Yanıt Güher Saruhan- Direskeneli
 Edinsel İmmün Yanıt Güher Saruhan- Direskeneli İTF Fizyoloji AD Doğal bağışıklık Edinsel bağışıklık Hızlı yanıt (saatler) Sabit R yapıları Sınırlı çeşidi tanıma Yanıt sırasında değişmez Yavaş yanıt (Gün-hafta)
Edinsel İmmün Yanıt Güher Saruhan- Direskeneli İTF Fizyoloji AD Doğal bağışıklık Edinsel bağışıklık Hızlı yanıt (saatler) Sabit R yapıları Sınırlı çeşidi tanıma Yanıt sırasında değişmez Yavaş yanıt (Gün-hafta)
VİRUS HASTALIKLARINDA TANI YÖNTEMLERİ
 VİRUS HASTALIKLARINDA TANI YÖNTEMLERİ Doç. Dr. Koray Ergünay MD PhD Hacettepe Üniversitesi Tıp Fakültesi Mikrobiyoloji ve Klinik Mikrobiyoloji Anabilim Dalı, Viroloji Ünitesi Viral Enfeksiyonlar... Klinik
VİRUS HASTALIKLARINDA TANI YÖNTEMLERİ Doç. Dr. Koray Ergünay MD PhD Hacettepe Üniversitesi Tıp Fakültesi Mikrobiyoloji ve Klinik Mikrobiyoloji Anabilim Dalı, Viroloji Ünitesi Viral Enfeksiyonlar... Klinik
I- Doğal-doğuştan (innate)var olan bağışıklık
 I- Doğal-doğuştan (innate)var olan bağışıklık Fagositik hücreler (makrofajlar, mast hücreleri) Kompleman sistemi(direkt bakteri hücre membranı parçalayarak diğer immün sistem hücrelerin bunlara atak yapmasına
I- Doğal-doğuştan (innate)var olan bağışıklık Fagositik hücreler (makrofajlar, mast hücreleri) Kompleman sistemi(direkt bakteri hücre membranı parçalayarak diğer immün sistem hücrelerin bunlara atak yapmasına
Hümoral İmmün Yanıt ve Antikorlar
 Hümoral İmmün Yanıt ve Antikorlar H. Barbaros ORAL Uludağ Üniversitesi Tıp Fakültesi İmmünoloji Anabilim Dalı Edinsel immün sistemin antijenleri bağlamak için kullandığı 3 molekül sınıfı: I.Antikorlar,
Hümoral İmmün Yanıt ve Antikorlar H. Barbaros ORAL Uludağ Üniversitesi Tıp Fakültesi İmmünoloji Anabilim Dalı Edinsel immün sistemin antijenleri bağlamak için kullandığı 3 molekül sınıfı: I.Antikorlar,
TÜRKĠYE DE ĠZOLE EDĠLEN ĠKĠ FARKLI TOXOPLASMA GONDII SUġUNDAN ÜRETĠLEN ADJUVANTE ERĠYĠK PROTEĠN AġILARININ UYARDIĞI ĠMMUN YANITIN KARġILAġTIRILMASI
 TÜRKĠYE DE ĠZOLE EDĠLEN ĠKĠ FARKLI TOXOPLASMA GONDII SUġUNDAN ÜRETĠLEN ADJUVANTE ERĠYĠK PROTEĠN AġILARININ UYARDIĞI ĠMMUN YANITIN KARġILAġTIRILMASI Ceylan Polat 1, Sultan Gülçe Ġz 2, Mert DöĢkaya 3, Hüseyin
TÜRKĠYE DE ĠZOLE EDĠLEN ĠKĠ FARKLI TOXOPLASMA GONDII SUġUNDAN ÜRETĠLEN ADJUVANTE ERĠYĠK PROTEĠN AġILARININ UYARDIĞI ĠMMUN YANITIN KARġILAġTIRILMASI Ceylan Polat 1, Sultan Gülçe Ġz 2, Mert DöĢkaya 3, Hüseyin
DİCLE ÜNİVERSİTESİ TIP FAKÜLTESİ DÖNEM II. KAN-DOLAŞIM ve SOLUNUM DERS KURULU
 DİCLE ÜNİVERSİTESİ TIP FAKÜLTESİ DÖNEM II KAN-DOLAŞIM ve SOLUNUM DERS KURULU Doç.Dr. Engin DEVECİ İMMÜN SİSTEM TİPLERİ I- Doğal-doğuştan (innate)var olan bağışıklık Fagositik hücreler (makrofajlar, mast
DİCLE ÜNİVERSİTESİ TIP FAKÜLTESİ DÖNEM II KAN-DOLAŞIM ve SOLUNUM DERS KURULU Doç.Dr. Engin DEVECİ İMMÜN SİSTEM TİPLERİ I- Doğal-doğuştan (innate)var olan bağışıklık Fagositik hücreler (makrofajlar, mast
Moleküler Yöntemlerin Klinik Mikrobiyolojide Kullanımı Ne zaman? Nerede? Ne kadar? Klinik Parazitoloji
 Moleküler Yöntemlerin Klinik Mikrobiyolojide Kullanımı Ne zaman? Nerede? Ne kadar? Klinik Parazitoloji Metin Korkmaz Ege Üniversitesi Tıp Fakültesi Tıbbi Parazitoloji AD İnsandaki Paraziter Hastalıkların
Moleküler Yöntemlerin Klinik Mikrobiyolojide Kullanımı Ne zaman? Nerede? Ne kadar? Klinik Parazitoloji Metin Korkmaz Ege Üniversitesi Tıp Fakültesi Tıbbi Parazitoloji AD İnsandaki Paraziter Hastalıkların
İMMUNİZASYON. Bir bireye bağışıklık kazandırma! Bireyin yaşı? İmmunolojik olarak erişkin mi? Maternal antikor? Konak antijene duyarlı mı? Sağlıklı mı?
 İMMUNİZASYON Bir bireye bağışıklık kazandırma! Bireyin yaşı? İmmunolojik olarak erişkin mi? Maternal antikor? Konak antijene duyarlı mı? Sağlıklı mı? Canlıya antijen verdikten belli bir süre sonra, o canlıda
İMMUNİZASYON Bir bireye bağışıklık kazandırma! Bireyin yaşı? İmmunolojik olarak erişkin mi? Maternal antikor? Konak antijene duyarlı mı? Sağlıklı mı? Canlıya antijen verdikten belli bir süre sonra, o canlıda
T Lenfositleri. Dr. Göksal Keskin
 T Lenfositleri Dr. Göksal Keskin Lenfositlerin ortak özellikleri-1 Kazanılmış bağışıklık sisteminin en önemli elemanlarıdır Spesifite özellikleri var Bellekleri var Primer lenfoid organlarda üretilirler
T Lenfositleri Dr. Göksal Keskin Lenfositlerin ortak özellikleri-1 Kazanılmış bağışıklık sisteminin en önemli elemanlarıdır Spesifite özellikleri var Bellekleri var Primer lenfoid organlarda üretilirler
İMMUNOLOJİK TANI YÖNTEMLERİ
 İMMUNOLOJİK TANI YÖNTEMLERİ Presipitasyon G)İMMUNOASSAY TESTLER İşaretli antikorların kullanılmasıyla 1942 de; FA Fluoresan Antikor (Fluorokromlar) 1954 de; IFA (İndirekt Fluoresan Antikor) 1960 da; RIA
İMMUNOLOJİK TANI YÖNTEMLERİ Presipitasyon G)İMMUNOASSAY TESTLER İşaretli antikorların kullanılmasıyla 1942 de; FA Fluoresan Antikor (Fluorokromlar) 1954 de; IFA (İndirekt Fluoresan Antikor) 1960 da; RIA
T.C. YILDIZ TEKNİK ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ
 T.C. YILDIZ TEKNİK ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ İSTANBUL DAKİ KAN MERKEZLERİNDEN ELDE EDİLEN DONÖR KAN ÖRNEKLERİNDE, LEISHMANIA PARAZİTLERİNİN YENİ MİKROKÜLTÜR YÖNTEMİ VE DİĞER YÖNTEMLER İLE KARŞILAŞTIRMALI
T.C. YILDIZ TEKNİK ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ İSTANBUL DAKİ KAN MERKEZLERİNDEN ELDE EDİLEN DONÖR KAN ÖRNEKLERİNDE, LEISHMANIA PARAZİTLERİNİN YENİ MİKROKÜLTÜR YÖNTEMİ VE DİĞER YÖNTEMLER İLE KARŞILAŞTIRMALI
ÇEKİRDEK EĞİTİM PROGRAMI
 ÇEKİRDEK EĞİTİM PROGRAMI Tıp Fakülteleri Mezuniyet Öncesi İmmünoloji Eğitim Programı Önerisi in hücre ve dokuları ilgi hücrelerini isim ve işlevleri ile bilir. Kemik iliği, lenf nodu, ve dalağın anatomisi,
ÇEKİRDEK EĞİTİM PROGRAMI Tıp Fakülteleri Mezuniyet Öncesi İmmünoloji Eğitim Programı Önerisi in hücre ve dokuları ilgi hücrelerini isim ve işlevleri ile bilir. Kemik iliği, lenf nodu, ve dalağın anatomisi,
ORGANİZMALARDA BAĞIŞIKLIK MEKANİZMALARI
 ORGANİZMALARDA BAĞIŞIKLIK MEKANİZMALARI Organizmalarda daha öncede belirtildiği gibi hücresel ve humoral bağışıklık bağışıklık reaksiyonları vardır. Bunlara ilave olarak immünoljik tolerans adı verilen
ORGANİZMALARDA BAĞIŞIKLIK MEKANİZMALARI Organizmalarda daha öncede belirtildiği gibi hücresel ve humoral bağışıklık bağışıklık reaksiyonları vardır. Bunlara ilave olarak immünoljik tolerans adı verilen
MOLEKÜLER BİYOLOJİ LABORATUVARI
 MOLEKÜLER 2014-2015 BİYOLOJİ LABORATUVARI GÜZ DÖNEMİ MOLEKÜLER BİYOLOJİ LABORATUVARI 7.HAFTA DERS NOTLARI GAZİ ÜNİVERSİTESİ FEN FAKÜLTESİ BİYOLOJİ BÖLÜMÜ Sayfa 1 / 6 1. RFLP (RESTRİKSİYON PARÇA UZUNLUK
MOLEKÜLER 2014-2015 BİYOLOJİ LABORATUVARI GÜZ DÖNEMİ MOLEKÜLER BİYOLOJİ LABORATUVARI 7.HAFTA DERS NOTLARI GAZİ ÜNİVERSİTESİ FEN FAKÜLTESİ BİYOLOJİ BÖLÜMÜ Sayfa 1 / 6 1. RFLP (RESTRİKSİYON PARÇA UZUNLUK
LENFOİD SİSTEM DR GÖKSAL KESKİN ARALIK-2014
 LENFOİD SİSTEM DR GÖKSAL KESKİN ARALIK-2014 Lenfoid Sistem Lenfositlerin, mononükleer fagositlerin ve diğer yardımcı rol oynayan hücrelerin bulunduğu, yabancı antijenlerin taşınıp yoğunlaştırıldığı, Antijenin
LENFOİD SİSTEM DR GÖKSAL KESKİN ARALIK-2014 Lenfoid Sistem Lenfositlerin, mononükleer fagositlerin ve diğer yardımcı rol oynayan hücrelerin bulunduğu, yabancı antijenlerin taşınıp yoğunlaştırıldığı, Antijenin
VİRAL ENFEKSİYONLAR VE KORUNMA. Yrd. Doç. Dr. Banu KAŞKATEPE
 VİRAL ENFEKSİYONLAR VE KORUNMA Yrd. Doç. Dr. Banu KAŞKATEPE VİRAL HASTALIKLARDA İMMÜNİTE Virüsler konak hücreye girdikten sonra çoğalır ve viral çoğalma belirli bir düzeye ulaştığında hastalık semptomları
VİRAL ENFEKSİYONLAR VE KORUNMA Yrd. Doç. Dr. Banu KAŞKATEPE VİRAL HASTALIKLARDA İMMÜNİTE Virüsler konak hücreye girdikten sonra çoğalır ve viral çoğalma belirli bir düzeye ulaştığında hastalık semptomları
KANSER AŞILARI. Prof. Dr. Tezer Kutluk Hacettepe Üniversitesi
 KANSER AŞILARI Prof. Dr. Tezer Kutluk Hacettepe Üniversitesi Bir Halk Sağlığı Sorunu Şu an dünyada 24.600.000 kanserli vardır. Her yıl 10.9 milyon kişi kansere yakalanmaktadır. 2020 yılında bu rakam %50
KANSER AŞILARI Prof. Dr. Tezer Kutluk Hacettepe Üniversitesi Bir Halk Sağlığı Sorunu Şu an dünyada 24.600.000 kanserli vardır. Her yıl 10.9 milyon kişi kansere yakalanmaktadır. 2020 yılında bu rakam %50
Kanın Bileşenleri. Total kan Miktarı: Vücut Ağırlığı x0.08. Plazma :%55 Hücreler : %45. Plazmanın %90 su
 KAN DOKUSU Kanın Bileşenleri Total kan Miktarı: Vücut Ağırlığı x0.08 Plazma :%55 Hücreler : %45 Plazmanın %90 su Kan Hücreleri Eritrosit Lökosit Trombosit Agranulosit Lenfosit Monosit Granulosit Nötrofil
KAN DOKUSU Kanın Bileşenleri Total kan Miktarı: Vücut Ağırlığı x0.08 Plazma :%55 Hücreler : %45 Plazmanın %90 su Kan Hücreleri Eritrosit Lökosit Trombosit Agranulosit Lenfosit Monosit Granulosit Nötrofil
(ZORUNLU) MOLEKÜLER İMMÜNOLOJİ I (TBG 607 TEORİK 3, 3 KREDİ)
 T. C. İSTANBUL BİLİM ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ TIBBİ BİYOLOJİ VE GENETİK ANABİLİM DALI YÜKSEK LİSANS PROGRAMI 2015-2016 EĞİTİM-ÖĞRETİM YILI DERS İÇERİKLERİ I. YARIYIL (ZORUNLU) MOLEKÜLER
T. C. İSTANBUL BİLİM ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ TIBBİ BİYOLOJİ VE GENETİK ANABİLİM DALI YÜKSEK LİSANS PROGRAMI 2015-2016 EĞİTİM-ÖĞRETİM YILI DERS İÇERİKLERİ I. YARIYIL (ZORUNLU) MOLEKÜLER
Klinik Mikrobiyoloji de Enzimli İmmün Deney Enzyme Immuno Assay. Dr. Dilek Çolak
 Klinik Mikrobiyoloji de Enzimli İmmün Deney Enzyme Immuno Assay Dr. Dilek Çolak İmmün Yanıt C. Macrophage A. Pathogen B. B cells D. Macrophage E. Macrophage F. T cell G. B cell H. Memory B cells I. Plasma
Klinik Mikrobiyoloji de Enzimli İmmün Deney Enzyme Immuno Assay Dr. Dilek Çolak İmmün Yanıt C. Macrophage A. Pathogen B. B cells D. Macrophage E. Macrophage F. T cell G. B cell H. Memory B cells I. Plasma
Mikrobiyolojide Moleküler Tanı Yöntemleri. Dr.Tuncer ÖZEKİNCİ Dicle Üniversitesi Tıp Fakültesi Tıbbi Mikrobiyoloji A.D
 Mikrobiyolojide Moleküler Tanı Yöntemleri Dr.Tuncer ÖZEKİNCİ Dicle Üniversitesi Tıp Fakültesi Tıbbi Mikrobiyoloji A.D 1 Enfeksiyonun Özgül Laboratuvar Tanısı Mikroorganizmanın üretilmesi Mikroorganizmaya
Mikrobiyolojide Moleküler Tanı Yöntemleri Dr.Tuncer ÖZEKİNCİ Dicle Üniversitesi Tıp Fakültesi Tıbbi Mikrobiyoloji A.D 1 Enfeksiyonun Özgül Laboratuvar Tanısı Mikroorganizmanın üretilmesi Mikroorganizmaya
Bağışıklık sistemi nasıl çalışır?
 On5yirmi5.com Bağışıklık sistemi nasıl çalışır? İnsanda bağışıklık sistemi, özellik ve görevleri nelerdir? Kaç çeşit bağışıklık sistemi vardır? Yayın Tarihi : 23 Ekim 2012 Salı (oluşturma : 10/3/2017)
On5yirmi5.com Bağışıklık sistemi nasıl çalışır? İnsanda bağışıklık sistemi, özellik ve görevleri nelerdir? Kaç çeşit bağışıklık sistemi vardır? Yayın Tarihi : 23 Ekim 2012 Salı (oluşturma : 10/3/2017)
Sivrisinek ve Phlebotomus mücadelesinde veya parazit hastalıkların anlatılmasında kullanılan ve de pek anlaşılmayan iki kavram vardır.
 Sivrisinek ve Phlebotomus mücadelesinde veya parazit hastalıkların anlatılmasında kullanılan ve de pek anlaşılmayan iki kavram vardır. Bu kavramlar ; vektör ve konak dır. VEKTÖR NEDİR? Herhangi bir bulaşıcı
Sivrisinek ve Phlebotomus mücadelesinde veya parazit hastalıkların anlatılmasında kullanılan ve de pek anlaşılmayan iki kavram vardır. Bu kavramlar ; vektör ve konak dır. VEKTÖR NEDİR? Herhangi bir bulaşıcı
Maymun Çiçek Virüsü (Monkeypox) VEYSEL TAHİROĞLU
 Maymun Çiçek Virüsü (Monkeypox) VEYSEL TAHİROĞLU insanlarda ölümcül hastalığa neden olabilir; her ne kadar genellikle çok daha az ciddi olsa da insan çiçek virüsü hastalığına benzer. Maymun çiçek virüsü
Maymun Çiçek Virüsü (Monkeypox) VEYSEL TAHİROĞLU insanlarda ölümcül hastalığa neden olabilir; her ne kadar genellikle çok daha az ciddi olsa da insan çiçek virüsü hastalığına benzer. Maymun çiçek virüsü
İMMÜN YANITIN EFEKTÖR GRUPLARI VE YANITIN DÜZENLENMESİ. Güher Saruhan- Direskeneli İTF Fizyoloji AD
 İMMÜN YANITIN EFEKTÖR GRUPLARI VE YANITIN DÜZENLENMESİ Güher Saruhan- Direskeneli İTF Fizyoloji AD HÜCRE İÇİ MİKROBA YANIT Veziküle alınmış mikroplu fagosit Sitoplazmasında mikroplu hücre CD4 + efektör
İMMÜN YANITIN EFEKTÖR GRUPLARI VE YANITIN DÜZENLENMESİ Güher Saruhan- Direskeneli İTF Fizyoloji AD HÜCRE İÇİ MİKROBA YANIT Veziküle alınmış mikroplu fagosit Sitoplazmasında mikroplu hücre CD4 + efektör
Agaroz jel elektroforezi
 MOLEKÜLER TEKNİKLER Dr. Naşit İĞCİ Nevşehir Hacı Bektaş Veli Üniversitesi Moleküler Biyoloji ve Genetik Bölümü 4. Sınıf (2017-2018 Bahar) 2. NOT Agaroz jel elektroforezi PAGE daha çok proteinlerin ve küçük
MOLEKÜLER TEKNİKLER Dr. Naşit İĞCİ Nevşehir Hacı Bektaş Veli Üniversitesi Moleküler Biyoloji ve Genetik Bölümü 4. Sınıf (2017-2018 Bahar) 2. NOT Agaroz jel elektroforezi PAGE daha çok proteinlerin ve küçük
Hücresel İmmünite Dicle Güç
 Hücresel İmmünite Dicle Güç dguc@hacettepe.edu.tr kekik imus Kalbe yakınlığı ve Esrarengiz hale Ruhun oturduğu yer Ruh cesaret yiğitlik Yunanlı Hekim MS 1.yy Kalp, pankreas, timus imus yaşla küçülür (timik
Hücresel İmmünite Dicle Güç dguc@hacettepe.edu.tr kekik imus Kalbe yakınlığı ve Esrarengiz hale Ruhun oturduğu yer Ruh cesaret yiğitlik Yunanlı Hekim MS 1.yy Kalp, pankreas, timus imus yaşla küçülür (timik
İMMÜN SİSTEM HASTALIKLARI VE BAKIMI. Öğr. Gör. Dr. Ayşegül Öztürk Birge ARALIK 2016
 İMMÜN SİSTEM HASTALIKLARI VE BAKIMI Öğr. Gör. Dr. Ayşegül Öztürk Birge ARALIK 2016 İmmünite ile allerji arasında yakın bir ilişki vardır. İmmünite antikorlarla vücudu korumak, Allerji ise, antikorlarla
İMMÜN SİSTEM HASTALIKLARI VE BAKIMI Öğr. Gör. Dr. Ayşegül Öztürk Birge ARALIK 2016 İmmünite ile allerji arasında yakın bir ilişki vardır. İmmünite antikorlarla vücudu korumak, Allerji ise, antikorlarla
Leishmaniasis. Türkiye deki Durum ve Tanı
 Leishmaniasis Türkiye deki Durum ve Tanı Prof.Dr. Seray Özensoy Töz Ege Üniversitesi Tıp Fakültesi Parazitoloji Anabilim Dalı seray.ozensoy.toz@ege.edu.tr Leishmaniasis Irak Savaşında 2000 Amerikan Askerinde
Leishmaniasis Türkiye deki Durum ve Tanı Prof.Dr. Seray Özensoy Töz Ege Üniversitesi Tıp Fakültesi Parazitoloji Anabilim Dalı seray.ozensoy.toz@ege.edu.tr Leishmaniasis Irak Savaşında 2000 Amerikan Askerinde
EĞİTİM-ÖĞRETİM BAHAR YARI YILI LİSANSÜSTÜ DERS PROGRAMI. Tarih Saat Konu Yer Anlatan
 2016- EĞİTİM-ÖĞRETİM BAHAR YARI YILI LİSANSÜSTÜ DERS PROGRAMI EĞİTİM-ÖĞRETİM BAŞLANGIÇ: 13 Şubat EĞİTİM-ÖĞRETİM BİTİŞ: 18 Mayıs Bitirme sınav tarihleri : 22 Mayıs-2 Haziran Bütünleme sınav tarihleri: 12-23
2016- EĞİTİM-ÖĞRETİM BAHAR YARI YILI LİSANSÜSTÜ DERS PROGRAMI EĞİTİM-ÖĞRETİM BAŞLANGIÇ: 13 Şubat EĞİTİM-ÖĞRETİM BİTİŞ: 18 Mayıs Bitirme sınav tarihleri : 22 Mayıs-2 Haziran Bütünleme sınav tarihleri: 12-23
15- RADYASYONUN NÜKLEİK ASİTLER VE PROTEİNLERE ETKİLERİ
 15- RADYASYONUN NÜKLEİK ASİTLER VE PROTEİNLERE ETKİLERİ İyonlaştırıcı radyasyonların biyomoleküllere örneğin nükleik asitler ve proteinlere olan etkisi hakkında yeterli bilgi yoktur. Ancak, nükleik asitlerden
15- RADYASYONUN NÜKLEİK ASİTLER VE PROTEİNLERE ETKİLERİ İyonlaştırıcı radyasyonların biyomoleküllere örneğin nükleik asitler ve proteinlere olan etkisi hakkında yeterli bilgi yoktur. Ancak, nükleik asitlerden
İNÖNÜ ÜNİVERSİTESİ SAĞLIK HİZMETLERİ MESLEK YÜKSEKOKULU TIBBİ LABORATUVAR TEKNİKLERİ PROGRAMI II DERS İÇERİKLERİ:
 İNÖNÜ ÜNİVERSİTESİ SAĞLIK HİZMETLERİ MESLEK YÜKSEKOKULU TIBBİ LABORATUVAR TEKNİKLERİ PROGRAMI II DERS İÇERİKLERİ: HEMATOLOJİ (2 4 6) 1 Hematolojiye giriş-tanımı, Hastaların genel değerlendirilmesi, 2 Kan,
İNÖNÜ ÜNİVERSİTESİ SAĞLIK HİZMETLERİ MESLEK YÜKSEKOKULU TIBBİ LABORATUVAR TEKNİKLERİ PROGRAMI II DERS İÇERİKLERİ: HEMATOLOJİ (2 4 6) 1 Hematolojiye giriş-tanımı, Hastaların genel değerlendirilmesi, 2 Kan,
Rahim ağzı kanseri hücreleri doku kültürü mikroskopik görüntüsü.
 Doç.Dr.Engin DEVECİ HÜCRE KÜLTÜRÜ Hücre Kültürü Araştırma Laboratuvarı, çeşitli hücrelerin invitro kültürlerini yaparak araştırmacılara kanser, kök hücre, hücre mekaniği çalışmaları gibi konularda hücre
Doç.Dr.Engin DEVECİ HÜCRE KÜLTÜRÜ Hücre Kültürü Araştırma Laboratuvarı, çeşitli hücrelerin invitro kültürlerini yaparak araştırmacılara kanser, kök hücre, hücre mekaniği çalışmaları gibi konularda hücre
Kanatlı Hayvan Hastalıkları
 Kanatlı Hayvan Hastalıkları Kanatlı sektörü ile ilgili genel bilgiler 1930 Merkez Tavukçuluk Enstitüsü 1952 Saf ırkların ilk kez ithal edilmesi 1963 Damızlık (Parent stock) ithali 1970 Yatırımlarda artma
Kanatlı Hayvan Hastalıkları Kanatlı sektörü ile ilgili genel bilgiler 1930 Merkez Tavukçuluk Enstitüsü 1952 Saf ırkların ilk kez ithal edilmesi 1963 Damızlık (Parent stock) ithali 1970 Yatırımlarda artma
Prof. Dr. Ahmet Özbilgin Celal Bayar Üniversitesi Tıp Fakültesi Parazitoloji Anabilim Dalı,Manisa
 Prof. Dr. Ahmet Özbilgin Celal Bayar Üniversitesi Tıp Fakültesi Parazitoloji Anabilim Dalı,Manisa 1. REDUCTION (Azaltma) 2. REPLACEMENT (Yerine bir şey koyma) 3. REFİNEMENT (Hayvanları rahatının sağlanması)
Prof. Dr. Ahmet Özbilgin Celal Bayar Üniversitesi Tıp Fakültesi Parazitoloji Anabilim Dalı,Manisa 1. REDUCTION (Azaltma) 2. REPLACEMENT (Yerine bir şey koyma) 3. REFİNEMENT (Hayvanları rahatının sağlanması)
POYRAZ TIBBİ CİHAZLAR EDVOTEK
 POYRAZ TIBBİ CİHAZLAR EDVOTEK EDVOTEK VİZYON Edvotek, bir çok disiplini bir araya getirerek karmaşık gibi görünen birçok bilimin temellerini anlatarak «Nasıl bilim adamı yetiştiririz?» sorusuna karşılık
POYRAZ TIBBİ CİHAZLAR EDVOTEK EDVOTEK VİZYON Edvotek, bir çok disiplini bir araya getirerek karmaşık gibi görünen birçok bilimin temellerini anlatarak «Nasıl bilim adamı yetiştiririz?» sorusuna karşılık
HIV/AIDS ve Diğer Retrovirus İnfeksiyonları,laboratuvar tanısı ve epidemiyolojisi
 HIV/AIDS ve Diğer Retrovirus İnfeksiyonları,laboratuvar tanısı ve epidemiyolojisi Prof Dr Ali Ağaçfidan İstanbul Tıp Fakültesi, Mikrobiyoloji ve Klinik Mikrobiyoloji Anabilim Dalı İnsan retrovirusları
HIV/AIDS ve Diğer Retrovirus İnfeksiyonları,laboratuvar tanısı ve epidemiyolojisi Prof Dr Ali Ağaçfidan İstanbul Tıp Fakültesi, Mikrobiyoloji ve Klinik Mikrobiyoloji Anabilim Dalı İnsan retrovirusları
b. Amaç: Bakterilerin patojenitesine karşı konakçının nasıl cevap verdiği ve savunma mekanizmaları ile ilgili genel bilgi öğretilmesi amaçlanmıştır.
 İMMÜNOLOJİİ I-DERS TANIMLARI 1- Tanım: Konakçı savunma mekanizmalarının öğretilmesi. b. Amaç: Bakterilerin patojenitesine karşı konakçının nasıl cevap verdiği ve savunma mekanizmaları ile ilgili genel
İMMÜNOLOJİİ I-DERS TANIMLARI 1- Tanım: Konakçı savunma mekanizmalarının öğretilmesi. b. Amaç: Bakterilerin patojenitesine karşı konakçının nasıl cevap verdiği ve savunma mekanizmaları ile ilgili genel
TÜBERKÜLOZ TANISINDA YENİ BELİRTEÇLER
 TÜBERKÜLOZ TANISINDA YENİ BELİRTEÇLER Doç.Dr.Alpaslan ALP Hacettepe Üniversitesi Tıp Fakültesi Tıbbi Mikrobiyoloji Anabilim Dalı 24.Mart.2017 Antalya 1 KLİMİK-2017 Kongresinin Değerli Düzenleme Kurulu
TÜBERKÜLOZ TANISINDA YENİ BELİRTEÇLER Doç.Dr.Alpaslan ALP Hacettepe Üniversitesi Tıp Fakültesi Tıbbi Mikrobiyoloji Anabilim Dalı 24.Mart.2017 Antalya 1 KLİMİK-2017 Kongresinin Değerli Düzenleme Kurulu
24 Şubat Enflamasyon DETAE Prof. Dr. Günnur Deniz Dr. Sema Bilgiç
 IMMN 7005. İMMÜN SİSTEM MORFOLOJİSİ 24 Şubat Enflamasyon DETAE Prof. Dr. Günnur Deniz Dr. Sema Bilgiç 3 Mart Hormon Etki Mekanizması Biyokimya Prof.Dr.Beyhan Ömer 10 Mart Isı Şoku Proteinleri DETAE Doç.Dr.
IMMN 7005. İMMÜN SİSTEM MORFOLOJİSİ 24 Şubat Enflamasyon DETAE Prof. Dr. Günnur Deniz Dr. Sema Bilgiç 3 Mart Hormon Etki Mekanizması Biyokimya Prof.Dr.Beyhan Ömer 10 Mart Isı Şoku Proteinleri DETAE Doç.Dr.
Yapay Bağışık Sistemler ve Klonal Seçim. Bmü-579 Meta Sezgisel Yöntemler Yrd. Doç. Dr. İlhan AYDIN
 Yapay Bağışık Sistemler ve Klonal Seçim Bmü-579 Meta Sezgisel Yöntemler Yrd. Doç. Dr. İlhan AYDIN Bağışık Sistemler Bağışıklık sistemi insan vücudunun hastalıklara karşı savunma mekanizmasını oluşturan
Yapay Bağışık Sistemler ve Klonal Seçim Bmü-579 Meta Sezgisel Yöntemler Yrd. Doç. Dr. İlhan AYDIN Bağışık Sistemler Bağışıklık sistemi insan vücudunun hastalıklara karşı savunma mekanizmasını oluşturan
Hücre Nükleusu, Nükleus Membranı, Nükleus Porları. Doç. Dr. Ahmet Özaydın
 Hücre Nükleusu, Nükleus Membranı, Nükleus Porları Doç. Dr. Ahmet Özaydın Nükleus (çekirdek) ökaryotlar ile prokaryotları ayıran temel özelliktir. Çekirdek hem genetik bilginin deposu hem de kontrol merkezidir.
Hücre Nükleusu, Nükleus Membranı, Nükleus Porları Doç. Dr. Ahmet Özaydın Nükleus (çekirdek) ökaryotlar ile prokaryotları ayıran temel özelliktir. Çekirdek hem genetik bilginin deposu hem de kontrol merkezidir.
Leishmania nın Türkiye deki Epidemiyolojisi ve Tanısı
 Leishmania nın Türkiye deki Epidemiyolojisi ve Tanısı Prof. Dr. Seray TÖZ Ege Üniversitesi Tıp Fakültesi Parazitoloji Anabilim Dalı, Bornova, Izmir seray.ozensoy.toz@ege.edu.tr İnsanlarda Leishmaniasis
Leishmania nın Türkiye deki Epidemiyolojisi ve Tanısı Prof. Dr. Seray TÖZ Ege Üniversitesi Tıp Fakültesi Parazitoloji Anabilim Dalı, Bornova, Izmir seray.ozensoy.toz@ege.edu.tr İnsanlarda Leishmaniasis
Mikotoksin nedir? En sık karşılaşılan mikotoksinler; Aspergillus Penicillium Fusarium Alternaria
 Mikotoksin nedir? Aspergillus Penicillium Fusarium Alternaria belirli nem ve ısı koşullarında oluşturdukları fungal metabolitler En sık karşılaşılan mikotoksinler; o aflatoksinler, o okratoksin, o trikotesen,
Mikotoksin nedir? Aspergillus Penicillium Fusarium Alternaria belirli nem ve ısı koşullarında oluşturdukları fungal metabolitler En sık karşılaşılan mikotoksinler; o aflatoksinler, o okratoksin, o trikotesen,
İMMÜNOBİYOLOJİ. Prof. Dr. Nursel GÜL. Ankara Üniversitesi Fen Fakültesi Biyoloji Bölümü
 İMMÜNOBİYOLOJİ Prof. Dr. Nursel GÜL Ankara Üniversitesi Fen Fakültesi Biyoloji Bölümü GİRİŞ İmmünoloji, organizmaların dışarıdan gelen mikroorganizmalara, parazitlere vb. birçok yabancı ajana karşı veya
İMMÜNOBİYOLOJİ Prof. Dr. Nursel GÜL Ankara Üniversitesi Fen Fakültesi Biyoloji Bölümü GİRİŞ İmmünoloji, organizmaların dışarıdan gelen mikroorganizmalara, parazitlere vb. birçok yabancı ajana karşı veya
I. YARIYIL MOLEKÜLER HÜCRE BİYOLOJİSİ I (TBG 601 TEORİK 3, 3 KREDİ)
 T. C. İSTANBUL BİLİM ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ TIBBİ BİYOLOJİ VE GENETİK ANABİLİM DALI YÜKSEK LİSANS PROGRAMI 2014-2015 EĞİTİM-ÖĞRETİM YILI DERS İÇERİKLERİ I. YARIYIL MOLEKÜLER HÜCRE BİYOLOJİSİ
T. C. İSTANBUL BİLİM ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ TIBBİ BİYOLOJİ VE GENETİK ANABİLİM DALI YÜKSEK LİSANS PROGRAMI 2014-2015 EĞİTİM-ÖĞRETİM YILI DERS İÇERİKLERİ I. YARIYIL MOLEKÜLER HÜCRE BİYOLOJİSİ
22 Şubat Enflamasyon DETAE Prof. Dr. Günnur Deniz Dr. Sema Bilgiç. 29 Şubat Sinyal iletimi DETAE Doç. Dr. Suzan Çınar
 IMMN 7005 İMMÜN SİSTEM MORFOLOJİSİ 22 Şubat Enflamasyon DETAE Prof. Dr. Günnur Deniz Dr. Sema Bilgiç 29 Şubat Sinyal iletimi DETAE Doç. Dr. Suzan Çınar 7 Mart Hücre Çoğalması ve DETAE Prof. Dr. Günnur
IMMN 7005 İMMÜN SİSTEM MORFOLOJİSİ 22 Şubat Enflamasyon DETAE Prof. Dr. Günnur Deniz Dr. Sema Bilgiç 29 Şubat Sinyal iletimi DETAE Doç. Dr. Suzan Çınar 7 Mart Hücre Çoğalması ve DETAE Prof. Dr. Günnur
T. C. İSTANBUL BİLİM ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ BİYOKİMYA ANABİLİM DALI YÜKSEK LİSANS PROGRAMI EĞİTİM-ÖĞRETİM YILI MÜFREDATI
 I. YARIYILI T. C. İSTANBUL BİLİM ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ BİYOKİMYA ANABİLİM DALI YÜKSEK LİSANS PROGRAMI 2016-2017 EĞİTİM-ÖĞRETİM YILI MÜFREDATI B 601 Temel Biyokimya I Zorunlu 3 0 3 4 B
I. YARIYILI T. C. İSTANBUL BİLİM ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ BİYOKİMYA ANABİLİM DALI YÜKSEK LİSANS PROGRAMI 2016-2017 EĞİTİM-ÖĞRETİM YILI MÜFREDATI B 601 Temel Biyokimya I Zorunlu 3 0 3 4 B
Vücutta dolaşan akkan sistemidir. Bağışıklığımızı sağlayan hücreler bu sistemle vücuda dağılır.
 HODGKIN LENFOMA HODGKIN LENFOMA NEDİR? Hodgkin lenfoma, lenf sisteminin kötü huylu bir hastalığıdır. Lenf sisteminde genç lenf hücreleri (Hodgkin ve Reed- Sternberg hücreleri) çoğalır ve vücuttaki lenf
HODGKIN LENFOMA HODGKIN LENFOMA NEDİR? Hodgkin lenfoma, lenf sisteminin kötü huylu bir hastalığıdır. Lenf sisteminde genç lenf hücreleri (Hodgkin ve Reed- Sternberg hücreleri) çoğalır ve vücuttaki lenf
DÖNEM 1- A, 3. DERS KURULU (2015-2016)
 DÖNEM 1- A, 3. DERS KURULU (2015-2016) DERS SAATİ DERS ADI DERS KONUSU DERSİ VEREN ÖĞRETİM ÜYESİ 4. DK 1. Hafta 07 Aralık Pazartesi Mikrobiyoloji Mikrobiyolojinin tarihçesi ve mikroorganizmalara genel
DÖNEM 1- A, 3. DERS KURULU (2015-2016) DERS SAATİ DERS ADI DERS KONUSU DERSİ VEREN ÖĞRETİM ÜYESİ 4. DK 1. Hafta 07 Aralık Pazartesi Mikrobiyoloji Mikrobiyolojinin tarihçesi ve mikroorganizmalara genel
DEHİDRE KÖPEKLERDE BİKARBONATLI SODYUM KLORÜR SOLÜSYONUNUN HEMATOLOJİK VE BİYOKİMYASAL PARAMETRELERE ETKİSİ
 T.C. ADNAN MENDERES ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ İÇ HASTALIKLARI ANABİLİM DALI VİH-YL 2007 0002 DEHİDRE KÖPEKLERDE BİKARBONATLI SODYUM KLORÜR SOLÜSYONUNUN HEMATOLOJİK VE BİYOKİMYASAL PARAMETRELERE
T.C. ADNAN MENDERES ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ İÇ HASTALIKLARI ANABİLİM DALI VİH-YL 2007 0002 DEHİDRE KÖPEKLERDE BİKARBONATLI SODYUM KLORÜR SOLÜSYONUNUN HEMATOLOJİK VE BİYOKİMYASAL PARAMETRELERE
YGS YE HAZIRLIK DENEMESi #13
 YGS YE HAZIRLIK DENEMESi #13 1) Canlılarda özelliklerin genlerle kontrol edildiği ve her genin en az bir özellikten sorumlu olduğu bilindiğine göre, I. Diploid canlılarda her özellik için iki gen bulunması
YGS YE HAZIRLIK DENEMESi #13 1) Canlılarda özelliklerin genlerle kontrol edildiği ve her genin en az bir özellikten sorumlu olduğu bilindiğine göre, I. Diploid canlılarda her özellik için iki gen bulunması
Salmonella. XLT Agar'da Salmonella (hidrojen sülfür oluşumuna bağlı olarak siyah) ve Citrobacter (sarı) kolonileri
 Enterobacteriaceae İnsan sağlığı açısından en önemli bakteri ailesidir. Doğal ortamları insan ve hayvan bağırsaklarıdır. Tipik klinik semptomlarla seyreden hastalığın (tifo, basilli dizanteri, veba) etkeni
Enterobacteriaceae İnsan sağlığı açısından en önemli bakteri ailesidir. Doğal ortamları insan ve hayvan bağırsaklarıdır. Tipik klinik semptomlarla seyreden hastalığın (tifo, basilli dizanteri, veba) etkeni
Biochemistry Chapter 4: Biomolecules. Hikmet Geçkil, Professor Department of Molecular Biology and Genetics Inonu University
 Biochemistry Chapter 4: Biomolecules, Professor Department of Molecular Biology and Genetics Inonu University Biochemistry/Hikmet Geckil Chapter 4: Biomolecules 2 BİYOMOLEKÜLLER Bilim adamları hücreyi
Biochemistry Chapter 4: Biomolecules, Professor Department of Molecular Biology and Genetics Inonu University Biochemistry/Hikmet Geckil Chapter 4: Biomolecules 2 BİYOMOLEKÜLLER Bilim adamları hücreyi
D Vitaminin Relaps Brucelloz üzerine Etkisi. Yrd.Doç.Dr. Turhan Togan Başkent Üniversitesi Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji
 D Vitaminin Relaps Brucelloz üzerine Etkisi Yrd.Doç.Dr. Turhan Togan Başkent Üniversitesi Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Bruselloz Brucella cinsi bakteriler tarafından primer olarak otçul
D Vitaminin Relaps Brucelloz üzerine Etkisi Yrd.Doç.Dr. Turhan Togan Başkent Üniversitesi Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Bruselloz Brucella cinsi bakteriler tarafından primer olarak otçul
HAYVANSAL HÜCRELER VE İŞLEVLERİ. YRD. DOÇ. DR. ASLI SADE MEMİŞOĞLU RESİM İŞ ZEMİN KAT ODA: 111
 HAYVANSAL HÜCRELER VE İŞLEVLERİ YRD. DOÇ. DR. ASLI SADE MEMİŞOĞLU RESİM İŞ ZEMİN KAT ODA: 111 asli.memisoglu@deu.edu.tr KONULAR HAYVAN HÜCRESİ HAYVAN, BİTKİ, MANTAR, BAKTERİ HÜCRE FARKLARI HÜCRE ORGANELLERİ
HAYVANSAL HÜCRELER VE İŞLEVLERİ YRD. DOÇ. DR. ASLI SADE MEMİŞOĞLU RESİM İŞ ZEMİN KAT ODA: 111 asli.memisoglu@deu.edu.tr KONULAR HAYVAN HÜCRESİ HAYVAN, BİTKİ, MANTAR, BAKTERİ HÜCRE FARKLARI HÜCRE ORGANELLERİ
Antikorlar, üretimlerini sağlayan antijen ile özgün tepkime veren globülin yapısında proteinlerdir. immunoglobülinler
 Antikorlar, üretimlerini sağlayan antijen ile özgün tepkime veren globülin yapısında proteinlerdir immunoglobülinler Kan plazmasındaki proteinlerin %12-19 u Antikorlar gamaglobülinlerdir Tisselius 1937
Antikorlar, üretimlerini sağlayan antijen ile özgün tepkime veren globülin yapısında proteinlerdir immunoglobülinler Kan plazmasındaki proteinlerin %12-19 u Antikorlar gamaglobülinlerdir Tisselius 1937
TLERDE SEROLOJİK/MOLEK HANGİ İNCELEME?) SAPTANMASI
 * VİRAL V HEPATİTLERDE TLERDE SEROLOJİK/MOLEK K/MOLEKÜLER LER TESTLER (NE ZAMANHANG HANGİ İNCELEME?) *VİRAL HEPATİTLERDE TLERDE İLAÇ DİRENCİNİN SAPTANMASI *DİAL ALİZ Z HASTALARININ HEPATİT T AÇISINDAN
* VİRAL V HEPATİTLERDE TLERDE SEROLOJİK/MOLEK K/MOLEKÜLER LER TESTLER (NE ZAMANHANG HANGİ İNCELEME?) *VİRAL HEPATİTLERDE TLERDE İLAÇ DİRENCİNİN SAPTANMASI *DİAL ALİZ Z HASTALARININ HEPATİT T AÇISINDAN
Hücre. 1 µm = 0,001 mm (1000 µm = 1 mm)!
 HÜCRE FİZYOLOJİSİ Hücre Hücre: Tüm canlıların en küçük yapısal ve fonksiyonel ünitesi İnsan vücudunda trilyonlarca hücre bulunur Fare, insan veya filin hücreleri yaklaşık aynı büyüklükte Vücudun büyüklüğü
HÜCRE FİZYOLOJİSİ Hücre Hücre: Tüm canlıların en küçük yapısal ve fonksiyonel ünitesi İnsan vücudunda trilyonlarca hücre bulunur Fare, insan veya filin hücreleri yaklaşık aynı büyüklükte Vücudun büyüklüğü
I. YARIYIL MOLEKÜLER HÜCRE BİYOLOJİSİ I (TBG 601, ZORUNLU, TEORİK 3, 3 KREDİ)
 T. C. İSTANBUL BİLİM ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ TIBBİ BİYOLOJİ VE GENETİK ANABİLİM DALI YÜKSEK LİSANS PROGRAMI 2017-2018 EĞİTİM-ÖĞRETİM YILI DERS İÇERİKLERİ I. YARIYIL MOLEKÜLER HÜCRE BİYOLOJİSİ
T. C. İSTANBUL BİLİM ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ TIBBİ BİYOLOJİ VE GENETİK ANABİLİM DALI YÜKSEK LİSANS PROGRAMI 2017-2018 EĞİTİM-ÖĞRETİM YILI DERS İÇERİKLERİ I. YARIYIL MOLEKÜLER HÜCRE BİYOLOJİSİ
POLİMERAZ ZİNCİR REAKSİYONU (PZR-PCR) VE RESTRİKSİYON PARÇA UZUNLUĞU POLİMORFİZMİ (RFLP)
 Deney: M 1 POLİMERAZ ZİNCİR REAKSİYONU (PZR-PCR) VE RESTRİKSİYON PARÇA UZUNLUĞU POLİMORFİZMİ (RFLP) a) PCR yöntemi uygulaması b) RPLF sonuçları değerlendirilmesi I. Araç ve Gereç dntp (deoksi Nükleotid
Deney: M 1 POLİMERAZ ZİNCİR REAKSİYONU (PZR-PCR) VE RESTRİKSİYON PARÇA UZUNLUĞU POLİMORFİZMİ (RFLP) a) PCR yöntemi uygulaması b) RPLF sonuçları değerlendirilmesi I. Araç ve Gereç dntp (deoksi Nükleotid
Merve ŞAHİNTÜRK Prof. Dr. Zübeyde ÖNER Süleyman Demirel Üniversitesi Mühendislik Fakültesi Gıda Mühendisliği Bölümü
 Merve ŞAHİNTÜRK Prof. Dr. Zübeyde ÖNER Süleyman Demirel Üniversitesi Mühendislik Fakültesi Gıda Mühendisliği Bölümü Kimyasal bileşiminin anne sütüne benzerlik göstermesi Temel besin ögeleri açısından zengin
Merve ŞAHİNTÜRK Prof. Dr. Zübeyde ÖNER Süleyman Demirel Üniversitesi Mühendislik Fakültesi Gıda Mühendisliği Bölümü Kimyasal bileşiminin anne sütüne benzerlik göstermesi Temel besin ögeleri açısından zengin
HLA Tiplendirmesi PCR-SSP. Türker Duman PhD
 HLA Tiplendirmesi PCR-SSP Türker Duman PhD Büyük Doku Uygunluk Kompleksi (Major Histocompatibility Complex - MHC) İlk olarak farklı fare suşlarında deri naklinin reddiyle tanımlanan genetik bölgedir Alloreaktiviteden
HLA Tiplendirmesi PCR-SSP Türker Duman PhD Büyük Doku Uygunluk Kompleksi (Major Histocompatibility Complex - MHC) İlk olarak farklı fare suşlarında deri naklinin reddiyle tanımlanan genetik bölgedir Alloreaktiviteden
TÜBİTAK BİDEB LİSE ÖĞRETMENLERİ FİZİK, KİMYA, BİYOLOJİ, MATEMATİK- PROJE DANIŞMANLIĞI EĞİTİMİ ÇALIŞTAYI LİSE3 (Çalıştay 2013) BİYOLOJİ GRUP TUHAF
 TÜBİTAK BİDEB LİSE ÖĞRETMENLERİ FİZİK, KİMYA, BİYOLOJİ, MATEMATİK- PROJE DANIŞMANLIĞI EĞİTİMİ ÇALIŞTAYI LİSE3 (Çalıştay 2013) BİYOLOJİ GRUP TUHAF PROJE ÖNERİSİ ADI TUHAF MATERYALLERDEN İZOLE EDİLEN DNA
TÜBİTAK BİDEB LİSE ÖĞRETMENLERİ FİZİK, KİMYA, BİYOLOJİ, MATEMATİK- PROJE DANIŞMANLIĞI EĞİTİMİ ÇALIŞTAYI LİSE3 (Çalıştay 2013) BİYOLOJİ GRUP TUHAF PROJE ÖNERİSİ ADI TUHAF MATERYALLERDEN İZOLE EDİLEN DNA
İSTANBUL MEDENİYET ÜNİVERSİTESİ TIP FAKÜLTESİ TIBBİ MİKROBİYOLOJİ ANABİLİM DALI MEZUNİYET SONRASI (UZMANLIK) EĞİTİMİ DERS MÜFREDATI
 İSTANBUL MEDENİYET ÜNİVERSİTESİ TIP FAKÜLTESİ TIBBİ MİKROBİYOLOJİ ANABİLİM DALI MEZUNİYET SONRASI (UZMANLIK) EĞİTİMİ DERS MÜFREDATI DERS KODU ve ADI TMİK 001: Vaka Değerlendirme Toplantısı TMİK 002: Makale
İSTANBUL MEDENİYET ÜNİVERSİTESİ TIP FAKÜLTESİ TIBBİ MİKROBİYOLOJİ ANABİLİM DALI MEZUNİYET SONRASI (UZMANLIK) EĞİTİMİ DERS MÜFREDATI DERS KODU ve ADI TMİK 001: Vaka Değerlendirme Toplantısı TMİK 002: Makale
Kanın fonksiyonel olarak üstlendiği görevler
 EGZERSİZ VE KAN Kanın fonksiyonel olarak üstlendiği görevler Akciğerden dokulara O2 taşınımı, Dokudan akciğere CO2 taşınımı, Sindirim organlarından hücrelere besin maddeleri taşınımı, Hücreden atık maddelerin
EGZERSİZ VE KAN Kanın fonksiyonel olarak üstlendiği görevler Akciğerden dokulara O2 taşınımı, Dokudan akciğere CO2 taşınımı, Sindirim organlarından hücrelere besin maddeleri taşınımı, Hücreden atık maddelerin
BAKTERİLERİN GENETİK KARAKTERLERİ
 BAKTERİLERİN GENETİK KARAKTERLERİ GENETİK MATERYALLER VE YAPILARI HER HÜCREDE Genetik bilgilerin kodlandığı bir DNA genomu bulunur Bu genetik bilgiler mrna ve ribozomlar aracılığı ile proteinlere dönüştürülür
BAKTERİLERİN GENETİK KARAKTERLERİ GENETİK MATERYALLER VE YAPILARI HER HÜCREDE Genetik bilgilerin kodlandığı bir DNA genomu bulunur Bu genetik bilgiler mrna ve ribozomlar aracılığı ile proteinlere dönüştürülür
Bacillus anthracis. Hayvanlarda şarbon etkenidir. Bacillus anthracis. Gram boyama. Bacillus anthracis. Bacillus anthracis
 Bacillus anthracis Gram pozitif, obligat aerop sporlu, çomak şeklinde bakterilerdir. 1µm eninde, 2-4 µm uzunluğunda, konkav sonlanan, kirpiksiz bakterilerdir. Bacillus anthracis in doğal yaşam ortamı topraktır.
Bacillus anthracis Gram pozitif, obligat aerop sporlu, çomak şeklinde bakterilerdir. 1µm eninde, 2-4 µm uzunluğunda, konkav sonlanan, kirpiksiz bakterilerdir. Bacillus anthracis in doğal yaşam ortamı topraktır.
Afrika Seyahati Sonrası İmporte Bir Sıtma Olgusu. A Case Imported Malaria After a Travel to Africa
 Afrika Seyahati Sonrası İmporte Bir Sıtma Olgusu 1, Mehmet KÖROĞLU 1, Tayfur DEMİRAY 1, Aziz ÖĞÜTLÜ 1, Oğuz KARABAY 1, Mustafa ALTINDİŞ 1 Özet Yayın Bilgisi Bu görüntülü sunumda, Afrika seyahati öyküsü
Afrika Seyahati Sonrası İmporte Bir Sıtma Olgusu 1, Mehmet KÖROĞLU 1, Tayfur DEMİRAY 1, Aziz ÖĞÜTLÜ 1, Oğuz KARABAY 1, Mustafa ALTINDİŞ 1 Özet Yayın Bilgisi Bu görüntülü sunumda, Afrika seyahati öyküsü
Sıtma ve Ülkemizdeki Son Durumu Doç.Dr. Özlem MİMAN
 Sıtma ve Ülkemizdeki Son Durumu Doç.Dr. Özlem MİMAN Dokuz Eylül Üniversitesi Tıp Fakültesi Parazitoloji AD, İzmir Aralık 2017 Sıtma İnsanlık tarihi kadar eski bilinen bir hastalık. Plasmodium cinsi kan
Sıtma ve Ülkemizdeki Son Durumu Doç.Dr. Özlem MİMAN Dokuz Eylül Üniversitesi Tıp Fakültesi Parazitoloji AD, İzmir Aralık 2017 Sıtma İnsanlık tarihi kadar eski bilinen bir hastalık. Plasmodium cinsi kan
2)Subatomik parçacıklardan oluşan radyasyon. α, β ışınları
 B) RADYASYON UYGULAMALARI Radyasyon = enerji yayılması 1)Elektromanyetik radyasyon. UV, X ve γ ışınları 2)Subatomik parçacıklardan oluşan radyasyon. α, β ışınları İyonizan ışınların canlı hücreler üzerine
B) RADYASYON UYGULAMALARI Radyasyon = enerji yayılması 1)Elektromanyetik radyasyon. UV, X ve γ ışınları 2)Subatomik parçacıklardan oluşan radyasyon. α, β ışınları İyonizan ışınların canlı hücreler üzerine
Mikroorganizmalar gözle görülmezler, bu yüzden mikroskopla incelenirler.
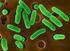 10. Sınıf Enfeksiyondan Korunma 2.Hafta ( 22-26 / 09 / 2014 ) ENFEKSİYON ETKENLERİNİN SINIFLANDIRILMASI 1.) BAKTERİLER 2.) VİRÜSLER Slayt No : 2 Mikroorganizmaların Sınıflandırılması ; a.) Sayısal Yöntem,
10. Sınıf Enfeksiyondan Korunma 2.Hafta ( 22-26 / 09 / 2014 ) ENFEKSİYON ETKENLERİNİN SINIFLANDIRILMASI 1.) BAKTERİLER 2.) VİRÜSLER Slayt No : 2 Mikroorganizmaların Sınıflandırılması ; a.) Sayısal Yöntem,
MOLEKÜLER TANISI DÜZEN GENETİK HASTALIKLAR TANI MERKEZİ. SERPİL ERASLAN, PhD
 β-talaseminin MOLEKÜLER TANISI DÜZEN GENETİK HASTALIKLAR TANI MERKEZİ SERPİL ERASLAN, PhD BETA TALASEMİ HEMOGLOBİNOPATİLER Otozomal resesif (globin gen ailesi) Özellikle Çukurova, Akdeniz kıyı şeridi,
β-talaseminin MOLEKÜLER TANISI DÜZEN GENETİK HASTALIKLAR TANI MERKEZİ SERPİL ERASLAN, PhD BETA TALASEMİ HEMOGLOBİNOPATİLER Otozomal resesif (globin gen ailesi) Özellikle Çukurova, Akdeniz kıyı şeridi,
BİRİNCİ BASAMAKTA PRİMER İMMÜN YETMEZLİK
 1 LERDE LABORATUVAR İPUÇLARI GENEL TARAMA TESTLERİ Tam kan sayımı Periferik yayma İmmünglobulin düzeyleri (IgG, A, M, E) İzohemaglutinin titresi (Anti A, Anti B titresi) Aşıya karşı antikor yanıtı (Hepatit
1 LERDE LABORATUVAR İPUÇLARI GENEL TARAMA TESTLERİ Tam kan sayımı Periferik yayma İmmünglobulin düzeyleri (IgG, A, M, E) İzohemaglutinin titresi (Anti A, Anti B titresi) Aşıya karşı antikor yanıtı (Hepatit
İyonize Radyasyonun Hücresel Düzeydeki Etkileri ve Moleküler Yaklaşımlar
 İyonize Radyasyonun Hücresel Düzeydeki Etkileri ve Moleküler Yaklaşımlar Aysun Manisalıgil, Ayşegül Yurt Dokuz Eylül Üniversitesi Sağlık Bilimleri Enstitüsü Medikal Fizik Anabilim Dalı Hücre ve Moleküller
İyonize Radyasyonun Hücresel Düzeydeki Etkileri ve Moleküler Yaklaşımlar Aysun Manisalıgil, Ayşegül Yurt Dokuz Eylül Üniversitesi Sağlık Bilimleri Enstitüsü Medikal Fizik Anabilim Dalı Hücre ve Moleküller
Adaptif İmmünoterapi. Prof.Dr.Ender Terzioğlu Akdeniz Üniversitesi Antalya
 Adaptif İmmünoterapi Prof.Dr.Ender Terzioğlu Akdeniz Üniversitesi Antalya Adaptif immünoterapi İmmün Sistemin kanser oluşumunda koruyucu rolü daha iyi anlaşılmıştır. Monoklonal antikor teknolojisi, Tümör
Adaptif İmmünoterapi Prof.Dr.Ender Terzioğlu Akdeniz Üniversitesi Antalya Adaptif immünoterapi İmmün Sistemin kanser oluşumunda koruyucu rolü daha iyi anlaşılmıştır. Monoklonal antikor teknolojisi, Tümör
Deneysel Hayvan Modelinde Candida Tropicalis Peritonitinin Tedavisinde Kaspofungin ve Amfoterisin B Etkinliğinin Karşılaştırılması
 Deneysel Hayvan Modelinde Candida Tropicalis Peritonitinin Tedavisinde Kaspofungin ve Amfoterisin B Etkinliğinin Karşılaştırılması Melis Demirci, Özlem Tünger, Kenan Değerli, Şebnem Şenol, Çiğdem Banu
Deneysel Hayvan Modelinde Candida Tropicalis Peritonitinin Tedavisinde Kaspofungin ve Amfoterisin B Etkinliğinin Karşılaştırılması Melis Demirci, Özlem Tünger, Kenan Değerli, Şebnem Şenol, Çiğdem Banu
I. YARIYIL TEMEL BİYOKİMYA I (B 601 TEORİK 3, 3 KREDİ)
 T.C. İSTANBUL BİLİM ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ BİYOKİMYA ANABİLİM DALI YÜKSEK LİSANS PROGRAMI 2014-2015 EĞİTİM-ÖĞRETİM YILI DERS İÇERİKLERİ I. YARIYIL TEMEL BİYOKİMYA I (B 601 TEORİK 3, 3
T.C. İSTANBUL BİLİM ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ BİYOKİMYA ANABİLİM DALI YÜKSEK LİSANS PROGRAMI 2014-2015 EĞİTİM-ÖĞRETİM YILI DERS İÇERİKLERİ I. YARIYIL TEMEL BİYOKİMYA I (B 601 TEORİK 3, 3
WEİL-FELİX TESTİ NEDİR NASIL YAPILIR? Weil Felix testi Riketsiyozların tanısında kullanılır.
 WEİL FELİX TESTİ WEİL-FELİX TESTİ NEDİR NASIL YAPILIR? Weil Felix testi Riketsiyozların tanısında kullanılır. Riketsiyöz tanısında çapraz reaksiyondan faydalanılır bu nedenle riketsiyaların çapraz reaksiyon
WEİL FELİX TESTİ WEİL-FELİX TESTİ NEDİR NASIL YAPILIR? Weil Felix testi Riketsiyozların tanısında kullanılır. Riketsiyöz tanısında çapraz reaksiyondan faydalanılır bu nedenle riketsiyaların çapraz reaksiyon
ASİT- BAZ DENGESİ VE DENGESİZLİKLERİ. Prof. Dr. Tülin BEDÜK 2016
 ASİT- BAZ DENGESİ VE DENGESİZLİKLERİ Prof. Dr. Tülin BEDÜK 2016 Herhangi bir çözeltinin asitliği veya bazlığı içindeki hidrojen iyonunun (H + ) konsantrasyonuna bağlıdır. Beden sıvılarının asit-baz dengesi
ASİT- BAZ DENGESİ VE DENGESİZLİKLERİ Prof. Dr. Tülin BEDÜK 2016 Herhangi bir çözeltinin asitliği veya bazlığı içindeki hidrojen iyonunun (H + ) konsantrasyonuna bağlıdır. Beden sıvılarının asit-baz dengesi
YGS YE HAZIRLIK DENEMESi #22
 YGS YE HAZIRLIK DENEMESi #22 1) Zigottan başlayıp yeni bir bireyin meydana gelmesiyle sonlanan olayların hepsine birden gelişme denir. Embriyonun gelişimi sırasında, I. Morula II. Gastrula III. Blastula
YGS YE HAZIRLIK DENEMESi #22 1) Zigottan başlayıp yeni bir bireyin meydana gelmesiyle sonlanan olayların hepsine birden gelişme denir. Embriyonun gelişimi sırasında, I. Morula II. Gastrula III. Blastula
VİRAL TANI KİTLERİ (GFJ-480)
 VİRAL TANI KİTLERİ (GFJ-480) CMV PCR Tanı Kiti Cytomegalovirus un Konvensiyonel PCR yöntemiyle tanınması. HHV-5 olarak da bilinen Sitomegalovirüs, herpes virus ailesinin bir üyesidir. Oldukça sık görülen
VİRAL TANI KİTLERİ (GFJ-480) CMV PCR Tanı Kiti Cytomegalovirus un Konvensiyonel PCR yöntemiyle tanınması. HHV-5 olarak da bilinen Sitomegalovirüs, herpes virus ailesinin bir üyesidir. Oldukça sık görülen
TRANSLASYON ve PROTEİNLER
 TRANSLASYON ve PROTEİNLER Prof. Dr. Sacide PEHLİVAN 13 Aralık 2016 mrna daki baz sırasının kullanılarak amino asitlerin doğru sıra ile proteini oluşturmasını kapsayan olayların tümüne Translasyon veya
TRANSLASYON ve PROTEİNLER Prof. Dr. Sacide PEHLİVAN 13 Aralık 2016 mrna daki baz sırasının kullanılarak amino asitlerin doğru sıra ile proteini oluşturmasını kapsayan olayların tümüne Translasyon veya
MOLEKÜLER BİYOLOJİ DOÇ. DR. MEHMET KARACA (5. BÖLÜM)
 MOLEKÜLER BİYOLOJİ DOÇ. DR. MEHMET KARACA (5. BÖLÜM) TRANSKRİPSİYONU (ÖKARYOTİK) STOPLAZMA DNA Transkripsiyon hnrna RNA nın işlenmesi mrna G AAA Eksport G AAA NÜKLEUS TRANSKRİPSİYONU (PROKARYOTİK) Stoplazma
MOLEKÜLER BİYOLOJİ DOÇ. DR. MEHMET KARACA (5. BÖLÜM) TRANSKRİPSİYONU (ÖKARYOTİK) STOPLAZMA DNA Transkripsiyon hnrna RNA nın işlenmesi mrna G AAA Eksport G AAA NÜKLEUS TRANSKRİPSİYONU (PROKARYOTİK) Stoplazma
HÜCRESEL İMMÜNİTENİN EFEKTÖR MEKANİZMALARI. Hücre İçi Mikropların Yok Edilmesi
 HÜCRESEL İMMÜNİTENİN EFEKTÖR MEKANİZMALARI Hücre İçi Mikropların Yok Edilmesi Hücre içi mikropları yok etmekle görevli özelleşmiş immün mekanizmalar hücre aracılı immüniteyi oluştururlar. Hücresel immünitenin
HÜCRESEL İMMÜNİTENİN EFEKTÖR MEKANİZMALARI Hücre İçi Mikropların Yok Edilmesi Hücre içi mikropları yok etmekle görevli özelleşmiş immün mekanizmalar hücre aracılı immüniteyi oluştururlar. Hücresel immünitenin
T.C. YILDIZ TEKNİK ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ DÜZLEMSEL HOMOTETİK HAREKETLER ALTINDAT.C. YILDIZ TEKNİK ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ
 T.C. YILDIZ TEKNİK ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ DÜZLEMSEL HOMOTETİK HAREKETLER ALTINDAT.C. YILDIZ TEKNİK ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ İMMUNOSTİMULAN POLİMERLER İLE ATTENÜE EDİLMİŞ LEISMANIA
T.C. YILDIZ TEKNİK ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ DÜZLEMSEL HOMOTETİK HAREKETLER ALTINDAT.C. YILDIZ TEKNİK ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ İMMUNOSTİMULAN POLİMERLER İLE ATTENÜE EDİLMİŞ LEISMANIA
İ. Ü İstanbul Tıp Fakültesi Tıbbi Biyoloji Anabilim Dalı Prof. Dr. Filiz Aydın
 İ. Ü İstanbul Tıp Fakültesi Tıbbi Biyoloji Anabilim Dalı Prof. Dr. Filiz Aydın Canlının en küçük birimi Hücre 1665 yılında ilk olarak İngiliz bilim adamı Robert Hooke şişe mantarından kesit alıp mikroskopta
İ. Ü İstanbul Tıp Fakültesi Tıbbi Biyoloji Anabilim Dalı Prof. Dr. Filiz Aydın Canlının en küçük birimi Hücre 1665 yılında ilk olarak İngiliz bilim adamı Robert Hooke şişe mantarından kesit alıp mikroskopta
HODGKIN DIŞI LENFOMA
 HODGKIN DIŞI LENFOMA HODGKIN DIŞI LENFOMA NEDİR? Hodgkin dışı lenfoma (HDL) veya Non-Hodgkin lenfoma (NHL), vücudun savunma sistemini sağlayan lenf bezlerinden kaynaklanan kötü huylu bir hastalıktır. Lenf
HODGKIN DIŞI LENFOMA HODGKIN DIŞI LENFOMA NEDİR? Hodgkin dışı lenfoma (HDL) veya Non-Hodgkin lenfoma (NHL), vücudun savunma sistemini sağlayan lenf bezlerinden kaynaklanan kötü huylu bir hastalıktır. Lenf
Hücre içinde bilginin akışı
 Hücre içinde bilginin akışı 1 DNA Çift Zincir Heliks 2 Hücre Çekirdeği ve Çekirdek Zarının Yapısal Organizasyonu Hatırlıyor musunuz? DNA Kromatin Kromatid Kromozom RNA Protein Çekirdek Çekirdekcik Nükleotid
Hücre içinde bilginin akışı 1 DNA Çift Zincir Heliks 2 Hücre Çekirdeği ve Çekirdek Zarının Yapısal Organizasyonu Hatırlıyor musunuz? DNA Kromatin Kromatid Kromozom RNA Protein Çekirdek Çekirdekcik Nükleotid
KALITSAL MOLEKÜLÜN BİÇİMİ ve ORGANİZASYONU PROF. DR. SERKAN YILMAZ
 KALITSAL MOLEKÜLÜN BİÇİMİ ve ORGANİZASYONU PROF. DR. SERKAN YILMAZ Değişik canlı gruplarında kalıtsal molekülün çeşidi, sayısı, biçimi ve organizasyonu bakımından farklılıklar bulunur. Ortak özellik: nükleik
KALITSAL MOLEKÜLÜN BİÇİMİ ve ORGANİZASYONU PROF. DR. SERKAN YILMAZ Değişik canlı gruplarında kalıtsal molekülün çeşidi, sayısı, biçimi ve organizasyonu bakımından farklılıklar bulunur. Ortak özellik: nükleik
Hücre Biyoloji Laboratuarı Güz dönemi Alıştırma Soruları (Dr.Selcen Çelik)
 Hücre Biyoloji Laboratuarı 2014-2015 Güz dönemi Alıştırma Soruları (Dr.Selcen Çelik Konular: ph ve tamponlar, hücre kültür tekniği, mikrometrik ölçüm ph ve Tamponlar 1. ph sı 8.2 olan 500 ml. 20mM Tris/HCl
Hücre Biyoloji Laboratuarı 2014-2015 Güz dönemi Alıştırma Soruları (Dr.Selcen Çelik Konular: ph ve tamponlar, hücre kültür tekniği, mikrometrik ölçüm ph ve Tamponlar 1. ph sı 8.2 olan 500 ml. 20mM Tris/HCl
TOKSOPLAZMA İNFEKSİYONUNUN LABORATUVAR TANISI UZM.DR.CENGİZ UZUN ALMAN HASTANESİ
 TOKSOPLAZMA İNFEKSİYONUNUN LABORATUVAR TANISI UZM.DR.CENGİZ UZUN ALMAN HASTANESİ KLİNİK Bağışıklık sistemi sağlam kişilerde akut infeksiyon Bağışıklık sistemi baskılanmış kişilerde akut infeksiyon veya
TOKSOPLAZMA İNFEKSİYONUNUN LABORATUVAR TANISI UZM.DR.CENGİZ UZUN ALMAN HASTANESİ KLİNİK Bağışıklık sistemi sağlam kişilerde akut infeksiyon Bağışıklık sistemi baskılanmış kişilerde akut infeksiyon veya
ADIM ADIM YGS-LYS 55. ADIM CANLILARIN SINIFLANDIRILMASI-15 VİRÜSLER
 ADIM ADIM YGS-LYS 55. ADIM CANLILARIN SINIFLANDIRILMASI-15 VİRÜSLER Virüsler Hücresel yapı da dahil olmak üzere canlıların ortak özelliklerini göstermeyen canlılardır. Prokaryotlardan daha küçüklerdir.
ADIM ADIM YGS-LYS 55. ADIM CANLILARIN SINIFLANDIRILMASI-15 VİRÜSLER Virüsler Hücresel yapı da dahil olmak üzere canlıların ortak özelliklerini göstermeyen canlılardır. Prokaryotlardan daha küçüklerdir.
İmmünyetmezlikli Konakta Viral Enfeksiyonlar
 İmmünyetmezlikli Konakta Viral Enfeksiyonlar Dr. Dilek Çolak 10 y, erkek hasta Olgu 1 Sistinozis Böbrek transplantasyonu Canlı akraba verici HLA 2 antijen uyumsuz 2 Olgu 1 Transplantasyon öncesi viral
İmmünyetmezlikli Konakta Viral Enfeksiyonlar Dr. Dilek Çolak 10 y, erkek hasta Olgu 1 Sistinozis Böbrek transplantasyonu Canlı akraba verici HLA 2 antijen uyumsuz 2 Olgu 1 Transplantasyon öncesi viral
Tam Kan Analizi. Yrd.Doç.Dr.Filiz BAKAR ATEŞ
 Tam Kan Analizi Yrd.Doç.Dr.Filiz BAKAR ATEŞ Tam Kan Analizi Tam kan analizi, en sık kullanılan kan testlerinden biridir. Kandaki 3 major hücreyi analiz eder: 1. Eritrositler 2. Lökositler 3. Plateletler
Tam Kan Analizi Yrd.Doç.Dr.Filiz BAKAR ATEŞ Tam Kan Analizi Tam kan analizi, en sık kullanılan kan testlerinden biridir. Kandaki 3 major hücreyi analiz eder: 1. Eritrositler 2. Lökositler 3. Plateletler
