SIĞIR OOSİTLERİNDE İNTRASİTOPLAZMİK SPERM ENJEKSİYONU (ICSI), ICSI SONRASI OOSİTLERİN AKTİVASYONU VE GELİŞİM AŞAMALARININ DEĞERLENDİRİLMESİ
|
|
|
- Elmas Gürsel
- 6 yıl önce
- İzleme sayısı:
Transkript
1 SIĞIR OOSİTLERİNDE İNTRASİTOPLAZMİK SPERM ENJEKSİYONU (ICSI), ICSI SONRASI OOSİTLERİN AKTİVASYONU VE GELİŞİM AŞAMALARININ DEĞERLENDİRİLMESİ Duygu BAKİ ACAR DOĞUM ve JİNEKOLOJİ ANABİLİM DALI DOKTORA TEZİ DANIŞMAN Prof. Dr. Ayhan BAŞTAN ANKARA
2 SIĞIR OOSİTLERİNDE İNTRASİTOPLAZMİK SPERM ENJEKSİYONU (ICSI), ICSI SONRASI OOSİTLERİN AKTİVASYONU VE GELİŞİM AŞAMALARININ DEĞERLENDİRİLMESİ Duygu BAKİ ACAR DOĞUM ve JİNEKOLOJİ ANABİLİM DALI DOKTORA TEZİ DANIŞMAN Prof. Dr. Ayhan BAŞTAN ANKARA
3 iii İÇİNDEKİLER Kabul ve Onay İçindekiler Önsöz Simgeler ve Kısaltmalar Şekiller Çizelgeler 1. GİRİŞ 1.1.In Vitro Fertilizasyonun (IVF) Tarihçesi 1.2. In Vitro Fertilizasyon In Vitro Fertilizasyonu Etkileyen Faktörler Spermatozoon Hazırlama Teknikleri Spermatozoon Kaynağı Vasata Katılacak Spermatozoon Dozu Fertilizasyon Vasatı Ortam Isısı ii iii vi vii xi xii Ortamın Gaz ve Nem Yoğunluğu 1.3. In Vitro Fertilizasyon Kriterleri 1.4. Mikromanipülasyon Teknikleri Zona İnceltme Zona Delme Subzonal Sperm Enjeksiyonu (SUZI)
4 iv Intrasitoplazmik Sperm Enjeksiyonu (ICSI) Spermatozoonların Hazırlanması Taze Boğa Spermatozoonunun Kullanılması Dondurulmuş-Çözülmüş Spermatozoon Kalitesinin Değerlendirilmesi Swim-up Yöntemi Percoll Yoğunluk Farkı Yöntemi Glass-wool Filtrasyon Tekniği Hiyaluronik Asit Kullanımı Sperma Yıkama Tekniği Oositin Hazırlanması In Vitro Maturasyon ve Fertilizasyon Sırasında Oositte Meydana Gelen 2 6 Fizyolojik Değişiklikler Partenogenezis 1.7. Oosit Aktivasyonu Oosit Aktivasyon Yöntemleri GEREÇ VE YÖNTEM Ovaryumların Toplanması Oositlerin Toplanması ve Seçimi In Vitro Oosit Maturasyonu Maturasyon Kriterlerinin Belirlenmesi ve Değerlendirilmesi Kumulus Ekspansiyonu Birinci Kutup Hücresinin Belirlenmesi Deney Düzeneği 38
5 v 2.6. Intrasitoplazmik Sperm Enjeksiyonu Oositin Hazırlanması Spermanın Hazırlanması Stok Solüsyonlar ve Vasatların Hazırlanması Intrasitoplazmik Sperm Enjeksiyonu 2.7. Oosit Aktivasyonu 2.8. Embriyo Kültürü 2.9. Embriyonik Gelişim Aşamalarının İzlenmesi İstatistiksel Değerlendirme 3. BULGULAR 3.1. In Vitro Maturasyon Bulguları Kumulus Ekspansiyonunun Belirlenmesi Birinci Kutup Hücresinin Belirlenmesi 3.2. Intrasitoplazmik Sperm Enjeksiyonu Bulguları 4. TARTIŞMA 5. SONUÇ VE ÖNERİLER ÖZET SUMMARY KAYNAKLAR ÖZGEÇMİŞ
6 vi ÖNSÖZ Son yıllarda gerçekleştirilen yoğun biyoteknoloji çalışmalarına rağmen, sığırlarda halen in vitro fertilizasyon yöntemiyle elde edilen canlı yavru oranları in vivo yavru elde etme oranlarından düşüktür. Bu nedenle, fertilizasyon ve embriyo oranlarını artırabilmek amacıyla her geçen gün yeni teknikler geliştirilmeye çalışılmaktadır. Sığırlarda intrasitoplazmik sperm enjeksiyonu yöntemi ile fertilizasyon sırasında meydana gelen değişiklikler, in vitro fertilizasyon sırasında ortaya çıkabilen aksaklıklar, spermatozoon problemlerinin neden olduğu infertilite gibi olgulara açıklık getirilebilmektedir. İnsan ve fare oositlerinde ICSI işlemi sonrasında herhangi bir işleme gerek kalmadan çok sayıda sağlıklı embriyo elde edilebilirken, sığır oositlerinde bunun için oosit aktivasyonu uygulaması şarttır. Fertilizasyon ve bölünme oranları, kalsiyum iyonofor (A 23187), etanol, elektrik stimülasyonu veya iyonomisin + 6 dimetilaminopurin (DMAP) gibi oosit aktivasyonunu sağlayan tedavilerle artırılabilmektedir. Kalsiyum iyonofor pratik ve hızlı uygulanabilir olması nedeniyle oosit aktivasyonunda en sık tercih edilen kimyasallardan biridir. Doktora programım süresince değerli öneri ve yardımlarıyla her konuda destek olan danışman hocam Prof. Dr. Ayhan Baştan a, tez izleme komitesi üyelerine, Ankara Üniversitesi Veteriner Fakültesi Doğum ve Jinekoloji Anabilim Dalı öğretim üyeleri ve yardımcılarına, tez çalışmamı gerçekleştirdiğim A. Ü. Veteriner Fakültesi Doğum ve Jinekoloji A.D. IVF laboratuarının kurulmasını sağlayan Biyoteknoloji Enstitüsü ne, çalışma aşamasındaki yardımlarından dolayı Gamze Çağıran a, Çubuk ilçe mezbahasındaki veteriner hekimler ve çalışanlarına, her koşulda bana destek olan eşim Yrd. Doç. Dr. Abuzer Acar a ve aileme teşekkürü borç bilirim.
7 vii SİMGELER ve KISALTMALAR > < % ABD AR ark. BO BSA Ca 2+ CaCl 2 CHX CO 2 CR1 CR1aa CSF DICI DISCO dk DMAP DNA Büyüktür Derece Küçüktür Yüzde Amerika Birleşik Devletleri Akrozom reaksiyonu Arkadaşları Bracket-Oliphant Sığır serum albumini Kalsiyum iyonu Kalsiyum klorür Sikloheksimid Karbondioksit Charles Rosenckrans 1 vasatı Aminoasitli Charles Rosencrans vasatı Sitostatik faktör Direkt intrasitoplazmik inseminasyon Oosit sitoplazmasına direkt inseminasyon Dakika Dimetilaminopurin Deoksiribonükleik asit
8 viii EFAF EGF FCS Fert. Frak V FSH g GVBD HEPES HIS C H 2 O ICI ICM ICSI IGF IP-3 IU IVF IVM IVP KCl K KOK Yağ asidi bulunmayan (Essential fatty acid free) Epidermal büyüme faktörü Fötal buzağı serumu (Fetal calf serum) Fertilizasyon Kısım (fraksiyon) V Follikül uyarıcı hormon Santrifüj devir sabiti Germinal vezikül dağılması N-(2 hidroksietil)-piperazin-n -(2 etanosulfonikasit) Güçlü iyonik sıvı Santigrad derece Su İntrasitoplazmik tohumlama İç hücre kitlesi (Inner cell mass) İntrasitoplazmik sperm enjeksiyonu Insulin benzeri büyüme faktörü Inositol 1,4,5-trifosfat Internasyonal ünite İn vitro fertilizasyon İn vitro maturasyon İn vitro üretim Potasyum Klorür Potasyum Kumulus oosit kompleksi
9 ix LH MAP ml mm mm Hg jltl nm j,m M I M II MDF MEM Mg MgCl 2 mg MIMIC MIST MPF mrna N 2 Na NaCl Luteinleştirici hormon Mitojen aktive edilmiş protein Mililitre Milimolar Milimetre Mikrogram Mikrolitre Mikrometre Mikromolar Metafaz I Metafaz II Maturasyon Düzenleyici Faktör Minimum esansiyal medyum Magnezyum Magnezyum klorür Miligram Sitoplazma içine mikroenjeksiyon Sperm transferi ile mikroenjeksiyon Metafaz destekleyici faktör Haberci (mesenger) ribonükleik asit Azot Sodyum Sodyum klorür
10 x NaOH Na 2 O 2 S 2 NaHCO 3 ng O 2 PBS ph PVP PZD RyR SMI SPSS SUZI TALP TCM UZI ZP Sodyum hidroksit Sodyum metabisülsit Sodyum bikarbonat Nanogram Oksijen Fosfatlı tampon solüsyonu Asitlik sabiti Polivinil pirolidon Kısmi zona diseksiyonu (Partial zona dissection) Ryanodin reseptörü Sperm mikroenjeksiyonu Statistic Packet of Social Science Subzonal sperm enjeksiyonu Tyrode nin albumin laktat pürivat vasatı Doku kültürü vasatı Zona altına enjeksiyon Zona pellusida
11 xi ŞEKİLLER Şekil Sığırlarda gamet etkileşimleri ve diğer olaylar 5 Şekil Sperm havuzu (a) ve PVP havuzu (b) 43 Şekil Mikromanipülatör sistemi (a), mikroenjeksiyon ve holding 43 iğnelerinin hazırlanması (b) Şekil İntrasitoplazmik sperm enjeksiyonunun aşamaları; oositin 44 holding iğnesi ile tutulması (a), ICSI iğnesinin yaklaştırılması (b), zona pellusida ve oolemmanın delinmesi (c) ve sperm enjeksiyonu (d) Şekil Kumulus ekspansiyonu (-) KOK (a) ve kumulus ekspansiyonu 48 (+) KOK (b) Şekil Birinci kutup hücresi (-) KOK (a) ve 1. kutup hücresi (+) KOK 48 (b) Şekil Maturasyon oranları 49 Şekil Grup I ve Grup II de saptanan bölünme, morula ve blastosist 51 oranları Şekil Elde edilen bölünme (a), morula (b) ve blastosist (c) aşamaları 52
12 xii ÇİZELGELER Çizelge Memeli in vitro fertilizasyonunun tarihsel gelişimi 2 Çizelge Spermatozoon konsantrasyonunun BSA katkılı ve BSA 8 katkısız vasatlarda in vitro fertilizasyon oranlarına etkisi Çizelge Çizelge Çizelge Çizelge Çizelge Çizelge Çizelge Çizelge Çizelge Çizelge Çizelge Çizelge Çizelge Çizelge Çizelge Çizelge Klasik swim-up metodunun avantaj ve dezavantajları Percoll yoğunluk farkı metodunun avantaj ve dezavantajları Glass-wool filtrasyon metodunun avantaj ve dezavantajları Sığır intrasitoplazmik oosit aktivasyonunda kullanılan kombinasyonlar Stok solüsyonlarının hazırlanması ve saklanması TL solüsyonlarının hazırlanması TALP solüsyonlarının hazırlanması CR1 stok vasatının hazırlanması CR1aa kültür vasatının hazırlanması PBS-A solüsyonunun hazırlanması PBS-B solüsyonunun hazırlanması PBS solüsyonunun hazırlanması Maturasyon oranları Grup I e ait oositlerin embriyonik gelişim aşamaları Grup II ye ait oositlerin embriyonik gelişim aşamaları Gruplar arasındaki bölünme, morula, blastosist oranları
13 1 1. GİRİŞ 1.1. In Vitro Fertilizasyonun (IVF) Tarihçesi Kaynağı tam olarak açıklanmamakla birlikte, in vitro fertilizasyonda ilk başarılı çalışma hamster gametleri ile 1969 yılında yapılmıştır. Bu çalışmalar spermatozoonun in vitro kapasite edilmesi ile memeli in vitro fertilizasyonunda yapılan ilk çalışmadır (Gordon, 1994). Chang (1959) tarafından yapılan tavşan yumurtalarının in vitro fertilizasyonu çalışması da klinik infertilite tedavisi gibi insan in vitro fertilizasyon (IVF) çalışmalarına önemli bir yol gösterici kaynak olmuştur. Bin sekiz yüz yetmiş sekiz ve 1953 yılları arasında memeli oositlerinde çok sayıda in vitro fertilizasyon çalışması yapılmıştır. Sığır oositlerinde ilk başarılı in vitro maturasyon (IVM) ve IVF çalışması Iritani ve Niwa (1977) tarafından Japonya da yapılmış, IVF metodu ile doğan ilk buzağı ise 1981 yılında elde edilmiştir. Bu çalışma, Brackett ve ark. nın (1982) ABD de yaptığı çalışmalara da öncülük etmiştir. İn vitro fertilizasyon ile elde edilen ilk buzağıdan sonra doğan iki IVF buzağısı da 1983 yılında Georgia da elde edilmiştir (Brackett ve Bousquet, 1984). In vitro fertilizasyon tekniği, temel bilimler ve uygulamalı bilimler alanında çok iyi kurulmuş bir teknolojidir. Embriyo üretimini sağlayan bu teknoloji bilimsel araştırmalarda, insanlarda infertilite tedavisinde, besi hayvanlarının üretiminin artırılmasında ve soyu tükenmekte olan hayvanların sayısının korunmasında kullanılmaktadır (Bavister, 2002). Reprodüktif biyoteknoloji, son 50 yıl içinde büyük gelişmeler kaydetmiştir (Çizelge ). Sığır embriyolarının in vitro üretimi (IVP) klasik ovulasyon indükleme teknikleri ve implantasyon öncesi embriyo gelişimi çalışmaları karşısında güvenilir bir alternatif olarak kabul edilmektedir
14 2 (Bavister, 1995). İnsanlarda, ilk başarılı IVF çalışmasını takiben yardımcı üreme teknolojilerini kullanan hasta sayısında hızla artış görülmüştür (Menezo ve ark., 2000). Türkiye de gerçekleştirilen ilk başarılı IVF çalışması, 1984 yılında Tekeli tarafından tavşanlar üzerinde gerçekleştirilmiş, Birler ve ark. (2002) tarafından yapılan IVF çalışması ile ülkemizde ilk IVF kuzuları elde edilmiştir. Çizelge Memeli in vitro fertilizasyonunun tarihsel gelişimi (Gordon, 2003) Yıl Olay Sperm kapasitasyonunun bulunması Tavşanda in vitro fertilizasyon İn vitro ortamda kapasite edilen sperm ile IVF İnsan oositinin in vitro fertilizasyonu Sığır oositinin in vitro fertilizasyonu IVF ile elde edilen embriyodan ilk insan doğumu IVF ile elde edilen embriyodan ilk buzağı doğumu Nükleer transfer ile koyunda ilk kopyalama IVM oositlerin IVF unun ardından doğan ilk buzağı IVP embriyoların transferi ile doğan ilk ikiz buzağılar Araştırmacı(lar) Austin, Chang Chang Yanagimachi ve Chang Bavister ve ark.; Edwards ve ark. Iritani ve Niwa Steptoe ve Edwards Brackett ve ark. Willadsen Hanada ve ark. Lu ve ark In Vitro Fertilizasyon Fertilizasyon; iki gametin birleşerek yeni bir bireyin gelişmesi ile ortaya çıkan karmaşık bir süreçtir. Başarılı bir in vitro fertilizasyon amacıyla sperm ve oosit hazırlığında, erkek ve dişi gametlerinin metabolik aktivitesi için mümkün olan en uygun kültür ortamına ihtiyaç duyulmaktadır. Spermatozoon-zona pellusida (ZP) karşılaşması ve bağlanması, gametler arası ilişkide ilk
15 3 aşamadır (Gordon, 1994). Akrozomdan enzim karakterli aktif maddelerin serbest kalması spermatozoon ve ZP arasındaki penetrasyonun şekillenmesi açısından zorunlu bir gelişmedir. Zona pellusida pek çok memeli türünde üç farklı glikoproteinden oluşur. Bunlar; Zona pellusida glikoprotein 1, 2 ve 3 tür (ZP1, ZP2, ZP3). Zona pellusida 3 ün spermatozoonla zona arasındaki bağın oluşmasında diğerlerine göre daha etkin olduğu bilinmekte ve bu işlem, türe özel olarak gerçekleşmektedir (Akyol, 2005). Bağlanma, ZP (ZP3) da bulunan sperm reseptörleri ve sperm plazma membranında bulunan proteinlerin bir araya gelmesi ile meydana gelmektedir (Gordon, 1994). Temel fertilizasyon süreci, boğa spermatozoonunun sekonder oositin ZP sında bulunan reseptörlere gevşek olarak tutunması ve ardından sıkıca bağlanması ile başlamaktadır. Bu bağlanma, tür spesifik olarak meydana gelmekte, boğa spermatozoonu yalnız inek oositinde bulunan ZP reseptörlerine bağlanabilmektedir (Gordon, 2003). Zona pellusidayı geçen spermatozoon perivitellin boşluğu da kısa sürede geçerek ovuma yaklaşmaktadır. Spermatozoon başı ovuma ulaşır ulaşmaz, ovum yüzeyinde bulunan çok sayıda mikrovillus tarafından sarılır. Plazma membranları arasında birleşme devam ederken aktif kuyruk hareketleri ile kuyruğun tamamı perivitellin boşluğa girer. Plazma membranı (oolemma) ile temas ve penetrasyon oositte ikinci mayoz bölünmeyi tetikler ve oositin bölünmesini tamamlayıp ikinci kutup hücresini de atmasıyla, oosit tam olarak fertilizasyona hazır hale gelmiş olur. Spermatozoonun ooplazma içine girmesinin ardından pronükleer formasyon ve singami gelişir. Kutup hücresinin atılmasını pronükleusun biçimlenmesi, gelişmesi ve birleşmesi izlemekte ve maternal-paternal kromozomların birlikteliği (singami) ile diploit durumun meydana gelmesi sonucunda fertilizasyon süreci tamamlanmaktadır (Brewis ve Wong, 1999). Fertilizasyonun gerçekleşebilmesi için oositin spermatozoon tarafından aktive edilmesi gerekmektedir. Bu uyarım olmadan oosit pronükleus formasyonu şekillenmemekte ve zigot haline gelememektedir. İnekte aktivasyon olgusunda vitellus hacmi, sıvının perivitellin boşluğa geçmesiyle
16 4 azalmaktadır. Aynı zamanda vitellus içinde bulunan spermin baş kısmı şişerek koyulaşmakta, jel haline gelmekte ve kendi karakteristik formunu kaybetmektedir. Böylece ortaya çıkan yapı spermatozoon başı formundan çok bir somatik hücrenin nükleusuna benzeyerek erkek pronükleusu oluşum sürecine girmektedir (Gordon, 1994). Spermatozoonun ooplazmaya girişiyle birlikte, nukleusu çevreleyen membran parçalanmakta ve kromozomların dekondenzasyon süreci başlamaktadır. Bu arada spermatozoonun orta ve kuyruk kısmı baştan ayrılmakta ve baş kısmının etrafı ovum sitoplazmasından köken alan yeni bir membranla sarılarak erkek proonukleusu oluşturulmaktadır. Bu olaylarla eş zamanlı olarak ikinci kutup cismini atan ovumda kromozomların etrafı, erkek pronukleus oluşumundaki gibi sitoplazmik bir membranla çevrilerek dişi pronukleusu şekillendirilmektedir. Pronuklear formasyon oluştuktan sonra her iki pronukleus ooplazma içinde merkeze doğru göç etmektedirler. Buluşmanın ardından pronukleus membranları erimekte, erkek ve dişi kromozom grupları birleşerek singami oluşturmaktadırlar. Singaminin oluşumuyla fertilizasyon aşaması tamamlanmaktadır (Hunter, 1996; Nagai, 2001). Fertilizasyon öncesi, fertilizasyon sırasında ve fertilizasyon sonrasında meydana gelen hücresel etkileşimler Şekil de resimlendirilmiştir.
17 5 Sperm ZP nın dış yüzüne bağlanır Oositte büzülme ile perivitellin boşluk büyür Kortikal granüller Aksesuar sperm Bir zona proteini ile etkileşime giren spermada Akrozom reaksiyonu (AR) 1. kutup cisimciği ^. Polispermi bloğu Hiperaktivasyon ve proteolitik enzimlerle ZP penetrasyonu ZP artık sperm penetrasyonuna izin vermez Kortikal granül döküntüleri Sperm, oositin plazma membranı ile kaynaşır Şekil Sığırlarda gamet etkileşimleri ve diğer olaylar (Gordon, 1994).
18 In Vitro Fertilizasyonu Etkileyen Faktörler Spermatozoon Hazırlama Teknikleri In vitro fertilizasyonun başarılı olabilmesi için, spermatozoonun kumulus hücrelerinden geçerek ooplazma içine girmesi ve erkek pronukleusun oluşum sürecine kadar olan fizyolojik ve biyokimyasal bütün aşamaları kusursuz bir şekilde tamamlaması gerekmektedir. Dolayısıyla uygun motilite ve yoğunlukta spermatozoonların bulunması zorunludur (Sungur ve Yurtaydın, 1991). Boğa sperması in vitro fertilizasyon işlemine dahil edilmeden önce içerdiği seminal plazma proteinlerinden ve dondurulmuş spermalarda, dondurma sırasında kullanılan yumurta sarısı ve gliserol gibi kriyoprotektanlardan arındırılmalıdır (Gordon, 1994; Leibfried-Rutledge, 1999). Bütün tekniklerde temel amaç, hareketli spermatozoon oranını artırmaktır. Ancak bu işlemler sırasında membran hasarlarının oluşması da kaçınılmaz bir durumdur. Membran hasarlarının gelişmesi durumunda, akrozomal ve sitosolik enzimler beklenenden daha erken salınmaktadır. İnek oositlerinin in vitro fertilizasyonunda adı geçen olumsuzluklardan dolayı pek çok laboratuarda, normalin çok üstünde (10 6 ) spermatozoon ile uzun süreli (20-24 saat) inkubasyon tercih edilmektedir (Gliedt ve ark., 1996; Yang ve ark., 1993) Spermatozoon Kaynağı In vitro fertilizasyonda kullanılan boğaların fertilizasyon yetenekleri arasında fark olduğuna dair değişik çalışmalar vardır. Örnek olarak, güçlü iyonik sıvıların (High Ionic Strength Medium-HIS) ve farklı boğa spermatozoonların
19 7 kullanıldığı bir çalışmada, %14-46 arasında fertilizasyon oranı tespit edilmiştir (Gliedt ve ark., 1996). Bracket-Oliphant (BO) vasatı ile direkt yıkama tekniğinin kullanıldığı başka bir çalışmada ise %51,5 ile %77,4 arasında bölünme oranı elde edilmiştir (Muyan, 1984). Bazı araştırıcılar ise, farklı boğa spermatozoonları ile in vitro fertilizasyon başarısının %13 - %94 arasında değiştiğini bildirmektedirler (Shioya, 1999; Yang ve ark., 1993). Boğalardaki bireysel farklılıklar mevsime, yaşa veya ejekulat kalitesine bağlı olabilmektedir. Ayrıca değişik boğalara ait spermatozoonların içerisinde bulunan dekapasitasyon faktör yoğunlukları da farklı olmakta yani seminal plazma kaynaklı düşük oranda fertilizasyon yeteneği ortaya çıkmaktadır (Abdoon, 2003; Mc Donald, 1989). Bazı boğaların spermatozoonlarının in vitro fertilizasyon yeteneğinin düşük olması, seminal plazmaya ve in vitro koşullarda spermatozoon yoğunluğunun ani düşüşüne bağlanmaktadır (Hafez, 1993; Mc Donald, 1989; Yang ve ark., 1993) Vasata Katılacak Spermatozoon Dozu In vitro koşullarda bir oositin fertilizasyonu için ortamda en az 5000 fertil spermatozoon bulunmalıdır. Ayrıca spermatozoon yoğunluğu, kapasitör ajanların miktarları ve inkubasyon süresi de fertilizasyon ve polispermi oranı üzerinde önemli ölçüde etkili olmaktadır. In vitro fertilizasyon laboratuarlarında yaygın olarak oosit başına 10x10 3 ile 20x10 3 arasında spermatozoon olacak şekilde fertilizasyon ortamı hazırlanmaktadır (Akyol, 2005). Saeki ve ark. (1995) tarafından yapılan bir çalışmada fertilizasyon vasatına değişik miktarda ve yoğunlukta spermatozoon katılmış ve Çizelge de verilen sonuçlar elde edilmiştir.
20 8 Çizelge Spermatozoon konsantrasyonunun BSA katkılı ve BSA katkısız vasatlarda in vitro fertilizasyon oranlarına etkisi (Saeki ve ark., 1995) Spermatozoon konsantrasyonu (hücre/ml) BSA katkılı fertilizasyon vasatı Oosit sayısı Fertil oosit sayısı-oranı (%) 65 9(14) 65 39(60) 67 60(90) 64 57(89) BSA katkısız fertilizasyon vasatı İncelenen oosit sayısı Fertil oosit sayısı-oranı (%) 2(3) 12(18) 51(77) 36(55) Fertilizasyon Vasatı Uygun IVF vasat sistemleri geliştirirken, sekonder oositin ve spermatozoon penetrasyonunun oluşabileceği ortamlar geliştirilmeye çalışılmaktadır. In vitro fertilizasyon sistemlerinde fertilizasyon vasatının in vivo ortamdaki şartları taklit edebilmesi, bir başka ifadeyle sekonder oosit ve kapasite olmuş spermatozoon için uygun bir ortam sağlaması ve spermatozoonun oosite penetrasyonunu kolaylaştırması gerekmektedir (Abdoon, 2003). Bu amaçla en çok tercih edilen fertilizasyon vasatı Tyrode nin Albumin Laktat Piruvat (TALP) vasatıdır (Gordon, 1994). Gordon (1994) a göre TALP vasatı ilk olarak Bavister ve Yanagimachi tarafından 1977 yılında hamsterler üzerinde geliştirilmiştir. İn vitro fertilizasyonda kullanılan diğer vasatlar ise; TCM-199, Ham s F- 10, Ham s F-12, BO, SFR 199-2, Waymouth vasatlarıdır. Kültür ortamlarına ise FCS, FSH, LH, bikarbonat, piruvat, laktat ve antibiyotik destek maddeleri eklenmektedir (Akyol, 2005) Ortam Isısı Farklı kültür sıcaklıklarının karşılaştırıldığı bir çalışmada 38,5ºC ve 40ºC nin fertilizasyon ve erken embriyonik gelişim döneminde benzer sonuçlar verdiği
21 9 ancak 41ºC nin bu dönemde zararlı etkilerinin olduğu bildirilmiştir (Rivera ve Hansen, 2001) Sığır oositlerinin in vitro fertilizasyonunda, ısının fertilizasyon üzerine etkileri araştırılmış ve IVF için en uygun ısı olan 39ºC de en yüksek fertilizasyon oranlarına ulaşıldığı bildirilmiştir. Yapılan bir çalışmada 37ºC deki inkubasyonda %60,8 lik bir bölünme oranı sağlanırken, bu oran 39ºC de %76,7 olarak saptanmıştır (Gordon, 1994) Ortamın Gaz ve Nem Yoğunluğu In vitro fertilizasyon sürecinde geleneksel olarak %5 CO2 ve hava ortamı kullanılsa da ; %5 CO2, %5 O2 ve %90 N2 ortamları gibi değişik atmosferlerle yapılan çalışmalar da bulunmaktadır (Gordon, 1994). Vasatın buharlaşmaması için inkübatör içerisindeki nemin maksimum olması sağlanmalıdır (Boone ve Shapiro, 1990). Sonuç olarak ortamın gaz ve nem yoğunluğu fertilizasyon oranını etkilemektedir In Vitro Fertilizasyon Kriterleri Shioya (1993) ya göre, in vitro fertilizasyonun belirlenmesi için önemli ölçütler şunlardır; 1. Ooplazma içinde spermatozoon kuyruğunun saptanması, 2. Spermatozoon başının ooplazma içerisinde görülmesi, 3. Erkek ve dişi pronükleusların ooplazma içinde varlığı, 4. Birinci ve ikinci kutup hücrelerinin saptanması, 5. Zona pellusida veya perivitellin boşlukta spermatozoon varlığı,
22 10 6. İkinci mayoz bölünmenin telofaz aşamasının yani oosit aktivasyonunun tespiti. Brackett ve ark. (1981) tarafından yapılan bir çalışmada ise perivitellin boşlukta çift kutup hücresinin görülmesi, bölünmelerin başlangıcı ve kortikal granüllerin kaybolması fertilizasyon ölçütü olarak kullanılmaktadır Mikromanipülasyon Teknikleri Gamet manipülasyon yöntemleri, pratikte kullanılmakla birlikte, normal spermatozoon-oosit ilişkisi hakkında yapılan araştırmalarda da denenmektedir. Fare, hamster, tavşan ve sığır oositlerine sperm enjeksiyonunun başarısını etkileyen faktörler hakkında birçok çalışma yapılmıştır (Markert, 1983; Keefer ve Brackett, 1987; Clarke ve Johnson, 1988; Lassalle ve Testart, 1988; Martin ve ark., 1988; Keefer ve ark., 1990). Spermatozoon motilitesinde anormallik veya spermatozoon sayısının az olduğu durumlarda kullanılan 4 yardımcı fertilizasyon tekniği bulunmaktadır. Bu teknikler; 1. Zona inceltme (Zona thinning) 2. Zona delme (Zona drilling) 3. Subzonal sperm enjeksiyonu (SUZI) 4. Intrasitoplazmik sperm enjeksiyonu (ICSI) (Gordon, 1994). İlk üç teknikte ZP bariyeri kaldırılmaktadır. Bununla birlikte bu tekniklerde spermatozoon hareketli ve vitellin membranla birleşebilme kapasitesine sahip olmalıdır. Dördüncü metot olan intrasitoplazmik sperm enjeksiyonunda ise spermatozoon ooplazma içine enjekte edilmekte, hem ZP bariyeri geçilmekte hem de spermatozoon-oosit membranı birleşmesi gerçekleşmektedir. İntrasitoplazmik sperm enjeksiyonu yönteminde spermatozoonun hareketli olmasına ihtiyaç yoktur, canlı hatta bozulmamış
23 11 olması yeterlidir. Bu yöntem, değerli evcil ve egzotik hayvan türlerinin spermatozoonlarının uzun süre saklanarak kullanılmasını sağlamakta, spermatozoonun kapasitasyon ve depolanma sorunlarının üstesinden gelinmesine yardımcı olmaktadır. Ancak, tüm bu 4 teknik de oosite zarar verme ve polispermi gibi bir dizi risk içermektedir. Bununla birlikte, bu teknikler çok pahalı ekipmanlar ve çok iyi yetişmiş personel gerektirmektedir (Keefer, 1990). Mikromaniplasyon yöntemlerinde, uzun mesafeli objektiflerle çalışabilen invert mikroskop veya bir alana sabitlenmiş mikroskop, mikromaniplatörler (Leitz ve Narashige en çok tercih edilen maniplatörlerdir) ve cam pipetlerin hazırlanabilmesi için iğne puller ile mikroforge sistemleri gerekmektedir. Oosit holding pipetinin ölçüleri araştırmacılara göre farklılık göstermekle birlikte, genellikle dış çapı j,m ve iç çapı da 5-20 j,m arasında olmaktadır. Enjeksiyon pipetlerinin şekli ve ölçüleri yapılacak tekniğe göre farklılık göstermektedir. Kısmi zona diseksiyonunda keskin uçlu mikropipetler kullanılırken, zona açma yönteminde keskin uçlu mikrokancalar tercih edilmektedir. Zona delmek için kullanılacak enjeksiyon iğneleri daha küçük dış çapa (4-8 j,m) ve iç çapa (2-5 j,m) sahiptir. Spermatozoon yerleştirme veya enjeksiyonu için kullanılacak enjeksiyon iğneleri daha konik ve daha büyük ölçülerde olmaktadır. Spermatozoon enjeksiyon iğnelerinin ölçüleri ise enjekte edilecek spermatozoonun büyüklüğüne bağlıdır. Pipetlerin basınç/emme kontrolü amacıyla geliştirilen farklı hidrolik sistemler mevcuttur. Mikropipetler, tüplerle bir mikrometre enjektörü veya mikroenjektör ünitesine bağlıdır. Tüp sistemi ve enjektör florinert, hafif silikon yağı ya da su ile doldurulmaktadır. Maniplatörün kurulum seçenekleri genellikle, ulaşılabilen ekipmanlara, laboratuarda kullanılmak üzere öğrenilen tekniklere ve personelin tercihine göre değişmektedir (Keefer, 1990).
24 Zona İnceltme Zona inceltme metodu ile normalden daha düşük sayıda spermatozoon bulunan durumlarda fertilizasyon gerçekleştirilebilmektedir. Sığır IVF de enzimatik yöntemle zona inceltme metoduyla yapılmış herhangi bir çalışma bildirilmemiştir. Bununla birlikte, insan IVF çalışmalarında fertilizasyon problemli hastalarda hafif tripsinizasyon tedavisi uygulanabilmektedir. Farelerde yapılan çalışmalarda, düşük spermatozoon konsantrasyonlarında pronaz enzimi ile kısmi zona inceltme yöntemi kullanılarak fertilizasyon sağlanmış ve bu yöntemin güvenli olduğu bildirilmiştir (Gordon, 2003). Zona inceltme metodu, geçmişinde fertilizasyon problemleri olan hastalarda kullanılmakta ve genellikle tripsinizasyon tedavisi uygulanmaktadır. Kiessling ve ark. (1988) nın yaptığı bir çalışmada, tripsinizasyon tedavisi ile fertilizasyonu sağlanan 8 oositten 2 tanesinin fertilize olduğu fakat gelişiminin devam etmediği bildirilmektedir. Mordel ve ark. (1992) tarafından zona inceltmenin etkinliğinin araştırılması amacıyla yapılan bir çalışmada, güvenilirliği ve düşük spermatozoon konsantrasyonu ile fertilizasyona ulaşılabilmesi amacıyla pronaz enzimi kullanılmış, çalışma sonucunda bu yöntemin, düşük penetrasyon yeteneği olan spermatozoona sahip erkekler için faydalı bir yöntem olduğu ortaya konmuştur Zona Delme Zona delme, ZP içine bulunan yolların lazer ablasyonu veya bir zona solventinin lokal olarak uygulanması ile kimyasal olarak mikro manipülasyonudur. Kısmi zona diseksiyonu (PZD) ise genellikle zonada yarık açmayı sağlayan mekanik bir tekniktir. Basovsky (1999) tarafından yapılan bir çalışmada, PZD yapılan oosit ensizyonu sonrası en düşük spermatozoon konsantrasyonu ile fertilizasyonda dikkat çekici bir artış elde edilmiştir. Bu tekniğin amacı her ne kadar oositin fertilizasyonunu kolaylaştırmak olsa da,
25 13 bu gibi teknikler insan ve diğer embriyoların hatching aşamasına yardımcı olmak için de uygulanmaktadır. Yapılan çalışmalarda, insan IVF embriyolarının %25-30 undan daha azı kültür aşamasında hatchinge ulaşabilmektedir ve hatching sürecine ulaşabilmesi umuduyla zonayı zayıflatmak için zona açma işlemleri uygulanmaktadır. Dokras ve ark. (1994), 2-5 günlük insan embriyolarının ZP larında yarık açılarak, bu işlemin kısmi ve tam hatching oranlarında önemli gelişmeler sağladığını bildirmişlerdir. Wazzan ve ark. (1990), fareler üzerinde yaptıkları bir çalışmada, epididimisten elde edilen spermatozoon kullanılarak zona delme metodu ile fertilizasyon başarısının arttığını belirtmektedirler. Proksimal epididimal tıkanmanın olduğu ve yalnız kaput bölgesindeki spermatozoonlara ulaşılabilen hastalarda bu tekniğin kullanılabileceği açıklanmıştır. Barlow ve ark. (1991), uzun süreli vazektomize edilen farelerden alınan spermatozoonlarla kısmi zona delme yöntemi ile başarılı bir fertilizasyonun elde edildiğini belirtmişlerdir. Edirisinghe ve ark. (1991) tarafından yapılan bir çalışmada ise çok düşük spermatozoon sayısına sahip farelerde zona delme yöntemi uygulanan oositlerde, herhangi bir uygulama yapılmayan oositlere oranla daha yüksek (%61-%6) fertilizasyon oranına sahip olduğu gözlenmiştir. İlk zona delme yöntemi fare oositlerinde, oosit zarından spermatozoonun girebileceği kadar bir delik açılarak gerçekleştirilmiş ve bu teknik ile canlı yavrular elde edildiği bildirilmiştir (Depypere ve ark., 1988). Rodent oositlerinde Tyrode s solüsyonu kullanılarak ZP da delik açılmasını takiben fertilizasyon uygulandığı ve başarılı olduğu bildirilmektedir (Gordon, 2003). Vanderhyden ve ark. (1989) tarafından gerçekleştirilen bir çalışmada rat oositlerinin ZP sını delmek amacıyla asit Tyrode kullanılmıştır. Fare ve hamster oositlerinde yapılan çalışmalarda ZP nın hatasız olarak delinmesinde lazer teknolojisinin başarılı olduğu belirtilmektedir. Bu türlerde yapılan lazerle zona delme çalışmaları ile düşük spermatozoon konsantrasyonlarında, embriyo gelişimine herhangi bir yan etki olmadan IVF
26 14 etkinliğinde gelişmeler sağlanmıştır. Son yıllarda lazer teknolojisinde meydana gelen bu gelişmeler, biyomedikal çalışmalar ve uygulamalar açısından yol gösterici olmuştur (Gordon, 1994). Katska ve ark. (1999), zona delme işlemi gerçekleştirilen sığır blastosistlerinin hatching olabilme oranının, kontrol grubundaki embriyolardan çok daha yüksek olduğunu rapor etmektedir. Park ve ark. (1999), hatching oranını artırmak amacıyla sığır embriyolarında 1.48 j,m diyot lazer ışını kullanarak yaptıkları bir çalışma sonucunda, hatchinge başlama ve başarı oranında dikkat çekici bir artış tespit etmişlerdir Subzonal Sperm Enjeksiyonu (SUZI) Subzonal sperm enjeksiyonu, ZP altına bir ya da daha fazla sayıda spermatozoon yerleştirme tekniğidir. Subzonal mikroenjeksiyon işlemi ile spermatozoonun ZP ya bağlanma süreci pas geçilmekte, bunu akrozom reaksiyonu takip etmekte ve daha sonra spermatozoon zona içindeki perivitellin yüzeye penetre olmaktadır. İnsanda yardımcı üreme yöntemlerinde 10 dan daha fazla spermatozoon ile SUZI yapıldığında polispermi sıkıntısı ortaya çıkmaktadır. Yapılan çalışmalar ortalama 4 spermatozoon enjeksiyonunun herhangi bir polispermi riski ortaya çıkarmadan fertilizasyon oranında artış meydana getirdiğini göstermektedir. Bu ve benzeri nedenlerle SUZI, fertilizasyon için gerekli mekanizmaların aydınlatılması amacıyla uygulanmıştır (Gordon,2003). Subzonal sperm enjeksiyonu yöntemi (aynı zamanda zona altına enjeksiyon (UZI), spermatozoon mikroenjeksiyon (SMI) ve spermatozoon transferi ile mikroenjeksiyon (MIST) olarak da adlandırılmaktadır) ile elde edilen ilk canlı yavru, Mann (1988) tarafından fareler üzerine yapılan bir çalışmada elde edilmiştir. Spermatozoonun perivitellin boşluğa mikroenjeksiyonu ya da SUZI, insan IVF çalışmalarında erkek infertilitesi
27 15 açısından etkili bir tedavi seçeneği olmaktadır. Subzonal sperm enjeksiyonu yöntemi ile birçok çocuk dünyaya gelmiştir (Gordon, 1994). Garrisi ve ark. (1993), insan IVF tekniğinde çok az sperma örneği ile yeterli hareketli spermatozoon elde edilebilmesi, oolemmaya erişim garantisi ve spermatozoon ile oositin direkt ilişkisi gibi avantajları nedeniyle SUZI tekniğinin kullanılmasını tavsiye etmektedir. Ancak başarılı bir SUZI için yüksek derecede teknik beceri, oositler için normal ph ve çevre kontrolünün çok sıkı denetlenmesi gerekmektedir. Sığır oositleri üzerinde çok sınırlı sayıda SUZI çalışması yapılmıştır. Yapılan çalışmalar ise Almanya (Schwiderski ve ark., 1990), ABD (Yang ve ark., 1990; Heuwieser ve ark., 1991) ve Tayland (Pavasuthipaisit ve ark., 1994) da gerçekleştirilmiştir. Subzonal sperm enjeksiyonu (SUZI) yöntemi sığırlarda, spermatozoon-oosit etkileşimi açısından dikkate değer bir teknik olarak belirtilmekle birlikte, fertilizasyon oranları genellikle düşük bulunmaktadır (Gordon, 1994) Intrasitoplazmik Sperm Enjeksiyonu (ICSI) Yardımcı fertilizasyon tekniklerinden biri olan intrasitoplazmik sperm enjeksiyonu (ICSI), spermatozoonun direkt oositin sitoplazması içine mekanik olarak yerleştirilmesi metodudur. Bu tekniğin kullanılması ile spermatozoon penetrasyonunu içeren kumulus hücresi-hiyaluronik asit matriks bariyeri, zona pellusida ve ooplazmik membran pas geçilmektedir. Intrasitoplazmik sperm enjeksiyonu yöntemi uygulanarak bu bariyerlerin pas geçilmesi ile fertilizasyon ve embriyo gelişiminde spermatozoon gibi çeşitli rollerin bu sürece etkisi ayrıntılı olarak araştırılabilmektedir (Chung ve ark., 2000). Intrasitoplazmik sperm enjeksiyonu yönteminde (aynı zamanda oosit sitoplazmasına direkt enjeksiyon (DISCO), direkt intrasitoplazmik enjeksiyon
28 16 (DICI), intrasitoplazmik enjeksiyon (ICI) ve sitoplazma içine mikroenjeksiyon (MIMIC) olarak da adlandırılmaktadır), herhangi bir spermatozoon tipi (spermatozoon başı, hareketsiz, ölü ve kusurlu spermatozoon) ile kapasitasyon ya da akrozom reaksiyonuna gerek kalmadan fertilizasyon sağlanabilmektedir (Gordon, 1994). Intrasitoplazmik sperm enjeksiyonu, küçük laboratuar hayvanlarında ve insanda kanıtlanmış bir yöntemdir. Intrasitoplazmik sperm enjeksiyonu insanlarda, özellikle erkek hastalarda gözlenen ciddi infertilite problemleri nedeniyle popülaritesi gittikçe artan bir tekniktir (Palermo ve ark., 1992). Intrasitoplazmik sperm enjeksiyonu başarısını etkileyen faktörler; Spermatozoonun ön tedavisi (immobilizasyon, akrozom reaksiyonu) Spermatozoon/sperma parametreleri Maternal yaş/oosit kalitesi Oosit zarının karakteri Spermatozoon depolanma alanı Stimülasyon protokolleri Polivinilpirolidon (PVP) kullanımı Mikromanipülatör tipi (Piezo, konvansiyonel vb.) Deneyim olarak sıralanmaktadır (Goto ve ark., 1997). Çiftlik hayvanlarında gamet mikromaniplasyon yöntemiyle yapılan en dikkat çekici çalışma Goto ve ark. (1990) tarafından gerçekleştirilmiştir. Bu çalışmada, in vitro şartlarda maturasyonu sağlanan oositin sitoplazmasına ölü boğa spermatozoonu enjekte edilerek embriyonik gelişme izlenmiş, sağlıklı, canlı ve normal bir buzağının doğumu ile araştırma sonuçlanmıştır. İnsan, fare ve tavşanlarda yapılan çalışmaların aksine, sığırlarda spermatozoon enjeksiyonu ile ilgili az sayıda çalışma bulunmaktadır. İlk ICSI buzağıları yıllar önce Japonya da doğmuş olsa da, bu türde başarıyı etkileyen faktörler hala yeterince açıklığa kavuşturulamamıştır. Ancak bu sonuç ile in
29 17 vitro şartlarda mature edilen sığır oositlerinin spermatozoon mikroenjeksiyonu yöntemi ile fertilize edilebildiği ve elde edilen zigotların gelişim aşamalarını tamamlayabildiği ortaya konmaktadır (Goto ve ark., 1990). Westhusin ve ark. (1984) tarafından yapılan sığır oositlerinde spermatozoon enjeksiyonu sonrası pronükleer biçimlenme çalışmasından beri birçok araştırmacı, sığırlarda ICSI tekniğinin geliştirilmesi amaçlı çok sayıda araştırma yapmıştır. Ancak ICSI tekniğinde en sık karşılaşılan problem, mikroenjeksiyon yapılan sığır oositlerinde düşük oranda canlı embriyo elde edilmesi olarak belirtilmektedir. Spermatozoon enjeksiyonu ile ilgili bir problem de belirsiz spermatozoon dekondenzasyon seviyesi ile mikroenjeksiyon sonrası pronükleer biçimlenme arasındaki ilişkidir. Sınırlayıcı faktörlerden biri, sığır oositlerinin enjeksiyon sürecine fare ve tavşan oositlerine oranla daha az duyarlı olmasıdır. Spermatozoon enjeksiyonu sonrası sığır oositlerinin ancak %2 si aktive olmaktadır. Bu nedenle sığır oositlerinde spermatozoon mikroenjeksiyonu sonrası canlı embriyo oranları diğer türlerden daha düşük olmaktadır. Diğer türlerden farklı olarak, sığır oositlerinin farklı tedavi yöntemleri ile aktive edilmesi gerektiği ortaya konulmaktadır (Chung, 1999). Intrasitoplazmik sperm enjeksiyonu, fertilizasyonda ve embriyo gelişiminde çeşitli spermatozoon bileşenlerinin etkisi gibi normal fertilizasyon sürecinin analizinde yararlı bir yöntemdir. Rutin olarak ICSI de, hareketli spermatozoonlar seçilerek enjeksiyondan hemen önce hareketsiz hale getirilir. Spermatozoon hareketsizliği, spermatozoon kuyruğunun mikroenjeksiyon pipeti ile petri tabanına bastırılarak kırılması (Keskintepe ve ark., 1997), kriyoprotektan olmaksızın dondurularak (Goto ve ark., 1990; Keefer ve ark., 1990) veya ses dalgaları (Keefer, 1989; Goto, 1993) gibi yöntemlerle gerçekleştirilmektedir. Bu hareketsizleştirme, büyük olasılıkla spermatozoon plazma membranında sebep olduğu hasar nedeniyle ICSI ile yapılan fertilizasyon oranlarında artışa neden olmaktadır (Dozortsev ve ark., 1995).
30 18 Boğa spermatozoonu, epididimis boyunca olan değişiklikler gibi bir takım etkenlerle, fiziksel ve kimyasal şartlara çok dirençli bir çekirdeğe sahiptir. Aynı durum insan spermatozoonu için de geçerli olmaktadır. Boğa spermatozoon çekirdeğinin düşük ısılara direnci, dondurulmuş-çözdürülmüş sperma ile yapılan suni tohumlamalar sonucu doğan milyonlarca buzağı ile kanıtlanmıştır. Diğer taraftan, 30 dakika boyunca 90 C ısıya maruz kalan insan spermatozoonlarının hamster oositine enjeksiyonunun ardından pronükleus geliştiği de ortaya konmuştur (Gordon, 1994). Katayose ve ark. (1992) tarafından yapılan bir çalışmada, 20 gün etanol/metanol içinde saklanan insan spermatozoonunun dekondenzasyon ve pronükleus gelişimi sağlayabildiği saptanmıştır. Deoksiribonükleik asit (DNA) ile spermatozoonspesifik temel proteinler, protaminler ve kromatini yoğunlaştıran olgular arasındaki ilişki spermatozoon çekirdeğini yapısal olarak dirençli ve genetik olarak inaktif tutmaktadır. Sığır gibi çiftlik hayvanlarında, spermatozoonun epididimisten geçişi sırasında gerçekleşen protaminlerin disülfid kemikleri ile yaptıkları geniş çapraz bağlantılar sayesinde spermatozoon çekirdeği fiziksel ve kimyasal etkenlere karşı daha dirençli hale gelmektedir (Gordon, 1994). Memeli spermatozoon DNA sı, mitotik kromozomlardan en az 6 kat daha yoğun bir özelliğe sahip olan en sağlam sıkıştırılmış ökaryotik DNA dır (Ward ve Coffey, 1991). Yapılan araştırmalar, sığır oositlerine sperm enjeksiyonunun SUZI tekniğinden daha yüksek fertilizasyon oranı sağladığını bildirmektedir. Sperm enjeksiyonu ile kısa kuyruklu spermatozoona bağlı infertilite problemi olan boğalarda başarılı fertilizasyonlar elde edildiği rapor edilmektedir. Bu gibi sonuçlar gösteriyor ki, boğa infertilitesi ya da fertilite zayıflığı gibi sebeplere bağlı durumlarda sperm enjeksiyonu IVF a oranla çok daha üstün olmaktadır (Heuwieser ve ark., 1992). Catt ve ark. (1994) tarafından yapılan bir çalışmada ICSI metodu ile yapılan fertilizasyonların SUZI metoduna göre tartışılmaz bir üstünlük sağladığı ortaya konmuştur. Aynı çalışmada, spermatozoon hasarının (spermatozoon kuyruğunun pipet ile kırılması) oositin normal fertilizasyon sürecini başarıyla tamamlayabilme oranını
31 19 artırmakta olduğu belirtilmektedir. Bununla birlikte, oositi aktive eden sinyallerin spermatozoon hasarıyla serbest kalan bileşenler olup olmadığı tam olarak açıklanmamıştır Spermatozoonların Hazırlanması İn vitro fertilizasyonda kullanıma hazır olabilmesi için ister taze ister dondurulmuş spermatozoon kullanılsın, spermanının mutlaka bir takım işlemlerden geçirilmesi gerekmektedir. Bu işlemler spermatozoon hücrelerinin basitçe yıkanması olabildiği gibi, yüksek motiliteye sahip normal spermatozoonların elde edilmesi amacıyla uzun yıllardır gelişmekte olan bazı tekniklerden bir ya da birkaçının kullanılmasını kapsamaktadır. Sperma kalitesi ve spermatozoon hareketlerinin zayıf olduğu durumlarda, spermatozoon ayırma teknikleri daha da önem kazanmaktadır (Gordon, 2003) Taze Boğa Spermatozoonunun Kullanılması In vitro fertilizasyon uygulamalarında taze spermatozoon daha çok insanlarda kullanılmakta, sığır çalışmalarında nadir olarak tercih edilmektedir. Araştırmalarda ve ticari uygulamalarda genellikle dondurulmuş spermatozoon kullanılmaktadır. In vitro fertilizasyon uygulamalarında erkek gametlerinin kullanılmasından önce, seminal plazma proteinlerinin hızla ve etkili bir şekilde uzaklaştırılması amacıyla sığır spermatozoonunun yıkanması zorunludur. Yıkama işlemi çoğunlukla santrifüjle sedimentasyon ve taze vasat içinde resüspansiyonu ile yapılmaktadır (Gordon, 2003). Verbercmoes ve ark. (2000), taze boğa spermatozoonunun motilitesi ve zar bütünlüğü üzerine santrifügasyonun etkisini inceledikleri bir çalışmada, seminal veya epididimal plazmadan spermatozoon örneklerinin elde edilmesi amacıyla santrifüj işleminin gerekli olduğunu tespit etmişlerdir. Araştırmacılar, spermatozoon
32 20 zarında herhangi bir mekanik hasara neden olmadan spermatozoon ve plazmanın ayrılmasında ortalama santrifüj hızının 3214 x g olduğunu belirtmektedirler Dondurulmuş-Çözülmüş Spermatozoon Kalitesinin Değerlendirilmesi Suni tohumlama istasyonlarında bulunan sığırlardan elde edilen spermanın dondurulabilmesi için spermanın mutlaka bilinen motilite ve normalite standartlarına uygun olması gerekmektedir. Bununla birlikte, dondurulmuş spermatozoonun motilitesinin ve diğer karakteristik özelliklerinin çözüldükten sonra da uygun olup olmadığının kontrolü gerekmektedir (Gordon, 2003) Swim-up Yöntemi Motilite, boğa spermatozoonunun reprodüktif kanaldan geçişini yani serviks girişinden oviduktun ampulla bölgesine ulaşabilmesi için gereken zorunlu bir özelliktir. Spermatozoon başının ZP içine girebilmesi için, spermatozoonun kuyruğu tarafından hareketli uyarı (hiperaktif motilite) gerekmektedir. Swimup tekniği 1980 lerde iyi hazırlanmış bir adım olarak birçok laboratuarda, sığır oositlerinde IVF çalışmalarında yüksek motiliteye sahip spermatozoon örnekleri elde etmekte kullanılmaya başlanmıştır (Gordon, 2003). Parrish ve ark. (1984) tarafından yapılan bir çalışmada, swim-up yöntemi kullanılarak elde edilen yüksek motiliteye sahip spermatozoonların kullanılmasının fertilizasyon oranlarını önemli ölçüde artırdığı ortaya konmuştur.
33 21 Swim-up prosedürü, çözdürülmüş spermatozoon örneğinin alınarak genellikle kalsiyum içermeyen Tyrode s Albumin Laktat Piruvat (TALP) vasatı gibi uygun vasatlar ile yeterli miktarda üzerinin kaplanmasını içermektedir. Kalsiyum içermeyen bu vasatlar hem swim-up yönteminde hem de sonradan yapılacak olan spermatozoon yıkama işlemlerinde kullanılmaktadır. Sperma örneğinin üzerinin vasat ile kaplanmasının ardından altta bulunan spermadan motil spermatozoonların TALP vasatının üst yüzeyine yüzebilmesi amacıyla dakika süreyle 39 C deki inkübatörde bekletilmektedir. Swim-up tüplerinin açılandırılması (45 eğimle) ile tüplerin dik olarak bekletilmesine oranla daha fazla motil spermatozoon elde edilebilmektedir. Buna ek olarak TALP vasatına 5mM glisin eklenmesinin de spermatozoon kalitesini ve izleyen embriyo gelişimini artırdığı belirtilmektedir (Gordon, 2003; Henkel ve Schill, 2003). Swim-up yönteminin avantaj ve dezavantajları Çizelge de açıklanmaktadır. Çizelge Klasik swim-up metodunun avantaj ve dezavantajları (Henkel ve Schill, 2003). Avantaj l arı Kolay uygulanabilir Ucuz Yüksek motiliteye sahip spermatozoon elde edilebilmekte Dezavantajları Yüksek spermatozoon sayısı ve motilitesi gerektirmekte Diğer yöntemlere göre daha az sayıda spermatozoon elde edilmekte Spermatozoonun serbest oksijen radikalleri nedeniyle zarar görme riski Normal kromatine sahip spermatozoon yüzdesinde önemli düşüş görülmekte
34 Percoll Yoğunluk Farkı Yöntemi Spermatozoon ayırma yöntemlerinden bir diğeri olan Percoll (Polivinilpirolidon (PVP) ile kaplı silika parçacıklarının koloidal süspansiyonu) metodu 1980 lerde yaygın olarak kabul görmeye ve insan yardımcı üreme teknolojisinde başarıyla kullanılmaya başlanmıştır. Percoll ayırma yönteminin alternatif yöntemlere göre iki önemli avantajı bulunmaktadır: (i) en fazla motil spermatozoonun elde edilebilmesi ve (ii) motil spermatozoonun seminal plazma, somatik hücreler ile ölü ve morfolojik olarak anormal spermatozoonlardan hızla ayrılmasıdır. Bir diğer dikkat çekici özelliği de motil spermatozoonun fertilizasyon kapasitesini düşürebilen olası serbest oksijen radikallerinden korumasıdır. Bilinmektedir ki, süperoksit radikalleri, hidrojen peroksit ve hidroksil radikali spermatozoonun lipit zarında peroksidatif hasara neden olabilmektedir. Percoll yönteminin sayılan tüm bu avantajlarının yanında, içeriğindeki yüksek seviyede endotoksin gibi bazı dezavantajları da bulunmaktadır (Çizelge ). Bu nedenle günümüzde Percoll yöntemine birçok alternatif yöntem geliştirilmektedir. Bunlardan biri de HEPES tamponlu izotonik vasat içinde bulunan kaplanmış koloidal silika parçacıkları ile PureSperm yoğunluk farkı metodudur (Gordon, 2003, Henkel ve Schill, 2003). Dondurulmuş çö zdürülmüş sığır spermasında motil ve motil olmayan spermatozoonların ayrılması amacıyla uygulanan Percoll yoğunluk farkı yöntemi kısaca, kullanılan test tüpünün en üst yüzeyinden en alt yüzeyine doğru yoğunluk artışı (%45 Percoll, %90 Percoll ve motil spermatozoon) şeklinde açıklanmaktadır. Uygulama sırasında tüpün en alt kısmına %90 Percoll, ortaya %45 Percoll ve en üste de spermatozoon konulmakta, ardından tüp dakika süreyle santrifüj edilmektedir. Santrifüj işlemi sona erdiğinde, yüksek motiliteye sahip spermatozoonlar tüpün en alt yüzeyinde yer almaktadır (Henkel ve Schill, 2003).
35 23 Çizelge Percoll yoğunluk farkı metodunun avantaj ve dezavantajları (Henkel ve Schill, 2003). Avantaj l arı Yüksek motiliteye sahip spermatozoon elde edilebilmesi Çok düşük sperm yoğunluğuna sahip ejakulattan bile spermatozoonların ayrılabilmesi Lökositlerin başarıyla ayrılabilmesi Serbest oksijen radikallerinin önemli miktarda azaltılabilmesi Dezavantajları Farklı vasatlar arasında iyi evre oluşumunun zamanla azalması Pahalı olması Muhtemel endotoksin riski bulunması Percoll un IVF/ICSI de fazla kullanılamaması Sığır embriyolarının in vitro üretiminde Percoll yoğunluk farkı metodunun kullanılmasının sebebi tam olarak açıklanamamakla birlikte, normalden daha yüksek oranda erkek yavru elde edilmektedir (Gordon, 2003). Rheingatz ve ark. (2000) IVP sistemlerinden elde edilen blastosistlerde cinsiyet oranında Percoll ile swim-up yöntemlerini karşılaştırdıkları bir çalışmada, swim-up metodu ile elde edilen embriyolarda daha yüksek oranda erkek embriyo elde ettiklerini belirtmektedir Glass-wool Filtrasyon Tekniği Glass-wool filtrasyon yöntemi, seyreltilmiş boğa spermasının cam boncuklardan oluşan bir katmandan geçirilerek canlı spermatozoonların filtreden geçerken, ölü spermatozoonların bu katmanda tutulması prensibine dayanmaktadır. İnsan IVF uygulamalarında çözdürülen spermatozoon örneklerinin cam boncuklardan meydana gelen sütunlardan filtrasyonu ile elde edilen motil spermatozoon sonuçlarının, swim-up metodundan çok daha fazla olduğu ortaya konmuştur (Çizelge ). Bu çalışmalar göstermiştir ki glass-wool filtrasyon tekniği ile daha kaliteli spermatozoon popülasyonu elde edilmektedir (Gordon, 2003).
36 24 Çizelge Glass-wool filtrasyon metodunun avantaj ve dezavantajları (Henkel ve Schill, 2003). Avantaj l arı Kolay uygulanabilmesi İyi motiliteye sahip spermatozoon elde edilebilmesi Lökositlerin başarıyla ayrılabilmesi Serbest oksijen radikallerinin önemli miktarda azaltılabilmesi Çok düşük spermatozoon yoğunluğundaki ejekülattan dahi spermatozoon elde edilebilmesi Dezavantajları Pahalı olması Diğer spermatozoon ayıraç metotları kadar temiz filtrat elde edilememesi Kalıntı ve doku döküntülerinden yeterince temizlenememesi Hiyaluronik Asit Kullanımı Boğa spermasından motil spermatozoon izolasyonunda hiyaluronik asit kullanılması yararlı olabilmektedir. Düşük motiliteye sahip spermanın çözdürülmesinin ardından hiyaluronik asit kullanılması, IVF sonuçlarının daha iyi olmasını sağlayabilmektedir (Gordon, 2003) Sperma Yıkama Tekniği Boğa spermasının, plazma proteinlerinden hızlı ve etkili olarak uzaklaştırılması amacıyla yıkanması pratik bir yöntemdir. Bu teknik aynı zamanda yumurta sarısı ve gliserol gibi kimyasal maddeleri içeren kriyoprezervatif vasatların uzaklaştırılmasında da etkili olmaktadır. Boğa spermasının istenmeyen maddelerin uzaklaştırılmasında taze vasat içinde
37 25 sentrifugal sedimantasyon ve resüspansiyon ile yıkama işlemi en hızlı ve etkili yöntemdir. Fakat bu yöntemde santrifüj sırasında spermatozoonları öldürme ve hareketliliğinde azalmaya yol açmaktadır (Gordon, 1994) Oositin Hazırlanması İn vitro fertilizasyon sırasında, spermatozoonun in vitro ortamda maturasyonu sağlanan sığır oositlerine daha rahat ulaşabilmesi amacıyla oosit çevresinde bulunan kumulus hücre katının bir kısmının ya da tamamının, uygun boyutlarda mikropipetler ile mekanik olarak, hyaluronidaz gibi enzimler kullanılarak, sodyum sitrat gibi kimyasal ajanlar veya vorteks yardımıyla soyulması gerekmektedir. Oosit temizleme işlemlerinin fertilizasyon yeteneğini ya da takip eden embriyonik gelişme oranını azaltabileceği düşünülmekle birlikte, bu durum tam olarak açıklanmamıştır (Gordon, 1994). Bottcher ve ark. (1990) tarafından yapılan bir çalışmada kumulus hücrelerinin uzaklaştırılmasının hasar görmüş ZP ve anormal ooplazma oranını önemli ölçüde artırdığı belirtilmektedir. Diğer taraftan Cox (1991), yaptığı bir çalışmada mekanik olarak kumulus hücreleri uzaklaştırılan ve kültür ortamında mature edilen sığır oositlerinde, tedavinin hiçbir etkisinin olmadığını rapor etmektedir. Hamster, fare ve insan oositlerinden farklı olarak, sığır oositleri yüksek hücre içi lipit içeriği nedeniyle koyu görünüme sahiptir. Germinal vezikül ve/veya pronükleusun tanımlanabilmesi için yüksek hızla santrifüj edilerek hücre içi lipidin uzaklaştırılması gerekmektedir, çünkü sitoplazmanın koyu görünümü hücre içi yapıların ve mayotik durumun tam olarak değerlendirilmesini zorlaştırmaktadır (Goodrowe ve ark., 1988). Oositlerin santrifugasyonu ilk olarak Wall ve ark. (1985) tarafından, transgenik sığır ve domuz zigotları üretmek amacıyla pronükleer enjeksiyon işleminde gerçekleştirilmiştir. Uygulanan santrifüjün embriyolar üzerine herhangi bir olumsuz etkisinin olmadığı tespit edilmiştir. Rho ve ark. (1998), yaptıkları bir
38 26 çalışmada sperm mikroenjeksiyonu amacıyla oositlerin 6000 x g de 5 dakika santrifüj edilmesinin etkili olduğunu belirtmektedir. Sığır oositlerinin ICSI öncesi santrifüjü ile mikroenjeksiyon pipeti içindeki spermatozoonun oosit sitoplazması içine verilişi net olarak görülebilmektedir. Iwasaki ve ark. (1990) tarafından yapılan bir çalışmada, in vitro ortamda üretilen sığır blastosistlerinin trofoblast hücrelerinde ve iç hücre kitlelerinde (inner cell mass-icm) karakteristik olarak bulunan birçok lipit damlacıklarının varlığı kanıtlanmaktadır. Bu lipitler sitoplazma içinde damlacıklar halinde bulunmakta, genellikle endoplazmik retikulum ile yakın uzaysal ilişki göstermekte ve hücreler için yalnız besin kaynağı olarak değil, aynı zamanda membranların fonksiyonları ve fiziksel özelliklerinin modifikasyonunda da etkili oldukları düşünülmektedir. Ancak embriyoların yüksek hızla santrifüjünün ardından zigottan hücre içi lipitlerin yaklaşık %90 nın uzaklaştırılmasının, in vitro ve in vivo yavru canlılığı üzerinde zararlı bir etkisinin olmadığı belirtilmektedir (Nagashima ve ark., 1995) In Vitro Maturasyon ve Fertilizasyon Sırasında Oositte Meydana Gelen Fizyolojik Değişiklikler Birçok memeli türünde oositler, mayoz bölünmenin metafaz II aşamasında ovule olur ve spermatozoon ile fertilizasyon sırasında veya yapay stimülasyonlar ile (partenogenetik aktivasyon gibi) aktive olana kadar bu aşamada durur. Nükleer klonlama gibi başarılı embriyo biyoteknoloji prosedürlerinin anlaşılabilmesi için in vitro oosit aktivasyonu fenomonunun da çok iyi anlaşılabilmesi gerekmektedir. İn vivo şartlarda mayoz bölünmenin metafaz II aşamasında durmasında metafaz destekleyici faktör (MPF) ve/veya sitostatik faktörün (CSF) rolü olduğu düşünülmektedir. Metafaz destekleyici faktör mayalar, memeliler, omurgasızlar ve amfibik canlılarda bulunan siklin ve P34 protein molekülleridir. P34 protein miktarı hücre siklusu boyunca sabittir ve bu protein fosforile ve fosforile olmayan olarak 2 formda
39 27 bulunmaktadır. Fosforile olmayan formu kinaz aktivitesine sahiptir. Siklin proteinleri ise interfaz aşamasında sentezlenmekte ve metafaz sırasında pik yapmaktadır. P34 cdc2 alt ünitesi ile siklin bağlayan kompleksler kinaz aktivitesini harekete geçirmektedir. Metafaz destekleyici faktörün aktif formu ise hücrelerin interfazdan M-fazına geçişini sağlamaktadır (Gilbert, 1991; Parrish ve ark., 1992). Normal hücre siklusunda siklinler periyodik olarak azalıp artmaktadır. Böylece MPF inaktif ve aktif hale geçerken hücreler de interfaz ve metafaz aşamasında görünmektedir. Amfibik ve memeli oositlerinde sürekli sentezlenen CSF veya c-mos gibi bir grup proteinin, siklin B nin çözülmesini sağlayarak MPF nin sürekliliğine ve metafazın bulunduğu aşamada durmasına neden olduğu düşünülmektedir. Aynı zamanda spermatozoonun matur oosite penetrasyonunun (fertilizasyon) hamster, fare, tavşan, sığır ve koyunda hücre içi serbest kalsiyumun periyodik olarak azalıp artmasına yol açtığına inanılmaktadır (Yang ve ark. 1994). Uzun süreli kalsiyum salınımının biyolojik fonksiyonları tam olarak bilinmemekte fakat hücre içi serbest kalsiyum artışının CSF nin inaktive olmasını sağladığı düşünülmektedir. Nükleer oluşumun geri dönüşümsüz olarak şekillenmesi safhasında sürekli sentezlenen olgunlaşmamış CSF nin inaktive edilebilmesi amacıyla, fertilizasyon sırasında serbest kalsiyumun birkaç saat süreyle periyodik olarak salınması gerekmektedir. Aktivasyonda serbest kalsiyumun çoklu pulzatil kalsiyum halinde salınımları çeşitli olgularla desteklenmektedir (Yang ve ark., 1994). Mayozisin başlaması sırasında oositler, kendisini fertilizasyon için hazırlayan bir seri nükleer ve sitosolik değişiklikler geçirmektedir. Bu değişiklikler çekirdek zarfının çözülmesi (GVBD), kromatin yoğunlaşması, iğ formasyonu ve sitosolik değişiklikler, organellerin yeniden dağılması ve Ca 2+ un serbest kalma mekanizmasının olgunlaşmasıdır. Düzenlenen progresyon ve maturasyon süresince bu değişikliklerin tamamlanması, uygun
40 28 fertilizasyonun ve gelişimin başlamasını garantilemektedir. İki kinazın aktivasyonu (histon H1 kinaz ve mitojen aktive edilmiş protein (MAP) kinaz), mayozun başlaması ve tamamlanması için başvurulması gereken bir olgudur. Histon H1 kinaz veya MPF, siklin-b ve p34 cdc2 alt ünitelerinden oluşmaktadır ve memeli oositlerinde mayozun başlatıcısı olarak kabul edilmektedir. Germinal vezikül çözünmesi ve mayozun tamamlanmasında, histon H1 kinaz tarafından histon, laminalar ve mikrotubüllerin fosforilasyonu şarttır (He ve ark., 1997). Kalsiyum salınımının, birçok hücre tipinde mayotik ve mitotoik geçişe katıldığı farklı çalışmalarda gösterilmiştir. Memeli oositlerinde hücre içi Ca 2+ salınması fertilizasyona eşlik etmekte ve embriyonik gelişimi aktive etmektedir. Ancak maturasyonda Ca 2+ salınmasının rolü tam olarak açıklanamamaktadır (Homa, 1995). Fare ve hamster oositlerinde Ca 2+ GVBD dan önce yükselir, bununla birlikte bu türlerde GVBD ın tamamlanması için gerekli görülmemektedir. Sığır ve domuz oositlerinde ise Ca 2+, GVBD ve mayozun tamamlanabilmesi için gereklidir (Kaufman ve Homa, 1993). Memeli oositlerinde Ca 2+ salınımında, 2 hücre içi reseptör/kanal rol oynamaktadır. Bunlardan en çok karşılaşılanı 1,4,5,-inositol trifosfat reseptörüdür (InsP3R). Fare oositlerinin maturasyonunda Ca 2+ salınımını sağlamakta ve fertilizasyon sırasında Ca 2+ salınımı ile fare neslinin devamında kritik rol oynamaktadır. Kas hücrelerindeki predominant Ca 2+ kanalı olan ryanodine reseptörünün (RyR), fare, sığır ve domuz oositlerinde Ca 2+ salınımında etkili olduğu rapor edilmiştir (Swan, 1992). Fertilizasyon süresince Ca 2+ yükselmekte ve histon H1 kinaz ile MAP kinaz kritik bir noktada birbirini etkilemektedir. Mayoz bölünmenin tamamlanması için fertilizasyonda spermatozoon tarafından Ca 2+ yanıtı uyarılmakta ve kinaz aktivitesinde sapma meydana gelmektedir (Homa, 1995). Kalsiyum iyonunun artışı ilk olarak spermatozoonun penetre olduğu bölgede başlamakta ve ardından oositin tüm yüzeylerine yayılmaktadır.
41 29 Kalsiyum iyonunun tekrarlayan salınımı, nörotransmitterler, hormonlar ve büyüme faktörlerine karşı çeşitli somatik hücrelerin yanıtı ile şekillenmektedir. Fertil oositlerde Ca 2+ salınımının diğer bir rolü de ekinodermler, kurbağalar ve memelilerde kortikal granüllerin ekzositozu ile polisperminin engellenmesidir. Mekanizması tam olarak aydınlatılamasa da, Ca 2+ iyonunun hücre siklusunun ilerlemesinde çok önemli etkisi olduğu düşünülmektedir (Whitaker ve Patel, 1990). Farelerde spermatozoonun oosite penetrasyonu ile Ca 2+ salınımı uyarılmaktadır. Bunun sonucunda kısa aralıklarla 3-4 kez geçici Ca 2+ dalgası oluşmakta veya 3-4 dakika süren uzamış Ca 2+ salınması meydana gelmektedir. İlk salınımları takiben saniyelik keskin Ca 2+ cevapları ortaya çıkmaktadır. Hamster oositlerinde Ca 2+ değeri nm e yükselmektedir. Bu döngü birbirini tekrarlayarak 3 saat kadar sürebilmektedir. Domuzda Ca 2+ salınımı farelere benzemekle birlikte 18 dakika aralıklarla meydana gelmekte ve uzayan Ca 2+ yükselişi 2,5 saat içinde ortaya çıkmaktadır (Miyazaki ve ark., 1993). Fertilizasyon sırasında sığır oositinde 3 farklı hücre içi Ca 2+ salınım aşaması meydana gelmektedir. Bu aşamalardan en önemlisi spermatozoon tarafından uyarılan Ca 2+ yükselmesidir. Kalsiyum iyonunun bu dönemdeki değeri ortalama 56±11 nm dur. Pik yaptığı dönemlerde ise bu değer 870±184 nm e yükselmektedir. Belirlenen bu değer kısa süreli yükselmelerde ulaştığı değerden (420±27nM) çok yüksektir. Sperm penetrasyonundan sonra hücre içi Ca 2+ salınımının artması, oositinin iç ve dış çeperinde oluşan delinmeleri göstermektedir. Fertilizasyondan 9 saat sonra (spermatozoon penetrasyonundan yaklaşık 3-5 saat sonra) bir oosit için ortalama 2,8±1,6 kez ve 24,3±7,3 dakika süren Ca 2+ salınımı olmaktadır (Chung, 1999).
42 Partenogenezis Oositin, spermatozoon ile herhangi bir etkileşim olmadan gelişimine devam etmesi partenogenezis olarak adlandırılmaktadır. Sığır gibi memeli canlıların büyük çoğunluğunda, matur oositler fertilizasyona kadar metafaz II aşamasında beklemekte veya partenogenetik aktivasyon meydana gelmektedir. Partenogenetik olarak üretilen embriyolar özellikle, embriyo kültür sistemlerindeki problemlerin ve IVF laboratuarlarının kalite kontrolüne farklı bakış açılarının ortaya konmasında kullanılmaktadır. Presicce ve Yang (1994) tarafından yapılan bir çalışmada, sığır oositlerinin etanol ve siklohekzimid ile aktivasyonunda yaşlı oositlerin genç oositlerden daha hızlı aktive olduğu belirtilmektedir. Aynı çalışmada, kendiliğinden aktivasyon oranlarının yaşlı oositlerde (%6-57), genç oositlerden (%0-14) daha yüksek olduğu saptanmıştır. Lechniak ve ark. (1998), kendiliğinden partenogenetik aktivasyonun suboptimal kültür şartlarına işaret ettiğini ve araştırıcılar tarafından döllenmeyen sığır oositlerinin bulunduğu bu grubun, in vitro embriyo üretimi amacıyla kullanılan vasatın verim oranının değerlendirilmesinde kullanılması gerektiğini belirtmektedirler. Partenogenetik embriyolar genellikle, kalsiyum konsantrasyonu artışı, oositin eylem potansiyelinin uygulanışı veya aktivasyonun başlaması ve embriyo gelişiminde spermatozoonla ilişkili faktörlerin kullanılması ile üretilmektedir. Shi ve ark. (2000), sığır oositlerinde ilk 3 hücre siklusunun bölünmesini, ooplazma içinde depolanan maternal mrna kontrolü ile ilerletmişlerdir. Aoyagi ve Konishi (1994) ise sığır oositlerinin elektrik stimülasyonu ve kalsiyum iyonofor-siklohekzimid kombinasyonunun embriyo gelişiminin blastosist aşamasına ulaşmasında en uygun metot olduğunu ortaya koymuşlardır.
43 Oosit Aktivasyonu Fertilizasyon sürecinde spermatozoon ve sekonder oosit arasında meydana gelen etkileşim sonucu bir dizi morfolojik ve biyokimyasal değişim ortaya çıkmaktadır. Birçok havyan türünde bu süreçteki anahtar mekanizma kalsiyum sinyalleridir. Spermatozoonun oosite penetrasyonundan birkaç dakika sonra hücre içi rezervlerden hızlı ve geçici kalsiyum hareketleri meydana gelmektedir. Bu sinyaller, endoplazmik retikulumda veya hücre dışında bulunan kalsiyum rezervlerindeki kalsiyum kullanılarak meydana getirilmektedir (Tosti ve ark., 2002). Spermatozoon tarafından doğal yolla oluşturulan aktivasyon olgusu mayoz bölünmenin yeniden başlamasına ve 2. kutup hücresinin atılmasına yol açmaktadır. Bunun sonucunda pronükleus şekillenmekte, DNA sentezi başlamakta ve embriyonik bölünme meydana gelmektedir. Yapay oosit aktivasyonu sığır oositlerinin intrasitoplazmik sperm enjeksiyonu işleminde ve soyu tehlike altındaki hayvan türlerinin klonlanma prosedürlerinde uygulanması zorunlu bir adımdır (Grabiec ve ark., 2007). Fertilizasyonun ardından pronükleer DNA sentezinin aktivasyonu, özellikle erken embriyonik gelişim aşamasında önemli bir olgudur. Fertilizasyondan kısa süre sonra mayoz bölünme yeniden başlayarak, aktive edilen oositin kromatinlerinin yarısı 2. kutup hücresi ile dışarı atılmaktadır. Ardından kalan oosit kromatini ile spermatozoon başı maternal ve paternal pronükleusa dönüşerek pronükleer gelişim veya pronükleer formasyon süreci tamamlanmış olmaktadır. İlk mitoz bölünmenin profaz aşamasında maternal ve paternal DNA birleşerek iki katına çıkmakta, ardından blastomerler eşit olarak ayrılarak ilk embriyo bölünmesi ortaya çıkmaktadır (Soloy ve ark., 1997).
44 Oosit Aktivasyon Yöntemleri Fare ve insan oositlerinin aksine, sığır oositleri mikroenjeksiyon pipetinin mekanik uyarımı ile aktive edilememektedir ve ICSI işleminden önce veya sonra aktivasyon uygulamasının yapılması gerekmektedir. Sığır oositlerinde aktivasyon yöntemleri; İyonomisin (A23187) (Ware ve ark., 1989), Etanol (Nagai, 1987), 6-dimetilaminopürin (DMAP) (Keskintepe ve ark., 2002) Elektrik uyarımı (Kono ve ark., 1989), Sikloheksimid (CHX) (Sirard ve ark., 1989), Sitosiyalizin (Lagutina ve ark., 2004) Puromisin (Murase ve ark., 2004) uygulamalarıdır. Sığır oositlerinin aktivasyonuna yönelik birçok araştırma yapılmış ve çok çeşitli kombinasyonlar geliştirilmiştir. Chung (1999), sığır oositlerinde farklı aktivasyon metotlarının etkilerini araştırdıkları bir çalışmada, ICSI sonrası 5 µm iyonomisin (A23187), 5 µm iyonomisin + 1,9 mm DMAP kombinasyonu ve 5 µm - 50 µm iyonomisin kombinasyonları sonucunda en etkili yöntemin 5 µm iyonomisin + 1,9 mm DMAP kombinasyonu olduğunu bildirmişlerdir. Chen ve ark. (1997) nın yaptıkları bir çalışmada ise 50 µm kalsiyum iyonofor ve %7 etanol karşılaştırılmış ve başarılı sonuçlar elde edilmiştir. İntrasitoplazmik sperm enjeksiyonunda en çok tercih edilen yöntemler 5-50 µm kalsiyum iyonofor, %7 etanol, 1,9 mm DMAP, 5 µm iyonomisin + 1,9mM DMAP kombinasyonu tedavileri ve elektrik stimülasyonu olarak belirtilmektedir (Chung, 1999). İyonomisin uygulaması, hayvanlarda oosit aktivasyonunda sıklıkla kullanılan ve en etkili yapay uyarıcılardan bir olarak bildirilmektedir. Kalsiyum iyonofor, oosit aktivasyonu için düşük seviyede olması gereken maturasyon destekleyici faktörün (MDF) dengelenmesinde en sık kullanılan kimyasaldır. Oosit aktivasyonu kalsiyuma bağımlı bir olaydır
45 33 ve iyonomisin doğrudan hücre dışı kalsiyum salınımı sağlamaktadır. Oosit aktivasyonunda kalsiyuma bağımlı süreçlerin araştırılmasında iyonomisin çok kullanışlı bir kimyasal olarak bildirilmektedir. Ancak hayvan türlerine göre farklı stimülatörlerin etkinlikleri de farklılık gösterebilmektedir. Domuz oositlerinde in vitro inseminasyonun ardından elektriksel uyarımla aktivasyon sonuçlarının iyonomisin ile aktive edilen oositlere oranla daha başarılı olduğu belirtilmektedir (Wang ve ark., 1998). Collas ve ark. (1993) tarafından yapılan bir çalışmada, sığır oositlerinde elektrik uyarımından dakika sonra histon H1 kinaz aktivitesi düşüşe geçerken, iyonomisin uygulamasından 5 saat sonra bu aktivitenin düştüğü belirlenmiştir. Elektrik uyarımları geçici Ca 2+ artışını çok hızlı etkilerken, iyonomisin uygulaması geçici Ca 2+ artışında küçük yükselmeler sağlamaktadır. Sığır oositlerinde etanol ve iyonomisin ile aktivasyon yöntemleri karşılaştırıldığında, oositin yaşının önem kazandığı bildirilmektedir (Ware ve ark., 1989; Soloy ve ark., 1997). Etanol, metafaz II aşamasında bulunan oositi aktive etmekte ve ileri embriyo aşamalarında plazma membranından IP-3 ün salınmasına yol açarak, IP-3 kaynaklı Ca 2+ salınımını desteklemektedir. Nagai (1987), etanol ile aktivasyonda 27 saatlik maturasyonda en yüksek etkinin alındığını belirtmektedir. Maturasyon süresi uzun olan oositlerin aktivasyon oranları, kısa sürede mature edilen oositlerden daha yüksek bulunmuştur. Son yıllarda yapılan birçok çalışmada, iyonomisin ile protein fosforilasyon inhibitörü olan DMAP veya protein sentez inhibitörü olarak CHX kombinasyonları kullanılmıştır (Susko-Parrish ve ark., 1994; Soloy ve ark., 1997). Dimetilaminopürin uygulaması ile pronükleer formasyon ve birinci mitotik hücre siklusunun interfaz aşaması meydana gelmektedir. Siklohekzimid, DMAP gibi protein desteğinin devam etmesinin yanı sıra DNA replikasyonunu başlatması amacıyla da kullanılmaktadır (Yoo ve ark, 2003).
46 34 Birçok araştırmacı tarafından kullanılan farklı aktivasyon metotları Çizelge de açıklanmaktadır. Çizelge Sığır intrasitoplazmik oosit aktivasyonunda kullanılan kombinasyonlar (Gordon, 2003). Oosit aktivasyon tedavisi İyonomisin + Etanol İyonomisin (50 a,m, 3 dakika) İyonomisin + DMAP Çoklu iyonomisin dozları İyonomisin (50 a,m, 5 dakika) Kaynak Chen ve Seidel (1997) Keskintepe ve Brackett (2000) Chung ve ark., (2000) Keskintepe ve Brackett (2000) Keefer (1990), iyonomisin (A23187) aktivasyonunu takiben sığır oositlerinin enjeksiyon sonrası 48. saatte %23-38 oranında 2-8 hücreli aşamaya geldiğini belirtmektedir. Bu aktivasyon metodu, ICSI ile elde edilen ilk buzağı çalışmasında da uygulanmıştır (Goto ve ark., 1990). Keskintepe ve Brackett (2000) tarafından yapılan bir çalışmada oositlerin, sperm enjeksiyonundan 30 dakika sonra 50 u.m kalsiyum iyonofor (A23187) içeren vasat içinde 5 dakika süreyle inkubasyonu gerçekleştirilmiştir. Kullanılan boğa spermatozoonları enjeksiyon öncesi 1 saat heparin içeren vasatla kapasite edilmiştir. Çalışma sonunda bölünme ve blastosist gelişimi oranları sırasıyla %52,4 ve %24,4 olarak bildirilmiştir. Keskintepe ve ark. (2002) tarafından gerçekleştirilen bir başka çalışmada ise, iyonomisin (15 u.m) ile 5 dk. ve ardından Dimetilaminopurin (DMAP) ile 4 saat aktivasyon sonrasında yine başarılı sonuçlar elde edilmiştir. Kanada da yapılan bir çalışmada sığır oositlerinde, normal fertilizasyon sürecinde gözlenen kalsiyum salınımı taklit edilerek iyonomisin ile 30 dk. aralıklarla 5 er dk. lık aktivasyonlar gerçekleştirilmiştir. Yapılan çalışmada, diğer çalışmalarla paralel olarak tek başına ICSI tekniğinin yeterli olmadığı, sığır oositlerinde mutlaka aktivasyon yapılması gerektiği sonucuna varılmıştır (Chung ve ark., 2000).
47 35 Sunulan çalışmanın amacı, hayvancılık alanına yeni giren biyoteknolojik çalışmalardan biri olan ICSI metodunun sığır oositlerine uygulanması, ICSI sonrası oositlerin Ca iyonofor ile aktivasyonu sonucu elde edilen embriyoların değerlendirilmesidir.
48 36 2. GEREÇ VE YÖNTEM 2.1. Ovaryumların Toplanması Çalışmada kullanılan toplam 500 adet oosit Ankara ili Çubuk ilçesinde bulunan özel bir mezbahada kesilen düve ve ineklerden elde edilen ovaryumlardan sağlandı. Ovaryumlar çevre dokulardan uzaklaştırıldıktan sonra içinde taşıma vasatı bulunan termoslara konuldu. Taşıma vasatı olarak penisilin ( IU/ml), dihidrostreptomisin sülfat ( ng/ml) ve amfoterisin-b (50 ng/ml) eklenmiş (A5955, Sigma Co., EU), ısısı C ye ayarlanmış steril %0,9 luk NaCl kullanıldı. Taşıma vasatı her çalışmada taze olarak hazırlandı. Karkastan alınan ovaryumlar en fazla 4 saat içinde laboratuara getirilerek oosit toplama işlemine geçildi Oositlerin Toplanması ve Seçimi Laboratuara getirilen ovaryumlar kan ve taşıma vasatından uzaklaştırılmak amacıyla 2 kez %0,9 luk NaCl ile yıkandı ve kurutma kağıdı ile kurutuldu. Aspirasyon işlemi amacıyla ucuna 18 Gauge luk steril iğne takılmış lastik pistonlu enjektör kullanıldı. Aspirasyon işlemi ovaryumlar üzerinde bulunan 2-8 mm çaplı folliküllerden gerçekleştirildi. Elde edilen follikül sıvısı, ısısı 37 C ye ayarlanmış su banyosu içinde bulunan konik santrifüj tüplerinde toplandı. Toplanan follikül sıvısında bulunan kumulus oosit komplekslerinin dibe çökmesi için tüpler 39 C ye ayarlı etüvde 5 dakika bekletildi. Bu sürenin sonunda üstteki süpernatant atılarak dipteki çöküntü üzerine 5 ml maturasyon vasatı eklendi ve kumulus oosit kompleksleri çevre hücrelerden uzaklaştırıldı. Bu işlem 3 kez tekrarlandı. Elde edilen kumulus oosit kompleksleri, önceden alt kısımları bistüri yardımıyla çizilerek hazırlanmış 90x15 mm petrilere alınarak A kalite kumulus
49 37 oosit kompleksleri belirlendi. Seçme işlemi, stereomikroskop altında (10x20-10x30) gerçekleştirildi. Çalışmada kullanılacak kumulus oosit kompleksleri, Brackett ve Zuelke (1993) nin tarif ettiği şekilde seçildi. Buna göre, zona pellusidası sağlam, sitoplazması bir örnek koyu renkli, çevresinde sıkı şekilde 4 ve daha yukarı kumulus hücre katı bulunanlar A kalite oositler olarak değerlendirildi In Vitro Oosit Maturasyonu Follikül aspirasyonu ile seçilen A kalite oositlerin in vitro maturasyon vasatı olarak hidroksietil piperazin-n-2-etansülfonik asit (HEPES) içeren TCM 199 (M2520, Sigma Co., EU) kullanıldı. Vasata protein katkısı olarak %5 yeni doğan buzağı serumu (Newborn calf serum-ncs, N4637, Sigma Co., E) ve kontaminasyonun engellenmesi amacıyla antibiyotik-antimikotik solüsyon (100 IU/ml penisilin, 100 ng/ml streptomisin ve 0.25 ng/ml amfoterisin-b - Biol. Ind ) eklendi. Maturasyonda kullanılacak vasat her çalışmada taze olarak hazırlandı. Oosit toplanmasından 2 saat önce maturasyon vasatı 100 er nl lik damlalar halinde 35x10 mm lik petrilere kondu ve üzeri mineral yağ ile kaplanarak %5 CO2 li atmosferde, 39 C de maksimum neme sahip etüvde ekilibrasyona bırakıldı. Seçilen A kalite oositler, ekilibrasyona bırakılan maturasyon vasatında her bir damlaya oosit olacak şekilde (5 j,l/oosit) konarak %5 CO2 li atmosferde, 39 C de maksimum neme sahip etüvde 22 saat inkubasyona bırakıldı Maturasyon Kriterlerinin Belirlenmesi ve Değerlendirilmesi Maturasyonun belirlenmesi amacıyla kumulus oosit kompleksleri, kumulus ekspansiyonu ve 1. kutup hücresinin görülmesi yönünden incelendi.
50 Kumulus Ekspansiyonu Kumulus oosit kompleksleri stereomikroskop (10X20-10X30) altında oositi çevreleyen kumulus hücrelerinin genişlemesi bakımından değerlendirildi. Buna göre kumulus hücrelerinde genişleme olan oositler matur olarak kabul edildi Birinci Kutup Hücresinin Belirlenmesi Kumulus ekspansiyonu olan oositler pipetasyon işlemi ile kumulus hücrelerinden tamamen ayrıldı. Daha sonra bu oositler stereomikroskop altında incelenerek 1. kutup hücresinin varlığı açısından incelendi ve 1. kutup hücresini atan oositler matur olarak değerlendirildi Deney Düzeneği Çalışmada A kalite oositlere ICSI uygulanmasının ardından iki grup belirlendi. Buna göre Grup I (n=250 oosit) 5 j,m Ca iyonofor uygulanan grup ve Grup II (n=250 oosit) aktivasyon uygulanmayan kontrol grubu olarak düzenlendi. Tüm oositlere aynı in vitro maturasyon ve ICSI protokolleri uygulandı Intrasitoplazmik Sperm Enjeksiyonu Oositin Hazırlanması Yirmi iki saat inkübasyona tabi tutulan oositler Hepes içeren Tyrode nin Albumin Laktat Pirüvat vasatına (HEPES TALP) alınarak birkaç kez yıkandı ve maturasyon vasatının uzaklaştırılması sağlandı. Daha önce ucu
51 39 inceltilerek hazırlanan pipetlerle oositlere birkaç kez pipetasyon işlemi uygulandı ve hiyaluronik asit yardımıyla kumulus hücreleri tamamen soyuldu. Kumulus hücreleri soyulan oositlerden düzgün kenarlı, 1. kutup hücresini atmış ve koyu sitoplazmalı oositler seçildi. Intrasitoplazmik sperm enjeksiyonunun gerçekleştirileceği 90x15 mm lik petri içine, 6-8 adet damlacık oluşturulacak şekilde ~5 jltl HEPES TALP vasatı konularak her bir damlacığa bir adet oosit konuldu. Hazırlanan oositler, ICSI işlemine kadar %5 CO 2 li atmosferde, 39 C de maksimum neme sahip etüvde bekletildi Spermanın Hazırlanması Motil spermatozoonların seçimi amacıyla swim-up yöntemi kullanıldı. Ticari olarak hazırlanmış olan 3 adet sperm payeti (17,5x10 6 spermatozoon/payet) 37 C deki suda 30 saniye süreyle çözdürülerek steril konik tüpe aktarıldı. Tüp 320 g de 5 dk. santrifüj edilerek motil spermatozoonların dibe çökmesi ve kriyoprotektanlardan ayrılması sağlandı. Santrifüjün ardından tüpün dip kısmında 0,5-1 ml içerik kalana kadar üstteki süpernatant atıldı ve dipteki tortudan 250 jltl alınarak içinde 1 ml Tyrode nin albumin laktat pirüvat sperm medyumu (Sperm-TALP) olan 2-3 tüpün dip kısmına yavaşça bırakıldı. Bu tüpler 45 açı ile etüve konarak 38 C de 1 saat inkübe edildi. İnkübasyonun sonunda tüpün üst kısmından 800 jltl süpernatant dikkatlice alınarak başka bir tüpe aktarıldı ve 320 g de 5 dk santrifüj edildi. Dipte 500 jltl kalana kadar süpernatant atıldı ve istenilen motil spermatozoonlar elde edildi Stok Solüsyonlar ve Vasatların Hazırlanması Tyrode nin Albumin Laktat Piruvat Vasatı (TALP), Hansen (2000) in tarif ettiği metoda uygun olarak kullanım amacına göre; vasatların hazırlanacağı stok
52 40 solüsyonlar (Çizelge ), TALP solüsyonlarının hazırlanmasında kullanılan TL solüsyonu (Çizelge ), ICSI işlemine alınacak oositlerin yıkanması için HEPES katkılı HEPES TALP (Çizelge ), spermatozoonların hazırlanması için Sp-TALP (Çizelge ), ICSI işleminde kullanılmak amacıyla IVF-TALP (Çizelge ), kültür vasatı olarak CR1 (Çizelge ) ve CR1aa vasatları çalışma öncesinde taze olarak hazırlandı (Çizelge ). Çizelge Stok solüsyonlarının hazırlanması ve saklanması (Hansen, 2000). Stok no Stok 1 Stok ismi Na-laktat Hazırlanma şekli %98 lik şurup Saklanma koşulları 4 C Stok 2 Na-piruvat gr 100 ultra saf suda çözdürüldü 4 C, 1 ay Stok 7 Heparin 20 mg 10 ml ultra saf suda çözdürüldü 20 C Stok 17 NaCl g, 50 ml ultra saf suda çözdürüldü 4 C Stok 18 KCl g, 50 ml ultra saf suda çözdürüldü 4 C Stok 19 NaHCO g, 50 ml ultra saf suda çözdürüldü 4 C, 1 hafta Stok 20 Stok 21 Stok 22 Stok 23 PO 4 1 M HEPES CaCl 2 MgCl g NaH 2 PO 4 +H 2 O, 50 ml ultra saf suda çözdürüldü 119 g, 400 ml ultra saf suda çözdürüldü, ph 7 ye ayarlandı, hacim 500 ml ye tamamlandı g CaCl 2 +2H 2 O, 50 ml ultra saf suda çözdürüldü G MgCl 2 +6H 2 O, 50 ml ultra saf suda çözdürüldü 4 C 4 C 4 C 4 C
53 41 Qizelge TL solüsyonlarının hazırlanması (Hansen, 2000) Igerik Sp-TL HEPES-TL IVF-TL Su (ml) 39,6 22,125 20,0785 Stok 17 NaCl (ml) 2,17 1,25 1,25 Stok 18 KCl (ml) 0,98 0,5 0,5 Stok 19 Bikarbonat (ml) 5 0,2 2,5 Stok 20 Fosfat (ml) 0,5 0,25 0,25 Stok 1 Na-Laktat (ml) 0,184 0,0465 0,0615 Stok 21 Hepes (ml) 0,5 0,25 - Stok 22 Ca Klorür (ml) 0,5 0,25 0,25 Stok 23 Mg Klorür (ml) 0,55 0,125 0,125 ph 7,4 7,3 7,4 Osmolarite (mosm) Qizelge TALP solüsyonlarının hazırlanması (Hansen, 2000). Igerik Sp-TALP HEPES-TALP IVF-TALP TL (ml) 9, BSA Frak. V (mg) BSA EFAF (mg) Stok 2 Piruvat 0,5 0,1 0,1 Stok 8 antibiyotik (ml) 0,1 0,1 0,1 Stok 7 Heparin (µl)
54 42 Çizelge CR1 stok vasatının hazırlanması (Hansen, 2000) İçerik NaCl (g) KCl (g) NaHCO 3 (g) Na Piruvat (g) Glutamin (g) Hemi kalsiyum laktat (g) Ultra saf su (ml) Miktar 0,670 0,023 0,220 0,004 0,015 0, Çizelge CR1aa kültür vasatının hazırlanması (Hansen, 2000) İçerik CR1 Stok (ml) EFAF BSA (mg) Gentamisin ( j,l) Nonesansiyel amino asitler 100x ( j,l) Esansiyel amino asitler 50x ( j,l) Miktar , Intrasitoplazmik Sperm Enjeksiyonu Matur oositlerin bulunduğu petri inkübatörden alınarak aynı petriye motil spermatozoonları içeren -40 nl lik sperm havuzu yapıldı ve oosit damlacıkları ile sperm havuzu arasına pastör pipeti ile -10 jltl %4 polivinilpirolidon (PVP) içeren bir çizgi çizildi (Şekil ), mineral yağ ile kaplanarak damlacıkların üzeri kapatıldı ve petri tekrar etüve kondu.
55 43 a b Şekil Sperm havuzu (a) ve PVP havuzu (b) Sperm mikroenjeksiyonu işleminde invert mikroskobu bulunan Leica DM IL marka optik ve Narishige MMN1 marka mikromaniplatörlü sistem kullanıldı. Mikroenjeksiyon iğnesi olarak dış çapı um olan Humagen marka (MIC-35-30) ve holding iğnesi olarak da iç çapı ^m olan Humagen marka (MPH-MED-30) iğneler kullanıldı. Mikroenjeksiyon ve holding iğneleri mikomanipülatöre takılarak netlik ayarları ile ön kontrolleri yapıldı (Şekil ). a b Şekil Mikromanipülatör sistemi (a), mikroenjeksiyon ve holding iğnelerinin hazırlanması (b)
56 44 İçinde oosit ve spermatozoonların bulunduğu petri alınarak manipülatörün ayarları bozulmadan mikroskoba yerleştirildi. Öncelikle mikroenjeksiyon iğnesine PVP havuzundan bir miktar PVP çekilerek iğne sperm havuzuna getirildi. Morfoloji ve motilite yönünden uygun bir spermatozoon seçilerek, mikroenjeksiyon iğnesinin ucu ile spermatozoonun kuyruğu kırıldı ve hareketsizliği sağlandı. Hareketsiz spermatozoon iğne içine çekilerek oositin bulunduğu damlacığa getirildi. Oosit holding iğnesi ile kutup cisimciği saat 6 veya 12 yönünde olacak şekilde tutuldu. İçinde spermatozoon bulunan mikroenjeksiyon iğnesi saat 3 yönünde oosite yaklaştırılarak oositin zona pellusidası ve oolemma tek seferde delindi. Oosit içine tam olarak girildiğinin anlaşılması amacıyla mikroenjeksiyon pipeti içine bir miktar ooplazma çekildi ve ooplazma ile spermatozoon dikkatle oosit içine enjekte edildi (Şekil ). Tüm oositler için aynı işlem dikkatle tekrarlandı. c d Şekil İntrasitoplazmik sperm enjeksiyonunun aşamaları; oositin holding iğnesi ile tutulması (a), ICSI iğnesinin yaklaştırılması (b), zona pellusida ve oolemmanın delinmesi (c) ve sperm enjeksiyonu (d)
57 Oosit Aktivasyonu Sperm enjekte edilen oositler Ware ve ark. (1989) nın tarif ettiği metotla aktive edildi. Grup I de (n=250) oositler Ca ve Mg içermeyen PBS solüsyonunda (Çizelge ; ve ) hazırlanmış 5µM Ca iyonofor (A23187, Sigma Co., EU) ile % 5 CO2 atmosfer ve 38,5 Co sıcaklıkta 5 dakika boyunca aktivasyon işlemine tabi tutuldu. Aktivasyonun ardından oositler % 5 buzağı serumu eklenmiş TCM 199 ile 3 kere yıkandı. Grup II de (n=250) bulunan oositlere ise herhangi bir aktivasyon işlemi uygulanmadan kültür vasatına alındı. Çizelge PBS-A solüsyonunun hazırlanması. İçerik NaCl (g) KCl (g) Na HPO 2 4 (g) KH PO 2 4 (g) Miktar 8,0 0,2 1,15 0,2 Bu karışım ultra saf su ile 700 ml ye tamamlandı. Çizelge PBS-B solüsyonunun hazırlanması. CaCl İçerik MgCl 2.6H (g) / O CaCl (g) 2.2H 2 O (g) 2 2 Miktar 1,0 / 1,1395 1,0 Hazırlanan PBS-B 100 ml ye tamamlandı. 10 ml stok solüsyondan alınarak ultra saf su ile 100 ml ye tamamlandı ve PBS-B solüsyonu elde edildi.
58 46 Çizelge PBS solüsyonunun hazırlanması. İçerik PBS-A solüsyon (ml) PBS-B solüsyon (ml) Glukoz (g) Sodyum piruvat (g) Miktar ,0 0,036 Aktivatörün hazırlanmasında Ca ve Mg içermeyen PBS kullanıldığı için PBS-B solüsyonu yerine 100 ml PBS-A solüsyonu eklendi Embriyo Kültürü Intrasitoplazmik sperm enjeksiyonunun ardından oositler CR1aa embriyo kültür vasatına alınarak 3 gün inkübe edildi. Daha sonra 5 gün %5 buzağı serumu eklenmiş CR1aa kültürüne alınarak embriyo gelişimi izlendi Embriyonik Gelişim Aşamalarının İzlenmesi Intrasitoplazmik sperm enjeksiyonunun ardından embriyonun gelişim aşamaları Leica DFC 280 ve M205C stereomikroskop kullanılarak yapıldı. Embriyonun gelişim aşamaları 48. saatte bölünme, 120. saatte morula ve 168. saatte blastosist aşamasına ulaşıp ulaşamamasına göre değerlendirildi İstatistiksel Değerlendirme Elde edilen sonuçlar Statistic Packet of Social Science (SPSS) 14 Paket Programı kullanılarak ki-kare testi ile değerlendirildi.
59 47 3. BULGULAR Çalışmada, mezbahadan alınan 375 adet ovaryum üzerinde bulunan 2949 adet 2-8 mm çaplı follikülden oosit aspirasyonu yapılarak toplam 1438 adet kumulus oosit kompleksi elde edildi. Bu oositlerden 517 adet kumulus oosit kompleksi A kalite ve 921 adet kumulus oosit kompleksi B ve C kalite olarak sınıflandırıldı. Çalışma (Grup I, n=250) ve kontrol (Grup II, n=250) grubunda toplam 500 adet A kalite kumulus oosit kompleksi kullanıldı In Vitro Maturasyon Bulguları In vitro maturasyon bulgularının belirlenmesinde, kumulus ekspansiyonu ve 1. kutup hücresinin atılması kriter olarak alındı Kumulus Ekspansiyonunun Belirlenmesi In vitro maturasyon işlemine tabi tutulan toplam 500 adet kumulus oosit kompleksinden (KOK) 473 adet oositte tam kumulus ekspansiyonu (%94,6) tespit edildi (Şekil ).
60 48 a b Şekil Kumulus ekspansiyonu (-) KOK (a) ve kumulus ekspansiyonu (+) KOK (b) Birinci Kutup Hücresinin Belirlenmesi In vitro maturasyon sonrası toplam 500 adet kumulus oosit kompleksinden 438 adet oositte (%87,6) 1. kutup hücresinin atıldığı gözlendi (Şekil ; Şekil ; Çizelge ). Şekil Birinci kutup hücresi (-) KOK (a) ve 1. kutup hücresi (+) KOK (b).
61 49 Çizelge Maturasyon oranları. Maturasyon Kriteri Kumulus ekspansiyonu Sayı 473 Oran % 94,6 Birinci kutup hücresi , %94,6 1 %87, Kumulus Ekspansyonu I.Kutup Hücresi. Şekil Maturasyon oranları Intrasitoplazmik Sperm Enjeksiyonu Bulguları Toplam 500 adet A kalite oosit kullanılarak gerçekleştirilen ICSI uygulamasının ardından Grup I de bulunan 250 adet oosite 5 u.m Ca iyonofor ile aktivasyon işlemi yapıldı. Grup II de bulunan 250 adet oosite ise herhangi bir aktivasyon işlemi uygulanmadan embriyo kültürüne alındı.
62 50 Intrasitoplazmik sperm enjeksiyonunun ardından 5 u.m Ca iyonofor ile aktivasyon yapılan 250 adet oositin (Grup I), 112 (%44,8) tanesinde bölünme, 43 (%17,2) tanesinde morula ve 29 (%11,6) tanesinde blastosist aşamaları elde edildi (Çizelge 3.2.1). Qizelge Grup I e ait oositlerin embriyonik gelişim aşamaları. Oosit Bölünme Morula Blastosist Sayı Oran (%) 44,8 17,2 11,6 Intrasitoplazmik sperm enjeksiyonunun ardından herhangi bir aktivasyon işlemi uygulanmadan embriyo kültür vasatına alınan 250 adet oositin (Grup II), 67 (%26,8) tanesinde bölünme, 23 (%9,2) tanesinde morula ve 8 (%3,2) tanesinde de blastosist aşamaları gözlendi (Çizelge 3.2.2). Qizelge Grup II ye ait oositlerin embriyonik gelişim aşamaları. Oosit Bölünme Morula Blastosist Sayı Oran (%) 26,8 9,2 3,2 A kalite oositlerde intrasitoplazmik sperm enjeksiyonunun ardından en yüksek bölünme oranları aktivasyon işlemi gerçekleştirilen Grup I e ait oositlerde görüldü. Grup I de bulunan oositlere uygulanan 5 u.m Ca iyonofor ile aktivasyon işlemi sonucu elde edilen bölünme oranları ile Grup II de bulunan oositlerde elde edilen bölünme oranları arasındaki fark istatistiksel açıdan önemli bulundu (p<0,001; Şekil ; Şekil ).
63 51 ekil Grup I ve Grup II de saptanan bölünme, morula ve blastosist oranları. Intrasitoplazmik sperm enjeksiyonu sonrası morula ve blastosist aşamasına ulaşan embriyo oranlarında, gruplar arasında istatistiksel yönden önemli bir fark bulunmadı (p>0,05; Çizelge ). Elde edilen bu sonuçlara göre 5 u.m Ca iyonofor ile aktivasyon işleminin, özellikle oositlerin bölünme aşamasına ulaşabilmesi açısından gerekli olduğu kanısına varıldı. Qizelge Gruplar arasındaki bölünme, morula, blastosist oranları. Sayı Grup I Oran (%) Sayı Grup II Oran (%) Bölünme ,8 a 67 26,8 b Morula 43 17,2 23 9,2 Blastosist 29 11,6 8 3,2 a, b: Aynı satırda farklı harfler taşıyan gruplar arasındaki fark önemlidir (p<0,001).
64 52 a b c Şekil Elde edilen bölünme (a), morula (b) ve blastosist (c) aşamaları
BİYOTEKNOLOJİ NEDİR? Canlılar aracılığı ile ürün ve hizmet üretmektir
 BİYOTEKNOLOJİ NEDİR? Canlılar aracılığı ile ürün ve hizmet üretmektir Reprodüktif Biyoteknolojinin Amacı Canlılarda in vivo ve in vitro koşullarda gen kaynaklarının uzun süreli korunması ve daha fazla
BİYOTEKNOLOJİ NEDİR? Canlılar aracılığı ile ürün ve hizmet üretmektir Reprodüktif Biyoteknolojinin Amacı Canlılarda in vivo ve in vitro koşullarda gen kaynaklarının uzun süreli korunması ve daha fazla
FERTİLİZASYON-Döllenme
 FERTİLİZASYON-Döllenme Tanım Spermatozoon ile Oosit II nin birleşerek yeni bir canlı olan ZİGOT u şekillendirmesi Ovulasyonla yumurta yoluna atılan Oosit korona radiata hücreleri ile sarılıdır. - Oosit
FERTİLİZASYON-Döllenme Tanım Spermatozoon ile Oosit II nin birleşerek yeni bir canlı olan ZİGOT u şekillendirmesi Ovulasyonla yumurta yoluna atılan Oosit korona radiata hücreleri ile sarılıdır. - Oosit
TÜRKİYE CUMHURİYETİ ANKARA ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ İNTRASTOPLAZMİK SPERM ENJEKSİYONU (İCSİ) YAPILAN SIĞIR OOSİTLERİNDE KALSİYUM İYONOF
 TÜRKİYE CUMHURİYETİ ANKARA ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ İNTRASTOPLAZMİK SPERM ENJEKSİYONU (İCSİ) YAPILAN SIĞIR OOSİTLERİNDE KALSİYUM İYONOFOR, 6-DİMETİLAMİNOPURİN ve ETANOLÜN EMBRYO GELİŞİMİNE
TÜRKİYE CUMHURİYETİ ANKARA ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ İNTRASTOPLAZMİK SPERM ENJEKSİYONU (İCSİ) YAPILAN SIĞIR OOSİTLERİNDE KALSİYUM İYONOFOR, 6-DİMETİLAMİNOPURİN ve ETANOLÜN EMBRYO GELİŞİMİNE
Fertilizasyon ve Erken Embriyogenez
 Fertilizasyon ve Erken Embriyogenez Prof.Dr. Alp Can Histoloji-Embriyoloji ABD Embriyoloji (Gelişim Bilimi) [embriyo=cenin, logos=bilim] Tanımsal (deskriptif embriyoloji) Gelişim mekanizmaları İnsanın
Fertilizasyon ve Erken Embriyogenez Prof.Dr. Alp Can Histoloji-Embriyoloji ABD Embriyoloji (Gelişim Bilimi) [embriyo=cenin, logos=bilim] Tanımsal (deskriptif embriyoloji) Gelişim mekanizmaları İnsanın
Sığrlarda Embryo Transferi. Prof.Dr.Serhat Pabuccuoğlu
 Sığrlarda Embryo Transferi Prof.Dr.Serhat Pabuccuoğlu BİYOTEKNOLOJİ NEDİR? Canlılar aracılığı ile ürün ve hizmet üretmektir Reprodüktif Biyoteknolojinin Amacı Canlılarda in vivo ve in vitro koşullarda
Sığrlarda Embryo Transferi Prof.Dr.Serhat Pabuccuoğlu BİYOTEKNOLOJİ NEDİR? Canlılar aracılığı ile ürün ve hizmet üretmektir Reprodüktif Biyoteknolojinin Amacı Canlılarda in vivo ve in vitro koşullarda
Üreme Biyolojisi ve Yapay Tohumlama
 Üreme Biyolojisi ve Yapay Tohumlama 7. Hafta Prof. Dr. Gürsel DELLAL Döllenme (Fertilizasyon=Fekondasyon): -Sperm ve oositin II in birleşmesi -Ovulasyonda kendisini saran corona radiata hücre katı ile
Üreme Biyolojisi ve Yapay Tohumlama 7. Hafta Prof. Dr. Gürsel DELLAL Döllenme (Fertilizasyon=Fekondasyon): -Sperm ve oositin II in birleşmesi -Ovulasyonda kendisini saran corona radiata hücre katı ile
Giriş Fertilizasyon Pre-Embriyogenez
 Giriş Fertilizasyon Pre-Embriyogenez Prof.Dr. Alp Can Histoloji-Embriyoloji Anabilim Dalı Embriyoloji (Gelişim Bilimi) [embriyo=cenin, logos=bilim] İnsanın gelişimindeki yapı-işlev ilişkisi Tanımsal (deskriptif
Giriş Fertilizasyon Pre-Embriyogenez Prof.Dr. Alp Can Histoloji-Embriyoloji Anabilim Dalı Embriyoloji (Gelişim Bilimi) [embriyo=cenin, logos=bilim] İnsanın gelişimindeki yapı-işlev ilişkisi Tanımsal (deskriptif
Çiftlik Hayvanlarında Cinsiyetin Denetimi
 Çiftlik Hayvanlarında Cinsiyetin Denetimi Cinsiyetin belirlenmesi Demokritus (MÖ: 470-402) Sağ testisten erkek, sol testisten dişi yavruların dünyaya geldiğini ileri sürmüştür. Fötal yaşamda cinsiyetin
Çiftlik Hayvanlarında Cinsiyetin Denetimi Cinsiyetin belirlenmesi Demokritus (MÖ: 470-402) Sağ testisten erkek, sol testisten dişi yavruların dünyaya geldiğini ileri sürmüştür. Fötal yaşamda cinsiyetin
ÜNİTE 7 FERTİLİZASYON VE ZİGOTUN OLUŞUMU
 ÜNİTE 7 FERTİLİZASYON VE ZİGOTUN OLUŞUMU Prof. Dr. Süleyman KAPLAN 7.1. Fertilizasyondan Hemen Önce Gametlerin Durumu Erkek cinsiyet hücresi olan sperm fertilizasyondan önce sitoplâzmasının çoğunu kaybederek
ÜNİTE 7 FERTİLİZASYON VE ZİGOTUN OLUŞUMU Prof. Dr. Süleyman KAPLAN 7.1. Fertilizasyondan Hemen Önce Gametlerin Durumu Erkek cinsiyet hücresi olan sperm fertilizasyondan önce sitoplâzmasının çoğunu kaybederek
Yardımcı üreme teknolojisi (YÜT) son yıllarda birçok infertil çiftin çocuk sahibi olmalarını sağlamaktadır.
 İlknur M. GÖNENÇ Yardımcı üreme teknolojisi (YÜT) son yıllarda birçok infertil çiftin çocuk sahibi olmalarını sağlamaktadır. Bilim adamları Miriam F. Menkin ve John Rock ın ilk olarak 1944 yılında bir
İlknur M. GÖNENÇ Yardımcı üreme teknolojisi (YÜT) son yıllarda birçok infertil çiftin çocuk sahibi olmalarını sağlamaktadır. Bilim adamları Miriam F. Menkin ve John Rock ın ilk olarak 1944 yılında bir
İN VİTRO EMBRİYO ÜRETİMİ
 İN VİTRO EMBRİYO ÜRETİMİ İn vitro döllemenin tarihçesi Karl von Baer (1825): Modern embriyolojinin babası olarak da kabul edilir. Köpek ovaryumu ve ovositleri üzerine ilk ciddi çalışmaları yapmıştır. Walter
İN VİTRO EMBRİYO ÜRETİMİ İn vitro döllemenin tarihçesi Karl von Baer (1825): Modern embriyolojinin babası olarak da kabul edilir. Köpek ovaryumu ve ovositleri üzerine ilk ciddi çalışmaları yapmıştır. Walter
YUMURTA TİPLERİ BÖLÜNME ŞEKİLLERİ İNVİTRO FERTİLİZASYON VE EMBRİYO NAKLİ. Doç. Dr. Alev Gürol BAYRAKTAROĞLU
 YUMURTA TİPLERİ BÖLÜNME ŞEKİLLERİ İNVİTRO FERTİLİZASYON VE EMBRİYO NAKLİ Doç. Dr. Alev Gürol BAYRAKTAROĞLU Yumurta tipleri : Çeşitli hayvan yumurtaları, taşıdıkları lecithus (vitellus) maddesinin azlığına
YUMURTA TİPLERİ BÖLÜNME ŞEKİLLERİ İNVİTRO FERTİLİZASYON VE EMBRİYO NAKLİ Doç. Dr. Alev Gürol BAYRAKTAROĞLU Yumurta tipleri : Çeşitli hayvan yumurtaları, taşıdıkları lecithus (vitellus) maddesinin azlığına
Transgenik Hayvan Üretimi. Hayvancılıkta biyoteknoloji dersi
 Transgenik Hayvan Üretimi Hayvancılıkta biyoteknoloji dersi TRANSGENİK HAYVAN TEKNOLOJİSİ Transgenik hayvanlar gen transferi yoluyla hücrelerinde yabancı genleri taşıyan hayvanlardır. Çiftlik hayvanlarına
Transgenik Hayvan Üretimi Hayvancılıkta biyoteknoloji dersi TRANSGENİK HAYVAN TEKNOLOJİSİ Transgenik hayvanlar gen transferi yoluyla hücrelerinde yabancı genleri taşıyan hayvanlardır. Çiftlik hayvanlarına
DOKUZ EYLÜL ÜNİVERSİTESİ
 3/0/016 00:00:00 Döner Sermaye İşletmesi Teklif No 016130 İLAN HASTANEMİZİN İHTİYACI OLAN AŞAĞIDA YAZILI MALZEME(LER) TEKLİF ALMA SURETİYLE SATIN ALINACAKTIR. İLGİLENEN FİRMALARIN 6/0/016 TARİHİ, SAAT
3/0/016 00:00:00 Döner Sermaye İşletmesi Teklif No 016130 İLAN HASTANEMİZİN İHTİYACI OLAN AŞAĞIDA YAZILI MALZEME(LER) TEKLİF ALMA SURETİYLE SATIN ALINACAKTIR. İLGİLENEN FİRMALARIN 6/0/016 TARİHİ, SAAT
İN-VİTRO FERTİLİZASYON (IVF) VE EMBRİYO TRANSFERİ (ET)
 İN-VİTRO FERTİLİZASYON (IVF) VE EMBRİYO TRANSFERİ (ET) Yardımcı üreme tekniklerinin (YÜT) (Assisted Reproduction Techniques, ART) temel amacı, infertil çiftin sağlıklı bir bebek sahibi olmasıdır. IVF-ET
İN-VİTRO FERTİLİZASYON (IVF) VE EMBRİYO TRANSFERİ (ET) Yardımcı üreme tekniklerinin (YÜT) (Assisted Reproduction Techniques, ART) temel amacı, infertil çiftin sağlıklı bir bebek sahibi olmasıdır. IVF-ET
Çiftlik Hayvanlarında Embriyo Aktarımı. Prof Dr Fatin Cedden
 Çiftlik Hayvanlarında Embriyo Aktarımı Prof Dr Fatin Cedden İlk embriyo transferi 1890 da Walter Heape tarafından Büyük Britanya da tavşan üzerinde gerçekleştirildi Sığırda yapılan ilk embriyo transferi
Çiftlik Hayvanlarında Embriyo Aktarımı Prof Dr Fatin Cedden İlk embriyo transferi 1890 da Walter Heape tarafından Büyük Britanya da tavşan üzerinde gerçekleştirildi Sığırda yapılan ilk embriyo transferi
Uluslararası nsan Bilimleri Dergisi ISSN: 1303-5134
 Uluslararası nsan Bilimleri Dergisi ISSN: 1303-5134 www.insanbilimleri.com 29.09.2004 DÖLLENME VE DÖLLENME ANOMAL LER N N YARDIMLA ÜREME TEKN KLER NDEK ÖNEM Dr. F. Gürcan BEB TO LU * gurcanbebitoglu@yahoo.com
Uluslararası nsan Bilimleri Dergisi ISSN: 1303-5134 www.insanbilimleri.com 29.09.2004 DÖLLENME VE DÖLLENME ANOMAL LER N N YARDIMLA ÜREME TEKN KLER NDEK ÖNEM Dr. F. Gürcan BEB TO LU * gurcanbebitoglu@yahoo.com
CANLILARDA DÖLLENME PROF.DR. NURSEL GÜL
 CANLILARDA DÖLLENME GİRİŞ Erkek ve dişi gametin birleşmesi olup iki olayında nedenidir. Bu iki önemli olayın birisi yumurtanın aktive olması yani gelişime engel olduğu bildirilen sitostatik faktörün etkisiz
CANLILARDA DÖLLENME GİRİŞ Erkek ve dişi gametin birleşmesi olup iki olayında nedenidir. Bu iki önemli olayın birisi yumurtanın aktive olması yani gelişime engel olduğu bildirilen sitostatik faktörün etkisiz
DOKUZ EYLÜL ÜNİVERSİTESİ
 07/02/2019 00:00:00 Döner Sermaye İşletmesi Teklif No: 2019832 İLAN HASTANEMİZİN İHTİYACI OLAN AŞAĞIDA YAZILI MALZEME(LER) TEKLİF ALMA SURETİYLE SATIN ALINACAKTIR. İLGİLENEN FİRMALARIN 11/02/2019 TARİHİ,
07/02/2019 00:00:00 Döner Sermaye İşletmesi Teklif No: 2019832 İLAN HASTANEMİZİN İHTİYACI OLAN AŞAĞIDA YAZILI MALZEME(LER) TEKLİF ALMA SURETİYLE SATIN ALINACAKTIR. İLGİLENEN FİRMALARIN 11/02/2019 TARİHİ,
Sperm sıvısı ve sperm sıvısının bileşimi
 Sperm sıvısı ve sperm sıvısının bileşimi Çiftlik Hayvanlarında Üreme Biyolojisi ve Yapay Tohumlama Prof Dr Fatin CEDDEN Giriş Sperm sıvısı (semen) spermatozoa ve seminal plazmadan meydana gelir Seminal
Sperm sıvısı ve sperm sıvısının bileşimi Çiftlik Hayvanlarında Üreme Biyolojisi ve Yapay Tohumlama Prof Dr Fatin CEDDEN Giriş Sperm sıvısı (semen) spermatozoa ve seminal plazmadan meydana gelir Seminal
DÖLLENME VE BÖLÜNMELER
 DÖLLENME VE BÖLÜNMELER Ovulasyonda kendisini saran corona radiata hücreleri ile birlikte ovaryumdan atılan ve ovidukta düşen yumurta hücresi, ovidukt silyumlarının ve düz kas kontraksiyonlarının etkisiyle
DÖLLENME VE BÖLÜNMELER Ovulasyonda kendisini saran corona radiata hücreleri ile birlikte ovaryumdan atılan ve ovidukta düşen yumurta hücresi, ovidukt silyumlarının ve düz kas kontraksiyonlarının etkisiyle
DOKUZ EYLÜL ÜNİVERSİTESİ
 08/06/06 00:00:00 Döner Sermaye İşletmesi Teklif No 064084 İLAN HASTANEMİZİN İHTİYACI OLAN AŞAĞIDA YAZILI MALZEME(LER) TEKLİF ALMA SURETİYLE SATIN ALINACAKTIR. İLGİLENEN FİRMALARIN 0/06/06 TARİHİ, SAAT
08/06/06 00:00:00 Döner Sermaye İşletmesi Teklif No 064084 İLAN HASTANEMİZİN İHTİYACI OLAN AŞAĞIDA YAZILI MALZEME(LER) TEKLİF ALMA SURETİYLE SATIN ALINACAKTIR. İLGİLENEN FİRMALARIN 0/06/06 TARİHİ, SAAT
ÇOK HÜCRELİ ORGANİZMALARIN GELİŞİMİ
 ÇOK HÜCRELİ ORGANİZMALARIN GELİŞİMİ Seçici gen ifadesi embriyonun gelişmesini sağlayan 4 temel işlevi denetler: 1. Hücre çoğalması 2. Hücre farklılaşması 3. Hücre etkileşimleri 4. Hücre hareketi HÜCRE
ÇOK HÜCRELİ ORGANİZMALARIN GELİŞİMİ Seçici gen ifadesi embriyonun gelişmesini sağlayan 4 temel işlevi denetler: 1. Hücre çoğalması 2. Hücre farklılaşması 3. Hücre etkileşimleri 4. Hücre hareketi HÜCRE
ERKEN BÖLÜNME DEĞERLENDİRMESİNİN İNTRASİTOPLAZMİK SPERM ENJEKSİYONU SONUÇLARIYLA İLİŞKİLENDİRİLMESİ
 T. C. İSTANBUL BİLİM ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ HİSTOLOJİ VE EMBRİYOLOJİ ANABİLİM DALI ERKEN BÖLÜNME DEĞERLENDİRMESİNİN İNTRASİTOPLAZMİK SPERM ENJEKSİYONU SONUÇLARIYLA İLİŞKİLENDİRİLMESİ Biyolog
T. C. İSTANBUL BİLİM ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ HİSTOLOJİ VE EMBRİYOLOJİ ANABİLİM DALI ERKEN BÖLÜNME DEĞERLENDİRMESİNİN İNTRASİTOPLAZMİK SPERM ENJEKSİYONU SONUÇLARIYLA İLİŞKİLENDİRİLMESİ Biyolog
ıo. Urünün raf ömrü üretim tarihinden itibaren i yıl olmalıdır.
 12)VİTRİFİKASYON KİT TEKNİK ŞART AMESİ I. Oosit, Embryo ve Blastosistlerin Vitrifikasyon yöntemi ile dondurulması amacı ile kullaru lmalıd ır. 2. Ürün Equilihrnıion Solution - ES (white cap) i x 1 ml.
12)VİTRİFİKASYON KİT TEKNİK ŞART AMESİ I. Oosit, Embryo ve Blastosistlerin Vitrifikasyon yöntemi ile dondurulması amacı ile kullaru lmalıd ır. 2. Ürün Equilihrnıion Solution - ES (white cap) i x 1 ml.
Canlılarda Üreme ve Gelişme 1.Üreme Hücreleri (Gametler) 1.1.Erkek Üreme Hücreleri Spermler akrozom 1.2.Dişi Üreme Hücreleri Yumurtalar vitellus
 Canlılarda Üreme ve Gelişme 1.Üreme Hücreleri (Gametler) Üreme hücreleri erkeklerde sperm dişilerde yumurta adını alır.yumurtanın meydana gelişi oogenezis, spermin meydana gelişi ise spermatogenezis adını
Canlılarda Üreme ve Gelişme 1.Üreme Hücreleri (Gametler) Üreme hücreleri erkeklerde sperm dişilerde yumurta adını alır.yumurtanın meydana gelişi oogenezis, spermin meydana gelişi ise spermatogenezis adını
DOKUZ EYLÜL ÜNİVERSİTESİ
 03/0/016 00:00:00 Döner Sermaye İşletmesi Teklif No 016835 İLAN HASTANEMİZİN İHTİYACI OLAN AŞAĞIDA YAZILI MALZEME(LER) TEKLİF ALMA SURETİYLE SATIN ALINACAKTIR. İLGİLENEN FİRMALARIN 08/0/016 TARİHİ, SAAT
03/0/016 00:00:00 Döner Sermaye İşletmesi Teklif No 016835 İLAN HASTANEMİZİN İHTİYACI OLAN AŞAĞIDA YAZILI MALZEME(LER) TEKLİF ALMA SURETİYLE SATIN ALINACAKTIR. İLGİLENEN FİRMALARIN 08/0/016 TARİHİ, SAAT
DEHİDRE KÖPEKLERDE BİKARBONATLI SODYUM KLORÜR SOLÜSYONUNUN HEMATOLOJİK VE BİYOKİMYASAL PARAMETRELERE ETKİSİ
 T.C. ADNAN MENDERES ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ İÇ HASTALIKLARI ANABİLİM DALI VİH-YL 2007 0002 DEHİDRE KÖPEKLERDE BİKARBONATLI SODYUM KLORÜR SOLÜSYONUNUN HEMATOLOJİK VE BİYOKİMYASAL PARAMETRELERE
T.C. ADNAN MENDERES ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ İÇ HASTALIKLARI ANABİLİM DALI VİH-YL 2007 0002 DEHİDRE KÖPEKLERDE BİKARBONATLI SODYUM KLORÜR SOLÜSYONUNUN HEMATOLOJİK VE BİYOKİMYASAL PARAMETRELERE
DOKUZ EYLÜL ÜNİVERSİTESİ
 //205 00:00:00 Döner Sermaye İşletmesi Teklif No 205695 İLAN HASTANEMİZİN İHTİYACI OLAN AŞAĞIDA YAZILI MALZEME(LER) TEKLİF ALMA SURETİYLE SATIN ALINACAKTIR. İLGİLENEN FİRMALARIN //205 TARİHİ, SAAT 0:00
//205 00:00:00 Döner Sermaye İşletmesi Teklif No 205695 İLAN HASTANEMİZİN İHTİYACI OLAN AŞAĞIDA YAZILI MALZEME(LER) TEKLİF ALMA SURETİYLE SATIN ALINACAKTIR. İLGİLENEN FİRMALARIN //205 TARİHİ, SAAT 0:00
DOKUZ EYLÜL ÜNİVERSİTESİ
 3//03 00:00:00 Döner Sermaye İşletmesi Teklif No 039378 İLAN HASTANEMİZİN İHTİYACI OLAN AŞAĞIDA YAZILI MALZEME(LER) SATIN ALINACAKTIR. İLGİLENEN FİRMALARIN 5//03 TARİHİ, SAAT :00 'E/A KADAR TEKLİFLERİNİ
3//03 00:00:00 Döner Sermaye İşletmesi Teklif No 039378 İLAN HASTANEMİZİN İHTİYACI OLAN AŞAĞIDA YAZILI MALZEME(LER) SATIN ALINACAKTIR. İLGİLENEN FİRMALARIN 5//03 TARİHİ, SAAT :00 'E/A KADAR TEKLİFLERİNİ
GELİŞİMİN 1. VE 2. HAFTASI
 GELİŞİMİN 1. VE 2. HAFTASI (Fertilizasyon, Segmentasyon, İmplantasyon ve Bilaminar disk) PROF. DR. İSMAİL SEÇKİN FERTİLİZASYON A ) Germ hücrelerinin fertilizasyon bölgesine taşınması Oositin ampullaya
GELİŞİMİN 1. VE 2. HAFTASI (Fertilizasyon, Segmentasyon, İmplantasyon ve Bilaminar disk) PROF. DR. İSMAİL SEÇKİN FERTİLİZASYON A ) Germ hücrelerinin fertilizasyon bölgesine taşınması Oositin ampullaya
In vitro Embryo Production and Transfer in Cattle. Numan AKYOL* Sedat Hamdi KIZIL* Tahir KARAŞAHİN*
 Lalahan İN VİTRO Hay. SIĞIR Araşt. EMBRİYOSU Enst. Derg. ÜRETİM 2007, 47 VE (1) TRANSFERİ 1-8 İN VİTRO SIĞIR EMBRİYOSU ÜRETİM VE TRANSFERİ In vitro Embryo Production and Transfer in Cattle Numan AKYOL*
Lalahan İN VİTRO Hay. SIĞIR Araşt. EMBRİYOSU Enst. Derg. ÜRETİM 2007, 47 VE (1) TRANSFERİ 1-8 İN VİTRO SIĞIR EMBRİYOSU ÜRETİM VE TRANSFERİ In vitro Embryo Production and Transfer in Cattle Numan AKYOL*
YAZILIYA HAZIRLIK TEST SORULARI. 10. Sınıf
 YAZILIYA HAZIRLIK TEST SORULARI 10. Sınıf 1) Hücre döngüsünün interfaz evresini yeni tamamlamış bir hücre ile bu hücrenin döngü sonunda oluşturduğu yeni hücrelerde; I. DNA miktarı II. Gen Sayısı III. Gen
YAZILIYA HAZIRLIK TEST SORULARI 10. Sınıf 1) Hücre döngüsünün interfaz evresini yeni tamamlamış bir hücre ile bu hücrenin döngü sonunda oluşturduğu yeni hücrelerde; I. DNA miktarı II. Gen Sayısı III. Gen
Tüp Bebek Merkezi her şey bebek için
 Tüp Bebek Merkezi her şey bebek için Yeni bir hayata dair minik bir ses, kocaman bir umut. Medicana International İstanbul Hastanesi Tüp Bebek Merkezi deneyimli uzman kadrosu ve son teknoloji ürünü tıbbi
Tüp Bebek Merkezi her şey bebek için Yeni bir hayata dair minik bir ses, kocaman bir umut. Medicana International İstanbul Hastanesi Tüp Bebek Merkezi deneyimli uzman kadrosu ve son teknoloji ürünü tıbbi
Şekil 1. Mitoz bölünmenin profaz evresi.
 KONU 9. HÜCRE BÖLÜNMESİ MİTOZ BÖLÜNME Mitoz bölünme tek hücreli canlılardan, çok hücreli canlılara ve insana kadar birçok canlı grubu tarafından gerçekleştirilebilir. Mitoz bölünme sonunda bölünen hücrelerden
KONU 9. HÜCRE BÖLÜNMESİ MİTOZ BÖLÜNME Mitoz bölünme tek hücreli canlılardan, çok hücreli canlılara ve insana kadar birçok canlı grubu tarafından gerçekleştirilebilir. Mitoz bölünme sonunda bölünen hücrelerden
TÜRKİYE CUMHURİYETİ ANKARA ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ
 TÜRKİYE CUMHURİYETİ ANKARA ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ FARKLI BÜYÜKLÜKTEKİ SIĞIR OOSİTLERİNİN MATURASYON VE FERTİLİZASYONU ÜZERİNE İNSÜLİN BENZERİ BÜYÜME FAKTÖRÜ-1 (IGF-1) VE EPİDERMAL BÜYÜME
TÜRKİYE CUMHURİYETİ ANKARA ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ FARKLI BÜYÜKLÜKTEKİ SIĞIR OOSİTLERİNİN MATURASYON VE FERTİLİZASYONU ÜZERİNE İNSÜLİN BENZERİ BÜYÜME FAKTÖRÜ-1 (IGF-1) VE EPİDERMAL BÜYÜME
DİŞİ EŞEY HÜCRELERİNİN GELİŞMESİ OLGUNLAŞMASI. Doç. Dr. A. Gürol BAYRAKTAROĞLU
 DİŞİ EŞEY HÜCRELERİNİN GELİŞMESİ OLGUNLAŞMASI Doç. Dr. A. Gürol BAYRAKTAROĞLU OVOGENEZİS Dişi eşey hücresinin gelişip olgunlaşmasına ovogenezis denir. Spermatogenezisteki gibi çoğalma, büyüme ve olgunlaşma
DİŞİ EŞEY HÜCRELERİNİN GELİŞMESİ OLGUNLAŞMASI Doç. Dr. A. Gürol BAYRAKTAROĞLU OVOGENEZİS Dişi eşey hücresinin gelişip olgunlaşmasına ovogenezis denir. Spermatogenezisteki gibi çoğalma, büyüme ve olgunlaşma
Embriyo Kriyoprezervasyonu
 ÜREME TIBBI VE CERRAHİSİ DERNEĞİ İnfertilite Tedavisinde Güncel Yaklaşımlar Toplantısı Ankara, 21.12.2014 Embriyo Kriyoprezervasyonu Dr. Sinan Özkavukcu Ankara Üniversitesi Tıp Fakültesi ÜYTE Merkezi Laboratuvar
ÜREME TIBBI VE CERRAHİSİ DERNEĞİ İnfertilite Tedavisinde Güncel Yaklaşımlar Toplantısı Ankara, 21.12.2014 Embriyo Kriyoprezervasyonu Dr. Sinan Özkavukcu Ankara Üniversitesi Tıp Fakültesi ÜYTE Merkezi Laboratuvar
15- RADYASYONUN NÜKLEİK ASİTLER VE PROTEİNLERE ETKİLERİ
 15- RADYASYONUN NÜKLEİK ASİTLER VE PROTEİNLERE ETKİLERİ İyonlaştırıcı radyasyonların biyomoleküllere örneğin nükleik asitler ve proteinlere olan etkisi hakkında yeterli bilgi yoktur. Ancak, nükleik asitlerden
15- RADYASYONUN NÜKLEİK ASİTLER VE PROTEİNLERE ETKİLERİ İyonlaştırıcı radyasyonların biyomoleküllere örneğin nükleik asitler ve proteinlere olan etkisi hakkında yeterli bilgi yoktur. Ancak, nükleik asitlerden
Prof Dr Bülent GÜLEKLİ Dokuz Eylül Üniversitesi Tıp Fakültesi Kadın Hastalıkları ve Doğum ABD Reprodüktif Endokrinoloji Bilim Dalı Öğretim Üyesi
 Üreme Tıbbı Derneği ve TJOD Ankara Şubesi Ortak Eğitim Toplantısı HER YÖNÜYLE PCOS 24 Şubat 2013 Prof Dr Bülent GÜLEKLİ Dokuz Eylül Üniversitesi Tıp Fakültesi Kadın Hastalıkları ve Doğum ABD Reprodüktif
Üreme Tıbbı Derneği ve TJOD Ankara Şubesi Ortak Eğitim Toplantısı HER YÖNÜYLE PCOS 24 Şubat 2013 Prof Dr Bülent GÜLEKLİ Dokuz Eylül Üniversitesi Tıp Fakültesi Kadın Hastalıkları ve Doğum ABD Reprodüktif
Rahim ağzı kanseri hücreleri doku kültürü mikroskopik görüntüsü.
 Doç.Dr.Engin DEVECİ HÜCRE KÜLTÜRÜ Hücre Kültürü Araştırma Laboratuvarı, çeşitli hücrelerin invitro kültürlerini yaparak araştırmacılara kanser, kök hücre, hücre mekaniği çalışmaları gibi konularda hücre
Doç.Dr.Engin DEVECİ HÜCRE KÜLTÜRÜ Hücre Kültürü Araştırma Laboratuvarı, çeşitli hücrelerin invitro kültürlerini yaparak araştırmacılara kanser, kök hücre, hücre mekaniği çalışmaları gibi konularda hücre
İstanbul Tıp Fakültesi Tıbbi Biyoloji ABD Prof.Dr. Filiz AYDIN
 İstanbul Tıp Fakültesi Tıbbi Biyoloji ABD Prof.Dr. Filiz AYDIN Fertilizasyonda 46 kromozom Her bir kromozom çift kromadit-(92) Hücre bölündükten sonra her hücre de 46 kromozom bulunur Mitoz bölünme G1
İstanbul Tıp Fakültesi Tıbbi Biyoloji ABD Prof.Dr. Filiz AYDIN Fertilizasyonda 46 kromozom Her bir kromozom çift kromadit-(92) Hücre bölündükten sonra her hücre de 46 kromozom bulunur Mitoz bölünme G1
Farklı Su Sıcaklığı ve Işık Ortamında
 Karadeniz Alabalıklarının (Salmo coruhensis) Farklı Su Sıcaklığı ve Işık Ortamında Sperm Kalite Parametreleri Gökhan TUNÇELLİ, Devrim MEMİŞ İstanbul Üniversitesi Su Bilimleri Fakültesi Yetiştiricilik Anabilim
Karadeniz Alabalıklarının (Salmo coruhensis) Farklı Su Sıcaklığı ve Işık Ortamında Sperm Kalite Parametreleri Gökhan TUNÇELLİ, Devrim MEMİŞ İstanbul Üniversitesi Su Bilimleri Fakültesi Yetiştiricilik Anabilim
EŞEYLİ ÜREME EŞEY HÜCRELERİ VE DÖLLENME (FERTİLİZASYON) Eşeysel üreme haploit ve diploit hücrelerin her ikisini de gerektirir.
 EŞEYLİ ÜREME EŞEY HÜCRELERİ VE DÖLLENME (FERTİLİZASYON) Eşeysel üreme haploit ve diploit hücrelerin her ikisini de gerektirir. Mayoz ve mitoz bölünmelerin olduğu yaşam evreleri vardır. EŞEYLİ ÜREMENİN
EŞEYLİ ÜREME EŞEY HÜCRELERİ VE DÖLLENME (FERTİLİZASYON) Eşeysel üreme haploit ve diploit hücrelerin her ikisini de gerektirir. Mayoz ve mitoz bölünmelerin olduğu yaşam evreleri vardır. EŞEYLİ ÜREMENİN
Canlılarda mitoz, amitoz ve mayoz olmak üzere üç çeşit bölünme görülür.
 HÜCRE BÖLÜNMELERİ Canlılarda mitoz, amitoz ve mayoz olmak üzere üç çeşit bölünme görülür. I. MİTOZ BÖLÜNME Mitoz bölünme tek hücreli canlılardan, çok hücreli canlılara ve insana kadar bir çok canlı grubu
HÜCRE BÖLÜNMELERİ Canlılarda mitoz, amitoz ve mayoz olmak üzere üç çeşit bölünme görülür. I. MİTOZ BÖLÜNME Mitoz bölünme tek hücreli canlılardan, çok hücreli canlılara ve insana kadar bir çok canlı grubu
ÖZET CEVAP: Oosit retrivalin hemen ardından intrauterin hcg uygulaması implantasyon oranlarını, kimyasal ve klinik gebelik oranlarını artırmaktadır.
 Intrauterine administration of hcg immediately after oocyte retrieval and the outcome of ICSI: a randomized controlled trial Oosit Retrivalden hemen sonra intrauterin hcg uygulamasının ICSI sonuçları üzerine
Intrauterine administration of hcg immediately after oocyte retrieval and the outcome of ICSI: a randomized controlled trial Oosit Retrivalden hemen sonra intrauterin hcg uygulamasının ICSI sonuçları üzerine
İNSANDA ÜREME, BÜYÜME VE GELİŞME
 İNSANDA ÜREME, BÜYÜME VE GELİŞME Canlıların kendine benzer yavrular oluşturmasına üreme denir. Üreme tüm canlılar için ortak özellik olup canlının neslinin devamlılığını sağlar. Canlılar neslini devam
İNSANDA ÜREME, BÜYÜME VE GELİŞME Canlıların kendine benzer yavrular oluşturmasına üreme denir. Üreme tüm canlılar için ortak özellik olup canlının neslinin devamlılığını sağlar. Canlılar neslini devam
Sperma DNA İçeriği. Cinsiyeti Belirlenmiş Sperma Gebelik Oranları?
 Sütçü Düvelerde Cinsiyeti Belirlenmiş Sperma ile Farklı Saatlerde Yapılan Tohumlamanın Gebelik Oranı Üzerine Etkisi X-Y SPERM DNA FARKI Sperma DNA İçeriği Barış GÜNER1, Melih ERTÜRK2, Melih YENİTAVŞANLI3,
Sütçü Düvelerde Cinsiyeti Belirlenmiş Sperma ile Farklı Saatlerde Yapılan Tohumlamanın Gebelik Oranı Üzerine Etkisi X-Y SPERM DNA FARKI Sperma DNA İçeriği Barış GÜNER1, Melih ERTÜRK2, Melih YENİTAVŞANLI3,
ENDOMETRİAL KO-KÜLTÜRÜN BAŞARILI OLARAK ETKİLEDİĞİ HASTA TOPLULUĞU KİMLERDİR?
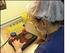 ENDOMETRİAL KO-KÜLTÜRÜN BAŞARILI OLARAK ETKİLEDİĞİ HASTA TOPLULUĞU KİMLERDİR? Bio. Semra Sertyel ALMAN HASTANESİ IVF LABORATUARLARI YÜT de başarıyı etkileyen faktörler Kadın yaşı Erkek Faktörü Uygun olmayan
ENDOMETRİAL KO-KÜLTÜRÜN BAŞARILI OLARAK ETKİLEDİĞİ HASTA TOPLULUĞU KİMLERDİR? Bio. Semra Sertyel ALMAN HASTANESİ IVF LABORATUARLARI YÜT de başarıyı etkileyen faktörler Kadın yaşı Erkek Faktörü Uygun olmayan
YGS YE HAZIRLIK DENEMESi #15
 YGS YE HAZIRLIK DENEMESi #15 1) Bir hücrede meydana gelen bölünme evrelerinden birine ait şekil yukarıdaki gibi ise; I. Diploit kromozomludur. II. Glikozu nişasta şeklinde depolar. III. Sitoplazması boğumlanma
YGS YE HAZIRLIK DENEMESi #15 1) Bir hücrede meydana gelen bölünme evrelerinden birine ait şekil yukarıdaki gibi ise; I. Diploit kromozomludur. II. Glikozu nişasta şeklinde depolar. III. Sitoplazması boğumlanma
Polikistik over sendromu olan kadınlarda, cerrahi veya Yardımcı Üreme. Teknikleri ile kanıta dayalı infertilite tedavisi
 Polikistik over sendromu olan kadınlarda, cerrahi veya Yardımcı Üreme Teknikleri ile kanıta dayalı infertilite tedavisi Polikistik over sendromu (PKOS), 1930 yılında wedge rezeksiyonun tariflenmesinden
Polikistik over sendromu olan kadınlarda, cerrahi veya Yardımcı Üreme Teknikleri ile kanıta dayalı infertilite tedavisi Polikistik over sendromu (PKOS), 1930 yılında wedge rezeksiyonun tariflenmesinden
YGS YE HAZIRLIK DENEMESi #12
 YGS YE HAZIRLIK DENEMESi #12 1) İnsanda döllenme sırasında, I. Spermdeki çekirdek, sentrozomun yumurtaya geçmesi II. Spermdeki akrozomun patlayarak zona pellusidayı eritmesi III. Yumurtadaki salgı maddelerinin
YGS YE HAZIRLIK DENEMESi #12 1) İnsanda döllenme sırasında, I. Spermdeki çekirdek, sentrozomun yumurtaya geçmesi II. Spermdeki akrozomun patlayarak zona pellusidayı eritmesi III. Yumurtadaki salgı maddelerinin
KAPASİTASYON. Çiftlik Hayvanlarında Yapay Tohumlama Prof. Dr. Fatin CEDDEN
 KAPASİTASYON Çiftlik Hayvanlarında Yapay Tohumlama Prof. Dr. Fatin CEDDEN Giriş Sıçanlarda 1951 yılında yapılan ilk çalışmalarda dişinin uterusunda 10-12 saat geçirmedikçe, spermatozoanın dölleme kabiliyetini
KAPASİTASYON Çiftlik Hayvanlarında Yapay Tohumlama Prof. Dr. Fatin CEDDEN Giriş Sıçanlarda 1951 yılında yapılan ilk çalışmalarda dişinin uterusunda 10-12 saat geçirmedikçe, spermatozoanın dölleme kabiliyetini
EMBRİYOLOJİ VE GENETİK DERSİNE GİRİŞ ARŞ. GÖR. KEVSER İLÇİOĞLU
 EMBRİYOLOJİ VE GENETİK 1 DERSİNE GİRİŞ ARŞ. GÖR. KEVSER İLÇİOĞLU 2/16 EMBRİYOLOJİ NEDİR? Embriyoloji; zigottan, hücreler, dokular, organlar ile tüm vücudun oluşmasına kadar geçen ve doğuma kadar devam
EMBRİYOLOJİ VE GENETİK 1 DERSİNE GİRİŞ ARŞ. GÖR. KEVSER İLÇİOĞLU 2/16 EMBRİYOLOJİ NEDİR? Embriyoloji; zigottan, hücreler, dokular, organlar ile tüm vücudun oluşmasına kadar geçen ve doğuma kadar devam
ıı. Üretici, ithalatçı veya bavi olarak TITUBB da kayıtlı olunmalı ve kayıtlı olunduğuna
 145 MiKRON(!-lm) DENUDP.SYON pipeti TEKNiK Ş.~RTNAMESi 1. ICSI'den önce oositten kümülüs kümesini soymak, fertilizasyon kontrolü, oositin manipulasyonu. ernbr ivolar, blastokistler ve blastomerler için
145 MiKRON(!-lm) DENUDP.SYON pipeti TEKNiK Ş.~RTNAMESi 1. ICSI'den önce oositten kümülüs kümesini soymak, fertilizasyon kontrolü, oositin manipulasyonu. ernbr ivolar, blastokistler ve blastomerler için
BÜYÜKBAŞ HAYVANCILIK ARAŞTIRMALARI ÇALIŞMA GRUBU. Önder SÖZEN Koordinatör 19.03.2014
 BÜYÜKBAŞ HAYVANCILIK ARAŞTIRMALARI ÇALIŞMA GRUBU Önder SÖZEN Koordinatör 19.03.2014 SUNU PLANI Çalışma Grubu Bağlı Enstitüler/İstasyonlar Dünya ve Türkiye de Büyükbaş Hayvancılık Verileri Devam Eden, Sonuçlanan,
BÜYÜKBAŞ HAYVANCILIK ARAŞTIRMALARI ÇALIŞMA GRUBU Önder SÖZEN Koordinatör 19.03.2014 SUNU PLANI Çalışma Grubu Bağlı Enstitüler/İstasyonlar Dünya ve Türkiye de Büyükbaş Hayvancılık Verileri Devam Eden, Sonuçlanan,
HÜCRE BÖLÜNMESİ VE ÜREME. Mitoz Bölünme ve Eşeysiz Üreme 1
 HÜCRE BÖLÜNMESİ VE ÜREME Mitoz Bölünme ve Eşeysiz Üreme 1 Hücrenin bölünmeye başlamasından itibaren onu takip eden diğer hücre bölünmesine kadar geçen zaman aralığına hücre döngüsü denir. Hücreler belli
HÜCRE BÖLÜNMESİ VE ÜREME Mitoz Bölünme ve Eşeysiz Üreme 1 Hücrenin bölünmeye başlamasından itibaren onu takip eden diğer hücre bölünmesine kadar geçen zaman aralığına hücre döngüsü denir. Hücreler belli
TOPRAK TOPRAK TEKSTÜRÜ (BÜNYESİ)
 TOPRAK Toprak esas itibarı ile uzun yılların ürünü olan, kayaların ve organik maddelerin türlü çaptaki ayrışma ürünlerinden meydana gelen, içinde geniş bir canlılar âlemini barındırarak bitkilere durak
TOPRAK Toprak esas itibarı ile uzun yılların ürünü olan, kayaların ve organik maddelerin türlü çaptaki ayrışma ürünlerinden meydana gelen, içinde geniş bir canlılar âlemini barındırarak bitkilere durak
Giriş ve Genel Tanımlamalar Fer/lizasyon
 Dönem 1-Sunum 1/ 2016 Giriş ve Genel Tanımlamalar Fer/lizasyon Prof.Dr. Alp Can Ankara Üniversitesi Tıp Fakültesi Histoloji-Embriyoloji ABD www.alpcan.com Embriyoloji (Gelişim Bilimi) [embriyo=cenin, logos=bilim]
Dönem 1-Sunum 1/ 2016 Giriş ve Genel Tanımlamalar Fer/lizasyon Prof.Dr. Alp Can Ankara Üniversitesi Tıp Fakültesi Histoloji-Embriyoloji ABD www.alpcan.com Embriyoloji (Gelişim Bilimi) [embriyo=cenin, logos=bilim]
2003 ÖSS BİYOLOJİ SORULARI VE CEVAPLARI
 2003 ÖSS BİYOLOJİ SORULARI VE CEVAPLARI 1. Bir hücrede oksijenli solunum, protein sentezi, fotosentez olaylarının tümünün gerçekleşebilmesi için, bu hücrede; I. ribozom, II. kloroplast, III. mitokondri,
2003 ÖSS BİYOLOJİ SORULARI VE CEVAPLARI 1. Bir hücrede oksijenli solunum, protein sentezi, fotosentez olaylarının tümünün gerçekleşebilmesi için, bu hücrede; I. ribozom, II. kloroplast, III. mitokondri,
Mayoz Bölünmenin Oluşumu
 MAYOZ BÖLÜNME NEDİR? 03 Ocak 2012, 23:39 Osman BEDEL MAYOZ BÖLÜNME NEDİR? Kromozom sayılarının nesiller boyu sabit tutulması mayoz bölünme ile sağlanır. Mayoz özel bir hücre bölünmesidir. Bu bölünme ile
MAYOZ BÖLÜNME NEDİR? 03 Ocak 2012, 23:39 Osman BEDEL MAYOZ BÖLÜNME NEDİR? Kromozom sayılarının nesiller boyu sabit tutulması mayoz bölünme ile sağlanır. Mayoz özel bir hücre bölünmesidir. Bu bölünme ile
IN VITRO SIĞIR BLASTOSİST ÜRETİMİ ÜZERİNE TANIMLANMIŞ MEDYUMLARIN ETKİSİ VE BLASTOSİSTLERİN FARKLI KRİYOPREZERVASYON TEKNİKLERİ İLE DONDURULMASI
 IN VITRO SIĞIR BLASTOSİST ÜRETİMİ ÜZERİNE TANIMLANMIŞ MEDYUMLARIN ETKİSİ VE BLASTOSİSTLERİN FARKLI KRİYOPREZERVASYON TEKNİKLERİ İLE DONDURULMASI Tolga AKKOÇ Doktora Tezi Zootekni Anabilim Dalı Danışman:
IN VITRO SIĞIR BLASTOSİST ÜRETİMİ ÜZERİNE TANIMLANMIŞ MEDYUMLARIN ETKİSİ VE BLASTOSİSTLERİN FARKLI KRİYOPREZERVASYON TEKNİKLERİ İLE DONDURULMASI Tolga AKKOÇ Doktora Tezi Zootekni Anabilim Dalı Danışman:
10. SINIF KONU ANLATIMI 12 EŞEYLİ VE EŞEYSİZ ÜREME SORU ÇÖZÜMÜ
 10. SINIF KONU ANLATIMI 12 EŞEYLİ VE EŞEYSİZ ÜREME SORU ÇÖZÜMÜ Eşeysiz Üreme ile ilgili, I. Canlının yararlı özelliklerinin korunmasını sağlar. II. Canlının değişen ortam koşullarına uyumunu artırır. III.
10. SINIF KONU ANLATIMI 12 EŞEYLİ VE EŞEYSİZ ÜREME SORU ÇÖZÜMÜ Eşeysiz Üreme ile ilgili, I. Canlının yararlı özelliklerinin korunmasını sağlar. II. Canlının değişen ortam koşullarına uyumunu artırır. III.
ORTOPEDİK PROTEZ ENFEKSİYONLARINDA SONİKASYON DENEYİMİ
 ORTOPEDİK PROTEZ ENFEKSİYONLARINDA SONİKASYON DENEYİMİ Dr. Şua Sümer Selçuk Üniversitesi Tıp Fakültesi Enf. Hast. ve Klin. Mikr. AD 17 Mayıs 2016 Prostetik eklem ameliyatları yaşlı popülasyonun artışına
ORTOPEDİK PROTEZ ENFEKSİYONLARINDA SONİKASYON DENEYİMİ Dr. Şua Sümer Selçuk Üniversitesi Tıp Fakültesi Enf. Hast. ve Klin. Mikr. AD 17 Mayıs 2016 Prostetik eklem ameliyatları yaşlı popülasyonun artışına
Özel Formülasyon DAHA İYİ DAHA DÜŞÜK MALIYETLE DAHA SAĞLIKLI SÜRÜLER VE DAHA FAZLA YUMURTA IÇIN AGRALYX!
 Özel Formülasyon DAHA İYİ Yumurta Verimi Kabuk Kalitesi Yemden Yararlanma Karaciğer Sağlığı Bağırsak Sağlığı Bağışıklık Karlılık DAHA DÜŞÜK MALIYETLE DAHA SAĞLIKLI SÜRÜLER VE DAHA FAZLA YUMURTA IÇIN AGRALYX!
Özel Formülasyon DAHA İYİ Yumurta Verimi Kabuk Kalitesi Yemden Yararlanma Karaciğer Sağlığı Bağırsak Sağlığı Bağışıklık Karlılık DAHA DÜŞÜK MALIYETLE DAHA SAĞLIKLI SÜRÜLER VE DAHA FAZLA YUMURTA IÇIN AGRALYX!
YGS YE HAZIRLIK DENEMESi #18
 YGS YE HAZIRLIK DENEMESi #18 1) Bakterilerin gerçekleştirdiği, I. Kimyasal enerji sayesinde besin sentezleme II. Işık enerjisini kimyasal bağ enerjisine dönüştürme III. Kimyasal bağ enerjisini ATP enerjisine
YGS YE HAZIRLIK DENEMESi #18 1) Bakterilerin gerçekleştirdiği, I. Kimyasal enerji sayesinde besin sentezleme II. Işık enerjisini kimyasal bağ enerjisine dönüştürme III. Kimyasal bağ enerjisini ATP enerjisine
Sperm DNA Yapısı Değerlendirilmesi. Prof. Dr. Esat Orhon
 Sperm DNA Yapısı Değerlendirilmesi Prof. Dr. Esat Orhon DNA kırıklarının nedeni nedir? Unpaired Electrons Serbest radikal nedir? Çift oluşturamamış, tek kalmış elektron veya elektronlar içeren atomlar
Sperm DNA Yapısı Değerlendirilmesi Prof. Dr. Esat Orhon DNA kırıklarının nedeni nedir? Unpaired Electrons Serbest radikal nedir? Çift oluşturamamış, tek kalmış elektron veya elektronlar içeren atomlar
10. SINIF KONU ANLATIMI. 16 ÜREME BÜYÜME GELİŞME Döllenme ve Aile Planlaması Soru Çözümü
 10. SINIF KONU ANLATIMI 16 ÜREME BÜYÜME GELİŞME Döllenme ve Aile Planlaması Soru Çözümü DÖLLENME Dişi üreme sistemine giren sperm hücreleri yumurta hücresinin salgıladığı FERTİLİZİN sayesinde yumurta hücresini
10. SINIF KONU ANLATIMI 16 ÜREME BÜYÜME GELİŞME Döllenme ve Aile Planlaması Soru Çözümü DÖLLENME Dişi üreme sistemine giren sperm hücreleri yumurta hücresinin salgıladığı FERTİLİZİN sayesinde yumurta hücresini
Gonadlar: Dişide ovaryumlar (yumurtalıklar), erkekte de testislerdir. Gametler: Yeni bir canlının gelişmesini başlatmak için bir araya gelen dişi ve
 Gonadlar: Dişide ovaryumlar (yumurtalıklar), erkekte de testislerdir. Gametler: Yeni bir canlının gelişmesini başlatmak için bir araya gelen dişi ve erkek cinsiyet hücreleridir. Gametogenezis: Dişi ve
Gonadlar: Dişide ovaryumlar (yumurtalıklar), erkekte de testislerdir. Gametler: Yeni bir canlının gelişmesini başlatmak için bir araya gelen dişi ve erkek cinsiyet hücreleridir. Gametogenezis: Dişi ve
DOKUZ EYLÜL ÜNİVERSİTESİ
 20/01/2016 00:00:00 Döner Sermaye İşletmesi Teklif No 2016430 İLAN HASTANEMİZİN İHTİYACI OLAN AŞAĞIDA YAZILI MALZEME(LER) İHALE İLE SATIN ALINACAKTIR. İLGİLENEN FİRMALARIN 26/01/2016 TARİHİ, SAAT 10:00
20/01/2016 00:00:00 Döner Sermaye İşletmesi Teklif No 2016430 İLAN HASTANEMİZİN İHTİYACI OLAN AŞAĞIDA YAZILI MALZEME(LER) İHALE İLE SATIN ALINACAKTIR. İLGİLENEN FİRMALARIN 26/01/2016 TARİHİ, SAAT 10:00
HANDAN TUNCEL. İstanbul Üniversitesi, Cerrahpaşa Tıp Fakültesi Biyofizik Anabilim Dalı
 HÜCRENİN ÇOĞALMASI VE FARKLILAŞIMININ BİYOFİZİĞİ HANDAN TUNCEL İstanbul Üniversitesi, Cerrahpaşa Tıp Fakültesi Biyofizik Anabilim Dalı hntuncel@istanbul.edu.tr G1; presentetik, S; DNA sentez fazı G2;
HÜCRENİN ÇOĞALMASI VE FARKLILAŞIMININ BİYOFİZİĞİ HANDAN TUNCEL İstanbul Üniversitesi, Cerrahpaşa Tıp Fakültesi Biyofizik Anabilim Dalı hntuncel@istanbul.edu.tr G1; presentetik, S; DNA sentez fazı G2;
ADIM ADIM YGS LYS. 73. Adım ÜREME BÜYÜME GELİŞME EMBRİYONİK ZARLAR İNSAN EMBRİYOSUNUN GELİŞİMİ-1
 ADIM ADIM YGS LYS 73. Adım ÜREME BÜYÜME GELİŞME EMBRİYONİK ZARLAR İNSAN EMBRİYOSUNUN GELİŞİMİ-1 EMBRİYONUN DIŞINDA YER ALAN ZARLAR Zigotun gelişmesi ardından oluşan embriyo; sürüngen, kuş ve memelilerde
ADIM ADIM YGS LYS 73. Adım ÜREME BÜYÜME GELİŞME EMBRİYONİK ZARLAR İNSAN EMBRİYOSUNUN GELİŞİMİ-1 EMBRİYONUN DIŞINDA YER ALAN ZARLAR Zigotun gelişmesi ardından oluşan embriyo; sürüngen, kuş ve memelilerde
Prof Dr Bulent GULEKLI Dokuz Eylul Universitesi Tıp Fakültesi Kadın Hast ve Doğum Anabilim Dalı ve Üreme Endokrinolojis Bilim dalı Izmir
 Prof Dr Bulent GULEKLI Dokuz Eylul Universitesi Tıp Fakültesi Kadın Hast ve Doğum Anabilim Dalı ve Üreme Endokrinolojis Bilim dalı Izmir ART için ovarian stimulasyonu ve ovulasyon indüksiyonundaki problemler
Prof Dr Bulent GULEKLI Dokuz Eylul Universitesi Tıp Fakültesi Kadın Hast ve Doğum Anabilim Dalı ve Üreme Endokrinolojis Bilim dalı Izmir ART için ovarian stimulasyonu ve ovulasyon indüksiyonundaki problemler
CANLILARDA ÜREME. Üreme canlıların ortak özelliğidir. Her canlının kendine benzer canlı meydana getirebilmesi üreme ile gerçekleşir
 CANLILARDA ÜREME EYLÜL 3.HAFTA MİTOZ VE EŞEYSİZ ÜREME Her canlının kendine benzer canlı meydana getirebilmesi üreme ile gerçekleşir Üreme canlıların ortak özelliğidir 3 4 Canlılar hücrelerden meydana gelir
CANLILARDA ÜREME EYLÜL 3.HAFTA MİTOZ VE EŞEYSİZ ÜREME Her canlının kendine benzer canlı meydana getirebilmesi üreme ile gerçekleşir Üreme canlıların ortak özelliğidir 3 4 Canlılar hücrelerden meydana gelir
1) HOLDING PIPET TEKNIK SARTNAMESI
 1) HOLDING PIPET TEKNIK SARTNAMESI 1. Pipet insan oosit mikromanipulasyonlarında, oositi zarar vermeden tutma işleminde kullanılmaya uygun 2. Mikropipet borosilika camından imal edilmiş olmalıdır ve gamma
1) HOLDING PIPET TEKNIK SARTNAMESI 1. Pipet insan oosit mikromanipulasyonlarında, oositi zarar vermeden tutma işleminde kullanılmaya uygun 2. Mikropipet borosilika camından imal edilmiş olmalıdır ve gamma
 1- Aşağıda verilen mayoz bölünme geçirmekte olan hücrelerin evrelerini ve her birinin kromozom sayısını yazınız. (6*1,5=9 ) 5- Mayoz bölünmede kalıtsal çeşitliliği sağlayan olaylar nelerdir? (2*4=8 ) Profaz_I
1- Aşağıda verilen mayoz bölünme geçirmekte olan hücrelerin evrelerini ve her birinin kromozom sayısını yazınız. (6*1,5=9 ) 5- Mayoz bölünmede kalıtsal çeşitliliği sağlayan olaylar nelerdir? (2*4=8 ) Profaz_I
LYS ANAHTAR SORULAR #6. Mitoz ve Mayoz Bölünme Eşeyli ve Eşeysiz Üreme İnsanda Üreme
 LYS ANAHTAR SORULAR #6 Mitoz ve Mayoz Bölünme Eşeyli ve Eşeysiz Üreme İnsanda Üreme 1) 2n = 40 kromozomlu memeli türünde, Dişinin ovaryumlarında yumurta hücresi oluşurken anafaz I evresinde gonozomların
LYS ANAHTAR SORULAR #6 Mitoz ve Mayoz Bölünme Eşeyli ve Eşeysiz Üreme İnsanda Üreme 1) 2n = 40 kromozomlu memeli türünde, Dişinin ovaryumlarında yumurta hücresi oluşurken anafaz I evresinde gonozomların
KLONLAMA. Prof. Dr. Fatma Savran Oğuz
 KLONLAMA Prof. Dr. Fatma Savran Oğuz Tek yumurta ikizleri doğal klonlardır. Araştırıcılar ilk önceleri bu doğal olayı taklit ederek klonlama çalışmalarına başlamışlardır. Tek yumurta ikizlerinde embriyo
KLONLAMA Prof. Dr. Fatma Savran Oğuz Tek yumurta ikizleri doğal klonlardır. Araştırıcılar ilk önceleri bu doğal olayı taklit ederek klonlama çalışmalarına başlamışlardır. Tek yumurta ikizlerinde embriyo
10. SINIF KONU ANLATIMI 6 MAYOZ BÖLÜNME-3
 10. SINIF KONU ANLATIMI 6 MAYOZ BÖLÜNME-3 Mayoz Bölünmenin Genel Özellikleri Üreme ana hücrelerinde görülür. Üreme hücrelerinin oluşmasını sağlar. Sadece 2n kromozomlu hücrelerde görülür. 4 yeni hücre
10. SINIF KONU ANLATIMI 6 MAYOZ BÖLÜNME-3 Mayoz Bölünmenin Genel Özellikleri Üreme ana hücrelerinde görülür. Üreme hücrelerinin oluşmasını sağlar. Sadece 2n kromozomlu hücrelerde görülür. 4 yeni hücre
Hücre Nükleusu, Nükleus Membranı, Nükleus Porları. Doç. Dr. Ahmet Özaydın
 Hücre Nükleusu, Nükleus Membranı, Nükleus Porları Doç. Dr. Ahmet Özaydın Nükleus (çekirdek) ökaryotlar ile prokaryotları ayıran temel özelliktir. Çekirdek hem genetik bilginin deposu hem de kontrol merkezidir.
Hücre Nükleusu, Nükleus Membranı, Nükleus Porları Doç. Dr. Ahmet Özaydın Nükleus (çekirdek) ökaryotlar ile prokaryotları ayıran temel özelliktir. Çekirdek hem genetik bilginin deposu hem de kontrol merkezidir.
Prenatal devre insan ve memeli hayvanlarda uterus içerisinde geçer. Kanatlı hayvanlarda ise yumurta içinde kuluçkada geçen devredir.
 Embriyoloji, genel anlamıyla canlıların oluşmasını ve gelişmesini inceleyen bir bilim dalıdır. İnsan ve memeli hayvanların doğumdan önceki, kanatlı hayvanların ise kuluçka dönemindeki hayatını inceler.
Embriyoloji, genel anlamıyla canlıların oluşmasını ve gelişmesini inceleyen bir bilim dalıdır. İnsan ve memeli hayvanların doğumdan önceki, kanatlı hayvanların ise kuluçka dönemindeki hayatını inceler.
BOĞA SPERMASININ SULANDIRILMASI VE DONDURULMASI AŞAMALARI. Dr Decuadro-Hansen IMV Technologies Fransa
 BOĞA SPERMASININ SULANDIRILMASI VE DONDURULMASI AŞAMALARI Dr Decuadro-Hansen IMV Technologies Fransa Giriş Spermanın ilk dondurulup saklanması 1945 de bildirildikten sonra, birçok memeli türünden sperma
BOĞA SPERMASININ SULANDIRILMASI VE DONDURULMASI AŞAMALARI Dr Decuadro-Hansen IMV Technologies Fransa Giriş Spermanın ilk dondurulup saklanması 1945 de bildirildikten sonra, birçok memeli türünden sperma
DİŞİ ÜREME ORGANLARI
 DİŞİ ÜREME ORGANLARI Dişi üreme organları dişi gamet hücresi ovumu (yumurtayı) üreten ovaryumlar ile ovumun döllendiği, döllenme sonrasında gebeliğin şekillendiği ve gelişen yavrunun dışarı çıkarıldığı
DİŞİ ÜREME ORGANLARI Dişi üreme organları dişi gamet hücresi ovumu (yumurtayı) üreten ovaryumlar ile ovumun döllendiği, döllenme sonrasında gebeliğin şekillendiği ve gelişen yavrunun dışarı çıkarıldığı
Spermatozoanın Dişi Genital Kanalındaki Hareketi. Üreme Biyolojisi ve Yapay Tohumlama Prof. Dr. Fatin CEDDEN
 Spermatozoanın Dişi Genital Kanalındaki Hareketi Üreme Biyolojisi ve Yapay Tohumlama Prof. Dr. Fatin CEDDEN Döllenme Sperm hücresinin ovuma girip kaynaşması olayına (fekondasyon) Döllenme denir. Bu olgu
Spermatozoanın Dişi Genital Kanalındaki Hareketi Üreme Biyolojisi ve Yapay Tohumlama Prof. Dr. Fatin CEDDEN Döllenme Sperm hücresinin ovuma girip kaynaşması olayına (fekondasyon) Döllenme denir. Bu olgu
T. C. DİCLE ÜNİVERSİTESİ VETERİNER FAKÜLTESİ KAMU HİZMET STANDARTLARI TABLOSU
 BİRİM: BESİN/GIDA HİJYENİ VE TEKNOLOJİSİ ANABİLİM DALI T. C. 1 Gıda analizleri mikrobiyolojik- 2 Gıda analizleri serolojik ve toksikolojik- 3 Danışmanlık hizmeti 1. Yapılacak analizleri ve ilgili mevzuatı
BİRİM: BESİN/GIDA HİJYENİ VE TEKNOLOJİSİ ANABİLİM DALI T. C. 1 Gıda analizleri mikrobiyolojik- 2 Gıda analizleri serolojik ve toksikolojik- 3 Danışmanlık hizmeti 1. Yapılacak analizleri ve ilgili mevzuatı
Mayoz ve Eşeyli Üreme Biyoloji Ders Notları
 A. Mayoz Bölünme Mayoz ve Eşeyli Üreme Biyoloji Ders Notları Eşeyli üremenin temelidir. Eşey ana hücrelerinden (2n), eşey hücrelerini (n) oluşturan özelleşmiş bölünme şeklidir. Mayoz I ve II olarak birbirini
A. Mayoz Bölünme Mayoz ve Eşeyli Üreme Biyoloji Ders Notları Eşeyli üremenin temelidir. Eşey ana hücrelerinden (2n), eşey hücrelerini (n) oluşturan özelleşmiş bölünme şeklidir. Mayoz I ve II olarak birbirini
STERİLİZASYON. Sterilizasyon Yöntemleri. Sterilizasyonu Etkileyen Faktörler
 STERİLİZASYON Tüm canlı mikroorganizmaların tam olarak uzaklaştırılması veya öldürülmesi işlemidir. Türk Gıda Kodeksi Çiğ Süt ve Isıl İşlem Görmüş Sütleri Tebliği ne göre sterilizasyon; oda sıcaklığında
STERİLİZASYON Tüm canlı mikroorganizmaların tam olarak uzaklaştırılması veya öldürülmesi işlemidir. Türk Gıda Kodeksi Çiğ Süt ve Isıl İşlem Görmüş Sütleri Tebliği ne göre sterilizasyon; oda sıcaklığında
Laboratuvar Tekniği. Adnan Menderes Üniversitesi Tarımsal Biyoteknoloji Bölümü TBY 118 Muavviz Ayvaz (Yrd. Doç. Dr.) 5. Hafta (14.03.
 Laboratuvar Tekniği Adnan Menderes Üniversitesi Tarımsal Biyoteknoloji TBY 118 Muavviz Ayvaz (Yrd. Doç. Dr.) 5. Hafta (14.03.2014) 1 5. Haftanın Ders İçeriği DNA ekstraksiyonu DNA ekstraksiyonunun amacı
Laboratuvar Tekniği Adnan Menderes Üniversitesi Tarımsal Biyoteknoloji TBY 118 Muavviz Ayvaz (Yrd. Doç. Dr.) 5. Hafta (14.03.2014) 1 5. Haftanın Ders İçeriği DNA ekstraksiyonu DNA ekstraksiyonunun amacı
BMM307-H02. Yrd.Doç.Dr. Ziynet PAMUK
 BMM307-H02 Yrd.Doç.Dr. Ziynet PAMUK ziynetpamuk@gmail.com 1 BİYOELEKTRİK NEDİR? Biyoelektrik, canlıların üretmiş olduğu elektriktir. Ancak bu derste anlatılacak olan insan vücudundan elektrotlar vasıtasıyla
BMM307-H02 Yrd.Doç.Dr. Ziynet PAMUK ziynetpamuk@gmail.com 1 BİYOELEKTRİK NEDİR? Biyoelektrik, canlıların üretmiş olduğu elektriktir. Ancak bu derste anlatılacak olan insan vücudundan elektrotlar vasıtasıyla
DAHA İYİ ÖZEL FORMÜLASYON. Yumurta Verim Kabuk Kalitesi Yemden Yararlanma Karaciğer Sağlığı Bağırsak Sağlığı Bağışıklık Karlılık
 ÖZEL FORMÜLASYON DAHA İYİ Yumurta Verim Kabuk Kalitesi Yemden Yararlanma Karaciğer Sağlığı Bağırsak Sağlığı Bağışıklık Karlılık DAHA DÜŞÜK MALİYETLE DAHA SAĞLIKLI SÜRÜLER VE DAHA FAZLA YUMURTA İÇİN AGRALYX
ÖZEL FORMÜLASYON DAHA İYİ Yumurta Verim Kabuk Kalitesi Yemden Yararlanma Karaciğer Sağlığı Bağırsak Sağlığı Bağışıklık Karlılık DAHA DÜŞÜK MALİYETLE DAHA SAĞLIKLI SÜRÜLER VE DAHA FAZLA YUMURTA İÇİN AGRALYX
DÖNEM 1- A, 3. DERS KURULU (2015-2016)
 DÖNEM 1- A, 3. DERS KURULU (2015-2016) DERS SAATİ DERS ADI DERS KONUSU DERSİ VEREN ÖĞRETİM ÜYESİ 4. DK 1. Hafta 07 Aralık Pazartesi Mikrobiyoloji Mikrobiyolojinin tarihçesi ve mikroorganizmalara genel
DÖNEM 1- A, 3. DERS KURULU (2015-2016) DERS SAATİ DERS ADI DERS KONUSU DERSİ VEREN ÖĞRETİM ÜYESİ 4. DK 1. Hafta 07 Aralık Pazartesi Mikrobiyoloji Mikrobiyolojinin tarihçesi ve mikroorganizmalara genel
Osmaniye Korkut Ata Üniversitesi, Biyoloji Bölümü Araştırma Laboratuarları ve Üniteleri
 Osmaniye Korkut Ata Üniversitesi, Biyoloji Bölümü Araştırma Laboratuarları ve Üniteleri Biyoloji Bölümünde Merkezi Araştırma Laboratuarlarının Kurulumu Osmaniye Korkut Ata Üniversitesi, Biyoloji Bölümü
Osmaniye Korkut Ata Üniversitesi, Biyoloji Bölümü Araştırma Laboratuarları ve Üniteleri Biyoloji Bölümünde Merkezi Araştırma Laboratuarlarının Kurulumu Osmaniye Korkut Ata Üniversitesi, Biyoloji Bölümü
Hd 50. Hidrojen Molekülleri. Hidrojen bakımından zengin alkali su. Gerekli mineral takviyeleri. Üstün antioksidan etkisi
 Hd 50 Hidrojen Molekülleri Hidrojen bakımından zengin alkali su Üstün antioksidan etkisi Gerekli mineral takviyeleri Dayanıklı ve mükemmel performans Hidrojen molekülleri doğal ortamda bulunur, basit yapıdadır
Hd 50 Hidrojen Molekülleri Hidrojen bakımından zengin alkali su Üstün antioksidan etkisi Gerekli mineral takviyeleri Dayanıklı ve mükemmel performans Hidrojen molekülleri doğal ortamda bulunur, basit yapıdadır
HAYVAN BESLEMEDE ENKAPSÜLASYON TEKNOLOJİSİ VE ÖZELLİKLERİ. Prof.Dr. Seher KÜÇÜKERSAN
 HAYVAN BESLEMEDE ENKAPSÜLASYON TEKNOLOJİSİ VE ÖZELLİKLERİ Prof.Dr. Seher KÜÇÜKERSAN Enkapsülasyon katı, sıvı ve gaz malzemelerin kaplanarak kapsüller içinde tutulması ile çok küçük bir maddeyi veya tüm
HAYVAN BESLEMEDE ENKAPSÜLASYON TEKNOLOJİSİ VE ÖZELLİKLERİ Prof.Dr. Seher KÜÇÜKERSAN Enkapsülasyon katı, sıvı ve gaz malzemelerin kaplanarak kapsüller içinde tutulması ile çok küçük bir maddeyi veya tüm
CANLILARIN YAPISINDA BULUNAN TEMEL BİLEŞENLER
 CANLILARIN YAPISINDA BULUNAN TEMEL BİLEŞENLER Canlıların yapısında bulunan moleküller yapısına göre 2 ye ayrılır: I. İnorganik Bileşikler: Bir canlı vücudunda sentezlenemeyen, dışardan hazır olarak aldığı
CANLILARIN YAPISINDA BULUNAN TEMEL BİLEŞENLER Canlıların yapısında bulunan moleküller yapısına göre 2 ye ayrılır: I. İnorganik Bileşikler: Bir canlı vücudunda sentezlenemeyen, dışardan hazır olarak aldığı
2)Subatomik parçacıklardan oluşan radyasyon. α, β ışınları
 B) RADYASYON UYGULAMALARI Radyasyon = enerji yayılması 1)Elektromanyetik radyasyon. UV, X ve γ ışınları 2)Subatomik parçacıklardan oluşan radyasyon. α, β ışınları İyonizan ışınların canlı hücreler üzerine
B) RADYASYON UYGULAMALARI Radyasyon = enerji yayılması 1)Elektromanyetik radyasyon. UV, X ve γ ışınları 2)Subatomik parçacıklardan oluşan radyasyon. α, β ışınları İyonizan ışınların canlı hücreler üzerine
YGS YE HAZIRLIK DENEMESi #22
 YGS YE HAZIRLIK DENEMESi #22 1) Zigottan başlayıp yeni bir bireyin meydana gelmesiyle sonlanan olayların hepsine birden gelişme denir. Embriyonun gelişimi sırasında, I. Morula II. Gastrula III. Blastula
YGS YE HAZIRLIK DENEMESi #22 1) Zigottan başlayıp yeni bir bireyin meydana gelmesiyle sonlanan olayların hepsine birden gelişme denir. Embriyonun gelişimi sırasında, I. Morula II. Gastrula III. Blastula
Hücre. 1 µm = 0,001 mm (1000 µm = 1 mm)!
 HÜCRE FİZYOLOJİSİ Hücre Hücre: Tüm canlıların en küçük yapısal ve fonksiyonel ünitesi İnsan vücudunda trilyonlarca hücre bulunur Fare, insan veya filin hücreleri yaklaşık aynı büyüklükte Vücudun büyüklüğü
HÜCRE FİZYOLOJİSİ Hücre Hücre: Tüm canlıların en küçük yapısal ve fonksiyonel ünitesi İnsan vücudunda trilyonlarca hücre bulunur Fare, insan veya filin hücreleri yaklaşık aynı büyüklükte Vücudun büyüklüğü
TEKRAR DOLAŞIMLI ÜRETİM SİSTEMLERİNDE SU KALİTESİ ve YÖNETİMİ
 TEKRAR DOLAŞIMLI ÜRETİM SİSTEMLERİNDE SU KALİTESİ ve YÖNETİMİ Tekrar dolaşımlı (resirkülasyonlu) su ürünleri yetiştiricilik sistemleri, günümüzde özellikle doğal su kaynaklarının tükenmeye başlamasıyla
TEKRAR DOLAŞIMLI ÜRETİM SİSTEMLERİNDE SU KALİTESİ ve YÖNETİMİ Tekrar dolaşımlı (resirkülasyonlu) su ürünleri yetiştiricilik sistemleri, günümüzde özellikle doğal su kaynaklarının tükenmeye başlamasıyla
Hücre Transfeksiyonu
 1 Hücre Transfeksiyonu Tanımlar Transformasyon: Bakteri ve bitkilere gene/k materyal aktarılması işlemidir. Transdüksiyon: Ökaryo/k hücrelere gene/k materyallerin viral yöntemlerle aktarılması işlemidir.
1 Hücre Transfeksiyonu Tanımlar Transformasyon: Bakteri ve bitkilere gene/k materyal aktarılması işlemidir. Transdüksiyon: Ökaryo/k hücrelere gene/k materyallerin viral yöntemlerle aktarılması işlemidir.
