KARIŞIMLAR. Mustafa Atalay mustafaatalay.wordpress.com Sayfa 1
|
|
|
- Gözde Kubilay
- 10 yıl önce
- İzleme sayısı:
Transkript
1 KARIŞIMLAR ÇÖZÜCÜLER ve ÇÖZELTĠLER Bir maddenin, başka bir madde içerisinde gözle görülemeyecek kadar küçük tanecikler halinde dağılarak, her yerinde aynı özelliği taşıyan karışım oluşturması olayına çözünme denir. Bir çözeltide, genellikle miktarı fazla olan bileşene çözücü (çözen), miktarı az olan bileşene ise çözünen denir.bazı karışımlarda karışımı oluşturan maddeler birbiri içerisinde karışımın her noktasına eşit oranda(homojen) dağılmıştır. Çözen ve çözünenin oluşturduğu bu tür homojen karışımlara çözelti adı verilir. Çözünme olayında, maddenin homojen bir karışım oluşturacak biçimde karışması sözkonusudur. Bu durumda çözünenin katı ve çözücünün sıvı olması gerekmez. Maddenin katı, sıvı ve gaz halleri değişik şekillerde bir araya gelerek çözelti oluşturabilirler. Öyleyse katı-katı, sıvı-sıvı, gaz-gaz, katı-sıvı, gaz-sıvı homojen karışımlarına çözelti diyebiliriz. Kimyasal tepkimelerin pek çoğu sıvı çözelti ortamında yürüdüğünden, en çok kullanılan çözeltiler sıvı çözeltilerdir. Katı-katı çözeltilerine örnek olarak metal alaşımları verilebilir. Örneğin, kalayın bakır içerisinde çözünmesiyle bronz oluşur. Sıvı sıvı çözeltilerine örnek olarak alkol ile su karışımını verebiliriz. Alkol ve su birbiri içerisinde her oranda karışabilirler. Gaz-gaz çözeltilerine örnek olarak yanda görüldüğü gibi O 2 ve Ar gazları karışımı verilebilir. Ayrı kaplarda bulunan gazlar aynı kaba konulurlarsa homojen bir karışım oluştururlar. Oda koşullarında sıvı halde bulunan cıvanın gümüş katısı içerisinde çözünmesiyle oluşan amalgam (diş dolgusu) sıvıkatı çözeltisine örnek olarak verilebilir. Gaz-sıvı çözeltilerine örnek olarak, karbondioksit gazının su içerisinde çözünmesiyle hazırlanan karbonatlı su (gazoz, kola vb.) verilebilir. Bütün gaz karışımları birer çözeltidir; çünkü gaz gaz karışımlarının tamamı homojendir. Karışımlar oluşturulurken çözeltiyi oluşturacak bileşenlerin kütlereleri toplamı, karışımın kütlesine eşit olur. Ancak karıştırma işlemi sırasında bileşenlerin hacimleri toplamı oluşan karışımın hacmine eşit olmaz. Bunu yandaki örnekle daha kolay anlayabiliriz. Pinpon topları ve bilyeler farklı kaplardayken, aynı kap içerisinde karıştırılıyorlar. Oluşan karışımın kütlesi, bilyelerin ve pinpon toplarının kütleleri toplamına eşit olur. Ancak oluşan karışımda bilyeler, pinpon topları arasındaki boşluklara yerleşebildiği Mustafa Atalay mustafaatalay.wordpress.com Sayfa 1
2 için karışımın toplam hacmi, bilyelerin ve pinpon toplarının hacimlerinin toplamına eşit olmaz.yandaki şekilde ayrı kaplarda bulunan 50 ml etanol ve 50 ml su, ayrı bir kapta karıştırıldığında toplam hacim 100 ml'den az olmaktadır. Bir miktar şekeri suya atıp karıştırdığımızda, şeker suda çözünür. Şekerli su adını verdiğimiz bu karışımda, fazla miktarda bulunan bileşene (suya) çözücü ya da çözen, karışımda az bulunan bileşene (şeker) çözünen adı verilir. Çözünme olayı, bir katının bir sıvıda çözünmesi ile gerçekleşebileceği gibi, katı, sıvı ya da gazların birbiri içinde çözünmesiyle de gerçekleşebilir. Örneğin, kalayın bakır içerisinde çözünmesiyle bronz, civanın gümüş içerisinde çözünmesiyle amalgam (diş dolgusu), asetik asitin su içerisinde çözünmesiyle sirke, karbondioksitin su içinde çözünmesiyle karbonatlı su(gazoz) çözeltisi elde edilir. Tablo. Çözücü ve çözünenin fiziksel hallerine göre çözelti türleri Çözeltinin Fiziksel Hali Çözelti Örneği Çözücü ve Fiziksel Hali Çözünen ve Fiziksel Hali Pirinç Bakır - Katı Çinko - Katı KATI Bronz Bakır - Katı Kalay ve kurşun karışımı - Katı Kolonya Su - Sıvı Etil alkol - Sıvı SIVI Şekerli Su Su - Sıvı Şeker - Katı GAZ Hava Azot - Gaz Oksijen - Gaz Çözeltiler oluşurken çözücü ve çözünen molekülleri bir araya gelir. Bunların molekülleri arasında oluşan itme ve çekme kuvvetleri sonucunda çözünenin tanecikleri ayrılabiliyorsa, çözünen, moleküllerine veya iyonlarına ayrılır. Çözücü molekülleri arasına çözünen taneciklerinin homojen dağılmasına çözünme denir. Şeker, alkol, üre, N 2 ve O 2 gibi maddeler suda çözündüklerinde sadece moleküllerine ayrışırlar ve iyon oluşturmazlar. Bu tür çözünmelere moleküler çözünme denir. Çözünme sonucunda suyun iletkenliğinde değişme olmaz. Asit, baz ve tuzların sudaki çözeltilerinde ise çözünen maddeler iyonlarına ayrışırlar. Bu durumda, çözelti elektriği iletebilir. Asitler, bazlar ve tuzların sudaki çözünmelerine iyonik çözünme denir. Metallerde elektriği serbest hareket edebilen elektronlar iletirken, sulu çözeltilerde elektriği iyonlar iletir. İyonik çözünmeye iyonlaşma denir. İyonlaşma ile çözünme farklıdır. Şeker suda çok iyi çözünmesine rağmen iyonlaşmaz. AgCl ise suda çok az çözünür fakat iyonlaşır. Çözünme sonunda su molekülleri arasına karışan moleküller ve iyonlar su molekülleri tarafından sarılır. Buna hidratlaşma denir. Çözünme ve erime olayları genellikle birbiriyle karıştırılır. Örneğin günlük yaşamımızda çay içinde çözünen şekeri eridi olarak tanımlayabiliyoruz. Gerçekte, şekerin suda çözünmesi söz konusudur. Aynı şekilde tuzun su ile karıştırılması durumunda, tuzun suda erimesi değil çözünmesi söz konusudur. Tuzun eriyebilmesi için ısıtılması ve erime sıcaklığı olan Mustafa Atalay mustafaatalay.wordpress.com Sayfa 2
3 801 o C'ye ulaşması gerekir. Erimede madde katı halden sıvı hale geçerken, çözünmede maddeler birbiri içerisinde homojen olarak dağılmaktadırlar. Yandaki şekilde erime ve çözünme olayları arasındaki fark görülmektedir. Sıvı Çözeltilerde Çözücü ile Çözünen Arasındaki EtkileĢim Apolar moleküller arasındaki çekim kuvvetleri yalnızca London kuvvetleridir. London kuvvetleri, çekirdek etrafındaki elektron bulutlarının herhangi bir anda simetrik olmaması durumunda ortaya çıkar. Dipol-dipol etkileşimi; su, kloroform,etil alkol gibi polar sıvılarda ve polar moleküllü katılarda görülür. Polar sıvıların birbiri içinde çözünmeleri moleküllerin bu şekilde etkileşmeleriyle ortaya çıkar. Yukarıdaki şekilde heptan ve pentan apolardır. Aralarındaki çekim kuvvetleri yalnızca London kuvvetleridir. Aseton ve klor molekülleri polar yapıya sahiptirler ve aralarında dipol-dipol etkileşimi vardır. Polar moleküller yukarıda görüldüğü gibi aynı molekül eksenli olarak birbirleriyle etkileşebildikleri gibi paralel molekül eksenli olarak da etkileşebilirler. Dipoldipol etkileşimi iyon dipol etkileşiminden daha zayıftır. Polar moleküller arsındaki dipol-dipol kuvvetleri London kuvvetlerinden daha güçlüdür. Bazı moleküller arasında ise hidrojen bağlarından dolayı moleküller arasında daha güçlü çekim kuvvetleri ortaya çıkabilir. Polar moleküllerin su ile karışma isteği çok yüksektir. Örneğin etanol su ile her oranda rahatlıkla karışabilir. Çünkü aralarında hidrojen bağları oluşturarak çözünürler. Yanda su ve etanol molekülleri arasında hidrojen bağı oluşumu gösterilmiştir. Apolar ve polar sıvı maddeler genellikle birbirleri ile karışmazlar. Polar bir maddenin kendi tanecikleri arasındaki çekim kuvvetleri, apolar maddenin tanecikleriyle oluşan çekim kuvvetlerinden çok fazladır. Bu durumda polar moleküller birbirini daha çok çekecek ve apolar moleküllerle olan çekim kuvvetlerini tercih etmeyecekleri için iki madde birbiri içerisinde çözünmeyecektir. Oluşan karışımda aynı tür tanecikler birarada durmaya çalışacakları için, yoğunluğu fazla olan madde kap içerisinde dibe inecek ve diğer sıvı üstte kalacaktır. Böylece iki ayrı bileşenli iki saf faz içeren bir sistem elde edilmiş olur. İkisi de polar, ya da ikisi de apolar olan sıvılar birbiriyle karıştırıldığında yapilarindaki uyum nedeniyle birbiri içerisinde çözüneceklerdir. Örneğin, apolar yapıya sahip iyot, apolar CCl 4 içerisinde kolayca çözünür. Katı iyotta moleküller arası çekim kuvveti, sıvı CCl 4 molekülleri arasındaki çekim kuvvetine oldukça yakındır. Bu durumda iyot molekülleri ile CCl 4 molekülleri birbiri içerisinde dağılabilecek ve çözünme gerçekleşmiş olacaktır. Genellikle polar maddeler polar çözücülerde, apolar maddeler de apolar çözücülerde çözünür. Elmastaki karbon atomları birbirine güçlü kovalent bağlarla bağlanmış düzgün dörtyüzlülerden oluşmuş kristal yapıya sahip bir maddedir. Atomlar arasındaki bağların çok güçlü olması nedeniyle elmas gibi ağ örgülü katılar hemen hemen hiçbir çözücüde çözünmezler. Mustafa Atalay mustafaatalay.wordpress.com Sayfa 3
4 Polar sıvılar, çoğu iyonik ve polar kovalent bileşikler için çözücü özelliğe sahiptir. Su iyi bir polar çözücüdür. Maddelerin su içerisinde çözünmeleri sırasında, iyonik maddelerin iyonları, polar kovalent maddelerin ise dipolleri, polar su moleküllerinin dipolleri tarafından elektrostatik olarak çekilir. Pozitif iyon veya dipolün pozitif ucu, su molekülünün negatif ucunu çekerken, negatif iyon veya dipolün negatif ucu ise su molekülünün pozitif ucu tarafından çekilir. Böylece iyonik ve polar kovalent kristalden tanecikler uzaklaşarak çözeltiye geçerler. İyon-dipol ve dipol-dipol etkileşimleri oldukça güçlü etkileşimlerdir. Mustafa Atalay mustafaatalay.wordpress.com Sayfa 4
5 NaCl kristalindeki Na + iyonu, Cl - iyonları tarafından her yöne eşit ölçüde çekilmektedir. Aynı şekilde herbir Cl - iyonu da Na + iyonu tarafından her yöne eşit kuvvetle çekilmektedir. Yüzeydeki iyonlarda ise elektrostatik çekim kuvvetleri denkliği yoktur. Su molekülleri, bu yüzey iyonlarından Na + iyonlarını eksi uçlarıyla, eksi olan Cl - iyonlarını da artı uçlarıyla çekerek katı fazdan çözeltiye taşır. Böylece iyon-dipol etkileşmesi, iyonları kristal yüzeyinden uzaklaştırarak çözeltiye geçirir. Çözünen iyonların su molekülleri ile çevrilmesi sonucunda oluşan çözünmeye hidratlaģma(hidratasyon) adı verilir. Çözeltideki tüm iyonlar hidratlaşmış haldedir. Eğer su yerine başka bir çözücü tercih edilirse, çözünmeye hidratlaşma yerine solvatasyon adı verilir. Çözünme Entalpisi Bir çözelti oluşumu sırasında çözücü ve çözünen tanecikler arasında etkileşim kuvvetleri ortaya çıkacağından enerji değişimi de kaçınılmazdır. Bir çözelti oluşumu üç basamakta gerçekleşir. 1. Çözücü moleküllerinin ayrılması 2. Çözünen moleküllerin ayrılması 3. Çözücü ve çözünen moleküllerinin karışması Birinci ve ikinci basamakta çözücü ve çözünen moleküllerinin birbirinden ayrılabilmesi için bir miktar enerji gerekir. Bu nedenle ayrılma işlemleri endotermiktir(ısı alan). Bu bölümde ayrılma için gerekli olan enerjiler ile gösterilecektir. Üçüncü basamakta çözücü ve çözünen molekülleri karışır. Bu basamak endotermik(ısı alan) veya ekzotermik(ısı veren) olabilir. Çözeltinin ısısını ile gösterirsek, çözelti ısısı bu üç basamağın ısıları toplamına eşittir. Mustafa Atalay mustafaatalay.wordpress.com Sayfa 5
6 Çözelti ısısı = + + şeklinde hesaplanır. Eğer moleküller arası çekim kuvvetleri yaklaģık aynı ise moleküller geliģigüzel karıģır. Bunun sonucunda homojen karıģımlar oluģur. Bu tip çözeltilerin özellikleri genellikle saf bileģenlerin özelliklerine bakılarak belirlenebilir. Böyle çözeltilere ideal çözelti adı verilir. Çözünme ısısı sıfır olan çözeltiler ideal çözelti olarak adlandırılırlar. Şekil. İdeal Çözeltilerde çözünme entalpisi sıfırdır. Eğer çözünen ile çözücü tanecikleri arasındaki etkileşim, çözünen ve çözücünün kendi tanecikleri arasındaki etkileşimden daha kuvvetli ise çözünme işlemi ekzotermik olarak gerçekleşir. Eğer çözünen çözücü etkileşimi, çözünen ve çözücünün tanecikleri arasındaki etkileşimden daha zayıf ise çözünme işlemi endotermik olarak gerçekleşir. Ekzotermik olaylarda değeri negatif, endotermik olaylarda ise pozitiftir. Çözelti oluşumu iki etken tarafından yürütülür. 1. Çözünme aşamalarındaki enerji değişimi 2. Çözünmedeki düzensizlik eğilimi Bütün sistemler kararlı hale gelmek için en düşük enerji seviyesinde bulunmak ve en düzensiz yapıya ulaşmak ister. Kendiliğinden gerçekleşen çözünmelerde genellikle enerji açığa çıkar. Bu tür çözünmelerde sistem enerjisini azaltır. İyonik katıların suda çözünmeleri genellikle istemlidir. Bir madde, bir çözücüde çözündüğünde ortamla ısı alışverişi olur. Bu ısıya çözünme ısısı denir. Çözeltideki ısı bazı bağların kopması, bazı kimyasal bağların ise oluşması sonucunda Mustafa Atalay mustafaatalay.wordpress.com Sayfa 6
7 değişir. CO 2 gazının şekerli su içerisinde çözünmesi sırasında CO 2 moleküllerinin enerji seviyesi azalır. Gazlar sıvılarda çözünürken genellikle ısı açığa çıkar. Başka bir deyişle gazların suda çözünmesi olayı ekzotermiktir. Gaz moleküllerini birbirinden ayırmak için fazladan enerji gerekmediğinden gaz moleküllerinin solvatasyon ısısı yeterli olmaktadır. Bunun sonucunda gazların sıvılardaki çözünürlüğü daima ısı veren olur. Bir metal tuzunun su içinde çözünmesi ısı alan ya da ısı veren şeklinde gerçekleşebilir. Çözünen maddeyi oluşturan kristalleri bir arada tutan bağ enerjisine eşit miktarda enerji, çözünme için gereklidir. İyonik kristalin iyonlardan oluşması sırasında verdiği bu enerjiye kristal enerjisi denir. İyonlar hidratlaşırken hidratasyon ısısı adını verdiğimiz enerji açığa çıkar. Hidratasyon enerjisinin büyüklüğü, iyonik kristalde iyonları ayrıştırmak için gerekli enerjiden(kristal enerjisi) daha büyükse iyonik katı suda çözünür. = - Kristal Enerjisi + Hidratasyon Enerjisi İyonik bir katının suda çözünmesi sırasındaki enerji değişimi yukarıdaki bağıntıya göre hesaplanır. Genelde iyonik kristallerin kristal enerjileri ile hidratasyon enerjileri birbirine yakın değerlerdir. Bu nedenle çözünme ısıları oldukça düşüktür. Örneğin AgF iyonik kristalinin kristal enerjisi -910 kj/mol iken hidratasyon enerjisi -930,5 kj/mol'dür. Bu durumda AgF için çözünme ısısı -20,4 kj/mol olur. KCl iyonik kristalinin kristal enerjisi -700,6 kj/mol iken hidratasyon enerjisi -683,4 kj/mol'dür. Bu durumda KCl için çözünme ısısı +17,2 kj/mol olur. Çözünme ısılarının hesaplanması işlemi yalnızca seyreltik çözeltiler için yapılır. ÇÖZELTĠLERĠN DERĠġĠMĠ Çözeltileri, içinde çözünmüş maddelerin karşılaştırılması temelinde incelediğimizde karşımıza derişik ve seyreltik çözelti tanımlamaları çıkar. Seyreltik Çözelti Bir başka çözeltiye göre az miktarda çözünen madde içeren çözeltilere seyreltik çözelti denir. Yandaki kapların her ikisinde de çözeltiler eşit miktarda çözünen madde kullanılarak hazırlanmıştır. Bu çözeltilerden sağdaki soldakine göre daha seyreltik bir çözeltidir. Derişik Çözelti Bir başka çözeltiye göre daha çok miktarda çözünmüş madde içeren çözeltilere derişik çözelti denir. Yandaki kapların her ikisinde de çözeltiler eşit miktarda çözünen madde kullanılarak hazırlanmıştır. Bu çözeltilerden soldaki sağdakine göre daha derişik bir çözeltidir. ÇÖZELTĠLERĠN DERĠġĠMĠ (KONSANTRASYON) Bir çözelti içerisinde az ya da çok miktarda madde çözünmüş olabilir. Çözeltideki çözünen madde miktarının, çözelti miktarına ya da çözücü miktarına oranına, o çözeltinin derişimi denir. Çözelti içerisinde çözünen madde miktarını, çözeltinin derişimi belirler. Derişim, verilen bir çözücüde ya da çözeltide bulunan çözünen maddenin miktarının bir ölçüsüdür. Derişimin değişik amaçlarla kullanımı söz konusu olabildiği için değişik birimlerle verilmesi mümkündür. Mustafa Atalay mustafaatalay.wordpress.com Sayfa 7
8 Seyreltik ve derişik olarak kullandığımız ifadelerle çözeltinin derişimini kabaca ifade etmiş oluruz. Ancak bu ifadeler bize çözeltideki çözücü ve çözünen madde ile ilgili kesin bilgiler vermez. Derişimin sayısal olarak belirtilmesi çeşitli şekillerde yapılır. Bilindiği gibi, çözünen madde miktarı ve çözücü miktarı mol sayısı, kütle, hacim ve eşdeğer ağırlık olarak ölçülebilir. Ölçtüğümüz birimlere bağlı olarak da derişim türü değişir. En çok kullanılan derişim birimleri; kütlece yüzde derişim, molarite, molalite ve normalitedir. Kütlece Yüzde DeriĢim Bir çözeltinin 100 gramında çözünmüş halde bulunan madde miktarının gram cinsinden değerine kütlece yüzde derişim denir. Genelde yüzde derişim kütlece verilir. Çözünen madde kütlesi Kütlece yüzde derişim = x100 Çözelti kütlesi Örnek: 75 gram suda 25 gram NaOH çözerek hazırlanan çözelti kütlece % kaç NaOH içerir? Örnek: 80 gram kütlece % 20'lik X tuzu çözeltisine, 4 gram X tuzu ve 96 gram su katılırsa, oluşan çözelti kütlece % kaç X tuzu içerir? Örnek: 250 gram kütlece % 4'lük X tuzu çözeltisine, 150 gram kütlece % 10'luk X tuzu çözeltisi katılıyor. Oluşan karışım kütlece % kaç X tuzu içerir? Örnek: 40 gram kütlece % 20'lik NaCl çözeltisine kaç gram su katılırsa kütlece % 8'lik NaCl çözeltisi elde edilir? Örnek: Yoğunluğu 1,3 g/ml olan 200 mililitre AgNO 3 çözeltisi 80 gram AgNO 3 içermektedir. Çözeltinin kütlece % 40 AgNO 3 içermesi için, çözeltiye daha kaç gram AgNO 3 katılması gerekir? Örnek: 3 mol NaOH kullanarak hazırlanan 500 mililitre çözeltinin özkütlesi 1,2 g/ml olduğuna göre, bu çözelti kütlece % kaç NaOH içerir? (NaOH=40) Hacimce Yüzde DeriĢim Sıvı sıvı çözeltiler hacim olarak ölçülebildiğinden bazı çözeltilerin derişimleri hacim yüzdesine göre hazırlanır. Bu durumda, 100 ml çözeltide bulunan çözünmüş maddenin, mililitre olarak miktarı belirtilir. Örneğin, kolonyada hacimce alkol yüzdesi,kolonyanın derecesini gösterir. 80 o 'lik kolonya denince, 100 ml kolonyada 80 ml alkol bulunuyor demektir. Bir başka derişim birimi de çözünen kütlesinin çözeltinin hacmine oranıyla verilir. Örneğin, 100 ml çözeltide 1 gram NaCl içeren çözeltinin derişimi %1'dir. Bu birim genellikle eczacılıkta kullanılır. Bir ton suya bir damla mürekkep damlatılırsa, derişimi ifade etmek için daha hassas ölçüm değerleri kullanmak gerekir. Örneğin, derişimi 1 mg/l olan bir çözeltide, 1 litre içerisinde 0,001 gram madde bulunmaktadır. Başka bir deyişle bu çözeltinin 1000 ml'sinde 0,001 gram, ml'sinde 1 gram madde bulunmaktadır. Bu derişim çok küçük bir sayısal değerdir. Bu tür derişimleri ifade etmek için büyük rakamlar yazmak yerine milyonda bir(ppm) veya milyarda bir(ppb) kısım kısaltmaları kullanılır. 1 ppm = 1 mg/l 1 ppb = 1 g/l ppm ve ppb birimleri çok hassas ölçümler yapıldığında gerekli olmaktadır. Mol Kesri Bir çözeltideki herhangi bir bileşenin mol sayısının, çözeltiyi oluşturan bütün maddelerin mol sayıları toplamına oranıdır. Karışımdaki herhangi bir maddeninn mol kesri(x) aşağıdaki gibi gösterilir. X = n, çözeltideki herhangi bir bileşenin mol sayısı, n T ise toplam mol sayısıdır. Bir karışımda bulunan maddelerin her birinin mol kesirlerinin toplamı 1'e eşittir. X T = X 1 + X X n = 1 Mustafa Atalay mustafaatalay.wordpress.com Sayfa 8
9 MOLAR DERĠġĠM (MOLARĠTE) Çözeltilerin derişimleri, çözeltinin birim hacminde çözünen maddenin mol sayısı olarak da belirtilebilir. 1 L çözeltide çözünen maddenin mol cinsinden değerine molarite adı verilir. Molarite (M) = Çözünenin mol say ısı (n) Çözeltinin hacmi(v) Molaritenin birimi mol/l'dir. mol/l birimi yerine "molar" terimi de kullanılabilir. Çözeltiler hazırlanırken, kullanılacak olan saf maddeler alınır ve istenilen derişim ve hacimde çözelti hazırlanır. Örnek: Yukarıdaki şekilde 0,01 M 250 ml KMnO 4 çözeltisinin hazırlanması basamakları gösterilmiştir. 0,395 gram KMnO 4 tartılarak 250 mililitrelik balon kaba konulur. Üzerine bir miktar(yaklaşık 240 ml) su ilave edilir ve tuzun iyice çözünmesinin sağlanması için karışım karıştırılarak sallanır. Son aşamada çözelti hacmini 250 ml'ye tamamlayacak şekilde su ilave edilir. Böylece istenilen hacim ve derişimde çözelti hazırlanmış olur. Örnek: Aşağıdaki çözeltilerin molar derişimlerini hesaplayınız. a) 21,2 gram Na 2CO 3 kullanılarak hazırlanan 500 mililitre çözelti. (Na 2CO 3=106) b) 0,5 mol NaOH ile hazırlanan 2 litre çözelti. c) NK'da 8,96 litre hacim kaplayan NH 3 ile hazırlanan 400 mililitre çözelti. d) 2,408x10 23 tane NH 3 molekülüyle hazırlanan 500 mililitre çözelti. Örnek: 8 gram NaOH'in suda çözünmesiyle oluşan 250 mililitre çözeltinin molar derişimi kaçtır? (NaOH=40 g/mol) Örnek: 0,5 molar 400 ml Ca(OH) 2 çözeltisinde kaç gram Ca(OH) 2 çözünmüştür? (Ca(OH) 2 = 74 g/mol) Örnek: 0,8 molarlık KOH çözeltisi hazırlamak için 11,2 gram KOH kullanıldığına göre çözeltinin hacmi kaç mililitredir? (KOH = 56) Örnek: 27 o C sıcaklıkta ve 2 atmosfer basınçta 12,3 litre hacim kaplayan HCl gazı ile 500 mililitrelik çözelti hazırlanıyor. Çözeltinin molar derişimi nedir? Örnek: 14 gram azot ve yeterince hidrojen kullanılarak gerçekleştirilen tepkime sonucunda elde edilen NH 3 gazı ile 2 litre çözelti hazırlanıyor. Hazırlanan çözeltinin molar derişimi kaçtır? (N=14, H=1) Örnek: 53,2 gram X 2SO 4 ile 400 ml çözelti hazırlanıyor. Çözeltideki X 2SO 4'ün molar derişimi 0,5 olduğuna göre, X elementinin atom kütlesi nedir? ( O=16, S=32) Madde miktarlarının doğrudan mol olarak ölçülemediği durumlarda, mol sayısını başka miktarlarla ilişkilendirmek gerekir. Kütlesi ve hacmi bilinen bir çözeltinin yoğunluğu bulunabilir. Çözücü ve çözünen madde miktarları bilinemez. Mustafa Atalay mustafaatalay.wordpress.com Sayfa 9
10 Bir çözeltinin yoğunluğu, çözeltinin kütlesi ve hacmi bilinmeden de bulunabilir. Bunun için çözeltinin molar derişimi, kütlece yüzdesi ve çözünen maddenin mol kütlesi bilinmelidir. Aşağıdaki örneklerde bu durumla ilgili çalışmalar vardır. Örnek: Kütlece % 20 NaOH içeren çözeltinin özkütlesi 1,2 g/ml'dir. Bu çözeltinin 60 gramına 100 ml su katıldığında, son çözeltideki NaOH derişimi kaç M olur? (NaO = 40) A) 2,0 B) 1,5 C) 1,0 D) 0,6 E) 0,3 Örnek: Kütlece % 21 HNO 3 içeren çözeltinin özkütlesi 1,2 g/ml'dir. Bu çözeltinin 250 mililitresinde kaç mol HNO 3 bulunur? ( HNO 3 =63) A) 0,2 B) 0,4 C) 0,5 D) 0,8 E) 1,0 Örnek: Derişik HCl çözeltisinin yoğunluğu 1,2 g/ml ve kütlece % 36,5 HCl içerdiğine göre, 50 ml çözeltide kaç mol HCl bulunur? (H=1, Cl=35,5) A) 0,6 B) 1,2 C) 3 D) 4,2 E) 6 Örnek: Derişik nitrik asit ( HNO 3 ) çözeltisinin yoğunluğu 1,4 g/ml'dir. Çözeltideki HNO 3 'ün kütlece yüzdesi 72'dir. Çözeltinin molar derişimi kaçtır? (HNO 3=63) A) 12 B) 14 C) 16 D) 18 E) 19 MOLALĠTE(m) Molalite, birim kilogram(kg) çözücü içerisinde çözünen maddenin mol cinsinden değeridir. Çözünen maddenin mol sayısının, çözücünün kg cinsinden kütlesine bölünmesiyle elde edilir. Molalite = Yandaki şekilde potasyum kloratın 0,1 M'lık(solda) ve 0,1 m'lik(sağda) iki çözeltisi hazırlanmıştır. Her iki çözeltide de 0,1 mol(19,4 g) potasyum klorat kullanılmıştır. Birinci çözelti hazırlanırken potasyum klorat önce az miktar su ile karıştırılarak çalkalanmış, daha sonra çözelti hacmi 1 litreye tamamlanacak şekilde su eklenmiştir. İkinci çözelti hazırlanırken, yine aynı miktar potasyum klorat su ile çalkalanarak karıştırılmış ve sonrasında su miktarı 1000 grama tamamlanmıştır. Bu nedenle iki çözeltiye dikkatle bakıldığında, 0,1 m'lik çözelti hacminin daha fazla olduğu görülecektir. Bunun nedeni kullanılan su hacminin, 0,1 M'lik çözeltidekinden daha fazla olmasıdır. Molalite ve molarite değerleri hesaplanırken, bu ayrıma dikkat edilmelidir. Molaritede, çözelti hacmi ile işlem yapılırken, molalitede çözücü kütlesi ile işlem yapılması gerekmektedir. Örnek: 400 gram suda 9,8 gram H 2SO 4 içeren çözeltinin molalitesini hesaplayınız.(h 2SO 4 = 98 g/mol) Örnek: 0,15 m NaCl çözeltisi hazırlamak için 500 gram su içerisinde kaç gram NaCl çözünmesi gerekir? (NaCl = 58,5 g/mol) Örnek: 34 gram Na 2SO 4 tuzunun 250 gram suda çözünmesiyle hazırlanan çözeltinin a) molalitesini hesaplayınız.(na 2SO 4 = 136 g/mol) b) Çözeltinin molaritesinin molalitesinden büyük mü küçük mü olduğunu tartışınız. Örnek: 0,8 m Demir(III) nitrat çözeltisinden a) 0,2 mol demir(iii) nitrat elde edebilmek için, çözeltiden kaç gram alınmalıdır?(demir(iii) nitrat = 242 g/mol) Mustafa Atalay mustafaatalay.wordpress.com Sayfa 10
11 b) 0,05 mol Fe 3+ iyonu elde edebilmek için, çözeltiden kaç gram alınmalıdır? c) 0,09 mol iyonu edebilmek için, çözeltiden kaç gram alınmalıdır? Örnek: Su, içerisinde çözünen bir madde varsa daha düşük sıcaklıkta donar. Metanolün(CH 3OH) suyun donma noktasına etkisini incelemek için metanol kullanılarak 0,05 molallik ve 0,25 molallik iki ayrı çözelti hazırlanıyor. Her iki çözelti için kullanılan su kütleleri 200'er gram olduğuna göre, çözeltilerde kaçar gram metanol kullanılmıştır?( CH 3OH = 32 g/mol) Örnek: Şekildeki iki kapta aynı çözeltinin farklı sıcaklıklardaki örnekleri verilmiştir. a) Çözeltilerin molar derişimlerini karşılaştırınız. b) Çözeltilerin molalitelerini karşılaştırınız. Seyreltme Çözelti içerisine çözücü eklendiğinde (seyreltme) ya da çözücü buharlaştırıldığında (derişik hale getirme) çözünmüş maddenin mol sayısı değişmez. Bu durumda, çözünen maddenin başlangıçtaki ve sonuçtaki mol sayısı aynı olur. Çözelti seyreltilirken çözeltinin hacmi artar. Başlangıçta çözelti içerisinde bulunan çözünen mol sayısı seyreltme sonucunda daha büyük bir hacme bölünür. Böylece molar derişim azaltılmış olur. Çözeltilere çözücü eklenmesi, ya da çözücü buharlaştırılması ile ilgili hesaplamalarda aşağıdaki eşitlikler esas alınır. Seyreltmeden önceki mol sayısı n 1 = M 1 x V 1 Seyreltmeden sonraki mol sayısı n 2 = M 2 x V 2 Her iki durumda da çözünen maddenin mol sayısı aynı olduğuna göre, n 1 = n 2 M 1 x V 1 = M 2 x V 2 bağıntısı yazılır. Çözeltiye çözücü eklenmesi molar deriģimi düģürür. Çözücü buharlaģtırılırsa çözeltinin molar deriģimi artar. Örnek: 1,2 M NaCl çözeltisinin 400 mililitresine 100 mililitre su ekleniyor. Oluşan çözeltinin molar derişimi kaçtır? Örnek: 800 mililitre, 0,5 M NaOH çözeltisinin 600 mililitresi buharlaştırıldığında, oluşan çözeltinin molar derişimi kaç olur? Örnek: 400 mililitre 0,8 M HNO 3 çözeltisine kaç mililitre su eklenirse, HNO 3 molar derişimi 0,32 olur? Örnek: Özkütlesi 1,2 g/ml olan derişik NH 3 çözeltisinin 20 mililitresi 400 mililitreye seyreltiliyor. Son çözeltide NH 3 molaritesi 0,3 oluyor. Buna göre derişik NH 3 çözeltisi kütlece % kaçlıktır? (NH 3=17) Çözeltilerin KarıĢtırılması Aynı tür çözünen ve çözücü içeren iki ayrı çözeltinin birbirine karıştırılması durumunda, karışımdaki çözünen maddenin toplam mol sayısı, her iki çözeltiden gelen çözünen maddelerin mol sayıları toplamına eşittir. Birinci çözeltide çözünen maddenin mol sayısı n 1 = M 1 x V 1 İkinci çözeltide çözünen maddenin mol sayısı n 2 = M 2 x V 2 n T = n 1 + n 2 olduğuna göre, Mustafa Atalay mustafaatalay.wordpress.com Sayfa 11
12 M s x V s = M 1 x V 1 + M 2 x V 2 bağıntısı yazılır. Örnek: 200 mililitre 0,4 M NaOH çözeltisiyle, 800 mililitre 0,8 M NaOH çözeltisi karıştırılıyor. Karışımdaki NaOH molar derişimi kaçtır? Örnek: 200 mililitre 0,5 M NaOH çözeltisi içerisinde 8 gram daha katı NaOH çözülüyor. Çözeltiye su eklenerek hacim 1200 mililitreye tamamlanıyor. Son çözeltideki NaOH molar derişimi nedir? (NaOH=40) Örnek: 2 litre 0,4 M HCl çözeltisi hazırlamak için, 0,5 M ve 0,1 M HCl çözeltileri karıştırılıyor. Bu çözeltilerden kaçar mililitre kullanılmıştır? Örnek: 0,5 M 400 mililitre NaOH çözeltisine, başka bir NaOH çözeltisinin 600 mililitresi ilave edildiğinde, son çözeltinin molar derişimi 0,8 oluyor. 600 mililitrelik çözeltinin molar derişimi kaçtır? ĠYONLARIN MOLAR DERĠġĠMĠ Bir katı madde suda çözündüğünde, iyonlarına ayrışabiliyorsa, çözeltideki iyonlarında molar derişimleri hesaplanabilir. İyonlar çözeltinin her tarafına homojen dağılacakları için dolaşabildikleri hacim, çözeltinin hacmi olacaktır. Buna göre, çözelti içerisindeki iyonun mol sayısının çözelti hacmine bölünmesiyle, iyonun molar derişimi bulunacaktır. İyonların molar derişimleri belirtilirken, iyon köşeli parantez içerisinde gösterilir. Örnek: 100 mililitre 0,4 molar NaCl çözeltisi ve 400 mililitre 0,2 M FeCl 3 çözeltisi karıştırılıyor. Karışımdaki toplam molar derişimi kaçtır? Örnek: 0,2 M NaCl, 0,5 M BaCl 2 ve 0,08 M FeCl 3 çözeltilerinin eşit hacimleri karıştırılıyor. Karışımdaki toplam Örnek: molar derişimi kaçtır? Cl derişimi 0,4 mol/lt olan 500 mililitre CaCl 2 çözeltisi kaç gram CaCl 2 içerir? (CaCl 2 = 111) Örnek: 0,4 M 500 mililitre Al(NO 3) 3 çözeltisi 800 mililitreye seyreltilirse, oluşan çözeltide Örnek: 5,3 gram X 2CO 3 ile 500 mililitre çözelti hazırlanıyor. Çözeltideki X + elementinin atom kütlesi kaçtır? (C=12, O=16) Cl Cl NO 3 molar derişimi kaç olur? molar derişimi 0,2 olduğuna göre, X Örnek: 300 mililitre 0,2 M MgCl 2 çözeltisi ile NaCl çözeltisinin 200 mililitresi karıştırılıyor. Karışımdaki Cl - molar derişimi 0,44 olduğuna göre NaCl çözeltisinin başlangıçtaki molar derişimi kaçtır? Örnek: Sertlik derecesi 1 olan suyun litresinde 10 miligram CaCO 3 bulunmaktadır. Buna göre, sertlik derecesi 15 olan suda Ca +2 molar derişimi kaç olur? (CaCO 3=100) ĠYON DENKLEMLERĠ VE ELEKTRĠK ĠLETKENLĠĞĠ Çözeltileri kendi içerisinde elektrolit çözeltiler ve elektrolit olmayan çözeltiler olarak sınıflamıştık. Elektrolit olan çözeltilerde, çözünen maddenin iyonları aracılığıyla elektrik akımı iletilir.kristal halinde zaten var olan iyonlar, çözelti oluştuğunda, çözelti içinde dağılırlar ve iyonlaşmış olurlar. Örneğin, NaCl iyonik bileşiği Na + ve Cl - iyonlarından oluşmuştur. Kristal içinde bulunan iyonlar su içerisinde kolayca dağılır ve çözelti içinde serbestçe hareket edebilir. NaCl(k) Su Na + (suda) + Cl - (suda) Bütün iyonik bileşikler NaCl iyonik katısı gibi suda çok çözünmez. AgCl iyonik katısı suda çok az çözünebilen iyonik bir katıdır. Ancak, AgCl'nin suda çözünen kısmı yinede iyonlarına ayrışır. Mustafa Atalay mustafaatalay.wordpress.com Sayfa 12
13 AgCl(k) Su Ag + (suda) + Cl - (suda) Eşit derişimli ve hacimli AgNO 3 ve NaCl çözeltileri karıştırıldığında, az çözünen bileşik olan AgCl katısı oluşur. Tepkimenin iyon denklemi aşağıdaki gibidir. Ag + (suda) + NO 3 (suda) + Na + (suda) + Cl - (suda) Su AgCl(k) + Na + (suda) + NO 3 (suda) Tepkimede AgCl çöktüğünden, tepkimenin net iyon denklemi aşağıdaki gibi olur. Ag + (suda) + Cl - (suda) Su AgCl(k) Suda çok az çözünebilen ve büyük kısmı çöken maddelerle ilgili sorular çözülürken, bu tür maddelerin suda çözünmediği varsayılacaktır. Örnek: 400 mililitre 0,2 M FeCl 3 çözeltisi ile 100 mililitre NaOH çözeltisi karıştırılıyor. Karışımdaki tüm Fe +3 iyonları çökeldikten sonra OH - molaritesi 0,12 oluyor. Buna göre başlangıçtaki, NaOH molaritesi kaçtır? Örnek: 9,68 gram X(NO 3) 3 bileşiği ile hazırlanan 200 mililitre çözelti, 300 mililitre 0,4 M NaOH çözeltisi ile karıştırılıyor. Karışımdaki X +3 ve OH - iyonlarının tümü çöktüğüne göre X'in atom kütlesi kaçtır? (N=14, O=16) Örnek: Molar derişimi 0,2 olan AlCl 3 çözeltisinin 400 mililitresindeki Cl - iyonlarının tümünü çöktürmek için, molar derişimi 1,2 olan AgNO 3 çözeltisinden kaç mililitre kullanmak gerekir? Örnek: 0,2 M 100 mililitre XCl n çözeltisi ile 0,3 M 200 mililitre AgNO 3 çözeltisi karıştırıldığında, tüm Ag + ve Cl - iyonları AgCl şeklinde çöküyor. Buna göre XCl n formülündeki n kaçtır? Örnek: 1 molar 500 mililitre NaOH çözeltisi ile 300 mililitre Mg(NO 3) 2 çözeltisi karıştırılıyor. Mg(OH) 2 bileşiğinin suda çözünmediği varsayılıyor. Karışımdaki OH - molaritesi 0,1 olduğuna göre, başlangıçtaki Mg(NO 3) 2 çözeltisi kaç molarlıktır? Örnek: 200 mililitre 0,2 M CuSO 4 çözeltisi ile 300 mililitre 0,4 M NaOH çözeltisi karıştırıldığında, kaç gram Cu(OH) 2 çöker? (Cu(OH) 2=98) Örnek: 700 mililitre 0,5 M Na 2CO 3 çözeltisi ile 300 mililitre 0,4 M HCl tepkimeye sokuluyor. Na 2CO HCl 2 NaCl + H 2O + CO 2 Buna göre, tepkime sonucunda oluşan CO 2'in NK'da hacmi kaç litredir? Örnek: 600 mililitre 0,2 M AgNO 3 çözeltisi ile 400 mililitre K 2CrO 4 çözeltisi karıştırılıyor. İşlem sonucunda Ag 2CrO 4 çökeltisi oluşuyor. Son karışımdaki Ag + molar derişimi 0,02 olduğuna göre, başlangıçtaki K 2CrO 4 molar derişimi kaçtır? Örnek: X elementinin klorla oluşturduğu bileşiğin 0,6 molü kullanılarak 300 mililitre çözelti hazırlanıyor. Bu çözeltinin 100 mililitresindeki klor iyonlarının tümünü çöktürmek için, 0,1M 200 mililitre AgNO 3 çözeltisi kullanılıyor. Buna göre, X elementi ile klorun oluşturduğu bileşiğin formülü nedir? Örnek: I. KCl çözeltisi ile Ba(NO 3) 2 çözeltisi karıştırılıyor. Karıştırma işleminin sonucunda bir çökelme olmuyor. II. Ba(NO 3) 2 çözeltisi ile K 2CrO 4 çözeltisi karıştırılıyor ve karışımda bir çökelme görülüyor. III. AgNO 3 çözeltisi ile KCl çözeltisi karıştırılıyor ve karışımda bir çökelme gözleniyor. Buna göre, yukarıdaki karışımlarda çöken maddelerin formülleri nedir? Örnek: X 2O HCl 2 XCl H 2O tepkimesine göre 8 gram X 2O 3 ile 600 mililitre 0,5 M HCl çözeltisi tam olarak birleşiyor. Buna göre, X elementinin atom kütlesi kaçtır? (O=16) Mustafa Atalay mustafaatalay.wordpress.com Sayfa 13
14 Çözünürlük ve Çözünme Hızı Bir çözelti elde edilebilmesi için çözücü ve çözünenin biraraya gelmesi ve çözünmenin gerçekleşmesi gerekir. Çözeltileri, içerisinde çözünmüş madde miktarı bakımından doymuş, doymamış ve aşırı doymuş çözeltiler olarak sınıflayabiliriz. Çözünen madde çözücü ile karıştırıldığında önce çözünme gerçekleşir. Bir süre sonra çökelme başlar. Çözünme hızı ile çökelme hızı eşit olduğunda çözünen maddenin çözelti içerisindeki derişimi sürekli aynı olur. İçinde bir miktar katı madde kalan çözelti doymuş olur. Aşağıdaki şekilde 1. bardaktaki çözeltide dipte azda olsa katı madde kaldığı için çözeltimiz doymuştur. İkinci bardakta ise çözelti içerisinde katı madde çözünmeye devam ettiği için çözelti henüz doymamıştır. Çeşitli katı maddelerinin çözünürlüklerinin sıcaklıkla değişim grafiği aşağıdaki gibidir. Çeşitli sıcaklıklarda maddelerin çözünürlüklerine bakıldığında çözünme miktarlarının genellikle farklı olduğu görülmektedir. Belirli bir sıcaklık derecesinde,belirli miktar çözücüde çözünebilen maksimum madde derişimine çözünürlük denir. Çözünürlük,ayırt edici ve çözücünün ve çözünenin miktarına bağlı olmayan bir özelliktir. Aşağıda verilen grafikte maddelerin çözünürlüğünü gösteren eğrilerin geçtiği noktalarda çözelti doygundur. Mustafa Atalay mustafaatalay.wordpress.com Sayfa 14
15 Grafik. Çeşitli katı maddelerin çözünürlüklerinin sıcaklıkla değişimi Çözeltiler, çözünen madde miktarına göre üç farklı gruba ayrılabilir. 1. Doymuş Çözelti Derişik çözeltilerde çözünebilecek olan maddenin bir üst sınırı vardır. Örneğin,100 ml su içerisine fazlaca şeker atılırsa, şekerin bir kısmı çözünmeden kalacaktır. Bu durumda çözünebilen şeker ve suyun oluşturduğu çözeltiye doymuş çözelti denir. Belirli bir sıcaklık ve basınçta, çözücünün çözebileceği kadar madde içeren doymuş bir çözeltiye daha fazla çözünen eklendiğinde,eklenen madde çözünmeden kalır. Örneğin, 25 o C sıcaklıkta 100 ml suda 36 gram tuzun çözünmesiyle oluşan doymuş çözeltiye daha fazla tuz eklendiğinde,eklenen tuz çözünmez ve tuzlu suyun dibinde birikir. Doymuş bir çözeltiye sabit sıcaklıkta, çözünen madde eklenmesi durumunda, eklenen madde çözünmeden kalır. Doymuş çözeltiler kararlıdır ve koşullar değişmedikçe çözeltide çökme ya da çözünme olayları gözlenmez. Grafik. Çözelti Çeşitleri. 2. Doymamış Çözelti Bir çözeltide doygunluk miktarının altında çözünmüş madde varsa,bu çözeltiye doymamış çözelti denir.doymamış bir çözeltiye daha fazla çözünen madde eklenirse, çözündüğü görülür. Başka bir deyişle, doymamış bir çözelti doygunluk noktasına gelene kadar çözünen maddeyi çözebilir. 3. Aşırı Doymuş Çözelti Bir çözeltide doygunluk miktarının üstünde madde çözünmüş ise, yani çözelti çözebileceğinden daha çok çözünen madde içeriyorsa, böyle çözeltilere de aşırı doymuş çözelti adı verilir. Aşırı doymuş olarak hazırlanan çözeltiler kararsızdır. Yüksek bir sıcaklıkta hazırlanmış olan doymuş çözelti, soğumaya bırakıldığında bazen çökme olmayabilir. Bu çözelti daha düşük sıcaklıkta içermesi gereken maddeden fazlasını yapısında barındırmış olur. Başka bir deyişle, bu çözelti düşük sıcaklıkta aşırı madde içerir. Bu çözeltiye küçük bir parça çözünen kristali eklendiğinde, çok hızlı bir çökme gerçekleşir. Aşırı madde dibe çöker ve çözelti barındırması gereken miktarla doymuş hale gelir. Evde hazırlanmış olan reçellerde aşırı doymuşluğa rastlanabilir. Reçelin şekerlenmesi onun hazırlanması sırasında aşırı doymuş olduğunu gösterir. Aşırı doymuş çözeltiler, zamanla aşırı miktarın çökmesiyle kararlı hale gelirler yani doymuş olurlar. Mustafa Atalay mustafaatalay.wordpress.com Sayfa 15
16 Şekil.(a)Aşırı doymuş sodyum asetat(ch 3COONa) sulu çözeltisi.(b) Aşırı doymuş çözeltiye ufak bir parça sodyum asetat kristali eklenirse aşırı çözünmüş kısım hemen kristalleşir. Sıvılar da katılar gibi başka sıvılar içinde çözünebilir. Örneğin, etil alkolle su birbiri içerisinde her oranda karışarak çözünebilirler. Etil alkol, gliserin, sirke gibi sıvılar suda her oranda çözünebilirken, benzaldehit suda çok az çözünür. Bu nedenle, çözünürlük sıvılar içinde ayırt edici özellik olarak kullanılır. Hava, gazlardan oluşan bir karışımdır. Havayı oluşturan gazlar gibi bütün gazlar birbiriyle her oranda karışır. Gazlar da, katılar ve sıvılar gibi suda çözünebilirler. Gazların sudaki çözünürlükleri oldukça azdır. Örneğin, oksijen gazı ya da karbondioksit gazı suda çok az çözünen gazlardır. Gazların küçük bir kısmının sudaki çözünürlüğü ise fazladır. Örneğin,amonyak ( NH 3 ) gazı suda çok çözünür. Gazlarda da çözünürlük ayırt edici özellik olarak kullanılır. Çözünürlüğü Etkileyen Etmenler Sıcaklık, basınç, çözücü ve çözünenin türü gibi faktörler çözünürlüğü etkiler. 1. Sıcaklık Sıcaklık çözünürlüğü önemli ölçüde etkiler. Çözünme ısı alan(endotermik) ise, sıcaklığın yükseltilmesi çözünürlüğü artırır. Isı veren ise, sıcaklığın yükseltilmesi çözünürlüğü azaltır. Katıların çözünmesi genellikle ısı alan olduğundan, sıcaklık artışı katıların çözünürlüğünü artırır. Bazı katı maddelerin, sıcaklık artışıyla çözünürlükleri azalır. Örneğin, sodyum sülfatın çözünürlüğü sıcaklık arttıkça azalır(bakınız katıların çözünürlük grafiği). Gazların suda çözünmeleri sırasında ise ısı açığa çıkar. Bu nedenle gazların çözünürlüğü sıcaklık arttıkça azalır. Mustafa Atalay mustafaatalay.wordpress.com Sayfa 16
17 Grafik. Çeşitli gazların çözünürlüklerinin sıcaklıkla değişimi 2. Çözücü ve Çözünenin Türü Çözücü ve çözünen maddelerin molekül yapıları, polarlıkları bakımından ne kadar çok benzer yapıdalarsa, çözünme o kadar iyi olur. Polar çözücüler polar maddeleri, apolar çözücülerde apolar maddeleri iyi çözer. Su içerisinde yemek tuzu, şeker ve etil alkol gibi maddeler iyi çözünür. Naftalin, zeytinyağı gibi maddeler ise suda hemen hemen hiç çözünmez. Oysa organik çözücülerde (benzin, aseton), etil alkol çok az çözünürken, benzaldehit çok iyi çözünür. 3. Basınç Katı ve sıvılar sıkıştırılamadığından basınçla çözünürlükleri değişmez. Ancak gazlar sıkıştırılabilme özelliğine sahip olduklarından, uygulanan basınçla orantılı olarak çözünürlükleri değişir. Basınç artırılırsa çözünürlük artar ya da basınç düşürülürse çözünürlük azalır. Denge Durumu Basınç artırılıyor Yeni denge oluşuyor Şekil.Gazların çözünürlüğünün basınçla değişimi Kanımızda çözünmüş halde hava bulunur. Deniz dibine doğru dalan bir kimsenin uzun süre su altında kalması durumunda, basınç artması nedeniyle, daha çok hava çözünür. Böylece, havanın bileşiminde yer alan azot gazı da fazla çözünmüş olur. Deniz dibinden hızla yukarı çıkan dalgıcın kanındaki azot, basınç azalacağından hızla gaz haline geçer ve plazmadan ayrılır. Oluşan gaz kabarcıkları kanın damarlarda dolaşımını engeller. Kanın gidemediği dokular beslenemez ve hasar görürler. Oluşan bu hasara vurgun denir. Mustafa Atalay mustafaatalay.wordpress.com Sayfa 17
18 Grafik. Gazların çözünürlüğünün basınçla değişimi. Çözünme Hızı Çözünme hızı, birim zamanda belirli miktardaki çözücüde çözünen madde miktarıdır. Çözünürlüğü, çözünme hızı ile karıştırmamak gerekir. Çözünme hızını etkileyen etmenler 1. Çözücü ve çözünen türü 2. Sıcaklık 3. Çözücü ve çözünenin değme yüzeylerinin büyüklüğü 4. Çözücü ile çözüneni karıştırmak Çözünme hızını etkileyen etmenlerden karıştırmak ve yüzey büyüklüğü çözünürlüğü etkilemez. Fakat, çözücü ve çözünen türü ile sıcaklık hem çözünme hızını hem de çözünürlüğü etkiler. Çözeltilerin Elektrik Ġletkenlikleri Çözeltileri elektrik iletkenliklerine göre de gruplandırabiliriz. Elektrik akımını iletebilen çözeltilere elektrolit çözeltiler denir. İyonik yapılı bileşiklerin(tuzlar) çözeltileri, asit ve baz çözeltileri iletkendir. Bu maddeler suda iyonlar halinde çözünürler ve çözelti içerisindeki hareketleriyle elektrik akımını iletirler. Örneğin, yemek tuzu suda iyonlarına ayrışarak çözünür ve elektrik akımını iletir. Çeşme suyu da elektriği iletebilir. Şeker, alkol, üre, N 2, O 2 gibi maddeler suda çözündüklerinde, sadece moleküllerine ayrışırlar ve iyon oluşturmazlar. Bu tür moleküler çözünmeler sonucunda oluşan çözeltiler, iyon içermedikleri için elektriği iletmezler. Bu tür çözeltilere elektrolit olmayan çözeltiler denir. Şekil. Çeşitli çözeltilerin elektrik iletkenliği. Moleküler çözünmüş olan sükroz çözeltisi elektriği iletmezken, iyonlaşmanın gerçekleştiği çözeltiler, iyon derişimlerine bağlı olarak elektriği az ya da çok iletirler. Çözeltiler içerdikleri H + iyonu derişimine göre asidik, bazik, ve nötr çözeltiler olarak gruplandırılabilir. Asit, Baz ve Tuz çözeltileri elektrolit çözeltilerdir. Mustafa Atalay mustafaatalay.wordpress.com Sayfa 18
19 Çözünürlük ile ilgili örnekler Çözünürlük (g/100 cm 3su) Sıcaklık ( C) o Bir X katı maddesinin çözünürlüğünün sıcaklığa bağlı değişimi yukarıdaki gibidir. 1'den 7'ye kadar olan soruları yukarıda grafiğe göre yanıtlayınız.(d su = 1 g/cm 3 ) o C sıcaklıkta 400 gram su içerisinde en çok kaç gram X katısı çözünebilir? A) 128 B) 256 C) 320 D) 512 E) gram X in 200 gram su içerisinde çözün-mesiyle doymuş çözelti oluşuyor. Çözeltinin hazırlandığı sıcaklık kaç o C dir? A) 30 B) 40 C) 50 D) 60 E) o C de hazırlanmış 400 gram doymuş X çö-zeltisinin sıcaklığı 60 o C ye çıkarılıyor. 60 o C sıcaklıkta çözeltinin tekrar doyabilmesi için kaç gram daha X eklenmesi gerekir? A) 50 B) 60 C) 80 D) 120 E) o C deki doymuş X çözeltisi kütlece yüzde kaçlık olur? A) 20 B) 40 C) 50 D) 80 E) o C sıcaklıkta 200 gram su ile hazırlanmış doymuş X çözeltisinin sıcaklığı 60 o C ye düşü-rülürse kaç gram X çökelmiş olur? A) 20 B) 40 C) 60 D) 80 E) o C de 400 gram su ile hazırlanan doymuş X çözeltisinin sıcaklığı 30 o C ye düşürülüyor. Çökelen maddenin olmaması için 30 o C sıcak-lıkta çözeltiye kaç gram su eklenmelidir? A) 600 B) 500 C) 400 D) 320 E) o C'de 30 gram X kullanılarak elde edilecek çözelti kaç gram olur? A) 35 B) 40 C) 50 D) 55 E) 65 Mustafa Atalay mustafaatalay.wordpress.com Sayfa 19
20 Çözünürlük (gr X / 100ml su) t ( o C) X katısının sudaki çözünürlüğünün sıcaklıkla değişimi grafikte görülmektedir. Aşağıdaki 8-17 arasındaki soruları bu grafiğe göre yanıtlayınız.(d su= 1 g/ml) ml su kullanılarak 66 o C de X in doygun çözeltisi hazırlanıyor. Çözelti kaç gramdır? A) 210 B) 225 C) 240 D) 250 E) litre su kullanılarak 50 o C de X in doygun çözeltisi hazırlanıyor. Sıcaklık 66 o C ye yükseltildiğinde doygun çözelti oluşması için, çözücünün yüzde kaçı buharlaştırılmalıdır? A) 20 B) 40 C) 50 D) 60 E) X in 66 o C de doygun çözeltisinin derişimi kütlece yüzde kaçtır? A) 10 B) 15 C) 20 D) 25 E) ml su kullanılarak X in 70 o C de doygun çözeltisi hazırlanıyor. Sıcaklık 40 o C ye düşürülüyor. Kaç gr X çöker? A) 20 B) 30 C) 40 D) 60 E) soruda X in çökmemesi için kaç ml su eklenmelidir? A) 200 B) 400 C) 500 D) 1000 E) gr X kullanılarak 200 gram çözelti hazırlanıyor. Çözelti kaç o C de doygun hale gelir? A) 40 B) 50 C) 60 D) 66 E) gr X, 200 ml kaynar suda çözülüyor ve soğumaya bırakılıyor. X in çökmeye başlaması için sıcaklık kaç o C nin altına düşmelidir? A) 40 B) 50 C) 60 D) 66 E) ml suda 75 gr X çözülebilmesi için sıcaklık en az kaç o C olmalıdır? A) 40 B) 50 C) 60 D) 66 E) Hangi sıcaklıkta X in doygun çözeltisinin derişimi kütlece % 20 tir? A) 60 o C B) 66 o C C) 70 o C D) 73 o C E) 80 o C 17. Eşit miktarlarda su kullanılarak X in 40 o C ve 70 o C de doygun çözeltileri hazırlanıyor. İki çözelti karıştırılıyor. X in çökmemesi için, sıcaklık en az kaç o C olmalıdır? A) 50 B) 55 C) 60 D) 65 E) 70 Mustafa Atalay mustafaatalay.wordpress.com Sayfa 20
21 Çözünürlük (g.x / 100 g su) (Sıcaklık o C) X katısının çözünürlüğünün sıcaklıkla değişimi şekildeki gibidir soruları grafikteki bilgilere göre yanıtlayınız. (d su= 1 g/ml) o C de 400 gram su ile hazırlanan X çözeltisi kaç gramdır? A) 320 B) 520 C) 600 D) 720 E) o C de 100 gram su ile hazırlanan doymuş X çözeltisi 20 o C ye kadar soğutuluyor. Kaç gram X çöker? A) 20 B) 40 C) 60 D) 80 E) 100 ÇÖZELTĠLERĠN DERĠġĠME BAĞLI(KOLLĠGATĠF) ÖZELLĠKLERĠ Çözünen taneciklerin derişimlerine bağlı olan özelliklere kolligatif özellikler adı verilir. Bu bölümde incelenecek kolligatif özellikler, çözücünün buhar basıncının düşmesi, kaynama sıcaklığının yükselmesi, donma noktasının alçalması ve bir zardan farklı çözelti içine geçme eğilimidir. Buhar Basıncının DüĢmesi Bir sıvıda uçucu olmayan bir katı bir madde ya da uçucu olan bir sıvı çözündüğünde sıvının buhar basıncı düşer. Buhar basıncının düşmesi buharlaşmanın daha az olduğu anlamına gelir. Tuz gibi suda çözünen bir maddenin çözelti içerisindeki miktarı arttıkça suyun buharlaşması ve buhar basıncı düşer. Çözünen maddenin mol kesri arttıkça buhar basıncında daha büyük düşme gerçekleşir. Çözeltilerin buhar basınçları, saf sıvıların buhar basıncından farklıdır. Çözünen derişimi ile çözeltinin buhar basıncı arasındaki ilişki Fransız Kimyacı F. M. Rault tarafından bulunmuştur. Buna göre uçucu bileşeni bulunmayan bir çözeltideki buhar basıncı düşmesi, çözeltideki çözünen maddenin mol kesriyle doğru orantılıdır. Suyun çözücü tuzun çözünen olduğu bir çözeltide, çözeltinin buhar basıncını suyun mol kesri belirler. Mustafa Atalay mustafaatalay.wordpress.com Sayfa 21
22 Şekil. Uçucu olmayan bir çözünenin çözücüye eklenmesi durumunda oluşan buhar molekülleri sayısında bir azalma olduğu için basınç düşer. Herhangi bir çözeltinin buhar basıncı(p T), çözeltiyi oluşturan bileşenlerinin buhar basınçlarının toplamına eşittir. P T = P 1 + P P n Çözüneni A, çözücüsü B olan iki bileşenli bir ideal çözeltide, P B çözücünün kısmi buhar basıncı, P A çözünenin kısmi buhar basıncıdır. Çözücünün kısmi buhar basıncını hesaplamak için saf çözücünün o sıcaklıktaki buhar basıncı ile çözeltideki mol kesri çarpılır. Saf çözücünün buhar basıncını belirli bir sıcaklıkta ile ve çözücünün mol kesrini X çözücü ile gösterirsek, P B =. X çözücü işlemi bize çözücünün o sıcaklıktaki kısmi basıncını verir. Çözünenin kısmi basıncını bulmak için de, P A =. X çözünen bağıntısı kullanılır. Çözeltinin toplam basıncı ise, P T = P A =. X çözünen + P B =. X çözücü denklemiyle hesaplanır. Suyun buhar basıncının suya etilen glikol eklenmesiyle nasıl değiştiğini aşağıdaki örnekle inceleyelim. Örnek: Etilen glikol(hoch 2CH 2OH) antifriz olarak kullanılan bir maddedir. 90 o C sıcaklıkta 100 ml etilen glikol ve 100 ml su ile hazırlanan çözeltide suyun buhar basıncını hesaplayınız.(etilen glikolün özkütlesi 1,15 g/ml, suyun özkütlesi 1 g/ml'dir. Saf suyun 90 o C sıcaklıktaki buhar basıncı 525,8 mmhg'dir. Etilen gilkol= 62 g/mol, H 2O = 18 g/mol) Çözüm: Önce çözeltiyi oluşturan maddelerin mol sayılarını bulalım. 100 ml etilen glikol x x = 1,86 mol etilen glikol 100 ml su x = 5,56 mol su P su = (X su )( ) = (0,749)(525,8 mm Hg) = 394 mmhg Çözeltilerde Donma Noktası DüĢmesi ve Kaynama Noktası Yükselmesi Uçucu olmayan bir katı madde sıvı içerisinde çözündüğünde, sıvının özelliklerinde değişme olur. Belirli bir sıcaklıkta, arı suyun buhar basıncını düşürebilmek için, içerisine suda çözünebilen katı bir madde (tuz, şeker) eklenebilir. Böyle bir durumda, aynı sıcaklıkta, oluşan çözeltinin buhar basıncı, arı suyun buhar basıncından düşük olur. Çünkü, çözünen madde molekülleri, birim yüzeydeki çözücü moleküllerinin sayısını azaltır. Bu durum çözücünün daha yavaş ve zor buharlaşmasına,dolayısıyla buhar basıncının düşmesine neden olur. Buhar basıncının açık hava basıncına eşit olması (kaynama) için, çözeltinin daha yüksek sıcaklıklara ısıtılması gerekir. Başka bir deyişle, buhar basıncı düşünce kaynama noktası da yükselmiş olur. Bu nedenle, içinde katı madde çözünmüş çözeltilerin kaynama noktası saf çözücünün kaynama noktasından daha yüksektir. Kolligatif özellikler, çözünenin cinsine bağlı olmayıp yalnızca çözeltide bulunan taneciklerin derişimine bağlıdır ve taneciklerin molekül, anyon veya katyon oluşlarına bağlı değildir. Örneğin, 1 molal metanol(ch 3OH) çözeltisi ile 1 molal etanol(c 2H 5OH) çözeltisinin çözücüleri aynı olmak koşuluyla kaynama noktaları yükselmeleri ile donma noktası alçalmaları aynı iken,1 molallik sofra tuzu(nacl) çözeltisinde, tuz Na + ve Cl - iyonlarına ayrışır ve çözeltideki tanecik sayısı iki katına çıktığı için, kaynama noktası yükselmesi ve donma noktası alçalması metanol ve etanolün iki katı olur. Saf çözücünün içerisinde ne kadar çok katı madde çözünürse, kaynamaya noktasındaki yükselme miktarı o kadar fazla olacaktır. Çözeltinin kaynama noktasındaki yükselme miktarı, birim hacimde bulunan tanecik(iyon, molekül gibi) miktarı ile doğru orantılı değiģir. İyonlaşmadan çözünen maddenin bir molü 1000 gram çözücü ile karıştırılıp çözününce, donma noktası 1,86 o C düşer; kaynama noktası ise 0,52 o C yükselir. İyonlaşarak çözünebilen maddelerde ise Mustafa Atalay mustafaatalay.wordpress.com Sayfa 22
23 bu değişmeler, çözünen maddenin verdiği iyon sayısı ile çarpımı kadar olur. Elektrolitlerin seyreltik çözeltilerinin donma noktası, elektrolit olmayan ideal çözeltilere göre daha fazla düşer. Örneğin, AgNO 3, K 2SO 4 ve AlCl 3 gibi elektrolitler, elektrolit olmayan bir maddenin aynı derişimdeki çözeltisine göre donma noktasını sırasıyla iki, üç ve dört kat azaltır. Bu durumda iyon sayısı donma noktasını farklı hale getirir. Zayıf elektrolitlerin çözeltilerinde iyonlaşmanın tam olmaması sebebiyle, aynı derişimdeki elektrolit olmayan çözeltilerin kolligatif özelliklerinin tam katları alınarak bir hesap yapılamaz. Grafik. Suyun faz diyagramı(kırmızı çizgiler) ve uçucu olmayan bir katının suda çözünmesiyle oluşan çözeltinin faz diyagramı(mavi çizgiler). Çözeltinin kaynama noktası suyunkinden yüksek, donma noktası ise suyunkinden düşüktür. Kaynama sıcaklığı yükselmesi ölçülerek mol kütlesi belirlenmesi yöntemine ebüliyoskopi denir. Bir çözücünün çözelti oluşturduğunda kaynama noktasında meydana gelen değişim, bağıntısıyla bulunur., çözücünün kaynama noktası değişimini, K k, çözücünün kaynama noktası yükselme sabitini(ebüliyoskopi sabiti), m değeri ise molaliteyi gösterir. Bir çözelti içerisinde,uçucu olmayan bir maddenin çözünmesi, donma noktasının düşmesine de neden olur. Örneğin suya şeker ilave edildiğinde, 0 o C'nin altındaki sıcaklıkta donar. Tuzlu suyun donma noktası da donma sırasında sürekli düşer.yani tuzlu suyun kaynaması veya donması sırasında sıcaklık sabit kalmaz. Bu durumda karışımların erime ve kaynama sıcaklıklarının sabit olmadığını söyleyebiliriz. Donma sıcaklığı alçalması ölçülerek mol kütlesi belirlenmesi yöntemine kriyoskopi denir. Şekil.(a) Buzun 0 o C sıcaklıkta saf sudaki denge konumu.(b) İçinde çözünen madde bulunan suda buzun denge durumu. Bir çözücü çözelti oluşturduğunda, donma noktasında meydana gelen değişim, Mustafa Atalay mustafaatalay.wordpress.com Sayfa 23
24 bağıntısıyla bulunur., çözücünün donma noktası değişimini, K d, çözücünün donma noktası alçalması sabitini(kriyoskopi sabiti), m değeri ise molaliteyi gösterir. Su için K k değeri 0,52 o C/m iken K d değeri 1,86 o C/m dir. Maddelerin ısınma eğrileri incelenerek, bir sıvının arı madde veya çözelti olduğu anlaşılır. Tablo. Bazı çözücü maddelerin molal kaynama noktaları, K k değerleri, donma noktaları ve K d değerleri Grafik. Suyun(kırmızı) ve bir sulu çözeltinin(yeşil) (a) kaynama eğrisi ve (b) donma eğrisi. Donma ve kaynama noktalarındaki bu değişme, çözünen katı miktarına, çözünen maddenin yapısına ve çözücünün yapısına göre az veya çok olur. Tuz ve su kullanılarak hazırlanan bir çözelti ısıtıldığında, 100 o C'nin üstünde kaynamaya başlayacaktır. Ancak kaynama süresince su buharlaşacağı için, birim hacimde çözelti başına tuz miktarı artacaktır. Böylece çözeltinin özkütlesi artmış olacaktır. Bu durumda buharlaşma daha zor ve yavaş gerçekleşecektir. Başka bir deyişle, kaynama noktası sabit kalmayacak ve yükselecektir. Çözelti doyma noktasına ulaşıncaya kadar, bu yükselme devam edecektir. Çözelti doyma noktasına ulaştığında çözeltinin özkütlesi sabit kalacaktır. Başka bir deyişle, birim hacimdeki tuz miktarı sabit kalacaktır. Bunun nedeni, buharlaşan su miktarı ile orantılı olarak, buharlaşan suyun çözmüş olduğu tuzun, katı halde dibe çökmesidir. Bu durumda kaynama sıcaklığı sabit kalacaktır. Yani, kaynama sırasında doyma noktasına ulaşan çözeltilerde, sıcaklık sabit kalacaktır. Aynı durum, oluşturulan çözeltinin donma olayı için de geçerlidir. Yani hazırlanan tuzlu su çözeltisi soğutulursa, donma olayı sabit sıcaklıkta gerçekleşmeyecektir. Çözeltilerde, kaynama noktasındaki yükselme ve donma noktasındaki düşme, çözeltinin birim hacminde çözünen madde miktarı ile orantılı olarak değişir. Çözeltilerde, çözünen madde miktarının artması kaynama noktasını yükseltirken, donma Mustafa Atalay mustafaatalay.wordpress.com Sayfa 24
25 noktasının düşmesine neden olur. Öyleyse çözeltilerin sıcaklık-zaman grafikleri, saf çözücülerin grafiklerinden farklı olacaktır. Bu durumda karışımların, saf maddelerden farklı olarak, erime ve kaynama noktalarının sabit olmadığını söyleyebiliriz. Maddelerin ısınma eğrilerinin incelenmesi sırasında, bir maddenin saf madde ya da çözelti olduğu, erime ve kaynama sıcaklıklarının sabit olup olmadığına bakılarak anlaşılabilir. Kaynama noktasının yükselmesi için çözünenin uçucu olmaması gerekirken, donma noktası alçalmasına ait böyle bir sınırlama yoktur. Örnek: I. Saf su II. 500 gram su + 0,5 mol C 6H 12O 6 III. 200 gram su + 0,1 mol NaCl IV. 800 gram su + 0,4 mol AlCl 3 Aynı sıcaklıkta bulunan saf su ile verilen çözeltilerin, a) aynı sıcaklıktaki denge buhar basınçlarını, b) aynı dış basınçtaki kaynama noktalarını ve donma noktalarını karşılaştırınız. Örnek: 250 gram suda 72 gram C 6H 12O 6 bileşiğinin çözünmesiyle oluşan çözeltinin, 1 atmosfer basınç altında donmaya başlama sıcaklığı kaç 0 C olur? (C 6H 12O 6=180) Örnek: 400 gram su içerisinde 92 gram etil alkolün(c 2H 5OH) çözünmesiyle hazırlanan çözeltinin donma noktası -a 0 C oluyor. Aynı basınçta 500 gram su ve bir miktar NaCl ile hazırlanan çözeltinin donma noktası da -a 0 C oluyor. Buna göre ikinci çözeltide kaç gram NaCl kullanılmıştır? (NaCl=58,5, C 2H 5OH=46) Örnek: 0,5 M NaCl çözeltisinin kaynamaya başladığı sıcaklık 100,5 0 C ise, 1M AlCl 3 çözeltisi hangi sıcaklıkta kaynamaya başlar? Ozmoz Suyun yarı geçirgen bir zardan, derişimin düşük olduğu taraftan yüksek olduğu tarafa geçişine ozmoz denir. Şekil. Çözücü moleküllerinin yarı geçirgen bir zardan çözeltiye geçişi Yarı geçirgen zar, yalnızca belli tür molekülleri ya da iyonları bir taraftan diğer tarafa geçirebilir. Yarı geçirgen zar su moleküllerinin geçişini engellemez. Suyun çok yoğun olduğu bölgeden diğer tarafa geçişi sırasında oluşan basınca osmotik basınç adı verilir. Başka bir deyişle, derişimi yüksek olan tarafın derişimi düşük olan taraftaki çözücüye uyguladığı emme kuvveti ozmotik basınçtır. Mustafa Atalay mustafaatalay.wordpress.com Sayfa 25
26 Yanda görüldüğü gibi yarı geçirgen zar her iki çözeltiyi birbirinden ayırır. Yani, çözeltilerin karışmasına engel olurken, seçici bir şekilde çözücü moleküllerinin geçişine izin verir(a). Seyreltik çözeltideki su molekülleri zardan geçerek derişik çözeltinin derişimini düşürür. Su geçişi derişik çözeltinin seviyesini yükseltmeye başlar. Su geçişi dengeye ulaştığı anda(b), oluşan ozmotik basınç, kaba girecek su moleküllerinin geçişini engellemeye başlar. Yani ozmozda suda çözünmüş maddelerin çok olduğu kısım, suda çözünmüş maddelerin az olduğu kısma bir ozmotik basınç uygular. Ozmotik basınç ne kadar büyükse, yoğun ortama geçişi durdurmak için gerekli olan çözeltinin yüksekliği de o kadar büyüktür. Sistem dengeye ulaştığında, yarı geçirgen zardan iki yöne de eşit sayıda çözücü molekülü geçiş yapmaya başlar. Su ya da sulu çözelti dolu bölmelerin kabın çeperlerine uygulayacağı basınca hidrostatik basınç denir. Ozmoz canlı organizmalar için de çok önemlidir. Hücre zarları, küçük moleküllerin ve hidratlaşmış iyonların geçişine izin verecek şekilde yapılanmış yarı geçirgen bir zardır. Hücre içindeki ve dışındaki çözünen maddelerin derişim farkı ozmotik basıncın oluşmasına neden olur. Hücre içi ve dışı derişim farklı olursa bir taraftan diğer tarafa suyun geçmesi söz konusu olur. İzotonik bir çözelti içerisindeki hücre içi ve dışı derişimler eşit olduğu için içe ve dışa su giriş ve çıkışı aynı olduğu için net bir hareketten söz edilemez(a). Hipertonik çözelti içerisinde, hücre dışı derişimi içeriye göre çok yüksek olduğu için hücre su kaybeder, büzülür, belki de çok su kaybettiği için ölür. Hipotonik bir çözeltide, hücre içi madde derişimi yüksek olduğu için hücre su alır ve şişer. Çok fazla su alırsa patlayabilir. Ters Ozmoz Çözücünün yarı geçirgen bir zar yardımıyla daha yoğun bir ortamdan daha az yoğun bir ortama geçmesine ters ozmoz denir. Ters ozmozda yüksek basınç kullanılır. Yandaki şekilde görüldüğü gibi, su geçişinin olması gereken yönün tersine Mustafa Atalay mustafaatalay.wordpress.com Sayfa 26
27 gerçekleşebilmesi için, çözeltinin bulunduğu taraftan, çözeltinin ozmotik basıncından daha yüksek bir basıncın uygulanması gerekir. Bu durumda su molekülleri çözücünün bulunduğu tarafa geçiş yapacaklardır. Heterojen KarıĢımlar Özelliği her yerinde aynı olmayan karışımlardır. Heterojen karışımlarda karışımı oluşturan tanecikler birbiri içerisinde homojen dağılım göstermezler. Bileşimindeki farklı fazları ayrık bir biçimde birarada bulundururlar(kumlu su, zeytinyağı su gibi). Heterojen karışımlar, süspansiyonlar, emülsiyonlar, aeresoller, kolloitler ve adi karışımlar gibi gruplara ayrılabilirler.karışımları oluşturan maddelerden biri diğeri içinde dağılıyorsa dağılan maddeye dağılan faz, diğer maddeye ise dağıtan faz denir. Süspansiyon Dağıtan fazı sıvı, dağılan fazı katı olan, katı sıvı heterojen karışımlardır. Tebeşir tozu-su, çamurlu su, kum su karışımı örnek olarak verilebilir. Genellikle süzme ile bileşenlerine ayrılırlar. Kumlu su filtre kağıdından süzülürse kum ve su birbirinden ayrılır. Kan bir süspansiyon karışımdır; ancak ayrıştırılması süzme ile gerçekleşmez. Santrifüjlenerek kan içerisindeki hücreler ve proteinler çöktürülür ve plazma kısmından ayrılmış olur. Emülsiyon Dağıtan ve dağılan fazları sıvı olan sıvı sıvı heterojen karışımlardır. su-kloroform, suzeytinyağı karışımı, su-mazot karışımı, süt, mayonez örnek olarak verilebilir. Genellikle ayırma hunisi adı verilen ve maddelerin özkütle farkının kullanıldığı aletle birbirlerinden ayrılırlar; ancak süt ve mayonezin bileşenlerine ayrıştırılması ayırma hunisi ile gerçekleşmez. Aerosol Dağıtan fazı gaz, dağılan fazı katı veya sıvı olan katı gaz veya sıvı gaz heterojen karışımlardır. Sis ve bulut sıvı aeresol örnekleridir. Duman, amonyum klorür buharı katı aeresol örnekleridir. Bir gazın bulunduğu ortamda asılı durumda bulunan sıvı damlacıklarıyla veya katı parçacıklarıyla oluşurlar. Gaz içerisinde asılı kalan sıvı damlacıkların ya da katı parçacıklarının boyutları çok küçüktür ve gaz içerisinde kolayca dağılır. Kolloitler Katı taneciklerinin bir sıvı içerisinde çıplak gözle görülemeyecek kadar küçük tanecikler halinde heterojen olarak dağılmasıyla oluşan karışıma kolloit denir. Bir katının sıvı faz içerisinde dağılmasıyla oluşan kolloit sisteme ise sol adı verilir. Yandaki şekilde soldaki bardak içerisinde tanecikler görünmezken(çözelti) sağdaki bardakta ışığın etkisiyle tanecikler farkedilebilmektedir(kolloit). Kolloitlerde dağılan tanecik boyutları, süspansiyon karışımları ile çözeltide dağılan tanecik boyutlarının arasında bir boyuttadır ve normal olarak bakıldığında farklı fazlar anlaşılamamaktadır. Adi KarıĢımlar Katı katı heterojen karışımlardır. Un toz şeker karışımı, toprak, kükürt tozu-demir tozu örnek olarak verilebilir. Ayrıştırılmaları daha kolaydır. Örneğin, kükürt tozu ile demir tozu birbirinden mıknatıs yardımıyla ayrılabilir. Mustafa Atalay mustafaatalay.wordpress.com Sayfa 27
28 Yukarıda anlatılan heterojen karışımları oluşturan maddelelerin tanecik boyutlarıni çözeltiyi oluşturan taneciklerin boyutlarıyla karşılaştıracak olursak, tanecik boyutu 10-9 m'den küçük olanlar çözelti, 10-9 m ve 10-6 m arasında olanlar kolloit, parçacık boyutu 10-6 m'den büyük olanlar ise süspansiyon olarak tanımlanabilir. Sabun köpüğü kolloitler için iyi bir örnektir. Sabun molekülünün yapısını incelediğimizde, suyu seven(hidrofil) bir baş kısmı ve suyu sevmeyen(hidrofob) bir kuyruk kısmından oluştuğunu görürüz. Sabun molekülleri diğer sabun molekülleri ile hidrofob uçlarından baş başa gelerek sabun misellerini oluştururlar. Sabunun temizlemesinde aktif olan madde, uzun zinciri oluşturan yağ asidi anyonudur. Karboksilat anyonu polar ve hiddrofil kısımdır., suda çözünür. Alkilden oluşan taraf ise apolar ve hidrofob olan kısımdır, suda çözünmez. Bu iki zıt etkiden dolayı suda kolloidal karışımlar vererek miselleri oluşturur. Yukarıdaki şekilde görüldüğü gibi, polar baş kısımlar sulu ortama yönelirlerken, hidrofob kuyruk tarafları da birbirlerine yönelirler(a). Sabun moleküllerinin apolar kuyruk kısımları kir parçacıklarını sarar(şekil(b)). Polar olan baş kısımları da su moleküllerine yönelir. Böylece kir parçacığı suda asılı hale gelerek tutunduğu ortamdan ayrılır ve suya geçer. Su ile emülsiyon oluşturur. Böylece tamizlik işlemi gerçekleştirilmiş olur. Homojenizasyon Heterojen karışımı oluşturan, dağılan fazın homojene yakın bir şekilde dağılmasının sağlanmasına homojenizasyon denir. Buradaki homojenize terimini, bildiğimiz homojen ile karıştırmamak gerekir. Homojenizasyon özellikle gıda ve boya sanayinde önemlidir. Homojenizasyon işleminde heterojen karışımı oluşturan dağılan fazın taneciklerinin boyutlarının küçültülmesi(toz haline getirilmesi) gerçekleştirildikten sonra, emülgatör adı verilen katkı maddelerinin kullanılması ile Mustafa Atalay mustafaatalay.wordpress.com Sayfa 28
29 karışımın homojenize olması sağlanmış olur. Burada katkı maddeleri ve toz haline getirme işlemleri, heterojen karışımı oluşturan maddelerin faz ayrılmasına uğramasını engellemek ya da geciktirmek için yapılır. Emülsiyonu oluşturan sıvılar kendi haline bırakıldığında, bir süre sonra birbirlerinden ayrılır ve farklı faz oluştururlar. Bu nedenle hidrofil ve hidrofob uç içeren emülgatörler kullanılarak faz ayrılmasının önüne geçilir. Emülgatörler yağ ve sudan oluşmuş bir karışıma katılırsa, yağın ve suyun iyi bir şekilde birbirine karışması sağlanmış olur. Bu durumdaki karışım daha kararlı, homojene yakın ve farklı fazları içermeyen bir emülsiyon oluşturur. Günümüzde emülgatörler, margarin, mayonez, kremalı soslar, şekerler, işlenmiş paketli gıdalar gibi birçok ürünün üretilmesinde kullanılmaktadırlar. İlaçlarda ve boya sanayinde de faz ayrımını önlemek için çeşitli emülgatörler kullanılmaktadır. Mustafa Atalay mustafaatalay.wordpress.com Sayfa 29
Fiziksel özellikleri her yerde aynı olan (homojen) karışımlara çözelti denir. Bir çözeltiyi oluşturan her bir maddeye çözeltinin bileşenleri denir.
 GENEL KİMYA 1 LABORATUARI ÇALIŞMA NOTLARI DENEY: 8 ÇÖZELTİLER Dr. Bahadır KESKİN, 2011 @ YTÜ Fiziksel özellikleri her yerde aynı olan (homojen) karışımlara çözelti denir. Bir çözeltiyi oluşturan her bir
GENEL KİMYA 1 LABORATUARI ÇALIŞMA NOTLARI DENEY: 8 ÇÖZELTİLER Dr. Bahadır KESKİN, 2011 @ YTÜ Fiziksel özellikleri her yerde aynı olan (homojen) karışımlara çözelti denir. Bir çözeltiyi oluşturan her bir
Genel Kimya. Bölüm 7: ÇÖZELTİLER VE ÇÖZÜNÜRLÜK. Yrd. Doç. Dr. Mustafa SERTÇELİK Kafkas Üniversitesi Kimya Mühendisliği Bölümü
 Genel Kimya Bölüm 7: ÇÖZELTİLER VE ÇÖZÜNÜRLÜK Yrd. Doç. Dr. Mustafa SERTÇELİK Kafkas Üniversitesi Kimya Mühendisliği Bölümü ÇÖZELTİ VE TÜRLERİ Eğer bir madde diğer bir madde içinde molekül, atom veya iyonları
Genel Kimya Bölüm 7: ÇÖZELTİLER VE ÇÖZÜNÜRLÜK Yrd. Doç. Dr. Mustafa SERTÇELİK Kafkas Üniversitesi Kimya Mühendisliği Bölümü ÇÖZELTİ VE TÜRLERİ Eğer bir madde diğer bir madde içinde molekül, atom veya iyonları
Çözelti iki veya daha fazla maddenin birbiri içerisinde homojen. olarak dağılmasından oluşan sistemlere denir.
 3. ÇÖZELTİLER VE ÇÖZELTİ KONSANTRASYONLARI Çözelti: Homojen karışımlardır. Çözelti iki veya daha fazla maddenin birbiri içerisinde homojen olarak dağılmasından oluşan sistemlere denir. Çözelti derişimi
3. ÇÖZELTİLER VE ÇÖZELTİ KONSANTRASYONLARI Çözelti: Homojen karışımlardır. Çözelti iki veya daha fazla maddenin birbiri içerisinde homojen olarak dağılmasından oluşan sistemlere denir. Çözelti derişimi
Bir maddenin başka bir madde içerisinde homojen olarak dağılmasına ÇÖZÜNME denir. Çözelti=Çözücü+Çözünen
 ÇÖZÜCÜ VE ÇÖZÜNEN ETKİLEŞİMLERİ: Çözünme olayı ve Çözelti Oluşumu: Bir maddenin başka bir madde içerisinde homojen olarak dağılmasına ÇÖZÜNME denir. Çözelti=Çözücü+Çözünen Çözünme İyonik Çözünme Moleküler
ÇÖZÜCÜ VE ÇÖZÜNEN ETKİLEŞİMLERİ: Çözünme olayı ve Çözelti Oluşumu: Bir maddenin başka bir madde içerisinde homojen olarak dağılmasına ÇÖZÜNME denir. Çözelti=Çözücü+Çözünen Çözünme İyonik Çözünme Moleküler
ÇÖZELTİLER VE ÇÖZELTİ KONSANTRASYONLARI 3.1. Çözeltiler için kullanılan temel kavramlar
 1.10.2015. ÇÖZELTİLER VE ÇÖZELTİ KONSANTRASYONLARI.1. Çözeltiler için kullanılan temel kavramlar Homojen karışımlardır. Çözelti iki veya daha fazla maddenin birbiri içerisinde homojen olarak dağılmasından
1.10.2015. ÇÖZELTİLER VE ÇÖZELTİ KONSANTRASYONLARI.1. Çözeltiler için kullanılan temel kavramlar Homojen karışımlardır. Çözelti iki veya daha fazla maddenin birbiri içerisinde homojen olarak dağılmasından
ÇÖZÜNÜRLÜĞE ETKİ EDEN FAKTÖRLER
 ÇÖZÜNÜRLÜĞE ETKİ EDEN FAKTÖRLER 1- SICAKLIK 2- ORTAK İYON ETKİSİ 3- ÇÖZÜCÜ ÇÖZÜNEN CİNSİ 4- BASINCIN ETKİSİ 1- SICAKLIK ETKİSİ Sıcaklık etkisi Le Chatelier prensibine bağlı olarak yorumlanır. ENDOTERMİK
ÇÖZÜNÜRLÜĞE ETKİ EDEN FAKTÖRLER 1- SICAKLIK 2- ORTAK İYON ETKİSİ 3- ÇÖZÜCÜ ÇÖZÜNEN CİNSİ 4- BASINCIN ETKİSİ 1- SICAKLIK ETKİSİ Sıcaklık etkisi Le Chatelier prensibine bağlı olarak yorumlanır. ENDOTERMİK
HACETTEPE ÜNĐVERSĐTESĐ ÖĞRETĐM TEKNOLOJĐLERĐ VE MATERYAL GELĐŞTĐRME KONU ANLATIMI. Hazırlayan: Hale Sümerkan. Dersin Sorumlusu: Prof. Dr.
 HACETTEPE ÜNĐVERSĐTESĐ ÖĞRETĐM TEKNOLOJĐLERĐ VE MATERYAL GELĐŞTĐRME KONU ANLATIMI Hazırlayan: Hale Sümerkan Dersin Sorumlusu: Prof. Dr.Đnci Morgil ANKARA 2008 ÇÖZELTĐLER Çözeltiler, iki ya da daha fazla
HACETTEPE ÜNĐVERSĐTESĐ ÖĞRETĐM TEKNOLOJĐLERĐ VE MATERYAL GELĐŞTĐRME KONU ANLATIMI Hazırlayan: Hale Sümerkan Dersin Sorumlusu: Prof. Dr.Đnci Morgil ANKARA 2008 ÇÖZELTĐLER Çözeltiler, iki ya da daha fazla
ÇÖZELTİLERİN KOLİGATİF ÖZELLİKLERİ
 ÇÖZELTİLERİN KOLİGATİF ÖZELLİKLERİ Çözeltilerin sadece derişimine bağlı olarak değişen özelliklerine koligatif özellikler denir. Buhar basıncı düşmesi, Kaynama noktası yükselmesi, Donma noktası azalması
ÇÖZELTİLERİN KOLİGATİF ÖZELLİKLERİ Çözeltilerin sadece derişimine bağlı olarak değişen özelliklerine koligatif özellikler denir. Buhar basıncı düşmesi, Kaynama noktası yükselmesi, Donma noktası azalması
İnstagram:kimyaci_glcn_hoca SIVI ÇÖZELTİLER VE ÇÖZÜNÜRLÜK. kimyaci_glcn_hoca
 SIVI ÇÖZELTİLER VE ÇÖZÜNÜRLÜK SIVI ÇÖZELTİLER H 2 O, CH 3 CI, HF, H 2 S gibi moleküller; *Sıvılar ise polardır. * Bu tür maddeler dipol dipol etkileşimi oluşturur *Birbiri içerisinde *Çözelti:Çözünen +
SIVI ÇÖZELTİLER VE ÇÖZÜNÜRLÜK SIVI ÇÖZELTİLER H 2 O, CH 3 CI, HF, H 2 S gibi moleküller; *Sıvılar ise polardır. * Bu tür maddeler dipol dipol etkileşimi oluşturur *Birbiri içerisinde *Çözelti:Çözünen +
Çözeltiler. MÜHENDİSLİK KİMYASI DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN. Yrd. Doç. Dr. Atilla EVCİN Afyonkarahisar Kocatepe Üniversitesi 2006
 Çözeltiler Çözelti, iki veya daha fazla maddenin homojen bir karışımı olup, en az iki bileşenden oluşur. Bileşenlerden biri çözücü, diğeri ise çözünendir. MÜHENDİSLİK KİMYASI DERS NOTLARI Yrd. Doç. Dr.
Çözeltiler Çözelti, iki veya daha fazla maddenin homojen bir karışımı olup, en az iki bileşenden oluşur. Bileşenlerden biri çözücü, diğeri ise çözünendir. MÜHENDİSLİK KİMYASI DERS NOTLARI Yrd. Doç. Dr.
KARIŞIMLAR HOMOJEN KARŞIMLAR 1.ÇÖZÜCÜLER VE ÇÖZELTİLER:
 KARIŞIMLAR HOMOJEN KARŞIMLAR 1.ÇÖZÜCÜLER VE ÇÖZELTİLER: Kimyasal tepkimeler arasında, çözelti ve çözelti tepkimeleri önemli yer tutmaktadır. Bir maddenin başka bir madde içinde, gözle görülemeyecek kadar
KARIŞIMLAR HOMOJEN KARŞIMLAR 1.ÇÖZÜCÜLER VE ÇÖZELTİLER: Kimyasal tepkimeler arasında, çözelti ve çözelti tepkimeleri önemli yer tutmaktadır. Bir maddenin başka bir madde içinde, gözle görülemeyecek kadar
 1. 250 ml 0,20 M CuSO 4 (aq) çözeltisi hazırlamak için gerekli olan CuSO 4.5H 2 O kütlesini bulunuz. Bu çözeltiden 100 ml 0,10 M CuSO 4 (aq) çözeltisini nasıl hazırlarsınız?( Cu: 63,5; S:32; O:16; H:1)
1. 250 ml 0,20 M CuSO 4 (aq) çözeltisi hazırlamak için gerekli olan CuSO 4.5H 2 O kütlesini bulunuz. Bu çözeltiden 100 ml 0,10 M CuSO 4 (aq) çözeltisini nasıl hazırlarsınız?( Cu: 63,5; S:32; O:16; H:1)
TURUNCU RENGĐN DANSI NASIL OLUR?
 KĐMYA EĞĐE ĞĐTĐM M SEMĐNER NERĐ PROF. DR. ĐNCĐ MORGĐL TURUNCU RENGĐN DANSI NASIL OLUR? HAZIRLAYAN: GÜLÇĐN YALLI KONU: ÇÖZELTĐLER KONU BAŞLIĞI: TURUNCU RENGĐN DANSI NASIL OLUR? ÇÖZELTĐLER Fiziksel özellikleri
KĐMYA EĞĐE ĞĐTĐM M SEMĐNER NERĐ PROF. DR. ĐNCĐ MORGĐL TURUNCU RENGĐN DANSI NASIL OLUR? HAZIRLAYAN: GÜLÇĐN YALLI KONU: ÇÖZELTĐLER KONU BAŞLIĞI: TURUNCU RENGĐN DANSI NASIL OLUR? ÇÖZELTĐLER Fiziksel özellikleri
6.PPB (milyarda bir kısım) Kaynakça Tablo A-1: Çözelti Örnekleri... 5 Tablo B-1:Kolloidal Tanecikler... 8
 İçindekiler A. ÇÖZELTİLER... 2 1.Çözünme... 2 2.Homojenlik... 4 3.Çözelti... 5 4.Çözünürlük... 5 Çözünürlüğe Sıcaklık Ve Basınç Etkisi... 6 B. KARIŞIMLAR... 7 1.Çözeltiler... 7 2.Kolloidal Karışımlar...
İçindekiler A. ÇÖZELTİLER... 2 1.Çözünme... 2 2.Homojenlik... 4 3.Çözelti... 5 4.Çözünürlük... 5 Çözünürlüğe Sıcaklık Ve Basınç Etkisi... 6 B. KARIŞIMLAR... 7 1.Çözeltiler... 7 2.Kolloidal Karışımlar...
KOLLİGATİF ÖZELLİKLER SORU ÇÖZÜMÜ
 KOLLİGATİF ÖZELLİKLER SORU ÇÖZÜMÜ KOLLİGATİF ÖZELLİKLER Çözeltinin derişimine bağlı özelliklerine KOLİGATİF ÖZELLİK denir. Kaynama noktası Buhar basıncı Donma noktası Osmotik Basınç Çözünen Madde çözündüğünde:
KOLLİGATİF ÖZELLİKLER SORU ÇÖZÜMÜ KOLLİGATİF ÖZELLİKLER Çözeltinin derişimine bağlı özelliklerine KOLİGATİF ÖZELLİK denir. Kaynama noktası Buhar basıncı Donma noktası Osmotik Basınç Çözünen Madde çözündüğünde:
GENEL KİMYA. Yrd.Doç.Dr. Tuba YETİM
 GENEL KİMYA ÇÖZELTİLER Homojen karışımlara çözelti denir. Çözelti bileşiminin ve özelliklerinin çözeltinin her yerinde aynı olması sebebiyle çözelti, «homojen» olarak nitelendirilir. Çözeltinin değişen
GENEL KİMYA ÇÖZELTİLER Homojen karışımlara çözelti denir. Çözelti bileşiminin ve özelliklerinin çözeltinin her yerinde aynı olması sebebiyle çözelti, «homojen» olarak nitelendirilir. Çözeltinin değişen
Aeresol. Süspansiyon. Heterojen Emülsiyon. Karışım. Kolloidal. Çözelti < 10-9 m Süspansiyon > 10-6 m Kolloid 10-9 m m
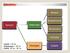 Aeresol Süspansiyon Karışım Heterojen Emülsiyon Kolloidal Çözelti < 10-9 m Süspansiyon > 10-6 m Kolloid 10-9 m - 10-6 m Homojen Çözelti Dağılan Faz Dağılma Fazı Kolloid Tipi katı katı,sıvı,gaz sol katı
Aeresol Süspansiyon Karışım Heterojen Emülsiyon Kolloidal Çözelti < 10-9 m Süspansiyon > 10-6 m Kolloid 10-9 m - 10-6 m Homojen Çözelti Dağılan Faz Dağılma Fazı Kolloid Tipi katı katı,sıvı,gaz sol katı
ELEMENT Aynı tür atomlardan oluşmuş saf maddelere element denir. ELEMENTLERİN ÖZELLİKLERİ 1. Aynı tür atomlardan oluşurlar. 2. Saf ve homojendirler.
 SAF MADDE: Aynı cins atom ya da moleküllerden oluşmuş maddelere, saf medde ÖR. Elementler saf maddelerdir. Çünkü; hepsi aynı cins atomlardan oluşmuşlardır. Bileşikler saf maddelerdir. Çünkü; hepsi aynı
SAF MADDE: Aynı cins atom ya da moleküllerden oluşmuş maddelere, saf medde ÖR. Elementler saf maddelerdir. Çünkü; hepsi aynı cins atomlardan oluşmuşlardır. Bileşikler saf maddelerdir. Çünkü; hepsi aynı
ÇÖZÜNÜRLÜK ÇÖZÜNÜRLÜĞE ETKİ EDEN FAKTÖRLER
 ÇÖZÜNÜRLÜK ÇÖZÜNÜRLÜĞE ETKİ EDEN FAKTÖRLER ÇÖZÜNÜRLÜK Belirli sıcaklık ve basınçta genelde 100 g suda çözünen maksimum madde miktarına çözünürlük denir. Çözünürlük t C de X gr / 100 gr su olarak ifade
ÇÖZÜNÜRLÜK ÇÖZÜNÜRLÜĞE ETKİ EDEN FAKTÖRLER ÇÖZÜNÜRLÜK Belirli sıcaklık ve basınçta genelde 100 g suda çözünen maksimum madde miktarına çözünürlük denir. Çözünürlük t C de X gr / 100 gr su olarak ifade
Kimyafull Gülçin Hoca
 KOLLİGATİF ÖZELLİKLER Kimyafull Gülçin Hoca Buhar basıncının düşmesi Kaynama sıcaklığının yükselmesi Donma sıcaklığının düşmesi Ozmotik basınç A) BUHAR BASINCI DÜŞMESİ RAOULT yasası: Bir çözeltiyi oluşturan
KOLLİGATİF ÖZELLİKLER Kimyafull Gülçin Hoca Buhar basıncının düşmesi Kaynama sıcaklığının yükselmesi Donma sıcaklığının düşmesi Ozmotik basınç A) BUHAR BASINCI DÜŞMESİ RAOULT yasası: Bir çözeltiyi oluşturan
KARIŞIMLARIN SINIFLANDIRILMASI
 IN SINIFLANDIRILMASI Doğadaki maddelerin çoğu saf halde bulunmaz. Çevremizde gördüğümüz maddeler genellikle karışım halindedir. Soluduğumuz hava, yediğimiz çikolata, kek, içtiğimiz meyve suyu, süt hatta
IN SINIFLANDIRILMASI Doğadaki maddelerin çoğu saf halde bulunmaz. Çevremizde gördüğümüz maddeler genellikle karışım halindedir. Soluduğumuz hava, yediğimiz çikolata, kek, içtiğimiz meyve suyu, süt hatta
KARIŞIMLARIN SINIFLANDIRILMASI HAZIRLAYAN FEHMİ GÜR
 IN SINIFLANDIRILMASI HAZIRLAYAN FEHMİ GÜR IN SINIFLANDIRILMASI Karışımlar hangi özelliklerine göre sınıflandırılır? Karışımların sınıflandırılmasında belirleyici olan faktörler nelerdir? Farklı maddelerin
IN SINIFLANDIRILMASI HAZIRLAYAN FEHMİ GÜR IN SINIFLANDIRILMASI Karışımlar hangi özelliklerine göre sınıflandırılır? Karışımların sınıflandırılmasında belirleyici olan faktörler nelerdir? Farklı maddelerin
HEDEF VE DAVRANIŞLAR:
 HEDEF VE DAVRANIŞLAR: 1) Çözünürlük konusuna giriş yapılır ve günlük hayattan örnekler vererek anlaşılmasının sağlanır. 2) Çözünürlüğe etki eden faktörlerin anlatılır ve örneklerle pekiştirilir. 3) Çözünürlüğe
HEDEF VE DAVRANIŞLAR: 1) Çözünürlük konusuna giriş yapılır ve günlük hayattan örnekler vererek anlaşılmasının sağlanır. 2) Çözünürlüğe etki eden faktörlerin anlatılır ve örneklerle pekiştirilir. 3) Çözünürlüğe
MOL KAVRAMI I. ÖRNEK 2
 MOL KAVRAMI I Maddelerin taneciklerden oluştuğunu biliyoruz. Bu taneciklere atom, molekül ya da iyon denir. Atom : Kimyasal yöntemlerle daha basit taneciklere ayrılmayan ve elementlerin yapıtaşı olan taneciklere
MOL KAVRAMI I Maddelerin taneciklerden oluştuğunu biliyoruz. Bu taneciklere atom, molekül ya da iyon denir. Atom : Kimyasal yöntemlerle daha basit taneciklere ayrılmayan ve elementlerin yapıtaşı olan taneciklere
ÇÖZÜNME ve ÇÖZÜNÜRLÜK
 ÇÖZÜNME ve ÇÖZÜNÜRLÜK Prof. Dr. Mustafa DEMİR M.DEMİR 05-ÇÖZÜNME VE ÇÖZÜNÜRLÜK 1 Çözünme Olayı Analitik kimyada çözücü olarak genellikle su kullanılır. Su molekülleri, bir oksijen atomuna bağlı iki hidrojen
ÇÖZÜNME ve ÇÖZÜNÜRLÜK Prof. Dr. Mustafa DEMİR M.DEMİR 05-ÇÖZÜNME VE ÇÖZÜNÜRLÜK 1 Çözünme Olayı Analitik kimyada çözücü olarak genellikle su kullanılır. Su molekülleri, bir oksijen atomuna bağlı iki hidrojen
ÇÖZELTİLERDE YÜZDELİK İFADELER. Ağırlıkça yüzde (% w/w)
 ÇÖZELTİ HAZIRLAMA İki veya daha çok maddenin çıplak gözle veya optik araçlarla yan yana fark edilememesi ve mekanik yollarla ayrılamaması sonucu oluşturdukları karışıma çözelti adı verilir. Anorganik kimyada,
ÇÖZELTİ HAZIRLAMA İki veya daha çok maddenin çıplak gözle veya optik araçlarla yan yana fark edilememesi ve mekanik yollarla ayrılamaması sonucu oluşturdukları karışıma çözelti adı verilir. Anorganik kimyada,
ÖĞRETĐM TEKNOLOJĐSĐ VE MATERYAL GELĐŞTĐRME ÇÖZELTĐLER
 ÖĞRETĐM TEKNOLOJĐSĐ VE MATERYAL GELĐŞTĐRME ÇÖZELTĐLER Ders Sorumlusu: Prof. Dr. Đnci MORGĐL HAZIRLAYAN: NAZLI KIRCI ANKARA,2008 KONU ANLATIMI ÇÖZELTĐLER Đki ya da daha fazla kimyasal maddenin herhangi
ÖĞRETĐM TEKNOLOJĐSĐ VE MATERYAL GELĐŞTĐRME ÇÖZELTĐLER Ders Sorumlusu: Prof. Dr. Đnci MORGĐL HAZIRLAYAN: NAZLI KIRCI ANKARA,2008 KONU ANLATIMI ÇÖZELTĐLER Đki ya da daha fazla kimyasal maddenin herhangi
YouTube:Kimyafull Gülçin Hoca Serüveni DERİŞİM BİRİMLERİ Ppm-ppb SORU ÇÖZÜMLERİ
 Serüveni DERİŞİM BİRİMLERİ Ppm-ppb SORU ÇÖZÜMLERİ ppm Toplam madde miktarının milyonda 1 birimlik maddesine denir. NOT: 1 kg su = 1 Litre ppm =. 10 6 1 kg çözeltide çözünen maddenin mg olarak kütlesine
Serüveni DERİŞİM BİRİMLERİ Ppm-ppb SORU ÇÖZÜMLERİ ppm Toplam madde miktarının milyonda 1 birimlik maddesine denir. NOT: 1 kg su = 1 Litre ppm =. 10 6 1 kg çözeltide çözünen maddenin mg olarak kütlesine
Paylaşılan elektron ya da elektronlar, her iki çekirdek etrafında dolanacaklar, iki çekirdek arasındaki bölgede daha uzun süre bulundukları için bu
 4.Kimyasal Bağlar Kimyasal Bağlar Aynı ya da farklı cins atomları bir arada tutan kuvvetlere kimyasal bağlar denir. Pek çok madde farklı element atomlarının birleşmesiyle meydana gelmiştir. İyonik bağ
4.Kimyasal Bağlar Kimyasal Bağlar Aynı ya da farklı cins atomları bir arada tutan kuvvetlere kimyasal bağlar denir. Pek çok madde farklı element atomlarının birleşmesiyle meydana gelmiştir. İyonik bağ
FARMASÖTİK TEKNOLOJİ I «ÇÖZELTİLER»
 FARMASÖTİK TEKNOLOJİ I «ÇÖZELTİLER» Uygun bir çözücü içerisinde bir ya da birden fazla maddenin çözündüğü veya moleküler düzeyde disperse olduğu tektür (homojen: her tarafta aynı oranda çözünmüş veya dağılmış
FARMASÖTİK TEKNOLOJİ I «ÇÖZELTİLER» Uygun bir çözücü içerisinde bir ya da birden fazla maddenin çözündüğü veya moleküler düzeyde disperse olduğu tektür (homojen: her tarafta aynı oranda çözünmüş veya dağılmış
4. Açısal momentum kuantum sayısı (,) 2 olan bir orbital türü ile ilgili, 5. Orbitaller Maksimum elektron sayısı
 Kuantum Sayıları Ve rbitaller 1. Başkuantum sayısı (n) belirtilen temel enerji düzeylerinden hangisinde bulunabilecek maksimum orbital sayısı yanlış verilmiştir? Başkuantum sayısı (n) Maksimum orbital
Kuantum Sayıları Ve rbitaller 1. Başkuantum sayısı (n) belirtilen temel enerji düzeylerinden hangisinde bulunabilecek maksimum orbital sayısı yanlış verilmiştir? Başkuantum sayısı (n) Maksimum orbital
5) Çözünürlük(Xg/100gsu)
 1) I. Havanın sıvılaştırılması II. abrika bacasından çıkan SO 3 gazının H 2 O ile birleşmesi III. Na metalinin suda çözünmesi Yukardaki olaylardan hangilerinde kimyasal değişme gerçekleşir? 4) Kütle 1
1) I. Havanın sıvılaştırılması II. abrika bacasından çıkan SO 3 gazının H 2 O ile birleşmesi III. Na metalinin suda çözünmesi Yukardaki olaylardan hangilerinde kimyasal değişme gerçekleşir? 4) Kütle 1
BİLEŞİKLER ve FORMÜLLERİ
 BİLEŞİKLER ve FORMÜLLERİ Bileşikler ve Formülleri Bilinen yaklaşık 120 çeşit element vardır. Bu elementlerin yaklaşık % 90 ı tabiatta bulunur. Ancak bugün bilinen yaklaşık 30 milyon bileşik vardır. Buna
BİLEŞİKLER ve FORMÜLLERİ Bileşikler ve Formülleri Bilinen yaklaşık 120 çeşit element vardır. Bu elementlerin yaklaşık % 90 ı tabiatta bulunur. Ancak bugün bilinen yaklaşık 30 milyon bileşik vardır. Buna
KARIŞIMLAR. Çözünme: En az iki maddenin birbiri içinde homojen bir şekilde dağılmasına çözünme denir.
 ÇÖZÜCÜLER VE ÇÖZELTİLER KARIŞIMLAR Çözünme: En az iki maddenin birbiri içinde homojen bir şekilde dağılmasına çözünme denir. Çözelti: Boyutu 10 nanometreden küçük olacak şekilde dağılmış maddelerin oluşturduğu
ÇÖZÜCÜLER VE ÇÖZELTİLER KARIŞIMLAR Çözünme: En az iki maddenin birbiri içinde homojen bir şekilde dağılmasına çözünme denir. Çözelti: Boyutu 10 nanometreden küçük olacak şekilde dağılmış maddelerin oluşturduğu
EYVAH ŞEKERĐM KAYBOLDU!!!!! 9. SINIF 4. ÜNĐTE KARIŞIMLAR
 EYVAH ŞEKERĐM KAYBOLDU!!!!! 9. SINIF 4. ÜNĐTE KARIŞIMLAR KĐMYA ĐLE ĐLĐŞKĐSĐ ve GÜNLÜK HAYATLA ĐLĐŞKĐSĐ ŞEKERĐN ÇAYDA YA DA BAŞKA BĐR SIVIDA KARIŞTIRILDIĞINDA KAYBOLMASI, KĐMYADA ÇÖZÜNME OLGUSUYLA AÇIKLANABĐLĐR.
EYVAH ŞEKERĐM KAYBOLDU!!!!! 9. SINIF 4. ÜNĐTE KARIŞIMLAR KĐMYA ĐLE ĐLĐŞKĐSĐ ve GÜNLÜK HAYATLA ĐLĐŞKĐSĐ ŞEKERĐN ÇAYDA YA DA BAŞKA BĐR SIVIDA KARIŞTIRILDIĞINDA KAYBOLMASI, KĐMYADA ÇÖZÜNME OLGUSUYLA AÇIKLANABĐLĐR.
Maddelerin ortak özellikleri
 On5yirmi5.com Maddelerin ortak özellikleri Maddelerin ortak özellikleri, ayırt edici özelliklerinin incelenip hallerine göre sınıflandırılmasının yapılması... Yayın Tarihi : 30 Ekim 2012 Salı (oluşturma
On5yirmi5.com Maddelerin ortak özellikleri Maddelerin ortak özellikleri, ayırt edici özelliklerinin incelenip hallerine göre sınıflandırılmasının yapılması... Yayın Tarihi : 30 Ekim 2012 Salı (oluşturma
Kimya Mühendisliği Bölümü, 2014/2015 Öğretim Yılı, Bahar Yarıyılı 0102-Genel Kimya-II Dersi, Dönem Sonu Sınavı
 Kimya Mühendisliği Bölümü, 2014/2015 Öğretim Yılı, Bahar Yarıyılı 0102-Genel Kimya-II Dersi, Dönem Sonu Sınavı 20.05.2015 Soru (puan) 1 (20 ) 2 (20 ) 3 (20 ) 4 (25) 5 (20 ) 6 (20 ) Toplam Alınan Puan Not:
Kimya Mühendisliği Bölümü, 2014/2015 Öğretim Yılı, Bahar Yarıyılı 0102-Genel Kimya-II Dersi, Dönem Sonu Sınavı 20.05.2015 Soru (puan) 1 (20 ) 2 (20 ) 3 (20 ) 4 (25) 5 (20 ) 6 (20 ) Toplam Alınan Puan Not:
T.C. Ölçme, Seçme ve Yerleştirme Merkezi
 T.C. Ölçme, Seçme ve Yerleştirme Merkezi LİSANS YERLEŞTİRME SINAVI-2 KİMYA TESTİ 17 HAZİRAN 2017 CUMARTESİ Bu testlerin her hakkı saklıdır. Hangi amaçla olursa olsun, testlerin tamamının veya bir kısmının
T.C. Ölçme, Seçme ve Yerleştirme Merkezi LİSANS YERLEŞTİRME SINAVI-2 KİMYA TESTİ 17 HAZİRAN 2017 CUMARTESİ Bu testlerin her hakkı saklıdır. Hangi amaçla olursa olsun, testlerin tamamının veya bir kısmının
Birden çok maddenin kimyasal bağ oluşturmadan bir arada bulunmasıyla meydana gelen maddelere karışım denir.
 Anahtar Kavramlar Çözelti çözücü çözünen homojen hetorojen derişik seyreltik Birden çok maddenin kimyasal bağ oluşturmadan bir arada bulunmasıyla meydana gelen maddelere karışım denir. Solduğumuz hava;
Anahtar Kavramlar Çözelti çözücü çözünen homojen hetorojen derişik seyreltik Birden çok maddenin kimyasal bağ oluşturmadan bir arada bulunmasıyla meydana gelen maddelere karışım denir. Solduğumuz hava;
ÇÖZÜNME OLGUSU VE ÇÖZELTĐLER SÜRE : 2 DERS SAATĐ
 ÇÖZÜNME OLGUSU VE ÇÖZELTĐLER SÜRE : 2 DERS SAATĐ HAZIRLAYANLAR: NAZLI KIRCI ESRA N.ÇECE SUPHĐ SEVDĐ HEDEF VE DAVRANIŞLAR. HEDEF 1 : ÇÖZELTĐ VE ÖZELLĐKLERĐNĐ KAVRAYABĐLME DAVRANIŞLAR : 1. Çözünme kavramını
ÇÖZÜNME OLGUSU VE ÇÖZELTĐLER SÜRE : 2 DERS SAATĐ HAZIRLAYANLAR: NAZLI KIRCI ESRA N.ÇECE SUPHĐ SEVDĐ HEDEF VE DAVRANIŞLAR. HEDEF 1 : ÇÖZELTĐ VE ÖZELLĐKLERĐNĐ KAVRAYABĐLME DAVRANIŞLAR : 1. Çözünme kavramını
GIDALARIN BAZI FİZİKSEL NİTELİKLERİ
 GIDALARIN BAZI FİZİKSEL NİTELİKLERİ 1 Gıdaların bazı fiziksel özellikleri: Yoğunluk Özgül ısı Viskozite Gıdaların kimyasal bileşimi ve fiziksel yapılarına bağlı olarak BELLİ SINIRLARDA DEĞİŞİR!!! Kimyasal
GIDALARIN BAZI FİZİKSEL NİTELİKLERİ 1 Gıdaların bazı fiziksel özellikleri: Yoğunluk Özgül ısı Viskozite Gıdaların kimyasal bileşimi ve fiziksel yapılarına bağlı olarak BELLİ SINIRLARDA DEĞİŞİR!!! Kimyasal
ASİT-BAZ DENGESİ ÖSS DE ÇIKMIŞ SORULAR
 1. Amonyağın, NH 3, baz özelliği gösterdiğini açıklayan denklem aşağıdakilerden hangisidir? A) NH 3(gaz) NH 3(sıvı) B) N 2(gaz) + 3H 2(gaz) 2NH 3(gaz) C) 2NH 3(gaz) +5/2O 2(gaz) 2NO (gaz) + 3H 2 O (gaz)
1. Amonyağın, NH 3, baz özelliği gösterdiğini açıklayan denklem aşağıdakilerden hangisidir? A) NH 3(gaz) NH 3(sıvı) B) N 2(gaz) + 3H 2(gaz) 2NH 3(gaz) C) 2NH 3(gaz) +5/2O 2(gaz) 2NO (gaz) + 3H 2 O (gaz)
KARIŞIM NEDİR? YANDAKİ RESİMDE GÖRÜLEN SALATA KARIŞIM MIDIR?
 KARIŞIMLAR KARIŞIM NEDİR? YANDAKİ RESİMDE GÖRÜLEN SALATA KARIŞIM MIDIR? Birden çok maddenin kimyasal bağ oluşturmadan bir arada bulunmasıyla meydana gelen maddelere karışım denir. Karışımlar görünümlerine
KARIŞIMLAR KARIŞIM NEDİR? YANDAKİ RESİMDE GÖRÜLEN SALATA KARIŞIM MIDIR? Birden çok maddenin kimyasal bağ oluşturmadan bir arada bulunmasıyla meydana gelen maddelere karışım denir. Karışımlar görünümlerine
KĐMYA EĞĐTĐMĐ DERSĐ PROF.DR.ĐNCĐ MORGĐL
 KĐMYA EĞĐE ĞĐTĐMĐ DERSĐ PROF.DR.ĐNC NCĐ MORGĐL SINIF:11 DERS SAATĐ:4 KĐMYASAL REAKSĐYONLAR Sulu çözeltilerde olan reaksiyonlar Sulu çözeltilerde çökelme ve çözünme ile ilgili kurallar Gaz çıkışıışı olan
KĐMYA EĞĐE ĞĐTĐMĐ DERSĐ PROF.DR.ĐNC NCĐ MORGĐL SINIF:11 DERS SAATĐ:4 KĐMYASAL REAKSĐYONLAR Sulu çözeltilerde olan reaksiyonlar Sulu çözeltilerde çökelme ve çözünme ile ilgili kurallar Gaz çıkışıışı olan
Doğal Rb elementinin atom kütlesi 85,47 g/mol dür ve atom kütleleri 84,91 g/mol olan 86 Rb ile 86,92 olan 87
 Doğal Rb elementinin atom kütlesi 85,47 g/mol dür ve atom kütleleri 84,91 g/mol olan 86 Rb ile 86,92 olan 87 Rb izotoplarından oluşmuştur. İzotopların doğada bulunma yüzdelerini hesaplayınız. Bir bileşik
Doğal Rb elementinin atom kütlesi 85,47 g/mol dür ve atom kütleleri 84,91 g/mol olan 86 Rb ile 86,92 olan 87 Rb izotoplarından oluşmuştur. İzotopların doğada bulunma yüzdelerini hesaplayınız. Bir bileşik
Çözünürlük kuralları
 Çözünürlük kuralları Bütün amonyum, bileşikleri suda çok çözünürler. Alkali metal (Grup IA) bileşikleri suda çok çözünürler. Klorür (Cl ), bromür (Br ) ve iyodür (I ) bileşikleri suda çok çözünürler, ancak
Çözünürlük kuralları Bütün amonyum, bileşikleri suda çok çözünürler. Alkali metal (Grup IA) bileşikleri suda çok çözünürler. Klorür (Cl ), bromür (Br ) ve iyodür (I ) bileşikleri suda çok çözünürler, ancak
II. Bileşenlerinin özelliklerini taşırlar. III. Hacimleri, çözücü ve çözünen hacimleri toplamına eşittir. yargılarından hangileri doğrudur?
 Sıvı Çözeltiler / Çözünme ve Derişim / Sıvı Ortamda Çözünme Olayı BÖLÜM 4 Test. Çözeltiler ile ilgili, I. Homojen karışımlardır. II. Bileşenlerinin özelliklerini taşırlar. III. Hacimleri, çözücü ve çözünen
Sıvı Çözeltiler / Çözünme ve Derişim / Sıvı Ortamda Çözünme Olayı BÖLÜM 4 Test. Çözeltiler ile ilgili, I. Homojen karışımlardır. II. Bileşenlerinin özelliklerini taşırlar. III. Hacimleri, çözücü ve çözünen
GAZLAR GAZ KARIŞIMLARI
 DALTON KISMİ BASINÇLAR YASASI Aynı Kaplarda Gazların Karıştırılması Birbiri ile tepkimeye girmeyen gaz karışımlarının davranışı genellikle ilgi çekicidir. Böyle bir karışımdaki bir bileşenin basıncı, aynı
DALTON KISMİ BASINÇLAR YASASI Aynı Kaplarda Gazların Karıştırılması Birbiri ile tepkimeye girmeyen gaz karışımlarının davranışı genellikle ilgi çekicidir. Böyle bir karışımdaki bir bileşenin basıncı, aynı
GENEL KİMYA 101 ÖDEV 3
 TOBB EKONOMİ VE TEKNOLOJİ ÜNİVERSİTESİ-27 Kasım 2013 Bütün Şubeler GENEL KİMYA 101 ÖDEV 3 ÖNEMLİ! Ödev Teslim Tarihi: 6 Aralık 2013 Soru 1-5 arasında 2 soru Soru 6-10 arasında 2 soru Soru 11-15 arasında
TOBB EKONOMİ VE TEKNOLOJİ ÜNİVERSİTESİ-27 Kasım 2013 Bütün Şubeler GENEL KİMYA 101 ÖDEV 3 ÖNEMLİ! Ödev Teslim Tarihi: 6 Aralık 2013 Soru 1-5 arasında 2 soru Soru 6-10 arasında 2 soru Soru 11-15 arasında
DENEY I ÇÖZELTİ KONSANTRASYONLARI. Genel Bilgi
 DENEY I ÇÖZELTİ KONSANTRASYONLARI Genel Bilgi 1. Çözelti İki ya da daha fazla maddenin herhangi bir oranda bir araya gelerek oluşturdukları homojen karışıma çözelti denir. Diğer bir deyişle, bir maddenin
DENEY I ÇÖZELTİ KONSANTRASYONLARI Genel Bilgi 1. Çözelti İki ya da daha fazla maddenin herhangi bir oranda bir araya gelerek oluşturdukları homojen karışıma çözelti denir. Diğer bir deyişle, bir maddenin
KARIŞIMLAR. Birden çok maddenin kimyasal bağ oluşturmadan bir arada bulunmasıyla meydana gelen mad-delere karışım denir.
 KARIŞIMLAR Birden çok maddenin kimyasal bağ oluşturmadan bir arada bulunmasıyla meydana gelen mad-delere karışım denir. 1-HETEROJEN KARIŞIMLAR (ADİ KARIŞIMLAR) Karışımı oluşturan maddeler karışımın her
KARIŞIMLAR Birden çok maddenin kimyasal bağ oluşturmadan bir arada bulunmasıyla meydana gelen mad-delere karışım denir. 1-HETEROJEN KARIŞIMLAR (ADİ KARIŞIMLAR) Karışımı oluşturan maddeler karışımın her
DENEY 3. MADDENİN ÜÇ HALİ: NİTEL VE NİCEL GÖZLEMLER Sıcaklık ilişkileri
 DENEY 3 MADDENİN ÜÇ HALİ: NİTEL VE NİCEL GÖZLEMLER Sıcaklık ilişkileri AMAÇ: Maddelerin üç halinin nitel ve nicel gözlemlerle incelenerek maddenin sıcaklık ile davranımını incelemek. TEORİ Hal değişimi,
DENEY 3 MADDENİN ÜÇ HALİ: NİTEL VE NİCEL GÖZLEMLER Sıcaklık ilişkileri AMAÇ: Maddelerin üç halinin nitel ve nicel gözlemlerle incelenerek maddenin sıcaklık ile davranımını incelemek. TEORİ Hal değişimi,
Soygazların bileşik oluşturamamasının sebebi bütün orbitallerinin dolu olmasındandır.
 KİMYASAL BAĞLAR Kimyasal bağ, moleküllerde atomları birarada tutan kuvvettir. Bir bağın oluşabilmesi için atomlar tek başına bulundukları zamankinden daha kararlı (az enerjiye sahip) olmalıdırlar. Genelleme
KİMYASAL BAĞLAR Kimyasal bağ, moleküllerde atomları birarada tutan kuvvettir. Bir bağın oluşabilmesi için atomlar tek başına bulundukları zamankinden daha kararlı (az enerjiye sahip) olmalıdırlar. Genelleme
ÇÖZÜNÜRLÜK DENGESİ (Kçç)
 ÇÖZÜNÜRLÜK DENGESİ (Kçç) ÇÖZELTİLERDE ÇÖZÜNME VE ÇÖKELME OLAYLARI Çözeltiler doymuşluklarına göre üçe ayrılırlar: 1- Doymamış çözeltiler: Belirli bir sıcaklıkta ve basınçta çözebileceğinden daha az miktarda
ÇÖZÜNÜRLÜK DENGESİ (Kçç) ÇÖZELTİLERDE ÇÖZÜNME VE ÇÖKELME OLAYLARI Çözeltiler doymuşluklarına göre üçe ayrılırlar: 1- Doymamış çözeltiler: Belirli bir sıcaklıkta ve basınçta çözebileceğinden daha az miktarda
6. Aşağıdaki tablodan yararlanarak X maddesinin ne olduğunu (A, B,C? ) ön görünüz.
 1. Lavosier yasası nedir, açıklayınız. 2. C 2 H 4 + 3O 2 2CO 2 + 2 H 2 O tepkimesine göre 2,0 g etilenin yeterli miktarda oksijenle yanması sonucu oluşan ürünlerin toplam kütlesi nedir, hesaplayınız. 3.
1. Lavosier yasası nedir, açıklayınız. 2. C 2 H 4 + 3O 2 2CO 2 + 2 H 2 O tepkimesine göre 2,0 g etilenin yeterli miktarda oksijenle yanması sonucu oluşan ürünlerin toplam kütlesi nedir, hesaplayınız. 3.
Serüveni 4.ÜNİTE MADDENİN HALLERİ ORTAK VE AYIRDEDİCİ ÖZELLİKLER
 Serüveni 4.ÜNİTE MADDENİN HALLERİ ORTAK VE AYIRDEDİCİ ÖZELLİKLER MADDENİN HALLERİ MADDE MİKTARINA BAĞLI ÖZELLİKLER:(ORTAK ÖZELLİKLER) :Madde miktarının ölçüsüdür. :Maddenin boşlukta kapladığı yerdir Eylemsizlik:Maddenin
Serüveni 4.ÜNİTE MADDENİN HALLERİ ORTAK VE AYIRDEDİCİ ÖZELLİKLER MADDENİN HALLERİ MADDE MİKTARINA BAĞLI ÖZELLİKLER:(ORTAK ÖZELLİKLER) :Madde miktarının ölçüsüdür. :Maddenin boşlukta kapladığı yerdir Eylemsizlik:Maddenin
Ünite. Karışımlar. Homojen Karışımlar 62 Heterojen Karışımlar 84 Karışımların Ayrılması 93
 Ünite 2 Karışımlar Homojen Karışımlar 62 Heterojen Karışımlar 84 Karışımların Ayrılması 93 HOMOJEN KARIŞIMLAR 1. Boyutu 10 nm den daha küçük olacak şekilde dağılmış maddelerin oluşturduğu karışıma çözelti
Ünite 2 Karışımlar Homojen Karışımlar 62 Heterojen Karışımlar 84 Karışımların Ayrılması 93 HOMOJEN KARIŞIMLAR 1. Boyutu 10 nm den daha küçük olacak şekilde dağılmış maddelerin oluşturduğu karışıma çözelti
ÜNİTE 9. Çözeltiler. Amaçlar. İçindekiler. Öneriler
 ÜNİTE 9 Çözeltiler Amaçlar Bu üniteyi çalıştıktan sonra, Çözelti ve çözelti türlerini tanımlayabilecek, Çözünme olgusunu ve çözünürlüğü kavrayacak, Elektrolitleri ve çeşitlerini tanımlayabilecek, Çözelti
ÜNİTE 9 Çözeltiler Amaçlar Bu üniteyi çalıştıktan sonra, Çözelti ve çözelti türlerini tanımlayabilecek, Çözünme olgusunu ve çözünürlüğü kavrayacak, Elektrolitleri ve çeşitlerini tanımlayabilecek, Çözelti
4. ÇÖZÜNÜRLÜK. Çözünürlük Çarpımı Kçç. NaCl Na+ + Cl- (%100 iyonlaşma) AgCl(k) Ag + (ç) + Cl - (ç) (Kimyasal dengeye göre iyonlaşma) K = [AgCl(k)]
![4. ÇÖZÜNÜRLÜK. Çözünürlük Çarpımı Kçç. NaCl Na+ + Cl- (%100 iyonlaşma) AgCl(k) Ag + (ç) + Cl - (ç) (Kimyasal dengeye göre iyonlaşma) K = [AgCl(k)] 4. ÇÖZÜNÜRLÜK. Çözünürlük Çarpımı Kçç. NaCl Na+ + Cl- (%100 iyonlaşma) AgCl(k) Ag + (ç) + Cl - (ç) (Kimyasal dengeye göre iyonlaşma) K = [AgCl(k)]](/thumbs/69/61024076.jpg) 4. ÇÖZÜNÜRLÜK Çözünürlük Çarpımı NaCl Na+ + Cl- (%100 iyonlaşma) AgCl(k) Ag + (ç) + Cl - (ç) (Kimyasal dengeye göre iyonlaşma) + - [Ag ][Cl ] K = [AgCl(k)] K [AgCl(k)] = [Ag + ] [Cl - ] = [Ag + ] [Cl -
4. ÇÖZÜNÜRLÜK Çözünürlük Çarpımı NaCl Na+ + Cl- (%100 iyonlaşma) AgCl(k) Ag + (ç) + Cl - (ç) (Kimyasal dengeye göre iyonlaşma) + - [Ag ][Cl ] K = [AgCl(k)] K [AgCl(k)] = [Ag + ] [Cl - ] = [Ag + ] [Cl -
BİYOKİMYASAL ÇÖZELTİLER
 2. HAFTA BİYOKİMYASAL ÇÖZELTİLER Çözelti hazırlanması % Çözeltiler, molar çözeltiler, normal çözeltiler, osmolar çözeltiler, izotonik çözeltiler, molal çözeltiler, ppm çözeltiler BİYOKİMYASAL ÇÖZELTİLER
2. HAFTA BİYOKİMYASAL ÇÖZELTİLER Çözelti hazırlanması % Çözeltiler, molar çözeltiler, normal çözeltiler, osmolar çözeltiler, izotonik çözeltiler, molal çözeltiler, ppm çözeltiler BİYOKİMYASAL ÇÖZELTİLER
Örnek : 3- Bileşiklerin Özellikleri :
 Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani
Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani
5. ÇÖZÜNÜRLÜK DENGESİ
 5. ÇÖZÜNÜRLÜK DENGESİ Birçok tuz suda çok az çözünür. Tuzların sudaki çözünürlüğünden faydalanarak çökelek oluşumu kontrol edilebilir ve çökme olayı karışımları ayırmak için kullanılabilir. Çözünürlük
5. ÇÖZÜNÜRLÜK DENGESİ Birçok tuz suda çok az çözünür. Tuzların sudaki çözünürlüğünden faydalanarak çökelek oluşumu kontrol edilebilir ve çökme olayı karışımları ayırmak için kullanılabilir. Çözünürlük
Genel Kimya Prensipleri ve Modern Uygulamaları Petrucci Harwood Herring 8. Baskı. Bölüm 4: Kimyasal Tepkimeler
 Genel Kimya Prensipleri ve Modern Uygulamaları Petrucci Harwood Herring 8. Baskı Bölüm 4: Kimyasal Tepkimeler İçindekiler 4-1 Kimyasal Tepkimeler ve Kimyasal Eşitlikler 4-2 Kimyasal Eşitlik ve Stokiyometri
Genel Kimya Prensipleri ve Modern Uygulamaları Petrucci Harwood Herring 8. Baskı Bölüm 4: Kimyasal Tepkimeler İçindekiler 4-1 Kimyasal Tepkimeler ve Kimyasal Eşitlikler 4-2 Kimyasal Eşitlik ve Stokiyometri
2+ 2- Mg SO 4. (NH 4 ) 2 SO 4 (amonyum sülfat) bileşiğini katyon ve anyonlara ayıralım.
 KONU: Kimyasal Tepkimeler Dersin Adı Dersin Konusu İYONİK BİLEŞİKLERİN FORMÜLLERİNİN YAZILMASI İyonik bağlı bileşiklerin formüllerini yazmak için atomların yüklerini bilmek gerekir. Bunu da daha önceki
KONU: Kimyasal Tepkimeler Dersin Adı Dersin Konusu İYONİK BİLEŞİKLERİN FORMÜLLERİNİN YAZILMASI İyonik bağlı bileşiklerin formüllerini yazmak için atomların yüklerini bilmek gerekir. Bunu da daha önceki
ÇÖZELTİ HAZIRLAMA. Kimyasal analizin temel kavramlarından olan çözeltinin anlamı, hazırlanışı ve kullanılışının öğrenilmesidir.
 1. DENEYİN AMACI ÇÖZELTİ HAZIRLAMA Kimyasal analizin temel kavramlarından olan çözeltinin anlamı, hazırlanışı ve kullanılışının öğrenilmesidir. 2. DENEYİN ANLAM VE ÖNEMİ Bir kimyasal bileşikte veya karışımda
1. DENEYİN AMACI ÇÖZELTİ HAZIRLAMA Kimyasal analizin temel kavramlarından olan çözeltinin anlamı, hazırlanışı ve kullanılışının öğrenilmesidir. 2. DENEYİN ANLAM VE ÖNEMİ Bir kimyasal bileşikte veya karışımda
Çözelti konsantrasyonları. Bir çözeltinin konsantrasyonu, çözeltinin belirli bir hacmi içinde çözünmüş olan madde miktarıdır.
 Çözelti konsantrasyonları Bir çözeltinin konsantrasyonu, çözeltinin belirli bir hacmi içinde çözünmüş olan madde miktarıdır. 1 -Yüzde ( % ) -Molarite (M) -Molalite (m) -Normalite (N) çözelti konsantrasyonlarını
Çözelti konsantrasyonları Bir çözeltinin konsantrasyonu, çözeltinin belirli bir hacmi içinde çözünmüş olan madde miktarıdır. 1 -Yüzde ( % ) -Molarite (M) -Molalite (m) -Normalite (N) çözelti konsantrasyonlarını
Kütlesi,hacmi,eylemsizliği olan,tanecikli yapıdaki her şeye madde denir. Yer yüzünde gözümüzle görebildiğimiz her şey maddedir.
 Madde Tanımı Kütlesi,hacmi,eylemsizliği olan,tanecikli yapıdaki her şeye madde denir. Yer yüzünde gözümüzle görebildiğimiz her şey maddedir. MADDENİN MADDENİN HALLERİ HALLERİ maddenin haller i MADDENİN
Madde Tanımı Kütlesi,hacmi,eylemsizliği olan,tanecikli yapıdaki her şeye madde denir. Yer yüzünde gözümüzle görebildiğimiz her şey maddedir. MADDENİN MADDENİN HALLERİ HALLERİ maddenin haller i MADDENİN
Serüveni 3. ÜNİTE KİMYASAL TÜRLER ARASI ETKİLEŞİM GÜÇLÜ ETKİLEŞİM. o İYONİK BAĞ o KOVALENT BAĞ o METALİK BAĞ
 Serüveni 3. ÜNİTE KİMYASAL TÜRLER ARASI ETKİLEŞİM GÜÇLÜ ETKİLEŞİM o İYONİK BAĞ o KOVALENT BAĞ o METALİK BAĞ KİMYASAL TÜR 1. İYONİK BAĞ - - Ametal.- Kök Kök Kök (+) ve (-) yüklü iyonların çekim kuvvetidir..halde
Serüveni 3. ÜNİTE KİMYASAL TÜRLER ARASI ETKİLEŞİM GÜÇLÜ ETKİLEŞİM o İYONİK BAĞ o KOVALENT BAĞ o METALİK BAĞ KİMYASAL TÜR 1. İYONİK BAĞ - - Ametal.- Kök Kök Kök (+) ve (-) yüklü iyonların çekim kuvvetidir..halde
7. Sınıf Fen ve Teknoloji
 KONU: Karışımlar Birden fazla maddenin özelliklerini kaybetmeden oluşturdukları topluluğa karışım denir. İçme suyu, gazoz, limonata, meyve suyu, yemekler, salata, süt, ayran, hava, sis, çamur vb. birer
KONU: Karışımlar Birden fazla maddenin özelliklerini kaybetmeden oluşturdukları topluluğa karışım denir. İçme suyu, gazoz, limonata, meyve suyu, yemekler, salata, süt, ayran, hava, sis, çamur vb. birer
00213 ANALİTİK KİMYA-I SINAV VE ÇALIŞMA SORULARI
 00213 ANALİTİK KİMYA-I SINAV VE ÇALIŞMA SORULARI A) TANIMLAR, KAVRAMLAR ve TEMEL HESAPLAMALAR: 1. Aşağıdaki kavramları birer cümle ile tanımlayınız. Analitik kimya, Sistematik analiz, ph, Tesir değerliği,
00213 ANALİTİK KİMYA-I SINAV VE ÇALIŞMA SORULARI A) TANIMLAR, KAVRAMLAR ve TEMEL HESAPLAMALAR: 1. Aşağıdaki kavramları birer cümle ile tanımlayınız. Analitik kimya, Sistematik analiz, ph, Tesir değerliği,
A A A A A A A A A A A
 LYS 2 KİMYA TESTİ 1. Bu testte 30 soru vardır. 2. Cevaplarınızı, cevap kâğıdının Kimya Testi için ayrılan kısmına işaretleyiniz. 1. Eşit miktarlardaki suda; 3.. 36 gram Fe(NO 3 ) 2. n mol NaCl çözülerek
LYS 2 KİMYA TESTİ 1. Bu testte 30 soru vardır. 2. Cevaplarınızı, cevap kâğıdının Kimya Testi için ayrılan kısmına işaretleyiniz. 1. Eşit miktarlardaki suda; 3.. 36 gram Fe(NO 3 ) 2. n mol NaCl çözülerek
MADDE NEDİR? Çevremize baktığımızda gördüğümüz her şey örneğin, dağlar, denizler, ağaçlar, bitkiler, hayvanlar ve hava birer maddedir.
 MADDE NEDİR? Çevremize baktığımızda gördüğümüz her şey örneğin, dağlar, denizler, ağaçlar, bitkiler, hayvanlar ve hava birer maddedir. Her maddenin bir kütlesi vardır ve bu tartılarak bulunur. Ayrıca her
MADDE NEDİR? Çevremize baktığımızda gördüğümüz her şey örneğin, dağlar, denizler, ağaçlar, bitkiler, hayvanlar ve hava birer maddedir. Her maddenin bir kütlesi vardır ve bu tartılarak bulunur. Ayrıca her
1. BÖLÜM : ANALİTİK KİMYANIN TEMEL KAVRAMLARI
 ANALİTİK KİMYA DERS NOTLARI Yrd.Doç.Dr.. Hüseyin ÇELİKKAN 1. BÖLÜM : ANALİTİK KİMYANIN TEMEL KAVRAMLARI Analitik kimya, bilimin her alanında faydalanılan, maddenin özellikleri hakkında bilgi veren yöntemlerin
ANALİTİK KİMYA DERS NOTLARI Yrd.Doç.Dr.. Hüseyin ÇELİKKAN 1. BÖLÜM : ANALİTİK KİMYANIN TEMEL KAVRAMLARI Analitik kimya, bilimin her alanında faydalanılan, maddenin özellikleri hakkında bilgi veren yöntemlerin
ASİTLER- BAZLAR. Suyun kendi kendine iyonlaşmasına Suyun Otonizasyonu - Otoprotoliz adı verilir. Suda oluşan H + sadece protondur.
 ASİTLER- BAZLAR SUYUN OTONİZASYONU: Suyun kendi kendine iyonlaşmasına Suyun Otonizasyonu - Otoprotoliz adı verilir. Suda oluşan H + sadece protondur. H 2 O (S) H + (suda) + OH - (Suda) H 2 O (S) + H +
ASİTLER- BAZLAR SUYUN OTONİZASYONU: Suyun kendi kendine iyonlaşmasına Suyun Otonizasyonu - Otoprotoliz adı verilir. Suda oluşan H + sadece protondur. H 2 O (S) H + (suda) + OH - (Suda) H 2 O (S) + H +
Bilgi İletişim ve Teknoloji
 MADDENİN HALLERİ Genel olarak madde ya katı ya sıvı ya da gaz hâlinde bulunur. İstenildiğinde ortam şartları elverişli hâle getirilerek bir hâlden diğerine dönüştürülebilir. Maddenin katı, sıvı ve gaz
MADDENİN HALLERİ Genel olarak madde ya katı ya sıvı ya da gaz hâlinde bulunur. İstenildiğinde ortam şartları elverişli hâle getirilerek bir hâlden diğerine dönüştürülebilir. Maddenin katı, sıvı ve gaz
ONDOKUZ MAYIS ÜNİVERSİTESİ MÜHENDİSLİK FAKÜLTESİ KİMYA MÜHENDİSLİĞİ BÖLÜMÜ ORGANİK KİMYA LABORATUVARI DENEY 8 : YÜZEY GERİLİMİNİN BELİRLENMESİ
 ONDOKUZ MAYIS ÜNİVERSİTESİ MÜHENDİSLİK FAKÜLTESİ KİMYA MÜHENDİSLİĞİ BÖLÜMÜ ORGANİK KİMYA LABORATUVARI DENEY 8 : YÜZEY GERİLİMİNİN BELİRLENMESİ DENEYİN AMACI Gazlarda söz konusu olmayan yüzey gerilimi sıvı
ONDOKUZ MAYIS ÜNİVERSİTESİ MÜHENDİSLİK FAKÜLTESİ KİMYA MÜHENDİSLİĞİ BÖLÜMÜ ORGANİK KİMYA LABORATUVARI DENEY 8 : YÜZEY GERİLİMİNİN BELİRLENMESİ DENEYİN AMACI Gazlarda söz konusu olmayan yüzey gerilimi sıvı
Gaz hali genel olarak molekül ve atomların birbirinden uzak olduğu ve çok hızlı hareket ettiği bir haldir.
 GAZLAR Maddeler tabiatta katı, sıvı ve gaz olmak üzere üç halde bulunurlar. Gaz hali genel olarak molekül ve atomların birbirinden uzak olduğu ve çok hızlı hareket ettiği bir haldir. Gaz molekülleri birbirine
GAZLAR Maddeler tabiatta katı, sıvı ve gaz olmak üzere üç halde bulunurlar. Gaz hali genel olarak molekül ve atomların birbirinden uzak olduğu ve çok hızlı hareket ettiği bir haldir. Gaz molekülleri birbirine
ÇÖZÜNÜRLÜK (ORTAK İYON ETKİSİ ) (Çöktürme ile Ayırma)
 ÇÖZÜNÜRLÜ (ORTA İYON ETİSİ ) (Çöktürme ile Ayırma) Prof. Dr. ustafa DEİR 08ORTA İYON ETİSİ07B ÇÖZÜNÜRLÜ ÇÖTÜRE İLE AYIRA 1 ORTA İYON ETİSİ 08ORTA İYON ETİSİ07B ÇÖZÜNÜRLÜ ÇÖTÜRE İLE AYIRA ORTA İYON ETİSİ
ÇÖZÜNÜRLÜ (ORTA İYON ETİSİ ) (Çöktürme ile Ayırma) Prof. Dr. ustafa DEİR 08ORTA İYON ETİSİ07B ÇÖZÜNÜRLÜ ÇÖTÜRE İLE AYIRA 1 ORTA İYON ETİSİ 08ORTA İYON ETİSİ07B ÇÖZÜNÜRLÜ ÇÖTÜRE İLE AYIRA ORTA İYON ETİSİ
BİLEŞİKLER VE FORMÜLLERİ
 BİLEŞİKLER VE FORMÜLLERİ Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur). Bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere
BİLEŞİKLER VE FORMÜLLERİ Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur). Bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere
Ünite. Karışımlar. Homojen Karışımlar 72 Heterojen Karışımlar 102 Karışımların Ayrılması 118
 Ünite 2 Karışımlar Homojen Karışımlar 72 Heterojen Karışımlar 102 Karışımların Ayrılması 118 KARIŞIMLAR Karışımlar Bir küp şekerin suda çözünmesi. Çözeltinin özellikleri, çözücüsünden oldukça farklıdır.
Ünite 2 Karışımlar Homojen Karışımlar 72 Heterojen Karışımlar 102 Karışımların Ayrılması 118 KARIŞIMLAR Karışımlar Bir küp şekerin suda çözünmesi. Çözeltinin özellikleri, çözücüsünden oldukça farklıdır.
ÇÖZELTİLERİN KOLİGATİF ÖZELLİKLERİ HAZIRLAYAN FEHMİ GÜR
 ÇÖZELTİLERİN KOLİGATİF ÖZELLİKLERİ HAZIRLAYAN FEHMİ GÜR KOLİGATİF ÖZELLİKLER Uçucu olmayan maddelerin çözeltilerinin bazı fiziksel özellikleri; saf çözücününkinden farklıdır. Bu çözeltiler hazırlanırken,
ÇÖZELTİLERİN KOLİGATİF ÖZELLİKLERİ HAZIRLAYAN FEHMİ GÜR KOLİGATİF ÖZELLİKLER Uçucu olmayan maddelerin çözeltilerinin bazı fiziksel özellikleri; saf çözücününkinden farklıdır. Bu çözeltiler hazırlanırken,
MADDENİN YAPISI VE ÖZELLİKLERİ ATOM
 MADDENİN YAPISI VE ÖZELLİKLERİ ATOM ATOMUN YAPISI Elementlerin tüm özelliğini gösteren en küçük parçasına atom denir. Atomu oluşturan parçacıklar farklı yüklere sa-hiptir. Atomda bulunan yükler; negatif
MADDENİN YAPISI VE ÖZELLİKLERİ ATOM ATOMUN YAPISI Elementlerin tüm özelliğini gösteren en küçük parçasına atom denir. Atomu oluşturan parçacıklar farklı yüklere sa-hiptir. Atomda bulunan yükler; negatif
4. 25 o C de sulu çözeltilerin özellikleri ile ilgili olarak, 5. ph 7 olan sulu çözelti için,
 1. ( ) ( ) ( ( ) Yukarıda verilen asit baz tepkimesinde asit özellik gösteren maddeler hangileridir? A), 4. 25 o C de sulu çözeltilerin özellikleri ile ilgili olarak, I. ph poh ise OH 1x10 7 II. OH H ise
1. ( ) ( ) ( ( ) Yukarıda verilen asit baz tepkimesinde asit özellik gösteren maddeler hangileridir? A), 4. 25 o C de sulu çözeltilerin özellikleri ile ilgili olarak, I. ph poh ise OH 1x10 7 II. OH H ise
MADDENİN AYIRT EDİCİ ÖZELLİKLERİ. Nazife ALTIN Bayburt Üniversitesi, Eğitim Fakültesi
 MADDENİN AYIRT EDİCİ ÖZELLİKLERİ Bayburt Üniversitesi, Eğitim Fakültesi www.nazifealtin.wordpress.com MADDENİN AYIRT EDİCİ ÖZELLİKLERİ Bir maddeyi diğerlerinden ayırmamıza ve ayırdığımız maddeyi tanımamıza
MADDENİN AYIRT EDİCİ ÖZELLİKLERİ Bayburt Üniversitesi, Eğitim Fakültesi www.nazifealtin.wordpress.com MADDENİN AYIRT EDİCİ ÖZELLİKLERİ Bir maddeyi diğerlerinden ayırmamıza ve ayırdığımız maddeyi tanımamıza
İLK ANYONLAR , PO 4. Cl -, SO 4 , CO 3 , NO 3
 İLK ANYONLAR Cl -, SO -, CO -, PO -, NO - İLK ANYONLAR Anyonlar negatif yüklü iyonlardır. Kalitatif analitik kimya analizlerine ilk anyonlar olarak adlandırılan Cl -, SO -, CO -, PO -, NO - analizi ile
İLK ANYONLAR Cl -, SO -, CO -, PO -, NO - İLK ANYONLAR Anyonlar negatif yüklü iyonlardır. Kalitatif analitik kimya analizlerine ilk anyonlar olarak adlandırılan Cl -, SO -, CO -, PO -, NO - analizi ile
İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA
 İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA İNCELENİR Her tarafında aynı özelliği gösteren, tek bir madde
İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA İNCELENİR Her tarafında aynı özelliği gösteren, tek bir madde
İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA İNCELENİR
 KARIŞIMLAR İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA İNCELENİR Her tarafında aynı özelliği gösteren, tek
KARIŞIMLAR İKİ YADA DAHA FAZLA MADDENİN ÖZELLİKLERİNİ KAYBETMEDEN ÇEŞİTLİ ORANLARDA KARIŞMASI İLE OLUŞAN TOPLULUĞA KARIŞIM DENİR KARIŞIMLAR İKİ SINIFTA İNCELENİR Her tarafında aynı özelliği gösteren, tek
TAMPON ÇÖZELTİLER. Prof.Dr.Mustafa DEMİR M.DEMİR 09-TAMPON ÇÖZELTİLER 1
 TAMPON ÇÖZELTİLER Prof.Dr.Mustafa DEMİR M.DEMİR 09-TAMPON ÇÖZELTİLER 1 Tampon çözeltiler Kimyada belli ph larda çözelti hazırlamak ve bunu uzun süre kullanmak çok önemlidir. Ancak bu çözeltilerin saklanması
TAMPON ÇÖZELTİLER Prof.Dr.Mustafa DEMİR M.DEMİR 09-TAMPON ÇÖZELTİLER 1 Tampon çözeltiler Kimyada belli ph larda çözelti hazırlamak ve bunu uzun süre kullanmak çok önemlidir. Ancak bu çözeltilerin saklanması
Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı
 Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani madde yani bileşik
Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani madde yani bileşik
5.111 Ders Özeti #23 23.1
 5.111 Ders Özeti #23 23.1 Asit/Baz Dengeleri (Devam) Konu: Titrasyon Cuma günü ders notlarından Asidik tampon etkisi: Zayıf asit, HA, protonlarını ortamdaki kuvvetli bazın OH iyonlarına aktarır. Zayıf
5.111 Ders Özeti #23 23.1 Asit/Baz Dengeleri (Devam) Konu: Titrasyon Cuma günü ders notlarından Asidik tampon etkisi: Zayıf asit, HA, protonlarını ortamdaki kuvvetli bazın OH iyonlarına aktarır. Zayıf
İnstagram:kimyaci_glcn_hoca H A 9.HAMLE SULU ÇÖZELTİLERDE DENGE ASİT VE BAZ DENGESİ 2.BÖLÜM. kimyaci_glcn_hoca
 13 H A M L E D E 9.HAMLE SULU ÇÖZELTİLERDE DENGE ASİT VE BAZ DENGESİ 2.BÖLÜM ZAYIF ASİT VE ZAYIF BAZ İYONLAŞMA YÜZDESİ 0,1 M Kuvvetli Asit HBr 1. Her iki asit çözeltisinin hacimleri ve derişimleri eşit
13 H A M L E D E 9.HAMLE SULU ÇÖZELTİLERDE DENGE ASİT VE BAZ DENGESİ 2.BÖLÜM ZAYIF ASİT VE ZAYIF BAZ İYONLAŞMA YÜZDESİ 0,1 M Kuvvetli Asit HBr 1. Her iki asit çözeltisinin hacimleri ve derişimleri eşit
SIVILAR VE ÖZELLİKLERİ
 SIVILAR VE ÖZELLİKLERİ Sıcaklık düşürüldükçe kinetik enerjileri azalan gaz molekülleri sıvı hale geçer. Sıvı haldeki tanecikler birbirine temas edecek kadar yakın olduğundan aralarındaki çekim kuvvetleri
SIVILAR VE ÖZELLİKLERİ Sıcaklık düşürüldükçe kinetik enerjileri azalan gaz molekülleri sıvı hale geçer. Sıvı haldeki tanecikler birbirine temas edecek kadar yakın olduğundan aralarındaki çekim kuvvetleri
KİMYA II DERS NOTLARI
 KİMYA II DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN Sulu Çözeltilerin Doğası Elektrolitler Metallerde elektronların hareketiyle elektrik yükü taşınır. Saf su Suda çözünmüş Oksijen gazı Çözeltideki moleküllerin
KİMYA II DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN Sulu Çözeltilerin Doğası Elektrolitler Metallerde elektronların hareketiyle elektrik yükü taşınır. Saf su Suda çözünmüş Oksijen gazı Çözeltideki moleküllerin
İDEAL GAZ KARIŞIMLARI
 İdeal Gaz Karışımları İdeal gaz karışımları saf ideal gazlar gibi davranırlar. Saf gazlardan n 1, n 2,, n i, mol alınarak hazırlanan bir karışımın toplam basıncı p, toplam hacmi v ve sıcaklığı T olsun.
İdeal Gaz Karışımları İdeal gaz karışımları saf ideal gazlar gibi davranırlar. Saf gazlardan n 1, n 2,, n i, mol alınarak hazırlanan bir karışımın toplam basıncı p, toplam hacmi v ve sıcaklığı T olsun.
ÖĞRENME ALANI : MADDE VE DEĞĐŞĐM ÜNĐTE 5 : MADDENĐN HALLERĐ VE ISI
 ÖĞRENME ALANI : MADDE VE DEĞĐŞĐM ÜNĐTE 5 : MADDENĐN HALLERĐ VE ISI F- HAL DEĞĐŞĐM ISILARI (ERĐME DONMA VE BUHARLAŞMA YOĞUŞMA ISISI) 1- Hal Değişim Sıcaklıkları (Noktaları) 2- Hal Değişim Isısı 3- Hal Değişim
ÖĞRENME ALANI : MADDE VE DEĞĐŞĐM ÜNĐTE 5 : MADDENĐN HALLERĐ VE ISI F- HAL DEĞĐŞĐM ISILARI (ERĐME DONMA VE BUHARLAŞMA YOĞUŞMA ISISI) 1- Hal Değişim Sıcaklıkları (Noktaları) 2- Hal Değişim Isısı 3- Hal Değişim
Atomlar ve Moleküller
 Atomlar ve Moleküller Madde, uzayda yer işgal eden ve kütlesi olan herşeydir. Element, kimyasal tepkimelerle başka bileşiklere parçalanamayan maddedir. -Doğada 92 tane element bulunmaktadır. Bileşik, belli
Atomlar ve Moleküller Madde, uzayda yer işgal eden ve kütlesi olan herşeydir. Element, kimyasal tepkimelerle başka bileşiklere parçalanamayan maddedir. -Doğada 92 tane element bulunmaktadır. Bileşik, belli
PERİYODİK CETVEL Mendeleev Henry Moseley Glenn Seaborg
 PERİYODİK CETVEL Periyodik cetvel elementleri sınıflandırmak için hazırlanmıştır. İlkperiyodik cetvel Mendeleev tarafından yapılmıştır. Mendeleev elementleri artan kütle numaralarına göre sıralamış ve
PERİYODİK CETVEL Periyodik cetvel elementleri sınıflandırmak için hazırlanmıştır. İlkperiyodik cetvel Mendeleev tarafından yapılmıştır. Mendeleev elementleri artan kütle numaralarına göre sıralamış ve
DERS ÖĞRETĐM TEKNOLOJĐLERĐ VE MATERYAL GELĐŞTĐRME KONU ÇALIŞMA YAPRAĞI HAZIRLAMA (MADDELERĐN AYIRT EDĐCĐ ÖZELLĐKLERĐ)
 DERS ÖĞRETĐM TEKNOLOJĐLERĐ VE MATERYAL GELĐŞTĐRME KONU ÇALIŞMA YAPRAĞI HAZIRLAMA (MADDELERĐN AYIRT EDĐCĐ ÖZELLĐKLERĐ) DERS SORUMLUSU : PROF. DR. Đnci MORGĐL HAZIRLAYAN Mustafa HORUŞ 20040023 ANKARA/2008
DERS ÖĞRETĐM TEKNOLOJĐLERĐ VE MATERYAL GELĐŞTĐRME KONU ÇALIŞMA YAPRAĞI HAZIRLAMA (MADDELERĐN AYIRT EDĐCĐ ÖZELLĐKLERĐ) DERS SORUMLUSU : PROF. DR. Đnci MORGĐL HAZIRLAYAN Mustafa HORUŞ 20040023 ANKARA/2008
5.111 Ders Özeti #22 22.1. (suda) + OH. (suda)
 5.111 Ders Özeti #22 22.1 Asit/Baz Dengeleri Devamı (Bölümler 10 ve 11) Konular: Zayıf baz içeren dengeler, tuz çözeltilerinin ph sı ve tamponlar Çarşamba nın ders notlarından 2. Suda Baz NH 3 H 2 OH Bazın
5.111 Ders Özeti #22 22.1 Asit/Baz Dengeleri Devamı (Bölümler 10 ve 11) Konular: Zayıf baz içeren dengeler, tuz çözeltilerinin ph sı ve tamponlar Çarşamba nın ders notlarından 2. Suda Baz NH 3 H 2 OH Bazın
