Değerli Katılımcılar, 3. Zoonotik Hastalıklar Sempozyumuna hoş geldiniz.
|
|
|
- Si̇mge Özgür Eriş
- 7 yıl önce
- İzleme sayısı:
Transkript
1 1
2 Değerli Katılımcılar, 3. Zoonotik Hastalıklar Sempozyumuna hoş geldiniz. Bilindiği gibi zoonotik hastalıklar enfeksiyon hastalıkları içerisinde önemli bir yere sahip olup çok eski tarihlerden beridir çeşitli halk sağlığı sorunlarına yol açmaktadırlar. (DSÖ: Tüm insan patojenlerinin en az %61 i zoonotik karakterde, son on yıl süresince dünyada salgına neden olan bulaşıcı hastalıkların %75 ini zoonozlar oluşturmaktadır.) Her geçen gün de bu hastalıklara yenileri ilave olmaktadır. Buna ülkemizde daha önceden görülmeyen ve son yıllarda belirlediğimiz Kırım-Kongo kanamalı ateşi, Avian influenza, Pandemik H1N1 (domuz gribi) ve Hantavirüs enfeksiyonu ile son dönemde belirlenen Batı Nil Ateşi örnek olarak gösterilebilir. Bu nedenle de zoonotik hastalıkların önemi bir kez daha artmaktadır. Zoonotik hastalıklar yapısı itibariyle mücadelesi oldukça zor ve multidisipliner bir yaklaşım sergilenmeyi gerektiren hastalıklardır. Bu hastalıkların hem insanları hem de hayvanları etkilemesi nedeniyle kontrole yönelik eylemlerde hem hayvan ve hem de insan sağlığı ile ilgilenen kurum ve kuruluşların kararlılık göstermesi şarttır. Ülkemizde bu anlamda işbirliği içerisinde güzel çalışmalarda bulunulmuştur. Yakın zamanlarda da yaşanan ve ilgili kurum ve kuruluşlarla yapılan ortak çalışmalarla mücadelesinde başarılı olduğumuz zoonotik hastalıklar (Kırım- Kongo kanamalı ateşi, Avian influenza gibi) bu anlamda hatırlanmalıdır. Zoonotik hastalıklarla ilgili önemli çalışmalardan birisi de bu gün açılışını yaptığımız 3. Zoonotik Hastalıklar Sempozyumu gibi bilimsel kongreler, paneller ve sempozyumların organizasyonu ve karşılıklı bilgi alışverişi ve iş birliğinin güçlendirilerek faydalı bir tartışma ortamının oluşturulmasıdır. Bu bağlamda 3. Zoonotik Hastalıklar Sempozyumunun ülkemize ve milletimize hayırlı olmasını ve başarılı geçmesini temenni eder, düzenlenmesinde emeği geçen herkese teşekkür ederim. 2 Prof. Dr. Nihat TOSUN Sağlık Bakanlığı Müsteşarı
3 Değerli Meslektaşlarımız, İlki Kasım 2006 ve ikincisi Kasım 2008 tarihlerinde yapılan Türkiye Zoonotik Hastalıklar Sempozyumlarının büyük başarısını takiben bu yıl 1-2 Kasım 2010 tarihinde, III. Türkiye Zoonotik Hastalıklar Sempozyumunu gerçekleştireceğimizi bildirmekten ve sizleri sempozyuma davet etmekten onur duyuyoruz. Dünyada olduğu gibi ülkemizde de ciddi halk sağlık tehdidi oluşturan zoonotik hastalıklar konusunda sektörler arası işbirliğine duyulan ihtiyaç ortadadır. Bu etkinliğin temel amacı bir araya gelen tıp ve veteriner uzmanlarının bilgilerini ve güçlerini birleştirerek zoonozlara karşı duyarlılığın arttırılması ve ortak mücadele stratejilerinin belirlenmesidir. Bu yıl sempozyum esnasında Tularemi, Bruselloz, Kuduz, KKKA, Şarbon, Batı Nil ensefaliti ve Hantavirus konuları değerli bilim adamları ve uzmanlar tarafından ele alınacaktır. Katılım ve desteğinizle amacına ulaşacağına inandığımız III. Türkiye Zoonotik Hastalıklar Sempozyumu nda sizlerle birlikte olmayı diliyor ve saygılarımızı sunuyoruz. Sempozyum Başkanları 3
4 4
5 5
6 DÜZENLEYEN KURULUŞLAR TC Sağlık Bakanlığı Temel Sağlık Hizmetleri Genel Müdürlüğü (TSHGM) TC Sağlık Bakanlığı Refik Saydam Hıfzıssıhha Merkezi Başkanlığı (RSHMB) TC Tarım ve Köyişleri Bakanlığı Koruma Kontrol Genel Müdürlüğü (KKGM) Türk Veteriner Hekimleri Birliği (TVHB) Tü r k i y e E n f e k s i y o n H a s t a l ı k l a r ı v e K l i n i k M i k r o b i y o l o j i U z m a n l ı k Derneği (EKMUD) SEMPOZYUM BAŞKANLARI Dr.Vet.Hek. Mehmet ALKAN TVHB Başkanı Doç.Dr. Muzaffer AYDEMİR KKGM Genel Müdürü Dr. Seraceddin ÇOM TSHGM Genel Müdürü Doç.Dr. Mustafa ERTEK RSHMB Başkanı Prof.Dr. Haluk VAHABOĞLU EKMUD Başkanı DÜZENLEME KOMİTESİ Doç.Dr. Hürrem BODUR EKMUD Mik.Dr. İsmail CEYHAN RSHMB Uzm.Dr. Hasan IRMAK TSHGM Doç.Dr. Selçuk KILIÇ RSHMB Vet.Hek. Ahmet UYAR KKGM Prof.Dr. Hakan YARDIMCI TVHB BİLİMSEL SEKRETARYA B.Uzm.Dr. Ayşe ÖZKAN Tel: aysepeker.ozkan@rshm.gov.tr aysepekerozkan@gmail.com RSHMB GENEL BİLGİLER Sempozyum Web Sitesi: Sempozyum Merkezi: TOBB Üniversitesi Sosyal Tesisleri, Söğütözü Cad No: , ANKARA Sempozyum Tarihi: 1-2 Kasım 2010 Sempozyum Dili: Sempozyum dili Türkçe dir. Kredilendirme: Sempozyuma katılım Türk Tabipleri Birliği STE Kredilendirme Kurulu tarafından kredilendirilecektir. Davet Mektubu: Sempozyuma katılım için kurumlara verilmek üzere talep edilecek davet yazıları sempozyum sekretaryası aracılığıyla isteyen katılımcılara gönderilecektir. 6
7 KİTAPÇIK İÇİNDE YERALAN YAZILARIN BİLİMSEL İÇERİĞİNİN SORUMLULUĞU YAZARLARINA AİTTİR. 7
8 Tularemi: Etken ve Epidemiyoloji Doç.Dr. Aynur KARADENİZLİ Giriş Tularemi, Francisella tularensis bakterisinin neden olduğu bir zoonozdur. Bu bakteri insanlar, kemirgenler, tavşanlar için çok virulandır. Hem insanlar hem de hayvanlar da tularemi salgınlarına yol açabilir. Şimdiye kadar insandan insana geçiş tanımlanmamıştır. Farklı alttürleri nedeniyle hastalığın klinik özellikleri coğrafik dağılımla ilişkili değişiklikler gösterir. Kuzey Amerikada daha sık görülen F. tularensis alttür tularensis bilinenen en virulan bakterilerdendir. Türkiyede rastlanan alttürü daha iyi kliniğe sahip olan F. tularensis alttür holarctica dır. Toplum sağlığı problemi, laboratuvar infeksiyonu oluşturma riski, bir biyoteror etkeni olma potansiyeli nedeniyle F. tularensis infeksiyon hastalıkları arasında ayrı bir öneme sahiptir. Tarihçe McCoy 1900 li yılların başında bubonik veba benzeri bir hastalık olarak sincaplarda tularemiyi tanımlamıştır. Bakterinin izole edildiği yer (Tulare ilçesi, Kaliforniya) nedeniyle ilk önce Bacterium tularense olarak adlandırılmıştır. İnsanlarda tularemi hastalığı ilk defa Dr.Edward Francis tarafından 1922 yılında tanımlanmıştır. Bakteri konjunktivit ve lokal lenfadenopatisi olan bir olgudan izole edilmiştir. Bakterinin adı araştırıcının anısına Francisella tularensis olarak yeniden adlandırılmıştır. Tularemi, eski Sovyetler Birliği (2.Dünya Savaşı sırasında olgu) ve ABD de ( yıları arasında 1400 olgu) toplum sağlığı sorunu olarak kabul edilmiştir. Savaş gibi felaketlere bağlı olarak hijyen şartlarının bozulması, kırsal alanlarda kemirgen, kene, tavşanlarla temas olasılığının artması ile tulareminin görülme sıklığı daha da artar yıllarında savaşın yıktığı Kosovada ortaya çıkan, 327 olguyu içeren salgın buna örnektir. Yüksek infektivite özelliği, aerosollerde nispeten stabil olması, yayılımının kolay olması gibi özelliklerinden dolayı F. tularensis Soğuk Savaş döneminde Doğu ve Batı da birçok ülkede biyolojik savaş silahı olarak geliştirilmiştir. Mikrobiyolojik Özellikleri ve Taksonomi Tularemi hastalığının etkeni küçük, pleomorfik, hareketsiz, zorunlu aerob, fakültatif hücreiçi parazitliği gösteren, Gram negatif bir bakteridir. Bakteri 8
9 0,2-0,5µm eninde 0,7-1,0µm uzunluğundadır. F. tularensis toksin üretmez, ince lipopolisakkarid içeren bir zarfı vardır. Bu bakteri Proteobakterilerin gama-altsınıfında, Francisellaceae familyasında bulunur. Bu familyada tek cins olan Francisella cinsinde iki farklı F. tularensis türü vardır: F. tularensis ve F. philomiragia. F. tularensis in 4 alttürü vardır. Bunların virulansları, coğrafik dağılımları farklılık gösterir. 1. F. tularensis alttür tularensis, 2. F. tularensis alttür holarctica (eski adı palearctica), 3. F. tularensis alttür novicida, 4. F. tularensis alttür mediasiatica Alttürlerin genel özellikleri F. tularensis alttür tularensis (Jellison Tip A): Yüksek düzeyde virulandır. Kuzey Amerika da yaygındır. Genellikle yaz mevsiminde ve kenelere bağlı olarak ortaya çıkar. ABD de yılları arasında izole edilen suşlarda, Tip A izolatlarının 2 alt grubu tanımlanmıştır. TipA-doğu ve TipA-batı olarak tanımlanan bu alt grupların coğrafik dağılımı, hastalık sonucu ve geçiş yolları farklıdır. TipA-doğu ile infekte kişilerde tulareminin daha ağır seyrettiği belirtilmektedir. F. tularensis alttür holarctica (Jellison Tip B): Türkiye de salgınlara neden olan olan alttür holarctica daha az virulan özelliğe sahiptir. Başlıca sonbahar ve kış aylarında ortaya çıkar ve yayılım genelde kontamine su, kemiriciler ve yaşamı sırasında su ve su kaynaklarıyla bağlantısı olan hayvanlar aracılığıyla olur. Hastalık kene ısırığı, av eti yenmesi, hayvan ya da haşere ısırığı ile de geçiş gösterebilir. F.tularensis alttür holarctica nın 3 farklı biyovarı bulunmaktadır. Bunlar; eritromisine duyarlı olan biovar I, eritromisine dirençli olan biovar II ve biovar japonica dır. F. tularensis alttür mediasiatica: Kazakistan ve Özbekistan dan izole edilmiştir. Orta düzeyde virulansa sahiptir. 9
10 F. tularensis alttür novicida: İmmun yetmezlikli kişilerde hastalık oluşturur. Nadir görülen bu alttür düşük virulansa sahiptir. Patogenez F. tularensis in kapsülü bir virulans faktörüdür. F. tularensis kapsülü nedeniyle PNL tarafından yıkımı engellenir ve yapılan çalışmalarda kapsülü olamayan mutant F. tularensis canlı aşı suşu (LVS) normal insan serumu tarafından hemen öldürülür. Bakteri kapsülünün insan serumunun bakterisidal etkisine karşı koruyucu olduğu bu şekilde gösterilmektedir. Başka bir olası virulans mekanizması da polimorfo nüveli lökositlerdeki oksidatif yanma sırasında oluşan okside edici maddelere karşı bakterinin karşı koyabilme yeteneği kabul edilmektedir. Atenü LVS suşunun bu oksidanlara karşı çok duyarlı olduğu bilinmektedir. Vahşi (wild) suşlardaki gerçek virulans faktörü bu oksitleyicilere karşı dirençten sorumludur. Bunun mekanizması tam olarak bilinmemektedir. Kemirgen makrofajlarında fagozom-lizozom füzyonunda, fagozom asidifikasyonunda ve konak demiri kullanımında yetersizlik vardır. Bunun dışında F. tularensis in virulansından sorumlu bir patojenite adası (FPI) saptanmıştır. Bunun 4 open reading frame (ORF) içerdiği bulunmuştur. FPI genlerinden birisi alttür holarctica nın neden olduğu tip B hastalıkta bulunmamaktadır. Bu da iyi seyirli kliniğe sahip olan bu formda sözkonusu bakterinin bu gen eksikliği nedeniyle düşük virulansa sahip olduğunu desteklemektedir. Virulans özellikleri yanısıra bakterinin hücreiçi yerleşim göstermesi de patogenezde önem taşır. Yapılan çalışmalar, F. tularensis in makrofaj içinde başlangıç döneminde membrana bağlı bir fagozom içerisinde bulunduğunu ve üremenin ileri döneminde sitoplazmaya salındığını göstermektedir. F. tularensis in LVS aşı suşunun makrofaj içine girdikten sonra bazı proteinleri indüklediği gösterilmiştir. Bunlardan 23kDa ağırlığındaki Ig1C proteini özellikle artar. Bununla ilgili gen silindiğinde mutant suşun makrofaj içerisinde çoğalamadığı ve farelerde hastalık oluşturamadığı gösterilmiştir. Bakteri deriden girdikten sonra yerel olarak çoğalır ve bölgesel lenf nodlarına yayılır. Daha sonra karaciğer, dalak ve akciğer gibi organlara yayılır. Bu faz bakteriyemi ile birlikte oluşur. Tüm dokularda yoğun inflamatuvar yanıt oluşur. PNL infiltrasyonunu değişik düzeyde nekroz, MNL birikimi (Makrofaj ve T lenfositleri içeren) izler. Sonuçta epiteloid hücre, dev hücre ve kazeöz 10
11 nekrozla beraber granuloma formasyonu izler. Fulminan seyirli Tip A tularemisinde doku nekrozu çok yaygındır ve olguların çoğunda pnömoni vardır. Konakta oluşan yanıt prognozu belirler. Tip A, Tip B ye göre konakta çok hızlı çoğalır ve konak yanıtı oluşmadan öldürücü etki gösterir. RES hücrelerinde canlılığını sürdürür. Hücreiçi yaşam döngüsü F. tularensis potansiyel bir biyolojik silah ve olası biyoterorizm ajanıdır. Bu nedenle doğadaki yaşam döngüsü epidemiyolojik açıdan önemlidir. Kesin olarak doğal kaynağı bilinmemektedir. Legionella, mikobakteriler, klamidya gibi diğer hücreiçi yerleşim gösteren bakterilerin kaynağı olan protozoalar Francisella yönünden de araştırılmıştır. Çalışmalar Francisella bakterilerinin bir yıldan fazla süre suda yada çamurda kalabildiğini göstermektedir. Virulans mekanizmaları, konak hücre içerisinde nasıl yaşayabildiği tamamiyle çözümlenmiş değildir. İnsanlarda aşı yapımında kullanılan avirulan canlı aşı suşu (LVS) bakterinin hücre içi döngüsü yönünden araştırılmaktadır. Bu suşla ilgili yapılan çalışmalarda suşun makrofajın hücre içerisine çok iyi adapte olduğu ve fagozomlarda yaşadığı gösterilmiştir. LVS suşu fare makrofajları üzerinde sitopatojenik etki gösterir. Ayrıca LVS asidik vesikül içerisine yerleşir ve bir asid fosfataz salarak nötrofillerde oksidatif yanmayı inhibe eder. Ayrıca LVS suşu murin makrofajlarda apoptozisi indükler. Birçok epideminin suyla bağlantısı olması nedeniyle Acanthomoeba türleri gibi suda serbest yaşayan amipler kaynak ve taşıyıcılık yönünden araştırılmıştır. Bir biyofilmin parçası olarak serbest yaşayan amipler ve bakteri toplulukları karmaşık etkileşimler içerisindedir. Çalışmalarla Acanthamoeba castellanii li ortamda F. tularensis in canlı kalabilmesi ve üremesinin arttığı gösterilmiştir. Bu veriler heryerde bulunabilen protozoaların F. tularensis için önemli bir çevresel kaynak olabileceğini göstermektedir. Serbest yaşayan amiplerde bulunan legionella, listeria, bazı mikobakteriler endosimbiyontlar olarak protozoa içerisinde yaşamlarını devam ettirirler. Francisella ise bu cinslerden farklı olarak artropod parazitlere ve simbiyontlara yakın benzerlik gösterir. Keneler doğal kaynak değillerdir. Epidemiyoloji İnfeksiyon; kene, sinek, sivrisineklerin ısırması yada kontamine çevresel örneklerle temas sonucunda bulaşır. İnsanlarda hastalık başlıca dört yolla oluşur. 11
12 1. Artropod ısırıkları (major yol), 2. İnfekte hayvan yenilmesi, infeksiyöz hayvana ait doku yada sıvıların ellenmesi, 3. Kontamine su veya yiyecek yenilmesi, 4. İnfektif aerosollerin inhalasyonu (infekte çimlerin biçilmesi sırasında olduğu gibi). Tularemide insandan insana geçiş yoktur. Dünyada tularemi salgınları başlıca Kuzey Amerika, İsveç, Finlandiya, İspanya, Türkiye ve Kosova dan bildirilmiştir yılında İsveçte 270, Kosovada 327, 20.yüzyılda ABD de 1368 olgu (yıllık <200 olgu), yılları arasında Türkiyeden 507 olgu tanımlanmıştır. Türkiyede 2005 yılından itibaren bildirimi zorunlu bir hastalıktır ve yılları arasında yaklaşık 1300 olgu bildirimi yapılmıştır. Kaynaklar 1. Abd H, Johansson T, Golovliov I, Sandstrom G, Forsman M. Survival and growth of Francisella tularensis in Acanthamoeba castellanii.appl Environ Microbiol 2003;69: Centers for Disease Control and Prevention. Tularemia - Oklahoma 2000; Morbidity and Mortality Weekly Report 2000;50: Clarridge JE. Impact of 16S rrna gene sequence analysis for identification of bacteria on clinical microbiology and infectious diseases. Clinical Microbiology Reviews 2004;17: Clarridge JE, Raich TJ, Sjosted A et al.characterization of two unusual clinically significant Francisella strains. J Clin Microbiol. 1996;34: Ellis J, Oyston PC, Green M, Titball RW. Tularemia. Clin Microbiol Rev 2002;15: Fortier AH, Slayter MV, Ziemba R, Meltzer MS, Nacy CA. Live vaccine strain of Francisella tularensis: infection and immunity in mice. Infect Immun 1991;59: Sjostedt A. Francisella. In: Garrity G et al, eds. The Proteobacteria, Part B, Bergey s Manual of Systematic Bacteriology, New York, NY, Springer, 2005: Tarnvik A, Berglund L. Tularemia. The European Respiratory Journal 2003;21: Karadenizli A, Gurcan S, Kolayli F, Vahaboglu H. Outbreak of tularaemia in Golcuk, Turkey in 2005: report of 5 cases and an overview of the literature from Turkey. Scand J Infect Dis 2005;37:
13 TULAREMİ: LABORATUVAR TANI Dr.Vet.Hek. Bekir ÇELEBİ Tularemi, anamnez, klinik bulgular, bakteriyolojik ve serolojik testlere dayanılarak tanı konulan bir hastalıktır. Tularemi hastalığının tanısı, klinik örneklerden etkenin izolasyonu, serolojik yöntemlerle antijenik yapının veya antikor varlığının gösterilmesiyle, genetik yapısının moleküler yöntemlerle belirlenmesiyle konulmaktadır. Tularemi tanısına yönelik direkt ve indirekt tanı yöntemler kullanılmaktadır. Tanıya yönelik uygulanan testler A. Spesifik olmayan rutin laboratuar testleri, B. Etkene yönelik özgül tanı yöntemleri olmak üzere iki ana bölüme ayrılabilir. Tularemi şüpheli olgularda yapılan ilk tanısal işlem tam kan sayımıdır. Ancak, eritrosit sedimentasyon hızı (ESR) dışındaki inceleme parametrelerinin tanısal değeri yoktur. Akut Tularemi olgularında bir akut faz reaktanı olan C-Reaktif Protein (CRP) düzeylerinde artış saptanmaktadır. ETKENE YÖNELİK ÖZGÜL TANI YÖNTEMLERİ Klinik olarak Tularemi şüpheli olgunun tanısında, kullanılan yöntemler; 1. Etkenin direkt olarak gösterilmesi: Mikroskopi ve DFA 2. Moleküler teknikler ile bakteri DNA sının gösterilmesi. 3. Kültür 4. Serolojik tanı yöntemleri: A. Aglütinasyon testleri: 1. Tüp Aglütinasyon Testi 2. Mikro-aglütinasyon testi (MAT) B. Enzym Immunoassay (EIA-ELISA) C. İndirekt Floresan Antikor Testi (IFAT) D. Western-Blot (WB) Francisella tularensis bulaşıcı karakteri nedeniyle laboratuvar çalışmalarına özen gösterilmesi gerekir. Yüksek aerosol bulaş potansiyeli nedeniyle F.tularensis klinik örnekleren izolasyonu minimum Biyogüvenlik Düzey (BGD-2) güvenlik standardına sahip laboratuarda ve tüm işlemler sınıf II 13
14 biyogüvenlik kabininde yapılmalıdır. Dünya Sağlık Örgütü antibiyogram, biyokimyasal testler, antijen üretimi gibi yoğun bakteri üretiminin yapıldığı çalışmaları BGD-3 laboratuvarlarda yapılmasını önermektedir. Alınacak örnek Türleri F.tularensis in laboratuvar tanısında hastaya ait klinik örnek olarak tam kan, serum, solunum sistemine ait sekresyonlar ve boğaz sürüntüsü, konjunktival sürüntü, lezyondan sürüntü, lenf aspiratı, doku biyopsisi, otopsi materyali kullanılır. Klinik örnekler biyogüvenlik kurallarına uygun gönderilmelidir. Bogaz sürüntüsü ve konjunktival sürüntü taransport besiyerleriyle (tercihen aktif kömürlü Amies veya modifiye Thayer Martin besiyeri), serum, kan, lenf aspiratı ve doku örnekleri vidalı kapalı tüpler içinde üçlü taşıma kapları ile gönderilmelidir. Salgın araştırmasına yönelik olarak da memeli hayvanlara ait serum, lenf aspiratı ve otopsi materyali, kene ve sivrisinek gibi artropodlar, çevresel örnek olarak su, toprak, çamur, hayvan dışkıları kullanılabilir. Etkenin direkt olarak gösterilmesi: Mikroskopi ve DFA Tularemi tanısında farengeal yıkama, balgam, açlık mide sıvısı, konjonktival eksuda ve ülser gibi klinik örneklere Gram ve Giemsa boyama uygulanabilir. Gram preparatta F.tularensis, küçük, pleomorfik, zayıf boyanan ve genellikle tek tek yerleşmiş Gram-negatif kokobasiller şeklinde görülür,ancak Gram boyalı direkt preparatın tanıda değeri yoktur. Biyopsi gibi klinik örneklerde hızlı tanı amacıyla direkt floresan antikor (DFA) veya immünohistokimyasal boyama yöntemleri kullanılarak antijen aranabilir. DFA yöntemi izole edilen suşların doğrulanması amacıyla da kullanılmaktadır. DFA; CDC tarafından Tularemi şüpheli olguların tanısında bir ön tanı kriteri olarak kabul edilmektedir. DFA yöntemi; moleküler yöntemlere göre orta derecede duyarlılığa sahiptir (10 6 bakteri/mi) ve sadece bazı Referans merkezlerinde uygulanabilmektedir. Kültür Tularemi hastalığın kesin tanısı, klinik örneklerden F.tularensis in izole edilmesiyle konulmaktadır. Tanıda kültür altın standart olarak kabul edilmektedir. Kültür için klinik örnekler lenf aspiratı, boğaz, konjunktival ve yara sürüntüsüdür. Ancak, F.tularensis üreme için sülfidril bileşikleri (sistein, sistin, tiyosülfat ve isovitalex) içeren zengin besiyerlerine gereksinim duyan bir bakteridir. Bu amaçla; sistein suplementli agar (Çukolata agar, Thayer Mar- 14
15 tin agar, BCYE veya benzeri) Francis besiyeri, sistein kalp infüzyon agar, glukoz sistein kanlı agar gibi zenginleştirilmiş besiyerleri kullanılmaktadır. F.tularensis in zenginleştirilmiş besiyerlerine ihtiyaç duymasına rağmen, sistein-bağımsız suşların izolasyonu da nadiren bildirilmiştir. Etiyolojik ajanın bilinmediği durumlarda koyun kanlı agar, çikolata agar ve Thayer Martin agar ekimleri, bilindiği durumlarda ise sistein kalp infüzyon agar ekimleri yapılır C de tercihen aerofilik ancak ortamda artmış CO 2 varlığı üremeyi stimüle edebileceğinden %5 CO 2 li ortamda inkübe edilebilir. Bakterinin sistein gereksinimi nedeniyle ilk izolasyonda koyun kanlı agarda ürese bile takip eden pasajlarda üremez. Sistein içeren zenginleştirilmiş besiyerlerinde 24. saatlik inkübasyonda görülemeyecek kadar küçük gri-beyaz renkli opak koloniler oluşturur. 48 saatlik inkübasyonu takiben 1 2 mm çapında beyazdan gri veya mavimsi-gri renkli, opak, düzgün kenarlı ve parlak yüzeyli hafif mukoid görünümlü, kendine özgü kokusu olan, S tipinde koloniler gelişir. Koloni morfolojisi ile Haemophilus ve Actinobacillus ile karışabilir. Şüpheli kolonilerin F.tularensis anti serumu ile lam aglutinasyonu veya DFA tanıya yardımcı olur. Üreme gecikebileceği için vasatlar 10 gün süre ile etüvde tutularak incelenmelidir. Sıvı besiyerlerinde üremesi daha zordur. F.tularensis in identifikasyonda otomatize sistemler güvenilir değildir. Kan kültüründe etken nadiren üretilmiştir, ancak otomatize kan kültürü sistemleri izolasyon olasılığını arttırmaktadır. Floralı ve kontamine örnek ekimlerinde penisilin, sikloheksimid, polimiksin B gibi antibiyotikli besiyerleri tercih edilir. Seroloji Kültür işlemlerinin yüksek güvenlikli laboratuar ve deneyimli personel gerektirmesi nedeniyle günümüzde tularemi tanısında klinik ve çevresel örneklerden kültür yerine serolojik testler en sık kullanılan tanı yöntemidir. Serolojik yöntemler antikor varlığının araştırılması ve antijen aranması olarak ayrılabilir. Serum antikor seviyeleri genellikle ilk 10 günde tanısal seviyelere ulaşmadığı için antikor varlığının araştırılmasının erken tanıda değeri çok azdır. Tularemide antikorlar genellikle ikinci haftadan sonra pozitifleşir, 4 5. haftalarda en yüksek düzeye ulaşır ve yıllarca düşük titrede pozitif olarak kalırlar. Antijen olarak FopA, LPS, dış membran karbohidrat- protein fraksiyonu (OMP) ve ölü bakteri hücresi kullanılır. Oluşan antikorlar, aglütinasyon, mikroaglütinasyon ve ELISA yöntemleri ile kolaylıkla araştırılabilir. 15
16 Günümüzde serolojik tanıda genellikle tüp aglütinasyon veya mikroaglütinasyon (MAT) yöntemi sıklıkla kullanılmaktadır. MAT, tüp aglütinasyona göre daha duyarlı bir yöntem olarak kabul edilmektedir. Standart tüp aglütinasyonu hastalığın başlangıcında genellikle negatiftir. İkinci hafta % oranda pozitifleşir ve 4. hafta sonunda tepe seviyeye ulaşır. Bu nedenle, tek bir pozitif aglütinasyon sonucunun tanısal değeri sınırlıdır ve akut enfeksiyon tanısında 7-10 gün arayla alınan çift serum örneğinde dört katlık artışının gösterilmesi gerekir. Alınan tek bir serum örneğinin muhtemel tanıyı destekleyecek titresi MAT için 1:128 ve tüp aglütinasyonunda 1: 160 olarak kabul edilmektedir. Tularemi antikorları Brucella, Yersinia spp.ve Proteus OX19 ile çapraz reaksiyon verebileceğinden düşük titredeki pozitiflikleri yorumlanırken dikkatli olunmalıdır. Son yıllarda ticari olarak kullanıma giren ELISA testinde etkene karşı gelişen antikorlar MAT ine göre daha erken dönemde saptanabilmektedir. IFA ve ELISA gibi teknikler ile IgM ve IgG antikorları saptanabilmektedir. Ig subtiplerinin IFA veya ELISA ile saptanabilmesi bazı tanı konulamayan olgularda hastalığın dönemi konusunda bilgi verebilmektedir. Son yıllarda, Antilipoprotein 43 ve 17 kda a karşı oluşan antikorları saptayan Western Blot (WB) yöntemi geliştirilmiştir. Genellikle uygun epidemiyolojik anemnez varlığında MAT testi ile negatif çıkan olguların WB yöntemiyle araştırılması önerilmektedir. WB esas olarak tularemi tanısında karşılaşılan yalancı-negatifliklerin önlemek ve tanıyı Doğrulamak amacıyla kullanılmaktadır. Moleküler Yöntemler Kültürde kolonilerin en erken saatte görülmesi, bakteriyolojik incelemenin BGD-3 laboratuvar koşullarında uygulanabilir olması ve serolojik testlerin erken dönemde yararlı olmaması nedeniyle günümüzde F.tularensis i saatler içinde saptayan polimeraz zincir reaksiyonu (PZR) ön plana çıkmıştır. Ayrıca moleküler yöntemlerle tiplendirme çalışması yapılarak yeni alt türler belirlenebilir, alt tür izolatların birbirleri ile ilişkileri ortaya konularak epidemiyolojik verilere ulaşılabilinir. Kültürde üremelerden, hastaya ait lezyonlardan, aspiratlardan ve çevresel örneklerden elde edilen DNA lar kullanılarak PZR ile F. tularensis genomik segmentlerinin amplifikasyonu sağlanır. Yapılan çalışmalar PZR ın kültüre göre daha duyarlı bir yöntem olduğu gösterilmiştir. Bu yöntemin laboratuar personeli için güvenli olması bir diğer avantajıdır. PZR temelli metodlarda 16
17 F. tularensis e ait hedeflenen başlıca genler: tul4 (17 KDa lık dış membran proteinlerini kodlar) ve fopa (Dış membran proteinlerini kodlar) dır. Tul 4 geni tüm F.tularensis alttürlerinde olduğu için genus düzeyindeki tanımlama için oldukça iyi bir hedef bölgedir. F.tularensis alttürlerini saptamak amacıyla Farklılık Bölgeleri-Regions of Difference olarak tanımlanan hedef bölgelerini içeren moleküler yönem kullanılabilir. RD1 bölgesi kullanılarak dört alt türün ayırımı yapılabilmektedir. F. tularensis in alt türlerinin klinik özellikleri ve mortalite oranları farklı olması, biyoteror etkeni olma potansiyeli nedeniyle alttür ayırımı önemlidir. Alt türlerin ayrımında PZR ile RD1 ve pdp genindeki değişikliklere, ISFtu2 insersiyon sekans elementinin olup olmamasına bakılmaktadır. Alttür izolatların ayrımında ve epidemiyolojik verilerin elde edilmesinde Multi-locus variable-number tandem repeat analysis (MLVA) yöntemi de kullanılmaktadır. Son yıllarda jel-bazlı PZR sistemleri yerine DNA miktarındaki artışın eş zamanlı olarak izlenebildiği Real-Time PZR teknikleri tercih edilmektedir. Real-Time PZR yönteminde F.tularesis in tanısında kullanılan başlıca gen bölgeleri foba, ISFtu2, 23kDa, tul4 gen bölgeleridir. Real-Time PZR konvansiyonel PZR a göre daha hızlı ve duyarlılığı daha iyidir. 1. Bernard K, Tessier S, Winstanley J, Chang D, Borczyk A. Early recognition of atypical Francisella tularensis strains lacking a cysteine requirement. J Clin Microbiol 1994; 2: Broekhuijsen M, Larsson P, Johansson A, Bystrom M, Eriksson U, Larsson E, Prior RG, Sjostedt A, Titball RW, Forsman M. Genome-wide DNA microarray analysis of Francisella tularensis strains demonstrates extensive genetic conservation within the species but identifies regions that are unique to the highly virulent F. tularensis subsp. tularensis. J Clin Microbiol ;41(7): Johansson A, Forsman M, Sjöstedt A.The development of tools for diagnosis of tularemia and typing of Francisella tularensis Nov- Dec;112(11-12): Keim P, Johansson A, Wagner DM. Molecular epidemiology, evolution, and ecology of Francisella. Ann N Y Acad Sci Jun;1105:30-17
18 66. Epub 2007 Apr Porsch-Ozcürümez M, Kischel N, Priebe H, Splettstösser W, Finke EJ, Grunow R.Comparison of enzyme-linked immunosorbent assay, Western blotting, microagglutination, indirect immunofluorescence assay, and flow cytometry for serological diagnosis of tularemia. Clin Diagn Lab Immunol Nov;11(6): Sjöstedt A, Kuoppa K, Johansson T, Sandström G. The 17 kda lipoprotein and encoding gene of Francisella tularensis LVS are conserved in strains of Francisella tularensis. Microb Pathog. 1992;13: Versage JL, Severin DD, Chu MC, Petersen JM. Development of a multitarget real-time TaqMan PCR assay for enhanced detection of Francisella tularensis in complex specimens. J Clin Microbiol Dec;41(12): WHO Guidelines on Tularaemia. WHO/CDS/EPR/ Wong JD, Shapiro DS. Francisella, pp: In: Murray PR (eds), Manual of Clinical Microbiology. 1999,7th ed. ASM press, Washington DC. 18
19 KORUMA VE KONTROL Tulareminin Kontrolü İçin Sağlık Bakanlığınca Yapılan Çalışmalar Uzm. Bio. Sevtap BOSTANCI Şb.Md.Uzm.Bio.Sevtap BOSTANCI (Sağlık Bakanlığı, Temel Sağlık Hizmetleri Genel Müdürlüğü, Zoonotik Hastalıklar Daire Başkanlığı, Gıda Kaynaklı ve Bakteriyel Zoonotik Hastalıklar Şube Müdürlüğü,Ankara) Tularemi çok değişik klinik görünümlerle ortaya çıkabilen zoonotik, bakteriyel bir hastalık olup ülkemizde 2005 yılından itibaren Bulaşıcı Hastalıkların İhbarı ve Bildirim Sistemi nde C Grubu Bildirimi Zorunlu Hastalıklar Listesinde yer almaktadır. Son yıllarda bazı illerimizde yeniden önem kazanan zoonotik hastalıklardan biri olmuştur. Ülkemizin içinde bulunduğu coğrafik yapı, alt yapı eksikliklerinden kaynaklanan problemler ve genel hijyen uygulamalarındaki noksanlıklar hastalığın görülme sıklığını artırmaktadır. Özellikle su ve besin kaynaklarının enfekte rodent karkasları veya dışkılarıyla kontamine olmasıyla hastalık insanlarda görülmüştür. Ülkemizde sıklıkla tulareminin orofarengeal formu görülmekte olup 2009 yılında Bakanlığımıza 428 vaka bildirimi söz konusu olmuştur. Söz konusu vakaların teşhisi, ihtiyaç duydukları tedavi imkanlarının sunulması ve kaynakta hastalıkla mücadele çalışmaları yapılmıştır. Tularemi Vakalarının Yıllara Göre Dağılımı (Türkiye, ) Yıl Vaka Sayısı Ölüm /
20 Ülkemizde Batı Karadeniz ve Marmara Bölgelerinde yaygın olarak görülürken, 2009 yılı ve 2010 yılının ilk yarısında özellikle İç Anadolu Bölgesi olmak üzere diğer bölgelerden de vakalar bildirilmiştir yılının ilk altı aylık verilerine göre 32 ilde tularemi olguları görülmüştür. Tularemi Vakalarının İllere Göre Dağılımı (Türkiye, Ocak-Haziran 2010) Tulareminin önlenmesi ve doğru teşhis edilebilmesi için Bakanlığımızca 11 Nisan 2005 tarihli ve 5103 sayılı (2005/61) Genelge yayınlanmış ve içme ve kullanma suyu kaynaklarının ve depolarının ıslahının yapılması ile tularemi ayırıcı tanısında dikkat edilecek hususlar illerimize bildirilmiştir. 20
21 ilk epidemilerin tanımlanmasında kültür, seroloji ve hayvan inokülasyonu (fare, kobay) yöntemleri, sonraları uzun yıllar boyunca aglütinasyon testi kullanılmıştır yılından sonra tularemi tanısının konulmasında hem hastaya ait örneklerden hem de su, çamur ve kemirgen ölülerinden örneklerde Real Time PCR yöntemi kullanılmaya başlanmıştır. Bakanlığımızca Uludağ Üniversitesi Tıp Fakültesi ile Refik Saydam Hıfzıssıhha Merkezi Başkanlığı tularemi tanısını koymak üzere yetkilendirilmiştir. Tulareminin doğru teşhis edilebilmesi için öncelikle vakanın doğru olarak tanımlanması gerekmektedir. Bu nedenle tularemi alanında çalışma yapan araştırmacıların ve illerinde bu olası sorunla karşılaşan sağlık çalışanlarının bir araya getirilmesi, hastalık ve etkenle ilgili bilgilerin güncellenmesi ve olası sorunların çözümüyle ilgili görüş alış verişinde bulunulması amacıyla belirlenen illerde eğitim toplantıları düzenlenmiştir. Ülkemizde görülen epidemilerin özellikle su kaynaklı olduğu düşünülmektedir. Bu nedenle gerekli tedbirlerin alınması ve sağlık problemleri yaşanmaması için ilgili kurum ve kuruluşlarla işbirliği halinde çalışmalar sürdürülmektedir. Hastalıktan korunma önlemleri arasında özellikle enfekte hayvan ölüleriyle temaslı suların kullanılmaması veya dezenfekte edilerek kullanılması önemlidir. Sağlıklı içme ve kullanma suyu temin edilmelidir. Riskli bölgelerde yaşayanlara, avcılara veya hastane çalışanlarından risk altındaki kişilere tularemi hastalığından korunma yolları konusunda eğitim verilmelidir. 21
22 Dünya Sağlık Örgütünün tularemiden korunma önerileri aşağıdaki Tablo da gösterilmiştir 2 Orofaringeal Tularemi Kaynatılmamış suların içilmemesi Suyun klrolandıktan sonra kullanılması Su kaynakları ile vektör hayvanların temasının engellenmesi Yiyecek Kaynaklı Tularemi Gıda ambarlarının vektör hayvanlarla temasının engellenmesi Hayvan dışkısı ile kontamine olmuş gıdaların yenmemesi Yıkama sırasında oluşan aerosoller ve tozlar enfeksiyöz olabileceği için gıdaların dikkatli yıkanması Respiratuvar veya Ülseroglanduler Tularemi - Enfeksiyöz aerosoller, enfekte hayvanlarla direk temas ve artropodların ısrımasına karşı önlem alınması - Yabani tavşan gibi hayvanların avlanması ve etlerinin tüketilmesinden kaçınılması - Yabani ve evcil hayvanlarla temas sonrasında ellerin yıkanması - Salgın durumunda kedi köpek gibi evcil hayvanlarla yakın temastan kaçınılması, evcil hayvanların düzenli olarak hastalık belirtileri açısından takibinin yapılması - Özellikle çiftçi veya bahçıvanlar gibi enfekte toz ve aerosollere maruz kalan kişilerin maske kullanması - Kene gibi kan emen artropodlardan korunmak için uzun kollu ve paçalı giysiler giyilmesi ve kene kovucu repellent kullanılması - Endemik bölgelerde temas riski yüksek olan kişilere aşılama yap Kaynaklar 1. Gürcan Ş. (editör) Francisella tularensis ve Tularemi, Nobel Tıp Kitabevleri: İstanbul, WHO Guidelines on tularemia. WHO /CDS/EPR/ Zoonotik Hastalıklar Hizmetiçi Eğitim Kitabı, Ankara,
23 BRUSELLOZ OLGULARINDA HASTALIK YÜKÜ Prof. Dr. Ahmet KALKAN Ahmet KALKAN 1, Simten MALHAN 2 1. Karadeniz Teknik Üniversitesi Tıp Fakültesi, Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Anabilim Dalı, TRABZON 2. Başkent Üniversitesi, Sağlık Bilimleri Fakültesi, Sağlık Kurumları İşletmeciliği Bölümü, ANKARA Bruselloz ülkemizde görülen zoonotik enfeksiyonlar içinde önemli bir sağlık sorunu olarak yerini korumaktadır. Gelişmiş batı ülkelerinin çoğunda eradikasyonu sağlanabilmiş olmasına rağmen ülkemizde henüz endemik düzeyde devam etmektedir. Ciddi sağlık sorunları yanı sıra önemli ölçüde ekonomik kayıplara neden olduğu düşünülmektedir. Ülkemizde bruselloz için bu güne kadar yapılmış bir hastalık yükü çalışması yoktur. O nedenle hastalığın yol açtığı sorunları güncel sağlık ölçütleri ile ifade etme olanağımız mevcut değildir. Bu ölçütlerin hesaplanması için ülkemizden bildirilen literatür verileri yeterli değildir. İhtiyaç duyulan verilerin bir komisyon tarafından planlanması ve elde edilmesi gereği vardır. Bu yazıda, sağlık ölçütleri, hastalık yükü ve maliyet analizi ile ilgili temel kavramlar kısaca ele alınacaktır. Bruselloz mortalitesi düşük ancak morbiditesi yüksek bir hastalıktır. Nadiren ölümlere neden olur. Ancak komplikasyonlar, kronikleşme, relaps ve reenfeksiyonlar nedeniyle ciddi sağlık sorunlarına, iş kaybına ve yaşam kalitesinin bozulmasına neden olmaktadır. Günümüzde bunların ölçülebilmesi ve ölçütlerle ifade edilebilmesi olanağı vardır. Tıp eğitimi ve sağlık politikaları günümüzde yeni kavramlar ve ölçütler ile yapılandırılmakta ve yürütülmektedir. Tıp eğitiminde kanıta dayalı tıp eğitimi pek çok ülkenin kabul ettiği modern eğitim yöntemi olmuştur. Sağlık politikalarının belirlenmesinde de kanıta dayalı sağlık politikaları geliştirilmiş ve bu sayede toplumların sağlık statülerinin geliştirilmesi ve sağlık hizmeti sunumundaki eşitsizliklerin ortadan kaldırılması ve kaynakların toplumun ihtiyaçlarına göre önceliklendirilmesi amaçlanmıştır. Bu nedenle, sağlık 23
24 kaynaklarının dağıtımı sürecinde karar mekanizmalarına yardımcı olabilecek, bilimsel yöntemlerin geliştirilmesi büyük önem taşımaktadır. Zamana bağlı sağlık durumu ölçütleri konusunda son otuz yıldır süregelen bilimsel çalışmalar 1993 yılında tamamlanmıştır. Yayınlanan Küresel Hastalık Yükü (KHY) çalışması ile ortaya atılan hastalık yükü kavramı ve bu kavramın ölçütü olarak önerilen DALY ( Disability-Adjusted life year = Sakatlığa Ayarlanmış Yaşam Yılı) sağlık planlamacılarına, toplumsal sağlık gereksinimlerini daha geniş anlamda saptamayı olası kılan yeni bir yaklaşım sunmaktadır. DALY, bir kişinin erken ölmesi nedeni ile kaybetmiş olduğu yıllar ile herhangi bir rahatsızlığı nedeni ile sakat olarak sürdürdüğü yaşam yıllarının birlikte ifade edildiği bir ölçüttür. DALY, hem maliyet hem de sağlık etkilerinin birlikte kullanıldığı bir ölçüt olduğundan farklı sağlık müdahaleleri sonucu ilave sağlıklı bir yaşam yılı üretebilmek için gerekli maliyetlerin karşılaştırılmasına da yardımcı olmaktadır. Hem gelişmiş hem de gelişmekte olan ülkelerde, mortalitenin giderek azalması ve yaşam boyu değişik derecelerde işlev kaybına neden olan kronik hastalıkların giderek yaygınlaşması, önerilen bu hastalık yükü kavramının önemini daha da arttırmaktadır. Görüldüğü üzere, DALY erken ölümden doğan kaybedilen yaşam yılları, sakatlık ya da iyi olmayan sağlık durumundan dolayı sağlıklı yaşam yıllarının kaybını da kapsar. Bir DALY, Bir sağlıklı yaşam yılından kayıp anlamına gelmektedir. Her iki ölümcül ve ölümcül olmayan sağlık çıktılarının etkilerini içermesi için yaygın bir para birimi veya ölçüme ihtiyaç duyulmaktadır. DALY ler bugüne kadar geliştirilmiş pek çok diğer özet ölçümlerde olduğu gibi zamanı ortak bir para birimi olarak kullanmaktadır. Bruselloz, ölüm ve sakatlıklara neden olabilmektedir. Bruselloz için DALY bir sağlık çıktı ölçü birimi olarak hastalık yükünün ifade edilmesinde önemli bir parametre olarak kabul edilebilir. Günümüzde sorunun boyutunun doğru algılanması ve ileride kanıta dayalı sağlık politikalarının düzenlenmesi ve kaynakların akılcı olarak dağıtılmasında önemli bir veri niteliği taşımaktadır. Sağlık değerlendirme ölçümlerinden bir diğeri de QALYler (Qualty Adjusted Life Years = Kaliteye Ayarlanmış Yaşam Yılları) dir. QALYler sağlık müdahelelerinin etkinliğini ölçmek için kullanılmaktadır. QALYler yaklaşımında sağlık çıktılarını değerlendiriken birim olarak kaliteye ayarlanmış bir yaşam yılı kullanılır. QALYler; sağlık durumunun süresinin, sağlık durumunun kalitesini yansıtan bir fayda değeri ile çarpılmasına dayanır. Sağlık durumları; belirli semptomlara veya bireyin fiziksel yetilerinde kronik bozukluklar gibi genel 24
25 işlevlere dayanır. Puanlamada önemli bir sorun; değerlendirmenin kimin tarafından yapılacağıdır. Uzmanların, sağlık profesyonellerinin, etkilenen kişilerin ya da genel nüfusun fikri alınabilmektedir. Bruselloz olgularında yaşam kalitesinin etkilenebileceğini düşündüğümüzde QALYler ölçütünün de DALY ölçütü kadar önemli bir değerlendirme olduğunu söyleyebiliriz. Birbirleri ile yarışan sağlık müdahalelerini değerlendirebilmek için kullanılan bir diğer yaklaşım ise QALY başı para birimi değerlendirmesidir. QALY başı para birimi ; QALYler etkinlik tahminini parasal değere dönüştürerek müdahaleleri maliyet ve QALY cinsinden değerlendirerek QALY başına TL olarak değerlendirme şansına sahiptir. Dolayısıyla sağlık müdahaleleri değerlendirebilmek için ilk adım maliyet verisine ulaşmak yani Hastalık Maliyeti ni hesaplamak olmaktır. Hastalık maliyeti (Cost of illness-coi), karşılaşılan bir sağlık problemiyle ilgili olarak kullanılacak olan kaynaklar için harcanan veya kaçınılmaz olarak katlanılan değerler olarak tanımlanabilir. Oluşacak hastalık durumu ile ilgili yapılması kaçınılmaz olan tüm masraflar, maddi veya manevi harcamalar olmasına bakılmaksızın hastalık maliyeti kavramını oluştururlar. Maliyetler doğrudan veya dolaylı maliyetler şeklinde olabilmektedir. Doğrudan maliyetler tıbbi olabileceği gibi, tıbbi olmayan doğrudan maliyetler de vardır. Bunlara örnek olarak evde tıbbi bakım hizmetini verebiliriz. Dolaylı maliyetler ise hastalıktan ötürü gerçekleşen işgünü kayıpları, erken emeklilik, erken ölümden dolayı hastanın ve çevresinin katlanmak zorunda olduğu maliyetleri temsil etmektedir. Bir hastalık için tıbbi giderler hastalığın tanısından başlar ve hastanın iyileşmesine veya ölümüne kadar devam eder. Bir hastalığın tanısı, tedavisi ve izlenmesinde ortalama bir hasta için getirilen yaklaşım ve hesaplamalar genellenebilen sonuçlar verebilir. Sağlık sorunlarının çözümü, herhangi bir hastalıkla ilgili olarak uygulanacak yöntemlerin belirlenmesi ve yapılacak seçimlerin hangi yöntemle ilgili olması gerektiği gibi pek çok konuda karar verebilmek için, çeşitli hastalıklar karşısında katlanılmak zorunda olunan ekonomik yükü bilmek gerekir. Hastalık maliyetinin belirlenmesinde, müdahale maliyetlerini hesaplanmasında izlenilen metodolojiye benzer sistematik adımlar kullanılır. Bunlar; maliyet analizini tasarlamak, maliyet envanteri oluşturmak ve maliyet analizi sonuçlarını hesaplamak şeklindedir. Ülkemizde bruselloz için yapılmış herhangi bir hastalık maliyeti çalışması yoktur. Bu konuda sağlıklı bir çalış- 25
26 manın yapılabilmesi, ulusal düzeyde bruselloz olguları için yapılan sağlık uygulamalarının doğru yansıtılması ile mümkündür. Hastalık maliyeti çalışmalarında kullanılan maliyet envanterini direk, dolaylı ve ölçülemeyen-manevi maliyetler oluşturur. Direk maliyetler; bir hastalığın bakımı, iyileştirilmesi ve o hastalıktan korunmak için bireyler, sigorta kurumları veya devlet tarafından harcanan paradır. Direk hastalık maliyetleri, medikal malzemelere ve servislere (ilaç, doktor vizitleri ve hastane masrafları) harcanan parayı oluşturur. Genellikle direk maliyetler, direk tıbbi ve direk tıbbi olmayan maliyetler olarak sınıflandırılır. Bu sınıflandırma kaynağın direk olarak tedavide kullanılıp kullanılmadığına bağlıdır. Maliyetlerin karşılanmasında sağlık sektörü ve hane halkının yükleri söz konusudur. Sağlık Sektörü maliyetleri; hastane yatış masrafları, ilaç masrafları, ambulans ile taşıma ve bakım masrafları, ayaktan tedavi ve poliklinik masraflarıdır. Hane Halkı Maliyetleri ise; hastane ve medikal malzeme için cepten yapılan harcamalar (sigorta var ise katkı payları), hastane ve medikal malzeme için cepten yapılan harcamalar (sigorta var ise katkı payları), ilaç masrafları (sigorta var ise katkı payları), hasta ve ailesinin hastaneye ulaşım masrafları, bakıma muhtaçlar için bakım masrafları ve hastalığa bağlı olarak evde yapılabilecek değişiklikler şeklinde özetlenebilir. Dolaylı maliyetler; hastalık, sakatlık veya erken ölümlerin yol açtığı toplumsal maliyetlerdir. Dolaylı maliyetlerin hesaplanmasında kullanılan yaklaşım İnsan-sermaye yaklaşımı human-capital approach, kişinin hastalığı dolayısıyla erken ölmesi sonucunda veya sakatlığı veya hastalığından ötürü kaybolan üretim bedelidir. Bu yaklaşımın en çok tartışılan noktası, insan sermayesi yaklaşımını, o bireyin kazancıyla ölçmesidir. Bunun için gereken veri ise her zaman her toplumda bulunamayabilir. Bir başka yaklaşım ödemeye istekli olma - Willingness to pay yaklaşımıdır. Bu yaklaşımda iki farklı yöntem vardır. İlkinde bir senaryo oluşturularak bireyden (hastalanmadan veya sakatlanmadan, bunların olduğu varsayması istenerek) belirli bir sağlık/hastalık konumuna ilişkin tercihini belirtmesi istenir. İkincisinde ise birey yaşam içinde izlenerek tercihleri gözlenir. Ancak bunun uygulanması zor ve pahalıdır. Riski etkileyebilecek küçük değişikliklerin değerini hesaplayamamak, toplumdaki tüm bireylerin refah içinde yaşıyor olmalarının varsayılması yöntemin olumsuz yönlerini oluşturmaktadır. Dolaylı maliyetler sadece hastanın değil ailelerin ve onlara bakan 26
27 aile üyelerinin kaybedilmiş üretim ve kazançlarını içermektedir. Manevi Maliyetler; Hastalığın neden olduğu ağrı, mutsuzluk, sıkıntı, ızdırap, stres gibi faktörlerin maliyetidir. Hesaplanmalarının olanaksızlığı nedeniyle çalışmalarda dikkate alınmazlar. Maliyet analizi hesapları; veri ve metodolojik kısıtlamalar nedeniyle, literatürdeki Hastalık Maliyeti-COI çalışmalarının çoğu, direk, indirek veya görünmeyen maliyetlerin temsil ettiği tam ekonomik hastalık maliyetlerinin sadece bir kısmını tahmin etmektedir. Bu bağlamda maliyet analizlerinde bir hastalığın tedavisi için yapılan tüm müdahalelerin maliyetleri ilk temel verilerdir. Her müdahalede, müdahalenin sunulması için gerekli olacak hizmet birimlerine ihtiyaç olacaktır. Bu nedenle, bir müdahalenin maliyeti aşağıda belirtilen parametreler konusunda bilgi elde edilerek hesaplanabilir: a. Müdahaleyi sunabilmek için gerekli olan sağlık hizmetlerinin birim maliyeti (C) b. Müdahale için gerekli her bir hizmet türünün miktarı (V) c. O hizmet için sağlık kurumuna başvuran kişi sayısı (n) Notasyonları kullanarak ülkedeki j (Mj) müdahalesinin toplam üretim maliyeti şu şekilde gösterilebilir: M j = s i= 1 C V ij ij n ij Yukarıdaki eşitlikte i hizmet düzeyleri ile (birinci basamak sağlık ocağı, hastane, vb.) j müdahalesi için ihtiyaç duyulan gerekli hizmetler gösterilmektedir. Denklemde s-türde uygun hizmetin bulunduğu varsayılmaktadır. J müdahalesinin üretiminde hizmetlerden bazılarına ihtiyaç duyulmuyorsa, V nin değerleri sıfır olacaktır. Cowley ve arkadaşları, müdahale maliyeti hesaplamalarının klinik rehberlere dayandırılması gerektiğini belirtmektedirler. Klinik rehberler bir ülkede mevcutsa bu rehberler hesaplamalarda doğrudan kullanılabilir. Aksi halde, 27
28 bu rehberlerin elde edilmesine yönelik girişim diğer bir alternatif yaklaşım olarak karşımıza çıkmaktadır. Cowley ve diğerleri müdahale maliyetleri hesaplamalarının klinik kılavuzlara dayandırılması gerekliliğinin üzerinde durmaktadırlar. Klinik kılavuzlar eğer ülkede klinisyenler tarafından yayınlanmış ise direk kullanılabilirler aksi taktirde alternatif yaklaşım kılavuzların oluşturulması yönündedir. Bruselloz akut, subakut ve kronik bruseloz olmak üzere farklı klinik tablolara neden olabilmektedir. Komplikasyonsuz akut bruselloz olgularından meningoensefalit, endokardit gibi ağır seyirli olgulara kadar değişen çok farklı klinik tablolar nedeniyle farklı klinik ve polikliniklere başvurular söz konusu olabilmektedir. Ülkemiz için brusellozun müdahele maliyeti; - Her bir klinik veya polikliniğin kullanılış yüzdeleri uzman görüşlerinden - Klinikleri ve poliklinikleri kullanan hasta oranı uzman görüşlerinden - İlaç günlük kullanım dozları uluslararası kılavuzlardan ve literatürden - Kullanılan tıbbi malzemeler hastane faturalarından - Klinik ve poliklinik fiyatları - SUT - Laboratuvar ve görüntüleme testleri fiyatları - SUT - Tıbbi malzeme fiyatları - SUT - İlaç fiyatları - İlaç Eczacılık Genel Müdürlüğü nden alınarak hesaplanabilir. Bruselloz kendini sınırlayan bir enfeksiyon değildir. Tıbbı, nadiren de cerrahi müdahele gerektirir. Müdahele maliyetlerinin standart ölçütlerle yapılması konunun mali boyutunun doğru tanımlanması için kaçınılmazdır. Yakın gelecekte ülkemizde brusellozun hastalık yükü çalışmalarının tamamlanacağını beklemekteyiz. İlgili ölçütlerin hesaplanması ile brusellozun eradikasyonu çalışmalarının, bruselloz olgularına uygulanacak müdahele planlamalarının ve sorunun büyüklüğünün tartışıldığı bilimsel platformlardaki terminolojinin önemli ölçüde güncelleneceğini düşünmekteyiz. 28
29 KAYNAKLAR: 1-Cowley P, Bodabilla L, Musgrove P, Saxenian H. Content and Financing of an Essential National Package of Health Services, Global Assessments in the Health Sector, World Health Organization, 1994, Lopez A, Mathers D, Ezzati M, Jamison D, Murray C. Measuring the Global Burden of Disease and Risk Factors , NCBI, Mikolich DJ, BOyce JM. Brucella species. In: Mandell GL, Douglas RG, Bennett JE (eds). Principles and Practice of Infectious Diseases. Thrid edition. New York: Willey Medical Publications, 1990: Öksüz E., Malhan S. Sağlığa Bağlı yaşam Kalitesi: Kalitemetri, Başkent Üniversitesi Yayınları, Rice D. Cost of illness studies: what is good about them? Inj Prev 2000;6: doi: /ip Sağlık Bakanlığı Refik Saydam Hıfzıssıhıa Merkezi Başkanlığı Hıfzıssıhha Mektebi Müdürlüğü Ulusal Hastalık Yükü ve Maliyet Etkililik Projesi, Segel J. Cost of Illness RTI international,
30 Dünya da Brusellosis Eradikasyon Programları ve Ülke Modelleri Prof Dr Osman ERGANİŞ Selçuk Üniversitesi Veteriner Fakültesi Mikrobiyoloji Anabilim Dalı, Kampus 42075, Selçuklu/Konya Özet Dünya da, Avrupa da ve komşu ülkelerde brusellosis kontrol ve eradikasyonuna yönelik faaliyetlerin temel uygulama ve stratejileri değerlendirilmeye çalışılmıştır. Hayvanlarda brusellosis vakalarının artmasını müteakiben insanlarda da brusellosis artmaktadır. Ülkelerin sosyoekonomik, kültürel ve coğrafik durumları, kontrol ve eradikasyon çalışmalarını etkilemektedir. Değişik ülkelerde uygulanan eradikasyon programlarının dizayınında, en önemli kriter; epidemiyolojik veriler olmakla birlikte, aşılamaksızın test ve kesim aşılamaksızın test ve imha genç hayvanlarda aşılama ile birlikte test ve kesim, sadece genç hayvanları aşılama, yaygın aşılama / mass vaccination ile enfeksiyonu kontrol altına aldıktan ve makul seviyelere indirdikten sonra, test ve kesim gibi farklı uygulamalar yapılmaktadır. Tüm bu işlemlerde erken uyarı sistemi kurulması, sıkı laboratuar tanı desteği, vektör ve hayvan hareketlerinin kontrolünün yeni bulaşma ve yayılmaların önlenmesinde önemli olduğu anlaşılmaktadır. Ülkeler, kendi (ekonomik, coğrafik, veteriner servisin yeterliliği, epidemiyoloji verilerin durumuna, vs) durumlarına göre ulusal brusellosis kontrol ve eradikasyon planı hazırlamaktadır. Plan uygulamaya konduktan sonra, başarı için merkezi otorite tüm paydaşlarla birlikte sürekli değerlendirmeler yaparak çalışmalıdır. Giriş Brusellosis dünyada oldukça yaygın olan zoonoz hastalıkların başında gelmektedir(erganiş ve Uçan 2010, OIE 2008). Akdeniz ülkelerinde insan ve hayvanlarda endemik olan brusellosis, Asya, Afrika ve Latin Amerika da yaygın bir zoonozdur (OIE 2008). Brucella cinsindeki bakteriler genetik birbirlerine oldukça benzer olmakla birlikte Yersinia enterocolitica O9, bazı Salmonella ssp ve E.coli ler ve Ochrobactrum anthropi ile genetik ve antijenik benzerlikler bilinmektedir (Erganiş ve İstanbulluoğlu 2002, Leal- Klevezas ve ark 2005). Hayvancılığın ilkel şartlarda yapıldığı, etkin koruma 30
31 tedbirlerinin uygulanmadığı ülkelerde, yeterli ısıl işlem görmemiş et ve süt ürünleri ile, atık fetuslar ve genital akıntılarla insanlara ve hayvanlara bulaşmaktadır (WHO 1999). Hayvanlardan insanlara bulaşmadaki önem sırasında göre Brucella melitensis (koyun-keçiden), B. abortus (sığırdan), B. suis (domuzdan) ve B. canis (kedi-köpekten) olarak sıralanabilir (Lee ve ark 2009, Pappas ve ark 2006, Roth ve ark 2003). Bu türlerin dışında, koçlardan izole edilen B. ovis, kemirgenlerden rat vb- izole edilen B. neotomae ile deniz memelilerinden izole dilen Brucella pinnipediae ve Brucella cetaceae bulunmaktadır. Bunlardan son ikisinin insanlara bulaştığına yönelik veri ortaya konmamıştır. Avrupa Birliği nde; Almanya, Belçika, Danimarka, Finlandiya, Hollanda, İngiltere, İrlanda, İsveç ve Lüksemburg brusellosisten ari ülkelerdir. Fransa nın 7 bölgesi ile İspanya nın 2 bölgesi eradike durumdadır. Halen Fransa, İspanya, Portekiz, İtalya, Yunanistan ve Kıbrıs Rum kesiminde AB destekli koyun-keçi brusellosis eradikasyon programları yürütülmektedir. Ermenistan, Azerbaycan, Irak, Suriye, Arnavutluk, Makedonya, Bosna-Hersek ve Sırbistan da brusellosis yaygındır (Benkirane 2006, Taleski ve ark 2002). Brusellosis ile mücadelede, hayvan hareketlerinin kontrolü, erken uyarı sistemi ile brusellosis vakalarının bildirimi, aşılama, bağışıklığın izlenmesi, ari sürülere sertifika verilmesi ve ariliğin sürdürülebilmesi için sürüye yeni hayvan girişlerinin kontrollü ari sürülerden olması, tüm bu işlemler sırasında sanitasyon kurallarına uyulması gerekir (2008/341/EC). En önemlisi, akut brusellosis vakalarının % 100 tazminat ile imha edilerek, bakteri saçımının durdurulmasıdır (Ireland 2010). Amerika Birleşik Devletleri (ABD) brusellosis eradikasyonu çalışmalarına seroprevalans %11.5 iken 1934 yılında mevzuat düzenlemeleri başlamış, 1954 yılında sığır brusellosisi için kongreden ödenek alınarak başlanılmış sve hastalık epidemiyolojik olarak 1957 yıllından itibaren belirgin olarak azaltılmış ve 2000 yılında (Ragan 2002, Olsen 2010) 50 eyaletin tümü brusellosisten ari hale getirilmiştir (Şekil-1). Ancak yaban hayatındaki bizonlar, elkler ve domuzlar, insan ve hayvan sağlığını tehdit etmektedir (Olsen 2010). Kore de, son yıllarda sığır (özellikle besi danaları) ve insan brusellosisinde hızlı artışlar gözlenmektedir (Lee ve ark 2009). 31
32 İnsan ve Hayvan Brusellosisi Arasındaki İlişki Bu konuda birçok araştırma olmakla birlikte 2 ülke -İtalya ve Yunanistanörnekleri üzerinde durulacaktır. Şekil-1. ABD de sığır brusellosisi eradikasyonunun yıllarındaki seyri (Ragan 2002) İtalya da yılları arasındaki koyun-keçi brusellosisi üzerinde retrospektif yapılan çalışma sonuçlarına göre (Şekil-2), kuzulama sezonu ve süt kuzusu (mart-nisan) kesimleri dikkate alınarak değerlendirildiğinde, insan brusellosis vakalarının mayıs-ağustosta arttığı, tespit edilmiştir. İkinci dönem yetişkin kuzu kesimlerinin yaygın olduğu kasım-ocak aylarında ise insan vakalarının artmadığı rapor edilmiştir (De Massis ve ark 2005). Şekil-3 İtalya da yıllarında kuzu kesimleri ile insan brusellosisi insidensi arasındaki ilişki. A. İkinci dönem kuzu kesimi ve insidens artışı, B. Erken kuzu kesimleri, C. İnsan brusellosisinde beklenen artışlar (De Massis ve ark 2005). 32
33 Şekil-3. İtalya da 2002 yılında insan brusellosisi insidensi ile koyun-keçi brusellosisi prevalansı arasındaki ilişki (De Massis ve ark 2005). Yunanistan da, 1975 yılında başlayan koyun-keçi brusellosisi eradikasyon programının etkisi ile hayvanlardaki azalışa paralel olarak insanlarda da azalış gözlenmiştir. Bu başarıdan sonra 1994 yılında aşılamadan vazgeçilmiş, eradikasyon test ve kesim ile sürdürülmeye başlanmıştır. Eradikasyon planının uygulamasındaki bazı esneklikler birkaç yıl içerisinde hayvan brusellosisinde artışa yol açmıştır (Şekil-4). Hayvanlardaki artış insan brusellosisinin artmasına sebep olmuştur (Minas ve ark 2004). 33
34 Şekil-4. Yunanistan da 1975 ten 2002 yılına kadar insan brusellosisin insidensi ile hayvanlarda aşılama arasındaki korelasyon (Minas ve ark 2004) B r u s e l l o s i s i n A k d e n i z Ü l k e l e r i n d e k i D u r u m u v e E r a d i k a s y o n Programları Sığır brusellosisi birçok ülkede vardır. İnsidensi, ülkeler arasında ve kendi içinde değişik oranlarda değişmektedir. Bazı ülkelerde tam olarak eradike edilmiştir. Hastalık Afrika, Orta Doğu, Orta ve Güney Amerika da ve gelişmekte olan ülkelerde önemli tehlike oluşturmaktadır. ABD de yaklaşık 50 yıllık bir eradikasyon çalışmasından sonra, bir eyalet dışında tüm bölgelerden eradike edilmiştir. AB ülkelerinden, Kuzey İrlanda, Yunanistan, İspanya, İtalya ve Portekiz de ulusal brusellosis eradikasyon projeleri yürütülmektedir. Sığırlarla birlikte koyun-keçi yetiştiriciliği yapılan ülkelerde sığırlarda B. melitensis e bağlı brusellosis görülebilmektedir (Alverez ve ark 2010). İspanya: Sığır brusellosisi kontrol ve eradikasyon programı 1978 yılında başlamış olmasına rağmen gerçek anlamda etkin mücadele çalışmaları 1990 ların ortalarından (süt ineklerinde ve besi hayvanlarında) itibaren başlamıştır da ülkesel prevalans % 6.59 iken 1997 de %2,58 e düşürülmüştür. Bunun üzerine planda bazı -ek epidemiyolojik çalışmalar yapılmadan aşılamanın yasaklanması gibi- değişikliklere gidilmiş, ancak 2001 yılından itibaren özellikle ekstensif yetiştirilen besi hayvanlarının sürü prevalansı (SP) nda önemli artışlar görülmüştür. İspanya nın kuzeyinde ve batısındaki işletmelerde salgınların merkezi durumundaki bölgelere RB51 aşısı ile yaygın aşılama, çevre bölgelere ise ring aşılma uygulama yaparak 34
35 te SP %30-47 iken 2009 yılında % 0 a, BP % 0.05 e indirilmiştir (Şekil-5). Başarıda hayvan hareketlerindeki sıkı kontroller ve biyogüvenlik tedbirleri ile etkin ve hızlı tanı sistemlerini kullanılmasının ve yaygın aşılama uygulamaları ile en önemlisi bunları sağlamadaki paydaşlar arası işbirliği ile sürekli durum analizlerinin yönetimi etkili olmuştur (Sanz ve ark 2010). İspanya AB destekli, koyun keçi brusellosisi eradikasyon planı da uygulamaktadır (Spain 2007). Şekil-5. İspanya da sığır brusellosisi salgınında aşılama ve başarı verileri (Sanz ve ark 2010). İsrail: İsrail de B. abortus 1985 te resmi olarak eradike edilmiştir. Veteriner servis, 2-6 aylık dişi buzağıların SC yolla S19 aşılanmasını ve aynı zamanda sörvelansı sürdürmüşlerdir de sporadik olarak sütçü işletmelerde B.melitensis biyotip 3 tespit edilmiş, diğer işletmelere yayılmaya başlamış ve yıllarında B.melitensis biyotip 1 daha baskın olmaya başlamıştır. Sığırlarda eradikasyon faaliyetleri test ve kesim ile sürdürülürken, çevredeki kuzu ve oğlaklara Rev-1 aşılaması yapılarak sürdürülmüştür (Refai ve ark 2002, WHO 1998). 35
36 İtalya: 1992 yılından beri brusellosis eradikasyon çalışmalarını sürdüren İtalya da, OBF (resmi olarak brusellosisten ari) sürülerde senede bir kere, diğer sürüler ise senede 2 kere serolojik testlerle brusellosis yönünden taranmaktadır yıllarındaki koyun keçi verilerine göre 20 bölgede sürülerin % taranmıştır. Pozitif bulunan hayvan oranları, 2005 yılında % 2.99, 2006 yılında % 2.16 ve 2007 yılında % 2.06 dır. Sicilya adasında ise 2003 yılında hayvanların % 9 u pozitif iken 2007 yılında % 6 sı pozitiftir (Italy, 2007). Klinik olarak brusellosis görülmemekle birlikte serolojik olarak brusellosis pozitiftir (OIE WAHID 2009). Kıbrıs: Kıbrıs Rum Kesimi (KRK) nde, yıllarında, aşı kullanmadan 13 yıl süreyle test ve kesim yapılarak uygulanan başarılı bir eradikasyon programı (WHO 1998) sonunda sığır brusellosisinin eradike edildiği, 1998 yılına kadar hastalığın görülmediği, li yıllarda hastalığın tekrar görülmeye başladığı, 2001 de tekrar eradikasyon projesi başlatıldığı ve 2007 yılı sonu itibarı ile toplam 330 sürüde sığır bulunan KRK de sığır brusellosisin eradike edildiği, toplam 3439 sürü ve koyun-keçiden oluşan küçük baş brusellozunun ise 2000 yılından itibaren arttığı, 2004 te prevalansın % 7 ye kadar çıktığı ve nihayet 2007 yılı sonu itibarı ile % 0.1 olduğu rapor edilmiştir (Cyprus Report, 2009). Kıbrıs Türk Kesiminde (KKTC), OIE ye resmi brusellosis bildirimi olmamakla beraber, Tarım ve Doğal Kaynaklar Bakanlığı için, AB kaynaklı Hayvancılık Projesi kapsamında hem sığırlar hem de koyun-keçiler için brusellosis kontrol ve eradikasyon planları hazırlanmıştır (Erganiş ve ark 2009a, Erganiş ve ark 2009b). Mısır: Mısır da sığır, buffalo, koyun, keçi, deve, domuz, at, eşek ve katırlarda brusellosis endemik olup, enfeksiyondan sorumlu en yaygın brucella etkenleri; B. melitensis, B. suis ve B. abortus tur. At-merkep-katır brusellosisinin, insan ve diğer hayvanlara brusellaların bulaşmasında potansiyel kaynak olabileceği ileri sürülmektedir. Tesadüfi örnekleme yöntemi ile yapılan bir serosörvey çalışmasında, atların % 5.88 i, eşeklerin % ve katırların %71.42 si pozitif bulunmuştur. Kontrol programı stratejisi, genç hayvanların (koyun keçi, buzağı, manda) aşılanması ile test ve kesim temeline dayanmaktadır. 6 ayın üzerindeki tüm hayvanlar, her 6 ayda bir serolojik olarak test edilmektedir. Pozitif veya şüpheli hayvanlar kesilmektedir. Lokal veteriner servis hayvan sahiplerine tazminat ödemektedir. Enfekte çiftlikler veya sürüler karantinaya alınmakta, periyodik olarak dezenfekte edilmektedir. Her 3 haftada bir serolojik olarak test uygulanmakta, üst üste 3 kere 36
37 negatif bulunan sürüler, hastalıktan ari olarak deklare edilmektedir. Genç hayvanlar, aşılama öncesinde serolojik olarak test edilmektedir. Bu kontrolle sırasında enfekte/reaktör olarak tespit edilenler de mevcut yasalara göre tazminatlı olarak kesilmektedir. Sağlıklı buzağı ve manda yavruları 3-7 aylık yaşta S-19 aşısıyla, sağlıklı kuzu ve oğlaklar ise 3-6 aylık iken Rev.1 aşısı ile aşılanmaktadır. (Banai 2002, WHO 1999). Şekil-6. Akdeniz ve Ortadoğu Bölgesi ülkelerinde insan brusellozisi (enfekte insan/ insan). Portekiz: Koyun-keçi brusellosisi eradikasyonuna 1998 yılında başlanmıştır yılında hayvanın ünü serolojik kontrolden geçirilmiş ve hayvan seropozitif (BP %2.73) bulunmuştur. Aynı yıl sürüden i (SP % 8.76) brusella pozitif olarak rapor edilmiştir yıllarında genç ve ergin hayvanlara konjuktival yolla yaygın Rev-1 aşılaması yapılmış, sonraki yıllarda sadece gençler aşılanmıştır yılında SP % 1.6 ya, BP ise % 0.52 ye düşürülmüştür (Portugal 2007). Portekiz de, Azor adalarında yılları arasında B. abortus RB51 aşılaması ile birlikte test ve kesim uygulanarak 5 yıllık bir sürede sığır busellosisi eradikasyonu hedeflenmiştir (Martin ve ark 2009). 37
38 Şekil-7. Portekiz in koyun-keçi brusellosis eradikasyon programının yıllarındaki sürü ve hayvan prevalans verileri (Portugal 2009) Suriye: Ülkede bruselosis endemik olup, hayvanlarda yaygın olduğundan insan vakaları da artmaktadır (1993 te 1391, 1997 de 6991) da RBP ve CF testleri kullanılarak random sample yöntemle toplanan hayvan örnekleri ile yapılan bir sörvey çalışmasında, sığırlarda % 2,86 (12554 hayvan), köy sığırlarında % 7,83 (1827), koyun ve keçilerde %1,81 (26755 hayvan) bulunmuştur.1995 yılında, Rev 1 ve S19 aşılama temelli, yılda tamamlanması beklenen bir ulusal brusellosis eradikasyon planı hazırlanmış, kaynak bulunamadığından başlatılamamıştır. Bu sebeple, brusellosis kontrol çalışmaları, standart koruyucu tedbirlerle (karantina, sütlere ısıl işlem, abortlarda fetus ve plasenta vs imhası gibi) sürdürüldüğü rapor edilmiştir(who 1999). 38
39 Şekil-8. Bölgede sığır brusellosisinin durumu (Kırmızı: Brusellosis olan ülkeler, yeşil: Ari ülkeler, beyaz: Veri olmayan ülkeler) (OIE, 2007) Türkiye: Türkiye de, ulusal bruselosis kontrol ve eradikasyon programını 1984 yılında başlatmıştır. Program uygulama ve başarı 26 yıl üzerinden planlanmıştır. Gerçekleştirilecek planın stratejisi, 4-8 aylık yaştaki tüm dişi buzağıların S-19, kuzu ve oğlakların Rev-1 ile aşılanması üzerine kurulmuştur. Tazminatlı test ve kesim planlanmamıştır yılında brusellosisi prevalansı sığırlarda ve koyun-keçilerde sırası ile %3,56 ve %1,26 iken, 1990 da, %1,2 ve %2.02, 1991 de %1.01, %1,83 bulunmuştur de sığırlar için %1.43, koyunlar için % 1.97 dir. Brusellosis in sürü prevalansı sığırlarda % 11.4, koyun-keçilerde ise % 15 tir (İyisan 2006, WHO 1999). Türkiye nin tarihinde, OIE ye gönderdiği verilere göre, 675 odakta 1854 vakada, sığır brusellosisi çıkmış, 1827 kesim, 21 ölüm ve 6 imha yapılmış; 2866 ring aşılama uygulanmış ve toplam hayvan aşılanmıştır. 39
40 Türkiye, nisan 2009 tarihinde yayımladığı sığır brusellosisi yönetmeliğine göre; isteğe bağlı arilik çalışmalarını yürütmekte, hastalık çıkışlarında tazminatlı kesim uygulamaktadır. Sağlık Bakanlığının verilerine göre 2002 yılında , 2003 yılında ve 2004 yılında kişide brusellosis bildirilmiştir. İnsanlarda brusellosis insidensi 1998 de de 11.2 iken, 2004 yılında de 26.1 dır. Yunanistan: Aşı kullanmaksızın, test ve kesim uygulaması ile yıllarındaki çalışmalarla adalardan hastalığı eradike etmiştir. Yarımadadan adalara hayvan girişini yasaklamıştır. Sadece aşılama uyguladığı yarımadada, test ve kesim uygulamadan enfeksiyonu oldukça azaltmasına rağmen tümden eradike edememiştir te insan brusellosis (B.melitensis) vakalarındaki artışlardan sonra yaygın aşılama uygulamaya başlamış, % 30 luk aşılama oranlarına ulaştıktan sonra insan vakalarında belirgin azalma gözlenmeye başlamıştır (Jelastopulu ve ark 200, Minas ve ark 2004, Taleski ve ark 2002) te % 5 olan sürü prevalansı, 2007 de % 3.04 e gerilemiştir. Yunanistan da, B. melitensis in baskın olduğu alanlarda, sığırlara Rev-1 aşısı kullanılmıştır (EU 2003). Makedonya: İnsanlarda, yılları arasında 45 vaka bildirimi olurken, son yıllarda artış göstermiş ve 1992 yılı brusellosis 44.2/ (907 vaka) ile en yüksek yıl olmuştur.bu durum koyun-keçi brusellosisinin artışı ile oldukça ilişkili bulunmuştur. Makedonya da insan brusellosis vakalarının mevsimsel (kasım ayında % 1.7 iken mayıs ayında %17.9 haziran ayında %16.5) olduğu rapor edilmiştir. Hayvanlarda, 2001 yılında 914 köyden toplam koyun test edilmiş, 134 köyde (sürü prevalansı-sp % 14.66) ve toplam 3938 koyunda (bireysel prevalans-bp %0.56) brusellosis tespit edilmiştir. Keçilerde ise, 2001 yılında SP % 9.01, BP %1.22, sığırlarda ise SP % 5.6, BP %0.3, bildirilmiştir (Taleski ve ark 2002). İzole edilenler genellikle B. melitensis biyotip 2 ve biyotip 3 olarak tanımlanmıştır yılına kadar Sağlık Kurumlarındaki uygulamalardan dolayı bildirim yapılmamış ve eradikasyon çalışmalarında başarı elde edilememiştir. Makedonya, aşılama yapmadan, test ve kesim stratejisi uygulamaktadır. Tüm hayvanların sağlık kontrolleri yapılarak eradikasyon çalışmalarını sürdürmektedir(taleski ve ark 2002). Bulgaristan: 1941 yılından beri brusellosisis ten ari olarak bilinmektedir (OIE WAHID 2010) yıllarında sadece 2 insanda brusellosis ra- 40
41 por edilmiştir. Yoğun olarak yaban domuzu ve sokak köpekleri bulunan bazı bölgelerde B. suis biyotip 2 ve B. canis izole edilmiştir (Taleski ve ark 2002) yılında Türkiye sınırındaki 3 köyde toplam 5 keçi 3 sığır ve 1 eşekte brusellosis tespit edilmiş ve itlaf edilerek kontrol ve eradikasyona çalışılmıştır. Bulaşma kaynağı olarak komşu ilkelerden yapılan kaçak hayvan ticareti olabileceği ileri sürülmüştür (Bulgaria 2007). Hırvatistan: Hırvatistan 1961 den 1990 a kadar brusellosisten ari idi yılından itibaren ilk olarak koyunlarda B. melitensis salgını görülmüş, sonra keçilerde (B. melitensis ve B.suis) ve domuzlarda (B.suis) görülmüş ve insan vakalarında da önemli artışlar gözlenmiştir. Keçiler ile domuzlardaki brusellosis artışının yaban domuzlarından kaynaklandığı ileri sürülmüştür(taleski ve ark 2002). Sırbistan: yıllarında 578 koyun ve keçide, 5 sığırda, 111 domuzda, 5 köpekte ve 5 eşekte brusellosis tespit edilmiştir yılında, veteriner ve medikal kontroller, finans, mevzuat, gibi tüm katılımcıların etkili katılımı ile -aşılamaksızın- 10 yıllık bir kontrol ve eradikasyon planı başlatılmıştır (Taleski ve ark 2002). Diğer Bazı Ülkelerdeki Koyun-Keçi Brusellosisi Kontrol ve Eradikasyon Çalışmaları Cezayir, 1995 yılında keçilerde test ve kesim ve hayvan hareketlerini kısıtlama yaklaşımı ile bir program başlatmış, 3 yıl sonra başarılı bulunmamıştır. Yaygın aşılama temelli yeni bir program başlatmışlardır. Tunus, 1991 de epizootik brusellosisin yayılmasını durdurmak için konjuktival yolla Rev-1 aşısı ile yaygın aşılama kullanılmıştır. Fas, 1996 da epizootik durumdan çıkmak için ülkenin batısında aşılama yapmıştır. Bu sebeple, ülkenin geri kalan kısmında epidemiyolojik bir sörvey gerçekleştirmiş küçük ruminantlarda brusellosis bulunmadığı tespit edilmiştir. İran, intensif yetiştirme uygulanan sürülere 1983 yılında RBPT ve SAT ile serolojik kontrol ve kulak numara sistemi başlatmış, pozitif hayvanlara kesim uygulanmış ve hayvan sahiplerine tazminat ödenmiştir. Ayrıca genç hayvanlara Rev-1 aşılaması yapılmış, bu uygulamalar, 1983 te %3.2 iken 1996 da % 0.5 e düşürülmüştür. İran da, ekstensif yetiştirilen sürülerde genç hayvanlara Rev-1 aşılaması yapılmıştır. Seropozitif hayvanlar sürüden alınmamıştır. Seropozitiflik 1994 te %3 iken 1998 de % 2.2 ye düşmüştür. Kuveyt 1993 te normal Rev-1 aşısının 1/50 si kadar düşük doz aşı ile SC yolla yaygın aşılama kampanyası başlatılmış ve 41
42 yılına kadar risk altındaki populasyonun % 75 ine kadar aşılanarak yürütülmüştür (Benkirane 2006). Aşılama ve Duyarlılık Brusellosise karşı duyarlılık erişkin hayvanlarda daha yüksektir. Genç hayvanlar genellikle Brucellosise dirençlidir. Brusellalara karşı direnç gelişimi üzerinde kazanılmış bağışıklığın önemli bir etkisi vardır. Bu sebeple, prevalansın yüksek olduğu ülkelerde, sığırların B.abortus S19 ve/veya RB 51 aşıları, koyun-keçilerin ise B. melitensis Rev.1 ile aşılanarak enfeksiyonun insidensi ve prevalansı azaltılır (Benkirane 2006, Yingst and Hoover 2003). B. abortus S19 ve RB51 aşıları, sığırları B. melitensis e karşı korumamaktadır. Bu sebeple B. melitensis e bağlı atık tespite edilen sığır sürülerine Rev- 1 aşısı kullanılır. Brusellosise karşı bağışıklıkta sellüler bağışıklık humoral bağışıklıktan daha etkindir. Bu sebeple brusellosisten korunmada canlı aşılar kullanılmaktadır(carvalho Neta ve ark 2010, Yingst and Hoover 2003). Eradikasyon Planlarının Temel Aşamaları Enfeksiyonun gerçek durumunun ortaya konması için epidemiyolojik çalışmalarla, sürü insidensi (Sİ), sürü prevalansı (SP) ve hayvan-bireysel prevalans (BP) verileri belirlenir. Durum ortaya konulduktan sonra, zoonotik, ekonomik, veteriner servis yetkinliği vb durumlar dikkate alınarak hangi yöntemlerin kullanılacağına karar verilir. Seçilen yöntemlere göre yapılacak uygulamaların ulusal ekonomiye katkıları dikkate alınarak ekonomik analizi yapılır. Eradikasyon planının uygulamasında veteriner servis merkez yönetiminde paydaşlarla birlikte izleme ve değerlendirmeler yapılır. Muhtemel varsayımlar ve bunlar gerçekleştirilmediğinde ne gibi risklerle karşılaşılacağı ortaya konur (Şekil-9). 42
43 Şekil-9. Kontrol ve Eradikasyonun Planlarının temel Aşamaları Şekil-10. Brusellosis Kontrol ve Eradikasyonunda Strateji Seçimi (EU 2001) 43
44 Planların Özü: Strateji Belirlenmesi Strateji belirlenmesi için öncelikle hastalığın prevalansının tespiti gerekir. Proğramın başında etiyolojik sörveyans çalışmaları ile aborte fetuslardan etkenin (B. abortus, B. melitensis, B.suis, B.canis) durumu belirlenir. Serolojik sörvelans çalışmalarla sürü prevalansı (SP) ve bireysel prevalans (BP) sonuçlarına göre strateji (plan seçimi, aşı tercihi, vs) yapılır. B. melitensis çıkan sığır sürülerine B. melitensis Rev-1 aşısı uygulanmalıdır (Banai 2002, Refai ve ark 2002 ). Rev-1 aşısı pratikte yıllarca SC yolla enjeksiyon enjeksiyonla uygulanmıştır. İspanya, Macaristan ve Türkiye gibi bazı ülkelerde göze damlatılarak-konjuktival yolla- uygulanan Rev-1 aşısı üretilmiştir (Erganiş ve ark 2009). Koyun-keçi brusellosisi kontrol ve eradikasyon proğramı uygulayan ve kısa sürede yaygın aşılama yaparak kontrolde başarılı sonuçlar alan ülkelerde konjuktival Rev-1 aşısı tercih edilmiştir (Benkirane 2006, Blasco, 2006, Neto ve Vaz 2002, Stournara ve ark. 2007). Yeni atık yapan akut- brusellosisli hayvanların sürüden uzaklaştırılması ile yeni enfeksiyonların çıkışı arasında önemli korelasyon tespit edilmiştir (Stringer ve ark 2008). Bu sebeple hayvan hareketlerinin kontrolü eradikasyonun başarısında çok önemli bir uygulamadır. Eğer, ülkede brusellosis var ve veteriner servis yeterli değilse (Şekil-9, Tablo-1), yaygın aşılama uygulanır (EU, 2001). Yaygın aşılama ekstensif yetiştiricilik yapılan işletmelerde ara verilmeksizin hastalık çıkışları minimize edilinceye kadar sürdürülmelidir. İlk yıl tüm hayvanlar sonraki yıllarda sadece genç aşılama olabileceği gibi her yıl tüm hayvanlar aşılanarak ta sürdürülebilir (Benkirane 2006). Hastalık prevalansı yüksek ise ekonomik durum ve veteriner servis yeterli olsa bile hastalığın öncelikle kontrol altına alınması gerekir. Bunun başarılabilmesi içinde yaygın aşılama ile populasyonda bağışıklık sağlanarak kontrol altına alınır. Hatta bir süre test ve kesim işleminden bile vazgeçilir. Hayvan hareketleri kontrol edilir. Eğer bu aşamada depopulasyon ile kontrol altına alınmaya çalışılır ve hayvan hareketleri de kontrol edilemez durumda ise, programın başarı şansı oldukça düşüktür. Ülke ekonomisi için makul, bir seviyeye ( % 1-2) çekildikten ve populasyondaki sürülerin önemli bir kısmında (> % 75-80) bağışıklık sağlandıktan sonra test ve kesim e geçilir (Tablo-1) (Benkirane 2006, EU 2001). 44
45 Hastalık prevalansı oldukça düşük, veteriner servis ve finans desteği yeterli ise test+kesim ile eradikasyon sürdürülür (EU 2001, EC 2009). Hastalık prevalansı, test ve imha / kesim (EC 2004) için uygun değerlere düşürülen ülkelerde, proje sonlarına doğru, proje yönetiminin, saha ekiplerinin, yetiştiricilerin ve bakanlık sorumlularının eradikasyon projesini işini sıkı tutmamaları, hastalığın tekrar artmasına sebep olmaktadır (Sheahan ve ark. 2006). Tablo-1. Brucella Kontrol Stratejilerinin Avantaj ve Dezavantajları (EU 2001) Strateji Avantajlar Dezavantajlar -İnsanlara bulaşmayı azaltır -Gebe hayvanlarda aşıya bağlı -Sürü bağışıklığı kısa sürede sağlanır düşüklere sebep olabilir -Hastalığın etkin bir şekilde kontrolü sağlanır ve hastalığa bağlı kayıpları azaltır -Hasta hayvanlar ile aşılı hayvanların birbirinden ayrılması kısa dönemde mümkün değildir -Üreticiler tarafından kolay kabul edilir -Organize etmesi kolaydır ve ekonomiktir Yaygın -Hasta hayvanlar bir süre daha -Genç hayvanların aşılanması ile sürü bağışıklığı Aşılama sürü içinde kalır sağlanabilir Genç hayvanların aşılanması ve Ergin hayvanların test ve kesimi Aşılama yapılmadan Test ve Kesim -Aşıya bağlı düşükler en alt seviyededir -Hasta olmayan aşılı hayvanlardaki serolojik yanıt hasta hayvanlarla aşılı hayvanların test ile ayrımına olanak sağlar -Başarılı olursa hastalığın bölgede elimine edilmesi ile sonuçlanır. -Aşısız hayvanlarda tanısal testler daha etkindir ancak yine de optimal değildir. -Sürü bağışıklığı yavaş sağlanır -Aşılı-enfekte hayvanların birbirinden ayrımı için kullanılan serolojik testler optimum değildir. Tek bir hayvanda hastalığın kesin tanısı için dayanak teşkil etmez -Salgın ve bunu takiben insan enfeksiyonları riski -Yüksek maliyet -Etkili çalışan VS zorunludur (Hayvan tanımlama ve kayıt, Laboratuvar desteği, Hayvan hareketlerinin kontrolü) -Sadece hastalık prevalansının düşük olduğu yerler için uygundur -Aşılamanın sağladığı koruyuculuğun kaldırılması hastalık prevalansının artmasına neden olabilir -Etkili olması için tüm sürünün kesimi gerekebilir 45
46 Avrupa Birliği mevzuatlarına göre kontrol ve eradikasyon planı hazırlanmasının kriterleri aşağıda (90/424/EC ve 2008/341/EC) özetlenmiştir. Eradikasyon programı aşağıdaki kriterleri karşılamalıdır (90/424/EC): 1- Hastalık hakkındaki epidemiyolojik durumu ortaya koymalıdır /tanımlamalıdır. 2- Programın masraf/ fayda analizi yapılmış olmalıdır. 3- Programın amaçları, süresi ve tamamlandıktan sonraki kazanımları tanımlanmalıdır. 4- Programın tamamlanmasından sorumlu merkezi ve yerel kurumların koordinasyon ve kontrolünden sorumlu merkezi yetkili belirlenmiş olmalıdır. 5- Programın uygulanacağı coğrafik ve idari alan sınırları tanımlanmalıdır. 6- İlgili alandaki şüpheli veya tanısı konmuş hastalık salgınlarının bildirimini sağlayan bir sistem olmalıdır. 7- Programa ilişkin hastalıktan etkilenen veya bulaşan hayvanların hayvan hareketleri konusunda kontrol prosedürleri ve özel kurallar tanımlanmalıdır. 8- Program dahilindeki işletmelerin (holdings) kayıt sistemi olmalıdır. 9- Hayvanların orijinlerinin tanımlanmalıdır 10- İşletmeler ve bölgelere uygulanacak değişik durumlar (örneğin; sığır brusellosisi için B1 B2, B3, B4) ile söz konusu hastalıktan etkilenen veya kontamine olan işletmelerin statü kaybı/durumlarının bölgeler veya işletmeler arası hayvan hareketlerinde neler uygulanacağı gibi durumların tanımlanmış olması gerekir. 11- Gerekirse, hastalık için kullanılacak örnekleme ve test metodları ile analizlerinin tanımlanmalıdır. 12- Epidemiyolojik verilerin ve hastalığa özgü koruyucu yöntemlerin ışığında; program dahilinde gerçekleştirilen kontrollerde pozitif (testlere göre pozitiflik ölçüleri) bulunanlara neler uygulanacağı, ne gibi tedbirler alınacağı, gibi ölçüler, hastalığın hızlı ve güvenli bir eradikasyonunu sağlamak için programda açık bir şekilde ortaya konmalıdır. Örneğin: A- Hastalıktan süpheli veya bulaşmadan şüpheli durumlarda olan hayvanların kesimleri için; karkasların imhası veya işlemden sonra insan tüketimine yönelik uygulamalar ile bu uygulamaların halk ve/veya hayvan sağlığına etkileri veya etin tüketilmesi durumunda insan sağlığına herhangi bir zararı olmayacağına yönelik veriler garantiler belirtilmelidir. 46
47 B- Hastalığı bulaştıran tüm ürünlerin (karkas süt deri vs) imhası veya ürüne uygulanacak işlemin her türlü muhtemel bulaşmadan koruyacağını açıklanmalıdır. C- Enfekte işletmelerin dezenfeksiyon için yapılacak işlemler tanımlanmalıdır. D- Terapotik veya koruyucu işlemler seçilmelidir (2001/82/EC). E- Kesimle depopulasyon uygulanmış işletmelere restoking -sağlıklı hayvan temini- yapılacağı belirtilmelidir. F- Enfekte işletme çevresindeki sörvelans zonu kriterleri tanımlanmalıdır. 13- Gerekirse, kesilen hayvanlar için, yetiştiricilere /hayvan sahiplerine ödenecek -yeterli miktarda ve mümkün olduğunca hızlı bir şekilde - tazminat verme kuralları belirlenmelidir. 14- Merkezi yetkili otorite (4. maddede belirtilen) tarafından görevlendirilen program sorumlusu, gelişmeleri AB komisyonunun ilgili birimlerine düzenli ve tam bir şekilde raporlandırmalıdır. Monitoring Programı için Kriterler 1-Eradikasyon programında belirtilen 1-9, 12, 13 ve 14. maddelerde belirtilen kriterler 2-Hastalığın serolojik, mikrobiyolojik, patolojik veya epidemiyolojik analizlerini veya hastalığa uygun diğer yöntemlerin analizini temel alan bir monitoring sistemi 3-Epidemiyolojik özelliklerinin ışığında hastalığın olmadığının/yokluğunun/ eradike edildiğinin bilimsel olarak gösterilmesine yönelik bir sistem tanımlanmalıdır. Ulusal Eradikasyon Kontrol ve İzleme Programlarında Temel Kriterler (2008/341/EC) 1-Programın Amacı: Eradikasyon programının amacı 90/424/EEC Komisyon kararının Ekinde belirtilen zoonozlardan veya hayvan hastalıklarından olmalıdır. Eradikasyon programının final hedefi, hastalıktan ari liğe veya resmi olarak hastalıktan ari liğe yönelik olmalıdır. Diğer tüm mevzuatlarla da uyumlu olmalıdır. 2-Uygulanacağı Coğrafya: Program tüm ülkeye uygulanabilmeli, sınır ötesi bulaşan durumlarda diğer ülkelerle işbirliğini de içermelidir. 47
48 3-Süresi: Program yıllar üzerinden planlanmalıdır. Yıllık uygulamalarla insidens veya prevalansta ne gibi uygulamalar yapılarak ne kadar azalma hedeflendiği ve bu gelişmelere bağlı olarak programın kaç yıl süreceği belirtilmelidir 4-Hedefleri: Programın hedefleri, programın bitiş tarihi ile eradikasyona erişilebilecek şekilde oluşturulmalıdır. Eğer program bir yıldan fazla sürecek ise ortalama başarılara göre en az yıllık kazanım hedefleri oluşturulmalıdır. En uygun indiaktörler olarak (örneğin insidens mümkünse- prevalans), hedef hayvanların sağlık kaliteleri ve epidemiyolojik üniteler (sürü, işletme, ahır vs) seçilmiş olmalıdır. Gerektiğinde tanımlamalar verilmelidir. 5-Uygulama ölçüleri/kriterleri: Bildirimi zorunlu hastalık olmalı, varsa rezervuarları veya vektörlerinden asıl hayvanı koruma ölçüleri tanımlanmalı, (akuatik, kümes hayvanları, yaban hayvanları dışındaki) tüm hedef hayvanlar kimliklendirilmiş olmalı ve tüm epidemiyolojik birimler (mesela sürü, ahır, işletme vs) kayıtlı olmalıdır. Buralardaki hayvan hareketleri kontrol ve kayıt altına alınmalıdır. Epidemiyolojik kontrollerde kullanılacak testler ile bunların enfekte sağlıklı ve şüpheli kriterleri açık olarak tanımlanmalıdır. Kullanılacak aşı/aşılar belirtilmelidir. Aşı, AB standartlarında güvenlik testlerinden geçmiş olmalıdır (2001/82/EC) 6-Yönetimi: Program merkezi veteriner otoritenin kontrolü altında olmalıdır. Programın başarılı tamamlanabilmesi için her bir veteriner servisin ve paydaşın yetki ve sorumluluğu açık olarak tanımlanmalı ve açık bir yönetim zinciri (kimin kime karşı ve ne şekilde sorumlu olacağı vs) belirtilmelidir. Tüm program sürecindeki finans personel ve ekipman kaynaklarının sağlanacağının garanti edilmesi gerekir. Programın düzenli işlemesi programın etkili ve yetkili bir şekilde izlenmesi, değerlendirilmesi ve raporlandırılması gerekir. 7- Ekonomik Analiz (Masraf /Fayda): Program farklı senaryolara göre planlanır. Programın her bir senaryo durumuna göre gerçekleşebilmesi için gerekli (laboratuvar test kitleri ve aşı ve aşılama ile diğer sarfları ile ekipmanlara, personel harcamaları, hayvan, karkas süt vb imha, kesim ve tazminat gibi) tüm harcamalar yıllık olarak gösterilir. Yıllık ve / veya program sonundaki kazanımlar dikkate alınarak, harcamalarla karşılaştırılarak masraf/fayda analizleri yapılır. 48
49 Kaynaklar Alvarez J, Saez JL, García N, Serrat C, Pérez-Sancho M, Gonzalez S, Ortega MJ, Gou J, Carbajo L, Garrido F, Goyache J,Domínguez L (2010) Management of an outbreak of brucellosis due to B. melitensis in dairy cattle in Spain. Research in Veterinary Science, (Baskıda) Benkirane A. (2006) Ovine and caprine brucellosis: World distribution and control/eradication strategies in West Asia/North Africa region. Small Ruminant Research 62; Blasco JM. (2006) Existing and future vaccines against brucellosis in small ruminants. Small Ruminant Research 62: Bricker BJ and Halling SM (1994) Differentiation of Brucella abortus bv. 1, 2, and 4, Brucella melitensis, Brucella ovis, and Brucella suis bv. 1 by PCR. Journal of Cli. Microbiology, 32(11): Bulgaria (2007) Cases of Brucella melitensis in the Republic of Bulgaria. Brussels SCoFCAH, scfcah/animal_health/bm_ _bg.pdf Carvalho Neta AV, Mol JPS, Xavier MN, Paixao TA, Lage AP, Santos, RL. (2010) Pathogenesis of bovine brucellosis. The Veterinary Journal 184: Cyprus report (2009) Bovine and Sheep & Goat Brucellosis. Veterinary Services, Republic of Cyprus SCoFCAH; 3-4 February De Massis F, Di Girolamo A, Petrini A, Pizzigallo E and Giovannini A. (2005) Correlation between animal and human brucellosis in Italy during the period European Society of Clinical Microbiology and Infectious Diseases. CMI, 11, EC (2003) Procedures of the administrative co-ordination of the eradication, control and monitoring programmes (Council Decision 90/424/EC) by Unit SANCO/E2. EC (2004) Regulation (EC) No 854/2004 of The European Parliament and 49
50 of the Council of 29 April 2004 laying down specific rules for the organisation of official controls on products of animal origin intended for human consumption. EC (2009) Working Document on Eradication of Bovine Sheep and Goats Brucellosis in the EU. SANCO/6095/2009. Erganiş O ve İstanbulluoğlu (2002) İmmünoloji. 3. Baskı. S.Ü. Veteriner Fakültesi Basım Ünitesi, Konya. Erganiş O, İstanbulluoğlu E, Paşa D, Önder T, Özgen G (2009a) KKTC Sığır Brusellosisi Kontrol ve Eradikasyon Planı. Lefkoşa-KKTC. Erganiş O, İstanbulluoğlu E, Paşa D, Önder T, Özgen G (2009b) KKTC Koyun-Keçi Brusellosisi Kontrol ve Eradikasyon Planı. Lefkoşa-KKTC. Erganiş O, Yonucu AE, Dönen M, Bilen Y ve Yalvaç M (2009) Vetal Aborvac R CS Aşısı Saha Etkinlik Denemesi Raporu Adıyaman. Erganiş O ve Uçan U.S (2010)Veteriner Epidemiyoloji. 3. Baskı S.Ü. Veteriner Fakültesi Basım Ünitesi, Konya. EU (1999) The Modification of Technical Annexes of Council Directive 64/432/EEC to take account of Scientific Developments. SANCO/B3/ R10/1999 EU (2003). In order to evaluate the progress of the bovine brucellosisi eradication programme Final report of mission carried out in Greece from September DG(SANCO/8629/2002). Gorvel JP and Moreno E. (2002) Brucella intracellular life: from invasion to intracellular replication. Veterinary Microbiology 90:
51 Ireland (2010) Brucellosis eradication programme. uk/index/animal-health/animal-diseases/br/br-eradication-prog.htm İyisan S. (2006) hayvanlarda brusellosisinin epidemiyolojisi. I. Ulusal Zoonoz Kongresi, TOOB Konferans Salonu, Ankara. Italy (2007) The Italian Eradication Programme for sheep and goat brucellosis. Ministry of Health. Jelastopulu E, Bikas C, Petropoulos C and Leotsinidis M (2008) Incidence of human brucellosis in a rural area in Western Greece after the implementation of a vaccination programme against animal brucellosi. BMC Public Health 8: Lapraik, RD, Brown DD, Mann H, and Brand T (1975) Brucellosis: a study of five calves from reactor dams. Vet Record, 97 (3): Leal-Klevezas, DS, Martınez-de-la-Vega,O, Ramırez-Barba,EJ Osterman, B,Martınez-Soriano, JP and Simpson,J. (2005) Genotyping of Ochrobactrum spp. by AFLP Analysis. Journal Of Bacteriology, 187 (7): Lee BY, Higgins IM, Moon OK, Clegg TA, McGrath G, Collins DM, Park JY, Yoon HC, Lee SC and More SJ (2009) Surveillance and control of bovine brucellosis in the Republic of Korea during Preventive Veterinary Medicine 90: Martins H, Garin-Bastuji B, Lima F, Flor L, Pina Fonseca A and Boinas F (2009) Eradication of bovine brucellosis in the Azores, Portugal Outcome of a 5-year programme ( ) based on test-and-slaughter and RB51 vaccination. Prev. Vet. Med. 90: Minas A, Minas M, Stournara A, and Tselepidis S The effects of Rev.1 vaccination of sheep and goats on human brucellosis in Greece. Preventive Veterinary Medicine 64: Neto F. and Vaz Y.(2002)Conjunctival Rev 1 Vaccination Of Adult Sheep And Goats In Tras-Os-Montes, Portugal. Epidémiol et santé anim.,42,
52 OIE (2007) 9th Conference of the OIE Regional Commission for the Middle East Damascus (Syria), 29 October to 01 November OIE (2008) Bovine Brucellosis. Chapter p: Terrestrial Manual. Olsen SC (2010) Brucellosis in the United States: Role and significance of wildlife reservoirs. Vaccine 28 (Baskıda). Pappas, G., Papadimitriou, P., Akritidis, N., Christou, L., Tsianos, E.V., A new global map of human brucellosis. Lancet Infect. Dis. 6, Portugal (2009) Sheep and goat brucellosis eradication programme. Epidemiological situation. SCoFCAH, Brussels, 3-4 th February ec.europa.eu/food/committees/regulatory/scfcah/animal_health/ presentations/ _sheep_goats_brucellosis_pt.pdf Ragan VE (2002) The Animal and Plant Health Inspection Service (APHIS) brucellosis eradication program in the United States. Veterinary Microbiology 90: Roth, F, Zinsstag J, Orkhon D, Chimed-Ochir, G, Hutton G, Cosovi O, Carin G, and Otte, J. (2003)Human health benefits from livestock vaccination for brucellosis: case study. Bulletin of the World Health Organization, 81 (12): Sanz C, Saez JL, Alvarez J, Sanz C, Cortes M, Pereira G, Reyes A Rubio F, Martín J, García N, Domínguez L, Hermoso-de-Mendoza M, Hermoso-de- Mendoza J (2010) Mass vaccination as acomplementary tool in the control of a severe outbreak of bovine brucellosis due to Brucella abortus in Extremadura, Spain. Preventive Veterinary Medicine (Baskıda). Sheahan M, O Hagan G, Seamus PS and Kenny K (2006) Brucellosis in cattle in Ireland : Progress towards eradication continues. Continuing education, Irish Veterinary Journal 59 (4) : Spain (2007) Spanish National Eradication Programme on Sheep and Goat Brucellosis. Result and evolution. Ministerio De Medio Ambiente. 52
53 Stournara A., Minas A., Bourtzi-Chatzopoulou E., Stack J., Koptopoulos G., Petridou E. and Sarris K. (2007)Assessment of serological response of young and adult sheep to conjunctival vaccination with Rev-1 vaccine by fluorescence polarization assay (FPA) and other serological tests for B. melitensis. Veterinary Microbiology 119 : Stringer LA, Guitian FJ, Abernethy DA, Honhold NH and Menzies FD (2008) Risk associated with animals moved from herds infected with brucellosis in Northern Ireland. Preventive Veterinary Medicine 84: WHO (1998) The Development of New/Improved Brucellosis Vaccines: Report of WHO Meeting. Geneva, Switzerland December WHO (1999) Human And Animal Brucellosis. Epidemiological Surveillance in the MZCP Countries. MZCP/Bruc/98.1. Report of a WHO/MZCP Workshop, Damascus, Syrian Arab Republic, 4-5 May Yingst S. and Hoover DL (2003) T Cell Immunity to Brucellosis. Critical Reviews in Microbiology, 29(4): /341/EC (2008) Commission Decision of 25 April 2008 laying down Community criteria for national programmes for the eradication, control and monitoring of certain animal diseases and zoonoses 53
54 BRUSELLOZUN KONTROLÜ AMACIYLA SAĞLIK BAKANLIĞINCA YAPILAN ÇALIŞMALAR Uzm. Dr. Hasan IRMAK (Genel Müdür Yardımcısı) Sağlık Bakanlığı, Temel Sağlık Hizmetleri Genel Müdürlüğü, Ankara Bruselloz, gerek toplum sağlığı gerekse hayvancılık endüstrisi için kontrol altına alınması gereken önemli bir zoonotik hastalık olup ülkemizde yaygın olarak görülmektedir. Bruselloz, Sağlık Bakanlığı Bulaşıcı Hastalıkların İhbarı ve Bildirimi Sisteminde A Grubu Bildirimi Zorunlu Hastalıklar Listesinde yer almaktadır. Hastalık, ağırlıklı olarak Doğu Anadolu, Güneydoğu Anadolu ve İç Anadolu Bölgelerimizde görülmele birlikte ülkemizin hemen her bölgesinden vaka bildirimleri yapılmaktadır (Tablo 1). Tablo 1. Bruselloz Vakalarının Bölgelere ve Yıllara Göre Dağılımı ( ) İnsanlarda bruselloz bütün dünyada görülmekle birlikte ülkeden ülkeye hastalığın insidansı ve prevalansı değişmektedir. İnsanlarda bruselloz sıklığı, hayvanlardaki sıklık ile paralellik gösterir. Özellikle Akdeniz ülkeleri, Arabistan, Hindistan, Meksika, Orta ve Güney Amerika da daha yaygındır (Şekil 1) 54
55 Şekil 1. Brusellozun dünyadaki dağılımı Bulaşmanın kolaylığı ve yaygınlığı nedeniyle, insan brusellozu hemen hemen bütünüyle hayvanlardan ve hayvansal ürünlerden kaynaklanmaktadır. Hayvansal gıdalar içinde en önemli bruselloz kaynaklarının başında pastörize edilmemiş süt ve süt ürünleri ile çiğ veya yeterli pişirilmemiş etler ve sakatatlar gelmektedir. Bruselloz Türkiye de endemik olarak görülmekte olup 2009 yılında 9324 vaka bildirimi yapılmıştır (Tablo 2). Hastalık, ülkemizde hemen her bölgeden bildirilmektedir (Şekil 2). Sözkonusu hastalığın Bruselloz hastalık yükü çalışmaları devam etmektedir. Tablo 2. Bruselloz Vaka ve Ölümlerinin Yıllara Dağılımı Yıllar Vaka Sayısı Ölüm * *: İlk 6 ay 55
56 Şekil yılında bildirilen Bruselloz vakalarının illere dağılımı. Bruselloz tanısı, yalnızca klinik bulgularla konulamaz. Klinik bulgularla beraber mutlaka bakteriyolojik ve serolojik testler yapılmalıdır. Endemik bölgelerde yaşayan ve ateş hikâyesi olan veya endemik bölgeye seyahat hikâyesi olan hastalarda, bruselloz akla getirilmelidir. Tanıda hastanın hikâyesi çok önemlidir. Hastalara bazı temel sorular mutlaka sorulmalı bu amaçla, hastanın mesleği, gıda tüketimine dair özellikler, hayvanlarla temas hikâyesi ve endemik bölgelere seyahat edip etmediği mutlaka araştırılmalıdır. Brusellozun ülkemizde yaygın görüldüğü ve endemik bir hastalık olduğu unutulmamalıdır. İnsan brusellozu, enfekte hayvanlarla doğrudan ya da dolaylı temas ile bulaşır. Bu nedenle insanlarda enfeksiyonun önlenmesi ve kontrolü, bu temas zincirinin kırılması ve hayvan rezervuarlarında enfeksiyonun kontrolü ve eliminasyonuna bağlıdır. Pratik olarak hayvanlarda bu enfeksiyonun kontrolü ve eliminasyonu, uzun soluklu enfeksiyon kontrol programlarının uygulanmasını gerektirir. Ayrıca bu programların uygulanması için eğitimli personele ve önemli miktarda mali kaynağa ihtiyaç vardır. Brusellozun yaygın olduğu Doğu Anadolu, Güneydoğu Anadolu ve İç Anadolu Bölgelerimizde aile hayvancılığı yaygın olarak yapılmakta olup bütün aile bireylerinin hayvanlarla yakın teması vardır (Şekil 3). Bu nedenle hastalıktan korunmada aile bireylerinin eğitilmesi büyük önem taşımaktadır. 56
57 Hayvan bakıcıları, çobanlar, mezbaha çalışanları, sütçüler, suni tohumlama yapan teknisyenler ve veteriner hekimlerin enfekte hayvan dokuları, deri ve yün gibi hayvansal materyallerle devamlı temas riski vardır. Bu meslek grupları brusellozun bulaşma yolları ve alınması gereken korunma önlemleri hakkında periyodik olarak bilgilendirilmelidir. Aile hayvancılığında ve çiftlik hayvancılığında kontamine hayvan atıklarının bertarafı ve çevre dezenfeksiyonu usulüne uygun olarak yapılmalı, çiftliklerdeki sanitasyon koşulları standartlara uygun hale getirilmeli ve kontrol edilmelidir. Brusellozla mücadele kapsamında Sağlık Bakanlığınca yapılması planlanan çalışmalar şunlardır: Sağlık çalışanlarının hastalık hakkında bilgilendirilmesini ve bilinçlendirilmesini sağlamak, Halkın hastalık ve korunma yöntemleri hakkında bilgilendirilmesini ve bilinçlendirilmesine yönelik çalışmaları yürütmek, Hastalığın teşhis ve tedavisi için standart tanı ve tedavi algoritmasını belirlemek, Teşhis ve tedavi için gerekli alt yapıyı oluşturmak, İlgili kurum ve kuruluşlarla gerekli işbirliğini gerçekleştirmek. 57
58 Brusellozla daha etkin mücadele edebilmek amacıyla Sağlık Bakanlığı bünyesinde Bruselloz Bilim Danışma Kurulu oluşturuldu. Bilim Kurulunun önerileri doğrultusunda Bruselloz Kontrol Programı oluşturuldu. Teşhis, tedavi ve izlemlerde standardizasyonu sağlamak için Zoonotik Hastalıklar Eğitim Modülü hazırlandı. Yine Bilim Danışma Kurulumuz aracılığı ile brusellozda hastane yükünü belirlemeye yönelik bir çalışma başlatıldı. Toplumun ülkemizde sık görülen bruselloz ve diğer zoonotik hastalıkların bulaşma yolları ve bu hastalıklardan korunma konularında bilinçlendirilmesi ve risk gruplarının eğitilmesi, enfeksiyonların kontrolü açısından son derece önemlidir. Kaynaklar 1. Alp Meşe E. İnsanlarda bruselloz. Doğanay M, Altıntaş N. Zoonozlar: Hayvanlardan insanlara bulaşan enfeksiyonlar. Ankara: Bilimsel Tıp Yayınevi, 2009: Zoonotik Hastalıklar Hizmetiçi Eğitim Kitabı, Ankara,
59 HAYVANLARDA BRUCELLA AŞILARI AVANTAJ VE DEZAVANTAJLARI Dr. Sevil ERDENLİĞ 1 1 Pendik Veteriner Kontrol ve Araştırma Enstitüsü, Brucella Aşıları Üretim Laboratuvarı Özet Brucellosise karşı aşılama, hastalığı kontrol etmek için kullanılan en pratik ve en etkili yoldur. Bu amaçla eskiden beri çok çeşitli aşılar değişen derecelerdeki başarı oranları ile kullanılagelmiştir. Bunlar arasında klasik canlı smooth aşılar, inaktif aşılar, mutant rough aşılar, rekombinat aşılar ve DNA aşıları sayılabilir. B. abortus S19 ve B. melitensis Rev 1 suşlarından hazırlanan canlı, attenüe smooth aşılar hastalığa karşı korumada dünyada en yaygın olarak kullanılmakta olan aşılardır. Ancak bu aşıların, infeksiyonun tanısı için kullanılan serolojik testlerde yanlış pozitif yanıt oluşturma, insanda patojenik olma ve ergin hayvanlarda kullanıldığında sütle atılım ve abort gibi yan etkileri bulunmaktadır. Fakat bugüne kadar geliştirilip kullanılan brucella aşılarından bazılarının deney hayvanlarında oldukça ümit verici sonuçları olmasına rağmen, hiçbir aşı hedef hayvan populasyonlarında B. abortus S19 ve B. melitensis Rev 1 aşıları kadar etkin bir koruma sağlayamamıştır. Bu nedenle daha iyisi geliştirilip test edilinceye kadar, B. abortus S19 ve B. melitensis Rev 1 aşıları brusellosisin profilaksisinde referens aşılar olarak kalmaya devam edecektir. Giriş Brucellosis ile mücadelede, diğer infeksiyöz hastalıkların mücadele programlarında geçerli olduğu üzere veteriner hizmetlerinin alt yapısının ve mali kaynakların yeterli olması esastır. Bu iki husus yeterli olduğunda, izlenmesi gereken son husus hastalığın sürü bazındaki prevelansının belirlenmesidir. Sürü prevelansının (kolektif prevelans, infekte sürü oranı) çok düşük olduğunda (sürülerin % 1 inden azı infekte olduğunda) sadece test ve kesim yöntemine bağlı bir kontrol ve eradikasyon programı tavsiye edilir. Prevelans orta düzeyde ise (sürülerin yaklaşık % 5 i infekte) sürüye katılan genç hayvanların aşılanması ergin hayvanların test ve kesimi orta ve uzun vadede hastalığın eradikasyonu için önerilen bir uygulamadır. Ancak ülkemizdeki gibi hastalığın prevelansı yüksek ise (sürülerin % 10 ve üzeri infekte ise) ülkenin veteriner hizmetlerinin alt yapısı ve mali kaynakları yeterli dahi 59
60 olsa tüm sürünün aşılanması hastalığın kontrol etmek için uygulanacak tek makul stratejidir(7,8,23,36). Hastalık prevelansının yüksek olduğu yerlerde test ve kesimin uygulanması en zengin ülkelerin bile göze alabileceği bir kontrol ve eradikasyon stratejisi değildir. Tüm sürünün düzenli aralıklar ile aşılanması hastalığa bağlı abortları ve dolayısı ile bulaşmayı en aza indireceğinden beraberinde hastalığın prevelansında anlamlı düşmeler şekillendirecektir. Aşılama en pratik ve en etkili bir kontrol yöntemi olarak değerlendirilmektedir(2,8,16,23,32). Aşılarda Olması Gereken özellikler İdeal bir brucella aşısında olması gereken özellikler şu şekilde sıralanabilir. Aşı sağlam ve uzun süreli etkili bir bağışıklık şekillendirmelidir. Tüm fizyolojik durumlarda kullanılabilecek kadar zararsız olmalıdır. Hastalığın tanısında kullanılan serolojik testler ile karışacak reaksiyonlar vermemelidir. Aşıyı uygulayanlara bulaşma ve infeksiyon riski taşımamalıdır. Aşı suşu hayvanların çeşitli sekret ve ekskretleri ile saçılmamalıdır. Kullanımı çevre için de güvenli olmalıdır. Ancak, tüm bu özellikleri bünyesinde barındıran bir brucella aşısı bugün için mevcut değildir(7,8,35). Brusellosise karşı günümüze kadar kullanılmış ve kullanılmakta olan brucella aşılarından sırası ile bahsetmek gerekirse, genel bir kural olarak, fakültatif hücre içi mikroorganizmalara karşı en etkili, sağlam ve uzun süren bir bağışıklığın oluşturulmasında tercih edilen canlı aşılardan başlamak gerekir. Bugün için en başarılı olarak kabul edilen brucella aşıları, canlı, attenüe ve smooth (S) morfolojiye sahip suşlar ile hazırlanan aşılardır. Bunlar arasında klasik S aşıları olarak bilinen B. melitensis Rev 1 suşundan hazırlanan aşı koyun ve keçi brusellozunun, B. abortus S19 suşundan hazırlanan aşı sığır brusellozunun profilaksisinde kullanılan bugün için dünyada alternatifsiz en iyi bağışıklık veren aşılar olarak kabul edilmektedir(2,7,8,19,32,36). Brucella abortus S19 Aşısı B. abortus S19 aşısı, ilk olarak 1930 yılında Buck tarafından geliştirilmiştir. Aşı suşu 1923 yılında bir ineğin sütünden izole edilmiş virulent bir suştur ve bu suş oda ısısında bir yıl bekletildikten sonra attenüe olmuştur(9). Aşı, normalde 3-6 aylık dişi buzağıların aşılanmasında kullanılmaktadır. Gerek kontrollü saha çalışmaları ve gerekse yapılan araştırmalar bu aşının sığır brusellosisinin kontrolü ve önlenmesinde hastalığın klinik vakalarını dramatik bir şekilde azaltarak, infeksiyon odaklarını elimine ederek, dolayısı ile 60
61 bulaşmayı engelleyerek hastalığın prevelansını ciddi bir şekilde düşüren en etkili bir aşı olduğunu ortaya koymuştur(32,35). Aşının subkutan yol ile uygulanan tek bir dozunun yaşam boyu bağışıklık verdiğini belirten yayınlar olmakla birlikte, aşının en az birkaç gebelik boyunca koruduğu gösterilmiştir. Ancak aşılamanın tekrar edilmesinin oluşan bağışıklığı güçlendirdiği bildirilmektedir(35). Fakat bu aşının bazı istenmeyen etkileri de bulunmaktadır. Bu suş, sığırlar için düşük bir virulansa sahip olmakla beraber, gebe ineklerde standart doz ile gebeliğin ilk iki trimestirinde uygulandığında, %1-2.5 oranında aborta sebep olabilmekte ve abort yapan hayvanlarda etken süt ile saçılabilmektedir. Aşının erkek hayvanlarda kullanımı kontraendikedir(13,30,33,37). Bir diğer ve en önemli dezavantajı ise, aşı suşunun sahip olduğu smooth lipopolisakkarit (S-LPS) tabakası sebebi ile oluşturduğu ve infeksiyona bağlı olarak ortaya çıkan antikorlardan ayırt edilemeyen anti- LPS antikorlardır. Diğer Gram negatif bakterilerde de olduğu üzere S-LPS, O-polisakkarit (O-PS), kor oligosakkarit ve lipid A olmak üzere 3 tabakadan oluşmuştur. O-PS tabakası ise gerek smooth canlı aşılar ve gerekse infeksiyondan kaynaklanan antikorların çoğunluğunun kendisine karşı yönlendirildiği immunodominant bir bölümdür. Bu durumda aşılama sonrası seropozitifliğin hayvanın yaşına, aşının dozuna ve uygulama yoluna göre değişmek sureti ile uzun süre devam etmesi, hastalığın serolojik tanısında uygulanan testlerin yorumlanmasında zorluklara neden olmaktadır (7,8,17,30,33,37). Brucella melitensis Rev 1 Aşısı B. melitensis Rev 1 aşısı, streptomisine bağlı virulent bir S B. melitensis suşunun retromutasyonu ile attenüe olmuş bir suştan 1950 li yıllarda Elberg ve Faunce tarafından geliştirilmiştir. Suş, küçük ruminantlara karşı düşük derecede virulans gösterir, son derece immunojeniktir ve tekrarlayan pasajlarda virulent forma döndürülememiştir(15,17). Aşının, koyun ve keçileri B. melitensis infeksiyonundan ve koçları ve koyunları B. ovis infeksiyonundan etkili bir şekilde koruduğu gösterilmiştir(6,21). Yapılan yayınlar son derece sınırlı da olsa aşının sığırlardaki B. melitensis infeksiyonuna karşı kullanılabileceğini belirten yayınlar mevcuttur(25). Aşının standart dozu 3-6 aylık yaşlardaki kuzu ve oğlaklara 1-2X10 9 CFU dur. Aşının yaşam boyu bağışıklık verdiği kabul edilmektedir(17,37). B. melitensis Rev 1 aşısı, B. abortus S19 aşısına benzer şekilde aşının gebeliğin ilk 3 ayında uygulandığında aborta neden olma, aşılama sonrası serolojik testlerin yorumlanmasına müdahale eden seropozitiflik oluşturma ve insanlar için patojenik olma gibi dezavan- 61
62 tajlara sahiptir. Rev 1 suşunun insanlar için patojen olması ve insanlarda brusellosisin tedavi seçeneklerinden biri olan streptomisine dirençli olması aşının kazara insanlara inoküle olması problem yaratabilir. Ancak uygun önlemler alındığında bu durum küçük bir risk teşkil etmektedir. Bu aşının koçlarda testiküler lezyonlardan izole edilmesi aşının erkek hayvanlarda tehlikeli olabileceğini düşündürmüş ise de bu son derece nadir olarak rastlanılan bir bulgudur ve bu aşının erkek kuzu ve oğlaklar ile koçlara subkutan ya da konjuktival olarak uygulanması koyunlara uygulanması ile aynı risk ve sonuçları taşımaktadır(2,7,8,16,17). Rev 1 aşısı genital organlarda kolonize olmaz sadece lenf yumrularına ve dalağa sınırlıdır(29). Dolayısı ile koçlarda sadece B. melitensis için değil B. ovis infeksiyonunun da profilaksisi için etkili bir şekilde kullanılmaktadır(6,7). Diğer Canlı Brusella Aşıları Canlı aşı suşlarından hazırlanan ve geçmişte belli bir başarı ile kullanılmış ancak yaygın bir kabul görmemiş brucella aşıları arasında, B. suis in mukoid bir suşu olan M aşısı, B. abortus dan köken alan 104-M aşısı, Çin Halk Cumhuriyeti nde sığır koyun ve keçileri brusellosisten korumak için oral aşılamalarda uzun yıllar kullanılan B. suis suş 2 S-2 aşısı ve yine aynı ülkede koyun keçi ve geyikleri hastalıktan korumak için kullanılan B. melitensis suş 5 aşıları sayılabilir. Ancak bu aşılar klasik S aşılar ile karşılaştırıldığında daha düşük düzeyde koruma sağlamışlardır(43). Eski Sovyetler Birliği nde 1970 li yıllardan sonra resmi olarak kullanılmağa başlanılan ve B. abortus 82 suşundan hazırlanan aşının büyük bir başarı ile kullanıldığı bildirilmektedir. Koloni morfolojisinin SR olduğu bildirilen bu suştan hazırlanan aşının B. abortus S19 aşısına olan üstünlüğünün, aşılama sonrası seropozitiflik oluşturmaması olduğu bildirilmektedir(41). Ölü Brucella Hücreleri veya Antijenik Fraksiyonlarından Hazırlanan Aşılar Brusellosisin profilaksisinde kullanılan, gerek ölü suşlardan ve gerekse çeşitli adjuvanlar ile birlikte antijenik fraksiyonlardan hazırlanan inaktif aşılar, koruyucu bağışıklıkta rol oynayan epitoplara ait çok sayıda bilgiye ve çok başarılı yeni nesil adjuvanların keşiflerine rağmen, Rev 1 ve S19 gibi klasik S canlı aşıların başarısına hiçbir zaman ulaşamamışlardır(8). B. melitensis 53H38 ve B. abortus 45/20 suşlarından hazırlanan aşılar geçmişte kullanılmış ve bugün için artık kullanılmayan bakterin aşılara örnektir. Formaldehit ile inaktive edilen yağ adjuvanlı bir aşı olan H38 bakterini abortlara karşı 62
63 iyi bir koruma sağlamış ancak aşılama sonrası oluşturduğu seropozitiflik ve aşılama yerindeki ciddi lokal reaksiyonlar aşının kullanımını sınırlamıştır(4,43). B. abortus 45/20 aşısı başlangıçta Rough (R) canlı aşı olarak 1922 yılında S B. abortus 45 suşunun kobaylarda 20 kez pasajlanması ile geliştirilmiştir. Ancak bu suşun canlı aşı olarak kullanıldığında stabil kalmayarak S virulent formuna dönmesi, anti O-PS antikorlar oluşturarak serolojik testlere müdahale etmesi aşının inaktif olarak kullanımına yol açmıştır. Ancak aşının etkili olabilmesi için 2 aşılamanın gerekmesi, göreceli olarak orta düzeyde bir bağışıklık şekillendirmesi, aşılama sonrası seropozitiflik ve ciddi lokal aşı reaksiyonu oluşturması, sonunda aşının kullanımının kesilmesine yol açmıştır(3,12). Brucella spp den elde edilen ve immunojenik olduğu düşünülen çok sayıda antijenik fraksiyonlardan hazırlanarak eski ve yeni nesil birçok adjuvan ile hazırlanan sayısız aşı çalışması bulunmaktadır. Bunlar arasında en önemlileri, hücre duvarları, dış membran proteinleri, S-LPS ve R-LPS, eriyen SDS ektraktları, eriyen brusella antijenleri (BASA), periplasmik proteinler, tuzla modifiye brusella proteinleri, sentetik peptitler, L7/L12 ribosomal protein, Cu-Zn superoksit dismutaz (SOD) vb. olarak sayılabilir(28,43). Rough Mutant Aşılar Canlı S antibrusella aşılarının aşılama sonrası oluşturduğu ve şartlara göre uzun sürebilen seropozitiflik, hastalığın eradikasyonunda ciddi bir engel teşkil ettiğinden bu problemi ortadan kaldıran ideal canlı R aşıların geliştirilmesi üzerine yoğun çalışmalar süregelmektedir. Bu aşılardan en dikkate değeri ve bugün için ABD ve çoğu Latin Amerika ülkelerinde ve dünyanın bazı ülkelerinde 1996 yılından beri resmi olarak kullanılan ve uygulandığı ülkelerde B. abortus S19 aşısının yerini alan RB51 aşısıdır. Bu aşı B. abortus 2308 suşunun tekrarlayan in vitro pasajları sonrasında seçilen spontan bir R mutantıdır. Suşun R özelliği son derece stabildir, in vitro ve in vivo yapılan çok sayıda pasaj sonrası R özelliğini korumuştur. Suşun O zinciri olmadığından ve sadece M benzeri bir O zinciri olduğundan, serolojik testler ile ölçülebilen anti-o antikorlarını tanımlanamayacak düzeyde çok az oluşturmaktır(10,31,39,42). Aşının standart dozu 4-12 aylık yaşlar arasındaki sığırlarda deri altı olarak 1-3.4X10 10 CFU olarak uygulanmaktadır. Aşının abort yapma ve sütle atılma riskinden dolayı gebe hayvanlarda kullanılmaması gerektiği bildirilmektedir(37,39). Bu etkiyi gidermenin bir yolunun aşının dozunu azaltmak olduğu bildirilmektedir(40). Aşının dozunun 1X10 9 CFU olarak uygulanmasının buzağılık döneminde hayvanları hastalıktan koru- 63
64 mazken ergin sığırlarda koruduğu bildirilmektedir. Bu dozun gebeliğin geç devrelerinde yapıldığında atık ve plasentitise neden olmadığı, ancak aşılı hayvanların büyük bir çoğunluğunda etkenin saçıldığı bildirilmektedir(44). Farelerde yapılan testlerde tüm brucella türlerine karşı koruyucu olarak bulunmuş ancak koyun ve keçide yeterli bir bağışıklık sağlamamıştır (26). Hastalığa karşı aşının oluşturduğu bağışıklık düzeyleri hakkındaki araştırma sonuçları tartışmalıdır. Buzağılık döneminde yapılan tek bir dozun hastalığa karşı korumasının S19 aşısına benzer olduğu ancak O zincirine karşı hiçbir antikor oluşturmadığı bildirilmektedir (31,40). Hatta bazı çalışmalar S19 suşundan daha iyi bir bağışıklık sağladığını bildirmektedir (43). Başka çalışmalarda ise aşının B. abortus infeksiyonuna karşı çok düşük bir bağışıklık sağladığı bildirilmektedir (10,38). Benzer şekilde aşının abort yapıcı etkileri ve insanlar üzerindeki patojenitesi üzerindeki araştırma sonuçları da tartışmalıdır. Aşının, gebe kadınlar, küçük çocuklar, endokarditis ve neurobrucellosis gibi streptomisinin kullanılmayacağı durumlardaki insanlar için tedavi seçeneği olan rifampisine dirençli olması ve de RB51 suşu ile infekte olan insanların çoğu hastanede teşhis edilememesi (özel serolojik testler) bu aşının kullanımının önemli bir dezavantajı olarak değerlendirilmektedir (31). Bu aşının koyunlarda B. melitensis infeksiyonuna karşı ve koçlarda B. ovis e karşı bir koruma sağladığına dair bir veri bulunmamaktadır (8,27). Rough canlı aşılardan etkili bağışıklık konusunda standart klasik S aşılar ile karşılaştırılabilir bir bağışıklık elde edildiğini gösteren çalışmaların olması ve bu aşılarla geliştirilen aşıların O-polisakkarit zincire karşı antikor oluşturmadığından serolojik testlere müdahale etmemesi, daha etkili ideal R aşıların geliştirilmesi konusunda yoğun arayışlara neden olmuştur. Geliştirilen bu mutant aşılar arasında B. melitensis 16M ve B. suis 2579 suşlarının S-LPS nin sentezi için gerekli bir enzim olan glikoziltransferaz genlerinde (WboA) transposon mutagenesisi ile oluşturulmuş kanamisine dirençli VTRM1 ve VTRS1 suşlarından hazırlanmış mutant aşılar, B. abortus un 2308 suşunun rfbk genindeki mutasyonu sonunda oluşturulan B. abortus manb core, wbka ve perr mutantları sayılabilir. Bu yeni mutant aşıların farelerde RB51 aşısından daha iyi bir koruma sağladığı bildirilmektedir. Ancak bu suşlar S19 ve Rev 1 suşlarından daha düşük bir koruma göstermişlerdir(11,31,45). Yapılan bir çalışmada keçilerde RB51, manb core, VTRM1 olmak üzere 3 çeşit R aşı etkinlik yönünden Rev 1 ile karşılaştırmalı olarak değerlendirilmiştir. R aşılar keçilerde etkili bir bağışıklık şekillendirememişlerdir. VTRM1 aşısı CFU dozunda etkili bir bağışıklık sağlayamazken Rev 1 aşısı azaltılmış 64
65 dozda dahi etkili olmuştur(18). Rough aşıların tanısal testler ile karışacak antikorlar oluşturmaması avantajına karşılık bir takım dezavantajları vardır. Bunlar, bu aşılar ile infekte olan insan ve hayvanların standart serolojik testler ile tanımlanamadan gözden kaçması, anti-ops antikorlarının hastalıktan korunmada önemli olabilmeleri ve bu aşıların fazla attenüe olmuş olmaları nedeni ile hayvanlarda yeterince antijenik uyarı sağlayacak kadar uzun süre kalmamaları olarak sayılabilir(8). Rough canlı aşıların, aşılı infekte ayırımı yapabilme avantajının yanında, aşılamanın uygulandığı farklı zeminler dikkate alınarak, erişilebilir hedefler açısından olayı daha geniş bir çerçevede görmek gerekir. Bruselloz kontrolünün başarıldığı ve eradikasyonun uygulanabilir olduğu veya çok düşük prevelanslı olan ülkelerde R aşılarının kullanılmasının istenmesi anlaşılabilirdir. Ancak, bu noktada bu aşıların özellikle RB51 aşısının hastalığın orta ve yüksek prevelans gösterdiği, serolojik testlerin ancak ticari amaçlı veya hastalıktan şüphelenildiği, düzenli olarak değil de ancak sporadik ve isteğe bağlı olarak yapıldığı ülkelerde kullanımı son derece tartışmalıdır. Hastalığın prevelansının yüksek olduğu yerlerde, tek amaç mümkün olan en yüksek bağışıklık seviyesini mümkün olan en fazla sayıda hayvanda oluşturmaktır. Bu aşamada aşılı infekte ayrımı öncelikli bir öneme sahip olmamaktadır. Genelde gelişmekte olan ülkelerde görülen bu koşullar altında, brusellosisin kontrol ve eradikasyonunda 60 yıldan fazla dünyanın bir çok ülkesinde etkili bir şekilde kullanılmış ve kullanılmakta olan, standartları oturmuş, etkinliliği sayısız kontrollü çalışmalar ile kanıtlanmış ve bilinen klasik smooth canlı aşıların kullanımı, karşılaştırmalı kontrollü deneylerde tam olarak test edilmemiş, bu çalışmalarda alınan sonuçların hala tartışmalı olduğu bu aşılara tercih edilmelidir(31). DNA Aşıları Yeni kuşak aşılar arasında, Brucella immunojenlerinin etkili bir hücre aracılı immuniteyi uyararak koruyucu bir bağışıklık oluşturmak için recombinant antijenler olarak kullanımı birçok araştırmacı grup tarafından araştırılmıştır. Rekombinant aşılarda immonojenler uygun bir vektör sistemi ile (rekombinant bakteri, bitki veya böcek virusları) verilebildiği gibi bunlardan saflaştırılarak uygun bir adjuvan ile de uygulanabilirler lı yıllarda geliştirilen gen terapisi teknolojisi, bunun mikrobiyal patojenlere karşı koruyucu bağışıklık geliştirmek üzere kullanımına ilişkin çok sayıda araştırmayı beraberinde getirmiştir. DNA aşısının temel prensibi koruyucu bağışıklığı uyaran antijenleri 65
66 kodlayan genlerin uygulanmasıdır. Çıplak DNA aşıları olduğu gibi bu DNA parçacıklarının bir plasmid vektör ile uygulanması da söz konusudur. DNA aşıları, yakın gelecekte yeni kuşak brucella aşılarının geliştirilmesinde ilginç ve umut verici yaklaşımlar olabilir(1,28). Ancak şu an için amaca uygun olarak geliştirilen bir DNA aşısı bulunmamaktadır. Gelecekteki İdeal Canlı Aşılar Gelecekte moleküler genetik yöntemleri ile ideal bir brucella aşısı geliştirmek için iki farklı temel yaklaşımın benimsenmesi faydalı olacaktır. Bunlar, B. melitensis Rev 1 ve B. abortus S19 suşlarından tanısal önemi olan antijenleri kodlayan genlerin çıkarılması ile geliştirilen mutant suşlardan aşı hazırlanması. Bir diğeri ise transposon mutagenesisi veya O-zinciri biyosentezinde rol alan genlerin S virulent suşlardan çıkarılması ile yeni Rough aday aşılarının geliştirilmesidir. Böylelikle bu mutant suşlar daha düşük bir virulansa sahip olacaklar ve S Brucella spp tarafından oluşturulan anti O zinciri antikorlarını saptayan klasik serolojik testlerin yorumlanmasına müdahale etmeyerek aşılı ile infekte hayvan arasında kolayca ayırım yapılabilecektir. Ancak şu an için dünyada yukarıdaki amaçlara uygun tam olarak valide edilmiş ticari bir anti brucella aşısı yoktur ve geliştirilinceye ve uygun olarak test edilinceye kadar B. melitensis Rev 1 küçük ruminantlarda ve B. abortus S19 büyükbaş hayvanlarda brusellosise karşı kullanılan referens aşılar olarak kullanılmaya devam etmelidir(8,31). Ülkemizdeki Brucella Aşılamaları Anti-brusella aşılamalarının ülkemizde geçmişten bugüne kadar uygulamaları özetlenecek olursa; Türkiye de brusellosis kontrol ve eradikasyon projesi 1983 yılında başlamış ve 25 yıl sürmesi planlanmıştı. Bu programa göre 4-8 aylık yaştaki tüm dişi buzağılar ve 3-8 aylık yaşlar arasındaki tüm dişi, erkek kuzu ve oğlakların aşılanması hedeflenmişti. Bu program çerçevesinde ülkemizde milyonlarca sığır, koyun ve keçi aşılandı. Ancak aşının uygulama oranları hiçbir zaman istenilen düzeyde olamadı ve de sürüdeki sadece genç hayvanların aşılanması diğer yaş gruplarındaki hayvanları infeksiyona açık hale getirmeye devam etti. Ülkemizde B. melitensis Rev 1 aşısının standart dozu (genç dozu) 3-6 aylık dişi ve erkek kuzu ve oğlaklara derialtı (SC) yolla 1-3X10 9 CFU/doz miktarında ve B. abortus S19 standart dozu 3-6 aylık dişi danalara X10 9 CFU/doz olarak uygulanmaktadır. 66
67 Ergin Doz Brucella Aşılamaları Hastalığın ülkemiz gibi endemik olduğu yerlerde önerilen kitle aşılamasında her yaştaki hayvan grubunun aşılanması, sürüde infeksiyon açık hayvan bırakılmaması esastır. Ancak bu dozların yetişkin hayvanlarda gebelik süresince uygulandığında abort şekillendirebildiği ve süt ve vajinal akıntılar ile saçılım yapabileceği bildirilmektedir. Bu yüzden ülkemizde bu yan etkilerin en minimal olarak gerçekleşebildiği ya da hiç gerçekleşmediği 0.5-1X10 5 CFU/doz, ergin koyun keçi dozu olarak, 1-3X10 9 CFU/doz ergin sığır dozu olarak 1991 yılından beri uygulanmaktadır. Ergin S19 aşı uygulaması 2 yıl önce aşılı infekte ayrımında yaşanılan zorluklardan dolayı kaldırılmıştır. Ancak B. melitensis aşısının ergin koyun ve keçilerde kullanımının infeksiyonuna karşı tek başına yeterli bağışık vermediğini, asla tam doz genç aşısının yerini alamayacağını bildiren araştırmalar bulunmaktadır(7). Sığırlarda ergin aşılama ABD de başarılı bir biçimde kullanılmıştır. Florida da düşük doz ergin aşının koruma değerleri üzerine yapılan çalışmalarda ve benzeri diğer çalışmalardan alınan sonuçlar ergin aşının tam doz aşıya benzer sonuçlar verdiği yönünde olmuştur. Düşük doz aşı uygulanan hayvanlarda yavru atma riskinin çok düşük olduğu ve iki senede bir aşılamanın tekrar edilmesi gerektiği yapılan çalışmalar ile ortaya konmuştur.(5,14,30,33,34). Uluslararası Salgın Hastalıklar Ofisi (OIE) ergin dişi sığırlarda kullanılacak dozu 0.3-3X10 9 CFU/doz olarak önermektedir(37). Ergin aşı uygulamalarının istenmeyen 2 etkisi vardır. Bunlar, aşılamadan sonra bazı hayvanlarda kalıcı olabilen antikor titreleridir ve yanlış pozitif reaksiyona neden olurlar. Bazı hayvanlarda abort, sütle atılım ve arthritis gibi bulgular gözlenebilir(2). Ancak laktasyon döneminde tam doz B. melitensis Rev 1 uygulanmış koyunlarda dahi abort ve sütle atılımın olmadığını bildiren çalışmalar da vardır(7,19). Konjuktival Yol İle Yapılan Brucella Aşılamaları Smooth canlı klasik brucella aşılamalarında söz konusu bu yan etkileri minimize eden bir uygulama olarak OIE klasik olan subkutan aşılama yerine konjuktival aşılamayı önermektedir. Bu aşılar her ne kadar abort yapma ve sütle atılıma riskini derialtı uygulanan aşılara göre daha az taşısa da bu riskler bu aşılarda da söz konusudur. Bu yüzden aşılamaların hayvanların gebe olmadığı, laktasyonda oldukları yada gebeliği son aylarında yapılmasının bu riskleri son derece minimize edeceği bildirilmektedir(7,8) Ülkemizde kitlesel brusella aşılamalarında kullanılmak üzere B. abortus S19 67
68 ve B. melitensis Rev 1 suşlarından hazırlanan aşıların üretilip kullanılması planlanmaktadır. Kuzu ve oğlaklarda subkutan ve konjuktival uygulamada doz aynıdır. Aşı tek bir doz olarak 30-50µl bir hacim içinde 0.5-2X10 9 CFU olarak konjuktival keseye uygulanır. Sığırlarda 40-50µl bir hacim içinde 5-10X10 9 CFU/doz olarak tek doz veya yaklaşık 1 yıl ara ile iki kez uygulanmaktadır(37). Konjuktival Brucella Aşılamalarının Avantajları Bu aşılama yönteminin deri altı yol ile uygulamaya göre avantajları şu şekilde özetlenebilir. Bu aşılama yolu ile sağlanan bağışıklık standart metod ile oluşturulana benzerdir.sadece baş lenf yumrularına lokalize olduklarından generalize bir aşı infeksiyonu oluşturmazlar ve bu nedenle abort ve saçılım riskinin çok daha azdır.yukarıda bahsedilen nedenlerden dolayı aşılama sonrası kalıcı titreler standart yönteme göre çok daha kısa sürede ortadan kaybolmaktadır. Örneğin 4 aylıkken aşılanan bir kuzu 4-6 aydan daha kısa bir süre içinde serolojik olarak negatif hale dönmektedir. Hayvan ne kadar erken aşılanırsa üretilen seropositivite o karda kısa sürede ortadan kalkacaktır. S19 konjuktival aşısı içerdiği mikroorganizma sayısının az olması nedeni ile tüm yaştaki dişi sığırlarda uygulanabilecek ve bu da sahada aşının uygulanma oranını ve pratikliğini artıracaktır. Dolayısı ile kitle aşılamalarına uygundur. Parenteral olarak uygulanmadığından kazara uygulayıcının aşıyı kendisine injekte etme riski ortadan kalkmaktadır. Tüm bu faktörler bu aşılama yöntemini cazip kılan faktörlerdir(20,22,24,46). Konjuktival aşılama subkutan aşılamaya göre abort şekillendirmesi ve sütle saçılım gibi durumlar dikkate alındığında daha güvenli bir aşı olduğunu kanıtlamış ve birçok ülke (İspanya, Fransa, Portekiz, Yunanistan), bu yol ile aşılama yaparak ülkelerindeki hastalık prevelansını çok düşük seviyelere düşürüp eradikasyon aşamasına gelmişlerdir. Ayrıca Fas, Tunus, Cezayir, Mısır ve bazı diğer ülkelerde konjuktival yolla aşılamalar başarı ile uygulanmaktadır. KAYNAKLAR 1. Al-Mariri, A., Tibor A., Mertens P., De Bolle X., Michel P., Godfroid J., Walravens K. and Letesson J.J. (2001): Induction of immune response in BALB/c mice with a DNA vaccine encoding bacterioferritin or P39 of Brucella spp., Infect. Immun., 69, Alton, G.G. (1970): Vaccination of goats with reduced doses of Rev 1 Brucella melitensis vaccine. Res. Vet. Sci., 2,
69 3. Alton, G.G., Corner L.A. and Plackett P. (1983): Vaccination of cattle against brucellosis using either a reduced dose of strain 19 or one or two doses of 45/20 vaccine. Aust. Vet. J., 60, Alton, G.G., (1985): Rev 1 and H38 Brucella melitensis vaccines. In: Verger, J.M., Plommet, M. (Eds.), Brucella melitensis. Martinus Nijhoff, Dordrecht, Beckett F.W. and McDiarmid S.C. (1985): The effect of reduced-dose Brucella abortus strain 19 vaccination in accredited dairy herds. Br. Vet. J., 141, Blasco, J.M., Marin C.M., Barberan M., Moriyon I. and Diaz R. (1987): Immunization with Brucella melitensis Rev 1 against Brucella ovis infection of rams. Vet. Microbiol., 14, Blasco, J.M. (1997): A review of the use of B. melitensis Rev 1 vaccine in adult sheep and goats. Preventive Veterinary Medicine, 31, Blasco, J.M. (2006): Existing and future vaccines against brucellosis in small ruminants, Small Ruminant Research,62, Buck, J.M. (1930): Studies of vaccination during calfhood to prevent bovine infectious abortion, J.Agric., Res, 41, Cheville, N.F., Olsen S.C., Jensen A.E., Stevens M.G., Palmer M.V. and Florance A.M. (1996a): Effects of age at vaccination on efficacy of Brucella abortus RB51 to protect cattle against brucellosis. Am. J. Vet. Res., 57, Cheville, N.F., Olsen S.C., Jensen A.E., Stevens M.G., Florance A.M., Houng H.-H., Drazek S.E., Warren R.L., Hadfield T.L. and Hoover D.L. (1996b): Bacterial persistence and immunity in goats vaccinated with a pure deletion mutant or the parental 16M strain of Brucella melitensis. Infect. Immun., 64 7, Chukwu, C. (1987): Comparison of cell-mediated immune responses to Brucella abortus strain 19 vaccine and Brucella abortus 45/20 killed vaccine in cattle. Microbiosci. Lett., 34, Corbel M.J., Stuart F.A., Brewer R.A., Jeffrey M. and Bradley R. (1989b): Arthropathy associated with Brucella abortus strain 19 vaccination in cattle. II. Experimental studies. Br. Vet. J. 145, Deyoe B.L., Dorsey T.A., Meredith K.B. (1979): Effect of reduced dosages of B. abortus S19 in cattle vaccinated as yearlings in proceedings 83 rd Annula meeting, Us Animal Health Assıciation, 69
70 Elberg, S.S., and Faunce W.K. (1957): Immunization against Brucella infection. IV. Immunity conferred on goats by a non-dependant mutant from a streptomycin dependant mutant strain of Brucella melitensis. J. Bacteriol., 73, Elberg S.S. (1981): Rev 1 Brucella malitensis vaccine.part II : Vet Bull., 51, Elberg S.S. (1996): Rev 1 Brucella malitensis vaccine.part III : Vet Bull., 66, Elzer, P.H., Enright, F.M, McQuiston, J.R., Boyle, S.M., Schurig, G.G. (1998): evaluation of a rough mutant of Brucella melitensis in pregnant goats, Res, Vet. Sci.,64, Eroğlu M., Çoker, A. ve Mete K., (1988). Laktasyon dönemindeki koyunların Brucella melitensis Rev 1 ile aşılanma neticelerinin araştırılması. Pendik Veteriner Mikrobiyoloji Dergisi,19(1-2), Fensterbank R., Pardon P., Marly J.(1982): Comparison between subcutaneous and conjunctival route of vaccination of. Rev 1 strain against B. melitensis infection in ewes. Ann Rech Vet.,13, Fensterbank R., Pardon P. and Marly J. (1982): Efficacy of Brucella melitensis Rev 1 vaccine against Brucella ovis infection in rams. Ann. Rech. Vet., 13, Fensterbank R., Pardon P., Marly J.(1985): Vaccination of ewes by a single conjunctival administration of Brucella melitensis Rev 1 vaccine. Ann Rech Vet., 16, Garin-Bastuji B. (1996): Control programmes of B. melitensis infection in sheep and goats.in : FAO/WHO/OIE round table on the use of Rev 1 vaccine in small ruminants and cattle(b.garin-bastuji, A Benkirane,eds) CNEVA. Maison-Alfort, France, Jiménez de Bagués M.P., Marin C.M., Barberan M., Blasco J.M. (1989): Responses of ewes to B. melitensis Rev 1 vaccine administered by subcutaneous or conjunctival routes at different stages of pregnancy. Ann Rech Vet., 20, Jiménez de Bagués M.P., Marin C.M., Blasco J.M. (1991): Effect of antibiotic therapy and S19 vaccination on the spread of B. melitensis within an infected dairy herd..prev Vet. Med., 11, Jiménez de Bagués M.P., Elzer P.H., Jones S.M., Blasco J.M., Enright F.M., Schurig G.G. and Winter A.J. (1994): Vaccination with Brucella abortus rough mutant RB51 protects BALB/c mice against virulent 70
71 strains of Brucella abortus, Brucella melitensis, and Brucella ovis. Infect. Immun., 62, Jiménez de Bagués M.P., Barberan M., Marin C.M. and Blasco J.M. (1995): The Brucella abortus RB51 vaccine does not confer protection against Brucella ovis in rams. Vaccine, Kurar, E., Spliter,G. (1997): Nucleic acid vaccination of Brucella abortus ribosomal L7/L12 gene elicits immune response, vaccine, 15, Lantier, F., Fensterbank,R.(1985): Kinetics of Rev 1 infection in sheep. In: Plommet, M., Verger,J.M (Ed.), Brucella melitensis, Martinus Nijhoff, McDiarmid A. (1951): The vaccination of pregnant cattle with S19 Br abortus vaccine during an outbreak of brucellosis in a dairy herd. Vet. Record. 63, Moriyon, I., Grillo M.J., Monreal D., Gonzalez D., Marin C., Lopez- Goni I., Mainar-Jamie R.C., Moreno E., Blasco J.M. (2004): Rough vaccines in animal brucellosis: Structural and genetic basis and present status, Vet. Res., 35, Nicoletti, P. (1976): A preliminary report on the efficacy of adult vaccination using S19 in selected dairy herds in Florida, In proceeding 80th Annual Meeting, US Animal Health Assoc., Nicoletti, P. (1977): Adult vaccination in Crawford RP, Hidolgs RS (ed): Bovine brıcellosis-an International symposium. College Station, Texas A.M. Iniversity Pres., Nicoletti P., Jones L.M., Bermen D.T., (1978): Adult vaccination with Standard and reduced dose of Brucella abortus S.19 vaccine in a diry herd infected with brucellosis, JAVMA, 173, Nicoletti P. (1990): Vaccination. In: Animal Brucellosis. K.Nielsen & J. Duncan,Eds,CRC Pres,Inc.Boca Rat-n,FL., Nicoletti P. (2010): Brucellosis: Past, present and future, Biol. Med. Sci.,XXX/J, O.I.E., (2009). Manual of Standards for Diagnostic tests and Vaccines. Thirdedition,. Office International of Epizooties, Paris, France. Caprine and ovinebrucellosis chapter(2.7.2), Bovine Brucellosis chapter (2.4.3). 38. Olsen S.C. (2000): Immune responses and efficacy after administration of a commercial B. abortus strain RB51 vaccine to 71
72 cattle, Vet. Therapeutics., 1, Palmer, M.V., Cheville N.F. and Jensen A.E. (1996): Experimental infection of pregnant cattle with the vaccine candidate Brucella abortus strain RB51: pathologic, bacteriologic, and serologic findings. Vet. Pathol., 33, Palmer, M.V., Olsen S.C. and Cheville N.F. (1997): Safety and immunogenicity of Brucella abortus strain RB51 vaccine in pregnant cattle. Am. J. Vet. Res., 58, Salmokov, K.M., Fomin A.M., Plotnikova E.M., Safina G.M., Galimova G.M., Salmokova A.V., Ivanov A.V., Panin A.N., Sklyarov O.D., Shumilov K.V., Klimanov A.I. (2010): Comparative study of the immunobiological properties of live brucellosis vaccines, Vaccine. 28S, Schurig G.G., Roop R.M., Bagchi T., Boyle S., Buhrman D. and Srirangananathan N. (1991): Biological properties of RB51; a stable rough strain of Brucella abortus. Vet. Microbiol., 28, Schurig G.G., Srirangananathan N. And Corbel M.J. (2002):Brucellosis vaccines:past present and future. Vet. Microbiol., 90, Stevens M.G., Henager S.G., Olsen S.C., Cheville N.F. (1994): Serologic responses in diagnostic tests for brucellosis in cattle vaccinated with Brucella abortus S19 or RB51, J.Clin. Microbiol., 32, Winter A.J., Schurig G.G., Boyle S.M., Srigananathan N., Bevins J.S., Enright F.M., Elzer P.H. and Kopec J.D. (1996): Protection of BALB/c mice against homologous and heterologous species of Brucella by rough strain vaccines derived from Brucella melitensis and Brucella suis biovar 4. Am. J. Vet. Res., 57, Zundel E., Verger J.M., Grayon M., Michel R. (1992): Conjunctival vaccination of pregnant ewes and goats with Brucella melitensis Rev 1 vaccine: safety and serological responses. Ann Rech. Vet. 23,
73 Kuduzda Korunma ve İmmünoprofilaksi Uygulamaları Doç. Dr. F. Şebnem ERDİNÇ SB Ankara Eğitim ve Araştırma Hastanesi 1. İnfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Kliniği Gelişmiş ülkelerin çoğunda kuduz hastalığı kontrol altındadır. Ülkemizde ise halen endemiktir. Sağlık Bakanlığı, Temel Sağlık Hizmetleri Genel Müdürlüğü tarafından, kuduz ve kuduz şüpheli ısırık vakaları ile ilgili olarak hazırlanan Kuduz Korunma ve Kontrol Yönergesi 2001 yılında Dünya Sağlık Örgütü nün önerileri doğrultusunda güncellenmiştir. Konuyla ilgili uygulamalar bu yönerge doğrultusunda yapılmalıdır. Hastalığın rezervuarı olarak pek çok vahşi ve evcil hayvan sayılabilmektedir. Ülkemizde kuduza yakalanma olasılığı olan hayvan türleri arasında, kurt, kır kurdu, tilki, çakal, yaban kedisi, kokarca ve gelincik gibi vahşi hayvanlar; köpek, kedi, sığır,koyun, keçi ve at gibi evcil hayvanlar sayılabilir. RİSKLİ TEMAS - Tüm vahşi ve evcil etobur hayvan ısırıkları, yeri ne olursa olsun kuduz için risk oluşturur. - Isırık dışı yaralar: Açık yara, kesi, müköz membranların tükrük, salya ve diğer nöral doku gibi potansiyel enfekte olabilecek materyalle teması ve tırmalama da riskli olarak kabul edilir/ Kuduz ancak virusun ısırık yarası, deride daha önce mevcut kesi veya bütünlük bozulması veya müköz membran temasıyla geçer. PROFİLAKSİ GEREKTİRMEYEN TEMAS - İnsan ısırıklarında kuduz olmadığı sürece profilaksi gerekmez. - Ülkemizde ve dünyada bugünkü verilerle fare, sıçan, sincap, hamster, kobay, gerbil, tavşan, yabani tavşan ısırıklarında insana kuduz geçişi gösterilmemiştir. Bu nedenle hayvan sağlığı ile ilgili kurumlar özel bir veri bildirmedikçe, bu tür hayvan ısırıklarında proflaksi gerekmez. 73
74 - Kuduz bir hayvanı beslemek, kan, idrar ve feçesle temas, pişmiş et ve sütünü yemek kuduz geçişi açısından risk oluşturmaz ve profilaksi gerekli değildir. - Kuduz hastasına rutin bakım yapan sağlık personeline müköz membran veya bütünlüğü bozulmuş deriye infeksiyöz materyal teması olmadıkça profilaksi gerekmez. - Rutin aşılanan kedi, köpek gibi hayvan ısırıklarında, hayvanın gözlenmesi şartı ile profilaksi gerekmez. Gerekirse bu konuda aşılamayı yapan veteriner hekimden bilgi istenmelidir. Kuduz yönünden sürekli risk oluşturan işlerde çalışan kişilerde temas öncesi profilaksi, şüpheli ısırık-temas durumlarında ise temas sonrası profilaksi uygulanmaktadır. TEMAS ÖNCESİ PROFİLAKSİ Temas öncesi profilaksi, kuduz riskli temas sonrası yaklaşım gerekliliğini ortadan kaldırmaz. Bununla birlikte kuduz immünoglobulin kullanımına gerek kalmaz ve aşı dozunu azaltır. Temas sonrası yaklaşımın gecikebileceği koşullarda koruyuculuğundan yararlanılır. Fark edilmeyecek temaslar için de koruyuculuk sağlayabilir. Temas öncesi profilaksi önerilen kişiler - Kuduz açısından yüksek riskli olan kişiler; veteriner hekimler, hayvan bakıcıları, kuduz laboratuarı çalışanları, - Kuduz olasılığı olan hayvanlarla sık temas eden kişiler, - Köpek kuduzunun yüksek olup, uygun tıbbi yaklaşımın verilemeyeceği bölgelere seyahat edenler. Aşı uygulama şekli ve takvimi: Kas içi uygulama: Deltoid kas içine 0., 7., ve 21. (ya da 28.) günlerde toplam üç doz aşı uygulanır İntradermal uygulama: İntradermal uygulamaya uygun olan aşı preperatları kullanılır. Halen insan diploid hücre kültürlerinde hazırlanmış intradermal aşı preperatları, bu amaçla kullanılmaktadır. Klorokin veya meflokin gibi antimalaryal ilaç alan veya alması gereken kişilere intradermal şema uygulanmamalıdır. Deltoid bölge üstüne 0., 7. 74
75 ve 21.(ya da 28.) günlerde 0.1 ml olarak uygulanır. Rapel doz: Kuduz virüs veya aşı üretiminde çalışanlar gibi yüksek risk grubunda olanlarda her altı ayda bir, diğer risk gruplarında iki yılda bir kuduz antikorları ölçülür. Eğer RFFIT ile tam nötralizasyon 1/5 serum dilüsyon altında ise, bir doz rapel önerilir. Bunun dışında normal bir kişide tam doz uygulamadan 2-4 hafta sonra antikor yanıtı gelişeceğinden rutin olarak antikor titre ölçümü önerilmez. Risk grubunda 2-3 yılda bir rapel yapılabilir. Ancak bağışıklığı baskılananlarda antikor ölçümü gereklidir. Temas öncesi proflaksi uygulananlarda, temas sonrası yaklaşım: Bu grupta kuduz şüpheli temasta, kuduz immünglobulinine gerek yoktur. 0. ve 3. günde olmak üzere toplam iki doz aşı uygulanır. TEMAS SONRASI PROFİLAKSİ Bir hayvanın davranışı ve görünümü, ısırık veya temasın durumu kuduz yaklaşımı için ipucu veren verilerdir. Öncelikle kuduz şüpheli bir temas olup olmadığı ve temasın niteliği değerlendirilmelidir. Temas sonrası profilaksi; Yara bakımı, Aşı uygulanması, Kuduz immünglobulin uygulanması, basamaklarını kapsar. Yara Bakımı Kuduz şüpheli temas profilaksisinde en önemli adım yara bakımıdır. Bu uygulama kuduz virüsü geçişini yüksek oranda azaltmaktadır. Tüm ısırık ve tırmık yaraları bol akarsu ve sabunla hemen yıkanmalı ve temizlenmeli, arkasından iyot, povidone-iodine gibi virusidal ajanlar uygulanmalıdır. Tüm hastalar tetanoz profilaksisi yönünden değerlendirilmelidir. Derin ve geniş yaralanmalarda kozmetik faktörler ve enfeksiyon riski değerlendirilerek, kuduz proflaksisi gerekiyorsa mutlaka yara çevresine kuduz immünglobulini yapıldıktan sonra sutür atılabilir. 75
76 Aşı Uygulanması Tüm temas sonrası bağışıklama yaklaşımları, arada geçen süre ve ısırık ya da ısırık dışı temas olup olmadığına bakmaksızın kuduz immünglobulin ve aşısının birlikte verilmesini kapsamalıdır. Mevcut hücre kültürü aşılarından her birinin yeterli etkinliğe sahip olduğu gösterilmiştir. Doz: 0.,3., 7., 14. ve 28. günlerde toplam beş doz uygulanır. Temas sonrası olabildiğince erken başlanmalıdır. Kuduzda inkübasyon süresi çok değişken olduğundan, temas sonrası geçen süreye bakmaksızın aşılamaya başlanmalıdır. Aşı, erişkinlerde deltoid bölgeye, kas içine uygulanır. Küçük çocuklarda uyluk anterolateral bölgeye kas içine uygulanabilir. Gluteal bölgeye enjeksiyon, antikor titresini düşürdüğü için asla yapılmamalıdır. 10 günlük gözlem süresi içinde şüpheli temasa neden olan hayvanın kuduz olmadığı kanıtlanırsa, aşı uygulamasına son verilir. Daha önce tam doz aşılanmış veya temas öncesi tam doz profilaksi uygulanmış kişilerde, temas sonrası bağışıklama, 0. ve 3. günlerde iki doz aşı, kas içine uygulanarak yapılır. Kuduz İmmünglobulini Uygulanması Kuduz immünglobulini tek dozda, bir kez uygulanır. Amaç aşılama ile antikor üretimi sağlanıncaya dek antikor düzeyini pasif olarak sağlamaktır. İlk aşı dozu ile birlikte aynı gün veya bir hafta sonrasına kadar uygulanabilir. İyileşmeye başlamış bir yara bile olsa mutlaka yaranın etrafına uygulanmalıdır. İlk aşı dozundan bir hafta sonra antikor yanıtı oluşacağından önerilmez. Gecikmiş vakalarda geçen süreye bakılmaksızın uygulanır. Dozu: İnsan kaynaklı olanlar için, 20 IU/kg; heterolog olanlarda, 40IU/kg olarak tam dozda yapılmalıdır. Dozun artırılmasının hiçbir yararı yoktur ve antikor yanıtını baskılayabilir. Uygulama, anatomik olarak uygunsa yara çevresi ve içine yapılmalıdır. Geri kalan miktar aşının yapıldığı ekstremiteden farklı bir ekstremiteye ve kas içine uygulanır. Eğer önerilen doz miktarı tüm yaraya uygulamak için yetersiz kalıyor ise steril serum fizyolojik ile 2-3 kat sulandırılarak immünglobulin miktarı arttırılabilir. 76
77 Asla aşıyla aynı enjektörle ve aynı anatomik bölgeye yapılmaz. At kaynaklı immünglobulin uygulanmadan önce test edilmelidir. Deri testi heterolog serum proteinlerine karşı IgE ile gelişen (Tip 1) hipersensitiviteyi tespit etmek için yapılır. 1/10 oranında seyreltilmiş 0.1 ml antiserum bilek-dirsek arası bölgeye 3mm çapında intradermal olarak yapılır. Aynı miktarda fizyolojik tuzlu su ile kontrol intradermal enjeksiyon yapılır. 15 dakika sonra antiserum uygulanan alanda çapın 6mm daha büyük olması, lokal ödem veya sistemik reaksiyon pozitif olarak kabul edilir. Negatif deri testi hipersensitivite reaksiyonu olmayacağı garantisi vermez. Gelişebilecek anafilaktik reaksiyona müdahele edebilmek için adrenalin hazır bulundurulmalıdır. Serumların Yan Etkileri İnsan kaynaklı kuduz immunglobulininin kullanılmasının ardından lokal ağrı ve hafif ateş gözlenebilir. İnsan kaynaklı kuduz immunglobulinine özgün olmamakla birlikte, diğer benzer bazı immunglobulinlerin enjeksiyonunun ardından çok nadiren anjiyonörotik ödem, nefrotik sendrom, anafilaksi geliştiği bildirilmiştir. At kaynaklı saflaştırılmamış anti-kuduz serumunun ise, anafilaksi gibi önemli yan etkilerine daha sık rastlanır. Human Rabies İmmun globuline (HRIG) e oranla çok ucuz olan at kaynaklı kuduz immun globulini (ARS-ERIG) ın total yan etki görülme oranı %1 6.1 dir. Bu yan etkilerde görülme sıklığına göre enjeksiyon yerinde lokal reaksiyon, jeneralize ürtiker, eritematöz döküntüler, eklem ağrısı, ateş ve atopik hastalarda astım krizidir. Kuduz immünglobulini gerektirmeyen durumlar: Temas öncesi tam aşılama yapılanlar, Daha önce hücre kültür aşılarıyla temas sonrası tam aşılama yapılanlar, Belge ile ispatlanmış, kuduz antikor titresi bulunanlar. Aşı uygulaması gerekmeyen durumlar -Aşılı hayvan tarafından ısırılma veya temas, -Bilinen ve halen sağlam bir hayvan tarafından 10 günden daha önce ısırılmış veya temas etmiş olanlar 77
78 -Fare gibi diğer küçük kemiriciler tarafından ısırılan veya teması olanlar, -Soğukkanlı hayvanlar tarafından ısırılanlar, -Kuduz veya kuduz şüpheli hayvanı besleyen, kan, idrar, dışkısı ile teması olan, etini ve sütünü pişirdikten sonra yiyenler, -Aşı ve immünglobulin yapılması risk oluşturup, 10 gün hayvanı gözleme alma seçeneği olan durumlar(ağır hastalık, malnütrisyon gibi) -Kuduz olmayan insan ısırıkları, -Kuduz hastasına rutin bakım uygulayanlar. Profilaksi uygulamalarında başarısızlık nedenleri: Toplumun tüm kesimlerinin özellikle çocukların kuduz şüpheli temas durumunda yara bakımı konusunda eğitilmesi ve bir sağlık kurumuna başvurması gerektiğini biliyor olması gerekmektedir. Ülkemizde her yıl çok sayıda kuduz riskli temas bildirilmektedir. Ancak kesin kuduz teması sonrası profilaksi başarısı konusunda halihazırda veri bulunmamaktadır. Tayland da, kuduz hayvan ile temas sonrası yüz ve baş bölgesinde yaralanma ile başvuran ve profilaksi başarısızlığı görülen 5 olgu bildirilmiştir. Tümü hücre kültürü aşısı ve immünglobulin uygulanmış olan bu olguların, 3 ünde yara bölgesine immünglobulin uygulamasından önce cerrahi kapatma işlemi yapıldığı, birinde ise intramüsküler immünglobin uygulandığı, daha sonra yaraya dikiş atıldığı, ancak yara çevresine immünglobulin uygulaması yapılmadığı belirtilmiştir. Tüm olgularda immünglobulin uygulamasının yara bölgesine yeterince uygulanmadığı saptanmıştır. Aşı veya immünglobulin temin edilememesi de önemli nedenlerdir. Özellikle insan kaynaklı immünglobulin bulunamaması, at kaynaklı serum kullanımının yan etkilerinden kaçınılmasına yol açabilmekte, yönergede belirtilen serum temin edilememesi durumunda önerilen alternatif aşılama tercih edilmektedir. Ülkemizde 2001 yılında yapılan bir çalışmada, 5 doz aşı + immünglobulin uygulanan 43 hasta ile aşı şeması uygulanan 42 hasta karşılaştırılmıştır. İlk grup hastada 7. günde %30 oranında koruyucu antikor düzeyi saptanmış, ikinci grupta ise bu oran %53 olarak bulunmuştur. Bir ay sonundaki koruyucu antikor yüzdeleri, birinci grupta %90, ikinci grupta %95 olarak saptanmıştır. Bu çalışma serum antikor düzeyinin bir hafta sonunda şeması ile hastaların yarısında koruyucu düzeye ulaştığını göstermektedir. Kuduz hastalığı patogenezi dikkate alındığında yara bakımı ve yara bölgesine immünglobulin uygulanması gerekliliği önemini korumaktadır. Yine serum uygulamasına alternatif arayışı ile yapılan 78
79 bir çalışmada, çok sayıda vücut bölgesine intradermal uygulanan aşılama yöntemleri denenmiş ancak immünglobulin uygulamasına alternatif olacak bir sonuç elde edilememiştir. Bu nedenle, her temas olgusunun, temas edilen hayvan, yaralanma bölgesi (sinir innervasyon sıklığı dikkate alınarak; örneğin el, yüz, baş bölgeleri), yaranın derinliği ve genişliği gibi özellikleri dikkate alınarak yara bakımı ve serum uygulaması ön planda olacak şekilde değerlendirilmesi gerekmektedir. Kaynaklar 1. Bleck TP, Rupprecht CE. Rhabdoviruses. In: Mandell GL, Bennet JE, Dolin R (eds.) Principles Practice of Infectious Diseases. 6th ed. Philedelphia: Churchill Livingstone, 2005: Khawplod p, Wilde H, Tepsumethanon S,et al. Prospective immunogenicity study of multiple intradermal injections of rabies vaccine in an effort to obtain an early immune response without the use of immunoglobulin. Clin Infect Dis 2002;35(12): Kuduz Korunma ve Kontrol Yönergesi T.C. Sağlık Bakanlığı Temel Sağlık Hizmetleri Genel Müdürlüğü / 7755 tarih ve sayı. 4. Kuduz Şüpheli Isırık Görülme ve Kuduz Mortalite Hızları, Türkiye, Temel Sağlık Hizmetleri Genel Müdürlüğü Çalışma Yıllığı Rabies vaccines. WHO position paper. Weekly Epidemiological Record, 2007, 82, Tulek N, Senocak H, Yetkin A, Un H, Aylan O. Antibody response achieved by different rabies prophylaxis methods. Int J Infect Dis. 2006;10: WHO Expert Committee on Rabies. Eighth Report. WHO Technical Report Series 824, Geneva:World Health Organization, WHO Expert Consultation on Rabies. First Report. WHO Technical Report Series 931, Geneva:World Health Organization, Wilde H, Sirikawin S, Sabcharoen A, et al. Failure of postexposure treatment of rabies in children.clin Infect Dis 1996;22(2):
80 SAĞLIK BAKANLIĞI: MEVCUT DURUM VE KUDUZ HASTALIĞI İLE İLGİLİ YÜRÜTÜLEN ÇALIŞMALAR Vet. Hekim Ahmet SAFRAN, Sağlık Bakanlığı, Temel Sağlık Hizmetleri Genel Müdürlüğü Zoonotik hastalıklar dünyada pek çok ülkede olduğu gibi ülkemizde de hala önemli halk sağlığı problemlerine neden olmaktadırlar. Toplumun sosyo-ekonomik durumu, kültürel alışkanlıkları bu hastalıkların görülmesinde önemli bir faktör olmasına karşın kaynakta hastalığın kontrol altına alınamayışı da diğer bir faktör olarak karşımıza çıkmaktadır. Ülkemiz için önemli zoonotik hastalıklardan birisi uzun yıllardır önemini koruyan kuduz hastalığıdır. Sağlık Bakanlığınca kuduz ve kuduz şüpheli temas olguları ile ilgili yürütülen çalışmalar bir program dâhilinde sürdürülmektedir. Kuduz ve kuduz şüpheli temaslılara yaklaşım ve uygulamalar, yürürlükte olan Kuduz Korunma ve Kontrol Yönergesi çerçevesinde yapılmaktadır. Bu çerçevede kuduz şüpheli teması söz konusu olan insan olguları değerlendirilerek ihtiyaç duydukları sağlık hizmetleri kendilerine sunulmaktadır. Kuduz insan vakalarının yıllara göre dağılımına bakıldığında, 1980 yılında 30 kuduz vakası olmasına rağmen 1989 yılında 10 vaka, 1999 yılında 7 vaka, 2009 yılında 2 vaka görülmüştür. Kuduz profilaksisinde 1987 yılından itibaren doku kültürü aşısı kullanılmaya başlanmış ve 1996 yılından itibaren de semple tipi kuduz aşısı uygulamasından tamamen vazgeçilmiştir. Kuduz Vakalarının Yıllara Göre Dağılımı (Türkiye; *) *2010 yılı 10 ay 80
81 Kuduz şüpheli temasa maruz kalanlara profilakside uygulanan doku kültürü aşısı ve kuduz antiserumu Sağlık Bakanlığı tarafından temin edilmekte ve ücretsiz olarak uygulanması sağlanmaktadır. Bu çerçevede 2009 yılında kuduz aşısı ve antiserumu için harcanan miktar yaklaşık 7 milyon Türk lirasıdır. Her ne kadar yıllar itibariyle kuduz vakalarında bir düşüş olsa da kuduz şüpheli temas olgularında tedrici bir artış yaşanmış olup 2009 yılında Sağlık Bakanlığına ; 2010 yılının ilk 6 ayında da kuduz şüpheli temas olgusu bildirilmiştir. Kuduz Şüpheli Temas Vakalarının Yıllara Göre Dağılımı (Türkiye, ) Kuduz Şüpheli Temas Olgularının İllere Göre İnsidans Dağılımı (2009, de) 81
82 Kuduz şüpheli temas olgularının artışı, ülkemizin önemli bir problemi olan sahipsiz hayvan popülâsyonunun sayısının kontrol altına alınamaması ve bunlara bağlı şüpheli temasın artmasının olduğu düşünülmektedir. Kuduz Şüpheli Temasa Neden Olan Hayvanların Tür Dağılımı (Türkiye, 2009, %) vaka sayısı Problemin asıl kaynağı olan sahipsiz hayvanların rehabilitasyonu ve kontrol altına alınması ve hayvanlarda gerekli aşılamaların yapılması sağlanmalıdır. Bunun için yeterli bütçe ve personel tahsisinin yapılması ve ilgili kurumların bir program dâhilinde kontrol çalışmalarını yürütmeleri ile kuduz hastalığı kontrol altına alınabilecektir. Ayrıca toplumun da hastalığa karşı duyarlılığın arttırılması ve mücadeleye katkı ve katılımının sağlanması da başka bir önemli noktadır. Sağlık Bakanlığınca yürütülen profilaksi ve sürveyans hizmetlerinin yanı sıra koruyucu hekimlik anlayışında eğitim dokümanlarının hazırlanması ve dağıtılması, hizmet içi eğitim ile bilgilendirme ve bilinçlendirme çalışmalarına da devam edilmektedir. Ayrıca, veteriner hekimler ve kuduz laboratuvarı çalışanları gibi risk grubunda yer alanlara temas öncesi profilaksi uygulamaları sağlık kurum ve kuruluşlarında yapılmaktadır. Bu çerçevede, 2009 yılında temas öncesi profilaksi kapsamında 3 doz kuduz aşısı 716 kişiye, 1 doz rapel aşıda 275 kişiye uygulanmıştır. Bunun yanı sıra başta Tarım ve Köyişleri Bakanlığı olmak üzere ilgili kurum ve kuruluşlarla koordinasyon ve işbirliği konularında azami itina gösterilmektedir. 82
83 Sahada yaşanan sıkıntıların başında ise toplumda bazı kesimin konuya ilişkin aşırı duyarlı ve titiz olmasına rağmen bazı kişilerin hala umursamaz ve önemsemez bir tavır sergilemesidir. Özellikle aşı programına devam konusunda hassas olunmasının istenilmesi ve sağlık kuruluşlarınca takip edilmesine rağmen bazı olgulara ulaşmakta veya aşısının yapılmasında güçlükler yaşanabilmektedir. Kuduz riskli temas sayısının oldukça yüksek olması da ayrı bir problem olarak karşımıza çıkmaktadır. Kuduz şüpheli temasa neden olan hayvanların müşahedeye alınması ve müşahede sonucunun ilgili sağlık birimlerine iletilmesinde de zaman zaman sıkıntı olabilmektedir. 83
84 Abdullah KÖSE Ankara Büyükşehir Belediyesi Sağlık İşleri Dairesi Başkanlığı Veteriner Şube Müdürü Sayın Oturum Başkanı, değerli katılımcılar, saygıdeğer konuklar sizleri şahsım ve kurumum adına saygılarımla selamlıyorum. Sunuma öncelikle yerel yönetimlerde konunun yasal boyutları ile başlayarak ülke genelinde ve Ankara ili özelinde, yerel yönetimlerin kuduz açısından öncelikli önem arz eden sahipli ve sahipsiz evcil hayvanlar ile ilgili olarak yapılan çalışmalar konusunda bilgi vererek başlamak istiyorum. Belediyeler çalışmalarını 5199 sayılı Hayvanları Koruma Kanunu ve Yönetmeliği, 5996 sayılı Veteriner Hizmetleri Bitki Sağlığı Gıda ve Yem Kanunu, 5216 sayılı Büyükşehir Belediyeleri Yasası, 5393 sayılı Belediyeler Yasası, 1593 sayılı Hıfzıssıhha Kanunu, İl Hıfzıssıhha Kurulu Karalarları ile İl Hayvanları Koruma Kurulu Kararları, Bakanlık Genelgeleri ve Belediye Meclis Kararları temelinde faaliyet göstermektedirler. Yerel yönetimler son yıllarda tarihinde 5199 sayılı Hayvanları Koruma Kanunu ve da yürürlüğe giren ilgili yönetmeliği kapsamında ağırlıklı olarak çalışmalarını sürdürmektedirler. Bu kapsamda, Çevre ve Orman Bakanlığı ikincil mevzuat hazırlamakta, hayvan hakları ile ilgili denetim ve gözetim hayvan barınaklarına yardım, eğitici yayın hazırlama gibi görevler üstlenmiştir. Tarım Bakanlığı da; pet shoplara ruhsat verme ve denetim, deney hayvanları üretim yerlerinin ruhsatlandırılması ve denetimi, hayvan hareketleri ve benzeri görevleri bulunmaktadır. Yerel yönetimlerin ise; sahipsiz hayvanları toplama yakalama, tedavi, aşılama, kısırlaştırma, karantina, kısırlaştırılan ve tedavileri tamamlanan hayvanların alındıkları ortama geri bırakma, barındırma, sahiplendirme, hayvan sevgisinin yaygınlaştırılmasının sağlanması, yönetmelikte bulunan diğer görevleri yerine getirmektedirler. Mevcut durum: Ülke genelinde Çevre ve Orman Bakanlığı verilerine göre sahipsiz sokak hayvanı sayısı minimum tahmin edilmektedir yılı verilerine göre ülke genelinde kısırlaştırma işlemi,
85 kuduz aşısı, karma aşı, hayvan (küpelenerek) işaretlenmiş, sokak hayvanı alındığı ortama bırakılmıştır. Barınaklarda bulunan hayvan sayısı ise adettir. Ülke genelinde 3226 Belediye ve toplam 116 adet barınak bulunmaktadır. Ankara Büyükşehir Belediyesi olarak çalışmalarımız, sahipli ve sahipsiz hayvanlara yönelik olarak sürmekte olup, sahipsiz hayvanlara verilen hizmetler ilçe belediyeleri ve gönüllü hayvan sever kuruluşlarca getirilen hayvanların muayene, tedavi, kısırlaştırma, kuduz aşısı, parazitlere karşı sağıtımı Kurtuluş Parkı içerisinde bulunan Tarım ve Köyişleri Bakanlığınca ruhsatlandırılan Evcil Hayvanlar Sağlık Merkezimizde, merkezden uzak ilçelerde verilen hizmetlerimiz 2 adet tam donanımlı geçici hayvan kliniği aracı ile 4 adet hayvan toplama ve nakil aracı ile sağlanmaktadır. Sağlık Merkezimiz 320m 2 kapalı alanda modern şekilde kurulan, veteriner hekimlikte kullanılan ve son yıllarda geliştirilen cihazlarla hizmet vermekte olup, içerisinde 2 adet muayene odası, ameliyathane, sterilizasyon odası, tam donanımlı laboratuar, röntgen, ultrasonografi ve endoskopi cihazlarının bulunduğu Türkiye Atom Enerjisi kurumu tarafından ruhsatlı görüntüleme ünitesi bulunmaktadır. Kısırlaştırma operasyonları sonrası geçici bakımları ise Sincan da bulunan geçici bakım merkezinde yürütülmektedir. Bu kapsamda; ( ilk altı aylık veri) yılları arasında; 12,506 adet kuduz aşısı, 4,257 adet dişi 3,021 adet erkek toplam 7,278 adet kısırlaştırma operasyonu, 19,613 adet paraziter ilaç uygulaması, mikroçip ile 2748 kayıt işlemi, 933 adet görüntüleme (röntgen, USG, endoskopi), 945 adet laboratuar hizmeti ve 18,190 adet diğer veterinerlik hizmeti olmak üzere toplam 62,213 genel veterinerlik hizmeti verilmiştir. İlimiz dahilinde sahipli ve sahipsiz hayvanların (öncelikle köpeklerin) kayıt altına alınması çalışmalarımız da başlamış bulunmaktadır. Bu amaçla Avrupa Birliğine üye ülkelerin uygulamaya başlamış bulundukları hayvanlara ISO veya ISO e uygun elektronik tanımlama (mikrochip) takılması projesi geliştirilmektedir. Bu sistemle sahipli hayvanlar ile sokaklardan toplanan ve kısırlaştırılan sahipsiz hayvanlara uygulanarak bilgisayar ortamında takibi sağlanacaktır. Sisteme ait alt yapı (donanım ve yazılım) örneği kurulmuş olup, denme aşamasındadır. Sistemle sahipli ve sahipsiz evcil hayvanların izlenmeleri, çevreye zarar vermeden sağlıklı bir şekilde yaşamalarını ve hazırlanan veri tabanı ile internet ortamında izlenmeleri amaçlanmaktadır. 85
86 Hayvan Kayıt ve Takip Sistemi, Transponder (mikrochip) uygulanmasının tüm Ankara geneline uygulanabilmesi, ilgili resmi kurum ve kuruluşlarla eşgüdüm içinde çalışma yapılabilmesi, Türkiye geneli ve uluslararası bir internet sitesi ve veri tabanı ile bu hizmetin ülkemiz ve diğer ülkeler arasında da hizmete sunulacak bir şekilde, sistem için çalışmalar sürmektedir. Uygulamanın öncelikle tüm Ankara genelinde uygulanabilmesi için metropol ilçe belediyelerine sisteme ait transponder, transponder okuyucusu, yakalama kafesi ve yazılım gibi malzemeler Başkanlık Olur u ve Meclis kararı ile devredilmesi planlanmaktadır. Yapılan bu hizmetlere ilave olarak belediyemiz Çevre ve Orman Bakanlığınca Ankara İline kurulacak barınak için arazi tespit çalışmaları sürmekte olup, tespit edilecek araziye sahipsiz hayvanlara yönelik barınak inşa edilecektir. Ayrıca; Tarım ve Köyişleri Bakanlığınca 2005 Yılı Avrupa Birliği mali yardımları çerçevesinde uygulamaya konulan Türkiye de Kuduz Hastalığının Kontrolü Projesi kapsamında Ankara, İzmir ve İstanbul İllerinde hayvan barınağı bakım ünitesi yapılması planlamıştır. Barınağın yapılması için Belediyemizce yer tahsisi yapılmış ve inşaat ruhsatı verilmiştir. Ankara ya hizmet sunacak olan bir adet hayvan hastanesi ve 4 adet geçici hayvan barınağından oluşan hayvan barınağı bakım ünitesinin inşası konusunda Tarım ve Köy İşleri Bakanlığı ile birlikte çalışmalar sürmektedir. Tesisin inşaatı bitme aşamasında olup, inşaatı sonrası Belediyemize devir edilmesi ve amacına uygun olarak kullanıma açılması hususu Belediyemiz Meclisinde tarihinde görüşülerek karara bağlanmıştır. Belediyemiz hayvan sevgisini geliştirmek adına Sincan ve Keçiören İlçesinde evcil hayvanlar parkı açmıştır. Sincan evcil hayvanlar parkımız Türkiye nin hayvan çeşitliliği ve kapsamı bakımından en büyük evcil havyan parkıdır. İçinde 16 tür ve 450 ye yakın havyan bulunmaktadır. Parkımız 7 gün 24 saat ücretsiz olarak ziyaret edilmektedir. Parkımızda ayrıca Ankara evi tarzında dekore edilmiş bir kafeterya, iki halı saha, iki basketbol ve voleybol sahası, 900 metrelik koşu ve yürüyüş parkuru, iki kondisyon çalışma alanı, iki çocuk oyun parkı ve tüm bu alanlara hizmet vermek için planlanmış spor tesisi vardır. 86
87 Belediyemizce, zoonoz hastalıkların önlenmesine de yardımcı olan; Çevre ve Orman Bakanlığı çıkarılan ve sayılı Tıbbi Atıkların Yönetmeliği ne göre tıbbi atıkların toplanması, taşınması ve bertarafı yapılmaktadır. Ankara İli genelinde 87 hastane, 39 Diyaliz Merkezi, 305 Sağlık Ocağı ve 1839 diğer sağlık kuruluşu olmak üzere; toplam 2270 sağlık kuruluşunun tıbbi atıkları toplanmaktadır. Tıbbi atıklar 13 lisanslı kamyonla toplanmakta olup, Sincan Çadırtepe düzenli depolama alanında bertaraf edilmektedir. Günlük ortalama 25 ton tıbbi atık toplanmakta ve bertaraf edilmektedir. İlimizde hayvanlara yönelik çalışmalar Büyükşehir Belediyesi ve İlçe Belediyeleri ile koordineli şekilde yürütülmektedir. Sahipsiz hayvanların toplanması hizmetleri öncelikle ilçe belediyelerince yürütülmekte ve imkanları ölçüsünde veterinerlik hizmetleri verilmekte olup, imkanlarını aşan durumlarda gerekli veterinerlik hizmetleri belediyemiz tarafından verilmektedir. İlimizde 2005 yılı AB mali yardımları çevresinde Türkiye de Kuduz Hastalığının Kontrolü Projesi kapsamında İl Tarım Müdürlüğü öncülüğünde 2008 yılında 4689 adet, 2009 yılında adet, 2010 yılında adet kuduz aşısı kedi ve köpeklere uygulanmıştır sayılı Kanun ve Yönetmelik ile başlayan çalışmalar sonucu hayvan sayılarının artışlarının durdurularak, azalma eğiliminde olmadığı gözlenmektedir. Sokak hayvanlarının bir bölümü de sahipli hayvanların sokağa terkleri ile oluşmaktadır. Köpek popülasyonunun yönetimini daha etkin sürdürülebilmesi için; Belediyelerin yeterli bütçe, personel, araç temini ve uygun bir alt yapı kurmaları, kapatılan Veteriner İşleri Müdürlüklerinin etkin hale getirilmesi, Sahipli ve sahipsiz hayvanların, etkin bir sistem ile kayıt altına alınarak, yaşamları boyunca kontrol ve takibinin sağlanması, Ülke genelinde eşgüdümlü kısırlaştırma ve aşılama kampanyasıyla rehabilitasyon hizmetlerine katkı sağlanması, paraziter uygulamalarının da periyo- 87
88 dik olarak uygulanması, Barınak yapımı ve sahiplendirmenin artarak sürdürülmesi,ayrıca 5199 sayılı Kanun ve bağlı Yönetmeliğin ülkemiz gerçeklerine uygun hale getirilmesi için yeniden gözden geçirilmesi de bizleri çözüme daha çabuk ulaştıracaktır. Beni dinlediğiniz için hepinize teşekkür eder, saygılar sunarım. 88
89 KLİNİK VE EPİDEMİYOLOJİK AÇIDAN KIRIM-KONGO KANAMALI ATEŞİ (KKKA) HASTALIĞINDA SON DURUM Doç. Dr. Nazif ELALDI Cumhuriyet Üniversitesi Tıp Fakültesi, Klinik Bakteriyoloji ve İnfeksiyon Hastalıkları Anabilim Dalı, SİVAS. Epidemiyoloji Etken virus insanlara başlıca vektör olan Hyalomma cinsi kenelerin, özellikle de H. m. marginatum un kan emmesi sırasında bulaşıp, zoonotik infeksiyon hastalığı oluşturmaktadır. Aksine sığır ve koyun gibi Hyalomma cinsi keneler için konak olan hayvanlarda belirtisiz infeksiyon ve bir hafta kadar süren geçici viremi oluşturmaktadır. CCHFV daha önce aralarında Hyalomma anatolicum anatolicum, Hyalomma truncatum, Hyalomma marginatum rufipes, Hyalomma impeltatum, Hyalomma impressum, Amblyomma variegatum ve Boophilus decolaratus türleri ile Rhipicephalus, Ornithodoros, Dermacentor ve Ixodes türleri de olan 30 civarında keneden izole edilmiştir. Virus bu kenelerden izole edilse bile bunlardan bazılarının henüz biyolojik vektör olduğu kanıtlanmamıştır. Günümüze kadar Hyalomma, Dermacentor ve Rhipicephalus cinsinden birkaç türün biyolojik vektör olduğu gösterilmiştir. Sığır, koyun, keçi, yabani tavşan ve tilki gibi hayvanlardan da izole edilen virus, ülkemizde Kelkit Vadisi kırsal kesiminde hayvanlar üzerinden toplanan H. m. marginatum ve R. bursa kene havuzlarında, yakın zamanda da Karadeniz Bölgesi nde yine hayvanlardan toplanan 421 kene havuzunun 46 (%11) sında gösterilmiştir. Keneler arasında virus, trans-ovarial, trans-stadial ve veneryal yolla aktarılmaktadır. Hastalık yaş ve cins farkı göstermeden sıklıkla orta yaşlı hayvancılıkla uğraşanlarda, mezbaha çalışanlarında ve kırsal kesimde yaşayanlarda görülmekte, infekte hayvanların kan ve dokuları ile temas sonucu bulaşmakta ve çiğ süt içimi ile de bulaşın olabileceği bildirilmektedir. Anneden bebeğe horizontal bulaş da mümkündür. Ülkemizde KKKA ya ait ilk epidemiyolojik veriler yayınlandığında kadın/erkek oranları yaklaşık eşit olmasına rağmen T.C. Sağlık Bakanlığı nın 2010 yılı verilerine göre erkekler kadınlara göre 89
90 daha fazla hastalığa yakalanmaktadır (%45 e karşılık %55). Bir bölgede virus bulaşını başlıca vektör kenelerin yoğunluğu ve vektörleri infekte edecek olan konağın bolluğu gibi faktörler de etkilemektedir. Hastalık için tarım çalışanları ve hayvancılık ile uğraşanlar, veterinerler, hasta hayvan ile teması olanlar ve akut hastalarla temas olasılığı olduğundan endemik bölgelerde görev yapan sağlık personeli, askerler, kamp yapanlar ile deri fabrikası işçileri yüksek risk altındadır. Türkiye de 2006 yılında Tokat ve Sivas kırsalında insanlar arasında yapılan bir seroprevelans çalışmasında bu bölgede yaşayan insanların %12.8 inde hastalığın geçirilmiş olduğunu gösteren anti- CCHFV IgG pozitifliği saptanmıştır. Bu çalışmada aynı zamanda 40 yaş (yıl) üzerinde olma, kene yapışması ve teması öyküsü olması ve hayvancılık ve çiftçilik ile uğraşma KKKA seropozitifliği ile ilişkili bulunmuştur. Doğu Avrupa ve Asya daki KKKA epidemilerinin genellikle insanlar tarafından oluşturan çevresel şartlara bağlı olarak geliştiği düşünülmektedir. Kırım daki ilk epideminin, İkinci Dünya Savaşı yıllarında kene ile infekte olmuş bölgelerin tarıma açılması nedeniyle oluştuğu sanılmaktadır. Eski Sovyetler Birliği ve Bulgaristan da olan epidemiler ise ziraatçılık ve hayvancılıktaki değişmelere bağlıdır. Hastalık mevsimsel özellik göstermektedir. Eski Sovyetler Birliği nde Haziran ve Temmuz aylarında olgu sayısı açısından en yüksek sayıya ulaşılmaktadır. Güney Afrika Cumhuriyeti nde olguların çoğu İlkbahar ve Sonbaharda ortaya çıkmaktadır. Genel olarak hastalığın Haziran-Eylül arasındaki aylarda ortaya çıktığı bildirilmektedir. Bununla birlikte bölgeye göre değişmekte ve Ocak ayında da görülebilmektedir. KKKA, günümüze kadar Asya, Afrika Ortadoğu ülkeleri ve Doğu Avrupa da gözlenmiştir. Türkiye de ilk kez 2002 yılının yaz aylarında Orta Karadeniz Bölgesi ve İç Anadolu Bölgesi nin Karadeniz Bölgesi ne yakın olan kesimindeki hastanelere karın ağrısı, bulantı-kusma, ishal, eklem ve kas ağrıları, ateş ve döküntü şikayetleri olan 46 hastadan bazılarından elde edilen serumların 2003 yılında CCHFV açısından test edilmesinden sonra tanımlanmıştır. T. C. Sağlık Bakanlığı verilerine göre hastalığın tanımlandığı 2002 yılından 2010 yılı arasındaki 9 yıllık sürede Türkiye de virolojik ve/veya serolojik olarak doğrulanmış toplam 5317 KKKA olgusu bildirilmiş ve bunlardan 267 (%5) si kaybedilmiştir. İnfekte hastalar ile temastan sonra gelişen nozokomiyal (hastane kaynak- 90
91 lı) KKKA epidemileri vardır. Özellikle hastalığın sık görüldüğü yerlerde bu mümkün olabilmekte ise de, yaz mevsiminde hastalığın görüldüğü bölgelere olan seyahatler nedeniyle başka bölgelerde de görülebileceği klinisyenler tarafından unutulmamalı ve KKKA benzeri klinik ve laboratuvar bulguları olan hastaların seyahat ve hasta teması açısından sorgulanması gereklidir. Nozokomiyal KKKA olguları bugüne kadar hastalığın endemik/ epidemik olduğu birçok ülkeden bildirilmiştir. Bu epidemilerde fatalite oranları oldukça yüksektir. Bunların arasında iyi irdelenmiş olanı Güney Afrika Cumhuriyeti nde Cape Town daki Tygerberg Hastanesi nde 1984 yılı Eylül ayında oluşan bir nozokomiyal KKKA epidemisidir. Bu hastanede bir indeks KKKA olgusunu takiben 7 sağlık personeline KKKA bulaşı olmuş, bunlardan biri ölmüş ve epideminin bariyer önlemleri ile kontrol altına alındığı bildirilmiştir. Bu hastanedeki epidemiyolojik araştırmalar sırasında sağlık personeli arasında 3 ü iğne batması olmak üzere toplam 9 yaralanma saptanmış, bu yaralanmalardan 3 ünde KKKA gelişmiştir. Buna göre iğne batmasının oluşturduğu morbidite 3/9 (%33) tür. Aynı araştırmada kanama gelişen hastalar ile toplam 46 temas öyküsü saptanmış, bunlardan 4 ünde KKKA gelişmiştir. Buna göre infektivite oranı 4/46 (%8.7) dır. Kanama gelişen ve gelişmeyen hastalar ile olan toplam 459 temas öyküsü saptanmış olup, yaklaşık infektivite oranı 7/459 (%1.5) olarak hesaplanmıştır. Bizim ülkemizde de KKKA lı hastaların sıklıkla takip edildiği merkezlerden nozokomiyal olgular (hastadan personele, hastadan hastaya) bildirilmektedir. Serolojik test sonuçlarına göre yapılan önceki çalışmalar, Dünyada çeşitli coğrafik bölgelerdeki CCHFV ler arasında ya çok az antijenik farklılığın olduğunu, yada antijenik farklılık olmadığını belirtmekte iken, günümüzde nükleik asit sekans analiz sonuçlarına göre coğrafik suşlar arasında önemli antijenik farklılıklar olduğunu göstermektedir. S genom segmentine göre yapılan sekans analizi, ilk olarak yayınlanan ve bu genetik farklılığı belirgin olarak ortaya koyan tekniktir. Buna göre; örneğin Birleşik Arap Emirlikleri nde yılları arasında izole edilen virus, daha önce Çin de koyunlardan izole edilen C68031 suşundan %10-12 farklı nükleotid farklılıkları içermektedir. Yine S segmentine göre Kosova da 2001 yılında izole edilen virus, Nijerya dan izole edilen suştan %17, Drosdov suşundan %4 farklıdır. Yunanistan da Rhipicephalus bursa türü bir keneden izole edilen ve günümüze kadar insanlarda hastalık oluşturduğu gösterilemeyen AP92 suşu, Kosova ve Arnavutluk dan izole edilen iki suştan sırasıyla %24.3 ve %25.3 oranında farklı nükleotid içermekte, dolayısıyla bu suşlara 91
92 benzememektedir. Bu suş, Avrupa suşlarından farklı bir suş olarak kabul edilmektedir. Birçok viral genetik analiz çalışması S genom viral segmentine göre yapılmasına rağmen, az sayıda çalışma M genom segmentine göre yapılmıştır. Bu çalışmalardan birinde Rusya ve Tacikistan suşları farklı filogenetik yapıdadır. Ülkemizde 2003 yılında Karadeniz Bölgesi nde insanlardan izole edilen virus, Drosdov ve Kosova suşu ile genetik olarak doğrudan bağlantılı ve aralarında S genom segmentine göre %1 lik nükleotid farklılığı gözlenmektedir. Aynı şekilde ülkemizde hastalardan izole edilen bu virus, 2002 de İran da hastalardan izole edilen virustan da filogenetik olarak farklıdır. Yakın zamanda ülkemizde yapılan bir çalışmada hastalığın artık endemik olduğu Kelkit Vadisi nde hayvanlar üzerinden toplanan 69 kene havuzunun 4 ünden izole edilen 4 farklı CCHFV suşunun S genom segmenti sekans analizine göre Kosova, Bulgaristan ve Drosdov suşlarına benzer olduğu gösterilmiştir. Dünyada sadece farklı coğrafik bölgelerden izole edilen viruslar arasında genetik farklılıklar olmayıp, farklı kene türlerinden izole edilen virusların da genetik olarak farklı olabileceği önceden bilinmektedir. Nitekim ülkemizden yapılan bu çalışmada H. m. marginatum kene havuzundan izole edilen virus ile R. bursa kene havuzlarından elde edilen 3 suş arasında %2.3 ile %2.8 farklılık gözlendiği bildirilmiştir. Dünyada günümüzde farklı coğrafyalarda filogenetik olarak sekiz farklı CCHFV klonu bulunmaktadır. Ülkemizden izole edilen CCHFV suşları beşinci klonda yer almaktadır. Klinik seyir Hastalığın inkübasyon dönemi, kene ısırığından sonra 2-12 gün arasında değişmektedir. Hastane personeli arasında indeks olguyu takiben gelişen olgularda ise 3-10 (ortalama 5.6) gündür. Bizim 2004 yılı içinde takip ettiğimiz 92 olgu arasında hastaların semptomların başlamasından sonra ortalama 5 gün içinde hastaneye başvurduklarını gözlemledik. Hastalık genellikle inkübasyonu takiben ani başlayan şiddetli baş ağrısı ve ateş ve titreme gibi influenza benzeri belirtilerle başlar. Ortalama ateş süresi 7-9 gün civarındadır. Bununla birlikte olguların yarısında ilk muayenede ateş saptanamayabilir. Hastaların %44 ünde ateşin ikinci ve altıncı günleri arasında saat arası olmak üzere kısa ateşsiz bir dönem izleyebilir. Bu durum deve sırtı veya iki pikli ateş grafiği oluşturur. Kas ağrısı, boğaz ağrısı, fotofobi görülebilir. Kas ağrıları yoğun olup özellikle sırtın alt kesimi ve bacaklarda görülür. Bulantı ve kusmalar da sıktır. Hastaların %50 sinde diffüz karın ağrısı görülür. Karın ağrısı bazen çok yoğun olup ishal de eşlik edebilir. 92
93 Hastalığın 2 ve 4. günleri arasında hastalar kızarık görünümde olup konjuktivada kızarıklık izlenir. Bizim gözlemlerimize göre olguların yaklaşık yarısında ciltte ve konjuktivalarda kızarıklık görülmektedir. Yüzde kızarıklık çok belirgin olup boyun, göğüs ve ellerde de görülebilir. Kanamaların görüldüğü dönemin hemen öncesinde karın ağrısı, tekrarlayan kusmalar ve ciddi bel ağrıları klinik olarak önemli tanısal bulgulardır. Bradikardi ve ateş-nabız diskordansı da saptanabilir. Hastalığın 3-6. günlerinden sonra maküler ve makülopapüler döküntüler ile peteşi ve purpura izlenir (Resim 1A ve B). Bu döküntüler genellikle burun kanaması, hematemez ve melena ile birliktedir. Kan alınan venin üzerindeki ciltte ekimoz ve kanama alanları önemli fizik muayene bulgularıdır (Resim 2). Bu dönemde hastalar sıklıkla apatiktir ve şiddetli kliniği olanlarda deliriyum ve koma görülebilir. Kanaması olan hastalarda hematüri, burun kanaması, gastrointestinal sistem ve kadınlarda vajinal kanamalar görülebilir. Fizik muayenede %20-40 arasında hepatomegali ve splenomegali görüldüğü bildirilmektedir. Ölüm genellikle hastalığın gününde izlenir ve ortalama fatalite oranı %20-50 arasındadır. Bununla birlikte ülkemizde takip edilen olgulardaki fatalite oranı %2-12 arasında ortalama %5.7 civarındadır. Daha önce yapılan çalışmalarda hastalığın şiddetli kategoride olup olmadığını gösteren ve değişik araştırmacılar tarafından öne sürülen bazı laboratuar parametrelerinin olduğu ve bu parametrelerin kullanılması halinde ölümün yüksek olasılıkla önceden tahmin edilebileceği bildirilmiştir. Bunlardan ilki Swanepoel ve ark. tarafından tanımlanmıştır. Buna göre hastalık semptomlarının başlamasından sonraki ilk 5 gün içinde 1-Kan lökosit sayısı 10 bin/mm3, 2-Kan trombosit sayısı 20 bin/mm3, 3- aspartat aminotransferaz (AST) değeri 200 İU/L, 4-alanin aminotransferaz (ALT) değeri 150 İU/L ve 5-aktive parsiyel tromboplastin (aptt) 60 sn veya fibrinojen seviyesi 110 µg/dl kriterlerinden en az birisi varsa hastanın şiddetli kategoride olduğu ve hastalıkta %90 ölümü gösterebileceği bildirilmiştir. İlk olarak, bu kriterlerin tanımlanmasının üzerinden yıllar geçmiş ve artık günümüzde hastalık için yeni laboratuar parametreleri gündeme gelmiştir. İkincisi, bu kriterler sporadik olgular için tanımlanmış olup kriterlerin salgın durumunda uygulanabilirliği açık değildir. Üçüncüsü, bizim yaptığımız çalışmalarda olgularımızın %80 i bu tanıma göre neredeyse şiddetli kategoride iken vaka ölüm oranımız %5-7 arasında olup olgularımızdaki ölümü tahmin etmede başarısızdır. Hepsinden önemlisi de bu hastalara verilecek destek tedavileri göz önüne alınmadan geliştirilmiş kriterler olduğundan, 93
94 artık günümüzdeki olgulara uygulanamaz. Bu yüzden farklı kriterlere ihtiyacımız bulunmaktadır. Ülkemizde Bakır ve ark. larının çalışmasında serum AST, laktat dehidrojenaz (LDH), kreatin fosfokinaz (CPK) ve international normalized ratio (INR) nun ölen olgularda yaşayanlara göre yüksek olduğu, bilinç bozukluğu ve splenomegalinin ise fatalite tahmininde bağımsız faktörler olduğu gösterilmiştir. Ergönül ve ark. larına göre serum AST ve ALT değerlerinin yüksek seviyeleri (>700 ve >900 İU/L) şiddetli olguları göstermede daha duyarlıdır. Çevik ve ark. ise kanda /mm3 ve altında trombositopeni ile birlikte somnolans ve melenanın ölümü gösteren bağımsız parametreler olduğunu ileri sürmektedirler. Hastalarda kandaki virüs yükünün ve doğal öldürücü (natural killer) hücrelerin ölümle bağlantılı olduğunu ve yüksek seviyelerinin ölümü gösterebileceğini gösteren klinik ve laboratuar çalışmaları da bulunmaktadır. Çevik ve ark. larına göre kanda virüs yükü 1 milyar kopya/ml ve üzerinde ise %90 civarında duyarlılık ve özgüllük ile ölümü tahmin edebilmektedir. Yakın zamanda yayınlanan ve ülkemizde yapılmış başka bir çalışmada da ishal, melena, hematemez, hematüri, yüksek ALT seviyesi ve uzamış aptt KKKA lı hastalarda ölümü gösteren bağımsız risk faktörü olarak belirlenmiştir. KAYNAKLAR 1. Albayrak H, Ozan E, Kurt M. An antigenic investigation of Crimean-Congo hemorrhagic fever virus (CCHFV) in hard ticks from provinces in northern Turkey. Trop Anim Health Prod. 2010;42(7): Anonymous. USSR lymedisease/cchf44.html 3. Bakir M, Ugurlu M, Dokuzoguz B, et al. Crimean-Congo haemorrhagic fever outbreak in Middle Anatolia; A multicenter study of clinical features and outcome measures. J Med Microbiol 2005;54: Capua I. Crimean-Congo haemorrhagic fever in ostriches: A public health risk for countries of the European Union? Avian Pathology 1998;27(2): Casals J. Antigenic similarity between the virus causing Crimean hemorrhagic fever and Congo virus. Proc Soc Exp Biol Med 1969;131(1): Cevik MA, Erbay A, Bodur H, et al. Clinical and laboratory features of Crimean-Congo hemorrhagic fever: predictors of fatality. Int J Infect Dis 2008;12: Cevik MA, Erbay A, Bodur H, et al. Viral load as a predictor of outcome in 94
95 Crimean-Congo hemorrhagic fever. Clin Infect Dis 2007;45(7):e Charrel RN, Attoui H, Butenko AM. Tick-borne virus diseases of human interest in Europe. Clin Microbiol Infect 2004;10: Duh D, Saksida A, Petrovec M, et al. Viral load as predictor of Crimean- Congo hemorrhagic fever outcome. Emerg Infect Dis 2007; 13 (11): Ergonul O, Celikbas A, Baykam N, Eren S, Dokuzoguz B. Analysis of riskfactors among patients with Crimean-Congo haemorrhagic fever virus infection: severity criteria revisited. Clin Microbiol Infect 2006;12(6): Ergonul O. Crimean-Congo haemorrhagic fever. Lancet Infect Dis 2006;6(4): Gear JH. Clinical aspects of African viral hemorrhagic fevers. Rev Infect Dis 1989; 11 (Suppl 4): Gunes T, Engin A, Poyraz O, Elaldi N, Kaya S, Dokmetas I, Bakir M, Cinar Z. Crimean-Congo hemorrhagic fever virus in high-risk population, Turkey. Emerg Infect Dis. 2009;15(3): Gözalan A, Akın L, Rolain J-M, ve ark. Tokat ili ve çevresinde saptanan olası bir salgının epidemiyolojik yönden değerlendirilmesi. Mikrobiyol Bult 2004;38(1-2): Hatipoglu CA, Bulut C, Yetkin MA, Ertem et al. Evaluation of clinical and laboratory predictors of fatality in patients with Crimean-Congo haemorrhagic fever in a tertiary care hospital in Turkey. Scand J Infect Dis. 2010;42(6-7): Hoogstraal H. The epidemiology of tick-borne Crimean/Congo hemorrhagic fever in Asia, Europe, and Africa. J Med Entomol 1979;15: Joubert JR, King JB, Rossouw DJ, Cooper R. A nosocomial outbreak of Crimean-Congo haemorrhagic fever at Tygerberg Hospital. Part III. Clinical pathology and pathogenesis. S Afr Med J 1985;68(10): Karti SS, Odabasi Z, Korten V, et al. Crimean-Congo hemorrhagic fever in Turkey. Emerg Infect Dis 2004;10(8): Nabeth P, Cheikh DO, Lo B, Faye O, et al. Crimean-Congo hemorrhagic fever, Mauritania. Emerg Infect Dis 2004;10(12): Nichol ST. Bunyaviruses. In: Knipe DM, Howley PM, Griffin DE, Lamb RA, Roizman B, Straus SE (eds). Fields Virology. 4 th ed. New York: Lippincot Williams and Wilkins, 2001, Vol 2.CHAPTER Oldfield EC 3rd, Wallace MR, Hyams KC, Yousif AA, Lewis DE, Bourgeois 95
96 AL. Endemic infectious diseases of the Middle East. Rev Infect Dis 1991;13(Suppl 3): Onguru P, Ozgur AE, Akinci E, et al. High serum levels of neopterin in patients with Crimean-Congo hemorrhagic fever and its relation with mortality. J Infect 2008; 56: Simpson DI, Knight EM, Courtois G, Williams MC, Winbren MP, Kibukamusoke J. Congo virus: A hitherto undescribed virus occuring in Africa. Part I. Human isolation-clinical notes. East Afr Med J 1967;44(2): Simpson DI. Viral haemorrhagic fevers of man. Bull World Health Organ 1978;56(6): Suleiman MN, Muscat-Baron JM, Harries JR, et al. Congo/Crimean haemorrhagic fever in Dubai. An outbreak at the Rashid hospital. Lancet 1980;2(8201): Swanepoel R, Gill DE, Shepherd AJ, Leman PA, Mynhardt JH, Harvey S. The clinical pathology of Crimean/Congo hemorrhagic fever. Rev Infect Dis 1989;11(Suppl 4): Tonbak S, Aktas M, Altay K, et al. Crimean-Congo hemorrhagic fever virus: genetic analysis and tick survey in Turkey. J Clin Microbiol 2006; 44(11): van Eeden PJ, Joubert JR, van de Wal BW, King JB, de Kock A, Groenewald JH. A nosocomial outbreak of Crimean-Congo haemorrhagic fever at Tygerberg Hospital. Part I. Clinical features. S Afr Med J 1985;68(10): Whitehouse CA. Crimean-Congo hemorrhagic fever. Antiviral Res 2004;64(3): Wolfel R, Paweska JT, Petersen N, et al. Virus detection and monitoring of viral load in Crimean-Congo hemorrhagic fever virus patients. Emerg Infect Dis 2007; 13 (7): World Health Organization. Communicable Disease profile Iraq. Updated 19 March Communicable Disease Working Group on Emergencies, HQ Division of Communicable Disease Control, EMRO WHO Office, Baghdad. 32. World Health Organization. Communicable Disease Profile in Iraq (2003). whocds200317/1profile.pdf#search= Communicable Disease profile Iraq 33. World Health Organization. Viral hemorrhagic fever in Iraq confirmed as 96
97 Congovirus. Wkly Epidemiol Rec 1979;54: World Health Organization. Viral hemorrhagic fever, Pakistan. Wkly Epidemiol Rec 1976;51(33): Yashina L, Petrova I, Seregin S, et al. Genetic variability of Crimean- Congo haemorrhagic fever virus in Russia and Central Asia. J Gen Virol 2003;84: Yilmaz M, Aydin K, Akdogan E, et al. Peripheral blood natural killer cells in Crimean-Congo hemorrhagic fever. J Clin Virol 2008; 42:
98 DÜNDEN BUGÜNE KKKA Uz. Dr. Tamer Sami Pelitli SAĞLIK BAKANLIĞI TSHGM ZOONOTİK VE PARAZİTER HASTALIKLAR DAİRE BAŞKANLIĞI İlk defa 2002 yılında, Tokat ili ve civarında klinik olarak halsizlik, yaygın vücut ağrısı, ateş, kusma ve baş ağrıları ile bir takım laboratuar bulgularına (trombositopeni,lökopeni ve karaciğer enzim yüksekliği vb.) haiz benzer vakaların görülmesi üzerine araştırmalar başlatılmıştır. İlk bulgular ve yapılan incelemelerden hastalığın riketsiyal bir enfeksiyon olabileceği ihtimali üzerinde durulmuş, bölgede hizmet veren çeşitli fakülte ve devlet hastanelerinde yatan vakalardan kan örneği alınarak RSHMB ye ulaştırılmış ve buradan da riketsiyal enfeksiyonlar yönünden incelenmek üzere yurt dışına (Japonya da bulunan National Instutte of İnfectious Diseases-Toyama ve Fransa da bulunan Centre National de Reference des Ricketsioses Groupe Hospitalier de la Timone Universite d aix-marseille II ye) gönderildi. Yurt dışından gelen analiz sonuçları 7 hastanın akut Q ateşi olduğu, 8 hastanın ise Q ateşi için geçirilmiş enfeksiyon olduğu anlaşılmıştır. Ancak,2003 yılının yine bahar ve yaz aylarında aynı klinik tablo ile seyreden benzer vakaların bakanlığımıza bildirilmesi üzerine çalışmalara tekrar başlandı. Olgulardan alınan kan ve serum örneklerinin analizleri Pastör Enstitüsünde yaptırılmış ve analiz sonucunda hastalığın KKKA olduğu 2003 yılı Ağustos ayı ortalarında kesin olarak ortaya konuldu. Hastalığın belirlenmesinden sonra Kırım-Kongo Kanamalı Ateşi Bilimsel Kurulu daha da genişletilerek hastalıkla ilgili alınması gereken önlemler ve bundan sonra yapılacak olan çalışmalar belirlendi. Yine aynı komisyon her yıl belirli dönemlerde toplanarak gerekli değerlendirme ve planlamalara ilişkin tavsiyelerde bulunmaktadır. Kırım Kongo Kanamalı Ateşi Hastalığı; ilk tespit edildiği 2002 yılından bugüne kadar, havaların ısınmaya başlaması ile birlikte hastalığın taşıyıcısı ve bulaştırıcısı olan kenelerin aktif hale gelmesi sonucu, Nisan-Ekim ayları arasında ülkemizde önemli bir halk sağlığı sorunu teşkil etmeye devam etmektedir. Son yıllarda hastalığın görüldüğü alan genişlemiş olup, hemen hemen 98
99 ülkemizin her bölgesinden sporadik vaka bildirimi yapılmaktadır. T.C. Sağlık Bakanlığı,hastalıktan korunma ve kontrol konusunda çeşitli faaliyetler yürütmektedir. Bunlar: Kırım Kongo Kanamalı Ateşi Hastalığının aşısı ve spesifik tedavisi olmadığı için hastalıktan korunma çok önemlidir. Bunun için de eğitim faaliyetleri ön planda gelmektedir. Bu amaçla hem personelin hem de halkın eğitimlerinde kullanılmak üzere KKKA Eğitim Modülü hazırlanmış ve illere dağıtıldı. Hem endemik bölgelerde hem de endemik olmayan ancak sporadik olarak vaka görülen bölgelerde çalışan sağlık personelinin eğitimi için bölge çalıştayları yapıldı. Bu çalıştaylara İl Sağlık Müdürlükleri Bulaşıcı Hastalıklar Şubesi nde çalışan personel, infeksiyon hastalıkları uzmanları, dahiliye uzmanları, çocuk hastalıkları uzmanları ve acil serviste çalışan hekimler katıldı. KKKA hastalığı, konunun uzmanı öğretim üyeleri tarafından anlatıldı. Kene Tutunması ile Gelen Hastalara Yaklaşım Algoritması ve Vaka Yönetim Algoritması oluşturularak tüm sağlık kuruluşlarına dağıtılmıştır. KKKA Hastalarına Uygulanması Önerilen Standart Enfeksiyon Kontrol Önlemleri Ve Sağlık Çalışanının Korunması rehberi hazırlanmıştır. KKKA hastalığının en yoğun görüldüğü illerde hane ziyaretleri ile yüz yüze halk eğitimi yapılmaktadır. Bu kapsamda 2009 yılında hane ziyaret edilerek toplam kez, 2010 yılında ise hane ziyaret edilerek kez yüz yüze eğitim verilmiştir. Eğitimlerde kullanılmak üzere, 2010 yılında afiş ve el broşürü hazırlandı ve başta endemik iller olmak üzere 81 ilimizin tamamına dağıtıldı. Korunma konusunda kene-insan temasının önlenmesi önemlidir. Kene ile mücadele kapsamında iki türlü çalışma planlandı. Hastalık riskinin bulunduğu yerlerde kene popülasyonunu kabul edilebilir bir seviyeye indirgenmesi çalışmaları çerçevesinde Tarım ve Köyişleri Bakanlığımız tarafından sığırlar başta olmak üzere çiftlik hayvanlarında periyodik olarak ilaçlama çalışmaları sürdürülmektedir. İkinci çalışma ise pilot bir ilde yürütülmekte olan hayvanların zamanında uygun şekilde ilaçlanmasının sağlanmasıyla hayvandaki kene sayısında azalmanın tespiti ve kenelerde ilaca karşı direnç durumunun araştırılması projesidir. 99
100 Bu projenin sonuçları doğrultusunda KKKA nin endemik olduğu bölgelerde uygulamaya geçilecektir. Kene tutunması durumunda kullanılmak üzere kene çıkarma kartı dağıtıldı, halkın bu kartı kullanmasının keneyi vücudundan hemen çıkarma konusunda duyarlılığını artıracağı ön görüldü. Hastaların daha yakından takip ve tedavi gerektiren durumlarda bir üst basamak sağlık kuruluşuna sevk edilmeleri gerekmektedir. Sevk edilecek hastalar için 16 ilde bölge merkezleri oluşturuldu. Hastaların tedavisinde kullanılmak üzere immün serum oluşturuldu ve bir çalışma kapsamında bazı hastaların tedavisinde kullanılmaktadır, bu çalışmanın sonuçlarına göre kullanımının yaygınlaştırılması hedeflenmektedir. Ribavirin adlı ilacın etkinliğini araştırmak üzere bir çalışma grubu oluşturuldu, bu çalışmanın hazırlıkları sürmektedir. Vaka görülen yerler tespit edilerek bu bölgelerde kene popülasyonu araştırıldı, hastalık etkenini taşıyan kenenin Hyalomma soyuna ait olduğu tespit edildi. Ayrıca bu verilere dayanılarak ülkemizin kene ve vaka haritası çıkarıldı. 100
101 VAKALARIN COĞRAFİK DAĞILIMI (TÜRKİYE, ) 101
102 KKKA hastalığının bildirimi için Web tabanlı bildirim sistemi oluşturuldu. Vaka bazlı sürveyans yapılmaktadır. Hastalıkla ilgili bilgilere kolay ulaşılabilmesi için bir web sitesi (www. kirimkongo.gov.tr) kurulmuş olup, ayrıca vatandaşların hastalık hakkında merak ettiği konularda danışmaları için bir e-posta adresi oluşturuldu. 102
103 Standart bilgiler ve yöntemlerle eğitim yapılması amacıyla hem sağlık personeli hem de halk eğitimlerinde kullanılmak üzere içerisinde KKKA nın da yer aldığı Zoonotik Hastalıklar Eğitim Modülü hazırlandı ve illere dağıtıldı. Sonuç olarak; tespit edildiği yıldan beri, her sene artış gösterme eğiliminde olan KKKA vaka sayısı 2009 yılında yaklaşık aynı kalırken, 2010 yılında %35 oranında azaldı. 103
104 KIRIM KONGO KANAMALI ATEŞİ HASTALIĞI VE TARIM VE KÖYİŞLERİ BAKANLIĞININ ÇALIŞMALARI Ahmet UYAR, Şube Müdürü TKB Koruma ve Kontrol Genel Müdürlüğü Halk Sağlığı Hizmetleri Daire Başkanlığı Zoonoz Hastalıklardan Korunma Hizmetleri Şubesi Keneler yaklaşık 200 kadar hastalık etkenini insanlara ve hayvanlara bulaştırabilmektedir. Bunların içinde özellikle Lime Borreliosis (LB), Tick-Borne Encephalitisi (TBE), Q Humması, bazı Anaplasma ve Rickettsia kökenli hastalıklar insanlar açısından önem arzetmektedir. Bu hastalıklardan birisi de Kırım-Kongo Kanamalı Ateşi (KKKA) Hastalığıdır. Hastalık etkeni Bunyaviridae ailesinin Nairovirüs soyu içinde yer alan 100 nm büyüklüğünde tek sarmallı, segmentli bir RNA virüsüdür. Zoonoz karakterli bir hastalık olmakla beraber hayvanlarda asemptomatik, insanlarda ise sporadik vakalar ve salgınlar şeklinde seyretmektedir. Hastalık ilk kez yıllarının yaz aylarında Kırım da Nazi işgalinden kurtulan köylülere yardım eden Sovyet askerleri arasında görülmüş, ateş ve kanamadan dolayı Kırım kanamalı ateşi olarak isimlendirilmiştir yılında Zaire de ateşli bir hastadan izole edilen Kongo virüsünden antijenik olarak ayırt edilememiş ve böylece hastalık Kırım-Kongo Kanamalı Ateşi Hastalığı (KKKAH) olarak isimlendirilmiştir li yıllardan önce olguların çoğu Sovyetler Birliği, Bulgaristan, Kongo ve Uganda dan bildirilmiştir yılları arasında Güney Afrika Cumhuriyeti, Kongo, Moritanya, Tanzanya ve Senegal den detaylı çalışmalar sunulmuş, Irak, Pakistan, Birleşik Arap Emirlikleri, Suudi Arabistan, Umman ve Çin den çok sayıda vaka bildirilmiştir yılı itibariyle de Pakistan, İran Senegal, Arnavutluk, Yugoslavya, Bulgaristan, Kenya, Moritanya ve Türkiye den yeni salgınlar bildirilmiştir. KKKA virüsü doğada kene-vertabralı-kene döngüsü içinde dolaşır. Keneler hastalığın doğadaki esas taşıyıcısıdırlar. Evcil ve yabani hayvanlar virüsü 7-10 gün kadar barındırabilmelerine karşın, virüs kenelerde ömür boyu hatta 104
105 nesiller boyu kalmakta ve çoğalabilmektedir. Virüs Hyalomma genusundan kenelerle, özellikle H. marginatum marginatum tarafından taşınmaktadır. Virüs 30 kadar kene türünden izole edilmiştir ancak vektör yeteneği kanıtlanmış kene türleri Amblyomma variegatum, Hyalomma marginatum, H. rufipes, H.anatolicum, H.asiaticum, H.truncatum, H.impeltatum, Dermacentor marginatus, Rhipicephalus evertsi, Rh. rossicus dur.. Bunlardan Hyalomma marginatum, H. asiaticum ile H. anatolicum un Avrasyanın farklı bölgelerinde, Hyalomma rufipes in ise Afrika da Kırım-Kongo virüsünün ana vektörleri oldukları kabul edilmektedir. Vektörlük potansiyeli kanıtlanmış kenelerden Hyalomma marginatum, Hyalomma anatolicum ve Dermacentor marginatus ülkemizde de yaygın olarak bulunur. Ancak ülkemizde hastalığın insanlara bulaştırılması ile ilişkili kene türü H. marginatum olarak göze çarpmaktadır. H. marginatum yaban hayatı ile çok yakın ilişkili olup, bozkır ikliminin diğer iklim kuşakları ile kesiştiği bölgelerde özellikle de kuru taban örtüsüne sahip bodur ormanlık (meşe ve ardıç) alanlarda yayılış gösterir. Hyalomma marginatum iki konaklı bir yaşam döngüsüne sahiptir. Larva ve nimf evreleri, beslenmek için küçük yabani hayvanlar (özellikle tavşan ve kirpi) ile yerden beslenen kuşları (karga, keklik, sığırcık, hindi vs.) tercih etmektedirler. Larvadan nimfe dönüşüm aşaması (gömlek değiştirme) bu konaklar üzerinde gerçekleşir. Bu hayvanlardan gün boyunca kan emip beslenirler ve doymuş nimf olarak yere düşerler. Yere düşen nimfle, çevre şartlarna bağlı olarak 4-20 günde gömlek değiştirerek aç erişkin haline gelirler (erkek ve dişi erişkin aç keneler). Bu dönem genellikle sonbahara geldiğinden, aç erişkin keneler konak aramak yerine doğada kışı geçirebilecekleri bir yere saklanırlar. Kış bitince ertesi yılın ilkbaharında aktif hale gelirler. Bu keneler diğer bazı kenelerin aksine otlara tırmanıp konak beklemezler ve toprakta veya bodur bitkiler altına 105
106 gizlenerek etraflarından kan emebilecekleri büyük bir konağın ( sığır, koyun, at keçi gibi evcil hayvanlar ve insan ile domuz gibi yabani hayvanlar) geçmesini beklerler. Çevrede bir konağın varlığını hissetmedikleri taktirde aylarca saklandıkları yerde bekleyebilirler. Uygun konağı bulup konağa tutunan erişkin keneler, bu konaklardan 9-14 gün boyunca kan emer ve çiftleşme olayını kan emme sırasında gerçekleştirirler. Doyan dişi keneler toprağa düşer ve kendilerine yumurtlamak için uygun bir yer bulup sayısı 7000 e kadar varan yumurta bırakıp ölürler. Hyalomma marginatum un yaşam döngüsü, konak hayvan bulabilmesi ve mevsime bağlı olarak 4 ay ile1,5 yıl arasında değişen sürede tamamlanır. İnsanlara bulaşma, enfekte kenelerin insana tutunarak kan emmesi veya ezilmesi, enfekte olmuş hayvanların taze kesilmiş dokuları ve hasta insanların salgıları ile temas sonucunda olmaktadır. İnsanlarda kenenin tutunup kan emmesi sonucu virüsün alınmasını müteakip kuluçka süresi ortalama 1-3 gündür, bu süre en fazla 9 gün olabilmektedir. Enfekte kan, ifrazat veya dokulara doğrudan temas sonucu bulaşmalarda bu süre ortalama 5-6 gün olup en fazla 13 gün olabilmektedir. İnsanlarda görülen semptomlar ateş, kırgınlık, baş ağrısı, halsizlik, aşırı duyarlılık, kollarda, bacaklarda ve sırtta şiddetli ağrı ve belirgin bir iştahsızlıkla başlar. Bazen kusma, karın ağrısı veya ishal de olabilir. İlk günlerde yüz ve göğüste peteşi ve konjonktivalarda kızarıklık dikkati çeker. Gövde ve ekstremitelerde ekimozlar oluşabilir. Ölüm daha çok hastalığın ikinci haftasında (5-14. gün) görülmektedir. İyileşme ise günlerde olmaktadır. Ülkemizin, Çorum, Yozgat, Sivas, Tokat, Amasya, Bayburt, Gümüşhane, Çankırı, Kastamonu, Karabük, Erzurum ve Erzincan illeri başta olmak üzere Karadeniz ve Ege Bölgesinin iç kesimleri Trakya Bölgesinin ve Torosların dağlık kesimleri, İç Anadolu Bölgesinin kuzeyi riskli bölgelerdir. Biyolojisi gereği evcil hayvanlarımız ve insanlarımız bu keneleri riskli bölgeler dediğimiz meşelik ormanlara yakın olan tarla ve ormanlık arazilerden almaktadırlar. Şehirlerimizde, sahil kıyı kesimlerinde, ovalık ve yabani hayvanların bulunmadığı ovalarda bu hastalık riski de yok denecek kadar azdır. Hastalık; yaban hayatı ile iç içe olan tarım arazilerinde çalışan köylüler, orman işçileri ile bu riskli yerlere ava veya pikniğe gidenler, çiftlik çalışanları, çobanlar, kasaplar, mezbaha çalışanları, hayvancılık ile uğraşanlar, veteriner hekimler, veteriner sağlık teknisyenleri, hastalarla temas olasılığı bu- 106
107 lunan salgın bölgelerinde görev yapan sağlık personeli, askerler ve kamp yapanlar risk grubundaki insanlardır. Hastalık, ülkemizde yıllarının bahar ve yaz aylarında bazı illerimizde görülmüş Bakanlığımız ve Sağlık Bakanlığının yaptığı çalışmalar sonucunda KKKAH olduğu tespit edilmiştir. KKKA Hastalığının görüldüğü ilk andan itibaren Bakanlığımız ile Sağlık Bakanlığı ortak çalışmalar başlatmış ve bu konuda ortak çalışma grupları oluşturulmuş, Refik Saydam Hıfzısıhha Merkez Başkanlığı ile Etlik Merkez Veteriner Kontrol ve Araştırma Enstitüsü vakaların görüldüğü illerde hasta insan ve hayvanlardan alınan kan ve serum örneklerini karşılıklı olarak insan ve hayvan açısından incelemişlerdir. İnsan ve hayvan sağlığı açısından önemli olan ve ülkemizde yaygın olarak görülen zoonoz hastalıklarla etkili olarak mücadele edilebilmesi, koruma tedbirlerinin alınabilmesi, zoonoz hastalıklarla ilgili plan, proje ve prensiplerin tespiti ile bu konudaki her türlü faaliyetin sürdürülmesini temin etmek amacıyla Sağlık Bakanlığı ve Tarım ve Köyişleri Bakanlığı arasında 1991 yılında iki Bakanlık arasında bir protokol imzalanmış ve protokol gereği Türkiye Zoonoz Milli Komitesi oluşturulmuştur. Komitenin yaptığı ilk toplantıda insan ve hayvan sağlığının korunması ve halkın bu konuda bilinçlendirilmesi amacıyla ilk planda Kuduz, Toxoplasmosis, Brucellosis ve Echinococcosis için mücadele raporları hazırlanmıştır. KKKA Hastalığı ile ilgili olarak sekreteryası yılları arasında Bakanlığımız tarafından yürütülen Türkiye Zoonoz Milli Komitesi nin 2003 yılı içerisindeki iki olağan toplantı gündemine de alınarak hastalığın durumu ve koruma tedbirleri konusunda iki bakanlığın alacağı tedbirler detaylı görüşülmüştür. Yine yıllarında yapılan olağan toplantılarda ana gündem maddesi olarak KKKA Hastalığı görüşülmüştür. Hastalığın tespit edilmesinden itibaren gerek bakanlığımız personelinin gerekse toplumun bilgilendirilmesi amacıyla poster, afiş ve broşür hazırlanarak dağıtımları sağlandı. Vakaların görüldüğü illerde hayvanlardan alınan kan ve serum örnekleri incelendi ve kenelerde ve evcil hayvanlarda tür belirleme ve serolojik çalışmalar yapıldı. 107
108 Konu ile ilgili olarak gerek Sayın Bakanlar düzeyinde gerekse üst yönetim düzeyinde ilgili bakanlıklar arası koordinasyon toplantıları düzenlenerek durum değerlendirilmeleri yapılmış ve gerekli tedbirlerin alınması hususunda çalışmalar yapılmıştır. Tarım ve Köyişleri Bakanlığı olarak her ne kadar hayvanlarda hastalık belirtisi görülmese de kenelerin taşıdığı etkenlerle (virüslerle) insanlarda ölüme neden olan Kırım Kongo Kanamalı Ateşi hastalığın önlenmesi ve aynı zamanda hayvanlarda paraziter hastalıkların ve verim kaybının ortadan kaldırılmasını amacıyla evcil hayvanların ilaçlanması önem arz etmiştir. Kene aktivasyonunun Nisan-Eylül aylarında yoğun olarak görüldüğü dikkate alındığında evcil hayvanların kene mücadelesine uygun ilaçlarla düzenli olarak ilaçlanması gerektiğinden 2007 yılında Bakanlığımızca riskli olarak kabul edilen 36 İl Müdürlüğünce (Adana, Afyonkarahisar, Amasya, Ankara, Artvın, Aydın, Balıkesır, Bayburt, Bılecık, Bolu, Cankırı, Corum, Erzıncan, Erzurum, Eskısehır, Gumushane, Gıresun, Isparta, Mersin, Izmır, Karabuk, Kastamonu, Kayserı, Kırıkkale, Kırklarelı, Kırsehır, Kutahya, Manısa,, Mugla, Ordu, Samsun, Sıvas, Tokat, Trabzon, Sanlıurfa ve Yozgat) hayvanlarda kene ilaçlaması yapılmış olup 2008 yılında da bu ilaçlama çalışmaları devam etmiştir. Ancak 2009 yılında ise Sağlık Bakanlığı ile yapılan protokol gereği KKKA Hastalığının görülme riskinin bulunduğu ve vakaların %85-90 oranında görüldüğü 15 İl Müdürlüğünce (Amasya, Ankara, Bolu, Çankırı, Çorum, Erzurum, Giresun, Gümüşhane, Karabük, Kastamonu, Ordu, Samsun, Sivas, Tokat ve Yozgat) ilaçlama çalışmalarına devam edilmiştir yılında da bu ilaçlama çalışmalarına gereken önem verilerek riskli bölgelerdeki hayvanlarımızın ilaçlanması sağlanmıştır. Tüm hayvan hareketleri öncesinde hayvanlarda gerekli kene ilaçlaması yapılmasının sağlanması hususunda ilaçlama yapılmayan hayvanların sevklerine müsaade edilmemesi hususunda İl Müdürlüklerine talimat verilmiştir. Kırım Kongo Kanamalı Ateşi Hastalığını önlemede asıl amaç insan-kene temasını kesmektir. Bu amaçla ilaçla mücadelenin yanı sıra yetiştiricilerimizin bilgilendirilmesi amacıyla İl/İlçe Müdürlüğümüzde görevli Veteriner hekimlere, bunlarla birlikte Sağlık İl Müdürlüğü, Çevre ve Orman İl Müdürlüğü personeli olmak üzere TSK ya bağlı görev yapan Veteriner Hekim subaylar, Tabipler Odası, Veteriner Hekimler Odası, avcı dernekleri, Tıp ve Veteriner Fakülteleri gibi ilgili kurum ve kuruluşların personeli de eğiticilerin 108
109 eğitimi kapsamında bilgilendirilmesi amacıyla 2009 yılında toplam 48 ilde eğitim çalışmaları yapılmıştır. Bu eğitimlerde Üniversiteler, Sağlık Bakanlığı ve Bakanlığımız birlikte çalışmıştır yılında başta KKKA Hastalığında rol oynayan kenelerle ilgili olarak mezbahalarda kesim öncesi ve sonrası alınacak önlemler ile ilgili olarak mezbaha sorumlu yöneticileri olmak üzere Hayvan Sağlığı Şube Müdürleri ve Veteriner Hekimlere yönelik 7 ayrı bölgede toplamda 53 il müdürlüğü için eğitimler gerçekleştirilmiştir. Kırım Kongo Kanamalı Ateşi (KKKA) Hastalığı ile ilgili olarak hizmet içi eğitimler dışında, Bakanlığımız konu ile ilgili diğer Bakanlık ve kuruluşlarla da koordineli olarak çeşitli çalışmalar yapmaktadır. Bu maksatla başta Sağlık Bakanlığı olmak üzere İçişleri Bakanlığı, Milli Eğitim Bakanlığı, Çevre ve Orman Bakanlığı Diyanet İşleri Başkanlığı ile ortaklaşa alınan bir kararla, Kırım-Kongo Kanamalı Ateşi (KKKA) Hastalığı ile mücadele süreci içinde İl Sağlık Müdürlüğü, İl Müftülükleri ile İl Tarım Müdürlükleri nin ortaklaşa toplumun bilinçlendirilmesine yönelik çalışma yapmaları karara bağlanmıştır. Bu amaçla 81 İl Müdürlüğümüz İl Sağlık Müdürlüğü, İl Milli Eğitim Müdürlüğü ve İl Müftülükleri ile irtibata geçerek toplumu bilinçlendirme çalışmalarına yönelik planlamanın yapılması, çalışmalarda görsel ve yazılı yerel basından da faydalanılması, Kırım Kongo Kanamalı Ateşi (KKKA) Hastalığı ve kenelerden korunma yöntemlerine yönelik hususlara dikkat edilmesi hususunda Bakanlığımızca talimatlandırılmıştır. 2008, 2009 ve 2010 yıllarında Kırım Kongo Kanamalı Ateşi Hastalığının (KKKA) kenelerle bulaşması, enfeksiyon kaynağı kenelerin yaban hayatıyla iç içe olan ormanlık, piknik yerleri ve tarım arazilerinden insan ve evcil hayvanlara tutunmaları nedeniyle bu bölgelerde çalışan ve bulaşma riski taşıyan tarım işçisi, köylü, orman işçisi, avcı veya pikniğe gidenler için, Diyanet İşleri Başkanlığına vaaz ve hutbelerde anlatılmak üzere hastalıktan korunmaya yönelik kontrol tedbirleri bildirilmiştir. Yine toplumun bilgilendirilmesi ve bilinçlendirilmesi amacıyla hastalık ve kenelerden korunma yöntemleri hakkında afiş, broşür ve liftlet bastırılarak dağıtımı yapılmış ve zaman zaman da basına bu konuda yazılı ve sözlü açıklamalarda bulunulmuştur. Bu korunma yöntemlerine ilişkin alınacak tedbirlerden bazıları aşağıda belirtilmiştir. 109
110 Keneler uçma ve sıçrama kabiliyeti olmadığından genellikle yerde bulunurlar. Bu nedenle uzun otların, çimlerin ve çalılıkların bulunduğu yerlerde dolaşılırken daha dikkatli olunması gerekmektedir. Kenelerin yaşama alanlarında bulunabilecek kişiler tarafından (hayvancılıkla uğraşanlar, tarlada çalışanlar, orman işçileri, piknik yapanlar, mezbahada çalışanlar vs) repellent olarak bilinen böcek kovucu ilaçların vücutlarına sürülmesi veya elbiselerine emdirerek kullanmaları, kenelerin birkaç saat vücuda yaklaşmalarını engellemektedir. Kenelerin bulunabileceği yerlerde veya piknik alanlarında, bacakları kapatan kıyafetler tercih edilip uzun kollu giysiler giyilmeli, pantolonlar çoraplarının içine sokulmalı ve kapalı ayakkabılar giyilmelidir. Ayrıca açık renkli kıyafetler kene tesbitini kolaylaştırdığından tercih edilmelidir. Vücut (koltuk atı, kulak içi ve çevresi, göbek deliğinin içi, dizlerin arakası, saç ve kıllı bölgelerin içi ve çevresi, bacak arası, bel bölgesi) kene yönünden sık sık kontrol edilmeli, kene varsa en yakın sağlık kuruluşuna gidilmeli veya kene bir cımbızla, kenenin deriye yapıştığı yerden tutularak çıkarılmalıdır. Kenenin uzaklaştırılmasından sonra ellerin su ve sabunla yıkanması, kenenin tutunduğu bölgenin ise iyot çözeltisi gibi bir antiseptikle, alkolle veya deterjanlı su ise temizlenmesi gerekmektedir. Vücuduna kene tutunan kişiler 10 güne kadar ani başlayan ateş, baş ağrısı, yoğun halsizlik, bulantı ve kusma gibi şikayetler yönünden kendilerini izlemeli, böyle bir şikayetin olması durumunda en yakın sağlık kuruluşuna başvurmalıdır. Keneler çıkartılırken öldürülmemeli ve patlatılmamalıdır. Keneleri vücuttan uzaklaştırmak amacıyla üzerlerine sigara basmak, kolonya veya gazyağı dökmek gibi yöntemlere başvurulmamalıdır. Hayvancılıkla uğraşan kişiler, hayvanlarını Mart-Eylül ayları arasında kene yönünden mutlaka ilaçlatmalı, hayvanları meradan geldikten sonra mutlaka kene yönünden kontrol etmelidir. Kene bulunan hayvan barınakları İl/İlçe tarım Müdürlüklerinin sorumluluğunda uygun ilaçlarla usulüne uygun olarak ilaçlanmalıdır. Görev nedeni ile risk grubunda yer alan kişiler, hayvan veya hasta insanların kan ve vücut sıvıları ile temastan kaçınmalı; temas halinde mutlaka eldiven, önlük, gözlük, maske vb. koruyucu önlemler almalıdır. 110
111 Tüm hastalıklarda olduğu gibi KKKA da da korunma ve kontrol önlemlerinin alınması çok önemli ve gereklidir. Bu amaçla coğrafik ve ekolojik yapıdan dolayı, riskli bölgedeki vatandaşlarımız yaban hayatı ile iç içe yaşamak zorunda olduklarından sürekli olarak kene enfestasyonlarına maruz kalmaktadırlar. Yukarıda değinilen korunma yolları, tarım veya hayvancılıkla uğraşan bölge insanlarına bazen anlaşılmaz gelmekte veya gereksiz eziyet olarak görülmektedir. Diğer taraftan kent merkezlerinde kenelerle ilgili gereksiz boyutlarda bir panik yaşanırken, kırsal kesimde bunun tam aksine çok duyarsız kalınmaktadır. Kırsal kesimde yaşayan insanlarımıza keneden korunma yollarını bir yaşam tarzı olarak kabul ettirip, kene-insan temasını kestiğimizde, insanlardaki hastalık da ortadan kalkacaktır. Bu durumda kenelerle birlikte yaşamayı öğrenmek ve bu doğrultuda hareket etmek gerekir. KAYNAKLAR 1. (Editörler) Doğanay, M.; Altıntaş, N. (2009). Zoonozlar Hayvanlardan insanlara bulaşan enfeksiyonlar. Bilimsel Tıp Yayınevi, Ankara, Vatansever, Z. (2009). Vektör kene ekolojisi. 16. Ulusal Parazitoloji Kongresi Özet Kitabı 1-7 Kasım 2009 Adana, Kırım Kongo Kanamalı Atesi (2005). T.C. Sağlık Bakanlığı, Temel Sağlık Hizmetleri Genel Müdürlüğü. Ankara, Koruma ve Kontrol Genel Müdürlüğü. Kırım Kongo Kanamalı Ateşi 111
112 BUNYAVİRUSLAR VE AŞI ÇALIŞMALARI Prof. Dr. Aykut ÖZDARENDELİ Fırat Ü.Veteriner Fak. Viroloji AD Bunyavirüs ailesinde yer alan 350 den fazla virüs dünyada yaygın olarak bulunmaktadır. Bu ailede yer alan çoğu virüs artropodlar tarafından taşınmakta olup insanlarda, evcil hayvanlarda ve bitkilerde önemli hastalıklara neden olmaktadır. Son yıllarda vektörlerle bulaşan viral hastalıkların artışına paralel olarak, bunyavirüsler ve neden oldukları hastalıkların önemi de artmıştır. Bu aileye bağlı virüsler zarflı, 100 nm çapında, segmentli RNA ya sahip, negatif ya da ambi-sense kodlama stratejisine sahiptirler. Bunyavirüslerin replikasyonunda ilk adım virüsün affinite duyduğu hücreye reseptörler aracılığı ile bağlanmasıyla başlar, füzyonu takiben endositozis yoluyla hücre içerisine girer. Primer transkripsiyon ve translasyon sonucu, virüsün replikasyonu ve transkripsiyonu için gerekli olan erken proteinler sentezlenir. Virüsün genlerinin replikasyonu ve virionu oluşturacak viral proteinlerin sentezlenmesini takiben, golgi aygıtında bu viral unsurların biraraya geldiği viral toplanma aşaması gerçekleştirilir. Virüs, hücreyi plazma membranından tomurcuklanarak veya alternatif olarak golgi aygıtından ekzositoz yoluyla terk ederek viral replikasyonunu tamamlar. Bunyavirüsler, large(l), medium (M), small (S) segmentlerini içeren parçalı bir genoma sahiptir. Dört yapısal protein üç genom segment tarafından kodlanır, RNA-bağlı RNA polimeraz (L protein) büyük (L) segment tarafından, glikoproteinler (Gn ve Gc) orta büyüklükte (M) segment tarafından ve nükleokapsit proteini (N) ise küçük segment (S) tarafından kodlanır. Bunyavirüs ailesinde yer alan virüsler moleküler ve serolojik karakterlerine göre 5 genusa toplanmaktadır. Bunlar, Orthobunyavirüs, Phlebovirüs, Hantavirüs, Nairovirüs ve Tospovirüs olarak isimlendirilmektedir. Tospovirüs leri de içeren çoğu bunyavirüsler artropodlardan izole edilmiş olan arbovirüslerdir. Hantavirüs ler sadece kemiriciler (rodentler) tarafından taşınan taşınan virüslerdir. Bütün bu dört farklı cinsten elde edilen virüsler insanlar için patojeniktir. Bununla birlikte, insanlarda hastalığa neden olan virüs sayısı 20 den fazla değildir. Tablo 1 de Bunyavirüs ailesinde yer alan bazı önemli patojenler, oluşturdukları hastalıklar ve coğrafik dağılımları özetlenmiştir. 112
113 Tablo 1. Bunyaviridae Ailesinde Yer Alan Bazı Önemli Patojenler 113
114 Bunyavirüslerde koruyucu immünitenin Gn ve Gc antijenlerine karşı oluşan nötralizan antikorlarla ilişkili olduğu bilinmektedir. Bununla beraber, bunyavirüslerle enfekte olmuş insanlarda yapılan bazı çalışmalarda sitotoksik T lenfosit yanıtının da geliştiği ortaya konulmuştur. Bu ailede yer alan önemli zoonoz etkenlere karşı aşı çalışmaları özellikle son yıllarda artış göstermektedir. Aşı geliştirme çalışmalarının başında, insanlarda yüksek mortaliteyle seyreden ve biyolojik silah olarak sınıflandırılan Hantavirüsler gelmektedir. Renal Sendromlu Hemorajik Fever (HFRS) hem rodent beyninden hem de hücre kültüründen hazırlanmış ve Asya da insanlarda denenmiş aşılar mevcuttur. Rodent beyninden hazırlanan inaktif aşı Batı ülkelerinde kullanım alanı bulmamıştır. Ticari bir aşı olan ve süt emen fare yavrularının beyninden hazırlanan ticari Hantavax aşısı 10 yıldan beri Kore de insanlarda kullanılmaktadır. Formalin ile inaktive edilen ve alimünyum hidroksit ile adjuvanize edilmiş Hantavax aşısı 1 er ay aralıkla iki doz verilmekte ve 12 ay sonra boost yapılmaktadır. Aşılanmış insanlara uygulanan ELISA testi sonucunda antikor oluşumu gözlenmiş olmasına rağmen nötralize edici antikorların ancak aşılanmış insanların yarısında oluştuğu rapor edilmiştir. Hantavax aşısı ile saha çalışmaları yapılmamış ve vaka kontrol çalışmaları istatistik verilerin oluşturulabilmesi için yeterli görülmemiştir. Çin de Hantaan virüs (HTNV) ve Seul virüs (SEOV) hücre kültürü sisteminde çoğaltılarak inaktif aşıları hazırlanmış ve süt emen fare yavrularının beyninden hazırlanan HTNV aşısı ile immünite yönünden karşılaştırılmıştır. Yaklaşık insanda yapılan çalışmada SEOV aşısı 3 doz verildiğinde aşılanan insanların %80 inde nötralizan antikor oluştururken diğer iki aşı ancak aşılana insanların %50 sinde nötralizan antikor oluşturduğu saptanmıştır. Bir başka çalışmada bivalant aşı kullanılmış, SEOV ve HTNV hücre kültürlerinde üretilerek formalinle inaktive edilmiş ve kolum kromatografi ile pürifiye edilerek ve alimünyum hidroksit ile adjuvanize edilmiştir. İki hafta aralıklarla 2 doz olarak insanlara uygulanmış ve aşılanan insanlarda %93 oranında nötralizan antikor oluşmuştur. Son yıllarda daha güvenli olan ve hücre kültürü ya da fare beyninde hazırlanan aşılarda görülen dezavantajları ortadan kaldırmak için aşı geliştirmede moleküler yaklaşımlar denenmiştir. Rekombinant vaccinia virüs sistemi kullanılarak HTNV nin M ve S gen ürünleri üretilmiş ve 16 gönüllü insanda denenmiştir. Herhangibir yan etki görülmezken sadece yüksek doz verilen gönüllülerde nötralizan antikorlar oluşmuştur. Aynı sistem kullanılarak yapılan Faz 2 çalışmasında yüksek dozda verilen rekombinant aşı gönüllerin %72 sinde nötralizan antikor 114
115 oluşturmuştur. Bir başka moleküler hantavirüs aşı yaklaşımı olarak DNA aşısı geliştirilmiş ve gönüllülerde faz 1 çalışmaları devam etmektedir. Rift Vadisi Humması (RVF) virüsü, Bunyaviridae ailesinde yer alan önemli zoonozlardan birisidir. Formalinle inaktive edilmiş NDBR 103 adlı inaktif aşının hazırlanmasında Entebbe RVF suşu fare beyninde 184 kez pasajlandıktan sonra primer maymun böbrek hücresinde üretilerek aşı hazırlanmış ve 1977 de 500 gönüllü insanda denenmiştir. Daha sonraki yıllarda formalininaktive TSI-GSD 200 aşısının hazırlanması FRhL-2 hücreleri kullanılmış ve daha iyi güvenlik (safety) laboratuar şartları oluşturulmuştur. TSI-GSD 200 aşısı 0-7 ve 28.günlerde 3 doz şeklinde gönüllülere uygulanmış ve aşılanan gönüllülerde %90 oranında 1: 40 veya daha yüksek nötralizan titre elde edilmiştir. Ayrıca veteriner hekimlikte kullanılan ve koyunların aşılanmasında kullanılan RVF in pantropik suşundan hazırlanan ve formalinle inaktive edilmiş aşı uygulamaları söz konusudur. Canlı attenüe RVF aşıları uzun yıllardan beri üzerinde çalışılan bir konudur. Bu aşılar arasında hem insanlarda hem de hayvanlarda kullanılabilme potansiyeli bulunan MP-12 adı verilen canlı aşı suşudur. 5-flourouracil (5FU) varlığında 12 kez pasajı yapılmış olup aynı zamanda ısıya duyarlı mutant bir virüs elde edilerek patojenitesi ortadan kaldırılmıştır. Son yıllarda rekombinant yollarla daha güvenli RVF karşı aşı geliştirme çabaları artmıştır. Virüs Benzeri Patiküller (VLP) en ümit verici olanıdır. Virüsün Gn, Gc ve N proteinleri içeren VLP, hücreler içerisine girerek MHC II tarafından sunulmaktadırlar. Günümüzde Kırım Kongo Kanamalı Ateş Hastalığına (KKKAH) karşı mevcut koruyucu bir aşı bulunmamaktadır. Bununla beraber, 1971 yılında eski Rusya nın Rostov bölgesinde süt emen fare yavrularının beyninden hazırlanan ve formalin ile inaktive edilerek hazırlanan aşı, 1500 kişiye verilmiş aynı şekilde hazırlanan inaktif aşı, Bulgaristan daki 583 gönüllüde denenmiştir. Bununla beraber, KKKAH virüsüne karşı aşı hazırlama çalışmaları oldukça kısıtlı çalışma şartlarında ve eski tarihlerde yapıldığı için konuyla ilgili bilimsel olarak tatmin edici veriler bulunmamaktadır yılında farelerde gerçekleştirilen bir araştırmada KKKAH virüsünün M geni kullanılarak yapılan DNA immünizasyonu çalışmasında, immünize edilen farelerde nötralizan antikorlar gelişmiş ancak hayvan modeli olmadığından dolayı çelınç deneyleri gerçekleştirilememiştir. Kırım Kongo Kanamalı Ateş Hastalığına karşı rekombinant ve inaktif aşı ge- 115
116 liştirilmesi konusunda 2010 Haziran ayında yürürlüğe giren TÜBİTAK KA- MAG tarafından desteklenen bir proje söz konusudur. Sağlık Bakanlığı nın içerisinde yer aldığı ve Fırat Üniversitesi Veteriner Fakültesi nde yürütülen proje kapsamında KKKAH karşı rekombinant ve inaktif aşı geliştirilmesi çalışmaları devam etmektedir. KAYNAKLAR 1- Elliot RM., Bouloy M., Calisher CH., Goldbach R., Moyer JT., Nichol ST., Petterson P., Schmaljohn, CS., Family Bunyaviridae. In: van regenmortel, MHV., Fauquet, CM., Bishop, DHL., Carstens EB., Estes, MK., Lemon S., Maniloff J., Mayo MA., McGeogch D., Pringle CR., Wickner RB., Virus Taxonomy. Seventh Report International Committee Virus Taxonomy. Seventh Report International Committee of Viruses. Academic Press, San Diego, CA, , (1996). 2- Elliot RM., Molecular Biology of Bunyaviruses. Jounal of General Virology, 71, , (1990). 3- Ikegami T., Makino S. Rift Valley Fever Vaccines. Vaccine, 27, D61-D64, (2009). 4- Schmaljohn C., Vaccines for Hantaviruses. Vaccine, 27, D61-D64, (2009). 5- Spik K., Shurtleff A., McElroy AK., Guttieri CM., Hooper JW., Schmaljohn C. Immunogenicity of combination DNA vaccines for Rift Valley fever virus, tick-borne encephalitis virus, Hantaan virus, and Crimean Congo hemorrhagic fever virus. Vaccine, 24, , (2006). 6- Tkanchenko EA., Butenko AM., Badalov ME., Zavodov TI., Chumakov MP., Investigation of the immunogenic activity of killed brain vaccine against Crimean hemorrhagic fever, Tr. Inst. Polio. Virusn. Entsegalitov Akad. Med. Nauk SSSR, 19, , (1971). 7- Vasilenko SM., Results of the investigation on etiology, epidemiologic features and the specific prophylactic of Crimean hemorrhagic fever (CHF) in Bulgaria, In: Abstr. Inv. Pap. 9. Int. Congr. Trop. Med. Malar., Athens, October 1973, Vol: I, Whitehouse CA., Crimean Congo Hemorrhagic Fever Virus., Antiviral research, 64, 145, , (2004). 8- Zoonozlar., Ed. Doğanay M, Altıntaş M. Bunyavirüslerin Neden Olduğu Zoonozlar Ergönül Ö, Özdarendeli A. p Bilimsel Tıp Yayınevi. Ankara (2009). 116
117 ŞARBONUN MOLEKÜLER EPİDEMİYOLOJİSİ Prof. Dr. Rıza DURMAZ Refik Saydam Hıfzıssıhha Merkez Başkanlığı, Salgın Hastalıklar Araştırma Müdürlüğü Moleküler Mikrobiyoloji Araştırma ve Uygulama Lab, Ankara Şarbon, gelişmiş ülkelerde yok denecek seviyeye inmişken, ülkemizin de içinde bulunduğu gelişmekte olan ülkelerde halen önemini korumaktadır. Avrupa da yılları arasında bildirilmiş toplam insan şarbon olgularının %91 i altı Akdeniz ülkesinden (Türkiye, İspanya, İtalya, Yunanistan, Bulgaristan, Yugoslavya), %52 si ise Türkiye den rapor edilmiştir (1). Şarbon özellikle ülkemizin doğu sınırını oluşturan kuzey Kafkasya bölgesinde endemik olarak seyretmektedir. Bu bölgelerdeki hayvan hareketleri sınır illerimizi etkilemektedir. Bölgelere göre insan şarbon olgularının dağılımına bakıldığında ( ) Marmara Bölgesi nde 149, Ege Bölgesi nde 69, Akdeniz Bölgesi nde 173, Orta Anadolu da 480, Kuzey Anadolu da 534, Doğu Anadolu da 1706, Güney Doğu Anadolu da 230 olgu şeklindedir. Bu verilere göre Doğu Anadolu Bölgesi ilk sırada yer almakta, bu bölgede ikinci sırada gelen bölgenin üç katı kadar insan şarbon olgusu görülmektedir (1-3). Hastalık bölgede en sık Erzurum ve Kars ta görülmektedir (4,5). Dünya Hayvan Sağlığı Örgütü (Office International Enzootica,OIE) verilerine göre ülkemizde yılları arasında toplam 1304 sığır hastalıktan etkilenmiş, 882 si ölümle sonuçlanmıştır; 556 koyun/keçi etkilenmiş, bunların 518 i ölmüştür. Bu vakaların da çoğu Doğu Anadolu bölgesinden bildirilmiştir (6). Tarım Bakanlığının verilerine göre (7) Türkiye de 2007 yılında 131 birimde şarbon mihrakı tespit edilmiş, bunlardan 16 birim aktif mihrak olarak değerlendirilmiştir. Bu mihraklarda hayvan sirayete maruz kalmış, 530 hayvan ölmüş ve 82 adedine şarbon teşhisi konmuştur. Türkiye de belirlenen şarbon odaklarının önemli bir kısmı Doğu Anadolu bölgesindeki illerden (Erzurum 18 mihrak ve Kars 16 mihrak) bildirmiştir. Bu mihraklarda genelde yıl içerisinde birden fazla şarbon salgını görülmüş ve çok sayıda hayvan ve insan hastalıktan etkilenmiştir. Kars ilinde yılları arasında 464 hayvan şarbonu saptanmış, şüpheli hayvanların tamamından Bacillus anthracis izole edilmiştir (8). 117
118 Şarbonla mücadele erken tanı, etkili antibiyotiklere duyarlılığın belirlenmesi, uygun tedavi, kaynağının saptanması ve kontrol programlarının uygulanması ile mümkün olmaktadır. Laboratuvar tanısı ve antibiyotiklere duyarlılıkların belirlenmesinde fenotipik yöntemler oldukça iyi sonuçlar vermektedir. Ancak, korunma ve etkin kontrol önlemlerinin belirlenmesi için hayati öneme sahip olan kaynak ve bulaş yollarının belirlenmesinde moleküler yöntemlere gereksinim vardır. Moleküler tiplendirme yöntemleri ile farklı kaynaklardan üretilen B. anthracis izolatları arasındaki epidemiyolojik ilişki doğrulanabilmekte ve bir ülkede görülen majör genotipik klonlar belirlenerek, ülkedeki kökenlerin orijini hakkında fikir sahibi olunabilmektedir. Klonal ilişkinin ortaya konulmasıyla majör epidemik klonların ne kadar insan veya hayvanı etkileyebildiği, bu klonun kaç yıldan beri devamlılığını koruduğu belirlenebilmektedir. Şarbon açısından kaynak görevi olabilecek toprak, ot veya meraların kontaminasyon durumu araştırılabilmektedir (9,10). Biyolojik silah olarak kullanılabilecek olan şarbon sporlarının orijini ve bu sporlara maruz kalan kişilerin doğrulaması yapılabilmektedir. Buradan hareketle şarbon basilinin yayılma derecesi ve kaç yıllık süre içerisinde klonal özelliğini koruyabildiği hakkında bilgi sahibi olunabilmektedir (11-15). Moleküler tiplendirme çalışmaları şarbon basillerinin majör belirli genotiplerinin olduğunu ve bu tiplerin coğrafik bölgelere göre sınırlı dağılım gösterdiğini ortaya koymuştur (11-13). B. anthracis suşlarının genomik yapısındaki yüksek homojeniteden dolayı, birçok bakteride altın standart olan pulsed-field gel electrophoresis yönteminin ayrım gücü bu suşların tiplendirilmesinde yetersiz kalmaktadır (14-17). Bunun yerine polimeraz zincir reaksiyon (PZR) bazlı yöntemlerden biri olan amplified fragment length polymorphisms (AFLP) (15) ve koruyucu (protektif) antijeni kodlayan gen bölgesinin hedef alındığı baz dizi analizi çalışmalarına (18) yönelme olmuş, ancak bu çalışmalardan da arzu edilen yarar sağlanamamıştır. Suşlar arasındaki genetik ilişkiyi gösterebilecek yeni moleküler yöntemlere ihtiyaç duyulmuştur. Bu amaçla geliştirilen yaklaşımlardan biri, çok sayıda lokustaki tekrarlayan gen bölgelerinin analizidir (multilocus variable number tandem repeat analysis, MLVA). MLVA da kullanılan sıralı tekrarlar (tandem repeats), satellitler arasında sınıflandırılmakta; minisatellitler baz çifti, mikrosatellitler ise 1-8 baz çifti uzunluktadır (19). Sıralı tekrarlar, özellikle genomik yapısı yüksek derecede korunmuş olan Bacillus antharacis, Mycobacterium tuberculosis, Yersinia pestis ve Brucella spp. gibi patojenlerde yaygın şekilde kullanılmaktadır (14,15,20). İncelen lokusların içerisindeki sıralı tekrarla- 118
119 rın sayısı suşlar arasında değişiklik gösterebilmekte ve buna bağlı olarak amplifiye edilen lokusun büyüklüğü değişmektedir. Sıralı tekrarların sayı farklılığı genel olarak epidemiyolojik olarak ilişkisiz olan suşlarda gözlenmekte, aynı soydan gelen salgınla ilişkili olan suşlarda ise korunmaktadır. Dolayısıyla epidemik olarak ilişkisiz kaynaklardan üretilmiş olan izolatların lokusları büyüklük ve sıralı tekrar sayısı bakımından farklılık göstermektedir (20). MLVA yanında diğer yeni bir tiplendirme yöntemi olan Single Nucleotide Repeats (SNR) analizi de epidemik izolatların ayrıntılı analzileri için kullanılmakta ve bu yöntemle MLVA nın ortak olarak bulduğu epidemik suşlar alttiplere ayrılabilmektedir (21,22). B. antharacis için yapılan ilk çok lokuslu variable number tandem repeat (VNTR) analizi, sekiz lokuslu MLVA (MLVA-8) dır. MLVA-8; altısı kromozamal (vrra, vrrb1, vrrb2, vrrc1, vrrc2, GG3), ikisi plazmit (pxo1, pxo2) olmak üzere toplam sekiz lokus içermektedir (23). Ancak, MLVA-8 in ayrım gücünün yetersizliği kısa sürede anlaşılmış ve incelenen lokus sayısı yirmi beşe (MLVA-25) çıkarılmıştır. MLVA-25 içerisinde CG3, bams44, bams3, vrrb2, bams5, bams15, bams1, vrrc1, bams13, vrrb1, bams28, vrrc2, bams53, bams31, vrra, bams25, bams21, bams34, bams24, bams51, bams22, bams23, bams30, pxo1, pxo2 lokusları yer almaktadır (24). Sekizli MLVA yönteminde amlifiye edilen lokus büyüklüklerinin görüntülenmesinde agaroz jel elektroforezi yeterli olurken, MLVA-25 yönteminde kapiller jel elektroforezi ve mültipleks polimeraz zincir reaksiyon uygulamalarına gereksinim duyulmaktadır. MLVA-25, B. anthracis in bölgesel genotiplerini belirlemenin yanında, dünyadaki farklı genotiplerin tanımlanmasını da sağlayan en geçerli yöntemdir. MLVA-25 moleküler tiplendirme yöntemi kullanılarak değişik ülkelerdeki hayvan ve insan izolatlarının analizleri üzerine çalışmalar devam etmektedir. İtalya da 2004 yazında kırk bir epidemi gözlenmiş ve farklı alanlardan 124 hayvan etkilenmiş. Epidemi süresince toplan 53 izolat MLVA-25 ile tiplendirildiğinde suşların tamamının tek bir genotipte olduğu gösterilmiş, aynı suşlar Single Nucleotide Repeat (SNR) analysis yöntemiyle incelendiklerinde beş farklı altgenotip saptanmıştır (22). Çin de 1033 B. anthracis suşu single nucleotide polymorphisms yöntemiyle incelendiğinde üç majör lineages (grup) ve 12 altgrup (sub-lineages) saptanmıştır (25). Bu majör gruplardan birinin (A lineage) dünyada yaygın halde olduğu ve modern şarbonun coğrafik dağılımına temel oluşturduğu gösterilmiştir. Bu suş- 119
120 lardan 191 tanesi arşivden seçilerek MLVA ile incelendiğinde herbir SNP içerisindeki suşların rezolüsyonu artmıştır (25). Davul halayına katılan 24 yaşındaki bir kadında gastrointestinal şarbon gelişiyor. Davuldan ve çevreden örnekler alınıyor ve altı çevre örneğinden B.anthracis üretiliyor. MLVA-8 ile yapılan tiplendirme sonucunda hastanın izolatı ile çevreden üretilen altı suşun aynı klondan oldukları doğrulanıyor (9). Bu sonuçlardan hareketle davul tozundan kaynaklanan sporların şarbon için kaynak oluşturabileceği vurgulanıyor. Polonya da yapılan çalışmada laboratuvar suşları ile Sterne 34F2A aşı suşunun klonal benzerliği araştırılmış ve laboratuvar suşlarının aşı suşundan farklı MLVA profili sergilediği gösterilmiştir (26). Ülkemizde B. anthracis suşlarının moleküler tiplendirilmesine yönelik olarak yayınlanmış veri bulunmamaktadır. TÜBİTAK tarafından desteklenen bir proje yürütülmektedir. Projenin 18 aylık süreci içerisinde toplam 179 suşa ait laboratuar çalışmaları tamamlanmıştır. Şuşların 80 tanesi (%44.7) insan, 98 tanesi (%54.7) hayvan, bir tanesi (%0.6) çevre izolatıdır. Suşlar yoğunlukla Kars (92 suş) ve Kayseri (51 suş) illerinden toplanmış olup, bunları Sivas (15), Malatya (9), Van (9) ve Kırşehir (3 suş) illeri izlemektedir. Bu suşlardan 105 tanesinin MLVA tiplendirme sonuçlarının analizi tamamlanmıştır. Bu verilere göre 105 suş içerisinde 71 farklı genotip saptanmıştır. Genotiplerin 16 tanesi küme halinde olup, kümeler 2-8 suş içermektedir. Kümeleşme oranı %46.7 dır, diğer bir ifadeyle ülkemizin çoğunlukla doğu Anadolu bölgesinden toplanan şarbon olgularının yarıya yakını bulaş sonucu ortaya çıkmıştır. Aynı küme içerisinde yer alan suşların ayrıntılı analizi yapıldığında bulaşın belirli bir il veya sınırlı bir zaman periyodu içerisinde kalmadığı ve ayrıca hayvanlar arasında olduğu gibi hayvanlarla insanlar arasında ortak klondan gelen suşların olduğu da görülmüştür. Sonuç olarak, diğer enfeksiyonlarda olduğu gibi şarbon hastalığının insan ve hayvanlar arasındaki bulaş derecesinin ortaya konulması, salgınların doğrulanması ve ülkemizdeki klonların flogenetik analizi için moleküler tiplendirme çalışmalarına devam edilmelidir. Kaynaklar: 1. Doğanay M. Bacillus anthracis ve diğer Bacillus türleri. Topçu AW, Söyletir G, Doğanay M (yazarlar). İnfeksiyon Hastalıkları ve Mikrobiyolojisi. İstanbul; Nobel Tıp Kitabevleri, 2002;
121 &DOSYAISIM=121.htm. 4. Tasyaran MA, Deniz O, Ertek M, Cetin K. Anthrax meningitis: case report and review. Scand J Infect Dis. 2002;34(1): Ozkurt Z, Parlak M, Tastan R, Dinler U, Saglam YS, Ozyurek SF. Anthrax in eastern Turkey, Emerg Infect Dis. 2005;11(12): OIE: mald=20 (Şubat 2008 tarihli erişim). 7. Tarım Bakanlığı 2007 Genel Hastalık Raporu, Koruma Kontrol Genel Müdürlüğü, Ankara. 8. Otlu S, Sahin M, Genç O. Occurrence of anthrax in Kars district, Turkey. Acta Vet Hung. 2002;50(1): Centers for Disease Control and Prevention (CDC) Gastrointestinal anthrax after an animal-hide drumming event - New Hampshire and Massachusetts, MMWR Morb Mortal Wkly Rep. 2010;59(28): Lewerin SS, Elvander M, Westermark T, et al. Anthrax outbreak in a Swedish beef cattle herd--1st case in 27 years: Case report. Acta Vet Scand. 2010;52: Maya M, Natzide M, Rigvava S, et al. Diversity of Bacillus antharacis stains from the Former Soviet Union. Appl Environ Microbiol 2006; 72(8): Ryu C, Lee K, Hawng HJ, Yoo CK, Seong WK, Oh HB. Molecular characterization of Korean Bacillus anthracis isolates by amplified fragment length polymorphism analysis and multilocus variable-number tandem repeat analysis. Appl Environ Microbiol. 2005; 71: Sue D, Marston CK, Hoffmaster AR, Wilkins PP. Genetic diversity in Bacillus anthracis historical collection ( ). J Clin. Microbiol. 2007; 45: Keim P, van Ert MN, Pearson T et al. Anhrax molecular epidemiology and forensics:using the appropriate marker for different evolutionary scales. Infection, Genetics and Evolution. 2004; 4: Valjevac S, Hilaire V, Lisanti O et al. Comparison of minisatellite polymorphisms in the Bacillus cereus complex: a simple assay for large-scale screening and identification of strains most closely related to Bacillus anthracis. Appl Environ Microbiol ;71: Zhong W, Shou Y, Yoshida TM, Marrone BL. Differentiation of Bacillus anthracis, B. cereus, and B. thuringiensis by using pulsed-field gel 121
122 electrophoresis. Appl Environ Microbiol. 2007;73(10): Harrell LJ, Andersen GL, Wilson KH. Genetic variability of Bacillus anthracis and related species. J Clin Microbiol. 1995;33(7): Price L B, Hugh-Jones ME, Jackson P, Keim P. Natural genetic diversity in the protective antigen gene of Bacillus anthracis. J. Bacteriol. 1999;181: Le Flèche P, Hauck Y, Onteniente L, et al. A tandem repeats database for bacterial genomes: application to the genotyping of Yersinia pestis and Bacillus anthracis. BMC Microbiol. 2001;1: Lista F, Faggioni G, Valjevac S, et al. Genotyping of Bacillus anthracis strains based on automated capillary 25-loci multiple locus variablenumber tandem repeats analysis. BMC Microbiol. 2006; 6;6: Garofolo G, Ciammaruconi A, Fasanella A, et al. SNR analysis: molecular investigation of an anthrax epidemic. BMC Vet Res. 2010;6: Kuroda M, Serizawa M, Okutani A, Sekizuka T, Banno S, Inoue S. Genome-wide single nucleotide polymorphism typing method for identification of Bacillus anthracis species and strains among B. cereus group species. J Clin Microbiol. 2010;48(8): Epub Keim P, Price LB, Klevytska AM, et al. Multiple-Locus Variable-Number Tandem Repeat Analysis Reveals Genetic Relationships within Bacillus anthracis. J Bacteriol 2000;182: Ryu C, Lee K, Hawng HJ, Yoo CK, Seong WK, Oh HB. Molecular characterization of Korean Bacillus anthracis isolates by amplified fragment length polymorphism analysis and multilocus variablenumber tandem repeat analysis. Appl Environ Microbiol 2005; 71: Simonson TS, Okinaka RT, Wang B, et al. Bacillus anthracis in China and its relationship to worldwide lineages. BMC Microbiol. 2009;9: Gierczynski R, Jakubczak A, Jagielski M. Extended multiple-locus variable-number tandem-repeat analysis of Bacillus anthracis strains isolated in Poland. Pol J Microbiol. 2009;58(1):
123 İNSANLARDA ŞARBON KLİNİĞİ VE TEDAVİ YAKLAŞIMI Doç. Dr. Mustafa Kasım KARAHOCAGİL Yüzüncü Yıl Üniversitesi Tıp Fakültesi Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji AD. Şarbon, Gram-pozitif bir basil olan Bacillus anthracis in etken olduğu zoonotik bir enfeksiyon hastalığıdır. B. anthracis in sporları ile kontamine otları yiyen sığır, koyun, keçi gibi ot yiyen memeli hayvanlardan insanlara bulaşır. İnsan enfeksiyonları genellikle enfekte hayvan ve hayvan ürünleri ile direkindirek temas yolu ile oluşur. Dünyada görülme sıklığı gittikçe azalmakla birlikte bazı Latin Amerika, Haiti, Afrika, Orta Doğu ve Merkezi Asya ülkelerinde endemik olarak görülmektedir. Amerika da B. anthracis sporları içeren mektuplarla oluştuğu anlaşılan akciğer şarbonu olguları ile birlikte bu bakteri biyoterörizm etkenleri listesinde en üst sıralara çıkarak, dünyanın dikkatini çekmeye başlamıştır. Şarbon ülkemizde endemik bir hastalıktır ve İç, Doğu ve Güneydoğu Anadolu Bölge lerinde daha sık görülmektedir. EPİDEMİYOLOJİ VE BULAŞ Enfekte konak basillerin vegetatif formlarını etrafına saçar, hava ile temas eden basiller sporule olur ve yeni bir konak tarafından alınıncaya kadar toprakta on yıllarca canlı kalabilir. İnsan enfeksiyonu insidansı enfekte hayvan sayısı ile doğru orantılı olarak artar. Aslında insanlar ot yiyen hayvanlara göre şarbona orta derecede dirençlidir, fakat yinede salgınlar görülebilir. İnsan şarbonunun oluşması etkene maruziyet seviyesine bağlıdır. Genel olarak şarbon için enfektif doz (ID 50 ) binler - on binler ile ifade edilir. Şarbon etkeni üç ana yol ile vücuda girer; i) Temas yolu ile deriden, ii) Sporların solunum yolu ile akciğerlerden ve iii) Hasta veya ölmüş hayvanların kontamine etlerinin yenilmesi ile gastrointestinal kanaldan. İnsan enfeksiyonlarının büyük çoğunluğu enfekte hayvanlarla veya kontamine deri, yün ve et gibi hayvansal ürünlerle, kaşıma, çizik, kesik gibi travmalarla bütünlüğü bozulmuş deriden doğrudan temas ile oluşur. Enfeksiyonun böcekler ve sineklerle mekanik olarak bulaşabileceği gösterilmiştir. Sinek- 123
124 lerendemik bölgelerde geniş salgınlara neden olabilir. Şarbon bulaş kaynağına göre; tarımsal, endüstriyel ve laboratuar kaynaklı olmak üzere üçe veya bir başka sınıflamaya göre endüstriyel ve endüstriyel dışı olarak ikiye ayrılır. Günümüzde biyolojik savaş veya biyoterörizm amaçlı, kasıtlı bulaş abartılı şekilde popüler bir diğer şarbon bulaş kaynağını oluşturmaktadır. Endüstriyel kökenli şarbon, B. antracis sporları ile kontamine hayvansal ürünlerin; keçi kılı, yün, deri, post ve kemik gibi, sanayide işlenmesi esnasında oluşur. Sıklıkla deri şarbonu veya daha az olarak akciğer şarbonu oluşur. Endüstriyel dışı şarbon ise çiftçi, çi, besici, veteriner, kasap ve sakatatçı gibi meslek gruplarını etkiler. Ülkemizde görülen şarbon olguları genellikle tarımsal kökenlidir. Tarımsal kökenli şarbon, enfekte hayvanlarla direkt temas sonucu gelişir, bu sebeple özellikle hayvanlarda şarbonun sık görüldüğü mevsimlerde insanlarda da sıklığı artar ve genellikle deri şarbonu şeklinde görülür. Enfekte veya ölmüş hayvanların kesilmesi, derisinin yüzülmesi, etinin kıyılması sonucu direkt temasla deri şarbonu veya daha nadir olarak enfekte etlerin çiğ ya da az pişirilmiş olarak yenilmesiyle gastrointestinal sistem şarbonu gelişir. Şarbon hastalığının insandan insana bulaşması çok nadirdir. Enfekte yara ve akıntı ile temas sonucu bulaşma riski vardır. Bu olguların hepsi deri şarbonudur. İnhalasyonel ve gastrointestinal şarbon bulaşı bildirilmemiştir. Şarbon her yaş ve cinste görülür. Mesleki maruziyet sonucu oluşan doğal şarbon olgularında pek çok ülkede erkek cinste daha sık görülür. Tarım kesiminde çalışan orta yaş grubu da bu enfeksiyona daha sık yakalanmaktadır. Çocukların şarbona karşı daha az hassas olduğuna dair iddialar olsa da, Bravata ve arkadaşlarının çocuk şarbon yayınlarını incelediği bir çalışmasında bunu kanıtlayacak ya da reddedecek bir kanıt bulunamadığı bildirilmiştir. Şarbon, endemik ülkelerde her mevsimde görülebilir. Ülkemizde de her mevsim görülmekle birlikte olgu sayısı en fazla daha sıcak ve yağışsız olan geç yaz ve erken sonbahar aylarında (Temmuz-Ekim) görülmektedir. KLİNİK BELİRTİ VE BULGULAR Şarbon sporları organizmaya giriş kapısına göre üç temel klinik formda hastalık oluşturur; i) Deri şarbonu, ii) Akciğer şarbonu ve iii) Gastrointestinal şarbon. Primer yerleşim yerlerinden herhangi birinden lenfohematojen yolla yayılım ile şarbon sepsisi ve şarbon menenjiti gibi ağır sistemik klinik 124
125 tablolar gelişebilir. Doğanay ve ark yılları arasında ülkemizden bildirilen şarbon olgularını inceledikleri çalışmalarında klinik bulguları verilen toplam 426 olguda, 413 (%96.9) deri şarbonu, 8 (%1.9) gastrointestinal şarbon (orofarengeal 7 ve barsak şarbonu 1) ve 5 (%1.2) şarbon menenjiti (3 ü deri şarbonu kaynaklı) bildirilmişlerdir. Deri Şarbonu: Dünyada doğal oluşan insan şarbonu olgularının %95 ten fazlasını deri şarbonu oluşturmaktadır. Deri şarbonu sporlarının kesik, kaşıma veya böcek veya sinek ısırması gibi küçük travmalarla bütünlüğü bozulmuş deriye inokülasyonu ile oluşur. İnkübasyon periyodu birkaç saatten 3 haftaya kadar değişebilir, sıklıkla 2-6 gündür. Lezyonlar genellikle yüz, boyun, ense, eller, bilekler ve kollar gibi vücudun açık bölgelerinde yerleşmeye eğilimlidir. Deri şarbonunda genellikle tek lezyon görülmekle beraber, nadiren birden fazla inokülasyon varsa birden fazla lezyon görülebilir. Deri şarbonu genellikle inokülasyon yerinde kaşınma ve yanma ile başlar. Takiben tek, küçük, ağrısız ve kaşıntılı bir papül gelişir. Çoğu zaman kaşıntının eşlik ettiği papül nedeniyle hasta veya doktorlar tarafından böcek-örümcek ısırması zannedilerek göz ardı edilir. Papül oluşumundan 1-2 gün sonra lezyon genişler, veziküler forma döner ve çevresinde eritem ve ödem oluşur. Vezikül içeriği lökositten fakir ancak bol basil içeren berrak serosangienöz (jelatinöz) bir sıvı karakterdedir. Birkaç gün içinde vezikül içindeki sıvı bulanır, koyu bir renk alır. Veziküler lezyon hemorajik nekrotik bir karaktere dönererek mavi-siyah renk alır. Vezikülün üstü ince bir tabaka ile örtülüdür ve kolayca rüptüre olur. Keskin kenarlı, ortası çökük siyah bir eskar ile kaplı yüzeyel ülser oluşur. Ülser tipik olarak endurasyon ile çevrilidir ve bazı olgularda iz bırakmayan ödem belirgindir. Bazen nekroze lezyonu çevreleyen ödemli doku üzerinde küçük veziküller gelişir. Bunlar inokülasyona bağlı olmaksızın gelişen satellit lezyonlardır. Bunlar da nekroze olur, siyahlaşır ve primer lezyonla birleşir. Bu genişlemiş lezyona şarbon püstülü adı verilir (eski adı pustula malign). Çapı 6-9 cm ye kadar ulaşabilir. Eskarı çevreleyen doku geniş ödemli ve kırmızıdır. Hastalığın şiddetine göre yüksek ateş, bölgesel lenfanjit ve lenfadenit vardır. Lenf düğümleri şiş ve ağrılıdır. Deride nekroz yerinde ağrı ve apseleşme olmaz. Ancak, sekonder enfeksiyon gelişirse ağrı ve apseleşme olabilir. Deri şarbo- 125
126 nu ağır veya ılımlı seyredebilir. Bazen sekonder yayılımla sepsis, menenjit, toksemik şok ve organ tutulumları gibi ciddi komplikasyonlar görülebilir. Deri şarbonunun histopatolojik özelliği damar konjesyonu, kanama, jelatinöz ödem ve nekroz ile karakterizedir. Nekroz olgunlaştıktan sonra tipik olarak siyah bir kurut teşekkül eder. Oluşan siyah kurut nedeniyle şarbon hastalığına batı literatüründe Yunanca da kömür anlamına gelen anthrakis teriminden gelen anthrax denilmiştir. Tipik kurut yedi-on gün içinde gelişir. Komplikasyon gelişmezse lezyon 1-3 hafta içinde yavaş iyileşir. Antibiyotik tedavisi ile iyileşme süresi kısalmaz. Tam olarak iyileşme süresi lezyonun lokalizasyonu, büyüklüğü ve ciddiyeti ile ilişkilidir. Lezyonun etrafındaki ödemin azalması ile kabuk ayrılmaya başlar, iki-üç hafta içinde de düşer ve garanülasyon ile iyileşir. Deri şarbonu kendini sınırlar ve olguların %80-90 ında lezyon tedavi ile komplikasyonsuz iyileşir. Küçük-orta deri şarbon lezyonları iz bırakmadan tamamen iyileşirken, büyük lezyonlar veya hareketli bölgelerdeki lezyonları ciddi skar bırakır ve kontrakte olurlar. Özellikle göz kapaklarını tutan lezyonlarda tedaviden sonra derin skar ve şekil bozukluğu kalabilir. Bazen püstüller formda ve sekonder enfeksiyon geliştiğinde kabuk ayrılması gecikir ve belirgin skar oluşur. Bu olgularda normal fonksiyonlarını geri kazanmak için rekonstruktif cerrahi ve deri greftlerine ihtiyaç gösterebilirler. Deri şarbonunun tekrarladığını bildiren olgular nadirdir. Bu olgular daha hafif geçmeye eğilimlidir. Püstüler formda bazen tablo ağır seyreder, toksemi ve sepsis gelişerek, ölüme yol açabilir. Yüz, boyun, ense, göğüs ve özellikle periorbital bölgede yerleşen lezyonlarda ödem fazladır ve yayılma eğilimi gösterir. Ödem yüze, boyuna ve göğüs ön duvarına yayılır. Trakeaya baskı yaparak solunum sıkıntısına yol açabilir. Aşırı ödem, büller, endürasyon gibi şiddetli lokal reaksiyonlarla karakterize, ağır toksemiye yol açan belirtilerle seyreden tablo şarbon ödemi olarak isimlendirilir (eski adı edema malign veya malignant edema). Şarbon ödemi püstuler forma göre daha ciddi ve tehlikelidir. Bu hastalarda yüksek ateş, toksemi, hipotansiyon ve şok görülebilir. Ülkemizin Doğu Anadolu Bölge sinden 85 deri şarbonu olgusunu bildiren bir çalışmada; deri ülseri ve siyah eskar %100, lezyon çevresinde şişlik ve eritem %70.6, halsizlik-keyifsizlik %34.1, lezyonda kaşıntı %32.9, ateş %12.9 ve aksiler lenfadenopati %12.9 olarak bildirilmiştir. Yine yetişkin ve çocuk 126
127 hastaları içeren 132 deri şarbonu olgusunu bildiren diğer bir çalışmada blister %76, eskar %69.7, lezyon çevresinde şişlik %75, ateş %81.3 ve lenfadenopati %94.8 olarak bildirilmiştir. Akciğer Şarbonu: Akciğer şarbonu nadir ve ölümcül bir şarbon formudur. Doğal yollarla oluşumu 19. yüzyıl boyunca hayvan yün ve derileri ile ilişkili endüstriyel sektörlerde çalışanlarda sık görülmesine rağmen, günümüzde her bir olgu biyoterörizmi akla getirmektedir. B. anthracis sporlarının inhalasyonu sonucu akciğer şarbonu gelişir. inhalasyon ile 5 µm den daha küçük partiküller halinde terminal bronşiollere ve alveollere ulaşan sporlar, alveoler makrofajlar tarafından fagosite edilir ve mediastinal lenf düğümlerine taşınır. Akciğer şarbonu primer hava yolları hastalığı değil mediastinal tutulumla seyreden bir hastalık olarak düşünülmelidir. İnkubasyon periyodu 4-6 gün, ortalama 4 gündür, ancak güne uzayabilir. İnkübasyon periyodu süresince sessizce şarbon basili lenf nodlarında çoğalır ve toksinlerini oluşturur. Lenf düğümlerinde hemorajik nekroz gelişir. Bunu hemorajik mediastinit takip eder. Makrofajlar içindeki basiller çoğalarak makrofajları patlatır ve serbest hale gelir, serbest basiller yeni makrofajları tutar bu arada sistemik dolaşıma geçerek, sekonder bakteriyemi ile menenjit gibi uzak organ tutulumlarına ve sistemik bulgulara yol açar. Semptomlar iki-beş gün içinde grip benzeri hastalık bulguları ile karakterize erken prodrom bulguları (Hafif ateş, kırgınlık, miyalji ve yorgunluk şikayetleri) ile başlar. Bazı olgularda belirgin baş ağrısı, derin yorgunluk, bulanık görme, fotofobi, kuru öksürük ve göğüste hafif rahatsızlık hissi görülebilir. Akciğer şarbonu bifazik seyirlidir ve semptomları akut faz başlamasından önce nonspesifiktir. Önce 2-3 gün hafif prodromal başlangıç belirti ve bulguları görülür. Ardından orta-şiddetli akut hastalık tablosuna ilerler. Hastanın ateşi yükselir, nabzı süratlenir, öksürük, dispne ve siyanoz gelişir. Hastada solunum sıkıntısı, plörotik göğüs ağrısı, aşırı terleme, toksemi, şuur bulanıklığı, konfüzyon ve koma gelişerek ölümle sonuçlanır. Dinlemekle akciğerlerde yaş raller duyulabilir ancak balgam oluşumu pek görülmez. Bulantı, kusma, solgunluk veya siyanoz, aşırı terleme, mental durum değişiklikleri ve hemokonsantrasyon bulguları grip benzeri hastalıklardan ziyade akciğer şarbonu ile birlikte sık görülür. Bu evrede kan kültür pozitifliği tipiktir. Hastalar tedavi alsa da geç fulminan evreye (eskiden fulminan 127
128 akut faz) girebilirler. Bu hastalar ağır bakteriyemi ve toksemi nedeniyle entubasyon gerektiren solunum yetmezliği, sepsis, menenjit ve çoklu organ yetmezliğine girer. Ölüm sıklıkla 24 saat içinde gelişir. Akciğer şarbonu hemorajik mediastinal lenfadenit ile karakterizedir. Akciğer grafisinde mediastinal genişleme görülür. Bu mediastinal lenfadenopati ve hemorajik mediastinit ile uyumludur. Mediasten gölgesi homojen ve kenarları düzgündür. Radyolojik olarak mediastinal genişleme ve plevral efüzyon tipiktir ve akciğer şarbonu için en doğru prediktörler olarak bildirilmiştir. Olguların çoğunluğunda plevral efüzyon görülür, sıklıkla bilateraldir ve jelatinöz veya hemorajiktir. Akciğer şarbonu, deri ve bağırsak şarbonuna bağlı gelişen sepsislerde de görülebilir. Bu olgularda basillerin embolizasyonuna bağlı hemorajik pnömoni ve bronkopnömoni gelişir. Hastalarda yüksek ateş ve öksürük vardır. Kanlı balgam çıkarırlar. Balgamda ve kanda şarbon basillerini izole etmek mümkündür. Akciğer grafilerinde ise pnömoni ve bronkopnömoni ile uyumlu bulgular vardır. Gastrointestinal Şarbon: Orofarengeal ve barsak şarbonu gastrointestinal şarbonu oluşturur. Gastrointestinal şarbon için olağan konak olan ot yiyen hayvanlarda oldukça yaygınken, insanlarda oldukça nadir görülür. Gelişmekte olan ülkelerde özellikle kırsal bölgelerde görülür ve şarbon olgularının yaklaşık %1 ini oluşturur. İnkubasyon periyodu 3-7 gündür. B. anthracis sporları ile kontamine etlerin az pişirilmiş veya pişirilmeden kurutulmuş olarak tüketilmesi ile bulaşır. Nadiren kontamine diğer gıdalar veya içeceklerin alınmasıyla da bulaş oluşabilir. Özellikle geri kalmış ülkelerde ölen hayvan etlerinin paylaşıldığı topluluklarda salgınlar görülebilir. Bu durumda gastrointestinal şarbon olgu sayısı deri şarbon olgu sayısını aşabilir. Kontamine gıda tüketimini takiben gastrointestinal mukozada şarbon lezyonları oluşur. Şarbon lezyonları gastrointestinal kanalın her yerinde görülebilir. Tek veya birden fazla ülser, yaygın mukoza ödemi ve asit gelişir. Gastrointestinal şarbon formunda akciğer şarbonunda olduğu gibi sekonder bakteriyemi, sepsis ve organ tutulumları sık görülür. Ağır toksemi, sepsis ve septik şok gelişerek hastalar kaybedilir. Gastrointestinal şarbonda iki klinik form tanımlanmıştır; orofarengeal şarbon ve bağırsak şarbonu. Bu formlar aynı konakta birlikte görülebilir. 128
129 1. Orofarengeal şarbon: Lezyon ağız boşluğu, yanak mukozası, dil, tonsiller ve farenks arka duvarında yerleşebilir. Klinik tablo ağız ve farenkste şişlik, boğaz ağrısı, ciddi farenjit, disfaji, odynofaji, boyunda bölgesel ağrılı lenfadenit, yüksek ateş ve toksemi ile karakterizedir. Bazı olgularda boyunda ve göğüs ön duvarında ciddi ödem ve lenfadenit nedeniyle solunum sıkıntısı görülebilir ve trakeostomi gerekebilir. Ülsere lezyonun üzeri birinci haftada beyaz-gri psödomembranla kaplanır. Bütün orofarengeal şarbon olgularında boyun ve ensede belirgin ödem tipiktir. Bazı olgularda yüzde de ödem görülür. 2. Bağırsak şarbonu: Lezyon her bölgede terleşebilmesine rağmen en sık terminal ileum veya çekum bölgesinde bağırsak duvarına yerleşir. Mide, duodenum ve proksimal ileumda daha az oranda yerleşebilir. Hastalarda bulantı, kusma, iştahsızlık, kırgınlık, karın ağrısı, hematemez ve kanlı ishal vardır. Karın ağrısı şiddetlenerek cerrahi akut karın bulgularını taklit edebilir. Mezenterik lenf bezleri şiş ve hemorajiktir. Semptomlar başladıktan iki-dört gün sonra süratle masif asit gelişir ve kanlı ishal, hematemez şiddetlenir. Asit sıvısının rengi açık veya pürülan olabilir. Sekonder bakteriyemi ile menenjit gibi sistemik tutulum tabloları sıklıkla ortaya çıkar. Şarbon Menenjiti: Akciğer, gastrointestinal ve deri şarbonunda primer yerleşim odaklarından lenfohematojen yayılım sonucu gelişir. Bu klinik formların %5 inde menenjit geliştiği belirtilmektedir. Aslında menenjit deri şarbonunun nadir bir komplikasyonudur. Diğer şarbon tiplerinde ise %40-50 ye varan oranlarda görülür. Bazı hastalarda primer lezyon olmadan menenjit tablosu görülebilir. Başlangıç semptomları, ani başlangıçlı baş ağrısı, ateş, üşüme-titreme, bulantı ve kusmadır. Ense sertliği gibi meninks irritasyon bulguları erken evrede görülmeyebilir, ancak tablo ilerledikçe ortaya çıkar. Saatler içinde epileptik nöbetler, delirium ve koma gelişir. Klinik tablo tipik akut hemorajik menenjittir. Beyin omurilik sıvısı basıncı artmıştır ve hemorajiktir, damarlarda trombüs ve kortikal hemoraji gözlenir. Beynin parankimal ve subaraknoidal hemorajisine nekrotizan vaskülitin ve diffüz serebral arterit neden olduğu ve endotel hasarının basil sayısıyla ilişkili olduğu düşünülmektedir. Şarbon Sepsisi: Şarbon sepsisi primer yerleşim odaklarından herhangi birinden lenfohematojen yayılım sonucu gelişen oldukça ağır bir klinik tab- 129
130 lodur. Hangi yolla vücuda girerse girsin B. antracis sporları makrofajlar tarafından fagosite edilir ve bölgesel lenf bezlerine taşınır. Endospor makrofaj içinde vejetatif hale geçer ve çoğalır. Bu bakteriler makrofajlardan dışarı çıkar ve dolaşım sistemine yayılır. Dolaşımda basil sayısı /ml ye ulaşınca ağır sepsis kliniği oluşur. Deri şarbonu nadiren sepsise yol açarken, akciğer ve gastrointestinal şarbon formlarında bakterinin iç organ yerleşimi nedeniyle sık gelişir. Hastalık hafif seyirli nonspesifik bulgularla seyreden başlangıç evresinden sonra aniden gelişen yüksek ateş, toksemi ve şok ile seyreder. Saatler içinde şuur bulanıklığı, dispne, siyanoz ve koma gelişerek, ölümle sonuçlanır. Sepsis olgularının otopsilerinde karaciğer, dalak, lenf düğümleri ve meninkslerde nekroz ve hemorajik infiltrasyonlar, lezyon çevresindeki damarlarda trombüsler görülür. Prognoz: Temel olarak, sekonder bakteriyemi ile sistemik yayılım olmadan önce tanı konularak uygun antibiyotik ve destek tedavisi erken başlanabilirseşarbonun tüm formları tedavi edilebilir. Deri dışı şarbon olgularında erken doğru tanı konulması özellikle zordur ve bu sebeple bu formlarda mortalite oranı oldukça yüksektir. Şarbonun her üç klinik formu da öldürücüdür. Bununla birlikte deri şarbonu kendini sınırlayarak kendiliğinden düzelebilir. Tedavi edilmeyen olguların %10-20 sinde ölüm görülebilir. Tedavi ile bu oran %0-3 e inmiştir. Batı kaynaklarında uygun antimikrobiyal tedaviyle mortalite oranlarının <%1 altında olduğu bildirilmektedir. Akciğer şarbonu, şarbon sepsisi ve şarbon menenjiti de hemen daima öldürücüdür yılları arasında bildirilen 82 akciğer şarbon olgusunun irdelendiği bir çalışmada olguların büyük çoğunluğunda şarbon antiserumu ve/veya antibiyotik kullanıldığı halde mortalite oranı %92 olarak bildirilmiştir. Şarbon menenjitinde prognoz oldukça kötüdür. Menenjit bulguları ortaya çıktıktan sonra olguların %75 i 24 saat içinde, toplamda olguların %95 i kaybedilir Gastrointestinal şarbonda ise ölüm oranı tedaviye rağmen %25-75 arasındadır. Gastrointestinal şarbonunda nekroze-hemorajik barsak anslarında geniş rezeksiyon ihtiyacı olabilir. Doğanay ve ark ülkemizden bildirilen şarbon olgularını inceledikleri çalışmalarında toplam 426 olguda mortalite sayı ve oranlarını, deri şarbonu için 4 (%0.96), gastrointestinal şarbon için 3 (%37.5), şarbon menenjiti için 5 130
131 (%100) ve toplamda 12 (%2.8) olarak bildirmişlerdir. Deri şarbonunda görülen toplam 4 ölümden ikisinin sepsis, diğer ikisinin ise yaygın ödem, toksemi ve havayolu obstrüksiyonu nedeniyle olduğunu bildirmişlerdir. Yine aynı çalışmada 10 olguda göz kapağı deformitesi ve ektropiyon, 7 şer olguda hava yolu obstrüksiyonu ve derin doku nekrozu, 3 şer olguda toksemik şok ve sepsis, 2 şer olguda pnömoni, süperenfeksiyon ve erken doğum, birer olguda temporal arter tutulumu ve menenjit olmak üzere toplam 38 komplikasyon bildirilmişlerdir. TANI VE AYIRICI TANI Şarbonun klinik tanısında sadece batı ülkeleri değil endemik görüldüğü ülkelerde de hastalığın giderek azalması nedeniyle tanı problemleri yaşanmaktadır. Şarbon tanısı için lezyondan, vücut sıvı ve çıkartılarından veya kandan etkenin görülmesi ve üretilmesi altın standarttır. Ancak çoğu zaman başlanan antibiyotik tedavisi nedeniyle bakterinin gösterilmesi veya üretilmesi mümkün olamamaktadır. O zaman serolojik testler ve PCR gibi yöntemler devreye girmektedir. Deri şarbonu, lezyonun tipik görünümü ile kolayca tanınır. Maruziyet hikayesi, hızlı gelişen ağrısız lezyon ve lezyon çevresinde orantısız yaygın ödem ve eritem ile çevrelenmiş siyah kurutlu ülser tanı için en önemli ipuçları- dır. Deri şarbonu ayırıcı tanısında karbonkül, erizipel, nekrotizan sellülitler, klostridial enfeksiyonlar, primer sifiliz şankırı, orf, ruam, ülsereglandüler tularemi, ektima gangrenozum, böcek-örümcek ısırıkları ve fare ısırığı hastalığdüşünülmelidir. Bu hastalıkların hepsinde karakteristik şarbon ödemi görülmemesi ayırıcı tanı için değerlidir. Ayrıca şarbon lezyonunda sekonder enfeksiyon dışında iltihap ve ağrı görülmemesi tipiktir. Kesin tanı şarbonla uyumlu cilt lezyonlarından yapılan yaymada çok az lökosit görülürken, bol Gram-pozitif kapsüllü basillerin görülmesi ve kültürde B. anthracis in üretilmesi ile konur. Direkt preparat ve kültür için uygun materyal; tedavi almamış erken şarbon lezyonlarında vezikül sıvısından hazırlanırken, eski lezyonlarda ise krut bir forseps ile kaldırılır, kapiller tüp ile ülser tabanından materyal alınır. Sistemik bulguları olan, sekonder bakteriyemik veya sepsis olgularında antibiyotik öncesi alınan kan kültürlerinde de üreme görülür. İnhalasyon şarbonunda, başlangıç belirti ve bulguları nonspesifiktir. Bu yüzden özellikle erken inhalasyonel şarbonu üst solunum yolu belirti ve 131
132 bulgularının belirgin olmamasına rağmen, influenzadan ayırmak oldukça zordur. Erken dönemde inhalasyonel şarbon influenza dışında mikoplaz- ma pnömonisi, viral pnömoniler, legionella hastalığı, psittakoz, Q fever, histoplasmosis, koksidiomikosiz, tularemi ve akciğer maliniteleri ile de karışır. Şüpheli şarbon sporlarına maruziyet hikayesi tanı için çok önemlidir. Geç dönemde ise hastalarda kardiyopulmoner kollaps, plevral efüzyon ve mediasten genişlemesi vardır. Bu aşamada tüberküloz, akut bakteriyel mediastinit, mediastende genişlemeye neden olan aort anevrizma rüptürü, süperior vena kava sendromu ve sarkoidoz ayırıcı tanıda akla gelmelidir. Direk akciğer grafisi ve akciğer tomografisinde mediastinal genişleme ve bilateral efüzyon görülmesi ayırıcı tanı için değerlidir. Akciğer şarbonunda primer akciğer parankim tutulumu belirgin olmadığı için radyolojik olarak pulmoner infiltrat ve konsolidasyon beklenmese de, pulmoner ödem ve otopsilerde tespit edilen hiyalin membran oluşumuna bağlı olarak görülebilir. Akciğer şarbonunda tipik olarak balgam çıkarma yoktur veya çok azdır, plevral efüzyon ise sık görülür. Plevral sıvıdan ve eğer varsa balgam örneklerinden Gram boyama, kültür ve PCR yapılmalıdır. Bu hastalarda, plevral sıvıdan, balgamdan veya kan kültürlerinde B. anthracis in üretilmesi ile kesin tanı konur. Akciğer şarbonunda antibiyotik tedavisi öncesi alınan kan kültürlerde şarbon basilinin üretilmesi deri şarbonuna göre daha sıktır. Antibiyotik verilmiş hastalarda ise PCR tanı yöntemi olarak tercih edilebilir şarbon saldırı tecrübesi nazal sürüntü örneklerinin tanıda yararlı olamayacağını, pulmoner efüzyon ya da bronşiyal biyopsi örneklerinden yapılan immünhistokimyasal boyama ya da PCR ın tanıda değerli olduğunu göstermiştir. Orofarengeal şarbonun ayırıcı tanısında streptokok tonsillofarenjiti, Ludwig anjini, Vincent anjini, parafarengeal apse, difteri ve derin boyun enfeksiyonları akla gelmelidir. Peritonsiller apse ile sıklıkla karıştırılır, ancak insizyonla pürülan drenaj görülmemesi tipiktir. Orofarengeal lezyonda Gram-pozitif, kapsüllü basillerin gösterilmesi, kültürde B. anthracis in üretilmesi ile kesin tanı konur. Bağırsak şarbonu ise gıda zehirlenmeleri, akut karın yapan diğer nedenler ve diğer hemorajik gastroenterit veya nekrotizan enterit yapan hastalıklar ve amipli-basilli dizanteri ile karışır. Etkenin dışkı, kusmuk veya asit sıvısında gösterilmesi ve üretilmesi ile kesin tanı konur. Menenjit olguları subaraknoid kanama ve diğer hemorajik menenjit yapan hastalıklarla karışır. Tanı BOS ta Gram-pozitif basillerin gösterilmesi ve BOS 132
133 ve kanda bakterinin izolasyonu veya PCR ile bakteri DNA sının gösterilmesi ile tanı koyulur. Şarbon sepsisi olgularında primer lezyon belli ise tanı kolaydır, değilse diğer bakteriyel sepsislerden klinik olarak ayırt etmek oldukça zordur. Kesin tanı kan kültüründe B. anthracis izolasyonu ya da PCR ile bakteri DNA sının gösterilmesiyle konur. Serolojik olarak, PA ve LF ye karşı antikor titresindeki artışın ELISA ile gösterilmesi tanıda yardımcı olur. İdeal olarak, iki-dört hafta aralarla alınan iki veya daha fazla serum örneğinde antikor titre artışının gösterilmesi tanı koydurur. Ne yazık ki seroloji erken tanıda faydalı değildir. En erken semptomlar başladıktan bir hafta sonra serumda antikorlar pozitif bulunabilir. Bu yüzden tek serum örneği alınacaksa başlangıçtan bir hafta sonra alınması önerilir. TEDAVİ YAKLAŞIMI Enfeksiyonun erken evresinde ve doğru uygulanmaya başlandığı takdirde şarbon antibiyotik tedavisine cevap veren bir enfeksiyondur. Hafif-orta deri şarbonu dışındaki bütün şarbon formlarında hızlı uygun antibiyotik tedavisinin başlanması hayati öneme sahiptir. Neyse ki B. anthracis tetrasiklin, makrolid, aminoglikozit, florokinolon, karbapenem, klindamisin, rifampisin, kloramfenikol ve 1. kuşak sefalosporin gibi geniş bir yelpazedeki antibiyotiklere duyarlı bir basildir. Dünyada penisiline dirençli insan kaynaklı izolatların bildirildiği fakat bunların sayısının 10 dan az olduğu belirtilmektedir. Bununla birlikte penisilin direncinin en azından bazı kökenlere bağlı olabileceği gösterildiği için asıl üzerinde durulması gereken prensip, eğer şarbon tedavisinde penisilin başlanacaksa yeterli dozda başlanmasıdır. Dünyada şarbon suşlarında penisilin direncinin giderek arttığı ve bazı çalışmalarda %10 lara ulaştığı şeklindeki abartılı iddialara rağmen, DSÖ doğal oluşan deri şarbonu tedavisinde penisilinleri hala ilk tercih edilecek ilaç olarak bildirmektedir. Ancak yinede izolatlara antibiyotik duyarlılık testleri yapılması ve hastaların yakın takibi önerilmektedir. Bu yüzden tedavi öncesi kültür alınması tanın kesinleştirilmesi yanında antibiyotik duyarlılığının belirlenmesine zemin hazırlayacaktır. Doğanay ve ark ülkemizden bildirilen şarbon olgularını inceledikleri çalışmalarında antibiyotik duyarlılık sonuçlarının verildiği toplam 138 insan izolatında penisilin direnci görülmediğini bildirmişlerdir. 133
134 IM prokain penisilin, oral amoksisilin veya penisilin V komplike olmamış ılımlı deri şarbonunda kullanılabileceği DSÖ rehberinde yer almıştır. Penisilin G ise yaygın ödemi olan ciddi deri şarbonunda önerilmektedir. Penisilin allerjisi olanlarda eritromisin, tetrasiklinler, florokinolonlar ve birinci kuşak sefalosporinler alternatif olarak seçilebilecek antibiyotiklerdir. Siprofloksasin ve doksisiklin şarbonun primer tedavisinde penisilinlere en iyi alternatifler olarak kabul edilmektedir. Doksisiklinin SSS ye düşük penetrasyonu önemli bir dezavantajdır. B. anthracis ikinci ve üçüncü kuşak sefalosporinlere invitro yüksek oranda dirençlilik gösterdiğinden, bu antibiyotiklerin şarbon tedavisinde kullanılması önerilmez. Sistemik bulgularla seyreden, hayatı tehdit eden şarbon enfeksiyonlarda parenteral tedavi verilmelidir. Penisilinler kullanılamıyorsa İV olarak doksisiklin veya siprofloksasin kullanılabilir, ancak 8 yaş altı çocuklarda zorunlu olmadıkça kullanılmamalıdır. Doğal oluştuğu bilinen hafif deri şarbonu olgularında prokain penisilin U, saatte bir İM veya penisilin V 6 saat ara ile 500 mg veya amoksisilin 8 saat ara ile 500 mg oral olarak verilebilir. Ağır deri şarbonu vakalarında (sistemik bulgu varlığı, aşırı yaygın ödem veya baş-boyun-yüz lezyon varlığında) tedavi İV yolla kristalize penisilin mu günlük dozda semptomlar düzelene ve ateş düşene dek verilmeli ve gerekiyorsa alternatif ilaçlarla kombinasyon düşünülmelidir. Daha sonra a IM yoldan prokain penisilin, oral penisilin V veya amoksisilin ile tedaviye devam edilebilir. Deri şarbonunda penisilinler kullanılmayacaksa siprofloksasin 750 mg 2x1 veya doksisiklin 100 mg 2x1 oral yolla kullanılabilir. Biyoterörizm şüpheli deri şarbon enfeksiyonlarında muhtemel penisilin direnci nedeniyle siprofloksasin ve doksisiklinin ile 60 günlük tedavi planlanması uygundur. Penisilin veya alternatifi bir antibiyotik deri şarbonunda tek başına kullanılabilir. Ancak DSÖ hayatı tehdit eden diğer şarbon formları ve deri şarbonunun ciddi sistemik komplikasyonları varlığında IV penisilinin bir veya iki etkili antibiyotikle birlikte kombine verilmesini önermektedir. Akciğer şarbonu vakalarında siprofloksasin, klaritromisin, klindamisin, vankomisin veya rifampisin ile birlikte, gastrointestinal şarbonda ise bir aminoglikozid ile birlikte kombine edilebilir. Klindamisinin şarbon basilinin ekzotoksin üretimini azaltarak kliniği olumlu etkilediği düşünülmektedir. Bunun yanında toksin sentezini azaltacağı düşünülen diğer antibiyotiklerde (doksisiklin, rifampisin ve klaritromisin) de bu amaçla kullanılabilir. Şarbon menenjitlerinde ise kristalize penisilin ile beraber rifampisin, vankomisin, meropenem ve kloram- 134
135 fenikol önerilmektedir. Şarbon menenjitinde doksisiklinin zayıf BOS geçişi nedeniyle florokinolonların tercih edilmesi gerektiği önerilmektedir. Penisilin allerjisi olan şarbon menenjiti olgularında florokinolon veya meropenem, rifampisin veya vankomisin ile beraber tedavide kullanılabilir (Tablo 1). Özellikle biyoterör etkeni olarak kullanılan şarbon suşlarının penisiline azalmış duyarlılık gösterebileceği unutulmamalıdır. Doğal olmayan biyoterörizm şüpheli diğer şarbon enfeksiyonlarında siprofloksasin ve doksisiklinin ilk seçenek olması gerektiği batı kaynaklı rehberlerde vurgulanmaktadır. Hayatı tehdit eden böyle bir ihtimal halinde çocuklarda, hamile ve emzikli kadınlarda da doksisiklin veya siprofloksasin kullanılması gerekli olabilir. Özellikle başlangıç bulguları grip benzeri hastalıklardan ayrımı yapılması oldukça zor olan inhalasyonel şarbon şüphesi varsa doğrulanmasa bile kültür sonuçları çıkıncaya kadar 2-3 günlük periyotta ampirik tedavide bu antibiyotiklerin kullanımı önerilebilir. Hayatı tehdit eden durumlarda bu ilaçların vankomisin veya rifampisin ile kombine verilmesi gerekebilir. Ancak antibiyogram testlerine göre etken eğer duyarlı bulunursa penisilin veya amoksisiline değiştirilmelidir. Tablo 1. Şarbonda Önerilen Antibiyotik Tedavi Rejimleri (Kaynak 5 ten alınmıştır). ANTİBİOTİK Penisilin V Penisilin G, Prokain Penisilin G, Sodyum veya Potasyum Ampisilin Amoksisilin Siprofloksasin 1 Klaritromisin 2 YETİŞKİN DOZLARI 4X500 mg oral 1-2X mu IM 4-6X4 mu IV 4-6X1-2 g IV 3X500 mg oral 2X500 mg oral 2X400 mg IV 2X500 mg oral veya IV 135 ÇOCUK DOZLARI mg/kg/gün oral 4 bölünmüş dozda U/kg/gün IM U/kg/gün IV 4-6 bölünmüş dozda mg/kg/gün IV 4-6 bölünmüş dozda >20 kg 3X500 mg oral <20 kg 3X40 mg/kg oral Genellikle önerilmez, Sadece acil durumlarda 2X10-15 mg/kg oral veya IV ve 1g/gün aşılmaz Önerilmez
136 Klindamisin 2 Doksisiklin Eritromisin Rifampisin 3 4X oral 3-4X IV 2X100 mg oral 4X500 mg oral g/gün oral veya IV 2-4 bölünmüş dozda X8-25 mg/kg/gün oral 3-4X15-40 mg/kg/gün IV Genellikle <8 yaş altına önerilmez, Sadece acil durumlarda <8 yaş, 2X2.2 mg/ kg oral >8 yaş, >45 kg, 2X100 mg oral >8 yaş, <45 kg, 2X2.2 mg/kg oral mg/kg/gün oral 4 bölünmüş dozda 1-2X10-20 mg/kg oral Streptomisin 4 1X1 gr IM mg/kg/gün IM Tetrasiklin 4X500 mg oral Önerilmez Vankomisin 3 2X1 gr IV 40 mg/kg/gün IV 2-4 bölünmüş dozda 1 Penisilin alerjisi ve hayatı tehdit eden enfeksiyon varsa SSS ye geçen iki antibiyotikle kombinasyon önerilir. 2 Akciğer şarbonunda penisilin G ile klindamisin veya klaritromisin kombinasyonu önerilir. 3 Şarbon meningoensefalitinde penisilin G ile vankomisin ve rifampisin kombinasyonu önerilir. 4 Gastrstrointestinal şarbonda penisilin G ile streptomisin veya diğer bir aminoglikozit kombinasyonu önerilir. Deri şarbonunda tedavi süresi konusu tartışmalıdır. Önerilen komplikasyonsuz deri şarbonu tedavi süresi 3-7 gündür. Sistemik şarbon içinse yeterli kısa tedavi deneyimi olmadığından günlük tedavi önerilir. Doğal olmayan biyoterör amaçlı bir şarbon şüphesi varlığında antibiyotik tedavisi yanında aşı uygulamasının tek başına antibiyotik tedavisinden sağlanan korunmayı arttırabileceği bildirilmektedir. Bu durumda siprofloksasin veya doksisiklinle birlikte yeni cansız Protektif Antijen (PA) temelli şarbon aşısının uygulanması önerilir. Aşı kullanılamayan olgularda antibiyotik tedavisinin süresi 60 güne kadar uzatılması önerilirken, aşı ile birlikte bu sürenin aşıya karşı yeterli immün cevabın gelişeceği süre olan 4-6 haftaya kadar inebileceği bildirilmiştir. İlk antibiyotik uygulamasından saat sonra lezyondan şarbon basili
137 izolasyonu mümkün olmamaktadır. Lezyonda enfl nflamasyonun devam etmesi üretilmiş serbest bakteriyel toksinin etkisine bağlı olduğu düşünülebilir. Antibiyotik tedavisi lezyonun progresyonunu veya toksin ilişkili sistemik hasarı etkileyememektedir. Ancak antibiyotik tedavisinin erken başlaması lezyonun büyümesini ve toksin yükünün artmasını önleyerek iyileşmeyi olumlu etkiler. Bu yüzden klinisyenlerin erken başlanan antibiyotik tedavisinin iyileşmeyi olumlu etkileyeceğini, buna rağmen iyileşmenin gecikeceğini, antibiyotik tedavisini uzatmanın bu süreyi kısaltmayacağını ve erken cerrahi müdahalenin gereksiz olduğunu bilmeleri gereklidir. Akut enflamasyon varlığında deri şarbonuna cerrahi müdahale önerilmez. Semptomların artmasına ve lezyonun genişlemesine yol açar. Lokal, antibiyotik içeren merhemlerin hiçbir etkisi yoktur. Deri lezyonunun lokal pansumanının yapılması ve steril ıslak gazlı bezle kapatılması yeterlidir. Bu işlemler yapılırken çevre ve sağlık personeli enfekte edilmemelidir. Akut enflamasyon sonrası gelişen deformite ve derin doku skarları özellikle fonksiyonel bozukluğa neden olan skarlar cerrahi olarak düzeltilebilir. Gastrointestinal şarbonda klinik tablo akut abdomene benzer ve yanlışlıkla cerrahi müdahale yapılabilir. Bunun yanında ciddi enflamasyon ve hemoraji ile nekroz ile giden barsak segmentlerinin rezeksiyonu için cerrahi uygulanabilir ve hayat kurtarıcı olabilir. Sistemik şarbon enfeksiyonlarının tedavisinde, agresif IV antibiyotik tedavisi ile birlikte yoğun bakım desteği de verilmelidir. Sıvı açığının düzeltilmesi, şoktaki olgularda vazopressörlerin kullanılması, hipoksik olgularda oksijen tedavisi gerekebilir. Akciğer şarbonunda gelişen plevral efüzyonun tekrarlayan torasentezlerle veya göğüs drenaj tüpleri ile boşaltımının sağ kalım oranlarını arttırdığı 82 olgunun irdelendiği bir çalışmada bildirilmiştir. Bu hem oksijenizasyonu düzeltmektedir hem de özellikle plevral sıvıda yüksek oranda bulunan toksinlerin özellikle LF nin uzaklaştırılmasını sağlamaktadır. Trakea ve larenkse bası yapan ödem durumlarında entübasyon, trakeostomi veya solunum desteği gerekir. Steroidlerin tedavide yeri yoktur, ancak hayatı tehdit eden ağır ödeme bağlı trakeal obstrüksiyon varlığında, masif plevral efüzyon ve masif asit varlığında steroid verilmesinin faydalı olduğunu bildiren olgu sunuları vardır. Bunun yanında şarbon menenjitinde hiperventilasyon ve mannitole yeterli cevap yoksa steroid eklemenin serebral ödem ve enflamasyon için faydalı olabileceğini bildiren olgu sunuları da mevcuttur. 137
138 Toksin konakta belli bir kritik düzey aştıktan sonra ölüm kaçınılmazdır. Bu nedenle şarbon patogenezi üzerinden yeni tedavi yöntemleri araştırılmaktadır. Bu araştırmalarda hedeflenen ana konular; toksin komponentleri ile konak hücre reseptörleri arasındaki ilişki, konak hücrede toksinle meydana gelen olaylar ve virülans faktörleridir. Tedavide bazı eski Sovyetler Birliği ülkelerinde ve Çin de nadiren kullanılmakla beraber değişik hayvan türlerinden elde edilen şarbon antiserumu etkili olmasına rağmen yan etkileri nedeniyle terk edilmiştir. Aşılı insanlardan elde edilen hiperimmünserum ve monoklonal antikor temelli yaklaşımlar günümüzde çalışılmaya devam etmektedir. Basilin toksinlerini patogenez üzerinden hedef alan bu çalışmalar gelecek için umut vermektedir. O zamana kadar erken uygun antibiyotik tedavisi ve destek tedavisi hayat kurtarıcı tek seçenek olarak görünmektedir. KAYNAKLAR 1. Anthrax: Current, comprehensive information on pathogenesis, microbiology, epidemiology, diagnosis, treatment, and prophylaxis. Last updated July 28, Bravata DM, Holty JE, Wang E, et al. Inhalational, gastrointestinal, and cutaneous anthrax in children: a systematic review of cases: 1900 to Arch Pediatr Adolesc Med 2007 Sep;161(9): Dixon TC, Meselson M, Guillemin J, Hanna Pc. Anthrax. N Engl J Med 1999; 341: Doğanay M. İnsanlarda Şarbon. In: Doğanay M, Altıntaş N (eds). Zoonozlar. Hayvanlarda İnsanlara Bulaşan Enfeksiyonlar. Bilimsel Tıp Yayınevi Ankara 2009 pp Doğanay M, Eşel D. Bacillus anthracis ve diğer bacillus türleri. In: Topçu AW, Söyletir G, Doğanay M (eds). Enfeksiyon Hastalıkları ve Mikrobiyolojisi 3th ed. Nobel Tıp Kitabevi İstanbul 2008 pp Doganay M, Metan G. Human anthrax in Turkey from 1990 to Vector Borne Zoonotic Dis 2009 Apr;9(2): Doganay M, Metan G, Alp E. A review of cutaneous anthrax and its outcome. J Infect Public Health. 2010;3(3): HPA (Health Protection Agency, United Kingdom). Guidelines for action in the event of a deliberate release of anthrax. Version Apr Irmak, H, Buzgan, T, Karahocagil, MK, Sakarya, N, et al. Cutaneous ma- 138
139 nifestations of anthrax in Eastern Anatolia: A review of 39 cases. Acta Med Okayama 2003; 57: Jernigan JA, Stephens DS, Ashford DA, et al. Bioterrorismrelated inhalation anthrax: the first 10 cases reported in the United States. Emerg Infect Dis 2001;7: Karahocagil MK, Akdeniz N, Akdeniz H, Calka O, Karsen H, Bilici A, Bilgili SG, Evirgen O. Cutaneous anthrax in Eastern Turkey: a review of 85 cases. Clin Exp Dermatol Jul;33(4): Kaya A, Tasyaran MA, Erol S, Ozkurt Z. Anthrax in adults and children: A review of 132 cases in Turkey. Eur J Clin Microbiol Infect Dis 2002; 21: Martin GJ, Friedlander AM. Bacillus anthracis (Anthrax). In: Mandell GL, Bennet JE, Dolin R (eds). Principles and Practice of Infectious Diseases (7th ed).churchill Livingstone Elsevier Philadelphia 2010 pp Turnbull P and WHO Anthrax Working Group. Anthrax in humans and animals: Geneva: World Health Organisation, Sejvar I, Tenover FC, Stephens D. Menagement of anthrax meningitis. Laneet Infect Dis 2005; 5: Sirisanthana T, Brown EA.Anthrax of the gastrointestinal tract. Emerg Infeet Dis 2002; 8:
140 KORUNMA VE HAYVAN ŞARBON AŞILARI Dr.Vet.Hek. Funda KALINBACAK Etlik Merkez Veteriner Kontrol Ve Araştırma Enstitüsü Anthrax Aşı Üretim Laboratuarı Anthrax (Şarbon), Office International des Epizooties nin (OIE) B listesi hastalıklar grubu içinde yer alır. Özellikle koyun, keçi, sığır, manda, deve gibi ot yiyen hayvanların yüksek mortalite ile seyreden bakteriyel bir hastalığı olmakla birlikte daha az olarakta domuz, at ve et yiyenlerde görülür. Zoonoz bir hastalık olması nedeniyle önem taşımaktadır. Hastalık etkeni 1-2 µm eninde, 3-8 µm uzunluğunda, aerobik, Gram pozitif, hareketsiz, çubuk şeklinde, kapsüllü, spor oluşturan Bacillus anthracis dir. Sporlar tabiat şartlarına, kimyasallara ve dezenfektanlara oldukça dayanıklıdır. Bu nedenle anthrax sporları ile bulaşık meralar hayvanlar için uzun süreli hastalık kaynağıdır. Bulaşma üç yolla olmaktadır. 1. Sindirim sistemi ile: Su, yem, ot, kemik ununa bulaşan vegetatif basil ve sporların sindirim sisteminde bulunan yara ve çiziklerden girmesiyle, 2. Solunum yolu ile: Toprak, post, kıl, yapağıda bulunan sporların solunum yolu ile alınmasıyla, 3. Deri yoluyla: Derideki kesik, ısırık, sıyrık, operasyon ve kırkma yaralarından mikropların girmesi ile oluşur. İnkubasyon periyodu hayvanın türü, direnci, mikroorganizmanın miktarı, virulensi ve giriş yolu ile değişmekle birlikte 1-14 gündür. Hastalık koyun ve keçilerde perakut seyrettiği için ani ölüm dışında klinik tablo görülmez. Sığırlarda yüksek ateş ve kan işeme, domuz ve atlarda subakut hatta kronik seyirde lokal şişkinlik, ateş ve büyümüş lenf yumruları dikkat çeker. Hayvanlarda ölümden hemen önce ve sonra doğal deliklerden kan gelmesi tipiktir. Hastalık çıktığında; Ölen hayvanların ve bulaşık maddelerin doğru şekilde ortadan kaldırılması, Doğru dezenfeksiyon, Hastalığa duyarlı hayvanların aşılanması ve risk altındaki meslek mensuplarının korunması önem taşımaktadır. 140
141 Yurdumuzda anthrax hastalığına karşı ilk olarak 1910 yılında Pasteur aşısı kullanılmaya başlanmış akabinde 1929 yılında Süreyya Aygün ün Türk Üniversal Anthrax Aşısı kullanılmıştır. Bu iki aşı özellikle devlet haralarına ve ordu elindeki hayvanlara uygulanmıştır yılından itibaren Max Sterne tarafından geliştirilen ve dünyada kabul gören B. anthracis 34 F2 suşu ile hazırlanan aşı, Etlik Merkez Veteriner Kontrol ve Araştırma Enstitüsünde üretilmekte olup başarıyla kullanılmaktadır. ANT ETVAC Anthrax Aşısı sığır, at, deve, manda, koyun, keçi ve domuzların anthrax hastalığına karşı %50 v/v gliserin- fizyolojik tuzlu su, % 0,1-0,025 v/w saponin (titreye uygun olarak) ve 10 7 /ml canlı spor içeren attenue bakteriyel bir aşıdır. Aşı üretimi Casein Digest Mediumda gerçekleştirilmektedir. Sterilite, bağışıklık ve zararsızlık kontrolleri O.I.E, European Pharmacopoei ve WHO ye göre yapılmaktadır. Aşı hastalık riski olan yerlerde ilkbaharda, hastalık çıkan yerlerde sağlıklı hayvanlara koruma amaçlı uygulanır. Tektırnaklılarda 21 gün diğerlerinde 10 gün içerisinde bağışıklık oluşur. Bir yıl bağışıklık verir. Hastalık etkeni olan Bacillus anthracis in çevre şartlarına dirençli olması sebebiyle hastalık çıkan mihrakların 5 yıl süreyle her yıl aşılanması, hayvanların iyi bakım ve beslenme ile doğal dirençlerinin arttırılması hastalıkla mücadelede etkin bir yoldur. Enstitümüzde yıllık aşı üretim miktarı dozdur. Yıllık üretim TKB Koruma ve Kontrol Genel Müdürlüğünce her yıl yayınlanan Hayvan Hastalık ve Zaralıları ile Mücadele Programı kitapçığındaki il kontenjanlarına göre yapılmaktadır. Anthrax, 3285 sayılı Hayvan Sağlığı ve Zabıtası Kanunu ve ilgili yönetmeliğe göre ihbarı mecburi bir hastalıktır. Etkenin bilinen özelliklerine karşı önlemler alınmalı, kanun ve yönetmelikler eksiksiz uygulanmalıdır. Bununla birlikte çevreyi koruma bilinci ile hayvan sahipleri ve yerel yöneticilerin katkıları sağlanmalıdır. 141
142 Batı Nil Virusu: Viroloji, Epidemiyoloji ve Mikrobiyolojik Tanı Yrd. Doç. Dr. Koray ERGÜNAY Hacettepe Üniversitesi Tıp Fakültesi Tıbbi Mikrobiyoloji Anabilim Dalı Viroloji Ünitesi Batı Nil virusu - Viroloji, Replikasyon ve Patogenez: Batı Nil virusu (BNV), Flaviviridae ailesi Flavivirus cinsi, Japon Ensefaliti serokompleksinde sınıflandırılan bir virustur. Aynı aile ve cins içerisinde, BNV gibi vektör aracılığıyla bulaşan sarı humma, Dengue, kene ensefaliti gibi birçok başka virus da bulunmaktadır (1). BNV virionları nm çaplı, zarflı partiküllerdir. Virusun genomunu pozitif polariteli, yaklaşık bazçifitinden oluşan tek iplikli bir RNA oluşturur. Genomun 5 ve 3 uçlarında protein kodlamayan bölgeler (non-coding region, NC) bulunur; bunların sınırlandırdığı genomdan virusa ait 3 yapısal (C, prm ve E) ve 7 yapısal olmayan proteini (NS1, NS2a, NS2b, NS3, NS4a, NS4b, NS5) kodlanır. Genom, tek bir poliprotein olarak transkripsiyona uğrar; viral ve hücresel proteazların etkisiyle işlevsel viral proteinler oluşur (2). BNV nin yapısal proteinlerinden C, ana kapsid proteinidir ve genomik RNA yı bağlar. PreM ise virusun biraraya gelişi sırasında erken füzyonu önler, ayrıca E proteininin olgunlaşmasına katkıda bulunur. E proteini ise virusun hedef hücreye tutunması, füzyonu ve biraraya gelmesi aşamalarında görev alır. E ve M proteinleri, virusa karşı B ve T lenfosit yanıtından sorumludur. E proteini ise ayrıca virusun serotip spesifitesini belirler, viral hemaglutinin özelliği taşır ve nötralizan antikorların ana hedefidir (3,4). Virusun yapısal olmayan (non-structural) proteinlerinin ana görevi ise viral replikasyon, transkripsiyonun düzenlenmesi ve konağın antiviral yanıtının modülasyonudur. Yapısal olmayan proteinlerden NS1, viral replikaz için kofaktör aktivitesi gösterir. NS2a ise interferon yanıtını baskılar, ayrıca virusun biraraya gelişinde rol alır. NS3 proteaz, NTPaz ve helikaz aktivitesine sahiptir. NS2B de NS3 ün proteolitik aktivitesi için kofaktör görevi görür. NS4a ve NS4b, hücreiçi interferon sinyalizasyonunu modifiye eder. NS5 ise RNAbağımlı RNA polimeraz enzimi ve virusun replikaz enzimidir (5-9). 142
143 BNV nin in vitro koşullarda hücre yüzeyinde bağlandığı moleküller arasında yüzey lektinlerinden DC-SIGN, DC-SIGNR ve integrin a v b 3 belirtilmiş, ancak nöronlar gibi patogenezde önemli hücrelere girişte kullanılan reseptör henüz kesin olarak gösterilememiştir (6,10,11). Hücre reseptörüne tutunmanın ardından reseptöre bağımlı endositoz mekanizmasını kullanarak, klatrin kaplı çukucuklar ile hücre içerisine alınır. E proteinindeki ph ya bağlı konformasyonel değişikliğın ardından virus zarfı ile endozomal membranın füzyonu gerçekleşir, ardından nükleokapsid sitoplazmaya geçer (12,13). Endoplazmik retikulumla ilişkili membran sisteminde virus, replikaz enzimini kullanarak genoma komplementer negatif polariteli RNA sentezler ve bu molekülü kalıp olarak kullanarak yeni pozitif polariteli viral RNA ların oluşmasını sağlar. Sentezlene RNA lar ise ya yeni viral proteinlerin sentezini sürdürür ya da kapsid içine paketlenir. Virusun olgunlaşması endoplazmik retikulumda olur, burada tomurcuklanan immatür partiküller prm proteini içerirler. Trans-golgi ağında transportu sırasında prm proteininin parçalanır, olgun M proteini içeren enfektif virion oluşur ve ekzositozla hücreyi terk eder (14-16). BNV nin konakta bulunma ve hastalık oluşturabilmesi, hedef hücreleri enfekte edebilme ve konağın immün yanıtından kaçabilme özelliklerine bağlıdır (6). BNV, enfekte ettiği hücreleede sitolitik etki gösterir, ayrıca apopotozisi indükler (17,18). Geniş bir hücre tropizmine sahip olan BNV nin çeşitli omurgalı türlerinde ve kuşlarda enfeksiyon oluşturabilmesi, birçok farklı ya da türler arasında korunmuş molekülleri reseptör olarak kullanabildiğini göstermektedir (6,19,20). Rodent modellerinde vektörle konağa inokülasyonunun ardından ilk replikasyon deri Langerhans hücrelerinde gerçekleşmektedir (21). Langerhans hücrelerinin göçü ve bölgesel lenf nodlarına ulaşmasının ardından viremi ortaya çıkar ve dalak ve böbrek gibi periferal organların enfeksiyonu izlenir. Daha sonra BNV, immün yanıtın etkisiyle serum ve diğer organlardan temizlenir, ancak hayvanların bir bölümünde merkezi sinir sistemi enfeksiyonu ortaya çıkar. Virusun kan-beyin bariyerini aşma mekanizmaları tam olarak açıklanmamış olmasına karşın, endotel hücrelerinde çeşitli sitokinlere bağlı geçirgenlik artışı sorumlu tutulmaktadır (22,23). Merkezi sinir sisteminde BNV, beyin, beyin sapı ve medulla spinalis te bulunun nöronları enfekte eder ve en belirgin olarak medulla spinalis ön boynuz hücrelerinde ve beyin sapında hasar ortaya çıkar. Enfekte nöronların çevresindeki diğer nöronlar da, virusun oluşturduğu hasardan etkilenir. Bazı olgularda, immün yanıtın oluşturduğu doku zedelenmesinin 143
144 de patogeneze katkıda bulunabildiği tespit edilmiştir (24-27). BNV de Genetik Çeşitlilik ve Virulansa Etkisi Çeşitli kaynaklardan izole edeilen BNV lerin dizi ve filogenetik analizleri, tüm dünyada izlenen 2 ana virus genotipi ( lineage, köken) olduğuna işaret etmektedir. Bunlardan genotip 1; Avrupa, Asya, Kuzey Afrika, Amerika kıtası ve Avustralya (Kunjin virusu) da saptanan izolatları kapsamaktadır. Genotip 1 de sınıflandırılan izolatların farklı subtipler/varyantlar halinde dağılım göstermesi (subtip A: çoğu Avrupa, Asya ve Amerika izolatı, subtip B: Kunjin virus subtip C: Hindistan izolatları) dikkati çekmektedir. Genotip 2 ise klasik olarak Sahara altı Afrika ve Madagaskar da bulunan izolatları içermektedir. Genotip 1 e bağlı semptomatik hastalık ve ölümlerin genotip 2 ye göre daha sıklıkla izlenmesi, bu genotipin virulansının daha yüksek olduğu yorumlarına yol açmıştır. Genotip 2 ise düşük virulans gösteren Afrika ya özgül bir genotip olarak kabul edilmiştir (28-30). Ancak güncel çalışmalarda, genotip 2 içinde sınıflandırılan izolatların Çek Cumhuriyeti-Avusturya bölgesinde çeşitli kuş türlerinde saptanması, ayrıca bu genotipe ait yüksek patojen virusların da varlığının gösterilmesi, bu genellemenin geçersiz olduğunu düşündürmektedir. Güncel veriler, her iki ana genotip içerisinde düşük ve yüksek patojen izolatların bulunduğuna işaret etmektedir (31-34). BNV nin tanımlanan 2 ana genotipine ek olarak, Avrupa ve Asya da en az 5 farklı genotipin bulunduğu ortaya konulmuştur. En son İspanya dan rapor edilen bu yeni genotiplerin virulansı ve insan patojeni olarak önemi henüz açıklanmış değildir (31,35-37). Ancak güncel çalışmalarda, Avrupa da endemik bölgelerde farklı genotiplerin aynı anda dolaşımda olabileceği gösterilmiştir (31). Amerika kıtasında da yeni bir genotipin baskın olarak saptandığı bildirilmiştir (38,39). BNV de virulansla ilişkili olabilecek varyasyon ve spesifik mutasyonlar, yoğun olarak araştırılmaktadır.yapılan çalışmalar, E proteindeki glikozilasyonların replikasyon ve patogenez için önemli olduğunu, bunu etkileyen mutasyonların nöroinvazyonu etkilediğini göstermektedir (40,41). NS1 proteinin glikozilasyon paternleri de virulansla etkilidir ve bunlarda değişime yol açan mutasyonlar, viremi düzeyini düşürmektedir (6). Virusun interferon yanıtını modifiye etmesi sağlayan yapısal olmayan proteinlerdeki değişiklikler de virulansla ilişkilidir (42-44). Bir başka faktör olarak, viral poliproteinin parçalanma etkinliğini değiştirecek mutasyonların da replikasyon etkinli- 144
145 ğini değiştireceği düşünülmektedir (34, 45). Ancak virulans ya da nöroinvaziflik özelliği ile doğrudan ilişkilendirilecek genetik bir varyasyon ya da mutasyon henüz belirlenmiş değildir (6,34). Ek olarak virusun replikasyonunda RNA-bağımlı RNA polimeraz kullanması sonucu oluşan varyantlar, antijenik çeşitlilik oluşturarak nötralizan antikorlardan kaçışına katkıda bulunuyor olabilir (46). Virus dışında, konağa ait faktörler de enfeksiyonun gidişini etkilemektedir. CCR5 gibi çeşitli kemokin reseptörlerindeki varyasyonların BNV enfeksiyonlarının kliniğini etkileyebildiğine işaret eden veriler bulunmaktadır (6,47). Bulaşma ve Global Epidemiyoloji: BNV nin doğal yaşam döngüsü çeşitli kanatlılar ve en yaygın olarak Culex cinsi ornitofilik sivrisinekler arasında izlenir. Virus farklı ekolojik ve davranış özellikleri gösteren 60 civarında sivrisinek türünde gösterilmiş olmasına karşın bunların onundan azının bulaşmada önemli rol oynadığı düşünülmektedir (48,49). Vektörlerin enfekte olması viremik konaktan kan emme sonucu gerçekleşir. Buna ek olarak, vektör türlerde vertikal geçiş varlığına işaret eden kanıtlar da bulunmaktadır (50,51). Farklı cins ve türlerden yumuşak ve sert kenelerin de BNV ile enfekte olarak virusu kanatlılar ve rodentlere aktarma potansiyeli bilinmekte, ancak bu yolun virusun epidemiyolojisine etkilerinin kısıtlı olduğu düşünülmektedir (48,52). Kanatlılar, BNV için en önemli rezervuardır ve yüksek düzeyde viremi oluşturur. Saha ve laboratuvar çalışmaları ile birçok kanatlı türünün BNV enfeksiyonuna duyarlı olduğu gösterilmiştir (48,53,54). Enfeksiyonun enzootik olduğu eski dünyada kanatlılarlarda BNV enfeksiyonu belirgin bir semptomatoloji ya da mortalite oluşturmaz. Buna karşın İsrail deki 1998 salgınında ve özellikle Amerika kıtasına geçişini takiben virus, karga ailesinde sınıflandırılan türler (Corvidae) başta olmak üzere kanatlılarda önemli düzeyde mortalite ile seyretmiş, çevrede toplu kuş ölümlerinin gözlenmesinin bölgesel virus aktivitesine işaret ettiği saptanmıştır (48,55,56). Virusun kanatlılara bulaşması en belirgin olarak vektör sivrisinekler aracılığyla gerçekleşir. Buna ek olarak, oral ve fekal-oral yolun da virusun dağılımına katkıda bulunduğunu gösteren kanıtlar vardır (57). Epidemiyolojik ve filogenetik veriler, virusun eski dünyada farklı bölgeler arasındaki dağılımında göçmen kuşların etkili olduğuna işaret etmektedir. Göçmen olmayan, ancak belirli bir bölgede yaşayan kuş türlerinin ise, bölgesel BNV aktivitesinin sürdürülmesi ile ilişkili olduğu düşünülmektedir (58,59). 145
146 Çeşitli memeli türleri de BNV ile enfekte olmasına ve klinik belirti göstermesine karşın, viremi düzeyinin vektör sivrisinekleri enfekte edecek düzeyde olmaması nedeniyle ölü konak olarak tanımlanırlar. BNV enfeksiyonu en sık olarak insanlar ve atlarda saptanmaktadır. İnsanlardaki BNV maruziyetinin küçük bir kısmında semptomatik hastalık ve/veya merkezi sinir sistemi tutulumu ortaya çıkar; buna karşın çoğunlukla asemptomatik enfeksiyon ve serokonversiyon gözlenir. Atlarda da semptomatik enfeksiyon görece düşük sıklıktadır, ancak nadir olguda nörolojik tutulum ortaya çıkar. BNV nin insana en etkin bulaşması, enfekte vektör sivrisinekler aracılığıyla gerçekleşir (58,60-62). Bunun dışında kan ve kan ürünlerinin transfüzyonu, organ transplantasyonu da virusun nakledilmesinde rol oynar. İntrauterin yol ve anne sütü; ayrıca muhtemel aerosol kaynaklı bulaşma ve laboratuvar maruziyetleri de sporadik olgular şeklinde bildirilmiştir (63-68). BNV enfeksiyonu ve virusa maruziyet insan ve atlara ek olarak diğer memeliler (köpek, kedi, ayı, domuz, geyik, rakun, tavşan vb.), sürüngen ve amfibianlar (kurbağa, timsah), rodentler ve yarasalarda saptanmıştır (61,69-75). Bunların çoğunun, virusun yaşam döngüsüne etkilerinin sınırlı olduğu düşünülmesine rağmen, sürüngenlerin uzun süreli viremi oluşturarak virusun kış aylarında hayatta kalmasını sağlayarak amplifikasyona katkısı bulunması muhtemeldir (71,72). BNV insidansı Kuzey Amerika, Avrupa ve Akdeniz havzasında ılıman iklime sahip bölgelerde mevsimsel özellik gösterir ve en yüksek virus aktivitesi temmuz-ekim ayları arasında izlenir (58,61). Amerika Birleşik Devletlerinde virusun güneye yayılımıyla birlikte insan olgularının saptandığı süre genişlemiş ve nisan-aralık aylarını da içine almaya başlamıştır (58). Güney Afrika da ise bulaşma, yılın ilk ilkbahar ve yaz yağmurları ile artış göstermektedir (76). BNV vektör aracılığıyla bulaşma gösteren viruslar arasında, tüm dünyada en fazla yaygınlık gösteren enfeksiyondur (48). İlk kez 1937 yılında Afrika kıtasında, günümüz Uganda sında yer alan Batı Nil bölgesinde ateşli, hafif bir hastalık geçiren bir kişiden izole edilmiştir (B 956 suşu) (77). Eski dünyada BNV ye bağlı enfeksiyonlar elli yılı aşkın bir süredir saptanmakta ve vektör sivrisinekler, at, insan ve diğer çeşitli konaklardan Afrika, Avrupa, Akdeniz ve Ortadoğu, Asya nın çeşitli diğer bölgeleri ve Avustralya dan (Kunjin virus) rapor edilmektedir. İlk zamanlarda düşük patojeniteye sahip bir ajan olarak 146
147 kabul edilen BNV nin etken olduğu ve ensefalit olgularının izlendiği epidemiler, ve 1957 yıllarında İsrail, yıllarında Fransa ve 1974 Güney Afrika saptanmıştır. Takip eden yıllarda Akdeniz havzasında saptanan belli başlı BNV epidemileri Cezayir (1994), Fas(1996), Tunus (1997 ve 2003), Romanya ( ), Çek Cumhuriyeti (1997), İsrail ( ), Rusya ( ) ve Fransa (2003) dan rapor edilmiştir (48,58,60,78,79). Son olarak daha önceden diğer konaklarda duyarlı virusun varlığı tanımlanmış olan İtalya ve Macaristan da insan BNV olguları saptanmış; 2010 yılı temmuz-ağustos aylarında ise Yunanistan ilk kez BNV nin etken olduğu bir salgın bildirimi yapmıştır (80-83) yılından önce batı yarıkürede rastlanmayan BNV, 1999 da önce New York şehrinde saptanmış, daha sonra hızla Amerika Birleşik Devletlerinde yayılarak kuzeyde Kanada ve Güney Amerika ya ulaşmıştır (79,84,85). Türkiye de BNV Epidemiyolojisi: Türkiye, BNV için endemik kabul edilebilecek bir coğrafyada bulunmaktadır. Virusun Türkiye deki aktivitesine ilişkin ilk veri 1971 yılında yapılan bir çalışmada elde edilmiş; Ankara ve Hatay bölgelerinde koyunlarda BNV ye karşı nötralizan antikorlar saptanmıştır (86). Virusa insan maruziyeti ise; Ari ve Meço tarafından hemaglutinasyon inhibisyon testi kullanılarak yapılan çalışmalarda araştırılmış, sonuçlar gruba özgül antikor varlığı şeklinde rapor edilmiştir (87,88). Ancak bu çalışmalarda elde edilen sonuçların, Flaviviruslar arasına izlenen ve hemaglutinasyon inhibisyon yöntemi gibi gruba özgül testlerde ortaya çıkan antijenik çapraz reaksiyonlara bağlı olması kuvvetle muhtemeldir (89). Serter in Ege bölgesi kaynaklı çalışmasında 1074 kişinin %29.1 inde BNV antikorları saptanmış, bunun %74 lük bir bölümü de nötralizasyon testiyle doğrulanmıştır (90). Özkul ve arkadaşları, ülkemizin çeşitli bölgelerinde birçok memeli türünde virus maruziyetini doğrulamıştur (91). Bu çalışmada Hatay, Adana, Antalya, Muğla, İzmir, Şanlıurfa, Bursa ve Ankara da bulunan 10 farklı ilden toplanan örnekler incelenmiş; büyükbaş hayvanlarda %4, köpeklerde 37.7%, atlarda %13.5, katırlarda %2.5, insanlarda %20.4 ve koyunlarda 1% oranlarında BNV nötralizan antikorları gösterilmiştir (91). Güneydoğu Anadolu bölgesi Şanlıurfa ve Siverek de grubumuzun yaptığı bir çalışmada ise BNV nötralizan antikorları %9.4 oranında saptanarak bu bölgede de virus aktivitesi doğrulanmıştır (92). Güncel diğer bir çalışmamızda ise, Ankara bölgesinde virus aktivitesi yeniden gösterilmiş, ayrıca Konya, Yozgat ve Sivas da yaşayan kişilerde de maruziyet tespit edilerek Orta Anadolu bölgesinde kan donörlerinde seroprevalans %
148 olarak saptanmıştır (93). Görüldüğü gibi, ülkemizin çeşitli bölgelerinde BNV aktivitesinin varlığı çeşitli seroepidemiyolojik çalışmalarla doğrulanmıştır. Buna karşın, semptomatik BNV enfeksiyonlarına ait raporlar çok daha kısıtlı sayıdadır. Bunlardan ilki, Arpacı ve arkadaşları tarafından rapor edilmiş olan kemik iliği transplantasyonu sonrasında nedeni açıklanamayan yüksek ateş ve nörolojik bulguların ortaya çıkması sonucu değerlendirilerek kanda BNV RT-PCR pozitif olarak saptanan bir olgudur (94). Grubumuzun retrospektif bir çalışmasında ise 87 nedeni bilinmeyen merkezi sinir sistemi enfeksiyonu olgusu değerlendirilmiş; 2 olgu (%2.3) muhtemel BNV enfeksiyonu olarak tanımlanmıştır (95). Ülkemizde BNV için vektör kapasitesi bulunan çeşitli sivrisinek türlerinin varlığı bilinmektedir (95). Buna karşın Güneydoğu Anadolu bölgesinde yapılan çalışmamızda sivirisineklerde virus varlığı doğrulanamamış; Kızılırmak deltası ve Karadeniz bölgesinde yapılan çalışmalarda ise doğada yaşayan kuş türleri ve sert kenelerde virus saptanmamıştır (97-99). Mikrobiyolojik Tanı: BNV enfeksiyonlarının tanısında genel olarak virusun izolasyonu, viral antijenler ya da nükleik asidin saptanması ve virusa karşı oluşan özgül immün yanıtın gösterilmesi yaklaşımları uygulanmaktadır. İnsanlardaki semptomatik enfeksiyonların tanısı ya da çeşitli hayvanlarda sürveyans amaçlı çalışmalarda, amaca uygun yaklaşımlar tercih edilmektedir (100). Virusun izolasyonu, hücre kültürlerinde üretilebilen diğer viruslarda olduğu gibi BNV için de altın standart yöntemdir. Ancak yüksek viremi izlenen vektörler ve kuşlar dışında, insanlarda ortaya çıkan viremi düşük düzeydedir ve bu nedeniyle izolasyon çalışmaları genellikle olumlu sonuç vermemektedir. İzolasyonda Vero hücreleri, sivrisinek kökenli C6/36 hücreleri ya da süt emen farelere inokülasyon yöntemleri kullanılabilmektedir ( ). Viral RNA nın RT-PCR (Reverse Transcription Polymerase Chain Reaction; ters transkripsiyonlu polimeraz zincir tepkimesi) yöntemiyle saptanması tanı ve tarama amaçlı uygulamalarda sık olarak yararlanılan bir yaklaşımdır (102). Viral genomun farklı bölgelerini hedef alan primer/prob setleri, ayrıca standart/ nested RT-PCR ve standart/gerçek zamanlı RT-PCR yaklaşımları arasında duyarlılık açısından farklar saptanmıştır ( ). Gerçek zamanlı PCR yöntemleri olarak 5 ekzonükleaz (Taqman ), ardışık prob hibridizas- 148
149 yonu ve FRET (LightCycler ), NASBA, dallı DNA ( branched DNA ) gibi çeşitli platformlar BNV saptanması amacıyla kullanılmış, bu yöntemlere dayanan ticari testler geliştirilmiştir (102). Viral RNA nın saptanması, kullanılan teknikle da değişiklik göstermekle birlikte, genel olarak analitik duyarlılığı çok yüksek olan bir tanı yaklaşımıdır. Ayrıca, yönteme göre kantitatif sonuç elde edilmesi de mümkündür ( ). Ancak, özellikle insanlarda gelişen BNV enfeksiyonlarında vireminin erken dönemde ve kısa süreli olması; immün yanıtın ortaya çıkmasıyla birlikte azalarak ortadan kalkması nedeniyle nükleik asit testlerinin tanı etkinliği genellikle virusa maruziyetin genellikle ilk 7 günüyle sınırlı olmaktadır (103,105). Ayrıca virustaki genetik çeşitliliğe bağlı olarak ya da primer/prob bağlanma dizilerinde mutasyon bulunan izolatlarda, nükleik asit testlerinin etkinlik ve duyarlılıkları değişmektedir (106,107). Nükleik asit testleri, kan donörlerinin viremi açısından taranması amacıyla da kullanılmaktadır (102). BNV ye bağlı enfeksiyonların tanısında sıklıkla serolojik testlerle özgül antikorların varlığının tespiti yaklaşımı uygulanmaktadır (100). BNV antikorlarının saptanması için IgM-antikor yakalama enzim immünoassay (MAC-ELISA), indirekt IgG ELISA, indirekt fluoresan antikor testi (IFAT), plak redüksiyon nötralizasyon testi (PRNT) gibi yöntemler kullanılmaktadır. Hemaglutinasyon inhibisyon ve kompleman birleşmesi gibi testler gruba özgül ve total antikorları saptamaları, ayrıca görece düşük duyarlılıkları nedeniyle yerlerini diğer testlere bırakmıştır. ELISA ve IFAT yöntemine dayanan birçok ticari test sistemi de geliştirilmiştir. Bu testlerde kullanılan antijen kaynağı ve test platformuna bağlı olarak duyarlılık ve özgüllükleri çeşitlilik göstermektedir (108,109). PRNT yöntemi ise, virusun hücre kültürlerinde oluşturduğu sitopatik etkinin önlenmesi esasına dayalı bir doğrulama testidir ve antikor özgüllüğünün belirlenmesinde kullanılmaktadır (101). Mikroküreciklere bağlı antijen/antikorlar ile lateral akım immünokromatografisi esasına dayanan çeşitli testlerin de geliştirilme ve standardizasyon süreçleri devam etmektedir (108, 110). Uygun semptomatoloji izlenen ve serum ya da beyin omurilik sıvısı (BOS) örneklerinde MAC-ELISA yöntemi ile IgM antikorlarının saptanan kişilerde bu sonuçlar, akut BNV enfeksiyonunu gösteren önemli bir bulgu olarak kabul edilmektedir (100,108). Semptomatik olan BNV enfeksiyonlarının büyük bir kısmında 8.gün ve sonrasında IgM antikorları pozitif olarak saptanır. Merkezi sinir sistemi tutulumu olan olgularda ise nörolojik bulguların ortaya 149
150 çıktığı dönemde genellikle IgM antikorları da pozitiftir (100,105,111). IgG türü antikorlar ise IgM nin ardından yaklaşık 4. günde pozitifleşmektedir (105). IgA antikorları da IgM ile benzer zamanlarda ortaya çıkar (112). BOS ta IgM antikorlarının saptanması, lumber ponksiyon sırasında kan kontaminasyonu olmamış ya da kan-beyin bariyeri bozulmamışsa enfeksiyon lehine yorumlanır (100,108). BNV enfeksiyonlarında, olgulardan elde edilen serolojik test sonuçlarının değerlendirilmesinde çeşitli güçlükler izlenmektedir. Bunlardan en önemlisi, genel olarak Flaviviruslar, ayrıca aynı serogrup üyeleri arasında izlenen antijenik benzerliğe bağlı serolojik çapraz reaksiyonlardır (89,113). IgG antikorları için daha sık olarak izlenen çapraz reaksiyonların ekarte edilerek antikor spesifitesini doğrulanması, virusa karşı nötralizan antikorların PRNT yöntemi ile gösterilmesi ile mümkündür (101,109). Bir diğer sorun ise, BNV ye karşı sentezlenen antikorların enfeksiyon sonrasındaki uzun süreli persistansıdır. Enfekte kişilerde serumda IgM ve IgA antikorlarının ve BOS ta IgM antikorlarının uzun süreler varlığını devam ettirerek tanısal testlerde reaktif sonuç verdikleri ortaya konulmuştur (112,114,115). Serumda IgM ve IgA antikorlarının özellikle ilk 200 gün boyunca persistans gösterebildiği, ayrıca IgM antikorlarının 12 ayı aşacak süreler pozitifliğini sürdürebildiği saptanmıştır (112). Akut ya da yakın zamanda geçirilen enfeksiyonların önceki maruziyetlerden ayrılması amacıyla IgG avidite testleri ya da akut ve konvelesan dönemde alınan serumlarda nötralizan antikor titre artışının PRNT ile saptanması yaklaşımları uygulanmaktadır. PRNT, IgM pozitif örneklerde de özgüllüğün konfirmasyonu amacıyla kullanılmaktadır (108,116). Sonuç olarak BNV de serolojik testlerin doğru olarak yorumlanabilmesi için, enfeksiyonun bölgesel epidemiyolojisi, kişinin önceden geçirdiği Flaviviral enfeksiyonlar ve aşılamalar, endemik bölgelere seyahat öyküsü gibi çeşitli faktörler test sonuçları ile birlikte değerlendirilmeli; tanı klinik bulgular ve doğrulama testleri ile desteklenmelidir (100). Amerika Birleşik Devletleri nde CDC ve Avrupa Birliği nde ECDC tarafından BNV enfeksiyonlarında kılavuz alınacak güncel tanı kriterleri, bölgesel epidemiyoloji ve diğer faktörler gözönüne alınarak duyurulmaktadır (117,118). Son zamanlarda saptanan ilginç bir diğer bulgu ise, BNV ile enfeksiyon geçirmiş kişilerin bazılarında ve hayvan deneylerinde viral RNA nın uzun süreli persistansının gösterilmesidir (119,120). 150
151 Yukarıda açıklanan yöntemlere ek olarak sinekler ve kanatlılarda tarama çalışmalarında kullanılmak üzere, viral antijenlerin saptandığı farklı yöntem ve duyarlılıklara sahip çeşitli ticari test sistemleri de bulunmaktadır (Vec- Test, RAMP ) ( ). Ayrıca enfekte doku örneklerinde in situ hibridizasyon, immünhistokimya, çeşitli yöntemlerle antijen ve viral RNA tespiti de uygulanabilmektedir (100). Kaynaklar 1. Heinz FX, Collett MS, Purcell RH et al. Family: Flaviviridae. In: Van Regenmortel MHV, Fauquet CM, Bishop DHL, Carstens EB, Estes MK, Lemon SM, et al., editors. Virus taxonomy: classification and nomenclature of viruses. 7th Report of the International Committee on Taxonomy of Viruses. San Diego: Academic Press; p Chambers, TJ, Hahn CS, Galler R, Rice CM. Flavivirus genome organization, expression, and replication. Annu Rev Microbiol 1990; 44: Campbell GL, Marfin AA, Lanciotti RS, Gubler DJ. West Nile virus. Lancet Infect Dis 2002; 2: Sanchez MD, Pierson TC, McAllister D et al. Characterization of neutralizing antibodies to West Nile virus. Virology 2005; 336: Mukhopadhyay S, Kuhn RJ, Rossmann MG A structural perspective of the flavivirus life cycle. Nat Rev Microbiol 2005; 3: Samuel MA, Diamond MS. Pathogenesis of West Nile Virus Infection: a balance between virulence, innate and adaptive immunity and viral evasion. J Virol 2006; 80: Egloff MP, Benarroch D, Selisko B et al. An RNA cap (nucleoside-2-o-)- methyltransferase in the flavivirus RNA polymerase NS5: crystal structure and functional characterization. EMBO J 2002; 21: Guo JT, Hayashi J, Seeger C. West Nile virus inhibits the signal transduction pathway of alpha interferon. J Virol 2005; 79: Liu WJ, Wang XJ, Mokhonov VV et al. Inhibition of interferon signaling by the New York 99 strain and Kunjin subtype of West Nile virus involves blockage of STAT1 and STAT2 activation by nonstructural proteins. J Virol 2005; 79: Davis CW, Nguyen HY, Hanna SL et al.west Nile virus discriminates between DC-SIGN and DC-SIGNR for cellular attachment and infection. J Virol 2006; 80:
152 11. Chu JJ, Ng ML. Interaction of West Nile virus with a v b 3 integrin mediates virus entry into cells. J Biol Chem 2004; 279: Chu JJ, Ng ML. Infectious entry of West Nile virus occurs through a clathrin-mediated endocytic pathway. J Virol 2004; 78: Gollins SW, Porterfield JS. The uncoating and infectivity of the flavivirus West Nile on interaction with cells: effects of ph and ammonium chloride. J Gen Virol 1986; 67(Pt. 9): Mackenzie JM, Westaway EG. Assembly and maturation of the flavivirus Kunjin virus appear to occur in the rough endoplasmic reticulum and along the secretory pathway, respectively. J Virol 2001; 75: Guirakhoo F, Heinz FX, Mandl CW et al. Fusion activity of flaviviruses: comparison of mature and immature (prm containing) tick-borne encephalitis virions. J Gen Virol 1991; 72(Pt. 6): Elshuber S, Allison SL, Heinz FX, Mandl CW. Cleavage of protein prm is necessary for infection of BHK-21 cells by tick-borne encephalitis virus. J Gen Virol 2003; 84: Shrestha B, Gottlieb D, Diamond MS. Infection and injury of neurons by West Nile encephalitis virus. J Virol 2003; 77: Parquet MC, Kumatori A, Hasebe F et al. West Nile virus-induced baxdependent apoptosis. FEBS Lett 2001; 500: Garcia-Tapia D, Loiacono CM, Kleiboeker SB. Replication of West Nile virus in equine peripheral blood mononuclear cells. Vet Immunol Immunopathol 2006; 110: Root JJ, Hall JS, McLean RG et al. Serologic evidence of exposure of wild mammals to flaviviruses in the central and eastern United States. Am J Trop Med Hyg 2005; 72: Byrne SN, Halliday GM, Johnston LJ, King NJ. Interleukin-1b but not tumor necrosis factor is involved in West Nile virus-induced Langerhans cell migration from the skin in C57BL/6 mice. J Investig Dermatol 2001; 117: Hunsperger EA, Roehrig JT. Temporal analyses of the neuropathogenesis of a West Nile virus infection in mice. J Neurovirol 2006; 12: Wang T, Town T, Alexopoulou L et al. Toll-like receptor 3 mediates West Nile virus entry into the brain causing lethal encephalitis. Nat Med 2004; 10: Ceccaldi PA, Lucas M, Despres P. New insights on the neuropathology of West Nile virus. FEMS Microbiol Lett 2004; 233:
153 25. Guarner J, Shieh WJ, Hunter S et al. Clinicopathologic study and laboratory diagnosis of 23 cases with West Nile virus encephalomyelitis. Hum Pathol 2004; 35: Kleinschmidt-DeMasters BK, Marder BA, Levi ME et al. Naturally acquired West Nile virus encephalomyelitis in transplant recipients: clinical, laboratory, diagnostic, and neuropathological features. Arch Neurol 2004; 61: Leis AA, Stokic DS. Neuromuscular manifestations of human West Nile virus infection. Curr Treat Options Neurol. 2005; 7: Lanciotti RS, Ebel GD, Deubel V et al. Complete genome sequences and phylogenetic analysis of West Nile virus strains isolated from the United States, Europe, and the Middle East. Virology 2002; 298: Charrel RN, Brault AC, Gallian P et al. Evolutionary relationship between Old World West Nile virus strains. Evidence for viral gene flow between Africa, the Middle East, and Europe. Virology 2003; 315: Burt FJ, Grobbelaar AA, Leman PA et al. Phylogenetic relationships of southern African West Nile virus isolates. Emerg Infect Dis 2002; 8: Bakonyi T, Ivanics E, Erdelyi K et al. Lineage 1 and 2 strains of encephalitic West Nile virus, Central Europe. Emerg Infect Dis. 2006; 12: Beasley DW, Li L, Suderman MT, Barrett AD. Mouse neuroinvasive phenotype of West Nile virus strains varies depending upon virus genotype. Virology 2002; 296: Venter M, Myers TG, Wilson MAet al. Gene expression in mice infected with West Nile virus strains of different neurovirulence. Virology 2005; 342: Botha MB, Markotter W, Wolsfaardt M et al. Genetic determinants of virulence in pathogenic lineage 2 West Nile virus strains. Emerg Infect Dis 2008; 14: Bondre VP, Jadi RS, Mishra AC et al. West Nile virus isolates from India: evidence for a distinct genetic lineage. J Gen Virol 2007; 88: Bakonyi T, Hubalek Z, Rudolf I, Nowotny N. Novel flavivirus or new lineage of West Nile virus, central Europe. Emerg Infect Dis 2005; 11: Vazquez A, Sanchez-Seco MP, Ruiz S et al. Putative New Lineage of West Nile Virus, Spain. Emerg Infect Dis 2010; 16: Davis C, Ebel G, Lanciotti R et al. Phylogenetic analysis of North American West Nile virus isolates, : evidence for the emergence of a dominant genotype. Virology 2005; 342:
154 39. Snapinn KW, Holmes EC, Young DS et al. Declining growth rate of West Nile virus in North America. J Virol 2007; 81: Shirato K, Miyoshi H, Goto A et al. Viral envelope protein glycosylation is a molecular determinant of the neuroinvasiveness of the New York strain of West Nile virus. J Gen Virol 2004; 85: Beasley DW, Whiteman MC, Zhang S et al. Envelope protein glycosylation status influences mouse neuroinvasion phenotype of genetic lineage 1 West Nile virus strains. J Virol 2005; 79: Keller BC, Fredericksen BL, Samuel MA et al. Resistance to alpha/beta interferon is a determinant of West Nile virus replication fitness and virulence. J Virol 2006; 80: Liu WJ, Wang XJ, Clark DC et al. A single amino acid substitution in the West Nile virus nonstructural protein NS2A disables its ability to inhibit alpha/beta interferon induction and attenuates virus virulence in mice. J Virol 2006; 80: Puig-Basagoiti F, Tilgner M, Bennett CJ et al. A mouse cell-adapted NS4B mutation attenuates West Nile virus RNA synthesis. Virology. 2007; 361: Stocks CE, Lobigs M. Signal peptidase cleavage at the flavivirus CprM junction: dependence on the viral NS2B 3 protease for efficient processing requires determinants in C, the signal peptide, and prm. J Virol 1998; 72: Jerzak G, Bernard KA, Kramer LD, Ebel GD. Genetic variation in West Nile virus from naturally infected mosquitoes and birds suggests quasispecies structure and strong purifying selection. J. Gen. Virol. 2005; 86: Glass WG, McDermott DH, Lim JK et al. CCR5 deficiency increases risk of symptomatic West Nile virus infection. J Exp Med 2006; 203: Hayes EB, Komar N, Nasci RS et al. Epidemiology and Transmission Dynamics of West Nile Virus Disease. Emerg Infect Dis 2005; 11: Turell MJ, Dohm DJ, Sardelis MR et al. An update on the potential of north American mosquitoes (Diptera: Culicidae) to transmit West Nile virus. J Med Entomol 2005; 42: Miller BM, Nasci RS, Godsey MS et al. First field evidence for natural vertical transmission of West Nile virus in Culex univittatus complex mosquitoes from Rift Valley Province, Kenya. Am J Trop Med Hyg 2000; 62:
155 51. Goddard LB, Roth AE, Reisen WK, Scott TW. Vertical transmission of West Nile Virus by three California Culex (Diptera: Culicidae) species. J Med Entomol 2003; 40: Lawrie CH, Uzcategui NY, Gould EA, Nuttall PA. Ixodid and argasid tick species and West Nile virus. Emerg Infect Dis 2004; 10: Komar N, Langevin S, Hinten S et al. Experimental infection of North American birds with the New York 1999 Strain of West Nile virus. Emerg Infect Dis 2003; 9: Rappole JH, Hubalek Z. Migratory birds and West Nile virus. J Appl Microbiol 2003; 94 Suppl: 47S-58S. 55. Malkinson M, Banet C, Weisman Y et al. Introduction of West Nile virus in the Middle East by migrating white storks. Emerg Inf Dis 2002; 8: Steele KE, Schoepp RJ, Komar N et al. Pathology of fatal West Nile virus infections in native and exotic birds during the 1999 outbreak in New York City, New York. Vet Pathol 200; 37: Hartemink NA, Davis SA, Reiter P et al. Importance of bird-to-bird transmission for the establishment of West Nile virus. Vector Borne Zoonotic Dis 2007; 7: Reiter P. West Nile virus in Europe: understanding the present to gauge the future. Euro Surveill 2010; 15(10): pii= Peterson AT, Vieglais DA, Andreasen JK. Migratory birds modeled as critical transport agents for West Nile virus in North America. Vector Borne Zoonotic Dis 2003; 3: Hayes CG. West Nile fever. In: Monath TP, editor. The arboviruses: epidemiology and ecology, vol. V. Boca Raton (FL): CRC Press; p Zeller H, Schuffenecker I. West Nile Virus: An Overview of Its Spread in Europe and the Mediterranean Basin in Contrast to Its Spread in the Americas. Eur J Clin Microbiol Infect Dis 2004; 23: Bunning ML, Bowen RA, Cropp CB et al. Experimental infection of horses with West Nile virus. Emerg Infect Dis 2002; 8: (Anonim). Update: investigations of West Nile virus infections among recipients of organ transplantation and blood transfusion. Morbid Mortal Wkly Rep 2002; 51: (Anonim). Possible West Nile virus transmission to an infant through breast feeding-michigan Morbid Mortal Wkly Rep 51:
156 65. (Anonim). Intrauterine West Nile infection New York, Morbid Mortal Wkly Rep 2002; 51: Hayes EB, O Leary DR. West Nile virus infection: a pediatric perspective. Pediatrics. 2004; 113: Centers for Disease Control and Prevention. Possible dialysis-related West Nile virus transmission-georgia, MMWR Morb Mortal Wkly Rep 2004; 53: Centers for Disease Control and Prevention. Laboratory-acquired West Nile virus infections-united States, MMWR Morb Mortal Wkly Rep 2002; 51: Ratterree MS, Gutierrez RA, Travassos da Rosa AP et al. Experimental infection of rhesus macaques with West Nile virus: level and duration of viremia and kinetics of the antibody response after infection. J Infect Dis 2004; 189: Austgen LE, Bowen RA, Bunning ML et al. Experimental infection of cats and dogs with West Nile virus. Emerg Infect Dis 2004; 10: Klenk K, Komar N. Poor replication of West Nile virus (New York 1999 strain) in three reptilian and one amphibian species. Am J Trop Med Hyg 2003; 69: Klenk K, Snow J, Morgan K et al. Alligators as west nile virus amplifiers. Emerg Infect Dis. 2004; 10: Miller DL, Mauel MJ, Baldwin C et al. West Nile virus in farmed alligators. Emerg Infect Dis 2003; 9: Nir Y, Beemer A, Goldwasser RA. West Nile virus infection in mice following exposure to a viral aerosol. Br J Exp Pathol 1965; 46: Lichtensteiger CA, Heinz-Taheny K, Osborne TS et al. West Nile virus encephalitis and myocarditis in wolf and dog. Emerg Infect Dis 2003; 9: McIntosh BM, Jupp PG, Dos Santos I, Meenehan GM. Epidemics of West Nile and Sindbis viruses in South Africa with Culex (Culex) univittatus Theobald as vector. S Afr J Sci 1976; 72: Smithburn KC, Hughes TP, Burke AW, Paul JH. A neurotropic virus isolated from the blood of a native of Uganda. Am J Trop Med Hyg. 1940; 20: Calistri P, Giovannini A, Hubalek Z et al. Epidemiology of West Nile in Europe and in the Mediterranean Basin. Open Virol J 2010; 4:
157 79. Dauphin G, Zientara S, Zeller H, Murgue B. West Nile: worldwide current situation in animals and humans. Comp Immunol Mircobiol Infect Dis 2004; 27: Krisztalovics K, Ferenczi E, Molnar Z, Csohan A, Ban E, Zoldi V, et al. West Nile virus infections in Hungary, August- September Euro Surveill 2008; 13:pii= Barzon L, Squarzon L, Cattai M, Franchin E, Pagni S, Cusinato R, et al. West Nile virus infection in Veneto region, Italy, Euro Surveill 2009; 14:pii= Rizzo C, Vescio F, Declich S et al. West Nile virus transmission with human cases in Italy, August-September Euro Surveill 2009; 14:pii= Papa A, Danis K, Baka A et al. Ongoing outbreak of West Nile virus infections in humans in Greece, July-August Euro Surveill 2010; 15:pii= Lanciotti RS, Roehrig JT, Deubel V et al. Origin of the West Nile virus responsible for an outbreak of encephalitis in the northeastern United States. Science 1999; 286: Hayes CG. West Nile virus: Uganda, 1937, to New York City, Ann N Y Acad Sci 2001; 951: Radda A. Antibodies against group A and B Arboviruses in domestic animals from Turkey. EU Tıp Fak Mec 1971; 10: Ari A. Studies on activity and and ecology of arboviruses in Turkey. Turk Hij Tecr Biyol Derg 1972; 32: Meço O. West Nile arbovirus antibodies with hemagglutination inhibition (HI) in residents of Southeast Anatolia. Mikrobiyol Bul 1977; 11: Allwinn R, Doerr HW, Emmerich P et al. Cross-reactivity in flavivirus serology: new implications of an old finding? Med Microbiol Immunol 2002; 190: Serter D. Present status of arbovirus sero-epidemiology in the Aegean region of Turkey. Zbl Bakt; 1980(S9): Özkul A, Yıldırım Y, Pınar D et al. Serological evidence of West Nile Virus (WNV) in mammalian species in Turkey. Epidemiol Infect 2005; 29: Ergunay K, Ozer N, Us D et al. Seroprevalence of West Nile Virus and Tick-Borne Encephalitis Virus in Southeastern Turkey: First Evidence for Tick-Borne Encephalitis Virus Infections. Vector Borne Zoonotic Dis 2007; 7:
158 93. Ergunay K, Saygan MB, Aydogan S et al. West Nile Virus seroprevalence in blood donors from Central Anatolia, Turkey. Vector Borne Zoonotic Dis 2009; (DOI: doi: /vbz ) 94. Arpacı F, Çetin T, Kubar A ve ark. West Nile Virus infection in a patient with acute graft-versus-host disease. Haematologica 2009; 94(S2): Ergünay K, Aydoğan S, Menemenlioğlu D ve ark. Ankara Bölgesinde Nedeni Bilinmeyen Merkezi Sinir Sistemi Enfeksiyonlarında Batı Nil Virusunun Araştırılması. Mikrobiyol Bul 2010; 44: Ramsdale CD, Alten B, Çağlar SS et al. A revised, annotated checklist of the mosquitoes (Diptera, Culicidae) of Turkey. European Mosquito Bull 2001; 9: Ozer N, Ergunay K, Simsek F et al. West Nile virus studies in the Sanliurfa Province of Turkey. J Vector Ecol 2007; 32: Albayrak, H, Ozan, E. Molecular Detection of Avian Influenza Virus but not West Nile Virus in Wild Birds in Northern Turkey. Zoonoses Public Health (DOI: /j x). 99. Albayrak, H, Ozan, E, Kurt, M. Molecular Detection of Crimean-Congo Hemorrhagic Fever Virus (CCHFV) but not West Nile Virus (WNV) in Hard Ticks from Provinces in Northern Turkey. Zoonoses Public Health (DOI: /j x) Hayes EB, Sejvar JJ, Zaki SR et al. Virology, pathology and clinical manifestations of West Nile virus disease. Emerg Infect Dis 2005; 11: Kauffman EB, Jones SA, Dupuis AP et al. Virus detection protocols for West Nile virus in vertebrate and mosquito specimens. J Clin Microbiol 2003; 41: Shi PY, Kramer LD. Molecular detection of West Nile virus RNA. Expert Rev Mol Diagn 2003; 3: Lanciotti RS, Kerst AJ, Nasci RS et al. Rapid detection of west nile virus from human clinical specimens, field-collected mosquitoes, and avian samples by a TaqMan reverse transcriptase-pcr assay. J Clin Microbiol 2000; 38: Shi PY, Kauffman EB, Ren P et al. High-throughput detection of West Nile virus RNA. J Clin Microbiol 2001; 39: Busch MP, Kleinman SH, Tobler LH et al. Virus and antibody dynamics in acute west Nile virus infection. J Infect Dis 2008; 198:
159 106. Niedrig M, Linke S, Zeller H, Drosten C. First international proficiency study on West Nile virus molecular detection. Clin Chem 2006; 52: Papin JF, Vahrson W, Dittmer DP. SYBR green-based real-time quantitative PCR assay for detection of West Nile Virus circumvents false-negative results due to strain variability. J Clin Microbiol 2004; 42: Shi PY, Wong SJ. Serologic diagnosis of West Nile virus infection. Expert Rev Mol Diagn 2003; 3: Niedrig M, Sonnenberg K, Steinhagen K, Paweska JT. Comparison of ELISA and immunoassays for measurement of IgG and IgM antibody to West Nile virus in humans against virus neutralization. J Virol Methods 2007; 139: Wong SJ, Demarest VL, Boyle RH et al. Detection of human anti-flavivirus antibodies with a West Nile virus recombinant antigen microsphere immunoassay. J Clin Microbiol 2004; 42: Tardei G, Ruta S, Chitu V et al. Evaluation of immunoglobulin M (IgM) and IgG enzyme immunoassays in serological diagnosis of West Nile infection. J Clin Microbiol 2000; 38: Prince HE, Tobler LH, Lape-Nixon M et al. Development and persistence of West Nile virus-specific immunoglobulin M (IgM), IgA, and IgG in viremic blood donors. J Clin Microbiol 2005; 43: Niedrig M, Donoso-Mantke O, Altmann D, Zeller H. First international diagnostic accuracy study for the serological detection of West Nile virus infection. BMC Infect Dis 2007; 7: Prince HE, Tobler LH, Yeh C et al. Persistence of West Nile virusspecific antibodies in viremic blood donors. Clin Vaccine Immunol 2007; 14: Kapoor H, Signs K, Somsel P et al. Persistance of West Nile Virus (WNV) IgM antibodies in cerebrospinal fluid from patients with CNS disease. J Clin Virol 2004; 31: Fox JL, Hazell SL, Tobler LH, Busch MP. Immunoglobulin G avidity in differentiation between early and late antibody responses to West Nile virus. Clin Vaccine Immunol 2006; 13: Murray K, Walker C, Herrington E et al. Persistent infection with West Nile virus years after initial infection. J Infect Dis 2010; 201: Appler KK, Brown AN, Steward BS et al. Persistence of West Nile virus in the central nervous system and periphery of mice. PLoS One 5(5): 159
160 e10649.doi: / journal.pone Nasci RS, Gottfried KL, Burkhalter K et al. Comparison of vero cell plaque assay, TaqMan reverse transcriptase polymerase chain reaction RNA assay, and VecTest antigen assay for detection of West Nile virus in field-collected mosquitoes. J Am Mosq Control Assoc 2002; 18: Burkhalter KL, Lindsay R, Anderson R et al. Evaluation of commercial assays for detecting West Nile virus antigen. J Am Mosq Control Assoc 2006; 22: Williges E, Farajollahi A, Nelder MP, Gaugler R. Comparative field analyses of rapid analyte measurement platform and reverse transcriptase polymerase chain reaction assays for West Nile virus surveillance. J Vector Ecol 2009; 34:
161 Batı Nil virüs enfeksiyonununda Klinik ve Tedavi Doç. Dr Selma Tosun Manisa Devlet Hastanesi Klinik Mikrobiyoloji ve Enfeksiyon Hastalıkları Batı Nil Virüsü (BNV) insanlar, atlar, kuşlar ve vahşi hayvanlarda çeşitli nörolojik semptomlara neden olan ve artropotlarla bulaşan bir virüstür. Birçok ülkede insan, köpek, at, kuş gibi çeşitli hayvanlarda hafif ateşli hastalıklardan menenjit, ensefalit veya ölüme kadar uzanan farklı klinik tablolara yol açmaktadır. Son yıllarda özellikle Amerika Birleşik Devletleri, Asya, Afrika, Orta-Doğu, Balkanlar, Doğu ve Güney-Avrupa da insanlar, atlar, köpekler ve kanatlı hayvanlarda ölümlerle sonuçlanan BNV enfeksiyonlarına rastlanmaktadır. Yapılan çalışmalar özellikle kuru ve sıcak yaz mevsiminde insanlarda ve atlarda BNV enfeksiyonunun arttığını doğrulamaktadır (3,4,19). Klinik belirti ve bulgular İnkübasyon periyodu 2-15 gün arasında olup genel olarak 1-6 gündür. İnkübasyon özellikle immünsüpresiflerde uzun olabilir. Batı Nil Virusu enfeksiyonu bir çok olguda hafif şiddette seyreder. Sivrisinek ısırıkları ile enfekte olan bir çok kişide hastalık asemptomatik seyirli olur, klinik hastalık görülmez. Bulgular tipik olarak 3-7 gün süren grip benzeri tablo, bel ve baş ağrısı, kas ağrısı, ateş, titreme, halsizlik, lenfadenopati ve göz ağrısı (retroorbital ağrı) şeklinde kendini gösterir. Bazı hastalarda farenjit, bulantı, kusma, karın ağrısı, ishal görülebilir. Daha şiddetli olgularda başağrısı ile birlikte görülen yüksek ateş, vücut kaslarında zayıflık, boyunu dik tutamama, uyuşukluk, zihinsel karışıklık, koma, kas titremeleri, konvülziyonlar ve paralizi gelişebilir. Başağrısı BNV için çoğu zaman önde gelen bulgu olabilir. BNV menenjiti genellikle ateş, başağrısı ve ense sertliğine yol açar.bilinç değişikliği fazla görülmez, olduğunda da ılımlıdır; bazen letarjiyle, nadiren de konfüzyon veya komayla sonuçlanabilir. SSS tutulumu olduğunda başağrısından aseptik menenjit ve ensefalite kadar değişen klinik tablolar görülebilir ve genellikle diğer benzeri viral sendromlardan ayırt edilemez. Kişilerin %60-75 inde mental durum değişikliği veya fokal nörolojik bulgularla karakterize olan ensefalit veya meningoensefalit bildirilmektedir. Nöroinvaziv BNV olgularının %25-35 inde ensefalit bulgusu olmaksızın menenjit görülmektedir. Kol ve bacak paralizisi gibi fokal nörolojik defisitler, 161
162 optik nörit, ataksi ve ekstrapiramidal belirtiler, konvülsiyon, poliradikülit, myelit, bazen flask paraliziler, mental durum değişikliği, kranial sinir felçleri görülebilir. Ayrıca tremor ve hareket bozuklukları da bildirilmiştir. BNV ye bağlı myelit tablosu, BNV ye eşlik eden flask paralizi sendromu olarak gözlenebilir ama menenjit ya da ensefalitten daha az sıklıktadır. Bu sendrom genellikle akut gelişir, duyu kaybı olmaksızın asimetrik şekilde kol ve bacaklarda güçsüzlük veya paralizi ile seyreder. Ağrı bazen paraliziden önce gelir. Ateş, başağrısı veya diğer semptomlar olmaksızın da paralizi görülebilir. Bazen, solunum kaslarının tutulması sonucu akut solunum yetmezliği görülebilir. Az sayıda hastada ense, gövde, kollar veya bacaklarda görülen makülopapüler veya morbiliform döküntüler olabilir. Döküntüler bir hafta kadar devam eder ve kaşıntısızdır Ayrıca düşük oranda da olsa myokardit, pankreatit ve fulminan hepatit olabildiği bildirilmiştir (3,4,7,11,16,19,22) yılında ABD de yapılan bir çalışmada, 19 BNV enfeksiyonu olgusunda ateş %90, başağrısı %58, boyunu dik tutamama %21, durumda değişiklik %58, kaslarda zayıflık %42, serebellar anomaliler ise %11 oranında saptanmıştır (20). İsrail de 2000 yılında saptanan 417 BNV olgusunda, hastaneye yatırılan 233 olguda yüksek ateş %98.3, başağrısı %57.9, koma durumu %16.7, gastro-intestinal semptomlar %18.5, nörolojik semptomlar %9.4 oranında saptanmış; hastalardaki mortalite oranının %14.1 olduğu ve ölen hastaların %87.9 unun 70 ve üzeri yaş grubunda olduğu bildirilmiştir (9). Genel olarak yaz sonu-sonbahar başı dönemde açıklanamayan ensefalit veya menenjit olguları görülen 50 yaş üzeri erişkin olgular varsa BNV ve diğer arbovirüs enfeksiyonlarından şüphelenilebilir. Mortalite oranı %3-15 arasında değişmektedir. Yüksek mortalite genellikle yaşlı insanlarda (50 yaş ve üzeri) görülmektedir (7,16,19,22). Tedavi Batı Nil virüsü enfeksiyonunun bilinen bir tedavisi yoktur. Bu nedenle enfeksiyonun tedavisi öncelikle destek tedavisi şeklinde olmalıdır. Şiddetli olgularda sıklıkla hastaneye yatmayı gerektiren destek tedavi, IV sıvı verilmesi, solunum desteği ve sekonder enfeksiyon gelişmesinin önlenmesi temel yapılacak uygulamalardır (6,8,12,18,21). 162
163 Batı Nil Virusu ensefaliti olan hastalar hastaneye yatırılmalı ve tedavi edilebilir santral sistemi lezyonları ortadan kaldırılmalıdır. Olgular, Nörolog, Enfeksiyon Hastalıkları hekimi, Yoğun bakım hekimi ve gerektiğinde Psikiatrist ile birlikte izlenmelidir. Hastaneye yatırılan hastalarda öneriler Sıvı-elektrolit dengesinin sağlanması için IV sıvı Solunum yetersizliğinde ventilatör desteği Serebral ödem takibi Konvülsiyonlar açısından takip ve gerekirse tedavi Duyu kaybı ile birlikte olan ve olmayan motor paralizi açısından değerlendirme yapılması şeklindedir. Analjezikler ve antipiretikler hastalığın ılımlı seyrettiği durumlarda yararlı olabilir. BNV ensefalitinde en sık ölüm nedeni nöron ölümü ve dejenerasyonu sonucu beyin ödemi oluşmasıdır. Steroid ve osmotik solüsyonlar bazı olgularda beyin ödemini azalttığı için beyin ödemi ve herniasyona karşı kısa süreli kullanımları önerilmektedir. BNV tedavisinde bilinen etkin bir antiviral yoktur. Bununla birlikte interferon alfa 2b ve ribavirinle değişik çalışmalar yapılmıştır. İnsan interferonu (alfa 2b) ile ribavirinin BNV deki etkisinin araştırıldığı bir çalışmada vero cell doku kültürüne ribavirin veya interferon alfa-2b eklenmiş, bu uygulamadan saat önce ve sonra ortama Culex pipiens eklenmiş, sonuçta interferon alfa-2b koruyucu ve tedavi edici bulunmuştur. Bu çalışmada ribavirin in vitro olarak koruyucu bulunmuş ama tedavi edici etkisinin olmadığı bildirilmiştir. Sonuç olarak bu çalışmada IFN alfa 2b, ribavirine göre daha etkin bulunmuş, kombine kullanım için ise HCV tedavisinde olduğu gibi ileri çalışmalara gerek olduğu vurgulanmıştır (1). Odelola ve ark. virüs inokülasyonundan sonra intraperitoneal olarak 1.5 mg. ribavirin uygulanması sonucu BNV ile enfekte farede sağ kalma oranının %83, kontrol grubunda ise %25 olduğunu bildirmişlerdir (15). Daha yakın tarihli bir çalışmada Jordan ve ark. invitro olarak insan oligodendroglial hücrelerindeki enfeksiyonun yüksek doz ribavirinle (200 mg) inhibe olduğunu bildirmişlerdir (10). 163
164 Bir başka çalışmada da farelerde spinal kord dokularının BNV inoküle edilmeden önce alfa ve beta interferonla korunduğunu bildirmişlerdir (17). Rusya da yapılan bir başka fare deneyinde ribavirinle hayvanların %85 inde sağ kalım sağlandığı bildirilmiştir (14). BNV tedavisinde interferon alfa 2b nin başarılı olduğunu bildiren az sayıda çalışmanın yanı sıra başarısız olduğunu bildiren ve yine az sayıda olgu içeren çalışmalar bulunmaktadır (5,13). Farklı bir çalışmada BNV enfeksiyonunun endemik olduğu İsrail de donörlerden elde edilen BNV immun globulini ile yapılan fare deneylerinde oldukça başarılı sonuçlar bildirilmiştir (2). Sonuç olarak BNV olgularının tedavisinde temel amaç destek tedavi olup halen bilinen etkili ve spesifik bir tedavi bulunmamaktadır. KAYNAKLAR 1) Anderson JF, Rahal JJ. Efficacy of interferon alpha-2b and ribavirin against West Nile virus in vitro. Emerg Infect Dis Jan;8(1): ) Ben-Nathan D, Gershoni-Yahalom O, Samina I, et al. Using high titer West Nile intravenous immunoglobulin from selected Israeli donors for treatment of West Nile virus infection. BMC Infect Dis Feb 17;9:18. 3) Centers for Disease Control and Prevention Guidelines for surveillance, prevention, and control of West Nile Virus infection United States. MMWR Morb Mortal Wkly Rep 2000;49: ) Centers for Disease Control and Prevention. Epidemic/Epizootic West Nile Virus in the United States: Revised Guidelines for Surveillance,Prevention, and Control, 2003, 5)Chan-Tack KM, Forrest G. Failure of interferon alpha-2b in a patient with West Nile virus meningoencephalitis and acute flaccid paralysis. Scand J Infect Dis. 2005;37(11-12): ) Chowers YM, Lang R, David BD. Clinical characteristics of the West Nile Fever outbreak, Israel, Emerg Infect Dis 2001; 7: ) Erdem H, Pahsa A. Yeni bir pandemi mi? Batı Nil virüs enfeksiyonu. İnfeksiyon Dergisi 2003;17(2): ) Huhn DG, Montgomery PS, Dworkin SM. West Nile in the United States: An update on an emerging infectious disease. Am Family Physician 2003; 164
165 68: ) Giladi M, Cotter ME, Martin AD, et al. West Nile encephalitis in Israel 1999: The New York connection. Emerg Infect Dis 2001; 7: )Jordan I, Briese T, Fischer N, Lau JYN, Lipkin WI Ribavirin inhibits West Nile virus replication and cytopathic effect in neural cells. J Infect Dis 2000;182: doi: / )Kılıç A, Doğancı L. Batı Nil Virus. Türk Mikrobiyol Cem Derg 2003; 33: ???? 12)Leysson P, De Clercq E, Neyts J. Perspectives for the treatment of infections with flaviviridae. Clin Microbiol Rev 2000; 13: )Lewis M, Amsden JR. Successful treatment of West Nile virus infection after approximately 3 weeks into the disease course. Pharmacotherapy Mar;27(3): )Loginova SIa, Borisevich SV, Pashchenko IuA, Bondarev VP. Ribavirin prophylaxis and therapy of experimental West Nile fever. Antibiot Khimioter. 2009;54(11-12): ) Odelola HA Antiviral activity of Virazole on replication of viruses isolated in Nigeria. In: Siegenthaler W, Luthy R, editors. Current chemotherapy (Proc 10th International Congress of Chemotherapy, Zurich). Vol. 1. Washington: American Society of Microbiology; 1978;1: ) Sampathkumar P. West Nile Virus: Epidemiology, clinical presentation, diagnosis and prevention. Mayo Clin Proc 2003; 78: ) Shahar A, Lustig S, Akov Y, Schneider P, Levin R Different pathogenicity of encephalitic togaviruses in organotypic cultures of spinal cord slices. J Neurosci Res 1990;25: doi: /jnr )Shimoni Z, Niven J, Pitlick S, Bulvik S. Treatment of West Nile Virus encephalitis with intravein immunoglobulin (Letters). Emerg Infect Dis 2001; 7: ) Serter D. Arbovirüs Enfeksiyonları. Turkiye Klinikleri J Int Med Sci 2006, 2(28): ) Weiss D, Carr D, Kellachan J, et al. Clinical findings of West Nile Virus infection in hospitalized patients, New York and New Jersey Emerg Infect.Dis 2001; 7: ) West Nile Virus: Treatment Information and Guidance for Clinicians 22)Yazıcı Z. Batı Nil Virusu infeksiyonu. İnfeksiyon Dergisi (Turkish Journal of Infection) 2005; 19 (1):
166 BATI NİL VİRUSU ENFEKSİYONUNDA (WEST NİLE VİRUS) KORUNMA VE KONTROL Dr.Vet.Hek. Arife ERTÜRK Etlik Merkez Veteriner Kontrol ve Araştırma Enstitüsü Viroloji Teşhis Lab. Şefi Batı Nil Virusu (BNV); insanlar, atlar, kuşlar ve vahşi hayvanlarda çeşitli nörolojik semptomlara neden olan ve vektörlerle (artropotlarla) bulaşan Flaviviridae ailesine mensup zoonoz bir arbovirusdur. Afrika, Asya ve Güney Avrupa da uzun süredir bilinen, hastalık son yıllarda Kuzey Amerika ve Avrupa nın ılıman bölgelerinde, insanlarda ve tek tırnaklılarda artan ensefalit vakası ile seyreden salgınlara sebep olmaktadır. Virus ilk defa 1937 yılında Uganda nın Batı Nil bölgesinde ateşli hastalık geçiren bir kadından izole edilmiştir. Kısa bir süre sonra da Afrika, Orta Doğu ve Güney Avrupa da insanlar, kuşlar ve sivrisineklerde yaygın olan Flaviviruslar arasına girmiştir. Bu bölgelerde Batı Nil Virusu enfeksiyonu genellikle hafif ve subklinik seyirli olarak görülmüşse de, 1990 ların başından itibaren enfeksiyonun insanlardaki sıklığı ve ciddiyeti artmıştır. Enfeksiyon daha önceleri etkilenmemiş bölgelerde de görülmeye başlamıştır. Buna en çarpıcı örnek olarak virusun 1999 yılında Amerika Birleşik Devletleri New York şehrinde görülmesi ve bunu takip eden 3 yıl içerisinde Kuzey Amerika da ki hayvanlar ve insanlarda yayılması verilebilir (CDC Guidelines for Surveillance, Prevention, and Control, 2003). BNV un dünyadaki dağılımı haritada gösterilmiştir. 166
167 Harita 1: BNV un dünyadaki dağılımı Göçmen kuşlar virus yayılımında, hastalığın endemik olduğu bölgelerden sporadik salgınların çıktığı bölgelere virusu taşımaları da dahil olmak üzere birincil rolü üstlenirler (Burke ve Monath 2001). BNV sivrisinek-kuşsivrisinek taşınma döngüsünde varlığını sürdürürken insan ve atlar son konakçı (dead end) olarak değerlendirilirler. Virus, doğal vektör olarak sivrisinek, kene gibi arthropotlar ile kanatlı hayvanları kullanır. Genel olarak Cu/ex, Aedes cinsi sivrisineklerle yabani ve evcil kuşlar arasındaki sirkulasyon infeksiyonu yaymaktadır. Argus ve Hyolomma cinsi keneler de virus ile enfekte olmaktadır (Diamond,2003). Enfeksiyon spektrumunda insanlar başta olmak üzere özellikle atlar, köpekler, vahşi ve evcil kanatlı hayvanlar, koyunlar, develer ile deney hayvanları yer almaktadır. Batı Nil Virusu enfeksiyonunda yayılma, artropot-enfekte kuşlar-artropot siklusu şeklindedir. İnsanlara bulaşma, özellikle enfekte Culex cinsi sivrisineklerin ısırması yolu ile olur (McMinn, 1997). Keneler kanlarında yoğun virus olan enfekte kuşlardan beslendikleri zaman enfekte hale gelirler. Enfekte sinek ve keneler konakçıdan beslenirken, BNV un yayılmasında önemli rol oynayabilir (McMinn, 1997). Batı Nil virusu kuş popülasyonu ile uyum halinde yaşayan bir virustur. Kuş 167
TULAREMİ: Etken ve Epidemiyoloji. Doç.Dr. Aynur Karadenizli Kocaeli Üniversitesi Mikrobiyoloji AD
 TULAREMİ: Etken ve Epidemiyoloji Doç.Dr. Aynur Karadenizli Kocaeli Üniversitesi Mikrobiyoloji AD Francisella tularensis Tarihçe Tavşan hastalığı (Yato Byo, 1818) Lemming ateşi (Norveç, 1890) Tularemi hastalığı
TULAREMİ: Etken ve Epidemiyoloji Doç.Dr. Aynur Karadenizli Kocaeli Üniversitesi Mikrobiyoloji AD Francisella tularensis Tarihçe Tavşan hastalığı (Yato Byo, 1818) Lemming ateşi (Norveç, 1890) Tularemi hastalığı
TULAREMİ. Doç.Dr. Aynur KARADENİZLİ. Kocaeli Üniversitesi Tıp Fakültesi Mikrobiyoloji ve Klinik Mikrobiyoloji Anabilim Dalı
 55 TULAREMİ Doç.Dr. Aynur KARADENİZLİ Kocaeli Üniversitesi Tıp Fakültesi Mikrobiyoloji ve Klinik Mikrobiyoloji Anabilim Dalı Tularemi hastalığı bakteriyel bir zoonoz olup, küçük, gram negatif bir kokobasil
55 TULAREMİ Doç.Dr. Aynur KARADENİZLİ Kocaeli Üniversitesi Tıp Fakültesi Mikrobiyoloji ve Klinik Mikrobiyoloji Anabilim Dalı Tularemi hastalığı bakteriyel bir zoonoz olup, küçük, gram negatif bir kokobasil
Tularemi: Tanı yöntemleri. Doç.Dr. Aynur Karadenizli Kocaeli Üniversitesi Tıbbi Mikrobiyoloji AD
 Tularemi: Tanı yöntemleri Doç.Dr. Aynur Karadenizli Kocaeli Üniversitesi Tıbbi Mikrobiyoloji AD Dünyada Tularemi Francisella tularensis: Taksonomi Bacterium tularensis Tulare kasabası, Kaliforniya, Dr.
Tularemi: Tanı yöntemleri Doç.Dr. Aynur Karadenizli Kocaeli Üniversitesi Tıbbi Mikrobiyoloji AD Dünyada Tularemi Francisella tularensis: Taksonomi Bacterium tularensis Tulare kasabası, Kaliforniya, Dr.
Laboratuvarda Tularemi Örnekleriyle Çalışma Rehberi
 Laboratuvarda Tularemi Örnekleriyle Çalışma Rehberi Doç.Dr. Aynur Karadenizli Kocaeli Üniversitesi Tıp Fakültesi Mikrobiyoloji ve Klinik Mikrobiyoloji AD, Kocaeli Bakteri ile çalışmaya uygun laboratuar
Laboratuvarda Tularemi Örnekleriyle Çalışma Rehberi Doç.Dr. Aynur Karadenizli Kocaeli Üniversitesi Tıp Fakültesi Mikrobiyoloji ve Klinik Mikrobiyoloji AD, Kocaeli Bakteri ile çalışmaya uygun laboratuar
Tulareminin Laboratuvar Tanı Yöntemleri. Dr. Fetiye Kolaylı KOÜ Tıp Fakültesi Tıbbi Mikrobiyoloji AD
 Tulareminin Laboratuvar Tanı Yöntemleri Dr. Fetiye Kolaylı KOÜ Tıp Fakültesi Tıbbi Mikrobiyoloji AD F. tularensis in tanımlanmasında Direk mikroskopik inceleme Seroloji Bakterinin izolasyonu Moleküler
Tulareminin Laboratuvar Tanı Yöntemleri Dr. Fetiye Kolaylı KOÜ Tıp Fakültesi Tıbbi Mikrobiyoloji AD F. tularensis in tanımlanmasında Direk mikroskopik inceleme Seroloji Bakterinin izolasyonu Moleküler
MOLEKÜLER TANI VE TİPLENDİRME YÖNTEMLERİ
 MOLEKÜLER TANI VE TİPLENDİRME YÖNTEMLERİ Doç.Dr. Aynur KARADENİZLİ Kocaeli Üniversitesi Tıp Fakültesi, Mikrobiyoloji ve Klinik Mikrobiyoloji AD, Kocaeli Francisella tularensis Küçük, aerobik, pleomorfik,
MOLEKÜLER TANI VE TİPLENDİRME YÖNTEMLERİ Doç.Dr. Aynur KARADENİZLİ Kocaeli Üniversitesi Tıp Fakültesi, Mikrobiyoloji ve Klinik Mikrobiyoloji AD, Kocaeli Francisella tularensis Küçük, aerobik, pleomorfik,
BRUSELLOZUN İNSANLARDA ÖNLENMESİ VE KONTROLÜ
 BRUSELLOZUN İNSANLARDA ÖNLENMESİ VE KONTROLÜ Prof. Dr. Fatma Ulutan Gazi Üniversitesi Tıp T p Fakültesi Klinik Mikrobiyoloji ve Enfeksiyon Hastalıklar kları Anabilim Dalı BRUSELLOZ KONTROLÜ VE ERADİKASYONU
BRUSELLOZUN İNSANLARDA ÖNLENMESİ VE KONTROLÜ Prof. Dr. Fatma Ulutan Gazi Üniversitesi Tıp T p Fakültesi Klinik Mikrobiyoloji ve Enfeksiyon Hastalıklar kları Anabilim Dalı BRUSELLOZ KONTROLÜ VE ERADİKASYONU
Sağlık Hizmetlerinde Maliyet
 Sağlık Hizmetlerinde Maliyet Sağlık İşletmelerinde Maliyet Sağlık işletmelerinde maliyetleri oluşturan faktörlerin bilinmesi ve bütçedeki yeri Artan maliyetlerin kontrol altına alınması Üretimin/kaynakların
Sağlık Hizmetlerinde Maliyet Sağlık İşletmelerinde Maliyet Sağlık işletmelerinde maliyetleri oluşturan faktörlerin bilinmesi ve bütçedeki yeri Artan maliyetlerin kontrol altına alınması Üretimin/kaynakların
Davet. Doç. Dr. Şaban GÜRCAN Simpozyum Başkanı
 Davet Değerli Meslektaşlarımız, Tularemi son yıllarda Türkiye de yeniden önem kazanan ve bildirimi artan hastalıklardan biri olarak dikkati çekmektedir. Sağlık Bakanlığı nın bu hastalığı bildirimi zorunlu
Davet Değerli Meslektaşlarımız, Tularemi son yıllarda Türkiye de yeniden önem kazanan ve bildirimi artan hastalıklardan biri olarak dikkati çekmektedir. Sağlık Bakanlığı nın bu hastalığı bildirimi zorunlu
VİRUS HASTALIKLARINDA TANI YÖNTEMLERİ
 VİRUS HASTALIKLARINDA TANI YÖNTEMLERİ Doç. Dr. Koray Ergünay MD PhD Hacettepe Üniversitesi Tıp Fakültesi Mikrobiyoloji ve Klinik Mikrobiyoloji Anabilim Dalı, Viroloji Ünitesi Viral Enfeksiyonlar... Klinik
VİRUS HASTALIKLARINDA TANI YÖNTEMLERİ Doç. Dr. Koray Ergünay MD PhD Hacettepe Üniversitesi Tıp Fakültesi Mikrobiyoloji ve Klinik Mikrobiyoloji Anabilim Dalı, Viroloji Ünitesi Viral Enfeksiyonlar... Klinik
TEK SAĞLIK YAKLAŞIMIYLA ZOONOTİK HASTALIKLARA BAKIŞ (SAĞLIK BAKANLIĞI PERSPEKTİFİ)
 TEK SAĞLIK YAKLAŞIMIYLA ZOONOTİK HASTALIKLARA BAKIŞ (SAĞLIK BAKANLIĞI PERSPEKTİFİ) Dr. Ebru AYDIN Zoonotik ve Vektörel Hastalıklar Daire Başkanı 1 SAĞLIK BAKANLIĞINDA ZOONOTİK HASTALIKLAR İLE İLGİLİ YAPILANMA
TEK SAĞLIK YAKLAŞIMIYLA ZOONOTİK HASTALIKLARA BAKIŞ (SAĞLIK BAKANLIĞI PERSPEKTİFİ) Dr. Ebru AYDIN Zoonotik ve Vektörel Hastalıklar Daire Başkanı 1 SAĞLIK BAKANLIĞINDA ZOONOTİK HASTALIKLAR İLE İLGİLİ YAPILANMA
Maymun Çiçek Virüsü (Monkeypox) VEYSEL TAHİROĞLU
 Maymun Çiçek Virüsü (Monkeypox) VEYSEL TAHİROĞLU insanlarda ölümcül hastalığa neden olabilir; her ne kadar genellikle çok daha az ciddi olsa da insan çiçek virüsü hastalığına benzer. Maymun çiçek virüsü
Maymun Çiçek Virüsü (Monkeypox) VEYSEL TAHİROĞLU insanlarda ölümcül hastalığa neden olabilir; her ne kadar genellikle çok daha az ciddi olsa da insan çiçek virüsü hastalığına benzer. Maymun çiçek virüsü
TEK SAĞLIK TÜRK VETERİNER HEKİMLERİ BİRLİĞİ. Prof.Dr. Ender YARSAN. Halk Sağlığı Uygulamalarında Veteriner Hekimliği Hizmetlerinin Rolü Sempozyum
 TEK SAĞLIK TÜRK VETERİNER HEKİMLERİ BİRLİĞİ Halk Sağlığı Uygulamalarında Veteriner Hekimliği Hizmetlerinin Rolü Sempozyum Prof.Dr. Ender YARSAN Türk Veteriner Hekimleri Birliği Merkez Konseyi II. Başkanı
TEK SAĞLIK TÜRK VETERİNER HEKİMLERİ BİRLİĞİ Halk Sağlığı Uygulamalarında Veteriner Hekimliği Hizmetlerinin Rolü Sempozyum Prof.Dr. Ender YARSAN Türk Veteriner Hekimleri Birliği Merkez Konseyi II. Başkanı
TULAREMİ OLGU SORGULAMA FORMU. Dr. Güven ÇELEBİ Zonguldak Karaelmas Üniversitesi Tıp Fakültesi Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji AD
 TULAREMİ OLGU SORGULAMA FORMU Dr. Güven ÇELEBİ Zonguldak Karaelmas Üniversitesi Tıp Fakültesi Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji AD TULAREMİ OLGU SORGULAMA FORMU Genel Bilgiler: Tularemi olgu
TULAREMİ OLGU SORGULAMA FORMU Dr. Güven ÇELEBİ Zonguldak Karaelmas Üniversitesi Tıp Fakültesi Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji AD TULAREMİ OLGU SORGULAMA FORMU Genel Bilgiler: Tularemi olgu
Francisella tularensis
 Francisella tularensis BAKTERİYOLOJİK ÖZELLİKLERİ ve TANI YÖNTEMLERİ Prof. Dr. Suna Gedikoğlu Uludağ Üniversitesi Tıp Fakültesi Mikrobiyoloji ve Enfeksiyon Hastalıkları AD TULAREMİ F tularensis in oluşturduğu
Francisella tularensis BAKTERİYOLOJİK ÖZELLİKLERİ ve TANI YÖNTEMLERİ Prof. Dr. Suna Gedikoğlu Uludağ Üniversitesi Tıp Fakültesi Mikrobiyoloji ve Enfeksiyon Hastalıkları AD TULAREMİ F tularensis in oluşturduğu
KIRIM KONGO KANAMALI ATEŞİ HASTALIĞI (KKKA) VE KARADENİZ BÖLGESİ NDEKİ DURUMU
 KIRIM KONGO KANAMALI ATEŞİ HASTALIĞI (KKKA) VE KARADENİZ BÖLGESİ NDEKİ DURUMU Hamza KADI Veteriner Hekim Samsun Veteriner Kontrol Enstitüsü Viroloji Laboratuvarı Tarihçe 12. yy da bugünkü Tacikistan bölgesinde
KIRIM KONGO KANAMALI ATEŞİ HASTALIĞI (KKKA) VE KARADENİZ BÖLGESİ NDEKİ DURUMU Hamza KADI Veteriner Hekim Samsun Veteriner Kontrol Enstitüsü Viroloji Laboratuvarı Tarihçe 12. yy da bugünkü Tacikistan bölgesinde
TULAREMİ KONTROL ve KORUNMA. Dr. Kemalettin ÖZDEN
 TULAREMİ KONTROL ve KORUNMA Dr. Kemalettin ÖZDEN Bulaş yolları Deri ve mukozal yol: İnfekte kene veya sinek gibi vektörlerin ısırmasıyla veya infekte hayvan dokuları, hayvan çıkartılarıyla (idrar, dışkı
TULAREMİ KONTROL ve KORUNMA Dr. Kemalettin ÖZDEN Bulaş yolları Deri ve mukozal yol: İnfekte kene veya sinek gibi vektörlerin ısırmasıyla veya infekte hayvan dokuları, hayvan çıkartılarıyla (idrar, dışkı
Bruselloz: GüncelLiteratürler EşliğindeGüncelleme
 Bruselloz: GüncelLiteratürler EşliğindeGüncelleme Dr. Tuba TURUNÇ Başkent Üniversitesi Dr. Turgut Noyan Adana Uygulama ve Araştırma Merkezi Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji EKMUD Çukurova
Bruselloz: GüncelLiteratürler EşliğindeGüncelleme Dr. Tuba TURUNÇ Başkent Üniversitesi Dr. Turgut Noyan Adana Uygulama ve Araştırma Merkezi Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji EKMUD Çukurova
Francisella tularensis:
 Francisella tularensis: Doğal Rezervuarları,, Vektörleri ve Bulaşma Yolları Doç.Dr. Zati Vatansever Ankara Üniversitesi Veteriner Fakültesi Parazitoloji Anabilim Dalı Tularemi (tavşan an ateşi, geyik sineği
Francisella tularensis: Doğal Rezervuarları,, Vektörleri ve Bulaşma Yolları Doç.Dr. Zati Vatansever Ankara Üniversitesi Veteriner Fakültesi Parazitoloji Anabilim Dalı Tularemi (tavşan an ateşi, geyik sineği
Başarılı bir kongre ve toplantı olması dileği
 Dr. Suna Gedikoğlu Elimde olmayan bir neden ile kongreye katılamadığım için üzgünüm Bu toplantıda emekli ve kıdemli bir öğretim üyesi olarak deneyimlerimi paylaşmayı arzu etmiştim Katılamamakla beraber
Dr. Suna Gedikoğlu Elimde olmayan bir neden ile kongreye katılamadığım için üzgünüm Bu toplantıda emekli ve kıdemli bir öğretim üyesi olarak deneyimlerimi paylaşmayı arzu etmiştim Katılamamakla beraber
SAĞLIK ÇALIŞANLARININ ENFEKSİYON RİSKLERİ
 SAĞLIK ÇALIŞANLARININ ENFEKSİYON RİSKLERİ Sağlık hizmeti veren, Doktor Ebe Hemşire Diş hekimi Hemşirelik öğrencileri, risk altındadır Bu personelin enfeksiyon açısından izlemi personel sağlığı ve hastane
SAĞLIK ÇALIŞANLARININ ENFEKSİYON RİSKLERİ Sağlık hizmeti veren, Doktor Ebe Hemşire Diş hekimi Hemşirelik öğrencileri, risk altındadır Bu personelin enfeksiyon açısından izlemi personel sağlığı ve hastane
SARS (SEVERE ACUTE RESPİRATORY SYNDROME) CİDDİ AKUT SOLUNUM YETMEZLİĞİ SENDROMU
 SARS (SEVERE ACUTE RESPİRATORY SYNDROME) CİDDİ AKUT SOLUNUM YETMEZLİĞİ SENDROMU Coronavirus lar, Coronaviridae ailesinde yer alan zarflı RNA virüsleridir. İnsan ve hayvanlarda solunum yolu ve gastrointestinal
SARS (SEVERE ACUTE RESPİRATORY SYNDROME) CİDDİ AKUT SOLUNUM YETMEZLİĞİ SENDROMU Coronavirus lar, Coronaviridae ailesinde yer alan zarflı RNA virüsleridir. İnsan ve hayvanlarda solunum yolu ve gastrointestinal
VİRAL ENFEKSİYONLAR VE KORUNMA. Yrd. Doç. Dr. Banu KAŞKATEPE
 VİRAL ENFEKSİYONLAR VE KORUNMA Yrd. Doç. Dr. Banu KAŞKATEPE MERS-CoV (Middle East Respiratoy Seyndrome- Corona Virus Mers-CoV Öyküsü İlk olgu: v Haziran 2012 Suudi Arabistan v Pnömoni ve akut böbrek yetmezliği-
VİRAL ENFEKSİYONLAR VE KORUNMA Yrd. Doç. Dr. Banu KAŞKATEPE MERS-CoV (Middle East Respiratoy Seyndrome- Corona Virus Mers-CoV Öyküsü İlk olgu: v Haziran 2012 Suudi Arabistan v Pnömoni ve akut böbrek yetmezliği-
TULAREMİ DE KORUNMA VE KONTROL
 TULAREMİ DE KORUNMA VE KONTROL Ferruh N. Ayoğlu ICD-9 9 021, ICD-10 A21 Rabbit fever, Deer-fly fever, Ohara disease,, Francis disease Kaynak: Control of Communicable Disease Manual Maxy-Rosenau Rosenau-Last
TULAREMİ DE KORUNMA VE KONTROL Ferruh N. Ayoğlu ICD-9 9 021, ICD-10 A21 Rabbit fever, Deer-fly fever, Ohara disease,, Francis disease Kaynak: Control of Communicable Disease Manual Maxy-Rosenau Rosenau-Last
ANTRAKS (ŞARBON) septisemik, bulaşıcı, zoonoz
 ANTRAKS (ŞARBON) septisemik, bulaşıcı, zoonoz ÖLÜMden hemen önce ya da sonra doğal boşluklardan KAN PIHTILAŞMAMA KOYU RENK alma DALAKta büyüme ÖDEM ETİYOLOJİ Bacillus anthracis Gram pozitif kapsüllü *
ANTRAKS (ŞARBON) septisemik, bulaşıcı, zoonoz ÖLÜMden hemen önce ya da sonra doğal boşluklardan KAN PIHTILAŞMAMA KOYU RENK alma DALAKta büyüme ÖDEM ETİYOLOJİ Bacillus anthracis Gram pozitif kapsüllü *
İMMUNİZASYON. Bir bireye bağışıklık kazandırma! Bireyin yaşı? İmmunolojik olarak erişkin mi? Maternal antikor? Konak antijene duyarlı mı? Sağlıklı mı?
 İMMUNİZASYON Bir bireye bağışıklık kazandırma! Bireyin yaşı? İmmunolojik olarak erişkin mi? Maternal antikor? Konak antijene duyarlı mı? Sağlıklı mı? Canlıya antijen verdikten belli bir süre sonra, o canlıda
İMMUNİZASYON Bir bireye bağışıklık kazandırma! Bireyin yaşı? İmmunolojik olarak erişkin mi? Maternal antikor? Konak antijene duyarlı mı? Sağlıklı mı? Canlıya antijen verdikten belli bir süre sonra, o canlıda
Dünyada ve Türkiyede Tularemi. Prof. Dr. Okan Töre Uludağ Üniversitesi Tıp Fakültesi Tıbbi Mikrobiyoloji A.D.
 Dünyada ve Türkiyede Tularemi Prof. Dr. Okan Töre Uludağ Üniversitesi Tıp Fakültesi Tıbbi Mikrobiyoloji A.D. Tarihçe Hastalık ilk kez 1911 de G.W. McCoy tarafından Tulare kasabasında yer sincaplarında
Dünyada ve Türkiyede Tularemi Prof. Dr. Okan Töre Uludağ Üniversitesi Tıp Fakültesi Tıbbi Mikrobiyoloji A.D. Tarihçe Hastalık ilk kez 1911 de G.W. McCoy tarafından Tulare kasabasında yer sincaplarında
Ülkemizde Önem Kazanan Zoonotik Hastalıkların Güncel Durumu: «Tularemi»
 Ülkemizde Önem Kazanan Zoonotik Hastalıkların Güncel Durumu: «Tularemi» Doç. Dr. Selçuk Kılıç Türkiye Halk Sağlığı Kurumu Ulusal Tularemi Referans Laboratuvarı 2. Ulusal Klinik Mikrobiyoloji Kongresi,
Ülkemizde Önem Kazanan Zoonotik Hastalıkların Güncel Durumu: «Tularemi» Doç. Dr. Selçuk Kılıç Türkiye Halk Sağlığı Kurumu Ulusal Tularemi Referans Laboratuvarı 2. Ulusal Klinik Mikrobiyoloji Kongresi,
TULAREMİ KORUNMA KONTROL VE
 TULAREMİ KORUNMA KONTROL VE AŞI ÇALIŞMALARI Meliha Meriç Koç Kocaeli Üniversitesi Tıp T p Fakültesi Klinik Bakteriyoloji ve Enfeksiyon Hastalıklar kları Anabilim Dalı F. tularensis in bulaş yolları Kontamine
TULAREMİ KORUNMA KONTROL VE AŞI ÇALIŞMALARI Meliha Meriç Koç Kocaeli Üniversitesi Tıp T p Fakültesi Klinik Bakteriyoloji ve Enfeksiyon Hastalıklar kları Anabilim Dalı F. tularensis in bulaş yolları Kontamine
Prof.Dr. Meltem Yalınay Çırak Gazi Üniversitesi Tıp Fakültesi Mikrobiyoloji ve Klinik Mikrobiyoloji A.D. SALGINLARIN İZLENMESİ VE MOLEKÜLER
 SALGIN ARAŞTIRMASINDA MOLEKÜLER MİKROBİYOLOJİ LABORATUVARININ ROLÜ Prof.Dr. Meltem Yalınay Çırak Gazi Üniversitesi Tıp Fakültesi Mikrobiyoloji ve Klinik Mikrobiyoloji A.D. SALGINLARIN İZLENMESİ VE MOLEKÜLER
SALGIN ARAŞTIRMASINDA MOLEKÜLER MİKROBİYOLOJİ LABORATUVARININ ROLÜ Prof.Dr. Meltem Yalınay Çırak Gazi Üniversitesi Tıp Fakültesi Mikrobiyoloji ve Klinik Mikrobiyoloji A.D. SALGINLARIN İZLENMESİ VE MOLEKÜLER
VETERİNER HEKİMLİK ALANINDA ANTİMİKROBİYEL DİRENÇ İZLEME ve KONTROL STRATEJİLERİ EYLEM PLANI
 VETERİNER HEKİMLİK ALANINDA ANTİMİKROBİYEL DİRENÇ İZLEME ve KONTROL GIDA ve KONTROL GENEL MÜDÜRLÜĞÜ VETERİNER SAĞLIK ÜRÜNLERİ ve HALK SAĞLIĞI DAİRESİ BAŞKANLIĞI A Veteriner Hekimlik Alanında Antimikrobiyel
VETERİNER HEKİMLİK ALANINDA ANTİMİKROBİYEL DİRENÇ İZLEME ve KONTROL GIDA ve KONTROL GENEL MÜDÜRLÜĞÜ VETERİNER SAĞLIK ÜRÜNLERİ ve HALK SAĞLIĞI DAİRESİ BAŞKANLIĞI A Veteriner Hekimlik Alanında Antimikrobiyel
HIZLI VE YÜKSEK ÇÖZÜNÜRLÜKTE BRUCELLA GENOTİPLENDİRİLMESİ İÇİN MOLEKÜLER BİR YÖNTEM GELİŞTİRİLMESİ
 HIZLI VE YÜKSEK ÇÖZÜNÜRLÜKTE BRUCELLA GENOTİPLENDİRİLMESİ İÇİN MOLEKÜLER BİR YÖNTEM GELİŞTİRİLMESİ SELÇUK KILIÇ, BEKİR ÇELEBİ, MEHMET GENÇ, CANAN KETRE, MUSTAFA KOLUKIRIK 1, Ankara 2 Bioeksen Ar-Ge Teknolojileri
HIZLI VE YÜKSEK ÇÖZÜNÜRLÜKTE BRUCELLA GENOTİPLENDİRİLMESİ İÇİN MOLEKÜLER BİR YÖNTEM GELİŞTİRİLMESİ SELÇUK KILIÇ, BEKİR ÇELEBİ, MEHMET GENÇ, CANAN KETRE, MUSTAFA KOLUKIRIK 1, Ankara 2 Bioeksen Ar-Ge Teknolojileri
Viral Hepatitler. Hepatit A Virus. Viral Hepatitler- Tarihsel Bakış. Hepatit Tipleri. Hepatit A Klinik Özellikler
 Viral Hepatitler- Tarihsel Bakış Viral Hepatitler İnfeksiyöz Viral hepatitler A NANB E Enterik yolla geçen Dr. Ömer Şentürk Serum B D C F, G, TTV,? diğerleri Parenteral yolla geçen Hepatit Tipleri A B
Viral Hepatitler- Tarihsel Bakış Viral Hepatitler İnfeksiyöz Viral hepatitler A NANB E Enterik yolla geçen Dr. Ömer Şentürk Serum B D C F, G, TTV,? diğerleri Parenteral yolla geçen Hepatit Tipleri A B
Ulusal Akılcı Antibiyotik Kullanımı ve Antimikrobiyal Direnç Stratejik Eylem Planı
 Türkiye Halk Sağlığı Halk Genel Sağlığı Müdürlüğü Kurumu Ulusal Akılcı Antibiyotik Kullanımı ve Antimikrobiyal Direnç Stratejik Eylem Planı Doç. Dr. Serap SÜZÜK YILDIZ Tıbbi Mikrobiyoloji Uzmanı, PhD SB
Türkiye Halk Sağlığı Halk Genel Sağlığı Müdürlüğü Kurumu Ulusal Akılcı Antibiyotik Kullanımı ve Antimikrobiyal Direnç Stratejik Eylem Planı Doç. Dr. Serap SÜZÜK YILDIZ Tıbbi Mikrobiyoloji Uzmanı, PhD SB
Türkiye de Toplum Kökenli Enfeksiyon Hastalıklarında Neredeyiz?
 Türkiye de Toplum Kökenli Enfeksiyon Hastalıklarında Neredeyiz? İzmir İl Sağlık Müdürü Enfeksiyon Hastalıkları Uzmanı Uz. Dr. Bediha TÜRKYILMAZ Toplum Kökenli Enfeksiyonlar Toplum kökenli enfeksiyon; önemli
Türkiye de Toplum Kökenli Enfeksiyon Hastalıklarında Neredeyiz? İzmir İl Sağlık Müdürü Enfeksiyon Hastalıkları Uzmanı Uz. Dr. Bediha TÜRKYILMAZ Toplum Kökenli Enfeksiyonlar Toplum kökenli enfeksiyon; önemli
HIV/AIDS epidemisinde neler değişti?
 HIV/AIDS epidemisinde neler değişti? Dr. Gülşen Mermut Ege Üniversitesi Tıp Fakültesi Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji ABD EKMUD İzmir Toplantıları - 29.12.2015 Sunum Planı Dünya epidemiyolojisi
HIV/AIDS epidemisinde neler değişti? Dr. Gülşen Mermut Ege Üniversitesi Tıp Fakültesi Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji ABD EKMUD İzmir Toplantıları - 29.12.2015 Sunum Planı Dünya epidemiyolojisi
Salmonella. XLT Agar'da Salmonella (hidrojen sülfür oluşumuna bağlı olarak siyah) ve Citrobacter (sarı) kolonileri
 Enterobacteriaceae İnsan sağlığı açısından en önemli bakteri ailesidir. Doğal ortamları insan ve hayvan bağırsaklarıdır. Tipik klinik semptomlarla seyreden hastalığın (tifo, basilli dizanteri, veba) etkeni
Enterobacteriaceae İnsan sağlığı açısından en önemli bakteri ailesidir. Doğal ortamları insan ve hayvan bağırsaklarıdır. Tipik klinik semptomlarla seyreden hastalığın (tifo, basilli dizanteri, veba) etkeni
IV. KLİMUD Kongresi, Kasım 2017, Antalya
 IV. KLİMUD Kongresi, 08-12 Kasım 2017, Antalya 1 HCV Tanısında Cut off/ Sinyal (S/CO)/TV) Değerlerinin Tanısal Geçerliliklerinin Değerlendirilmesi TÜLİN DEMİR¹, DİLARA YILDIRAN¹, SELÇUK KILIǹ, SELÇUK
IV. KLİMUD Kongresi, 08-12 Kasım 2017, Antalya 1 HCV Tanısında Cut off/ Sinyal (S/CO)/TV) Değerlerinin Tanısal Geçerliliklerinin Değerlendirilmesi TÜLİN DEMİR¹, DİLARA YILDIRAN¹, SELÇUK KILIǹ, SELÇUK
TOKSOPLAZMA İNFEKSİYONUNUN LABORATUVAR TANISI UZM.DR.CENGİZ UZUN ALMAN HASTANESİ
 TOKSOPLAZMA İNFEKSİYONUNUN LABORATUVAR TANISI UZM.DR.CENGİZ UZUN ALMAN HASTANESİ KLİNİK Bağışıklık sistemi sağlam kişilerde akut infeksiyon Bağışıklık sistemi baskılanmış kişilerde akut infeksiyon veya
TOKSOPLAZMA İNFEKSİYONUNUN LABORATUVAR TANISI UZM.DR.CENGİZ UZUN ALMAN HASTANESİ KLİNİK Bağışıklık sistemi sağlam kişilerde akut infeksiyon Bağışıklık sistemi baskılanmış kişilerde akut infeksiyon veya
Gelişen teknoloji Tanı ve tedavide kullanım Uygulanan teknikler çok gelişmiş bile olsalar kendine özgü komplikasyon riskleri taşımaktadırlar
 Gelişen teknoloji Tanı ve tedavide kullanım Uygulanan teknikler çok gelişmiş bile olsalar kendine özgü komplikasyon riskleri taşımaktadırlar 2 Hastanın hastanede yatış süresini uzatmakta Tedavi maliyetini
Gelişen teknoloji Tanı ve tedavide kullanım Uygulanan teknikler çok gelişmiş bile olsalar kendine özgü komplikasyon riskleri taşımaktadırlar 2 Hastanın hastanede yatış süresini uzatmakta Tedavi maliyetini
ANTİMİKROBİYAL DİRENÇ STRATEJİK EYLEM PLANI ( )
 ANTİMİKROBİYAL DİRENÇ STRATEJİK EYLEM PLANI (2018-2023) Prof. Dr. Selçuk KILIÇ T.C. Sağlık Bakanlığı Mikrobiyoloji Referans Laboratuvarları ve Biyolojik Ürünler Dairesi Başkanlığı Antimikrobiyal Direnç
ANTİMİKROBİYAL DİRENÇ STRATEJİK EYLEM PLANI (2018-2023) Prof. Dr. Selçuk KILIÇ T.C. Sağlık Bakanlığı Mikrobiyoloji Referans Laboratuvarları ve Biyolojik Ürünler Dairesi Başkanlığı Antimikrobiyal Direnç
WEİL-FELİX TESTİ NEDİR NASIL YAPILIR? Weil Felix testi Riketsiyozların tanısında kullanılır.
 WEİL FELİX TESTİ WEİL-FELİX TESTİ NEDİR NASIL YAPILIR? Weil Felix testi Riketsiyozların tanısında kullanılır. Riketsiyöz tanısında çapraz reaksiyondan faydalanılır bu nedenle riketsiyaların çapraz reaksiyon
WEİL FELİX TESTİ WEİL-FELİX TESTİ NEDİR NASIL YAPILIR? Weil Felix testi Riketsiyozların tanısında kullanılır. Riketsiyöz tanısında çapraz reaksiyondan faydalanılır bu nedenle riketsiyaların çapraz reaksiyon
ENFEKSİYON KONTROL KOMİTELERİNİN GÖREVLERİ VE SAĞLIK ÇALIŞANLARINDA ENFEKSİYON KONTROLÜ ve ÖNLENMESİ
 TC SAĞLIK BAKANLIĞI Refik Saydam Hıfzıssıhha Merkezi Başkanlığı ENFEKSİYON KONTROL KOMİTELERİNİN GÖREVLERİ VE SAĞLIK ÇALIŞANLARINDA ENFEKSİYON KONTROLÜ ve ÖNLENMESİ Dr. Mustafa ERTEK Refik Saydam Hıfzıssıhha
TC SAĞLIK BAKANLIĞI Refik Saydam Hıfzıssıhha Merkezi Başkanlığı ENFEKSİYON KONTROL KOMİTELERİNİN GÖREVLERİ VE SAĞLIK ÇALIŞANLARINDA ENFEKSİYON KONTROLÜ ve ÖNLENMESİ Dr. Mustafa ERTEK Refik Saydam Hıfzıssıhha
GENEL HEDEFLERİN BELİRLENMESİ Her konuda olduğu gibi zoonotik hastalıkların kontrolünde de öncelikle genel hedeflerin belirlenmesi gerekir.
 GENEL HEDEFLERİN BELİRLENMESİ Her konuda olduğu gibi zoonotik hastalıkların kontrolünde de öncelikle genel hedeflerin belirlenmesi gerekir. Bunun için de sırasıyla; Kontrol için temel gereksinimlerin temini,
GENEL HEDEFLERİN BELİRLENMESİ Her konuda olduğu gibi zoonotik hastalıkların kontrolünde de öncelikle genel hedeflerin belirlenmesi gerekir. Bunun için de sırasıyla; Kontrol için temel gereksinimlerin temini,
HAYVANLARDA BRUCELLOSİS VE. Uzm.Vet.Hek.Nedret AYDIN
 HAYVANLARDA BRUCELLOSİS VE EPİDEM DEMİYOLOJİSİ Uzm.Vet.Hek.Nedret AYDIN Brucella larınneden olduğu Brucellosis; sığır, koyun, keçi, domuz, koç vs. gibi hayvanlarda, özellikle, testis, meme, uterus gibi
HAYVANLARDA BRUCELLOSİS VE EPİDEM DEMİYOLOJİSİ Uzm.Vet.Hek.Nedret AYDIN Brucella larınneden olduğu Brucellosis; sığır, koyun, keçi, domuz, koç vs. gibi hayvanlarda, özellikle, testis, meme, uterus gibi
D Vitaminin Relaps Brucelloz üzerine Etkisi. Yrd.Doç.Dr. Turhan Togan Başkent Üniversitesi Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji
 D Vitaminin Relaps Brucelloz üzerine Etkisi Yrd.Doç.Dr. Turhan Togan Başkent Üniversitesi Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Bruselloz Brucella cinsi bakteriler tarafından primer olarak otçul
D Vitaminin Relaps Brucelloz üzerine Etkisi Yrd.Doç.Dr. Turhan Togan Başkent Üniversitesi Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Bruselloz Brucella cinsi bakteriler tarafından primer olarak otçul
Dr. Aysun YALÇI Gülhane Eğitim Araştırma Hastanesi , ANKARA
 Dr. Aysun YALÇI Gülhane Eğitim Araştırma Hastanesi 29.03.2017, ANKARA Sunum Planı Giriş Antimikrobiyal direnci önleme Direncin önlenmesinde WHO, İDSA,CDC önerileri El hijyeni Temas izolasyonu önlemleri
Dr. Aysun YALÇI Gülhane Eğitim Araştırma Hastanesi 29.03.2017, ANKARA Sunum Planı Giriş Antimikrobiyal direnci önleme Direncin önlenmesinde WHO, İDSA,CDC önerileri El hijyeni Temas izolasyonu önlemleri
Travmalı hastaya müdahale eden sağlık çalışanları, hasta kanı ve diğer vücut salgıları ile çalışma ortamında karşılaşma riski bulunan diğer sağlık
 Doç. Dr. Onur POLAT Travmalı hastaya müdahale eden sağlık çalışanları, hasta kanı ve diğer vücut salgıları ile çalışma ortamında karşılaşma riski bulunan diğer sağlık personeli gibi hastalardan bulaşabilecek
Doç. Dr. Onur POLAT Travmalı hastaya müdahale eden sağlık çalışanları, hasta kanı ve diğer vücut salgıları ile çalışma ortamında karşılaşma riski bulunan diğer sağlık personeli gibi hastalardan bulaşabilecek
SIĞIRLARIN NODÜLER EKZANTEMİ LUMPY SKIN DISEASE (LSD) Hastalık Kartı. Hazırlayan. Dr. M. Fatih BARUT Vet. Hekim
 SIĞIRLARIN NODÜLER EKZANTEMİ LUMPY SKIN DISEASE (LSD) Hastalık Kartı Hazırlayan Dr. M. Fatih BARUT Vet. Hekim Etlik Veteriner Kontrol Merkez Araştırma Enstitüsü Virolojik Teşhis Laboratuvarı Etken: Etken,
SIĞIRLARIN NODÜLER EKZANTEMİ LUMPY SKIN DISEASE (LSD) Hastalık Kartı Hazırlayan Dr. M. Fatih BARUT Vet. Hekim Etlik Veteriner Kontrol Merkez Araştırma Enstitüsü Virolojik Teşhis Laboratuvarı Etken: Etken,
Hazırlayan: Fadime Kaya Acıbadem Adana Hastanesi Enfeksiyon Kontrol Hemşiresi Hazırlanma Tarihi:
 Hazırlayan: Fadime Kaya Acıbadem Adana Hastanesi Enfeksiyon Kontrol Hemşiresi Hazırlanma Tarihi: 30.06.2018 » İnfluenzanın Tanımı» İnfluenza Bulaş Türleri» İnfluenza Nasıl Bulaşır?» Konak Seçimi» Klinik
Hazırlayan: Fadime Kaya Acıbadem Adana Hastanesi Enfeksiyon Kontrol Hemşiresi Hazırlanma Tarihi: 30.06.2018 » İnfluenzanın Tanımı» İnfluenza Bulaş Türleri» İnfluenza Nasıl Bulaşır?» Konak Seçimi» Klinik
CLOSTRIDIUM DIFFICILE ENFEKSİYONUNDA GLUTAMAT DEHİDROGENAZ VE TOKSİN A/B TESTLERİNİN TANI DEĞERİ VE MALİYET ETKİNLİĞİ
 CLOSTRIDIUM DIFFICILE ENFEKSİYONUNDA GLUTAMAT DEHİDROGENAZ VE TOKSİN A/B TESTLERİNİN TANI DEĞERİ VE MALİYET ETKİNLİĞİ Dr. Zahide Doyuk Bektaş Sağlık Bakanlığı Marmara Ünv. Pendik Eğitim Arş. Hastanesi
CLOSTRIDIUM DIFFICILE ENFEKSİYONUNDA GLUTAMAT DEHİDROGENAZ VE TOKSİN A/B TESTLERİNİN TANI DEĞERİ VE MALİYET ETKİNLİĞİ Dr. Zahide Doyuk Bektaş Sağlık Bakanlığı Marmara Ünv. Pendik Eğitim Arş. Hastanesi
ZOONOTİK HASTALIKLARDA TEK SAĞLIK YAKLAŞIMI VE ÖNEMİ KUDUZ ÖRNEĞİ
 ZOONOTİK HASTALIKLARDA TEK SAĞLIK YAKLAŞIMI VE ÖNEMİ KUDUZ ÖRNEĞİ Dr. Ebru AYDIN Zoonotik ve Vektörel Hastalıklar Daire Başkanı T.C. Sağlık Türkiye T.C. Bakanlığı Halk Sağlık Sağlığı Bakanlığı Kurumu Zoonotik
ZOONOTİK HASTALIKLARDA TEK SAĞLIK YAKLAŞIMI VE ÖNEMİ KUDUZ ÖRNEĞİ Dr. Ebru AYDIN Zoonotik ve Vektörel Hastalıklar Daire Başkanı T.C. Sağlık Türkiye T.C. Bakanlığı Halk Sağlık Sağlığı Bakanlığı Kurumu Zoonotik
Biyoterörizm ve Besin Güvenliğine Diyetisyen Yaklaşımı: Mevcut Hızlı Teşhis Yöntemleri
 Biyoterörizm ve Besin Güvenliğine Diyetisyen Yaklaşımı: Mevcut Hızlı Teşhis Yöntemleri Hacettepe Beslenme ve Diyetetik Günleri V. Mezuniyet Sonrası Eğitim Kursu Hacettepe Üniversitesi Kongre Merkezi 26.06.2015
Biyoterörizm ve Besin Güvenliğine Diyetisyen Yaklaşımı: Mevcut Hızlı Teşhis Yöntemleri Hacettepe Beslenme ve Diyetetik Günleri V. Mezuniyet Sonrası Eğitim Kursu Hacettepe Üniversitesi Kongre Merkezi 26.06.2015
Anti-HIV Pozitif Bulunan Hastada Kesin Tanı Algoritması. Doç. Dr. Kenan Midilli İ.Ü. Cerrahpaşa Tıp Fakültesi Tıbbi Mikrobiyoloji Anabilim Dalı
 Anti-HIV Pozitif Bulunan Hastada Kesin Tanı Algoritması Doç. Dr. Kenan Midilli İ.Ü. Cerrahpaşa Tıp Fakültesi Tıbbi Mikrobiyoloji Anabilim Dalı Testler farklı amaçlarla uygulanabilir: - Tanı, tarama, doğrulama,
Anti-HIV Pozitif Bulunan Hastada Kesin Tanı Algoritması Doç. Dr. Kenan Midilli İ.Ü. Cerrahpaşa Tıp Fakültesi Tıbbi Mikrobiyoloji Anabilim Dalı Testler farklı amaçlarla uygulanabilir: - Tanı, tarama, doğrulama,
SAĞLIK BAKANLIĞI BAKIŞ AÇISI İLE «TEK SAĞLIK» UYGULAMALARI
 SAĞLIK BAKANLIĞI BAKIŞ AÇISI İLE «TEK SAĞLIK» UYGULAMALARI Dr. Ebru AYDIN Zoonotik ve Vektörel Hastalıklar Daire Başkanı Halk Sağlığı Uygulamalarında Veterinerlik Hizmetlerinin Rolü Sempozyumu Ankara,
SAĞLIK BAKANLIĞI BAKIŞ AÇISI İLE «TEK SAĞLIK» UYGULAMALARI Dr. Ebru AYDIN Zoonotik ve Vektörel Hastalıklar Daire Başkanı Halk Sağlığı Uygulamalarında Veterinerlik Hizmetlerinin Rolü Sempozyumu Ankara,
İSTANBUL MEDENİYET ÜNİVERSİTESİ TIP FAKÜLTESİ TIBBİ MİKROBİYOLOJİ ANABİLİM DALI MEZUNİYET SONRASI (UZMANLIK) EĞİTİMİ DERS MÜFREDATI
 İSTANBUL MEDENİYET ÜNİVERSİTESİ TIP FAKÜLTESİ TIBBİ MİKROBİYOLOJİ ANABİLİM DALI MEZUNİYET SONRASI (UZMANLIK) EĞİTİMİ DERS MÜFREDATI DERS KODU ve ADI TMİK 001: Vaka Değerlendirme Toplantısı TMİK 002: Makale
İSTANBUL MEDENİYET ÜNİVERSİTESİ TIP FAKÜLTESİ TIBBİ MİKROBİYOLOJİ ANABİLİM DALI MEZUNİYET SONRASI (UZMANLIK) EĞİTİMİ DERS MÜFREDATI DERS KODU ve ADI TMİK 001: Vaka Değerlendirme Toplantısı TMİK 002: Makale
GIDA KONTROLÜNDE HIFZISSIHHANIN ROLÜ. Mustafa ERTEK
 GIDA KONTROLÜNDE HIFZISSIHHANIN ROLÜ Mustafa ERTEK Gıda Güvenliği İnsanların sağlıklı yaşaması için yeterli miktarda gıda alabilmesi ve bu gıdaların sağlık yönünden güvenli olması gerekmektedir. FAO/WHO
GIDA KONTROLÜNDE HIFZISSIHHANIN ROLÜ Mustafa ERTEK Gıda Güvenliği İnsanların sağlıklı yaşaması için yeterli miktarda gıda alabilmesi ve bu gıdaların sağlık yönünden güvenli olması gerekmektedir. FAO/WHO
Dünyada ve Türkiye de İnfluenza Epidemiyolojisi. Dr. Nurbanu Sezak Atatürk EAH Enfeksiyon Hst. ve Kln. Mikrobiyoloji Kliniği Kasım 2015
 Dünyada ve Türkiye de İnfluenza Epidemiyolojisi Dr. Nurbanu Sezak Atatürk EAH Enfeksiyon Hst. ve Kln. Mikrobiyoloji Kliniği Kasım 2015 İnfluenza Tip A ve B virusları Akut solunum yolu hastalığı Her yıl
Dünyada ve Türkiye de İnfluenza Epidemiyolojisi Dr. Nurbanu Sezak Atatürk EAH Enfeksiyon Hst. ve Kln. Mikrobiyoloji Kliniği Kasım 2015 İnfluenza Tip A ve B virusları Akut solunum yolu hastalığı Her yıl
GİRİŞ. Kan dolaşımı enfeksiyonları (KDE) önemli morbidite ve mortalite sebebi. ABD de yılda 200.000 KDE, mortalite % 35-60
 Dr. Tolga BAŞKESEN GİRİŞ Kan dolaşımı enfeksiyonları (KDE) önemli morbidite ve mortalite sebebi ABD de yılda 200.000 KDE, mortalite % 35-60 Erken ve doğru tedavi ile mortaliteyi azaltmak mümkün GİRİŞ Kan
Dr. Tolga BAŞKESEN GİRİŞ Kan dolaşımı enfeksiyonları (KDE) önemli morbidite ve mortalite sebebi ABD de yılda 200.000 KDE, mortalite % 35-60 Erken ve doğru tedavi ile mortaliteyi azaltmak mümkün GİRİŞ Kan
Komplike deri ve yumuşak doku enfeksiyonu etkeni çoklu dirençli patojenlerin bakteriyofaj duyarlılıklarının araştırılması
 Komplike deri ve yumuşak doku enfeksiyonu etkeni çoklu dirençli patojenlerin bakteriyofaj duyarlılıklarının araştırılması Aycan Gundogdu, Ph.D. Erciyes Üniversitesi Tıp Fakültesi Tıbbi Mikrobiyoloji Anabilim
Komplike deri ve yumuşak doku enfeksiyonu etkeni çoklu dirençli patojenlerin bakteriyofaj duyarlılıklarının araştırılması Aycan Gundogdu, Ph.D. Erciyes Üniversitesi Tıp Fakültesi Tıbbi Mikrobiyoloji Anabilim
Türkiye de Su Kaynaklı Tularemi Salgınlarının Değerlendirilmesi
 Türkiye de Su Kaynaklı Tularemi Salgınlarının Değerlendirilmesi Murat Kutlu, Çağrı Ergin, Selda Sayın Kutlu Pamukkale Üniversitesi Tıp Fakültesi Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Anabilim
Türkiye de Su Kaynaklı Tularemi Salgınlarının Değerlendirilmesi Murat Kutlu, Çağrı Ergin, Selda Sayın Kutlu Pamukkale Üniversitesi Tıp Fakültesi Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Anabilim
laboratuar muayeneleri esastır.
 Brucella ların neden olduğu Brucellosis; sığır, koyun, keçi, domuz, koç vs. gibi hayvanlarda, özellikle, testis, meme, uterus gibi genital organlara yerleşerek yavru atmalara ve infertiliteye yol açan
Brucella ların neden olduğu Brucellosis; sığır, koyun, keçi, domuz, koç vs. gibi hayvanlarda, özellikle, testis, meme, uterus gibi genital organlara yerleşerek yavru atmalara ve infertiliteye yol açan
YERSİNİA ENFEKSİYONLARI. Dr. Kaya Süer Yakın Doğu Üniversitesi Tıp Fakültesi Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji
 YERSİNİA ENFEKSİYONLARI Dr. Kaya Süer Yakın Doğu Üniversitesi Tıp Fakültesi Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji YERSİNİA Enterobactericeae ailesinden Yersinia pestis (veba etkeni) Yersinia
YERSİNİA ENFEKSİYONLARI Dr. Kaya Süer Yakın Doğu Üniversitesi Tıp Fakültesi Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji YERSİNİA Enterobactericeae ailesinden Yersinia pestis (veba etkeni) Yersinia
28 Eylül Dünya Kuduz Günü (1) NEDEN? yıl önce bugün (28 Eylül 1895 de) aramızdan ayrıldı Dünya Bilimine,
 28 Eylül Dünya Kuduz Günü (1) NEDEN? Çünkü dünyada KUDUZ aşısını ilk bulan büyük bilim insanı Louis PASTEUR (27 Aralık 1822-28 Eylül 1895) 123 yıl önce bugün (28 Eylül 1895 de) aramızdan ayrıldı Dünya
28 Eylül Dünya Kuduz Günü (1) NEDEN? Çünkü dünyada KUDUZ aşısını ilk bulan büyük bilim insanı Louis PASTEUR (27 Aralık 1822-28 Eylül 1895) 123 yıl önce bugün (28 Eylül 1895 de) aramızdan ayrıldı Dünya
T.C SÜLEYMAN DEMİREL ÜNİVERSİTESİ TIP FAKÜLTESİ. ENFEKSİYON HASTALIKLARI ve KLİNİK MİKROBİYOLOJİ ANABİLİM DALI 2015-2016 YILI DÖNEM V DERS PROGRAMI
 T.C SÜLEYMAN DEMİREL ÜNİVERSİTESİ TIP FAKÜLTESİ ENFEKSİYON HASTALIKLARI ve KLİNİK MİKROBİYOLOJİ ANABİLİM DALI 2015-2016 YILI DÖNEM V DERS PROGRAMI Prof.Dr. Füsun Zeynep AKÇAM Doç.Dr. Onur KAYA Doç.Dr.
T.C SÜLEYMAN DEMİREL ÜNİVERSİTESİ TIP FAKÜLTESİ ENFEKSİYON HASTALIKLARI ve KLİNİK MİKROBİYOLOJİ ANABİLİM DALI 2015-2016 YILI DÖNEM V DERS PROGRAMI Prof.Dr. Füsun Zeynep AKÇAM Doç.Dr. Onur KAYA Doç.Dr.
Hayvanlarda Klinik Özellikler, Tanı ve Tedavi
 Hayvanlarda Klinik Özellikler, Tanı ve Tedavi Doç. Dr. Ahmet ÜNVER Kafkas Üniversitesi, Veteriner Fakültesi Mikrobiyoloji Anabilim Dalı, Kars Hayvanlarda Klinik Özellikler 1-10 günlük inkubasyon dönemi
Hayvanlarda Klinik Özellikler, Tanı ve Tedavi Doç. Dr. Ahmet ÜNVER Kafkas Üniversitesi, Veteriner Fakültesi Mikrobiyoloji Anabilim Dalı, Kars Hayvanlarda Klinik Özellikler 1-10 günlük inkubasyon dönemi
Bacillus anthracis. Hayvanlarda şarbon etkenidir. Bacillus anthracis. Gram boyama. Bacillus anthracis. Bacillus anthracis
 Bacillus anthracis Gram pozitif, obligat aerop sporlu, çomak şeklinde bakterilerdir. 1µm eninde, 2-4 µm uzunluğunda, konkav sonlanan, kirpiksiz bakterilerdir. Bacillus anthracis in doğal yaşam ortamı topraktır.
Bacillus anthracis Gram pozitif, obligat aerop sporlu, çomak şeklinde bakterilerdir. 1µm eninde, 2-4 µm uzunluğunda, konkav sonlanan, kirpiksiz bakterilerdir. Bacillus anthracis in doğal yaşam ortamı topraktır.
Global Leishmaniasis. Leishmaniasis. Türkiye de leishmaniasis. Leishmaniasis. Leishmaniasis
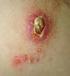 Leishmaniasis Leishmaniasis Leishmaniasis Tropik ve subtropik iklimlerde, Akdeniz bölgesi ülkelerde (88 ülke) görülür Her yıl 1,5 milyon yeni olgu eklenmektedir 350 milyon insan risk altında 23 farklı
Leishmaniasis Leishmaniasis Leishmaniasis Tropik ve subtropik iklimlerde, Akdeniz bölgesi ülkelerde (88 ülke) görülür Her yıl 1,5 milyon yeni olgu eklenmektedir 350 milyon insan risk altında 23 farklı
İnsan Brusellozu: Dünyada ve Ülkemizde Epidemiyoloji
 İnsan Brusellozu: Dünyada ve Ülkemizde Epidemiyoloji Doç. Dr. Üner KAYABAŞ İnönü Üniversitesi Tıp Fakültesi Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji AD Malatya Bruselloz dünya çapında yaygın bir
İnsan Brusellozu: Dünyada ve Ülkemizde Epidemiyoloji Doç. Dr. Üner KAYABAŞ İnönü Üniversitesi Tıp Fakültesi Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji AD Malatya Bruselloz dünya çapında yaygın bir
T.C SÜLEYMAN DEMİREL ÜNİVERSİTESİ TIP FAKÜLTESİ. ENFEKSİYON HASTALIKLARI ve KLİNİK MİKROBİYOLOJİ ANABİLİM DALI 2014-2015 YILI DÖNEM V DERS PROGRAMI
 T.C SÜLEYMAN DEMİREL ÜNİVERSİTESİ TIP FAKÜLTESİ ENFEKSİYON HASTALIKLARI ve KLİNİK MİKROBİYOLOJİ ANABİLİM DALI 2014-2015 YILI DÖNEM V DERS PROGRAMI Prof.Dr. Füsun Zeynep AKÇAM Doç.Dr. Onur KAYA Yrd.Doç.Dr.
T.C SÜLEYMAN DEMİREL ÜNİVERSİTESİ TIP FAKÜLTESİ ENFEKSİYON HASTALIKLARI ve KLİNİK MİKROBİYOLOJİ ANABİLİM DALI 2014-2015 YILI DÖNEM V DERS PROGRAMI Prof.Dr. Füsun Zeynep AKÇAM Doç.Dr. Onur KAYA Yrd.Doç.Dr.
Asist. Dr. Ayşe N. Varışlı
 Asist. Dr. Ayşe N. Varışlı 1 GİRİŞ: İshal tüm dünyada, özellikle de gelişmekte olan ülkelerde önemli bir sağlık problemi olarak karşımıza çıkmaktadır Akut ishal, özellikle çocuk ve yaşlı hastalarda önemli
Asist. Dr. Ayşe N. Varışlı 1 GİRİŞ: İshal tüm dünyada, özellikle de gelişmekte olan ülkelerde önemli bir sağlık problemi olarak karşımıza çıkmaktadır Akut ishal, özellikle çocuk ve yaşlı hastalarda önemli
Prediktör Testler ve Sıradışı Serolojik Profiller. Dr. Dilara İnan Isparta
 Prediktör Testler ve Sıradışı Serolojik Profiller Dr. Dilara İnan 04.06.2016 Isparta Hepatit B yüzey antijeni (HBsAg) HBV yüzeyinde bulunan bir proteindir; RIA veya EIA ile saptanır Akut ve kronik HBV
Prediktör Testler ve Sıradışı Serolojik Profiller Dr. Dilara İnan 04.06.2016 Isparta Hepatit B yüzey antijeni (HBsAg) HBV yüzeyinde bulunan bir proteindir; RIA veya EIA ile saptanır Akut ve kronik HBV
T.C. SAĞLIK BAKANLIĞI Temel Sağlık Hizmetleri Genel Müdürlüğü BRUSELLOZİS
 T.C. SAĞLIK BAKANLIĞI Temel Sağlık Hizmetleri Genel Müdürlüğü BRUSELLOZİS (Dünyadaki ve Ülkemizdeki durum; Yapılan Çalışmalar) Dr. Vet. Hekim Ramazan UZUN Vet. Hekim İbrahim KÖŞKER Vet. Hekim Ahmet SAFRAN
T.C. SAĞLIK BAKANLIĞI Temel Sağlık Hizmetleri Genel Müdürlüğü BRUSELLOZİS (Dünyadaki ve Ülkemizdeki durum; Yapılan Çalışmalar) Dr. Vet. Hekim Ramazan UZUN Vet. Hekim İbrahim KÖŞKER Vet. Hekim Ahmet SAFRAN
DOMUZ PLEUROPNEUMONİSİ. Dr. Kemal METİNER
 DOMUZ PLEUROPNEUMONİSİ Dr. Kemal METİNER Ekonomik kayıp Solunum güçlüğü Büyüme geriliği Akut formda ölüm ETİYOLOJİ Actinobacillus pleuropneumoniae Gram negatif, kokobasil ETİYOLOJİ Biyotipleri: Biyotip
DOMUZ PLEUROPNEUMONİSİ Dr. Kemal METİNER Ekonomik kayıp Solunum güçlüğü Büyüme geriliği Akut formda ölüm ETİYOLOJİ Actinobacillus pleuropneumoniae Gram negatif, kokobasil ETİYOLOJİ Biyotipleri: Biyotip
TULAREMİ: Epidemiyoloji ve Laboratuvar Tanı
 TULAREMİ: Epidemiyoloji ve Laboratuvar Tanı Prof. Dr. Ülkü ALTOPARLAK Atatürk Üniversitesi Tıp Fakültesi Tıbbi Mikrobiyoloji Anabilim Dalı V. Türkiye Zoonotik Hastalıklar Sempozyumu Bölgede Sorun Olan
TULAREMİ: Epidemiyoloji ve Laboratuvar Tanı Prof. Dr. Ülkü ALTOPARLAK Atatürk Üniversitesi Tıp Fakültesi Tıbbi Mikrobiyoloji Anabilim Dalı V. Türkiye Zoonotik Hastalıklar Sempozyumu Bölgede Sorun Olan
Nocardia Enfeksiyonları. Dr. H.Kaya SÜER Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji
 Nocardia Enfeksiyonları Dr. H.Kaya SÜER Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Nocardia Enfeksiyonları Nocardia insanlarda ve hayvanlarda lokalize veya dissemine enfeksiyonlardan sorumlu olabilen
Nocardia Enfeksiyonları Dr. H.Kaya SÜER Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Nocardia Enfeksiyonları Nocardia insanlarda ve hayvanlarda lokalize veya dissemine enfeksiyonlardan sorumlu olabilen
PERFORMANS SİSTEMİ. Prof. Dr. YAVUZ ÇOŞKUN Gaziantep Üniversitesi
 PERFORMANS SİSTEMİ Prof. Dr. YAVUZ ÇOŞKUN Gaziantep Üniversitesi SAĞLIK SİSTEMİ TANIMI WHO Dünya Sağlık Raporu (2000) de : Sağlık sistemi, birincil amacı sağlığın geliştirilmesi, yeniden tesisi ve sürekliliğinin
PERFORMANS SİSTEMİ Prof. Dr. YAVUZ ÇOŞKUN Gaziantep Üniversitesi SAĞLIK SİSTEMİ TANIMI WHO Dünya Sağlık Raporu (2000) de : Sağlık sistemi, birincil amacı sağlığın geliştirilmesi, yeniden tesisi ve sürekliliğinin
SU ÜRÜNLERİ SAĞLIĞI BÖLÜM BAŞKANLIĞI
 SU ÜRÜNLERİ SAĞLIĞI BÖLÜM BAŞKANLIĞI Hacı SAVAŞ-SÜMAE, Su Ürünleri Sağlığı Bölüm Başkanı Su Ürünleri Sağlığı Bölüm Başkanlığı enstitümüz bünyesinde faaliyet gösteren bölümlerden birisidir. 2000 yılı başından
SU ÜRÜNLERİ SAĞLIĞI BÖLÜM BAŞKANLIĞI Hacı SAVAŞ-SÜMAE, Su Ürünleri Sağlığı Bölüm Başkanı Su Ürünleri Sağlığı Bölüm Başkanlığı enstitümüz bünyesinde faaliyet gösteren bölümlerden birisidir. 2000 yılı başından
Brusellozda laboratuvar tanı yöntemleri 14.02.2006 1
 Brusellozda laboratuvar tanı yöntemleri 14.02.2006 1 Spesifik tanı yöntemleri: 1. Direk (kült ltür r ve bakterinin gösterilmesi) g 2. Antikorların n gösterilmesig 1.Standart tüp aglütinasyonu 2.Rose Bengal
Brusellozda laboratuvar tanı yöntemleri 14.02.2006 1 Spesifik tanı yöntemleri: 1. Direk (kült ltür r ve bakterinin gösterilmesi) g 2. Antikorların n gösterilmesig 1.Standart tüp aglütinasyonu 2.Rose Bengal
ETKEN BELİRLEMEDE KLASİK YÖNTEMLER, MOLEKÜLER YÖNTEMLER. Doç. Dr. Gönül ŞENGÖZ 9 Mayıs 2014
 ETKEN BELİRLEMEDE KLASİK YÖNTEMLER, MOLEKÜLER YÖNTEMLER Doç. Dr. Gönül ŞENGÖZ 9 Mayıs 2014 DM ve diyabetik ayak «1960 yılından sonra doğan her iki kadından biri 100 yaşını görecektir.» Age and Ageing Toplumda
ETKEN BELİRLEMEDE KLASİK YÖNTEMLER, MOLEKÜLER YÖNTEMLER Doç. Dr. Gönül ŞENGÖZ 9 Mayıs 2014 DM ve diyabetik ayak «1960 yılından sonra doğan her iki kadından biri 100 yaşını görecektir.» Age and Ageing Toplumda
B. garinii B. afzelii B. valaisiana B. japonica. B. tanukii. B. sinica B. andersonii B. bissettii
 LYME HASTALIĞI ETKEN ve İZOLASYON Doç. Dr. J. Sedef GÖÇMEN KÜTF Mikrobiyoloji ve Klinik Mikrobiyoloji Anabilim Dalı Kırıkkale - 2006 Spirochaetales takımı Leptospiraceae ve Spirochaetaceae ailesi Spirochaetaceae
LYME HASTALIĞI ETKEN ve İZOLASYON Doç. Dr. J. Sedef GÖÇMEN KÜTF Mikrobiyoloji ve Klinik Mikrobiyoloji Anabilim Dalı Kırıkkale - 2006 Spirochaetales takımı Leptospiraceae ve Spirochaetaceae ailesi Spirochaetaceae
Sıtma ve Ülkemizdeki Son Durumu Doç.Dr. Özlem MİMAN
 Sıtma ve Ülkemizdeki Son Durumu Doç.Dr. Özlem MİMAN Dokuz Eylül Üniversitesi Tıp Fakültesi Parazitoloji AD, İzmir Aralık 2017 Sıtma İnsanlık tarihi kadar eski bilinen bir hastalık. Plasmodium cinsi kan
Sıtma ve Ülkemizdeki Son Durumu Doç.Dr. Özlem MİMAN Dokuz Eylül Üniversitesi Tıp Fakültesi Parazitoloji AD, İzmir Aralık 2017 Sıtma İnsanlık tarihi kadar eski bilinen bir hastalık. Plasmodium cinsi kan
T.C TARIM VE ORMAN BAKANLIĞI PENDİK VETERİNER KONTROL ENSTİTÜSÜ MÜDÜRLÜĞÜ İSTANBUL
 T.C TARIM VE ORMAN BAKANLIĞI PENDİK VETERİNER KONTROL ENSTİTÜSÜ MÜDÜRLÜĞÜ İSTANBUL Emin Ayhan Baklan Veteriner Hekim Brusella Referans ve Aşı ÜreBm Laboratuvarı 1 Giriş Bruselloz, hem insan hem de hayvan
T.C TARIM VE ORMAN BAKANLIĞI PENDİK VETERİNER KONTROL ENSTİTÜSÜ MÜDÜRLÜĞÜ İSTANBUL Emin Ayhan Baklan Veteriner Hekim Brusella Referans ve Aşı ÜreBm Laboratuvarı 1 Giriş Bruselloz, hem insan hem de hayvan
Akreditasyon Sertifikası Eki (Sayfa 1/11) Akreditasyon Kapsamı
 Akreditasyon Sertifikası Eki (Sayfa 1/11) Tıbbi Laboratuar Adresi :Sağlık Mahallesi Saygun Caddesi No:55 Sıhhiye 06100 ANKARA / TÜRKİYE Tel : 0 312 565 53 62 Faks : 0 312 565 54 55 E-Posta : mikrobiyolojirldb@thsk.gov.tr
Akreditasyon Sertifikası Eki (Sayfa 1/11) Tıbbi Laboratuar Adresi :Sağlık Mahallesi Saygun Caddesi No:55 Sıhhiye 06100 ANKARA / TÜRKİYE Tel : 0 312 565 53 62 Faks : 0 312 565 54 55 E-Posta : mikrobiyolojirldb@thsk.gov.tr
Uluslararası Pencereden Enfeksiyon Kontrolü
 Uluslararası Pencereden Enfeksiyon Kontrolü Klinik Mikrobiyoloji Uzmanı Gözüyle Enfeksiyon Kontrol Yönetmeliği Dr. Şöhret Aydemir Amerika da 1950 li yıllarda enfeksiyon kontrolünün önemi anlaşılmaya başlanmış
Uluslararası Pencereden Enfeksiyon Kontrolü Klinik Mikrobiyoloji Uzmanı Gözüyle Enfeksiyon Kontrol Yönetmeliği Dr. Şöhret Aydemir Amerika da 1950 li yıllarda enfeksiyon kontrolünün önemi anlaşılmaya başlanmış
Enzimlerinin Saptanmasında
 Gram Negatif Bakterilerde Karbapenemaz Enzimlerinin Saptanmasında OXA-48 K-Se T, Blue-Carba Test ve PCR Testlerinin Etkinliğinin Karşılaştırılması Ayham Abulaila, Fatma Erdem, Zerrin Aktaş, Oral Öncül
Gram Negatif Bakterilerde Karbapenemaz Enzimlerinin Saptanmasında OXA-48 K-Se T, Blue-Carba Test ve PCR Testlerinin Etkinliğinin Karşılaştırılması Ayham Abulaila, Fatma Erdem, Zerrin Aktaş, Oral Öncül
HASTANE ENFEKSİYONLARI KAÇINILMAZDIR. SADECE BİR KISMI ÖNLENEBİLİR.
 Hastalar hastaneye başvurduktan sonra gelişen ve başvuru anında inkübasyon döneminde olmayan veya hastanede gelişmesine rağmen bazen taburcu olduktan sonra ortaya çıkabilen infeksiyonlar Genellikle hastaneye
Hastalar hastaneye başvurduktan sonra gelişen ve başvuru anında inkübasyon döneminde olmayan veya hastanede gelişmesine rağmen bazen taburcu olduktan sonra ortaya çıkabilen infeksiyonlar Genellikle hastaneye
Hollanda da Avian Influenza nın İzleme (Monitoring) ve Sürveyansı. Ruth Bouwstra DVM PhD GD Animal Health
 Hollanda da Avian Influenza nın İzleme (Monitoring) ve Sürveyansı Ruth Bouwstra DVM PhD GD Animal Health Hollanda Hollanda; küçük bir ülke İhracatçı ülke: ürünler Tarımsal gıda endüstrisinden ihraç edilen
Hollanda da Avian Influenza nın İzleme (Monitoring) ve Sürveyansı Ruth Bouwstra DVM PhD GD Animal Health Hollanda Hollanda; küçük bir ülke İhracatçı ülke: ürünler Tarımsal gıda endüstrisinden ihraç edilen
Moleküler Yöntemlerin Klinik Mikrobiyolojide Kullanımı Ne zaman? Nerede? Ne kadar? Klinik Parazitoloji
 Moleküler Yöntemlerin Klinik Mikrobiyolojide Kullanımı Ne zaman? Nerede? Ne kadar? Klinik Parazitoloji Metin Korkmaz Ege Üniversitesi Tıp Fakültesi Tıbbi Parazitoloji AD İnsandaki Paraziter Hastalıkların
Moleküler Yöntemlerin Klinik Mikrobiyolojide Kullanımı Ne zaman? Nerede? Ne kadar? Klinik Parazitoloji Metin Korkmaz Ege Üniversitesi Tıp Fakültesi Tıbbi Parazitoloji AD İnsandaki Paraziter Hastalıkların
Hastane Ortamında Klinik Mikrobiyoloji «KÜLTÜRÜ»
 Antimikrobial Farkındalık Simpozyumu Hastane Ortamında Klinik Mikrobiyoloji «KÜLTÜRÜ» Dr Gökhan AYGÜN Cerrahpaşa Tıp Fakültesi Tıbbi Mikrobiyoloji AD Kültür Tarihsel, toplumsal gelişme süreci içinde yaratılan
Antimikrobial Farkındalık Simpozyumu Hastane Ortamında Klinik Mikrobiyoloji «KÜLTÜRÜ» Dr Gökhan AYGÜN Cerrahpaşa Tıp Fakültesi Tıbbi Mikrobiyoloji AD Kültür Tarihsel, toplumsal gelişme süreci içinde yaratılan
ULUSAL PNÖMOKONYOZ ÖNLEME EYLEM PLANI
 ULUSAL PNÖMOKONYOZ ÖNLEME EYLEM PLANI 1. Sorunun öneminin saptanması Pnömokonyoz ülkemizde en sık görülen mesleki akciğer hastalıklarından biri olup, önlenebilir meslek hastalıklarının başında gelmektedir.
ULUSAL PNÖMOKONYOZ ÖNLEME EYLEM PLANI 1. Sorunun öneminin saptanması Pnömokonyoz ülkemizde en sık görülen mesleki akciğer hastalıklarından biri olup, önlenebilir meslek hastalıklarının başında gelmektedir.
Isırıkla İlgili Literatür İncelemesi
 Isırıkla İlgili Literatür İncelemesi Prof. Dr. Tuna DEMİRDAL İzmir Katip Çelebi Üniversitesi Tıp Fakültesi Enfeksiyon Hastalıkları AD, SB Atatürk Eğitim Araştırma Hastanesi Enfeksiyon Kliniği, İzmir Avcılarda
Isırıkla İlgili Literatür İncelemesi Prof. Dr. Tuna DEMİRDAL İzmir Katip Çelebi Üniversitesi Tıp Fakültesi Enfeksiyon Hastalıkları AD, SB Atatürk Eğitim Araştırma Hastanesi Enfeksiyon Kliniği, İzmir Avcılarda
Halis Akalın, Nesrin Kebabcı, Bekir Çelebi, Selçuk Kılıç, Mustafa Vural, Ülkü Tırpan, Sibel Yorulmaz Göktaş, Melda Sınırtaş, Güher Göral
 Halis Akalın, Nesrin Kebabcı, Bekir Çelebi, Selçuk Kılıç, Mustafa Vural, Ülkü Tırpan, Sibel Yorulmaz Göktaş, Melda Sınırtaş, Güher Göral Uludağ Üniversitesi Tıp Fakültesi Enfeksiyon Hastalıkları ve Klinik
Halis Akalın, Nesrin Kebabcı, Bekir Çelebi, Selçuk Kılıç, Mustafa Vural, Ülkü Tırpan, Sibel Yorulmaz Göktaş, Melda Sınırtaş, Güher Göral Uludağ Üniversitesi Tıp Fakültesi Enfeksiyon Hastalıkları ve Klinik
Cerrahpaşa Tıp Fakültesi Tıbbi Mikrobiyoloji Anabilim Dalı. Cerrahpaşa Tıp Fakültesi Enfeksiyon Hastalıkları Anabilim Dalı
 Hematoloji ve Kemik İliği Transplantasyon Hastalarında Rektal Kolonizasyon ve Bakteriyemi İlişkisinin Araştırılması Asiye Karakullukçu 1, Mehtap Biçer 2, Gökhan Aygün 1 Şeniz Öngören 3, Cem Ar 3, Elvin
Hematoloji ve Kemik İliği Transplantasyon Hastalarında Rektal Kolonizasyon ve Bakteriyemi İlişkisinin Araştırılması Asiye Karakullukçu 1, Mehtap Biçer 2, Gökhan Aygün 1 Şeniz Öngören 3, Cem Ar 3, Elvin
HIV TANISINDA YENİLİKLER
 HIV/AIDS KURSU HIV TANISINDA YENİLİKLER Dr. Mert Ahmet KUŞKUCU İ.Ü. Cerrahpaşa Tıp Fakültesi Tıbbi Mikrobiyoloji Anabilim Dalı Dünya Sağlık Örgütü Verileri (2016) YILLARA GÖRE HIV (+) SAPTANAN VAKA SAYISI
HIV/AIDS KURSU HIV TANISINDA YENİLİKLER Dr. Mert Ahmet KUŞKUCU İ.Ü. Cerrahpaşa Tıp Fakültesi Tıbbi Mikrobiyoloji Anabilim Dalı Dünya Sağlık Örgütü Verileri (2016) YILLARA GÖRE HIV (+) SAPTANAN VAKA SAYISI
T.C. SAĞLIK BAKANLIĞI Temel Sağlık Hizmetleri Genel Müdürlüğü GENELGE 2006/ 23
 B100TSH0110001 Bulaşıcı Hastalıklarla Mücadele 17.02.2006 / 1808 GENELGE 2006/ 23 Ülkemizin içinde bulunduğu coğrafik yapı, alt yapı eksikliklerinden kaynaklanan problemler ve genel hijyen uygulamalarındaki
B100TSH0110001 Bulaşıcı Hastalıklarla Mücadele 17.02.2006 / 1808 GENELGE 2006/ 23 Ülkemizin içinde bulunduğu coğrafik yapı, alt yapı eksikliklerinden kaynaklanan problemler ve genel hijyen uygulamalarındaki
TLERDE SEROLOJİK/MOLEK HANGİ İNCELEME?) SAPTANMASI
 * VİRAL V HEPATİTLERDE TLERDE SEROLOJİK/MOLEK K/MOLEKÜLER LER TESTLER (NE ZAMANHANG HANGİ İNCELEME?) *VİRAL HEPATİTLERDE TLERDE İLAÇ DİRENCİNİN SAPTANMASI *DİAL ALİZ Z HASTALARININ HEPATİT T AÇISINDAN
* VİRAL V HEPATİTLERDE TLERDE SEROLOJİK/MOLEK K/MOLEKÜLER LER TESTLER (NE ZAMANHANG HANGİ İNCELEME?) *VİRAL HEPATİTLERDE TLERDE İLAÇ DİRENCİNİN SAPTANMASI *DİAL ALİZ Z HASTALARININ HEPATİT T AÇISINDAN
Emrah Salman, Zeynep Ceren Karahan Ankara Üniversitesi Tıp Fakültesi. Tıbbi Mikrobiyoloji Anabilim Dalı
 Emrah Salman, Zeynep Ceren Karahan Ankara Üniversitesi Tıp Fakültesi Tıbbi Mikrobiyoloji Anabilim Dalı Antibiyotik kullanımına bağlı ishal etkeni olan Clostridium difficile, nozokomiyal diyarenin en sık
Emrah Salman, Zeynep Ceren Karahan Ankara Üniversitesi Tıp Fakültesi Tıbbi Mikrobiyoloji Anabilim Dalı Antibiyotik kullanımına bağlı ishal etkeni olan Clostridium difficile, nozokomiyal diyarenin en sık
BİRİNCİ BASAMAK TEDAVİLERİNDE AMOKSİSİLİN/KLAVULANAT İÇİN MALİYET ANALİZİ
 BİRİNCİ BASAMAK TEDAVİLERİNDE AMOKSİSİLİN/KLAVULANAT İÇİN MALİYET ANALİZİ TOPLUM KÖKENLİ PNÖMONİ ve KRONİK BRONŞİT ALEVLENMESİ, AKUT BAKTERİ RİNOSİNÜZİTİ, ORTA KULAK İLTİHABI VE TONSİL VE BOĞAZ ENFEKSİYONU
BİRİNCİ BASAMAK TEDAVİLERİNDE AMOKSİSİLİN/KLAVULANAT İÇİN MALİYET ANALİZİ TOPLUM KÖKENLİ PNÖMONİ ve KRONİK BRONŞİT ALEVLENMESİ, AKUT BAKTERİ RİNOSİNÜZİTİ, ORTA KULAK İLTİHABI VE TONSİL VE BOĞAZ ENFEKSİYONU
Doç.Dr. V. Soydal ATASEVEN
 Doç.Dr. V. Soydal ATASEVEN Mustafa Kemal Üniversitesi Veteriner Fakültesi Viroloji Anabilim Dalı, Hatay Sığırların Nodüler Ekzantemi - Afrika Hastalığı (LSD) Sığırların Üç Gün Hastalığı (Bovine Ephemeral
Doç.Dr. V. Soydal ATASEVEN Mustafa Kemal Üniversitesi Veteriner Fakültesi Viroloji Anabilim Dalı, Hatay Sığırların Nodüler Ekzantemi - Afrika Hastalığı (LSD) Sığırların Üç Gün Hastalığı (Bovine Ephemeral
