ÜNİTE 11. Asitler ve Bazlar. Amaçlar. İçindekiler. Öneriler
|
|
|
- Kelebek Kaymak
- 9 yıl önce
- İzleme sayısı:
Transkript
1 ÜNİTE 11 Asitler ve Bazlar Amaçlar Bu üniteyi çalıştıktan sonra, Asit ve baz kavramlarını bilecek, Zayıf asit, zayıf baz, kuvvetli asit, kuvvetli baz kavramlarını tanıyacak, Titrasyon ve ph kavramlarını öğreneceksiniz. İçindekiler Asit ve Baz Nedir? Asit ve Bazların Tanımlanması Asit ve Bazların Kuvveti Nötralizasyon Reaksiyonu Asitlerin ve Bazların Derişimlerinin Ölçülmesi Titrasyon Tampon Çözeltiler Özet Değerlendirme Soruları Öneriler Bu üniteyi kavrayabilmek için logaritma konusunda bilginiz olması gerekir. Üniteyi çalışırken tüm formül ve reaksiyonları en az bir kere de siz yazınız. Periyodik cetveli her zaman yanınızda bulundurun.
2 1. ASİT VE BAZ NEDİR? Asit ve bazlar canlı organizmalarda önemli işlevleri olan maddelerdir. Asitlerin ve bazların çoğu oldukça tehlikeli ve tahrip edici maddelerdir; bunlar proteini çözerek dokuyu tahrip ederler. Örneğin, derişik sülfürik asit kuvvetli bir asittir, suyu tutma özelliğine sahiptir. Eğer sülfürik asit canlı bir dokunun üzerine dökülürse çok kısa süre içinde o doku tahrip olur. Derişik bazlar da hücre duvarlarının (zar) yapımında rol alan yağlar ile reaksiyona girerek bu zarları asitlerden daha çok tahrip ederler. Örneğin, çamaşır yıkamada kullanılan bazı tür sabunlar ve deterjanlar baz içerirler. Yün ve ipek içeren elbiseler bu tür sabun ve deterjan ile yıkandıkları zaman, temizlik maddesinin içindeki bazlar yün ve ipek liflerinin kısalmasına ve kısmen de olsa çözülmelerine sebep olacaktır. Asitler suda çözündükleri zaman elektriği ileten çözeltiler elde ederiz. Asitler çinko, magnezyum gibi elementler ile reaksiyona girerek reaksiyon sonunda hidrojen gazı çıkmasına neden olurlar. Asitlerin tadı ekşidir ve mavi turnusol kağıdını kırmızıya çevirirler. Bazlar da suda çözündükleri zaman elektriği ileten çözeltiler oluştururlar. Bazların tadları acıdır ve ellendikleri zaman kayganlık hissi verir. Bazlar kırmızı turnusol kağıdını maviye çevirirler. Bazlar asitler ile reaksiyona girerek birbirlerinin özelliklerini nötralize ederler. Örneğin, mide hastalıkları ile ilgili ilaçlar bir baz olan bikarbonat (HCO - 3 ) içerirler. Bu baz midede bulunan hidroklorik asiti nötralize ederek kişiye rahatlama hissi verir. Çizelge Günlük Hayatımızdaki Bazı Bazlar ve Asitler. Asitler Formülü Yer Hidroklorik asit HCl Mide özsuyu Sitrik asit C 6 H 8 O 7 Limon suyu Fosforik asit H 3 PO 4 Coca-Cola gibi içkiler Asetik asit CH 3 COOH Sirke Karbonik asit H 2 CO 3 Gazoz Tartarik asit C 4 H 6 O 6 Şarap Bazlar Formülü Kullanım Yeri Amonyak NH 3 Gübre yapımı Sodyum hidroksit NaOH Sabun yapımı Sodyum bikorbonat NaHCO 3 Cam yapımı, gübre yapımı
3 2. ASİT VE BAZLARIN TANIMLANMALARI Günümüze kadar asitliğin ve bazlığın tanımı çok değişik şekillerde yapılmıştır. İlk modern tanım İsveç'li bilim adamı Svonte ARHENİUS tarafından 1884 yılında aşağıdaki şekilde yapılmıştır. Sudaki çözeltilerine H + iyonu veren maddelere "asit" denir. Aynı şekilde, Sudaki çözeltilerine OH - iyonu veren maddelere "baz" denir. Örneğin, hidroklorik asit (HCl) ve sodyum hidroksit (NaOH) için aşağıdaki eşitlikler yazılabilir. H 2 O HCl H + + Cl - H 2 O NaOH OH - + Na + İkinci bir tanımlama ise Danimarka'lı kimyacı J.N. BRØNSTED ve İngiliz kimyacı T.M. LOWRY tarafından 1923 yılında yapılmıştır. Buna göre, Bir proton verebilen maddelere "asit", bir proton alabilen maddelere "baz" denir. Bu tanımlamayla daha önceleri asit veya baz olarak düşünülmeyen birçok madde asit ve baz grubuna alınmıştır. Örneğin, bor triflorür bir asit gibi davranarak trimetilamin'deki azot üzerindeki bir çift elektronu kabul ederek bir kompleks oluşturur. F 3 B + : NMe 3 F 3 B - N + Me 3 Asit Baz
4 3. ASİT VE BAZLARIN KUVVETİ Suyun iyonlaşmasına ilişkin eşitliği, anlaşılması daha kolay olsun diye aşağıdaki şekilde yazarız: H 2 O H + + OH - Su Hidrojen Hidroksit iyonu iyonu (Baz) (Proton) Sulu çözeltilerden bahsettiğimiz zaman "proton" veya "hidrojen iyonu" terimini kullanırız. Fakat, gerçekde hidrojen iyonları su içinde hiçbir zaman tek başlarına bulunamaz. Bunlar her zaman hidronyum iyonu (H 3 O + ) denilen bir yapı içinde bulunurlar. H 2 O + H 2 O H 3 O + + OH - Hidronyum iyonu (Asit) Hidroksit iyonu (Baz) Hidronyum iyonları bir molekül suya ait hidrojen iyonunun (H + ) bir diğer su molekülüne aktarılması ile oluşan yapılardır. Asitleri proton veren maddeler olarak tanımlamıştık. Ancak farklı asitlerin proton verme yatkınlıkları farklıdır. İşte bu farklılık kuvvetli asit, kuvvetli baz, zayıf asit ve zayıf baz kavramlarının ortaya çıkmasına neden olur. Derişimleri aynı olan farklı asitlerin güçleri aynı değildir. Çözeltilerde tamamen iyonlaşarak tüm protonlarını veren asitlere "kuvvetli asit" denir. Çözeltilerde kısmen iyonlaşarak protonlarının bir kısmını veren asitlere de "zayıf asitler" denir. Kuvvetli bir asit çözeltisini suya ilave ettiğimiz zaman hidronyum iyonlarının derişiminde büyük bir artış olur. Örneğin, nitrik asit (HNO 3 ) kuvvetli bir asittir. 0,1 Molar HNO 3 içinde nitrik asit moleküllerinin % 92 'si iyonlaşarak hidronyum ve nitrat iyonu oluştururlar
5 HNO 3 + H 2 O H 3 O + + NO 3 - Nitrik asit Baz Asit Nitrat iyonu Hidroklorik asit (HCl), hidrobromik asit (HBr), hidroiyodik asit ve sülfürik asit (H 2 SO 4 ) diğer kuvvetli asitlere örnektir. Bir zayıf asitin suya ilavesi hidronyum iyonlarının derişimini çok az artırır. Örneğin, zayıf bir asit olan asetik asitin 0.1 molar çözeltisinde asetik asit moleküllerinin ancak % 1,3 'ü iyonlarına ayrışarak hidronyum ve asetat iyonlarını oluşturur. CH 3 COOH + H 2 O H 3 O + + CH 3 COO - Asetik asit Baz Asit Asetat iyonu Nitroz asit (HNO 2 ), karbonik asit (H 2 CO 3 ), borik asit (H 3 BO 3 ) zayıf asitlere örnektir. Çizelge Bazı Konjuge Asit-Baz Çiftlerinin Bağıl Kuvvetleri. Konjuge asit Formül Konjuge baz Adı Adı Formül Florosülfonik asit FSO 3 H Sülfürik asit H 2 SO 4 Hidroklorik asit HCl Nitrik asit HNO 3 Hidronyum iyonu H 3 O + Sulfuroz asit H 2 SO 3 Hidrojen sülfat iyonu HSO - 4 Fosforik asit H 3 PO 4 Nitroz asit HNO 2 Asetik asit CH 3 COOH Karbonik asit H 2 CO 3 Hidrojen sülfit iyonu HSO - 3 Dihidrojen fosfat iyonu H 2 PO - 4 Amonyum iyonu NH + 4 Hidrojen karbonat HCO - 3 Hidrojen fosfat iyonu HPO -2 4 Su H 2 O Amonyak NH 3 Florosulfonat FSO - 3 Hidrojen Sülfat iyonu HSO - 4 Klorür iyonu Nitrat iyonu Cl - NO - 3 Su H 2 O Hidrojen sülfit iyonu HSO - 3 Sülfat iyonu SO Dihidrojen fosfat iyonu H 2 PO - 4 Nitrit iyonu NO - 2 Asetat iyonu CH 3 COO - Bikarbonat iyonu HCO - 3 Sülfit iyonu SO Hidrojen fosfat iyonu HPO Amonyak NH 3 Karbonat iyonu CO Fosfat iyonu PO Hidroksit Amid iyonu OH - NH
6 ? Konjuge asit ve konjuge baz nedir? Bir baz bir asitin protonunu kaybetmesiyle oluşuyor ise bu baza "konjuge baz" denir. Örneğin tüm protik asitleri HA ile simgelersek Asit H + + Konjuge baz HA H + + A - Asit Konjuge baz H 2 O CH 3 COOH H + + CH 3 COO - Asit Konjuge baz Asetat iyonu (CH 3 COO - ) asetik asitin (CH 3 COOH) konjuge bazıdır. Aynı şekilde, Bir asit bir bazın bir proton kazanmasıyla oluşuyor ise bu asite "konjuge asit" denir. Örneğin, Baz + H + Konjuge asit B + H + BH + Baz Konjuge asit NH 3 + H 2 O Baz NH OH - Konjuge asit Bir baz olan amonyak (NH 3 ) bir proton kazanarak amonyum iyonu (NH 4+ ) oluşturur. Amonyum iyonu fazladan gelen protonu (H + ) daha sonra vererek bir asit gibi davranır. Kısaca, NH + 4 iyonu NH 3 'ün konjuge asitidir
7 Kısaca, bir asit ile bir baz arasındaki fark bir protondan (H + ) dolayı oluşuyor ise bunlara "konjuge asit-baz çifti" denir. Bir asit ne denli zayıfsa, konjuge baz o denli kuvvetli olur. Aksine bir baz ne denli kuvvetli ise, konjuge asiti o denli zayıf olur. Benzer şekilde, kuvvetli bir baz proton kapmaya çok eğilimlidir. Zayıf bir baz ise protonları çok az bir yüzdesi ile kabul eder. Örneğin, hidroksit iyonu (OH - ) kuvvetli bir bazdır ve protonlar ile derhal reaksiyona girer. Halbuki amonyak (NH 3 ) zayıf bir bazdır ve hidroksit iyonuna kıyasla protonlara karşı ilgisi daha azdır. Çizelge 11.2 'i incelerken dikkat edeceğimiz en önemli konu, asitlerin formüllerindeki hidrojen sayısı ile bu asitlerin asitlik kuvvetleri arasında bir ilişkinin olmayışıdır. Örneğin, hidroklorik asit (HCl) fosforik asite (H 3 PO 4 ) kıyasla çok kuvvetli bir asittir. Çizelge 11.2 'den de anlaşılacağı üzere tüm maddelerin bir asitlik ve bazlık kuvveti vardır. Tüm maddeleri bir skala içine sokabiliriz. Maddelerin asit veya baz olarak hareket etmeleri ve dolayısıyla asit veya baz olarak adlandırılmaları, birbirine göre göreceli olan asitlik veya bazlık kuvvetleri ile ilişkilidir. Örneğin, su bileşiğini ele alalım, su, asitliği kendinden fazla bir madde olan hidroklorik asit (HCl) ile karşı karşıya geldiği zaman bir baz gibi davranır. Buna karşılık aynı su bileşiği asitliği kendinden daha düşük olan amonyak (NH 3 ) ile karşı karşıya geldiği zaman bir asit gibi davranır. H 2 O + HCl H 3 O + + Cl - Baz Asit Asit Baz H 2 O + NH 3 NH OH - Asit Baz Asit Baz
8 4. NÖTRALİZASYON REAKSİYONU Asitler bazlar ile reaksiyonu girdiği zaman suyun ve bu su içinde çözünmüş iyonik bir bileşik meydana getirirler. Bu iyonik bileşiğe genellikle "tuz" adını veririz. Örneğin, HCl + NaOH H 2 O + NaCl Asit Baz Su Tuz Eğer eş miktarda hidronyum iyonları ve hidroksit iyonları reaksiyona girerse, meydana gelecek çözelti ne asidik ne de bazik özellikler gösterecektir. Bu tür özelliğe "nötrallik" denir. Bundan dolayı nötralizasyon reaksiyonları asidik veya bazik çözeltilerin nötral bir çözeltiye dönüştüğü reaksiyonlardır. Örneğin, hidroklorik asit ve sodyum hidroksit arasındaki reaksiyon gerçekte bunların sudaki iyonları arasında oluşur. Tüm reaksiyon eşitliği aşağıdaki şekilde yazılabiliriz. H + + Cl - + Na + + OH - H 2 O + Na + + Cl - Net iyonik eşitlik ise şöyle olur. H + + OH - H 2 O 5. ASİTLERİN VE BAZLARIN DERİŞİMİNİN ÖLÇÜLMESİ 5.1. ph Skalası Canlı organizmalar içindeki veya bir bilimsel araştırmada hidrojen iyonu (H + ) derişimindeki çok ufak değişikler çok önemli sonuçlar ortaya çıkarabilir. Bundan dolayı, bilim adamları sürekli olarak hidrojen iyonu derişimi ile ilgilenmişler ve bunu ölçme teknikleri geliştirmişlerdir. İsveç'li kimyacı Sorensen 1909 yılında hidrojen iyonu derişimini ölçmek için "ph skalası" denen bir yöntem geliştirilmiştir. Buna göre, hidrojen iyonu derişimi matematiksel olarak şöyle ifade edilmiştir. [H + ] = 1 x 10 -ph mol / lt veya ph = -log [H + ]
9 Bir çözeltinin ph 'si bu çözeltinin hidrojen iyonu [H + ] derişiminin eksi (-) logaritmasına eşittir. ph Skalasını logaritmik olarak ifade etmemizin sebebi, çok küçük rakamlar ile ifade edilen [H + ] iyonu derişimini tam sayılarla ifade etmek içindir. Örneğin, hidrojen iyon derişimi 1 x 10-5 mol/lt olan bir çözeltinin ph değeri 5' dir. Oda sıcaklığında saf suyun hidrojen iyonu [H + ] derişimi 1 x 10-7 mol / lt dir. Bundan dolayı saf suyun ph değeri 7 dir. Saf suda [H + ] = [OH - ] = 10-7 mol / lt dir. Bir çözeltinin ph değeri 0-7 arasında ise çözelti asidik Bir çözeltinin ph değeri 7-14 arasında ise çözelti bazik Bir çözeltinin ph değeri 7 ise çözelti nötürdür. ph artan asitlik artan baziklik [H + [OH - ] Şekil 11.1 ph Skalası
10 Çizelge Hidrojen ve Hidroksit İyonlarının ph Skalası ve Bunlara Karşılık Gelen Derişimler. H + (mol / lt) ph [OH - ] (mol / lt) 10 0 = = = Asidik 10-3 = = = = Nötral 10-7 = = = = Bazik = = = = = 1 Çizelge Günlük Hayatımızdaki Bazı Maddelerin ph Değerleri. Çözelti ph Hidroklorik asit (0,1 M)... 1 Mide suyu Sitrik asit (limon suyu) Asetik asit (Sirke) Karbonik asit (Gazoz) Domates suyu Kahve İdrar Yağmur suyu Süt Saf su Tükürük Kan Magnezyum hidroksit (Ülser ilacı)
11 5.2. ph Değerinin Ölçülmesi Bir çözeltinin ph değeri biyolojik moleküllerin aktivitesini etkilediğinden dolayı laboratuarlarda ph değerinin ölçümü büyük önem kazanır. Örneğin, bakteriler ancak dar bir ph aralığında çok iyi büyürler. Bundan dolayı, kültürün ph 'sı çok dikkatli şekilde ayarlanmalıdır. Biyolojik katalizör olan enzimler, en iyi şekilde ph 1 - ph 4 aralığında çalışırlar. Midede bulunan pepsin enzimi için bu değer 8-9 dur. Laboratuarlarda bir çözeltinin ph değeri ph metre denilen aygıtlar veya kolorimetrik indikatörler ile yapılır. Kolorimetrik yöntemde, asit-baz indikatörleri denilen belli hidrojen iyon derişimleriyle renkleri değişen kimyasal boyalar kullanılır (Çizelge 11.5) Örneğin, nitrazin boyası içeren kağıt ph 4,5 de sarı, ph 7,5 de mavidir. Bu tür özel kağıtlar hastanelerde idrarın ph'sını ölçmede çok kullanılır. Asidik idrar, kağıdı sarıya çevirerek ortada ciddi bir rahatsızlığın olduğunu gösterir. Çizelge 11.5 Farklı ph Değerlerinde Bazı Asit-Baz İndikatörlerin Renkleri Metil oranj Kırmızı Geçiş Sarı Geçiş Metil kırmızı Kırmızı Sarı Geçiş Turnusol kağıdı Kırmızı Mavi Geçiş Fenol ftalein Renksiz Kırmızı Çizelge 11.5'de görüldüğü gibi metil oranj indikatörü ph'nin dörtten yüksek olduğu çözeltilerde sarı, düşük olduğu çözeltilerde ise kırmızıdır. Benzer şekilde fenol ftalein indikatörü ph 'nin 8 'den düşük olduğu çözeltilerde renksiz, ph 'nin 10 'dan yüksek olduğu çözeltilerde kırmızıdır. 6. TİTRASYON Asit ve bazların bir çözeltideki derişimlerini ölçmek için "titrasyon" denen işlemden yararlanılır. Titrasyonda nötralizasyon reaksiyonunu kullanırız. Titrasyon işleminde, derişimi bilinen asit veya baz çözeltisi "büret" denen bir cam düzenekten derişimi bilinmeyen asit veya baz çözeltisine nötralizasyon tamamlanana kadar yavaş yavaş ilave edilir. Nötrolizasyon işleminin bitişi ise, bir ph metre veya bir asit-baz indikatörü ile gözlenebilir
12 Büret Derişimi bilinen asit veya baz çözeltisi Erlen Derişimi bilinmeyen asit veya baz Şekil 11.2 Titrasyon Düzeneği. Titrasyon kandaki alkaliliği veya midedeki asitliği veya idrardaki asitliği ölçmek için kullanılır. 7. TAMPON ÇÖZELTİLER Bir asit çözeltisine yeterli miktarda baz ilave edildiğinde veya benzer şekilde bir baz çözeltisine yeterli miktarda asit ilave edildiğinde oluşan çözeltilerin nötür özellikte (ph = 7) olduklarını belirttik. Ancak tampon çözeltiler olarak bilinen bazı çözeltilerde durum farklıdır. Tampon çözeltiler hem asit hem de baz ilavelerine karşı oldukça farklı davranırlar ve bu tür çözeltilerde ph değişimi yüksek olmaz. Asit veya baz ilave edildiği zaman çok az ph değişikliği gösteren çözeltilere "tampon" çözeltiler denir. İnsan vücudundaki kan plazmasının ph değeri normal olarak 7,4 civarındadır. Bu ph değeri 7,0 den aşağıya veya 7,8 den yukarı çıkarsa insan sağlığı için tehlikeli sonuçlar ortaya çıkabilir. Bunun gibi laboratuarlarda yapılan çoğu deneylerde kullanılan çözeltilerin kendilerine asit veya baz ilave edildiği zaman ph değerlerinin fazla değişmemesi istenir
13 ? Bu iş nasıl başarılır? Tampon çözeltiler ile bu işlerin üstesinden gelinir. Tampon çözeltiler zayıf bir asit ile bu asitin yeterli miktardaki tuzundan oluşmuşlardır. Örneğin, zayıf bir asit olan asetik asit (CH 3 COOH) ile bu asitin sodyum tuzu olan sodyum asetat (CH 3 COONa) belli oranlarda karıştırıldığında tampon çözelti oluştururlar. Diğer yaygın tampon çözeltiler de şunlardır, H 2 PO 4 - / HPO 4-2, NH 4 + / NH 3. Şayet ph 7 de bir litre 0,15 molar NaCl çözeltisine 1 ml 10 molar hidroklorik asit (HCl) ilave edersek, çözeltinin ph değeri 2 ye düşer. Buna karşılık, bir litre kan plazmasına 1 mol 10 molar HCl ilave edildiği zaman 7.4 olan kan plazmasının ph değeri sadece 7.2'ye düşer (Şekil 10.3). 1 ml 10 molar HCl ph=7 1 lt. 0,15 molar Na Cl ph=2 1 ml 10 molar HCl ph=7,4 1 lt. kan plazması ph=7,2 Şekil Tampon Etkisi.? Kan plazmasındaki ph değeri değişikliğinin bu kadar az olmasının sebebi nedir? Kan plazmasında temel tampon sistem karbonik asit - bikarbonat sistemdir. Aşağıdaki eşitliğe şöyle bir göz atalım. H + H 2 CO 3 H CO H + İlave edilen asit
14 Sisteme kuvvetli bir asit ilavesi H + derişimini arttırarak, reaksiyonun sağdan sola doğru yürümesine sebeb olacaktır. Yani daha fazla karbonik asit (H 2 CO 3 ) oluşacaktır. Karbonik asit kararsız bir madde olduğu için parçalanarak karbon dioksit (CO 2 ) ve suyu (H 2 O) oluşturacaktır. H 2 CO 3 H 2 O + CO 2 Oluşan karbon dioksit vücuttan solunum yoluyla atılır. Bu tampon sistemi tüm karbonat karbon dioksit ve su olarak vücuttan atılıncaya kadar devam eder. Bikarbonat sistemi aynı şekilde sisteme kuvvetli bir baz ilave edildiği zaman sistemin ph 'sının aynı kalmasına yardımcı olur. H 2 CO 3 H CO H + OH - ilave edilen baz İlave edilen baz ortamdaki hidrojen iyonu ile reaksiyona girerek su oluşturur. Azalan hidrojen iyonu derişimi reaksiyonu soldan sağa doğru gitmesine neden olur. Özet Asitler suda çözündükleri zaman elektriği ileten çözeltiler oluşturan bileşiklerdir. Asitler metaller ile reaksiyona girerek hidrojen açığa çıkmasına neden olurlar. Tatları ekşi olup mavi turnusol kağıdını kırmızıya çevirirler. Bazlar da suda çözündükleri zaman elektriği iletirler ve tatları acıdır. Bazlar kırmızı turnusol kağıdını maviye çevirirler. Brønsted- Lowry tanımlamasına göre asit bir proton (H + ) verebilen, baz ise bir proton kabul edebilen maddedir. Kuvvetli asit suda çözündüğü zaman tamamına yakın şekilde iyonize olur. Zayıf bir asit ise kısmen iyonlaşan asittir. Kuvvetli bir bazın protonlara karşı eğilimi zayıf bir baza nazaran daha çoktur. Asitler bazları nötürleştirirler. Eğer baz ve asitler eşdeğer miktarda kullanılıyor ise oluşan reaksiyona "nötralizasyon reaksiyonu" denir. Asit ve bazların bilinmiyen derişimlerini ölçmek için "titrasyon" denilen bir işlem kullanılır
15 Değerlendirme Soruları 1. Aşağıdaki ifadelerden hangisi yanlıştır? A) Asitlerin çözünmesiyle oluşan çözeltiler elektriği iletir. B) Bazların suda çözünmesiyle oluşan çözeltiler elektriği iletir. C) Bazların tadları genellikle acıdır. D) Asitlerin tadları genellikle ekşidir. E) Bazlar mavi turnusal kağıdını kırmızıya çevirir. 2. Aşağıdaki ifadelerden hangisi yanlıştır? A) Sudaki çözeltilerine H + katyonu veren maddelere asit denir. B) Bir proton verebilen maddelere asit denir. C) Bir proton alabilen maddelere baz denir. D) Bazlar sudaki çözeltilerde OH - iyonunu artırırlar. E) Sudaki çözeltilerine H + katyonu veren maddelere baz denir. 3. Aşağıdaki ifadelerden hangisi yanlıştır? A) Derişimleri aynı olan farklı asitlerin güçleri aynı değildir. B) Derişimleri aynı olan farklı bazların güçleri aynı değildir. C) Asitlerin güçleri moleküldeki H sayısı ile ters orantılıdır. D) Tamamen iyonlaşarak tüm protonlarını veren asitlere kuvvetli asit denir. E) Kısmen iyonlaşarak protonlarının bir kısmını veren asitlere zayıf asitler denir. 4. Aşağıdaki ifadede boş kalan yeri verilerden hangisi doğru şekilde tamamlar? Kuvvetli bir asit çözeltisini suya ilave ettiğimizde hidronyum iyonlarının derişiminde.... A) artış olur B) azalma olur C) değişme olmaz
16 5. Nitrik asitin (HNO 3 ) konjuge bazı aşağıdakilerden hangisidir? A) NO 2 - B) NO 2 + C) NO 3 - D)NO 3 + E) NH 3 6. Aşağıdaki reaksiyonda boş kalan yeri doldurunuz. HCl + NH Cl - A) NH 2 - B) NH 2 + C) NH 3 D) NH 4 - E) NH litrede 10-5 mol H + iyonu içeren çözeltinin ph değeri nedir? A) -5 B) 5 C) 9 D) -9 E) 1 8. ph Değeri 3 olan bir çözeltinin hidrojen iyonu [H + ] derişimi nedir? A) [H + ] = 1 x 10-3 mol /lt B) [H + ] = 3 x 10-1 mol /lt C) [H + ] = 3 x 10 1 mol /lt D) [H + ] = 1 x 10 3 mol /lt E) [H + ] = 3 x 10-3 mol /lt
ASİT-BAZ VE ph. MÜHENDİSLİK KİMYASI DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN. Yrd. Doç. Dr. Atilla Evcin Afyonkarahisar Kocatepe Üniversitesi 2006
 ASİT-BAZ VE ph MÜHENDİSLİK KİMYASI DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN Asitler ve bazlar günlük yaşantımızda sıkça karşılaştığımız kavramlardan biridir.insanlar, her nekadar asetil salisilik asit ve
ASİT-BAZ VE ph MÜHENDİSLİK KİMYASI DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN Asitler ve bazlar günlük yaşantımızda sıkça karşılaştığımız kavramlardan biridir.insanlar, her nekadar asetil salisilik asit ve
HACETTEPE ÜNĐVERSĐTESĐ KĐMYA EĞĐTĐMĐ ANABĐLĐM DALI ÖĞRETĐM TEKNĐKLERĐ VE MATERYAL GELĐŞTĐRME ASĐTLER VE BAZLAR KONU ANLATIMI ÇALIŞMA YAPRAĞI
 Asit ve Bazların Tanımı HACETTEPE ÜNĐVERSĐTESĐ KĐMYA EĞĐTĐMĐ ANABĐLĐM DALI ÖĞRETĐM TEKNĐKLERĐ VE MATERYAL GELĐŞTĐRME ASĐTLER VE BAZLAR KONU ANLATIMI ÇALIŞMA YAPRAĞI Hazırlayan: Beyza Ceren ÜNCÜ Asitler
Asit ve Bazların Tanımı HACETTEPE ÜNĐVERSĐTESĐ KĐMYA EĞĐTĐMĐ ANABĐLĐM DALI ÖĞRETĐM TEKNĐKLERĐ VE MATERYAL GELĐŞTĐRME ASĐTLER VE BAZLAR KONU ANLATIMI ÇALIŞMA YAPRAĞI Hazırlayan: Beyza Ceren ÜNCÜ Asitler
KİM-118 TEMEL KİMYA Prof. Dr. Zeliha HAYVALI Ankara Üniversitesi Kimya Bölümü
 KİM-118 TEMEL KİMYA Prof. Dr. Zeliha HAYVALI Ankara Üniversitesi Kimya Bölümü Bu slaytlarda anlatılanlar sadece özet olup ayrıntılı bilgiler ve örnek çözümleri derste verilecektir. BÖLÜM 13 Asitler ve
KİM-118 TEMEL KİMYA Prof. Dr. Zeliha HAYVALI Ankara Üniversitesi Kimya Bölümü Bu slaytlarda anlatılanlar sadece özet olup ayrıntılı bilgiler ve örnek çözümleri derste verilecektir. BÖLÜM 13 Asitler ve
ASİTLER, BAZLAR ve TUZLAR
 ASİTLER, BAZLAR ve TUZLAR 1. ASİTLER Sulu çözeltilerine Hidrojen İyonu veren maddelere asit denir. Ör 1 HCl : Hidroklorik asit HCl H + + Cl - Ör 2 H 2 SO 4 : Sülfürik asit H 2 SO 4 2H + + SO 4-2 Ör 3 Nitrik
ASİTLER, BAZLAR ve TUZLAR 1. ASİTLER Sulu çözeltilerine Hidrojen İyonu veren maddelere asit denir. Ör 1 HCl : Hidroklorik asit HCl H + + Cl - Ör 2 H 2 SO 4 : Sülfürik asit H 2 SO 4 2H + + SO 4-2 Ör 3 Nitrik
ASİTLER VE BAZLAR ASİT VE BAZ KAVRAMLARI
 ASİTLER VE BAZLAR ASİT VE BAZ KAVRAMLARI Prof. Dr. Mustafa DEMİR M.DEMİR 0ASİT VE BAZ KAVRAMLARI Asit ve baz, değişik zamanlarda değişik şekillerde tanımlanmıştır. Bugün bu tanımların hepsi de kullanılmaktadır.
ASİTLER VE BAZLAR ASİT VE BAZ KAVRAMLARI Prof. Dr. Mustafa DEMİR M.DEMİR 0ASİT VE BAZ KAVRAMLARI Asit ve baz, değişik zamanlarda değişik şekillerde tanımlanmıştır. Bugün bu tanımların hepsi de kullanılmaktadır.
ARES 1-ASİTLER. MADDENĠN YAPISI VE ÖZELLĠKLERĠ 4-ASĠTLER ve BAZLAR 8.SINIF FEN BĠLĠMLERĠ
 ARES EĞĠTĠM [Metni yazın] MADDENĠN YAPISI VE ÖZELLĠKLERĠ 4-ASĠTLER ve BAZLAR 8.SINIF FEN BĠLĠMLERĠ 1-ASİTLER Suda çözündüklerinde ortama H + iyonu verebilen bileşiklere asit denir. ASİTLERİN ÖZELLİKLERİ
ARES EĞĠTĠM [Metni yazın] MADDENĠN YAPISI VE ÖZELLĠKLERĠ 4-ASĠTLER ve BAZLAR 8.SINIF FEN BĠLĠMLERĠ 1-ASİTLER Suda çözündüklerinde ortama H + iyonu verebilen bileşiklere asit denir. ASİTLERİN ÖZELLİKLERİ
ASİTLER VE BAZLAR ASİT VE BAZ KAVRAMLARI M.DEMİR ASİT VE BAZ KAVRAMLARI 1
 ASİTLER VE BAZLAR ASİT VE BAZ KAVRAMLARI M.DEMİR ASİT VE BAZ KAVRAMLARI 1 Asit ve baz, değişik zamanlarda değişik şekillerde tanımlanmıştır. Bugün bu tanımların hepsi de kullanılmaktadır. Hangi tanımın
ASİTLER VE BAZLAR ASİT VE BAZ KAVRAMLARI M.DEMİR ASİT VE BAZ KAVRAMLARI 1 Asit ve baz, değişik zamanlarda değişik şekillerde tanımlanmıştır. Bugün bu tanımların hepsi de kullanılmaktadır. Hangi tanımın
Asitler, Bazlar ve Tuzlar
 1.Ünite Asitler, Bazlar ve Tuzlar Maddelerin Asitlik ve Bazik Özellikleri Test-1 1. I. Tatlarının ekşi olması II. Tahriş edici olması III. Ele kayganlık hissi vermesi Yukarıdaki özelliklerden hangileri
1.Ünite Asitler, Bazlar ve Tuzlar Maddelerin Asitlik ve Bazik Özellikleri Test-1 1. I. Tatlarının ekşi olması II. Tahriş edici olması III. Ele kayganlık hissi vermesi Yukarıdaki özelliklerden hangileri
ÇÖZELTİLERDE DENGE (Asit-Baz)
 ÇÖZELTİLERDE DENGE (AsitBaz) SUYUN OTOİYONİZASYONU Saf suyun elektrik akımını iletmediği bilinir, ancak çok hassas ölçü aletleriyle yapılan deneyler sonucunda suyun çok zayıf da olsa iletken olduğu tespit
ÇÖZELTİLERDE DENGE (AsitBaz) SUYUN OTOİYONİZASYONU Saf suyun elektrik akımını iletmediği bilinir, ancak çok hassas ölçü aletleriyle yapılan deneyler sonucunda suyun çok zayıf da olsa iletken olduğu tespit
5.111 Ders Özeti #22 22.1. (suda) + OH. (suda)
 5.111 Ders Özeti #22 22.1 Asit/Baz Dengeleri Devamı (Bölümler 10 ve 11) Konular: Zayıf baz içeren dengeler, tuz çözeltilerinin ph sı ve tamponlar Çarşamba nın ders notlarından 2. Suda Baz NH 3 H 2 OH Bazın
5.111 Ders Özeti #22 22.1 Asit/Baz Dengeleri Devamı (Bölümler 10 ve 11) Konular: Zayıf baz içeren dengeler, tuz çözeltilerinin ph sı ve tamponlar Çarşamba nın ders notlarından 2. Suda Baz NH 3 H 2 OH Bazın
Suda HCl. + - Suda 3H + + (PO ) Suda HNO 3. Suda 2H + + (CO ) H CO 2 3. Suda H PO. (Nitrik asit) SO (Sülfürik asit) (Karbonik asit) H CO H O.
 Asitler çözündüklerinde ortama H iyonu verebilen bileşiklere asit denir. Bazı Önemli Asitler HCl : Hidroklorik asit H SO : Sülfürik asit Asitler metal kaplarda saklanamazlar. Çünkü metallerle tepkimeye
Asitler çözündüklerinde ortama H iyonu verebilen bileşiklere asit denir. Bazı Önemli Asitler HCl : Hidroklorik asit H SO : Sülfürik asit Asitler metal kaplarda saklanamazlar. Çünkü metallerle tepkimeye
DENEY 5. ASİDİK VE BAZİK ÇÖZELTİLER ph Skalası ve ph Ölçümleri
 DENEY 5 ASİDİK VE BAZİK ÇÖZELTİLER ph Skalası ve ph Ölçümleri AMAÇ: Çeşitli asit ve baz çözeltileri için ph nın ve ph skalasının ne olduğunun anlaşılması, ph kağıtları ve ph-metre yardımı ile hazırlanmış
DENEY 5 ASİDİK VE BAZİK ÇÖZELTİLER ph Skalası ve ph Ölçümleri AMAÇ: Çeşitli asit ve baz çözeltileri için ph nın ve ph skalasının ne olduğunun anlaşılması, ph kağıtları ve ph-metre yardımı ile hazırlanmış
ASİTLER-BAZLAR VE TUZLAR SU ARITIMI. Hazırlayan: Arif Özgür ÜLGER
 ASİTLER-BAZLAR VE TUZLAR SU ARITIMI Hazırlayan: Arif Özgür ÜLGER ASİTLER Sulu çözeltilerinde Hidrojen İyonu maddelere asit denir. veren HCI H + + CI CH 3 COOH CH 3 COO + H + ASİTLERİN GENEL ÖZELLİKLERİ
ASİTLER-BAZLAR VE TUZLAR SU ARITIMI Hazırlayan: Arif Özgür ÜLGER ASİTLER Sulu çözeltilerinde Hidrojen İyonu maddelere asit denir. veren HCI H + + CI CH 3 COOH CH 3 COO + H + ASİTLERİN GENEL ÖZELLİKLERİ
ASİTLER- BAZLAR. Suyun kendi kendine iyonlaşmasına Suyun Otonizasyonu - Otoprotoliz adı verilir. Suda oluşan H + sadece protondur.
 ASİTLER- BAZLAR SUYUN OTONİZASYONU: Suyun kendi kendine iyonlaşmasına Suyun Otonizasyonu - Otoprotoliz adı verilir. Suda oluşan H + sadece protondur. H 2 O (S) H + (suda) + OH - (Suda) H 2 O (S) + H +
ASİTLER- BAZLAR SUYUN OTONİZASYONU: Suyun kendi kendine iyonlaşmasına Suyun Otonizasyonu - Otoprotoliz adı verilir. Suda oluşan H + sadece protondur. H 2 O (S) H + (suda) + OH - (Suda) H 2 O (S) + H +
Genel Kimya 101-Lab (4.Hafta) Asit Baz Teorisi Suyun İyonlaşması ve ph Asit Baz İndikatörleri Asit Baz Titrasyonu Deneysel Kısım
 Genel Kimya 101-Lab (4.Hafta) Asit Baz Teorisi Suyun İyonlaşması ve ph Asit Baz İndikatörleri Asit Baz Titrasyonu Deneysel Kısım Asit Baz Teorisi Arrhenius Teorisi: Sulu çözeltlerine OH - iyonu bırakan
Genel Kimya 101-Lab (4.Hafta) Asit Baz Teorisi Suyun İyonlaşması ve ph Asit Baz İndikatörleri Asit Baz Titrasyonu Deneysel Kısım Asit Baz Teorisi Arrhenius Teorisi: Sulu çözeltlerine OH - iyonu bırakan
HAZIRLAYAN Mutlu ġahġn. Hacettepe Fen Bilgisi Öğretmenliği DENEY NO: 3 DENEYĠN ADI: ASĠT, BAZ VE TUZLARIN ĠLETKENLĠĞĠ
 HAZIRLAYAN Mutlu ġahġn Hacettepe Fen Bilgisi Öğretmenliği DENEY NO: 3 DENEYĠN ADI: ASĠT, BAZ VE TUZLARIN ĠLETKENLĠĞĠ DENEYĠN AMACI: ASĠT, BAZ VE TUZLARIN SULU ÇÖZELTĠLERĠNDE ĠYONLARINA AYRIġARAK ELEKTRĠK
HAZIRLAYAN Mutlu ġahġn Hacettepe Fen Bilgisi Öğretmenliği DENEY NO: 3 DENEYĠN ADI: ASĠT, BAZ VE TUZLARIN ĠLETKENLĠĞĠ DENEYĠN AMACI: ASĠT, BAZ VE TUZLARIN SULU ÇÖZELTĠLERĠNDE ĠYONLARINA AYRIġARAK ELEKTRĠK
Doğal Rb elementinin atom kütlesi 85,47 g/mol dür ve atom kütleleri 84,91 g/mol olan 86 Rb ile 86,92 olan 87
 Doğal Rb elementinin atom kütlesi 85,47 g/mol dür ve atom kütleleri 84,91 g/mol olan 86 Rb ile 86,92 olan 87 Rb izotoplarından oluşmuştur. İzotopların doğada bulunma yüzdelerini hesaplayınız. Bir bileşik
Doğal Rb elementinin atom kütlesi 85,47 g/mol dür ve atom kütleleri 84,91 g/mol olan 86 Rb ile 86,92 olan 87 Rb izotoplarından oluşmuştur. İzotopların doğada bulunma yüzdelerini hesaplayınız. Bir bileşik
Suda çözündüğünde hidrojen iyonu verebilen maddeler asit, hidroksil iyonu verebilenler baz olarak tanımlanmıştır.
 7. ASİTLER VE BAZLAR Arrhenius AsitBaz Tanımı (1884) (Svante Arrhenius) Suda çözündüğünde hidrojen iyonu verebilen maddeler asit, hidroksil iyonu verebilenler baz olarak tanımlanmıştır. HCl H + + Cl NaOH
7. ASİTLER VE BAZLAR Arrhenius AsitBaz Tanımı (1884) (Svante Arrhenius) Suda çözündüğünde hidrojen iyonu verebilen maddeler asit, hidroksil iyonu verebilenler baz olarak tanımlanmıştır. HCl H + + Cl NaOH
HACETTEPE ÜNĐVERSĐTESĐ EĞĐTĐM FAKÜLTESĐ ÖĞRETĐM TEKNOLOJĐLERĐ VE MATERYAL GELĐŞTĐRME
 HACETTEPE ÜNĐVERSĐTESĐ EĞĐTĐM FAKÜLTESĐ KĐMYA ÖĞRETMENLĐĞĐ ÖĞRETĐM TEKNOLOJĐLERĐ VE MATERYAL GELĐŞTĐRME 8. SINIF FEN VE TEKNOLOJĐ DERSĐ 3. ÜNĐTE: MADDENĐN YAPISI VE ÖZELLĐKLERĐ KONU: BAZLAR ÇALIŞMA YAPRAĞI
HACETTEPE ÜNĐVERSĐTESĐ EĞĐTĐM FAKÜLTESĐ KĐMYA ÖĞRETMENLĐĞĐ ÖĞRETĐM TEKNOLOJĐLERĐ VE MATERYAL GELĐŞTĐRME 8. SINIF FEN VE TEKNOLOJĐ DERSĐ 3. ÜNĐTE: MADDENĐN YAPISI VE ÖZELLĐKLERĐ KONU: BAZLAR ÇALIŞMA YAPRAĞI
5.111 Ders Özeti #21 21.1
 5.111 Ders Özeti #21 21.1 AsitBaz Dengesi Bölüm 10 Okunsun Konular: Asit ve Bazların Sınıflandırılması, Suyun Öziyonlaşması, ph Fonksiyonları, Asit ve Baz Kuvvetleri, Zayıf Asit İçeren Dengeler. Asit ve
5.111 Ders Özeti #21 21.1 AsitBaz Dengesi Bölüm 10 Okunsun Konular: Asit ve Bazların Sınıflandırılması, Suyun Öziyonlaşması, ph Fonksiyonları, Asit ve Baz Kuvvetleri, Zayıf Asit İçeren Dengeler. Asit ve
KİMYA II DERS NOTLARI
 Yrd. Doç. Dr. Atilla EVCİN Afyonkarahisar Kocatepe Üniversitesi 007 KİYA II DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN Asit Baz Tanımları Asit ve baz, değişik zamanlarda değişik şekillerde tanımlanmıştır.
Yrd. Doç. Dr. Atilla EVCİN Afyonkarahisar Kocatepe Üniversitesi 007 KİYA II DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN Asit Baz Tanımları Asit ve baz, değişik zamanlarda değişik şekillerde tanımlanmıştır.
Bileşikteki atomların cinsini ve oranını belirten formüldür. Kaba formül ile bileşiğin molekül ağırlığı hesaplanamaz.
 BİLEŞİKLER Birden fazla elementin belirli oranlarda kimyasal yollarla bir araya gelerek, kendi özelligini kaybedip oluşturdukları yeni saf maddeye bileşik denir. Bileşikteki atomların cins ve sayısını
BİLEŞİKLER Birden fazla elementin belirli oranlarda kimyasal yollarla bir araya gelerek, kendi özelligini kaybedip oluşturdukları yeni saf maddeye bileşik denir. Bileşikteki atomların cins ve sayısını
5.111 Ders Özeti #23 23.1
 5.111 Ders Özeti #23 23.1 Asit/Baz Dengeleri (Devam) Konu: Titrasyon Cuma günü ders notlarından Asidik tampon etkisi: Zayıf asit, HA, protonlarını ortamdaki kuvvetli bazın OH iyonlarına aktarır. Zayıf
5.111 Ders Özeti #23 23.1 Asit/Baz Dengeleri (Devam) Konu: Titrasyon Cuma günü ders notlarından Asidik tampon etkisi: Zayıf asit, HA, protonlarını ortamdaki kuvvetli bazın OH iyonlarına aktarır. Zayıf
ASİTLER-BAZLAR VE TUZLAR. Hazırlayan: Arif Özgür ÜLGER Muğla-2016
 ASİTLER-BAZLAR VE TUZLAR Hazırlayan: Arif Özgür ÜLGER Muğla-2016 ASİTLER Sulu çözeltilerinde Hidrojen İyonu maddelere asit denir. veren HCI H + + CI CH 3 COOH CH 3 COO + H + ASİTLERİN GENEL ÖZELLİKLERİ
ASİTLER-BAZLAR VE TUZLAR Hazırlayan: Arif Özgür ÜLGER Muğla-2016 ASİTLER Sulu çözeltilerinde Hidrojen İyonu maddelere asit denir. veren HCI H + + CI CH 3 COOH CH 3 COO + H + ASİTLERİN GENEL ÖZELLİKLERİ
FEN ve TEKNOLOJİ / ASİT VE BAZLAR GÜNLÜK YAŞAMDA ASİT VE BAZLAR
 GÜNLÜK YAŞAMDA ASİT VE BAZLAR 1 Yüzyıllardır doğayı ve doğadan elde edilebilecek maddeleri keşfetme arzusu içinde olan insanoğlu 1400'lü yıllarda o güne kadar bilinmeyen bir asidi, yani HCl (hidrojen klorür,
GÜNLÜK YAŞAMDA ASİT VE BAZLAR 1 Yüzyıllardır doğayı ve doğadan elde edilebilecek maddeleri keşfetme arzusu içinde olan insanoğlu 1400'lü yıllarda o güne kadar bilinmeyen bir asidi, yani HCl (hidrojen klorür,
ÖZET. Asitler ve Bazlar ASİTLER VE BAZLAR
 Asitler ve Bazlar Asitlerin Genel Özellikleri Suda çözündüklerinde suya hidrojen (H + ) iyonu verir. Tatları ekşidir. Bunu asidik özellikteki limon, domates ve sirke gibi maddelerin tadına bakarak söyleyebiliriz.
Asitler ve Bazlar Asitlerin Genel Özellikleri Suda çözündüklerinde suya hidrojen (H + ) iyonu verir. Tatları ekşidir. Bunu asidik özellikteki limon, domates ve sirke gibi maddelerin tadına bakarak söyleyebiliriz.
TAMPONLAR-pH ve pk HESAPLAMALARI
 Genel tanımlamalar TAMPONLAR-pH ve pk HESAPLAMALARI YRD. DOÇ.DR SEDAT MOTOR Tamponlarla ilgili açıklamalara geçmeden önce asit, baz, ph ve pk kavramlarını hatırlayalım. Suda çözündügü zaman (H + ) iyonu
Genel tanımlamalar TAMPONLAR-pH ve pk HESAPLAMALARI YRD. DOÇ.DR SEDAT MOTOR Tamponlarla ilgili açıklamalara geçmeden önce asit, baz, ph ve pk kavramlarını hatırlayalım. Suda çözündügü zaman (H + ) iyonu
TAMPON ÇÖZELTİLER. Prof.Dr.Mustafa DEMİR M.DEMİR 09-TAMPON ÇÖZELTİLER 1
 TAMPON ÇÖZELTİLER Prof.Dr.Mustafa DEMİR M.DEMİR 09-TAMPON ÇÖZELTİLER 1 Tampon çözeltiler Kimyada belli ph larda çözelti hazırlamak ve bunu uzun süre kullanmak çok önemlidir. Ancak bu çözeltilerin saklanması
TAMPON ÇÖZELTİLER Prof.Dr.Mustafa DEMİR M.DEMİR 09-TAMPON ÇÖZELTİLER 1 Tampon çözeltiler Kimyada belli ph larda çözelti hazırlamak ve bunu uzun süre kullanmak çok önemlidir. Ancak bu çözeltilerin saklanması
ASİT-BAZ DENGESİ ÖSS DE ÇIKMIŞ SORULAR
 1. Amonyağın, NH 3, baz özelliği gösterdiğini açıklayan denklem aşağıdakilerden hangisidir? A) NH 3(gaz) NH 3(sıvı) B) N 2(gaz) + 3H 2(gaz) 2NH 3(gaz) C) 2NH 3(gaz) +5/2O 2(gaz) 2NO (gaz) + 3H 2 O (gaz)
1. Amonyağın, NH 3, baz özelliği gösterdiğini açıklayan denklem aşağıdakilerden hangisidir? A) NH 3(gaz) NH 3(sıvı) B) N 2(gaz) + 3H 2(gaz) 2NH 3(gaz) C) 2NH 3(gaz) +5/2O 2(gaz) 2NO (gaz) + 3H 2 O (gaz)
ÇÖZELTILERDE DENGE. Asitler ve Bazlar
 ÇÖZELTILERDE DENGE Asitler ve Bazlar Zayıf Asit ve Bazlar Değişik asitler için verilen ph değerlerinin farklılık gösterdiğini görürüz. Bir önceki konuda ph değerinin [H₃O + ] ile ilgili olduğunu gördük.
ÇÖZELTILERDE DENGE Asitler ve Bazlar Zayıf Asit ve Bazlar Değişik asitler için verilen ph değerlerinin farklılık gösterdiğini görürüz. Bir önceki konuda ph değerinin [H₃O + ] ile ilgili olduğunu gördük.
İnstagram:kimyaci_glcn_hoca H A 9.HAMLE SULU ÇÖZELTİLERDE DENGE ASİT VE BAZ DENGESİ 2.BÖLÜM. kimyaci_glcn_hoca
 13 H A M L E D E 9.HAMLE SULU ÇÖZELTİLERDE DENGE ASİT VE BAZ DENGESİ 2.BÖLÜM ZAYIF ASİT VE ZAYIF BAZ İYONLAŞMA YÜZDESİ 0,1 M Kuvvetli Asit HBr 1. Her iki asit çözeltisinin hacimleri ve derişimleri eşit
13 H A M L E D E 9.HAMLE SULU ÇÖZELTİLERDE DENGE ASİT VE BAZ DENGESİ 2.BÖLÜM ZAYIF ASİT VE ZAYIF BAZ İYONLAŞMA YÜZDESİ 0,1 M Kuvvetli Asit HBr 1. Her iki asit çözeltisinin hacimleri ve derişimleri eşit
Sulu Çözeltiler ve Kimyasal Denge
 Sulu Çözeltiler ve Kimyasal Denge Sulu Çözeltiler Çözelti: iki veya daha fazla maddenin meydana getirdiği homojen karışımdır. çözücü, Kütlece fazla olan (veya çözme işlemini yapan) bileşene çözücü denir.
Sulu Çözeltiler ve Kimyasal Denge Sulu Çözeltiler Çözelti: iki veya daha fazla maddenin meydana getirdiği homojen karışımdır. çözücü, Kütlece fazla olan (veya çözme işlemini yapan) bileşene çözücü denir.
Bu maddelerden ekşi olan ve turnusol kâğıdını kırmızı renge dönüştürenler asit özelliği taşır. Tadı acı olan, kayganlık hissi veren ve turnusol
 TUĞBA KÜÇÜKKAHRAMAN Asitler - Bazlar Bu maddelerden ekşi olan ve turnusol kâğıdını kırmızı renge dönüştürenler asit özelliği taşır. Tadı acı olan, kayganlık hissi veren ve turnusol kâğıdını mavi renge
TUĞBA KÜÇÜKKAHRAMAN Asitler - Bazlar Bu maddelerden ekşi olan ve turnusol kâğıdını kırmızı renge dönüştürenler asit özelliği taşır. Tadı acı olan, kayganlık hissi veren ve turnusol kâğıdını mavi renge
www.kimyahocam.com Bu tepkimede; ile CO 2 konjuge asit baz çiftidir. O ile OH konjuge asit baz çiftidir. CO 3 ÖRNEK 1 HCN (suda)
 SULU ÇÖZELT LERDE AS T VE BAZ DENGELER I AS T BAZ TANIMLARI Arrhenius Tanımı Arrhenius a göre, suda çözündüğünde iyonlaşarak H iyonu verebilen maddeler asit, H iyonu verebilen maddeler bazdır. Bu tanım
SULU ÇÖZELT LERDE AS T VE BAZ DENGELER I AS T BAZ TANIMLARI Arrhenius Tanımı Arrhenius a göre, suda çözündüğünde iyonlaşarak H iyonu verebilen maddeler asit, H iyonu verebilen maddeler bazdır. Bu tanım
3. ASİTLER VE BAZLAR 3.1. GİRİŞ
 3. ASİTLER VE BAZLAR 3.1. GİRİŞ Asitler ve bazlar günlük yaşantımızda sıkça karşılaştığımız kavramlardan biridir. İnsanlar, her ne kadar asetil salisilik asit ve magnezyum hidroksit gibi kimyasal isimlerini
3. ASİTLER VE BAZLAR 3.1. GİRİŞ Asitler ve bazlar günlük yaşantımızda sıkça karşılaştığımız kavramlardan biridir. İnsanlar, her ne kadar asetil salisilik asit ve magnezyum hidroksit gibi kimyasal isimlerini
DENEY 4. ASİT BAZ TİTRASYONLARI (indikatörlü, potansiyometrik)
 DENEY 4 ASİT BAZ TİTRASYONLARI (indikatörlü, potansiyometrik) AMAÇ: Asit baz titrasyon işlemini öğrenmek ve asit-baz titrasyonu ile derişimi bilinmeyen bir asit ve/veya bir baz çözeltisinin derişimini
DENEY 4 ASİT BAZ TİTRASYONLARI (indikatörlü, potansiyometrik) AMAÇ: Asit baz titrasyon işlemini öğrenmek ve asit-baz titrasyonu ile derişimi bilinmeyen bir asit ve/veya bir baz çözeltisinin derişimini
Sulu Çözeltilerde Asit - Baz Dengesi
 Bu notlara Youtube dan Kimya Elbistan kanalında ilgili videolarının açıklamalar kısmında ki linkten ücretsiz bir şekilde ulaşabilirsiniz. A. Asit ve Baz Tanımları Arrhenius Asit - Baz Tanımı Arrhenius
Bu notlara Youtube dan Kimya Elbistan kanalında ilgili videolarının açıklamalar kısmında ki linkten ücretsiz bir şekilde ulaşabilirsiniz. A. Asit ve Baz Tanımları Arrhenius Asit - Baz Tanımı Arrhenius
KİMYASAL BAĞ *Atomları bir arada tutan kuvvete kimyasal bağ denir.
 KİMYASAL BAĞ *Atomları bir arada tutan kuvvete kimyasal bağ denir. *Atomlar birleştiği zaman elektron dağılımındaki değişimlerin sonucunda kimyasal bağları meydana getirirler. *Kimyasal bağ oluşurken dışarıya
KİMYASAL BAĞ *Atomları bir arada tutan kuvvete kimyasal bağ denir. *Atomlar birleştiği zaman elektron dağılımındaki değişimlerin sonucunda kimyasal bağları meydana getirirler. *Kimyasal bağ oluşurken dışarıya
ASİTLER, BAZLAR VE TUZLAR
 ASİTLER, BAZLAR VE TUZLAR Kavramlar / Terimler Asit Baz Tuz Nötralleşme İndikatör p Aktif metal Soy metal Neler Öğreneceğiz? Bu ünitede, asitleri ve bazları gündelik deneyimlerimiz ile ilişkilendirerek
ASİTLER, BAZLAR VE TUZLAR Kavramlar / Terimler Asit Baz Tuz Nötralleşme İndikatör p Aktif metal Soy metal Neler Öğreneceğiz? Bu ünitede, asitleri ve bazları gündelik deneyimlerimiz ile ilişkilendirerek
8. SINIF KAZANIM TESTLERİ 2.SAYI. Ar-Ge Birimi Çalışmasıdır ŞANLIURFA İL MİLLİ EĞİTİM MÜDÜRLÜĞÜ DİZGİ & TASARIM İBRAHİM CANBEK MEHMET BOZKURT
 8. SINIF ŞANLIURFA İL MİLLİ EĞİTİM MÜDÜRLÜĞÜ KAZANIM TESTLERİ TÜRKÇE MATEMATİK T.C İNKİLAP TARİHİ VE ATATÜRKÇÜLÜK FEN VE TEKNOLOJİ DİN KÜLTÜRÜ VE AHLAK BİLGİSİ İNGİLİZCE Ar-Ge Birimi Çalışmasıdır 2.SAYI
8. SINIF ŞANLIURFA İL MİLLİ EĞİTİM MÜDÜRLÜĞÜ KAZANIM TESTLERİ TÜRKÇE MATEMATİK T.C İNKİLAP TARİHİ VE ATATÜRKÇÜLÜK FEN VE TEKNOLOJİ DİN KÜLTÜRÜ VE AHLAK BİLGİSİ İNGİLİZCE Ar-Ge Birimi Çalışmasıdır 2.SAYI
İLK ANYONLAR , PO 4. Cl -, SO 4 , CO 3 , NO 3
 İLK ANYONLAR Cl -, SO -, CO -, PO -, NO - İLK ANYONLAR Anyonlar negatif yüklü iyonlardır. Kalitatif analitik kimya analizlerine ilk anyonlar olarak adlandırılan Cl -, SO -, CO -, PO -, NO - analizi ile
İLK ANYONLAR Cl -, SO -, CO -, PO -, NO - İLK ANYONLAR Anyonlar negatif yüklü iyonlardır. Kalitatif analitik kimya analizlerine ilk anyonlar olarak adlandırılan Cl -, SO -, CO -, PO -, NO - analizi ile
PROJE TABANLI DENEY UYGULAMALARI
 PROJE TABANLI DENEY UYGULAMALARI KONU: ASĐTLER VE BAZLAR DERS: ORTAÖĞRETĐM KĐMYA DENEYLERĐ DERS SORUMLUSU: PROF. DR. ĐNCĐ MORGĐL HAZIRLAYAN: NAZLI KIRCI 20338561 HACETTEPE ÜNĐVERSĐTESĐ ANKARA 2007 PROJE
PROJE TABANLI DENEY UYGULAMALARI KONU: ASĐTLER VE BAZLAR DERS: ORTAÖĞRETĐM KĐMYA DENEYLERĐ DERS SORUMLUSU: PROF. DR. ĐNCĐ MORGĐL HAZIRLAYAN: NAZLI KIRCI 20338561 HACETTEPE ÜNĐVERSĐTESĐ ANKARA 2007 PROJE
ÜNİTE 3 ELEMENTLER ve ÖZELLİKLERİ Sayfa -1-
 ÜNİTE 3 ELEMENTLER ve ÖZELLİKLERİ Sayfa -1- Sayfa - 2- Sayfa - 3 - Sayfa - 4 - Sayfa - 5 - Sayfa - 6 - Sayfa - 7-4 Sayfa - 8 - NaCl (Sodyum Klorür) Yemek Tuzu Ġyonik Bağlı bileşik molekülleri bir örgü
ÜNİTE 3 ELEMENTLER ve ÖZELLİKLERİ Sayfa -1- Sayfa - 2- Sayfa - 3 - Sayfa - 4 - Sayfa - 5 - Sayfa - 6 - Sayfa - 7-4 Sayfa - 8 - NaCl (Sodyum Klorür) Yemek Tuzu Ġyonik Bağlı bileşik molekülleri bir örgü
Araş. Gör. Can GÜNGÖREN
 1 ph KAVRAMI VE HESABI Araş. Gör. Can GÜNGÖREN 2 ph ın Önemi Sulu çözeltilerde hidrojen iyonu aktivitesi çok önemli bir rol oynar. Kimyada, çözünmüş hidrojen iyonu aktivitesinin ölçüsüne ph denir. ph bir
1 ph KAVRAMI VE HESABI Araş. Gör. Can GÜNGÖREN 2 ph ın Önemi Sulu çözeltilerde hidrojen iyonu aktivitesi çok önemli bir rol oynar. Kimyada, çözünmüş hidrojen iyonu aktivitesinin ölçüsüne ph denir. ph bir
Her madde atomlardan oluşur
 2 Yaşamın kimyası Figure 2.1 Helyum Atomu Çekirdek Her madde atomlardan oluşur 2.1 Atom yapısı - madde özelliği Elektron göz ardı edilebilir kütle; eksi yük Çekirdek: Protonlar kütlesi var; artı yük Nötronlar
2 Yaşamın kimyası Figure 2.1 Helyum Atomu Çekirdek Her madde atomlardan oluşur 2.1 Atom yapısı - madde özelliği Elektron göz ardı edilebilir kütle; eksi yük Çekirdek: Protonlar kütlesi var; artı yük Nötronlar
ASİTLERİN VE BAZLARIN TEPKİMELERİ
 2. BÖLÜM ASİTLERİN VE BAZLARIN TEPKİMELERİ Asitler ve bazlar kimyasal özellikleri ve tepkimeleri bakımından çok önemli maddeler olup oldukça sık kullanılırlar. Bu bölümde asitler ve bazlar arasındaki tepkimeleri;
2. BÖLÜM ASİTLERİN VE BAZLARIN TEPKİMELERİ Asitler ve bazlar kimyasal özellikleri ve tepkimeleri bakımından çok önemli maddeler olup oldukça sık kullanılırlar. Bu bölümde asitler ve bazlar arasındaki tepkimeleri;
GİRİŞ ASİDİK KALKAN: MİDE
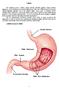 GİRİŞ Bir toplumun içecek kültürü, yaşam şekliyle yakından ilgilidir. Yaşam şeklinin değişmesi, içecek kültürünün de zamanla değişmesine neden olur. Doğal haliyle bu da içecek kültürü doğrudan ilişkilidir.
GİRİŞ Bir toplumun içecek kültürü, yaşam şekliyle yakından ilgilidir. Yaşam şeklinin değişmesi, içecek kültürünün de zamanla değişmesine neden olur. Doğal haliyle bu da içecek kültürü doğrudan ilişkilidir.
BÖLÜM. Asitler Bazlar ve Tuzlar. Asitler ve Bazları Tanıyalım Test Asitler ve Bazları Tanıyalım Test
 BÖLÜM 5 Asitler Bazlar ve Tuzlar Asitler ve Bazları Tanıyalım Test - 1... 2 Asitler ve Bazları Tanıyalım Test - 2... 2 Asitler ve Bazları Tanıyalım Test - 3... 2 Asitlerin / Bazların Tepkimeleri Test -
BÖLÜM 5 Asitler Bazlar ve Tuzlar Asitler ve Bazları Tanıyalım Test - 1... 2 Asitler ve Bazları Tanıyalım Test - 2... 2 Asitler ve Bazları Tanıyalım Test - 3... 2 Asitlerin / Bazların Tepkimeleri Test -
Asitler-Bazlar-Tuzlar. Prof Dr Arif ALTINTAŞ
 Asitler-Bazlar-Tuzlar Prof Dr Arif ALTINTAŞ Asitler Asitler kimyada önemli bir bileşik sınıfını oluşturur. Günlük gıda maddelerinin bir çoğunda asit vardır. Canlıların yaşamsal faaliyetlerinde asitlerin
Asitler-Bazlar-Tuzlar Prof Dr Arif ALTINTAŞ Asitler Asitler kimyada önemli bir bileşik sınıfını oluşturur. Günlük gıda maddelerinin bir çoğunda asit vardır. Canlıların yaşamsal faaliyetlerinde asitlerin
GRUP:İNDİKATÖR Mustafa ORDUERİ
 İLKÖĞRETİMDE DOĞAL BELİRTEÇLER KULLANILARAK ASİT ve BAZLARIN BELİRLENMESİ Asıl alt başlık stilini düzenlemek için tıklatın GRUP:İNDİKATÖR Mustafa ORDUERİ TUBİTAK BİDEB YİBO ÖĞRETMENLERİ FEN ve TEKNOLOJİ-FİZİK,KİMYA,BİYOLOJİ-MATEMATİK
İLKÖĞRETİMDE DOĞAL BELİRTEÇLER KULLANILARAK ASİT ve BAZLARIN BELİRLENMESİ Asıl alt başlık stilini düzenlemek için tıklatın GRUP:İNDİKATÖR Mustafa ORDUERİ TUBİTAK BİDEB YİBO ÖĞRETMENLERİ FEN ve TEKNOLOJİ-FİZİK,KİMYA,BİYOLOJİ-MATEMATİK
DENEY 8 POLİPROTİK ASİTLER: ph TİTRASYON EĞRİLERİ KULLANILARAK pka DEĞERLERİNİN BELİRLENMESİ
 DENEY 8 POLİPROTİK ASİTLER: ph TİTRASYON EĞRİLERİ KULLANILARAK pka DEĞERLERİNİN BELİRLENMESİ 8.1. AMAÇ Bir asidin titrasyonunu yapmak. Poliprotik bir asidin gücünü belirlemek. Bir asidin pka değerlerini
DENEY 8 POLİPROTİK ASİTLER: ph TİTRASYON EĞRİLERİ KULLANILARAK pka DEĞERLERİNİN BELİRLENMESİ 8.1. AMAÇ Bir asidin titrasyonunu yapmak. Poliprotik bir asidin gücünü belirlemek. Bir asidin pka değerlerini
ARRHENIUS KURAMI ASITLER VE BAZLAR
 ARRENIUS KURAMI Arrhenius kuramına göre, sulu çözeltide iyonlaşarak hidronyum iyonu, (aq), oluşturan maddelere asit; sulu çözeltide iyonlaşarak hidroksit, - (aq), oluşturan maddelere baz adı verilir. CMU,
ARRENIUS KURAMI Arrhenius kuramına göre, sulu çözeltide iyonlaşarak hidronyum iyonu, (aq), oluşturan maddelere asit; sulu çözeltide iyonlaşarak hidroksit, - (aq), oluşturan maddelere baz adı verilir. CMU,
Öğretimde Planlama ve Değerlendirme. DERS SORUMLUSU: Prof. Dr. Đnci MORGĐL
 Öğretimde Planlama ve Değerlendirme DERS SORUMLUSU: Prof. Dr. Đnci MORGĐL LĐMONATAMI GAZLI ĐÇECEK YAPABĐLĐR MĐYĐM? Günlük Yaşam Olayı: Günlük hayatta pek çok kez içtiğimiz limonlu içeceklere karbonat katılmasıyla
Öğretimde Planlama ve Değerlendirme DERS SORUMLUSU: Prof. Dr. Đnci MORGĐL LĐMONATAMI GAZLI ĐÇECEK YAPABĐLĐR MĐYĐM? Günlük Yaşam Olayı: Günlük hayatta pek çok kez içtiğimiz limonlu içeceklere karbonat katılmasıyla
CANLILARIN TEMEL BİLEŞENLERİ
 1 CANLILARIN TEMEL BİLEŞENLERİ Canlıların temel bileşenleri; inorganik ve organik bileşikler olmak üzere ikiye ayrılır. **İnorganik bileşikler: Canlılar tarafından sentezlenemezler. Dışarıdan hazır olarak
1 CANLILARIN TEMEL BİLEŞENLERİ Canlıların temel bileşenleri; inorganik ve organik bileşikler olmak üzere ikiye ayrılır. **İnorganik bileşikler: Canlılar tarafından sentezlenemezler. Dışarıdan hazır olarak
İÇERİK. Suyun Doğası Sulu Çözeltilerin Doğası
 İÇERİK Suyun Doğası Sulu Çözeltilerin Doğası Su içinde İyonik Bileşikler Su içinde Kovalent Bileşikler Çökelme Tepkimesi Asit-Baz Tepkimeleri (Nötürleşme) Yükseltgenme-İndirgenme Tepkimeleri Önemli Tip
İÇERİK Suyun Doğası Sulu Çözeltilerin Doğası Su içinde İyonik Bileşikler Su içinde Kovalent Bileşikler Çökelme Tepkimesi Asit-Baz Tepkimeleri (Nötürleşme) Yükseltgenme-İndirgenme Tepkimeleri Önemli Tip
BAZ KARIŞIMLARININ VOLUMETRİK ANALİZİ
 BAZ KARIŞIMLARININ VOLUMETRİK ANALİZİ NaOH-Na2CO3 Tayini Alkali ve toprak alkali metallerin hidroksitleri kuvvetli nem çekici özelliğe sahiptirler. Bu nedenle katı haldeki bu hidroksitlerin dış yüzeyleri
BAZ KARIŞIMLARININ VOLUMETRİK ANALİZİ NaOH-Na2CO3 Tayini Alkali ve toprak alkali metallerin hidroksitleri kuvvetli nem çekici özelliğe sahiptirler. Bu nedenle katı haldeki bu hidroksitlerin dış yüzeyleri
DENEY 4 KUVVETLİ ASİT İLE KUVVETLİ BAZ TİTRASYONU
 DENEY 4 KUVVETLİ ASİT İLE KUVVETLİ BAZ TİTRASYONU 4.1. AMAÇ Asit ve baz çözeltilerinin hazırlanması, nötralleşme tepkimelerinin yapılışlarının öğrenilmesi. 4.2.TEORİ Asit ve baz kavramı günlük hayatta
DENEY 4 KUVVETLİ ASİT İLE KUVVETLİ BAZ TİTRASYONU 4.1. AMAÇ Asit ve baz çözeltilerinin hazırlanması, nötralleşme tepkimelerinin yapılışlarının öğrenilmesi. 4.2.TEORİ Asit ve baz kavramı günlük hayatta
SINIF. Asit - Baz Tepkimeleri TEST. 1. Bazların genel özellikleri ile ilgili verilen aşağıdaki bilgilerden hangisi doğrudur?
 AZANI AVRAA TEST TEST 11 - Tepkimeleri 1. ların genel özellikleri ile ilgili verilen aşağıdaki bilgilerden hangisi doğrudur? Tatları ekşidir. avi turnosol kağıdının rengini kırmızıya çevirirler. lerle
AZANI AVRAA TEST TEST 11 - Tepkimeleri 1. ların genel özellikleri ile ilgili verilen aşağıdaki bilgilerden hangisi doğrudur? Tatları ekşidir. avi turnosol kağıdının rengini kırmızıya çevirirler. lerle
ASİT BAZ TİTRASYONU TEORİ
 ASİT BAZ TİTRASYONU AMAÇ Bu deneyde öğrenciler asit-baz titrasyonu ve standart çözelti hazırlamayı öğreneceklerdir. Ayrıca aspirin tableti içindeki asetil salisilik asit yüzdesini ve aspirin çözeltisinin
ASİT BAZ TİTRASYONU AMAÇ Bu deneyde öğrenciler asit-baz titrasyonu ve standart çözelti hazırlamayı öğreneceklerdir. Ayrıca aspirin tableti içindeki asetil salisilik asit yüzdesini ve aspirin çözeltisinin
KİMYA II DERS NOTLARI
 KİMYA II DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN Sulu Çözeltilerin Doğası Elektrolitler Metallerde elektronların hareketiyle elektrik yükü taşınır. Saf su Suda çözünmüş Oksijen gazı Çözeltideki moleküllerin
KİMYA II DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN Sulu Çözeltilerin Doğası Elektrolitler Metallerde elektronların hareketiyle elektrik yükü taşınır. Saf su Suda çözünmüş Oksijen gazı Çözeltideki moleküllerin
2+ 2- Mg SO 4. (NH 4 ) 2 SO 4 (amonyum sülfat) bileşiğini katyon ve anyonlara ayıralım.
 KONU: Kimyasal Tepkimeler Dersin Adı Dersin Konusu İYONİK BİLEŞİKLERİN FORMÜLLERİNİN YAZILMASI İyonik bağlı bileşiklerin formüllerini yazmak için atomların yüklerini bilmek gerekir. Bunu da daha önceki
KONU: Kimyasal Tepkimeler Dersin Adı Dersin Konusu İYONİK BİLEŞİKLERİN FORMÜLLERİNİN YAZILMASI İyonik bağlı bileşiklerin formüllerini yazmak için atomların yüklerini bilmek gerekir. Bunu da daha önceki
10. SINIF. $ + - şeklinde olduğuna göre NH 3. Asitler, Bazlar ve Tuzlar I ( Asitleri ve Bazları Tanıyalım ) TEST. ün suda çözünme denklemi; 1.
 10. SINIF K Asitler, Bazlar ve Tuzlar I ( Asitleri ve Bazları Tanıyalım ) 1. NH 3 ün suda çözünme denklemi; $ + - NH3^aqh+ HO^sh NH4 ^aqh+ OH ^aqh şeklinde olduğuna göre NH 3 ün sulu çözeltisi için aşağıdaki
10. SINIF K Asitler, Bazlar ve Tuzlar I ( Asitleri ve Bazları Tanıyalım ) 1. NH 3 ün suda çözünme denklemi; $ + - NH3^aqh+ HO^sh NH4 ^aqh+ OH ^aqh şeklinde olduğuna göre NH 3 ün sulu çözeltisi için aşağıdaki
CANLILARDA TAMPONLAMA
 CANLILARDA TAMPONLAMA ph= -log [H + ] / Sorensen, H potansiyeli örnekler Hücreler ve organizmalar özgül ve sabit bir sitozol ve hücre dışı sıvı ph sını korurlar Böylece biyomoleküllerin en uygun iyonik
CANLILARDA TAMPONLAMA ph= -log [H + ] / Sorensen, H potansiyeli örnekler Hücreler ve organizmalar özgül ve sabit bir sitozol ve hücre dışı sıvı ph sını korurlar Böylece biyomoleküllerin en uygun iyonik
ÇÖZÜNÜRLÜK (ORTAK İYON ETKİSİ ) (Çöktürme ile Ayırma)
 ÇÖZÜNÜRLÜ (ORTA İYON ETİSİ ) (Çöktürme ile Ayırma) Prof. Dr. ustafa DEİR 08ORTA İYON ETİSİ07B ÇÖZÜNÜRLÜ ÇÖTÜRE İLE AYIRA 1 ORTA İYON ETİSİ 08ORTA İYON ETİSİ07B ÇÖZÜNÜRLÜ ÇÖTÜRE İLE AYIRA ORTA İYON ETİSİ
ÇÖZÜNÜRLÜ (ORTA İYON ETİSİ ) (Çöktürme ile Ayırma) Prof. Dr. ustafa DEİR 08ORTA İYON ETİSİ07B ÇÖZÜNÜRLÜ ÇÖTÜRE İLE AYIRA 1 ORTA İYON ETİSİ 08ORTA İYON ETİSİ07B ÇÖZÜNÜRLÜ ÇÖTÜRE İLE AYIRA ORTA İYON ETİSİ
9. SINIF KONTEXT KĐMYA UYGULAMASI
 9. SINIF KONTEXT KĐMYA UYGULAMASI DERS SORUMLUSU: PROF. DR. ĐNCi MORGĐL HAZIRLAYAN: DERYA ÇAKICI 20338451 ANKARA, 2008 MİDEM NEDEN YANIYOR? Günlük yaşam olayı: Sindirim rahatsızlıklarından mide yanmasının
9. SINIF KONTEXT KĐMYA UYGULAMASI DERS SORUMLUSU: PROF. DR. ĐNCi MORGĐL HAZIRLAYAN: DERYA ÇAKICI 20338451 ANKARA, 2008 MİDEM NEDEN YANIYOR? Günlük yaşam olayı: Sindirim rahatsızlıklarından mide yanmasının
Görevi: Bütün vücut hücrelerinin içindeki ve dışlarındaki suyun düzenlenmesi, kalp ritmi, sinir uyarılarının ve kaskasılmalarının
 İNORGANİK BİLEŞİKLER Su Asit Baz Tuz Mineraller SU Özellikleri Yüksek yüzey gerilimine sahiptir Yüksek özgül ısı nedeniyle sıcaklık değişimine karşı dirençlidir Yüksek buharlaşma ısısı nedeniyle soğutma
İNORGANİK BİLEŞİKLER Su Asit Baz Tuz Mineraller SU Özellikleri Yüksek yüzey gerilimine sahiptir Yüksek özgül ısı nedeniyle sıcaklık değişimine karşı dirençlidir Yüksek buharlaşma ısısı nedeniyle soğutma
KONU 16 Asit-Baz Dengesi
 KONU 16 Asit-Baz Dengesi Hedefler ve Anahtar Becerileri Öğrenme: Hidratlı protonun doğasını gösterildiği şekilde kavramak H + (aq) or H 3 O + (aq) Arrhenius asit ve bazlarını tanımlamak ve tespit etmek.
KONU 16 Asit-Baz Dengesi Hedefler ve Anahtar Becerileri Öğrenme: Hidratlı protonun doğasını gösterildiği şekilde kavramak H + (aq) or H 3 O + (aq) Arrhenius asit ve bazlarını tanımlamak ve tespit etmek.
KİMYA. Kimya YGS. Kazanım Merkezli. Orta Düzey ÜÇ AŞAMALI TEST MODÜL SİSTEMİ
 S G Y Kimya KİMYA YGS Kazanım Merkezli SORUSORU BANKASI BANKASI İsabetli Soru Bankası Kazanımların Etkin Özeti Nöbetçi Öğretmen Uygulaması Güncel Soru ve Çözümleri zey ü el D ÜÇ AŞAMALI TEST MODÜL SİSTEMİ
S G Y Kimya KİMYA YGS Kazanım Merkezli SORUSORU BANKASI BANKASI İsabetli Soru Bankası Kazanımların Etkin Özeti Nöbetçi Öğretmen Uygulaması Güncel Soru ve Çözümleri zey ü el D ÜÇ AŞAMALI TEST MODÜL SİSTEMİ
6. I. Sirke ruhu (CH 3 COOH)
 ph ve poh Kavramları - Asit Baz İndikatörleri BÖLÜM 08 Test 04 1. Aşağıdaki maddelerin standart koşullarda ph değerleri ile ilgili verilen bilgilerden hangisi yanlıştır? 4. mavi turnusol kağıdı kırmızı
ph ve poh Kavramları - Asit Baz İndikatörleri BÖLÜM 08 Test 04 1. Aşağıdaki maddelerin standart koşullarda ph değerleri ile ilgili verilen bilgilerden hangisi yanlıştır? 4. mavi turnusol kağıdı kırmızı
ASİT- BAZ DENGESİ VE DENGESİZLİKLERİ. Prof. Dr. Tülin BEDÜK 2016
 ASİT- BAZ DENGESİ VE DENGESİZLİKLERİ Prof. Dr. Tülin BEDÜK 2016 Herhangi bir çözeltinin asitliği veya bazlığı içindeki hidrojen iyonunun (H + ) konsantrasyonuna bağlıdır. Beden sıvılarının asit-baz dengesi
ASİT- BAZ DENGESİ VE DENGESİZLİKLERİ Prof. Dr. Tülin BEDÜK 2016 Herhangi bir çözeltinin asitliği veya bazlığı içindeki hidrojen iyonunun (H + ) konsantrasyonuna bağlıdır. Beden sıvılarının asit-baz dengesi
PERİYODİK CETVEL Mendeleev Henry Moseley Glenn Seaborg
 PERİYODİK CETVEL Periyodik cetvel elementleri sınıflandırmak için hazırlanmıştır. İlkperiyodik cetvel Mendeleev tarafından yapılmıştır. Mendeleev elementleri artan kütle numaralarına göre sıralamış ve
PERİYODİK CETVEL Periyodik cetvel elementleri sınıflandırmak için hazırlanmıştır. İlkperiyodik cetvel Mendeleev tarafından yapılmıştır. Mendeleev elementleri artan kütle numaralarına göre sıralamış ve
C. ASİT ve BAZLARIN AŞINDIRICILIĞI Ölçme ve Değerlendirme Kazanım Değerlendirme Testi
 İçindekiler C. ASİT ve BAZLARIN AŞINDIRICILIĞI... 33 Ölçme ve Değerlendirme... 35 Kazanım Değerlendirme Testi - 2... 36 BÖLÜM 1 : ASİTLERİ ve BAZLARI TANIYALIM... 14 I. BİLEŞİKLERİN SINIFLANDIRILMASI...
İçindekiler C. ASİT ve BAZLARIN AŞINDIRICILIĞI... 33 Ölçme ve Değerlendirme... 35 Kazanım Değerlendirme Testi - 2... 36 BÖLÜM 1 : ASİTLERİ ve BAZLARI TANIYALIM... 14 I. BİLEŞİKLERİN SINIFLANDIRILMASI...
6.4. Çözünürlük üzerine kompleks oluşumunun etkisi ------------ 6.5. Çözünürlük üzerine hidrolizin etkisi ---------------------------- 6.6.
 iii İÇİNDEKİLER 1. GİRİŞ ------------------------------------------------------------------- 2. TANIMLAR ------------------------------------------------------------ 2.1. Atom-gram -------------------------------------------------------
iii İÇİNDEKİLER 1. GİRİŞ ------------------------------------------------------------------- 2. TANIMLAR ------------------------------------------------------------ 2.1. Atom-gram -------------------------------------------------------
4. 25 o C de sulu çözeltilerin özellikleri ile ilgili olarak, 5. ph 7 olan sulu çözelti için,
 1. ( ) ( ) ( ( ) Yukarıda verilen asit baz tepkimesinde asit özellik gösteren maddeler hangileridir? A), 4. 25 o C de sulu çözeltilerin özellikleri ile ilgili olarak, I. ph poh ise OH 1x10 7 II. OH H ise
1. ( ) ( ) ( ( ) Yukarıda verilen asit baz tepkimesinde asit özellik gösteren maddeler hangileridir? A), 4. 25 o C de sulu çözeltilerin özellikleri ile ilgili olarak, I. ph poh ise OH 1x10 7 II. OH H ise
Örnek : 3- Bileşiklerin Özellikleri :
 Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani
Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani
Test-1. Asitler, Bazlar ve Tuzlar. 1. I. Deterjanlı su. 4. H 2 SO 4 ve HNO 3 ile ilgili; I. Akü yapımı. II. Sirkeli su. II. Yapay gübre üretimi
 Kimya BÖLÜM-8 Test-1 1. I. Deterjanlı su II. Sirkeli su III. Amonyak çözeltisi Yukarıda verilen maddelerden hangilerine turnusol boyası damlatıldığında mavi renk alır? 4. H 2 SO 4 ve HNO 3 ile ilgili;
Kimya BÖLÜM-8 Test-1 1. I. Deterjanlı su II. Sirkeli su III. Amonyak çözeltisi Yukarıda verilen maddelerden hangilerine turnusol boyası damlatıldığında mavi renk alır? 4. H 2 SO 4 ve HNO 3 ile ilgili;
İnstagram:kimyaci_glcn_hoca H A 9.HAMLE SULU ÇÖZELTİLERDE DENGE ASİT VE BAZ DENGESİ. kimyaci_glcn_hoca
 13 H A M L E D E 9.HAMLE SULU ÇÖZELTİLERDE DENGE ASİT VE BAZ DENGESİ ASİTLER VE BAZLAR 1.Arrhenius Asit-Baz Tanımı Arrhenius a göre bir madde suda iyonlarına ayrışarak çözündüğünde ortamdaki; H + iyonları
13 H A M L E D E 9.HAMLE SULU ÇÖZELTİLERDE DENGE ASİT VE BAZ DENGESİ ASİTLER VE BAZLAR 1.Arrhenius Asit-Baz Tanımı Arrhenius a göre bir madde suda iyonlarına ayrışarak çözündüğünde ortamdaki; H + iyonları
Asitler ve Bazlar ÜNİTE. Amaçlar. İçindekiler. Yazar Doç.Dr. Ayşe Eren PÜTÜN
 Asitler ve Bazlar Yazar Doç.Dr. Ayşe Eren PÜTÜN ÜNİTE 13 Amaçlar Bu üniteyi çalıştıktan sonra; asit-baz kavramlarını ve aralarındaki farkı, suyun kendi kendine iyonlaşma olayını ve iyonlaşma sabitini,
Asitler ve Bazlar Yazar Doç.Dr. Ayşe Eren PÜTÜN ÜNİTE 13 Amaçlar Bu üniteyi çalıştıktan sonra; asit-baz kavramlarını ve aralarındaki farkı, suyun kendi kendine iyonlaşma olayını ve iyonlaşma sabitini,
Tüm yaşayan organizmalar suya ihtiyaç duyarlar Çoğu hücre suyla çevrilidir ve hücrelerin yaklaşık %70 95 kadarı sudan oluşur. Yerküre içerdiği su ile
 Su Kimyası Tüm yaşayan organizmalar suya ihtiyaç duyarlar Çoğu hücre suyla çevrilidir ve hücrelerin yaklaşık %70 95 kadarı sudan oluşur. Yerküre içerdiği su ile canlılık için gerekli ortamı sunar. Canlıların
Su Kimyası Tüm yaşayan organizmalar suya ihtiyaç duyarlar Çoğu hücre suyla çevrilidir ve hücrelerin yaklaşık %70 95 kadarı sudan oluşur. Yerküre içerdiği su ile canlılık için gerekli ortamı sunar. Canlıların
Serüveni 3.ÜNİTE:KİMYASAL TÜRLER ARASI ETKİLEŞİM FİZİKSEL VE KİMYASAL DEĞİŞİM KİMYASAL TEPKİME TÜRLERİ
 Serüveni 3.ÜNİTE:KİMYASAL TÜRLER ARASI ETKİLEŞİM FİZİKSEL VE KİMYASAL DEĞİŞİM KİMYASAL TEPKİME TÜRLERİ FİZİKSEL VE KİMYASAL DEĞİŞİM FİZİKSEL DEĞİŞİM Beş duyu organımızla algıladığımız fiziksel özelliklerdeki
Serüveni 3.ÜNİTE:KİMYASAL TÜRLER ARASI ETKİLEŞİM FİZİKSEL VE KİMYASAL DEĞİŞİM KİMYASAL TEPKİME TÜRLERİ FİZİKSEL VE KİMYASAL DEĞİŞİM FİZİKSEL DEĞİŞİM Beş duyu organımızla algıladığımız fiziksel özelliklerdeki
[H + ] > [OH ] ortam asidiktir. [H + ]. [OH ] = 10 14 'tür. [H + ] < [OH ] ise ortam baziktir. NİTELİK Yayıncılık [H + ] = [OH ] = 10 7 M
![[H + ] > [OH ] ortam asidiktir. [H + ]. [OH ] = 10 14 'tür. [H + ] < [OH ] ise ortam baziktir. NİTELİK Yayıncılık [H + ] = [OH ] = 10 7 M [H + ] > [OH ] ortam asidiktir. [H + ]. [OH ] = 10 14 'tür. [H + ] < [OH ] ise ortam baziktir. NİTELİK Yayıncılık [H + ] = [OH ] = 10 7 M](/thumbs/33/15881900.jpg) BÖLÜM - 3 Suyun Otoiyonizasyonu Çok hassas ölçüm aletleri ile yapılan ölçümlerde suyun mutlak bir yalıtkan olmadığı az da olsa elektriği ilettiği tespit edilmiştir. Bu durum suyun çok az iyonlaşabildiğini
BÖLÜM - 3 Suyun Otoiyonizasyonu Çok hassas ölçüm aletleri ile yapılan ölçümlerde suyun mutlak bir yalıtkan olmadığı az da olsa elektriği ilettiği tespit edilmiştir. Bu durum suyun çok az iyonlaşabildiğini
8. SINIF KAZANIM TESTLERİ 1.SAYI. Ar-Ge Birimi Çalışmasıdır ŞANLIURFA İL MİLLİ EĞİTİM MÜDÜRLÜĞÜ DİZGİ & TASARIM İBRAHİM CANBEK MEHMET BOZKURT
 8. SINIF ŞANLIURFA İL MİLLİ EĞİTİM MÜDÜRLÜĞÜ KAZANIM TESTLERİ TÜRKÇE MATEMATİK T.C İNKİLAP TARİHİ VE ATATÜRKÇÜLÜK FEN VE TEKNOLOJİ DİN KÜLTÜRÜ VE AHLAK BİLGİSİ İNGİLİZCE Ar-Ge Birimi Çalışmasıdır 1.SAYI
8. SINIF ŞANLIURFA İL MİLLİ EĞİTİM MÜDÜRLÜĞÜ KAZANIM TESTLERİ TÜRKÇE MATEMATİK T.C İNKİLAP TARİHİ VE ATATÜRKÇÜLÜK FEN VE TEKNOLOJİ DİN KÜLTÜRÜ VE AHLAK BİLGİSİ İNGİLİZCE Ar-Ge Birimi Çalışmasıdır 1.SAYI
ATOM ve YAPISI Maddelerin gözle görülmeyen (bölünmeyen) en parçasına atom denir. Atom kendinden başka hiçbir fiziksel ya da kimyasal metotlarla
 ATOM ve YAPISI Maddelerin gözle görülmeyen (bölünmeyen) en parçasına atom denir. Atom kendinden başka hiçbir fiziksel ya da kimyasal metotlarla kendinden farklı atomlara dönüşemezler. Atomda (+) yüklü
ATOM ve YAPISI Maddelerin gözle görülmeyen (bölünmeyen) en parçasına atom denir. Atom kendinden başka hiçbir fiziksel ya da kimyasal metotlarla kendinden farklı atomlara dönüşemezler. Atomda (+) yüklü
EVDE KİMYA SABUN. Yağ asitlerinin Na ve ya K tuzuna sabun denir. Çok eski çağlardan beri kullanılan en önemli temizlik maddeleridir.
 EVDE KİMYA SABUN Yağ asitlerinin Na ve ya K tuzuna sabun denir. Çok eski çağlardan beri kullanılan en önemli temizlik maddeleridir. CH 3(CH 2) 16 COONa: Sodyum stearat (Beyaz Sabun) CH 3(CH 2) 16 COOK:
EVDE KİMYA SABUN Yağ asitlerinin Na ve ya K tuzuna sabun denir. Çok eski çağlardan beri kullanılan en önemli temizlik maddeleridir. CH 3(CH 2) 16 COONa: Sodyum stearat (Beyaz Sabun) CH 3(CH 2) 16 COOK:
Atomlar ve Moleküller
 Atomlar ve Moleküller Madde, uzayda yer işgal eden ve kütlesi olan herşeydir. Element, kimyasal tepkimelerle başka bileşiklere parçalanamayan maddedir. -Doğada 92 tane element bulunmaktadır. Bileşik, belli
Atomlar ve Moleküller Madde, uzayda yer işgal eden ve kütlesi olan herşeydir. Element, kimyasal tepkimelerle başka bileşiklere parçalanamayan maddedir. -Doğada 92 tane element bulunmaktadır. Bileşik, belli
5) Çözünürlük(Xg/100gsu)
 1) I. Havanın sıvılaştırılması II. abrika bacasından çıkan SO 3 gazının H 2 O ile birleşmesi III. Na metalinin suda çözünmesi Yukardaki olaylardan hangilerinde kimyasal değişme gerçekleşir? 4) Kütle 1
1) I. Havanın sıvılaştırılması II. abrika bacasından çıkan SO 3 gazının H 2 O ile birleşmesi III. Na metalinin suda çözünmesi Yukardaki olaylardan hangilerinde kimyasal değişme gerçekleşir? 4) Kütle 1
PROJENİN AMACI. İÇEÇEKLERİN ph DEĞERLERİNİN ÖLÇÜLÜP MİDENİN ph DERECESİ KARŞILAŞTIRILMASI VE DEĞERLENDİRİLMESİ
 PROJENİN AMACI İÇEÇEKLERİN ph DEĞERLERİNİN ÖLÇÜLÜP MİDENİN ph DERECESİ KARŞILAŞTIRILMASI VE DEĞERLENDİRİLMESİ Bir toplumun içecek kültürü, yaşam şekliyle yakından ilgilidir. Yaşam şeklinin değişmesi, içecek
PROJENİN AMACI İÇEÇEKLERİN ph DEĞERLERİNİN ÖLÇÜLÜP MİDENİN ph DERECESİ KARŞILAŞTIRILMASI VE DEĞERLENDİRİLMESİ Bir toplumun içecek kültürü, yaşam şekliyle yakından ilgilidir. Yaşam şeklinin değişmesi, içecek
Çalışma Kâğıdı Tabloyu doldurunuz. 2. Çalışma hipotezleri: Grup İsmi:... Tarih:... Örnekler Tat Koku Diğer Özellikler
 Grup İsmi:... Tarih:... Çalışma Kâğıdı 1 1. Tabloyu doldurunuz. Örnekler Tat Koku Diğer Özellikler Sirke Limon suyu Tebeşir tozu Portakal suyu Yoğurt Karbonat Diş macunu Tuz 2. Çalışma hipotezleri:........................
Grup İsmi:... Tarih:... Çalışma Kâğıdı 1 1. Tabloyu doldurunuz. Örnekler Tat Koku Diğer Özellikler Sirke Limon suyu Tebeşir tozu Portakal suyu Yoğurt Karbonat Diş macunu Tuz 2. Çalışma hipotezleri:........................
kimyasal değişimin sembol ve formüllerle ifade edilmesidir.
 myasal reaksiyon Bir (veya birden fazla ) madde nin etkileşim sonucu yeni madde(lere) dönüşmesi işlemidir. ziksel değişim - renk değişimi - çökelek oluşumu - gaz çıkışı - ısı değişimi imyasal denklem aktif
myasal reaksiyon Bir (veya birden fazla ) madde nin etkileşim sonucu yeni madde(lere) dönüşmesi işlemidir. ziksel değişim - renk değişimi - çökelek oluşumu - gaz çıkışı - ısı değişimi imyasal denklem aktif
BİLEŞİKLER VE FORMÜLLERİ
 BİLEŞİKLER VE FORMÜLLERİ Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur). Bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere
BİLEŞİKLER VE FORMÜLLERİ Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur). Bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere
Ünite: 4. BAZLAR Suda çözündüğünde OH - iyonu veren maddelere H H + H+ OH - gazı oluşturur.
 4. FÖY FEN BİLİMLERİ Madde VE ENDÜSTRİ LGS ASİTLER VE BAZLAR Neler Öğreneceğiz? 2 Ders Saati Ünite: 4 Asitler ve Bazlar ph Kavramı Asit ve Bazların Etkileri Asit Yağmurları Asitler ve Bazlar ASİTLER Suda
4. FÖY FEN BİLİMLERİ Madde VE ENDÜSTRİ LGS ASİTLER VE BAZLAR Neler Öğreneceğiz? 2 Ders Saati Ünite: 4 Asitler ve Bazlar ph Kavramı Asit ve Bazların Etkileri Asit Yağmurları Asitler ve Bazlar ASİTLER Suda
ALKALİNİTE. 1 ) Hidroksitler 2 ) Karbonatlar 3 ) Bikarbonatlar
 ALKALİNİTE Bir suyun alkalinitesi, o suyun asitleri nötralize edebilme kapasitesi olarak tanımlanır. Doğal suların alkalinitesi, zayıf asitlerin tuzlarından ileri gelir. Bunların başında yer alan bikarbonatlar,
ALKALİNİTE Bir suyun alkalinitesi, o suyun asitleri nötralize edebilme kapasitesi olarak tanımlanır. Doğal suların alkalinitesi, zayıf asitlerin tuzlarından ileri gelir. Bunların başında yer alan bikarbonatlar,
Bu tepkimelerde, iki ya da daha fazla element birleşmesi ile yeni bir bileşik oluşur. A + B AB CO2 + H2O H2CO3
 DENEY 2 BİLEŞİKLERİN TEPKİMELERİ İLE TANINMASI 2.1. AMAÇ Bileşiklerin verdiği tepkimelerin incelenmesi ve bileşiklerin tanınmasında kullanılması 2.2. TEORİ Kimyasal tepkime bir ya da daha fazla saf maddenin
DENEY 2 BİLEŞİKLERİN TEPKİMELERİ İLE TANINMASI 2.1. AMAÇ Bileşiklerin verdiği tepkimelerin incelenmesi ve bileşiklerin tanınmasında kullanılması 2.2. TEORİ Kimyasal tepkime bir ya da daha fazla saf maddenin
5. GRUP KATYONLAR (Alkali grubu)
 5. GRUP KATYONLAR (Alkali grubu) Mg +2 Na + K + Li + Bu gruptaki katyonların hepsini çöktürebilen ortak bir reaktif yoktur. Na, K ve Li alkali metaller grubunun üyeleridir. NH 4 da bileşikleri alkali metal
5. GRUP KATYONLAR (Alkali grubu) Mg +2 Na + K + Li + Bu gruptaki katyonların hepsini çöktürebilen ortak bir reaktif yoktur. Na, K ve Li alkali metaller grubunun üyeleridir. NH 4 da bileşikleri alkali metal
PH DEĞERİNİN TAYİNİ 1. GENEL BİLGİLER YTÜ ÇEVRE MÜHENDİSLİĞİ BÖLÜMÜ ÇEVRE KİMYASI I LABORATUVARI
 1. GENEL BİLGİLER PH DEĞERİNİN TAYİNİ ph bir çözeltinin asitlik özelliğinin göstergesi olup, hidrojen iyonunun aktivitesinin eksi logaritmasına ( log [H + ]) eşittir. Çevre Mühendisliği uygulamalarında
1. GENEL BİLGİLER PH DEĞERİNİN TAYİNİ ph bir çözeltinin asitlik özelliğinin göstergesi olup, hidrojen iyonunun aktivitesinin eksi logaritmasına ( log [H + ]) eşittir. Çevre Mühendisliği uygulamalarında
TAMPON ÇÖZELTİLER-2. Prof.Dr.Mustafa DEMİR M.DEMİR(ADU) 12-TAMPON ÇÖZELTİLER-2 1
 TAMPON ÇÖZELTİLER-2 Prof.Dr.Mustafa DEMİR M.DEMİR(ADU) 12-TAMPON ÇÖZELTİLER-2 1 Tampon çözelti Tampon çözelti: Konjuge asit-baz çiftinin bulunduğu ve ph değişmelerine karşı direnç gösteren çözeltilere
TAMPON ÇÖZELTİLER-2 Prof.Dr.Mustafa DEMİR M.DEMİR(ADU) 12-TAMPON ÇÖZELTİLER-2 1 Tampon çözelti Tampon çözelti: Konjuge asit-baz çiftinin bulunduğu ve ph değişmelerine karşı direnç gösteren çözeltilere
00213 ANALİTİK KİMYA-I SINAV VE ÇALIŞMA SORULARI
 00213 ANALİTİK KİMYA-I SINAV VE ÇALIŞMA SORULARI A) TANIMLAR, KAVRAMLAR ve TEMEL HESAPLAMALAR: 1. Aşağıdaki kavramları birer cümle ile tanımlayınız. Analitik kimya, Sistematik analiz, ph, Tesir değerliği,
00213 ANALİTİK KİMYA-I SINAV VE ÇALIŞMA SORULARI A) TANIMLAR, KAVRAMLAR ve TEMEL HESAPLAMALAR: 1. Aşağıdaki kavramları birer cümle ile tanımlayınız. Analitik kimya, Sistematik analiz, ph, Tesir değerliği,
ASİTLER VE BAZLAR 1. ASİT VE BAZLARI TANIYALIM. Asitlerin Özellikleri
 ASİTLER VE BAZLAR 1. ASİT VE BAZLARI TANIYALIM Asitlerin Özellikleri Tatları ekşidir. Aşındırıcı özellikleri vardır. Cildi, mermer yüzeyi aşındırırlar ancak asitlerin çoğu plastik, cam veya metal yüzeyleri
ASİTLER VE BAZLAR 1. ASİT VE BAZLARI TANIYALIM Asitlerin Özellikleri Tatları ekşidir. Aşındırıcı özellikleri vardır. Cildi, mermer yüzeyi aşındırırlar ancak asitlerin çoğu plastik, cam veya metal yüzeyleri
4. Asit ve baz tepkimeleri ile ilgili olarak öğrenciler; 4.1. 4.2. 4.3. 4.1 4.4. 4.5. 4.6. 4.7. 4.8. 4.9. 4.10. 4.11. 4.
 4. Asit ve baz tepkimeleri ile ilgili olarak öğrenciler; 4.1. Asitleri ve bazları; dokunma, tatma ve görme duyuları ile ilgili özellikleri ile tanır. 4.2. Asitler ile H + iyonu, bazlar ile OH - iyonu arasında
4. Asit ve baz tepkimeleri ile ilgili olarak öğrenciler; 4.1. Asitleri ve bazları; dokunma, tatma ve görme duyuları ile ilgili özellikleri ile tanır. 4.2. Asitler ile H + iyonu, bazlar ile OH - iyonu arasında
BİLEŞİKLERİN ADLANDIRILMASI. Bileşikleri isimlendirmek için elementlerin ve bazı köklerin değerliklerinin ve isimlerinin bilinmesi gerekir.
 BİLEŞİKLERİN ADLANDIRILMASI Bileşikleri isimlendirmek için elementlerin ve bazı köklerin değerliklerinin ve isimlerinin bilinmesi gerekir. Bileşiklerin İsimlendirilmesi: 1.METAL-AMETAL(İYONİK ) BİL. İSİMLENDİRİLMESİ
BİLEŞİKLERİN ADLANDIRILMASI Bileşikleri isimlendirmek için elementlerin ve bazı köklerin değerliklerinin ve isimlerinin bilinmesi gerekir. Bileşiklerin İsimlendirilmesi: 1.METAL-AMETAL(İYONİK ) BİL. İSİMLENDİRİLMESİ
