1.1: Sürekli ve kesikli spektrum
|
|
|
- İbrahi̇m Muhiddin
- 8 yıl önce
- İzleme sayısı:
Transkript
1 Bölüm 1 ATOMUN YAPISI 1.1: Sürekli ve kesikli spektrum Beyaz k prizmadan geçirildiinde dalga boylarna göre krlarak bileenlerine ayrlr( ekil 1). Buna görünür n spektrumu denir. Renkler arasnda kesin bir snr olmamas nedeniyle bu tür spektrumlara sürekli spektrum denir. Yamurlu havalarda oluan gök kua! da sürekli bir spektrumdur. Eer bir atomdan yaylan n prizmadan geçirilecek olursa kesikli spektrum veya çizgi spektrumu elde edilir(ekil ).
2 ekil 3 de Hidrojen gaznn görünür bölgedeki çizgi spektrumu görülmektedir. Bu çizgilerin frekanslarn veren ampirik bir eitlik ilk kez Balmer tarafndan ortaya konmutur(1885). Bu nedenle bu seriye Balmer serisi denir. 1 = s 1 1 n n = 3,4,5 (1.1) Daha sonralar Hidrojenin tüm spektrum çizgilerinin frekanslar aadaki eitlikle bulunmutur. Bu seriler, bulan kiilerin adlar ile anlr: 1 v = 3, s -1 1 n i n d Lyman (UV= ultra viole ) serisi: ni = 1 Balmer ( visible ) serisi : ni = Paschen ( IR=infrared ) serisi: ni = 3 Pfund ( IR=infrared ) serisi: ni = 4 deerlerini alr Elementlerin çizgi spektrumlar onlarn parmak izi gibidir. Bu nedenle spektrumlarn analizinden elementler tayin edilirler. 1.. Atomik Spektrum ve Bohr Atom modeli 1913 de Niels Bohr Hidrojenin spektroskopik gözlemlerinden yararlanarak kendi adyla anlan Bohr atom modelini önerdi. Model, atomu güne sistemine benzetir. Proton ve nötronlardan ibaret çekirdek merkezde bulunur,
3 Elektronlar çekirdein çevresinde belirli enerjili yörüngelerde hareket ederler Neils Bohr bir yörüngenin (orbit) enerjisini ve yarçapn klasik mekanie göre öyle hesaplamtr: r yarçapl yörüngede v hzyla hareket eden ve kütlesi m olan bir elektronun için mv Merkez kaç kuvvet = r Elektronun yükü e, çekirdekteki yük says Z, vakumun geçirgenlii >o ise, Ze kulombik çekim = 4 r 0 dr. Bu iki kuvvet eit olmaldr: Aksi halde elektron ya atomdan uzaklar, ya da çekirdein üzerine düer. mv Ze = r 4 r 0 (1,1) Buradan öyle bulunur, v Ze = (1.) 4 mr 0 Öte yandan Planck n kuant teorisine göre enerji sürekli olmayp kuantlar (paketler ) halinde yaymlanr ve büyüklüü h/b dr. Kuantlara daha sonra Einstein foton demitir E = h h = Planck sbt = 6, Js. Yörüngedeki bir elektronun enerjisi, onun açsal momentumuna eittir. Açsal momentumun =mvr Açsal momentum, bir kuantn deerinin n tam say ile çarpmna eit olmaldr: n = 1,,3,4. kuant saysdr.
4 nh mvr = Bu eitlikten de v hesaplanr ve v = n h 4 m r Bu eitlik, eitlik () ile birletirilirse Ze 4 mr 0 = n h 4 m r r = n h 0 n a0 = Zme Z (1.3) bulunur. ao = 0,059 nm = Bohr yarçap denir, Z çekirdek yükü, m elektronun kütlesi. e elektronun yükü olduunu daha önce söylemitik. Hidrojen için Z =1 n = 1 için = 1 x 0,059 nm n = için = x 0,059 nm n = 3 için = 3 x0,059 nm Bu sonuç elektronun yarçap 1,, 3 ile orantl dairesel yörüngelerde hareket ettiini gösterir. Bu yörüngelerin enerjisini de aadaki ekilde hesaplamtr: 1 Elektronun kinetik enerjisi = - mv dikkate alnarak eitlik (1) yeniden düzenlenir, 1 Ze E = - mv = - 8 o r Ve eitlik (3) teki r nin deeri burada yerine konarak yörüngenin enerjisi öyle bulunur: 4 Z me 13.6Z E = - = - 8n h n 0 ev (1.5) (1.4) n = 1,, 3, 4 kuant saysn ( K.L,M,N yörüngelerini) gösterir.
5 Atom sadece 6E = hv (v =nü frekans) kadar enerji absorblar veya yaymlar. Eer E daha d yörüngenin, E1 ise iç yörüngenin enerjisini göstersin. Fark 6E = hv = E - E1 dir. E deerleri yerine eitlik (1.5) ki karlklar konursa, KE = h v = 1 13,6 n1 1 ev n Sonucu bulunur. 1 ev = Joul, v = c, KE= hc/ : ve dalga say!s! = 1 de erleri kullanarak ve n1 yerine ni( i=iç), n yerinede nd (d= d ) koyarak yukarda ki eitlii daha genel bir eitlik olan dalga say!s! cinsinden verebiliriz: 1 R 1 1 ni nd = H 19 13,6.1,60.10 J Burada RH = ,66.10 Js.3.10 ms (1.6) = 1, m -1 Rydberg Sabiti denir Bohr manyetik alan yokken hidrojen atomunun spektrumunu açklamada son derece baarl olmutur. Oysa manyetik alanda daha karmak bir spektrum gözlenir (Zeeman etkisi ). Bu problem, daha sonra temelde Bohr modeli ele alnarak Sommerfeld tarafndan ortadan kaldrlmtr. Ancak teklif edilen modellerin çok elektronlu atomlarda yetersiz, hatta kullanlamaz olduklar görüldü. Buda, modelin daha da gelitirilmesi gerektiini ortaya çkard. ekil 5 Bohr modelinin ekli ve çizgi spektrumundaki çizgilerin dalga saysnn nasl bulunduu açk bir ekilde görülmektedir. Örnek: nd = 3 ten, ni = ye elektron geçiine tekabül eden n dalga saysn serisini hesaplaynz ve hangi seride olduunu belirtin? cevap: Eitlik 1. de deerler yerine konarak hesaplama yaplr; v = ,58 (1/4-1/9 )=15.33 cm - bulunur. ni= ye geçi Balmer serisini belirtir.
6 ekil 3 Bohr atom modeli (
7 Tablo 1 de Hidrojenin spektrum çizgilerinin dalga boylar ve frekanslar verilmitir. seriler Dalgaboyu( nm) Frekanslar(cm -1 ) nd ni 93, Lyman 95, , , , , , Balmer 434, , , , Pacshen 1005, , ,8 r , Bracket Pfund : Kuantum mekani i : Belirsizlik prensibi: Kuantum mekaniinin önemli sonuçlarndan biri, bir taneciin momentumunu ve yerini ayn anda tam olarak tanmlamann imkânsz olduunu göstermesidir. Bu sonuç belirsizlik prensibi olarak Werner Heisenberg tarafndan 196 da ifade edilmitir. Eer bir taneciin yerindeki belirsizlii Kx, momentumundaki belirsizlii Kp ile gösterirsek, bu prensip iki belirsizliin çarpmnn u eitlii salamas gerektiini ifade eder: 6x.6x S h = Js.) ( 1.7) Eitlik, iki belirsizliin çarpmnn sabit olduunu gösterir. Bu nedenle yerini hassas olçmeye çalrken, momentumunda büyük bir belirsizlik meydana gelir, yada tersi. Bunu aadaki örnekte görebiliriz.
8 Örnek : T = 0,05 A o olan bir dalga ( kinetik enerjisi oldukça büyük) kullanlarak elektronun yerini hassas olarak ölçmek isteyelim. 1 A o = 10-8 cm Kp S erg Kp = mv = S / Elektronun kütlesi m = 9, g. yerine konduunda v = cm/ s gibi hemen hemen k hzna ( c = cm/ s) yakn bir belirsizlik bulunur. BelirsizIik prensibinin anlam, Bohr un önerdii yörüngeleri inkâr etmesidir: Yörünge kavramnn anlaml olmas için, elektronun momentumunu ve yerini kesin olarak tanmlamamz gerekir ( tpk gezegenlerinki gibi ). Ancak belirsizlik prensibi bize bunun imkânsz olduunu gösterir. Yörünge kavram sadece gezegenler için geçerlidir. Bu prensip Bohr modelinin tamamen geçersiz olduunu göstermitir. 1.3 : De Broglie eitli i ve kinetik enerji Kuantum mekaniinin formüle edilmesinde ilk katk Fransz fizikçi Louis De Broglie tarafndan yapld. Broglie elektronun dalga / tanecik tabiatnda olduunu teklif etti. Broglie'ye göre elektronun dalga boyu onun momentumuna (P=mv)baldr: P = h h = planck sabiti ( J.s) (1.8) h : = mv Dalga boyu ile tanecik (kütle) arasndaki iliki görülür. Belirli bir hza ulaan elektronun (taneciin )krnm özellikleri( tipik dalga özellii) göstermesi ve dalgann dalga boyunun De Broglie eitliinden beklenenle uyum içinde olmas eitliin doruluunun kantdr. Elektronlarn dalga özelliinin pratikteki uygulamas, elektron mikroskobudur. Elektronlar belirli bir hza ulatrmak için ( bu hzdaki elektronun dalga boyu yaklak 0,1 A o dür) 0 kv. Potansiyel fark kullanlr. Elektronlarn dalga boyu, molekülerin ba uzunluklar ile kyaslanabilir mertebede olduundan (ba uzunluklar tipik olarak 1 A o civarndadr) elde edilen krnm modeli, molekülerin yaplarnn ayrntlarn elde etmek için analizlenebilir. Eitlik(1.6) ya göre, elektronun momentumu ne kadar büyükse dalga boyu o kadar
9 küçüktür. Öte yandan bir elektronun kinetik enerjisi, onun momentumunun karesi ile orantldr, KE = P m e = m v m e = 1 mv 1.9 O halde elektronun dalga boyu küçüldükçe kinetik enerjisi artar. Dalga boyu büyüdükçe kinetik enerjisi azalr :Kutu modeli ve enerjinin kuantlamas! Atomlarn foton!!nlar! ( KE = h v ) yaydn daha önce söylemitik. Foton nlarn frekanslar (v) belli deerler alabildiine göre, atomlar belli deerlerde enerji yayarlar. Buna enerjinin kuntlamas denir. Atomlar ve moleküller için Schrodinger eitlii çözüldüünde fiziksel anlam olan dalga fonksiyonlarnn sadece belirli enerji deerleri için var olduu bulunur. Yani enerjinin kuantlamas Schrodinger eitliinin direkt bir sonucudur. Kuantlamay gösteren en basit model kutu modelidir( ekil 5). ekil 3 Kutu içindeki taneciin ilk dört dalga fonksiyonu a x Çözümü basitletirmek için taneciin (elektronun )kutuda tek boyutta hareket ettiini düünelim. Elektronu kutu içinde tutabilmek için I. ve III. bölgelerde potansiyel enerji V = W olmaldr. II. bölgede V = 0 olduundan elektronun kinetik enerjisi her hangi bir
10 deeri alabilir ve elektron Newton mekani ine göre kutunun herhangi bir yerinde olabilir. Elektrona elik eden dalgalar sinüs dalgalandr ve kutu duvarlar arasndaki bölgeye sar. Bu nedenle izin verilen dalga boylar öyledir: T = a/ n n = 1,,3,... Dalga boyu a/n olan dalgalar I = Sin Jx /: = Sin njx /a Sinüs dalgalar eklindedir. Taneciin momentumu De Broglie nin tanmndan belli, P = h = nh a n= 1,,3.... (1.10) kinetik enerjisinin de (tanecik sadece kinetik enerjiye sahiptir), momentumu ile ilgili olduunu biliyoruz: Ek = p m e (1,11) Bu nedenle taneciin alabilecei enerjiler n h E = n = 1,, 3,... (1.1) 8ma eklinde bulunur. Eitlik elektronun toplam enerjisinin n kuant saysna bal deerler alacan gösterir. Buna enerjinin kuantlamas denir. Kuantlama kavram, enerjinin sürekli bir deiim izlemeyeceini ancak kesikli de erler alaca!n! gösterir. Daha genel hal, üç boyutlu kutu içindeki elektronun enerjisi aadaki eklide bulunur: h n n x y nz E = ( + + ) (1.13) 8m a b c Son iki eitlikte her bir serbestlik ( boyut) için bir kuant saysna ihtiyaç olduu görülür. Bu yüzden üç boyutlu bir atom için, elektronun uzaysal pozisyonuyla ilgili üç kuant says beklemeliyiz. Kutu modeli hesaplamalarnn ilginç sonuçlarndan biride klasik tahminden farkl
11 olarak ; 1- Taneciin bulunma olaslnn sabit olmayp, x in bir fonksiyonu olmas, - Taneciin kutunun belirli bir yerinde bulunma olasl onun enerjisine bal olmas 1.3.4: Schrodinger dalga eitli i Elektronun dalga özellii gösterdiini daha önce belirtmitik. O zaman bir dalga denklemi olmal. Denklem 196 da Schrodinger tarafndan teklif edildi. Bu denklem kuantum mekaniinin temel eitliklerinden biri olup, modern kuantum teorisinin douunun balangcdr. Mikroskobik tanecikler kuantum mekaniine, makroskopik tanecikler klasik mekanie uygun olarak davranrlar. Uç boyutlu Schrodinger dalga eitli i öyledir: 8m ( E V ) = 0 x y z h ( 1.14) Burada X (pisi) : Dalga fonksiyonu, E:toplam enerji x,y,z: koordinatlar, V:Potansiyel enerji m: elektron kütlesi h: planck sabiti Dalga denkleminin çözümü, dalga fonksiyonu X yi verir. Gerçek dalgalar için X, dalgann genliine karndr, Fakat burada böyle bir fiziksel anlam yoktur. Ancak karesinin mutlak deerinin II I önemli bir fiziksel anlam vardr: Taneciin bulunma olaslnn matematiksel bir ifadesidir. (Gerçek dalgalarda n iddeti genliinin karesi ile orantldr. ) Hidrojen Atomu Schrödinger eitliinin hidrojen atomu için çözümü o kadar zor deildir. Ancak biz, burada problemi çözmeyeceiz. Çünkü bizim için, problemin çözüm metodundan çok sonuçlan ilgilendirir. Bununla beraber çözüm metodu daha önce verilen kutu modeline benzemedii söylenebilir. Hidrojen atomu durumunda, kutu küre seklindedir. Kutu modelinde olduu gibi baz kabullenmelerle dalga eitliinin çözümü mümkün hale getirilir: 1- Dalga fonksiyonu tek deerli olmaldr. - Dalga fonksiyonu sürekli olmaldr. 3- Dalga fonksiyonu, sonsuzda sfr olmaldr. 4- Elektronun tüm uzayda bulunma olasl bir olmaldr: Yani dalga fonksiyonu
12 normalize olmaldr. Z X dxdydz = 1 Üç boyutlu kutu modelinde olduu gibi, Schrödinger eitliinin hidrojen atomu için çözümünden de üç kuantum says elde edilir ( n, l, m ) Kartezyen koordinatlar ile tanmladmz üç boyutlu kutudaki kuantum saylar ayn arlkta olduklar halde, küresel polar koordinatlarda ( ekil 6) bu kuantum saylarnn arlklar ve toplam enerjiye katklar birbirinden farkldr. ekil 6. Küresel polar koordinatlar : x = r sinø.sin, y= r sin. cos, z = r cos Denklemin her bir çözümünden eigenfunction denen ve orbitalleri belirleyen bir seri n,l ve m deerleri elde edilir. n l ml Orbital türü Orbital says s ,0,+1 0-1,0,+1 -,-1,0,+1,+ s p 3s 3p 3d Elektronun atom içindeki gerçek dalmn daha kolay görünür hale getirmek için dalga fonksiyonu X( e:10) deki x,y,z kartezyen koordinatlar yerine polar koordinat deerleri(ekil 6) konur ve eitlik
13 ( r sin.sin) 8m ( E V ) = 0 ( r sin.cos ) ( r cos ) h Fonksiyon; aadaki gibi X ( r ø ) = R(r ) Ø(ø ) () r,, gibi tek bir deikene bal üç fonksiyona bölünebilir: Burada, R(r), X nin çekirdekten uzaklna, yani n ba kuant saysna (), açsal bam1ln, yani l açsal kuantum saysna. Ø(ø), açsal bam1ln, yani ml manyetik kuantum saysna :Radyal Dalga Fonksiyonu, R(r) Hidrojen atomu için ilk üç orbitalin radyal fonksiyonlar aadaki tabloda verilmitir. n =1,l =0,ml = 0 n =,l =0,ml = 0 1s orbitali s orbitali R = ( R = Z R = ) 3/ e -Zr/ao K1s e -Zr/ao a o Z ( ) 3/ ( - 1 ao Zr ) e -Zr/ao a o R=K s(- Z ) 3/ e -Zr/ao a o n =,l =1,ml = 0 p orbitali R = Z Zr ( ) 3/ ( ) e -Zr/ao 1 6 ao a o R = Kp r e -Zr/ao Verilen bir atom için Z sabit olacandan, dier sabitlerle birletirilerek fonksiyonlar daha basit olarak sa sütunda verilmitir. Burada Z = Çekirdek yükü, e= Tabii logaritma taban, ao = ilk orbital için Bohr yarçap ao = 5,9 pm. = 0, 59 A 0 ( ao = h / 4 mb e ) Hidrojen için Z = 1 dir. Z > 1 olan elementler için benzer orbitaller yaplabilir. Çok elektronlu atomlar için dalga fonksiyonunun tam çözümleri imkânszdr. Fakat ilk yaklam olarak hidrojen benzeri" orbitaller skça kullanlr. Bu ifadelerde iki nokta göze çarpar: 1 ) Radyal dalga fonksiyonu üstel olarak azalmaktadr. Bu azalma n = halinde n = 1 e
14 oranla daha yavatr. Bu azalmay tüm radyal fonksiyonlar için e Zr / nao eklinde genelletirebiliriz. Bu nedenle, çeitli orbita1lerin yarçap n arttkça artar. ) s radyal dalga fonksiyonunda bir node* un mevcudiyetidir. r =ao /Z halinde R=0 olur. Radyal fonksiyonun deeri pozitiften negatife deiir. Bunu genelletirirsek; s orbitallerinde: n - l p orbitallerinde: n - d orbitalerinde: n - 3 vs node vardr. ekil 1.4 de Hidrojen atomunun Is, s, p, 3s, 3p, 3d orbitallerine ait radyal fonksiyonlar görülmektedir ekil 1.4 de Hidrojen atomunun radyal fonksiyonlar! Elektronun uzayn çeitli noktalarnda bulunma olasl ile ilgilendiimize göre, radyal fonksiyonun kendisi deil karesi bizi daha çok ilgilendirir. Probleme öyle yaklaalm: Atomun tabakalardan meydana geldiini ve elektronun bulunma olaslnn bu tabakalar içinde olabileceini düünelim. Tabakalar ekil. 5 de
15 görülmektedir. ekil 1.5: Küre katmanlar Kürenin hacmi: V = 4/3Br 3, Kabuun hacmi: dv = 4Br dr Radyal fonksiyonun karesi ile kabuun hacminin çarpm radyal olas!l!k fonksiyonunu verir: R dv = R 4Jr dr. Burada dr çok ince olduundan ihmal edilebilir. ekil 1.6 da Hidrojen atomunun Is,s,p,3s,3p,3d orbitallerinin radyal olas!l!k fonks. Bu fonksiyon ve erilerden balca u özellikler görülebilir: 1) r =0 olduunda, 4nr R = 0 olur. Yani çekirdekteki deer sfr olmaldr.
16 ) Büyük r deerlerinde R -->(0) a yaklar ve 4Br R deeri de sfra yaklamaldr. 3) Ortalarda r ve R nin ikisi de belirli deerlere sahiptir. Bu nedenle r ye kar çizilen 4Br R nin erisi bir maksimum göstermelidir. Bu maksimum r = ao da yani Bohr yar çapnda meydana gelir. s orbitalinin radyal fonksiyon erisi hem pozitif (r < ao/z) hem de negatif (r > ao/z) olmakla beraber, Radyal olaslk fonksiyon erileri, R nin karesinin alnmas ile her yerde pozitifdir. Radyal fonksiyonun + dan - ye geçii, elektronun parçack olarak düünüldüünde bir çeliki gibi görülebilir. Fakat elektronun bir dalga olarak düünülmesi ile bu çeliki ortadan kalkar. Bu durumda elektron node'un her iki yüzünde de bulunabilir. Bir veya daha fazla node nin bulunuu, çekirdek ve en büyük maksima arasnda küçük maksimalara neden olur. Bu da buralarda elektron younluu olduunu gösterir. Bunlarn balanmaya etkisi aadaki ekilde açklanr: 1) Kovelent bir ban oluabilmesi için. Atomik orbitallerin tam örtümesi (overlap) gerekir. ( bu konu ilerde görülecektir.) Düük elektron younluklannn olduu bölgelerde ve özellikle dalga fonksiyonunun iaretinin deitii yerlerde iyi örtüme elde edilemez. ) s orbital elektronlar, zamanlarnn çok az bir ksmn çekirdee yakn bölgelerde geçirirler. Buda orbital enerjilerinin hesaplanmasnda son derece önemlidir. Belli bir n deeri için s elektronlarnn iyonlama enerjileri p elektronlarnkinden daima daha büyüktür. Çünkü s elektrolar çekirdek bünyesinde önemli elektron younluuna sahiptirler. Bu nedenle orbital enerji sralamas, s.s,p,3s,3p eklinde azalr :Dalga fonksiyonunun aç!sal k!sm! Elektron bulutunun eklini, eklin s,p,d,f orbital tiplerine bal olarak deiimini ve uzayda yönelilerini tayin eder. Bununla beraber s veya p gibi verilen bir orbital tipi için açsal dalga fonksiyonu ba kuantum saysna (n ),yada enerji seviyesine bal deildir. Baz tipik açsal fonksiyonlar u ekilde gösterilir: l = 0, m = 0 için Ø = (1/4 B) 1/ s orbitali l = 1, m = 0 için Ø = (3/4 B) 1/ cos pz orbitali l =, m = 0 için Ø = (6/16 B) 1/ 3cos-1 dz orbitali s ve p orbitali icin açsal fonksiyonlar ekil 1.7 da verilmitir: s orbitalleri Ø ye bal olmayp küresel bir simetriye sahiptir. Pz orbitali için z eksenine yönelmi iki küre ekli elde edilir, Px ve Py orbitalleride Pz orbitali ile tamamen ayn ekildedir. Ancak bunlar x ve y eksenine yönelmitir
17 ekil 1.8 : S ve Pz orbitallerinin açsal fonksiyonlar Açsal fonksiyonun çözümü d orbitalleri için dört loblu, f orbitalleri içinde alt loblu ekil verir. Elektronun bulunma olasl bizi daha çok ilgilendirdii için, X nin açsal ksmna kar gelen ksmn karesini ( Ø) almak gerekir.. Açsal fonksiyonun karesi alndnda farkl orbitaller farkl ekilde deiirler. s orbitali için fonsiyonun karesi alndnda, her hangi bir yüzey deiiklii görülmez. Ancak baka bir küre elde edilir. p ve d orbitalleri için fonksiyonun karesi eliptik bir ekil ortaya çkarr ( eki1 1. 8). z ekil 1.8. pz orbita1inin yeni biçimi imdi elektronun bulunma olasl, X ile ilgili olduuna göre Radyal ksmn karesi ile açsal ksmn karesi birletirilerek grafik edilmesi gerekir. Böyle bir gösteri iki ekilde yaplr. Ya noktalama ya da younluk erileri eklinde( ekil 1.9 a,b,). (a) da Hidrojen benzer p orbitalinin elektron younluu noktalama medodu ile, (b)de de younluk erileri eklinde gösterilir.
18 ekil 1.9 Hidrojen benzer p orbitalinin elektron younluu a) noktalama. b) younluk erileri 1.4 :Orbital Simetrisi ekil 1.10 de s,p,d,f orbitallerinin dalga fonksiyonlarnn açsal ksmlan ematik olarak gösterilmitir. Lob "lardaki iaretler, yönelmelerdeki dalga fonksiyonunun ald iaretleri göstermektedir. Örnein p orbitallerinde = 90 için cos = 0 dr ve 90 < < 70 için cos =( - )deer alr dalga fonksiyonlarnn iaretleri iki ba orbitalinin örtüme si düünüldüü zaman önemlidir. Orbital simetrileri almanca iki kelime olan "Gerade" ve "Angerade" ile belirtmek adet olmutur. Gerade = edeer, Angerade = edeer olmayan eklinde tanmlanr. A noktasndan B noktasna merkezden geçilerek gidildiinde, dalga fonksiyonunun iareti deimiyorsa gerade, ksaca ( g), deiiyorsa ungerade, ksaca ( u ) denir. Bu durumda; s orbitalleri(g), p orbitalleri(u), d orbitalleri (g),f orbitalleri(u) simetrilerine sahiptir (ekil 1.10).
19 Srasyla s orbitali, dxy orbitali, dz orbitali, pz orbitali ve f orbitali ekil Orbital simetrileri 1.5. KUANT SAYILARI n : Bakuant say!s! : Schrodinger eitliinin Hidrojen atomu için çözümünden de enerji düzeylerini bakuantum says n nin tayin ettii bulunur. Enerji ile ba kuantum says arasndaki iliki Bohr atomundaki gibidir: 4 Z me En = - 8n h Z = - n ev Bohr un bu eitlii enerjinin kuantlamas ve yüklü bir taneciin açsal momentumunu dikkate alarak nasl çkardn daha görmütük. Hâlbuki bu sonuç kuantum mekaniinin bir sonucu olarak ortaya çkar. Kuantum says, n birden sonsuza kadar herhangi bir tam say deerini alabilir. n = 1,,3,4,...W En düük enerji ( en büyük negatif) n in minumum deerine ( n =1) tekabül eder. n arttkça enerji artar (daha az negatif olur ), taki n sonsuz olana kadar. n sonsuz olduunda elektron artk atoma bal deildir.
20 l: Aç!sal kuant say!s!: elektronun orbital açsal momentumunun bir ölçüsüdür ve orbitalin eklini tayin eder. l sfrdan (n 1) e kadar deer alabilir: l = 0,1,,3,...(n 1) l nin deerleri orbital tiplerini belirler: l = 0,1,, 3, 4. s,p, d, f, g... gibi harflerle gösterilir. elk dört harf spektroskopik iaretlerden geri kalan alfabetik olarak türetilmitir, Her hangi bir orbital türünden kaç tane olduu l+1 ifadesiyle bulunabilir. Örnein, l = 1 p orbitallerini gösterir. P orbitallerin says= x1+1 = 3 bulunur. Bunlar px,py ve pz ile gösterilir. x, y,z yöneldii eksenleri gösterir. Elektrik ve manyetik alan olmadnda üç p orbitali dejeneredir. Yan enerjileri ayndr.. Manyetik alan uygulandnda enerjileri farklanr. m : Manyetik kuantum say!s!, m seçilen bir eksene doru açsal momentum bileeni ile ilgilidir. Orbitalin uzayda yönelimini tayin eder. m deeri sfr( 0 ) dahil -l ile + l arasnda deerler alr: m = -1, (-l +1),..., -1, 0, +1, +, , +1. Buna göre 1 = 1 için m = -1,0,+1 olur. Bunlara tekabül eden üç örbital (px,py, pz) vardr. Benzer ekilde, 1 = (d orbitalleri ) için,m = -,-1,0,+ 1,+ olur. be d orbitali olduunu gösterir. 1 = 3 ( f orbitalleri ) için,m = -3,--,-1,0,+1,+,+3 olur. Yedi f orbitali vardr. Tek s orbitali küresel olarak simetriktir. Üç p orbital seti, be d orbital seti ve yedi f orbital setinin de küresel simetriye sahip olmas ilginç bir sonuçtur. Yukardaki kurallardan kuantum saylan, n, l, m nin alabilecekleri deerler ve karlkl ilikileri öyle gösterilebilir. n l m Orbital türleri ve saylar Is. 0 0 s 1-1,0, +1 p (x,y,z) s 3 1-1,0, +1 3p (x,y, z) 3 -, -1,0,+1, + 3d( z, x - y, xy, xz, yz) s
21 Bu bilgileri örendikten sonra, kuantum saylan arasndaki ilikiyi özetleyebiliriz: 1- Verilen bir atom için n deeri ne kadar küçükse, orbital o kadar kararldr (daha düük enerjili) - n. enerji düzeyinde n tane orbital tipi vardr. ( n=3 için s,p, d gibi) 3- her bir tipten kadar orbital vardr. (bir s, üç p,be d, yedi f gibi) 4- Tüm orbitallerin radyal dalm fonksiyonlarnda n-l-1 kadar node vardr. Örnein 3s orbitalinde = 3-0-1= node, 4d orbitalinde = 4--1=1 node vardr. ) 5- tüm orbitallerin açsal dalm fonksiyonlarnda l kadar nodal yüzey vardr. ( s orbitallari için l=0, sfr, d orbitalleri için 1 =, iki ) ms : Spin Kuantum say!s! ve Pauli Prensibi : Kutu modeli deneyimizden beklendii gibi, bir atomdaki elektronlarn uzaysal dalmn tanmlamak için üç kuantum says gerekir. Bir atomdaki bir elektronu tam olarak tanmlamak için Spin kuantum says, ms diye bilinen dördüncü bir kuantum says daha tanmlanmaldr. Her elektron bir manyetik momente sahiptir. Bu manyetik moment, uygulanan manyetik alana paralel veya zt olmak üzere iki mümkün yönelimden birinde kuantize olur. Manyetik momentin büyüklüü aadaki eitlikle verilir. µ =,00[ S(S + 1)] 1/ Burada µ, Bohr magnetonu olup = eh/4bm = 9,7-4 amp,m, S = ImsI olarak ifade edilir. ms, spin kuantum saysnn alabilecei deerler = ±1/ dir. eki elektronlu bir atom için spinler ya paralel ( S =1) veya zttr (S=0). S=0 halinde elektronlann manyetik momentleri birbirlerini yok eder. Bu durumda iki elektron çiftlemitir denir. Sadece çiftlemi (S = 0) elektronlar içeren atomlar bir manyetik alanda çok az itilirler. Bunlara diamanyetik atomlar denir. Bir veya daha fazla çiftlememi (S=0 deil) elektron içeren atomlar manyetik alanda kuvvetle çekilirler. Bunlara para manyetik atomlar denir. Ayn spine sahip elektronlar birbirlerini kuvvetle iterler ve uzayn farkl bölgelerinde bulunmay tercih ederler. Bu "Pauli exc1usion "prensibinin temel bir sonucudur. Buna göre ayn spine sahip iki elektronun farkl dalga fonksiyonlar olmal, yani farkl orbitallerde bulunmaldir. Bir baka deyile, bir atomda dört kuant says ayn olan iki elektron bulunamaz, n, 1, m, kuantum saylan ayn olsa bile spin kuantum saylan +1 / veya -1 / eklinde farkl olur 1.6 Çok elektronlu atom imdiye kadar sadece Hidrojen atomu ile ilgili tartmalar yaptk. Çünkü Schrodinger dalga eitliinin tam çözümü Hidrojen atomu için mümkündür. Tek elektronlu ve Hidrojene izoelektronik He +,Li +, Be 3+ gibi atomlar içinde, tekabül eden çekirdek
22 yükleri (Z) kullanlarak dalga denklemi çözülebilir. He, Hidrojenden sonra en basit atom olan He atomunda dikkate aldmzda üç etkileim söz konusudur : 1- Elektronlardan biri ile çekirdek arasndaki çekim, - Öteki elektronla çekirdek arasndaki çekim, 3- iki elektron arasndaki itme. Bu üç bilinmeyenli bir denklem olup tam olarak çözülemez, Bununla beraber, baz yaklamlar kullanarak büyük bir dorulukla çözüme yaklaabiliriz. Fakat daha ar atomlar için, etkileimler daha da artacandan hesaplamalar oldukça zorlar. Çözüm için çeitli yaklamlar vardr. En fazla tercih edilenler Hartre-Fock yöntemi veya Self- Consstent Feild (SCF) yöntemidir. Bu yöntem u hesaplamalar içerir; 1 -Bir atomdaki elektronlarn her biri için uygun dalga fonksiyonunu kabül eder, -Seçilen elektrona dier elektronlann ve çekirdek alannn etkisinin hesab, 3- Dier elektronlarn alann da içeren bir dalga fonksiyonunun çkanlmas. Seçilen bir elektron için yaplan bu hesaplamalar, aynen ikinci, üçüncü,... vs elektronlar için tekrarlanr. Bu ileme tüm elektronlarn dalga fonksiyonlar düzeltilinceye kadar birçok defa devam edilir. Sonunda dalga fonksiyonlarnda farkllklar ihmal edilebilecek deerlere elde varlr. En sonunda ele geçen fonksiyonlara Self-Consistent denir ve atomu belirlemede en doru deerleri verir. Yukardaki gibi hesaplamalar öteki atomlarn orbitallerinin, Hidrojen orbitallerinden farkl olmadn gösterir. Esas fark, nükleer yükün artmasndan kaynaklanr. Bu tip orbitallere hidrojen-benzer orbitaller ad! verilir. Verilen ana enerji seviyesindeki orbitallerin enerjileri s<p<d<f srasnda art bulunmutur. Yüksek enerji düzeylerinde orbitaller arasndaki bu enerji sralamasnda farkllk görülür. Örnein, 6s<5d 4f<6p gibi. Verilen bir örbitalin enerjisi çekirdek yüküne baldr. Farkl tip orbitaller farkl derecelerde etkilenir. Bu nedenle tüm elementler için için geçerli tek bir sralama yoktur. Bununla birlikte aada verilen sra, en uygun olarak tesbit edilmitir, Is<s<p< 3s< 3p<4s< 3d< 4p<5s< 4d< 5p< 6s< 5d 4f< 6p< 7s< 6d Ancak bu sralama yukarda belirtildii gibi, her bir element için tam olarak geçerli deildir. Bununla beraber tüm elementlerin valans elektronlarn bulmada son derece yararldr. Birçok hallerde orbitaller birbirine yakn enerjidedir ve atomdaki ufak deimeler enerji seviyelerinde, dolays ile elektronlarn doldurulma sralarnda deimelere neden olabilir. ekil 1.11 da Moeller tarafndan teklif edilen orbital enerji sralama diyagram görülmektedir.
23 l = Mevcut olmayan orbitaller Bilinmeyen elementlerde doldurulmam orbitaller ekil Moeller 'in orbital sralama diyagram 1.7:Atomlarn elektronik Yaplar: Orbitallerin enerji seviyeleri ve Pauli prensibi dikkate alnarak elektronlarn orbitallere yerletirilmesi, yani atomun inasna Aufbau Prensibi denir. Minimum enerjili temel hal yaklak elektron konfigürasyonu Aufbau prensibi kullanlarak yaplr. Hidrojen atomunda temel halde tek elektron en düük enerjili orbital olan Is de bulunacaktr. Elektronun spini her hangi bir yönelmede olabilir (+1/ veya -1/ ). Yani Hidrojen gibi bir örnekte spin için geliigüzel bir dalm beklenir. Gerçekten Hidrojen atomlan bir manyetik alanda incelenecek olursa, yarsnn uygulanan manyetik alan dorultuunda, öteki yansnn ise ters dorultuda yöneldii görülür. Bu nedenle Hidrojen atomu için dört kuantum says ( 1,0,0,±1/) eklinde yazlr. Hidrojenden Helyuma geçildiinde elektron says ikiye çkar. Bu ikinci elektron en düük enerjili orbital olan ls'e yerlemelidir. Tabii yerleirken, Pauli prensibi gerei spini zt olmaldr. Bu durumda He atomunun iki elektronu için dört kuant says: 1,0,0,+1/ veya 1,0,0,-1/ ile gösterilir. He' dan Lityuma geçildiinde,üçüncü
24 elektron Is den sonra gelen en düük orbital olan s te bulunmaldr. Aada ilk be elementin elektronik konfgürasyonu ve son elektronlarn kuantum saylan verilmitir: 1H = 1s 1 1,0,0,± 1/ He = 1s 3Li =1s s 1 1,0,0,± ½ 1,0,0,± ½ 4Be 1s s 1,0,0,± ½ 5B 1s s p 1 1,0,0,± ½ Bu ileme elementlerin tam listesi elde edilinceye kadar devam edilebilir. Elementlerin elektron yaplarna ait tam liste Çizelge 1.1 de verilmistir. Deneysel olarak bulunan bu liste ile Aufbau yöntemine dayal olarak elde edilecek liste arasnda sadece birkaç fark görülecektir. Enerji seviyelerinin birbirlerine son derece yakn olmas nedeniyle bunlar arasnda deiimin olduu görülür. Örnein (n-l)d ve ns enerji seviyeleri birbirine çok yakndr, hatta ns'in enerjisi daha düüktür. Dolu ve yar dolu alt kabuklarn bulunmas baz özel kararllklar gösterirse de, en kararl düzenleme (n-l)d X ns eklinde olmayabilir. Cr ve Cu atomlannda yar dolu ve tam dolu alt kabuklarla ilgili ekstra kararllk görülur. Temel halde Cr 3d 5 4s 1 ; Cu 3d 10 4s 1 eklindedir. Hâlbuki Aufbau yönteminden beklenen elektronik yaplar srasyla 3d 4 4s ve 3d 9 4s olmaldir. Bu iki elementin kimyas üzerine yukardaki farkllklarn etkileri çok azdr. Cu+ iyonu ( 3d 10 4s 0 ) kararldr, fakat Cu + iyonu bir çok kimyasal ortamda daha kararldr. Sulu çözeltilerde Kromun en kararl iyonu, Cr 3+ dür. Cr + ve Cr 6+ ( CrO4 - ) iyonlarda kararldr. Fakat Cr + pratik olarak yoktur.cu + ve Cr 3 + komplekslerinde( dier birçok geçit elementleri gibi) ligant etkileri nedeni ile d elektronlann kolaylkla verebilir. Lantanit elementlerinin (57-71) de 5d ve 4f enerji düzeyleri birbirine son derece yakndr. Lântanit elementlerinde 57.elektron 5d ye girer. Bundan sonra 4f dolmaya balar. Baz lântanit element atomlar hiç 5d elektronu içermez. Bununla beraber genellikle tüm lântanit elementleri 6s 5d 1 4f n genel elektronik yapsndadr denebilir. Bu durumda, üphesiz en kararl oksidasyon hali 6s ve Sd elektronlarnn ( üç elektron) kaybedilmesiyle oluan +3 deerliidir. Autbau prensibi ve orbital enerji sras, elektron konfigürasyonunu tayin etmek için güvenle kullanlabilmesine ramen yukardaki anormallikler aklda tutulmas gerekir. Aksi halde ciddi yanllklar meydana gelebilir. Örnein, Potasyum, Kalsiyum, Scandiyum elementlerinde 4s 3d den daha düük enerjilidir. Ancak bu durum daha
25 Çizelge 1. Elementlerin elektronik konfigurasyonlar 1 H 1s 1 53 I [Kr] 5s 4d 10 5p 5 He Is 54 Xe [Kr] 5s 4d 10 5p 6 3 Lj [He] s 1 55 Sr [Xe] 6s 1 4 Be [He] s 56 Ba [Xe] 6s 5 B [He] s p 1 57 La [Xe] 6s 5d 1 6 C [He] s p 58 Ce [Xe] 6s 5d 1 4f 1 7 N He] s p 3 59 Pr [Xe] 6s 4f 3 8 O [HeJ s p 4 60 Nd [Xe] 6s 4f 4 9 F [He] s p 5 61 Pm [Xe] 6s 4f 5 10 Ne [ He} s p 6 6 Sm [Xe] 6s 4f 6 11 Na [Ne} 3s 1 63 Eu [Xe] 6s 4f 7 1 Mg [NeJ 3s 1 64 Gd [Xe] 6s 5d 1 4f 7 13 Al [Ne] 3s 3p 3 65 Tb [Xe] 6s 4f 9 14 Si [Nc] 3s 3p 3 66 Dy [Xe] 6s 4f 10 ] 5 P [Ne] 3s 3p 3 67 Ho [Xe] 6s 4f 11 i 6 S [NeJ 3s 3p 4 68 Er [Xe] 6s 4f 1 17 Cl [Ne] 3s 3p 5 69 Tm [Xe] 6s 4f 13 I8 Ar [Ne] 3s 3p 6 70 Yh [Xe] 6s 4f K [Ar] 4s 1 71 Lu [Xe] 6s 5d 1 4f 14 0 Ca [Ar] 4s. 7 Hf [Xe] 6s 5d 4f 14 1 Sc [A r J4s 3d 1 73 Ta [Xe] 6s 5d 3 4f 14 Ti [Ar] 4s 3d 74 W [Xe] 6s 5d 4 4f 14 3 V [Ar] 4s 3d 3 75 Re [Xe] 6s 5d 5 4f 14 4 Cr [Ar] 4s 3d 4 76 Os [Xe] 6s 5d 6 4f 14 5 Mn!Ar) 4s 3d 5 77 Ir [Xe ]6s 5d 7 4f 14 6 Fe [Ar] 4s 3d 6 78 Pt [Xe] 6s 5d 8 4f 14 7 Co [Ar] 4s 3d 7 79 Au [Xe] 6s 1 5d 10 4f 14 8 NE [Arj 4s 3d 8 80 Hg [Xe] 6s 5d 10 4f 14 9 Cu [Ar] 4s 3d Tl [Xe] 6s 5d 10 4f 14 6p 1 30 Zn [Ar] 4s 3d 10 8 Pb [Xe] 6s 5d 10 4f 14 6p 31 Ga [Ar ] 4s 3d 10 4p 1 83 Bi [Xe] 6s 5d 10 4f 14 6p 3 3 Ge!Ar] 4s 3d 10 4p 84 Po [Xe] 6s 5d 10 4f 14 6p 4 33 As [Ar] 4s 3d 10 4p 3 85 At [Xe] 6s 5d 10 4f 14 6p 5 34 Se [Ar] 4s 3d 10 4p 4 86 Ro [Xe] 6s 5d 10 4f 14 6p 6 35 Br [(Ar] 4s 3d 10 4p 5 87 Fr [Rn] 7s 1 36 Kr [Ar) 4s 3d 10 4p 6 88 Ra [Rn] 7s 37 Rb [Kr] 5s 1 89 Ac [Rn] 7s 6d 1 38 Sr [Kr] 5s 90 Th [Rn] 7s 6d 39 Y [Kr] 5s 4d 1 91 Pa [Rn ] 7s 6d 1 5f 4 0 Zr Kr ] 5s 4d 9 U [Rn] 7s 6d 1 5f 3 41 Nb [Kr] 5s 4d 3 93 Np Rn] 7s 6d 1 5f 4 4 Mo [Kr] 5s 1 4d 5 94 Pu [Rn]7s 5f 6 43 Te [Kr} 5s 4d 5 95 Am [Rn] 7s 5f 7 44 Ru [Kr] 5s 4d 6 96 Cm [Rn] 7s 6d 1 5f 7 45 Rh [Kr) 5s 4d 7 97 Bk [Rn] 7s 5f 9 46 Pd [Kr 5s 4d 8 98 Cf [Rn] 7s 5f Ag [Kr} 5s 1 4d Es [Rn] 7s 5f Cd [K r] 5s 4d Fm [Rn] 7s 5f 1 49 In [kr] 5s 4d 10 5p Md [Rn] 7s 5f Sn [Kr ] 5s 4d 10 5p 10 No[ Rn] 7s 5f Sb!Kr ] 5s 4d 10 5p Lr [Rn] 7s 5d 1 5f 14 5 Te [Kr] 5s 4d 10 5p 4
26 ar elementler ve yüklü iyonlar için doru deildir. Çeitli orbitallerin enerjileri çekirdek yükünün deimesine ve dier orbitallerin elektronlarla doldurulmasna kar hassastr. Bu özellikler, orbital enerjilerinin tam bir sralamasn yapmay engeller. ekil 1.11 de teklif edilen sralama en az hata ile en uygun sralamay vermesi açsndan önemlidir. 1.8:Atomik Haller ve Term Sembolleri Bir atomun spin katlln, açsal momentumunu ve enerji halini bir sembolle göstermek mümkündür. Örnein Hidrojen atomu için tek elektronun s,p,d,f orbitallerini igal etmesine bal olarak S,P,D,F hallerini gösterebiliriz. Hidrojenin temel hali ls 1 dir,halide 1S dir. Hidrojen atomundaki elektron p 1 e uyarld zaman P halindedir denir. Görüldüü gibi S,P,D,F halleri l=0,i,,3,..kuantum saylarna dolays ile s,p, d, f orbitallerine karndr.yukarda gösterilen S ten farkl olarak tüm elektron spinlerinin toplamn gösteren bir kuantum says daha vardr. Bu da S ile gösterilir. Tamamen dolu bir kabuk ve alt kabuklarda S=0 dr. Yani tüm elektronlar çiftlemitir. Kimyada spektrum hatlarnn saysndan kaynaklanan "katllk" diye tanmlanan kabul skça kullanlr. Bu çiftlememi elektron saysna baldr ve genellikle S+ 1 eklinde belirtilir. Eer S=0 ise katllk (x0+l=l) birdir ve tekli (singlet) hal olarak adlandrlr. Eer S=1/ ise (x1/+ 1 =) katllk ikidir ve hal çiftlidir (dublet ). S=l olmas halinde ise (x+ 1 =3) katillik üç olacak ve üçlü ( triplet ) hal olarak tanmlanacaktr. Karbon atomunu düünecek olursak ( Is s p ), tam dolu 1 s ve s uramamza gerek yoktur ( elektronlar çiftlemi olup S=0 dr). p deki iki elektron ayn orbital de çiftleebilir veya farkl orbitaller de paralel spinli olarak dalabilir ( S=l ). Hund kural, atomun temel halinde ikinci olasln olabileceini kabul ettiine göre S=l hali mevcut olup, S+ 1 den katlliin üç (triplet) olaca bulunur. 1 = 1 hali geçerli bu atom için bu durumda 3P sembolü yazlr. Bu sembole term sembolü denir. 1.9: Elementlerin Periyodikli i Çeitli elementlerle uraan kimyaclar için elementlerin periyodik tablosu, her bakmdan son derece önemlidir. Cetvel, kimyaclarn zor ve çok sayda çalmalarnn bir ürünüdür. Gerçekten elementlerin periyodikliinde, kuantum mekaniinin temeli vardr. Bu bakmdan burada, sadece kuantum mekaniinin sonucu olan orbitallere göre ksa bir deerlendirme yaplacaktr. Elementler, bileik olutururken en yüksek enerjili orbitallerini kullandklarndan, daha önce bahsedilen Aufbau prensibini de hatrlayarak elementleri aadaki gibi snflandrabiliriz:
27 1- IA ve IIA Alkali ve Toprak alkaliler: Bu elementler ns 1 ve ns elektron Konfigürasyonu ile karakterize edilir. - B Blok Elementleri ( Geçit Elementleri) : Bu elementlerin atomlar için karakteristik olan, temel halde ksmi olarak dolmu d orbitallerine sahip olmasdr. Örnein, ilk geçit elemekleri serisi Sc ( 4s 3d 1 )ile balar, Zn (4s 3d 10 ) 'ya kadar ilerler. 3- Lântanit ve Aktinit Elementleri: Teknik olarak bu iki seri, III B grubuna aittir. Fakat Bunlarn elektronik ve kimyasal özellikleri III B grubundan ayrlr. Lântanit serisi Ce ( 4f ) ile baslar, Lu( 4f 14 ) ile biter. Aktinit serisi Th(5f) ile baslar, Lr(5f 14 )ile son bulur. 4- Ametaller ve Post transisyon Elementleri(Grup III A -VIII A) : Bu grup elementleri p orbitallerinin maksimum elektron saysna tekabül eden alt dikey grubu kapsar. Smflandrma hassas deildir. Çünki metal ve ametal arasndaki çizgi biraz keyfidir. Tüm bu elementler (Hidrojen hariç) p orbitallerinin özelliklerini paylar. Soy gazlar tam dolu p orbitallerini temsil ederler. ekil 1 17 Periyotlar cetvelinde yukarda sözü edilen snflar gösterilmitir.
28 1 H ns (n-1) d np Ametaller IIIA IVA VA VIA VIIA He 3 Li 11 Na 4 Be Geçi elementleri 1 Mg IIIB IVB VB VIB VIIB VIIIB IB IIB 5 B 13 Al 6 C 14 Si 7 N 15 P 8 O 16 S 9 F 17 Cl 10 Ne 18 Ar 19 K 0 Ca 1 Sc Ti 3 V 4 Cr 5 Mn 6 Fe 7 Co 8 Ni 9 Cu 30 Zn 31 Ga 3 Ge 33 As 34 Se 35 Br 36 Kr 37 Rb 38 Sr 39 Y 40 Zr 41 Nb 4 Mo 43 Tc 44 Ru 45 Rh 46 Pd 47 Ag 48 Cd 49 In 50 Sn 51 Sb 5 Te 53 I 54 Xe 55 Cs 56 Ba 57 La 7 Hf 73 Ta 74 W 75 Re 76 Os 77 Ir 78 Pt 79 Au 80 Hg 81 Tl 8 Pb 83 Bi 84 Po 85 At 86 Rn 87 Fr 88 Ra 89 Ac Geçi ötesi elementler (n-)f Lantanit serisi Aktinit serisi ekil Periyotlar Cetvelinde elementlerin Yeri
29 Problemler 1- n-3 den n=l ve n = 6 dan n = ye elektron geçileri srasnda yaylan n frekanslar nedir?. Hangi spektrakopik seri içindedir?. - Aadaki elementlerin temel hal elektronik konfigürasyonlarn yaznz, elememi elektron saylann bulunuz. 6C, 8O, l5p, 0Ca, 3V, 64Gd, 75Re 3-Problem de verilen elementlerin hallerini ve term sembollerini yaznz. 4-Aadaki iyonlann elektronik konfigürasyonlarn yaznz. Temel halde eslememi elektron saylarn belirtiniz. Ti +3, 5Mn +, 9 Cu +,78 Pt +,, 64Gd3+, 80Hg + 5- ls,s,p,3s,3d örbitalierinin a ) Radyal dalm fonksiyonlarn, b) Radyal olaslk Fonksiyonlarn, c) açsal dalga fonks. d) açsal olaslk fonks. e) elektron younluk çizgi haritasn çiziniz.. 6- Hidrojen atomunda 3s ve 3p orbitalleri ayn enerji1ere sahiptirler, fakat klor atomunda 3s orbitalinin enerjisi 3p orbitalinin enerjisinden daha düüktür, bunun nedenini açklaynz. 7. pz, 3dz, 4s orbitallerini belirleyen doru kuant saylarn (n,l,m)belirleyiniz. 8. E =h/8ma eitliini kutu modelinde çkarn. Anlamn belirtin. 9 - bir atomda bir orbital dört kuant saysnn bir takm ile belirlenir. Verilen kuant saylar ile kaç orbital takm oluturulabilir. n = 4; n= 4, l=, n= 4, l= 3, ml= 0, n=4, l=4, n= 4, l= 0, ml= 1
1. ÜNİTE: MODERN ATOM TEORİSİ
 . ÜNİTE: MODERN ATOM TEORİSİ.4. Elektron Dizilimi ve Periyodik Sisteme Yerleşim Atomun Kuantum Modeli oluşturulduktan sonra Bohr, yaptığı çalışmalarda periyodik cetvel ile kuantum teorisi arasında bir
. ÜNİTE: MODERN ATOM TEORİSİ.4. Elektron Dizilimi ve Periyodik Sisteme Yerleşim Atomun Kuantum Modeli oluşturulduktan sonra Bohr, yaptığı çalışmalarda periyodik cetvel ile kuantum teorisi arasında bir
SCHRÖDİNGER: Elektronun yeri (yörüngesi ve orbitali) birer dalga fonksiyonu olan n, l, m l olarak ifade edilen kuantum sayıları ile belirlenir.
 . ATOMUN KUANTUM MODELİ SCHRÖDİNGER: Elektronun yeri (yörüngesi ve orbitali) birer dalga fonksiyonu olan n, l, m l olarak ifade edilen kuantum sayıları ile belirlenir. Orbital: Elektronların çekirdek etrafında
. ATOMUN KUANTUM MODELİ SCHRÖDİNGER: Elektronun yeri (yörüngesi ve orbitali) birer dalga fonksiyonu olan n, l, m l olarak ifade edilen kuantum sayıları ile belirlenir. Orbital: Elektronların çekirdek etrafında
İNSTAGRAM:kimyaci_glcn_hoca
 MODERN ATOM TEORİSİ ATOMUN KUANTUM MODELİ Bohr atom modeli 1 H, 2 He +, 3Li 2+ vb. gibi tek elektronlu atom ve iyonların çizgi spektrumlarını başarıyla açıklamıştır.ancak çok elektronlu atomların çizgi
MODERN ATOM TEORİSİ ATOMUN KUANTUM MODELİ Bohr atom modeli 1 H, 2 He +, 3Li 2+ vb. gibi tek elektronlu atom ve iyonların çizgi spektrumlarını başarıyla açıklamıştır.ancak çok elektronlu atomların çizgi
KİM-117 TEMEL KİMYA Prof. Dr. Zeliha HAYVALI Ankara Üniversitesi Kimya Bölümü
 KİM-117 TEMEL KİMYA Prof. Dr. Zeliha HAYVALI Ankara Üniversitesi Kimya Bölümü Bu slaytlarda anlatılanlar sadece özet olup ayrıntılı bilgiler ve örnek çözümleri derste verilecektir. BÖLÜM 4 PERİYODİK SİSTEM
KİM-117 TEMEL KİMYA Prof. Dr. Zeliha HAYVALI Ankara Üniversitesi Kimya Bölümü Bu slaytlarda anlatılanlar sadece özet olup ayrıntılı bilgiler ve örnek çözümleri derste verilecektir. BÖLÜM 4 PERİYODİK SİSTEM
GENEL KİMYA. Yrd.Doç.Dr. Tuba YETİM
 GENEL KİMYA ATOMUN ELEKTRON YAPISI Bohr atom modelinde elektronun bulunduğu yer için yörünge tanımlaması kullanılırken, kuantum mekaniğinde bunun yerine orbital tanımlaması kullanılır. Orbital, elektronun
GENEL KİMYA ATOMUN ELEKTRON YAPISI Bohr atom modelinde elektronun bulunduğu yer için yörünge tanımlaması kullanılırken, kuantum mekaniğinde bunun yerine orbital tanımlaması kullanılır. Orbital, elektronun
Bölüm 8: Atomun Elektron Yapısı
 Bölüm 8: Atomun Elektron Yapısı 1. Elektromanyetik Işıma: Elektrik ve manyetik alanın dalgalar şeklinde taşınmasıdır. Her dalganın frekansı ve dalga boyu vardır. Dalga boyu (ʎ) : İki dalga tepeciği arasındaki
Bölüm 8: Atomun Elektron Yapısı 1. Elektromanyetik Işıma: Elektrik ve manyetik alanın dalgalar şeklinde taşınmasıdır. Her dalganın frekansı ve dalga boyu vardır. Dalga boyu (ʎ) : İki dalga tepeciği arasındaki
Periodic Table of the. Elements I A II A III B IV B V B VI B VII B VIII B I B II B III A IV A V A VI A VII A VIII A 1 1 2 1 H H He 1.008 1.008 4.
 PERİYODİK SİSTEM Periodic Table of the s d p Elements I A II A III B IV B V B VI B VII B VIII B I B II B III A IV A V A VI A VII A VIII A 1 1 2 1 H H He 1.008 1.008 4.0026 3 4 5 6 7 8 9 10 2 Li Be B C
PERİYODİK SİSTEM Periodic Table of the s d p Elements I A II A III B IV B V B VI B VII B VIII B I B II B III A IV A V A VI A VII A VIII A 1 1 2 1 H H He 1.008 1.008 4.0026 3 4 5 6 7 8 9 10 2 Li Be B C
ATOMUN KUANTUM MODELİ
 ATOMUN KUANTUM MODELİ 926 yıllarında Erwin Schrödinger Heisenberg den bağımsız olarak de Broglie nin hipotezinden ilham alarak tüm parçacıkların hareketinin hesaplanabileceği bir dalga mekaniği oluşturmuştur.
ATOMUN KUANTUM MODELİ 926 yıllarında Erwin Schrödinger Heisenberg den bağımsız olarak de Broglie nin hipotezinden ilham alarak tüm parçacıkların hareketinin hesaplanabileceği bir dalga mekaniği oluşturmuştur.
Nötr (yüksüz) bir için, çekirdekte kaç proton varsa çekirdeğin etrafındaki yörüngelerde de o kadar elektron dolaşır.
 ATOM ve YAPISI Elementin özelliğini taşıyan en küçük parçasına denir. Atom Numarası Bir elementin unda bulunan proton sayısıdır. Protonlar (+) yüklü olduklarından pozitif yük sayısı ya da çekirdek yükü
ATOM ve YAPISI Elementin özelliğini taşıyan en küçük parçasına denir. Atom Numarası Bir elementin unda bulunan proton sayısıdır. Protonlar (+) yüklü olduklarından pozitif yük sayısı ya da çekirdek yükü
1.ÜNİTE MODERN ATOM TEORİSİ -2.BÖLÜM- ATOMUN KUANTUM MODELİ
 1.ÜNİTE MODERN ATOM TEORİSİ -2.BÖLÜM- ATOMUN KUANTUM MODELİ Bohr Modelinin Yetersizlikleri Dalga-Tanecik İkiliği Dalga Mekaniği Kuantum Mekaniği -Orbital Kavramı Kuantum Sayıları Yörünge - Orbital Kavramları
1.ÜNİTE MODERN ATOM TEORİSİ -2.BÖLÜM- ATOMUN KUANTUM MODELİ Bohr Modelinin Yetersizlikleri Dalga-Tanecik İkiliği Dalga Mekaniği Kuantum Mekaniği -Orbital Kavramı Kuantum Sayıları Yörünge - Orbital Kavramları
Element atomlarının atom ve kütle numaraları element sembolleri üzerinde gösterilebilir. Element atom numarası sembolün sol alt köşesine yazılır.
 Atom üç temel tanecikten oluşur. Bunlar proton, nötron ve elektrondur. Proton atomun çekirdeğinde bulunan pozitif yüklü taneciktir. Nötron atomun çekirdeğin bulunan yüksüz taneciktir. ise çekirdek etrafında
Atom üç temel tanecikten oluşur. Bunlar proton, nötron ve elektrondur. Proton atomun çekirdeğinde bulunan pozitif yüklü taneciktir. Nötron atomun çekirdeğin bulunan yüksüz taneciktir. ise çekirdek etrafında
5.111 Ders Özeti #5. Ödev: Problem seti #2 (Oturum # 8 e kadar)
 5.111 Ders Özeti #5 Bugün için okuma: Bölüm 1.3 (3. Baskıda 1.6) Atomik Spektrumlar, Bölüm 1.7, eşitlik 9b ye kadar (3. Baskıda 1.5, eşitlik 8b ye kadar) Dalga Fonksiyonları ve Enerji Düzeyleri, Bölüm
5.111 Ders Özeti #5 Bugün için okuma: Bölüm 1.3 (3. Baskıda 1.6) Atomik Spektrumlar, Bölüm 1.7, eşitlik 9b ye kadar (3. Baskıda 1.5, eşitlik 8b ye kadar) Dalga Fonksiyonları ve Enerji Düzeyleri, Bölüm
s, p, d Elementleri f Elementleri Asal Gazlar
 s, p, d Elementleri Hidrojen 1A Grubu: Alkali metaller 2A Grubu: Toprak Alkali Metaller 3A Grubu: Toprak Metalleri 4A Grubu 5A Grubu 6A Grubu: Kalkojenler 7A Grubu: Halojenler B Grubu: Geçiş Metalleri
s, p, d Elementleri Hidrojen 1A Grubu: Alkali metaller 2A Grubu: Toprak Alkali Metaller 3A Grubu: Toprak Metalleri 4A Grubu 5A Grubu 6A Grubu: Kalkojenler 7A Grubu: Halojenler B Grubu: Geçiş Metalleri
ATOMUN YAPISI. Özhan ÇALIŞ. Bilgi İletişim ve Teknolojileri
 ATOMUN YAPISI ATOMLAR Atom, elementlerin en küçük kimyasal yapıtaşıdır. Atom çekirdeği: genel olarak nükleon olarak adlandırılan proton ve nötronlardan meydana gelmiştir. Elektronlar: çekirdeğin etrafında
ATOMUN YAPISI ATOMLAR Atom, elementlerin en küçük kimyasal yapıtaşıdır. Atom çekirdeği: genel olarak nükleon olarak adlandırılan proton ve nötronlardan meydana gelmiştir. Elektronlar: çekirdeğin etrafında
kitabı olarak önerilen, Erdik ve Sarıkaya nın
 PERİYODİK CETVEL Aşağıda verilen özet bilginin ayrıntısını, ders kitabı olarak önerilen, Erdik ve Sarıkaya nın Temel Üniversitesi Kimyası" Kitabı ndan okuyunuz. Modern periyotlu dizge, elementleri artan
PERİYODİK CETVEL Aşağıda verilen özet bilginin ayrıntısını, ders kitabı olarak önerilen, Erdik ve Sarıkaya nın Temel Üniversitesi Kimyası" Kitabı ndan okuyunuz. Modern periyotlu dizge, elementleri artan
ATOM BİLGİSİ Atom Modelleri
 1. Atom Modelleri BÖLÜM2 Maddenin atom adı verilen bir takım taneciklerden oluştuğu fikri çok eskiye dayanmaktadır. Ancak, bilimsel bir (deneye dayalı) atom modeli ilk defa Dalton tarafından ileri sürülmüştür.
1. Atom Modelleri BÖLÜM2 Maddenin atom adı verilen bir takım taneciklerden oluştuğu fikri çok eskiye dayanmaktadır. Ancak, bilimsel bir (deneye dayalı) atom modeli ilk defa Dalton tarafından ileri sürülmüştür.
TOBB Ekonomi ve Teknoloji Üniversitesi. chem.libretexts.org
 9. Atomun Elektron Yapısı Elektromanyetik ışıma (EMI) Atom Spektrumları Bohr Atom Modeli Kuantum Kuramı - Dalga Mekaniği Kuantum Sayıları Elektron Orbitalleri Hidrojen Atomu Orbitalleri Elektron Spini
9. Atomun Elektron Yapısı Elektromanyetik ışıma (EMI) Atom Spektrumları Bohr Atom Modeli Kuantum Kuramı - Dalga Mekaniği Kuantum Sayıları Elektron Orbitalleri Hidrojen Atomu Orbitalleri Elektron Spini
1H: 1s 1 1.periyot 1A grubu. 5B: 1s 2 2s 2 2p 1 2.periyot 3A grubu. 8O: 1s 2 2s 2 2p 4 2.periyot 6A grubu. 10Ne: 1s 2 2s 2 2p 6
 PERİYODİK CETVEL Periyodik cetvel, benzer kimyasal özellik gösteren elementlerin alt alta gelecek şekilde artan atom numaralarına göre sıralandıkları çizelgelerdir. Periyodik cetveli oluşturan yatay satırlara
PERİYODİK CETVEL Periyodik cetvel, benzer kimyasal özellik gösteren elementlerin alt alta gelecek şekilde artan atom numaralarına göre sıralandıkları çizelgelerdir. Periyodik cetveli oluşturan yatay satırlara
Yrd. Doç. Dr. H. Hasan YOLCU. hasanyolcu.wordpress.com
 Yrd. Doç. Dr. H. Hasan YOLCU hasanyolcu.wordpress.com En az iki atomun belli bir düzenlemeyle kimyasal bağ oluşturmak suretiyle bir araya gelmesidir. Aynı atomda olabilir farklı atomlarda olabilir. H 2,
Yrd. Doç. Dr. H. Hasan YOLCU hasanyolcu.wordpress.com En az iki atomun belli bir düzenlemeyle kimyasal bağ oluşturmak suretiyle bir araya gelmesidir. Aynı atomda olabilir farklı atomlarda olabilir. H 2,
ATOMUN YAPISI VE PERİYODİK ÖZELLİKLER
 ATOMUN YAPISI VE PERİYODİK ÖZELLİKLER IŞIĞIN YAPISI Işığın; Dalga ve Parçacık olmak üzere iki özelliği vardır. Dalga Özelliği: Girişim, kırınım, polarizasyon, yayılma hızı, vb. Parçacık Özelliği: Işığın
ATOMUN YAPISI VE PERİYODİK ÖZELLİKLER IŞIĞIN YAPISI Işığın; Dalga ve Parçacık olmak üzere iki özelliği vardır. Dalga Özelliği: Girişim, kırınım, polarizasyon, yayılma hızı, vb. Parçacık Özelliği: Işığın
1. ÜNİTE: MODERN ATOM TEORİSİ İyon Yükleri ve Yükseltgenme Basamakları
 1. ÜNİTE: MODERN ATOM TEORİSİ 1.7. İyon Yükleri ve Yükseltgenme Basamakları Yüksüz bir atomun yapısındaki pozitif (+) yüklü protonlarla negatif () yüklü elektronların sayıları birbirine eşittir. Yüksüz
1. ÜNİTE: MODERN ATOM TEORİSİ 1.7. İyon Yükleri ve Yükseltgenme Basamakları Yüksüz bir atomun yapısındaki pozitif (+) yüklü protonlarla negatif () yüklü elektronların sayıları birbirine eşittir. Yüksüz
ATOMİK YAPI. Elektron Yükü=-1,60x10-19 C Proton Yükü=+1,60x10-19 C Nötron Yükü=0
 ATOMİK YAPI Elektron Yükü=-1,60x10-19 C Proton Yükü=+1,60x10-19 C Nötron Yükü=0 Elektron Kütlesi 9,11x10-31 kg Proton Kütlesi Nötron Kütlesi 1,67x10-27 kg Bir kimyasal elementin atom numarası (Z) çekirdeğindeki
ATOMİK YAPI Elektron Yükü=-1,60x10-19 C Proton Yükü=+1,60x10-19 C Nötron Yükü=0 Elektron Kütlesi 9,11x10-31 kg Proton Kütlesi Nötron Kütlesi 1,67x10-27 kg Bir kimyasal elementin atom numarası (Z) çekirdeğindeki
ATOMİK YAPI. Elektron Yükü=-1,60x10-19 C Proton Yükü=+1,60x10-19 C Nötron Yükü=0
 ATOMİK YAPI Atom, birkaç türü birleştiğinde çeşitli molekülleri, bir tek türü ise bir kimyasal öğeyi oluşturan parçacıktır. Atom, elementlerin özelliklerini taşıyan en küçük yapı birimi olup çekirdekteki
ATOMİK YAPI Atom, birkaç türü birleştiğinde çeşitli molekülleri, bir tek türü ise bir kimyasal öğeyi oluşturan parçacıktır. Atom, elementlerin özelliklerini taşıyan en küçük yapı birimi olup çekirdekteki
ATOM NEDİR? -Atom elementin özelliğini taşıyan en küçük parçasına denir. Her canlı-cansız madde atomdan oluşmuştur.
 DERS: KİMYA KONU : ATOM YAPISI ATOM NEDİR? -Atom elementin özelliğini taşıyan en küçük parçasına denir. Her canlı-cansız madde atomdan oluşmuştur. Atom Modelleri Dalton Bütün maddeler atomlardan yapılmıştır.
DERS: KİMYA KONU : ATOM YAPISI ATOM NEDİR? -Atom elementin özelliğini taşıyan en küçük parçasına denir. Her canlı-cansız madde atomdan oluşmuştur. Atom Modelleri Dalton Bütün maddeler atomlardan yapılmıştır.
PERİYODİK SİSTEM VE ELEKTRON DİZİLİMLERİ#6
 PERİYODİK SİSTEM VE ELEKTRON DİZİLİMLERİ#6 Periyodik sistemde yatay sıralara Düşey sütunlara.. adı verilir. 1.periyotta element, 2 ve 3. periyotlarda..element, 4 ve 5.periyotlarda.element 6 ve 7. periyotlarda
PERİYODİK SİSTEM VE ELEKTRON DİZİLİMLERİ#6 Periyodik sistemde yatay sıralara Düşey sütunlara.. adı verilir. 1.periyotta element, 2 ve 3. periyotlarda..element, 4 ve 5.periyotlarda.element 6 ve 7. periyotlarda
ELEKTRON DİZİLİMİ PAULİ DIŞLAMA İLKESİ:
 ELEKTRON DİZİLİMİ PAULİ DIŞLAMA İLKESİ: Bir atomdaki herhangi iki elektronun dört kuantum sayısı aynı olamaz. Bir atomun n,l,ml, kuant sayıları aynı olsa bile m s spin kuantum sayıları farklı olacaktır.
ELEKTRON DİZİLİMİ PAULİ DIŞLAMA İLKESİ: Bir atomdaki herhangi iki elektronun dört kuantum sayısı aynı olamaz. Bir atomun n,l,ml, kuant sayıları aynı olsa bile m s spin kuantum sayıları farklı olacaktır.
PERİYODİK CETVEL-ÖSS DE ÇIKMIŞ SORULAR
 PERİODİK CETVEL-ÖSS DE ÇIKMIŞ SORULAR 1. Bir elementin periyodik cetveldeki yeri aşağıdakilerden hangisi ile belirlenir? A) Atom ağırlığı B) Değerliği C) Atom numarası D) Kimyasal özellikleri E) Fiziksel
PERİODİK CETVEL-ÖSS DE ÇIKMIŞ SORULAR 1. Bir elementin periyodik cetveldeki yeri aşağıdakilerden hangisi ile belirlenir? A) Atom ağırlığı B) Değerliği C) Atom numarası D) Kimyasal özellikleri E) Fiziksel
ATOMUN YAPISI ATOMUN ÖZELLİKLERİ
 ATOM Elementlerin özelliğini taşıyan, en küçük yapı taşına, atom diyoruz. veya, fiziksel ve kimyasal yöntemlerle daha basit birimlerine ayrıştırılamayan, maddenin en küçük birimine atom denir. Helyum un
ATOM Elementlerin özelliğini taşıyan, en küçük yapı taşına, atom diyoruz. veya, fiziksel ve kimyasal yöntemlerle daha basit birimlerine ayrıştırılamayan, maddenin en küçük birimine atom denir. Helyum un
Genel Kimya. Bölüm 2. ATOMUN YAPISI VE PERIYODIK CETVEL. Yrd. Doç. Dr. Mustafa SERTÇELİK Kafkas Üniversitesi Kimya Mühendisliği Bölümü
 Genel Kimya Bölüm 2. ATOMUN YAPISI VE PERIYODIK CETVEL Yrd. Doç. Dr. Mustafa SERTÇELİK Kafkas Üniversitesi Kimya Mühendisliği Bölümü Atomlar Eşya malzeme madde element atom Temel parçacıklar (lepton ve
Genel Kimya Bölüm 2. ATOMUN YAPISI VE PERIYODIK CETVEL Yrd. Doç. Dr. Mustafa SERTÇELİK Kafkas Üniversitesi Kimya Mühendisliği Bölümü Atomlar Eşya malzeme madde element atom Temel parçacıklar (lepton ve
Çalışma Soruları 2: Bölüm 2
 Çalışma Soruları 2: Bölüm 2 2.1) Kripton(Kr) atomunun yarıçapı 1,9 Å dur. a) Bu uzaklık nanometre (nm) ve pikometre (pm) cinsinden nedir? b) Kaç tane kripton atomunu yanyana dizersek uzunlukları 1,0 mm
Çalışma Soruları 2: Bölüm 2 2.1) Kripton(Kr) atomunun yarıçapı 1,9 Å dur. a) Bu uzaklık nanometre (nm) ve pikometre (pm) cinsinden nedir? b) Kaç tane kripton atomunu yanyana dizersek uzunlukları 1,0 mm
KATILAR DA BALANMA L ( 3.2) R = A
 KATILAR DA BALANMA Katlar elektriksel iletkenliklerine göre üçe ayrlr: letken, Yar iletken, Yaltkan Metaller iletken katlardr. Bir metal ve bir yar iletken arasndaki fark, elektriksel iletkenliklerinin
KATILAR DA BALANMA Katlar elektriksel iletkenliklerine göre üçe ayrlr: letken, Yar iletken, Yaltkan Metaller iletken katlardr. Bir metal ve bir yar iletken arasndaki fark, elektriksel iletkenliklerinin
L SANS YERLE T RME SINAVI 1
 LSANS YERLETRME SINAVI MATEMATK TEST SORU KTAPÇII 9 HAZRAN 00. ( )( + ) + ( )( ) = 0 eitliini salayan gerçel saylarnn toplam kaçtr?. ( )( ) < 0 eitsizliinin gerçel saylardaki çözüm kümesi aadaki açk aralklarn
LSANS YERLETRME SINAVI MATEMATK TEST SORU KTAPÇII 9 HAZRAN 00. ( )( + ) + ( )( ) = 0 eitliini salayan gerçel saylarnn toplam kaçtr?. ( )( ) < 0 eitsizliinin gerçel saylardaki çözüm kümesi aadaki açk aralklarn
Atom. Atom 9.11.2015. 11 elektronlu Na. 29 elektronlu Cu
 Atom Maddelerin en küçük yapı taşlarına atom denir. Atomlar, elektron, nötron ve protonlardan oluşur. 1.Elektronlar: Çekirdek etrafında yörüngelerde bulunurlar ve ( ) yüklüdürler. Boyutları çok küçüktür.
Atom Maddelerin en küçük yapı taşlarına atom denir. Atomlar, elektron, nötron ve protonlardan oluşur. 1.Elektronlar: Çekirdek etrafında yörüngelerde bulunurlar ve ( ) yüklüdürler. Boyutları çok küçüktür.
ATOM BİLGİSİ I ÖRNEK 1
 ATOM BİLGİSİ I Elementlerin özelliklerini ta ıyan en küçük yapıta ı atomdur. Son çözümlemede, bütün maddelerin atomlar toplulu u oldu unu söyleyebiliriz. Elementler, aynı tür atomlardan, bile ik ve karı
ATOM BİLGİSİ I Elementlerin özelliklerini ta ıyan en küçük yapıta ı atomdur. Son çözümlemede, bütün maddelerin atomlar toplulu u oldu unu söyleyebiliriz. Elementler, aynı tür atomlardan, bile ik ve karı
I. ÇOK ELEKTRONLU ATOMLAR ĠÇĠN DALGA FONKSĠYONLARI
 5.111 Ders Özeti #8 Bugün için okuma: Bölüm 1.12 (3. Baskıda 1.11) Orbital Enerjileri ( çok-lu atomlar), Bölüm 1.13 (3. Baskıda 1.12) Katyapı Ġlkesi. Ders #9 için okuma: Bölüm 1.14 (3. Baskıda 1.13) Elektronik
5.111 Ders Özeti #8 Bugün için okuma: Bölüm 1.12 (3. Baskıda 1.11) Orbital Enerjileri ( çok-lu atomlar), Bölüm 1.13 (3. Baskıda 1.12) Katyapı Ġlkesi. Ders #9 için okuma: Bölüm 1.14 (3. Baskıda 1.13) Elektronik
Mobile Batman Üniversitesi Batı Raman Kampüsü Fen Edebiyat Fakültesi Arkeoloji Bölümü Batman
 Sorumlu Öğretim Üyesi Yrd.Doç.Dr. Mahmut AYDIN İletişim:aydinm135@gmail.com, Mobile.05357236743 Batman Üniversitesi Batı Raman Kampüsü Fen Edebiyat Fakültesi Arkeoloji Bölümü Batman Taşınabilir Enerji
Sorumlu Öğretim Üyesi Yrd.Doç.Dr. Mahmut AYDIN İletişim:aydinm135@gmail.com, Mobile.05357236743 Batman Üniversitesi Batı Raman Kampüsü Fen Edebiyat Fakültesi Arkeoloji Bölümü Batman Taşınabilir Enerji
Önerilen süre dakika (22 puan) dakika (16 puan) dakika (38 puan) 4. 9 dakika (24 puan) Toplam (100 puan) Ġsim
 Birinci Tek Saatlik Sınav 5.111 Ġsminizi aģağıya yazınız. Sınav sorularını sınav başladı komutunu duyuncaya kadar açmayınız. Sınavda notlarınız ve kitaplarınız kapalı olacaktır. 1. Problemlerin her bir
Birinci Tek Saatlik Sınav 5.111 Ġsminizi aģağıya yazınız. Sınav sorularını sınav başladı komutunu duyuncaya kadar açmayınız. Sınavda notlarınız ve kitaplarınız kapalı olacaktır. 1. Problemlerin her bir
I. FOTOELEKTRON SPEKTROSKOPĠSĠ (PES) PES orbital enerjilerini doğrudan tayin edebilir. (Fotoelektrik etkisine benzer!)
 5.111 Ders Özeti #9 Bugün için okuma: Bölüm 1.14 (3.Baskıda, 1.13) Elektronik Yapı ve Periyodik Çizelge, Bölüm 1.15, 1.16, 1.17, 1.18, ve 1.20 (3.Baskıda, 1.14, 1.15, 1.16, 1.17, ve 1.19) Atom Özelliklerinde
5.111 Ders Özeti #9 Bugün için okuma: Bölüm 1.14 (3.Baskıda, 1.13) Elektronik Yapı ve Periyodik Çizelge, Bölüm 1.15, 1.16, 1.17, 1.18, ve 1.20 (3.Baskıda, 1.14, 1.15, 1.16, 1.17, ve 1.19) Atom Özelliklerinde
Müh. Fak. G. Kimya Vize Soru ve Cevapları A Mühendislik Fakültesi Genel Kimya (Kimya Metal. ve Malz.)) Ara Sınav Soruları
 Müh. Fak. G. Kimya Vize Soru ve Cevapları A 08.11.2017 Adı ve Soyadı:.. Fak. No:... Mühendislik Fakültesi Genel Kimya (Kimya Metal. ve Malz.)) Ara Sınav Soruları 1) Bilinen tüm yöntemlerle kendisinden
Müh. Fak. G. Kimya Vize Soru ve Cevapları A 08.11.2017 Adı ve Soyadı:.. Fak. No:... Mühendislik Fakültesi Genel Kimya (Kimya Metal. ve Malz.)) Ara Sınav Soruları 1) Bilinen tüm yöntemlerle kendisinden
BÖLÜM 4 GİRİŞ MODERN ATOM TEORİSİ VE YENİ KUANTUM MEKANİĞİ
 BÖLÜM 4 MODERN ATOM TEORİSİ VE YENİ KUANTUM MEKANİĞİ GİRİŞ Ön Sıra, Soldan Sağa : I. Langmuir; M. Planck; M. Curie; H.A. Lorentz; A. Einstein; P. Langevin; C. Guye; C.T.R. Wilson; O.W. Richardson. Olmayanlar:
BÖLÜM 4 MODERN ATOM TEORİSİ VE YENİ KUANTUM MEKANİĞİ GİRİŞ Ön Sıra, Soldan Sağa : I. Langmuir; M. Planck; M. Curie; H.A. Lorentz; A. Einstein; P. Langevin; C. Guye; C.T.R. Wilson; O.W. Richardson. Olmayanlar:
ÇALIŞMA YAPRAĞI (KONU ANLATIMI)
 ÇALIŞMA YAPRAĞI (KONU ANLATIMI) ATOMUN YAPISI HAZIRLAYAN: ÇĐĞDEM ERDAL DERS: ÖĞRETĐM TEKNOLOJĐLERĐ VE MATERYAL GELĐŞTĐRME DERS SORUMLUSU: PROF.DR. ĐNCĐ MORGĐL ANKARA,2008 GĐRĐŞ Kimyayı ve bununla ilgili
ÇALIŞMA YAPRAĞI (KONU ANLATIMI) ATOMUN YAPISI HAZIRLAYAN: ÇĐĞDEM ERDAL DERS: ÖĞRETĐM TEKNOLOJĐLERĐ VE MATERYAL GELĐŞTĐRME DERS SORUMLUSU: PROF.DR. ĐNCĐ MORGĐL ANKARA,2008 GĐRĐŞ Kimyayı ve bununla ilgili
ATOMİK YAPI VE ATOMLAR ARASI BAĞLAR. Aytekin Hitit
 ATOMİK YAPI VE ATOMLAR ARASI BAĞLAR Aytekin Hitit Malzemeler neden farklı özellikler gösterirler? Özellikler Fiziksel Kimyasal Bahsi geçen yapısal etkenlerden elektron düzeni değiştirilemez. Ancak diğer
ATOMİK YAPI VE ATOMLAR ARASI BAĞLAR Aytekin Hitit Malzemeler neden farklı özellikler gösterirler? Özellikler Fiziksel Kimyasal Bahsi geçen yapısal etkenlerden elektron düzeni değiştirilemez. Ancak diğer
1.5. Periyodik Özellikler
 1.5. Periyodik Özellikler 9. sınıfta öğrendiğiniz gibi Mendeleyev in (Mendeliiv) periyodik tablo ile ilgili çalışmalarını değerlendiren Henry Moseley (Henri Mozli), günümüzde kullanılan modern periyodik
1.5. Periyodik Özellikler 9. sınıfta öğrendiğiniz gibi Mendeleyev in (Mendeliiv) periyodik tablo ile ilgili çalışmalarını değerlendiren Henry Moseley (Henri Mozli), günümüzde kullanılan modern periyodik
TÜBĐTAK-BAYG. Orbitaller, içten dışa doğru, aşağıdaki gibi gruplandırılır: (1s)(2s,2p)(3s,3p)(3d)(4s,4p)(4d)(4f)(5s,5p)
 1. Magnezyum metali N 2 gazı içinde ısıtıldığında, açık sarı renkli bir A bileşiği elde edilmektedir. A bileşiği hidroliz olunca (su ile tepkimeye girince), renksiz B gazı oluşmakta ve bu gazın sudaki
1. Magnezyum metali N 2 gazı içinde ısıtıldığında, açık sarı renkli bir A bileşiği elde edilmektedir. A bileşiği hidroliz olunca (su ile tepkimeye girince), renksiz B gazı oluşmakta ve bu gazın sudaki
Bugün için Okuma: Bölüm 1.5 (3. Baskıda 1.3), Bölüm 1.6 (3. Baskıda 1.4 )
 5.111 Ders Özeti #4 Bugün için Okuma: Bölüm 1.5 (3. Baskıda 1.3), Bölüm 1.6 (3. Baskıda 1.4 ) Ders #5 için Okuma: Bölüm 1.3 (3. Baskıda 1.6 ) Atomik Spektrumlar, Bölüm 1.7 de eģitlik 9b ye kadar (3. Baskıda
5.111 Ders Özeti #4 Bugün için Okuma: Bölüm 1.5 (3. Baskıda 1.3), Bölüm 1.6 (3. Baskıda 1.4 ) Ders #5 için Okuma: Bölüm 1.3 (3. Baskıda 1.6 ) Atomik Spektrumlar, Bölüm 1.7 de eģitlik 9b ye kadar (3. Baskıda
İnstagram:kimyaci_gln_hoca MODERN ATOM TEORİSİ-2.
 MODERN ATOM TEORİSİ-2 ATOM YARIÇAPI PERİYODİK ÖZELLİK DEĞİŞİMİ Kovalent Yarıçap: Tek bir kovalent bağla bağlanmış eşdeğer iki atomun çekirdekleri arasındaki uzaklığın yarısına kovalent yarıçap denir.(şekil1)
MODERN ATOM TEORİSİ-2 ATOM YARIÇAPI PERİYODİK ÖZELLİK DEĞİŞİMİ Kovalent Yarıçap: Tek bir kovalent bağla bağlanmış eşdeğer iki atomun çekirdekleri arasındaki uzaklığın yarısına kovalent yarıçap denir.(şekil1)
ATOMUN YAPISI VE PERIYODIK CETVEL
 ATOMUN YAPISI VE PERIYODIK CETVEL DALTON ATOM TEORISI - Tüm maddeler atomlardan yapılmıştır. - Farklı maddelerin atomlarıda birbirlerinden farklıdır. - Bir bileşiği oluşturan atomların kütleleri arasında
ATOMUN YAPISI VE PERIYODIK CETVEL DALTON ATOM TEORISI - Tüm maddeler atomlardan yapılmıştır. - Farklı maddelerin atomlarıda birbirlerinden farklıdır. - Bir bileşiği oluşturan atomların kütleleri arasında
Oksijen, flor ve neon elementlerinin kullanıldığı alanları araştırınız.
 Oksijen, flor ve neon elementlerinin kullanıldığı alanları araştırınız. 3.2 KİMYASAL BAĞLAR Çevrenizdeki maddeleri inceleyiniz. Bu maddelerin neden bu kadar çeşitli olduğunu düşündünüz mü? Eğer bu çeşitlilik
Oksijen, flor ve neon elementlerinin kullanıldığı alanları araştırınız. 3.2 KİMYASAL BAĞLAR Çevrenizdeki maddeleri inceleyiniz. Bu maddelerin neden bu kadar çeşitli olduğunu düşündünüz mü? Eğer bu çeşitlilik
İyonlar. İyon? Pozitif veya negatif yükü olan bir atoma yada atomlar grubuna iyon denir.
 İyonlar İyon? Pozitif veya negatif yükü olan bir atoma yada atomlar grubuna iyon denir. 1 Atomlardan İyon Oluşumu ve İyon Bir atomdan iyon denilen yüklü bir parçacık oluşturulabilir. Bunun için, nötral
İyonlar İyon? Pozitif veya negatif yükü olan bir atoma yada atomlar grubuna iyon denir. 1 Atomlardan İyon Oluşumu ve İyon Bir atomdan iyon denilen yüklü bir parçacık oluşturulabilir. Bunun için, nötral
Korozyon tanımını hatırlayalım
 8..20 Korozyonun kimyasal ve elektrokimyasal oluşum mekanizması Korozyon tanımını hatırlayalım Korozyon tepkimeleri, çoğu metallerin termodinamik kararsızlığı sonucu (Au, Pt, Ir ve Pd gibi soy metaller
8..20 Korozyonun kimyasal ve elektrokimyasal oluşum mekanizması Korozyon tanımını hatırlayalım Korozyon tepkimeleri, çoğu metallerin termodinamik kararsızlığı sonucu (Au, Pt, Ir ve Pd gibi soy metaller
Serüveni PERİYODİK ÖZELLİKLER DEĞİŞİMİ
 Serüveni PERİYODİK ÖZELLİKLER DEĞİŞİMİ PERİYODİK ÖZELLİKLERİN DEĞİŞİMİ ATOM YARIÇAPI Çekirdeğin merkezi ile en dış kabukta bulunan elektronlar arasındaki uzaklık olarak tanımlanır. Periyodik tabloda aynı
Serüveni PERİYODİK ÖZELLİKLER DEĞİŞİMİ PERİYODİK ÖZELLİKLERİN DEĞİŞİMİ ATOM YARIÇAPI Çekirdeğin merkezi ile en dış kabukta bulunan elektronlar arasındaki uzaklık olarak tanımlanır. Periyodik tabloda aynı
Kütlenin Korunumu Kanunu: Bir kimyasal reaksiyonda, reaksiyona giren maddelerin kütleleri toplamı, ürünlerin kütleleri toplamına eşittir.
 Atom Teorileri 1 Atom Kuramı Milattan önce beşinci yüzyılda, yunan filozofu Democritus, bütün maddeleri, bölünemez veya kesilemez anlamında atomos olarak adlandırılan, çok küçük, bölünmez taneciklerden
Atom Teorileri 1 Atom Kuramı Milattan önce beşinci yüzyılda, yunan filozofu Democritus, bütün maddeleri, bölünemez veya kesilemez anlamında atomos olarak adlandırılan, çok küçük, bölünmez taneciklerden
... ANADOLU L SES E T M YILI I. DÖNEM 10. SINIF K MYA DERS 1. YAZILI SINAVI SINIFI: Ö RENC NO: Ö RENC N N ADI VE SOYADI:
 2009-2010 E T M YILI I. DÖNEM 10. SINIF K MYA DERS 1. YAZILI SINAVI A 1. Plastik bir tarak saça sürtüldü ünde tara n elektrikle yüklü hale gelmesinin 3 sonucunu yaz n z. 2. Katot fl nlar nedir? Katot fl
2009-2010 E T M YILI I. DÖNEM 10. SINIF K MYA DERS 1. YAZILI SINAVI A 1. Plastik bir tarak saça sürtüldü ünde tara n elektrikle yüklü hale gelmesinin 3 sonucunu yaz n z. 2. Katot fl nlar nedir? Katot fl
MOL KAVRAMI I. ÖRNEK 2
 MOL KAVRAMI I Maddelerin taneciklerden oluştuğunu biliyoruz. Bu taneciklere atom, molekül ya da iyon denir. Atom : Kimyasal yöntemlerle daha basit taneciklere ayrılmayan ve elementlerin yapıtaşı olan taneciklere
MOL KAVRAMI I Maddelerin taneciklerden oluştuğunu biliyoruz. Bu taneciklere atom, molekül ya da iyon denir. Atom : Kimyasal yöntemlerle daha basit taneciklere ayrılmayan ve elementlerin yapıtaşı olan taneciklere
Elementlerin tüm özelliğini gösteren en küçük parçasına atom denir. Atomu oluşturan parçacıklar farklı yüklere sahiptir. Atomda bulunan yükler;
 Elementlerin tüm özelliğini gösteren en küçük parçasına atom denir. Atomu oluşturan parçacıklar farklı yüklere sahiptir. Atomda bulunan yükler; negatif yükler ve pozitif yüklerdir. Atomu oluşturan parçacıklar:
Elementlerin tüm özelliğini gösteren en küçük parçasına atom denir. Atomu oluşturan parçacıklar farklı yüklere sahiptir. Atomda bulunan yükler; negatif yükler ve pozitif yüklerdir. Atomu oluşturan parçacıklar:
vitamininin indirgenmesi istemli midir?
 5.111 Ders 27 Geçiş Metalleri Konular: Koordinasyon komplekslerinin oluşumu, koordinasyon sayısı, koordinasyon komplekslerinin gösterimi, koordinasyon komplekslerinin yapıları, şelat etkisi, izomerler,
5.111 Ders 27 Geçiş Metalleri Konular: Koordinasyon komplekslerinin oluşumu, koordinasyon sayısı, koordinasyon komplekslerinin gösterimi, koordinasyon komplekslerinin yapıları, şelat etkisi, izomerler,
Nadir ve Kıymetli Metaller Metalurjisi. Y.Doç.Dr. Işıl KERTİ
 Nadir ve Kıymetli Metaller Metalurjisi Y.Doç.Dr. Işıl KERTİ Ders içeriği 1. Giriş ve Periyodik cetvel 2. Kıymetli Metaller (Ag, Au, Pt, ) 3. Kıymetli Metaller (Ag, Au, Pt, ) 4. Kıymetli Metaller (Ag, Au,
Nadir ve Kıymetli Metaller Metalurjisi Y.Doç.Dr. Işıl KERTİ Ders içeriği 1. Giriş ve Periyodik cetvel 2. Kıymetli Metaller (Ag, Au, Pt, ) 3. Kıymetli Metaller (Ag, Au, Pt, ) 4. Kıymetli Metaller (Ag, Au,
Magnetic Materials. 7. Ders: Ferromanyetizma. Numan Akdoğan.
 Magnetic Materials 7. Ders: Ferromanyetizma Numan Akdoğan akdogan@gyte.edu.tr Gebze Institute of Technology Department of Physics Nanomagnetism and Spintronic Research Center (NASAM) Moleküler Alan Teorisinin
Magnetic Materials 7. Ders: Ferromanyetizma Numan Akdoğan akdogan@gyte.edu.tr Gebze Institute of Technology Department of Physics Nanomagnetism and Spintronic Research Center (NASAM) Moleküler Alan Teorisinin
Kimya Elbistan. youtube kanalı. Video Defter
 youtube kanalı Video Defter 1. Ünite Modern Atom Teorisi A. Atomun Kuantum Modeli 1873 yılında J. C. Maxwell ışığın elektromanyetik dalgalardan oluştuğunu ve elektromanyetik ışımayı açıklamıştır. 1900
youtube kanalı Video Defter 1. Ünite Modern Atom Teorisi A. Atomun Kuantum Modeli 1873 yılında J. C. Maxwell ışığın elektromanyetik dalgalardan oluştuğunu ve elektromanyetik ışımayı açıklamıştır. 1900
Malzemelerin Elektriksel. Özellikleri. Elektron hareketlili i letkenlik Enerji bant yap lar. Tan mlar
 Bölüm 7: Elektriksel Özellikler CEVAP ARANACAK SORULAR... Elektriksel iletkenlik ve direnç nasl tarif edilebilir? letkenlerin, yariletkenlerin ve yaltkanlarn ortaya çkmasnda hangi fiziksel süreçler bulunmaktadr?
Bölüm 7: Elektriksel Özellikler CEVAP ARANACAK SORULAR... Elektriksel iletkenlik ve direnç nasl tarif edilebilir? letkenlerin, yariletkenlerin ve yaltkanlarn ortaya çkmasnda hangi fiziksel süreçler bulunmaktadr?
DENEY RAPORU. Fotometrik Yöntemle Karıım Tayini (11 No lu deney)
 M.Hilmi EREN 04-98 - 3636 Enstrümantel Analiz II Lab. 9.Deney Grubu DENEY RAPORU DENEY ADI Fotometrik Yöntemle Karıım Tayini (11 No lu deney) DENEY TARH 31 Ekim 2003 Cuma AMAÇ Lambert-Beer yasasından ve
M.Hilmi EREN 04-98 - 3636 Enstrümantel Analiz II Lab. 9.Deney Grubu DENEY RAPORU DENEY ADI Fotometrik Yöntemle Karıım Tayini (11 No lu deney) DENEY TARH 31 Ekim 2003 Cuma AMAÇ Lambert-Beer yasasından ve
da. Elektronlar düşük E seviyesinden daha yüksek E seviyesine inerken enerji soğurur.
 5.111 Ders Özeti #6 Bugün için okuma: Bölüm 1.9 (3. Baskıda 1.8) Atomik Orbitaller. Ders #7 için okuma: Bölüm 1.10 (3. Baskıda 1.9) Elektron Spini, Bölüm 1.11 (3. Baskıda 1.10) Hidrojenin Elektronik Yapısı
5.111 Ders Özeti #6 Bugün için okuma: Bölüm 1.9 (3. Baskıda 1.8) Atomik Orbitaller. Ders #7 için okuma: Bölüm 1.10 (3. Baskıda 1.9) Elektron Spini, Bölüm 1.11 (3. Baskıda 1.10) Hidrojenin Elektronik Yapısı
Atomun Yapısı Boşlukta yer kaplayan, hacmi, kütlesi ve eylemsizliği olan her şeye madde denir. Maddeyi (elementi) oluşturan ve maddenin (elementin)
 Atomun Yapısı Boşlukta yer kaplayan, hacmi, kütlesi ve eylemsizliği olan her şeye madde denir. Maddeyi (elementi) oluşturan ve maddenin (elementin) kendi özelliğini taşıyan en küçük yapı birimine atom
Atomun Yapısı Boşlukta yer kaplayan, hacmi, kütlesi ve eylemsizliği olan her şeye madde denir. Maddeyi (elementi) oluşturan ve maddenin (elementin) kendi özelliğini taşıyan en küçük yapı birimine atom
PERİYODİK CETVEL. Yanıt : D. www.kimyahocam.com. 3 Li : 1s2 2s 1 2. periyot 1A grubu. 16 S : 1s2 2s 2 2p 6 3s 2 3p 4 3.
 PERİODİK CETVEL Periyodik cetvel, elementlerin atom numaraları temel alınarak düzenlenmiş bir sistemdir. Periyodik cetvelde, nötr atomlarının elektron içeren temel enerji düzeyi sayısı aynı olan elementler
PERİODİK CETVEL Periyodik cetvel, elementlerin atom numaraları temel alınarak düzenlenmiş bir sistemdir. Periyodik cetvelde, nötr atomlarının elektron içeren temel enerji düzeyi sayısı aynı olan elementler
MADDENİN SINIFLANDIRILMASI
 MADDENİN SINIFLANDIRILMASI MADDE Saf madde Karışımlar Element Bileşik Homojen Karışımlar Heterojen Karışımlar ELEMENT Tek cins atomlardan oluşmuş saf maddeye element denir. ELEMENTLERİN ÖZELLİKLERİ Elementler
MADDENİN SINIFLANDIRILMASI MADDE Saf madde Karışımlar Element Bileşik Homojen Karışımlar Heterojen Karışımlar ELEMENT Tek cins atomlardan oluşmuş saf maddeye element denir. ELEMENTLERİN ÖZELLİKLERİ Elementler
Modern Fizik (Fiz 206)
 Modern Fizik (Fiz 206) 3. Bölüm KUANTUM Mekaniği Bohr modelinin sınırları Düz bir dairenin çevresinde hareket eden elektronu tanımlar Saçılma deneyleri elektronların çekirdek etrafında, çekirdekten uzaklaştıkça
Modern Fizik (Fiz 206) 3. Bölüm KUANTUM Mekaniği Bohr modelinin sınırları Düz bir dairenin çevresinde hareket eden elektronu tanımlar Saçılma deneyleri elektronların çekirdek etrafında, çekirdekten uzaklaştıkça
3 1 x 2 ( ) 2 = E) f( x) ... Bir sigorta portföyünde, t poliçe yln göstermek üzere, sigortal saysnn
 SORU : Aada tanm verilen f fonksiyonlarndan hangisi denklemini her R için salar? f + = f t dt integral e A) f = e B) f = e C) f D) f = E) f = e ( ) = e ( ) SORU : Bir sigorta portföyünde, t poliçe yln
SORU : Aada tanm verilen f fonksiyonlarndan hangisi denklemini her R için salar? f + = f t dt integral e A) f = e B) f = e C) f D) f = E) f = e ( ) = e ( ) SORU : Bir sigorta portföyünde, t poliçe yln
Malzeme Bilgisi Prof. Dr. Akgün ALSARAN. Temel kavramlar Atomsal yapı
 Malzeme Bilgisi Prof. Dr. Akgün ALSARAN Temel kavramlar Atomsal yapı İçerik Temel kavramlar Atom modeli Elektron düzeni Periyodik sistem 2 Temel kavramlar Bütün maddeler kimyasal elementlerden oluşur.
Malzeme Bilgisi Prof. Dr. Akgün ALSARAN Temel kavramlar Atomsal yapı İçerik Temel kavramlar Atom modeli Elektron düzeni Periyodik sistem 2 Temel kavramlar Bütün maddeler kimyasal elementlerden oluşur.
maddelere saf maddeler denir
 Madde :Kütlesi olan her şeye madde denir. Saf madde: Aynı cins atom veya moleküllerden oluşan maddeye denir. Fiziksel yollarla kendisinden başka maddelere ayrışmayan maddelere saf maddeler denir Element:
Madde :Kütlesi olan her şeye madde denir. Saf madde: Aynı cins atom veya moleküllerden oluşan maddeye denir. Fiziksel yollarla kendisinden başka maddelere ayrışmayan maddelere saf maddeler denir Element:
Fizik ve Ölçme. Fizik deneysel gözlemler ve nicel ölçümlere dayanır
 Fizik ve Ölçme Fizik deneysel gözlemler ve nicel ölçümlere dayanır Fizik kanunları temel büyüklükler(nicelikler) cinsinden ifade edilir. Mekanikte üç temel büyüklük vardır; bunlar uzunluk(l), zaman(t)
Fizik ve Ölçme Fizik deneysel gözlemler ve nicel ölçümlere dayanır Fizik kanunları temel büyüklükler(nicelikler) cinsinden ifade edilir. Mekanikte üç temel büyüklük vardır; bunlar uzunluk(l), zaman(t)
Bohr Atom Modeli. ( I eylemsizlik momen ) Her iki tarafı mv ye bölelim.
 Bohr Atom Modeli Niels Hendrik Bohr, Rutherford un atom modelini temel alarak 1913 yılında bir atom modeli ileri sürdü. Bohr teorisini ortaya koyarak atomların çizgi spektrumlarının açıklanabilmesi için
Bohr Atom Modeli Niels Hendrik Bohr, Rutherford un atom modelini temel alarak 1913 yılında bir atom modeli ileri sürdü. Bohr teorisini ortaya koyarak atomların çizgi spektrumlarının açıklanabilmesi için
BÖLÜM 1. Matematiksel ndüksiyon Prensibi
 BÖLÜM 1 Matematiksel ndüksiyon Prensibi Matematiksel indüksiyon prensibini kullanarak a³a daki e³it(siz)liklerin her n N için gerçeklendi ini ispatlaynz. 1. 1 2 + 2 2 + 3 2 + + n 2 = n(n+1)(2n+1) 6 2.
BÖLÜM 1 Matematiksel ndüksiyon Prensibi Matematiksel indüksiyon prensibini kullanarak a³a daki e³it(siz)liklerin her n N için gerçeklendi ini ispatlaynz. 1. 1 2 + 2 2 + 3 2 + + n 2 = n(n+1)(2n+1) 6 2.
BÖLÜM 2 ATOMİK YAPI İÇERİK. Atom yapısı. Bağ tipleri. Chapter 2-1
 BÖLÜM 2 ATOMİK YAPI İÇERİK Atom yapısı Bağ tipleri 1 Atomların Yapıları Atomlar başlıca üç temel atom altı parçacıktan oluşur; Protonlar (+ yüklü) Nötronlar (yüksüz) Elektronlar (-yüklü) Basit bir atom
BÖLÜM 2 ATOMİK YAPI İÇERİK Atom yapısı Bağ tipleri 1 Atomların Yapıları Atomlar başlıca üç temel atom altı parçacıktan oluşur; Protonlar (+ yüklü) Nötronlar (yüksüz) Elektronlar (-yüklü) Basit bir atom
ELEMENTLERİN SEMBOLLERİ VE ATOM
 ELEMENT VE SEMBOLLERİ SAF MADDE: Kendisinden başka madde bulundurmayan maddelere denir. ELEMENT: İçerisinde tek cins atom bulunduran maddelere denir. Yani elementlerin yapı yaşı atomlardır. BİLEŞİK: En
ELEMENT VE SEMBOLLERİ SAF MADDE: Kendisinden başka madde bulundurmayan maddelere denir. ELEMENT: İçerisinde tek cins atom bulunduran maddelere denir. Yani elementlerin yapı yaşı atomlardır. BİLEŞİK: En
PERĐYODĐK ÇĐZELGE. Yrd.Doç.Dr. İbrahim İsmet ÖZTÜRK
 PERĐYODĐK ÇĐZELGE Yrd.Doç.Dr. İbrahim İsmet ÖZTÜRK 8.1. PERĐYODĐK ÇĐZELGENĐN GELĐŞMESĐ 8.2. ELEMENTLERĐN PERĐYODĐK SINIFLANDIRILMASI Katyon ve Anyonların Elektron Dağılımları 8.3.FĐZĐKSEL ÖZELLĐKLERDEKĐ
PERĐYODĐK ÇĐZELGE Yrd.Doç.Dr. İbrahim İsmet ÖZTÜRK 8.1. PERĐYODĐK ÇĐZELGENĐN GELĐŞMESĐ 8.2. ELEMENTLERĐN PERĐYODĐK SINIFLANDIRILMASI Katyon ve Anyonların Elektron Dağılımları 8.3.FĐZĐKSEL ÖZELLĐKLERDEKĐ
Aşağıda verilen özet bilginin ayrıntısını, ders kitabı. olarak önerilen, Erdik ve Sarıkaya nın Temel. Üniversitesi Kimyası" Kitabı ndan okuyunuz.
 KİMYASAL BAĞLAR Aşağıda verilen özet bilginin ayrıntısını, ders kitabı olarak önerilen, Erdik ve Sarıkaya nın Temel Üniversitesi Kimyası" Kitabı ndan okuyunuz. KİMYASAL BAĞLAR İki atom veya atom grubu
KİMYASAL BAĞLAR Aşağıda verilen özet bilginin ayrıntısını, ders kitabı olarak önerilen, Erdik ve Sarıkaya nın Temel Üniversitesi Kimyası" Kitabı ndan okuyunuz. KİMYASAL BAĞLAR İki atom veya atom grubu
Atomlar ve Moleküller
 Atomlar ve Moleküller Madde, uzayda yer işgal eden ve kütlesi olan herşeydir. Element, kimyasal tepkimelerle başka bileşiklere parçalanamayan maddedir. -Doğada 92 tane element bulunmaktadır. Bileşik, belli
Atomlar ve Moleküller Madde, uzayda yer işgal eden ve kütlesi olan herşeydir. Element, kimyasal tepkimelerle başka bileşiklere parçalanamayan maddedir. -Doğada 92 tane element bulunmaktadır. Bileşik, belli
Dolay s yla, elektromanyetik sabit c ile elektriksel geçirgenli i ve manyetik geçirgenlik aras nda bir ili ki vard r. 3
 Optik Özellikler Elektromanyetik radyasyon Ik malzeme üzerinde çarptnda nasl bir etkileme olur? Malzemelerin karakteristik renklerini ne belirler? Neden baz malzemeler saydam ve bazlar yarsaydam veya opaktr?
Optik Özellikler Elektromanyetik radyasyon Ik malzeme üzerinde çarptnda nasl bir etkileme olur? Malzemelerin karakteristik renklerini ne belirler? Neden baz malzemeler saydam ve bazlar yarsaydam veya opaktr?
GENEL KİMYA 04.01.2012. Elektromagnetik Radyasyon (Işıma) Elektromagnetik Radyasyon (Işıma) Elektromagnetik Radyasyon (Işıma)
 Elektromagnetik Radyasyon (Işıma) GENEL KİMYA Elektromagnetik radyasyon, elektriksel ve magnetik alanların birbirine dik yönde yayılması ile meydana gelir. 2 Elektromagnetik Radyasyon (Işıma) Elektromagnetik
Elektromagnetik Radyasyon (Işıma) GENEL KİMYA Elektromagnetik radyasyon, elektriksel ve magnetik alanların birbirine dik yönde yayılması ile meydana gelir. 2 Elektromagnetik Radyasyon (Işıma) Elektromagnetik
Öncelikle periyodik cetvelin bazı gruplarını inceleyelim:
 Yatay sütun Periyot : 7 tane periyot vardır Düşey Sütun Grup : 8 tane a grubu ve 8 tanede b grubu vardır. b grubu elementlerine geçiş elementleri denir. Öncelikle periyodik cetvelin bazı gruplarını inceleyelim:
Yatay sütun Periyot : 7 tane periyot vardır Düşey Sütun Grup : 8 tane a grubu ve 8 tanede b grubu vardır. b grubu elementlerine geçiş elementleri denir. Öncelikle periyodik cetvelin bazı gruplarını inceleyelim:
Kütlenin Korunumu Kanunu: Bir kimyasal reaksiyonda, reaksiyona giren maddelerin kütleleri toplamı, ürünlerin kütleleri toplamına eşittir.
 Atom Teorileri 1 Atom Kuramı Milattan önce beşinci yüzyılda, yunan filozofu Democritus, bütün maddeleri, bölünemez veya kesilemez anlamında atomos olarak adlandırılan, çok küçük, bölünmez taneciklerden
Atom Teorileri 1 Atom Kuramı Milattan önce beşinci yüzyılda, yunan filozofu Democritus, bütün maddeleri, bölünemez veya kesilemez anlamında atomos olarak adlandırılan, çok küçük, bölünmez taneciklerden
5.111 Ders Özeti #28 Geçiş Metalleri: Kristal Alan Teorisi Bölüm 16 s 681-683 ( 3. Baskıda s 631-633 ) Cuma Günü nün materyali.
 28.1 5.111 Ders Özeti #28 Geçiş Metalleri: Kristal Alan Teorisi Bölüm 16 s 681-683 ( 3. Baskıda s 631-633 ) Cuma Günü nün materyali d Orbitalleri Beş d orbitali vardır: d xy, d xz, d x 2 -y 2, d z 2 Bunların
28.1 5.111 Ders Özeti #28 Geçiş Metalleri: Kristal Alan Teorisi Bölüm 16 s 681-683 ( 3. Baskıda s 631-633 ) Cuma Günü nün materyali d Orbitalleri Beş d orbitali vardır: d xy, d xz, d x 2 -y 2, d z 2 Bunların
Dalton atom modelinde henüz keşfedilmedikleri için atomun temel tanecikleri olan proton nötron ve elektrondan bahsedilmez.
 MODERN ATOM TEORİSİ ÖNCESİ KEŞİFLER Dalton Atom Modeli - Elementler atom adı verilen çok küçük ve bölünemeyen taneciklerden oluşurlar. - Atomlar içi dolu küreler şeklindedir. - Bir elementin bütün atomları
MODERN ATOM TEORİSİ ÖNCESİ KEŞİFLER Dalton Atom Modeli - Elementler atom adı verilen çok küçük ve bölünemeyen taneciklerden oluşurlar. - Atomlar içi dolu küreler şeklindedir. - Bir elementin bütün atomları
PARAMETRK OLMAYAN STATSTKSEL TEKNKLER. Prof. Dr. Ali EN ÖLÇEKLER
 PARAMETRK OLMAYAN STATSTKSEL TEKNKLER Prof. Dr. Ali EN 1 Normal dalm artlarn salamayan ve parametrik istatistik tekniklerinin kullanlmasn elverisiz klan durumlarn bulunmas halinde, eldeki verilere bal
PARAMETRK OLMAYAN STATSTKSEL TEKNKLER Prof. Dr. Ali EN 1 Normal dalm artlarn salamayan ve parametrik istatistik tekniklerinin kullanlmasn elverisiz klan durumlarn bulunmas halinde, eldeki verilere bal
X +5 iyonunda; n = p + 1 eflitli i vard r. ATOM VE PER YOD K CETVEL ÖRNEK 15: ÖRNEK 16:
 A ÖRNEK 15: I. X +5 iyonunun proton say s, nötron say s ndan 1 eksiktir II. 14 Y 2 iyonunun elektron say s, X +5 iyonunun elektron say s ndan 6 fazlad r Buna göre X elementinin izotopunun atom ve kütle
A ÖRNEK 15: I. X +5 iyonunun proton say s, nötron say s ndan 1 eksiktir II. 14 Y 2 iyonunun elektron say s, X +5 iyonunun elektron say s ndan 6 fazlad r Buna göre X elementinin izotopunun atom ve kütle
Atom Yapısı & Atomlar Arası Bağlar
 Atom Yapısı & Atomlar Arası Bağlar Bölüm İçeriği Atom Bağları Birincil Bağlar İkincil Bağlar İyonik Kovalent Metalik van der Waals ATOMLAR ARASI BAĞLAR Atomlar malzemeyi oluşturmak için bağ kurarlar. Kurulan
Atom Yapısı & Atomlar Arası Bağlar Bölüm İçeriği Atom Bağları Birincil Bağlar İkincil Bağlar İyonik Kovalent Metalik van der Waals ATOMLAR ARASI BAĞLAR Atomlar malzemeyi oluşturmak için bağ kurarlar. Kurulan
GRUPLARDA ELEMENTLER
 GRULARDA ELEMENTLER Li e N 8 9 Ne 0 i 8 9 0 c Ti V r Mn e o Ni 8 u 9 Zn 0 e r r 8 Y 9 Zr 0 Nb Mo Tc Ru Rh d Ag d 8 9 n 0 b Xe a f Ta Re s r t 8 Au 9 g 80 Tl 8 b 8 i 8 o 8 At 8 Rn 8 r 8 Ra 88 Rf 0 Db 0
GRULARDA ELEMENTLER Li e N 8 9 Ne 0 i 8 9 0 c Ti V r Mn e o Ni 8 u 9 Zn 0 e r r 8 Y 9 Zr 0 Nb Mo Tc Ru Rh d Ag d 8 9 n 0 b Xe a f Ta Re s r t 8 Au 9 g 80 Tl 8 b 8 i 8 o 8 At 8 Rn 8 r 8 Ra 88 Rf 0 Db 0
BÖLÜM 2 D YOTLU DO RULTUCULAR
 BÖLÜ 2 DYOTLU DORULTUCULAR A. DENEYN AACI: Tek faz ve 3 faz diyotlu dorultucularn çalmasn ve davranlarn incelemek. Bu deneyde tek faz ve 3 faz olmak üzere tüm yarm ve tam dalga dorultucular, omik ve indüktif
BÖLÜ 2 DYOTLU DORULTUCULAR A. DENEYN AACI: Tek faz ve 3 faz diyotlu dorultucularn çalmasn ve davranlarn incelemek. Bu deneyde tek faz ve 3 faz olmak üzere tüm yarm ve tam dalga dorultucular, omik ve indüktif
BÖLÜM 1. stanbul Kültür Üniversitesi. Fonksiyonlar - Özellikleri ve Limit Kavram. ³eklinde tanmlanan fonksiyona Dirichlet fonksiyonu ad verilir.
 BÖLÜM 1 0, Q 1. f() = 1, R/Q, Fonksiyonlar - Özellikleri ve Limit Kavram ³eklinde tanmlanan fonksiyona Dirichlet fonksiyonu ad verilir. Buna göre a³a da verilen tanm bölgeleri altnda görüntü cümlelerini
BÖLÜM 1 0, Q 1. f() = 1, R/Q, Fonksiyonlar - Özellikleri ve Limit Kavram ³eklinde tanmlanan fonksiyona Dirichlet fonksiyonu ad verilir. Buna göre a³a da verilen tanm bölgeleri altnda görüntü cümlelerini
Atomik Absorpsiyon Spektrofotometresi
 Atomik Absorpsiyon Spektrofotometresi Özet AAS eser miktardaki metallerin (ppm ve ppb düzeyde) kantitatif analiz için kullanılmaktadır. Öncelikle analizi yapılacak örneğin çözeltisi hazırlanır. Hangi
Atomik Absorpsiyon Spektrofotometresi Özet AAS eser miktardaki metallerin (ppm ve ppb düzeyde) kantitatif analiz için kullanılmaktadır. Öncelikle analizi yapılacak örneğin çözeltisi hazırlanır. Hangi
K MYA ATOM VE PER YOD K CETVEL. Kavram Dersaneleri 10 ÖRNEK 1 :
 K MYA ATOM VE PER YOD K CETVEL ÖRNEK 1 : Bir elementin 60 X +2 iyonunda 25 elektron vard r. Ayn elementin, 58 X izotopunun atomundaki proton (p), nötron (n) ve elektron (e) say lar kaçt r? ÖRNEK 2: Bir
K MYA ATOM VE PER YOD K CETVEL ÖRNEK 1 : Bir elementin 60 X +2 iyonunda 25 elektron vard r. Ayn elementin, 58 X izotopunun atomundaki proton (p), nötron (n) ve elektron (e) say lar kaçt r? ÖRNEK 2: Bir
IĞDIR ÜNĠVERSĠTESĠ. ARAġTIRMA LABORATUVARI UYGULAMA VE ARAġTIRMA MERKEZĠ ANALĠZ FĠYAT LĠSTESĠ AAS ANALĠZ ÜCRETLERĠ
 IĞDIR ÜNĠVERSĠTESĠ ARAġTIRMA LABORATUVARI UYGULAMA VE ARAġTIRMA MERKEZĠ ANALĠZ FĠYAT LĠSTESĠ AAS ANALĠZ ÜCRETLERĠ Diğer Kamu Kurumları Bakır Analizi 80 TL 32 TL 52 TL 48 TL 78 TL Altın Analizi 80 TL 32
IĞDIR ÜNĠVERSĠTESĠ ARAġTIRMA LABORATUVARI UYGULAMA VE ARAġTIRMA MERKEZĠ ANALĠZ FĠYAT LĠSTESĠ AAS ANALĠZ ÜCRETLERĠ Diğer Kamu Kurumları Bakır Analizi 80 TL 32 TL 52 TL 48 TL 78 TL Altın Analizi 80 TL 32
MIT Açık Ders Malzemeleri http://ocw.mit.edu. 5.62 Fizikokimya II 2008 Bahar
 MIT Açık Ders Malzemeleri http://ocw.mit.edu 5.62 Fizikokimya II 2008 Bahar Bu materyallerden alıntı yapmak veya Kullanım Şartları hakkında bilgi almak in http://ocw.mit.edu/terms ve http://tuba.acikders.org.tr
MIT Açık Ders Malzemeleri http://ocw.mit.edu 5.62 Fizikokimya II 2008 Bahar Bu materyallerden alıntı yapmak veya Kullanım Şartları hakkında bilgi almak in http://ocw.mit.edu/terms ve http://tuba.acikders.org.tr
izotop MALZEME BILGISI B2
 1. Giriş 2. Temel Kavramlar 3. Atomlarda Elektronlar 4. Periyodik Tablo 5. Bağ Kuvvetleri ve Enerjileri 6. Atomlararası Birincil Bağlar 7. İkincil bağlar veya Van Der Waals Bağları 8. Moleküller Bu özelliklerinden
1. Giriş 2. Temel Kavramlar 3. Atomlarda Elektronlar 4. Periyodik Tablo 5. Bağ Kuvvetleri ve Enerjileri 6. Atomlararası Birincil Bağlar 7. İkincil bağlar veya Van Der Waals Bağları 8. Moleküller Bu özelliklerinden
BÖLÜM 2 ATOMİK YAPI İÇERİK. Atom yapısı. Bağ tipleri. Chapter 2-1
 BÖLÜM 2 ATOMİK YAPI İÇERİK Atom yapısı Bağ tipleri 1 Atomların Yapıları Atomlar başlıca üç temel atom altı parçacıktan oluşur; Protonlar (+ yüklü) Nötronlar (yüksüz) Elektronlar (-yüklü) Basit bir atom
BÖLÜM 2 ATOMİK YAPI İÇERİK Atom yapısı Bağ tipleri 1 Atomların Yapıları Atomlar başlıca üç temel atom altı parçacıktan oluşur; Protonlar (+ yüklü) Nötronlar (yüksüz) Elektronlar (-yüklü) Basit bir atom
FİZİKÇİ. 2. Kütlesi 1000 kg olan bir araba 20 m/sn hızla gidiyor ve 10 m bir uçurumdan aşağı düşüyor.
 1. Aşağıdakilerden hangisi Frekans ı tanımlamaktadır? a) Birim zamandaki titreşim sayısıdır ve boyutu sn -1 b) Birim zamandaki hızlanmadır c) Bir saniyedeki tekrarlanmadır d) Hızın zamana oranıdır 6. İki
1. Aşağıdakilerden hangisi Frekans ı tanımlamaktadır? a) Birim zamandaki titreşim sayısıdır ve boyutu sn -1 b) Birim zamandaki hızlanmadır c) Bir saniyedeki tekrarlanmadır d) Hızın zamana oranıdır 6. İki
PERİYODİK ÖZELLİKLER 1.ATOMLARIN BÜYÜKLÜĞÜ VE ATOM YARIÇAPI: Kovalent yarıçap: Van der Waals yarıçapı: İyon yarıçapı:
 PERİYODİK ÖZELLİKLER 1.ATOMLARIN BÜYÜKLÜĞÜ VE ATOM YARIÇAPI: Elementlerin fiziksel ( erime ve kaynama noktaları, yoğunluk, iletkenlik vb.) ve kimyasal özellikleri ( elektron alma ve verme ) atom yarıçaplarıyla
PERİYODİK ÖZELLİKLER 1.ATOMLARIN BÜYÜKLÜĞÜ VE ATOM YARIÇAPI: Elementlerin fiziksel ( erime ve kaynama noktaları, yoğunluk, iletkenlik vb.) ve kimyasal özellikleri ( elektron alma ve verme ) atom yarıçaplarıyla
Bölüm 2: Atomik Yapı & Atomarası Bağlar
 Bölüm 2: Atomik Yapı & Atomarası Bağlar Bağlanmayı ne sağlar? Ne tip bağlar vardır? Bağların sebep olduğu özellikler nelerdir? Chapter 2-1 Atomun yapısı (Birinci sınıf kimyası) atom electronlar 9.11 x
Bölüm 2: Atomik Yapı & Atomarası Bağlar Bağlanmayı ne sağlar? Ne tip bağlar vardır? Bağların sebep olduğu özellikler nelerdir? Chapter 2-1 Atomun yapısı (Birinci sınıf kimyası) atom electronlar 9.11 x
ANORGANİK KİMYA TEMEL KAVRAMLAR
 ANORGANİK KİMYA TEMEL KAVRAMLAR Prof. Dr. Halis ÖLMEZ Prof. Dr. Veysel T. YILMAZ Beşinci Baskı 2010 BEŞİNCİ BASKIYA ÖNSÖZ Z 1997 yılında birinci baskısı, 1998 yılında da ikinci, 2004 yılında üçüncü, 2008
ANORGANİK KİMYA TEMEL KAVRAMLAR Prof. Dr. Halis ÖLMEZ Prof. Dr. Veysel T. YILMAZ Beşinci Baskı 2010 BEŞİNCİ BASKIYA ÖNSÖZ Z 1997 yılında birinci baskısı, 1998 yılında da ikinci, 2004 yılında üçüncü, 2008
FİZİK 4. Ders 6: Atom Enerjisinin Kuantalanması
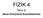 FİZİK 4 Ders 6: Atom Enerjisinin Kuantalanması Atom Enerjisinin Kuantalanması Atom Spektrumları Atom Modelleri Bohr Atom Modeli Atomun yapısı ve Laserler Dalga Parçacık İkilemi Tüm fizikçiler fotoelektrik
FİZİK 4 Ders 6: Atom Enerjisinin Kuantalanması Atom Enerjisinin Kuantalanması Atom Spektrumları Atom Modelleri Bohr Atom Modeli Atomun yapısı ve Laserler Dalga Parçacık İkilemi Tüm fizikçiler fotoelektrik
